感染症治療剤
【課題】 本発明は、細菌の耐性獲得も少なく、抗生物質とは異なる特徴を有し、細胞障害性を有さない15Kグラニュライシンと組み合わせて投与することで、15Kグラニュライシンを単独で用いるよりも強い殺菌効果を有する感染症治療剤を提供することを課題とする。
【解決手段】
本発明は、有効成分として15Kグラニュライシンと15Kグラニュライシンの体内発現ベクターの組み合わせ、15KグラニュライシンとIL-6、IL-23またはIL−27の組み合わせ、15Kグラニュライシンの体内発現ベクターとIL-6、IL−23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせを含み、副作用が少なく、かつ、細菌が耐性獲得をし難い、有効な感染症治療剤を提供することによって上記の課題を解決した。
【解決手段】
本発明は、有効成分として15Kグラニュライシンと15Kグラニュライシンの体内発現ベクターの組み合わせ、15KグラニュライシンとIL-6、IL-23またはIL−27の組み合わせ、15Kグラニュライシンの体内発現ベクターとIL-6、IL−23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせを含み、副作用が少なく、かつ、細菌が耐性獲得をし難い、有効な感染症治療剤を提供することによって上記の課題を解決した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、結核等の感染症を治療するための感染症治療剤に関する発明である。
【背景技術】
【0002】
医療において、感染症治療剤の存在が不可欠であることは言うまでもないことである。現在、数多くの抗生物質や合成抗菌剤等の感染症治療剤が提供されており、医療現場において用いられている。
【0003】
しかしながら、現在、感染症治療剤として、主に提供されている抗菌剤には、耐性菌の出現という、不可避の問題が伴っていることも事実である。つまり、新たな抗菌剤が提供されることにより、新たな耐性菌が生み出されている、という皮肉な状態が続いている。
【0004】
例えば、単一感染症において、死亡率第1位を占めている結核は、最近の増加傾向が、世界的な問題となっている。さらに、殆どの抗生物質に対して耐性を有する耐性菌の存在も確認されており、この問題も顕在化しつつある。
【0005】
現在グラニュライシンと呼ばれる、NK細胞やCTLに発現している分子が、結核菌等の細菌に対する直接の殺傷能力を有することが明らかとなっている〔Stenger,S.et al.,Science 282,121-125(1998)〕。
【0006】
グラニュライシンは、15Kとして造られた後、細胞傷害性顆粒内で、9Kにプロセシングされる。15Kと9Kのグラニュライシンはそれぞれ、マクロファージに入り込み、マクロファージに取り込まれた結核菌等の細菌を殺傷する。
しかし、9Kグラニュライシンがマクロファージに入り込むためには、同じ細胞傷害性顆粒内分子であるパーフォリンを必要とする。これは、9Kグラニュライシンが細胞内に入るためにはパーフォリンによって標的細胞に穴を空ける必要があるからである。従って、9Kグラニュライシンは細胞障害性がある。
ところが、15Kグラニュライシンは標的細胞に穴をあけるパーフォリンを必要とせず、マクロファージに入り込み、マクロファージに取り込まれた結核菌等の細菌を殺傷する。よって15Kグラニュライシンには細胞障害性がない。
【0007】
本発明者らは、9Kグラニュライシントランスジェニックマウスと15Kグラニュライシントランスジェニックマウスを作製し、それぞれのマウスとWild型コントロールマウスに5×105CFU、H37Rvヒト型結核菌を尾静脈から静脈内投与し、4週後のそれぞれの肺臓中の結核菌数を測定した。その結果15Kグラニュライシントランスジェニックマウスの肺臓では統計学的有意差(Student のt 検定でp<0.05)をもって9Kグラニュライシントランスジェニックマウスの肺臓より結核菌数の減少が認められた。このことより、15Kグラニュライシンは9Kグラニュライシンよりも生体内において抗結核殺傷効果、抗結核抑制効果が有意に強力であることが初めて発見され、また、9Kグラニュライシンは生体内において抗結核抑制効果が極めて弱いことが示唆された。
【0008】
上記の結果を踏まえて本発明者らは、細胞障害性を有さず9Kグラニュライシンよりも強力な結核抑制効果を有する15Kグラニュライシンを有効成分とした感染症治療剤及び15Kグラニュライシンをコードする遺伝子を組み込んで15Kグラニュライシンを体内発現させるベクターを有効成分として含む感染症治療剤を既に出願し、登録を受けている。(特許文献1)。
しかしながら、更に強力な感染症治療剤を作製するために、15Kグラニュライシンと組み合わせて投与することで15Kグラニュライシン単独で投与するよりもマクロファージに取り込まれた結核菌等の細菌による感染症に効果のある感染症治療剤が求められている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第4149713号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、細菌の耐性獲得も少なく、抗生物質とは異なる特徴を有し、細胞障害性を有さない15Kグラニュライシンと組み合わせて投与することで、15Kグラニュライシンを単独で用いるよりも強力にマクロファージに取り込まれた結核菌等の細菌を殺傷する効果を有する感染症治療剤を提供することを課題とする。
【課題を解決するための手段】
【0011】
請求項1に係る発明は、15Kグラニュライシンと15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターを有効成分として含む感染症治療剤に関する。
請求項2に係る発明は15Kグラニュライシンと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤に関する。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
請求項3に係る発明は15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤に関する。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
請求項4に係る発明は、以下の(a)、(b)を有効成分として含む感染症治療剤に関する。
(a)15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクター
(b)センダイウイルスのエンベロープにヒト型結核菌H37Rvの65KDaヒートショックプロテインをコードする遺伝子とインターロイキン12をコードする遺伝子を組み込んで、65KDaのヒートショックプロテインとインターロイキン12を体内発現させるベクター
請求項5に係る発明は、前記15Kグラニュライシンが、組換え蛋白質であることを特徴とする請求項1又は2に記載の感染症治療剤に関する。
請求項6に記載の発明は感染症の原因菌が結核菌である請求項1乃至5のいずれかに記載の感染症治療剤に関する。
【発明の効果】
【0012】
請求項1に係る発明によれば、15Kグラニュライシンと15Kグラニュライシンをコードする遺伝子を組み込んで15Kグラニュライシンを体内発現させるベクター(以下15Kグラニュライシンの体内発現ベクターと称する。)を有効成分として含む感染症治療剤を投与することによって細胞障害活性を示さず、15Kグラニュライシン単独もしくは15Kグラニュライシンの体内発現ベクターを単独で投与するよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0013】
請求項2に係る発明によれば、15Kグラニュライシンとインターロイキン6(以下IL-6と称する)、もしくはインターロイキン23(以下IL-23と称する)、もしくはインターロイキン27(以下IL−27と称する)のいずれか一つを有効成分として含む感染症治療剤を投与することによって細胞障害活性を示さず15Kグラニュライシン単独、もしくはIL-6、またはIL-23、またはIL−27を単独で投与するよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0014】
請求項3に係る発明によれば、15Kグラニュライシンの体内発現ベクターとIL-6、もしくはIL-23、もしくはIL-27のいずれか一つを有効成分として含む感染症治療剤を投与することによって15Kグラニュライシンの体内発現ベクターを単独、もしくはIL-6、またはIL-23、またはIL-27を単独で投与するよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0015】
請求項4に係る発明によれば、15Kグラニュライシンの体内発現ベクターと、本発明者らによって開発された結核菌に対する体内発現ベクターで、マウスの系だけではなく、ヒトの結核感染に最も近いモデルとされているカニクイザルの系でも結核の強い治療効果を示すHVJ-エンベロープHSP65DNAとIL-12のDNAの体内発現ベクター(以下HSP65DNAとIL-12DNA体内発現ベクターと称する)を有効成分として含む感染症治療剤を投与することによって、15Kグラニュライシンの体内発現ベクターを単独、もしくはHSP65DNAとIL-12DNA体内発現ベクター単独で投与するよりも更に強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
尚、HSP65DNAとIL-12DNA体内発現ベクターはヒト型結核菌H37Rvの65KDaヒートショックプロテインのDNA(HSP65DNA)とIL-12のDNAをセンダイウイルス(HVJ)のエンベロープに組み込んだ体内発現ベクターで、結核菌に対して強い治療効果を有することが知られている(Okada et.al, Jpn.J.Clin.Immunol.,31 (5) 356〜368(2008))。
【0016】
請求項5に係る発明によれば、15Kグラニュライシン蛋白質を安定して大量に供給することができる。
【0017】
請求項6に係る発明によれば、結核菌に有効な感染症治療剤を提供することができる。
【0018】
本発明により、15Kグラニュライシンと15Kグラニュライシンの体内発現ベクターの組み合わせ、15KグラニュライシンとIL-6、IL-23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとIL-6、IL−23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせによって副作用が認められず、15Kグラニュライシンを単独で投与するよりもさらにマクロファージに取り込まれた結核菌等の細菌に対して殺傷性のある感染症治療剤が提供される。
【図面の簡単な説明】
【0019】
【図1】結核菌に腹腔内感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン組換え蛋白質と15Kグラニュライシン発現ベクターの治療効果示す図である。
【図2】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン組換え蛋白質と、IL-6の治療効果を示す図である。
【図3】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシンの体内発現ベクターとIL-6の治療効果を示す図である。
【図4】結核菌にエアゾル感染させたマウス(BALB/c)の肝臓における15Kグラニュライシン組換え蛋白質とIL-6の治療効果を示した図である。
【図5】結核菌にエアゾル感染させたマウス(BALB/c)の肺臓における15Kグラニュライシン組換え蛋白質とIL-6の治療効果を示した図である。
【図6】結核菌にエアゾル感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの治療効果を示した図である。
【図7】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの治療効果を示した図である。
【図8】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン組換え蛋白質とIL-23の治療効果を示した図である。
【図9】結核菌にエアゾル感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン組換え蛋白質とIL-23の治療効果を示した図である。
【図10】結核菌にエアゾル感染させたマウス(DBA/1)の肺臓における15Kグラニュライシン組換え蛋白質とIL-23の治療効果を示した図である。
【図11】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン体内発現ベクターとIL-23の治療効果を示した図である。
【図12】結核菌にエアゾル感染させたマウス(BALB/c)の肺臓における15Kグラニュライシン組換え蛋白質とIL-27の治療効果を示した図である。
【図13】結核菌にエアゾル感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの治療効果を示した図である。
【発明を実施するための形態】
【0020】
以下、本発明の実施の形態について説明する。
本治療剤の有効成分として用いる15Kグラニュライシンは、生体から分離して用いることも可能であるが、生体微量成分である故、15Kグラニュライシンをコードする遺伝子を発現させて得られる、組換え蛋白質として用いることが好適である。また、15Kグラニュライシンをコードする遺伝子が組み込まれた、15Kグラニュライシンの体内発現ベクターを有効成分として、体内で15Kグラニュライシンを産生させることも、好適な手段である。
【0021】
(15Kグラニュライシンの組換え蛋白質の作製方法)
15Kグラニュライシンをコードする遺伝子配列は、既に報告されており、これを基に、15Kグラニュライシンをコードする遺伝子を効率的に調製して、この遺伝子を発現させることにより、15Kグラニュライシンの組換え蛋白質を調製することが可能である。
【0022】
具体的には、15Kグラニュライシンをコードする遺伝子配列の両端に対して相補的なヌクレオチド鎖を増幅用プライマーとして、PCR法等の遺伝子増幅法により、15Kグラニュライシンをコードする遺伝子の遺伝子増幅産物を調製する。
これを、適切な遺伝子発現用ベクターに組み込み、かかる組換えベクターで形質転換を行った大腸菌、枯草菌、酵母、昆虫細胞などの適切な宿主から、所望する15Kグラニュライシンを得ることができる。
【0023】
ここで用いる遺伝子発現用ベクターは、通常発現しようとする遺伝子の上流域にプロモーター,エンハンサー,および下流域に転写終了配列などを保有するものを用いるのが好適である。
【0024】
また、15Kグラニュライシン遺伝子の発現は、直接発現系に限らず、例えばβ−ガラクトシダーゼ遺伝子,グルタチオン−S−トランスフェラーゼ遺伝子やチオレドキシン遺伝子を利用した融合タンパク質発現系とすることもできる。
【0025】
遺伝子発現用ベクターとしては、例えば、宿主を大腸菌とするものとしては、pQE,pGEX,pT7−7,pMAL,pTrxFus,pET,pNT26CIIなどを例示することができる。また、宿主を枯草菌とするものとしては、pPL608,pNC3,pSM23,pKH80などを例示することができる。
【0026】
また、宿主を酵母とするものとしては、pGT5,pDB248X,pART1,pREP1,YEp13,YRp7,YCp50などを例示することができる。
【0027】
また、宿主を哺乳動物細胞または昆虫細胞とするものとしては、p91023,pCDM8,pcDL−SRα296,pBCMGSNeo,pSV2dhfr,pSVdhfr,pAc373,pAcYM1,pRc/CMV,pREP4,pcDNAIなどを例示することができる。
【0028】
これらの遺伝子発現ベクターは、15Kグラニュライシンを発現させる目的に応じて選択することができる。例えば、15Kグラニュライシンを発現させる場合には、宿主として大腸菌,枯草菌または酵母などを選択し得る遺伝子発現ベクターを選択するのが好ましく、少量でも確実に活性を有するように15Kグラニュライシンを発現させる場合には、哺乳動物細胞や昆虫細胞を宿主として選択し得る遺伝子発現ベクターを選択するのが好ましい。
【0029】
また、上記のように既存の遺伝子発現ベクターを選択することも可能であるが、目的に応じて適宜遺伝子発現ベクターを作出して、これを用いることも勿論可能である。
【0030】
15Kグラニュライシン遺伝子を組み込んだ上記遺伝子発現用ベクターの宿主細胞への導入およびこれによる形質転換法は、一般的な方法、例えば宿主細胞が大腸菌や枯草菌である場合には、塩化カルシウム法やエレクトロポレーション法などの手段により行うことができ、宿主が哺乳動物細胞や昆虫細胞の場合はリン酸カルシウム法,エレクトロポレーション法またはリポソーム法などの手段により行うことができる。
【0031】
このようにして得られる形質転換体を常法に従い培養することにより、所望する15Kグラニュライシンが蓄積される。かかる培養に用いられる培地は、宿主の性質に応じて適宜選択することができるが、例えば宿主が大腸菌である場合には、LB培地やTB培地などが、宿主が哺乳動物細胞の場合には、RPMI1640培地などを適宜用いることができる。
【0032】
この培養により得られる培養物からの15Kグラニュライシンの単離および精製は、常法に従い行うことが可能であり、例えば培養物を、15Kグラニュライシンの物理的および/または化学的性質を利用した各種の処理操作を用いて行うことが可能である。
【0033】
具体的には、タンパク沈澱剤による処理,限外濾過,ゲル濾過,高速液体クロマトグラフィー,遠心分離,電気泳動,特異抗体を用いたアフィニティクロマトグラフィー,透析法などを単独でまたはこれらの方法を組み合わせて用いることができる。
【0034】
(15Kグラニュライシンの体内発現ベクターの作製方法)
この形態の本治療剤の有効成分は、上記の組換え蛋白質の発現に用いられた、15Kグラニュライシンをコードする遺伝子を、体内発現ベクターに組み込んだ、組換えベクターである。
【0035】
体内発現ベクターとしては、例えば、アデノウイルスベクター、レトロウイルスベクター等を挙げることができるが、これらに限定されるものではない。体内発現ベクターは、例えば、上記のウイルス遺伝子を組み込んだコスミドベクターに、さらに、15Kグランニュライシンを発現可能な遺伝子を組み込んで、このコスミドベクターと、制限酵素処理を行った親ウイルスDNA−TPを、293細胞にトランスフェクションすることにより、この293細胞内で相同組換えが起こり、所望する体内発現ベクターが生産される。
【0036】
(15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを有効成分とした本治療剤)
15Kグラニュライシンの組換え蛋白質と15Kグラニュライシンの体内発現ベクターの両物質を用いることにより、単独で用いるよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0037】
15Kグラニュライシンは適切な医薬製剤担体を配合して、製剤組成物の形態に調製することが可能である(15Kグラニュライシンのみでも勿論可能である)。医薬製剤担体としては、例えば、具体的な剤型に応じて、適宜医薬製剤担体として慣用され得る、充填剤、増量剤、結合剤、付湿剤、安定剤、溶解補助剤、崩壊剤、表面活性剤などの賦形剤や希釈剤を自由に選択することができる。製剤組成物の形態は、15Kグラニュライシンを、感染症の治療用途に効果的に用い得る形態であれば特に限定されず、例えば、錠剤、粉末剤、顆粒剤、丸剤などの固剤であっても、液剤、懸濁剤、乳剤などの注射剤形態とすることもできる。また、15Kグラニュライシンに適切な担体を添加することによって、用時に液状とするべき乾燥品とすることも可能である。
【0038】
15Kグラニュライシンの体内発現ベクターは上述のようにして調製され得る体内発現ベクターを、単離・精製して、これを生体に投与することにより、生体内に15Kグラニュライシンが産生され、この15Kグラニュライシンの薬理効果が発揮され得る。
【0039】
投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではないが、有効成分である15Kグラニュライシン組換え蛋白質10000μg/50kgは1日1回または数回に分けて、また、15Kグラニュライシンの体内発現ベクター、2000μg/50kgは1日1回、、それぞれを数日間の間隔をあけて6回投与することが好ましい。
【0040】
尚、15Kグラニュライシンの体内発現ベクターは注射剤形態が一般的であるので、15Kグラニュライシンの組換え蛋白質に適切な担体を添加することによって注射剤形態として、15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを静脈内、筋肉内、骨内、関節内、皮下、皮内、腹腔内に同時または間隔をあけて交互に投与することもできる。
【0041】
(15Kグラニュライシンの組換え蛋白質とIL-6、IL−23、IL−27のいずれか一つを有効成分とした本治療剤)
15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23またはIL−27のいずれか一つを用いることにより、単独で用いるよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0042】
15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23またはIL−27は、適切な医薬製剤担体を配合して、製剤組成物の形態に調製することが可能である。医薬製剤担体としては、例えば、具体的な剤型に応じて、適宜医薬製剤担体として慣用され得る、充填剤、増量剤、結合剤、付湿剤、安定剤、溶解補助剤、崩壊剤、表面活性剤などの賦形剤や希釈剤を自由に選択することができる。製剤組成物の形態は、15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23、またはIL−27のいずれか一つを、感染症の治療用途に効果的に用い得る形態であれば特に限定されず、例えば、錠剤、粉末剤、顆粒剤、丸剤などの固剤であっても、液剤、懸濁剤、乳剤などの注射剤形態とすることもできる。また、15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23、またはIL−27のいずれか一つに適切な担体を添加することによって、用時に液状とするべき乾燥品とすることも可能である。
【0043】
このようにして得られる本治療剤の投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではないが、有効成分である15Kグラニュライシン組換え蛋白質10000μg/50kg、IL-6の場合は2500μg/50kg、IL-23の場合は5000μg/50kg、IL-27の場合は2500μg/50kgを1日1回または数回に分け、数日間から1週間以上の間隔をあけて6回投与することが好ましい。投与は両物質を同時または間隔をあけて交互に投与することもできる。
【0044】
尚15Kグラニュライシン蛋白質とインターロイキンの組み合わせは強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を有するため治療回数を3回に減らすことも可能である。
【0045】
このような各種の形態の医薬製剤は、その形態に応じて適当な投与経路、例えば、注射剤形態の場合には、静脈内、筋肉内、骨内、関節内、皮下、皮内、腹腔内投与などにより、固剤形態の場合には、経口や経腸投与などにより投与され得る。
【0046】
(15Kグラニュライシンの体内発現ベクターとIL-6またはIL−23またはIL−27のいずれか一つを有効成分とした本治療剤)
15Kグラニュライシンの体内発現ベクターとIL-6またはIL−23またはIL−27のいずれか一つを用いることにより、単独で用いるよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0047】
15Kグラニュライシンの体内発現ベクターとIL-6またはIL−23、またはIL27は、上述のように適切な医薬製剤担体を配合して製剤組成物の形態に調整して使用することができる。このようにして得られる本治療剤の投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではないが、有効成分である15Kグラニュライシンの体内発現ベクター2000μg/50kgは1日1回、IL-6の場合は2500μg/50kg、IL-23の場合は5000μg/50kg、IL-27の場合は2500μg/50kgを1日1回または数回に分け、それぞれを数日間から1週間以上の間隔をあけて6回投与することが好ましい。
【0048】
尚、15Kグラニュライシンの体内発現ベクターは注射剤形態が一般的であるので、IL-6またはIL−23、またはIL−27のいずれか一つに適切な担体を添加することによって注射剤形態として両物質を同時または交互に投与することもできる。
【0049】
(15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターを有効成分とした本治療剤)
15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの投与形態は、注射剤形態であることが一般的であり、静脈内、筋肉内、骨内、関節内、皮下、皮内、腹腔内投与などにより、投与され得る。このような本治療剤の投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではない。
【0050】
一般には、有効成分である15Kグラニュライシンの体内発現ベクター2000μg/50kg及びHSP65DNAとIL-12DNA体内発現ベクター2000μg/50kgを1日1回、数日間の間隔をあけて6回投与することが好ましい。
【0051】
尚15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせは強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を有するため治療回数を3回に減らすことも可能である。
【実施例】
【0052】
以下に、本発明の実施例を記載する。
【0053】
(1)15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクター、(2)15Kグラニュライシン組換え蛋白質とIL-6、IL−23、IL−27のいずれか一つ、(3)15Kグラニュライシンの体内発現ベクターとIL-6、IL−23、IL−27のいずれか一つ及び(4)15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL−12DNA体内発現ベクターを用いた時の細菌に対する殺傷効果の向上について説明する。
【0054】
以下に用いる相乗効果という用語はそれぞれの物質を単独で用いるよりも、二つの物質の組み合わせて用いる方が細菌に対する殺傷効果が向上した場合のことを言う。
【0055】
実験において用いるG1群からG10群の表示は以下の表1の通りである。
【0056】
【表1】

【0057】
(使用試薬等)
15Kグラニュライシン組換え蛋白質はR&D Systems社の精製蛋白質を使用した。IL-6はMiltenyi Biotec(Auburn, CA)社製の精製蛋白質を使用した。IL−23、IL−27はR&D Systems 社のrecombinant mouse IL-23及びrecombinant mouse IL-27の精製蛋白質を使用した。
【0058】
15Kグラニュライシンの体内発現ベクターは15Kグラニュライシンの遺伝子をCAGベクターに連結し、センダイウイルス(HVJ)のエンベロープに組み込んだ。また、HSP65DNAとIL−12DNAの体内発現ベクターはそれそれの遺伝子をpcDNA3・1ベクターに連結しセンダイウイルス(HVJ)エンベロープに組み込んだものを用いた。
マウスはDBA/1とBALB/cを用いた。これらのマウスは結核菌に易感染性である。
有意差検定にはStudentのt検定を用いた。
【0059】
以下の実験において15Kグラニュライシン組換え蛋白質を投与する場合は1匹(20g)あたり1日に4μg投与した。
15Kグラニュライシンの体内発現ベクターは1匹(20g)あたり1日に100μg/0.2mlを50μgずつ両側下肢の前頸骨筋に筋肉注射することによって投与した。
IL-6は1匹(20g)あたり1日に1μg(≧5×104International Unit)、IL−23は1匹(20g)あたり2μg(≧5×104International Unit)、IL-27は1匹(20g)あたり1日に1μg(≧5×104International Unit)を3回に分けて1/3ずつ腹腔内投与した。
【0060】
感染させる細菌はヒト型結核菌H37Rvを用いた。
結核菌を腹腔内感染させる場合は1×107CFUを生理食塩水0.2mlに懸濁し、これを腹腔内に投与することによって行った。
結核菌を肺感染させる場合にはエアゾルチャンバーで1×103CFUをマウス気道内に投与することによって行った。
【0061】
(実験1)
(腹腔内感染における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの結核菌に対する相乗効果について)
8週齢のDBA/1マウスに結核菌を腹腔内感染させた。そのマウスを何も与えない群(G1群)、15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを与える群(G2群)、15Kグラニュライシン組換え蛋白質のみを与える群(G5群)、15Kグラニュライシンの体内発現ベクターのみを与える群(G6群)に分けた。
【0062】
G2群には15Kグラニュライシン組換え蛋白質を4回、間隔をあけて投与した。また15Kグラニュライシンの体内発現ベクターを7回、間隔をあけて投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G6群には15Kグラニュライシンの体内発現ベクターのみをG2群と同日に投与した。G1群には与えなかった。
【0063】
その後解剖して肝臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0064】
その結果、G2群のコロニー数はG5群、G6群と比べて少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2群はG5群,G6群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0065】
また、コントロールであるG1群とG2群、G5群、G6群について同じ方法で有意差検定を行ったところG2群、G5群、G6群の全てにおいてG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図1)。
【0066】
従って15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターは肝臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0067】
(実験2)
(DBA/1マウスにおける15Kグラニュライシン組換え蛋白質とIL-6の結核菌に対する相乗効果について)
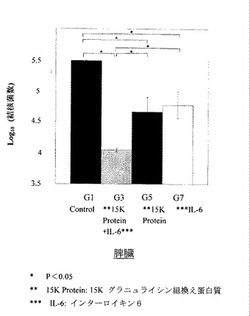
8週齢のDBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も与えない群(G1群)、15Kグラニュライシン組換え蛋白質とIL-6を与える群(G3群)と15Kグラニュライシン組換え蛋白質のみを与える群(G5群)、IL-6のみを与える群(G7群)に分けた。
【0068】
G3群には、15Kグラニュライシン組換え蛋白質とIL-6をそれぞれ交互に6回ずつ投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G7群にはIL-6のみをそれぞれ6回ずつ投与した。G1群には投与しなかった。
【0069】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0070】
その結果、G3群のコロニー数はG5群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG3群はG5群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0071】
また、コントロールであるG1群とG3、G5、G7群について同じ方法で有意差検定を行ったところG3群、G5群、G7群、の全てがG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図2)。
【0072】
従って15Kグラニュライシン組換え蛋白質とIL-6は脾臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0073】
(実験3)
(15Kグラニュライシンの体内発現ベクターとIL-6の結核菌に対する相乗効果について)
エアゾルチャンバーで結核菌を肺感染させた8週齢のDBA/1マウスを何も投与しない群(G1群)、15Kグラニュライシンの体内発現ベクターとIL-6を投与する群(G9群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、IL-6のみを投与する群(G10群)に分けた。
【0074】
G9群には15Kグラニュライシン体内発現ベクターとIL-6をそれぞれ6回ずつ投与した。投与は15Kグラニュライシンの体内発現ベクターを全実験期間の前半に行い、IL-6を後半に行った。G6群には15Kグラニュライシンの体内発現ベクターのみ、G10群にはIL-6のみを6回投与した。G1群には投与しなかった。
【0075】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0076】
その結果、G9群のコロニー数はG6群及びG10群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG9群はG6群、G10群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0077】
また、コントロールであるG1群とG9、G6、G10群について同じ方法で有意差検定を行ったところG9群、G6群、G10群、の全てがG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図3)。
【0078】
従って、15Kグラニュライシンの体内発現ベクターとIL-6の組み合わせは脾臓においてそれぞれ単独で用いるよりも結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0079】
(実験4)
(BALB/cマウスにおける15Kグラニュライシンの組換えタンパク質とIL-6の結核菌に対する相乗効果について)
結核の感染実験によく用いられるBALB/cマウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシン組換え蛋白質とIL-6を投与する群(G3群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、IL-6のみを投与する群(G7群)に分けた。
【0080】
G3群には、15Kグラニュライシン組換え蛋白質とIL-6をそれぞれ交互に6回ずつ投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G7群にはIL-6のみをそれぞれ6回投与した。G1群には投与しなかった。
【0081】
その後解剖して肝臓及び肺臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0082】
その結果、G3群のコロニー数はG5群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG3群はG5群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0083】
また、コントロールであるG1群とG3、G5、G7群について同じ方法で有意差検定を行ったところG3群、G5群、G7群、の全てがG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(肝臓(図4)、肺臓(図5))。
【0084】
従って15KグラニュライシンとIL-6は肝臓及び肺臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0085】
(実験5)
(肺感染における、DBA/1マウスにおける15Kグラニュライシンの組換えタンパク質と15Kグラニュライシンの体内発現ベクターの結核菌に対する相乗効果について)
8週齢のDBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを投与する群(G2群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)に分けた。
【0086】
G2群には15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを間隔をあけて6回、同日に投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G6群には15Kグラニュライシンの体内発現ベクターのみを6回投与した。
【0087】
その後解剖して肝臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0088】
その結果、G2群のコロニー数はG5群、G6群と比べて少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2群はG5群,G6群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図6)。
【0089】
従って15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターは肝臓において、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0090】
(実験6)
(肺感染における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの結核菌に対する相乗効果について)
8週齢のDBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを投与する群(G2群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)に分けた。
【0091】
G2群には15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを、間隔をあけて6回、同日に投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G6群には15Kグラニュライシンの体内発現ベクターのみを6回投与した。G1群には投与しなかった。
【0092】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0093】
その結果、G2群のコロニー数はG5群、G6群と比べて少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2群はG5群,G6群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0094】
また、コントロールであるG1群とG2、G5、G6群について同じ方法で各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2、G5群、G6群の全てにおいてG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。(図7)
【0095】
従って15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターは脾臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0096】
(実験7)
(15Kグラニュライシン組換え蛋白質とIL-23の結核菌に対する相乗効果について)
DBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシン組換え蛋白質とIL-23を投与する群(G3群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、IL-23のみを投与する群(G7群)に分けた。
【0097】
G3群には、15Kグラニュライシン組換え蛋白質とIL-23をそれぞれ交互に6回ずつ投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G7群にはIL-23のみをそれぞれ6回投与した。G1群には投与しなかった。
【0098】
その後解剖して脾臓、肝臓及び肺臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0099】
その結果、脾臓、肝臓及び肺臓の全てにおいてG3群のコロニー数はG5群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG3群はG5群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0100】
また、コントロールであるG1群とG3、G5、G7群について同じ方法で各群3匹ずつの有意差検定を行ったところG3群、G5群、G7群、の全てがG1に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(脾臓(図8)、肝臓(図9)、肺臓(図10))。
【0101】
従って15KグラニュライシンとIL-23は脾臓、肝臓、肺臓の全てにおいて、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0102】
(実験8)
(15Kグラニュライシンの体内発現ベクターとIL-23の結核菌に対する相乗効果について)
DBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシンの体内発現ベクターとIL-23を投与する群(G4群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、IL-23のみを投与する群(G7群)に分けた。
【0103】
G4群には、15Kグラニュライシンの体内発現ベクターとIL-23をそれぞれ交互に6回ずつ投与した。G6群には15Kグラニュライシンの体内発現ベクターのみを、G7群にはIL-23のみをそれぞれ6回ずつ投与した。G1群には投与しなかった。
【0104】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0105】
その結果、G4群のコロニー数はG6群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG4群はG6群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0106】
また、コントロールであるG1群とG4、G6、G7群について同じ方法で有意差検定を行ったところG4群、G6群、G7群、の全てがG1に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図11)。
【0107】
従って15Kグラニュライシンの体内発現ベクターとIL-23は脾臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0108】
(実験9)
(15Kグラニュライシンの体内発現ベクターとIL-27の結核菌に対する相乗効果について)
BALB/cマウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを15Kグラニュライシンの体内発現ベクターとIL-27を投与する群(G4群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、IL-27のみを投与する群(G7群)に分けた。
【0109】
G4群には15Kグラニュライシンの体内発現ベクターとIL-27をそれぞれ交互に6回ずつ投与した。G6群には15Kグラニュライシンの体内発現ベクターのみを、G7群にはIL-27のみをそれぞれ6回ずつ投与した。
【0110】
その後解剖して肺臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0111】
その結果、G4群のコロニー数はG6群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG4群はG6群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図12)。
【0112】
従って15Kグラニュライシンの体内発現ベクターとIL-27は肺臓において、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0113】
(実験10)
(15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの結核菌に対する相乗効果について)
エアゾルチャンバーで結核菌を肺感染させた8週齢のDBA/1マウスを15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターを投与する群(G11群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、HSP65DNAとIL-12DNA体内発現ベクターのみを投与する群(G12群)に分けた。
【0114】
G11群には15Kグラニュライシン体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターをそれぞれ6回ずつ交互に投与した。G6群には15Kグラニュライシンの体内発現ベクターのみ、G12群にはHSP65DNAとIL-12DNA体内発現ベクターのみを6回投与した。
【0115】
その後解剖して肝臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0116】
その結果、G11群のコロニー数はG6群及びG12群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG11群はG6群、G12群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図13)。
【0117】
従って、15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせは肝臓においてそれぞれ単独で用いるよりも結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【産業上の利用可能性】
【0118】
本発明により、有効成分として、15Kグラニュライシンと15Kグラニュライシンの体内発現ベクターの組み合わせ、15KグラニュライシンとIL-6、IL-23またはIL−27の組み合わせ、15Kグラニュライシンの体内発現ベクターとIL-6、IL−23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせを含み、副作用が少なく、かつ、細菌が耐性獲得をし難い、有効な感染症治療剤を提供することができる。
【技術分野】
【0001】
本発明は、結核等の感染症を治療するための感染症治療剤に関する発明である。
【背景技術】
【0002】
医療において、感染症治療剤の存在が不可欠であることは言うまでもないことである。現在、数多くの抗生物質や合成抗菌剤等の感染症治療剤が提供されており、医療現場において用いられている。
【0003】
しかしながら、現在、感染症治療剤として、主に提供されている抗菌剤には、耐性菌の出現という、不可避の問題が伴っていることも事実である。つまり、新たな抗菌剤が提供されることにより、新たな耐性菌が生み出されている、という皮肉な状態が続いている。
【0004】
例えば、単一感染症において、死亡率第1位を占めている結核は、最近の増加傾向が、世界的な問題となっている。さらに、殆どの抗生物質に対して耐性を有する耐性菌の存在も確認されており、この問題も顕在化しつつある。
【0005】
現在グラニュライシンと呼ばれる、NK細胞やCTLに発現している分子が、結核菌等の細菌に対する直接の殺傷能力を有することが明らかとなっている〔Stenger,S.et al.,Science 282,121-125(1998)〕。
【0006】
グラニュライシンは、15Kとして造られた後、細胞傷害性顆粒内で、9Kにプロセシングされる。15Kと9Kのグラニュライシンはそれぞれ、マクロファージに入り込み、マクロファージに取り込まれた結核菌等の細菌を殺傷する。
しかし、9Kグラニュライシンがマクロファージに入り込むためには、同じ細胞傷害性顆粒内分子であるパーフォリンを必要とする。これは、9Kグラニュライシンが細胞内に入るためにはパーフォリンによって標的細胞に穴を空ける必要があるからである。従って、9Kグラニュライシンは細胞障害性がある。
ところが、15Kグラニュライシンは標的細胞に穴をあけるパーフォリンを必要とせず、マクロファージに入り込み、マクロファージに取り込まれた結核菌等の細菌を殺傷する。よって15Kグラニュライシンには細胞障害性がない。
【0007】
本発明者らは、9Kグラニュライシントランスジェニックマウスと15Kグラニュライシントランスジェニックマウスを作製し、それぞれのマウスとWild型コントロールマウスに5×105CFU、H37Rvヒト型結核菌を尾静脈から静脈内投与し、4週後のそれぞれの肺臓中の結核菌数を測定した。その結果15Kグラニュライシントランスジェニックマウスの肺臓では統計学的有意差(Student のt 検定でp<0.05)をもって9Kグラニュライシントランスジェニックマウスの肺臓より結核菌数の減少が認められた。このことより、15Kグラニュライシンは9Kグラニュライシンよりも生体内において抗結核殺傷効果、抗結核抑制効果が有意に強力であることが初めて発見され、また、9Kグラニュライシンは生体内において抗結核抑制効果が極めて弱いことが示唆された。
【0008】
上記の結果を踏まえて本発明者らは、細胞障害性を有さず9Kグラニュライシンよりも強力な結核抑制効果を有する15Kグラニュライシンを有効成分とした感染症治療剤及び15Kグラニュライシンをコードする遺伝子を組み込んで15Kグラニュライシンを体内発現させるベクターを有効成分として含む感染症治療剤を既に出願し、登録を受けている。(特許文献1)。
しかしながら、更に強力な感染症治療剤を作製するために、15Kグラニュライシンと組み合わせて投与することで15Kグラニュライシン単独で投与するよりもマクロファージに取り込まれた結核菌等の細菌による感染症に効果のある感染症治療剤が求められている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第4149713号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、細菌の耐性獲得も少なく、抗生物質とは異なる特徴を有し、細胞障害性を有さない15Kグラニュライシンと組み合わせて投与することで、15Kグラニュライシンを単独で用いるよりも強力にマクロファージに取り込まれた結核菌等の細菌を殺傷する効果を有する感染症治療剤を提供することを課題とする。
【課題を解決するための手段】
【0011】
請求項1に係る発明は、15Kグラニュライシンと15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターを有効成分として含む感染症治療剤に関する。
請求項2に係る発明は15Kグラニュライシンと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤に関する。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
請求項3に係る発明は15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤に関する。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
請求項4に係る発明は、以下の(a)、(b)を有効成分として含む感染症治療剤に関する。
(a)15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクター
(b)センダイウイルスのエンベロープにヒト型結核菌H37Rvの65KDaヒートショックプロテインをコードする遺伝子とインターロイキン12をコードする遺伝子を組み込んで、65KDaのヒートショックプロテインとインターロイキン12を体内発現させるベクター
請求項5に係る発明は、前記15Kグラニュライシンが、組換え蛋白質であることを特徴とする請求項1又は2に記載の感染症治療剤に関する。
請求項6に記載の発明は感染症の原因菌が結核菌である請求項1乃至5のいずれかに記載の感染症治療剤に関する。
【発明の効果】
【0012】
請求項1に係る発明によれば、15Kグラニュライシンと15Kグラニュライシンをコードする遺伝子を組み込んで15Kグラニュライシンを体内発現させるベクター(以下15Kグラニュライシンの体内発現ベクターと称する。)を有効成分として含む感染症治療剤を投与することによって細胞障害活性を示さず、15Kグラニュライシン単独もしくは15Kグラニュライシンの体内発現ベクターを単独で投与するよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0013】
請求項2に係る発明によれば、15Kグラニュライシンとインターロイキン6(以下IL-6と称する)、もしくはインターロイキン23(以下IL-23と称する)、もしくはインターロイキン27(以下IL−27と称する)のいずれか一つを有効成分として含む感染症治療剤を投与することによって細胞障害活性を示さず15Kグラニュライシン単独、もしくはIL-6、またはIL-23、またはIL−27を単独で投与するよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0014】
請求項3に係る発明によれば、15Kグラニュライシンの体内発現ベクターとIL-6、もしくはIL-23、もしくはIL-27のいずれか一つを有効成分として含む感染症治療剤を投与することによって15Kグラニュライシンの体内発現ベクターを単独、もしくはIL-6、またはIL-23、またはIL-27を単独で投与するよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0015】
請求項4に係る発明によれば、15Kグラニュライシンの体内発現ベクターと、本発明者らによって開発された結核菌に対する体内発現ベクターで、マウスの系だけではなく、ヒトの結核感染に最も近いモデルとされているカニクイザルの系でも結核の強い治療効果を示すHVJ-エンベロープHSP65DNAとIL-12のDNAの体内発現ベクター(以下HSP65DNAとIL-12DNA体内発現ベクターと称する)を有効成分として含む感染症治療剤を投与することによって、15Kグラニュライシンの体内発現ベクターを単独、もしくはHSP65DNAとIL-12DNA体内発現ベクター単独で投与するよりも更に強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
尚、HSP65DNAとIL-12DNA体内発現ベクターはヒト型結核菌H37Rvの65KDaヒートショックプロテインのDNA(HSP65DNA)とIL-12のDNAをセンダイウイルス(HVJ)のエンベロープに組み込んだ体内発現ベクターで、結核菌に対して強い治療効果を有することが知られている(Okada et.al, Jpn.J.Clin.Immunol.,31 (5) 356〜368(2008))。
【0016】
請求項5に係る発明によれば、15Kグラニュライシン蛋白質を安定して大量に供給することができる。
【0017】
請求項6に係る発明によれば、結核菌に有効な感染症治療剤を提供することができる。
【0018】
本発明により、15Kグラニュライシンと15Kグラニュライシンの体内発現ベクターの組み合わせ、15KグラニュライシンとIL-6、IL-23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとIL-6、IL−23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせによって副作用が認められず、15Kグラニュライシンを単独で投与するよりもさらにマクロファージに取り込まれた結核菌等の細菌に対して殺傷性のある感染症治療剤が提供される。
【図面の簡単な説明】
【0019】
【図1】結核菌に腹腔内感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン組換え蛋白質と15Kグラニュライシン発現ベクターの治療効果示す図である。
【図2】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン組換え蛋白質と、IL-6の治療効果を示す図である。
【図3】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシンの体内発現ベクターとIL-6の治療効果を示す図である。
【図4】結核菌にエアゾル感染させたマウス(BALB/c)の肝臓における15Kグラニュライシン組換え蛋白質とIL-6の治療効果を示した図である。
【図5】結核菌にエアゾル感染させたマウス(BALB/c)の肺臓における15Kグラニュライシン組換え蛋白質とIL-6の治療効果を示した図である。
【図6】結核菌にエアゾル感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの治療効果を示した図である。
【図7】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの治療効果を示した図である。
【図8】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン組換え蛋白質とIL-23の治療効果を示した図である。
【図9】結核菌にエアゾル感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン組換え蛋白質とIL-23の治療効果を示した図である。
【図10】結核菌にエアゾル感染させたマウス(DBA/1)の肺臓における15Kグラニュライシン組換え蛋白質とIL-23の治療効果を示した図である。
【図11】結核菌にエアゾル感染させたマウス(DBA/1)の脾臓における15Kグラニュライシン体内発現ベクターとIL-23の治療効果を示した図である。
【図12】結核菌にエアゾル感染させたマウス(BALB/c)の肺臓における15Kグラニュライシン組換え蛋白質とIL-27の治療効果を示した図である。
【図13】結核菌にエアゾル感染させたマウス(DBA/1)の肝臓における15Kグラニュライシン体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの治療効果を示した図である。
【発明を実施するための形態】
【0020】
以下、本発明の実施の形態について説明する。
本治療剤の有効成分として用いる15Kグラニュライシンは、生体から分離して用いることも可能であるが、生体微量成分である故、15Kグラニュライシンをコードする遺伝子を発現させて得られる、組換え蛋白質として用いることが好適である。また、15Kグラニュライシンをコードする遺伝子が組み込まれた、15Kグラニュライシンの体内発現ベクターを有効成分として、体内で15Kグラニュライシンを産生させることも、好適な手段である。
【0021】
(15Kグラニュライシンの組換え蛋白質の作製方法)
15Kグラニュライシンをコードする遺伝子配列は、既に報告されており、これを基に、15Kグラニュライシンをコードする遺伝子を効率的に調製して、この遺伝子を発現させることにより、15Kグラニュライシンの組換え蛋白質を調製することが可能である。
【0022】
具体的には、15Kグラニュライシンをコードする遺伝子配列の両端に対して相補的なヌクレオチド鎖を増幅用プライマーとして、PCR法等の遺伝子増幅法により、15Kグラニュライシンをコードする遺伝子の遺伝子増幅産物を調製する。
これを、適切な遺伝子発現用ベクターに組み込み、かかる組換えベクターで形質転換を行った大腸菌、枯草菌、酵母、昆虫細胞などの適切な宿主から、所望する15Kグラニュライシンを得ることができる。
【0023】
ここで用いる遺伝子発現用ベクターは、通常発現しようとする遺伝子の上流域にプロモーター,エンハンサー,および下流域に転写終了配列などを保有するものを用いるのが好適である。
【0024】
また、15Kグラニュライシン遺伝子の発現は、直接発現系に限らず、例えばβ−ガラクトシダーゼ遺伝子,グルタチオン−S−トランスフェラーゼ遺伝子やチオレドキシン遺伝子を利用した融合タンパク質発現系とすることもできる。
【0025】
遺伝子発現用ベクターとしては、例えば、宿主を大腸菌とするものとしては、pQE,pGEX,pT7−7,pMAL,pTrxFus,pET,pNT26CIIなどを例示することができる。また、宿主を枯草菌とするものとしては、pPL608,pNC3,pSM23,pKH80などを例示することができる。
【0026】
また、宿主を酵母とするものとしては、pGT5,pDB248X,pART1,pREP1,YEp13,YRp7,YCp50などを例示することができる。
【0027】
また、宿主を哺乳動物細胞または昆虫細胞とするものとしては、p91023,pCDM8,pcDL−SRα296,pBCMGSNeo,pSV2dhfr,pSVdhfr,pAc373,pAcYM1,pRc/CMV,pREP4,pcDNAIなどを例示することができる。
【0028】
これらの遺伝子発現ベクターは、15Kグラニュライシンを発現させる目的に応じて選択することができる。例えば、15Kグラニュライシンを発現させる場合には、宿主として大腸菌,枯草菌または酵母などを選択し得る遺伝子発現ベクターを選択するのが好ましく、少量でも確実に活性を有するように15Kグラニュライシンを発現させる場合には、哺乳動物細胞や昆虫細胞を宿主として選択し得る遺伝子発現ベクターを選択するのが好ましい。
【0029】
また、上記のように既存の遺伝子発現ベクターを選択することも可能であるが、目的に応じて適宜遺伝子発現ベクターを作出して、これを用いることも勿論可能である。
【0030】
15Kグラニュライシン遺伝子を組み込んだ上記遺伝子発現用ベクターの宿主細胞への導入およびこれによる形質転換法は、一般的な方法、例えば宿主細胞が大腸菌や枯草菌である場合には、塩化カルシウム法やエレクトロポレーション法などの手段により行うことができ、宿主が哺乳動物細胞や昆虫細胞の場合はリン酸カルシウム法,エレクトロポレーション法またはリポソーム法などの手段により行うことができる。
【0031】
このようにして得られる形質転換体を常法に従い培養することにより、所望する15Kグラニュライシンが蓄積される。かかる培養に用いられる培地は、宿主の性質に応じて適宜選択することができるが、例えば宿主が大腸菌である場合には、LB培地やTB培地などが、宿主が哺乳動物細胞の場合には、RPMI1640培地などを適宜用いることができる。
【0032】
この培養により得られる培養物からの15Kグラニュライシンの単離および精製は、常法に従い行うことが可能であり、例えば培養物を、15Kグラニュライシンの物理的および/または化学的性質を利用した各種の処理操作を用いて行うことが可能である。
【0033】
具体的には、タンパク沈澱剤による処理,限外濾過,ゲル濾過,高速液体クロマトグラフィー,遠心分離,電気泳動,特異抗体を用いたアフィニティクロマトグラフィー,透析法などを単独でまたはこれらの方法を組み合わせて用いることができる。
【0034】
(15Kグラニュライシンの体内発現ベクターの作製方法)
この形態の本治療剤の有効成分は、上記の組換え蛋白質の発現に用いられた、15Kグラニュライシンをコードする遺伝子を、体内発現ベクターに組み込んだ、組換えベクターである。
【0035】
体内発現ベクターとしては、例えば、アデノウイルスベクター、レトロウイルスベクター等を挙げることができるが、これらに限定されるものではない。体内発現ベクターは、例えば、上記のウイルス遺伝子を組み込んだコスミドベクターに、さらに、15Kグランニュライシンを発現可能な遺伝子を組み込んで、このコスミドベクターと、制限酵素処理を行った親ウイルスDNA−TPを、293細胞にトランスフェクションすることにより、この293細胞内で相同組換えが起こり、所望する体内発現ベクターが生産される。
【0036】
(15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを有効成分とした本治療剤)
15Kグラニュライシンの組換え蛋白質と15Kグラニュライシンの体内発現ベクターの両物質を用いることにより、単独で用いるよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0037】
15Kグラニュライシンは適切な医薬製剤担体を配合して、製剤組成物の形態に調製することが可能である(15Kグラニュライシンのみでも勿論可能である)。医薬製剤担体としては、例えば、具体的な剤型に応じて、適宜医薬製剤担体として慣用され得る、充填剤、増量剤、結合剤、付湿剤、安定剤、溶解補助剤、崩壊剤、表面活性剤などの賦形剤や希釈剤を自由に選択することができる。製剤組成物の形態は、15Kグラニュライシンを、感染症の治療用途に効果的に用い得る形態であれば特に限定されず、例えば、錠剤、粉末剤、顆粒剤、丸剤などの固剤であっても、液剤、懸濁剤、乳剤などの注射剤形態とすることもできる。また、15Kグラニュライシンに適切な担体を添加することによって、用時に液状とするべき乾燥品とすることも可能である。
【0038】
15Kグラニュライシンの体内発現ベクターは上述のようにして調製され得る体内発現ベクターを、単離・精製して、これを生体に投与することにより、生体内に15Kグラニュライシンが産生され、この15Kグラニュライシンの薬理効果が発揮され得る。
【0039】
投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではないが、有効成分である15Kグラニュライシン組換え蛋白質10000μg/50kgは1日1回または数回に分けて、また、15Kグラニュライシンの体内発現ベクター、2000μg/50kgは1日1回、、それぞれを数日間の間隔をあけて6回投与することが好ましい。
【0040】
尚、15Kグラニュライシンの体内発現ベクターは注射剤形態が一般的であるので、15Kグラニュライシンの組換え蛋白質に適切な担体を添加することによって注射剤形態として、15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを静脈内、筋肉内、骨内、関節内、皮下、皮内、腹腔内に同時または間隔をあけて交互に投与することもできる。
【0041】
(15Kグラニュライシンの組換え蛋白質とIL-6、IL−23、IL−27のいずれか一つを有効成分とした本治療剤)
15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23またはIL−27のいずれか一つを用いることにより、単独で用いるよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0042】
15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23またはIL−27は、適切な医薬製剤担体を配合して、製剤組成物の形態に調製することが可能である。医薬製剤担体としては、例えば、具体的な剤型に応じて、適宜医薬製剤担体として慣用され得る、充填剤、増量剤、結合剤、付湿剤、安定剤、溶解補助剤、崩壊剤、表面活性剤などの賦形剤や希釈剤を自由に選択することができる。製剤組成物の形態は、15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23、またはIL−27のいずれか一つを、感染症の治療用途に効果的に用い得る形態であれば特に限定されず、例えば、錠剤、粉末剤、顆粒剤、丸剤などの固剤であっても、液剤、懸濁剤、乳剤などの注射剤形態とすることもできる。また、15Kグラニュライシンの組換え蛋白質とIL-6またはIL−23、またはIL−27のいずれか一つに適切な担体を添加することによって、用時に液状とするべき乾燥品とすることも可能である。
【0043】
このようにして得られる本治療剤の投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではないが、有効成分である15Kグラニュライシン組換え蛋白質10000μg/50kg、IL-6の場合は2500μg/50kg、IL-23の場合は5000μg/50kg、IL-27の場合は2500μg/50kgを1日1回または数回に分け、数日間から1週間以上の間隔をあけて6回投与することが好ましい。投与は両物質を同時または間隔をあけて交互に投与することもできる。
【0044】
尚15Kグラニュライシン蛋白質とインターロイキンの組み合わせは強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を有するため治療回数を3回に減らすことも可能である。
【0045】
このような各種の形態の医薬製剤は、その形態に応じて適当な投与経路、例えば、注射剤形態の場合には、静脈内、筋肉内、骨内、関節内、皮下、皮内、腹腔内投与などにより、固剤形態の場合には、経口や経腸投与などにより投与され得る。
【0046】
(15Kグラニュライシンの体内発現ベクターとIL-6またはIL−23またはIL−27のいずれか一つを有効成分とした本治療剤)
15Kグラニュライシンの体内発現ベクターとIL-6またはIL−23またはIL−27のいずれか一つを用いることにより、単独で用いるよりも強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を得ることができる。
【0047】
15Kグラニュライシンの体内発現ベクターとIL-6またはIL−23、またはIL27は、上述のように適切な医薬製剤担体を配合して製剤組成物の形態に調整して使用することができる。このようにして得られる本治療剤の投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではないが、有効成分である15Kグラニュライシンの体内発現ベクター2000μg/50kgは1日1回、IL-6の場合は2500μg/50kg、IL-23の場合は5000μg/50kg、IL-27の場合は2500μg/50kgを1日1回または数回に分け、それぞれを数日間から1週間以上の間隔をあけて6回投与することが好ましい。
【0048】
尚、15Kグラニュライシンの体内発現ベクターは注射剤形態が一般的であるので、IL-6またはIL−23、またはIL−27のいずれか一つに適切な担体を添加することによって注射剤形態として両物質を同時または交互に投与することもできる。
【0049】
(15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターを有効成分とした本治療剤)
15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの投与形態は、注射剤形態であることが一般的であり、静脈内、筋肉内、骨内、関節内、皮下、皮内、腹腔内投与などにより、投与され得る。このような本治療剤の投与量は、剤の投与方法、投与形態、患者の症状などに応じて適宜選択することが可能であり、特に限定されるべきものではない。
【0050】
一般には、有効成分である15Kグラニュライシンの体内発現ベクター2000μg/50kg及びHSP65DNAとIL-12DNA体内発現ベクター2000μg/50kgを1日1回、数日間の間隔をあけて6回投与することが好ましい。
【0051】
尚15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせは強いマクロファージに取り込まれた結核菌等の細菌の殺傷効果を有するため治療回数を3回に減らすことも可能である。
【実施例】
【0052】
以下に、本発明の実施例を記載する。
【0053】
(1)15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクター、(2)15Kグラニュライシン組換え蛋白質とIL-6、IL−23、IL−27のいずれか一つ、(3)15Kグラニュライシンの体内発現ベクターとIL-6、IL−23、IL−27のいずれか一つ及び(4)15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL−12DNA体内発現ベクターを用いた時の細菌に対する殺傷効果の向上について説明する。
【0054】
以下に用いる相乗効果という用語はそれぞれの物質を単独で用いるよりも、二つの物質の組み合わせて用いる方が細菌に対する殺傷効果が向上した場合のことを言う。
【0055】
実験において用いるG1群からG10群の表示は以下の表1の通りである。
【0056】
【表1】

【0057】
(使用試薬等)
15Kグラニュライシン組換え蛋白質はR&D Systems社の精製蛋白質を使用した。IL-6はMiltenyi Biotec(Auburn, CA)社製の精製蛋白質を使用した。IL−23、IL−27はR&D Systems 社のrecombinant mouse IL-23及びrecombinant mouse IL-27の精製蛋白質を使用した。
【0058】
15Kグラニュライシンの体内発現ベクターは15Kグラニュライシンの遺伝子をCAGベクターに連結し、センダイウイルス(HVJ)のエンベロープに組み込んだ。また、HSP65DNAとIL−12DNAの体内発現ベクターはそれそれの遺伝子をpcDNA3・1ベクターに連結しセンダイウイルス(HVJ)エンベロープに組み込んだものを用いた。
マウスはDBA/1とBALB/cを用いた。これらのマウスは結核菌に易感染性である。
有意差検定にはStudentのt検定を用いた。
【0059】
以下の実験において15Kグラニュライシン組換え蛋白質を投与する場合は1匹(20g)あたり1日に4μg投与した。
15Kグラニュライシンの体内発現ベクターは1匹(20g)あたり1日に100μg/0.2mlを50μgずつ両側下肢の前頸骨筋に筋肉注射することによって投与した。
IL-6は1匹(20g)あたり1日に1μg(≧5×104International Unit)、IL−23は1匹(20g)あたり2μg(≧5×104International Unit)、IL-27は1匹(20g)あたり1日に1μg(≧5×104International Unit)を3回に分けて1/3ずつ腹腔内投与した。
【0060】
感染させる細菌はヒト型結核菌H37Rvを用いた。
結核菌を腹腔内感染させる場合は1×107CFUを生理食塩水0.2mlに懸濁し、これを腹腔内に投与することによって行った。
結核菌を肺感染させる場合にはエアゾルチャンバーで1×103CFUをマウス気道内に投与することによって行った。
【0061】
(実験1)
(腹腔内感染における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの結核菌に対する相乗効果について)
8週齢のDBA/1マウスに結核菌を腹腔内感染させた。そのマウスを何も与えない群(G1群)、15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを与える群(G2群)、15Kグラニュライシン組換え蛋白質のみを与える群(G5群)、15Kグラニュライシンの体内発現ベクターのみを与える群(G6群)に分けた。
【0062】
G2群には15Kグラニュライシン組換え蛋白質を4回、間隔をあけて投与した。また15Kグラニュライシンの体内発現ベクターを7回、間隔をあけて投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G6群には15Kグラニュライシンの体内発現ベクターのみをG2群と同日に投与した。G1群には与えなかった。
【0063】
その後解剖して肝臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0064】
その結果、G2群のコロニー数はG5群、G6群と比べて少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2群はG5群,G6群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0065】
また、コントロールであるG1群とG2群、G5群、G6群について同じ方法で有意差検定を行ったところG2群、G5群、G6群の全てにおいてG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図1)。
【0066】
従って15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターは肝臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0067】
(実験2)
(DBA/1マウスにおける15Kグラニュライシン組換え蛋白質とIL-6の結核菌に対する相乗効果について)
8週齢のDBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も与えない群(G1群)、15Kグラニュライシン組換え蛋白質とIL-6を与える群(G3群)と15Kグラニュライシン組換え蛋白質のみを与える群(G5群)、IL-6のみを与える群(G7群)に分けた。
【0068】
G3群には、15Kグラニュライシン組換え蛋白質とIL-6をそれぞれ交互に6回ずつ投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G7群にはIL-6のみをそれぞれ6回ずつ投与した。G1群には投与しなかった。
【0069】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0070】
その結果、G3群のコロニー数はG5群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG3群はG5群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0071】
また、コントロールであるG1群とG3、G5、G7群について同じ方法で有意差検定を行ったところG3群、G5群、G7群、の全てがG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図2)。
【0072】
従って15Kグラニュライシン組換え蛋白質とIL-6は脾臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0073】
(実験3)
(15Kグラニュライシンの体内発現ベクターとIL-6の結核菌に対する相乗効果について)
エアゾルチャンバーで結核菌を肺感染させた8週齢のDBA/1マウスを何も投与しない群(G1群)、15Kグラニュライシンの体内発現ベクターとIL-6を投与する群(G9群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、IL-6のみを投与する群(G10群)に分けた。
【0074】
G9群には15Kグラニュライシン体内発現ベクターとIL-6をそれぞれ6回ずつ投与した。投与は15Kグラニュライシンの体内発現ベクターを全実験期間の前半に行い、IL-6を後半に行った。G6群には15Kグラニュライシンの体内発現ベクターのみ、G10群にはIL-6のみを6回投与した。G1群には投与しなかった。
【0075】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0076】
その結果、G9群のコロニー数はG6群及びG10群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG9群はG6群、G10群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0077】
また、コントロールであるG1群とG9、G6、G10群について同じ方法で有意差検定を行ったところG9群、G6群、G10群、の全てがG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図3)。
【0078】
従って、15Kグラニュライシンの体内発現ベクターとIL-6の組み合わせは脾臓においてそれぞれ単独で用いるよりも結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0079】
(実験4)
(BALB/cマウスにおける15Kグラニュライシンの組換えタンパク質とIL-6の結核菌に対する相乗効果について)
結核の感染実験によく用いられるBALB/cマウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシン組換え蛋白質とIL-6を投与する群(G3群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、IL-6のみを投与する群(G7群)に分けた。
【0080】
G3群には、15Kグラニュライシン組換え蛋白質とIL-6をそれぞれ交互に6回ずつ投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G7群にはIL-6のみをそれぞれ6回投与した。G1群には投与しなかった。
【0081】
その後解剖して肝臓及び肺臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0082】
その結果、G3群のコロニー数はG5群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG3群はG5群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0083】
また、コントロールであるG1群とG3、G5、G7群について同じ方法で有意差検定を行ったところG3群、G5群、G7群、の全てがG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(肝臓(図4)、肺臓(図5))。
【0084】
従って15KグラニュライシンとIL-6は肝臓及び肺臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0085】
(実験5)
(肺感染における、DBA/1マウスにおける15Kグラニュライシンの組換えタンパク質と15Kグラニュライシンの体内発現ベクターの結核菌に対する相乗効果について)
8週齢のDBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを投与する群(G2群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)に分けた。
【0086】
G2群には15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを間隔をあけて6回、同日に投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G6群には15Kグラニュライシンの体内発現ベクターのみを6回投与した。
【0087】
その後解剖して肝臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0088】
その結果、G2群のコロニー数はG5群、G6群と比べて少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2群はG5群,G6群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図6)。
【0089】
従って15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターは肝臓において、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0090】
(実験6)
(肺感染における15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターの結核菌に対する相乗効果について)
8週齢のDBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを投与する群(G2群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)に分けた。
【0091】
G2群には15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターを、間隔をあけて6回、同日に投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G6群には15Kグラニュライシンの体内発現ベクターのみを6回投与した。G1群には投与しなかった。
【0092】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0093】
その結果、G2群のコロニー数はG5群、G6群と比べて少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2群はG5群,G6群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0094】
また、コントロールであるG1群とG2、G5、G6群について同じ方法で各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG2、G5群、G6群の全てにおいてG1群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。(図7)
【0095】
従って15Kグラニュライシン組換え蛋白質と15Kグラニュライシンの体内発現ベクターは脾臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0096】
(実験7)
(15Kグラニュライシン組換え蛋白質とIL-23の結核菌に対する相乗効果について)
DBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシン組換え蛋白質とIL-23を投与する群(G3群)と15Kグラニュライシン組換え蛋白質のみを投与する群(G5群)、IL-23のみを投与する群(G7群)に分けた。
【0097】
G3群には、15Kグラニュライシン組換え蛋白質とIL-23をそれぞれ交互に6回ずつ投与した。G5群には15Kグラニュライシン組換え蛋白質のみを、G7群にはIL-23のみをそれぞれ6回投与した。G1群には投与しなかった。
【0098】
その後解剖して脾臓、肝臓及び肺臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0099】
その結果、脾臓、肝臓及び肺臓の全てにおいてG3群のコロニー数はG5群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG3群はG5群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0100】
また、コントロールであるG1群とG3、G5、G7群について同じ方法で各群3匹ずつの有意差検定を行ったところG3群、G5群、G7群、の全てがG1に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(脾臓(図8)、肝臓(図9)、肺臓(図10))。
【0101】
従って15KグラニュライシンとIL-23は脾臓、肝臓、肺臓の全てにおいて、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0102】
(実験8)
(15Kグラニュライシンの体内発現ベクターとIL-23の結核菌に対する相乗効果について)
DBA/1マウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを何も投与しない群(G1群)、15Kグラニュライシンの体内発現ベクターとIL-23を投与する群(G4群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、IL-23のみを投与する群(G7群)に分けた。
【0103】
G4群には、15Kグラニュライシンの体内発現ベクターとIL-23をそれぞれ交互に6回ずつ投与した。G6群には15Kグラニュライシンの体内発現ベクターのみを、G7群にはIL-23のみをそれぞれ6回ずつ投与した。G1群には投与しなかった。
【0104】
その後解剖して脾臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0105】
その結果、G4群のコロニー数はG6群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG4群はG6群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた。
【0106】
また、コントロールであるG1群とG4、G6、G7群について同じ方法で有意差検定を行ったところG4群、G6群、G7群、の全てがG1に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図11)。
【0107】
従って15Kグラニュライシンの体内発現ベクターとIL-23は脾臓において、それぞれ単独でも効果があるが、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0108】
(実験9)
(15Kグラニュライシンの体内発現ベクターとIL-27の結核菌に対する相乗効果について)
BALB/cマウスにエアゾルチャンバーで結核菌を肺感染させた。これらのマウスを15Kグラニュライシンの体内発現ベクターとIL-27を投与する群(G4群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、IL-27のみを投与する群(G7群)に分けた。
【0109】
G4群には15Kグラニュライシンの体内発現ベクターとIL-27をそれぞれ交互に6回ずつ投与した。G6群には15Kグラニュライシンの体内発現ベクターのみを、G7群にはIL-27のみをそれぞれ6回ずつ投与した。
【0110】
その後解剖して肺臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0111】
その結果、G4群のコロニー数はG6群及びG7群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG4群はG6群,G7群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図12)。
【0112】
従って15Kグラニュライシンの体内発現ベクターとIL-27は肺臓において、組み合わせて用いると結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【0113】
(実験10)
(15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの結核菌に対する相乗効果について)
エアゾルチャンバーで結核菌を肺感染させた8週齢のDBA/1マウスを15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターを投与する群(G11群)と15Kグラニュライシンの体内発現ベクターのみを投与する群(G6群)、HSP65DNAとIL-12DNA体内発現ベクターのみを投与する群(G12群)に分けた。
【0114】
G11群には15Kグラニュライシン体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターをそれぞれ6回ずつ交互に投与した。G6群には15Kグラニュライシンの体内発現ベクターのみ、G12群にはHSP65DNAとIL-12DNA体内発現ベクターのみを6回投与した。
【0115】
その後解剖して肝臓の細胞を7H11平板寒天培地で14日間培養し、結核菌のコロニー数を測定した。
【0116】
その結果、G11群のコロニー数はG6群及びG12群に比べ少なく、各群3匹ずつのコロニー数を対数(log10)にして有意差検定を行ったところG11群はG6群、G12群に対して統計学的有意差(P<0.05)をもって結核菌数の減少が認められた(図13)。
【0117】
従って、15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせは肝臓においてそれぞれ単独で用いるよりも結核菌に対する殺傷性が有意に向上し相乗効果があることが分かった。
【産業上の利用可能性】
【0118】
本発明により、有効成分として、15Kグラニュライシンと15Kグラニュライシンの体内発現ベクターの組み合わせ、15KグラニュライシンとIL-6、IL-23またはIL−27の組み合わせ、15Kグラニュライシンの体内発現ベクターとIL-6、IL−23またはIL−27の組み合わせ及び15Kグラニュライシンの体内発現ベクターとHSP65DNAとIL-12DNA体内発現ベクターの組み合わせを含み、副作用が少なく、かつ、細菌が耐性獲得をし難い、有効な感染症治療剤を提供することができる。
【特許請求の範囲】
【請求項1】
15Kグラニュライシンと15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターを有効成分として含む感染症治療剤。
【請求項2】
15Kグラニュライシンと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
【請求項3】
15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
【請求項4】
以下の(a)、(b)を有効成分として含む感染症治療剤。
(a)15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクター
(b)センダイウイルスのエンベロープにヒト型結核菌H37Rvの65KDaヒートショックプロテインをコードする遺伝子とインターロイキン12をコードする遺伝子を組み込んで、65KDaのヒートショックプロテインとインターロイキン12を体内発現させるベクター
【請求項5】
前記15Kグラニュライシンが、組換え蛋白質であることを特徴とする請求項1又は2に記載の感染症治療剤。
【請求項6】
感染症の原因菌が結核菌である請求項1乃至5のいずれかに記載の感染症治療剤。
【請求項1】
15Kグラニュライシンと15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターを有効成分として含む感染症治療剤。
【請求項2】
15Kグラニュライシンと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
【請求項3】
15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクターと以下の物質(a)乃至(c)のいずれか一つを有効成分として含む感染症治療剤。
(a) インターロイキン6
(b) インターロイキン23
(c) インターロイキン27
【請求項4】
以下の(a)、(b)を有効成分として含む感染症治療剤。
(a)15Kグラニュライシンをコードする遺伝子を組み込んで、15Kグラニュライシンを体内発現させるベクター
(b)センダイウイルスのエンベロープにヒト型結核菌H37Rvの65KDaヒートショックプロテインをコードする遺伝子とインターロイキン12をコードする遺伝子を組み込んで、65KDaのヒートショックプロテインとインターロイキン12を体内発現させるベクター
【請求項5】
前記15Kグラニュライシンが、組換え蛋白質であることを特徴とする請求項1又は2に記載の感染症治療剤。
【請求項6】
感染症の原因菌が結核菌である請求項1乃至5のいずれかに記載の感染症治療剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2010−254662(P2010−254662A)
【公開日】平成22年11月11日(2010.11.11)
【国際特許分類】
【出願番号】特願2009−191378(P2009−191378)
【出願日】平成21年8月20日(2009.8.20)
【出願人】(503198345)
【出願人】(304042777)株式会社アズバイオ (2)
【出願人】(509236210)
【出願人】(504136993)独立行政法人国立病院機構 (37)
【Fターム(参考)】
【公開日】平成22年11月11日(2010.11.11)
【国際特許分類】
【出願日】平成21年8月20日(2009.8.20)
【出願人】(503198345)

【出願人】(304042777)株式会社アズバイオ (2)
【出願人】(509236210)

【出願人】(504136993)独立行政法人国立病院機構 (37)
【Fターム(参考)】
[ Back to top ]

