慢性閉塞性肺疾患増悪感受性の検査法
【課題】慢性閉塞性肺疾患(COPD)増悪感受性の検査法の提供。
【解決手段】ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法。
【解決手段】ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、慢性閉塞性肺疾患(COPD)増悪感受性の検査法に関する。
【背景技術】
【0002】
慢性閉塞性肺疾患(COPD)とは、タバコ煙を主とする有害物質を長期に吸入曝露することで生じる肺の炎症性疾患である。この疾患の患者は、呼吸機能検査で正常に復すことのない気流閉塞を示す。気流閉塞は末梢気道病変と気腫性病変が様々な割合で複合的に作用することにより起こり、進行性である(日本呼吸器学会ガイドライン、2009)。COPDは2020年には全世界の死亡原因の第三位を占めると予測されている(WHO World Health Statistics, 2008)。COPDの増悪とは、COPDを発症した患者において、呼吸困難、咳、喀痰などの症状が日常の生理的変動を超えて急激に悪化し、安定期の治療内容の変更を要する状態をいう(日本呼吸器学会ガイドライン、2009)。COPD患者が入院治療を必要とする場合、そのほとんどは急性増悪が原因であると考えられている。
【0003】
COPDの増悪感受性と関連する遺伝的多型はいくつか報告されている(非特許文献1〜3)が、その遺伝的多型のCOPDの増悪の予防と治療における診断的価値は確立されていない。これらの遺伝的多型は当該遺伝子がコードするタンパク質の質的又は量的な変動をもたらすが、欠損を来すものではないため増悪の指標としては利用しづらく、これらの遺伝的多型と増悪との相関をもとに臨床的に有用な検査法を生み出すには至っていない。
【0004】
シグレック14(Siglec-14)は自然免疫系の細胞(顆粒球、単球など)に発現する免疫グロブリンスーパーファミリーに属する膜タンパク質である(非特許文献4及び特許文献1)。シグレック14は細胞外領域でシアル酸を含む糖鎖を認識し、膜貫通領域でアダプタータンパク質DAP12と会合する(非特許文献4)。またシグレック14は免疫細胞の活性化に関わることも報告されている(特許文献2の図3A、非特許文献5)。シグレック14とシグレック5(Siglec-5)の1〜2番目の免疫グロブリン様ドメインは互いに99%以上のアミノ酸配列相同性を示すことが知られている(非特許文献4)。一方、遺伝的多型によりシグレック14を発現しないヒト個体が比較的高い頻度で存在する(非特許文献5)。この遺伝的多型は、シグレック14遺伝子(SIGLEC14)由来の5'部分と、当該遺伝子に隣接するシグレック5遺伝子(SIGLEC5)由来の3'部分とからなる融合遺伝子シグレック14/5(SIGLEC14/5)(そのタンパク質産物のアミノ酸配列はシグレック5と同一である)が形成され、シグレック14タンパク質をコードする配列領域が失われたものである。この遺伝子多型をホモ接合性で有するヒト個体はシグレック14を発現しない。このような遺伝子多型を検出できる検出用試薬も開発されている(特許文献2)。
【0005】
シグレック14に対するアロ抗体が輸血副作用に関連する可能性が示唆されている(特許文献2、非特許文献6)。しかし、シグレック14の生体における機能は明らかではなく、その発現の有無とヒトの疾患との明確な関連性は知られていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−345786号公報
【特許文献2】特開2010−35551号公報
【非特許文献】
【0007】
【非特許文献1】Lin CL et al., "Mannose-binding lectin gene polymorphism contributes to recurrence of infective exacerbation in patients with COPD." Chest., (2011) 139(1):43-51
【非特許文献2】Foreman MG., et al., "Polymorphic variation in surfactant protein B is associated with COPD exacerbations." Eur. Respir. J., (2008) 32(4):938-944
【非特許文献3】Muller B and Tamm M., "Biomarkers in acute exacerbation of chronic obstructive pulmonary disease: among the blind, the one-eyed is king." Am. J. Respir. Crit. Care Med., (2006) 174(8):848-849
【非特許文献4】Angata T., et al., "Discovery of Siglec-14, a novel sialic acid receptor undergoing concerted evolution with Siglec-5 in primates." FASEB J., (2006) 20(12):1964-73
【非特許文献5】Yamanaka M, et. al., "Deletion polymorphism of SIGLEC14 and its functional implications." Glycobiology. (2009) 19(8):841-846
【非特許文献6】Yasui K, et al., "Detection of anti-Siglec-14 alloantibodies in blood components implicated in nonhaemolytic transfusion reactions." Br. J. Haematol., (2011) 153(6):794-796
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、COPD増悪感受性の検査法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するため鋭意検討を重ねた結果、シグレック14の遺伝子型がCOPD増悪感受性と強く相関することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は以下を包含する。
[1] ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法。
[2] 前記生物学的試料が、血液由来試料である、上記[1]の方法。
[3] 前記生物学的試料中のシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、上記[1]又は[2]の方法。
[4] 血液由来試料中の可溶性シグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、上記[2]の方法。
[5] 前記生物学的試料中のゲノムDNA配列に基づいて、シグレック14の遺伝子型を決定する、上記[1]又は[2]の方法。
[6] 決定されたシグレック14の遺伝子型の野生型アレルの数を、増悪感受性の指標とする、上記[1]〜[5]の方法。
[7] 前記ヒト被験体が慢性閉塞性肺疾患を発症した患者である、上記[1]〜[6]の方法。
【発明の効果】
【0011】
本発明の方法を用いればCOPD患者の増悪感受性を早期に検査することができる。
【図面の簡単な説明】
【0012】
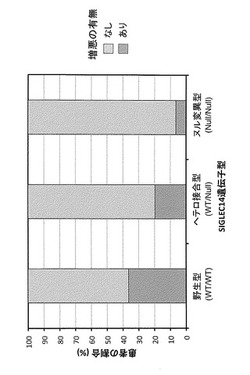
【図1】シグレック14遺伝子型とAnthonisenらの定義によるCOPD細菌性増悪の有無との関係を示す図である。各バーの上部(淡色)が増悪なし、下部(濃色)が増悪ありを示す。野生型の増悪ありの95%信頼区間は22.2〜53.4%、ヘテロ接合型の増悪ありの95%信頼区間は12.1〜30.4%、ヌル変異型の増悪ありの95%信頼区間は1.8〜20.7%である。
【図2】シグレック14遺伝子型とRodriguez-Roisinの定義によるCOPD増悪の頻度との関係を示す図である。各バーの最上部から最下部(淡色〜濃色)までのそれぞれの部分は、順番に、0回、1回、2回、3回の増悪頻度(回数/年)を示す。
【図3】シグレック14タンパク質特異的ELISAの結果を示す図である。横軸は検出した各Siglec-Fc(Siglec-14-Fc及びSiglec-5-Fc)の添加濃度を示す。黒塗り丸がSiglec-14-Fc、白抜き丸がSiglec-5-Fcを表す。
【図4】シグレック14遺伝子多型と可溶性シグレック14の血中濃度との関係を示す図である。白抜きバーは、シグレック5と14をともに検出する抗体によって検出された、シグレック5及び14の血清中の総濃度を示す。黒塗りバーは、シグレック14を特異的に認識する抗体を用いたELISAによって検出された、シグレック14の血清中濃度を示す。
【発明を実施するための形態】
【0013】
以下、本発明を詳細に説明する。
本発明では、慢性閉塞性肺疾患(COPD)患者の増悪感受性と強く相関する遺伝的マーカー及び血清マーカーを検出することにより、増悪感受性に基づく患者の層別化を可能とする。
【0014】
本発明は、被験体(好ましくはヒト被験体)のシグレック14の遺伝子型を指標としてその被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法に関する。より具体的には、本発明は、ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、それを慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法に関する。
【0015】
本発明は、ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、それを慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を判定するための指標となるデータを収集する方法も提供する。
【0016】
本発明において、シグレック14の遺伝子型の決定とは、検査対象のヒト被験体(被験ヒト個体)のゲノム上のシグレック14遺伝子座が有するアレル(対立遺伝子)の組み合わせを決定することを意味する。シグレック14遺伝子には遺伝的多型が存在することが知られており、一部のヒトでは、シグレック14遺伝子とシグレック5遺伝子が融合してシグレック14/5融合遺伝子を形成し、その結果、シグレック14タンパク質は産生されない(ヌル変異型アレルへの変異)ことが分かっている。すなわち本発明において、シグレック14の遺伝子型の決定とは、具体的には、シグレック14遺伝子(野生型アレル)をホモ接合で有する遺伝子型(野生型;WT/WT)、シグレック14の野生型アレルとヌル変異型アレルとのヘテロ接合である遺伝子型(ヘテロ接合型;WT/Null)、シグレック14のヌル変異型アレルのホモ接合である遺伝子型(ヌル変異型;Null /Null)のいずれであるかを決定することをいう。
【0017】
ここで、ゲノム上のシグレック14遺伝子(野生型アレル)は、例えば、配列番号1に示す塩基配列を有する。配列番号1の1001〜4405番目が野生型シグレック14タンパク質をコードするORFに対応するゲノム領域であり、そこにコードされている野生型シグレック14タンパク質のアミノ酸配列を配列番号2に示す。シグレック14の配列情報はGenBank等のデータベースでも公開されており、例えばヒトシグレック14の配列情報はGenBankアクセッション番号AAX47338、NP_001092082等で入手することができる。配列番号2に示すシグレック14タンパク質は、シグナルペプチド(配列番号2の1〜17番目)と成熟タンパク質(配列番号2の18〜396番目)からなり、成熟タンパク質は、免疫グロブリン様ドメイン1(配列番号2の26〜140番目)、免疫グロブリン様ドメイン2(配列番号2の149〜233番目)、リンカー(配列番号2の234〜251番目)、免疫グロブリン様ドメイン3(配列番号2の265〜326番目)、膜貫通ドメイン(配列番号2の359〜381番目)及びサイトゾル尾部(配列番号2の382〜396番目)を含む。免疫グロブリン様ドメイン1〜3を含む細胞外領域又はその部分断片は可溶性である。
【0018】
ゲノム上のシグレック5遺伝子の塩基配列の例を、配列番号3に示す。配列番号3の1001〜19105番目がシグレック5タンパク質をコードするORFに対応するゲノム領域である。そこにコードされているシグレック5タンパク質のアミノ酸配列を配列番号4に示す。なおシグレック5タンパク質のアミノ酸配列は、シグレック14/5融合タンパク質のアミノ酸配列と同一である。
【0019】
ゲノム上のシグレック14/5融合遺伝子の塩基配列の例を、配列番号5に示す。配列番号5の1001〜19105番目がシグレック14/5融合タンパク質をコードするORFに対応するゲノム領域である。シグレック14/5融合タンパク質のアミノ酸配列は、シグレック5タンパク質のアミノ酸配列と同一であり、両者は同一のタンパク質であるため、シグレック14/5融合タンパク質のアミノ酸配列も配列番号4に示すものである。
【0020】
本発明の方法で検出されるゲノム上のシグレック14遺伝子(野生型アレル)は、配列番号1に示す塩基配列を有するものであってよいが、配列番号2のアミノ酸配列をコードする限り異なる塩基配列を有していてもよい。さらに、ゲノム上のシグレック14遺伝子(野生型アレル)は、配列番号2のアミノ酸配列において1〜数個(例えば2〜5個)のアミノ酸の欠失、置換又は付加の変異を引き起こす塩基変異を含むものであってもよい。
【0021】
本発明で検査に供する生物学的試料は、基本的には、慢性閉塞性肺疾患の増悪感受性について検査しようとするヒト被験体から採取する。検査対象のヒト被験体は、健康であっても健康でなくてもよい。一実施形態では、検査対象となるヒト被験体は、肺疾患を有する者、特に、慢性閉塞性肺疾患(COPD)を発症した者が好適である。別の実施形態では、検査対象となるヒト被験体は、喫煙者であるか又は喫煙歴がある者が好適である。検査対象となるヒト被験体はまた、粉塵や大気汚染条件に長期間曝露されたか又はされている者が好適である。被験体が慢性閉塞性肺疾患を発症しているか否かは、臨床現場で用いられている通常の基準に基づいて判断すればよいが、例えば、気流制限(気管支の狭窄・閉塞などによって生じた、呼吸をする際の空気の流れの制限)が認められ、かつ気管支拡張剤投与後に行った肺機能検査で1秒率(FEV1/FVC)が0.7以下の場合に、慢性閉塞性肺疾患に罹患していると判断することができる。ここで、FEV1は、一秒量、すなわち、息をできるだけ速く吐き出したときに1秒間で吐き出すことのできる呼気量である。またFVCは、努力肺活量、すなわち、息を大きく吸い込みできるだけ速く吐き出したときの肺活量である。
【0022】
生物学的試料は、例えば、血液(例えば、末梢血)、血清、血漿、又は血液中の白血球等の、血液由来試料であってよいし、皮膚、粘膜(口腔粘膜、鼻内粘膜等)、骨髄、脂肪等の単離組織試料(例えば、口腔擦過試料、手術切除組織等)及びそこに含まれる細胞を含む試料、又は他の生体試料(例えば、気道洗浄液、口内洗浄液等の体内洗浄液、若しくは喀痰等)であってもよいが、これらに限定されない。本発明の検査方法に用いる生物学的試料は、一実施形態では、血液由来試料が好ましい。
【0023】
生物学的試料を用いて被験体のシグレック14の遺伝子型を決定する方法の一例として、生物学的試料中のDNAについてシグレック14遺伝子とシグレック14/5融合遺伝子の有無を検出する方法が挙げられる。生物学的試料は上記のような任意のものであってよいが、血液由来試料、例えば血液又は血液中の白血球等が好ましい。
【0024】
生物学的試料中のDNAについて検出実験を行う場合、当該生物学的試料を直接実験に供してもよいが、予め、溶血処理や、DNA抽出及び精製処理を行っておくことがより好ましい。溶血処理や、生物学的試料からのDNA抽出・精製は、常法により行うことができるが、例えば、溶血試薬を用いた溶血処理の後、遠心分離によって白血球等の細胞を分離し、それを市販のDNA抽出・精製キットを用いて処理することにより、簡便にゲノムDNAを精製することができる。
【0025】
一実施形態では、生物学的試料中のゲノムDNA配列に基づくシグレック14の遺伝子型決定は、シグレック14遺伝子を特異的に増幅するプライマーセット(シグレック14遺伝子特異的プライマーセット)と、シグレック14/5融合遺伝子を特異的に増幅するプライマーセット及び場合によりシグレック5遺伝子を特異的に増幅するプライマーセットを用いたPCRによって行うことができる。この遺伝子型決定は、例えば、特許文献2に記載のシグレック14遺伝子のアレル検出方法に基づいて行うことができる。
【0026】
シグレック14遺伝子特異的プライマーセットは、シグレック14遺伝子中の塩基配列に基づき、シグレック14/5融合遺伝子又はシグレック5遺伝子を増幅させないように設計する。その各プライマーは、シグレック14遺伝子とシグレック5遺伝子における保存領域の外側(保存領域より5'側及び3'側)に設計することが好ましい。シグレック14遺伝子とシグレック5遺伝子の保存領域は、配列番号1の塩基配列中では753番目〜2110番目に相当する。通常は、シグレック14遺伝子特異的プライマーセットのフォワードプライマーは753番目より5'末端側の領域に、リバースプライマーは2110番目より3'末端側の領域に設計する。好ましい具体的なプライマーとしては、フォワードプライマーとしては配列番号6に示す塩基配列を含むプライマー、リバースプライマーとしては配列番号7に示す塩基配列を含むプライマーが挙げられる。
【0027】
シグレック5遺伝子を特異的に増幅するプライマーセット(シグレック5遺伝子特異的プライマーセット)の各プライマーも、シグレック14遺伝子とシグレック5遺伝子における保存領域の外側(保存領域より5'側及び3'側)に設計することが好ましい。シグレック14遺伝子とシグレック5遺伝子の保存領域は、配列番号1の塩基配列中では753番目〜2110番目に相当し、配列番号3の塩基配列中では753番目〜2114番目に相当する。好ましい具体的なプライマーとしては、フォワードプライマーとしては配列番号8に示す塩基配列を含むプライマー、リバースプライマーとしては配列番号9に示す塩基配列を含むプライマーが挙げられる。
【0028】
シグレック14/5融合遺伝子を特異的に増幅するプライマーセットの各プライマーも同様に設計することができるが、好ましい実施形態では、シグレック14遺伝子特異的プライマーセットのフォワードプライマーと、シグレック5遺伝子特異的プライマーセットのリバースプライマーから構成されるプライマーセットを、シグレック14/5融合遺伝子特異的プライマーセットとして用いることができる。
【0029】
これら各プライマーの塩基長については特に制限はないが、アニーリング温度及びアニーリングの特異性等の点から、15〜40塩基、好ましくは20〜35塩基である。
【0030】
PCRは、例えば、鋳型となる生物学的試料由来のゲノムDNA、耐熱性DNAポリメラーゼ、デオキシリボヌクレオシド三リン酸混合物、PCR適合バッファー、上記プライマーセットを混合して反応液を調製し、変性工程、アニーリング工程、及びDNA伸長工程を含む核酸増幅工程を複数サイクル行うことにより実施する。
【0031】
PCR反応完了後、生成したPCR反応産物(核酸増幅産物)を検出する。PCR反応液に二本鎖DNA検出試薬(例えばSYBR Greenやエチジウムブロマイドなど)を添加し、適当な光源の存在下で反応産物を検出するか、反応産物をアガロースゲル電気泳動やキャピラリー電気泳動などで分離し、二本鎖DNA検出試薬(例えばSYBR Greenやエチジウムブロマイドなど)を用いてPCR反応産物を検出することができる。
【0032】
その結果、シグレック14遺伝子特異的プライマーセットによる増幅産物が検出されない場合は、シグレック14遺伝子の双方の野生型アレルを欠失していることが示される。さらに、シグレック14/5遺伝子特異的プライマーセットによる増幅産物が検出されるが、シグレック5遺伝子特異的プライマーセットによる増幅産物が検出されない場合、シグレック14遺伝子とシグレック5遺伝子とが融合したシグレック14/5融合遺伝子をホモ接合性で有することが示される。この場合、遺伝子型をヌル変異型と決定できる。
【0033】
一方、シグレック14遺伝子特異的プライマーセットによる増幅産物が検出される場合、シグレック14遺伝子の少なくとも一方の野生型アレルを有していることが示される。さらに、シグレック14/5遺伝子特異的プライマーセットによる増幅産物とシグレック5遺伝子特異的プライマーセットによる増幅産物の双方が検出される場合、シグレック14遺伝子の野生型アレルをヘテロ接合性で有し、シグレック14遺伝子はヌル変異型アレル(シグレック14/5融合遺伝子)となっていることが示される。この場合、遺伝子型は野生型アレルについてヘテロ接合型と決定できる。
【0034】
また、シグレック14遺伝子特異的プライマーセットによる増幅産物が検出され、かつ、シグレック5遺伝子特異的プライマーセットによる増幅産物も検出されるが、シグレック14/5遺伝子特異的プライマーセットによる増幅産物は検出されない場合は、シグレック14遺伝子の野生型アレルをホモ接合性で有し、シグレック14/5融合遺伝子は存在しないことが示される。この場合、遺伝子型は野生型と決定できる。
【0035】
なおシグレック14遺伝子特異的プライマーセットによる増幅産物とシグレック14/5遺伝子特異的プライマーセットによる増幅産物の検出結果だけで、シグレック14の各遺伝子型を識別することができるが、シグレック5遺伝子特異的プライマーセットによる増幅産物の検出結果を検討することで、さらにその遺伝子型の決定結果を裏付けることができる。
【0036】
別の実施形態では、生物学的試料中のゲノムDNA配列に基づくシグレック14の遺伝子型決定は、シグレック14遺伝子に特異的なプローブを用いたサザンブロット法によって行ってもよい。
【0037】
シグレック14遺伝子に特異的な核酸プローブは、シグレック14遺伝子中の塩基配列に基づき、シグレック14/5融合遺伝子又はシグレック5遺伝子にアニールしないように設計することが好ましい。具体的には、シグレック14遺伝子とシグレック5遺伝子の保存領域(配列番号1の753番目〜2110番目)を避け、かつシグレック14遺伝子に特異的な領域に設計すればよい。シグレック14遺伝子に特異的な核酸プローブは、例えば、配列番号1の2110番目より3'末端側の領域を選択して設計することができる。
【0038】
またシグレック5遺伝子又はシグレック14/5融合遺伝子に特異的な核酸プローブを設計・作製して、シグレック14遺伝子に特異的な核酸プローブに加えて、サザンブロット法に用いることがさらに好ましい。
【0039】
核酸プローブの塩基長については特に制限はないが、アニーリング温度やアニーリングの特異性等を考慮すると、通常は20〜10,000塩基対程度、好ましくは20〜1,000塩基対程度である。
【0040】
かかる核酸プローブを用いたサザンブロッティングでは、まず、例えば、ヒト被験体由来の生物学的試料から抽出したゲノムDNAを直接ナイロン膜などの薄膜に固相化するか、又は適当な方法(制限酵素等による消化など)で断片化しアガロースゲル電気泳動などにより分離した後、ナイロン膜などの薄膜に転写し固相化する。次いで、上記のシグレック14遺伝子に特異的な核酸プローブを調製し、ラベルを導入し、薄膜上のゲノムDNAとハイブリダイズさせればよい。ラベルとしては、放射性同位元素(32P、33P、35S等)、蛍光色素(Cy3やCy5等)、又はビオチンやジゴキシゲニンなどのエピトープを用いることができる。ビオチンやジゴキシゲニンなどのエピトープを導入した場合は、核酸プローブの検出に二次検出試薬(蛍光色素を結合したストレプトアビジンや抗ジゴキシゲニン抗体など)を必要とする。ハイブリダイズしなかったプローブを洗浄操作により除いた後、ハイブリダイズした核酸プローブをラベル法に応じた方法で検出すればよい。
【0041】
別法では、シグレック14遺伝子特異的な核酸プローブを薄膜又はガラス面などに固相化し、そこに、適当な方法(機械的剪断、制限酵素等による消化など)で断片化しラベルを導入したゲノムDNAをハイブリダイズさせてもよい。ラベルとしては放射性同位元素(32P、33P、35S等)、蛍光色素(Cy3やCy5等)、或いはビオチンやジゴキシゲニンなどのエピトープを用いることができる。ビオチンやジゴキシゲニンなどのエピトープを導入した場合は、核酸プローブの検出に二次検出試薬(蛍光色素を結合したストレプトアビジンや抗ジゴキシゲニン抗体)を必要とする。ハイブリダイズしなかったプローブを洗浄操作により除いた後、ハイブリダイズしたゲノムDNAをラベル法に応じた方法で検出することができる。
【0042】
サザンブロット法では、シグレック14遺伝子特異的な核酸プローブとゲノムDNAとのハイブリダイゼーションシグナルが検出できる場合、シグレック14の遺伝子型は野生型(ホモ接合)又はヘテロ接合型であることが示される。この場合、シグレック14/5融合遺伝子特異的な核酸プローブとゲノムDNAとのハイブリダイゼーションシグナルが検出されれば、シグレック14の遺伝子型はヘテロ接合型であると決定され、該シグナルが検出されなければ、野生型(ホモ接合)であると決定される。一方、シグレック14遺伝子特異的な核酸プローブとゲノムDNAとのハイブリダイゼーションシグナルが検出できない場合、シグレック14遺伝子の野生型アリルの双方が欠失し、シグレック14/5融合遺伝子がホモ接合性で存在することが示され、すなわちシグレック14の遺伝子型はヌル変異型と決定される。
【0043】
またシグレック14の遺伝子型は、生物学的試料中のシグレック14タンパク質を検出することによっても決定できる。シグレック14タンパク質は、シグレック14を特異的に認識する抗体を用いて検出することができる。「シグレック14を特異的に認識する抗体」とは、シグレック14タンパク質に特異的に結合し、かつシグレック5タンパク質には結合しない抗体をいう。この実施形態では、シグレック14を特異的に認識する抗体を用いて、生物学的試料中のシグレック14タンパク質を検出すればよい。本発明において検出対象となる「シグレック14タンパク質」は、シグレック14遺伝子によってコードされた配列番号2に示すアミノ酸配列からなるタンパク質だけでなく、当該タンパク質からシグナルペプチドが除去されたもの、配列番号2に示すアミノ酸配列において1〜数個のアミノ酸残基の欠失、置換又は付加を含む配列からなるタンパク質、配列番号2に示すアミノ酸配列の細胞外領域又はその一部である可溶性シグレック14タンパク質等を包含する。本発明において検出対象となる好ましい「シグレック14タンパク質」は、シグレック14タンパク質に特有の免疫グロブリン様ドメイン3を有する。シグレック14タンパク質は、例えば配列番号2に示すアミノ酸配列又はその一部をコードする塩基配列を有するDNAを用いて遺伝子工学的に組換え産生することができる。
【0044】
シグレック14について野生型(WT/WT)の遺伝子型を有する被験体、及びヘテロ接合型(WT/Null)の遺伝子型を有する被験体は、シグレック14タンパク質を発現する。一方、ヌル変異型(Null /Null)の遺伝子型を有する被験体は、シグレック14の野生型アレルを欠損しておりシグレック14/5融合遺伝子のみを有するため、シグレック14タンパク質を発現しない。なおシグレック14/5融合遺伝子から発現されるシグレック14/5融合タンパク質は、シグレック5タンパク質と同一のタンパク質である。したがって生物学的試料中のシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定することができる。
【0045】
シグレック14を特異的に認識する抗体は、ポリクローナル抗体であってもモノクローナル抗体であってもよく、従来公知の方法で取得することができる。例えば、シグレック14に対するポリクローナル抗体は、シグレック14タンパク質を用いて、マウス、ラット、ウサギ、ヤギ、ヒツジ、ロバ等の動物を免疫感作し、一定期間経過後血清を採取し、プロテインA、プロテインG、抗原タンパク質、抗原ペプチドなどを固相化したカラムなどで精製することで得ることができる。シグレック14タンパク質の一部又は全体を抗原として用いて抗体を作成した後、シグレック5タンパク質の一部(シグレック14タンパク質と高い配列相同性を示す部分を含む)又は全部と交差反応する画分を吸着などにより除去した画分を、シグレック14タンパク質を特異的に認識する抗体として調製することができる。あるいは、免疫に用いる抗原としてシグレック14タンパク質に特異的な領域を用いることにより、シグレック5タンパク質を含む他のシグレックタンパク質と交差反応しない抗体を得ることもできる。シグレック14タンパク質に特異的な領域としては、例えば、シグレック14タンパク質の細胞外領域に含まれるがシグレック5タンパク質の細胞外領域には含まれない領域が挙げられ、具体例では、配列番号2の238番〜358番の領域がシグレック14タンパク質に特異的な領域に相当する。本発明では、シグレック14タンパク質に特異的な領域、好ましくはリンカー及び/又は免疫グロブリン様ドメイン3、例えば配列番号2の238番〜358番の領域、を特異的に認識する抗体を、シグレック14を特異的に認識する抗体として好適に用いることができる。
【0046】
また、シグレック14に対するモノクローナル抗体は、上記ポリクローナル抗体と同様の免疫感作を行い、一定期間経過後、例えば脾臓細胞を採取し、該細胞とミエローマ細胞とを細胞融合し、得られたハイブリドーマをスクリーニングし、シグレック14タンパク質に対する抗体産生ハイブリドーマを取得して、その培養物又は培養上清から調製することができる。
【0047】
さらに、上記抗体の抗原結合性フラグメント(Fab、F(ab’)2など)も同様に使用することができる。
【0048】
ポリクローナル抗体、モノクローナル抗体いずれの場合も、ヒト由来の他のシグレックタンパク質(例えば、シグレック5、シグレック6)に交差反応しないことを確認することが望ましい。使用する抗体は、ラベルされたものでも、ラベルされていないものでもよい。抗体は、例えば、蛍光色素(フルオレセイン、R-フィコエリスリン、アロフィコシアニン等の検出可能な蛍光色素)やビオチン等でラベルすることができる。
【0049】
ラベルなしの抗シグレック14抗体を用いる場合は、抗体作製に用いた動物の免疫グロブリンのFc等を認識する二次抗体(蛍光色素又はビオチンなどでラベルしたもの)、ビオチンなどでラベルした抗体を用いる場合はこのラベルと特異的に結合するプローブ(蛍光色素ラベルしたストレプトアビジンなど)を二次試薬に用いて検出することができる。
【0050】
シグレック14を特異的に認識する抗体の好適な具体例は、後述の参考例に記載された、clone 40-1として規定されるシグレック14特異的モノクローナル抗体である。本抗体及びその作製については、Yamanaka M et al., Glycobiology. 2009, 19(8):841-846に開示されている。このclone 40-1のモノクローナル抗体は、シグレック14の細胞外領域と結合することができ、可溶性シグレック14タンパク質を認識することができる。
【0051】
シグレック14を特異的に認識する抗体を使用した生物学的試料中のシグレック14タンパク質の検出は、例えば、ELISA法や、フローサイトメトリーによる解析により行うことができる。
【0052】
本発明の方法の好適な一実施形態では、例えばシグレック14を特異的に認識する抗体を用いて、生物学的試料、特に血液由来試料中の可溶性シグレック14タンパク質を検出することにより、試料中の可溶性シグレック14タンパク質の有無又は量を決定し、それによりシグレック14の遺伝子型を決定することができる。血液由来試料としては、全血、血清、血漿等が挙げられ、血清がより好ましい。可溶性シグレック14タンパク質とは、膜貫通ドメインよりC末端側の領域を欠損した、シグレック14タンパク質の細胞外領域又はその一部を含むタンパク質である。すなわち可溶性シグレック14タンパク質は、全長シグレック14タンパク質の免疫グロブリン様ドメイン1、2及び3並びにリンカーのうち少なくとも1つを含み、膜貫通ドメイン及びサイトゾル尾部を含まない部分タンパク質である。この可溶性シグレック14タンパク質は、生体内で、細胞膜等の生体膜に結合しておらず、血液等の生体液中に遊離形態で存在する。理論により限定されることは意図しないが、可溶性シグレック14タンパク質は、生体内で、シグレック14遺伝子からスプライシングバリアントとして又は全長シグレック14タンパク質の分解により生成されるものと考えられる。
【0053】
血液由来試料中の可溶性シグレック14タンパク質の検出は、例えば、以下のようにして行うことができる。まず、試験プレートのウェルに、シグレック5とシグレック14をともに認識する抗体を添加し、PBS等のバッファー中、室温で終夜静置して抗体を固相に結合させる(固相化)。なお抗シグレック5抗体の多くは、シグレック14と交差反応し、シグレック5とシグレック14をともに認識する抗体である(Angata T et al., FASEB J. 2006, 20(12):1964-1973)。固相化後、溶液を除去し、洗浄バッファー(例えば、0.05% Tween 20等の界面活性剤含有PBS)で各ウェルを洗浄し、希釈液(例えば、1% BSA含有PBS)を添加して室温にてブロッキングを行う。溶液を除去し、を添加し、室温で2時間静置した。洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、血液由来試料(好ましくは、血清)又はその希釈サンプルを添加し、室温で数時間(例えば2時間)静置する。洗浄バッファーで各ウェルを洗浄した後、可溶性シグレック14を認識可能でありビオチン化等のラベリングがされている、シグレック14を特異的に認識する抗体(好ましくはモノクローナル抗体、例えばclone 40-1の抗体)をそこに添加し、室温で数時間(例えば、2時間)静置する。溶液を除去し、洗浄バッファーでウェルを洗浄し、ラベルの検出を行う。例えば、抗体をビオチン化した場合は、ストレプトアビジン-コンジュゲート化ホースラディッシュペルオキシダーゼと基質を添加して反応させ、反応産物を450 nmの吸光度で測定すればよい。このELISA法では、シグレック5を検出することなく、可溶性シグレック14を特異的に検出することができる。
【0054】
従来、ヒト血中の可溶性シグレック14の存在は明らかになっていなかった。しかし本発明により、シグレック14遺伝子(野生型アレル)を有するヒト被験体の血中にはシグレック14が可溶性形態(可溶性シグレック14)で存在すること、一方、シグレック5は血中に可溶性形態ではほとんど存在しないことが示された。このため、生物学的試料中の可溶性シグレック14の検出には、シグレック14を特異的に認識する抗体だけでなくシグレック5とシグレック14をともに認識する抗体も使用することができる。なお可溶性シグレック14の検出に用いる、シグレック14を特異的に認識する抗体は、可溶性シグレック14タンパク質、すなわちシグレック14の細胞外領域又はその一部と結合(認識)することができるものであり、例えば免疫グロブリン様ドメイン3と結合(認識)することが好ましい。
【0055】
したがって生物学的試料(好ましくは、血清等の血液由来試料)中に可溶性シグレック14タンパク質が検出される場合、その試料を採取したヒト被験体は、シグレック14遺伝子をホモ接合で有する野生型又はヘテロ接合で有するヘテロ接合型である。特に、可溶性シグレック14タンパク質がより高濃度(例えば、おおむね180ng/ml血清以上)で検出される場合は、シグレック14遺伝子について野生型であると決定でき、逆に、可溶性シグレック14タンパク質がより低濃度(例えば、おおむね1〜80ng/ml血清)で検出される場合はヘテロ接合型であると決定できる。可溶性シグレック14タンパク質が中間的な濃度(例えば、おおむね80ng/ml超、180ng/ml血清未満)である場合は、さらにゲノムDNA上のシグレック14遺伝子の検出を行うなどして、シグレック14の遺伝子型を決定することが望ましい。一方、調べた生物学的試料中にシグレック14タンパク質が検出されない場合、シグレック14の野生型アレルを両方とも欠損したヌル変異型(シグレック14/5融合遺伝子をホモ接合で有する)と決定できる。
【0056】
別の実施形態では、フローサイトメトリーにより白血球上に発現したシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定することもできる。例えば、被験体の血液を血液凝固を防ぐ試薬(EDTA、クエン酸、ヘパリンなど)を含む採血管に採取してそれを生物学的試料とする。必要に応じて、その血液から塩化アンモニウムなどを用いた赤血球の溶血により白血球を単離するか、又はフィコールなどを用いた密度勾配遠心法などにより白血球を単離する。さらに、ヒト白血球又は全血試料にシグレック14特異的な抗体を添加し、一定時間保温した後、洗浄により結合しなかった抗体を除き、フローサイトメーターを用いて白血球上のシグレック14タンパク質の有無を検出する。この際、顆粒球又は単球上でのシグレック14タンパク質の発現を検出することが望ましい。白血球上のシグレック14タンパク質が検出される場合、その試料を採取したヒト被験体は、シグレック14遺伝子をホモ接合で有する野生型又はヘテロ接合で有するヘテロ接合型である。一方、白血球上のシグレック14タンパク質が検出されない場合、シグレック14の野生型アレルを両方とも欠損したヌル変異型(シグレック14/5融合遺伝子をホモ接合で有する)である。
【0057】
本発明では、以上のようにして決定されたヒト被験体のシグレック14の遺伝子型を指標として、該被験体における慢性閉塞性肺疾患の増悪感受性を検査することができる。すなわち、本発明による慢性閉塞性肺疾患(COPD)の増悪感受性の検査は、COPDと強く相関するバイオマーカー(遺伝的マーカー又は血清マーカー等)としてのシグレック14の遺伝子型に基づいて行われる。
【0058】
ここで慢性閉塞性肺疾患の増悪感受性とは、慢性閉塞性肺疾患(COPD)を発症した後の増悪の生じやすさ(素因)を意味する。慢性閉塞性肺疾患の増悪感受性は、限定するものではないが、例えば、慢性閉塞性肺疾患患者が1年以内に増悪を生じる割合として表すこともできる。慢性閉塞性肺疾患の増悪(急性増悪)とは、呼吸困難、咳、喀痰などの慢性閉塞性肺疾患の症状が日常の生理的変動を超えて急激に悪化し、安定期の治療内容の変更を要する状態をいう(日本呼吸器学会ガイドライン、2009)。慢性閉塞性肺疾患の増悪は、Anthonisenらの定義(Anthonisen NR et al., Ann Intern Med. 1987, 106:196-204)や、Rodriguez-Roisinの定義(Rodriguez-Roisin, R. Chest 2000, 117:398S-401S)に従って判別することができる。本発明において、「慢性閉塞性肺疾患の増悪感受性が高い」ことは、慢性閉塞性肺疾患を発症した場合に増悪を生じる確率が高いことを意味する。
【0059】
本発明では、ヒト被験体がシグレック14遺伝子の野生型アレルを有すると決定された場合、このバイオマーカーと慢性閉塞性肺疾患の増悪感受性との相関に基づいて、慢性閉塞性肺疾患の増悪感受性がより高いものと検査される。
【0060】
具体的には、あるヒト被験体のシグレック14の遺伝子型が野生型であり、すなわちシグレック14遺伝子の野生型アレルをホモ接合で有していると決定された場合、その被験体における慢性閉塞性肺疾患(COPD)の増悪感受性は高いことが示される。本発明の方法において、野生型の場合のCOPDの増悪感受性(COPD増悪はAnthonisenの定義による)は、限定するものではないが、およそ22%〜53%の増悪率、好ましくはおよそ34%〜39%の増悪率である。一方、ヒト被験体のシグレック14の遺伝子型がヘテロ接合型であり、すなわちシグレック14遺伝子の野生型アレルをヘテロ接合性で有し、ヌル変異型アレル(シグレック14/5融合遺伝子)を1つ有していると決定された場合、その被験体におけるCOPDの増悪感受性は野生型と比較すれば相対的に低いがヌル変異型と比較すると相対的に高いことが示される。ヘテロ接合型の場合のCOPDの増悪感受性(同様にAnthonisenの定義による)は、限定するものではないが、およそ12%〜35%の増悪率、好ましくはおよそ18%〜21%の増悪率である。さらに、ヒト被験体のシグレック14の遺伝子型がヌル変異型であり、すなわちヌル変異型アレル(シグレック14/5融合遺伝子)をホモ接合で有すると決定された場合、その被験体におけるCOPDの増悪感受性は低いことが示される。ヌル変異型の場合のCOPDの増悪感受性(同様にAnthonisenの定義による)は、限定するものではないが、およそ2%〜20%の増悪率、好ましくはおよそ6%〜7%未満の増悪率である。ここで増悪率とは、慢性閉塞性肺疾患患者が1年以内に増悪を引き起こす割合(%)をいう。
【0061】
また上記のように、シグレック14の遺伝子型の野生型アレルの数が多いほど、COPDの増悪感受性は増加する。すなわち、シグレック14の野生型アレルを有しないヌル変異型よりも、野生型アレルを1つ有するヘテロ接合型の方が、COPDが増悪しやすく、シグレック14の野生型アレルを1つ有するヘテロ接合型よりも、野生型アレルをホモ接合で2つ有する野生型の方が、COPDが増悪しやすい。したがって本発明の方法によれば、決定されたシグレック14の遺伝子型の野生型アレルの数の多さに基づいて、増悪感受性の高さが検査される。すなわち本発明では、決定されたシグレック14の遺伝子型の野生型アレルの数を増悪感受性の指標とすることができる。
【0062】
さらには、決定したシグレック14の遺伝子型においてシグレック14の野生型アレルを有する場合には、高頻度の増悪を生じるリスクがあるものとして検査される。すなわち、シグレック14の野生型アレルをヘテロ接合で有するヘテロ接合型、及びその野生型アレルをホモ接合で有する野生型では、例えば、年間に2回以上、とりわけ年間に3回以上の高頻度の増悪を起こすリスクが高いものとして検査される。
【0063】
COPDの増悪は回復に時間を要し、また増悪を繰り返すほど肺機能が急激に低下して生活の質(QOL)や予後が悪化することが知られている。本発明の方法によれば、予めヒト被験体のCOPDの増悪感受性を検査しておくことができるため、増悪を重点的に予防することが望ましいCOPD患者を選択することができて有利である。
【実施例】
【0064】
以下、実施例を用いて本発明をさらに具体的に説明する。但し、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0065】
[参考例]シグレックタンパク質及び抗シグレック抗体の製造
(1)シグレックタンパク質の製造
ヒトシグレック14タンパク質の細胞外領域;3つの免疫グロブリン(Ig)様ドメインを含む)とヒトIgG Fc領域との融合タンパク質を既報に従って調製した(Angata T et al., FASEB J. 2006, 20(12):1964-1973、特開2006-345786号公報)。具体的には、まず、ヒトシグレック14タンパク質の完全長cDNA(GenBankアクセッション番号AY854038)をプラスミド中にクローニングし、それを鋳型DNAとして、シグレック14の細胞外領域に相当する核酸配列をPCRによりPfu DNAポリメラーゼを用いて増幅した。このPCRには以下のプライマーを使用した:HsSig5/14 Expr F(5'-ccctctagagccaccATGCTGCCCCTGCTGCTGCTGCCC-3'(配列番号10); "tctaga"はXbaI部位である)及びHsSig14 Fc R(5'-atcGGAAGAGGAGCTTCTCTGCACA-3'(配列番号11); 5'末端の配列"atc"はEcoR V部位の半配列である)(両プライマー配列中、大文字はシグレック14のcDNA配列に一致する塩基を表す)。得られたPCR産物をXbaIで切断し、ヒトIgG Fc領域コード配列を含むプラスミドEK-Fc/pcDNA3.1(-)のXbaI-EcoR V部位にクローニングし、インサートの配列を確認した。EK-Fc/pcDNA3.1(-)は、pcDNA3.1(-)(Invitrogen社)のEcoRVとEcoRIサイトの間にFLAGタグ/エンテロキナーゼ認識配列をコードする領域及びヒトIgG1のヒンジ領域からC末端(Fc)までをコードするゲノム由来DNA断片を挿入したベクターである。FLAGタグ/エンテロキナーゼ認識配列をコードする領域の5'上流に読み枠が合うようにEK-Fc/pcDNA3.1(-)にcDNA断片を挿入する事により、挿入したcDNA断片(ここではシグレック14の上記細胞外領域をコードするインサート)由来のポリペプチドとFLAGタグ/エンテロキナーゼ認識配列、ヒトIgGのヒンジ領域及びFc領域が融合された可溶性タンパク質を発現するための組換え発現ベクターを得ることができる。
【0066】
得られた組換え発現ベクターを、リポフェクトアミン2000を用いて293細胞に導入した。次いで培地を、2%低IgG-FBS(HyClone, Logan, UT, USA)を含むOpti-MEM(Invitrogen)に交換し、6日間培養した。回収した培地を遠心分離して培養上清を採取し、産生した組換えタンパク質(上記シグレック14細胞外領域+Fcの融合タンパク質;Siglec-14-Fc)を、プロテインAセファロースへの吸着、0.1 Mグリシン-HClバッファー(pH 3.0)による抽出及び1/10量の1M Tris-HClバッファー(pH 8.0)での中和により、培養上清から精製した。
【0067】
また上記と同様の方法で、ヒトシグレック5タンパク質の細胞外領域(3つの免疫グロブリン(Ig)様ドメインを含む、ヒトシグレック14の上記細胞外領域と対応する領域)とヒトIgG Fc領域との融合タンパク質(Siglec-5-Fc)を作製し、精製した。
【0068】
(2)抗シグレック14抗体の作成
次いで、このようにして得られた、シグレック14の細胞外領域とIgG Fc領域との融合タンパク質(Siglec-14-Fc)を用いて、シグレック14を特異的に認識する抗体を既報に従って作製した(Yamanaka M et al., Glycobiology. 2009, 19(8):841-846)。
【0069】
具体的には、BALB/cマウスを、上記で精製した組換え融合タンパク質Siglec-14-Fcを用いて繰り返し免疫した後、その脾臓を採取し、ポリエチレングリコールを用いて脾細胞とマウス由来ミエローマ細胞を常法により融合した。得られたハイブリドーマクローンを、シグレック14又はシグレック5完全長タンパク質発現ベクターを導入したCOS-7細胞を用いたフローサイトメトリーにより、シグレック14又はシグレック5に対する反応性についてスクリーニングした。次いで、シグレック14又はシグレック5を安定的に発現するTHP-1細胞を用いたフローサイトメトリーにより、さらにシグレック14又はシグレック5に対する反応性についてスクリーニングした。このようにして、シグレック14を特異的に認識しシグレック5を認識しない抗体を産生するハイブリドーマクローン(Clone 40-1)を作製した。このハイブリドーマクローンclone 40-1の無血清培養上清をプロテインGセファロース(登録商標)(GE Healthcare)への吸着に供することによって、シグレック14特異的モノクローナル抗体を精製した。このシグレック14特異的モノクローナル抗体(clone 40-1)は、シグレック14の細胞外領域の免疫グロブリン様ドメイン3に結合する抗体である。
【0070】
なお、シグレック14とシグレック5の両方を特異的に認識するマウスモノクローナル抗体(Clone 194128)は、R&D Systems社(Minneapolis, MN, USA)から市販品を購入して後述の実施例で用いた。
【0071】
[実施例1]シグレック14遺伝子(SIGLEC14)の遺伝的多型とCOPD増悪の相関
日本医科大学呼吸ケアクリニックに来訪した外来患者のうち、以下の条件を満たす方に研究への参加意思の有無を訊ねた:(1)現在又は過去に喫煙歴があること、(2)咳嗽、喀痰、呼吸困難があること。研究参加の意志表示をした患者からはインフォームドコンセントを得た。肺機能検査は肺機能検査システムCHESTAC(Chest株式会社)を用いて行い、常法に従って気管支拡張薬投与後の1秒率(FEV1/FVC)が0.7以下の患者を慢性閉塞性肺疾患(COPD)患者と診断した。COPD患者に対しては1年間にわたり毎月フォローアップを行い、増悪に関する質問を含む問診を行った。問診では、Anthonisenらの定義(Anthonisen NR et al., Ann Intern Med. 1987, 106:196-204)による細菌性の増悪の有無、及びRodriguez-Roisinの定義(Rodriguez-Roisin, R. Chest 2000, 117:398S-401S)によるより軽度な増悪を含む増悪の頻度の両方について質問した。
【0072】
一方、患者の末梢血より常法に従いDNAを採取し、シグレック14遺伝的多型の解析を既報に準じて行った(Yamanaka M et al., Glycobiology. 2009, 19(8):841-6;特開2010-35551号公報)。具体的には、患者から同意のもと末梢血約10 mlを採取し、ACK溶血液(150 mM塩化アンモニウム、10 mM炭酸水素カリウム、0.1 mMエチレンジアミン四酢酸)を用いて赤血球を溶血させた。この液から遠心操作により白血球を得た。得られた白血球(5 x 106細胞)からDNeasy Blood & Tissue Kit(QIAGEN社)を用いてゲノムDNAを精製した。このゲノムDNAを鋳型として、PCRを実施した。PCRに用いた反応液(20μl)の組成は以下の通り:ゲノムDNA 100 ng、プライマー各0.3μM、デオキシリボヌクレオシド三リン酸(dATP、dCTP、dGTP、dTTP)各0.2 mM、耐熱性DNAポリメラーゼExpand High Fidelity enzyme(ロシュ・ダイアグノスティクス)0.5ユニット、塩化マグネシウム1.5 mM、1 x Expand High Fidelity Buffer(ロシュ・ダイアグノスティクス)。
【0073】
PCRの反応サイクルは、94℃で2分の後、(94℃で15秒;56℃で30秒;72℃で90秒)を10サイクル、続いて(94℃で15秒;56℃で30秒;72℃で90秒+各サイクル5秒ずつ延長)を20サイクル、続いて72℃で7分とした。
【0074】
PCRには、シグレック14遺伝子、シグレック5遺伝子及びシグレック14/5融合遺伝子を、それぞれ特異的に増幅する以下に示すプライマーセットを用いた。
【0075】
シグレック14遺伝子増幅用プライマーセット
フォワードプライマー(14F):5'-AGGATTTATTCTCCCATCTCGCT-3'(配列番号6)
リバースプライマー(14R):5'-GATGCTGATGGCGAGGTTCTG-3'(配列番号7)
シグレック5遺伝子増幅用プライマーセット
フォワードプライマー(5F):5'-GTGGTTCTGACATCTCACCTCATC-3'(配列番号8)
リバースプライマー(5R):5'-CCTGAAGATGGTGATGGTCTG-3'(配列番号9)
シグレック14/5融合遺伝子増幅用プライマーセット
フォワードプライマー(14F):5'-AGGATTTATTCTCCCATCTCGCT-3'(配列番号6)
リバースプライマー(5R):5'-CCTGAAGATGGTGATGGTCTG-3'(配列番号9)
【0076】
続いて、上記で得られたPCR反応産物を、1%アガロースゲルを用いてTAEバッファー(40 mMトリス、40 mM酢酸、0.1 mMエチレンジアミン四酢酸)中で電気泳動し(各レーン10μl)、増幅産物を分離した。エチジウムブロマイドでゲルを染色し、紫外線ランプで照射してDNAを検出し、撮影した。
【0077】
プライマー対5F+5Rはシグレック5遺伝子の一部を、プライマー対14F+14Rはシグレック14遺伝子の一部を特異的に増幅する。プライマー対14F+5Rはシグレック14/5融合遺伝子が存在する場合にはこの遺伝子の約1.7 kbの領域を増幅する。同じプライマー対を用いて野生型アリルから、本実験で用いた反応条件下でこの産物は生じない。
【0078】
この結果、プライマー対5F+5Rによるシグレック5遺伝子の増幅とプライマー対14F+14Rによるシグレック14遺伝子の増幅の双方が検出されたがプライマー対14F+5Rによるシグレック14/5融合遺伝子の増幅が検出されなかった患者を野生型(WT/WT)と決定した。またプライマー対5F+5Rによるシグレック5遺伝子の増幅とプライマー対14F+14Rによるシグレック14遺伝子の増幅の双方が検出されず、プライマー対14F+5Rによるシグレック14/5融合遺伝子の増幅が検出された患者をヌル変異型(SIGLEC14 null;Null/Null)と決定した。さらに、プライマー対5F+5Rによるシグレック5遺伝子の増幅、プライマー対14F+14Rによるシグレック14遺伝子の増幅、及びプライマー対14F+5Rによるシグレック14/5融合遺伝子の増幅の全てが検出された患者をヘテロ接合型(WT/Null)と決定した。
【0079】
さらに、シグレック14遺伝子多型とCOPD増悪との相関を調べるため、JMP genomics software ver 3.1を使用して統計的解析を行った。Anthonisenらの定義による増悪の有無にシグレック14の遺伝子型が及ぼす影響の解析にはロジスティック回帰分析を用いた。Rodriguez-Roisinの定義による増悪の頻度にシグレック14の遺伝子型が及ぼす影響の解析にはポアソン回帰分析を用いた。尤度を最大化する一般化線形モデルを採用した。年齢と性別を共変数とし、増悪頻度に影響があるとされる喫煙状況、吸入ステロイドの使用の有無、気管支拡張薬投与後の1秒量対予測値(FEV1 % predicted)を共変数として解析を行った。
【0080】
結果を図1〜2及び表1〜2に示す。図1及びにはシグレック14の遺伝子型毎の、Anthonisenらの定義によるCOPDの細菌性増悪の有無の割合を示した。また図2には、シグレック14の遺伝子型毎の、Rodriguez-Roisinの定義によるCOPD増悪の各頻度の割合を示した。
【0081】
【表1】

【0082】
【表2】

【0083】
シグレック14の野生型アリルの数と、増悪の有無(図1)、増悪の頻度(図2)との間にはいずれも正の相関が認められ(ヌル変異型[野生型アリル数:0]<ヘテロ接合型[野生型アリル数:1]<野生型[野生型アリル数:2])、いずれも統計的に有意であった(それぞれp = 0.0015およびp = 0.0002)。この結果から、シグレック14遺伝子の野生型アリルの数が多くなるほど、増悪感受性が高くなることが示された(図1及び2)。例えば、野生型アリルをホモ接合で有する野生型(WT/WT)の患者は35〜45%程度の割合で増悪を経験したのに対し、野生型アリルを持たずSIGLEC14-nullアリルのホモ接合であるヌル変異型(Null/Null)の患者でのCOPD増悪割合は10%未満と低く、増悪感受性は顕著に低かった。さらに、野生型アリルの数が多いほど、増悪頻度が特に高い(2回以上、とりわけ3回以上)患者が出現し、すなわち野生型アリルの数が多い場合にはCOPD増悪頻度が特に高くなるリスクがあることも示された(図2)。
【0084】
この結果から、シグレック14遺伝子型を解析することにより、COPD患者の増悪感受性を予測し、患者を層別化できることが示された。
【0085】
[実施例2]シグレック14を特異的に検出するELISAの開発
参考例で作製したシグレック14を特異的に認識する抗体(clone 40-1)1 mgを、市販のタンパク質ビオチン化キット(Biotin Protein Labeling Kit, ロシュ・ダイアグノスティクス)を用いてビオチン化し、検出用抗体とした。
【0086】
96ウェルプレートの各ウェルに、シグレック5とシグレック14をともに認識する抗体(clone 194128, R&D Systems)を添加(0.1 μg抗体/100 μl PBS/ウェル)し、室温で終夜静置して抗体を固相化した。この溶液を除去し、洗浄バッファー(0.05% Tween 20含有PBS)で各ウェルを3回洗浄(400 μl/ウェル)し、希釈液(1% BSA含有PBS, 300 μl/ウェル)を添加して室温にて1時間ブロッキングを行った。この溶液を除去し、希釈液で段階希釈した標準試料(Siglec-14-Fc及びSiglec-5-Fc)を添加し、室温で2時間静置した。洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、上記で調製したビオチン化抗シグレック14抗体を添加(0.05 μg抗体/100 μl 1% BSA含有PBS/ウェル)し、室温で2時間静置した。この溶液を除去し、洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、ストレプトアビジン-コンジュゲート化ホースラディッシュペルオキシダーゼ(希釈液で1:1000希釈、100 μl/ウェル)を添加し、室温で20分静置した。この溶液を除き、洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、基質(SureBlue Reserve, Kirkegaard & Perry Laboratories, Inc.)を添加(100 μl/ウェル)し、10〜15分インキュベートし、1N塩酸を添加(100 μl/ウェル)して反応を止め、450 nmの吸光度を測定した。
【0087】
結果を図3に示す。このELISAにおいて、Siglec-14-Fcは1.56〜100 ng/mlの範囲で定量的に測定できたのに対し、Siglec-5-Fcは検出されなかった。すなわち、このELISAを用いることにより、類似するシグレック5を検出することなく、シグレック14を特異的に検出し定量することができることが示された。なお基質添加後のインキュベーション時間を変えることにより、増感及び減感が可能であった。
【0088】
[実施例3]シグレック14の遺伝的多型と可溶性シグレック14の血中濃度の相関
上記実施例と同様にインフォームドコンセントを得た患者から採血を行い、血清及びゲノムDNAを得た。各患者のシグレック14の遺伝的多型(遺伝子型)の解析を実施例1と同様の手順で行った。
【0089】
血清は希釈液(1% BSA含有PBS)を用いて20倍に希釈し、これを被験サンプルとして、実施例2に記載したシグレック14を特異的に検出するELISAを実施した。また、同血清を希釈液を用いて200倍に希釈し、市販のシグレック5と14をともに検出できる抗体を用いたELISAキット(R&D Systems)を使用してシグレック5及びシグレック14の総濃度も測定した。
【0090】
結果を図4に示す。黒い棒グラフはシグレック14特異的に検出するELISA、白い棒グラフはシグレック5と14をともに検出するELISAを用いて、同一セットの試料を測定した結果である。試料1〜19はシグレック14の遺伝子型がヌル変異型(Null/Null)の患者、試料20〜37はヘテロ接合型(WT/Null)の患者、試料38〜53は野生型(WT/WT)の患者に由来する血清である。
【0091】
図4に示すように、シグレック14特異的に検出するELISAを用いて測定した結果、シグレック14遺伝子型がWT/WT及びWT/Nullの患者からは、可溶性シグレック14が検出されたが、Null/Nullの患者からは検出されなかった。したがってNull/Nullとそれ以外の遺伝子型を血清中の可溶性シグレック14タンパク質の有無に基づいて鑑別することが可能である。さらに、シグレック14遺伝子型がWT/WTの患者の血清中可溶性シグレック14濃度はWT/Nullのそれと比較して高い傾向が認められ、シグレック14の野生型アレルの数に応じて血中の可溶性シグレック14濃度が高くなることが示された。
【0092】
なお、シグレック5とシグレック14をともに検出するELISAを用いて測定した結果、Null/Nullの患者の血清からは可溶性シグレック5/シグレック14はごく微量しか検出されなかった。すなわち、血中に可溶性形態で存在するのはほとんどシグレック14であり、シグレック5は血中に存在しないか、存在してもごく微量であることが示された。
【産業上の利用可能性】
【0093】
本発明は、慢性閉塞性肺疾患(COPD)患者の増悪感受性と強く相関する遺伝的マーカー及び血清マーカー等を検出することにより、増悪感受性に基づく患者の層別化と個別化治療を可能とすることができる。増悪感受性の検査・判定結果に基づいてCOPD患者の適切な層別化やモニタリングを行うことにより、患者のQOL及び予後の改善、並びに医療資源の有効利用につなげることができる。
【配列表フリーテキスト】
【0094】
配列番号6〜11:プライマー
【技術分野】
【0001】
本発明は、慢性閉塞性肺疾患(COPD)増悪感受性の検査法に関する。
【背景技術】
【0002】
慢性閉塞性肺疾患(COPD)とは、タバコ煙を主とする有害物質を長期に吸入曝露することで生じる肺の炎症性疾患である。この疾患の患者は、呼吸機能検査で正常に復すことのない気流閉塞を示す。気流閉塞は末梢気道病変と気腫性病変が様々な割合で複合的に作用することにより起こり、進行性である(日本呼吸器学会ガイドライン、2009)。COPDは2020年には全世界の死亡原因の第三位を占めると予測されている(WHO World Health Statistics, 2008)。COPDの増悪とは、COPDを発症した患者において、呼吸困難、咳、喀痰などの症状が日常の生理的変動を超えて急激に悪化し、安定期の治療内容の変更を要する状態をいう(日本呼吸器学会ガイドライン、2009)。COPD患者が入院治療を必要とする場合、そのほとんどは急性増悪が原因であると考えられている。
【0003】
COPDの増悪感受性と関連する遺伝的多型はいくつか報告されている(非特許文献1〜3)が、その遺伝的多型のCOPDの増悪の予防と治療における診断的価値は確立されていない。これらの遺伝的多型は当該遺伝子がコードするタンパク質の質的又は量的な変動をもたらすが、欠損を来すものではないため増悪の指標としては利用しづらく、これらの遺伝的多型と増悪との相関をもとに臨床的に有用な検査法を生み出すには至っていない。
【0004】
シグレック14(Siglec-14)は自然免疫系の細胞(顆粒球、単球など)に発現する免疫グロブリンスーパーファミリーに属する膜タンパク質である(非特許文献4及び特許文献1)。シグレック14は細胞外領域でシアル酸を含む糖鎖を認識し、膜貫通領域でアダプタータンパク質DAP12と会合する(非特許文献4)。またシグレック14は免疫細胞の活性化に関わることも報告されている(特許文献2の図3A、非特許文献5)。シグレック14とシグレック5(Siglec-5)の1〜2番目の免疫グロブリン様ドメインは互いに99%以上のアミノ酸配列相同性を示すことが知られている(非特許文献4)。一方、遺伝的多型によりシグレック14を発現しないヒト個体が比較的高い頻度で存在する(非特許文献5)。この遺伝的多型は、シグレック14遺伝子(SIGLEC14)由来の5'部分と、当該遺伝子に隣接するシグレック5遺伝子(SIGLEC5)由来の3'部分とからなる融合遺伝子シグレック14/5(SIGLEC14/5)(そのタンパク質産物のアミノ酸配列はシグレック5と同一である)が形成され、シグレック14タンパク質をコードする配列領域が失われたものである。この遺伝子多型をホモ接合性で有するヒト個体はシグレック14を発現しない。このような遺伝子多型を検出できる検出用試薬も開発されている(特許文献2)。
【0005】
シグレック14に対するアロ抗体が輸血副作用に関連する可能性が示唆されている(特許文献2、非特許文献6)。しかし、シグレック14の生体における機能は明らかではなく、その発現の有無とヒトの疾患との明確な関連性は知られていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−345786号公報
【特許文献2】特開2010−35551号公報
【非特許文献】
【0007】
【非特許文献1】Lin CL et al., "Mannose-binding lectin gene polymorphism contributes to recurrence of infective exacerbation in patients with COPD." Chest., (2011) 139(1):43-51
【非特許文献2】Foreman MG., et al., "Polymorphic variation in surfactant protein B is associated with COPD exacerbations." Eur. Respir. J., (2008) 32(4):938-944
【非特許文献3】Muller B and Tamm M., "Biomarkers in acute exacerbation of chronic obstructive pulmonary disease: among the blind, the one-eyed is king." Am. J. Respir. Crit. Care Med., (2006) 174(8):848-849
【非特許文献4】Angata T., et al., "Discovery of Siglec-14, a novel sialic acid receptor undergoing concerted evolution with Siglec-5 in primates." FASEB J., (2006) 20(12):1964-73
【非特許文献5】Yamanaka M, et. al., "Deletion polymorphism of SIGLEC14 and its functional implications." Glycobiology. (2009) 19(8):841-846
【非特許文献6】Yasui K, et al., "Detection of anti-Siglec-14 alloantibodies in blood components implicated in nonhaemolytic transfusion reactions." Br. J. Haematol., (2011) 153(6):794-796
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、COPD増悪感受性の検査法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するため鋭意検討を重ねた結果、シグレック14の遺伝子型がCOPD増悪感受性と強く相関することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は以下を包含する。
[1] ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法。
[2] 前記生物学的試料が、血液由来試料である、上記[1]の方法。
[3] 前記生物学的試料中のシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、上記[1]又は[2]の方法。
[4] 血液由来試料中の可溶性シグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、上記[2]の方法。
[5] 前記生物学的試料中のゲノムDNA配列に基づいて、シグレック14の遺伝子型を決定する、上記[1]又は[2]の方法。
[6] 決定されたシグレック14の遺伝子型の野生型アレルの数を、増悪感受性の指標とする、上記[1]〜[5]の方法。
[7] 前記ヒト被験体が慢性閉塞性肺疾患を発症した患者である、上記[1]〜[6]の方法。
【発明の効果】
【0011】
本発明の方法を用いればCOPD患者の増悪感受性を早期に検査することができる。
【図面の簡単な説明】
【0012】
【図1】シグレック14遺伝子型とAnthonisenらの定義によるCOPD細菌性増悪の有無との関係を示す図である。各バーの上部(淡色)が増悪なし、下部(濃色)が増悪ありを示す。野生型の増悪ありの95%信頼区間は22.2〜53.4%、ヘテロ接合型の増悪ありの95%信頼区間は12.1〜30.4%、ヌル変異型の増悪ありの95%信頼区間は1.8〜20.7%である。
【図2】シグレック14遺伝子型とRodriguez-Roisinの定義によるCOPD増悪の頻度との関係を示す図である。各バーの最上部から最下部(淡色〜濃色)までのそれぞれの部分は、順番に、0回、1回、2回、3回の増悪頻度(回数/年)を示す。
【図3】シグレック14タンパク質特異的ELISAの結果を示す図である。横軸は検出した各Siglec-Fc(Siglec-14-Fc及びSiglec-5-Fc)の添加濃度を示す。黒塗り丸がSiglec-14-Fc、白抜き丸がSiglec-5-Fcを表す。
【図4】シグレック14遺伝子多型と可溶性シグレック14の血中濃度との関係を示す図である。白抜きバーは、シグレック5と14をともに検出する抗体によって検出された、シグレック5及び14の血清中の総濃度を示す。黒塗りバーは、シグレック14を特異的に認識する抗体を用いたELISAによって検出された、シグレック14の血清中濃度を示す。
【発明を実施するための形態】
【0013】
以下、本発明を詳細に説明する。
本発明では、慢性閉塞性肺疾患(COPD)患者の増悪感受性と強く相関する遺伝的マーカー及び血清マーカーを検出することにより、増悪感受性に基づく患者の層別化を可能とする。
【0014】
本発明は、被験体(好ましくはヒト被験体)のシグレック14の遺伝子型を指標としてその被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法に関する。より具体的には、本発明は、ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、それを慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法に関する。
【0015】
本発明は、ヒト被験体由来の生物学的試料を用いて該被験体のシグレック14の遺伝子型を決定し、それを慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を判定するための指標となるデータを収集する方法も提供する。
【0016】
本発明において、シグレック14の遺伝子型の決定とは、検査対象のヒト被験体(被験ヒト個体)のゲノム上のシグレック14遺伝子座が有するアレル(対立遺伝子)の組み合わせを決定することを意味する。シグレック14遺伝子には遺伝的多型が存在することが知られており、一部のヒトでは、シグレック14遺伝子とシグレック5遺伝子が融合してシグレック14/5融合遺伝子を形成し、その結果、シグレック14タンパク質は産生されない(ヌル変異型アレルへの変異)ことが分かっている。すなわち本発明において、シグレック14の遺伝子型の決定とは、具体的には、シグレック14遺伝子(野生型アレル)をホモ接合で有する遺伝子型(野生型;WT/WT)、シグレック14の野生型アレルとヌル変異型アレルとのヘテロ接合である遺伝子型(ヘテロ接合型;WT/Null)、シグレック14のヌル変異型アレルのホモ接合である遺伝子型(ヌル変異型;Null /Null)のいずれであるかを決定することをいう。
【0017】
ここで、ゲノム上のシグレック14遺伝子(野生型アレル)は、例えば、配列番号1に示す塩基配列を有する。配列番号1の1001〜4405番目が野生型シグレック14タンパク質をコードするORFに対応するゲノム領域であり、そこにコードされている野生型シグレック14タンパク質のアミノ酸配列を配列番号2に示す。シグレック14の配列情報はGenBank等のデータベースでも公開されており、例えばヒトシグレック14の配列情報はGenBankアクセッション番号AAX47338、NP_001092082等で入手することができる。配列番号2に示すシグレック14タンパク質は、シグナルペプチド(配列番号2の1〜17番目)と成熟タンパク質(配列番号2の18〜396番目)からなり、成熟タンパク質は、免疫グロブリン様ドメイン1(配列番号2の26〜140番目)、免疫グロブリン様ドメイン2(配列番号2の149〜233番目)、リンカー(配列番号2の234〜251番目)、免疫グロブリン様ドメイン3(配列番号2の265〜326番目)、膜貫通ドメイン(配列番号2の359〜381番目)及びサイトゾル尾部(配列番号2の382〜396番目)を含む。免疫グロブリン様ドメイン1〜3を含む細胞外領域又はその部分断片は可溶性である。
【0018】
ゲノム上のシグレック5遺伝子の塩基配列の例を、配列番号3に示す。配列番号3の1001〜19105番目がシグレック5タンパク質をコードするORFに対応するゲノム領域である。そこにコードされているシグレック5タンパク質のアミノ酸配列を配列番号4に示す。なおシグレック5タンパク質のアミノ酸配列は、シグレック14/5融合タンパク質のアミノ酸配列と同一である。
【0019】
ゲノム上のシグレック14/5融合遺伝子の塩基配列の例を、配列番号5に示す。配列番号5の1001〜19105番目がシグレック14/5融合タンパク質をコードするORFに対応するゲノム領域である。シグレック14/5融合タンパク質のアミノ酸配列は、シグレック5タンパク質のアミノ酸配列と同一であり、両者は同一のタンパク質であるため、シグレック14/5融合タンパク質のアミノ酸配列も配列番号4に示すものである。
【0020】
本発明の方法で検出されるゲノム上のシグレック14遺伝子(野生型アレル)は、配列番号1に示す塩基配列を有するものであってよいが、配列番号2のアミノ酸配列をコードする限り異なる塩基配列を有していてもよい。さらに、ゲノム上のシグレック14遺伝子(野生型アレル)は、配列番号2のアミノ酸配列において1〜数個(例えば2〜5個)のアミノ酸の欠失、置換又は付加の変異を引き起こす塩基変異を含むものであってもよい。
【0021】
本発明で検査に供する生物学的試料は、基本的には、慢性閉塞性肺疾患の増悪感受性について検査しようとするヒト被験体から採取する。検査対象のヒト被験体は、健康であっても健康でなくてもよい。一実施形態では、検査対象となるヒト被験体は、肺疾患を有する者、特に、慢性閉塞性肺疾患(COPD)を発症した者が好適である。別の実施形態では、検査対象となるヒト被験体は、喫煙者であるか又は喫煙歴がある者が好適である。検査対象となるヒト被験体はまた、粉塵や大気汚染条件に長期間曝露されたか又はされている者が好適である。被験体が慢性閉塞性肺疾患を発症しているか否かは、臨床現場で用いられている通常の基準に基づいて判断すればよいが、例えば、気流制限(気管支の狭窄・閉塞などによって生じた、呼吸をする際の空気の流れの制限)が認められ、かつ気管支拡張剤投与後に行った肺機能検査で1秒率(FEV1/FVC)が0.7以下の場合に、慢性閉塞性肺疾患に罹患していると判断することができる。ここで、FEV1は、一秒量、すなわち、息をできるだけ速く吐き出したときに1秒間で吐き出すことのできる呼気量である。またFVCは、努力肺活量、すなわち、息を大きく吸い込みできるだけ速く吐き出したときの肺活量である。
【0022】
生物学的試料は、例えば、血液(例えば、末梢血)、血清、血漿、又は血液中の白血球等の、血液由来試料であってよいし、皮膚、粘膜(口腔粘膜、鼻内粘膜等)、骨髄、脂肪等の単離組織試料(例えば、口腔擦過試料、手術切除組織等)及びそこに含まれる細胞を含む試料、又は他の生体試料(例えば、気道洗浄液、口内洗浄液等の体内洗浄液、若しくは喀痰等)であってもよいが、これらに限定されない。本発明の検査方法に用いる生物学的試料は、一実施形態では、血液由来試料が好ましい。
【0023】
生物学的試料を用いて被験体のシグレック14の遺伝子型を決定する方法の一例として、生物学的試料中のDNAについてシグレック14遺伝子とシグレック14/5融合遺伝子の有無を検出する方法が挙げられる。生物学的試料は上記のような任意のものであってよいが、血液由来試料、例えば血液又は血液中の白血球等が好ましい。
【0024】
生物学的試料中のDNAについて検出実験を行う場合、当該生物学的試料を直接実験に供してもよいが、予め、溶血処理や、DNA抽出及び精製処理を行っておくことがより好ましい。溶血処理や、生物学的試料からのDNA抽出・精製は、常法により行うことができるが、例えば、溶血試薬を用いた溶血処理の後、遠心分離によって白血球等の細胞を分離し、それを市販のDNA抽出・精製キットを用いて処理することにより、簡便にゲノムDNAを精製することができる。
【0025】
一実施形態では、生物学的試料中のゲノムDNA配列に基づくシグレック14の遺伝子型決定は、シグレック14遺伝子を特異的に増幅するプライマーセット(シグレック14遺伝子特異的プライマーセット)と、シグレック14/5融合遺伝子を特異的に増幅するプライマーセット及び場合によりシグレック5遺伝子を特異的に増幅するプライマーセットを用いたPCRによって行うことができる。この遺伝子型決定は、例えば、特許文献2に記載のシグレック14遺伝子のアレル検出方法に基づいて行うことができる。
【0026】
シグレック14遺伝子特異的プライマーセットは、シグレック14遺伝子中の塩基配列に基づき、シグレック14/5融合遺伝子又はシグレック5遺伝子を増幅させないように設計する。その各プライマーは、シグレック14遺伝子とシグレック5遺伝子における保存領域の外側(保存領域より5'側及び3'側)に設計することが好ましい。シグレック14遺伝子とシグレック5遺伝子の保存領域は、配列番号1の塩基配列中では753番目〜2110番目に相当する。通常は、シグレック14遺伝子特異的プライマーセットのフォワードプライマーは753番目より5'末端側の領域に、リバースプライマーは2110番目より3'末端側の領域に設計する。好ましい具体的なプライマーとしては、フォワードプライマーとしては配列番号6に示す塩基配列を含むプライマー、リバースプライマーとしては配列番号7に示す塩基配列を含むプライマーが挙げられる。
【0027】
シグレック5遺伝子を特異的に増幅するプライマーセット(シグレック5遺伝子特異的プライマーセット)の各プライマーも、シグレック14遺伝子とシグレック5遺伝子における保存領域の外側(保存領域より5'側及び3'側)に設計することが好ましい。シグレック14遺伝子とシグレック5遺伝子の保存領域は、配列番号1の塩基配列中では753番目〜2110番目に相当し、配列番号3の塩基配列中では753番目〜2114番目に相当する。好ましい具体的なプライマーとしては、フォワードプライマーとしては配列番号8に示す塩基配列を含むプライマー、リバースプライマーとしては配列番号9に示す塩基配列を含むプライマーが挙げられる。
【0028】
シグレック14/5融合遺伝子を特異的に増幅するプライマーセットの各プライマーも同様に設計することができるが、好ましい実施形態では、シグレック14遺伝子特異的プライマーセットのフォワードプライマーと、シグレック5遺伝子特異的プライマーセットのリバースプライマーから構成されるプライマーセットを、シグレック14/5融合遺伝子特異的プライマーセットとして用いることができる。
【0029】
これら各プライマーの塩基長については特に制限はないが、アニーリング温度及びアニーリングの特異性等の点から、15〜40塩基、好ましくは20〜35塩基である。
【0030】
PCRは、例えば、鋳型となる生物学的試料由来のゲノムDNA、耐熱性DNAポリメラーゼ、デオキシリボヌクレオシド三リン酸混合物、PCR適合バッファー、上記プライマーセットを混合して反応液を調製し、変性工程、アニーリング工程、及びDNA伸長工程を含む核酸増幅工程を複数サイクル行うことにより実施する。
【0031】
PCR反応完了後、生成したPCR反応産物(核酸増幅産物)を検出する。PCR反応液に二本鎖DNA検出試薬(例えばSYBR Greenやエチジウムブロマイドなど)を添加し、適当な光源の存在下で反応産物を検出するか、反応産物をアガロースゲル電気泳動やキャピラリー電気泳動などで分離し、二本鎖DNA検出試薬(例えばSYBR Greenやエチジウムブロマイドなど)を用いてPCR反応産物を検出することができる。
【0032】
その結果、シグレック14遺伝子特異的プライマーセットによる増幅産物が検出されない場合は、シグレック14遺伝子の双方の野生型アレルを欠失していることが示される。さらに、シグレック14/5遺伝子特異的プライマーセットによる増幅産物が検出されるが、シグレック5遺伝子特異的プライマーセットによる増幅産物が検出されない場合、シグレック14遺伝子とシグレック5遺伝子とが融合したシグレック14/5融合遺伝子をホモ接合性で有することが示される。この場合、遺伝子型をヌル変異型と決定できる。
【0033】
一方、シグレック14遺伝子特異的プライマーセットによる増幅産物が検出される場合、シグレック14遺伝子の少なくとも一方の野生型アレルを有していることが示される。さらに、シグレック14/5遺伝子特異的プライマーセットによる増幅産物とシグレック5遺伝子特異的プライマーセットによる増幅産物の双方が検出される場合、シグレック14遺伝子の野生型アレルをヘテロ接合性で有し、シグレック14遺伝子はヌル変異型アレル(シグレック14/5融合遺伝子)となっていることが示される。この場合、遺伝子型は野生型アレルについてヘテロ接合型と決定できる。
【0034】
また、シグレック14遺伝子特異的プライマーセットによる増幅産物が検出され、かつ、シグレック5遺伝子特異的プライマーセットによる増幅産物も検出されるが、シグレック14/5遺伝子特異的プライマーセットによる増幅産物は検出されない場合は、シグレック14遺伝子の野生型アレルをホモ接合性で有し、シグレック14/5融合遺伝子は存在しないことが示される。この場合、遺伝子型は野生型と決定できる。
【0035】
なおシグレック14遺伝子特異的プライマーセットによる増幅産物とシグレック14/5遺伝子特異的プライマーセットによる増幅産物の検出結果だけで、シグレック14の各遺伝子型を識別することができるが、シグレック5遺伝子特異的プライマーセットによる増幅産物の検出結果を検討することで、さらにその遺伝子型の決定結果を裏付けることができる。
【0036】
別の実施形態では、生物学的試料中のゲノムDNA配列に基づくシグレック14の遺伝子型決定は、シグレック14遺伝子に特異的なプローブを用いたサザンブロット法によって行ってもよい。
【0037】
シグレック14遺伝子に特異的な核酸プローブは、シグレック14遺伝子中の塩基配列に基づき、シグレック14/5融合遺伝子又はシグレック5遺伝子にアニールしないように設計することが好ましい。具体的には、シグレック14遺伝子とシグレック5遺伝子の保存領域(配列番号1の753番目〜2110番目)を避け、かつシグレック14遺伝子に特異的な領域に設計すればよい。シグレック14遺伝子に特異的な核酸プローブは、例えば、配列番号1の2110番目より3'末端側の領域を選択して設計することができる。
【0038】
またシグレック5遺伝子又はシグレック14/5融合遺伝子に特異的な核酸プローブを設計・作製して、シグレック14遺伝子に特異的な核酸プローブに加えて、サザンブロット法に用いることがさらに好ましい。
【0039】
核酸プローブの塩基長については特に制限はないが、アニーリング温度やアニーリングの特異性等を考慮すると、通常は20〜10,000塩基対程度、好ましくは20〜1,000塩基対程度である。
【0040】
かかる核酸プローブを用いたサザンブロッティングでは、まず、例えば、ヒト被験体由来の生物学的試料から抽出したゲノムDNAを直接ナイロン膜などの薄膜に固相化するか、又は適当な方法(制限酵素等による消化など)で断片化しアガロースゲル電気泳動などにより分離した後、ナイロン膜などの薄膜に転写し固相化する。次いで、上記のシグレック14遺伝子に特異的な核酸プローブを調製し、ラベルを導入し、薄膜上のゲノムDNAとハイブリダイズさせればよい。ラベルとしては、放射性同位元素(32P、33P、35S等)、蛍光色素(Cy3やCy5等)、又はビオチンやジゴキシゲニンなどのエピトープを用いることができる。ビオチンやジゴキシゲニンなどのエピトープを導入した場合は、核酸プローブの検出に二次検出試薬(蛍光色素を結合したストレプトアビジンや抗ジゴキシゲニン抗体など)を必要とする。ハイブリダイズしなかったプローブを洗浄操作により除いた後、ハイブリダイズした核酸プローブをラベル法に応じた方法で検出すればよい。
【0041】
別法では、シグレック14遺伝子特異的な核酸プローブを薄膜又はガラス面などに固相化し、そこに、適当な方法(機械的剪断、制限酵素等による消化など)で断片化しラベルを導入したゲノムDNAをハイブリダイズさせてもよい。ラベルとしては放射性同位元素(32P、33P、35S等)、蛍光色素(Cy3やCy5等)、或いはビオチンやジゴキシゲニンなどのエピトープを用いることができる。ビオチンやジゴキシゲニンなどのエピトープを導入した場合は、核酸プローブの検出に二次検出試薬(蛍光色素を結合したストレプトアビジンや抗ジゴキシゲニン抗体)を必要とする。ハイブリダイズしなかったプローブを洗浄操作により除いた後、ハイブリダイズしたゲノムDNAをラベル法に応じた方法で検出することができる。
【0042】
サザンブロット法では、シグレック14遺伝子特異的な核酸プローブとゲノムDNAとのハイブリダイゼーションシグナルが検出できる場合、シグレック14の遺伝子型は野生型(ホモ接合)又はヘテロ接合型であることが示される。この場合、シグレック14/5融合遺伝子特異的な核酸プローブとゲノムDNAとのハイブリダイゼーションシグナルが検出されれば、シグレック14の遺伝子型はヘテロ接合型であると決定され、該シグナルが検出されなければ、野生型(ホモ接合)であると決定される。一方、シグレック14遺伝子特異的な核酸プローブとゲノムDNAとのハイブリダイゼーションシグナルが検出できない場合、シグレック14遺伝子の野生型アリルの双方が欠失し、シグレック14/5融合遺伝子がホモ接合性で存在することが示され、すなわちシグレック14の遺伝子型はヌル変異型と決定される。
【0043】
またシグレック14の遺伝子型は、生物学的試料中のシグレック14タンパク質を検出することによっても決定できる。シグレック14タンパク質は、シグレック14を特異的に認識する抗体を用いて検出することができる。「シグレック14を特異的に認識する抗体」とは、シグレック14タンパク質に特異的に結合し、かつシグレック5タンパク質には結合しない抗体をいう。この実施形態では、シグレック14を特異的に認識する抗体を用いて、生物学的試料中のシグレック14タンパク質を検出すればよい。本発明において検出対象となる「シグレック14タンパク質」は、シグレック14遺伝子によってコードされた配列番号2に示すアミノ酸配列からなるタンパク質だけでなく、当該タンパク質からシグナルペプチドが除去されたもの、配列番号2に示すアミノ酸配列において1〜数個のアミノ酸残基の欠失、置換又は付加を含む配列からなるタンパク質、配列番号2に示すアミノ酸配列の細胞外領域又はその一部である可溶性シグレック14タンパク質等を包含する。本発明において検出対象となる好ましい「シグレック14タンパク質」は、シグレック14タンパク質に特有の免疫グロブリン様ドメイン3を有する。シグレック14タンパク質は、例えば配列番号2に示すアミノ酸配列又はその一部をコードする塩基配列を有するDNAを用いて遺伝子工学的に組換え産生することができる。
【0044】
シグレック14について野生型(WT/WT)の遺伝子型を有する被験体、及びヘテロ接合型(WT/Null)の遺伝子型を有する被験体は、シグレック14タンパク質を発現する。一方、ヌル変異型(Null /Null)の遺伝子型を有する被験体は、シグレック14の野生型アレルを欠損しておりシグレック14/5融合遺伝子のみを有するため、シグレック14タンパク質を発現しない。なおシグレック14/5融合遺伝子から発現されるシグレック14/5融合タンパク質は、シグレック5タンパク質と同一のタンパク質である。したがって生物学的試料中のシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定することができる。
【0045】
シグレック14を特異的に認識する抗体は、ポリクローナル抗体であってもモノクローナル抗体であってもよく、従来公知の方法で取得することができる。例えば、シグレック14に対するポリクローナル抗体は、シグレック14タンパク質を用いて、マウス、ラット、ウサギ、ヤギ、ヒツジ、ロバ等の動物を免疫感作し、一定期間経過後血清を採取し、プロテインA、プロテインG、抗原タンパク質、抗原ペプチドなどを固相化したカラムなどで精製することで得ることができる。シグレック14タンパク質の一部又は全体を抗原として用いて抗体を作成した後、シグレック5タンパク質の一部(シグレック14タンパク質と高い配列相同性を示す部分を含む)又は全部と交差反応する画分を吸着などにより除去した画分を、シグレック14タンパク質を特異的に認識する抗体として調製することができる。あるいは、免疫に用いる抗原としてシグレック14タンパク質に特異的な領域を用いることにより、シグレック5タンパク質を含む他のシグレックタンパク質と交差反応しない抗体を得ることもできる。シグレック14タンパク質に特異的な領域としては、例えば、シグレック14タンパク質の細胞外領域に含まれるがシグレック5タンパク質の細胞外領域には含まれない領域が挙げられ、具体例では、配列番号2の238番〜358番の領域がシグレック14タンパク質に特異的な領域に相当する。本発明では、シグレック14タンパク質に特異的な領域、好ましくはリンカー及び/又は免疫グロブリン様ドメイン3、例えば配列番号2の238番〜358番の領域、を特異的に認識する抗体を、シグレック14を特異的に認識する抗体として好適に用いることができる。
【0046】
また、シグレック14に対するモノクローナル抗体は、上記ポリクローナル抗体と同様の免疫感作を行い、一定期間経過後、例えば脾臓細胞を採取し、該細胞とミエローマ細胞とを細胞融合し、得られたハイブリドーマをスクリーニングし、シグレック14タンパク質に対する抗体産生ハイブリドーマを取得して、その培養物又は培養上清から調製することができる。
【0047】
さらに、上記抗体の抗原結合性フラグメント(Fab、F(ab’)2など)も同様に使用することができる。
【0048】
ポリクローナル抗体、モノクローナル抗体いずれの場合も、ヒト由来の他のシグレックタンパク質(例えば、シグレック5、シグレック6)に交差反応しないことを確認することが望ましい。使用する抗体は、ラベルされたものでも、ラベルされていないものでもよい。抗体は、例えば、蛍光色素(フルオレセイン、R-フィコエリスリン、アロフィコシアニン等の検出可能な蛍光色素)やビオチン等でラベルすることができる。
【0049】
ラベルなしの抗シグレック14抗体を用いる場合は、抗体作製に用いた動物の免疫グロブリンのFc等を認識する二次抗体(蛍光色素又はビオチンなどでラベルしたもの)、ビオチンなどでラベルした抗体を用いる場合はこのラベルと特異的に結合するプローブ(蛍光色素ラベルしたストレプトアビジンなど)を二次試薬に用いて検出することができる。
【0050】
シグレック14を特異的に認識する抗体の好適な具体例は、後述の参考例に記載された、clone 40-1として規定されるシグレック14特異的モノクローナル抗体である。本抗体及びその作製については、Yamanaka M et al., Glycobiology. 2009, 19(8):841-846に開示されている。このclone 40-1のモノクローナル抗体は、シグレック14の細胞外領域と結合することができ、可溶性シグレック14タンパク質を認識することができる。
【0051】
シグレック14を特異的に認識する抗体を使用した生物学的試料中のシグレック14タンパク質の検出は、例えば、ELISA法や、フローサイトメトリーによる解析により行うことができる。
【0052】
本発明の方法の好適な一実施形態では、例えばシグレック14を特異的に認識する抗体を用いて、生物学的試料、特に血液由来試料中の可溶性シグレック14タンパク質を検出することにより、試料中の可溶性シグレック14タンパク質の有無又は量を決定し、それによりシグレック14の遺伝子型を決定することができる。血液由来試料としては、全血、血清、血漿等が挙げられ、血清がより好ましい。可溶性シグレック14タンパク質とは、膜貫通ドメインよりC末端側の領域を欠損した、シグレック14タンパク質の細胞外領域又はその一部を含むタンパク質である。すなわち可溶性シグレック14タンパク質は、全長シグレック14タンパク質の免疫グロブリン様ドメイン1、2及び3並びにリンカーのうち少なくとも1つを含み、膜貫通ドメイン及びサイトゾル尾部を含まない部分タンパク質である。この可溶性シグレック14タンパク質は、生体内で、細胞膜等の生体膜に結合しておらず、血液等の生体液中に遊離形態で存在する。理論により限定されることは意図しないが、可溶性シグレック14タンパク質は、生体内で、シグレック14遺伝子からスプライシングバリアントとして又は全長シグレック14タンパク質の分解により生成されるものと考えられる。
【0053】
血液由来試料中の可溶性シグレック14タンパク質の検出は、例えば、以下のようにして行うことができる。まず、試験プレートのウェルに、シグレック5とシグレック14をともに認識する抗体を添加し、PBS等のバッファー中、室温で終夜静置して抗体を固相に結合させる(固相化)。なお抗シグレック5抗体の多くは、シグレック14と交差反応し、シグレック5とシグレック14をともに認識する抗体である(Angata T et al., FASEB J. 2006, 20(12):1964-1973)。固相化後、溶液を除去し、洗浄バッファー(例えば、0.05% Tween 20等の界面活性剤含有PBS)で各ウェルを洗浄し、希釈液(例えば、1% BSA含有PBS)を添加して室温にてブロッキングを行う。溶液を除去し、を添加し、室温で2時間静置した。洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、血液由来試料(好ましくは、血清)又はその希釈サンプルを添加し、室温で数時間(例えば2時間)静置する。洗浄バッファーで各ウェルを洗浄した後、可溶性シグレック14を認識可能でありビオチン化等のラベリングがされている、シグレック14を特異的に認識する抗体(好ましくはモノクローナル抗体、例えばclone 40-1の抗体)をそこに添加し、室温で数時間(例えば、2時間)静置する。溶液を除去し、洗浄バッファーでウェルを洗浄し、ラベルの検出を行う。例えば、抗体をビオチン化した場合は、ストレプトアビジン-コンジュゲート化ホースラディッシュペルオキシダーゼと基質を添加して反応させ、反応産物を450 nmの吸光度で測定すればよい。このELISA法では、シグレック5を検出することなく、可溶性シグレック14を特異的に検出することができる。
【0054】
従来、ヒト血中の可溶性シグレック14の存在は明らかになっていなかった。しかし本発明により、シグレック14遺伝子(野生型アレル)を有するヒト被験体の血中にはシグレック14が可溶性形態(可溶性シグレック14)で存在すること、一方、シグレック5は血中に可溶性形態ではほとんど存在しないことが示された。このため、生物学的試料中の可溶性シグレック14の検出には、シグレック14を特異的に認識する抗体だけでなくシグレック5とシグレック14をともに認識する抗体も使用することができる。なお可溶性シグレック14の検出に用いる、シグレック14を特異的に認識する抗体は、可溶性シグレック14タンパク質、すなわちシグレック14の細胞外領域又はその一部と結合(認識)することができるものであり、例えば免疫グロブリン様ドメイン3と結合(認識)することが好ましい。
【0055】
したがって生物学的試料(好ましくは、血清等の血液由来試料)中に可溶性シグレック14タンパク質が検出される場合、その試料を採取したヒト被験体は、シグレック14遺伝子をホモ接合で有する野生型又はヘテロ接合で有するヘテロ接合型である。特に、可溶性シグレック14タンパク質がより高濃度(例えば、おおむね180ng/ml血清以上)で検出される場合は、シグレック14遺伝子について野生型であると決定でき、逆に、可溶性シグレック14タンパク質がより低濃度(例えば、おおむね1〜80ng/ml血清)で検出される場合はヘテロ接合型であると決定できる。可溶性シグレック14タンパク質が中間的な濃度(例えば、おおむね80ng/ml超、180ng/ml血清未満)である場合は、さらにゲノムDNA上のシグレック14遺伝子の検出を行うなどして、シグレック14の遺伝子型を決定することが望ましい。一方、調べた生物学的試料中にシグレック14タンパク質が検出されない場合、シグレック14の野生型アレルを両方とも欠損したヌル変異型(シグレック14/5融合遺伝子をホモ接合で有する)と決定できる。
【0056】
別の実施形態では、フローサイトメトリーにより白血球上に発現したシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定することもできる。例えば、被験体の血液を血液凝固を防ぐ試薬(EDTA、クエン酸、ヘパリンなど)を含む採血管に採取してそれを生物学的試料とする。必要に応じて、その血液から塩化アンモニウムなどを用いた赤血球の溶血により白血球を単離するか、又はフィコールなどを用いた密度勾配遠心法などにより白血球を単離する。さらに、ヒト白血球又は全血試料にシグレック14特異的な抗体を添加し、一定時間保温した後、洗浄により結合しなかった抗体を除き、フローサイトメーターを用いて白血球上のシグレック14タンパク質の有無を検出する。この際、顆粒球又は単球上でのシグレック14タンパク質の発現を検出することが望ましい。白血球上のシグレック14タンパク質が検出される場合、その試料を採取したヒト被験体は、シグレック14遺伝子をホモ接合で有する野生型又はヘテロ接合で有するヘテロ接合型である。一方、白血球上のシグレック14タンパク質が検出されない場合、シグレック14の野生型アレルを両方とも欠損したヌル変異型(シグレック14/5融合遺伝子をホモ接合で有する)である。
【0057】
本発明では、以上のようにして決定されたヒト被験体のシグレック14の遺伝子型を指標として、該被験体における慢性閉塞性肺疾患の増悪感受性を検査することができる。すなわち、本発明による慢性閉塞性肺疾患(COPD)の増悪感受性の検査は、COPDと強く相関するバイオマーカー(遺伝的マーカー又は血清マーカー等)としてのシグレック14の遺伝子型に基づいて行われる。
【0058】
ここで慢性閉塞性肺疾患の増悪感受性とは、慢性閉塞性肺疾患(COPD)を発症した後の増悪の生じやすさ(素因)を意味する。慢性閉塞性肺疾患の増悪感受性は、限定するものではないが、例えば、慢性閉塞性肺疾患患者が1年以内に増悪を生じる割合として表すこともできる。慢性閉塞性肺疾患の増悪(急性増悪)とは、呼吸困難、咳、喀痰などの慢性閉塞性肺疾患の症状が日常の生理的変動を超えて急激に悪化し、安定期の治療内容の変更を要する状態をいう(日本呼吸器学会ガイドライン、2009)。慢性閉塞性肺疾患の増悪は、Anthonisenらの定義(Anthonisen NR et al., Ann Intern Med. 1987, 106:196-204)や、Rodriguez-Roisinの定義(Rodriguez-Roisin, R. Chest 2000, 117:398S-401S)に従って判別することができる。本発明において、「慢性閉塞性肺疾患の増悪感受性が高い」ことは、慢性閉塞性肺疾患を発症した場合に増悪を生じる確率が高いことを意味する。
【0059】
本発明では、ヒト被験体がシグレック14遺伝子の野生型アレルを有すると決定された場合、このバイオマーカーと慢性閉塞性肺疾患の増悪感受性との相関に基づいて、慢性閉塞性肺疾患の増悪感受性がより高いものと検査される。
【0060】
具体的には、あるヒト被験体のシグレック14の遺伝子型が野生型であり、すなわちシグレック14遺伝子の野生型アレルをホモ接合で有していると決定された場合、その被験体における慢性閉塞性肺疾患(COPD)の増悪感受性は高いことが示される。本発明の方法において、野生型の場合のCOPDの増悪感受性(COPD増悪はAnthonisenの定義による)は、限定するものではないが、およそ22%〜53%の増悪率、好ましくはおよそ34%〜39%の増悪率である。一方、ヒト被験体のシグレック14の遺伝子型がヘテロ接合型であり、すなわちシグレック14遺伝子の野生型アレルをヘテロ接合性で有し、ヌル変異型アレル(シグレック14/5融合遺伝子)を1つ有していると決定された場合、その被験体におけるCOPDの増悪感受性は野生型と比較すれば相対的に低いがヌル変異型と比較すると相対的に高いことが示される。ヘテロ接合型の場合のCOPDの増悪感受性(同様にAnthonisenの定義による)は、限定するものではないが、およそ12%〜35%の増悪率、好ましくはおよそ18%〜21%の増悪率である。さらに、ヒト被験体のシグレック14の遺伝子型がヌル変異型であり、すなわちヌル変異型アレル(シグレック14/5融合遺伝子)をホモ接合で有すると決定された場合、その被験体におけるCOPDの増悪感受性は低いことが示される。ヌル変異型の場合のCOPDの増悪感受性(同様にAnthonisenの定義による)は、限定するものではないが、およそ2%〜20%の増悪率、好ましくはおよそ6%〜7%未満の増悪率である。ここで増悪率とは、慢性閉塞性肺疾患患者が1年以内に増悪を引き起こす割合(%)をいう。
【0061】
また上記のように、シグレック14の遺伝子型の野生型アレルの数が多いほど、COPDの増悪感受性は増加する。すなわち、シグレック14の野生型アレルを有しないヌル変異型よりも、野生型アレルを1つ有するヘテロ接合型の方が、COPDが増悪しやすく、シグレック14の野生型アレルを1つ有するヘテロ接合型よりも、野生型アレルをホモ接合で2つ有する野生型の方が、COPDが増悪しやすい。したがって本発明の方法によれば、決定されたシグレック14の遺伝子型の野生型アレルの数の多さに基づいて、増悪感受性の高さが検査される。すなわち本発明では、決定されたシグレック14の遺伝子型の野生型アレルの数を増悪感受性の指標とすることができる。
【0062】
さらには、決定したシグレック14の遺伝子型においてシグレック14の野生型アレルを有する場合には、高頻度の増悪を生じるリスクがあるものとして検査される。すなわち、シグレック14の野生型アレルをヘテロ接合で有するヘテロ接合型、及びその野生型アレルをホモ接合で有する野生型では、例えば、年間に2回以上、とりわけ年間に3回以上の高頻度の増悪を起こすリスクが高いものとして検査される。
【0063】
COPDの増悪は回復に時間を要し、また増悪を繰り返すほど肺機能が急激に低下して生活の質(QOL)や予後が悪化することが知られている。本発明の方法によれば、予めヒト被験体のCOPDの増悪感受性を検査しておくことができるため、増悪を重点的に予防することが望ましいCOPD患者を選択することができて有利である。
【実施例】
【0064】
以下、実施例を用いて本発明をさらに具体的に説明する。但し、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0065】
[参考例]シグレックタンパク質及び抗シグレック抗体の製造
(1)シグレックタンパク質の製造
ヒトシグレック14タンパク質の細胞外領域;3つの免疫グロブリン(Ig)様ドメインを含む)とヒトIgG Fc領域との融合タンパク質を既報に従って調製した(Angata T et al., FASEB J. 2006, 20(12):1964-1973、特開2006-345786号公報)。具体的には、まず、ヒトシグレック14タンパク質の完全長cDNA(GenBankアクセッション番号AY854038)をプラスミド中にクローニングし、それを鋳型DNAとして、シグレック14の細胞外領域に相当する核酸配列をPCRによりPfu DNAポリメラーゼを用いて増幅した。このPCRには以下のプライマーを使用した:HsSig5/14 Expr F(5'-ccctctagagccaccATGCTGCCCCTGCTGCTGCTGCCC-3'(配列番号10); "tctaga"はXbaI部位である)及びHsSig14 Fc R(5'-atcGGAAGAGGAGCTTCTCTGCACA-3'(配列番号11); 5'末端の配列"atc"はEcoR V部位の半配列である)(両プライマー配列中、大文字はシグレック14のcDNA配列に一致する塩基を表す)。得られたPCR産物をXbaIで切断し、ヒトIgG Fc領域コード配列を含むプラスミドEK-Fc/pcDNA3.1(-)のXbaI-EcoR V部位にクローニングし、インサートの配列を確認した。EK-Fc/pcDNA3.1(-)は、pcDNA3.1(-)(Invitrogen社)のEcoRVとEcoRIサイトの間にFLAGタグ/エンテロキナーゼ認識配列をコードする領域及びヒトIgG1のヒンジ領域からC末端(Fc)までをコードするゲノム由来DNA断片を挿入したベクターである。FLAGタグ/エンテロキナーゼ認識配列をコードする領域の5'上流に読み枠が合うようにEK-Fc/pcDNA3.1(-)にcDNA断片を挿入する事により、挿入したcDNA断片(ここではシグレック14の上記細胞外領域をコードするインサート)由来のポリペプチドとFLAGタグ/エンテロキナーゼ認識配列、ヒトIgGのヒンジ領域及びFc領域が融合された可溶性タンパク質を発現するための組換え発現ベクターを得ることができる。
【0066】
得られた組換え発現ベクターを、リポフェクトアミン2000を用いて293細胞に導入した。次いで培地を、2%低IgG-FBS(HyClone, Logan, UT, USA)を含むOpti-MEM(Invitrogen)に交換し、6日間培養した。回収した培地を遠心分離して培養上清を採取し、産生した組換えタンパク質(上記シグレック14細胞外領域+Fcの融合タンパク質;Siglec-14-Fc)を、プロテインAセファロースへの吸着、0.1 Mグリシン-HClバッファー(pH 3.0)による抽出及び1/10量の1M Tris-HClバッファー(pH 8.0)での中和により、培養上清から精製した。
【0067】
また上記と同様の方法で、ヒトシグレック5タンパク質の細胞外領域(3つの免疫グロブリン(Ig)様ドメインを含む、ヒトシグレック14の上記細胞外領域と対応する領域)とヒトIgG Fc領域との融合タンパク質(Siglec-5-Fc)を作製し、精製した。
【0068】
(2)抗シグレック14抗体の作成
次いで、このようにして得られた、シグレック14の細胞外領域とIgG Fc領域との融合タンパク質(Siglec-14-Fc)を用いて、シグレック14を特異的に認識する抗体を既報に従って作製した(Yamanaka M et al., Glycobiology. 2009, 19(8):841-846)。
【0069】
具体的には、BALB/cマウスを、上記で精製した組換え融合タンパク質Siglec-14-Fcを用いて繰り返し免疫した後、その脾臓を採取し、ポリエチレングリコールを用いて脾細胞とマウス由来ミエローマ細胞を常法により融合した。得られたハイブリドーマクローンを、シグレック14又はシグレック5完全長タンパク質発現ベクターを導入したCOS-7細胞を用いたフローサイトメトリーにより、シグレック14又はシグレック5に対する反応性についてスクリーニングした。次いで、シグレック14又はシグレック5を安定的に発現するTHP-1細胞を用いたフローサイトメトリーにより、さらにシグレック14又はシグレック5に対する反応性についてスクリーニングした。このようにして、シグレック14を特異的に認識しシグレック5を認識しない抗体を産生するハイブリドーマクローン(Clone 40-1)を作製した。このハイブリドーマクローンclone 40-1の無血清培養上清をプロテインGセファロース(登録商標)(GE Healthcare)への吸着に供することによって、シグレック14特異的モノクローナル抗体を精製した。このシグレック14特異的モノクローナル抗体(clone 40-1)は、シグレック14の細胞外領域の免疫グロブリン様ドメイン3に結合する抗体である。
【0070】
なお、シグレック14とシグレック5の両方を特異的に認識するマウスモノクローナル抗体(Clone 194128)は、R&D Systems社(Minneapolis, MN, USA)から市販品を購入して後述の実施例で用いた。
【0071】
[実施例1]シグレック14遺伝子(SIGLEC14)の遺伝的多型とCOPD増悪の相関
日本医科大学呼吸ケアクリニックに来訪した外来患者のうち、以下の条件を満たす方に研究への参加意思の有無を訊ねた:(1)現在又は過去に喫煙歴があること、(2)咳嗽、喀痰、呼吸困難があること。研究参加の意志表示をした患者からはインフォームドコンセントを得た。肺機能検査は肺機能検査システムCHESTAC(Chest株式会社)を用いて行い、常法に従って気管支拡張薬投与後の1秒率(FEV1/FVC)が0.7以下の患者を慢性閉塞性肺疾患(COPD)患者と診断した。COPD患者に対しては1年間にわたり毎月フォローアップを行い、増悪に関する質問を含む問診を行った。問診では、Anthonisenらの定義(Anthonisen NR et al., Ann Intern Med. 1987, 106:196-204)による細菌性の増悪の有無、及びRodriguez-Roisinの定義(Rodriguez-Roisin, R. Chest 2000, 117:398S-401S)によるより軽度な増悪を含む増悪の頻度の両方について質問した。
【0072】
一方、患者の末梢血より常法に従いDNAを採取し、シグレック14遺伝的多型の解析を既報に準じて行った(Yamanaka M et al., Glycobiology. 2009, 19(8):841-6;特開2010-35551号公報)。具体的には、患者から同意のもと末梢血約10 mlを採取し、ACK溶血液(150 mM塩化アンモニウム、10 mM炭酸水素カリウム、0.1 mMエチレンジアミン四酢酸)を用いて赤血球を溶血させた。この液から遠心操作により白血球を得た。得られた白血球(5 x 106細胞)からDNeasy Blood & Tissue Kit(QIAGEN社)を用いてゲノムDNAを精製した。このゲノムDNAを鋳型として、PCRを実施した。PCRに用いた反応液(20μl)の組成は以下の通り:ゲノムDNA 100 ng、プライマー各0.3μM、デオキシリボヌクレオシド三リン酸(dATP、dCTP、dGTP、dTTP)各0.2 mM、耐熱性DNAポリメラーゼExpand High Fidelity enzyme(ロシュ・ダイアグノスティクス)0.5ユニット、塩化マグネシウム1.5 mM、1 x Expand High Fidelity Buffer(ロシュ・ダイアグノスティクス)。
【0073】
PCRの反応サイクルは、94℃で2分の後、(94℃で15秒;56℃で30秒;72℃で90秒)を10サイクル、続いて(94℃で15秒;56℃で30秒;72℃で90秒+各サイクル5秒ずつ延長)を20サイクル、続いて72℃で7分とした。
【0074】
PCRには、シグレック14遺伝子、シグレック5遺伝子及びシグレック14/5融合遺伝子を、それぞれ特異的に増幅する以下に示すプライマーセットを用いた。
【0075】
シグレック14遺伝子増幅用プライマーセット
フォワードプライマー(14F):5'-AGGATTTATTCTCCCATCTCGCT-3'(配列番号6)
リバースプライマー(14R):5'-GATGCTGATGGCGAGGTTCTG-3'(配列番号7)
シグレック5遺伝子増幅用プライマーセット
フォワードプライマー(5F):5'-GTGGTTCTGACATCTCACCTCATC-3'(配列番号8)
リバースプライマー(5R):5'-CCTGAAGATGGTGATGGTCTG-3'(配列番号9)
シグレック14/5融合遺伝子増幅用プライマーセット
フォワードプライマー(14F):5'-AGGATTTATTCTCCCATCTCGCT-3'(配列番号6)
リバースプライマー(5R):5'-CCTGAAGATGGTGATGGTCTG-3'(配列番号9)
【0076】
続いて、上記で得られたPCR反応産物を、1%アガロースゲルを用いてTAEバッファー(40 mMトリス、40 mM酢酸、0.1 mMエチレンジアミン四酢酸)中で電気泳動し(各レーン10μl)、増幅産物を分離した。エチジウムブロマイドでゲルを染色し、紫外線ランプで照射してDNAを検出し、撮影した。
【0077】
プライマー対5F+5Rはシグレック5遺伝子の一部を、プライマー対14F+14Rはシグレック14遺伝子の一部を特異的に増幅する。プライマー対14F+5Rはシグレック14/5融合遺伝子が存在する場合にはこの遺伝子の約1.7 kbの領域を増幅する。同じプライマー対を用いて野生型アリルから、本実験で用いた反応条件下でこの産物は生じない。
【0078】
この結果、プライマー対5F+5Rによるシグレック5遺伝子の増幅とプライマー対14F+14Rによるシグレック14遺伝子の増幅の双方が検出されたがプライマー対14F+5Rによるシグレック14/5融合遺伝子の増幅が検出されなかった患者を野生型(WT/WT)と決定した。またプライマー対5F+5Rによるシグレック5遺伝子の増幅とプライマー対14F+14Rによるシグレック14遺伝子の増幅の双方が検出されず、プライマー対14F+5Rによるシグレック14/5融合遺伝子の増幅が検出された患者をヌル変異型(SIGLEC14 null;Null/Null)と決定した。さらに、プライマー対5F+5Rによるシグレック5遺伝子の増幅、プライマー対14F+14Rによるシグレック14遺伝子の増幅、及びプライマー対14F+5Rによるシグレック14/5融合遺伝子の増幅の全てが検出された患者をヘテロ接合型(WT/Null)と決定した。
【0079】
さらに、シグレック14遺伝子多型とCOPD増悪との相関を調べるため、JMP genomics software ver 3.1を使用して統計的解析を行った。Anthonisenらの定義による増悪の有無にシグレック14の遺伝子型が及ぼす影響の解析にはロジスティック回帰分析を用いた。Rodriguez-Roisinの定義による増悪の頻度にシグレック14の遺伝子型が及ぼす影響の解析にはポアソン回帰分析を用いた。尤度を最大化する一般化線形モデルを採用した。年齢と性別を共変数とし、増悪頻度に影響があるとされる喫煙状況、吸入ステロイドの使用の有無、気管支拡張薬投与後の1秒量対予測値(FEV1 % predicted)を共変数として解析を行った。
【0080】
結果を図1〜2及び表1〜2に示す。図1及びにはシグレック14の遺伝子型毎の、Anthonisenらの定義によるCOPDの細菌性増悪の有無の割合を示した。また図2には、シグレック14の遺伝子型毎の、Rodriguez-Roisinの定義によるCOPD増悪の各頻度の割合を示した。
【0081】
【表1】

【0082】
【表2】

【0083】
シグレック14の野生型アリルの数と、増悪の有無(図1)、増悪の頻度(図2)との間にはいずれも正の相関が認められ(ヌル変異型[野生型アリル数:0]<ヘテロ接合型[野生型アリル数:1]<野生型[野生型アリル数:2])、いずれも統計的に有意であった(それぞれp = 0.0015およびp = 0.0002)。この結果から、シグレック14遺伝子の野生型アリルの数が多くなるほど、増悪感受性が高くなることが示された(図1及び2)。例えば、野生型アリルをホモ接合で有する野生型(WT/WT)の患者は35〜45%程度の割合で増悪を経験したのに対し、野生型アリルを持たずSIGLEC14-nullアリルのホモ接合であるヌル変異型(Null/Null)の患者でのCOPD増悪割合は10%未満と低く、増悪感受性は顕著に低かった。さらに、野生型アリルの数が多いほど、増悪頻度が特に高い(2回以上、とりわけ3回以上)患者が出現し、すなわち野生型アリルの数が多い場合にはCOPD増悪頻度が特に高くなるリスクがあることも示された(図2)。
【0084】
この結果から、シグレック14遺伝子型を解析することにより、COPD患者の増悪感受性を予測し、患者を層別化できることが示された。
【0085】
[実施例2]シグレック14を特異的に検出するELISAの開発
参考例で作製したシグレック14を特異的に認識する抗体(clone 40-1)1 mgを、市販のタンパク質ビオチン化キット(Biotin Protein Labeling Kit, ロシュ・ダイアグノスティクス)を用いてビオチン化し、検出用抗体とした。
【0086】
96ウェルプレートの各ウェルに、シグレック5とシグレック14をともに認識する抗体(clone 194128, R&D Systems)を添加(0.1 μg抗体/100 μl PBS/ウェル)し、室温で終夜静置して抗体を固相化した。この溶液を除去し、洗浄バッファー(0.05% Tween 20含有PBS)で各ウェルを3回洗浄(400 μl/ウェル)し、希釈液(1% BSA含有PBS, 300 μl/ウェル)を添加して室温にて1時間ブロッキングを行った。この溶液を除去し、希釈液で段階希釈した標準試料(Siglec-14-Fc及びSiglec-5-Fc)を添加し、室温で2時間静置した。洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、上記で調製したビオチン化抗シグレック14抗体を添加(0.05 μg抗体/100 μl 1% BSA含有PBS/ウェル)し、室温で2時間静置した。この溶液を除去し、洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、ストレプトアビジン-コンジュゲート化ホースラディッシュペルオキシダーゼ(希釈液で1:1000希釈、100 μl/ウェル)を添加し、室温で20分静置した。この溶液を除き、洗浄バッファーで各ウェルを3回洗浄(400 μl/ウェル)し、基質(SureBlue Reserve, Kirkegaard & Perry Laboratories, Inc.)を添加(100 μl/ウェル)し、10〜15分インキュベートし、1N塩酸を添加(100 μl/ウェル)して反応を止め、450 nmの吸光度を測定した。
【0087】
結果を図3に示す。このELISAにおいて、Siglec-14-Fcは1.56〜100 ng/mlの範囲で定量的に測定できたのに対し、Siglec-5-Fcは検出されなかった。すなわち、このELISAを用いることにより、類似するシグレック5を検出することなく、シグレック14を特異的に検出し定量することができることが示された。なお基質添加後のインキュベーション時間を変えることにより、増感及び減感が可能であった。
【0088】
[実施例3]シグレック14の遺伝的多型と可溶性シグレック14の血中濃度の相関
上記実施例と同様にインフォームドコンセントを得た患者から採血を行い、血清及びゲノムDNAを得た。各患者のシグレック14の遺伝的多型(遺伝子型)の解析を実施例1と同様の手順で行った。
【0089】
血清は希釈液(1% BSA含有PBS)を用いて20倍に希釈し、これを被験サンプルとして、実施例2に記載したシグレック14を特異的に検出するELISAを実施した。また、同血清を希釈液を用いて200倍に希釈し、市販のシグレック5と14をともに検出できる抗体を用いたELISAキット(R&D Systems)を使用してシグレック5及びシグレック14の総濃度も測定した。
【0090】
結果を図4に示す。黒い棒グラフはシグレック14特異的に検出するELISA、白い棒グラフはシグレック5と14をともに検出するELISAを用いて、同一セットの試料を測定した結果である。試料1〜19はシグレック14の遺伝子型がヌル変異型(Null/Null)の患者、試料20〜37はヘテロ接合型(WT/Null)の患者、試料38〜53は野生型(WT/WT)の患者に由来する血清である。
【0091】
図4に示すように、シグレック14特異的に検出するELISAを用いて測定した結果、シグレック14遺伝子型がWT/WT及びWT/Nullの患者からは、可溶性シグレック14が検出されたが、Null/Nullの患者からは検出されなかった。したがってNull/Nullとそれ以外の遺伝子型を血清中の可溶性シグレック14タンパク質の有無に基づいて鑑別することが可能である。さらに、シグレック14遺伝子型がWT/WTの患者の血清中可溶性シグレック14濃度はWT/Nullのそれと比較して高い傾向が認められ、シグレック14の野生型アレルの数に応じて血中の可溶性シグレック14濃度が高くなることが示された。
【0092】
なお、シグレック5とシグレック14をともに検出するELISAを用いて測定した結果、Null/Nullの患者の血清からは可溶性シグレック5/シグレック14はごく微量しか検出されなかった。すなわち、血中に可溶性形態で存在するのはほとんどシグレック14であり、シグレック5は血中に存在しないか、存在してもごく微量であることが示された。
【産業上の利用可能性】
【0093】
本発明は、慢性閉塞性肺疾患(COPD)患者の増悪感受性と強く相関する遺伝的マーカー及び血清マーカー等を検出することにより、増悪感受性に基づく患者の層別化と個別化治療を可能とすることができる。増悪感受性の検査・判定結果に基づいてCOPD患者の適切な層別化やモニタリングを行うことにより、患者のQOL及び予後の改善、並びに医療資源の有効利用につなげることができる。
【配列表フリーテキスト】
【0094】
配列番号6〜11:プライマー
【特許請求の範囲】
【請求項1】
ヒト被験体由来の生物学的試料を用いて、該被験体のシグレック14の遺伝子型を決定し、慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法。
【請求項2】
前記生物学的試料が、血液由来試料である、請求項1に記載の方法。
【請求項3】
前記生物学的試料中のシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、請求項1又は2記載の方法。
【請求項4】
血液由来試料中の可溶性シグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、請求項2記載の方法。
【請求項5】
前記生物学的試料中のゲノムDNA配列に基づいて、シグレック14の遺伝子型を決定する、請求項1又は2記載の方法。
【請求項6】
決定されたシグレック14の遺伝子型の野生型アレルの数を、増悪感受性の指標とする、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記ヒト被験体が慢性閉塞性肺疾患を発症した患者である、請求項1〜6のいずれか1項記載の方法。
【請求項1】
ヒト被験体由来の生物学的試料を用いて、該被験体のシグレック14の遺伝子型を決定し、慢性閉塞性肺疾患の増悪感受性の指標とすることを含む、ヒト被験体における慢性閉塞性肺疾患の増悪感受性を検査する方法。
【請求項2】
前記生物学的試料が、血液由来試料である、請求項1に記載の方法。
【請求項3】
前記生物学的試料中のシグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、請求項1又は2記載の方法。
【請求項4】
血液由来試料中の可溶性シグレック14タンパク質を検出することにより、シグレック14の遺伝子型を決定する、請求項2記載の方法。
【請求項5】
前記生物学的試料中のゲノムDNA配列に基づいて、シグレック14の遺伝子型を決定する、請求項1又は2記載の方法。
【請求項6】
決定されたシグレック14の遺伝子型の野生型アレルの数を、増悪感受性の指標とする、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記ヒト被験体が慢性閉塞性肺疾患を発症した患者である、請求項1〜6のいずれか1項記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−34455(P2013−34455A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2011−175356(P2011−175356)
【出願日】平成23年8月10日(2011.8.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度 独立行政法人 医薬基盤研究所 基礎研究推進事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(500557048)学校法人日本医科大学 (20)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成23年8月10日(2011.8.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度 独立行政法人 医薬基盤研究所 基礎研究推進事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(500557048)学校法人日本医科大学 (20)
【Fターム(参考)】
[ Back to top ]

