房室弁逆流及び心室リモデリング逆転のためのシステム及び方法
【課題】心室の支持構造の形状歪みに局所的に対処することで、心室リモデリング及び房室弁逆流を治療する方法及びデバイスを提供すること。
【解決手段】房室弁を支持する構造を一部として含め、心臓の正常な形状を回復する方法及びデバイス。ここで説明する手法及びデバイスは、能動型及び受動型の両方の変位の原理に基づいて動作し、心臓リモデリングを逆転させ、虚血性房室弁逆流を制限する。
【解決手段】房室弁を支持する構造を一部として含め、心臓の正常な形状を回復する方法及びデバイス。ここで説明する手法及びデバイスは、能動型及び受動型の両方の変位の原理に基づいて動作し、心臓リモデリングを逆転させ、虚血性房室弁逆流を制限する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、心室リモデリングを逆転させ、弁の機能障害を修正する方法及びデバイスに関し、特に、心室組織に局所的に対処して再配向する方法及びデバイスに関する。いくつかの低侵襲的手法及び調整可能デバイスについて説明する。
【背景技術】
【0002】
虚血性心疾患の患者は、広範な病理変化を体験する。その一部には、心室拡大と、僧帽弁輪の拡大と、乳頭筋の変位及び繋留と、乳頭梗塞と、区域的及び大域的心室機能障害とが含まれる。僧帽弁の機能及び能力は、支持構造の微細な形状及び機能的完全性に依存する。
【0003】
心筋梗塞による拡大又は瘢痕化により左心室が変形すると、乳頭筋が繋留されるため、僧帽弁の十分な閉鎖が妨げられる。左心室は、二つの乳頭筋を有する。両方とも、左心室自由壁を起点とする。前乳頭筋は、左心室の前壁、外側縁の近くに付着する。後乳頭筋は、後壁の心室中隔の接合部近くを起点とする。僧帽弁の閉鎖は、その尖部の並置によって達成される。乳頭筋の繋留は、僧帽弁機能不全と尖部並置の障害とを発生させる重要なメカニズムの一つとなることが明らかになっている。虚血性僧帽弁逆流は、心疾患の患者において、著しい死亡率及び罹患率を占める(修復されない場合、心臓発作後及びバイパス術後の遅発性死亡率を二倍にする)。
【0004】
図1は、心臓2における心室拡大の基本的な問題及び房室弁逆流との関係を例示している(本明細書の本図及び他図に描かれた心臓は超音波映像において観察されたものとして提示されるため、提示した図は通常の解剖学的提示から反転されており、超音波振動子に最も近いことから、心尖4が最上部に表示されることに留意されたい)。心臓の最初のポンプ室である左心室8の損傷した筋肉壁6は、変形し、心室腔9の中心から外側に膨らむ。これにより、腱索14網によって僧帽弁尖部12が固定される乳頭筋10は、変位し、次に、尖部先端部を引っ張り、尖部の適切な一致(即ち、接合)を妨げる。その結果、不適切な閉鎖が生じ、左心房16から僧帽弁輪部18を越えて左心室腔9へと戻る僧帽弁逆流が発生する。こうした逆流は、心不全と、心拍障害と、突然死と、致命的な心臓弁感染症の素因とを引き起こす可能性がある。心室リモデリングによる著しい房室弁逆流が未だ発生していない患者においても、拡大は、心室腔容積を増加させ、心臓のポンピング負荷の比例した増加を招く。
【0005】
虚血性僧帽弁逆流を扱ったこれまでの研究には、以下が含まれる。
【0006】
(a)Czerらは、血管再生(冠動脈バイパスグラフト)のみでは僧帽弁逆流が改善しないことを記録している。冠動脈バイパス術を受けた2000人の患者の研究では、未矯正の僧帽弁逆流により、後発性死亡のリスクが倍加した。
【0007】
(b)僧帽弁形成術は、虚血性僧帽逆流の原因として、輪部の拡大のメカニズムに対処する。僧帽弁輪形成術には、僧帽弁輪部の周りに人工僧帽弁輪を縫着し、輪部のサイズを低減して、僧帽弁尖部の良好な閉鎖を矯正することが伴う。しかしながら、臨床的観察では、心臓の不適切な形状が矯正されないことから、これによってMRの度合いが常に低減されるとは限らないことを示唆された。加えて、弁輪形成手法は、付随するリスクの高い侵襲的手技である心臓の切開を含み、患者に心肺バイパスを用いる必要がある(心臓及び肺を迂回する人工ポンプを使用しながら、心臓を停止し、切開して輪を挿入する)。手技の有効性を評価するには、心臓が心肺バイパスから完全に解放された後、僧帽弁機能を検査する必要がある。外科的弁輪形成手技により目的を達成できなかった場合には、心肺バイパスを再び設け、輪の位置を調節する必要がある。反復的な心肺バイパスのサイクルは、以前から高い外科的僧帽弁輪形成術の罹患率及び死亡率を更に増加させる。こうした付随するリスクのため、外科的僧帽弁輪形成術は、この手技を行った際に最大の恩恵を得られる可能性がある病状の最も重い患者には提供されない場合が多い。
【0008】
(c)弁の尖部を外科的に掴み、縫合糸又はその他の締結具により縫合するための外科的手法が主張されてきた。こうした発明には、実施を成功させる能力を制限する、いくつかの難点が存在する。こうした手技の正当な理由となる十分なMRを有する患者において、尖部は、最初から位置がずれており、共に縫合又は締結するために単一のデバイスで尖部先端部を並置状態にする能力を制限又は妨害する。更に、尖部を掴むための提案される吸引デバイスは、効果を高めるために、血液を極めて急速に引き込む必要があり、即座に再輸血しなければ、結果として低血圧が生じる可能性がある。尖部表面を安定化する手段も利用する必要があり、そうでない場合には、尖部の締結を意図した縫合糸又はステープルが、代わりに尖部を変位させ得る。更に、尖部を過度に伸張させた場合には、縫合により尖部の張力が増加するため、縫合が成功しない場合がある。
【0009】
(d)場合によってバルーン又は支柱が付加される心膜クランプ又はハーネスといった、心室のサイズを抑制するその他の心室リモデリング手法及び特許が紹介されている。こうしたデバイスは、大域的心室拡大の状態にある心臓を取り囲むが、特定の区域的病変には対処しない(即ち、対象点の選択性、或いは適応性を提供しない)。その他のデバイスには、心臓を通して挿入され、そのポイントでの心室の直径を低減することを目的とする受動的張筋メカニズムが含まれる。心室を横断する恒久的移植構成材は、同じく、非常に侵襲的な処置である。更に、こうしたアプローチには、正確な標的化と頑丈な固着とが欠如している。むしろ、こうした手法及び/又はデバイスは、変位、張力、及び作用力における特定の領域的変化に対する心室形状の周囲的変化を対象としてきた。正確な標的化と、応力歪み及び変位の相互関係の矯正とは、房室弁の複雑な形状にとって特に重要である。
【発明の概要】
【発明が解決しようとする課題】
【0010】
したがって、必要なものは、心室の支持構造の形状歪みに局所的に対処することで、心室リモデリング及び房室弁逆流を治療する方法及びデバイスである。
【0011】
必要となる場合には弁の修復以外の作業を外科医に頻繁に強いる心肺バイパスなしで、特に、病状がより重篤で、この修復により最も大きな恩恵を受けるが、長期的なバイパスによるリスクが最大となる患者において、こうした手法を実行できれば更に望ましい。
【0012】
更に、心臓の形状に対する損傷は累進的であるため、逆流及び/又はリモデリングは、低減に最初に成功した後で再発する場合が多い。したがって、こうした条件に対処する、経時的に調節可能なアプローチを利用することが望ましい。
【課題を解決するための手段】
【0013】
本発明は、房室弁を支持する構造を一部として含め、心臓の正常な形状を回復する方法及びデバイスを提供する。本明細書で説明する手法及びデバイスは、能動型及び受動型の両方の変位の原理に基づいて動作し、心臓リモデリングを逆転させ、虚血性房室弁逆流を制限する。
【0014】
本発明の好適な実施形態は、心臓切開手術又は心肺バイパスを必要としない低侵襲的方法(例えば、胸腔鏡検査)を含む。これらは、代替療法と併せて、或いは代替療法なしで、実行してよい。心臓の二つ以上の位置を、本発明により同時に処置してよい。
【0015】
本発明により、乳頭筋を再配置することが可能であり、したがって、尖部の張力を軽減し、効果的に閉鎖できるように、正常な房室弁形状を回復することが可能である。なお、本明細書で説明する具体的な実施形態は左心室の僧帽弁逆流に関連するが、本明細書で説明する方法及びデバイスは、心臓右側での弁逆流及び他の心腔の拡大に対処するためにも等しく応用可能であり、「乳頭筋」という用語は、本明細書での使用において、左心室の乳頭筋と同等の機能性を有する任意の結合構造を意味する。更に、心臓の形状に関する「正常化」の使用は、正常な状態へ向かうことと、正常な心臓形状の必ずしも完全ではない回復とを意味する。同様に、下の特定の具体的な実施形態及び説明では、「外壁区域」という用語を使用して、乳頭筋に近接する、或いは基部(即ち、心室及び心房の接合部)へと延びる、心臓の領域を指すが、その他の場合には、このような形でこの用語を制限することは意図されない。
【0016】
手術中の観察では、乳頭筋の外部に加えた力又は圧力により、房室弁逆流(AVR)を除去できることが示唆される。本発明は、乳頭筋の部分に沿った縦の面に配置し、三次元空間において、こうした力を及ぼす(即ち、前記縦の面に垂直であると同時に半径方向へ向かう変位を発生させる)デバイスを提供する。
【0017】
AVRを治療するデバイスは、一般に、乳頭筋形状を正常化し、尖部の接合を改善できるように、心臓の心室腔の中心線へ向かう内側への外壁区域の変位を達成するために、心臓の外壁区域に作用する圧縮部材を含む。好適な実施形態において、デバイスは、心臓壁の取り付け部位への容易な送給のために、可逆的に折り畳み可能又は巻き付け可能である。
【0018】
一実施形態において、変位は、圧縮部材と、心臓から離れる方向への拡張に抵抗するデバイスの強化部分との間に配置された膨張可能なリザーバを調節可能な状態で膨張させ、これにより、圧縮部材を心臓壁区域へ移動させることにより達成される。リザーバは、断続的に(例えば、異なる時点での別個のステップにおいて)、或いは、心臓の電気的活動と時間的に同調するような、より周期的な形で、収縮及び再膨張させてもよい。膨張は、膨張流体又はゲルを供給源からリザーバへポンプで送ることにより達成してよい。こうしたデバイスは、心臓を取り囲む心膜の最上層又はその下への縫合等、任意の従来の手段により、外壁に非外傷的に固定してよい。
【0019】
デバイスの配置の誘導、或いはデバイスが作用する壁区域の変位のモニタリング及び/又は調節といった、本明細書で説明する任意の手技ステップの遂行は、心エコー画像により支援してよい。こうした画像化は、変位させることを意図した外壁区域の部分に固有の変位を達成するために、輪郭を合致させた圧縮部材を有するようにデバイスを設計する上でも有用である。
【0020】
別の実施形態において、変位は、圧縮部材と強化部分との間の充填可能領域に充填物を充填することにより達成される。充填物は、充填可能領域において硬化する培養組織(例えば、骨又は軟骨形成組織)を含んでよく、これにより、外壁区域に対する圧縮力を維持する。足場構造を利用して、培養組織を最初に受け入れてもよい。装置の一部は、乳頭筋形状を正常化し、尖部の接合を改善できるように、心臓壁区域を移動させるのに必要な変位力を独立して提供する度合いまで培養組織が硬化するのに必要となるものと同程度の期間で生体分解してよい。
【0021】
代替実施形態において、培養組織は、電気的トリガに応答して能動的に収縮及び弛緩する導電性高分子で構成される人工筋肉を含み、これによって、変位の度合いを変化させることにより、外壁区域を周期的に移動させる。
【0022】
デバイスの強化部分は、パッチ又はポーチの外部表面を備えてよく、それぞれ、膨張力又は充填力の結果としての心臓から離れる方向への拡張を制限するのに十分な剛性を有する公知の生体適合性材料で形成される。
【0023】
本発明は、更に、乳頭筋に近接する心臓の筋肉壁領域に材料を送給することで心臓の房室弁の逆流を低減する装置及び方法を提供する。材料は、前記筋肉壁領域の一部を心室腔の中心線へ向けて内側へ変位させ、これにより、乳頭筋形状を正常化し、尖部の接合を改善する。適切な材料は、送給後に形状を実質的に維持するヒドロゲル又はニッケルチタン合金(例えば、NitinolTM)を含む。材料は、例えば、バルーン又は線維芽細胞を含む細胞マトリクスといった、筋肉壁内に移植する構造内でカプセル化してよい。
【0024】
一実施形態において、材料は、筋肉壁領域に注入され、筋肉壁領域は、例えば、冠状静脈洞と心臓の僧帽弁輪部との間の組織平面にしてよい。代替として、この領域は、心臓の基部内の位置にしてよい。
【0025】
当業者は、AVRを制限するために乳頭筋を再配置する上記のデバイス及び方法を、他の心臓領域における心臓リモデリングの逆転において、更に一般的に応用してよいことを容易に理解し得よう。
【0026】
本発明の利点は、添付図面と併せて読むべき本発明の例示的な実施形態の以下の詳細な説明において明らかになろう。
【図面の簡単な説明】
【0027】
【図1】図1は虚血性僧帽弁逆流で発生する異常僧帽弁形状を示す心臓の断面図である。
【図2】図2は外部ポーチが取り付けられた心臓の断面図である。
【図3】図3は本発明のポーチまたはパッチ装置の1実施例を示す。
【図4】図4は本発明の1実施例による可膨張バルーン装置を示す。
【図5A】図5Aは本発明装置の1実施例と心臓外壁との境界面の断面図である。
【図5B】図Bは本発明装置の1実施例と心臓外壁との境界面の断面図である。
【図6A】図6Aは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6B】図6Bは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6C】図6Cは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6D】図6Dは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6E】図6Eは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図7A】図7Aは装置が僧帽輪部の拡張に対して追加的に対処するために取り付けられた心臓の断面図である。
【図7B】図7Bは装置が僧帽輪部の拡張に対して追加的に対処するために取り付けられた心臓の断面図である。
【図8A】図8Aは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図8B】図8Bは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図8C】図8Cは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図8D】図8Dは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図9A】図9Aは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図9B】図9Bは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図9C】図9Cは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図9D】図9Dは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図10A】図10Aは内部補強材が搬入されている壁部を有した心臓の断面図である。
【図10B】図10Bは内部補強材が搬入されている壁部を有した心臓の断面図である。
【図11】図11は高分子材料及び/又は冠状動脈洞を経由したカプセル構造の経皮的搬入を示す超音波画像を介した心臓を示す。
【図12】図12はカテーテル装置を介した高分子材料及び/又はカプセル構造搬入の部位に隣接する心臓領域の分解図である。
【図13】図13は冠状動脈洞と管状動脈輪に隣接した注入受領組織領域を示す。
【図14】図14は冠状動脈洞と心臓底部に隣接した注入受領組織領域を示す。
【図15】図15はカプセル内に生体適合材料を注入するのに利用されるカテーテル装置を示す。
【発明を実施するための形態】
【0028】
次に、本発明の好適な実施形態について、図面のいくつかの図を参照して説明する。
【0029】
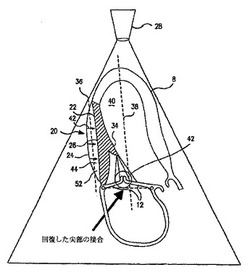
図2に例示する一実施形態において、本発明は、左心室8の心外膜の外壁区域22に固定されたデバイス20を提供する。デバイス20は、拡張PTFE又はDacronTM等のポリエステルによって、或いは下で説明するような十分な強化特性を呈する場合に、別の公知の生体適合性材料によって作られた、ポーチ24又はパッチ(図示なし)を含む。デバイス20は、外壁区域22と接触する圧縮部材26(例えば表面)を含む。圧縮部材は、ポーチ24の表面を含んでもよい。代替として、パッチの構成において、圧縮部材は、可膨張バルーンの外部表面となってもよい。下で説明する本発明の様々な実施形態において、圧縮部材26は、心筋組織を変形又は移動させる役割を果たす、不連続面と培養細胞材料及び/又は導電性高分子によって定められる表面とを含め、任意の表面を含む。表面は、追加として、接触するべき壁区域に対応するように輪郭を合致させてよい。移植の前に、心臓壁は、心エコー検査において超音波振動子28を使用して画像化してよく、輪郭合致面は、その後、例えばステレオリソグラフ製造法によって、予備成形してよい。
【0030】
デバイス20は、縫合、ステープル、歯付き固定具、又はその他といった公知の手段を介して外壁区域22に固定される。
【0031】
図3は、左心室8の外面に横たわり、縫合30により固定された楕円形の物体として、デバイス20を表している。パッチ又はポーチは、縫合の配置を容易にするために、延長縁部32又はリングを有してもよい。パッチ又はポーチは、心臓を取り囲む心膜の最上層の下に固定してもよい。
【0032】
図2に戻ると、AVRを治療するために、デバイス20は、損傷した乳頭筋34の上に位置決めされる。別個の梗塞が存在する場合には、梗塞の領域(超音波によって特定し得る)を覆うことが好ましいが、しかしながら、配置は損傷又は変形組織に限定されない。ポーチ又はパッチ及び圧縮部材の長軸線36は、心室腔40の中心線38と平行に並ぶ。パッチ又はポーチデバイス20の縁部は、表面に露出する任意の冠状血管を含めるのを避けるように注意して、心臓壁に縫着される。冠状血管の閉塞を回避するために行われるアプローチの一つは、半剛体の保護カバーを冠状動脈のうえに置くことである。別のアプローチは、そのエリアでは心臓壁にデバイスを縫合しないことである。冠状動脈自体が提供する抵抗力は、閉塞を防ぐのに十分である。標準の試験によって、心臓壁組織の生存可能性が制限されていると判断された場合には、心筋が生存可能な筋肉である場合に比べ、閉塞の可能性を回避する上での重要性は明らかに低い。
【0033】
デバイスは、更に、圧縮部材26を心室腔40の中心線38に向けて内側(矢印42の方向)に移動させるための変位メカニズムを含む。圧縮部材26の移動は、次に、乳頭筋をより正常な形状へと移動させ、僧帽弁尖部12間の接合42の改善をもたらす。図2の実施形態において、変位メカニズムは、成型バルーンその他の可膨張リザーバ44を備える。
【0034】
図4は、外部Dacron強化層46と、圧縮部材26を備える内層と、変位メカニズムの役割を果たすバルーン48等の可膨張リザーバとを備える、デバイス20の好適な実施形態を例示する。図5A及び5Bは、デバイス20の代替実施形態の断面図を提示する。図5Aにおいて、可膨張バルーン48は、ポーチ24に取り囲まれ、ポーチ24の外部表面は強化層46を備え、内層は圧縮部材26を備える。図5Bでは、可膨張バルーン48自体の表面が圧縮部材26を備え、バルーン48は、強化層46を備える表面を有するパッチ50によって覆われる。
【0035】
再び図4を参照すると、デバイス20を取り付けた後、下で説明するように、バルーン48には膨張流体52又はゲル材料が充填される。強化層46は、バルーン48の膨張が心臓の壁区域を(図2に示したように)心室腔の中心線に向けて内側へ優先的に変位させるように、構造を強化する。こうした結果は、剛体材料(例えば、プラスチック、チタン、ステンレス)の選択、或いは弾性率に応じた広い幅を有する更に柔軟な材料を使用することにより、強化層46が圧縮層26よりも硬くなるように設計することで得られる。これにより、壁区域22及び乳頭筋34は、正常な位置へ向けて再配置されるため、僧帽弁尖部12では、張力が解放され、逆流のない正常に近い状態で一致又は接合できるようになる。有効な弁の密閉を形成するのに十分な、接合した尖部表面が例示されている。位置決めと、固定と、変位のモニタリングとのプロセスは、望ましい修復を形成するのに必要な膨張流体52又はゲルの量を最小化するために、超音波振動子28による画像化によって誘導できる。生理食塩水、血液、又は硬化可能な高分子は、膨張材料のいくつかの選択肢となるが、しかしながら、多数の生体適合性材料が本発明の可膨張性の要件を満たすことは、当業者によって理解されるであろう。
【0036】
再び図4を参照すると、バルーン48は、強化層46から注射器取り付けポート56へ続くものとして例示されたプラスチック管のような、カニューレ又はアクセスポート54を含んでもよい。別の実施形態においては、自己密閉式シリコンゴムポートを利用して、後で引き抜く充填針を貫通させることができる。可膨張リザーバのサイズの長期的な安定性のために、注射器ポート56は、ロックするべきであり、或いは、プラスチック管を熱アニールして閉鎖するべきである。ポートを密閉するその他の方法は、この技術において公知である。更なる実施形態において、カニューレ又はアクセスポート54は、引き延ばして、皮膚の下の胸壁内に移植された滅菌皮下ポートに接続され、これにより、弁の能力を維持する必要に応じて、その後、リザーバ内の膨張材料を調節できる。
【0037】
本発明が更に提供する実施形態(図示なし)において、圧縮部材26を変位させるメカニズムには、移植時、及びおそらくはその後において断続的に、同じく圧縮部材と強化部分との間に配置された充填領域に、固体又はゲル材料を増加的に充填し、AVRの望ましい低減を達成することが含まれる。これは、より粘性の高い材料のための大きなポートを使用して、充填領域に滅菌ゲルを注ぎ込むこと、或いは、拡張PTFE、DacronTM、硬化可能な高分子、若しくは、シリコン又はその他の材料から成型された他の充填物の層を充填領域に詰め込むことで達成し得る。こうした充填物は、圧縮部材と強化部分との間に、或いは、単純に強化部分(例えば、パッチ)と心筋との間に、望ましい逆流の低減が達成されるまで追加してもよい。これは、長期的な維持において特に有効となり得る。
【0038】
上記の本発明の実施形態の利点は、完全に心臓の外部での方法により、乳頭筋の位置の直接的かつ標的を絞った再配置を提供するため、心肺バイパス又は心臓停止の必要がないことである。その他のアプローチとは異なり、本発明は、外科的な選択肢として応用可能だが、心筋の切除を必要とせず、これにより、筋肉層の完全性を維持し得る。本発明によるデバイスは、更に、可膨張リザーバの膨張及び/又は収縮を介して、或いはその他の充填方法を介して、圧縮要素の変位を増加的に変化させることで、乳頭筋再配置の即時的及び/又は断続的な調節を可能にする。
【0039】
図4に例示する実施形態において、本発明は、更に、圧縮部材26の変位、したがって心筋壁の区域22の変位が能動的となる実施形態を提供する。デバイス20は、心室の電気的活動と時間的に同調して拡張及び収縮するように作成され、これにより、損傷した非収縮壁を能動的デバイスに置き換える付加的な利点を提供して、心臓のポンピングを増大させる。
【0040】
能動的変位方法の一つには、心臓表面に配置された、或いは胸腔内の他の場所、若しくは横隔膜又は肋骨表面に固定された電気駆動ポンプ60に、プラスチック管58を介して、可膨張リザーバ(例えば、バルーン48)を接続することが伴う。最も単純な形態では、電気機械モータ62によりピストン64を駆動して、膨張流体52を供給リザーバ66からバルーン48内へポンピングし、心臓が弛緩した際に流体を抜き出す。膨張流体は、効率的なポンプの動作のために、好ましくは相対的に非粘性である。ポンプ60は、デバイス20に隣接する心臓壁72に歯付きアタッチメント70で固定されたワイヤ68によって記録され、ポンプの始動のために増幅された電気信号によりトリガされる。代替として、ポンプ60は、心臓電気信号を感知して、ポンプに増幅信号を出力する標準の経静脈心臓ペースメーカによってトリガできる。ポンプの動作のための電気エネルギは、皮膚を介した高周波送電を使用して非侵襲的に再充電される皮下電池に格納できる。ポンプ60を膨張リザーバに接続する管58は、静的(非拡張)実施形態においてバルーンを充填するのに使用された小さなアクセスポート54より大きな内径を有し、したがって、抵抗の少ないものとなる。
【0041】
図6Aを参照すると、能動的変位は、代替として、パッチ又はポーチ24に加えて、或いはパッチ又はポーチ24の代わりに、遺伝工学的置換筋肉又は人工筋肉(心筋細胞)の細片74を使用して達成してもよい。梗塞が乳頭筋に関与して、これを変位させる場合、こうした人工筋肉を含む外部パッチは、梗塞のある壁を再成形し、AVRを軽減すると共に、収縮及び弛緩を高めて、全体的な心臓機能を改善する利点を提供する。
【0042】
こうした人工筋肉は、例えば、梗塞のある領域上で、心臓周期と時間的に同調して、電気的に収縮をトリガされるピロール単位を反復する導電性高分子(ポリピロール又はポリチオフェン等)によって作成される。図6B乃至図6Eは、架橋及び並列高分子構造を備えるいくつかの人工筋肉の実施形態を例示している。導電性高分子細片は、電流が通過する際にサイズ及び形状を変化させることが可能であり、そのため、拡張及び収縮し、力を生成する能力を有する。最近の進歩は、40メガニュートン/平方メートル(心筋の250倍を上回る)の張力を達成可能な膨張するピロールに基づく高分子と、長さを23%(心筋繊維の歪みに相当)まで変化させるアコーディオン状のチオフェンに基づく高分子とをもたらしている。こうした人工筋肉の更なる説明については、参照により本明細書に組み込む、Madden JD, Cush RA, Kanigan TS, Hunter IW、高速収縮ポリピロールアクチュエータ、Synthetic Metals 2000; 113:185-92と、Madden JD, Madden PG, Hunter IW、ポリピロールアクチュエータの特徴付け:モデリング及び性能、SPIE第八回スマート構造及び材料:電気活性高分子活性体及びデバイスの年次シンポジウム議事録、Yoseph Bar-Cohen編、SPIE Press 2001と、Madden J、導電性高分子アクチュエータ、2000年度マサチューセッツ工科大学博士論文と、Marsella MJ, Reid RJ、分子筋肉に向けて:電気伝導性ポリ{シクロオクタテトラチオフェン}、Macromolecules 1999;32:5982-84と、Ding J, Price WE, Ralph SF, Wallace GG、多価電解質ドーパントを含有する機械的に強固なポリ(ビチオフェン)複合高分子の合成及び特性、Synthetic metals 2000;110(2):123-132と、Baugman RH、導電性高分子人工筋肉、Synthetic metals 1996;78:339-353とを参照されたい。
【0043】
図7A及び7Bを参照すると、超音波画像によって、図7Aに示すように僧帽弁輪部76が大幅に拡大している時期を認識するのを支援できる。この例において、弁の輪部76へ向かうデバイス20(ポーチとして図示)の圧縮部材26の拡張は、輪部のサイズも低減できる。左心室8と左心房16との間の心臓の溝80にある冠状血管(冠状静脈洞78)に、直接的に圧力が加わるのを回避するように注意する必要がある。こうした心臓の基部に向かう圧縮力の延長は、僧帽弁尖部12に強制される繋留の両端部(輪部及び心室)を修正する外部弁輪形成又は輪部サイズ低減を効果的に提供する。代替として、デバイス20の使用は、最近開発された他の経皮的輪部サイズ低減のためのアプローチと組み合わせることができる。ポーチの追加は、こうした他のデバイスの有効性を強化することが期待できる。図7Bは、僧帽弁輪拡大の低減に成功した様子を例示している。
【0044】
図8A及び8Bを参照すると、本発明は、更に、心臓リモデリングを逆転するアプローチを提供する。この実施形態により、局所的心臓障害及び個別の乳頭筋(34’、34’’の二箇所)の変位を有する患者だけでなく、冠動脈疾患又は筋肉細胞の内因性疾患(心不全を引き起こす心筋症)によって発生する左心室の大域的拡大及び機能障害を有する患者にも、応用が可能となる。図8Aに図示したように、こうした状況において、心臓2は、正常な弾丸型よりも球形に近くなり、両方の乳頭筋34’、34’’を心室腔82の中心から離れる方向へ変位させ、僧帽弁尖部84を伸張させ、閉鎖を不可能にし、逆流を生じさせる(なお、図示したものは、二つの乳頭筋34’、34’’を通った側部間の超音波図である)。この実施形態において、デバイス20(例えば、ポーチ)は、両方の乳頭筋上に置かれ、これらの筋肉を心室腔82及び僧帽弁輪部86に近付けて再配置するために膨張させ、これにより、(図8Bに反映されているように)尖部84の張力を軽減し、逆流を低減する。この実施形態の外観図は、解剖学的な配向性で(心尖を下にして)図8Cに例示されており、二つの乳頭筋の両方を変位させるために、二つの別個のポーチデバイス20が心臓2の後面に存在する。
【0045】
図8Dは、バルーン88として図示した二つの圧縮面が取り付けられ、これらの圧縮面をパッチ又はポーチ24として図示した強化層によって強化した、デバイス20の実施形態を例示している。パッチ又はポーチ24は、その縁部に沿って、更にはバルーン88を囲むポイント90において、心臓2に縫合される。こうした囲い込み縫合点90は、乳頭筋に対する望ましい効果を有するように、バルーンの側部方向への拡張を制限する。こうした大域的機能障害のための実施形態は、上記の任意の治療方法(即ち、能動的変位、輪部への圧縮の延長、その他)を単独で或いは組み合わせて利用するために修正してもよい。
【0046】
本明細書で説明した任意のデバイスの実施形態は、胸腔鏡検査又はロボット手術を使用する低侵襲的な方法で利用し得る。こうしたプロセスでは、細長い又は管状の内視及び操作デバイスを、胸壁の一つ以上の小さな開口部から胸腔に挿入する。例示的なデバイスは、ビデオ内視鏡装置と、心膜切開用の器具と、デバイスを心臓の外部表面に固定するための器具とを含む。こうした実施形態において、デバイス自体は、こうした導入ができるように可逆的に折り畳み可能又は巻き付け可能であり、形状記憶材料を備えた取り付けリング等、この技術で認知されている様々なメカニズムを使用して、自己拡張式にしてもよい。こうした自己拡張式の技術は、当業者に公知である。ポーチ又はパッチデバイスの形状、サイズ、及び材料における変化を伴うデバイスの多数の付加的な実施形態は、前記当業者に容易に理解されるであろう。例えば、長方形のデバイスを使用してよく、超音波又は磁気共鳴画像によって表示された心筋の損傷又は膨張部分のサイズに合わせて、医師は様々なサイズを利用及び選択可能である。
【0047】
図9A乃至9Dを参照すると、別の実施形態において、本発明は、超弾性ニッケルチタン合金(NitinolTM、www.nitinol.com)等の形状記憶材料で作られた、バネ又は輪のような構造を提供し、乳頭筋変位又は変形を維持し、心臓リモデリングを逆転するのに使用し得る。図9A及び9Bは、こうした変形デバイス92の二種類のバージョンを例示している。デバイス92は、乳頭筋を再配置し、僧帽弁尖部の接合を正常化できるように、心臓の外部表面に付加される予備成形済み又は調節可能な構造を備える。デバイス92は、心臓表面上に位置する取り付けリング94と、網目構造又は放射状スポークのような連続面又は断続面として、取り付けリングのレベルより下に延びる要素又は構造とを備えてよい。リング94を外部心臓表面22に付加することで、突出要素は乳頭筋を変位させ、(上記のように)心室腔の中心線へ方向付ける。デバイスは、僧帽弁尖部に影響する繋留を低減するために、乳頭筋34を心臓の基部(僧帽弁輪部18)へ方向付けるように成形してもよい。こうした湾入又は再配置デバイスは、ニッケルチタン合金のような固定又は形状記憶材料を備えてよい。様々な再配置の度合いを提供するために、様々なサイズ及び形状のデバイスを利用してよく、再配置の度合いは、デバイス又は外科医の指を置いて、心臓壁に圧力を加える際に、心エコー画像を介して推定できる。
【0048】
図10A及び10Bを参照すると、本発明は、更に、強化部の役割を果たす内部硬化材94を筋肉壁96内に送給することを伴うAVR低減方法及び装置を提供する。損傷した心臓壁は、通常、収縮筋細胞の喪失のため薄くなり、心室腔9内の圧力の影響を受けて外側へ膨らむ。この実施形態において、生物学的に適合する材料を含む内部硬化材94は、露出させた細部心臓壁を介して、或いは、大動脈弁を通過するカテーテル100によって、損傷した心臓壁96の領域内へ(例えば、注射器98による注入又は移植により)送給され、損傷した壁の位置を特定する電気的検知又は超音波画像化によって誘導される。図10Bは、影響された壁96を厚くし、変形が低減されるように材料の特性を変化させる、結果として生じた内部硬化材94又は強化部を示す。この結果、僧帽弁尖部12の繋留及び逆流が平行して低減される。この実施形態は、一方の乳頭筋が関与する局所的な損傷と、両方の筋肉に影響する大域的障害との両方に応用できる。注入する材料は、一部として、コラーゲンマトリクス又は筋芽細胞(患者自身の骨格筋等から取り出した原始筋細胞)を含んでよく、筋芽細胞は、血液の供給が制限される心臓壁内でも生存し続けることが明らかになっており、更に収縮能力を発現し得る。
【0049】
こうした硬化材は、心臓壁内部のポーチ104又は細胞足場のような構造内に送給してよい。初期構造は、構造が分解する前に、硬化材料に硬化する時間を与えるような形で、生体分解性にしてよい。
【0050】
また、当業者は、上記の手法及びデバイスが心室リモデリングの現象を制限し、或いは更に逆転させるという付加的な利点を有することを理解するであろう。リモデリングは、損傷壁及び非損傷壁(例えば、十分な血液の供給を有する壁及び有していない壁)の両方に影響を与える損傷した心臓の累進的な拡張であり、当初は損傷を受けなかった壁の収縮の減退を伴う。僧帽弁逆流は、こうしたリモデリングを招く強い刺激を提供するため、本発明のデバイスを使用して、こうした逆流を低減することで、リモデリングを制限することもできる。更に、Kelley STら(Circulation 1999;99:135-42)は、乳頭筋の近くに位置していない(したがって、逆流を発生させない)損傷壁の拡張を制限することにも、リモデリングを制限し、心臓全体の収縮機能を維持するという付加的利益があることを明らかにしている。したがって、本発明は、こうした付加的利益を提供する。
【0051】
図4のデバイスの実施形態による、急性又は慢性の虚血性僧帽弁逆流を有する十頭の動物における本発明者の経験では、全ての事例において、左心室のポンプ又は充填機能又は圧力に悪影響を与えることなく、逆流を反転及び除去できた。下壁梗塞と共に回旋枝の結紮により発生させた虚血性MRを有する十頭のヒツジを、六頭は急性状態で、四頭はMI後八週間で研究した。可膨張バルーンを収容したDacronTMポーチを、乳頭筋上に置き、エコーの誘導により調節し、左心室リモデリングを逆転する目的で、梗塞乳頭筋を僧帽弁前輪部に向けて再配置し、これにより尖部の繋留と僧帽弁逆流とを低減した。3Dエコーにより評価した僧帽弁形状は、乳頭筋から前輪部までの繋留距離を含め変化した。七頭のヒツジにおいては、ソノミクロメータ及び左心室Millarカテーテルを設置して、収縮末期及び収縮終期圧力容積関係(ESPVR及びEDPVR)の変化を評価し、ミクロスフェアを注射して、冠血流を評価した。十頭のヒツジ全てにおいて、中程度のMI後MRが、梗塞PMを正常方向へ再配置するポーチの利用のみ(n=3)又はエコー誘導バルーン膨張により消滅し、乳頭筋の繋留距離は、MI後の31.1±2.5mmから、ポーチ有りでは26.8±1.8mm(p<0.01 基準線=25.5±1.5mm)に減少し、左心室収縮性は変化しなかった(ESPVR勾配(ポーチ有り3.4±1.6mmに対してMI後2.8±1.6mm)。左心室の弾性定数は高くなる傾向にあったが(0.07±0.05ml-1に対してMI後0.05±0.03ml-1)、LVDEPは、僧帽弁逆流が消滅した際に変化しなかった。非梗塞領域への冠血流は、大きく低減されなかった。
【0052】
慢性の虚血清掃帽弁逆流を有する追加の五頭の動物では、僧帽弁逆流の低減に成功後、六乃至八週間に渡って再発性の漏出がないことが観察された。
【0053】
図11に示す別の実施形態において、本発明は、冠状静脈洞116と輪部との間の組織面114に(例えば、カテーテルシステム110により針を介して)注入するか、或いは針112を介してその他の形で挿入し、輪部の前方変位を生じさせる、注入可能な空間占拠材料108を使用して、輪部(破線及び18)を(矢印106によって示す方向に)前方変位させる装置及び手法を提供する。冠状静脈洞116は、心筋の最大の血管であり、僧帽弁輪に直接隣接して位置しており、経皮的カテーテルシステム110により容易にアクセスできるため、僧帽弁輪に影響を与え、或いは変位させるデバイスの配置に最適である。冠状静脈洞を介したデバイスの配置に特有の利点は、冠状静脈洞への経皮的アクセスの容易さであり、経皮的アクセスには、末梢脚部又は腕部静脈を介して、カテーテルを心臓の右側に進めることが伴う。これにより、デバイスが材料である場合、送給のための開胸手技は必要が無くなる。
【0054】
図12は、注入部位(群)に近接する心臓の領域の分解図である。注射針の直角の配向性118、120は、望ましい変位をもたらすために、必要なあらゆる場所へ材料108を注入する能力を示している。これは、輪部と冠状静脈洞との間の組織面、或いは更に下方の心臓基部へ方向付けることができる。生体適合性材料は、好ましくは、高分子ゲル又は同様の材料を含む。
【0055】
図11に図示したように、結果として生じる僧帽弁輪(破線及び18)の前方への変位は、全体的な僧帽弁輪面積を低減し、僧帽弁尖の接合を回復する。材料108の特徴には、変形の柔軟性が含まれ、材料の物理的特性は、収縮する心筋において通常発生する力に耐え、当初の形状及び体積を維持するように選択される。材料108は、好ましくは、当初は液体の形態であり、体温によって固まるため、Transvascular,Inc(カリフォルニア州メンロパーク)又はBioCardia,Inc(カリフォルニア州サウスサンフランシスコ)等の市販の経皮的カテーテルシステムを介して注入可能である。アルギン酸高分子等のヒドロゲルは、こうした材料の一例となる。こうした高分子は、生体適合性及び生体分解性であり、室温では液体の形態として、体温で凝固させることができる(こうした高分子の詳細については、参照により本明細書に組み込む、Vacanti JP, Langer R、組織工学:外科的復元及び移植のための生体交換デバイスの設計及び作成、Lancet, 1999 Jul;354 Suppl 1:SI32-4と、Marler JJ, Guba A, Rowley J, Koka R, Mooney D, Upton J, Vacanti JP、注入可能アルギン酸及び同系線維芽細胞による軟組織の増加、Plastic Reconstructive Surgery 2000; May;105(6):2049-58とを参照)。加えて、ヒドロゲルの堅固さは、心臓において存在する通常の負荷力に耐えるのに必要な度合いまで調節可能である。
【0056】
図13を参照すると、注射針122を有するカテーテル120が冠状静脈洞124に入っており、冠状静脈洞124と僧帽弁輪128との間の組織面内への生体材料108の一定量の注入132が、針122を介して、僧帽弁輪の長さに沿って、必要に応じて行われる。注入により、僧帽弁前尖34’’へ向かう僧帽弁後尖34’の前方又は内側への変位が生じ、適切な僧帽弁尖の接合(僧帽弁口130の閉鎖)が回復する。
【0057】
図14に例示した別の実施形態において、材料108は、注入材料の体積及び形状を維持する役割を果たす、高分子バルーン、又は線維芽細胞で構成された細胞マトリクスといった、カプセル化構造134又はシェル内に注入される。バルーン材料は、移植可能な可膨張バルーンを包含する人工尿道括約筋において使用されるもの、或いは形成外科において使用されるバルーンエキスパンダと同様にすることができる(こうした材料の詳細な説明については、参照により本明細書に組み込む、Wilson TS, Lemack GE, Zimmern PE、女性における固有括約筋欠損の管理、J Urol. 2003 May;169(5):1662-9と、Gonzalez R, Schimke CM、脊髄髄膜瘤における泌尿器学的再構築の戦略、Curr Opin Urol. 2002 Nov;12(6):485-90と、Kabaker SS, Kridel RW, Krugman ME, Swenson RW、脱毛症の治療における組織拡張、Arch. Otolaryngol Head Neck Surg. 1986 Jul;112(7):720-5と、Radovan C、軟組織の再構築における組織拡張、Plast Reconstr Surg 1984 Oct;74(4):482-92とを参照)。別の実施形態において、生体材料は、注入材料の体積及び形状の維持を可能にする線維芽細胞シェル内に注入できる。
【0058】
図15を参照すると、材料108は、冠状静脈洞124内のカテーテル136を介して、(図12の針の配向性118によって示したように)下方の心臓基部に、僧帽弁輪18の長さに沿って注入可能であり、結果として、僧帽弁尖12の適切な変位が生じる。心臓基部への注入は、輪部のレベルでの注入の補助として、或いは、輪部を変位させる独立した方法としての役割を果たす。
【0059】
別の実施形態において、材料108は、初期足場網と共に、組織工学材料で構成される。組織工学材料は、僧帽弁輪の変位をもたらすのに適切な物理的特性に適合させること、或いはカスタマイズすることが可能である。具体的には、組織工学材料は、患者自身の幹細胞で構成され、望ましい領域において軟骨性構造を発生させる軟骨細胞への転換をプログラムされる(参照により本明細書に組み込む、Yoshino H, Shin YM, Terai H, Vacanti JP、エレクトロスピニングによる生体分解性ナノファイバ足場及び骨組織工学での可能性、 Biomaterials. 2003 May;24(12):2077-82と、Abukawa H, Terai H, Hannouche D, Vacanti JP, Kaban LB, Troulis MJ、組織工学によるin vitroでの下顎顆頭の形成、J Oral Maxillofac Surg. 2003 Jan;61(1):94-100と、Fuchs JR, Terada S, Hannouche D, Ochoa ER, Vacanti JP, Fauza DO、工学的胎児軟骨:in vitroでの構造及び機能分析、J Pediatr Surg. 2002 Dec; 37(12):1720-5と、Young CS, Terada S, Vacanti JP, Honda M, Bartlett JD, Yelick PC、生体分解性高分子足場上の複雑な歯の構造の組織工学、J Dent Res. 2002 Oct;81(10):695-700とを参照)。軟骨性材料は、輪部の前方変位を発生させる望ましい物理的な堅固さと、心臓に存在する力に耐える能力とを有する。軟骨性構造は、必然的に、僧帽弁輪の前方部分に存在する。その他の組織工学材料は、輪部の変位を発生させる輪部又は心臓基部への筋肉の注入で構成できる(参照により本明細書に組み込む、Saxene AK, Willital GH, Vacanti JP、血管新生化三次元骨格筋組織工学、Biomed Mater Eng. 2001;11(4):275-81と、Saxena AK, Marler J, Benvenuto M, Willital GH, Vacanti JP、合成生体分解性高分子上での分離筋芽細胞を使用した細胞骨格筋組織工学:予備研究、Tissue Eng. 1999 Dec;5(6):525-32とを参照)。筋肉の付加的な利点は、心臓機能を増大させるために心臓周期に合わせた動的な収縮を発生させる可能性である。
【0060】
(複数の)注入の適切な局所化は、心エコー検査により支援してよい。追加として、適切な僧帽弁後輪部補正の有効性は、随意的に、リアルタイムの心エコー検査により非侵襲的にモニタリング及び誘導できる。
【0061】
上記の明細書は特定の好適な実施形態に関して説明されており、例示の目的から、多数の詳細が述べられているが、本発明の趣旨及び範囲から逸脱することなく、本発明が様々な修正及び追加的な実施形態の対象となり得ること、及び本明細書の特定の詳細を本発明の基本原理から逸脱することなく大幅に変更し得ることは、当業者には自明であろう。こうした修正及び追加的実施形態も、本発明に付随する特許請求の範囲及び趣旨に含まれるものである。
【技術分野】
【0001】
本発明は、心室リモデリングを逆転させ、弁の機能障害を修正する方法及びデバイスに関し、特に、心室組織に局所的に対処して再配向する方法及びデバイスに関する。いくつかの低侵襲的手法及び調整可能デバイスについて説明する。
【背景技術】
【0002】
虚血性心疾患の患者は、広範な病理変化を体験する。その一部には、心室拡大と、僧帽弁輪の拡大と、乳頭筋の変位及び繋留と、乳頭梗塞と、区域的及び大域的心室機能障害とが含まれる。僧帽弁の機能及び能力は、支持構造の微細な形状及び機能的完全性に依存する。
【0003】
心筋梗塞による拡大又は瘢痕化により左心室が変形すると、乳頭筋が繋留されるため、僧帽弁の十分な閉鎖が妨げられる。左心室は、二つの乳頭筋を有する。両方とも、左心室自由壁を起点とする。前乳頭筋は、左心室の前壁、外側縁の近くに付着する。後乳頭筋は、後壁の心室中隔の接合部近くを起点とする。僧帽弁の閉鎖は、その尖部の並置によって達成される。乳頭筋の繋留は、僧帽弁機能不全と尖部並置の障害とを発生させる重要なメカニズムの一つとなることが明らかになっている。虚血性僧帽弁逆流は、心疾患の患者において、著しい死亡率及び罹患率を占める(修復されない場合、心臓発作後及びバイパス術後の遅発性死亡率を二倍にする)。
【0004】
図1は、心臓2における心室拡大の基本的な問題及び房室弁逆流との関係を例示している(本明細書の本図及び他図に描かれた心臓は超音波映像において観察されたものとして提示されるため、提示した図は通常の解剖学的提示から反転されており、超音波振動子に最も近いことから、心尖4が最上部に表示されることに留意されたい)。心臓の最初のポンプ室である左心室8の損傷した筋肉壁6は、変形し、心室腔9の中心から外側に膨らむ。これにより、腱索14網によって僧帽弁尖部12が固定される乳頭筋10は、変位し、次に、尖部先端部を引っ張り、尖部の適切な一致(即ち、接合)を妨げる。その結果、不適切な閉鎖が生じ、左心房16から僧帽弁輪部18を越えて左心室腔9へと戻る僧帽弁逆流が発生する。こうした逆流は、心不全と、心拍障害と、突然死と、致命的な心臓弁感染症の素因とを引き起こす可能性がある。心室リモデリングによる著しい房室弁逆流が未だ発生していない患者においても、拡大は、心室腔容積を増加させ、心臓のポンピング負荷の比例した増加を招く。
【0005】
虚血性僧帽弁逆流を扱ったこれまでの研究には、以下が含まれる。
【0006】
(a)Czerらは、血管再生(冠動脈バイパスグラフト)のみでは僧帽弁逆流が改善しないことを記録している。冠動脈バイパス術を受けた2000人の患者の研究では、未矯正の僧帽弁逆流により、後発性死亡のリスクが倍加した。
【0007】
(b)僧帽弁形成術は、虚血性僧帽逆流の原因として、輪部の拡大のメカニズムに対処する。僧帽弁輪形成術には、僧帽弁輪部の周りに人工僧帽弁輪を縫着し、輪部のサイズを低減して、僧帽弁尖部の良好な閉鎖を矯正することが伴う。しかしながら、臨床的観察では、心臓の不適切な形状が矯正されないことから、これによってMRの度合いが常に低減されるとは限らないことを示唆された。加えて、弁輪形成手法は、付随するリスクの高い侵襲的手技である心臓の切開を含み、患者に心肺バイパスを用いる必要がある(心臓及び肺を迂回する人工ポンプを使用しながら、心臓を停止し、切開して輪を挿入する)。手技の有効性を評価するには、心臓が心肺バイパスから完全に解放された後、僧帽弁機能を検査する必要がある。外科的弁輪形成手技により目的を達成できなかった場合には、心肺バイパスを再び設け、輪の位置を調節する必要がある。反復的な心肺バイパスのサイクルは、以前から高い外科的僧帽弁輪形成術の罹患率及び死亡率を更に増加させる。こうした付随するリスクのため、外科的僧帽弁輪形成術は、この手技を行った際に最大の恩恵を得られる可能性がある病状の最も重い患者には提供されない場合が多い。
【0008】
(c)弁の尖部を外科的に掴み、縫合糸又はその他の締結具により縫合するための外科的手法が主張されてきた。こうした発明には、実施を成功させる能力を制限する、いくつかの難点が存在する。こうした手技の正当な理由となる十分なMRを有する患者において、尖部は、最初から位置がずれており、共に縫合又は締結するために単一のデバイスで尖部先端部を並置状態にする能力を制限又は妨害する。更に、尖部を掴むための提案される吸引デバイスは、効果を高めるために、血液を極めて急速に引き込む必要があり、即座に再輸血しなければ、結果として低血圧が生じる可能性がある。尖部表面を安定化する手段も利用する必要があり、そうでない場合には、尖部の締結を意図した縫合糸又はステープルが、代わりに尖部を変位させ得る。更に、尖部を過度に伸張させた場合には、縫合により尖部の張力が増加するため、縫合が成功しない場合がある。
【0009】
(d)場合によってバルーン又は支柱が付加される心膜クランプ又はハーネスといった、心室のサイズを抑制するその他の心室リモデリング手法及び特許が紹介されている。こうしたデバイスは、大域的心室拡大の状態にある心臓を取り囲むが、特定の区域的病変には対処しない(即ち、対象点の選択性、或いは適応性を提供しない)。その他のデバイスには、心臓を通して挿入され、そのポイントでの心室の直径を低減することを目的とする受動的張筋メカニズムが含まれる。心室を横断する恒久的移植構成材は、同じく、非常に侵襲的な処置である。更に、こうしたアプローチには、正確な標的化と頑丈な固着とが欠如している。むしろ、こうした手法及び/又はデバイスは、変位、張力、及び作用力における特定の領域的変化に対する心室形状の周囲的変化を対象としてきた。正確な標的化と、応力歪み及び変位の相互関係の矯正とは、房室弁の複雑な形状にとって特に重要である。
【発明の概要】
【発明が解決しようとする課題】
【0010】
したがって、必要なものは、心室の支持構造の形状歪みに局所的に対処することで、心室リモデリング及び房室弁逆流を治療する方法及びデバイスである。
【0011】
必要となる場合には弁の修復以外の作業を外科医に頻繁に強いる心肺バイパスなしで、特に、病状がより重篤で、この修復により最も大きな恩恵を受けるが、長期的なバイパスによるリスクが最大となる患者において、こうした手法を実行できれば更に望ましい。
【0012】
更に、心臓の形状に対する損傷は累進的であるため、逆流及び/又はリモデリングは、低減に最初に成功した後で再発する場合が多い。したがって、こうした条件に対処する、経時的に調節可能なアプローチを利用することが望ましい。
【課題を解決するための手段】
【0013】
本発明は、房室弁を支持する構造を一部として含め、心臓の正常な形状を回復する方法及びデバイスを提供する。本明細書で説明する手法及びデバイスは、能動型及び受動型の両方の変位の原理に基づいて動作し、心臓リモデリングを逆転させ、虚血性房室弁逆流を制限する。
【0014】
本発明の好適な実施形態は、心臓切開手術又は心肺バイパスを必要としない低侵襲的方法(例えば、胸腔鏡検査)を含む。これらは、代替療法と併せて、或いは代替療法なしで、実行してよい。心臓の二つ以上の位置を、本発明により同時に処置してよい。
【0015】
本発明により、乳頭筋を再配置することが可能であり、したがって、尖部の張力を軽減し、効果的に閉鎖できるように、正常な房室弁形状を回復することが可能である。なお、本明細書で説明する具体的な実施形態は左心室の僧帽弁逆流に関連するが、本明細書で説明する方法及びデバイスは、心臓右側での弁逆流及び他の心腔の拡大に対処するためにも等しく応用可能であり、「乳頭筋」という用語は、本明細書での使用において、左心室の乳頭筋と同等の機能性を有する任意の結合構造を意味する。更に、心臓の形状に関する「正常化」の使用は、正常な状態へ向かうことと、正常な心臓形状の必ずしも完全ではない回復とを意味する。同様に、下の特定の具体的な実施形態及び説明では、「外壁区域」という用語を使用して、乳頭筋に近接する、或いは基部(即ち、心室及び心房の接合部)へと延びる、心臓の領域を指すが、その他の場合には、このような形でこの用語を制限することは意図されない。
【0016】
手術中の観察では、乳頭筋の外部に加えた力又は圧力により、房室弁逆流(AVR)を除去できることが示唆される。本発明は、乳頭筋の部分に沿った縦の面に配置し、三次元空間において、こうした力を及ぼす(即ち、前記縦の面に垂直であると同時に半径方向へ向かう変位を発生させる)デバイスを提供する。
【0017】
AVRを治療するデバイスは、一般に、乳頭筋形状を正常化し、尖部の接合を改善できるように、心臓の心室腔の中心線へ向かう内側への外壁区域の変位を達成するために、心臓の外壁区域に作用する圧縮部材を含む。好適な実施形態において、デバイスは、心臓壁の取り付け部位への容易な送給のために、可逆的に折り畳み可能又は巻き付け可能である。
【0018】
一実施形態において、変位は、圧縮部材と、心臓から離れる方向への拡張に抵抗するデバイスの強化部分との間に配置された膨張可能なリザーバを調節可能な状態で膨張させ、これにより、圧縮部材を心臓壁区域へ移動させることにより達成される。リザーバは、断続的に(例えば、異なる時点での別個のステップにおいて)、或いは、心臓の電気的活動と時間的に同調するような、より周期的な形で、収縮及び再膨張させてもよい。膨張は、膨張流体又はゲルを供給源からリザーバへポンプで送ることにより達成してよい。こうしたデバイスは、心臓を取り囲む心膜の最上層又はその下への縫合等、任意の従来の手段により、外壁に非外傷的に固定してよい。
【0019】
デバイスの配置の誘導、或いはデバイスが作用する壁区域の変位のモニタリング及び/又は調節といった、本明細書で説明する任意の手技ステップの遂行は、心エコー画像により支援してよい。こうした画像化は、変位させることを意図した外壁区域の部分に固有の変位を達成するために、輪郭を合致させた圧縮部材を有するようにデバイスを設計する上でも有用である。
【0020】
別の実施形態において、変位は、圧縮部材と強化部分との間の充填可能領域に充填物を充填することにより達成される。充填物は、充填可能領域において硬化する培養組織(例えば、骨又は軟骨形成組織)を含んでよく、これにより、外壁区域に対する圧縮力を維持する。足場構造を利用して、培養組織を最初に受け入れてもよい。装置の一部は、乳頭筋形状を正常化し、尖部の接合を改善できるように、心臓壁区域を移動させるのに必要な変位力を独立して提供する度合いまで培養組織が硬化するのに必要となるものと同程度の期間で生体分解してよい。
【0021】
代替実施形態において、培養組織は、電気的トリガに応答して能動的に収縮及び弛緩する導電性高分子で構成される人工筋肉を含み、これによって、変位の度合いを変化させることにより、外壁区域を周期的に移動させる。
【0022】
デバイスの強化部分は、パッチ又はポーチの外部表面を備えてよく、それぞれ、膨張力又は充填力の結果としての心臓から離れる方向への拡張を制限するのに十分な剛性を有する公知の生体適合性材料で形成される。
【0023】
本発明は、更に、乳頭筋に近接する心臓の筋肉壁領域に材料を送給することで心臓の房室弁の逆流を低減する装置及び方法を提供する。材料は、前記筋肉壁領域の一部を心室腔の中心線へ向けて内側へ変位させ、これにより、乳頭筋形状を正常化し、尖部の接合を改善する。適切な材料は、送給後に形状を実質的に維持するヒドロゲル又はニッケルチタン合金(例えば、NitinolTM)を含む。材料は、例えば、バルーン又は線維芽細胞を含む細胞マトリクスといった、筋肉壁内に移植する構造内でカプセル化してよい。
【0024】
一実施形態において、材料は、筋肉壁領域に注入され、筋肉壁領域は、例えば、冠状静脈洞と心臓の僧帽弁輪部との間の組織平面にしてよい。代替として、この領域は、心臓の基部内の位置にしてよい。
【0025】
当業者は、AVRを制限するために乳頭筋を再配置する上記のデバイス及び方法を、他の心臓領域における心臓リモデリングの逆転において、更に一般的に応用してよいことを容易に理解し得よう。
【0026】
本発明の利点は、添付図面と併せて読むべき本発明の例示的な実施形態の以下の詳細な説明において明らかになろう。
【図面の簡単な説明】
【0027】
【図1】図1は虚血性僧帽弁逆流で発生する異常僧帽弁形状を示す心臓の断面図である。
【図2】図2は外部ポーチが取り付けられた心臓の断面図である。
【図3】図3は本発明のポーチまたはパッチ装置の1実施例を示す。
【図4】図4は本発明の1実施例による可膨張バルーン装置を示す。
【図5A】図5Aは本発明装置の1実施例と心臓外壁との境界面の断面図である。
【図5B】図Bは本発明装置の1実施例と心臓外壁との境界面の断面図である。
【図6A】図6Aは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6B】図6Bは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6C】図6Cは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6D】図6Dは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図6E】図6Eは活性移動機構として導電性高分子を採用した本発明の1実施例を示す。
【図7A】図7Aは装置が僧帽輪部の拡張に対して追加的に対処するために取り付けられた心臓の断面図である。
【図7B】図7Bは装置が僧帽輪部の拡張に対して追加的に対処するために取り付けられた心臓の断面図である。
【図8A】図8Aは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図8B】図8Bは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図8C】図8Cは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図8D】図8Dは複数の膨張させるデバイスが取り付けられた心臓の断面図と外観図である。
【図9A】図9Aは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図9B】図9Bは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図9C】図9Cは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図9D】図9Dは変形デバイスと、変形デバイスが取り付けられた心臓の断面図である。
【図10A】図10Aは内部補強材が搬入されている壁部を有した心臓の断面図である。
【図10B】図10Bは内部補強材が搬入されている壁部を有した心臓の断面図である。
【図11】図11は高分子材料及び/又は冠状動脈洞を経由したカプセル構造の経皮的搬入を示す超音波画像を介した心臓を示す。
【図12】図12はカテーテル装置を介した高分子材料及び/又はカプセル構造搬入の部位に隣接する心臓領域の分解図である。
【図13】図13は冠状動脈洞と管状動脈輪に隣接した注入受領組織領域を示す。
【図14】図14は冠状動脈洞と心臓底部に隣接した注入受領組織領域を示す。
【図15】図15はカプセル内に生体適合材料を注入するのに利用されるカテーテル装置を示す。
【発明を実施するための形態】
【0028】
次に、本発明の好適な実施形態について、図面のいくつかの図を参照して説明する。
【0029】
図2に例示する一実施形態において、本発明は、左心室8の心外膜の外壁区域22に固定されたデバイス20を提供する。デバイス20は、拡張PTFE又はDacronTM等のポリエステルによって、或いは下で説明するような十分な強化特性を呈する場合に、別の公知の生体適合性材料によって作られた、ポーチ24又はパッチ(図示なし)を含む。デバイス20は、外壁区域22と接触する圧縮部材26(例えば表面)を含む。圧縮部材は、ポーチ24の表面を含んでもよい。代替として、パッチの構成において、圧縮部材は、可膨張バルーンの外部表面となってもよい。下で説明する本発明の様々な実施形態において、圧縮部材26は、心筋組織を変形又は移動させる役割を果たす、不連続面と培養細胞材料及び/又は導電性高分子によって定められる表面とを含め、任意の表面を含む。表面は、追加として、接触するべき壁区域に対応するように輪郭を合致させてよい。移植の前に、心臓壁は、心エコー検査において超音波振動子28を使用して画像化してよく、輪郭合致面は、その後、例えばステレオリソグラフ製造法によって、予備成形してよい。
【0030】
デバイス20は、縫合、ステープル、歯付き固定具、又はその他といった公知の手段を介して外壁区域22に固定される。
【0031】
図3は、左心室8の外面に横たわり、縫合30により固定された楕円形の物体として、デバイス20を表している。パッチ又はポーチは、縫合の配置を容易にするために、延長縁部32又はリングを有してもよい。パッチ又はポーチは、心臓を取り囲む心膜の最上層の下に固定してもよい。
【0032】
図2に戻ると、AVRを治療するために、デバイス20は、損傷した乳頭筋34の上に位置決めされる。別個の梗塞が存在する場合には、梗塞の領域(超音波によって特定し得る)を覆うことが好ましいが、しかしながら、配置は損傷又は変形組織に限定されない。ポーチ又はパッチ及び圧縮部材の長軸線36は、心室腔40の中心線38と平行に並ぶ。パッチ又はポーチデバイス20の縁部は、表面に露出する任意の冠状血管を含めるのを避けるように注意して、心臓壁に縫着される。冠状血管の閉塞を回避するために行われるアプローチの一つは、半剛体の保護カバーを冠状動脈のうえに置くことである。別のアプローチは、そのエリアでは心臓壁にデバイスを縫合しないことである。冠状動脈自体が提供する抵抗力は、閉塞を防ぐのに十分である。標準の試験によって、心臓壁組織の生存可能性が制限されていると判断された場合には、心筋が生存可能な筋肉である場合に比べ、閉塞の可能性を回避する上での重要性は明らかに低い。
【0033】
デバイスは、更に、圧縮部材26を心室腔40の中心線38に向けて内側(矢印42の方向)に移動させるための変位メカニズムを含む。圧縮部材26の移動は、次に、乳頭筋をより正常な形状へと移動させ、僧帽弁尖部12間の接合42の改善をもたらす。図2の実施形態において、変位メカニズムは、成型バルーンその他の可膨張リザーバ44を備える。
【0034】
図4は、外部Dacron強化層46と、圧縮部材26を備える内層と、変位メカニズムの役割を果たすバルーン48等の可膨張リザーバとを備える、デバイス20の好適な実施形態を例示する。図5A及び5Bは、デバイス20の代替実施形態の断面図を提示する。図5Aにおいて、可膨張バルーン48は、ポーチ24に取り囲まれ、ポーチ24の外部表面は強化層46を備え、内層は圧縮部材26を備える。図5Bでは、可膨張バルーン48自体の表面が圧縮部材26を備え、バルーン48は、強化層46を備える表面を有するパッチ50によって覆われる。
【0035】
再び図4を参照すると、デバイス20を取り付けた後、下で説明するように、バルーン48には膨張流体52又はゲル材料が充填される。強化層46は、バルーン48の膨張が心臓の壁区域を(図2に示したように)心室腔の中心線に向けて内側へ優先的に変位させるように、構造を強化する。こうした結果は、剛体材料(例えば、プラスチック、チタン、ステンレス)の選択、或いは弾性率に応じた広い幅を有する更に柔軟な材料を使用することにより、強化層46が圧縮層26よりも硬くなるように設計することで得られる。これにより、壁区域22及び乳頭筋34は、正常な位置へ向けて再配置されるため、僧帽弁尖部12では、張力が解放され、逆流のない正常に近い状態で一致又は接合できるようになる。有効な弁の密閉を形成するのに十分な、接合した尖部表面が例示されている。位置決めと、固定と、変位のモニタリングとのプロセスは、望ましい修復を形成するのに必要な膨張流体52又はゲルの量を最小化するために、超音波振動子28による画像化によって誘導できる。生理食塩水、血液、又は硬化可能な高分子は、膨張材料のいくつかの選択肢となるが、しかしながら、多数の生体適合性材料が本発明の可膨張性の要件を満たすことは、当業者によって理解されるであろう。
【0036】
再び図4を参照すると、バルーン48は、強化層46から注射器取り付けポート56へ続くものとして例示されたプラスチック管のような、カニューレ又はアクセスポート54を含んでもよい。別の実施形態においては、自己密閉式シリコンゴムポートを利用して、後で引き抜く充填針を貫通させることができる。可膨張リザーバのサイズの長期的な安定性のために、注射器ポート56は、ロックするべきであり、或いは、プラスチック管を熱アニールして閉鎖するべきである。ポートを密閉するその他の方法は、この技術において公知である。更なる実施形態において、カニューレ又はアクセスポート54は、引き延ばして、皮膚の下の胸壁内に移植された滅菌皮下ポートに接続され、これにより、弁の能力を維持する必要に応じて、その後、リザーバ内の膨張材料を調節できる。
【0037】
本発明が更に提供する実施形態(図示なし)において、圧縮部材26を変位させるメカニズムには、移植時、及びおそらくはその後において断続的に、同じく圧縮部材と強化部分との間に配置された充填領域に、固体又はゲル材料を増加的に充填し、AVRの望ましい低減を達成することが含まれる。これは、より粘性の高い材料のための大きなポートを使用して、充填領域に滅菌ゲルを注ぎ込むこと、或いは、拡張PTFE、DacronTM、硬化可能な高分子、若しくは、シリコン又はその他の材料から成型された他の充填物の層を充填領域に詰め込むことで達成し得る。こうした充填物は、圧縮部材と強化部分との間に、或いは、単純に強化部分(例えば、パッチ)と心筋との間に、望ましい逆流の低減が達成されるまで追加してもよい。これは、長期的な維持において特に有効となり得る。
【0038】
上記の本発明の実施形態の利点は、完全に心臓の外部での方法により、乳頭筋の位置の直接的かつ標的を絞った再配置を提供するため、心肺バイパス又は心臓停止の必要がないことである。その他のアプローチとは異なり、本発明は、外科的な選択肢として応用可能だが、心筋の切除を必要とせず、これにより、筋肉層の完全性を維持し得る。本発明によるデバイスは、更に、可膨張リザーバの膨張及び/又は収縮を介して、或いはその他の充填方法を介して、圧縮要素の変位を増加的に変化させることで、乳頭筋再配置の即時的及び/又は断続的な調節を可能にする。
【0039】
図4に例示する実施形態において、本発明は、更に、圧縮部材26の変位、したがって心筋壁の区域22の変位が能動的となる実施形態を提供する。デバイス20は、心室の電気的活動と時間的に同調して拡張及び収縮するように作成され、これにより、損傷した非収縮壁を能動的デバイスに置き換える付加的な利点を提供して、心臓のポンピングを増大させる。
【0040】
能動的変位方法の一つには、心臓表面に配置された、或いは胸腔内の他の場所、若しくは横隔膜又は肋骨表面に固定された電気駆動ポンプ60に、プラスチック管58を介して、可膨張リザーバ(例えば、バルーン48)を接続することが伴う。最も単純な形態では、電気機械モータ62によりピストン64を駆動して、膨張流体52を供給リザーバ66からバルーン48内へポンピングし、心臓が弛緩した際に流体を抜き出す。膨張流体は、効率的なポンプの動作のために、好ましくは相対的に非粘性である。ポンプ60は、デバイス20に隣接する心臓壁72に歯付きアタッチメント70で固定されたワイヤ68によって記録され、ポンプの始動のために増幅された電気信号によりトリガされる。代替として、ポンプ60は、心臓電気信号を感知して、ポンプに増幅信号を出力する標準の経静脈心臓ペースメーカによってトリガできる。ポンプの動作のための電気エネルギは、皮膚を介した高周波送電を使用して非侵襲的に再充電される皮下電池に格納できる。ポンプ60を膨張リザーバに接続する管58は、静的(非拡張)実施形態においてバルーンを充填するのに使用された小さなアクセスポート54より大きな内径を有し、したがって、抵抗の少ないものとなる。
【0041】
図6Aを参照すると、能動的変位は、代替として、パッチ又はポーチ24に加えて、或いはパッチ又はポーチ24の代わりに、遺伝工学的置換筋肉又は人工筋肉(心筋細胞)の細片74を使用して達成してもよい。梗塞が乳頭筋に関与して、これを変位させる場合、こうした人工筋肉を含む外部パッチは、梗塞のある壁を再成形し、AVRを軽減すると共に、収縮及び弛緩を高めて、全体的な心臓機能を改善する利点を提供する。
【0042】
こうした人工筋肉は、例えば、梗塞のある領域上で、心臓周期と時間的に同調して、電気的に収縮をトリガされるピロール単位を反復する導電性高分子(ポリピロール又はポリチオフェン等)によって作成される。図6B乃至図6Eは、架橋及び並列高分子構造を備えるいくつかの人工筋肉の実施形態を例示している。導電性高分子細片は、電流が通過する際にサイズ及び形状を変化させることが可能であり、そのため、拡張及び収縮し、力を生成する能力を有する。最近の進歩は、40メガニュートン/平方メートル(心筋の250倍を上回る)の張力を達成可能な膨張するピロールに基づく高分子と、長さを23%(心筋繊維の歪みに相当)まで変化させるアコーディオン状のチオフェンに基づく高分子とをもたらしている。こうした人工筋肉の更なる説明については、参照により本明細書に組み込む、Madden JD, Cush RA, Kanigan TS, Hunter IW、高速収縮ポリピロールアクチュエータ、Synthetic Metals 2000; 113:185-92と、Madden JD, Madden PG, Hunter IW、ポリピロールアクチュエータの特徴付け:モデリング及び性能、SPIE第八回スマート構造及び材料:電気活性高分子活性体及びデバイスの年次シンポジウム議事録、Yoseph Bar-Cohen編、SPIE Press 2001と、Madden J、導電性高分子アクチュエータ、2000年度マサチューセッツ工科大学博士論文と、Marsella MJ, Reid RJ、分子筋肉に向けて:電気伝導性ポリ{シクロオクタテトラチオフェン}、Macromolecules 1999;32:5982-84と、Ding J, Price WE, Ralph SF, Wallace GG、多価電解質ドーパントを含有する機械的に強固なポリ(ビチオフェン)複合高分子の合成及び特性、Synthetic metals 2000;110(2):123-132と、Baugman RH、導電性高分子人工筋肉、Synthetic metals 1996;78:339-353とを参照されたい。
【0043】
図7A及び7Bを参照すると、超音波画像によって、図7Aに示すように僧帽弁輪部76が大幅に拡大している時期を認識するのを支援できる。この例において、弁の輪部76へ向かうデバイス20(ポーチとして図示)の圧縮部材26の拡張は、輪部のサイズも低減できる。左心室8と左心房16との間の心臓の溝80にある冠状血管(冠状静脈洞78)に、直接的に圧力が加わるのを回避するように注意する必要がある。こうした心臓の基部に向かう圧縮力の延長は、僧帽弁尖部12に強制される繋留の両端部(輪部及び心室)を修正する外部弁輪形成又は輪部サイズ低減を効果的に提供する。代替として、デバイス20の使用は、最近開発された他の経皮的輪部サイズ低減のためのアプローチと組み合わせることができる。ポーチの追加は、こうした他のデバイスの有効性を強化することが期待できる。図7Bは、僧帽弁輪拡大の低減に成功した様子を例示している。
【0044】
図8A及び8Bを参照すると、本発明は、更に、心臓リモデリングを逆転するアプローチを提供する。この実施形態により、局所的心臓障害及び個別の乳頭筋(34’、34’’の二箇所)の変位を有する患者だけでなく、冠動脈疾患又は筋肉細胞の内因性疾患(心不全を引き起こす心筋症)によって発生する左心室の大域的拡大及び機能障害を有する患者にも、応用が可能となる。図8Aに図示したように、こうした状況において、心臓2は、正常な弾丸型よりも球形に近くなり、両方の乳頭筋34’、34’’を心室腔82の中心から離れる方向へ変位させ、僧帽弁尖部84を伸張させ、閉鎖を不可能にし、逆流を生じさせる(なお、図示したものは、二つの乳頭筋34’、34’’を通った側部間の超音波図である)。この実施形態において、デバイス20(例えば、ポーチ)は、両方の乳頭筋上に置かれ、これらの筋肉を心室腔82及び僧帽弁輪部86に近付けて再配置するために膨張させ、これにより、(図8Bに反映されているように)尖部84の張力を軽減し、逆流を低減する。この実施形態の外観図は、解剖学的な配向性で(心尖を下にして)図8Cに例示されており、二つの乳頭筋の両方を変位させるために、二つの別個のポーチデバイス20が心臓2の後面に存在する。
【0045】
図8Dは、バルーン88として図示した二つの圧縮面が取り付けられ、これらの圧縮面をパッチ又はポーチ24として図示した強化層によって強化した、デバイス20の実施形態を例示している。パッチ又はポーチ24は、その縁部に沿って、更にはバルーン88を囲むポイント90において、心臓2に縫合される。こうした囲い込み縫合点90は、乳頭筋に対する望ましい効果を有するように、バルーンの側部方向への拡張を制限する。こうした大域的機能障害のための実施形態は、上記の任意の治療方法(即ち、能動的変位、輪部への圧縮の延長、その他)を単独で或いは組み合わせて利用するために修正してもよい。
【0046】
本明細書で説明した任意のデバイスの実施形態は、胸腔鏡検査又はロボット手術を使用する低侵襲的な方法で利用し得る。こうしたプロセスでは、細長い又は管状の内視及び操作デバイスを、胸壁の一つ以上の小さな開口部から胸腔に挿入する。例示的なデバイスは、ビデオ内視鏡装置と、心膜切開用の器具と、デバイスを心臓の外部表面に固定するための器具とを含む。こうした実施形態において、デバイス自体は、こうした導入ができるように可逆的に折り畳み可能又は巻き付け可能であり、形状記憶材料を備えた取り付けリング等、この技術で認知されている様々なメカニズムを使用して、自己拡張式にしてもよい。こうした自己拡張式の技術は、当業者に公知である。ポーチ又はパッチデバイスの形状、サイズ、及び材料における変化を伴うデバイスの多数の付加的な実施形態は、前記当業者に容易に理解されるであろう。例えば、長方形のデバイスを使用してよく、超音波又は磁気共鳴画像によって表示された心筋の損傷又は膨張部分のサイズに合わせて、医師は様々なサイズを利用及び選択可能である。
【0047】
図9A乃至9Dを参照すると、別の実施形態において、本発明は、超弾性ニッケルチタン合金(NitinolTM、www.nitinol.com)等の形状記憶材料で作られた、バネ又は輪のような構造を提供し、乳頭筋変位又は変形を維持し、心臓リモデリングを逆転するのに使用し得る。図9A及び9Bは、こうした変形デバイス92の二種類のバージョンを例示している。デバイス92は、乳頭筋を再配置し、僧帽弁尖部の接合を正常化できるように、心臓の外部表面に付加される予備成形済み又は調節可能な構造を備える。デバイス92は、心臓表面上に位置する取り付けリング94と、網目構造又は放射状スポークのような連続面又は断続面として、取り付けリングのレベルより下に延びる要素又は構造とを備えてよい。リング94を外部心臓表面22に付加することで、突出要素は乳頭筋を変位させ、(上記のように)心室腔の中心線へ方向付ける。デバイスは、僧帽弁尖部に影響する繋留を低減するために、乳頭筋34を心臓の基部(僧帽弁輪部18)へ方向付けるように成形してもよい。こうした湾入又は再配置デバイスは、ニッケルチタン合金のような固定又は形状記憶材料を備えてよい。様々な再配置の度合いを提供するために、様々なサイズ及び形状のデバイスを利用してよく、再配置の度合いは、デバイス又は外科医の指を置いて、心臓壁に圧力を加える際に、心エコー画像を介して推定できる。
【0048】
図10A及び10Bを参照すると、本発明は、更に、強化部の役割を果たす内部硬化材94を筋肉壁96内に送給することを伴うAVR低減方法及び装置を提供する。損傷した心臓壁は、通常、収縮筋細胞の喪失のため薄くなり、心室腔9内の圧力の影響を受けて外側へ膨らむ。この実施形態において、生物学的に適合する材料を含む内部硬化材94は、露出させた細部心臓壁を介して、或いは、大動脈弁を通過するカテーテル100によって、損傷した心臓壁96の領域内へ(例えば、注射器98による注入又は移植により)送給され、損傷した壁の位置を特定する電気的検知又は超音波画像化によって誘導される。図10Bは、影響された壁96を厚くし、変形が低減されるように材料の特性を変化させる、結果として生じた内部硬化材94又は強化部を示す。この結果、僧帽弁尖部12の繋留及び逆流が平行して低減される。この実施形態は、一方の乳頭筋が関与する局所的な損傷と、両方の筋肉に影響する大域的障害との両方に応用できる。注入する材料は、一部として、コラーゲンマトリクス又は筋芽細胞(患者自身の骨格筋等から取り出した原始筋細胞)を含んでよく、筋芽細胞は、血液の供給が制限される心臓壁内でも生存し続けることが明らかになっており、更に収縮能力を発現し得る。
【0049】
こうした硬化材は、心臓壁内部のポーチ104又は細胞足場のような構造内に送給してよい。初期構造は、構造が分解する前に、硬化材料に硬化する時間を与えるような形で、生体分解性にしてよい。
【0050】
また、当業者は、上記の手法及びデバイスが心室リモデリングの現象を制限し、或いは更に逆転させるという付加的な利点を有することを理解するであろう。リモデリングは、損傷壁及び非損傷壁(例えば、十分な血液の供給を有する壁及び有していない壁)の両方に影響を与える損傷した心臓の累進的な拡張であり、当初は損傷を受けなかった壁の収縮の減退を伴う。僧帽弁逆流は、こうしたリモデリングを招く強い刺激を提供するため、本発明のデバイスを使用して、こうした逆流を低減することで、リモデリングを制限することもできる。更に、Kelley STら(Circulation 1999;99:135-42)は、乳頭筋の近くに位置していない(したがって、逆流を発生させない)損傷壁の拡張を制限することにも、リモデリングを制限し、心臓全体の収縮機能を維持するという付加的利益があることを明らかにしている。したがって、本発明は、こうした付加的利益を提供する。
【0051】
図4のデバイスの実施形態による、急性又は慢性の虚血性僧帽弁逆流を有する十頭の動物における本発明者の経験では、全ての事例において、左心室のポンプ又は充填機能又は圧力に悪影響を与えることなく、逆流を反転及び除去できた。下壁梗塞と共に回旋枝の結紮により発生させた虚血性MRを有する十頭のヒツジを、六頭は急性状態で、四頭はMI後八週間で研究した。可膨張バルーンを収容したDacronTMポーチを、乳頭筋上に置き、エコーの誘導により調節し、左心室リモデリングを逆転する目的で、梗塞乳頭筋を僧帽弁前輪部に向けて再配置し、これにより尖部の繋留と僧帽弁逆流とを低減した。3Dエコーにより評価した僧帽弁形状は、乳頭筋から前輪部までの繋留距離を含め変化した。七頭のヒツジにおいては、ソノミクロメータ及び左心室Millarカテーテルを設置して、収縮末期及び収縮終期圧力容積関係(ESPVR及びEDPVR)の変化を評価し、ミクロスフェアを注射して、冠血流を評価した。十頭のヒツジ全てにおいて、中程度のMI後MRが、梗塞PMを正常方向へ再配置するポーチの利用のみ(n=3)又はエコー誘導バルーン膨張により消滅し、乳頭筋の繋留距離は、MI後の31.1±2.5mmから、ポーチ有りでは26.8±1.8mm(p<0.01 基準線=25.5±1.5mm)に減少し、左心室収縮性は変化しなかった(ESPVR勾配(ポーチ有り3.4±1.6mmに対してMI後2.8±1.6mm)。左心室の弾性定数は高くなる傾向にあったが(0.07±0.05ml-1に対してMI後0.05±0.03ml-1)、LVDEPは、僧帽弁逆流が消滅した際に変化しなかった。非梗塞領域への冠血流は、大きく低減されなかった。
【0052】
慢性の虚血清掃帽弁逆流を有する追加の五頭の動物では、僧帽弁逆流の低減に成功後、六乃至八週間に渡って再発性の漏出がないことが観察された。
【0053】
図11に示す別の実施形態において、本発明は、冠状静脈洞116と輪部との間の組織面114に(例えば、カテーテルシステム110により針を介して)注入するか、或いは針112を介してその他の形で挿入し、輪部の前方変位を生じさせる、注入可能な空間占拠材料108を使用して、輪部(破線及び18)を(矢印106によって示す方向に)前方変位させる装置及び手法を提供する。冠状静脈洞116は、心筋の最大の血管であり、僧帽弁輪に直接隣接して位置しており、経皮的カテーテルシステム110により容易にアクセスできるため、僧帽弁輪に影響を与え、或いは変位させるデバイスの配置に最適である。冠状静脈洞を介したデバイスの配置に特有の利点は、冠状静脈洞への経皮的アクセスの容易さであり、経皮的アクセスには、末梢脚部又は腕部静脈を介して、カテーテルを心臓の右側に進めることが伴う。これにより、デバイスが材料である場合、送給のための開胸手技は必要が無くなる。
【0054】
図12は、注入部位(群)に近接する心臓の領域の分解図である。注射針の直角の配向性118、120は、望ましい変位をもたらすために、必要なあらゆる場所へ材料108を注入する能力を示している。これは、輪部と冠状静脈洞との間の組織面、或いは更に下方の心臓基部へ方向付けることができる。生体適合性材料は、好ましくは、高分子ゲル又は同様の材料を含む。
【0055】
図11に図示したように、結果として生じる僧帽弁輪(破線及び18)の前方への変位は、全体的な僧帽弁輪面積を低減し、僧帽弁尖の接合を回復する。材料108の特徴には、変形の柔軟性が含まれ、材料の物理的特性は、収縮する心筋において通常発生する力に耐え、当初の形状及び体積を維持するように選択される。材料108は、好ましくは、当初は液体の形態であり、体温によって固まるため、Transvascular,Inc(カリフォルニア州メンロパーク)又はBioCardia,Inc(カリフォルニア州サウスサンフランシスコ)等の市販の経皮的カテーテルシステムを介して注入可能である。アルギン酸高分子等のヒドロゲルは、こうした材料の一例となる。こうした高分子は、生体適合性及び生体分解性であり、室温では液体の形態として、体温で凝固させることができる(こうした高分子の詳細については、参照により本明細書に組み込む、Vacanti JP, Langer R、組織工学:外科的復元及び移植のための生体交換デバイスの設計及び作成、Lancet, 1999 Jul;354 Suppl 1:SI32-4と、Marler JJ, Guba A, Rowley J, Koka R, Mooney D, Upton J, Vacanti JP、注入可能アルギン酸及び同系線維芽細胞による軟組織の増加、Plastic Reconstructive Surgery 2000; May;105(6):2049-58とを参照)。加えて、ヒドロゲルの堅固さは、心臓において存在する通常の負荷力に耐えるのに必要な度合いまで調節可能である。
【0056】
図13を参照すると、注射針122を有するカテーテル120が冠状静脈洞124に入っており、冠状静脈洞124と僧帽弁輪128との間の組織面内への生体材料108の一定量の注入132が、針122を介して、僧帽弁輪の長さに沿って、必要に応じて行われる。注入により、僧帽弁前尖34’’へ向かう僧帽弁後尖34’の前方又は内側への変位が生じ、適切な僧帽弁尖の接合(僧帽弁口130の閉鎖)が回復する。
【0057】
図14に例示した別の実施形態において、材料108は、注入材料の体積及び形状を維持する役割を果たす、高分子バルーン、又は線維芽細胞で構成された細胞マトリクスといった、カプセル化構造134又はシェル内に注入される。バルーン材料は、移植可能な可膨張バルーンを包含する人工尿道括約筋において使用されるもの、或いは形成外科において使用されるバルーンエキスパンダと同様にすることができる(こうした材料の詳細な説明については、参照により本明細書に組み込む、Wilson TS, Lemack GE, Zimmern PE、女性における固有括約筋欠損の管理、J Urol. 2003 May;169(5):1662-9と、Gonzalez R, Schimke CM、脊髄髄膜瘤における泌尿器学的再構築の戦略、Curr Opin Urol. 2002 Nov;12(6):485-90と、Kabaker SS, Kridel RW, Krugman ME, Swenson RW、脱毛症の治療における組織拡張、Arch. Otolaryngol Head Neck Surg. 1986 Jul;112(7):720-5と、Radovan C、軟組織の再構築における組織拡張、Plast Reconstr Surg 1984 Oct;74(4):482-92とを参照)。別の実施形態において、生体材料は、注入材料の体積及び形状の維持を可能にする線維芽細胞シェル内に注入できる。
【0058】
図15を参照すると、材料108は、冠状静脈洞124内のカテーテル136を介して、(図12の針の配向性118によって示したように)下方の心臓基部に、僧帽弁輪18の長さに沿って注入可能であり、結果として、僧帽弁尖12の適切な変位が生じる。心臓基部への注入は、輪部のレベルでの注入の補助として、或いは、輪部を変位させる独立した方法としての役割を果たす。
【0059】
別の実施形態において、材料108は、初期足場網と共に、組織工学材料で構成される。組織工学材料は、僧帽弁輪の変位をもたらすのに適切な物理的特性に適合させること、或いはカスタマイズすることが可能である。具体的には、組織工学材料は、患者自身の幹細胞で構成され、望ましい領域において軟骨性構造を発生させる軟骨細胞への転換をプログラムされる(参照により本明細書に組み込む、Yoshino H, Shin YM, Terai H, Vacanti JP、エレクトロスピニングによる生体分解性ナノファイバ足場及び骨組織工学での可能性、 Biomaterials. 2003 May;24(12):2077-82と、Abukawa H, Terai H, Hannouche D, Vacanti JP, Kaban LB, Troulis MJ、組織工学によるin vitroでの下顎顆頭の形成、J Oral Maxillofac Surg. 2003 Jan;61(1):94-100と、Fuchs JR, Terada S, Hannouche D, Ochoa ER, Vacanti JP, Fauza DO、工学的胎児軟骨:in vitroでの構造及び機能分析、J Pediatr Surg. 2002 Dec; 37(12):1720-5と、Young CS, Terada S, Vacanti JP, Honda M, Bartlett JD, Yelick PC、生体分解性高分子足場上の複雑な歯の構造の組織工学、J Dent Res. 2002 Oct;81(10):695-700とを参照)。軟骨性材料は、輪部の前方変位を発生させる望ましい物理的な堅固さと、心臓に存在する力に耐える能力とを有する。軟骨性構造は、必然的に、僧帽弁輪の前方部分に存在する。その他の組織工学材料は、輪部の変位を発生させる輪部又は心臓基部への筋肉の注入で構成できる(参照により本明細書に組み込む、Saxene AK, Willital GH, Vacanti JP、血管新生化三次元骨格筋組織工学、Biomed Mater Eng. 2001;11(4):275-81と、Saxena AK, Marler J, Benvenuto M, Willital GH, Vacanti JP、合成生体分解性高分子上での分離筋芽細胞を使用した細胞骨格筋組織工学:予備研究、Tissue Eng. 1999 Dec;5(6):525-32とを参照)。筋肉の付加的な利点は、心臓機能を増大させるために心臓周期に合わせた動的な収縮を発生させる可能性である。
【0060】
(複数の)注入の適切な局所化は、心エコー検査により支援してよい。追加として、適切な僧帽弁後輪部補正の有効性は、随意的に、リアルタイムの心エコー検査により非侵襲的にモニタリング及び誘導できる。
【0061】
上記の明細書は特定の好適な実施形態に関して説明されており、例示の目的から、多数の詳細が述べられているが、本発明の趣旨及び範囲から逸脱することなく、本発明が様々な修正及び追加的な実施形態の対象となり得ること、及び本明細書の特定の詳細を本発明の基本原理から逸脱することなく大幅に変更し得ることは、当業者には自明であろう。こうした修正及び追加的実施形態も、本発明に付随する特許請求の範囲及び趣旨に含まれるものである。
【特許請求の範囲】
【請求項1】
心臓の房室弁の逆流を低減する方法であって、
前記心臓の当該外壁区域と接触する圧縮部材を有する装置を心臓の外壁区域に固定するステップを備え、更に
当該圧縮部材を変位させるステップを備え、これにより、乳頭筋形状を正常化し、尖部の接合を改善するために、当該外壁区域を前記心臓の心室腔の中心線へ向けて内側へ移動させる方法。
【請求項2】
前記変位させるステップは、更に
前記装置を膨張させるステップを備え、前記装置は、更に、前記圧縮部材と強化部分との間に配置された可膨張リザーバを含む、請求項1記載の方法。
【請求項3】
前記変位させるステップは、更に、
前記装置を収縮させるステップを備える、請求項2記載の方法。
【請求項4】
前記変位させるステップは、更に、
前記膨張及び収縮させるステップを前記心臓の電気的活動と時間的に同調させるステップを備える、請求項3記載の方法。
【請求項5】
前記変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張流体をポンピングするステップを備える、請求項3記載の方法。
【請求項6】
前記変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張ゲルをポンピングするステップを備える、請求項3記載の方法。
【請求項7】
前記変位させるステップは、更に、
前記装置を、長期間に渡って、調整可能な形で断続的に膨張及び収縮させるステップを備え、前記装置は、更に、前記圧縮部材と強化部分との間に配置された可膨張リザーバを含む、請求項1記載の方法。
【請求項8】
前記固定するステップは、更に、
前記心臓を取り囲む心膜の最上層の下で、当該装置を前記心臓の前記外壁に縫合するステップを備える、請求項1記載の方法。
【請求項9】
前記固定するステップは、更に、
当該装置を前記心臓の前記外壁に縫合し、前記心臓を取り囲む前記心膜に取り付けるステップを備える、請求項1記載の方法。
【請求項10】
前記固定するステップは、更に、
心エコー画像化により前記装置の前記配置を誘導するステップを備える、請求項1記載の方法。
【請求項11】
前記変位させるステップは、更に、
心エコー画像化によって観察される尖部の接合に基づいて、当該圧縮部材の前記変位を誘導するステップを備える、請求項1記載の方法。
【請求項12】
更に、
心エコー画像化を介して収集したデータに基づいた輪郭を有するように当該装置を構築するステップを備える、請求項1記載の方法。
【請求項13】
前記変位させるステップは、更に、
当該装置に充填材料を充填するステップを備え、当該装置は、更に、前記圧縮部材と強化部分との間に配置された充填可能領域を含む、請求項1記載の方法。
【請求項14】
前記充填材料は、工学処理組織を含む、請求項13記載の方法。
【請求項15】
前記工学処理組織は、前記充填可能領域において硬化力を提供する、請求項14記載の方法。
【請求項16】
前記変位させるステップは、更に、
前記心臓の電気的活動に時間的に同調させて収縮させるために、前記工学処理組織を電気的にトリガするステップを備え、当該工学処理組織は、導電性高分子で構成された人工筋肉を含む、請求項13記載の方法。
【請求項17】
前記装置の少なくとも一部は、生体分解性であり、
前記工学処理組織は、乳頭筋形状を正常化し、尖部の接合を改善するために、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動させる役割を果たす、請求項13記載の方法。
【請求項18】
当該充填可能領域は、当該充填材料を受け入れるための足場構造を含む、請求項13記載の方法。
【請求項19】
前記外壁区域は、前記外壁の変形部分を備える、請求項1記載の方法。
【請求項20】
前記固定するステップは、侵襲的な心臓手技を含む、請求項1記載の方法。
【請求項21】
前記固定するステップは、一つ以上の小さな開口部と、胸壁を通って挿入された細長い管状構造とを介して、内視及び手術器具及びデバイスを導入する低侵襲的又は胸腔鏡手技を含む、請求項1記載の方法。
【請求項22】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項1記載の方法。
【請求項23】
更に、
前記心臓の異なる外壁区域において、前記固定するステップ及び変位させるステップを繰り返すステップを備える、請求項1記載の方法。
【請求項24】
当該異なる外壁区域は、前記心臓の反対側にある、請求項23記載の方法。
【請求項25】
前記変位させるステップは、僧帽弁輪サイズを低減する役割を果たす、請求項1記載の方法。
【請求項26】
心臓の房室弁の逆流を低減する方法であって、
装置を心臓の外壁区域に固定するステップを備え、当該装置は、乳頭筋形状を正常化し、尖部の接合を改善するために、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動できるように、前記心臓の当該外壁と接触する湾入圧縮部材を有する方法。
【請求項27】
前記固定するステップは、僧帽弁輪サイズを低減する役割を果たす、請求項26記載の方法。
【請求項28】
前記調節するステップは、更に、
心エコー画像化によって観察される尖部の接合に基づいて、当該圧縮部材の前記変位を誘導するステップを備える、請求項27記載の方法。
【請求項29】
前記固定するステップは、更に、
前記心臓を取り囲む心膜の最上層の下で、当該装置を前記心臓の前記外壁区域に縫合するステップを備える、請求項26記載の方法。
【請求項30】
前記固定するステップは、更に、
当該装置を前記心臓の前記外壁に縫合し、前記心臓を取り囲む前記心膜に取り付けるステップを備える、請求項26記載の方法。
【請求項31】
前記固定するステップは、更に、
心エコー画像化により前記装置の前記配置を誘導するステップを備える、請求項26記載の方法。
【請求項32】
更に、
心エコー画像化を介して収集したデータに基づいた輪郭を有するように当該装置を構築するステップを備える、請求項26記載の方法。
【請求項33】
前記外壁区域は、前記外壁の変形部分を備える、請求項26記載の方法。
【請求項34】
前記固定するステップは、侵襲的な心臓手技を含む、請求項26記載の方法。
【請求項35】
前記固定するステップは、胸腔鏡手技を含む、請求項26記載の方法。
【請求項36】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項26記載の方法。
【請求項37】
更に、
前記心臓の異なる外壁区域において、前記固定するステップ及び変位させるステップを繰り返すステップを備える、請求項26記載の方法。
【請求項38】
当該異なる外壁区域は、前記心臓の反対側にある、請求項37記載の方法。
【請求項39】
心臓の房室弁の逆流を低減する装置で、
乳頭筋形状を正常化し、尖部の接合を改善するために、心臓の外壁区域に、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動できるように接触するのに適した湾入圧縮部材と、
前記圧縮部材を前記心臓の前記外壁に固定するための手段と、を備える装置。
【請求項40】
更に、当該外壁区域の移動の度合いを変化させるために、当該装置を調節する手段を備える、請求項39記載の装置。
【請求項41】
前記圧縮部材は、当該外壁区画の輪郭に関連する輪郭を有する、請求項39記載の装置。
【請求項42】
前記装置は、巻き付け可能である、請求項39記載の装置。
【請求項43】
心臓リモデリングを逆転する方法で、
装置を心臓の外壁区域に固定するステップを備え、当該装置は、前記心臓の当該外壁区域と接触する圧縮部材を含み、更に
当該外壁区域を前記心室腔の前記中心線へ向けて内側へ周期的に移動させるために、当該圧縮部材を能動的に変位させるステップを備え、これにより、心臓形状を正常化する方法。
【請求項44】
前記能動的に変位させるステップは、更に、
前記装置を膨張させるステップを備え、前記装置は、更に、前記圧縮部材と強化部分との間に配置された可膨張リザーバを含み、更に、
前記装置を収縮させるステップを備える、請求項43記載の方法。
【請求項45】
前記能動的に変位させるステップは、更に、
前記膨張及び収縮させるステップを前記心臓の電気的活動と時間的に同調させるステップを備える、請求項44記載の方法。
【請求項46】
前記能動的に変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張流体をポンピングするステップを備える、請求項44記載の方法。
【請求項47】
前記能動的に変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張ゲルをポンピングするステップを備える、請求項44記載の方法。
【請求項48】
前記固定するステップは、更に、
前記心臓を取り囲む心膜の最上層の下で、当該装置を前記心臓の前記外壁に縫合するステップを備える、請求項43記載の方法。
【請求項49】
前記固定するステップは、更に、
当該装置を前記心臓の前記外壁に縫合し、前記心臓を取り囲む前記心膜に取り付けるステップを備える、請求項43記載の方法。
【請求項50】
前記固定するステップは、更に、
心エコー画像化により前記装置の前記配置を誘導するステップを備える、請求項43記載の方法。
【請求項51】
前記能動的に変位させるステップは、更に、
心エコー画像化によって観察される尖部の接合に基づいて、当該圧縮部材の前記変位を誘導するステップを備える、請求項43記載の方法。
【請求項52】
更に、
心エコー画像化を介して収集したデータに基づいた輪郭を有するように当該装置を構築するステップを備える、請求項43記載の方法。
【請求項53】
前記能動的に変位させるステップは、更に、
導電性高分子で構成された人工筋肉を含む工学処理組織を当該装置に充填するステップを備え、当該装置は、更に、当該外壁区域に隣接する充填可能領域を含み、更に
前記心臓の電気的活動に時間的に同調させて収縮させるために、当該工学処理組織を電気的にトリガするステップを備える、請求項43記載の方法。
【請求項54】
前記装置の少なくとも一部は、生体分解性である、請求項53記載の方法。
【請求項55】
当該充填可能領域は、当該工学処理組織を受け入れるための足場構造を含む、請求項53記載の方法。
【請求項56】
前記外壁区域は、前記外壁の変形部分を備える、請求項43記載の方法。
【請求項57】
前記固定するステップは、侵襲的な心臓手技を含む、請求項43記載の方法。
【請求項58】
前記固定するステップは、胸腔鏡手技を含む、請求項43記載の方法。
【請求項59】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項43記載の方法。
【請求項60】
更に、
前記心臓の異なる外壁区域において、前記固定するステップ及び能動的に変位させるステップを繰り返すステップを備える、請求項43記載の方法。
【請求項61】
当該異なる外壁区域は、前記心臓の反対側にある、請求項60記載の方法。
【請求項62】
心臓リモデリングを逆転する装置で、
心臓の外壁区画に接触するのに適した圧縮部材と
心臓形状を正常化するために、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ周期的に移動させる能動的変位メカニズムと
前記圧縮部材を前記心臓の前記外壁に固定するための手段と、を備える装置。
【請求項63】
前記能動的変位メカニズムは、
強化部分と
当該強化部分と当該圧縮部材との間に配置された可膨張リザーバで、膨張材料による前記可膨張リザーバの膨張が当該圧縮部材を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動させるようになる可膨張リザーバと
膨張材料供給部と、
当該リザーバ及び当該膨張材料供給部と連絡するポンプとを備え、当該ポンプは、当該リザーバを膨張及び収縮させる動作をする、請求項62記載の装置。
【請求項64】
前記強化部分は、パッチを備える、請求項63記載の装置。
【請求項65】
前記強化部分は、前記可膨張リザーバの外側への拡張に抵抗する、請求項63記載の装置。
【請求項66】
前記可膨張リザーバは、経由して前記リザーバの調節を実行し得るアクセスポートを含む、請求項64記載の装置。
【請求項67】
当該アクセスポートは、皮膚の下の胸壁内に固定可能である、請求項63記載の装置。
【請求項68】
当該アクセスポートは、皮膚の下のポーチ内で胸壁内に固定可能である、請求項63記載の装置。
【請求項69】
前記アクセスポートは、自己密閉式材料の一部において構成される、請求項63記載の装置。
【請求項70】
前記アクセスポートは、熱処理によってロック可能である、請求項63記載の装置。
【請求項71】
当該ポンプは、前記心臓の電気的活動と時間的に同調して動作する、請求項63記載の装置。
【請求項72】
当該ポンプは、胸壁又は腹部の付近に固定される、請求項63記載の装置。
【請求項73】
当該膨張材料は、流体を含む、請求項63記載の装置。
【請求項74】
当該膨張材料は、ゲルを含む、請求項63記載の装置。
【請求項75】
前記圧縮部材は、前記外壁区画の輪郭に関連する輪郭設計を有する、請求項62記載の装置。
【請求項76】
前記能動的変位メカニズムは、
強化部分と
前記心臓の電気的活動に時間的に同調させて電気的にトリガ可能な導電性高分子で構成された人工筋肉を含む、当該強化部分と当該圧縮部材との間に配置された充填可能領域とを備える、請求項62記載の装置。
【請求項77】
前記装置の少なくとも一部は、生体分解性である、請求項76記載の装置。
【請求項78】
当該充填可能領域は、当該導電性高分子を受け入れる構造を包含する、請求項76記載の装置。
【請求項79】
当該装置は、巻き付け可能である、請求項76記載の装置。
【請求項80】
心臓リモデリングを逆転する方法であって、
装置を心臓の外壁区域に固定するステップを備え、当該装置は、前記心臓の当該外壁区域と接触する圧縮部材と、強化部分と、硬化材料を内部に配置した、当該圧縮部材及び当該強化部分の間の領域とを含み、当該外壁区域を前記心室腔の前記中心線へ向けて内側へ移動させるために当該圧縮部材を変位させ、これにより心臓形状を正常化する方法。
【請求項81】
前記固定するステップは、僧帽弁輪サイズを低減する役割を果たす、請求項80記載の方法。
【請求項82】
前記硬化材料は、工学処理細胞材料を含む、請求項80記載の方法。
【請求項83】
前記細胞材料は、経時的に骨へと転換する、僧帽弁輪サイズを低減する役割を果たす、請求項82記載の方法。
【請求項84】
前記細胞材料は、経時的に軟骨へと転換する、僧帽弁輪サイズを低減する役割を果たす、請求項82記載の方法。
【請求項85】
前記細胞材料は、足場構造上に配置される、請求項82記載の方法。
【請求項86】
前記装置の少なくとも一部は、生体分解性であり、前記細胞材料は、当該外壁区域を前記心室腔の前記中心線へ向けて内側へ移動させ、これにより心臓形状を正常化する、請求項82記載の方法。
【請求項87】
前記固定するステップは、侵襲的な心臓手技を含む、請求項80記載の方法。
【請求項88】
前記固定するステップは、胸腔鏡手技を含む、請求項80記載の方法。
【請求項89】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項80記載の方法。
【請求項90】
更に、
前記心臓の異なる外壁区域において、前記固定するステップを繰り返すステップを備える、請求項80記載の方法。
【請求項91】
当該異なる外壁区域は、前記心臓の反対側にある、請求項90記載の方法。
【請求項92】
心臓リモデリングを逆転する方法であって、
前記心臓の組織の領域内に、組織の前記領域を前記心室腔の前記中心線へ向けて内側へ変位させるために材料を送給し、これにより心臓形状を正常化するステップ、を備える方法。
【請求項93】
心臓の房室弁の逆流を低減する方法であって、
乳頭筋に近接する心臓の筋肉壁領域に材料を送給するステップを備え、当該材料は、乳頭筋形状を正常化し、尖部の接合を改善するために、当該筋肉壁領域の一部を前記心臓の前記心室腔の前記中心線へ向けて内側へ変位させる方法。
【請求項94】
前記送給するステップは、更に、前記材料を注入するステップを備える、請求項92又は123記載の方法。
【請求項95】
前記筋肉壁領域は、前記心臓内の冠状静脈洞と僧帽弁輪との間の組織平面を備える、請求項92又は93記載の方法。
【請求項96】
前記筋肉壁領域は、前記心臓の基部の一部を備える、請求項92又は93記載の方法。
【請求項97】
前記筋肉壁領域は、損傷した組織を含む、請求項92又は93記載の方法。
【請求項98】
前記送給するステップは、更に、
超音波により前記筋肉壁領域を画像化するステップを含む、請求項92又は93記載の方法。
【請求項99】
前記材料は、送給後に所定の形状及び体積を維持する、請求項92又は93記載の方法。
【請求項100】
前記材料は、ニッケルチタン合金を含む、請求項92又は93記載の方法。
【請求項101】
前記材料は、体温近くで硬化するヒドロゲルを含む、請求項92又は93記載の方法。
【請求項102】
前記材料は、構造内にカプセル化される、請求項92又は93記載の方法。
【請求項103】
前記構造は、バルーンである、請求項102記載の方法。
【請求項104】
前記構造は、線維芽細胞で構成された細胞マトリクスである、請求項102記載の方法。
【請求項105】
前記材料は、工学処理細胞組織である、請求項92又は93記載の方法。
【請求項106】
前記細胞組織は、生体分解性足場網と共に送給される、請求項105記載の方法。
【請求項107】
前記細胞組織は、軟骨又は骨構造へと転換するようにプログラムされた幹細胞を含む、請求項105記載の方法。
【請求項108】
前記細胞組織は、前記心臓の電気的活動に時間的に同調した動的な収縮を発生させる筋細胞を含む、請求項105記載の方法。
【請求項109】
前記材料は、導電性高分子を含む、前記材料は、電気的トリガに応答することで、前記筋肉領域の前記一部を変位させる、請求項92又は93記載の方法。
【請求項110】
前記送給するステップは、侵襲的な心臓手技を含む、請求項92又は93記載の方法。
【請求項111】
前記送給するステップは、胸腔鏡手技を含む、請求項92又は93記載の方法。
【請求項112】
前記送給するステップは、僧帽弁輪サイズを低減する役割を果たす、請求項92又は93記載の方法。
【請求項113】
更に、
前記心臓の異なる筋肉壁領域において、前記送給するステップを繰り返すステップを備える、請求項92又は93記載の方法。
【請求項1】
心臓の房室弁の逆流を低減する方法であって、
前記心臓の当該外壁区域と接触する圧縮部材を有する装置を心臓の外壁区域に固定するステップを備え、更に
当該圧縮部材を変位させるステップを備え、これにより、乳頭筋形状を正常化し、尖部の接合を改善するために、当該外壁区域を前記心臓の心室腔の中心線へ向けて内側へ移動させる方法。
【請求項2】
前記変位させるステップは、更に
前記装置を膨張させるステップを備え、前記装置は、更に、前記圧縮部材と強化部分との間に配置された可膨張リザーバを含む、請求項1記載の方法。
【請求項3】
前記変位させるステップは、更に、
前記装置を収縮させるステップを備える、請求項2記載の方法。
【請求項4】
前記変位させるステップは、更に、
前記膨張及び収縮させるステップを前記心臓の電気的活動と時間的に同調させるステップを備える、請求項3記載の方法。
【請求項5】
前記変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張流体をポンピングするステップを備える、請求項3記載の方法。
【請求項6】
前記変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張ゲルをポンピングするステップを備える、請求項3記載の方法。
【請求項7】
前記変位させるステップは、更に、
前記装置を、長期間に渡って、調整可能な形で断続的に膨張及び収縮させるステップを備え、前記装置は、更に、前記圧縮部材と強化部分との間に配置された可膨張リザーバを含む、請求項1記載の方法。
【請求項8】
前記固定するステップは、更に、
前記心臓を取り囲む心膜の最上層の下で、当該装置を前記心臓の前記外壁に縫合するステップを備える、請求項1記載の方法。
【請求項9】
前記固定するステップは、更に、
当該装置を前記心臓の前記外壁に縫合し、前記心臓を取り囲む前記心膜に取り付けるステップを備える、請求項1記載の方法。
【請求項10】
前記固定するステップは、更に、
心エコー画像化により前記装置の前記配置を誘導するステップを備える、請求項1記載の方法。
【請求項11】
前記変位させるステップは、更に、
心エコー画像化によって観察される尖部の接合に基づいて、当該圧縮部材の前記変位を誘導するステップを備える、請求項1記載の方法。
【請求項12】
更に、
心エコー画像化を介して収集したデータに基づいた輪郭を有するように当該装置を構築するステップを備える、請求項1記載の方法。
【請求項13】
前記変位させるステップは、更に、
当該装置に充填材料を充填するステップを備え、当該装置は、更に、前記圧縮部材と強化部分との間に配置された充填可能領域を含む、請求項1記載の方法。
【請求項14】
前記充填材料は、工学処理組織を含む、請求項13記載の方法。
【請求項15】
前記工学処理組織は、前記充填可能領域において硬化力を提供する、請求項14記載の方法。
【請求項16】
前記変位させるステップは、更に、
前記心臓の電気的活動に時間的に同調させて収縮させるために、前記工学処理組織を電気的にトリガするステップを備え、当該工学処理組織は、導電性高分子で構成された人工筋肉を含む、請求項13記載の方法。
【請求項17】
前記装置の少なくとも一部は、生体分解性であり、
前記工学処理組織は、乳頭筋形状を正常化し、尖部の接合を改善するために、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動させる役割を果たす、請求項13記載の方法。
【請求項18】
当該充填可能領域は、当該充填材料を受け入れるための足場構造を含む、請求項13記載の方法。
【請求項19】
前記外壁区域は、前記外壁の変形部分を備える、請求項1記載の方法。
【請求項20】
前記固定するステップは、侵襲的な心臓手技を含む、請求項1記載の方法。
【請求項21】
前記固定するステップは、一つ以上の小さな開口部と、胸壁を通って挿入された細長い管状構造とを介して、内視及び手術器具及びデバイスを導入する低侵襲的又は胸腔鏡手技を含む、請求項1記載の方法。
【請求項22】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項1記載の方法。
【請求項23】
更に、
前記心臓の異なる外壁区域において、前記固定するステップ及び変位させるステップを繰り返すステップを備える、請求項1記載の方法。
【請求項24】
当該異なる外壁区域は、前記心臓の反対側にある、請求項23記載の方法。
【請求項25】
前記変位させるステップは、僧帽弁輪サイズを低減する役割を果たす、請求項1記載の方法。
【請求項26】
心臓の房室弁の逆流を低減する方法であって、
装置を心臓の外壁区域に固定するステップを備え、当該装置は、乳頭筋形状を正常化し、尖部の接合を改善するために、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動できるように、前記心臓の当該外壁と接触する湾入圧縮部材を有する方法。
【請求項27】
前記固定するステップは、僧帽弁輪サイズを低減する役割を果たす、請求項26記載の方法。
【請求項28】
前記調節するステップは、更に、
心エコー画像化によって観察される尖部の接合に基づいて、当該圧縮部材の前記変位を誘導するステップを備える、請求項27記載の方法。
【請求項29】
前記固定するステップは、更に、
前記心臓を取り囲む心膜の最上層の下で、当該装置を前記心臓の前記外壁区域に縫合するステップを備える、請求項26記載の方法。
【請求項30】
前記固定するステップは、更に、
当該装置を前記心臓の前記外壁に縫合し、前記心臓を取り囲む前記心膜に取り付けるステップを備える、請求項26記載の方法。
【請求項31】
前記固定するステップは、更に、
心エコー画像化により前記装置の前記配置を誘導するステップを備える、請求項26記載の方法。
【請求項32】
更に、
心エコー画像化を介して収集したデータに基づいた輪郭を有するように当該装置を構築するステップを備える、請求項26記載の方法。
【請求項33】
前記外壁区域は、前記外壁の変形部分を備える、請求項26記載の方法。
【請求項34】
前記固定するステップは、侵襲的な心臓手技を含む、請求項26記載の方法。
【請求項35】
前記固定するステップは、胸腔鏡手技を含む、請求項26記載の方法。
【請求項36】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項26記載の方法。
【請求項37】
更に、
前記心臓の異なる外壁区域において、前記固定するステップ及び変位させるステップを繰り返すステップを備える、請求項26記載の方法。
【請求項38】
当該異なる外壁区域は、前記心臓の反対側にある、請求項37記載の方法。
【請求項39】
心臓の房室弁の逆流を低減する装置で、
乳頭筋形状を正常化し、尖部の接合を改善するために、心臓の外壁区域に、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動できるように接触するのに適した湾入圧縮部材と、
前記圧縮部材を前記心臓の前記外壁に固定するための手段と、を備える装置。
【請求項40】
更に、当該外壁区域の移動の度合いを変化させるために、当該装置を調節する手段を備える、請求項39記載の装置。
【請求項41】
前記圧縮部材は、当該外壁区画の輪郭に関連する輪郭を有する、請求項39記載の装置。
【請求項42】
前記装置は、巻き付け可能である、請求項39記載の装置。
【請求項43】
心臓リモデリングを逆転する方法で、
装置を心臓の外壁区域に固定するステップを備え、当該装置は、前記心臓の当該外壁区域と接触する圧縮部材を含み、更に
当該外壁区域を前記心室腔の前記中心線へ向けて内側へ周期的に移動させるために、当該圧縮部材を能動的に変位させるステップを備え、これにより、心臓形状を正常化する方法。
【請求項44】
前記能動的に変位させるステップは、更に、
前記装置を膨張させるステップを備え、前記装置は、更に、前記圧縮部材と強化部分との間に配置された可膨張リザーバを含み、更に、
前記装置を収縮させるステップを備える、請求項43記載の方法。
【請求項45】
前記能動的に変位させるステップは、更に、
前記膨張及び収縮させるステップを前記心臓の電気的活動と時間的に同調させるステップを備える、請求項44記載の方法。
【請求項46】
前記能動的に変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張流体をポンピングするステップを備える、請求項44記載の方法。
【請求項47】
前記能動的に変位させるステップは、更に、
当該可膨張リザーバと供給リザーバとの間で膨張ゲルをポンピングするステップを備える、請求項44記載の方法。
【請求項48】
前記固定するステップは、更に、
前記心臓を取り囲む心膜の最上層の下で、当該装置を前記心臓の前記外壁に縫合するステップを備える、請求項43記載の方法。
【請求項49】
前記固定するステップは、更に、
当該装置を前記心臓の前記外壁に縫合し、前記心臓を取り囲む前記心膜に取り付けるステップを備える、請求項43記載の方法。
【請求項50】
前記固定するステップは、更に、
心エコー画像化により前記装置の前記配置を誘導するステップを備える、請求項43記載の方法。
【請求項51】
前記能動的に変位させるステップは、更に、
心エコー画像化によって観察される尖部の接合に基づいて、当該圧縮部材の前記変位を誘導するステップを備える、請求項43記載の方法。
【請求項52】
更に、
心エコー画像化を介して収集したデータに基づいた輪郭を有するように当該装置を構築するステップを備える、請求項43記載の方法。
【請求項53】
前記能動的に変位させるステップは、更に、
導電性高分子で構成された人工筋肉を含む工学処理組織を当該装置に充填するステップを備え、当該装置は、更に、当該外壁区域に隣接する充填可能領域を含み、更に
前記心臓の電気的活動に時間的に同調させて収縮させるために、当該工学処理組織を電気的にトリガするステップを備える、請求項43記載の方法。
【請求項54】
前記装置の少なくとも一部は、生体分解性である、請求項53記載の方法。
【請求項55】
当該充填可能領域は、当該工学処理組織を受け入れるための足場構造を含む、請求項53記載の方法。
【請求項56】
前記外壁区域は、前記外壁の変形部分を備える、請求項43記載の方法。
【請求項57】
前記固定するステップは、侵襲的な心臓手技を含む、請求項43記載の方法。
【請求項58】
前記固定するステップは、胸腔鏡手技を含む、請求項43記載の方法。
【請求項59】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項43記載の方法。
【請求項60】
更に、
前記心臓の異なる外壁区域において、前記固定するステップ及び能動的に変位させるステップを繰り返すステップを備える、請求項43記載の方法。
【請求項61】
当該異なる外壁区域は、前記心臓の反対側にある、請求項60記載の方法。
【請求項62】
心臓リモデリングを逆転する装置で、
心臓の外壁区画に接触するのに適した圧縮部材と
心臓形状を正常化するために、当該外壁区域を前記心臓の前記心室腔の前記中心線へ向けて内側へ周期的に移動させる能動的変位メカニズムと
前記圧縮部材を前記心臓の前記外壁に固定するための手段と、を備える装置。
【請求項63】
前記能動的変位メカニズムは、
強化部分と
当該強化部分と当該圧縮部材との間に配置された可膨張リザーバで、膨張材料による前記可膨張リザーバの膨張が当該圧縮部材を前記心臓の前記心室腔の前記中心線へ向けて内側へ移動させるようになる可膨張リザーバと
膨張材料供給部と、
当該リザーバ及び当該膨張材料供給部と連絡するポンプとを備え、当該ポンプは、当該リザーバを膨張及び収縮させる動作をする、請求項62記載の装置。
【請求項64】
前記強化部分は、パッチを備える、請求項63記載の装置。
【請求項65】
前記強化部分は、前記可膨張リザーバの外側への拡張に抵抗する、請求項63記載の装置。
【請求項66】
前記可膨張リザーバは、経由して前記リザーバの調節を実行し得るアクセスポートを含む、請求項64記載の装置。
【請求項67】
当該アクセスポートは、皮膚の下の胸壁内に固定可能である、請求項63記載の装置。
【請求項68】
当該アクセスポートは、皮膚の下のポーチ内で胸壁内に固定可能である、請求項63記載の装置。
【請求項69】
前記アクセスポートは、自己密閉式材料の一部において構成される、請求項63記載の装置。
【請求項70】
前記アクセスポートは、熱処理によってロック可能である、請求項63記載の装置。
【請求項71】
当該ポンプは、前記心臓の電気的活動と時間的に同調して動作する、請求項63記載の装置。
【請求項72】
当該ポンプは、胸壁又は腹部の付近に固定される、請求項63記載の装置。
【請求項73】
当該膨張材料は、流体を含む、請求項63記載の装置。
【請求項74】
当該膨張材料は、ゲルを含む、請求項63記載の装置。
【請求項75】
前記圧縮部材は、前記外壁区画の輪郭に関連する輪郭設計を有する、請求項62記載の装置。
【請求項76】
前記能動的変位メカニズムは、
強化部分と
前記心臓の電気的活動に時間的に同調させて電気的にトリガ可能な導電性高分子で構成された人工筋肉を含む、当該強化部分と当該圧縮部材との間に配置された充填可能領域とを備える、請求項62記載の装置。
【請求項77】
前記装置の少なくとも一部は、生体分解性である、請求項76記載の装置。
【請求項78】
当該充填可能領域は、当該導電性高分子を受け入れる構造を包含する、請求項76記載の装置。
【請求項79】
当該装置は、巻き付け可能である、請求項76記載の装置。
【請求項80】
心臓リモデリングを逆転する方法であって、
装置を心臓の外壁区域に固定するステップを備え、当該装置は、前記心臓の当該外壁区域と接触する圧縮部材と、強化部分と、硬化材料を内部に配置した、当該圧縮部材及び当該強化部分の間の領域とを含み、当該外壁区域を前記心室腔の前記中心線へ向けて内側へ移動させるために当該圧縮部材を変位させ、これにより心臓形状を正常化する方法。
【請求項81】
前記固定するステップは、僧帽弁輪サイズを低減する役割を果たす、請求項80記載の方法。
【請求項82】
前記硬化材料は、工学処理細胞材料を含む、請求項80記載の方法。
【請求項83】
前記細胞材料は、経時的に骨へと転換する、僧帽弁輪サイズを低減する役割を果たす、請求項82記載の方法。
【請求項84】
前記細胞材料は、経時的に軟骨へと転換する、僧帽弁輪サイズを低減する役割を果たす、請求項82記載の方法。
【請求項85】
前記細胞材料は、足場構造上に配置される、請求項82記載の方法。
【請求項86】
前記装置の少なくとも一部は、生体分解性であり、前記細胞材料は、当該外壁区域を前記心室腔の前記中心線へ向けて内側へ移動させ、これにより心臓形状を正常化する、請求項82記載の方法。
【請求項87】
前記固定するステップは、侵襲的な心臓手技を含む、請求項80記載の方法。
【請求項88】
前記固定するステップは、胸腔鏡手技を含む、請求項80記載の方法。
【請求項89】
更に、
前記装置を巻き付けるステップと、
前記外壁区域に近接する位置に前記装置を送給するステップと、
当該位置で前記装置を広げるステップと、を備える、請求項80記載の方法。
【請求項90】
更に、
前記心臓の異なる外壁区域において、前記固定するステップを繰り返すステップを備える、請求項80記載の方法。
【請求項91】
当該異なる外壁区域は、前記心臓の反対側にある、請求項90記載の方法。
【請求項92】
心臓リモデリングを逆転する方法であって、
前記心臓の組織の領域内に、組織の前記領域を前記心室腔の前記中心線へ向けて内側へ変位させるために材料を送給し、これにより心臓形状を正常化するステップ、を備える方法。
【請求項93】
心臓の房室弁の逆流を低減する方法であって、
乳頭筋に近接する心臓の筋肉壁領域に材料を送給するステップを備え、当該材料は、乳頭筋形状を正常化し、尖部の接合を改善するために、当該筋肉壁領域の一部を前記心臓の前記心室腔の前記中心線へ向けて内側へ変位させる方法。
【請求項94】
前記送給するステップは、更に、前記材料を注入するステップを備える、請求項92又は123記載の方法。
【請求項95】
前記筋肉壁領域は、前記心臓内の冠状静脈洞と僧帽弁輪との間の組織平面を備える、請求項92又は93記載の方法。
【請求項96】
前記筋肉壁領域は、前記心臓の基部の一部を備える、請求項92又は93記載の方法。
【請求項97】
前記筋肉壁領域は、損傷した組織を含む、請求項92又は93記載の方法。
【請求項98】
前記送給するステップは、更に、
超音波により前記筋肉壁領域を画像化するステップを含む、請求項92又は93記載の方法。
【請求項99】
前記材料は、送給後に所定の形状及び体積を維持する、請求項92又は93記載の方法。
【請求項100】
前記材料は、ニッケルチタン合金を含む、請求項92又は93記載の方法。
【請求項101】
前記材料は、体温近くで硬化するヒドロゲルを含む、請求項92又は93記載の方法。
【請求項102】
前記材料は、構造内にカプセル化される、請求項92又は93記載の方法。
【請求項103】
前記構造は、バルーンである、請求項102記載の方法。
【請求項104】
前記構造は、線維芽細胞で構成された細胞マトリクスである、請求項102記載の方法。
【請求項105】
前記材料は、工学処理細胞組織である、請求項92又は93記載の方法。
【請求項106】
前記細胞組織は、生体分解性足場網と共に送給される、請求項105記載の方法。
【請求項107】
前記細胞組織は、軟骨又は骨構造へと転換するようにプログラムされた幹細胞を含む、請求項105記載の方法。
【請求項108】
前記細胞組織は、前記心臓の電気的活動に時間的に同調した動的な収縮を発生させる筋細胞を含む、請求項105記載の方法。
【請求項109】
前記材料は、導電性高分子を含む、前記材料は、電気的トリガに応答することで、前記筋肉領域の前記一部を変位させる、請求項92又は93記載の方法。
【請求項110】
前記送給するステップは、侵襲的な心臓手技を含む、請求項92又は93記載の方法。
【請求項111】
前記送給するステップは、胸腔鏡手技を含む、請求項92又は93記載の方法。
【請求項112】
前記送給するステップは、僧帽弁輪サイズを低減する役割を果たす、請求項92又は93記載の方法。
【請求項113】
更に、
前記心臓の異なる筋肉壁領域において、前記送給するステップを繰り返すステップを備える、請求項92又は93記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】


【図8D】


【図9A】


【図9B】


【図9C】


【図9D】


【図10A】


【図10B】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】


【図8D】


【図9A】


【図9B】


【図9C】


【図9D】


【図10A】


【図10B】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2010−46546(P2010−46546A)
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願番号】特願2009−274729(P2009−274729)
【出願日】平成21年12月2日(2009.12.2)
【分割の表示】特願2004−518052(P2004−518052)の分割
【原出願日】平成15年6月27日(2003.6.27)
【出願人】(592017633)ザ ジェネラル ホスピタル コーポレイション (177)
【Fターム(参考)】
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願日】平成21年12月2日(2009.12.2)
【分割の表示】特願2004−518052(P2004−518052)の分割
【原出願日】平成15年6月27日(2003.6.27)
【出願人】(592017633)ザ ジェネラル ホスピタル コーポレイション (177)
【Fターム(参考)】
[ Back to top ]

