所定部位発光量測定方法、所定部位発光量測定装置、発現量測定方法、および測定装置
【課題】当該サンプルと同一のものに対して、所定の部位に発光たんぱく質が局在しているか否かを確認することができる所定部位発光量測定方法および所定部位発光量測定装置などを提供すること。
【解決手段】本発明における所定部位発光量測定装置は、移行塩基配列および発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子が導入されたサンプルと、サンプルを収納する容器と、容器を配置するステージと、サンプルの発光画像を撮像する発光画像撮像ユニットと、サンプルの蛍光画像を撮像する蛍光画像撮像ユニットと、情報通信端末と、で構成されている。
【解決手段】本発明における所定部位発光量測定装置は、移行塩基配列および発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子が導入されたサンプルと、サンプルを収納する容器と、容器を配置するステージと、サンプルの発光画像を撮像する発光画像撮像ユニットと、サンプルの蛍光画像を撮像する蛍光画像撮像ユニットと、情報通信端末と、で構成されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生きたサンプル内の所定の部位からの発光量を測定する所定部位発光量測定方法および所定部位発光量測定装置に関するものである。
本発明は、解析対象の遺伝子を導入した生きた細胞を対象として、蛍光測定および発光測定を組み合わせて、細胞周期のステージを同定すると共に解析対象の遺伝子の発現量を測定する発現量測定方法に関するものである。
本発明は、標本像を撮像して標本を観察する測定装置に関し、特に微弱光を発する発光標識および励起されて蛍光を発する蛍光標識が付与された標本の観察に適用して好適な測定装置に関するものである。
【背景技術】
【0002】
[I]ATPは、細胞内のエネルギーの供給源であり、生命現象に深く関わっている物質である。一方、ホタルのルシフェラーゼは、ATP、O2、Mg2+の存在下で、D‐ルシフェリンを発光基質として、オキシルシフェリン、CO2、AMP、ピロリン酸を生成する反応を触媒し、当該反応により発光する。また、ルシフェラーゼの発光反応はATP量に依存する。
【0003】
そのため、ルシフェラーゼの発光反応を利用してATPを定量することは古くから行われており、バイオ、臨床検査、食品衛生などの分野では、ルシフェラーゼを用いた細胞内のATP量の測定法が開発されている。
【0004】
例えば、細胞内のATP量の測定は、通常、以下の(1−1)〜(1−3)の工程で行われている。
(1−1)細胞または細菌を溶解してATPを抽出する。
(1−2)その抽出液をルシフェリンおよびルシフェラーゼを含む反応液に添加する。
(1−3)抽出液が添加された反応液から発光量を測定することで、細胞内のATPを定量する。
【0005】
また、破砕されてない細胞内のATP量の測定は、通常、以下の(2−1)〜(2−3)の工程で行われる。
(2−1)ルシフェラーゼ遺伝子を細胞に導入して発現させる。
(2−2)細胞を含む培養液中にルシフェリンを加える。
(2−3)ルシフェリンが加えられた培養液から発光量を測定することで、細胞内のATPを定量する。
【0006】
さらに、生きた細胞内の所定の部位(具体的にはミトコンドリア)におけるATP量の経時的測定は、以下の(3−1)および(3−2)の工程で行われる(非特許文献1)。
(3−1)ルシフェラーゼ遺伝子にミトコンドリア移行シグナル遺伝子を融合し、その融合した遺伝子を細胞に導入する。
(3−2)ルシフェラーゼが細胞内のミトコンドリアに局在しているという前提の下、細胞からの発光量を経時的に測定することで、細胞内のミトコンドリアにおけるATP量の変動を測定する。
なお、細胞内から発せられる発光の強度は極めて弱いので、1つの細胞を認識するために、イメージ・インテンシファイアを装着したCCDカメラでフォトンカウンティングを行う。また、ルシフェラーゼが細胞内のミトコンドリアに局在しているか否かは、発光量を測定した細胞とは別の細胞で確認する。具体的には、当該別の細胞を固定し、固定した細胞に抗ルシフェラーゼ抗体を反応させ、蛍光抗体法で細胞を観察することで局在の確認を行なう。これにより、測定した細胞からの発光量がミトコンドリアからの発光量に対応することを示した。
【0007】
[II]細胞増殖は生命維持において生物の基本的且つ重要な特徴の一つである。そして、細胞周期は細胞の成長やDNAの複製や染色体の分配や細胞の分裂などからなる複数の連続反応であり、細胞周期の各ステージにおいて様々な遺伝子の発現が変動することは十分に考えられる。また、細胞周期の異常や破綻は多くの慢性疾患や発癌に関与していると考えられている(特許文献1参照)。なお、特許文献1には、細胞周期調節因子の活性の測定法とそれを用いた癌の診断法に関する技術が開示されている。
【0008】
ところで、ルシフェラーゼ遺伝子をレポーター遺伝子として細胞に導入し、ルシフェラーゼ活性を指標にしてルシフェラーゼ遺伝子の発現の強さを調べる際、ルシフェラーゼ遺伝子の上流や下流に目的のDNA断片を繋ぐことで当該DNA断片がルシフェラーゼ遺伝子の転写に及ぼす影響を調べることができる。また、ルシフェラーゼ遺伝子の転写に影響を及ぼすと思われる転写因子などの遺伝子を発現ベクターに繋いでルシフェラーゼ遺伝子と共発現させることで、当該遺伝子の遺伝子産物がルシフェラーゼ遺伝子の発現に及ぼす影響を調べることができる。なお、ルシフェラーゼ遺伝子などのレポーター遺伝子を細胞に導入する方法には例えばリン酸カルシウム法やリポフェクチン法やエレクトロポーション法などがあり、各方法は目的や細胞の種類の違いに応じて使い分けられている。
【0009】
また、細胞内に導入され発現しているルシフェラーゼの活性の測定(モニター)は、まず細胞を溶解した細胞溶解液とルシフェリンやATPやマグネシウムなどを含む基質溶液とを反応させ、ついで基質溶液と反応させた細胞溶解液からの発光量を光電子増倍管を用いたルミノメーターで定量する、という手順で行われている。つまり、発光量は細胞を溶解した後に測定されている。これにより、ある時点でのルシフェラーゼ遺伝子の発現量を細胞全体の平均値として測定することができる。
【0010】
また、時間経過に沿ってルシフェラーゼ遺伝子の発現量を捉えるには生きた細胞からの発光量を経時的に測定する必要がある。そして、生きた細胞からの発光量の経時的測定は、まず細胞を培養するインキュベーターにルミノメーターの機能を付け、ついで全細胞集団からの発光量を、培養しながらルミノメーターで一定時間ごとに定量する、という手順で行われている。これにより、一定の周期性をもった発現リズムなどを測定することができ、よって、細胞全体におけるルシフェラーゼ遺伝子の発現量の経時的な変化を捉えることができる。
【0011】
しかし、上述した従来のレポーターアッセイでは、細胞周期のステージが異なる複数の細胞が混在しており、様々なステージの細胞を一群のデータとして取り扱っていた。そのため、細胞周期に関わる遺伝子を解析する際は、同調培養などの操作を行って細胞周期のステージを揃えている。
【0012】
[III]従来、標本像の結像倍率を高倍率と低倍率とに切り換えて標本を観察できる顕微鏡装置がよく利用されている。このような顕微鏡装置では、近年、高倍率の対物レンズによって低倍率の観察視野が制限されずに、より広範囲に標本の全体像を把握できるようにした顕微鏡装置が提案されている(たとえば、特許文献2参照)。特許文献2で開示されている顕微鏡装置では、低倍率で標本を観察する場合、高倍率の対物レンズを介さずに、焦点深度が従来よりも深い、すなわち、標本側の開口数(NA;Numerical Aperture)が従来よりも小さい低倍率専用の結像レンズを用いて標本像を結像するようにしている。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開2002−335997号公報
【特許文献2】特開平10−339845号公報
【非特許文献】
【0014】
【非特許文献1】H.J.Kennedy, A.E.Pouli, E.K.Ainscow, L.S.Jouaville, R.Rizzuto, G.A.Rutter, “Glucose generates sub−plasma membrane ATP microdomains in single islet β−cells.”, Journal of Biological Chemistry, vol.274, pp.13281−13291, 1999
【発明の概要】
【発明が解決しようとする課題】
【0015】
[I]しかしながら、従来技術では、細胞内の所定の部位に発光タンパク質が局在しているか否かを、発光量を測定した細胞とは別の細胞で確認しており、しかも蛍光抗体法で確認する際、細胞は死んでしまうので、発光量の測定対象である生きた細胞において、当該細胞内の所定の部位に発光タンパク質が局在しているか否かは必ずしも定かでなく、よって当該細胞からの発光量が所定の部位からの発光量であることも必ずしも明確でない、という問題点があった。
特に、複数の細胞に対する一過性の遺伝子導入の場合、全ての細胞に遺伝子が導入されるわけではないので、発光量の測定対象である生きた細胞と同じものに対して、遺伝子が細胞に導入されたか否かを確認し、遺伝子が導入された細胞内の所定の部位に発光タンパク質が局在するか否かを確認することが必要となる。
【0016】
本発明は、上記問題点に鑑みてなされたものであって、生きたサンプル内の所定の部位からの発光量を測定するにあたって、当該サンプルと同一のものに対して、所定の部位に発光たんぱく質が局在しているか否かを確認することができる所定部位発光量測定方法および所定部位発光量測定装置を提供することを目的とする。
【0017】
[II]しかしながら、従来技術における同調培養の操作は煩雑であるので、実験者にとって作業的に大きな負担となっていた、という問題点があった。
【0018】
本発明は、上記問題点に鑑みてなされたものであって、細胞に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる発現量測定方法を提供することを目的とする。
【0019】
[III]ところで、近年、細胞生物学、分子生物学などの研究分野では、緑色蛍光蛋白質(GFP;Green Fluorescent Protein)や生物発光酵素であるルシフェラーゼ遺伝子を発現のレポーターとして働かせ、細胞内の特定部位や機能蛋白質に蛍光標識や発光標識を付して生体細胞を観察する必要性が高まっている。このような細胞の観察では、通常、発現量の経時変化を捉えるため、時系列に細胞を観察し続ける必要がある。
【0020】
ところが、GFPを用いる観察では、GFPが励起光の照射に応じて蛍光を発する蛋白質であり、GFPを作用させた標本に大きな強度の励起光を照射して蛍光を得るため、標本に損傷を与えやすく、1〜2時間程度の観察が限度である。これに対して、ルシフェラーゼ遺伝子を用いる観察では、ルシフェラーゼ遺伝子が自己発光酵素であり、標本に損傷を与えることがなく、数日〜数週間程度の観察が可能である。このため、ルシフェラーゼ遺伝子を用いて経過観察を行い、この観察結果に応じて適宜にGFPを用いた観察に切り換えるようにして、標本の経時変化を捉えることが所望されている。
【0021】
しかしながら、ルシフェラーゼ遺伝子から発せられる光は極めて微弱なため、GFPからの蛍光を観察する場合などの蛍光観察で通常用いられる高倍率の結像光学系や、標本側および像側のNAが共に小さい従来の低倍率の結像光学系では、ルシフェラーゼ遺伝子からの微弱光を観察することはできず、蛍光観察と微弱光による微弱光観察とを両立する顕微鏡装置はこれまで実現されていない。また、微弱光観察による経過観察の結果に応じて即時に蛍光観察に切り換えられる顕微鏡装置も開発されていない。
【0022】
本発明は、上記に鑑みてなされたものであって、微弱光観察と蛍光観察とを適宜に切り換えることができるとともに、微弱光観察による観察結果に応じて即時に蛍光観察に切り換えることができる測定装置を提供することを目的とする。
【課題を解決するための手段】
【0023】
[I]上述した課題を解決し、目的を達成するために、本発明にかかる所定部位発光量測定方法は、発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定方法であって、前記融合遺伝子は、前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像ステップと、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定ステップと、前記判定ステップの判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定ステップと、を含むことを特徴とする。
【0024】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記融合遺伝子が導入された生きたサンプルが撮像範囲中に複数存在する場合、複数の前記サンプルの発光画像を撮る発光画像撮像ステップと、前記蛍光画像撮像ステップで撮像した蛍光画像および前記発光画像撮像ステップで撮像した発光画像を重ね合わせることで、前記判定ステップの判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定する選定ステップと、をさらに含み、前記蛍光画像撮像ステップは、複数の前記サンプルの蛍光画像を撮り、前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプルごとに判定し、前記発光量測定ステップは、前記選定ステップで選定したサンプルからの発光量を測定すること、を特徴とする。
【0025】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップを繰り返し実行することで、サンプル内の所定の部位からの発光量を経時的に得ること、を特徴とする。
【0026】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記サンプルからの発光を発光色別に分離する発光分離ステップ、をさらに含み、前記サンプルに導入される融合遺伝子は、複数存在し、前記移行塩基配列で移行させる発光タンパク質の移行先の部位と、前記発光タンパク質から発せられる発光の発光色と、前記蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製され、前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、前記発光量測定ステップは、前記判定ステップの判定結果が局在すると判定された場合、前記発光分離ステップで分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定すること、を特徴とする。
【0027】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記サンプルは、試料、組織、細胞、個体のいずれか1つであること、を特徴とする。
【0028】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記発光量測定ステップで測定した発光量に基づいて、前記選定ステップで選定したサンプル内の所定の部位におけるATPを定量するATP定量ステップ、をさらに含み、前記サンプルは細胞であり、前記所定の部位はミトコンドリアであり、前記移行塩基配列はミトコンドリア移行シグナルであり、前記発光タンパク質はルシフェラーゼであり、前記蛍光タンパク質は緑色蛍光タンパク質であり、前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップに加えてさらに前記ATP定量ステップを繰り返し実行することで、サンプル内の所定の部位からのATPを経時的に定量すること、を特徴とする。
【0029】
また、本発明は所定部位発光量測定装置に関するものであり、本発明にかかる所定部位発光量測定装置は、発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定装置であって、前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子を用い、当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像手段と、前記蛍光画像撮像手段で撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定手段と、前記判定手段の判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定手段と、を備えたことを特徴とする。
【0030】
[II]上述した課題を解決し、目的を達成するために、本発明にかかる発現量測定方法は、発光タンパク質を発現する発光関連遺伝子と蛍光タンパク質を発現する蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、細胞から発せられた蛍光の蛍光強度を測定する蛍光測定ステップと、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、前記細胞は、前記発光関連遺伝子、前記蛍光関連遺伝子および前記解析対象の遺伝子に加えてさらに、細胞周期の所定のステージで発現する細胞周期関連遺伝子を導入したものであり、前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定するステージ同定ステップ、をさらに含むことを特徴とする。
【0031】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記細胞が撮像範囲中に複数存在する場合、複数の細胞の蛍光画像を撮像する蛍光画像撮像ステップと、前記複数の細胞の発光画像を撮像する発光画像撮像ステップと、をさらに含み、前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、前記蛍光測定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて、各細胞から発せられた蛍光の蛍光強度をそれぞれ測定し、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、前記ステージ同定ステップは、前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、を特徴とする。
【0032】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、をさらに含み、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、を特徴とする。
【0033】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記蛍光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、を特徴とする。
【0034】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記発現量測定ステップは、前記選択ステップで選択した細胞を対象として、前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定すると共に、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて前記解析対象の遺伝子の細胞内における発現部位を同定すること、を特徴とする。
【0035】
また、本発明は発現量測定方法に関するものであり、本発明にかかる発現量測定方法は、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、前記細胞は、その所定の部位を蛍光物質で染色したものであり、当該細胞の蛍光画像を撮像する蛍光画像撮像ステップと、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを判定することで、細胞周期のステージを同定するステージ同定ステップと、をさらに含むことを特徴とする。
【0036】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記細胞が撮像範囲中に複数存在する場合、複数の細胞の発光画像を撮像する発光画像撮像ステップ、をさらに含み、前記蛍光画像撮像ステップは、前記複数の細胞の蛍光画像を撮像し、前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、前記ステージ同定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、を特徴とする。
【0037】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、をさらに含み、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、を特徴とする。
【0038】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、を特徴とする。
【0039】
[III]上記の目的を達成するために、この発明にかかる測定装置は、微弱光を発する発光標識および励起されて蛍光を発する蛍光標識が付与されて保持手段に保持される標本の標本像を結像する結像光学系と、該標本像を撮像する撮像手段とを備える測定装置において、前記結像光学系は、前記発光標識からの微弱光を前記標本像としての微弱光標本像を結像する微弱光結像光学系と、前記蛍光標識からの蛍光を前記標本像としての蛍光標本像を結像する蛍光結像光学系と、を備え、前記撮像手段は、前記微弱光標本像と前記蛍光標本像とを撮像することを特徴とする。なお、この発明にかかる測定装置は、顕微鏡光学系を有する計測装置を含むものである。
【0040】
また、この発明にかかる測定装置は、上記の発明において、前記蛍光結像光学系は、前記標本を照明する照明手段を備えることを特徴とする。
【0041】
また、この発明にかかる測定装置は、上記の発明において、前記撮像手段によって撮像された微弱光標本像の像特性をもとに、該微弱光標本像の撮像と前記蛍光標本像の撮像とを切り換える制御を行う撮像切換制御手段を備えたことを特徴とする。
【0042】
また、この発明にかかる測定装置は、上記の発明において、前記像特性は、前記微弱光標本像の像強度であり、前記撮像切換制御手段は、前記像強度が所定のしきい値より大きい場合、前記微弱光標本像の撮像から前記蛍光標本像の撮像に切り換えることを特徴とする。
【0043】
また、この発明にかかる測定装置は、上記の発明において、前記像強度は、前記微弱光標本像の全体または部分の像強度であって、所定時点から現時点までの累積の像強度または現時点の像強度であることを特徴とする。
【0044】
また、この発明にかかる測定装置は、上記の発明において、前記蛍光結像光学系は、前記蛍光標識の各点からの蛍光を略平行光束に変換する蛍光対物レンズと、前記蛍光対物レンズによって略平行光束に変換された蛍光を集光して前記蛍光標本像を結像する蛍光結像レンズと、前記蛍光標識を励起する励起光を選択的に透過させる励起光透過フィルター、前記蛍光標識からの蛍光を選択的に透過させる蛍光透過フィルターおよび前記励起光を反射し前記蛍光を透過させるダイクロイックミラーを有し、前記蛍光対物レンズと前記蛍光結像レンズとの間に配置される蛍光ユニットと、前記励起光を発する励起光源を有し、該励起光源からの励起光を前記ダイクロイックミラーによって反射させ前記標本に照射させる励起光照射手段と、を備えたことを特徴とする。
【0045】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系は、前記発光標識の各点からの微弱光を略平行光束に変換する微弱光対物レンズと、前記微弱光対物レンズによって略平行光束に変換された微弱光を集光して前記微弱光標本像を結像する微弱光結像レンズと、を備えたことを特徴とする。
【0046】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して互いに反対側に配置され、前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする。
【0047】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系の各視野を相対的に平行移動させる視野移動手段を備えることを特徴とする。
【0048】
また、この発明にかかる測定装置は、上記の発明において、前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有することを特徴とする。
【0049】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光対物レンズおよび前記蛍光対物レンズは、同一の対物レンズであり、前記微弱光結像光学系および前記蛍光結像光学系は、前記対物レンズを共用することを特徴とする。
【0050】
また、この発明にかかる測定装置は、上記の発明において、前記対物レンズと前記蛍光ユニットとの間の瞳空間に挿脱可能に配置され、該瞳空間に配置された場合、前記対物レンズからの微弱光を前記微弱光結像レンズに向けて反射させるミラーを備え、前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記ミラーを瞳空間に配置するとともに前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記ミラーを瞳空間に未配置にするとともに前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする。
【0051】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有し、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記微弱光結像光学系の視野内に移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記蛍光結像光学系の視野内に移動させる制御を行うことを特徴とする。
【0052】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系の各視野が前記標本を含むように前記微弱光結像光学系および前記蛍光結像光学系を移動させる光学系移動手段を備え、前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記微弱光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該微弱光結像光学系を移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記蛍光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該蛍光結像光学系を移動させる制御を行うことを特徴とする。
【0053】
また、この発明にかかる測定装置は、上記の発明において、前記光学系移動手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野の略中心点を結ぶ線分の中点を通り前記微弱光結像光学系および前記蛍光結像光学系の各光軸に略平行な回転軸を有し、該回転軸を中心に前記微弱光結像光学系および前記蛍光結像光学系を回転移動させることを特徴とする。
【0054】
また、この発明にかかる測定装置は、上記の発明において、前記撮像手段は、前記微弱光標本像を撮像する微弱光撮像手段と、前記蛍光標本像を撮像する蛍光撮像手段と、を備えることを特徴とする。
【0055】
また、この発明にかかる測定装置は、上記の発明において、前記撮像手段は、前記微弱光標本像を撮像する微弱光撮像手段と、前記蛍光標本像を撮像する蛍光撮像手段と、を備え、前記光学系移動手段は、前記微弱光結像光学系および前記微弱光撮像手段と、前記蛍光結像光学系および前記蛍光撮像手段と、をそれぞれ一体に移動させることを特徴とする。
【0056】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光標本像および前記蛍光標本像は、それぞれ前記微弱光結像レンズおよび前記蛍光結像レンズによって略同じ位置に結像され、前記撮像手段は、前記微弱光標本像および前記蛍光標本像が結像される位置に略一致して固定されることを特徴とする。
【0057】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系の少なくとも一方に対応し、前記標本に対して透過照明を行う照明手段を備えることを特徴とする。
【0058】
また、この発明にかかる測定装置は、上記の発明において、前記透過照明は、明視野観察用照明、暗視野観察用照明、微分干渉観察用照明および位相差観察用照明の少なくとも1つであることを特徴とする。
【0059】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系は、該微弱光結像光学系の標本側の開口数をNAoとし、前記微弱光標本像を結像する倍率をβとして、(NAo/β)2によって演算される値が0.01以上(本出願人による特許出願である特願2004−342940を引用。)であることを特徴とする。
【発明の効果】
【0060】
[I]本発明によれば、発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、所定の部位からの発光量を得るにあって、融合遺伝子は、移行塩基配列および発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、当該融合遺伝子が導入されたサンプルの蛍光画像を撮り、撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定し、判定結果が局在すると判定された場合、サンプルからの発光量を測定する。これにより、生きたサンプル内の所定の部位からの発光量を測定するにあたって、当該サンプルと同一のものに対して、所定の部位に発光たんぱく質が局在しているか否かを確認することができる、という効果を奏する。
【0061】
また、本発明によれば、融合遺伝子が導入された生きたサンプルが撮像範囲中に複数存在する場合、複数のサンプルの蛍光画像を撮り、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプルごとに判定し、複数のサンプルの発光画像を撮り、撮像した蛍光画像および撮像した発光画像を重ね合わせることで、判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定し、選定したサンプルからの発光量を測定する。これにより、複数のサンプルの中から個々のサンプルを識別し、単一のサンプル内の所定の部位からの発光量を測定することができる、という効果を奏する。
【0062】
また、本発明によれば、蛍光画像の撮像、局在の判定、発光画像の撮像、測定対象のサンプルの選定、発光量の測定を繰り返し実行することで、サンプル内の所定の部位からの発光量を経時的に得る。これにより、サンプル内の所定の部位における発光量の変動を経時的に測定することができる、という効果を奏する。
【0063】
また、本発明によれば、サンプルに導入される融合遺伝子は、複数存在し、移行塩基配列で移行させる発光タンパク質の移行先の部位と、発光タンパク質から発せられる発光の発光色と、蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製され、サンプルからの発光を発光色別に分離し、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、判定結果が局在すると判定された場合、分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定する。これにより、例えば、1つのサンプル内の複数の部位からの発光量を同時に測定することができる、という効果を奏する。
【0064】
また、本発明によれば、サンプルは、試料、組織、細胞、個体のいずれか1つであるので、様々なサンプルを対象とすることができる、という効果を奏する。
【0065】
また、本発明によれば、サンプルは細胞であり、所定の部位はミトコンドリアであり、移行塩基配列はミトコンドリア移行シグナルであり、発光タンパク質はルシフェラーゼであり、蛍光タンパク質は緑色蛍光タンパク質であり、測定した発光量に基づいて、選定したサンプル内の所定の部位におけるATPを定量し、蛍光画像の撮像、局在の判定、発光画像の撮像、測定対象のサンプルの選定、発光量の測定に加えてさらにATPの定量を繰り返し実行することで、サンプル内の所定の部位からのATPを経時的に定量する。これより、特定の細胞内のミトコンドリアにおけるATP量の変動を経時的に測定することができる、という効果を奏する。
【0066】
[II]本発明によれば、発光タンパク質を発現する発光関連遺伝子と蛍光タンパク質を発現する蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定し、細胞から発せられた蛍光の蛍光強度を測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定するにあたって、細胞は、発光関連遺伝子、蛍光関連遺伝子および解析対象の遺伝子に加えてさらに、細胞周期の所定のステージで発現する細胞周期関連遺伝子を導入したものであり、発現量の測定で発光強度を用いた場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、発現量の測定で蛍光強度を用いた場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定する。これにより、細胞に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに当該細胞に対して細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができる、という効果を奏する。具体的には、細胞周期との直接の関与が不明である解析対象の遺伝子に関して、薬剤投与や温度変化などの刺激で引き起こされる発現量の変化を細胞周期のステージと共に得ることができるので、当該解析対象の遺伝子と細胞周期との関与を検証することができる、という効果を奏する。また、細胞周期との直接の関与が示唆される解析対象の遺伝子に関して、当該解析対象の遺伝子の発現量と細胞周期のステージとを一緒に取得することができるので、当該解析対象の遺伝子が細胞周期マーカーとして有用であるか否かを評価することができる、という効果を奏する。
【0067】
また、本発明によれば、細胞が撮像範囲中に複数存在する場合、複数の細胞の蛍光画像を撮像し、複数の細胞の発光画像を撮像し、撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、撮像した蛍光画像に基づいて、各細胞から発せられた蛍光の蛍光強度をそれぞれ測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を細胞ごとに測定し、発現量の測定で発光強度を用いる場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定し、発現量の測定で蛍光強度を用いる場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定する。これにより、複数の細胞を対象として、解析対象の遺伝子の発現量を細胞ごとに測定すると共に、細胞周期のステージを細胞ごとに同定することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を細胞ごとに評価することができる、という効果を奏する。
【0068】
また、本発明によれば、ステージが同定された細胞の中から測定対象の細胞を選択し、測定した発光強度または測定した蛍光強度に基づいて、選択した細胞に導入された解析対象の遺伝子の発現量を測定する。これにより、複数の細胞の中から個々の細胞を識別し、単一の細胞を対象として、解析対象の遺伝子の発現量を測定すると共に、細胞周期のステージを同定することができる、という効果を奏する。
【0069】
また、本発明によれば、発光画像の撮像、蛍光画像の撮像、発光強度の測定、蛍光強度の測定、ステージの同定、細胞の選択、発現量の測定を繰り返し実行することで、選択した細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定する。これにより、単一の細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量の変動を経時的に測定することができる、という効果を奏する。
【0070】
また、本発明によれば、発現量の測定において、選択された細胞を対象として、測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、撮像した蛍光画像に基づいて解析対象の遺伝子の細胞内における発現部位を同定する。これにより、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができるだけでなく、解析対象の遺伝子の細胞内における発現部位を得ることができる、という効果を奏する。
【0071】
また、本発明によれば、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を測定するにあたって、細胞は、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色したものであり、当該細胞の蛍光画像を撮像し、撮像した蛍光画像に基づいて細胞の形状が変化したか否かを判定することで、細胞周期のステージを同定する。これにより、細胞に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに当該細胞に対して細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができる、という効果を奏する。具体的には、細胞周期との直接の関与が不明である解析対象の遺伝子に関して、薬剤投与や温度変化などの刺激で引き起こされる発現量の変化を細胞周期のステージと共に得ることができるので、当該解析対象の遺伝子と細胞周期との関与を検証することができる、という効果を奏する。また、細胞周期との直接の関与が示唆される解析対象の遺伝子に関して、当該解析対象の遺伝子の発現量と細胞周期のステージとを一緒に取得することができるので、当該解析対象の遺伝子が細胞周期マーカーとして有用であるか否かを評価することができる、という効果を奏する。
【0072】
また、本発明によれば、細胞が撮像範囲中に複数存在する場合、複数の細胞の発光画像を撮像し、複数の細胞の蛍光画像を撮像し、撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を細胞ごとに測定し、撮像した蛍光画像に基づいて細胞の形状が変化したか否かを細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定する。これにより、複数の細胞を対象として、解析対象の遺伝子の発現量を細胞ごとに測定すると共に、細胞周期のステージを細胞ごとに同定することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を細胞ごとに評価することができる、という効果を奏する。
【0073】
また、本発明によれば、ステージが同定された細胞の中から測定対象の細胞を選択し、測定した発光強度に基づいて、選択した細胞に導入された解析対象の遺伝子の発現量を測定する。これにより、複数の細胞の中から個々の細胞を識別し、単一の細胞を対象として、解析対象の遺伝子の発現量を測定すると共に、細胞周期のステージを同定することができる、という効果を奏する。
【0074】
また、本発明によれば、発光画像の撮像、蛍光画像の撮像、発光強度の測定、ステージの同定、細胞の選択、発現量の測定を繰り返し実行することで、選択した細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定する。これにより、単一の細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量の変動を経時的に測定することができる、という効果を奏する。
【0075】
[III]本発明にかかる測定装置によれば、微弱光観察と蛍光観察とを保持手段に保持されている同一の標本に対して個別に実行することができるとともに、微弱光観察による観察結果に応じて即時に蛍光観察に切り換えることができる。
【図面の簡単な説明】
【0076】
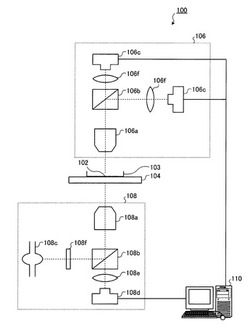
【図1】図1は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図2】図2は、所定部位発光量測定装置100の発光画像撮像ユニット106の構成の一例を示す図である。
【図3】図3は、所定部位発光量測定装置100の発光画像撮像ユニット106の構成の別の一例を示す図である。
【図4】図4は、所定部位発光量測定装置100の情報通信端末110の構成の一例を示すブロック図である。
【図5】図5は、所定部位発光量測定装置100で行われる処理の一例を示すフローチャートである。
【図6】図6は、蛍光画像撮像ユニット108で撮像した明視野像および蛍光像の一例を示す図である。
【図7】図7は、発光画像撮像ユニット106で撮像した明視野像および蛍光像の一例を示す図である。
【図8】図8は、発光画像撮像ユニット106および蛍光画像撮像ユニット108で撮像した重ね合わせ画像の一例を時系列で示す図である。
【図9】図9は、特定した細胞の発光強度の経時的変動の一例を示す図である。
【図10】図10は、GFP‐ミトコンドリア移行シグナル‐ルシフェラーゼを融合したプラスミドベクターを示す図である。
【図11】図11は、蛍光画像撮像ユニット108で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および蛍光像を示す図である。
【図12】図12は、発光画像撮像ユニット106で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および発光像を示す図である。
【図13】図13は、特定したHeLa細胞の発光強度の経時的変動を示す図である。
【図14】図14は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図15】図15は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図16】図16は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図17】図17は、EGFP−Luc遺伝子を導入したHeLa細胞の蛍光画像を示す図である。
【図18】図18は、EGFP−Luc遺伝子を導入したHeLa細胞の明視野画像と蛍光画像とを重ね合わせた画像を示す図である。
【図19】図19は、EGFP−Luc遺伝子を導入したHeLa細胞の発光画像を示す図である。
【図20】図20は、発現量測定装置1000の全体構成の一例を示す図である。
【図21】図21は、発現量測定装置1000の発光画像撮像ユニット1060の構成の一例を示す図である。
【図22】図22は、発現量測定装置1000の発光画像撮像ユニット1060の構成の別の一例を示す図である。
【図23】図23は、発現量測定装置1000の情報通信端末1100の構成の一例を示すブロック図である。
【図24】図24は、発現量測定装置1000で行われる処理の一例を示すフローチャートである。
【図25】図25は、本発明の実施の形態1にかかる顕微鏡装置の構成を示す図である。
【図26】図26は、図25に示した顕微鏡装置が微弱光観察と蛍光観察とを切り換える撮像切換処理の処理手順を示すフローチャートである。
【図27】図27は、本発明の実施の形態2にかかる顕微鏡装置の構成を示す図である。
【図28】図28は、本発明の実施の形態2にかかる顕微鏡装置の変形例の構成を示す図である。
【図29】図29は、本発明の実施の形態3にかかる顕微鏡装置の構成を示す図である。
【図30】図30は、本発明の実施の形態4にかかる顕微鏡装置の構成を示す図である。
【図31】図31は、本発明の実施の形態5にかかる顕微鏡装置の構成を示す図である。
【図32】図32は、本発明の実施の形態5にかかる顕微鏡装置の変形例の構成を示す図である。
【図33】図33は、本発明の実施の形態5にかかる顕微鏡装置の変形例の構成を示す図である。
【図34】図34は、本発明の実施の形態5にかかる顕微鏡装置の変形例の構成を示す図である。
【発明を実施するための形態】
【0077】
[I]以下に、本発明にかかる所定部位発光量測定方法および所定部位発光量測定装置の実施の形態を図面に基づいて詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。
【0078】
まず、本発明を実現する所定部位発光量測定装置100の構成について、図1〜図3を参照して説明する。図1は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【0079】
図1に示すように、所定部位発光量測定装置100は、サンプル102と、サンプル102を収納した容器103(具体的にはシャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体など)と、容器103を配置するステージ104と、発光画像撮像ユニット106と、蛍光画像撮像ユニット108と、情報通信端末110と、で構成されている。また、所定部位発光量測定装置100において、発光画像撮像ユニット106に含まれる対物レンズ106aと蛍光画像撮像ユニット108に含まれる対物レンズ108aとは、図示の如く、サンプル102、容器103およびステージ104を挟んで上下の対向する位置に配置される。なお、図14に示すように、発光画像撮像ユニット106および蛍光画像撮像ユニット108の配置を入れ替えてもよい。蛍光よりも微弱な発光を測定するための発光画像撮像ユニット106を下側に配置することにより、カバー開閉によるサンプル上方からの外乱光を完全に遮断できて発光画像のS/N比を増すことができる。発光画像撮像ユニット106と別体の蛍光画像撮像ユニット108は、レーザー走査式の光学系であってもよい。
【0080】
再び図1に戻り、サンプル102は、発光タンパク質をサンプル102内の所定の部位(例えば、ミトコンドリアや細胞質、核など)に移行させる移行塩基配列および当該発光タンパク質を発現する発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子を導入したものである。また、サンプル102は、生きたものであり、例えば、試料、組織、細胞、個体などである。なお、サンプル102は、具体的には、当該融合遺伝子が入ったプラスミドベクターを導入したものでもよい。
【0081】
発光画像撮像ユニット106は、具体的には正立型の発光顕微鏡であり、サンプル102の発光画像を撮像する。発光画像撮像ユニット106は、図示の如く、対物レンズ106aと、ダイクロイックミラー106bと、CCDカメラ106cと、結像レンズ106fと、で構成されている。対物レンズ106aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー106bは、サンプル102から発せられた発光を色別に分離し、2色の発光を用いて発光量を色別に測定する場合に用いる。CCDカメラ106cは、対物レンズ106a、ダイクロイックミラー106bおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影されたサンプル102の発光画像および明視野画像を撮る。また、CCDカメラ106cは、情報通信端末110と有線または無線で通信可能に接続される。ここで、サンプル102が撮像範囲中に複数存在する場合、CCDカメラ106cは、当該撮像範囲中に含まれる複数のサンプル102の発光画像および明視野画像を撮像してもよい。結像レンズ106fは、対物レンズ106aおよびダイクロイックミラー106bを介して当該結像レンズ106fに入射した像(具体的にはサンプル102を含む像)を結像する。なお、図1では、ダイクロイックミラー106bで分離した2つの発光に対応する発光画像を2台のCCDカメラ106cで別々に撮像する場合の一例を示しており、1つの発光を用いる場合には、発光画像撮像ユニット106は、対物レンズ106a、1台のCCDカメラ106cおよび結像レンズ106fで構成されてもよい。
【0082】
ここで、2色の発光を用いて発光量を色別に測定する場合、発光画像撮像ユニット106は、図2に示すように、対物レンズ106aと、CCDカメラ106cと、スプリットイメージユニット106dと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、スプリットイメージユニット106dおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影されたサンプル102の発光画像(スプリットイメージ)および明視野像を撮像してもよい。スプリットイメージユニット106dは、サンプル102から発せられた発光を色別に分離し、ダイクロイックミラー106bと同様、2色の発光を用いて発光量を色別に測定する場合に用いる。
【0083】
また、複数色の発光を用いて発光量を色別に測定する場合(つまり、多色の発光を用いる場合)、発光画像撮像ユニット106は、図3に示すように、対物レンズ106aと、CCDカメラ106cと、フィルターホイール106eと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、フィルターホイール106eおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影されたサンプル102の発光画像および明視野画像を撮像してもよい。フィルターホイール106eは、サンプル102から発せられた発光をフィルター交換によって色別に分離し、複数色の発光を用いて発光量を色別に測定する場合に用いる。
【0084】
再び図1に戻り、蛍光画像撮像ユニット108は、具体的には倒立型の蛍光顕微鏡であり、サンプル102の蛍光画像を撮像する。蛍光画像撮像ユニット108は、図示の如く、対物レンズ108aと、ダイクロイックミラー108bと、光源108cと、CCDカメラ108dと、結像レンズ108eと、シャッター108fと、で構成されている。対物レンズ108aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー108bは、サンプル102からの蛍光を透過するとともに、光源108cから照射された励起光がサンプル102へ照射されるように励起光の方向を変える。光源108cは、励起光を照射するためのものであり、具体的には、キセノンランプ、ハロゲン等のランプ、レーザー、LEDなどである。CCDカメラ108dは、対物レンズ108a、ダイクロイックミラー108bおよび結像レンズ108eを介して当該CCDカメラ108dのチップ面に投影されたサンプル102の蛍光画像および明視野画像を撮る。また、CCDカメラ108dは、情報通信端末110と有線または無線で通信可能に接続される。ここで、サンプル102が撮像範囲中に複数存在する場合、CCDカメラ108dは、当該撮像範囲中に含まれる複数のサンプル102の蛍光画像および明視野画像を撮像してもよい。結像レンズ108eは、対物レンズ108aおよびダイクロイックミラー108bを介して当該結像レンズ108eに入射した像(具体的にはサンプル102を含む像)を結像する。シャッター108fは、光源108cから照射された励起光を切り替える。換言すると、シャッター108fは、光源108cから照射された励起光を透過したり遮断したりすることで、サンプル102への励起光の照射を切り替える。
【0085】
ここで、発光画像撮像ユニット106および蛍光画像撮像ユニット108は、具体的には、それぞれ倒立型の発光顕微鏡および倒立型の蛍光顕微鏡でもよく、ステージ104は回転するものでもよい。
【0086】
また、図1および図14に示した所定部位発光量測定装置100は発光画像撮像ユニット106と蛍光画像撮像ユニット108とを別々に備えた構成であったが、所定部位発光量測定装置100は、図15に示すように、蛍光画像撮像ユニット108のみを備えた構成であってもよい。換言すると、所定部位発光量測定装置100は、蛍光画像撮像ユニット108のみで蛍光観察と発光観察の両方を行う構成であってもよい。なお、図15に示す所定部位発光量測定装置100で蛍光・発光観察を行う場合、所定部位発光量測定装置100は、発光画像を撮像する(発光検出を行う)際に、シャッター108fの切り替えを自動又は手動で行うと共にダイクロイックミラー108bを光路(図15中の点線)から外れた位置まで自動又は手動で移動することが可能な構成であることが好ましい。これにより、発光画像中のノイズを減らすことができる。また、図15に示す所定部位発光量測定装置100の場合、対物レンズ108aは、具体的には、“(開口数/倍率)2の値が0.01以上”という条件を満たすものであることが好ましい。
また、所定部位発光量測定装置100は、図16に示すように、励起光の照射をサンプル102の上方から行い且つ蛍光・発光観察をサンプル102の下方から行う構成であってもよい。ここで、図16に示す所定部位発光量測定装置100の構成のうち、これまで説明してない構成のみを説明する。励起用分光フィルター108gは、光源108cから発せられた励起光を、波長領域の異なる複数の励起光に分離する。光ファイバー108hは、励起用分光フィルター108gで分離した各励起光をサンプル102へ導く。コンデンサーレンズ108iは、サンプル102を均等に照明するために用いるレンズであり、光ファイバー108hにより導かれた各励起光を集光する。発光・蛍光分光用フィルター108jは、サンプル102から放出された蛍光や発光を、強度や波長などの違いで分離する。なお、図16に示す所定部位発光量測定装置100の場合、対物レンズ108aは、具体的には、“(開口数/倍率)2の値が0.01以上”という条件を満たすものであることが好ましい。
【0087】
再び図1に戻り、情報通信端末110は、具体的にはパーソナルコンピュータである。そして、情報通信端末110は、図4に示すように、大別して、制御部112と、システムの時刻を計時するクロック発生部114と、記憶部116と、通信インターフェース部118と、入出力インターフェース部120と、入力部122と、出力部124と、で構成されており、これら各部はバスを介して接続されている。
【0088】
記憶部116は、ストレージ手段であり、具体的には、RAMやROM等のメモリ装置、ハードディスクのような固定ディスク装置、フレキシブルディスク、光ディスク等を用いることができる。そして、記憶部116は制御部112の各部の処理により得られたデータなどを記憶する。
【0089】
通信インターフェース部118は、情報通信端末110と、CCDカメラ106cおよびCCDカメラ108dと、の間における通信を媒介する。すなわち、通信インターフェース部118は他の端末と有線または無線の通信回線を介してデータを通信する機能を有する。
【0090】
入出力インターフェース部120は、入力部122や出力部124に接続する。ここで、出力部124には、モニタ(家庭用テレビを含む)の他、スピーカやプリンタを用いることができる(なお、以下で、出力部124をモニタとして記載する場合がある。)。また、入力部122には、キーボードやマウスやマイクの他、マウスと協働してポインティングデバイス機能を実現するモニタを用いることができる。
【0091】
制御部112は、OS(Operating System)等の制御プログラムや各種の処理手順等を規定したプログラムや所要データを格納するための内部メモリを有し、これらのプログラムに基づいて種々の処理を実行する。そして、制御部102は、大別して、蛍光画像撮像指示部112aと、蛍光画像取得部112bと、判定部112cと、発光画像撮像指示部112dと、発光画像取得部112eと、選定部112fと、発光量測定部112gと、関連物質定量部112hと、で構成されている。
【0092】
蛍光画像撮像指示部112aは、通信インターフェース部116を介して、CCDカメラ108dへ蛍光画像および明視野画像の撮像を指示する。蛍光画像取得部112bは、CCDカメラ108dで撮像した蛍光画像および明視野画像を、通信インターフェース部116を介して取得する。
【0093】
判定部112cは、蛍光画像取得部112bで取得した蛍光画像および明視野画像に基づいて、サンプル102に融合遺伝子が導入されたか否かを判定したり、所定の部位に発光タンパク質が局在するか否かを判定したりする。ここで、蛍光画像取得部112bで取得した蛍光画像および明視野画像に複数のサンプル102が存在する場合、判定部112cは、蛍光画像および明視野画像に基づいて、サンプル102に融合遺伝子が導入されたか否かをサンプル102ごとに判定したり、所定の部位に発光タンパク質が局在するか否かをサンプル102ごとに判定したりしてもよい。
【0094】
発光画像撮像指示部112dは、通信インターフェース部116を介して、CCDカメラ106cへ発光画像および明視野画像の撮像を指示する。発光画像取得部112eは、CCDカメラ106cで撮像した発光画像および明視野画像を、通信インターフェース部116を介して取得する。
【0095】
選定部112fは、蛍光画像取得部112bで取得した蛍光画像および明視野画像ならびに発光画像撮像取得部112eで取得した発光画像および明視野画像を重ね合わせることで、判定部112cの判定結果が局在すると判定されたサンプル102の中から測定対象のサンプル102を選定する。
【0096】
発光量測定部112gは、判定部112cの判定結果が局在すると判定されたサンプル102や選定部112fで選定したサンプル102からの発光量を発光画像に基づいて測定する。関連物質定量部112hは、発光量測定部112gで測定した発光量に基づいて、当該発光量の増減に対して直接的または間接的に関連する物質の量を定量する。例えば、発光タンパク質がルシフェラーゼの場合、関連物質定量部112hは、例えば当該ルシフェラーゼの発光量の増減に対して直接的に関連する物質であるATPの量を定量する。つまり、関連物質定量部112hは、発光量測定部112gで測定した発光量に基づいてATPを定量するATP定量手段として用いることができる。
【0097】
以上の構成において、所定部位発光量測定装置100で行われる処理の一例を、図5を参照して説明する。なお、以下では、複数のサンプル102に同じ融合遺伝子を導入して、複数のサンプル102のうち特定のサンプル102における所定の部位での発光量を経時的に測定する場合の処理の一例について説明する。
【0098】
まず、情報通信端末110は、蛍光画像撮像指示部110aの処理で、通信インターフェース部116を介して、CCDカメラ108dへ蛍光画像および明視野画像の撮像を指示する(ステップSA−1)。つぎに、CCDカメラ108dは、撮像範囲中に存在する複数のサンプル102の蛍光画像および明視野画像を撮像し、(ステップSA−2:図6参照)、情報通信端末110へ送信する(ステップSA−3)。なお、励起光は蛍光画像を撮像する時のみサンプル102へ照射する。つぎに、情報通信端末110は、蛍光画像取得部112bの処理で、CCDカメラ108dで撮像した蛍光画像および明視野画像を、通信インターフェース部116を介して取得し、記憶部116の所定の記憶領域に記憶する(ステップSA−4)。
【0099】
つぎに、情報通信端末110は、判定部112cの処理で、蛍光画像と明視野画像とを比較することで、融合遺伝子が導入されているか否かをサンプル102ごとに判定し、導入されていると判定されたサンプル102に対してさらに当該サンプル102の所定の部位に発光タンパク質が局在するか否かを判定する(ステップSA−5)。これにより、図6に示すように、例えば、複数のサンプル102(細胞1〜細胞5)の中から、遺伝子が導入され、且つ所定の部位に発光タンパク質が局在しているもの(細胞1)を確認することができる。
【0100】
つぎに、遺伝子が導入され、且つ所定の部位に発光タンパク質が局在しているサンプル102が存在した場合(ステップSA−6:Yes)、情報通信端末110は、発光画像撮像指示部112dの処理で、通信インターフェース部116を介して、CCDカメラ106cに対して発光画像および明視野画像の撮像を指示する(ステップSA−7)。つぎに、CCDカメラ106cは、撮像範囲中に存在する複数のサンプル102の発光画像および明視野画像を撮像し(ステップSA−8:図7参照)、情報通信端末110へ送信する(ステップSA−9)。なお、図7に示した発光画像では、細胞2の発光が最も強い場合を一例として示している。
【0101】
つぎに、情報通信端末110は、発光画像取得部112eの処理で、CCDカメラ106cで撮像した発光画像および明視野画像を、通信インターフェース部116を介して取得すると共に、制御部112の処理で、クロック発生部114から時刻(後述する図8におけるT1に対応)を取得し、発光画像および明視野画像と時刻とを、既に記憶されている蛍光画像および明視野画像とさらに対応付けて記憶部116の所定の記憶領域に記憶する(ステップSA−10)。
【0102】
つぎに、情報通信端末110は、選定部112fの処理で、明視野画像、蛍光画像および発光画像を重ね合わせることで、判定部112cの判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定(特定)する(ステップSA−11)。なお、図6に示した例では、遺伝子が導入され、且つ所定の部位に発光タンパク質が局在している細胞は細胞1のみであるので、ステップSA−11では、図8に示すように、自動的に細胞1が特定される。
【0103】
つぎに、情報通信端末110は、発光量測定部112gの処理で、選定したサンプル102に対応する発光量(発光強度)を発光画像に基づいて測定し、選定したサンプル102(例えば図8における細胞1)を識別する識別情報と当該発光量とを、既に記憶されている蛍光画像、発光画像、明視野画像および時刻とさらに対応付けて記憶部116の所定の記憶領域に記憶する(ステップSA−12)。
【0104】
そして、情報通信端末110は、制御部112の処理で、上述したステップSA−1〜ステップSA−12を、例えば予め設定した時間間隔で所定の回数繰り返し実行する(SA−13)ことで、図9に示すように、選定したサンプル102(例えば、図6、図7および図8に示す細胞1)内の所定の部位における発光量の変動を、経時的(例えば、図8および図9に示す時刻T1〜T4ごと)に得る。
【0105】
以上、詳細に説明したように、所定部位発光量測定装置100によれば、サンプル102に導入する融合遺伝子は、移行塩基配列および発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、当該融合遺伝子が導入されたサンプル102の蛍光画像を撮り、撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定し、判定結果が局在すると判定された場合、サンプル102からの発光量を測定する。これにより、生きたサンプル102内の所定の部位からの発光量を測定するにあたって、当該サンプル102と同一のものに対して、所定の部位に発光たんぱく質が局在しているか否かを確認することができる。また、融合遺伝子が導入された生きたサンプルに対し発光タンパク質の局在を確認すると共に、当該サンプルからの発光量を測定するので、サンプルからの発光量は所定の部位からの発光量に明確に対応しており、測定した発光量が所定の部位からのものであることの信頼性を確保することができる。なお、サンプル102が例えば細胞の場合、発光成分を取り込んでいない細胞をカウントせずに、正確な統計解析が可能である。また、所定部位発光量測定装置100は、例えば、各種反応(例えば薬物刺激や光照射など)の検査や治療などに好適に用いることができる。
【0106】
また、所定部位発光量測定装置100によれば、融合遺伝子が導入された生きたサンプル102が撮像範囲中に複数存在する場合、複数のサンプル102の蛍光画像を撮り、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプル102ごとに判定し、複数のサンプル102の発光画像を撮り、撮像した蛍光画像および撮像した発光画像を重ね合わせることで、判定結果が局在すると判定されたサンプル102の中から測定対象のサンプル102を選定し、選定したサンプル102からの発光量を測定する。これにより、複数のサンプル102の中から個々のサンプル102を識別し、単一のサンプル102内の所定の部位からの発光量を測定することができる。また、蛍光および発光を画像で取得することで、測定対象のサンプル102と同一のサンプル102における発光タンパク質の局在と、当該サンプル102から発せられる発光強度と、を得ることができる。そのため、遺伝子の導入効率や細胞周期による個々の細胞の生理的な状態の違いの影響を排除した解析を行うことができる。ここで、本実施の形態の所定部位発光量測定装置100では、図5に示すように、一例として、蛍光画像を撮像した後、発光タンパク質が所定の部位に局在しているか否かの判定を行い、そして、局在すると判定された場合に発光画像を撮像する、という処理を行なっているが、発光画像の撮像は、蛍光画像の撮像とともに行なってもよい。換言すると、所定部位発光量測定装置100は、蛍光画像および発光画像を撮像した後、局在の判定を行なってもよい。具体的には、所定部位発光量測定装置100は、融合遺伝子が導入された生きたサンプル102が撮像範囲中に複数存在する場合、複数のサンプル102について、蛍光画像および発光画像を撮り、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプル102ごとに判定し、撮像した蛍光画像および撮像した発光画像を重ね合わせることで、判定結果が局在すると判定されたサンプル102の中から測定対象のサンプル102を選定し、選定したサンプル102からの発光量を測定してもよい。
【0107】
さらに、所定部位発光量測定装置100によれば、蛍光画像の撮像、局在の判定、発光画像の撮像、測定対象のサンプル102の選定、発光量の測定を繰り返し実行することで、サンプル102内の所定の部位からの発光量を経時的に得る。これにより、例えば特定のサンプル102内の所定の部位における発光量の変動を経時的に測定することができる。
【0108】
ここで、所定部位発光量測定装置100において、サンプルに導入される融合遺伝子は、複数存在し、移行塩基配列で移行させる発光タンパク質の移行先の部位と、発光タンパク質から発せられる発光の発光色と、蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製されたものでもよい。そして、この場合、所定部位発光量測定装置100は、サンプル102からの発光を発光色別に分離し、撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、判定結果が局在すると判定された場合、分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定してもよい。これにより、例えば、1つのサンプル102内の複数の部位からの発光量を同時に測定することができたり、サンプル102内の複数の部位からの発光量をサンプル102ごとに同時に測定することができたりする。
具体的には、サンプル102が細胞である場合、細胞に導入される融合遺伝子を2つ作製し、1つは、ミトコンドリア移行シグナルで移行させる緑色ルシフェラーゼの移行先の部位であるミトコンドリアと、緑色ルシフェラーゼから発せられる発光の発光色(緑色)と、GFPから発せられる蛍光の蛍光色(緑色)と、の組み合わせで作製され、残りの1つは、細胞質で発現させる赤色ルシフェラーゼから発せられる発光の発光色(赤色)と、CFPから発せられる蛍光の蛍光色(シアン)と、の組み合わせで作製されてもよい。そして、この場合、所定部位発光量測定装置100は、細胞からの発光を発光色別(緑色、赤色)に分離し、撮像した蛍光画像に基づいて、ミトコンドリアに緑色ルシフェラーゼが局在するか否かをGFPから発せられる蛍光色(緑色)で判定し、細胞質に赤色ルシフェラーゼが局在するか否かをCFPから発せられる蛍光色(シアン)で判定し、判定結果が局在すると判定された場合、分離した2つの発光(緑色、赤色)のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定してもよい。換言すると、細胞内のミトコンドリアに対しては、移行塩基配列としてミトコンドリア移行シグナル、発光タンパク質として緑色ルシフェラーゼ、蛍光タンパク質としてGFPを選択し、一方、当該細胞内の細胞質に対しては、移行塩基配列は用いず、発光タンパク質として赤色ルシフェラーゼ、蛍光タンパク質としてCFPを選択し、ミトコンドリアと細胞質での発光量(さらにはATP量など)の変動を発光強度の変化として個別に且つ同時に測定してもよい。
【0109】
また、所定部位発光量測定装置100において、測定した発光量に基づいて、当該発光量の増減に対して直接的または間接的に関連する物質の量を定量してもよい。具体的には、発光タンパク質がルシフェラーゼの場合、例えば当該ルシフェラーゼの発光量の増減に対して直接的に関連する物質であるATPの量を定量してもよい。これにより、特定のサンプル102内の所定の部位における関連物質(例えばATPなど)の量の変動を例えば経時的に測定することができる。
【0110】
また、他の実施の形態として、例えば、細胞周期ごとに発現量及び/又は局在部位が変化するような蛍光タンパク質および発光タンパク質を含む細胞を作製し、当該細胞から発せられる蛍光および発光を経時的に測定することで、細胞周期を、蛍光タンパク質の発現量及び/又は局在部位の変化で確認するとともに細胞の発光量の変動を経時的に測定してもよい。
また、複数の神経細胞を対象とした場合、神経細胞に導入する融合遺伝子として、発光タンパク質を発現する発光関連遺伝子、当該発光タンパク質を別の神経細胞へ移行させる移行塩基配列および蛍光タンパク質を発現する蛍光関連遺伝子を融合したものを作製し、当該融合遺伝子が導入された神経細胞から別の神経細胞へ発光タンパク質が移行する過程を、神経細胞から発せられる蛍光色で確認し、当該移行する過程における神経細胞における発光量の変動を経時的に測定してもよい。
【0111】
(付記)蛍光タンパク質を発現する蛍光関連遺伝子および発光タンパク質を発現する発光関連遺伝子を融合した融合遺伝子を導入したサンプルから発せられる蛍光の蛍光強度を測定する蛍光測定ステップと、
前記蛍光測定ステップで測定した蛍光強度に基づいてサンプルの位置を特定する位置特定ステップと、
当該サンプルから発せられる発光の発光強度を測定する発光測定ステップと、
前記発光測定ステップで測定した発光強度に基づいて発光量を定量する発光量定量ステップと、
を含むことを特徴とする蛍光・発光測定方法。
【0112】
[II]以下に、本発明にかかる発現量測定方法の実施の形態を図面に基づいて詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。
【0113】
まず、本発明を実施するための装置である発現量測定装置1000の構成について、図20〜図22を参照して説明する。図20は、発現量測定装置1000の全体構成の一例を示す図である。
【0114】
図20に示すように、発現量測定装置1000は、細胞1020と、細胞1020を収納した容器1030(具体的にはシャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体など)と、容器1030を配置するステージ1040と、発光画像撮像ユニット1060と、蛍光画像撮像ユニット1080と、情報通信端末1100と、で構成されている。また、発現量測定装置1000において、発光画像撮像ユニット1060に含まれる対物レンズ1060aと蛍光画像撮像ユニット1080に含まれる対物レンズ1080aとは、図示の如く、細胞1020、容器1030およびステージ1040を挟んで上下の対向する位置に配置される。なお、発光画像撮像ユニット1060および蛍光画像撮像ユニット1080の配置を入れ替えてもよい。
【0115】
細胞1020は、発光タンパク質(具体的にはルシフェラーゼ)を発現する発光関連遺伝子、蛍光タンパク質(具体的にはGFP)を発現する蛍光関連遺伝子および解析対象の遺伝子に加えてさらに、細胞周期における所定のステージで発現する細胞周期関連遺伝子を導入した生きたものである。ここで、本明細書において発光とは、生物発光および化学発光を含む概念である。
なお、細胞1020は、発光関連遺伝子と蛍光関連遺伝子と解析対象の遺伝子と細胞周期関連遺伝子とを融合した融合遺伝子を導入した生きたものでもよい。具体的には、細胞1020は、発光関連遺伝子と蛍光関連遺伝子と解析対象の遺伝子と細胞周期関連遺伝子とを融合したベクターを導入した生きたものでもよい。また、細胞1020に対し発光関連遺伝子または蛍光関連遺伝子と組み合わせて導入する解析対象の遺伝子の数は複数でもよい。換言すると、細胞1020に対し解析対象の遺伝子と発光関連遺伝子または蛍光関連遺伝子との組を複数導入してもよい。これにより、細胞周期のステージを同定すると共に、細胞1020に導入した複数の解析対象の遺伝子の発現量を一緒に測定することができる。
【0116】
ここで、蛍光で細胞周期のステージを同定し、発光で解析対象の遺伝子の発現量を測定する場合、細胞1020は、蛍光関連遺伝子と細胞周期関連遺伝子とを関連付けて導入すると共に、発光関連遺伝子と解析対象の遺伝子とを関連付けて導入した生きたものでもよい。具体的には、細胞1020は、蛍光関連遺伝子と細胞周期関連遺伝子とを融合したベクター(蛍光関連遺伝子導入ベクター)を導入すると共に、発光関連遺伝子と解析対象の遺伝子とを融合したベクター(発光関連遺伝子導入ベクター)を導入した生きたものでもよい。また、細胞周期関連遺伝子プロモーターを導入したベクターを細胞1020に導入してもよい。具体的には、細胞周期マーカーとして知られているCyclin B1プロモーターを導入したGFPセンサー(アマシャムバイオサイエンス社製)を細胞1020に導入してもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020を蛍光標識してもよい。また、解析対象の遺伝子プロモーターを導入したルシフェラーゼベクターを細胞1020に導入し、発現させてもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020をルシフェラーゼ標識してもよい。
【0117】
また、蛍光で細胞周期のステージを同定し、発光で解析対象の遺伝子の発現量を測定する場合、細胞1020は、発光関連遺伝子と解析対象の遺伝子とを導入し、細胞1020の所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きたものでもよい。具体的には、細胞1020は、発光関連遺伝子と解析対象の遺伝子とを融合した融合遺伝子(具体的には、発光関連遺伝子と解析対象の遺伝子とを融合したベクター)を導入し、細胞1020の所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きたものでもよい。ここで、細胞1020の核を、生細胞核染色試薬“DRAQ5”(Biostatus社製)を用いて染色してもよい。また、細胞1020の細胞膜を、“PKH LinkerKits”(SIGMA社製)を用いて染色してもよい(ただし、この場合、その形状から細胞周期のステージが同定可能な細胞(具体的にはPC12など)を用いる。)。
【0118】
また、発光で細胞周期のステージを同定し、蛍光で解析対象の遺伝子の発現量を測定する場合、細胞1020は、発光関連遺伝子と細胞周期関連遺伝子とを関連付けて導入すると共に、蛍光関連遺伝子と解析対象の遺伝子とを関連付けて導入した生きたものでもよい。具体的には、細胞1020は、発光関連遺伝子と細胞周期関連遺伝子とを融合したベクター(発光関連遺伝子導入ベクター)を導入すると共に、蛍光関連遺伝子と解析対象の遺伝子とを融合したベクター(蛍光関連遺伝子導入ベクター)を導入した生きたものでもよい。また、細胞周期関連遺伝子プロモーターを導入したベクターを細胞1020に導入してもよい。具体的には、Cyclin B1プロモーターを導入したルシフェラーゼベクターを作製し、細胞1020に導入してもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020をルシフェラーゼ標識してもよい。また、解析対象の遺伝子プロモーターを導入した蛍光タンパク質ベクターを細胞1020に導入し、発現させてもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020を蛍光標識してもよい。また、β−lactamase遺伝子をレポーター遺伝子として細胞1020に導入してもよい。
【0119】
なお、細胞周期関連遺伝子としては、サイクリン(具体的には、Cyclin A1、Cyclin A2、Cyclin B1、Cyclin B2、Cyclin B3、Cyclin C、Cyclin D1、Cyclin D2、Cyclin D3、Cyclin E1、Cyclin E2、Cyclin F、Cyclin G1、Cyclin G2、Cyclin H、Cyclin I、Cyclin T1、Cyclin T2a、Cyclin T2bなど)、サイクリンキナーゼ(具体的には、CDK2、CDK28など)などを適用してもよい。また、解析対象の遺伝子としては、上述した細胞周期関連遺伝子、サーカディアンリズム調節遺伝子(具体的には、period遺伝子、Kai遺伝子、timeless遺伝子、per遺伝子、clock遺伝子など)、その他細胞周期との関連性が不明な遺伝子などを適用してもよい。
【0120】
再び図20の説明に戻り、発光画像撮像ユニット1060は、具体的には正立型の発光顕微鏡であり、細胞1020の発光画像を撮像する。発光画像撮像ユニット1060は、図示の如く、対物レンズ1060aと、ダイクロイックミラー1060bと、CCDカメラ1060cと、で構成されている。対物レンズ1060aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー1060bは、細胞1020から発せられた発光を色別に分離し、2色の発光を用いて発光強度を色別に測定する場合に用いる。CCDカメラ1060cは、対物レンズ1060aを介して当該CCDカメラ1060cのチップ面に投影された細胞1020の発光画像や明視野画像を撮る。また、CCDカメラ1060cは、情報通信端末1100と有線または無線で通信可能に接続される。ここで、細胞1020が撮像範囲中に複数存在する場合、CCDカメラ1060cは、撮像範囲中に含まれる複数の細胞1020の発光画像や明視野画像を撮像してもよい。なお、図20では、ダイクロイックミラー1060bで分離した2つの発光に対応する発光画像を2台のCCDカメラ1060cで別々に撮像する場合の一例を示しており、1つの発光を用いる場合には、発光画像撮像ユニット1060は、対物レンズ1060aおよび1台のCCDカメラ1060cで構成されてもよい。
【0121】
ここで、2色の発光を用いて発光強度を色別に測定する場合、発光画像撮像ユニット1060は、図21に示すように、対物レンズ1060aと、CCDカメラ1060cと、スプリットイメージユニット1060dと、で構成されてもよい。そして、CCDカメラ1060cは、スプリットイメージユニット1060dを介して当該CCDカメラ1060cのチップ面に投影されたサンプル1020の発光画像(スプリットイメージ)や明視野像を撮像してもよい。スプリットイメージユニット1060dは、細胞1020から発せられた発光を色別に分離し、ダイクロイックミラー1060bと同様、2色の発光を用いて発光強度を色別に測定する場合に用いる。
【0122】
また、複数色の発光を用いて発光強度を色別に測定する場合(つまり、多色の発光を用いる場合)、発光画像撮像ユニット1060は、図22に示すように、対物レンズ1060aと、CCDカメラ1060cと、フィルターホイール1060eと、で構成されてもよい。そして、CCDカメラ1060cは、フィルターホイール1060eを介して当該CCDカメラ1060cのチップ面に投影された細胞102の発光画像や明視野画像を撮像してもよい。フィルターホイール1060eは、細胞1020から発せられた発光をフィルター交換によって色別に分離し、複数色の発光を用いて発光強度を色別に測定する場合に用いる。
【0123】
再び図20に戻り、蛍光画像撮像ユニット1080は、具体的には倒立型の蛍光顕微鏡であり、細胞1020の蛍光画像を撮像する。蛍光画像撮像ユニット1080は、図示の如く、対物レンズ1080aと、ダイクロイックミラー1080bと、キセノンランプ1080cと、CCDカメラ1080dと、で構成されている。CCDカメラ1080dは、対物レンズ1080aを介して当該CCDカメラ1080dのチップ面に投影された細胞1020の蛍光画像や明視野画像を撮る。また、CCDカメラ1080dは、情報通信端末1100と有線または無線で通信可能に接続される。ここで、細胞1020が撮像範囲中に複数存在する場合、CCDカメラ1080dは、撮像範囲中に含まれる複数の細胞1020の蛍光画像や明視野画像を撮像してもよい。ダイクロイックミラー1080bは、細胞102からの蛍光を透過するとともに、キセノンランプ1080cから照射された励起光が細胞1020へ照射されるように励起光の方向を変える。キセノンランプ1080cは励起光を照射する。
【0124】
ここで、発光画像撮像ユニット1060および蛍光画像撮像ユニット1080は、具体的には、それぞれ倒立型の発光顕微鏡および倒立型の蛍光顕微鏡でもよく、ステージ1040は回転するものでもよい。
【0125】
情報通信端末1100は、具体的にはパーソナルコンピュータである。そして、情報通信端末1100は、図23に示すように、大別して、制御部1120と、システムの時刻を計時するクロック発生部1140と、記憶部1160と、通信インターフェース部1180と、入出力インターフェース部1200と、入力部1220と、出力部1240と、で構成されており、これら各部はバスを介して接続されている。
【0126】
記憶部1160は、ストレージ手段であり、具体的には、RAMやROM等のメモリ装置、ハードディスクのような固定ディスク装置、フレキシブルディスク、光ディスク等を用いることができる。そして、記憶部1160は制御部1120の各部の処理により得られたデータなどを記憶する。
【0127】
通信インターフェース部1180は、情報通信端末1100と、CCDカメラ1060cおよびCCDカメラ1080dと、の間における通信を媒介する。すなわち、通信インターフェース部1180は他の端末と有線または無線の通信回線を介してデータを通信する機能を有する。
【0128】
入出力インターフェース部1200は、入力部1220や出力部1240に接続する。ここで、出力部1240には、モニタ(家庭用テレビを含む)の他、スピーカやプリンタを用いることができる(なお、以下で、出力部1240をモニタとして記載する場合がある。)。また、入力部1220には、キーボードやマウスやマイクの他、マウスと協働してポインティングデバイス機能を実現するモニタを用いることができる。
【0129】
制御部1120は、OS(Operating System)等の制御プログラムや各種の処理手順等を規定したプログラムや所要データを格納するための内部メモリを有し、これらのプログラムに基づいて種々の処理を実行する。そして、制御部1020は、大別して、蛍光画像撮像指示部1120aと、発光画像撮像指示部1120bと、蛍光画像取得部1120cと、発光画像取得部1120dと、判定部1120eと、蛍光測定部1120fと、発光測定部1120gと、ステージ同定部1120hと、選択部1120i、発現量測定部1120jと、で構成されている。
【0130】
蛍光画像撮像指示部1120aは、通信インターフェース部1160を介して、CCDカメラ1080dへ蛍光画像や明視野画像の撮像を指示する。発光画像撮像指示部1120bは、通信インターフェース部1160を介して、CCDカメラ1060cへ発光画像や明視野画像の撮像を指示する。蛍光画像取得部1120cは、CCDカメラ1080dで撮像した蛍光画像や明視野画像を、通信インターフェース部1160を介して取得する。発光画像取得部1120dは、CCDカメラ1060cで撮像した発光画像や明視野画像を、通信インターフェース部1160を介して取得する。
【0131】
判定部1120eは、蛍光画像および/または発光画像に基づいて、各遺伝子が導入されているか否かを細胞1020ごとに判定する。蛍光測定部1120fは、CCDカメラ1080dで撮像した蛍光画像に基づいて、各細胞1020から発せられた蛍光の蛍光強度をそれぞれ測定する。発光測定部1120gは、CCDカメラ1060cで撮像した発光画像に基づいて、各細胞1020から発せられた発光強度をそれぞれ測定する。
【0132】
ステージ同定部1120hは、蛍光測定部1120fで測定した蛍光強度または発光測定部1120gで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定する。なお、発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、CCDカメラ1080dで撮像した蛍光画像に基づいて細胞1020の形状が変化したか否かを判定することで、細胞周期のステージを同定してもよい。選択部1120iは、ステージ同定部1120hでステージが同定された細胞1020の中から測定対象の細胞1020を選択する。
【0133】
発現量測定部1120jは、選択部1120iで選択した細胞1020を対象として、ステージ同定部1120hで発光強度を用いる場合には蛍光測定部1120fで測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定し、ステージ同定部1120hで蛍光強度または蛍光画像を用いる場合には発光測定部1120gで測定した発光強度に基づいて解析対象の遺伝子の発現量を測定する。なお、発現量測定部1120jは、複数の細胞1020または選択部1120iで選択した細胞1020を対象として、蛍光測定部1120fで測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、CCDカメラ1080dで撮像した蛍光画像に基づいて解析対象の遺伝子の細胞1020内における発現部位を同定してもよい。
【0134】
以上の構成において、発現量測定装置1000で行われる処理の一例を、図24を参照して説明する。なお、以下では、発光関連遺伝子と細胞周期関連遺伝子とを融合したベクターおよび蛍光関連遺伝子と解析対象の遺伝子とを融合したベクターを複数の細胞1020に導入し、導入した複数の細胞1020のうち特定の細胞1020を対象として、発光強度で細胞周期のステージを同定しながら、蛍光強度で解析対象の遺伝子の発現量を経時的に測定すると共に蛍光画像で解析対象の遺伝子の細胞1020内における発現部位を経時的に同定する場合の処理の一例について説明する。
【0135】
まず、情報通信端末1100は、蛍光画像撮像指示部1100aの処理で通信インターフェース部1160を介してCCDカメラ1080dへ蛍光画像の撮像を指示し、発光画像撮像指示部1120bの処理で通信インターフェース部1160を介してCCDカメラ1060cへ発光画像の撮像を指示する(ステップSB−1)。つぎに、CCDカメラ1080dは、撮像範囲中に存在する複数の細胞1020の蛍光画像を撮像し(ステップSB−2)、当該蛍光画像を情報通信端末1100へ送信する(ステップSB−3)。一方、CCDカメラ1060cは、撮像範囲中に存在する複数の細胞1020の発光画像を撮像し(ステップSB−4)、当該発光画像を情報通信端末1100へ送信する(ステップSB−5)。なお、蛍光画像の撮像指示および発光画像の撮像指示は、異なる時刻または時間間隔で行ってもよい。例えば、細胞周期のステージを同定するために用いる発光画像の撮像は数時間おきに行い、解析対象の遺伝子の発現量を測定するために用いる蛍光画像の撮像は数分おきに行ってもよい。また、励起光は蛍光画像を撮像する時のみ細胞1020へ照射する。
【0136】
つぎに、情報通信端末1100は、(a)蛍光画像取得部1120cの処理で通信インターフェース部1160を介して蛍光画像を取得し、(b)発光画像取得部1120dの処理で通信インターフェース部1160を介して発光画像を取得し、(c)制御部1120の処理でクロック発生部1140から時刻を取得し、(d)取得した蛍光画像と発光画像と時刻とを対応付けて記憶部1160の所定の記憶領域に記憶する(ステップSB−6)。
【0137】
つぎに、情報通信端末1100は、判定部1120eの処理で、蛍光画像および/または発光画像に基づいて、ベクターが導入されているか否かを細胞1020ごとに判定する(ステップSB−7)。つぎに、ベクターが導入されている細胞1020が少なくとも1つ存在した場合(ステップSB−8:Yes)、情報通信端末1100は、蛍光測定部1120fの処理で蛍光画像に基づいて各細胞1020から発せられた蛍光の蛍光強度をそれぞれ測定すると共に、発光測定部1120gの処理で発光画像に基づいて各細胞1020から発せられた発光の発光強度をそれぞれ測定する(ステップSB−9)。
【0138】
つぎに、情報通信端末1100は、ステージ同定部1120hの処理で、発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定する(ステップSB−10)。なお、蛍光関連遺伝子と細胞周期関連遺伝子とを融合したベクターおよび発光関連遺伝子と解析対象の遺伝子とを融合したベクターを細胞1020に導入した場合、蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定してもよい。また、発光関連遺伝子と解析対象の遺伝子とを融合したベクターを細胞1020に導入し、その所定の部位(具体的には核、細胞膜、細胞質など)を蛍光物質で染色した場合、蛍光画像に基づいて細胞1020の形状が変化したか否かを細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定してもよい。
【0139】
つぎに、情報通信端末1100は、選択部1120iの処理で、ステップSA−10でステージが同定された細胞1020の中から測定対象の細胞1020を選択する(ステップSB−11)。つぎに、情報通信端末1100は、発現量測定部1120jの処理で、ステップSB−11で選択した細胞1020を対象として、蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、蛍光画像に基づいて解析対象の遺伝子の細胞1020内における発現部位を同定する(ステップSB−12)。なお、ステップSB−10において蛍光強度または蛍光画像を用いる場合、ステップSB−12では、発光強度に基づいて解析対象の遺伝子の発現量を測定してもよい。
【0140】
そして、情報通信端末1100は、制御部1120の処理で、上述したステップSB−1〜ステップSB−12までの処理を例えば予め設定した時間間隔で所定の回数繰り返し実行し、所定の回数終了した場合(ステップSB−13:Yes)には処理を終了する。
ここで、発光画像および蛍光画像の撮像および取得だけを繰り返し実行し、解析の時点で、発光強度の測定、蛍光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を行ってもよい。つまり、解析に必要な元データである発光画像および蛍光画像だけをまとめて取得し、その後、解析の時点で、発光強度の測定、蛍光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を行ってもよい。具体的には、発光画像および蛍光画像の取得後に、解析の時点で、細胞1020の選択、発現量の測定を行ってもよい。また、発光画像および蛍光画像の取得を行った後、解析の時点で、ステージの同定、細胞1020の選択を行ってもよい。また、発光画像および蛍光画像の取得後に、解析の時点で、細胞1020の選択を行ってもよい。
また、蛍光画像を取得した後、測定対象の細胞1020を選択し、そして発光画像を取得してもよい。
【0141】
以上、詳細に説明したように、発現量測定装置1000によれば、発光関連遺伝子と蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞1020を対象として、細胞1020から発せられた発光の発光強度を測定し、細胞1020から発せられた蛍光の蛍光強度を測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定するにあたって、細胞は、発光関連遺伝子、蛍光関連遺伝子および解析対象の遺伝子に加えてさらに細胞周期関連遺伝子を導入したものであり、発現量の測定で発光強度を用いる場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、発現量の測定で蛍光強度を用いる場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定する。これにより、細胞1020に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに当該細胞1020に対して細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる。また、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができる。具体的には、細胞周期との直接の関与が不明である解析対象の遺伝子に関して、薬剤投与や温度変化などの刺激で引き起こされる発現量の変化を細胞周期のステージと共に得ることができるので、当該解析対象の遺伝子と細胞周期との関与を検証することができる。また、細胞周期との直接の関与が示唆される解析対象の遺伝子に関して、当該解析対象の遺伝子の発現量と細胞周期のステージとを一緒に取得することができるので、当該解析対象の遺伝子が細胞周期マーカーとして有用であるか否かを評価することができる。なお、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、発現量測定装置1000は、細胞1020から発せられた発光の発光強度を測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を測定し、当該細胞1020の蛍光画像を撮像し、撮像した蛍光画像に基づいて細胞1020の形状が変化したか否かを判定することで、細胞周期のステージを同定してもよい。なお、発光誘導蛋白遺伝子の取り込みを確認するための方法を除き、蛍光融合遺伝子の変わりに蛍光色素を用いてもよいが、励起光による光毒性の影響を最小限にするために、蛍光色素による撮像は、蛍光のみで撮像する場合に比べて撮像回数を減らすようにすることができる。また、発現量測定装置1000は、例えば、各種反応(例えば薬物刺激や光照射など)の検査や治療などに好適に用いることができる。
【0142】
ここで、これまでは、レポーターアッセイを行う際に、様々な細胞周期ステージの細胞を一群のデータとして取り扱っていた。細胞周期は、細胞の成長、DNAの複製、染色体の分配、細胞の分裂などからなる複数の連続反応であり、そのステージにより様々な遺伝子の発現が変動することは十分に考えられる。そこで、発現量測定装置1000を利用すれば、細胞周期への直接の関与が不明である遺伝子に関して、薬剤や温度変化など、何らかの刺激により引き起こされる遺伝子発現量変化を検出したい場合に、細胞周期データと合わせることで、より詳細な解析結果が得られる。また、発現量測定装置1000を利用すれば、細胞周期との直接の関与が示唆される遺伝子に関しても、各細胞の細胞周期のステージが判別できるので、従来行ってきた同調培養などの操作を必要とせず、解析を行いたいステージの細胞のみを選択し、観察対象とすることができる。
【0143】
また、発現量測定装置1000によれば、細胞1020が撮像範囲中に複数存在する場合、複数の細胞1020の蛍光画像を撮像し、複数の細胞1020の発光画像を撮像し、撮像した発光画像に基づいて、各細胞1020から発せられた発光の発光強度をそれぞれ測定し、撮像した蛍光画像に基づいて、各細胞1020から発せられた蛍光の蛍光強度をそれぞれ測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を細胞1020ごとに測定し、発現量の測定で発光強度を用いる場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定し、発現量の測定で蛍光強度を用いる場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定する。これにより、複数の細胞1020を対象として、解析対象の遺伝子の発現量を細胞1020ごとに測定すると共に、細胞周期のステージを細胞1020ごとに同定することができる。また、解析対象の遺伝子と細胞周期のステージとの関連性を細胞1020ごとに評価することができる。なお、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、発現量測定装置1000は、撮像範囲中に存在する複数の細胞1020の発光画像を撮像し、複数の細胞1020の蛍光画像を撮像し、撮像した発光画像に基づいて、各細胞1020から発せられた発光の発光強度をそれぞれ測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を細胞1020ごとに測定し、撮像した蛍光画像に基づいて細胞1020の形状が変化したか否かを細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定してもよい。また、細胞周期ごとに比較することにより、条件が等しい細胞同士の比較評価を行うようにしてもよい。
【0144】
また、発現量測定装置1000によれば、ステージが同定された細胞1020の中から測定対象の細胞1020を選択し、測定した発光強度または測定した蛍光強度に基づいて、選択した細胞1020に導入された解析対象の遺伝子の発現量を測定する。これにより、複数の細胞1020の中から個々の細胞1020を識別し、単一の細胞1020を対象として、解析対象の遺伝子の発現量を測定すると共に、細胞周期のステージを同定することができる。
【0145】
また、発現量測定装置1000によれば、発光画像の撮像、蛍光画像の撮像、発光強度の測定、蛍光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を繰り返し実行することで、選択した細胞1020を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定する。これにより、単一の細胞1020を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量の変動を経時的に測定することができる。なお、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、発現量測定装置1000は、発光画像の撮像、蛍光画像の撮像、発光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を繰り返し実行することで、選択した細胞1020を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定してもよい。また、同一視野内の異なる細胞を、各々の細胞周期に応じたタイミングで撮像したタイムラプス映像または1画像上に同時に画像再生することにより、細胞周期を一致させた動画(またはコマ送り)ないし1画像表示をしてもよい。
【0146】
また、発現量測定装置1000によれば、発現量の測定において、選択された細胞1020を対象として、測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、撮像した蛍光画像に基づいて解析対象の遺伝子の細胞1020内における発現部位を同定する。これにより、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができるだけでなく、解析対象の遺伝子の細胞1020内における発現部位を得ることができる。
【0147】
また、発現量測定装置1000を利用すれば、具体的には、抗がん剤およびそのリード化合物の評価を行うことができる。特に、抗がん剤が細胞分裂の効率に有害な作用を持つかどうかの判断と、そのリード化合物が解析対象遺伝子の転写活性に影響を与えるかどうかを同時にモニターすることができる。また、発現量測定装置1000を利用すれば、具体的には、細胞周期と細胞の形態との関連を調べることができる。特に、PC12細胞などにおいては、細胞周期ステージ、分化段階によって形態が変わることが知られているが、その他の神経様細胞においても、細胞形態による詳細なステージ同定を行うことができ、細胞形態そのものを細胞周期または分化のフェーズマーカーとして用いることができる。また、発現量測定装置1000を利用すれば、具体的には、細胞周期に関わる可能性のある遺伝子において、発光検出にて細胞周期をモニタリングしながら、蛍光検出にて発現時期・局在性を同定することで、細胞周期との関連性の有無、または細胞周期マーカーとしての有用性を評価することができる。
【0148】
[III]以下、添付図面を参照して、本発明にかかる測定装置としての顕微鏡ユニットおよび顕微鏡装置の好適な実施の形態を詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。また、図面の記載において、同一部分には同一の符号を付している。
【0149】
(実施の形態1)まず、本発明の実施の形態1にかかる顕微鏡装置について説明する。図25は、この実施の形態1にかかる顕微鏡装置の構成を示す模式図である。図25に示すように、この実施の形態1にかかる顕微鏡装置100aは、蛍光観察を行う蛍光顕微鏡ユニット101と、微弱光観察を行う微弱光観察ユニット102aと、発光標識および蛍光標識が付与された標本Sを保持する保持手段としての保持部7と、各顕微鏡ユニット101,102aによって撮像した標本Sの標本像等を表示するモニター9と、顕微鏡装置100aの全体の処理および動作を制御する制御装置PC1と、を備える。蛍光顕微鏡ユニット101と微弱光顕微鏡ユニット102aとは、互いに隣接して配置される。
【0150】
蛍光顕微鏡ユニット101は、蛍光対物レンズとしての対物レンズ1および蛍光結像レンズとしての結像レンズ2を有する高倍率の蛍光結像光学系と、この蛍光結像光学系によって結像される標本Sの標本像である蛍光標本像を撮像する蛍光撮像手段としての撮像装置3と、標本Sを励起する励起光を発する励起光源4と、励起光源4からの励起光を集光するレンズ5と、蛍光ユニットとしての蛍光キューブ6と、を備える。
【0151】
対物レンズ1は、標本側に大きなNAを有し、標本Sに付与された蛍光標識の各点から発せられる蛍光をほぼ平行光束に変換する。結像レンズ2は、対物レンズ1によってほぼ平行光束に変換された蛍光を集光して標本Sの標本像である蛍光標本像を結像する。蛍光結像光学系は、蛍光標本像を40倍以上の高倍率で結像する。撮像装置3は、CCD、CMOS等の固体撮像素子を有し、この固体撮像素子の撮像面上に結像される蛍光標本像を撮像し、画像データを生成して制御装置PC1に出力する。
【0152】
蛍光キューブ6は、標本Sを励起するための励起光を選択的に透過させる励起光透過フィルターとしての励起フィルター6aと、この励起光によって励起された標本Sから発せられる蛍光を選択的に透過させる蛍光透過フィルターとしての吸収フィルター6bと、励起光を反射して蛍光を透過させるダイクロイックミラー6cとを一体に備える。励起フィルター6aは、励起光源4から発せられる各種波長の光の中から所定の波長域の励起光を抽出するバンドパスフィルターであり、吸収フィルター6bは、所定のカットオフ波長を有するロングウェーブパスフィルターである。なお、吸収フィルター6bは、所定の波長範囲の蛍光を抽出するバンドパスフィルターでもよい。バンドパスフィルターは、標本Sから発せられる微弱光と蛍光の波長が近い場合に有効である。
【0153】
励起光源4は、水銀ランプ、キセノンランプ、レーザー等によって実現され、励起光照射手段としての励起光源4およびレンズ5は、励起光源4からの励起光を、励起光フィルター6aを介し、ダイクロイックミラー6cによって反射させ標本Sに照射する。なお、励起光源4は、制御装置PC1からの指示をもとに点灯および消灯を行う。
【0154】
微弱光顕微鏡ユニット102aは、微弱光対物レンズとしての対物レンズ11および微弱光結像レンズとしての結像レンズ12を有する低倍率の微弱光結像光学系と、この微弱光結像光学系によって結像される標本Sの標本像である微弱光標本像を撮像する微弱光撮像手段としての撮像装置13と、を備える。
【0155】
対物レンズ11は、標本側に大きなNAを有し、標本Sに付与された発光標識の各点から自己発光によって発せられる微弱光をほぼ平行光束に変換する。結像レンズ12は、対物レンズ11によってほぼ平行光束に変換された微弱光を集光して標本Sの標本像である微弱光標本像を結像する。微弱光結像光学系は、蛍光結像光学系の結像倍率よりも低い結像倍率で微弱光標本像を結像する。このとき、微弱光結像光学系は、標本側のNAをNAo、結像倍率をβとして、(NAo/β)2≧0.01を満足することが望ましい。
【0156】
撮像装置13は、CCD、CMOS等の固体撮像素子を有し、この固体撮像素子の撮像面上に結像される微弱光標本像を撮像し、画像データを生成して制御装置PC1に出力する。なお、撮像装置13が有する固体撮像素子は、高感度のモノクロームCCDであって0℃程度の冷却CCDを用いるとよい。
【0157】
保持部7は、標本Sを直接載置するプレパラート、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体、インキュベーター等の保持部材7aと、この保持部材7aとともに標本Sを2次元的に移動させる可動ステージ7bとを有する。可動ステージ7bは、制御装置PC1からの指示をもとに、ステージ駆動部8によって駆動される。
【0158】
制御装置PC1は、CPUを備えたコンピュータ等の処理装置によって実現され、撮像装置3,13、励起光源4、ステージ駆動部8およびモニター9を電気的に接続し、これらの各構成部位の動作を制御する。制御装置PC1は、特に、撮像切換制御手段として、撮像装置13によって撮像される微弱光標本像の像特性をもとに、微弱光顕微鏡ユニット102aによる微弱光標本像の撮像と、蛍光顕微鏡ユニット101による蛍光標本像の撮像とを切り換える撮像切換処理の制御を行う。
【0159】
ここで、制御装置PC1が制御する撮像切換処理について説明する。図26は、撮像切換処理の処理手順を示すフローチャートである。図26に示すように、制御装置PC1は、可動ステージ7bによって微弱光結像光学系の視野内に移動された標本Sの微弱光標本像を撮像装置13によって撮像する(ステップS101)。この撮像結果をもとに、制御装置PC1は、微弱光標本像の像特性としての像強度があらかじめ設定したしきい値より大きい領域が微弱光標本像内にあるか否かを判断する(ステップS103)。像強度がしきい値より大きい領域がないと判断された場合(ステップS103:No)、制御装置PC1は、ステップS101からの処理を繰り返す。
【0160】
一方、像強度がしきい値より大きい領域があると判断された場合(ステップS103:Yes)、制御装置PC1は、ステップS101で撮像した微弱光標本像を記録し(ステップS105)、可動ステージ7bによって蛍光結像光学系の視野内に標本Sを移動する(ステップS107)。そして、制御装置PC1は、微弱光標本像の像強度がしきい値より大きい領域に対応する蛍光標本像を撮像装置3によって撮像して記録し(ステップS109)、撮像切換処理を終了する。なお、標本Sの経過観察を行う場合、制御装置PC1は、ステップS109の後、可動ステージ7bによって標本Sを再び微弱光結像光学系の視野内に移動し、ステップS101からの処理を繰り返すように制御するとよい。また、ステップS109での撮像は、タイムラプス撮像または1画像の撮像のどちらでもよい。また、同一視野内の異なる細胞を、各々の細胞周期に応じたタイミングで撮像したタイムラプス映像または1画像上に同時に画像再生することにより、細胞周期を一致させた動画(またはコマ送り)ないし1画像表示をしてもよい。
【0161】
制御装置PC1は、ステップS105およびS109では、撮像した微弱光標本像および蛍光標本像を自装置内に備えるRAM等の記憶部に記憶する。また、制御装置PC1は、ステップS101およびS109では、撮像した微弱光標本像および蛍光標本像をモニター9に逐次表示するようにしてもよい。さらに、制御装置PC1は、ステップS101〜S105の間、すなわち、微弱光顕微鏡ユニット102によって標本Sの微弱光観察を行っている間、励起光源4を消灯し、ステップS109で標本Sの蛍光観察を行う場合、励起光源4を点灯するように制御を行うとよい。あるいは、励起光源4から蛍光ユニット6までの光路上にシャッター等の遮光装置を設け、制御装置PC1は、未照射手段として、励起光源4を点灯および消灯する替わりに、遮光装置を開閉することによって励起光の照射を制御するようにしてもよい。
【0162】
なお、制御装置PC1は、ステップS103では、微弱光標本像内の部分的な領域の像強度をもとに蛍光観察への切り換えを判断するようにしたが、微弱光標本像の全体の像強度をもとに切り換えを判断するようにしてもよい。また、制御装置PC1は、これらの像強度を、たとえば、所定時点から現時点までの累積の像強度として取得してもよく、あるいは現時点の瞬間的な像強度として取得してもよい。なお、微弱光標本像の全体の像強度を取得する場合には、撮像装置13に替えてフォトマルチプライヤー等の高感度の受光素子を用いてもよい。
【0163】
以上説明したように、この実施の形態1にかかる顕微鏡装置によれば、蛍光観察用の蛍光顕微鏡ユニット101と微弱光観察用の微弱光顕微鏡ユニット102aとを隣接して備えるとともに、蛍光結像光学系および微弱光結像光学系の各視野内に標本Sを移動させる可動ステージ7bとを備えるため、適宜に蛍光観察と微弱光観察とを切り換えることができ、また、微弱光標本像の像特性としての像強度に応じて、微弱光観察から蛍光観察へ即時に切り換えることができる。
【0164】
なお、微弱光結像光学系は、対物レンズ11および結像レンズ12によって標本像を結像する無限遠補正光学系として説明したが、対物レンズのみによって標本像を結像する有限補正光学系としてもよい。
【0165】
また、上述した撮像切換処理では、微弱光標本像の像強度等の像特性をもとに微弱光観察から蛍光観察に切り換えるようにしたが、蛍光観察で標本Sに照射する励起光強度や標本Sから発光される蛍光強度が弱く、励起光および蛍光によって標本Sに与えるダメージが小さい場合などには、蛍光標本像の像強度等の像特性をもとに蛍光観察から微弱光観察に切り換えるようにしてもよい。
【0166】
(実施の形態2)つぎに、本発明の実施の形態2について説明する。上述した実施の形態1では、可動ステージ7bによって蛍光結像光学系および微弱光結像光学系の各視野内に標本Sを移動させるようにしたが、この実施の形態2では、蛍光結像光学系および微弱光結像光学系を移動させることによって各視野内に標本Sを配置するようにしている。
【0167】
図27は、本発明の実施の形態2にかかる顕微鏡装置の構成を示す模式図である。図27に示すように、この実施の形態2にかかる顕微鏡装置200は、顕微鏡装置100aと同様に蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を備え、また、これらの各顕微鏡ユニット201,202の中間位置に光学系移動手段としての回転駆動装置14および保持軸15a,15bを備える。さらに、顕微鏡装置200は、顕微鏡装置100aが備えた保持部7に替えて、可動範囲を小さくした可動ステージ17bを有する保持部17を備えるとともに、制御装置PC1に替えて、制御装置PC2を備える。その他の構成は、実施の形態1と同じであり、同一の構成部分には同一符号を付している。
【0168】
蛍光顕微鏡ユニット201は、蛍光顕微鏡ユニット101と同じ各構成部位を一体に保持する筐体21を備え、微弱光顕微鏡ユニット202は、微弱光顕微鏡ユニット102aと同じ各構成部位を一体に保持する筐体22を備える。
【0169】
回転駆動装置14は、蛍光顕微鏡ユニット201が備える蛍光結像光学系および微弱光顕微鏡ユニット202が備える微弱光結像光学系の各視野の略中心点を結ぶ線分の中点を通り各光学系の光軸に略平行な回転軸を有し、この回転軸を中心に、複数の保持軸15a,15bによって保持した蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を回転移動させる。ここで、固定軸15a,15bは、それぞれ筐体21,22を保持している。
【0170】
可動ステージ17bは、微弱光結像光学系の視野と概ね等しい範囲内で標本Sを移動させる。また、可動ステージ17bは、制御装置PC2からの指示をもとに、ステージ駆動部18によって駆動される。
【0171】
制御装置PC2は、制御装置PC1と同様に撮像装置3,13、励起光源4およびステージ駆動部18の動作を制御するのに加えて、回転駆動装置14の動作を制御する。制御装置PC2は、微弱光観察と蛍光観察とを切り換える場合、回転駆動装置14を制御して蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202の配置を切り換える。
【0172】
このように、この実施の形態2にかかる顕微鏡装置200よれば、回転駆動装置14によって蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を回転移動して蛍光観察と微弱光観察とを切り換えられるようにしているため、たとえば、培養液中に浸された標本等、高速で移動させることができない標本を観察対象とする場合でも、即時に蛍光観察と微弱光観察とを切り換えることができる。
【0173】
なお、顕微鏡装置200では、回転駆動装置14によって各顕微鏡ユニット201,202の全体を回転移動させるようにしているが、撮像装置3,13を1つの撮像装置で共用し、蛍光顕微鏡ユニット201から撮像装置3を除いた部分と、微弱光顕微鏡ユニット202から撮像装置13を除いた部分とを回転移動させて、互いに配置を切り換えるようにしてもよい。
【0174】
図28は、このようにした場合の顕微鏡装置の構成を示す模式図である。図28に示すように、この実施の形態2の変形例としての顕微鏡装置300は、顕微鏡装置200から撮像装置13を取り除き、微弱光顕微鏡ユニット202の全体を一体に保持した筐体22に替えて、微弱光結像光学系を一体に保持する筐体24を備えるとともに、蛍光顕微鏡ユニット201の全体を一体に保持した筐体21に替えて、撮像装置3を除いた部分を一体に保持する筐体23を備える。また、顕微鏡装置300は、制御装置PC2に替えて、制御装置PC3を備える。その他の構成は、顕微鏡装置200と同じであり、同一の構成部分には同一符号を付している。
【0175】
制御装置PC3は、制御装置PC2と同様に撮像装置3、励起光源4、ステージ駆動部18および回転駆動装置14の動作を制御する。ただし、制御装置PC2が蛍光観察と微弱光観察とに応じて撮像装置3,13の制御を切り換えていたのに対し、制御装置PC3は、蛍光観察および微弱光観察の両方の場合で撮像装置3を制御して標本像を撮像するようにしている。このとき、制御装置PC3は、蛍光観察および微弱光観察に応じて、撮像装置3によって撮像される標本像の範囲、結像倍率等を切り換えて認識する。
【0176】
なお、回転駆動装置14は、固定軸15a,15bによって筐体23,24を保持し、制御装置PC3からの指示をもとに、微弱光観察および蛍光観察に応じて、筐体23,24の配置を切り換える。
【0177】
このように、この実施の形態2の変形例としての顕微鏡装置300よれば、蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202から撮像装置3,13を除く部分を回転駆動装置14によって回転移動して蛍光観察と微弱光観察とを切り換えられるようにしているため、移動部分が軽量化され、より高速に移動および切り換えを行うことができる。また、顕微鏡装置300では、顕微鏡装置100a,200に比して撮像装置の数を削減しているため、撮像装置に関連する回路構成を簡略化することができるとともに、制御装置PC3の処理負荷を軽減させて処理の高速化をはかることができる。また、装置を安価にすることができる。
【0178】
なお、顕微鏡装置200,300では、回転駆動装置14によって蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202、またはこれら各ユニットの一部を回転移動させるようにしたが、回転移動に限らず、たとえば、可動ステージ17bに沿って蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を平行移動させて、各ユニット201,202の配置を切り換えるようにしてもよい。
【0179】
(実施の形態3)つぎに、本発明の実施の形態3について説明する。上述した実施の形態1および実施の形態2では、標本Sの同じ側に配置され独立した蛍光結像光学系および微弱光結像光学系を備えるようにしていたが、この実施の形態3では、光学系の一部を共用した蛍光結像光学系および微弱光結像光学系を備えるようにしている。
【0180】
図29は、本発明の実施の形態3にかかる顕微鏡装置の構成を示す模式図である。図29に示すように、この実施の形態3にかかる顕微鏡装置400は、顕微鏡装置100aが独立して備えた蛍光結像光学系および微弱光結像光学系の対物レンズを共用し、一体化した顕微鏡ユニットを備える。具体的には、顕微鏡装置400は、顕微鏡装置100aが備えた蛍光顕微鏡ユニット101と同様の顕微鏡ユニットを備え、さらに、この顕微鏡ユニットが有する対物レンズ1と蛍光キューブ6との間に挿脱可能なミラー34を備え、このミラー34によって図上で左側に約90度に折り曲げられる光軸上に、結像レンズ12に替わる結像レンズ32と撮像装置13とを備える。
【0181】
このようにして顕微鏡装置400は、対物レンズ1を共用し、対物レンズ1と結像レンズ2を有する蛍光結像光学系と、対物レンズ1と結像レンズ32とを有する微弱光結像光学系とを備える。また、顕微鏡400は、顕微鏡装置200が備えた保持部17およびステージ駆動部18を備えるとともに、励起光源4とレンズ5との間に未照射手段としてのシャッター33と、このシャッター33およびミラー34を動作させる光路切換駆動部35と、制御装置PC4と、を備える。その他の構成は、実施の形態1または実施の形態2と同じであり、同一の構成部分には同一符号を付している。
【0182】
制御装置PC4は、制御装置PC2と同様に撮像装置3,13およびステージ駆動部18の動作を制御するのに加えて、光路切換駆動部35を介してシャッター33およびミラー34の動作を制御する。制御装置PC4は、微弱光観察から蛍光観察に切り換える場合、対物レンズ1と蛍光キューブ6との間からミラー34を取り除き、シャッター33を開いて励起光源4からの励起光を標本Sに照射させる。一方、蛍光観察から微弱光観察に切り換える場合、制御装置PC4は、シャッター33を閉じて励起光源4からの励起光を遮光し、標本Sに対して励起光を未照射にするとともに、対物レンズ1と蛍光キューブ6との間の光路上にミラー34を挿入し配置して、標本Sからの微弱光を結像レンズ32に向けて反射させる。
【0183】
なお、結像レンズ32は、結像レンズ2よりも短い焦点距離を有し、結像レンズ32を有する微弱光結像光学系は、結像レンズ2を有する蛍光結像光学系の結像倍率よりも低い結像倍率で微弱光標本像を結像する。また、結像レンズ32を有する微弱光結像光学系は、標本側のNAをNAo’、結像倍率をβ’として、(NAo’/β’)2≧0.01を満足することが望ましい。
【0184】
このように、この実施の形態3にかかる顕微鏡装置400よれば、対物レンズを共用した蛍光結像光学系および微弱光結像光学系によって一体化した顕微鏡ユニットを備えるようにしているため、顕微鏡装置全体の小型化および簡素化をはかることができるとともに、蛍光観察と微弱光観察との切り換えにともなう移動部分が単一の光学素子となって軽量化されるため、より高速に移動および切り換えを行うことができる。
【0185】
なお、励起光源4からの励起光および標本Sからの蛍光と、標本Sからの微弱光との波長帯域が異なる場合、ミラー34に替えて、励起光および蛍光を透過させるとともに微弱光を反射させるダイクロイックミラーを用いるようにしてもよい。この場合、制御装置PC4は、蛍光観察と微弱光観察とを切り換える場合、ダイクロイックミラーを挿脱する必要はない。また、ダイクロイックミラーを用いる場合、制御装置PC4は、蛍光観察と微弱光観察とを同時に行うように制御してもよい。
【0186】
(実施の形態4)つぎに、本発明の実施の形態4について説明する。上述した実施の形態1では、標本Sに対して同じ側に蛍光顕微鏡ユニット101および微弱光顕微鏡ユニット102aを配置するようにしたが、この実施の形態4では、標本Sに対して互いに反対側に蛍光顕微鏡ユニットおよび微弱光顕微鏡ユニットを配置するようにしている。
【0187】
図30は、本発明の実施の形態4にかかる顕微鏡装置の構成を示す模式図である。図30に示すように、この実施の形態4にかかる顕微鏡装置500は、顕微鏡装置100aが備えた蛍光顕微鏡ユニット101および微弱光顕微鏡ユニット102aを備えるとともに、顕微鏡装置200が備えた保持部17およびステージ駆動部18を備え、さらに、制御装置PC5およびモニター9を備える。実施の形態1または実施の形態2と同じ構成部分には同一符号を付している。
【0188】
図30に示す顕微鏡装置500では、蛍光顕微鏡ユニット101は、図上で標本Sの下側に配置され、微弱光顕微鏡ユニット102aは、標本Sの上側に配置されている。なお、これら各ユニット101,102aの上下の配置関係は逆転させてもよい。
【0189】
制御装置PC5は、制御装置PC2と同様に撮像装置3,13、励起光源4およびステージ駆動部18の動作を制御する。制御装置PC5は、微弱光観察から蛍光観察に切り換える場合、励起光源4を点灯して標本Sに励起光を照射させ、蛍光観察から微弱光観察に切り換える場合、励起光源4を消灯し標本Sに対して励起光を未照射にする。
【0190】
なお、励起光源4からダイクロイックミラー6cを介した標本Sまでの光路上にシャッター33等の遮光装置を設け、制御装置PC5は、未照射手段として、励起光源4を点灯および消灯する替わりに、遮光装置を開閉することによって励起光の照射および未照射を制御するようにしてもよい。
【0191】
また、励起光源4からの励起光および標本Sからの蛍光と、標本Sからの微弱光との波長帯域が異なる場合、たとえば、結像レンズ12と撮像装置13との間に、微弱光を透過させるとともに励起光および蛍光を遮光する波長抽出フィルターを設け、制御装置PC5は、励起光源4を消灯させることなく蛍光観察と微弱光観察とを切り換えるようにしてもよい。あるいは、この場合、制御装置PC5は、蛍光観察と微弱光観察とを同時に行うように制御してもよい。
【0192】
このように、この実施の形態4にかかる顕微鏡装置500よれば、標本Sに対して互いに反対側に蛍光顕微鏡ユニット101および微弱光顕微鏡ユニット102aを配置するようにしているため、機械的な駆動を全くさせることなく、蛍光観察と微弱光観察とを即時に切り換えることができる。
【0193】
なお、制御装置PC5は、図示しない駆動装置によって蛍光顕微鏡ユニット101を微弱光顕微鏡ユニット102aに対して、可動ステージ17bに沿って相対的に移動させるようにしてもよい。この場合、微弱光顕微鏡ユニット102aによって標本Sの広範囲な領域を観察し続けながら、この広範囲な領域内の任意の微小領域の拡大像を蛍光顕微鏡ユニット101によって観察することができるとともに、標本Sを全く移動させることなく蛍光観察および微弱光観察を行うことができる。
【0194】
(実施の形態5)つぎに、本発明の実施の形態5について説明する。上述した実施の形態1〜4では、発光標識および蛍光標識からの微弱光および蛍光によって標本Sを観察するようにしていたが、この実施の形態5では、さらに透過照明によって標本Sを観察するようにしている。
【0195】
図31は、本発明の実施の形態5にかかる顕微鏡装置の構成を示す模式図である。図31に示すように、この実施の形態5にかかる顕微鏡装置600は、実施の形態1にかかる顕微鏡装置100aに加えて、透過照明を行う照明手段としての透過照明ユニット103aと、この透過照明ユニット103aが有するシャッター43等を駆動させる照明駆動部46と、制御装置PC1に替わる制御装置PC6と、を備える。その他の構成は、実施の形態1と同じであり、同一の構成部分には同一符号を付している。
【0196】
透過照明ユニット103aは、透過照明用の白色光を発するハロゲンランプ等の白色光源44と、白色光の照射および未照射を切り換えるシャッター43と、白色光源44からの白色光を標本S上に集光させる照明レンズ系45とを備え、標本Sに対して、蛍光顕微鏡ユニット101と反対側に配置されている。照明レンズ系45は、コレクタレンズ45aおよびコンデンサーレンズ45bを有し、標本Sに対してクリティカル照明を行う。なお、照明レンズ系45は、標本Sに対してケーラー照明を行うようにしてもよい。
【0197】
照明駆動部46は、制御装置PC6からの指示をもとに、シャッター43および蛍光照明ユニット104aを駆動する。ここで、蛍光照明ユニット104aは、筐体26によって一体に保持された励起光源4、レンズ5および蛍光キューブ6を有する。照明駆動部46は、シャッター43を開閉して標本Sに対する白色光の照射および未照射を切り換えるとともに、蛍光キューブ6を対物レンズ1と結像レンズ2との間の光路上に挿脱するように蛍光照明ユニット104aを移動させる。
【0198】
制御装置PC6は、制御装置PC1と同様に撮像装置3,13、励起光源4およびステージ駆動部8の動作を制御するのに加えて、照明駆動部46の動作を制御する。制御装置PC6は、蛍光観察から透過照明による観察に切り換える場合、蛍光キューブ6を対物レンズ1と結像レンズ2との間から取り除くように蛍光照明ユニット104aを移動させ、励起光源4を消灯し、シャッター43を開いて透過照明させる。透過照明による観察から蛍光観察に切り換える場合、制御装置PC6は、シャッター43を閉じ、蛍光キューブ6が対物レンズ1と結像レンズ2との間に配置されるように蛍光照明ユニット104aを移動させ、励起光源4を点灯する。
【0199】
また、微弱光観察から透過照明による観察に切り換える場合、制御装置PC6は、蛍光観察から透過照明による観察に切り換える場合の制御に加えて、ステージ駆動部8によって可動ステージ7bを駆動し、標本Sを蛍光結像光学系の視野内に移動させる制御を行う。なお、制御装置PC6は、シャッター43を開閉する替わりに、白色光源44を点灯および消灯するようにしてもよい。
【0200】
なお、透過照明ユニット103aは、明視野観察用の照明を行うように示したが、明視野観察用に限らず、暗視野観察用、微分干渉観察用または位相差観察用の照明を行うようにしてもよい。また、これらの各種観察用の照明を切り換え可能に備えてもよい。なお、微分干渉観察用の照明を行う場合、透過照明ユニット103aは、コンデンサーレンズ45bの光源側に偏光子および偏光分離プリズムを備え、蛍光結像光学系には、対物レンズ1の瞳側に偏光合成プリズムおよび検光子を配設するとよい。また、位相差観察用の照明を行う場合、透過照明ユニット103aは、コンデンサーレンズ45bの光源側にリングスリットを備え、蛍光結像光学系には、対物レンズ1の略瞳位置に位相板を配設するか、対物レンズ1を位相板を有する対物レンズに切り換えるようにするとよい。さらに、暗視野観察用の照明を行う場合、透過照明ユニット103aは、コンデンサーレンズ45bの光源側にリングスリット等を備えるようにするとよい。
【0201】
また、透過照明ユニット103aは、高倍率で透過照明による観察を行うために蛍光結像光学系に対応させて配置するように示したが、低倍率で観察を行えるように微弱光結像光学系に対応させて配置してもよい。あるいは、これらの結像光学系の両方に対応させて配置してもよく、各結像光学系に対して適宜配置を切り換えられるようにしてもよい。
【0202】
ところで、顕微鏡装置600では、顕微鏡装置100aの構成に透過照明ユニット103a、照明駆動部46をさらに備えるように示したが、これに限定されず、たとえば、図32〜図34に示すように、顕微鏡装置200,300,400の各構成に、透過照明ユニット103aと、照明駆動部46もしくは照明駆動部47とをさらに備えるようにしてもよい。
【0203】
図32に示す顕微鏡装置700は、顕微鏡装置200の構成に透過照明ユニット103a、照明駆動部46をさらに備えた場合であり、制御装置PC7は、制御装置PC2と同様に撮像装置3,13、励起光源4、回転駆動装置14およびステージ駆動部18を制御するとともに、制御装置PC6と同様に照明駆動部46によって透過照明ユニット103aおよび蛍光照明ユニット104aを制御する。
【0204】
図33に示す顕微鏡装置800は、顕微鏡装置300の構成に透過照明ユニット103a、照明駆動部46をさらに備えた場合であり、制御装置PC8は、制御装置PC3と同様に撮像装置3、励起光源4、回転駆動装置14およびステージ駆動部18を制御するとともに、制御装置PC6と同様に照明駆動部46によって透過照明ユニット103aおよび蛍光照明ユニット104aを制御する。
【0205】
図34に示す顕微鏡装置900は、顕微鏡装置300の構成に透過照明ユニット103a、照明駆動部47をさらに備えた場合であり、制御装置PC9は、制御装置PC4と同様に撮像装置3,13、およびステージ駆動部18を制御するとともに、照明駆動部47によって透過照明ユニット103a、ミラー34および蛍光照明ユニット105を制御する。
【0206】
すなわち、制御装置PC9は、蛍光観察または微弱光観察から透過照明による観察に切り換える場合、ミラー34および蛍光キューブ6を対物レンズ1と結像レンズ2との間から取り除くように蛍光照明ユニット105を移動させ、シャッター33を閉じて励起光を未照射とし、シャッター43を開いて透過照明させる。透過照明による観察から蛍光観察または微弱光に切り換える場合、制御装置PC9は、シャッター43を閉じ、蛍光キューブ6またはミラー34が対物レンズ1と結像レンズ2との間に配置されるように蛍光照明ユニット105またはミラー34を移動させる。蛍光観察を行う場合には、さらにシャッター33を開いて標本Sに蛍光を照射させる。
【0207】
このように、この実施の形態5にかかる顕微鏡装置600,700,800,900によれば、蛍光結像光学系および微弱光結像光学系の少なくとも一方に対応し、標本Sに対して透過照明を行う透過照明ユニットを備えるようにしているため、蛍光観察および微弱光観察ばかりでなく各種の透過照明による観察を行うことができ、標本Sを多角的に観察することができる。
【0208】
なお、上述した顕微鏡装置100a,200,300,400,600,700,800,900は、それぞれ正立型の顕微鏡装置として示したが、倒立型の顕微鏡装置としてもよい。また、上述した顕微鏡装置は、例えば、各種反応(例えば薬物刺激や光照射など)の検査や治療などに好適に用いることができる。
【0209】
以上、実施の形態について詳細に説明したが、本発明において、発光とは、化学反応により光を発生し得ることをいい、特に生物発光および化学発光を好適な例として含む用語である。これに対し、蛍光とは励起光により光を発生し得ることをいう。ここで、生物発光による光エネルギーにより励起されるBRET(生物発光共鳴エネルギー転移)は、基質溶液との化学反応が支配的要因であるので、本発明では発光に含めるものである。サンプルから発生する光は、特に生きた細胞に危害が少ない約400nm〜約900nmの間の波長を持つ電磁放射線をいう。発光するサンプルの撮像は、極めて低レベルの光(通常は単一光子事象)を検出し、画像の構築が可能になるまで光子放射を積分できる光検出器の使用を必要とする。そのような高感度光検出器の例には、単一光子事象を増幅した後、検出系に固有の背景ノイズに対して単一光子を検出できるカメラまたはカメラ群で、例えばCCDのような撮像素子群を具備するCCDカメラを例示できる。一般に、高感度を得るために、CCDカメラを液体窒素などで冷却する場合がある。高い開口数(NA)とくに、開口数(NA)/投影倍率(β)の2乗で表される光学的条件が0.01以上である対物レンズを用いる場合には、冷却温度をマイナス5℃〜マイナス20℃、好ましくはマイナス5℃〜常温でも画像化できると本発明者らによって確認された。さらに、検討を進めた結果、上記光学的条件(NA/β)の2乗が0.071以上である場合に、5分以内、場合によっては1分程度で視認可能で且つ解析可能な細胞画像を提供できることを突き止めた。一般に生きたサンプルは形状ないし発光部位の変化の為に、30分を越える撮像時間では鮮明な発光画像を得ることは困難な場合が多い。従って、本発明では、短時間、特に30分以内、好ましくは1分〜10分の間で1つの発光画像を取得し、撮像時間が速い蛍光測定との連携に有利な方法と装置を提供する。
【0210】
例えば関連する態様として、選択した生物適合成分の分布および/または局在に対するある処置の効果を記録するために、蛍光シグナルの局在および/または発光シグナルの強度を経時的に追跡したい場合は、光子放射の測定または撮像を選択した時間間隔で反復することにより、一連の画像を構築することができる。間隔は数分程度の短いものであってもよいし、数日または数週間程度に長いものであってもよい。発光画像または蛍光(または透過光)発光の重ね合せ画像は、画面表示、印刷された紙、グラフィック加工されたイメージ等の様々な形式で表現できる。
【0211】
他の関連する態様として、本発明は、発光性タンパク質をコードする遺伝子を誘導性プロモーターの制御下に含む構築物でトランスジェニックまたはキメラにした動物におけるプロモーター誘導事象の存在を検出した後にプロモーター誘導事象の活性度をモニタリングする方法を包含する。プロモーター誘導事象には、そのプロモーターを直接活性化する物質の投与、内因性プロモーター活性化因子の産生を刺激する物質の投与(例えばRNAウイルス感染によるインターフェロン産生の剌激)、内因性プロモーター活性化因子の産生をもたらす状態に置くこと(例えば熱ショックまたはストレス)などがある。
【0212】
またもう1つの態様として、本発明は、病原体による感染の重篤化を抑制するのに有効な治療用化合物を同定する方法をも包含する。この方法では、病原体と蛍光成分と発光成分の複合体を対照動物と実験動物、若しくはそれらの培養された組織(ないし細胞)に投与し、その実験動物を治療用化合物候補で処置する。そして、上述の方法によって測定対象であるサンプル内の蛍光シグナルの局在を確認した後に、局内が確認されたサンプルのみから発光シグナル(生物発光または化学発光)を連続的に測定する。こうすることによって、その化合物の治療上の有効性をモニタリングできる。
【0213】
さらなる別な態様として、本発明は、様々な不透明度を持つ媒質を通して局在化したサンプルを蛍光シグナルによって選んだ後で、局在が確認されたサンプルのみから連続的に発光測定する方法を包含する。この方法では、発光シグナルを、その媒質を透過した光子を積分して画像を作成することもできるが、局在が確認されたサンプルのみを媒質(例えば、臓器組織)から外科的に取り出して、取り出したサンプルを適宜の培養環境下で発光測定するように方法の改良を行なうことができる。限定された外科手術(例えばバイオプシー)は、元となる生物(例えば、哺乳類、とくにヒト)への身体的負担を最小限にし、必要なサンプルのみを安定した検査環境下に移して、種々の見込み有る薬剤に対する応答、治療後の経過管理、予防医学的試験を長期に実行できるという利点を有する。
【0214】
さらなる態様として、本発明は、ある生物内の特定の部位で、選択した物質(例えば溶存酸素またはカルシウム)の濃度を測定する方法を含むことができる。
【0215】
以上の説明において、本発明では次に示すような生物発光の画像解析(またはイメージング分析)ならではの分析試薬を提供することも可能である。とくに、本発明の好適な実施の形態では、不透明な組織を含まない、単離された細胞もしくは細胞群を主に含んでいるような生物学的試料の任意な生物学的活性(酵素活性、免疫学的活性、分子生物学的活性、遺伝学的活性、内科的活性など)を分析するための方法、試薬、ならびに装置を提供する。ここに、単離された細胞もしくは細胞群は、主に光透過性が高い材質からなる収容容器(例えば、ウエル、シャーレ、マイクロスライド、マイクロフルイディクス用チップ)中で長期間保持するので、細胞内活性を損失を最小限にするか実質的に失活せずに撮像を行うための独特な試薬または試薬環境を提供する。
【0216】
1.基質の長期使用に関する試薬とその取扱い
試料の細胞内活性を、例えば数時間から24時間、2日から6日間、1週間から数週間、または数週間超というように長期間培養などの技術で継続させる際、発光をもたらすためには、次のような特徴をもった取扱いが重要である。次に述べる幾つかの方法および/または試薬は、単独でもよいが、複数の方法を組み合わせる方がよい場合があるので、本発明では限定しない。
【0217】
(第1の取扱い方法) 現在市販または報告されている生物発光用試薬は、24時間まで観察可能な基質があるが、それ以上、例えば、数週間だと、基質の継ぎ足しが必要となる。細胞または細胞群を配置している培地に対して定期的ないし、測定の開始に同期して基質を添加する方法が好ましい。複数回の添加を行うのに適している試薬キットとして、同じパッケージに同封される発光タンパクを含む発光性試薬を含む収容手段(容器または袋)と、発光性試薬に対応する量の基質溶液(または基質含有培養液)を複数回の使用に足りるように複数に分割されて収容している収容手段(容器または袋)とを具備するのが好ましい。
【0218】
(第2の取扱い方法) 他の一面において、PH調整を長期に亘り実行する。そのために、例えば気体環境としての二酸化炭素ガスの濃度を一定量以上に保つ方法である。より詳細には、細胞が生き続けるに必要な最低量よりも高濃度なガスを存在させることができる。他方、充分大きな容量の気体環境を大気圧以上の蓄積容器(例えばガス用タンク)内に蓄積し、その容器から定期的ないし徐々に細胞(ないし細胞群)に向けて移動するように装置設計する。このような気体環境の局所的な移動は、細胞(ないし細胞群)の気体に対する代謝速度に応じた速度となるようにするのが好ましい。
【0219】
(第3の取扱い方法および試薬) PHを長時間一定に保証することが知られているHEPESを添加する。そのための方法には、上記気体環境の場合のように、細胞(ないし細胞群)が消費する固体、液体、気体の全てについての消費速度と関連したHEPES濃度に応じてHEPESを供給することができる。HEPESは、公知の除放性カプセルに封入して、有効数のカプセルを細胞(ないし細胞群)とともに液中ないし培地内に含ませておくことがさらに好ましい。有効量のHEPES(またはHEPESと同等のPH維持用化合物)を封入した徐放性カプセルを主に含んでいる溶液や培地は、本発明の目的を達成する有効な試薬となり得る。
【0220】
(第4の取扱い方法、装置または試薬) 本発明の主旨によれば、細胞または細胞群の内部温度を致命的な変化が起きない程度に調節するための保温用装置および/または薬剤を提供することができる。
【0221】
(第5の取扱い方法または試薬) 発光検出のバックグラウンドを長期に低くするための方法および/または試薬に関する。すなわち、生物発光(または化学発光)によるバックグラウンドの増加に関連する要素としての組織片、有色物(例えば発色性色素物質、とくにフェノールレッド色素))を除く方法であり、或いはこれら要素を予め充分に除去した培地または溶液を試薬として提供することができる。
【0222】
(第6の取扱い方法または試薬) 細胞、特に細胞群に対して基質を流通させることは発光の安定性や測定精度にとって重要である。方法としては、基質の細胞膜透過を助ける処理(例えば、圧力ショック、電気的ショック)を連続的、断続的または細胞の老化に応じて実行することができる。試薬としては、細胞膜透過性を補助または促進する添加物(例えば、膜溶解物質としての界面活性剤、膜浸透圧変容物質としての塩類)を含有する基質または別途緩衝溶液を試薬として提供することができる。これらの方法および/または試薬は、長期の測定中に細胞中において活性の有る基質が不足しないように、新鮮な細胞外の基質に対して透過性が継続するか、或いは一時的に透過性が高まるように設定するのが好ましい。
【0223】
(第7の取扱い方法) 均一な染色方法を達成する方法に関する。磁気ビーズをあらかじめ加えておき、数時間、または一日に一回攪拌する。通常は、収容する容器の底面上には細胞が貼り付いているため、上方から攪拌するのが好ましい。
【0224】
(第8の取扱い方法または試薬) 長期観察を行う際に、同一の細胞(または細胞群)について多数回の発光反応を繰り返すことで生じる副産物による、光学的または化学的な阻害の影響を除去する方法や試薬に関する。すなわち、基質を継ぎ足すような取扱いに応じて発光反応に伴う反応副産物が蓄積していく。この発光反応に伴う副産物(ピロリン酸)などを除去するために、副産物排除用物質(例えば、沈殿作用を有する金属イオン)を加える。
【0225】
(第9の取扱い方法または試薬) 発光成分としてのルシフェリンを再生させる方法または試薬に関する。ルシフェリンが発光後、オキシルシフェリンとなるが、これをルシフェリンに再生するための試薬をルシフェリンの老化または消耗に応じて細胞(または細胞群)に供給する方法が提供される。検出オキシルシフェリンがニトリル体2に変換された後、合成でも使われたように体内にあるシステインと反応し、ルシフェリンが再生することがホタルでは知られている。このような発光成分の活性低下を再生する再生物質を含んでいる基質、或いは別途の緩衝液を提供することも可能である。基質としては、他にセレンテラジンも含まれる。
【0226】
(第10の取扱い方法または試薬) 新規な試薬としてのカプセル封入型基質に関する。所定時間経過後または一定の時間間隔で溶出ないし液放出するようなカプセルに適当な基質(例えばルシフェリン)を封入しておき、基質を一定濃度を保つようにする。また、カプセルに封入されていない基質(例えばルシフェリン)と、カプセルに封入した同種の基質を同時に提供する方法、または混合した状態のカプセル含有溶液である試薬を提供することができる。また、徐放速度が異なる2以上のカプセルに同種の基質(例えばルシフェリン)を含有させた試薬を同時に細胞(ないし細胞群)と添加(または培地との接触)することにより、異なる放出時機に新鮮な基質が自動的に提供されるという利点を有する。こうすることによって、励起光照射時機と基質の放出時機を連携させることも可能となる。
【実施例1】
【0227】
ここでは、上述した実施の形態における所定部位発光量測定装置100を用いて、図10に示すプラスミドベクターを導入した複数のHeLa細胞を対象として、特定のHeLa細胞内のミトコンドリアからの発光量およびATP量を経時的に測定する。
【0228】
まず、本実施例1における実験プロトコルを説明する。
(1)蛍光タンパク質(GFP)とミトコンドリア移行シグナルとルシフェラーゼとが繋がった融合遺伝子を作製する。
(2)融合遺伝子が入ったプラスミドベクター(図10参照)をHeLa細胞に導入する。
(3)上述した実施の形態における所定部位発光量測定装置100(具体的には、本装置を構成する倒立蛍光顕微鏡)を用いて、GFPがミトコンドリアに局在しているか否かを判定することで、ルシフェラーゼがミトコンドリアに局在しているか否かを確認する(図11参照)。なお、図11は、所定部位発光量測定装置100を構成する蛍光画像撮像ユニット108で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および蛍光像を示す図である。
(4)HeLa細胞にヒスタミンを投与し、Ca2+を介したミトコンドリアのATP量の変動を引き起こす。
(5)上述した実施の形態における所定部位発光量測定装置100を用いて、ミトコンドリアから発せられる発光を画像として経時的に取得する(図12参照)。なお、図12は、所定部位発光量測定装置100を構成する発光画像撮像ユニット106で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および発光像を示す図である。
(6)上述した実施の形態における所定部位発光量測定装置100を用いて、明視野像、蛍光像および発光像を重ね合わせることで、測定する細胞を選定する。
(7)上述した実施の形態における所定部位発光量測定装置100を用いて、選定した細胞または領域の発光強度を経時的に測定し(図13参照)、ATP量の変動をモニタする。なお、図13は、所定部位発光量測定装置100で測定した、特定した番号1のHeLa細胞の発光強度の経時的変動を示す図である。
【0229】
つぎに、実験結果について説明する。図11に示すように、番号1のHeLa細胞においては、プラスミドベクターにより融合遺伝子が導入され且つミトコンドリアにルシフェラーゼが局在していることが確認でき、また、番号2および番号4のHeLa細胞においては、プラスミドベクターにより融合遺伝子が導入されていないことが確認でき、さらに、番号3のHeLa細胞においては、プラスミドベクターにより融合遺伝子が導入されているがミトコンドリアにルシフェラーゼが局在していないことが確認できた。なお、プラスミドベクターにより融合遺伝子が導入され且つミトコンドリアにルシフェラーゼが局在していることが確認できたHeLa細胞は、番号1の細胞のみであったので、測定対象のHeLa細胞は番号1のHeLa細胞に特定された。また、図12に示すように、番号3のHeLa細胞からの発光が最も強く、ついで番号1のHeLa細胞からの発光が強く、ついで番号2および番号4のHeLa細胞からの発光は同等の強さであることが確認できた。そして、図13に示すように、所定部位発光量測定装置100を用いることにより、番号1のHeLa細胞のミトコンドリアからの発光強度の経時変動をモニタすることができた。
【実施例2】
【0230】
ここでは、上述した実施の形態における図16に示す所定部位発光量測定装置100を用いて、ルシフェラーゼ遺伝子と緑色蛍光タンパク(GFP)遺伝子とを導入したHeLa細胞を対象として、当該HeLa細胞の発光観察および蛍光観察を行う。
【0231】
まず、本実施例2における実験プロトコルを説明する。
(1)ルシフェラーゼ遺伝子と緑色蛍光タンパク(GFP)遺伝子とを縦列して配置したベクター(EGFP−Luc、Clonetech社製)をリポフェクチン法によりHeLa細胞に導入する。
(2)ベクター導入から約24時間後、ベクターを導入したHeLa細胞を含む培養液(D−MEM、GIBCO、Invitrogen社製)にルシフェリンを500μM添加する。
(3)図16に示す所定部位発光量測定装置100のステージ104に、培養液を入れた容器を設置し、所定部位発光量測定装置100を用いてHeLa細胞の明視野画像、蛍光画像および発光画像を撮像する。なお、蛍光画像を撮像する場合には励起用分光フィルター108gおよび発光・蛍光分光用フィルター108jを入れ、当該撮像における露出時間を0.7秒間とした。また、発光画像を撮像する場合には発光・蛍光分光用フィルター108jを外し、当該撮像における露出時間を5分間とした。ここで、本実施例2では、対物レンズ108aとして、焦点距離(f)が9mmで開口数(NA)が0.75であるオリンパス社製の“Uapo 20X”を用いた。また、結像レンズ108eとして、焦点距離(f)が18mmで開口数(NA)が0.25で“(NA÷β)2”の値が0.035であるオリンパス社製の“LMPlanFL 10X”を用いた。また、光源108cとして、オリンパス社製のハロゲン光源“LG−PSs”を用いた。また、CCDカメラ108dとして、オリンパス社製の“DP−30BW”を用いた。また、励起用分光フィルター108gとして、オリンパス社製の“BP470−490”を用いた。また、発光・蛍光分光用フィルター108jとして、オメガ(Omega)社製の“510AF23”を用いた。
【0232】
つぎに、観察結果について説明する。図17は、ベクター(EGFP−Luc遺伝子)を導入したHeLa細胞の蛍光画像を示す図である。また、図18は、ベクター(EGFP−Luc遺伝子)を導入したHeLa細胞の蛍光画像と明視野画像とを重ね合わせた画像を示す図である。また、図19は、ベクター(EGFP−Luc遺伝子)を導入したHeLa細胞の発光画像を示す図である。図17、図18および図19に示すように、所定部位発光量測定装置100を用いて、遺伝子導入できたHeLa細胞を蛍光観察により特定することができ、さらに、当該特定したHeLa細胞を視野に入れてから発光画像の撮像を行うことができた。
【実施例3】
【0233】
ここでは、上述した実施の形態の発現量測定装置1000を用いて、蛍光で細胞周期のステージの同定しながら発光で解析対象の遺伝子の発現量の測定(解析対象の遺伝子のプロモーターアッセイ)を行う。
【0234】
まず、細胞に導入するベクターを作製する。具体的には、細胞周期関連遺伝子プロモーター導入ルシフェラーゼ(緑)発現ベクターを作製する。なお、用いる細胞はPC12である。つぎに、作製したベクターを細胞に導入する(トランスフェクション)。つぎに、細胞の細胞膜を“PKH LinkerKits(赤)”(SIGMA社製)を用いて染色する。つぎに、発現量測定装置1000を用いて、細胞周期のステージを同定しながら、解析対象遺伝子である細胞周期関連遺伝子のプロモータアッセイを行う。これにより、細胞周期と細胞の形態との関連を調べることができた。
【実施例4】
【0235】
ここでは、上述した実施の形態の発現量測定装置1000を用いて、発光で細胞周期のステージの同定しながら蛍光で解析対象の遺伝子の発現量の測定および発現時期・当該遺伝子の局在の同定を行う。
【0236】
まず、細胞に導入するベクターを作製する。具体的には、解析対象遺伝子プロモーターを導入した蛍光タンパク質ベクターを作製する。つぎに、HaloTag(登録商標)ベクター(プロメガ社製)を細胞に導入する。なお、用いる細胞はPC12である。つぎに、HaloTag(登録商標)リガンド(プロメガ社製)を細胞に添加して、細胞に対してルシフェラーゼ標識を行う。つまり、HaloTag(登録商標)(プロメガ社製)に対するリガンド結合により、細胞に対してルシフェラーゼ標識を行う。つぎに、発現量測定装置1000を用いて、細胞周期のステージをモニタリングしながら、細胞周期に関わる可能性のある解析対象遺伝子の発現時期・局在の同定を行う。これにより、当該解析対象遺伝子と細胞周期との関連性の有無、および当該解析対象遺伝子の細胞周期マーカーとしての有用性を評価することができた。
【0237】
以上のように、本発明にかかる所定部位発光量測定方法、所定部位発光量測定装置および測定装置は、生きたサンプル内の所定の部位からの発光量を測定する場合に有用であり、また、本発明にかかる発現量測定方法は、生きた細胞に導入した解析対象の遺伝子の発現量を測定すると共に細胞周期のステージを同定する場合に有用であり、バイオ、製薬、医療など様々な分野で好適に用いることができる。
【符号の説明】
【0238】
100 所定部位発光量測定装置
102 サンプル
103 容器
104 ステージ
106 発光画像撮像ユニット
106a 対物レンズ(発光観察用)
106b ダイクロイックミラー
106c CCDカメラ
106d スプリットイメージユニット
106e フィルターホイール
106f 結像レンズ
108 蛍光画像撮像ユニット
108a 対物レンズ(蛍光観察用)
108b ダイクロイックミラー
108c 光源
108d CCDカメラ
108e 結像レンズ
108f シャッター
108g 励起用分光フィルター
108h 光ファイバー
108i コンデンサーレンズ
108j 発光・蛍光分光用フィルター
110 情報通信端末
112 制御部
112a 蛍光画像撮像指示部
112b 蛍光画像取得部
112c 判定部
112d 発光画像撮像指示部
112e 発光画像取得部
112f 選定部
112g 発光量測定部
112h 関連物質定量部
114 クロック発生部
116 記憶部
118 通信インターフェース部
120 入出力インターフェース部
122 入力部
124 出力部
1000 発現量測定装置
1020 細胞
1030 容器
1040 ステージ
1060 発光画像撮像ユニット
1060a 対物レンズ(発光観察用)
1060b ダイクロイックミラー
1060c CCDカメラ
1060d スプリットイメージユニット
1060e フィルターホイール
1080 蛍光画像撮像ユニット
1080a 対物レンズ(蛍光観察用)
1080b ダイクロイックミラー
1080c キセノンランプ
1080d CCDカメラ
1100 情報通信端末
1120 制御部
1120a 蛍光画像撮像指示部
1120b 発光画像撮像指示部
1120c 蛍光画像取得部
1120d 発光画像取得部
1120e 判定部
1120f 蛍光測定部
1120g 発光測定部
1120h ステージ同定部
1120i 選択部
1120j 発現量測定部
1140 クロック発生部
1160 記憶部
1180 通信インターフェース部
1200 入出力インターフェース部
1220 入力部
1240 出力部
1,11 対物レンズ
2,12,32 結像レンズ
3,13 撮像装置
4 励起光源
5 レンズ
6 蛍光キューブ
6a 励起フィルター
6b 吸収フィルター
6c ダイクロイックミラー
7,17 保持部
7a 保持部材
7b,17b 可動ステージ
8,18 ステージ駆動部
9 モニター
14 回転駆動装置
15a,15b 固定軸
21,22,23,24,25,26 筐体
33,43 シャッター
34 ミラー
35 光路切換駆動部
44 白色光源
45 照明レンズ系
45a コレクタレンズ
45b コンデンサーレンズ
46 照明駆動部
100a,200,300,400,500,600,700,800,900 顕微鏡装置
101,201 蛍光顕微鏡ユニット
102a,202 微弱光顕微鏡ユニット
103a 透過照明ユニット
104a,105 蛍光照明ユニット
PC1〜PC9 制御装置
S 標本
【技術分野】
【0001】
本発明は、生きたサンプル内の所定の部位からの発光量を測定する所定部位発光量測定方法および所定部位発光量測定装置に関するものである。
本発明は、解析対象の遺伝子を導入した生きた細胞を対象として、蛍光測定および発光測定を組み合わせて、細胞周期のステージを同定すると共に解析対象の遺伝子の発現量を測定する発現量測定方法に関するものである。
本発明は、標本像を撮像して標本を観察する測定装置に関し、特に微弱光を発する発光標識および励起されて蛍光を発する蛍光標識が付与された標本の観察に適用して好適な測定装置に関するものである。
【背景技術】
【0002】
[I]ATPは、細胞内のエネルギーの供給源であり、生命現象に深く関わっている物質である。一方、ホタルのルシフェラーゼは、ATP、O2、Mg2+の存在下で、D‐ルシフェリンを発光基質として、オキシルシフェリン、CO2、AMP、ピロリン酸を生成する反応を触媒し、当該反応により発光する。また、ルシフェラーゼの発光反応はATP量に依存する。
【0003】
そのため、ルシフェラーゼの発光反応を利用してATPを定量することは古くから行われており、バイオ、臨床検査、食品衛生などの分野では、ルシフェラーゼを用いた細胞内のATP量の測定法が開発されている。
【0004】
例えば、細胞内のATP量の測定は、通常、以下の(1−1)〜(1−3)の工程で行われている。
(1−1)細胞または細菌を溶解してATPを抽出する。
(1−2)その抽出液をルシフェリンおよびルシフェラーゼを含む反応液に添加する。
(1−3)抽出液が添加された反応液から発光量を測定することで、細胞内のATPを定量する。
【0005】
また、破砕されてない細胞内のATP量の測定は、通常、以下の(2−1)〜(2−3)の工程で行われる。
(2−1)ルシフェラーゼ遺伝子を細胞に導入して発現させる。
(2−2)細胞を含む培養液中にルシフェリンを加える。
(2−3)ルシフェリンが加えられた培養液から発光量を測定することで、細胞内のATPを定量する。
【0006】
さらに、生きた細胞内の所定の部位(具体的にはミトコンドリア)におけるATP量の経時的測定は、以下の(3−1)および(3−2)の工程で行われる(非特許文献1)。
(3−1)ルシフェラーゼ遺伝子にミトコンドリア移行シグナル遺伝子を融合し、その融合した遺伝子を細胞に導入する。
(3−2)ルシフェラーゼが細胞内のミトコンドリアに局在しているという前提の下、細胞からの発光量を経時的に測定することで、細胞内のミトコンドリアにおけるATP量の変動を測定する。
なお、細胞内から発せられる発光の強度は極めて弱いので、1つの細胞を認識するために、イメージ・インテンシファイアを装着したCCDカメラでフォトンカウンティングを行う。また、ルシフェラーゼが細胞内のミトコンドリアに局在しているか否かは、発光量を測定した細胞とは別の細胞で確認する。具体的には、当該別の細胞を固定し、固定した細胞に抗ルシフェラーゼ抗体を反応させ、蛍光抗体法で細胞を観察することで局在の確認を行なう。これにより、測定した細胞からの発光量がミトコンドリアからの発光量に対応することを示した。
【0007】
[II]細胞増殖は生命維持において生物の基本的且つ重要な特徴の一つである。そして、細胞周期は細胞の成長やDNAの複製や染色体の分配や細胞の分裂などからなる複数の連続反応であり、細胞周期の各ステージにおいて様々な遺伝子の発現が変動することは十分に考えられる。また、細胞周期の異常や破綻は多くの慢性疾患や発癌に関与していると考えられている(特許文献1参照)。なお、特許文献1には、細胞周期調節因子の活性の測定法とそれを用いた癌の診断法に関する技術が開示されている。
【0008】
ところで、ルシフェラーゼ遺伝子をレポーター遺伝子として細胞に導入し、ルシフェラーゼ活性を指標にしてルシフェラーゼ遺伝子の発現の強さを調べる際、ルシフェラーゼ遺伝子の上流や下流に目的のDNA断片を繋ぐことで当該DNA断片がルシフェラーゼ遺伝子の転写に及ぼす影響を調べることができる。また、ルシフェラーゼ遺伝子の転写に影響を及ぼすと思われる転写因子などの遺伝子を発現ベクターに繋いでルシフェラーゼ遺伝子と共発現させることで、当該遺伝子の遺伝子産物がルシフェラーゼ遺伝子の発現に及ぼす影響を調べることができる。なお、ルシフェラーゼ遺伝子などのレポーター遺伝子を細胞に導入する方法には例えばリン酸カルシウム法やリポフェクチン法やエレクトロポーション法などがあり、各方法は目的や細胞の種類の違いに応じて使い分けられている。
【0009】
また、細胞内に導入され発現しているルシフェラーゼの活性の測定(モニター)は、まず細胞を溶解した細胞溶解液とルシフェリンやATPやマグネシウムなどを含む基質溶液とを反応させ、ついで基質溶液と反応させた細胞溶解液からの発光量を光電子増倍管を用いたルミノメーターで定量する、という手順で行われている。つまり、発光量は細胞を溶解した後に測定されている。これにより、ある時点でのルシフェラーゼ遺伝子の発現量を細胞全体の平均値として測定することができる。
【0010】
また、時間経過に沿ってルシフェラーゼ遺伝子の発現量を捉えるには生きた細胞からの発光量を経時的に測定する必要がある。そして、生きた細胞からの発光量の経時的測定は、まず細胞を培養するインキュベーターにルミノメーターの機能を付け、ついで全細胞集団からの発光量を、培養しながらルミノメーターで一定時間ごとに定量する、という手順で行われている。これにより、一定の周期性をもった発現リズムなどを測定することができ、よって、細胞全体におけるルシフェラーゼ遺伝子の発現量の経時的な変化を捉えることができる。
【0011】
しかし、上述した従来のレポーターアッセイでは、細胞周期のステージが異なる複数の細胞が混在しており、様々なステージの細胞を一群のデータとして取り扱っていた。そのため、細胞周期に関わる遺伝子を解析する際は、同調培養などの操作を行って細胞周期のステージを揃えている。
【0012】
[III]従来、標本像の結像倍率を高倍率と低倍率とに切り換えて標本を観察できる顕微鏡装置がよく利用されている。このような顕微鏡装置では、近年、高倍率の対物レンズによって低倍率の観察視野が制限されずに、より広範囲に標本の全体像を把握できるようにした顕微鏡装置が提案されている(たとえば、特許文献2参照)。特許文献2で開示されている顕微鏡装置では、低倍率で標本を観察する場合、高倍率の対物レンズを介さずに、焦点深度が従来よりも深い、すなわち、標本側の開口数(NA;Numerical Aperture)が従来よりも小さい低倍率専用の結像レンズを用いて標本像を結像するようにしている。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開2002−335997号公報
【特許文献2】特開平10−339845号公報
【非特許文献】
【0014】
【非特許文献1】H.J.Kennedy, A.E.Pouli, E.K.Ainscow, L.S.Jouaville, R.Rizzuto, G.A.Rutter, “Glucose generates sub−plasma membrane ATP microdomains in single islet β−cells.”, Journal of Biological Chemistry, vol.274, pp.13281−13291, 1999
【発明の概要】
【発明が解決しようとする課題】
【0015】
[I]しかしながら、従来技術では、細胞内の所定の部位に発光タンパク質が局在しているか否かを、発光量を測定した細胞とは別の細胞で確認しており、しかも蛍光抗体法で確認する際、細胞は死んでしまうので、発光量の測定対象である生きた細胞において、当該細胞内の所定の部位に発光タンパク質が局在しているか否かは必ずしも定かでなく、よって当該細胞からの発光量が所定の部位からの発光量であることも必ずしも明確でない、という問題点があった。
特に、複数の細胞に対する一過性の遺伝子導入の場合、全ての細胞に遺伝子が導入されるわけではないので、発光量の測定対象である生きた細胞と同じものに対して、遺伝子が細胞に導入されたか否かを確認し、遺伝子が導入された細胞内の所定の部位に発光タンパク質が局在するか否かを確認することが必要となる。
【0016】
本発明は、上記問題点に鑑みてなされたものであって、生きたサンプル内の所定の部位からの発光量を測定するにあたって、当該サンプルと同一のものに対して、所定の部位に発光たんぱく質が局在しているか否かを確認することができる所定部位発光量測定方法および所定部位発光量測定装置を提供することを目的とする。
【0017】
[II]しかしながら、従来技術における同調培養の操作は煩雑であるので、実験者にとって作業的に大きな負担となっていた、という問題点があった。
【0018】
本発明は、上記問題点に鑑みてなされたものであって、細胞に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる発現量測定方法を提供することを目的とする。
【0019】
[III]ところで、近年、細胞生物学、分子生物学などの研究分野では、緑色蛍光蛋白質(GFP;Green Fluorescent Protein)や生物発光酵素であるルシフェラーゼ遺伝子を発現のレポーターとして働かせ、細胞内の特定部位や機能蛋白質に蛍光標識や発光標識を付して生体細胞を観察する必要性が高まっている。このような細胞の観察では、通常、発現量の経時変化を捉えるため、時系列に細胞を観察し続ける必要がある。
【0020】
ところが、GFPを用いる観察では、GFPが励起光の照射に応じて蛍光を発する蛋白質であり、GFPを作用させた標本に大きな強度の励起光を照射して蛍光を得るため、標本に損傷を与えやすく、1〜2時間程度の観察が限度である。これに対して、ルシフェラーゼ遺伝子を用いる観察では、ルシフェラーゼ遺伝子が自己発光酵素であり、標本に損傷を与えることがなく、数日〜数週間程度の観察が可能である。このため、ルシフェラーゼ遺伝子を用いて経過観察を行い、この観察結果に応じて適宜にGFPを用いた観察に切り換えるようにして、標本の経時変化を捉えることが所望されている。
【0021】
しかしながら、ルシフェラーゼ遺伝子から発せられる光は極めて微弱なため、GFPからの蛍光を観察する場合などの蛍光観察で通常用いられる高倍率の結像光学系や、標本側および像側のNAが共に小さい従来の低倍率の結像光学系では、ルシフェラーゼ遺伝子からの微弱光を観察することはできず、蛍光観察と微弱光による微弱光観察とを両立する顕微鏡装置はこれまで実現されていない。また、微弱光観察による経過観察の結果に応じて即時に蛍光観察に切り換えられる顕微鏡装置も開発されていない。
【0022】
本発明は、上記に鑑みてなされたものであって、微弱光観察と蛍光観察とを適宜に切り換えることができるとともに、微弱光観察による観察結果に応じて即時に蛍光観察に切り換えることができる測定装置を提供することを目的とする。
【課題を解決するための手段】
【0023】
[I]上述した課題を解決し、目的を達成するために、本発明にかかる所定部位発光量測定方法は、発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定方法であって、前記融合遺伝子は、前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像ステップと、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定ステップと、前記判定ステップの判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定ステップと、を含むことを特徴とする。
【0024】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記融合遺伝子が導入された生きたサンプルが撮像範囲中に複数存在する場合、複数の前記サンプルの発光画像を撮る発光画像撮像ステップと、前記蛍光画像撮像ステップで撮像した蛍光画像および前記発光画像撮像ステップで撮像した発光画像を重ね合わせることで、前記判定ステップの判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定する選定ステップと、をさらに含み、前記蛍光画像撮像ステップは、複数の前記サンプルの蛍光画像を撮り、前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプルごとに判定し、前記発光量測定ステップは、前記選定ステップで選定したサンプルからの発光量を測定すること、を特徴とする。
【0025】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップを繰り返し実行することで、サンプル内の所定の部位からの発光量を経時的に得ること、を特徴とする。
【0026】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記サンプルからの発光を発光色別に分離する発光分離ステップ、をさらに含み、前記サンプルに導入される融合遺伝子は、複数存在し、前記移行塩基配列で移行させる発光タンパク質の移行先の部位と、前記発光タンパク質から発せられる発光の発光色と、前記蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製され、前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、前記発光量測定ステップは、前記判定ステップの判定結果が局在すると判定された場合、前記発光分離ステップで分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定すること、を特徴とする。
【0027】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記サンプルは、試料、組織、細胞、個体のいずれか1つであること、を特徴とする。
【0028】
また、本発明にかかる所定部位発光量測定方法は、前記に記載の所定部位発光量測定方法において、前記発光量測定ステップで測定した発光量に基づいて、前記選定ステップで選定したサンプル内の所定の部位におけるATPを定量するATP定量ステップ、をさらに含み、前記サンプルは細胞であり、前記所定の部位はミトコンドリアであり、前記移行塩基配列はミトコンドリア移行シグナルであり、前記発光タンパク質はルシフェラーゼであり、前記蛍光タンパク質は緑色蛍光タンパク質であり、前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップに加えてさらに前記ATP定量ステップを繰り返し実行することで、サンプル内の所定の部位からのATPを経時的に定量すること、を特徴とする。
【0029】
また、本発明は所定部位発光量測定装置に関するものであり、本発明にかかる所定部位発光量測定装置は、発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定装置であって、前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子を用い、当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像手段と、前記蛍光画像撮像手段で撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定手段と、前記判定手段の判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定手段と、を備えたことを特徴とする。
【0030】
[II]上述した課題を解決し、目的を達成するために、本発明にかかる発現量測定方法は、発光タンパク質を発現する発光関連遺伝子と蛍光タンパク質を発現する蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、細胞から発せられた蛍光の蛍光強度を測定する蛍光測定ステップと、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、前記細胞は、前記発光関連遺伝子、前記蛍光関連遺伝子および前記解析対象の遺伝子に加えてさらに、細胞周期の所定のステージで発現する細胞周期関連遺伝子を導入したものであり、前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定するステージ同定ステップ、をさらに含むことを特徴とする。
【0031】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記細胞が撮像範囲中に複数存在する場合、複数の細胞の蛍光画像を撮像する蛍光画像撮像ステップと、前記複数の細胞の発光画像を撮像する発光画像撮像ステップと、をさらに含み、前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、前記蛍光測定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて、各細胞から発せられた蛍光の蛍光強度をそれぞれ測定し、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、前記ステージ同定ステップは、前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、を特徴とする。
【0032】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、をさらに含み、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、を特徴とする。
【0033】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記蛍光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、を特徴とする。
【0034】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記発現量測定ステップは、前記選択ステップで選択した細胞を対象として、前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定すると共に、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて前記解析対象の遺伝子の細胞内における発現部位を同定すること、を特徴とする。
【0035】
また、本発明は発現量測定方法に関するものであり、本発明にかかる発現量測定方法は、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、前記細胞は、その所定の部位を蛍光物質で染色したものであり、当該細胞の蛍光画像を撮像する蛍光画像撮像ステップと、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを判定することで、細胞周期のステージを同定するステージ同定ステップと、をさらに含むことを特徴とする。
【0036】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記細胞が撮像範囲中に複数存在する場合、複数の細胞の発光画像を撮像する発光画像撮像ステップ、をさらに含み、前記蛍光画像撮像ステップは、前記複数の細胞の蛍光画像を撮像し、前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、前記ステージ同定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、を特徴とする。
【0037】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、をさらに含み、前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、を特徴とする。
【0038】
また、本発明にかかる発現量測定方法は、前記に記載の発現量測定方法において、前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、を特徴とする。
【0039】
[III]上記の目的を達成するために、この発明にかかる測定装置は、微弱光を発する発光標識および励起されて蛍光を発する蛍光標識が付与されて保持手段に保持される標本の標本像を結像する結像光学系と、該標本像を撮像する撮像手段とを備える測定装置において、前記結像光学系は、前記発光標識からの微弱光を前記標本像としての微弱光標本像を結像する微弱光結像光学系と、前記蛍光標識からの蛍光を前記標本像としての蛍光標本像を結像する蛍光結像光学系と、を備え、前記撮像手段は、前記微弱光標本像と前記蛍光標本像とを撮像することを特徴とする。なお、この発明にかかる測定装置は、顕微鏡光学系を有する計測装置を含むものである。
【0040】
また、この発明にかかる測定装置は、上記の発明において、前記蛍光結像光学系は、前記標本を照明する照明手段を備えることを特徴とする。
【0041】
また、この発明にかかる測定装置は、上記の発明において、前記撮像手段によって撮像された微弱光標本像の像特性をもとに、該微弱光標本像の撮像と前記蛍光標本像の撮像とを切り換える制御を行う撮像切換制御手段を備えたことを特徴とする。
【0042】
また、この発明にかかる測定装置は、上記の発明において、前記像特性は、前記微弱光標本像の像強度であり、前記撮像切換制御手段は、前記像強度が所定のしきい値より大きい場合、前記微弱光標本像の撮像から前記蛍光標本像の撮像に切り換えることを特徴とする。
【0043】
また、この発明にかかる測定装置は、上記の発明において、前記像強度は、前記微弱光標本像の全体または部分の像強度であって、所定時点から現時点までの累積の像強度または現時点の像強度であることを特徴とする。
【0044】
また、この発明にかかる測定装置は、上記の発明において、前記蛍光結像光学系は、前記蛍光標識の各点からの蛍光を略平行光束に変換する蛍光対物レンズと、前記蛍光対物レンズによって略平行光束に変換された蛍光を集光して前記蛍光標本像を結像する蛍光結像レンズと、前記蛍光標識を励起する励起光を選択的に透過させる励起光透過フィルター、前記蛍光標識からの蛍光を選択的に透過させる蛍光透過フィルターおよび前記励起光を反射し前記蛍光を透過させるダイクロイックミラーを有し、前記蛍光対物レンズと前記蛍光結像レンズとの間に配置される蛍光ユニットと、前記励起光を発する励起光源を有し、該励起光源からの励起光を前記ダイクロイックミラーによって反射させ前記標本に照射させる励起光照射手段と、を備えたことを特徴とする。
【0045】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系は、前記発光標識の各点からの微弱光を略平行光束に変換する微弱光対物レンズと、前記微弱光対物レンズによって略平行光束に変換された微弱光を集光して前記微弱光標本像を結像する微弱光結像レンズと、を備えたことを特徴とする。
【0046】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して互いに反対側に配置され、前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする。
【0047】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系の各視野を相対的に平行移動させる視野移動手段を備えることを特徴とする。
【0048】
また、この発明にかかる測定装置は、上記の発明において、前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有することを特徴とする。
【0049】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光対物レンズおよび前記蛍光対物レンズは、同一の対物レンズであり、前記微弱光結像光学系および前記蛍光結像光学系は、前記対物レンズを共用することを特徴とする。
【0050】
また、この発明にかかる測定装置は、上記の発明において、前記対物レンズと前記蛍光ユニットとの間の瞳空間に挿脱可能に配置され、該瞳空間に配置された場合、前記対物レンズからの微弱光を前記微弱光結像レンズに向けて反射させるミラーを備え、前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記ミラーを瞳空間に配置するとともに前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記ミラーを瞳空間に未配置にするとともに前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする。
【0051】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有し、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記微弱光結像光学系の視野内に移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記蛍光結像光学系の視野内に移動させる制御を行うことを特徴とする。
【0052】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系の各視野が前記標本を含むように前記微弱光結像光学系および前記蛍光結像光学系を移動させる光学系移動手段を備え、前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記微弱光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該微弱光結像光学系を移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記蛍光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該蛍光結像光学系を移動させる制御を行うことを特徴とする。
【0053】
また、この発明にかかる測定装置は、上記の発明において、前記光学系移動手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野の略中心点を結ぶ線分の中点を通り前記微弱光結像光学系および前記蛍光結像光学系の各光軸に略平行な回転軸を有し、該回転軸を中心に前記微弱光結像光学系および前記蛍光結像光学系を回転移動させることを特徴とする。
【0054】
また、この発明にかかる測定装置は、上記の発明において、前記撮像手段は、前記微弱光標本像を撮像する微弱光撮像手段と、前記蛍光標本像を撮像する蛍光撮像手段と、を備えることを特徴とする。
【0055】
また、この発明にかかる測定装置は、上記の発明において、前記撮像手段は、前記微弱光標本像を撮像する微弱光撮像手段と、前記蛍光標本像を撮像する蛍光撮像手段と、を備え、前記光学系移動手段は、前記微弱光結像光学系および前記微弱光撮像手段と、前記蛍光結像光学系および前記蛍光撮像手段と、をそれぞれ一体に移動させることを特徴とする。
【0056】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光標本像および前記蛍光標本像は、それぞれ前記微弱光結像レンズおよび前記蛍光結像レンズによって略同じ位置に結像され、前記撮像手段は、前記微弱光標本像および前記蛍光標本像が結像される位置に略一致して固定されることを特徴とする。
【0057】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系および前記蛍光結像光学系の少なくとも一方に対応し、前記標本に対して透過照明を行う照明手段を備えることを特徴とする。
【0058】
また、この発明にかかる測定装置は、上記の発明において、前記透過照明は、明視野観察用照明、暗視野観察用照明、微分干渉観察用照明および位相差観察用照明の少なくとも1つであることを特徴とする。
【0059】
また、この発明にかかる測定装置は、上記の発明において、前記微弱光結像光学系は、該微弱光結像光学系の標本側の開口数をNAoとし、前記微弱光標本像を結像する倍率をβとして、(NAo/β)2によって演算される値が0.01以上(本出願人による特許出願である特願2004−342940を引用。)であることを特徴とする。
【発明の効果】
【0060】
[I]本発明によれば、発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、所定の部位からの発光量を得るにあって、融合遺伝子は、移行塩基配列および発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、当該融合遺伝子が導入されたサンプルの蛍光画像を撮り、撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定し、判定結果が局在すると判定された場合、サンプルからの発光量を測定する。これにより、生きたサンプル内の所定の部位からの発光量を測定するにあたって、当該サンプルと同一のものに対して、所定の部位に発光たんぱく質が局在しているか否かを確認することができる、という効果を奏する。
【0061】
また、本発明によれば、融合遺伝子が導入された生きたサンプルが撮像範囲中に複数存在する場合、複数のサンプルの蛍光画像を撮り、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプルごとに判定し、複数のサンプルの発光画像を撮り、撮像した蛍光画像および撮像した発光画像を重ね合わせることで、判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定し、選定したサンプルからの発光量を測定する。これにより、複数のサンプルの中から個々のサンプルを識別し、単一のサンプル内の所定の部位からの発光量を測定することができる、という効果を奏する。
【0062】
また、本発明によれば、蛍光画像の撮像、局在の判定、発光画像の撮像、測定対象のサンプルの選定、発光量の測定を繰り返し実行することで、サンプル内の所定の部位からの発光量を経時的に得る。これにより、サンプル内の所定の部位における発光量の変動を経時的に測定することができる、という効果を奏する。
【0063】
また、本発明によれば、サンプルに導入される融合遺伝子は、複数存在し、移行塩基配列で移行させる発光タンパク質の移行先の部位と、発光タンパク質から発せられる発光の発光色と、蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製され、サンプルからの発光を発光色別に分離し、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、判定結果が局在すると判定された場合、分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定する。これにより、例えば、1つのサンプル内の複数の部位からの発光量を同時に測定することができる、という効果を奏する。
【0064】
また、本発明によれば、サンプルは、試料、組織、細胞、個体のいずれか1つであるので、様々なサンプルを対象とすることができる、という効果を奏する。
【0065】
また、本発明によれば、サンプルは細胞であり、所定の部位はミトコンドリアであり、移行塩基配列はミトコンドリア移行シグナルであり、発光タンパク質はルシフェラーゼであり、蛍光タンパク質は緑色蛍光タンパク質であり、測定した発光量に基づいて、選定したサンプル内の所定の部位におけるATPを定量し、蛍光画像の撮像、局在の判定、発光画像の撮像、測定対象のサンプルの選定、発光量の測定に加えてさらにATPの定量を繰り返し実行することで、サンプル内の所定の部位からのATPを経時的に定量する。これより、特定の細胞内のミトコンドリアにおけるATP量の変動を経時的に測定することができる、という効果を奏する。
【0066】
[II]本発明によれば、発光タンパク質を発現する発光関連遺伝子と蛍光タンパク質を発現する蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定し、細胞から発せられた蛍光の蛍光強度を測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定するにあたって、細胞は、発光関連遺伝子、蛍光関連遺伝子および解析対象の遺伝子に加えてさらに、細胞周期の所定のステージで発現する細胞周期関連遺伝子を導入したものであり、発現量の測定で発光強度を用いた場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、発現量の測定で蛍光強度を用いた場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定する。これにより、細胞に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに当該細胞に対して細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができる、という効果を奏する。具体的には、細胞周期との直接の関与が不明である解析対象の遺伝子に関して、薬剤投与や温度変化などの刺激で引き起こされる発現量の変化を細胞周期のステージと共に得ることができるので、当該解析対象の遺伝子と細胞周期との関与を検証することができる、という効果を奏する。また、細胞周期との直接の関与が示唆される解析対象の遺伝子に関して、当該解析対象の遺伝子の発現量と細胞周期のステージとを一緒に取得することができるので、当該解析対象の遺伝子が細胞周期マーカーとして有用であるか否かを評価することができる、という効果を奏する。
【0067】
また、本発明によれば、細胞が撮像範囲中に複数存在する場合、複数の細胞の蛍光画像を撮像し、複数の細胞の発光画像を撮像し、撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、撮像した蛍光画像に基づいて、各細胞から発せられた蛍光の蛍光強度をそれぞれ測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を細胞ごとに測定し、発現量の測定で発光強度を用いる場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定し、発現量の測定で蛍光強度を用いる場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定する。これにより、複数の細胞を対象として、解析対象の遺伝子の発現量を細胞ごとに測定すると共に、細胞周期のステージを細胞ごとに同定することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を細胞ごとに評価することができる、という効果を奏する。
【0068】
また、本発明によれば、ステージが同定された細胞の中から測定対象の細胞を選択し、測定した発光強度または測定した蛍光強度に基づいて、選択した細胞に導入された解析対象の遺伝子の発現量を測定する。これにより、複数の細胞の中から個々の細胞を識別し、単一の細胞を対象として、解析対象の遺伝子の発現量を測定すると共に、細胞周期のステージを同定することができる、という効果を奏する。
【0069】
また、本発明によれば、発光画像の撮像、蛍光画像の撮像、発光強度の測定、蛍光強度の測定、ステージの同定、細胞の選択、発現量の測定を繰り返し実行することで、選択した細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定する。これにより、単一の細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量の変動を経時的に測定することができる、という効果を奏する。
【0070】
また、本発明によれば、発現量の測定において、選択された細胞を対象として、測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、撮像した蛍光画像に基づいて解析対象の遺伝子の細胞内における発現部位を同定する。これにより、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができるだけでなく、解析対象の遺伝子の細胞内における発現部位を得ることができる、という効果を奏する。
【0071】
また、本発明によれば、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を測定するにあたって、細胞は、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色したものであり、当該細胞の蛍光画像を撮像し、撮像した蛍光画像に基づいて細胞の形状が変化したか否かを判定することで、細胞周期のステージを同定する。これにより、細胞に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに当該細胞に対して細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができる、という効果を奏する。具体的には、細胞周期との直接の関与が不明である解析対象の遺伝子に関して、薬剤投与や温度変化などの刺激で引き起こされる発現量の変化を細胞周期のステージと共に得ることができるので、当該解析対象の遺伝子と細胞周期との関与を検証することができる、という効果を奏する。また、細胞周期との直接の関与が示唆される解析対象の遺伝子に関して、当該解析対象の遺伝子の発現量と細胞周期のステージとを一緒に取得することができるので、当該解析対象の遺伝子が細胞周期マーカーとして有用であるか否かを評価することができる、という効果を奏する。
【0072】
また、本発明によれば、細胞が撮像範囲中に複数存在する場合、複数の細胞の発光画像を撮像し、複数の細胞の蛍光画像を撮像し、撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を細胞ごとに測定し、撮像した蛍光画像に基づいて細胞の形状が変化したか否かを細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定する。これにより、複数の細胞を対象として、解析対象の遺伝子の発現量を細胞ごとに測定すると共に、細胞周期のステージを細胞ごとに同定することができる、という効果を奏する。また、解析対象の遺伝子と細胞周期のステージとの関連性を細胞ごとに評価することができる、という効果を奏する。
【0073】
また、本発明によれば、ステージが同定された細胞の中から測定対象の細胞を選択し、測定した発光強度に基づいて、選択した細胞に導入された解析対象の遺伝子の発現量を測定する。これにより、複数の細胞の中から個々の細胞を識別し、単一の細胞を対象として、解析対象の遺伝子の発現量を測定すると共に、細胞周期のステージを同定することができる、という効果を奏する。
【0074】
また、本発明によれば、発光画像の撮像、蛍光画像の撮像、発光強度の測定、ステージの同定、細胞の選択、発現量の測定を繰り返し実行することで、選択した細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定する。これにより、単一の細胞を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量の変動を経時的に測定することができる、という効果を奏する。
【0075】
[III]本発明にかかる測定装置によれば、微弱光観察と蛍光観察とを保持手段に保持されている同一の標本に対して個別に実行することができるとともに、微弱光観察による観察結果に応じて即時に蛍光観察に切り換えることができる。
【図面の簡単な説明】
【0076】
【図1】図1は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図2】図2は、所定部位発光量測定装置100の発光画像撮像ユニット106の構成の一例を示す図である。
【図3】図3は、所定部位発光量測定装置100の発光画像撮像ユニット106の構成の別の一例を示す図である。
【図4】図4は、所定部位発光量測定装置100の情報通信端末110の構成の一例を示すブロック図である。
【図5】図5は、所定部位発光量測定装置100で行われる処理の一例を示すフローチャートである。
【図6】図6は、蛍光画像撮像ユニット108で撮像した明視野像および蛍光像の一例を示す図である。
【図7】図7は、発光画像撮像ユニット106で撮像した明視野像および蛍光像の一例を示す図である。
【図8】図8は、発光画像撮像ユニット106および蛍光画像撮像ユニット108で撮像した重ね合わせ画像の一例を時系列で示す図である。
【図9】図9は、特定した細胞の発光強度の経時的変動の一例を示す図である。
【図10】図10は、GFP‐ミトコンドリア移行シグナル‐ルシフェラーゼを融合したプラスミドベクターを示す図である。
【図11】図11は、蛍光画像撮像ユニット108で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および蛍光像を示す図である。
【図12】図12は、発光画像撮像ユニット106で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および発光像を示す図である。
【図13】図13は、特定したHeLa細胞の発光強度の経時的変動を示す図である。
【図14】図14は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図15】図15は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図16】図16は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【図17】図17は、EGFP−Luc遺伝子を導入したHeLa細胞の蛍光画像を示す図である。
【図18】図18は、EGFP−Luc遺伝子を導入したHeLa細胞の明視野画像と蛍光画像とを重ね合わせた画像を示す図である。
【図19】図19は、EGFP−Luc遺伝子を導入したHeLa細胞の発光画像を示す図である。
【図20】図20は、発現量測定装置1000の全体構成の一例を示す図である。
【図21】図21は、発現量測定装置1000の発光画像撮像ユニット1060の構成の一例を示す図である。
【図22】図22は、発現量測定装置1000の発光画像撮像ユニット1060の構成の別の一例を示す図である。
【図23】図23は、発現量測定装置1000の情報通信端末1100の構成の一例を示すブロック図である。
【図24】図24は、発現量測定装置1000で行われる処理の一例を示すフローチャートである。
【図25】図25は、本発明の実施の形態1にかかる顕微鏡装置の構成を示す図である。
【図26】図26は、図25に示した顕微鏡装置が微弱光観察と蛍光観察とを切り換える撮像切換処理の処理手順を示すフローチャートである。
【図27】図27は、本発明の実施の形態2にかかる顕微鏡装置の構成を示す図である。
【図28】図28は、本発明の実施の形態2にかかる顕微鏡装置の変形例の構成を示す図である。
【図29】図29は、本発明の実施の形態3にかかる顕微鏡装置の構成を示す図である。
【図30】図30は、本発明の実施の形態4にかかる顕微鏡装置の構成を示す図である。
【図31】図31は、本発明の実施の形態5にかかる顕微鏡装置の構成を示す図である。
【図32】図32は、本発明の実施の形態5にかかる顕微鏡装置の変形例の構成を示す図である。
【図33】図33は、本発明の実施の形態5にかかる顕微鏡装置の変形例の構成を示す図である。
【図34】図34は、本発明の実施の形態5にかかる顕微鏡装置の変形例の構成を示す図である。
【発明を実施するための形態】
【0077】
[I]以下に、本発明にかかる所定部位発光量測定方法および所定部位発光量測定装置の実施の形態を図面に基づいて詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。
【0078】
まず、本発明を実現する所定部位発光量測定装置100の構成について、図1〜図3を参照して説明する。図1は、所定部位発光量測定装置100の全体構成の一例を示す図である。
【0079】
図1に示すように、所定部位発光量測定装置100は、サンプル102と、サンプル102を収納した容器103(具体的にはシャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体など)と、容器103を配置するステージ104と、発光画像撮像ユニット106と、蛍光画像撮像ユニット108と、情報通信端末110と、で構成されている。また、所定部位発光量測定装置100において、発光画像撮像ユニット106に含まれる対物レンズ106aと蛍光画像撮像ユニット108に含まれる対物レンズ108aとは、図示の如く、サンプル102、容器103およびステージ104を挟んで上下の対向する位置に配置される。なお、図14に示すように、発光画像撮像ユニット106および蛍光画像撮像ユニット108の配置を入れ替えてもよい。蛍光よりも微弱な発光を測定するための発光画像撮像ユニット106を下側に配置することにより、カバー開閉によるサンプル上方からの外乱光を完全に遮断できて発光画像のS/N比を増すことができる。発光画像撮像ユニット106と別体の蛍光画像撮像ユニット108は、レーザー走査式の光学系であってもよい。
【0080】
再び図1に戻り、サンプル102は、発光タンパク質をサンプル102内の所定の部位(例えば、ミトコンドリアや細胞質、核など)に移行させる移行塩基配列および当該発光タンパク質を発現する発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子を導入したものである。また、サンプル102は、生きたものであり、例えば、試料、組織、細胞、個体などである。なお、サンプル102は、具体的には、当該融合遺伝子が入ったプラスミドベクターを導入したものでもよい。
【0081】
発光画像撮像ユニット106は、具体的には正立型の発光顕微鏡であり、サンプル102の発光画像を撮像する。発光画像撮像ユニット106は、図示の如く、対物レンズ106aと、ダイクロイックミラー106bと、CCDカメラ106cと、結像レンズ106fと、で構成されている。対物レンズ106aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー106bは、サンプル102から発せられた発光を色別に分離し、2色の発光を用いて発光量を色別に測定する場合に用いる。CCDカメラ106cは、対物レンズ106a、ダイクロイックミラー106bおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影されたサンプル102の発光画像および明視野画像を撮る。また、CCDカメラ106cは、情報通信端末110と有線または無線で通信可能に接続される。ここで、サンプル102が撮像範囲中に複数存在する場合、CCDカメラ106cは、当該撮像範囲中に含まれる複数のサンプル102の発光画像および明視野画像を撮像してもよい。結像レンズ106fは、対物レンズ106aおよびダイクロイックミラー106bを介して当該結像レンズ106fに入射した像(具体的にはサンプル102を含む像)を結像する。なお、図1では、ダイクロイックミラー106bで分離した2つの発光に対応する発光画像を2台のCCDカメラ106cで別々に撮像する場合の一例を示しており、1つの発光を用いる場合には、発光画像撮像ユニット106は、対物レンズ106a、1台のCCDカメラ106cおよび結像レンズ106fで構成されてもよい。
【0082】
ここで、2色の発光を用いて発光量を色別に測定する場合、発光画像撮像ユニット106は、図2に示すように、対物レンズ106aと、CCDカメラ106cと、スプリットイメージユニット106dと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、スプリットイメージユニット106dおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影されたサンプル102の発光画像(スプリットイメージ)および明視野像を撮像してもよい。スプリットイメージユニット106dは、サンプル102から発せられた発光を色別に分離し、ダイクロイックミラー106bと同様、2色の発光を用いて発光量を色別に測定する場合に用いる。
【0083】
また、複数色の発光を用いて発光量を色別に測定する場合(つまり、多色の発光を用いる場合)、発光画像撮像ユニット106は、図3に示すように、対物レンズ106aと、CCDカメラ106cと、フィルターホイール106eと、結像レンズ106fと、で構成されてもよい。そして、CCDカメラ106cは、フィルターホイール106eおよび結像レンズ106fを介して当該CCDカメラ106cのチップ面に投影されたサンプル102の発光画像および明視野画像を撮像してもよい。フィルターホイール106eは、サンプル102から発せられた発光をフィルター交換によって色別に分離し、複数色の発光を用いて発光量を色別に測定する場合に用いる。
【0084】
再び図1に戻り、蛍光画像撮像ユニット108は、具体的には倒立型の蛍光顕微鏡であり、サンプル102の蛍光画像を撮像する。蛍光画像撮像ユニット108は、図示の如く、対物レンズ108aと、ダイクロイックミラー108bと、光源108cと、CCDカメラ108dと、結像レンズ108eと、シャッター108fと、で構成されている。対物レンズ108aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー108bは、サンプル102からの蛍光を透過するとともに、光源108cから照射された励起光がサンプル102へ照射されるように励起光の方向を変える。光源108cは、励起光を照射するためのものであり、具体的には、キセノンランプ、ハロゲン等のランプ、レーザー、LEDなどである。CCDカメラ108dは、対物レンズ108a、ダイクロイックミラー108bおよび結像レンズ108eを介して当該CCDカメラ108dのチップ面に投影されたサンプル102の蛍光画像および明視野画像を撮る。また、CCDカメラ108dは、情報通信端末110と有線または無線で通信可能に接続される。ここで、サンプル102が撮像範囲中に複数存在する場合、CCDカメラ108dは、当該撮像範囲中に含まれる複数のサンプル102の蛍光画像および明視野画像を撮像してもよい。結像レンズ108eは、対物レンズ108aおよびダイクロイックミラー108bを介して当該結像レンズ108eに入射した像(具体的にはサンプル102を含む像)を結像する。シャッター108fは、光源108cから照射された励起光を切り替える。換言すると、シャッター108fは、光源108cから照射された励起光を透過したり遮断したりすることで、サンプル102への励起光の照射を切り替える。
【0085】
ここで、発光画像撮像ユニット106および蛍光画像撮像ユニット108は、具体的には、それぞれ倒立型の発光顕微鏡および倒立型の蛍光顕微鏡でもよく、ステージ104は回転するものでもよい。
【0086】
また、図1および図14に示した所定部位発光量測定装置100は発光画像撮像ユニット106と蛍光画像撮像ユニット108とを別々に備えた構成であったが、所定部位発光量測定装置100は、図15に示すように、蛍光画像撮像ユニット108のみを備えた構成であってもよい。換言すると、所定部位発光量測定装置100は、蛍光画像撮像ユニット108のみで蛍光観察と発光観察の両方を行う構成であってもよい。なお、図15に示す所定部位発光量測定装置100で蛍光・発光観察を行う場合、所定部位発光量測定装置100は、発光画像を撮像する(発光検出を行う)際に、シャッター108fの切り替えを自動又は手動で行うと共にダイクロイックミラー108bを光路(図15中の点線)から外れた位置まで自動又は手動で移動することが可能な構成であることが好ましい。これにより、発光画像中のノイズを減らすことができる。また、図15に示す所定部位発光量測定装置100の場合、対物レンズ108aは、具体的には、“(開口数/倍率)2の値が0.01以上”という条件を満たすものであることが好ましい。
また、所定部位発光量測定装置100は、図16に示すように、励起光の照射をサンプル102の上方から行い且つ蛍光・発光観察をサンプル102の下方から行う構成であってもよい。ここで、図16に示す所定部位発光量測定装置100の構成のうち、これまで説明してない構成のみを説明する。励起用分光フィルター108gは、光源108cから発せられた励起光を、波長領域の異なる複数の励起光に分離する。光ファイバー108hは、励起用分光フィルター108gで分離した各励起光をサンプル102へ導く。コンデンサーレンズ108iは、サンプル102を均等に照明するために用いるレンズであり、光ファイバー108hにより導かれた各励起光を集光する。発光・蛍光分光用フィルター108jは、サンプル102から放出された蛍光や発光を、強度や波長などの違いで分離する。なお、図16に示す所定部位発光量測定装置100の場合、対物レンズ108aは、具体的には、“(開口数/倍率)2の値が0.01以上”という条件を満たすものであることが好ましい。
【0087】
再び図1に戻り、情報通信端末110は、具体的にはパーソナルコンピュータである。そして、情報通信端末110は、図4に示すように、大別して、制御部112と、システムの時刻を計時するクロック発生部114と、記憶部116と、通信インターフェース部118と、入出力インターフェース部120と、入力部122と、出力部124と、で構成されており、これら各部はバスを介して接続されている。
【0088】
記憶部116は、ストレージ手段であり、具体的には、RAMやROM等のメモリ装置、ハードディスクのような固定ディスク装置、フレキシブルディスク、光ディスク等を用いることができる。そして、記憶部116は制御部112の各部の処理により得られたデータなどを記憶する。
【0089】
通信インターフェース部118は、情報通信端末110と、CCDカメラ106cおよびCCDカメラ108dと、の間における通信を媒介する。すなわち、通信インターフェース部118は他の端末と有線または無線の通信回線を介してデータを通信する機能を有する。
【0090】
入出力インターフェース部120は、入力部122や出力部124に接続する。ここで、出力部124には、モニタ(家庭用テレビを含む)の他、スピーカやプリンタを用いることができる(なお、以下で、出力部124をモニタとして記載する場合がある。)。また、入力部122には、キーボードやマウスやマイクの他、マウスと協働してポインティングデバイス機能を実現するモニタを用いることができる。
【0091】
制御部112は、OS(Operating System)等の制御プログラムや各種の処理手順等を規定したプログラムや所要データを格納するための内部メモリを有し、これらのプログラムに基づいて種々の処理を実行する。そして、制御部102は、大別して、蛍光画像撮像指示部112aと、蛍光画像取得部112bと、判定部112cと、発光画像撮像指示部112dと、発光画像取得部112eと、選定部112fと、発光量測定部112gと、関連物質定量部112hと、で構成されている。
【0092】
蛍光画像撮像指示部112aは、通信インターフェース部116を介して、CCDカメラ108dへ蛍光画像および明視野画像の撮像を指示する。蛍光画像取得部112bは、CCDカメラ108dで撮像した蛍光画像および明視野画像を、通信インターフェース部116を介して取得する。
【0093】
判定部112cは、蛍光画像取得部112bで取得した蛍光画像および明視野画像に基づいて、サンプル102に融合遺伝子が導入されたか否かを判定したり、所定の部位に発光タンパク質が局在するか否かを判定したりする。ここで、蛍光画像取得部112bで取得した蛍光画像および明視野画像に複数のサンプル102が存在する場合、判定部112cは、蛍光画像および明視野画像に基づいて、サンプル102に融合遺伝子が導入されたか否かをサンプル102ごとに判定したり、所定の部位に発光タンパク質が局在するか否かをサンプル102ごとに判定したりしてもよい。
【0094】
発光画像撮像指示部112dは、通信インターフェース部116を介して、CCDカメラ106cへ発光画像および明視野画像の撮像を指示する。発光画像取得部112eは、CCDカメラ106cで撮像した発光画像および明視野画像を、通信インターフェース部116を介して取得する。
【0095】
選定部112fは、蛍光画像取得部112bで取得した蛍光画像および明視野画像ならびに発光画像撮像取得部112eで取得した発光画像および明視野画像を重ね合わせることで、判定部112cの判定結果が局在すると判定されたサンプル102の中から測定対象のサンプル102を選定する。
【0096】
発光量測定部112gは、判定部112cの判定結果が局在すると判定されたサンプル102や選定部112fで選定したサンプル102からの発光量を発光画像に基づいて測定する。関連物質定量部112hは、発光量測定部112gで測定した発光量に基づいて、当該発光量の増減に対して直接的または間接的に関連する物質の量を定量する。例えば、発光タンパク質がルシフェラーゼの場合、関連物質定量部112hは、例えば当該ルシフェラーゼの発光量の増減に対して直接的に関連する物質であるATPの量を定量する。つまり、関連物質定量部112hは、発光量測定部112gで測定した発光量に基づいてATPを定量するATP定量手段として用いることができる。
【0097】
以上の構成において、所定部位発光量測定装置100で行われる処理の一例を、図5を参照して説明する。なお、以下では、複数のサンプル102に同じ融合遺伝子を導入して、複数のサンプル102のうち特定のサンプル102における所定の部位での発光量を経時的に測定する場合の処理の一例について説明する。
【0098】
まず、情報通信端末110は、蛍光画像撮像指示部110aの処理で、通信インターフェース部116を介して、CCDカメラ108dへ蛍光画像および明視野画像の撮像を指示する(ステップSA−1)。つぎに、CCDカメラ108dは、撮像範囲中に存在する複数のサンプル102の蛍光画像および明視野画像を撮像し、(ステップSA−2:図6参照)、情報通信端末110へ送信する(ステップSA−3)。なお、励起光は蛍光画像を撮像する時のみサンプル102へ照射する。つぎに、情報通信端末110は、蛍光画像取得部112bの処理で、CCDカメラ108dで撮像した蛍光画像および明視野画像を、通信インターフェース部116を介して取得し、記憶部116の所定の記憶領域に記憶する(ステップSA−4)。
【0099】
つぎに、情報通信端末110は、判定部112cの処理で、蛍光画像と明視野画像とを比較することで、融合遺伝子が導入されているか否かをサンプル102ごとに判定し、導入されていると判定されたサンプル102に対してさらに当該サンプル102の所定の部位に発光タンパク質が局在するか否かを判定する(ステップSA−5)。これにより、図6に示すように、例えば、複数のサンプル102(細胞1〜細胞5)の中から、遺伝子が導入され、且つ所定の部位に発光タンパク質が局在しているもの(細胞1)を確認することができる。
【0100】
つぎに、遺伝子が導入され、且つ所定の部位に発光タンパク質が局在しているサンプル102が存在した場合(ステップSA−6:Yes)、情報通信端末110は、発光画像撮像指示部112dの処理で、通信インターフェース部116を介して、CCDカメラ106cに対して発光画像および明視野画像の撮像を指示する(ステップSA−7)。つぎに、CCDカメラ106cは、撮像範囲中に存在する複数のサンプル102の発光画像および明視野画像を撮像し(ステップSA−8:図7参照)、情報通信端末110へ送信する(ステップSA−9)。なお、図7に示した発光画像では、細胞2の発光が最も強い場合を一例として示している。
【0101】
つぎに、情報通信端末110は、発光画像取得部112eの処理で、CCDカメラ106cで撮像した発光画像および明視野画像を、通信インターフェース部116を介して取得すると共に、制御部112の処理で、クロック発生部114から時刻(後述する図8におけるT1に対応)を取得し、発光画像および明視野画像と時刻とを、既に記憶されている蛍光画像および明視野画像とさらに対応付けて記憶部116の所定の記憶領域に記憶する(ステップSA−10)。
【0102】
つぎに、情報通信端末110は、選定部112fの処理で、明視野画像、蛍光画像および発光画像を重ね合わせることで、判定部112cの判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定(特定)する(ステップSA−11)。なお、図6に示した例では、遺伝子が導入され、且つ所定の部位に発光タンパク質が局在している細胞は細胞1のみであるので、ステップSA−11では、図8に示すように、自動的に細胞1が特定される。
【0103】
つぎに、情報通信端末110は、発光量測定部112gの処理で、選定したサンプル102に対応する発光量(発光強度)を発光画像に基づいて測定し、選定したサンプル102(例えば図8における細胞1)を識別する識別情報と当該発光量とを、既に記憶されている蛍光画像、発光画像、明視野画像および時刻とさらに対応付けて記憶部116の所定の記憶領域に記憶する(ステップSA−12)。
【0104】
そして、情報通信端末110は、制御部112の処理で、上述したステップSA−1〜ステップSA−12を、例えば予め設定した時間間隔で所定の回数繰り返し実行する(SA−13)ことで、図9に示すように、選定したサンプル102(例えば、図6、図7および図8に示す細胞1)内の所定の部位における発光量の変動を、経時的(例えば、図8および図9に示す時刻T1〜T4ごと)に得る。
【0105】
以上、詳細に説明したように、所定部位発光量測定装置100によれば、サンプル102に導入する融合遺伝子は、移行塩基配列および発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、当該融合遺伝子が導入されたサンプル102の蛍光画像を撮り、撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定し、判定結果が局在すると判定された場合、サンプル102からの発光量を測定する。これにより、生きたサンプル102内の所定の部位からの発光量を測定するにあたって、当該サンプル102と同一のものに対して、所定の部位に発光たんぱく質が局在しているか否かを確認することができる。また、融合遺伝子が導入された生きたサンプルに対し発光タンパク質の局在を確認すると共に、当該サンプルからの発光量を測定するので、サンプルからの発光量は所定の部位からの発光量に明確に対応しており、測定した発光量が所定の部位からのものであることの信頼性を確保することができる。なお、サンプル102が例えば細胞の場合、発光成分を取り込んでいない細胞をカウントせずに、正確な統計解析が可能である。また、所定部位発光量測定装置100は、例えば、各種反応(例えば薬物刺激や光照射など)の検査や治療などに好適に用いることができる。
【0106】
また、所定部位発光量測定装置100によれば、融合遺伝子が導入された生きたサンプル102が撮像範囲中に複数存在する場合、複数のサンプル102の蛍光画像を撮り、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプル102ごとに判定し、複数のサンプル102の発光画像を撮り、撮像した蛍光画像および撮像した発光画像を重ね合わせることで、判定結果が局在すると判定されたサンプル102の中から測定対象のサンプル102を選定し、選定したサンプル102からの発光量を測定する。これにより、複数のサンプル102の中から個々のサンプル102を識別し、単一のサンプル102内の所定の部位からの発光量を測定することができる。また、蛍光および発光を画像で取得することで、測定対象のサンプル102と同一のサンプル102における発光タンパク質の局在と、当該サンプル102から発せられる発光強度と、を得ることができる。そのため、遺伝子の導入効率や細胞周期による個々の細胞の生理的な状態の違いの影響を排除した解析を行うことができる。ここで、本実施の形態の所定部位発光量測定装置100では、図5に示すように、一例として、蛍光画像を撮像した後、発光タンパク質が所定の部位に局在しているか否かの判定を行い、そして、局在すると判定された場合に発光画像を撮像する、という処理を行なっているが、発光画像の撮像は、蛍光画像の撮像とともに行なってもよい。換言すると、所定部位発光量測定装置100は、蛍光画像および発光画像を撮像した後、局在の判定を行なってもよい。具体的には、所定部位発光量測定装置100は、融合遺伝子が導入された生きたサンプル102が撮像範囲中に複数存在する場合、複数のサンプル102について、蛍光画像および発光画像を撮り、蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプル102ごとに判定し、撮像した蛍光画像および撮像した発光画像を重ね合わせることで、判定結果が局在すると判定されたサンプル102の中から測定対象のサンプル102を選定し、選定したサンプル102からの発光量を測定してもよい。
【0107】
さらに、所定部位発光量測定装置100によれば、蛍光画像の撮像、局在の判定、発光画像の撮像、測定対象のサンプル102の選定、発光量の測定を繰り返し実行することで、サンプル102内の所定の部位からの発光量を経時的に得る。これにより、例えば特定のサンプル102内の所定の部位における発光量の変動を経時的に測定することができる。
【0108】
ここで、所定部位発光量測定装置100において、サンプルに導入される融合遺伝子は、複数存在し、移行塩基配列で移行させる発光タンパク質の移行先の部位と、発光タンパク質から発せられる発光の発光色と、蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製されたものでもよい。そして、この場合、所定部位発光量測定装置100は、サンプル102からの発光を発光色別に分離し、撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、判定結果が局在すると判定された場合、分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定してもよい。これにより、例えば、1つのサンプル102内の複数の部位からの発光量を同時に測定することができたり、サンプル102内の複数の部位からの発光量をサンプル102ごとに同時に測定することができたりする。
具体的には、サンプル102が細胞である場合、細胞に導入される融合遺伝子を2つ作製し、1つは、ミトコンドリア移行シグナルで移行させる緑色ルシフェラーゼの移行先の部位であるミトコンドリアと、緑色ルシフェラーゼから発せられる発光の発光色(緑色)と、GFPから発せられる蛍光の蛍光色(緑色)と、の組み合わせで作製され、残りの1つは、細胞質で発現させる赤色ルシフェラーゼから発せられる発光の発光色(赤色)と、CFPから発せられる蛍光の蛍光色(シアン)と、の組み合わせで作製されてもよい。そして、この場合、所定部位発光量測定装置100は、細胞からの発光を発光色別(緑色、赤色)に分離し、撮像した蛍光画像に基づいて、ミトコンドリアに緑色ルシフェラーゼが局在するか否かをGFPから発せられる蛍光色(緑色)で判定し、細胞質に赤色ルシフェラーゼが局在するか否かをCFPから発せられる蛍光色(シアン)で判定し、判定結果が局在すると判定された場合、分離した2つの発光(緑色、赤色)のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定してもよい。換言すると、細胞内のミトコンドリアに対しては、移行塩基配列としてミトコンドリア移行シグナル、発光タンパク質として緑色ルシフェラーゼ、蛍光タンパク質としてGFPを選択し、一方、当該細胞内の細胞質に対しては、移行塩基配列は用いず、発光タンパク質として赤色ルシフェラーゼ、蛍光タンパク質としてCFPを選択し、ミトコンドリアと細胞質での発光量(さらにはATP量など)の変動を発光強度の変化として個別に且つ同時に測定してもよい。
【0109】
また、所定部位発光量測定装置100において、測定した発光量に基づいて、当該発光量の増減に対して直接的または間接的に関連する物質の量を定量してもよい。具体的には、発光タンパク質がルシフェラーゼの場合、例えば当該ルシフェラーゼの発光量の増減に対して直接的に関連する物質であるATPの量を定量してもよい。これにより、特定のサンプル102内の所定の部位における関連物質(例えばATPなど)の量の変動を例えば経時的に測定することができる。
【0110】
また、他の実施の形態として、例えば、細胞周期ごとに発現量及び/又は局在部位が変化するような蛍光タンパク質および発光タンパク質を含む細胞を作製し、当該細胞から発せられる蛍光および発光を経時的に測定することで、細胞周期を、蛍光タンパク質の発現量及び/又は局在部位の変化で確認するとともに細胞の発光量の変動を経時的に測定してもよい。
また、複数の神経細胞を対象とした場合、神経細胞に導入する融合遺伝子として、発光タンパク質を発現する発光関連遺伝子、当該発光タンパク質を別の神経細胞へ移行させる移行塩基配列および蛍光タンパク質を発現する蛍光関連遺伝子を融合したものを作製し、当該融合遺伝子が導入された神経細胞から別の神経細胞へ発光タンパク質が移行する過程を、神経細胞から発せられる蛍光色で確認し、当該移行する過程における神経細胞における発光量の変動を経時的に測定してもよい。
【0111】
(付記)蛍光タンパク質を発現する蛍光関連遺伝子および発光タンパク質を発現する発光関連遺伝子を融合した融合遺伝子を導入したサンプルから発せられる蛍光の蛍光強度を測定する蛍光測定ステップと、
前記蛍光測定ステップで測定した蛍光強度に基づいてサンプルの位置を特定する位置特定ステップと、
当該サンプルから発せられる発光の発光強度を測定する発光測定ステップと、
前記発光測定ステップで測定した発光強度に基づいて発光量を定量する発光量定量ステップと、
を含むことを特徴とする蛍光・発光測定方法。
【0112】
[II]以下に、本発明にかかる発現量測定方法の実施の形態を図面に基づいて詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。
【0113】
まず、本発明を実施するための装置である発現量測定装置1000の構成について、図20〜図22を参照して説明する。図20は、発現量測定装置1000の全体構成の一例を示す図である。
【0114】
図20に示すように、発現量測定装置1000は、細胞1020と、細胞1020を収納した容器1030(具体的にはシャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体など)と、容器1030を配置するステージ1040と、発光画像撮像ユニット1060と、蛍光画像撮像ユニット1080と、情報通信端末1100と、で構成されている。また、発現量測定装置1000において、発光画像撮像ユニット1060に含まれる対物レンズ1060aと蛍光画像撮像ユニット1080に含まれる対物レンズ1080aとは、図示の如く、細胞1020、容器1030およびステージ1040を挟んで上下の対向する位置に配置される。なお、発光画像撮像ユニット1060および蛍光画像撮像ユニット1080の配置を入れ替えてもよい。
【0115】
細胞1020は、発光タンパク質(具体的にはルシフェラーゼ)を発現する発光関連遺伝子、蛍光タンパク質(具体的にはGFP)を発現する蛍光関連遺伝子および解析対象の遺伝子に加えてさらに、細胞周期における所定のステージで発現する細胞周期関連遺伝子を導入した生きたものである。ここで、本明細書において発光とは、生物発光および化学発光を含む概念である。
なお、細胞1020は、発光関連遺伝子と蛍光関連遺伝子と解析対象の遺伝子と細胞周期関連遺伝子とを融合した融合遺伝子を導入した生きたものでもよい。具体的には、細胞1020は、発光関連遺伝子と蛍光関連遺伝子と解析対象の遺伝子と細胞周期関連遺伝子とを融合したベクターを導入した生きたものでもよい。また、細胞1020に対し発光関連遺伝子または蛍光関連遺伝子と組み合わせて導入する解析対象の遺伝子の数は複数でもよい。換言すると、細胞1020に対し解析対象の遺伝子と発光関連遺伝子または蛍光関連遺伝子との組を複数導入してもよい。これにより、細胞周期のステージを同定すると共に、細胞1020に導入した複数の解析対象の遺伝子の発現量を一緒に測定することができる。
【0116】
ここで、蛍光で細胞周期のステージを同定し、発光で解析対象の遺伝子の発現量を測定する場合、細胞1020は、蛍光関連遺伝子と細胞周期関連遺伝子とを関連付けて導入すると共に、発光関連遺伝子と解析対象の遺伝子とを関連付けて導入した生きたものでもよい。具体的には、細胞1020は、蛍光関連遺伝子と細胞周期関連遺伝子とを融合したベクター(蛍光関連遺伝子導入ベクター)を導入すると共に、発光関連遺伝子と解析対象の遺伝子とを融合したベクター(発光関連遺伝子導入ベクター)を導入した生きたものでもよい。また、細胞周期関連遺伝子プロモーターを導入したベクターを細胞1020に導入してもよい。具体的には、細胞周期マーカーとして知られているCyclin B1プロモーターを導入したGFPセンサー(アマシャムバイオサイエンス社製)を細胞1020に導入してもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020を蛍光標識してもよい。また、解析対象の遺伝子プロモーターを導入したルシフェラーゼベクターを細胞1020に導入し、発現させてもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020をルシフェラーゼ標識してもよい。
【0117】
また、蛍光で細胞周期のステージを同定し、発光で解析対象の遺伝子の発現量を測定する場合、細胞1020は、発光関連遺伝子と解析対象の遺伝子とを導入し、細胞1020の所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きたものでもよい。具体的には、細胞1020は、発光関連遺伝子と解析対象の遺伝子とを融合した融合遺伝子(具体的には、発光関連遺伝子と解析対象の遺伝子とを融合したベクター)を導入し、細胞1020の所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きたものでもよい。ここで、細胞1020の核を、生細胞核染色試薬“DRAQ5”(Biostatus社製)を用いて染色してもよい。また、細胞1020の細胞膜を、“PKH LinkerKits”(SIGMA社製)を用いて染色してもよい(ただし、この場合、その形状から細胞周期のステージが同定可能な細胞(具体的にはPC12など)を用いる。)。
【0118】
また、発光で細胞周期のステージを同定し、蛍光で解析対象の遺伝子の発現量を測定する場合、細胞1020は、発光関連遺伝子と細胞周期関連遺伝子とを関連付けて導入すると共に、蛍光関連遺伝子と解析対象の遺伝子とを関連付けて導入した生きたものでもよい。具体的には、細胞1020は、発光関連遺伝子と細胞周期関連遺伝子とを融合したベクター(発光関連遺伝子導入ベクター)を導入すると共に、蛍光関連遺伝子と解析対象の遺伝子とを融合したベクター(蛍光関連遺伝子導入ベクター)を導入した生きたものでもよい。また、細胞周期関連遺伝子プロモーターを導入したベクターを細胞1020に導入してもよい。具体的には、Cyclin B1プロモーターを導入したルシフェラーゼベクターを作製し、細胞1020に導入してもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020をルシフェラーゼ標識してもよい。また、解析対象の遺伝子プロモーターを導入した蛍光タンパク質ベクターを細胞1020に導入し、発現させてもよい。また、HaloTag(登録商標)ベクター(プロメガ社製)を細胞1020に導入し、HaloTag(登録商標)リガンド(プロメガ社製)を細胞1020に添加して、細胞1020を蛍光標識してもよい。また、β−lactamase遺伝子をレポーター遺伝子として細胞1020に導入してもよい。
【0119】
なお、細胞周期関連遺伝子としては、サイクリン(具体的には、Cyclin A1、Cyclin A2、Cyclin B1、Cyclin B2、Cyclin B3、Cyclin C、Cyclin D1、Cyclin D2、Cyclin D3、Cyclin E1、Cyclin E2、Cyclin F、Cyclin G1、Cyclin G2、Cyclin H、Cyclin I、Cyclin T1、Cyclin T2a、Cyclin T2bなど)、サイクリンキナーゼ(具体的には、CDK2、CDK28など)などを適用してもよい。また、解析対象の遺伝子としては、上述した細胞周期関連遺伝子、サーカディアンリズム調節遺伝子(具体的には、period遺伝子、Kai遺伝子、timeless遺伝子、per遺伝子、clock遺伝子など)、その他細胞周期との関連性が不明な遺伝子などを適用してもよい。
【0120】
再び図20の説明に戻り、発光画像撮像ユニット1060は、具体的には正立型の発光顕微鏡であり、細胞1020の発光画像を撮像する。発光画像撮像ユニット1060は、図示の如く、対物レンズ1060aと、ダイクロイックミラー1060bと、CCDカメラ1060cと、で構成されている。対物レンズ1060aは、具体的には、(開口数/倍率)2の値が0.01以上のものである。ダイクロイックミラー1060bは、細胞1020から発せられた発光を色別に分離し、2色の発光を用いて発光強度を色別に測定する場合に用いる。CCDカメラ1060cは、対物レンズ1060aを介して当該CCDカメラ1060cのチップ面に投影された細胞1020の発光画像や明視野画像を撮る。また、CCDカメラ1060cは、情報通信端末1100と有線または無線で通信可能に接続される。ここで、細胞1020が撮像範囲中に複数存在する場合、CCDカメラ1060cは、撮像範囲中に含まれる複数の細胞1020の発光画像や明視野画像を撮像してもよい。なお、図20では、ダイクロイックミラー1060bで分離した2つの発光に対応する発光画像を2台のCCDカメラ1060cで別々に撮像する場合の一例を示しており、1つの発光を用いる場合には、発光画像撮像ユニット1060は、対物レンズ1060aおよび1台のCCDカメラ1060cで構成されてもよい。
【0121】
ここで、2色の発光を用いて発光強度を色別に測定する場合、発光画像撮像ユニット1060は、図21に示すように、対物レンズ1060aと、CCDカメラ1060cと、スプリットイメージユニット1060dと、で構成されてもよい。そして、CCDカメラ1060cは、スプリットイメージユニット1060dを介して当該CCDカメラ1060cのチップ面に投影されたサンプル1020の発光画像(スプリットイメージ)や明視野像を撮像してもよい。スプリットイメージユニット1060dは、細胞1020から発せられた発光を色別に分離し、ダイクロイックミラー1060bと同様、2色の発光を用いて発光強度を色別に測定する場合に用いる。
【0122】
また、複数色の発光を用いて発光強度を色別に測定する場合(つまり、多色の発光を用いる場合)、発光画像撮像ユニット1060は、図22に示すように、対物レンズ1060aと、CCDカメラ1060cと、フィルターホイール1060eと、で構成されてもよい。そして、CCDカメラ1060cは、フィルターホイール1060eを介して当該CCDカメラ1060cのチップ面に投影された細胞102の発光画像や明視野画像を撮像してもよい。フィルターホイール1060eは、細胞1020から発せられた発光をフィルター交換によって色別に分離し、複数色の発光を用いて発光強度を色別に測定する場合に用いる。
【0123】
再び図20に戻り、蛍光画像撮像ユニット1080は、具体的には倒立型の蛍光顕微鏡であり、細胞1020の蛍光画像を撮像する。蛍光画像撮像ユニット1080は、図示の如く、対物レンズ1080aと、ダイクロイックミラー1080bと、キセノンランプ1080cと、CCDカメラ1080dと、で構成されている。CCDカメラ1080dは、対物レンズ1080aを介して当該CCDカメラ1080dのチップ面に投影された細胞1020の蛍光画像や明視野画像を撮る。また、CCDカメラ1080dは、情報通信端末1100と有線または無線で通信可能に接続される。ここで、細胞1020が撮像範囲中に複数存在する場合、CCDカメラ1080dは、撮像範囲中に含まれる複数の細胞1020の蛍光画像や明視野画像を撮像してもよい。ダイクロイックミラー1080bは、細胞102からの蛍光を透過するとともに、キセノンランプ1080cから照射された励起光が細胞1020へ照射されるように励起光の方向を変える。キセノンランプ1080cは励起光を照射する。
【0124】
ここで、発光画像撮像ユニット1060および蛍光画像撮像ユニット1080は、具体的には、それぞれ倒立型の発光顕微鏡および倒立型の蛍光顕微鏡でもよく、ステージ1040は回転するものでもよい。
【0125】
情報通信端末1100は、具体的にはパーソナルコンピュータである。そして、情報通信端末1100は、図23に示すように、大別して、制御部1120と、システムの時刻を計時するクロック発生部1140と、記憶部1160と、通信インターフェース部1180と、入出力インターフェース部1200と、入力部1220と、出力部1240と、で構成されており、これら各部はバスを介して接続されている。
【0126】
記憶部1160は、ストレージ手段であり、具体的には、RAMやROM等のメモリ装置、ハードディスクのような固定ディスク装置、フレキシブルディスク、光ディスク等を用いることができる。そして、記憶部1160は制御部1120の各部の処理により得られたデータなどを記憶する。
【0127】
通信インターフェース部1180は、情報通信端末1100と、CCDカメラ1060cおよびCCDカメラ1080dと、の間における通信を媒介する。すなわち、通信インターフェース部1180は他の端末と有線または無線の通信回線を介してデータを通信する機能を有する。
【0128】
入出力インターフェース部1200は、入力部1220や出力部1240に接続する。ここで、出力部1240には、モニタ(家庭用テレビを含む)の他、スピーカやプリンタを用いることができる(なお、以下で、出力部1240をモニタとして記載する場合がある。)。また、入力部1220には、キーボードやマウスやマイクの他、マウスと協働してポインティングデバイス機能を実現するモニタを用いることができる。
【0129】
制御部1120は、OS(Operating System)等の制御プログラムや各種の処理手順等を規定したプログラムや所要データを格納するための内部メモリを有し、これらのプログラムに基づいて種々の処理を実行する。そして、制御部1020は、大別して、蛍光画像撮像指示部1120aと、発光画像撮像指示部1120bと、蛍光画像取得部1120cと、発光画像取得部1120dと、判定部1120eと、蛍光測定部1120fと、発光測定部1120gと、ステージ同定部1120hと、選択部1120i、発現量測定部1120jと、で構成されている。
【0130】
蛍光画像撮像指示部1120aは、通信インターフェース部1160を介して、CCDカメラ1080dへ蛍光画像や明視野画像の撮像を指示する。発光画像撮像指示部1120bは、通信インターフェース部1160を介して、CCDカメラ1060cへ発光画像や明視野画像の撮像を指示する。蛍光画像取得部1120cは、CCDカメラ1080dで撮像した蛍光画像や明視野画像を、通信インターフェース部1160を介して取得する。発光画像取得部1120dは、CCDカメラ1060cで撮像した発光画像や明視野画像を、通信インターフェース部1160を介して取得する。
【0131】
判定部1120eは、蛍光画像および/または発光画像に基づいて、各遺伝子が導入されているか否かを細胞1020ごとに判定する。蛍光測定部1120fは、CCDカメラ1080dで撮像した蛍光画像に基づいて、各細胞1020から発せられた蛍光の蛍光強度をそれぞれ測定する。発光測定部1120gは、CCDカメラ1060cで撮像した発光画像に基づいて、各細胞1020から発せられた発光強度をそれぞれ測定する。
【0132】
ステージ同定部1120hは、蛍光測定部1120fで測定した蛍光強度または発光測定部1120gで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定する。なお、発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、CCDカメラ1080dで撮像した蛍光画像に基づいて細胞1020の形状が変化したか否かを判定することで、細胞周期のステージを同定してもよい。選択部1120iは、ステージ同定部1120hでステージが同定された細胞1020の中から測定対象の細胞1020を選択する。
【0133】
発現量測定部1120jは、選択部1120iで選択した細胞1020を対象として、ステージ同定部1120hで発光強度を用いる場合には蛍光測定部1120fで測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定し、ステージ同定部1120hで蛍光強度または蛍光画像を用いる場合には発光測定部1120gで測定した発光強度に基づいて解析対象の遺伝子の発現量を測定する。なお、発現量測定部1120jは、複数の細胞1020または選択部1120iで選択した細胞1020を対象として、蛍光測定部1120fで測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、CCDカメラ1080dで撮像した蛍光画像に基づいて解析対象の遺伝子の細胞1020内における発現部位を同定してもよい。
【0134】
以上の構成において、発現量測定装置1000で行われる処理の一例を、図24を参照して説明する。なお、以下では、発光関連遺伝子と細胞周期関連遺伝子とを融合したベクターおよび蛍光関連遺伝子と解析対象の遺伝子とを融合したベクターを複数の細胞1020に導入し、導入した複数の細胞1020のうち特定の細胞1020を対象として、発光強度で細胞周期のステージを同定しながら、蛍光強度で解析対象の遺伝子の発現量を経時的に測定すると共に蛍光画像で解析対象の遺伝子の細胞1020内における発現部位を経時的に同定する場合の処理の一例について説明する。
【0135】
まず、情報通信端末1100は、蛍光画像撮像指示部1100aの処理で通信インターフェース部1160を介してCCDカメラ1080dへ蛍光画像の撮像を指示し、発光画像撮像指示部1120bの処理で通信インターフェース部1160を介してCCDカメラ1060cへ発光画像の撮像を指示する(ステップSB−1)。つぎに、CCDカメラ1080dは、撮像範囲中に存在する複数の細胞1020の蛍光画像を撮像し(ステップSB−2)、当該蛍光画像を情報通信端末1100へ送信する(ステップSB−3)。一方、CCDカメラ1060cは、撮像範囲中に存在する複数の細胞1020の発光画像を撮像し(ステップSB−4)、当該発光画像を情報通信端末1100へ送信する(ステップSB−5)。なお、蛍光画像の撮像指示および発光画像の撮像指示は、異なる時刻または時間間隔で行ってもよい。例えば、細胞周期のステージを同定するために用いる発光画像の撮像は数時間おきに行い、解析対象の遺伝子の発現量を測定するために用いる蛍光画像の撮像は数分おきに行ってもよい。また、励起光は蛍光画像を撮像する時のみ細胞1020へ照射する。
【0136】
つぎに、情報通信端末1100は、(a)蛍光画像取得部1120cの処理で通信インターフェース部1160を介して蛍光画像を取得し、(b)発光画像取得部1120dの処理で通信インターフェース部1160を介して発光画像を取得し、(c)制御部1120の処理でクロック発生部1140から時刻を取得し、(d)取得した蛍光画像と発光画像と時刻とを対応付けて記憶部1160の所定の記憶領域に記憶する(ステップSB−6)。
【0137】
つぎに、情報通信端末1100は、判定部1120eの処理で、蛍光画像および/または発光画像に基づいて、ベクターが導入されているか否かを細胞1020ごとに判定する(ステップSB−7)。つぎに、ベクターが導入されている細胞1020が少なくとも1つ存在した場合(ステップSB−8:Yes)、情報通信端末1100は、蛍光測定部1120fの処理で蛍光画像に基づいて各細胞1020から発せられた蛍光の蛍光強度をそれぞれ測定すると共に、発光測定部1120gの処理で発光画像に基づいて各細胞1020から発せられた発光の発光強度をそれぞれ測定する(ステップSB−9)。
【0138】
つぎに、情報通信端末1100は、ステージ同定部1120hの処理で、発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定する(ステップSB−10)。なお、蛍光関連遺伝子と細胞周期関連遺伝子とを融合したベクターおよび発光関連遺伝子と解析対象の遺伝子とを融合したベクターを細胞1020に導入した場合、蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定してもよい。また、発光関連遺伝子と解析対象の遺伝子とを融合したベクターを細胞1020に導入し、その所定の部位(具体的には核、細胞膜、細胞質など)を蛍光物質で染色した場合、蛍光画像に基づいて細胞1020の形状が変化したか否かを細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定してもよい。
【0139】
つぎに、情報通信端末1100は、選択部1120iの処理で、ステップSA−10でステージが同定された細胞1020の中から測定対象の細胞1020を選択する(ステップSB−11)。つぎに、情報通信端末1100は、発現量測定部1120jの処理で、ステップSB−11で選択した細胞1020を対象として、蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、蛍光画像に基づいて解析対象の遺伝子の細胞1020内における発現部位を同定する(ステップSB−12)。なお、ステップSB−10において蛍光強度または蛍光画像を用いる場合、ステップSB−12では、発光強度に基づいて解析対象の遺伝子の発現量を測定してもよい。
【0140】
そして、情報通信端末1100は、制御部1120の処理で、上述したステップSB−1〜ステップSB−12までの処理を例えば予め設定した時間間隔で所定の回数繰り返し実行し、所定の回数終了した場合(ステップSB−13:Yes)には処理を終了する。
ここで、発光画像および蛍光画像の撮像および取得だけを繰り返し実行し、解析の時点で、発光強度の測定、蛍光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を行ってもよい。つまり、解析に必要な元データである発光画像および蛍光画像だけをまとめて取得し、その後、解析の時点で、発光強度の測定、蛍光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を行ってもよい。具体的には、発光画像および蛍光画像の取得後に、解析の時点で、細胞1020の選択、発現量の測定を行ってもよい。また、発光画像および蛍光画像の取得を行った後、解析の時点で、ステージの同定、細胞1020の選択を行ってもよい。また、発光画像および蛍光画像の取得後に、解析の時点で、細胞1020の選択を行ってもよい。
また、蛍光画像を取得した後、測定対象の細胞1020を選択し、そして発光画像を取得してもよい。
【0141】
以上、詳細に説明したように、発現量測定装置1000によれば、発光関連遺伝子と蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞1020を対象として、細胞1020から発せられた発光の発光強度を測定し、細胞1020から発せられた蛍光の蛍光強度を測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定するにあたって、細胞は、発光関連遺伝子、蛍光関連遺伝子および解析対象の遺伝子に加えてさらに細胞周期関連遺伝子を導入したものであり、発現量の測定で発光強度を用いる場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、発現量の測定で蛍光強度を用いる場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定する。これにより、細胞1020に導入した解析対象の遺伝子の発現量の測定において同調培養の操作を行わずに当該細胞1020に対して細胞周期のステージを同定することができ、その結果、実験者の作業的な負担を軽減することができる。また、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができる。具体的には、細胞周期との直接の関与が不明である解析対象の遺伝子に関して、薬剤投与や温度変化などの刺激で引き起こされる発現量の変化を細胞周期のステージと共に得ることができるので、当該解析対象の遺伝子と細胞周期との関与を検証することができる。また、細胞周期との直接の関与が示唆される解析対象の遺伝子に関して、当該解析対象の遺伝子の発現量と細胞周期のステージとを一緒に取得することができるので、当該解析対象の遺伝子が細胞周期マーカーとして有用であるか否かを評価することができる。なお、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、発現量測定装置1000は、細胞1020から発せられた発光の発光強度を測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を測定し、当該細胞1020の蛍光画像を撮像し、撮像した蛍光画像に基づいて細胞1020の形状が変化したか否かを判定することで、細胞周期のステージを同定してもよい。なお、発光誘導蛋白遺伝子の取り込みを確認するための方法を除き、蛍光融合遺伝子の変わりに蛍光色素を用いてもよいが、励起光による光毒性の影響を最小限にするために、蛍光色素による撮像は、蛍光のみで撮像する場合に比べて撮像回数を減らすようにすることができる。また、発現量測定装置1000は、例えば、各種反応(例えば薬物刺激や光照射など)の検査や治療などに好適に用いることができる。
【0142】
ここで、これまでは、レポーターアッセイを行う際に、様々な細胞周期ステージの細胞を一群のデータとして取り扱っていた。細胞周期は、細胞の成長、DNAの複製、染色体の分配、細胞の分裂などからなる複数の連続反応であり、そのステージにより様々な遺伝子の発現が変動することは十分に考えられる。そこで、発現量測定装置1000を利用すれば、細胞周期への直接の関与が不明である遺伝子に関して、薬剤や温度変化など、何らかの刺激により引き起こされる遺伝子発現量変化を検出したい場合に、細胞周期データと合わせることで、より詳細な解析結果が得られる。また、発現量測定装置1000を利用すれば、細胞周期との直接の関与が示唆される遺伝子に関しても、各細胞の細胞周期のステージが判別できるので、従来行ってきた同調培養などの操作を必要とせず、解析を行いたいステージの細胞のみを選択し、観察対象とすることができる。
【0143】
また、発現量測定装置1000によれば、細胞1020が撮像範囲中に複数存在する場合、複数の細胞1020の蛍光画像を撮像し、複数の細胞1020の発光画像を撮像し、撮像した発光画像に基づいて、各細胞1020から発せられた発光の発光強度をそれぞれ測定し、撮像した蛍光画像に基づいて、各細胞1020から発せられた蛍光の蛍光強度をそれぞれ測定し、測定した発光強度または測定した蛍光強度に基づいて解析対象の遺伝子の発現量を細胞1020ごとに測定し、発現量の測定で発光強度を用いる場合には測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定し、発現量の測定で蛍光強度を用いる場合には測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定する。これにより、複数の細胞1020を対象として、解析対象の遺伝子の発現量を細胞1020ごとに測定すると共に、細胞周期のステージを細胞1020ごとに同定することができる。また、解析対象の遺伝子と細胞周期のステージとの関連性を細胞1020ごとに評価することができる。なお、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、発現量測定装置1000は、撮像範囲中に存在する複数の細胞1020の発光画像を撮像し、複数の細胞1020の蛍光画像を撮像し、撮像した発光画像に基づいて、各細胞1020から発せられた発光の発光強度をそれぞれ測定し、測定した発光強度に基づいて解析対象の遺伝子の発現量を細胞1020ごとに測定し、撮像した蛍光画像に基づいて細胞1020の形状が変化したか否かを細胞1020ごとに判定することで、細胞周期のステージを細胞1020ごとに同定してもよい。また、細胞周期ごとに比較することにより、条件が等しい細胞同士の比較評価を行うようにしてもよい。
【0144】
また、発現量測定装置1000によれば、ステージが同定された細胞1020の中から測定対象の細胞1020を選択し、測定した発光強度または測定した蛍光強度に基づいて、選択した細胞1020に導入された解析対象の遺伝子の発現量を測定する。これにより、複数の細胞1020の中から個々の細胞1020を識別し、単一の細胞1020を対象として、解析対象の遺伝子の発現量を測定すると共に、細胞周期のステージを同定することができる。
【0145】
また、発現量測定装置1000によれば、発光画像の撮像、蛍光画像の撮像、発光強度の測定、蛍光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を繰り返し実行することで、選択した細胞1020を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定する。これにより、単一の細胞1020を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量の変動を経時的に測定することができる。なお、発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入し、その所定の部位(具体的には、核、細胞膜、細胞質など)を蛍光物質で染色した生きた細胞1020を対象とした場合、発現量測定装置1000は、発光画像の撮像、蛍光画像の撮像、発光強度の測定、ステージの同定、細胞1020の選択、発現量の測定を繰り返し実行することで、選択した細胞1020を対象として、細胞周期のステージを同定しながら解析対象の遺伝子の発現量を経時的に測定してもよい。また、同一視野内の異なる細胞を、各々の細胞周期に応じたタイミングで撮像したタイムラプス映像または1画像上に同時に画像再生することにより、細胞周期を一致させた動画(またはコマ送り)ないし1画像表示をしてもよい。
【0146】
また、発現量測定装置1000によれば、発現量の測定において、選択された細胞1020を対象として、測定した蛍光強度に基づいて解析対象の遺伝子の発現量を測定すると共に、撮像した蛍光画像に基づいて解析対象の遺伝子の細胞1020内における発現部位を同定する。これにより、解析対象の遺伝子と細胞周期のステージとの関連性を評価することができるだけでなく、解析対象の遺伝子の細胞1020内における発現部位を得ることができる。
【0147】
また、発現量測定装置1000を利用すれば、具体的には、抗がん剤およびそのリード化合物の評価を行うことができる。特に、抗がん剤が細胞分裂の効率に有害な作用を持つかどうかの判断と、そのリード化合物が解析対象遺伝子の転写活性に影響を与えるかどうかを同時にモニターすることができる。また、発現量測定装置1000を利用すれば、具体的には、細胞周期と細胞の形態との関連を調べることができる。特に、PC12細胞などにおいては、細胞周期ステージ、分化段階によって形態が変わることが知られているが、その他の神経様細胞においても、細胞形態による詳細なステージ同定を行うことができ、細胞形態そのものを細胞周期または分化のフェーズマーカーとして用いることができる。また、発現量測定装置1000を利用すれば、具体的には、細胞周期に関わる可能性のある遺伝子において、発光検出にて細胞周期をモニタリングしながら、蛍光検出にて発現時期・局在性を同定することで、細胞周期との関連性の有無、または細胞周期マーカーとしての有用性を評価することができる。
【0148】
[III]以下、添付図面を参照して、本発明にかかる測定装置としての顕微鏡ユニットおよび顕微鏡装置の好適な実施の形態を詳細に説明する。なお、この実施の形態によりこの発明が限定されるものではない。また、図面の記載において、同一部分には同一の符号を付している。
【0149】
(実施の形態1)まず、本発明の実施の形態1にかかる顕微鏡装置について説明する。図25は、この実施の形態1にかかる顕微鏡装置の構成を示す模式図である。図25に示すように、この実施の形態1にかかる顕微鏡装置100aは、蛍光観察を行う蛍光顕微鏡ユニット101と、微弱光観察を行う微弱光観察ユニット102aと、発光標識および蛍光標識が付与された標本Sを保持する保持手段としての保持部7と、各顕微鏡ユニット101,102aによって撮像した標本Sの標本像等を表示するモニター9と、顕微鏡装置100aの全体の処理および動作を制御する制御装置PC1と、を備える。蛍光顕微鏡ユニット101と微弱光顕微鏡ユニット102aとは、互いに隣接して配置される。
【0150】
蛍光顕微鏡ユニット101は、蛍光対物レンズとしての対物レンズ1および蛍光結像レンズとしての結像レンズ2を有する高倍率の蛍光結像光学系と、この蛍光結像光学系によって結像される標本Sの標本像である蛍光標本像を撮像する蛍光撮像手段としての撮像装置3と、標本Sを励起する励起光を発する励起光源4と、励起光源4からの励起光を集光するレンズ5と、蛍光ユニットとしての蛍光キューブ6と、を備える。
【0151】
対物レンズ1は、標本側に大きなNAを有し、標本Sに付与された蛍光標識の各点から発せられる蛍光をほぼ平行光束に変換する。結像レンズ2は、対物レンズ1によってほぼ平行光束に変換された蛍光を集光して標本Sの標本像である蛍光標本像を結像する。蛍光結像光学系は、蛍光標本像を40倍以上の高倍率で結像する。撮像装置3は、CCD、CMOS等の固体撮像素子を有し、この固体撮像素子の撮像面上に結像される蛍光標本像を撮像し、画像データを生成して制御装置PC1に出力する。
【0152】
蛍光キューブ6は、標本Sを励起するための励起光を選択的に透過させる励起光透過フィルターとしての励起フィルター6aと、この励起光によって励起された標本Sから発せられる蛍光を選択的に透過させる蛍光透過フィルターとしての吸収フィルター6bと、励起光を反射して蛍光を透過させるダイクロイックミラー6cとを一体に備える。励起フィルター6aは、励起光源4から発せられる各種波長の光の中から所定の波長域の励起光を抽出するバンドパスフィルターであり、吸収フィルター6bは、所定のカットオフ波長を有するロングウェーブパスフィルターである。なお、吸収フィルター6bは、所定の波長範囲の蛍光を抽出するバンドパスフィルターでもよい。バンドパスフィルターは、標本Sから発せられる微弱光と蛍光の波長が近い場合に有効である。
【0153】
励起光源4は、水銀ランプ、キセノンランプ、レーザー等によって実現され、励起光照射手段としての励起光源4およびレンズ5は、励起光源4からの励起光を、励起光フィルター6aを介し、ダイクロイックミラー6cによって反射させ標本Sに照射する。なお、励起光源4は、制御装置PC1からの指示をもとに点灯および消灯を行う。
【0154】
微弱光顕微鏡ユニット102aは、微弱光対物レンズとしての対物レンズ11および微弱光結像レンズとしての結像レンズ12を有する低倍率の微弱光結像光学系と、この微弱光結像光学系によって結像される標本Sの標本像である微弱光標本像を撮像する微弱光撮像手段としての撮像装置13と、を備える。
【0155】
対物レンズ11は、標本側に大きなNAを有し、標本Sに付与された発光標識の各点から自己発光によって発せられる微弱光をほぼ平行光束に変換する。結像レンズ12は、対物レンズ11によってほぼ平行光束に変換された微弱光を集光して標本Sの標本像である微弱光標本像を結像する。微弱光結像光学系は、蛍光結像光学系の結像倍率よりも低い結像倍率で微弱光標本像を結像する。このとき、微弱光結像光学系は、標本側のNAをNAo、結像倍率をβとして、(NAo/β)2≧0.01を満足することが望ましい。
【0156】
撮像装置13は、CCD、CMOS等の固体撮像素子を有し、この固体撮像素子の撮像面上に結像される微弱光標本像を撮像し、画像データを生成して制御装置PC1に出力する。なお、撮像装置13が有する固体撮像素子は、高感度のモノクロームCCDであって0℃程度の冷却CCDを用いるとよい。
【0157】
保持部7は、標本Sを直接載置するプレパラート、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体、インキュベーター等の保持部材7aと、この保持部材7aとともに標本Sを2次元的に移動させる可動ステージ7bとを有する。可動ステージ7bは、制御装置PC1からの指示をもとに、ステージ駆動部8によって駆動される。
【0158】
制御装置PC1は、CPUを備えたコンピュータ等の処理装置によって実現され、撮像装置3,13、励起光源4、ステージ駆動部8およびモニター9を電気的に接続し、これらの各構成部位の動作を制御する。制御装置PC1は、特に、撮像切換制御手段として、撮像装置13によって撮像される微弱光標本像の像特性をもとに、微弱光顕微鏡ユニット102aによる微弱光標本像の撮像と、蛍光顕微鏡ユニット101による蛍光標本像の撮像とを切り換える撮像切換処理の制御を行う。
【0159】
ここで、制御装置PC1が制御する撮像切換処理について説明する。図26は、撮像切換処理の処理手順を示すフローチャートである。図26に示すように、制御装置PC1は、可動ステージ7bによって微弱光結像光学系の視野内に移動された標本Sの微弱光標本像を撮像装置13によって撮像する(ステップS101)。この撮像結果をもとに、制御装置PC1は、微弱光標本像の像特性としての像強度があらかじめ設定したしきい値より大きい領域が微弱光標本像内にあるか否かを判断する(ステップS103)。像強度がしきい値より大きい領域がないと判断された場合(ステップS103:No)、制御装置PC1は、ステップS101からの処理を繰り返す。
【0160】
一方、像強度がしきい値より大きい領域があると判断された場合(ステップS103:Yes)、制御装置PC1は、ステップS101で撮像した微弱光標本像を記録し(ステップS105)、可動ステージ7bによって蛍光結像光学系の視野内に標本Sを移動する(ステップS107)。そして、制御装置PC1は、微弱光標本像の像強度がしきい値より大きい領域に対応する蛍光標本像を撮像装置3によって撮像して記録し(ステップS109)、撮像切換処理を終了する。なお、標本Sの経過観察を行う場合、制御装置PC1は、ステップS109の後、可動ステージ7bによって標本Sを再び微弱光結像光学系の視野内に移動し、ステップS101からの処理を繰り返すように制御するとよい。また、ステップS109での撮像は、タイムラプス撮像または1画像の撮像のどちらでもよい。また、同一視野内の異なる細胞を、各々の細胞周期に応じたタイミングで撮像したタイムラプス映像または1画像上に同時に画像再生することにより、細胞周期を一致させた動画(またはコマ送り)ないし1画像表示をしてもよい。
【0161】
制御装置PC1は、ステップS105およびS109では、撮像した微弱光標本像および蛍光標本像を自装置内に備えるRAM等の記憶部に記憶する。また、制御装置PC1は、ステップS101およびS109では、撮像した微弱光標本像および蛍光標本像をモニター9に逐次表示するようにしてもよい。さらに、制御装置PC1は、ステップS101〜S105の間、すなわち、微弱光顕微鏡ユニット102によって標本Sの微弱光観察を行っている間、励起光源4を消灯し、ステップS109で標本Sの蛍光観察を行う場合、励起光源4を点灯するように制御を行うとよい。あるいは、励起光源4から蛍光ユニット6までの光路上にシャッター等の遮光装置を設け、制御装置PC1は、未照射手段として、励起光源4を点灯および消灯する替わりに、遮光装置を開閉することによって励起光の照射を制御するようにしてもよい。
【0162】
なお、制御装置PC1は、ステップS103では、微弱光標本像内の部分的な領域の像強度をもとに蛍光観察への切り換えを判断するようにしたが、微弱光標本像の全体の像強度をもとに切り換えを判断するようにしてもよい。また、制御装置PC1は、これらの像強度を、たとえば、所定時点から現時点までの累積の像強度として取得してもよく、あるいは現時点の瞬間的な像強度として取得してもよい。なお、微弱光標本像の全体の像強度を取得する場合には、撮像装置13に替えてフォトマルチプライヤー等の高感度の受光素子を用いてもよい。
【0163】
以上説明したように、この実施の形態1にかかる顕微鏡装置によれば、蛍光観察用の蛍光顕微鏡ユニット101と微弱光観察用の微弱光顕微鏡ユニット102aとを隣接して備えるとともに、蛍光結像光学系および微弱光結像光学系の各視野内に標本Sを移動させる可動ステージ7bとを備えるため、適宜に蛍光観察と微弱光観察とを切り換えることができ、また、微弱光標本像の像特性としての像強度に応じて、微弱光観察から蛍光観察へ即時に切り換えることができる。
【0164】
なお、微弱光結像光学系は、対物レンズ11および結像レンズ12によって標本像を結像する無限遠補正光学系として説明したが、対物レンズのみによって標本像を結像する有限補正光学系としてもよい。
【0165】
また、上述した撮像切換処理では、微弱光標本像の像強度等の像特性をもとに微弱光観察から蛍光観察に切り換えるようにしたが、蛍光観察で標本Sに照射する励起光強度や標本Sから発光される蛍光強度が弱く、励起光および蛍光によって標本Sに与えるダメージが小さい場合などには、蛍光標本像の像強度等の像特性をもとに蛍光観察から微弱光観察に切り換えるようにしてもよい。
【0166】
(実施の形態2)つぎに、本発明の実施の形態2について説明する。上述した実施の形態1では、可動ステージ7bによって蛍光結像光学系および微弱光結像光学系の各視野内に標本Sを移動させるようにしたが、この実施の形態2では、蛍光結像光学系および微弱光結像光学系を移動させることによって各視野内に標本Sを配置するようにしている。
【0167】
図27は、本発明の実施の形態2にかかる顕微鏡装置の構成を示す模式図である。図27に示すように、この実施の形態2にかかる顕微鏡装置200は、顕微鏡装置100aと同様に蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を備え、また、これらの各顕微鏡ユニット201,202の中間位置に光学系移動手段としての回転駆動装置14および保持軸15a,15bを備える。さらに、顕微鏡装置200は、顕微鏡装置100aが備えた保持部7に替えて、可動範囲を小さくした可動ステージ17bを有する保持部17を備えるとともに、制御装置PC1に替えて、制御装置PC2を備える。その他の構成は、実施の形態1と同じであり、同一の構成部分には同一符号を付している。
【0168】
蛍光顕微鏡ユニット201は、蛍光顕微鏡ユニット101と同じ各構成部位を一体に保持する筐体21を備え、微弱光顕微鏡ユニット202は、微弱光顕微鏡ユニット102aと同じ各構成部位を一体に保持する筐体22を備える。
【0169】
回転駆動装置14は、蛍光顕微鏡ユニット201が備える蛍光結像光学系および微弱光顕微鏡ユニット202が備える微弱光結像光学系の各視野の略中心点を結ぶ線分の中点を通り各光学系の光軸に略平行な回転軸を有し、この回転軸を中心に、複数の保持軸15a,15bによって保持した蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を回転移動させる。ここで、固定軸15a,15bは、それぞれ筐体21,22を保持している。
【0170】
可動ステージ17bは、微弱光結像光学系の視野と概ね等しい範囲内で標本Sを移動させる。また、可動ステージ17bは、制御装置PC2からの指示をもとに、ステージ駆動部18によって駆動される。
【0171】
制御装置PC2は、制御装置PC1と同様に撮像装置3,13、励起光源4およびステージ駆動部18の動作を制御するのに加えて、回転駆動装置14の動作を制御する。制御装置PC2は、微弱光観察と蛍光観察とを切り換える場合、回転駆動装置14を制御して蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202の配置を切り換える。
【0172】
このように、この実施の形態2にかかる顕微鏡装置200よれば、回転駆動装置14によって蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を回転移動して蛍光観察と微弱光観察とを切り換えられるようにしているため、たとえば、培養液中に浸された標本等、高速で移動させることができない標本を観察対象とする場合でも、即時に蛍光観察と微弱光観察とを切り換えることができる。
【0173】
なお、顕微鏡装置200では、回転駆動装置14によって各顕微鏡ユニット201,202の全体を回転移動させるようにしているが、撮像装置3,13を1つの撮像装置で共用し、蛍光顕微鏡ユニット201から撮像装置3を除いた部分と、微弱光顕微鏡ユニット202から撮像装置13を除いた部分とを回転移動させて、互いに配置を切り換えるようにしてもよい。
【0174】
図28は、このようにした場合の顕微鏡装置の構成を示す模式図である。図28に示すように、この実施の形態2の変形例としての顕微鏡装置300は、顕微鏡装置200から撮像装置13を取り除き、微弱光顕微鏡ユニット202の全体を一体に保持した筐体22に替えて、微弱光結像光学系を一体に保持する筐体24を備えるとともに、蛍光顕微鏡ユニット201の全体を一体に保持した筐体21に替えて、撮像装置3を除いた部分を一体に保持する筐体23を備える。また、顕微鏡装置300は、制御装置PC2に替えて、制御装置PC3を備える。その他の構成は、顕微鏡装置200と同じであり、同一の構成部分には同一符号を付している。
【0175】
制御装置PC3は、制御装置PC2と同様に撮像装置3、励起光源4、ステージ駆動部18および回転駆動装置14の動作を制御する。ただし、制御装置PC2が蛍光観察と微弱光観察とに応じて撮像装置3,13の制御を切り換えていたのに対し、制御装置PC3は、蛍光観察および微弱光観察の両方の場合で撮像装置3を制御して標本像を撮像するようにしている。このとき、制御装置PC3は、蛍光観察および微弱光観察に応じて、撮像装置3によって撮像される標本像の範囲、結像倍率等を切り換えて認識する。
【0176】
なお、回転駆動装置14は、固定軸15a,15bによって筐体23,24を保持し、制御装置PC3からの指示をもとに、微弱光観察および蛍光観察に応じて、筐体23,24の配置を切り換える。
【0177】
このように、この実施の形態2の変形例としての顕微鏡装置300よれば、蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202から撮像装置3,13を除く部分を回転駆動装置14によって回転移動して蛍光観察と微弱光観察とを切り換えられるようにしているため、移動部分が軽量化され、より高速に移動および切り換えを行うことができる。また、顕微鏡装置300では、顕微鏡装置100a,200に比して撮像装置の数を削減しているため、撮像装置に関連する回路構成を簡略化することができるとともに、制御装置PC3の処理負荷を軽減させて処理の高速化をはかることができる。また、装置を安価にすることができる。
【0178】
なお、顕微鏡装置200,300では、回転駆動装置14によって蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202、またはこれら各ユニットの一部を回転移動させるようにしたが、回転移動に限らず、たとえば、可動ステージ17bに沿って蛍光顕微鏡ユニット201および微弱光顕微鏡ユニット202を平行移動させて、各ユニット201,202の配置を切り換えるようにしてもよい。
【0179】
(実施の形態3)つぎに、本発明の実施の形態3について説明する。上述した実施の形態1および実施の形態2では、標本Sの同じ側に配置され独立した蛍光結像光学系および微弱光結像光学系を備えるようにしていたが、この実施の形態3では、光学系の一部を共用した蛍光結像光学系および微弱光結像光学系を備えるようにしている。
【0180】
図29は、本発明の実施の形態3にかかる顕微鏡装置の構成を示す模式図である。図29に示すように、この実施の形態3にかかる顕微鏡装置400は、顕微鏡装置100aが独立して備えた蛍光結像光学系および微弱光結像光学系の対物レンズを共用し、一体化した顕微鏡ユニットを備える。具体的には、顕微鏡装置400は、顕微鏡装置100aが備えた蛍光顕微鏡ユニット101と同様の顕微鏡ユニットを備え、さらに、この顕微鏡ユニットが有する対物レンズ1と蛍光キューブ6との間に挿脱可能なミラー34を備え、このミラー34によって図上で左側に約90度に折り曲げられる光軸上に、結像レンズ12に替わる結像レンズ32と撮像装置13とを備える。
【0181】
このようにして顕微鏡装置400は、対物レンズ1を共用し、対物レンズ1と結像レンズ2を有する蛍光結像光学系と、対物レンズ1と結像レンズ32とを有する微弱光結像光学系とを備える。また、顕微鏡400は、顕微鏡装置200が備えた保持部17およびステージ駆動部18を備えるとともに、励起光源4とレンズ5との間に未照射手段としてのシャッター33と、このシャッター33およびミラー34を動作させる光路切換駆動部35と、制御装置PC4と、を備える。その他の構成は、実施の形態1または実施の形態2と同じであり、同一の構成部分には同一符号を付している。
【0182】
制御装置PC4は、制御装置PC2と同様に撮像装置3,13およびステージ駆動部18の動作を制御するのに加えて、光路切換駆動部35を介してシャッター33およびミラー34の動作を制御する。制御装置PC4は、微弱光観察から蛍光観察に切り換える場合、対物レンズ1と蛍光キューブ6との間からミラー34を取り除き、シャッター33を開いて励起光源4からの励起光を標本Sに照射させる。一方、蛍光観察から微弱光観察に切り換える場合、制御装置PC4は、シャッター33を閉じて励起光源4からの励起光を遮光し、標本Sに対して励起光を未照射にするとともに、対物レンズ1と蛍光キューブ6との間の光路上にミラー34を挿入し配置して、標本Sからの微弱光を結像レンズ32に向けて反射させる。
【0183】
なお、結像レンズ32は、結像レンズ2よりも短い焦点距離を有し、結像レンズ32を有する微弱光結像光学系は、結像レンズ2を有する蛍光結像光学系の結像倍率よりも低い結像倍率で微弱光標本像を結像する。また、結像レンズ32を有する微弱光結像光学系は、標本側のNAをNAo’、結像倍率をβ’として、(NAo’/β’)2≧0.01を満足することが望ましい。
【0184】
このように、この実施の形態3にかかる顕微鏡装置400よれば、対物レンズを共用した蛍光結像光学系および微弱光結像光学系によって一体化した顕微鏡ユニットを備えるようにしているため、顕微鏡装置全体の小型化および簡素化をはかることができるとともに、蛍光観察と微弱光観察との切り換えにともなう移動部分が単一の光学素子となって軽量化されるため、より高速に移動および切り換えを行うことができる。
【0185】
なお、励起光源4からの励起光および標本Sからの蛍光と、標本Sからの微弱光との波長帯域が異なる場合、ミラー34に替えて、励起光および蛍光を透過させるとともに微弱光を反射させるダイクロイックミラーを用いるようにしてもよい。この場合、制御装置PC4は、蛍光観察と微弱光観察とを切り換える場合、ダイクロイックミラーを挿脱する必要はない。また、ダイクロイックミラーを用いる場合、制御装置PC4は、蛍光観察と微弱光観察とを同時に行うように制御してもよい。
【0186】
(実施の形態4)つぎに、本発明の実施の形態4について説明する。上述した実施の形態1では、標本Sに対して同じ側に蛍光顕微鏡ユニット101および微弱光顕微鏡ユニット102aを配置するようにしたが、この実施の形態4では、標本Sに対して互いに反対側に蛍光顕微鏡ユニットおよび微弱光顕微鏡ユニットを配置するようにしている。
【0187】
図30は、本発明の実施の形態4にかかる顕微鏡装置の構成を示す模式図である。図30に示すように、この実施の形態4にかかる顕微鏡装置500は、顕微鏡装置100aが備えた蛍光顕微鏡ユニット101および微弱光顕微鏡ユニット102aを備えるとともに、顕微鏡装置200が備えた保持部17およびステージ駆動部18を備え、さらに、制御装置PC5およびモニター9を備える。実施の形態1または実施の形態2と同じ構成部分には同一符号を付している。
【0188】
図30に示す顕微鏡装置500では、蛍光顕微鏡ユニット101は、図上で標本Sの下側に配置され、微弱光顕微鏡ユニット102aは、標本Sの上側に配置されている。なお、これら各ユニット101,102aの上下の配置関係は逆転させてもよい。
【0189】
制御装置PC5は、制御装置PC2と同様に撮像装置3,13、励起光源4およびステージ駆動部18の動作を制御する。制御装置PC5は、微弱光観察から蛍光観察に切り換える場合、励起光源4を点灯して標本Sに励起光を照射させ、蛍光観察から微弱光観察に切り換える場合、励起光源4を消灯し標本Sに対して励起光を未照射にする。
【0190】
なお、励起光源4からダイクロイックミラー6cを介した標本Sまでの光路上にシャッター33等の遮光装置を設け、制御装置PC5は、未照射手段として、励起光源4を点灯および消灯する替わりに、遮光装置を開閉することによって励起光の照射および未照射を制御するようにしてもよい。
【0191】
また、励起光源4からの励起光および標本Sからの蛍光と、標本Sからの微弱光との波長帯域が異なる場合、たとえば、結像レンズ12と撮像装置13との間に、微弱光を透過させるとともに励起光および蛍光を遮光する波長抽出フィルターを設け、制御装置PC5は、励起光源4を消灯させることなく蛍光観察と微弱光観察とを切り換えるようにしてもよい。あるいは、この場合、制御装置PC5は、蛍光観察と微弱光観察とを同時に行うように制御してもよい。
【0192】
このように、この実施の形態4にかかる顕微鏡装置500よれば、標本Sに対して互いに反対側に蛍光顕微鏡ユニット101および微弱光顕微鏡ユニット102aを配置するようにしているため、機械的な駆動を全くさせることなく、蛍光観察と微弱光観察とを即時に切り換えることができる。
【0193】
なお、制御装置PC5は、図示しない駆動装置によって蛍光顕微鏡ユニット101を微弱光顕微鏡ユニット102aに対して、可動ステージ17bに沿って相対的に移動させるようにしてもよい。この場合、微弱光顕微鏡ユニット102aによって標本Sの広範囲な領域を観察し続けながら、この広範囲な領域内の任意の微小領域の拡大像を蛍光顕微鏡ユニット101によって観察することができるとともに、標本Sを全く移動させることなく蛍光観察および微弱光観察を行うことができる。
【0194】
(実施の形態5)つぎに、本発明の実施の形態5について説明する。上述した実施の形態1〜4では、発光標識および蛍光標識からの微弱光および蛍光によって標本Sを観察するようにしていたが、この実施の形態5では、さらに透過照明によって標本Sを観察するようにしている。
【0195】
図31は、本発明の実施の形態5にかかる顕微鏡装置の構成を示す模式図である。図31に示すように、この実施の形態5にかかる顕微鏡装置600は、実施の形態1にかかる顕微鏡装置100aに加えて、透過照明を行う照明手段としての透過照明ユニット103aと、この透過照明ユニット103aが有するシャッター43等を駆動させる照明駆動部46と、制御装置PC1に替わる制御装置PC6と、を備える。その他の構成は、実施の形態1と同じであり、同一の構成部分には同一符号を付している。
【0196】
透過照明ユニット103aは、透過照明用の白色光を発するハロゲンランプ等の白色光源44と、白色光の照射および未照射を切り換えるシャッター43と、白色光源44からの白色光を標本S上に集光させる照明レンズ系45とを備え、標本Sに対して、蛍光顕微鏡ユニット101と反対側に配置されている。照明レンズ系45は、コレクタレンズ45aおよびコンデンサーレンズ45bを有し、標本Sに対してクリティカル照明を行う。なお、照明レンズ系45は、標本Sに対してケーラー照明を行うようにしてもよい。
【0197】
照明駆動部46は、制御装置PC6からの指示をもとに、シャッター43および蛍光照明ユニット104aを駆動する。ここで、蛍光照明ユニット104aは、筐体26によって一体に保持された励起光源4、レンズ5および蛍光キューブ6を有する。照明駆動部46は、シャッター43を開閉して標本Sに対する白色光の照射および未照射を切り換えるとともに、蛍光キューブ6を対物レンズ1と結像レンズ2との間の光路上に挿脱するように蛍光照明ユニット104aを移動させる。
【0198】
制御装置PC6は、制御装置PC1と同様に撮像装置3,13、励起光源4およびステージ駆動部8の動作を制御するのに加えて、照明駆動部46の動作を制御する。制御装置PC6は、蛍光観察から透過照明による観察に切り換える場合、蛍光キューブ6を対物レンズ1と結像レンズ2との間から取り除くように蛍光照明ユニット104aを移動させ、励起光源4を消灯し、シャッター43を開いて透過照明させる。透過照明による観察から蛍光観察に切り換える場合、制御装置PC6は、シャッター43を閉じ、蛍光キューブ6が対物レンズ1と結像レンズ2との間に配置されるように蛍光照明ユニット104aを移動させ、励起光源4を点灯する。
【0199】
また、微弱光観察から透過照明による観察に切り換える場合、制御装置PC6は、蛍光観察から透過照明による観察に切り換える場合の制御に加えて、ステージ駆動部8によって可動ステージ7bを駆動し、標本Sを蛍光結像光学系の視野内に移動させる制御を行う。なお、制御装置PC6は、シャッター43を開閉する替わりに、白色光源44を点灯および消灯するようにしてもよい。
【0200】
なお、透過照明ユニット103aは、明視野観察用の照明を行うように示したが、明視野観察用に限らず、暗視野観察用、微分干渉観察用または位相差観察用の照明を行うようにしてもよい。また、これらの各種観察用の照明を切り換え可能に備えてもよい。なお、微分干渉観察用の照明を行う場合、透過照明ユニット103aは、コンデンサーレンズ45bの光源側に偏光子および偏光分離プリズムを備え、蛍光結像光学系には、対物レンズ1の瞳側に偏光合成プリズムおよび検光子を配設するとよい。また、位相差観察用の照明を行う場合、透過照明ユニット103aは、コンデンサーレンズ45bの光源側にリングスリットを備え、蛍光結像光学系には、対物レンズ1の略瞳位置に位相板を配設するか、対物レンズ1を位相板を有する対物レンズに切り換えるようにするとよい。さらに、暗視野観察用の照明を行う場合、透過照明ユニット103aは、コンデンサーレンズ45bの光源側にリングスリット等を備えるようにするとよい。
【0201】
また、透過照明ユニット103aは、高倍率で透過照明による観察を行うために蛍光結像光学系に対応させて配置するように示したが、低倍率で観察を行えるように微弱光結像光学系に対応させて配置してもよい。あるいは、これらの結像光学系の両方に対応させて配置してもよく、各結像光学系に対して適宜配置を切り換えられるようにしてもよい。
【0202】
ところで、顕微鏡装置600では、顕微鏡装置100aの構成に透過照明ユニット103a、照明駆動部46をさらに備えるように示したが、これに限定されず、たとえば、図32〜図34に示すように、顕微鏡装置200,300,400の各構成に、透過照明ユニット103aと、照明駆動部46もしくは照明駆動部47とをさらに備えるようにしてもよい。
【0203】
図32に示す顕微鏡装置700は、顕微鏡装置200の構成に透過照明ユニット103a、照明駆動部46をさらに備えた場合であり、制御装置PC7は、制御装置PC2と同様に撮像装置3,13、励起光源4、回転駆動装置14およびステージ駆動部18を制御するとともに、制御装置PC6と同様に照明駆動部46によって透過照明ユニット103aおよび蛍光照明ユニット104aを制御する。
【0204】
図33に示す顕微鏡装置800は、顕微鏡装置300の構成に透過照明ユニット103a、照明駆動部46をさらに備えた場合であり、制御装置PC8は、制御装置PC3と同様に撮像装置3、励起光源4、回転駆動装置14およびステージ駆動部18を制御するとともに、制御装置PC6と同様に照明駆動部46によって透過照明ユニット103aおよび蛍光照明ユニット104aを制御する。
【0205】
図34に示す顕微鏡装置900は、顕微鏡装置300の構成に透過照明ユニット103a、照明駆動部47をさらに備えた場合であり、制御装置PC9は、制御装置PC4と同様に撮像装置3,13、およびステージ駆動部18を制御するとともに、照明駆動部47によって透過照明ユニット103a、ミラー34および蛍光照明ユニット105を制御する。
【0206】
すなわち、制御装置PC9は、蛍光観察または微弱光観察から透過照明による観察に切り換える場合、ミラー34および蛍光キューブ6を対物レンズ1と結像レンズ2との間から取り除くように蛍光照明ユニット105を移動させ、シャッター33を閉じて励起光を未照射とし、シャッター43を開いて透過照明させる。透過照明による観察から蛍光観察または微弱光に切り換える場合、制御装置PC9は、シャッター43を閉じ、蛍光キューブ6またはミラー34が対物レンズ1と結像レンズ2との間に配置されるように蛍光照明ユニット105またはミラー34を移動させる。蛍光観察を行う場合には、さらにシャッター33を開いて標本Sに蛍光を照射させる。
【0207】
このように、この実施の形態5にかかる顕微鏡装置600,700,800,900によれば、蛍光結像光学系および微弱光結像光学系の少なくとも一方に対応し、標本Sに対して透過照明を行う透過照明ユニットを備えるようにしているため、蛍光観察および微弱光観察ばかりでなく各種の透過照明による観察を行うことができ、標本Sを多角的に観察することができる。
【0208】
なお、上述した顕微鏡装置100a,200,300,400,600,700,800,900は、それぞれ正立型の顕微鏡装置として示したが、倒立型の顕微鏡装置としてもよい。また、上述した顕微鏡装置は、例えば、各種反応(例えば薬物刺激や光照射など)の検査や治療などに好適に用いることができる。
【0209】
以上、実施の形態について詳細に説明したが、本発明において、発光とは、化学反応により光を発生し得ることをいい、特に生物発光および化学発光を好適な例として含む用語である。これに対し、蛍光とは励起光により光を発生し得ることをいう。ここで、生物発光による光エネルギーにより励起されるBRET(生物発光共鳴エネルギー転移)は、基質溶液との化学反応が支配的要因であるので、本発明では発光に含めるものである。サンプルから発生する光は、特に生きた細胞に危害が少ない約400nm〜約900nmの間の波長を持つ電磁放射線をいう。発光するサンプルの撮像は、極めて低レベルの光(通常は単一光子事象)を検出し、画像の構築が可能になるまで光子放射を積分できる光検出器の使用を必要とする。そのような高感度光検出器の例には、単一光子事象を増幅した後、検出系に固有の背景ノイズに対して単一光子を検出できるカメラまたはカメラ群で、例えばCCDのような撮像素子群を具備するCCDカメラを例示できる。一般に、高感度を得るために、CCDカメラを液体窒素などで冷却する場合がある。高い開口数(NA)とくに、開口数(NA)/投影倍率(β)の2乗で表される光学的条件が0.01以上である対物レンズを用いる場合には、冷却温度をマイナス5℃〜マイナス20℃、好ましくはマイナス5℃〜常温でも画像化できると本発明者らによって確認された。さらに、検討を進めた結果、上記光学的条件(NA/β)の2乗が0.071以上である場合に、5分以内、場合によっては1分程度で視認可能で且つ解析可能な細胞画像を提供できることを突き止めた。一般に生きたサンプルは形状ないし発光部位の変化の為に、30分を越える撮像時間では鮮明な発光画像を得ることは困難な場合が多い。従って、本発明では、短時間、特に30分以内、好ましくは1分〜10分の間で1つの発光画像を取得し、撮像時間が速い蛍光測定との連携に有利な方法と装置を提供する。
【0210】
例えば関連する態様として、選択した生物適合成分の分布および/または局在に対するある処置の効果を記録するために、蛍光シグナルの局在および/または発光シグナルの強度を経時的に追跡したい場合は、光子放射の測定または撮像を選択した時間間隔で反復することにより、一連の画像を構築することができる。間隔は数分程度の短いものであってもよいし、数日または数週間程度に長いものであってもよい。発光画像または蛍光(または透過光)発光の重ね合せ画像は、画面表示、印刷された紙、グラフィック加工されたイメージ等の様々な形式で表現できる。
【0211】
他の関連する態様として、本発明は、発光性タンパク質をコードする遺伝子を誘導性プロモーターの制御下に含む構築物でトランスジェニックまたはキメラにした動物におけるプロモーター誘導事象の存在を検出した後にプロモーター誘導事象の活性度をモニタリングする方法を包含する。プロモーター誘導事象には、そのプロモーターを直接活性化する物質の投与、内因性プロモーター活性化因子の産生を刺激する物質の投与(例えばRNAウイルス感染によるインターフェロン産生の剌激)、内因性プロモーター活性化因子の産生をもたらす状態に置くこと(例えば熱ショックまたはストレス)などがある。
【0212】
またもう1つの態様として、本発明は、病原体による感染の重篤化を抑制するのに有効な治療用化合物を同定する方法をも包含する。この方法では、病原体と蛍光成分と発光成分の複合体を対照動物と実験動物、若しくはそれらの培養された組織(ないし細胞)に投与し、その実験動物を治療用化合物候補で処置する。そして、上述の方法によって測定対象であるサンプル内の蛍光シグナルの局在を確認した後に、局内が確認されたサンプルのみから発光シグナル(生物発光または化学発光)を連続的に測定する。こうすることによって、その化合物の治療上の有効性をモニタリングできる。
【0213】
さらなる別な態様として、本発明は、様々な不透明度を持つ媒質を通して局在化したサンプルを蛍光シグナルによって選んだ後で、局在が確認されたサンプルのみから連続的に発光測定する方法を包含する。この方法では、発光シグナルを、その媒質を透過した光子を積分して画像を作成することもできるが、局在が確認されたサンプルのみを媒質(例えば、臓器組織)から外科的に取り出して、取り出したサンプルを適宜の培養環境下で発光測定するように方法の改良を行なうことができる。限定された外科手術(例えばバイオプシー)は、元となる生物(例えば、哺乳類、とくにヒト)への身体的負担を最小限にし、必要なサンプルのみを安定した検査環境下に移して、種々の見込み有る薬剤に対する応答、治療後の経過管理、予防医学的試験を長期に実行できるという利点を有する。
【0214】
さらなる態様として、本発明は、ある生物内の特定の部位で、選択した物質(例えば溶存酸素またはカルシウム)の濃度を測定する方法を含むことができる。
【0215】
以上の説明において、本発明では次に示すような生物発光の画像解析(またはイメージング分析)ならではの分析試薬を提供することも可能である。とくに、本発明の好適な実施の形態では、不透明な組織を含まない、単離された細胞もしくは細胞群を主に含んでいるような生物学的試料の任意な生物学的活性(酵素活性、免疫学的活性、分子生物学的活性、遺伝学的活性、内科的活性など)を分析するための方法、試薬、ならびに装置を提供する。ここに、単離された細胞もしくは細胞群は、主に光透過性が高い材質からなる収容容器(例えば、ウエル、シャーレ、マイクロスライド、マイクロフルイディクス用チップ)中で長期間保持するので、細胞内活性を損失を最小限にするか実質的に失活せずに撮像を行うための独特な試薬または試薬環境を提供する。
【0216】
1.基質の長期使用に関する試薬とその取扱い
試料の細胞内活性を、例えば数時間から24時間、2日から6日間、1週間から数週間、または数週間超というように長期間培養などの技術で継続させる際、発光をもたらすためには、次のような特徴をもった取扱いが重要である。次に述べる幾つかの方法および/または試薬は、単独でもよいが、複数の方法を組み合わせる方がよい場合があるので、本発明では限定しない。
【0217】
(第1の取扱い方法) 現在市販または報告されている生物発光用試薬は、24時間まで観察可能な基質があるが、それ以上、例えば、数週間だと、基質の継ぎ足しが必要となる。細胞または細胞群を配置している培地に対して定期的ないし、測定の開始に同期して基質を添加する方法が好ましい。複数回の添加を行うのに適している試薬キットとして、同じパッケージに同封される発光タンパクを含む発光性試薬を含む収容手段(容器または袋)と、発光性試薬に対応する量の基質溶液(または基質含有培養液)を複数回の使用に足りるように複数に分割されて収容している収容手段(容器または袋)とを具備するのが好ましい。
【0218】
(第2の取扱い方法) 他の一面において、PH調整を長期に亘り実行する。そのために、例えば気体環境としての二酸化炭素ガスの濃度を一定量以上に保つ方法である。より詳細には、細胞が生き続けるに必要な最低量よりも高濃度なガスを存在させることができる。他方、充分大きな容量の気体環境を大気圧以上の蓄積容器(例えばガス用タンク)内に蓄積し、その容器から定期的ないし徐々に細胞(ないし細胞群)に向けて移動するように装置設計する。このような気体環境の局所的な移動は、細胞(ないし細胞群)の気体に対する代謝速度に応じた速度となるようにするのが好ましい。
【0219】
(第3の取扱い方法および試薬) PHを長時間一定に保証することが知られているHEPESを添加する。そのための方法には、上記気体環境の場合のように、細胞(ないし細胞群)が消費する固体、液体、気体の全てについての消費速度と関連したHEPES濃度に応じてHEPESを供給することができる。HEPESは、公知の除放性カプセルに封入して、有効数のカプセルを細胞(ないし細胞群)とともに液中ないし培地内に含ませておくことがさらに好ましい。有効量のHEPES(またはHEPESと同等のPH維持用化合物)を封入した徐放性カプセルを主に含んでいる溶液や培地は、本発明の目的を達成する有効な試薬となり得る。
【0220】
(第4の取扱い方法、装置または試薬) 本発明の主旨によれば、細胞または細胞群の内部温度を致命的な変化が起きない程度に調節するための保温用装置および/または薬剤を提供することができる。
【0221】
(第5の取扱い方法または試薬) 発光検出のバックグラウンドを長期に低くするための方法および/または試薬に関する。すなわち、生物発光(または化学発光)によるバックグラウンドの増加に関連する要素としての組織片、有色物(例えば発色性色素物質、とくにフェノールレッド色素))を除く方法であり、或いはこれら要素を予め充分に除去した培地または溶液を試薬として提供することができる。
【0222】
(第6の取扱い方法または試薬) 細胞、特に細胞群に対して基質を流通させることは発光の安定性や測定精度にとって重要である。方法としては、基質の細胞膜透過を助ける処理(例えば、圧力ショック、電気的ショック)を連続的、断続的または細胞の老化に応じて実行することができる。試薬としては、細胞膜透過性を補助または促進する添加物(例えば、膜溶解物質としての界面活性剤、膜浸透圧変容物質としての塩類)を含有する基質または別途緩衝溶液を試薬として提供することができる。これらの方法および/または試薬は、長期の測定中に細胞中において活性の有る基質が不足しないように、新鮮な細胞外の基質に対して透過性が継続するか、或いは一時的に透過性が高まるように設定するのが好ましい。
【0223】
(第7の取扱い方法) 均一な染色方法を達成する方法に関する。磁気ビーズをあらかじめ加えておき、数時間、または一日に一回攪拌する。通常は、収容する容器の底面上には細胞が貼り付いているため、上方から攪拌するのが好ましい。
【0224】
(第8の取扱い方法または試薬) 長期観察を行う際に、同一の細胞(または細胞群)について多数回の発光反応を繰り返すことで生じる副産物による、光学的または化学的な阻害の影響を除去する方法や試薬に関する。すなわち、基質を継ぎ足すような取扱いに応じて発光反応に伴う反応副産物が蓄積していく。この発光反応に伴う副産物(ピロリン酸)などを除去するために、副産物排除用物質(例えば、沈殿作用を有する金属イオン)を加える。
【0225】
(第9の取扱い方法または試薬) 発光成分としてのルシフェリンを再生させる方法または試薬に関する。ルシフェリンが発光後、オキシルシフェリンとなるが、これをルシフェリンに再生するための試薬をルシフェリンの老化または消耗に応じて細胞(または細胞群)に供給する方法が提供される。検出オキシルシフェリンがニトリル体2に変換された後、合成でも使われたように体内にあるシステインと反応し、ルシフェリンが再生することがホタルでは知られている。このような発光成分の活性低下を再生する再生物質を含んでいる基質、或いは別途の緩衝液を提供することも可能である。基質としては、他にセレンテラジンも含まれる。
【0226】
(第10の取扱い方法または試薬) 新規な試薬としてのカプセル封入型基質に関する。所定時間経過後または一定の時間間隔で溶出ないし液放出するようなカプセルに適当な基質(例えばルシフェリン)を封入しておき、基質を一定濃度を保つようにする。また、カプセルに封入されていない基質(例えばルシフェリン)と、カプセルに封入した同種の基質を同時に提供する方法、または混合した状態のカプセル含有溶液である試薬を提供することができる。また、徐放速度が異なる2以上のカプセルに同種の基質(例えばルシフェリン)を含有させた試薬を同時に細胞(ないし細胞群)と添加(または培地との接触)することにより、異なる放出時機に新鮮な基質が自動的に提供されるという利点を有する。こうすることによって、励起光照射時機と基質の放出時機を連携させることも可能となる。
【実施例1】
【0227】
ここでは、上述した実施の形態における所定部位発光量測定装置100を用いて、図10に示すプラスミドベクターを導入した複数のHeLa細胞を対象として、特定のHeLa細胞内のミトコンドリアからの発光量およびATP量を経時的に測定する。
【0228】
まず、本実施例1における実験プロトコルを説明する。
(1)蛍光タンパク質(GFP)とミトコンドリア移行シグナルとルシフェラーゼとが繋がった融合遺伝子を作製する。
(2)融合遺伝子が入ったプラスミドベクター(図10参照)をHeLa細胞に導入する。
(3)上述した実施の形態における所定部位発光量測定装置100(具体的には、本装置を構成する倒立蛍光顕微鏡)を用いて、GFPがミトコンドリアに局在しているか否かを判定することで、ルシフェラーゼがミトコンドリアに局在しているか否かを確認する(図11参照)。なお、図11は、所定部位発光量測定装置100を構成する蛍光画像撮像ユニット108で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および蛍光像を示す図である。
(4)HeLa細胞にヒスタミンを投与し、Ca2+を介したミトコンドリアのATP量の変動を引き起こす。
(5)上述した実施の形態における所定部位発光量測定装置100を用いて、ミトコンドリアから発せられる発光を画像として経時的に取得する(図12参照)。なお、図12は、所定部位発光量測定装置100を構成する発光画像撮像ユニット106で撮像した、プラスミドベクターを導入したHeLa細胞の明視野像および発光像を示す図である。
(6)上述した実施の形態における所定部位発光量測定装置100を用いて、明視野像、蛍光像および発光像を重ね合わせることで、測定する細胞を選定する。
(7)上述した実施の形態における所定部位発光量測定装置100を用いて、選定した細胞または領域の発光強度を経時的に測定し(図13参照)、ATP量の変動をモニタする。なお、図13は、所定部位発光量測定装置100で測定した、特定した番号1のHeLa細胞の発光強度の経時的変動を示す図である。
【0229】
つぎに、実験結果について説明する。図11に示すように、番号1のHeLa細胞においては、プラスミドベクターにより融合遺伝子が導入され且つミトコンドリアにルシフェラーゼが局在していることが確認でき、また、番号2および番号4のHeLa細胞においては、プラスミドベクターにより融合遺伝子が導入されていないことが確認でき、さらに、番号3のHeLa細胞においては、プラスミドベクターにより融合遺伝子が導入されているがミトコンドリアにルシフェラーゼが局在していないことが確認できた。なお、プラスミドベクターにより融合遺伝子が導入され且つミトコンドリアにルシフェラーゼが局在していることが確認できたHeLa細胞は、番号1の細胞のみであったので、測定対象のHeLa細胞は番号1のHeLa細胞に特定された。また、図12に示すように、番号3のHeLa細胞からの発光が最も強く、ついで番号1のHeLa細胞からの発光が強く、ついで番号2および番号4のHeLa細胞からの発光は同等の強さであることが確認できた。そして、図13に示すように、所定部位発光量測定装置100を用いることにより、番号1のHeLa細胞のミトコンドリアからの発光強度の経時変動をモニタすることができた。
【実施例2】
【0230】
ここでは、上述した実施の形態における図16に示す所定部位発光量測定装置100を用いて、ルシフェラーゼ遺伝子と緑色蛍光タンパク(GFP)遺伝子とを導入したHeLa細胞を対象として、当該HeLa細胞の発光観察および蛍光観察を行う。
【0231】
まず、本実施例2における実験プロトコルを説明する。
(1)ルシフェラーゼ遺伝子と緑色蛍光タンパク(GFP)遺伝子とを縦列して配置したベクター(EGFP−Luc、Clonetech社製)をリポフェクチン法によりHeLa細胞に導入する。
(2)ベクター導入から約24時間後、ベクターを導入したHeLa細胞を含む培養液(D−MEM、GIBCO、Invitrogen社製)にルシフェリンを500μM添加する。
(3)図16に示す所定部位発光量測定装置100のステージ104に、培養液を入れた容器を設置し、所定部位発光量測定装置100を用いてHeLa細胞の明視野画像、蛍光画像および発光画像を撮像する。なお、蛍光画像を撮像する場合には励起用分光フィルター108gおよび発光・蛍光分光用フィルター108jを入れ、当該撮像における露出時間を0.7秒間とした。また、発光画像を撮像する場合には発光・蛍光分光用フィルター108jを外し、当該撮像における露出時間を5分間とした。ここで、本実施例2では、対物レンズ108aとして、焦点距離(f)が9mmで開口数(NA)が0.75であるオリンパス社製の“Uapo 20X”を用いた。また、結像レンズ108eとして、焦点距離(f)が18mmで開口数(NA)が0.25で“(NA÷β)2”の値が0.035であるオリンパス社製の“LMPlanFL 10X”を用いた。また、光源108cとして、オリンパス社製のハロゲン光源“LG−PSs”を用いた。また、CCDカメラ108dとして、オリンパス社製の“DP−30BW”を用いた。また、励起用分光フィルター108gとして、オリンパス社製の“BP470−490”を用いた。また、発光・蛍光分光用フィルター108jとして、オメガ(Omega)社製の“510AF23”を用いた。
【0232】
つぎに、観察結果について説明する。図17は、ベクター(EGFP−Luc遺伝子)を導入したHeLa細胞の蛍光画像を示す図である。また、図18は、ベクター(EGFP−Luc遺伝子)を導入したHeLa細胞の蛍光画像と明視野画像とを重ね合わせた画像を示す図である。また、図19は、ベクター(EGFP−Luc遺伝子)を導入したHeLa細胞の発光画像を示す図である。図17、図18および図19に示すように、所定部位発光量測定装置100を用いて、遺伝子導入できたHeLa細胞を蛍光観察により特定することができ、さらに、当該特定したHeLa細胞を視野に入れてから発光画像の撮像を行うことができた。
【実施例3】
【0233】
ここでは、上述した実施の形態の発現量測定装置1000を用いて、蛍光で細胞周期のステージの同定しながら発光で解析対象の遺伝子の発現量の測定(解析対象の遺伝子のプロモーターアッセイ)を行う。
【0234】
まず、細胞に導入するベクターを作製する。具体的には、細胞周期関連遺伝子プロモーター導入ルシフェラーゼ(緑)発現ベクターを作製する。なお、用いる細胞はPC12である。つぎに、作製したベクターを細胞に導入する(トランスフェクション)。つぎに、細胞の細胞膜を“PKH LinkerKits(赤)”(SIGMA社製)を用いて染色する。つぎに、発現量測定装置1000を用いて、細胞周期のステージを同定しながら、解析対象遺伝子である細胞周期関連遺伝子のプロモータアッセイを行う。これにより、細胞周期と細胞の形態との関連を調べることができた。
【実施例4】
【0235】
ここでは、上述した実施の形態の発現量測定装置1000を用いて、発光で細胞周期のステージの同定しながら蛍光で解析対象の遺伝子の発現量の測定および発現時期・当該遺伝子の局在の同定を行う。
【0236】
まず、細胞に導入するベクターを作製する。具体的には、解析対象遺伝子プロモーターを導入した蛍光タンパク質ベクターを作製する。つぎに、HaloTag(登録商標)ベクター(プロメガ社製)を細胞に導入する。なお、用いる細胞はPC12である。つぎに、HaloTag(登録商標)リガンド(プロメガ社製)を細胞に添加して、細胞に対してルシフェラーゼ標識を行う。つまり、HaloTag(登録商標)(プロメガ社製)に対するリガンド結合により、細胞に対してルシフェラーゼ標識を行う。つぎに、発現量測定装置1000を用いて、細胞周期のステージをモニタリングしながら、細胞周期に関わる可能性のある解析対象遺伝子の発現時期・局在の同定を行う。これにより、当該解析対象遺伝子と細胞周期との関連性の有無、および当該解析対象遺伝子の細胞周期マーカーとしての有用性を評価することができた。
【0237】
以上のように、本発明にかかる所定部位発光量測定方法、所定部位発光量測定装置および測定装置は、生きたサンプル内の所定の部位からの発光量を測定する場合に有用であり、また、本発明にかかる発現量測定方法は、生きた細胞に導入した解析対象の遺伝子の発現量を測定すると共に細胞周期のステージを同定する場合に有用であり、バイオ、製薬、医療など様々な分野で好適に用いることができる。
【符号の説明】
【0238】
100 所定部位発光量測定装置
102 サンプル
103 容器
104 ステージ
106 発光画像撮像ユニット
106a 対物レンズ(発光観察用)
106b ダイクロイックミラー
106c CCDカメラ
106d スプリットイメージユニット
106e フィルターホイール
106f 結像レンズ
108 蛍光画像撮像ユニット
108a 対物レンズ(蛍光観察用)
108b ダイクロイックミラー
108c 光源
108d CCDカメラ
108e 結像レンズ
108f シャッター
108g 励起用分光フィルター
108h 光ファイバー
108i コンデンサーレンズ
108j 発光・蛍光分光用フィルター
110 情報通信端末
112 制御部
112a 蛍光画像撮像指示部
112b 蛍光画像取得部
112c 判定部
112d 発光画像撮像指示部
112e 発光画像取得部
112f 選定部
112g 発光量測定部
112h 関連物質定量部
114 クロック発生部
116 記憶部
118 通信インターフェース部
120 入出力インターフェース部
122 入力部
124 出力部
1000 発現量測定装置
1020 細胞
1030 容器
1040 ステージ
1060 発光画像撮像ユニット
1060a 対物レンズ(発光観察用)
1060b ダイクロイックミラー
1060c CCDカメラ
1060d スプリットイメージユニット
1060e フィルターホイール
1080 蛍光画像撮像ユニット
1080a 対物レンズ(蛍光観察用)
1080b ダイクロイックミラー
1080c キセノンランプ
1080d CCDカメラ
1100 情報通信端末
1120 制御部
1120a 蛍光画像撮像指示部
1120b 発光画像撮像指示部
1120c 蛍光画像取得部
1120d 発光画像取得部
1120e 判定部
1120f 蛍光測定部
1120g 発光測定部
1120h ステージ同定部
1120i 選択部
1120j 発現量測定部
1140 クロック発生部
1160 記憶部
1180 通信インターフェース部
1200 入出力インターフェース部
1220 入力部
1240 出力部
1,11 対物レンズ
2,12,32 結像レンズ
3,13 撮像装置
4 励起光源
5 レンズ
6 蛍光キューブ
6a 励起フィルター
6b 吸収フィルター
6c ダイクロイックミラー
7,17 保持部
7a 保持部材
7b,17b 可動ステージ
8,18 ステージ駆動部
9 モニター
14 回転駆動装置
15a,15b 固定軸
21,22,23,24,25,26 筐体
33,43 シャッター
34 ミラー
35 光路切換駆動部
44 白色光源
45 照明レンズ系
45a コレクタレンズ
45b コンデンサーレンズ
46 照明駆動部
100a,200,300,400,500,600,700,800,900 顕微鏡装置
101,201 蛍光顕微鏡ユニット
102a,202 微弱光顕微鏡ユニット
103a 透過照明ユニット
104a,105 蛍光照明ユニット
PC1〜PC9 制御装置
S 標本
【特許請求の範囲】
【請求項1】
発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定方法であって、
前記融合遺伝子は、前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、
当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像ステップと、
前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定ステップと、
前記判定ステップの判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定ステップと、
を含むことを特徴とする所定部位発光量測定方法。
【請求項2】
前記融合遺伝子が導入された生きたサンプルが撮像範囲中に複数存在する場合、
複数の前記サンプルの発光画像を撮る発光画像撮像ステップと、
前記蛍光画像撮像ステップで撮像した蛍光画像および前記発光画像撮像ステップで撮像した発光画像を重ね合わせることで、前記判定ステップの判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定する選定ステップと、
をさらに含み、
前記蛍光画像撮像ステップは、複数の前記サンプルの蛍光画像を撮り、
前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプルごとに判定し、
前記発光量測定ステップは、前記選定ステップで選定したサンプルからの発光量を測定すること、
を特徴とする請求項1に記載の所定部位発光量測定方法。
【請求項3】
前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップを繰り返し実行することで、サンプル内の所定の部位からの発光量を経時的に得ること、
を特徴とする請求項2に記載の所定部位発光量測定方法。
【請求項4】
前記サンプルからの発光を発光色別に分離する発光分離ステップ、
をさらに含み、
前記サンプルに導入される融合遺伝子は、複数存在し、前記移行塩基配列で移行させる発光タンパク質の移行先の部位と、前記発光タンパク質から発せられる発光の発光色と、前記蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製され、
前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、
前記発光量測定ステップは、前記判定ステップの判定結果が局在すると判定された場合、前記発光分離ステップで分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定すること、
を特徴とする請求項1に記載の所定部位発光量測定方法。
【請求項5】
前記サンプルは、試料、組織、細胞、個体のいずれか1つであること、
を特徴とする請求項1から4のいずれか1つに記載の所定部位発光量測定方法。
【請求項6】
前記発光量測定ステップで測定した発光量に基づいて、前記選定ステップで選定したサンプル内の所定の部位におけるATPを定量するATP定量ステップ、
をさらに含み、
前記サンプルは細胞であり、前記所定の部位はミトコンドリアであり、前記移行塩基配列はミトコンドリア移行シグナルであり、前記発光タンパク質はルシフェラーゼであり、前記蛍光タンパク質は緑色蛍光タンパク質であり、
前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップに加えてさらに前記ATP定量ステップを繰り返し実行することで、サンプル内の所定の部位からのATPを経時的に定量すること、
を特徴とする請求項3に記載の所定部位発光量測定方法。
【請求項7】
発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定装置であって、
前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子を用い、
当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像手段と、
前記蛍光画像撮像手段で撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定手段と、
前記判定手段の判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定手段と、
を備えたことを特徴とする所定部位発光量測定装置。
【請求項8】
発光タンパク質を発現する発光関連遺伝子と蛍光タンパク質を発現する蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、細胞から発せられた蛍光の蛍光強度を測定する蛍光測定ステップと、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、
前記細胞は、前記発光関連遺伝子、前記蛍光関連遺伝子および前記解析対象の遺伝子に加えてさらに、細胞周期の所定のステージで発現する細胞周期関連遺伝子を導入したものであり、
前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定するステージ同定ステップ、
をさらに含むことを特徴とする発現量測定方法。
【請求項9】
前記細胞が撮像範囲中に複数存在する場合、
複数の細胞の蛍光画像を撮像する蛍光画像撮像ステップと、
前記複数の細胞の発光画像を撮像する発光画像撮像ステップと、
をさらに含み、
前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、
前記蛍光測定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて、各細胞から発せられた蛍光の蛍光強度をそれぞれ測定し、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、
前記ステージ同定ステップは、前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、
を特徴とする請求項8に記載の発現量測定方法。
【請求項10】
前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、
をさらに含み、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、
を特徴とする請求項9に記載の発現量測定方法。
【請求項11】
前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記蛍光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、
を特徴とする請求項10に記載の発現量測定方法。
【請求項12】
前記発現量測定ステップは、前記選択ステップで選択した細胞を対象として、前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定すると共に、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて前記解析対象の遺伝子の細胞内における発現部位を同定すること、
を特徴とする請求項11に記載の発現量測定方法。
【請求項13】
発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、
前記細胞は、その所定の部位を蛍光物質で染色したものであり、
当該細胞の蛍光画像を撮像する蛍光画像撮像ステップと、
前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを判定することで、細胞周期のステージを同定するステージ同定ステップと、
をさらに含むことを特徴とする発現量測定方法。
【請求項14】
前記細胞が撮像範囲中に複数存在する場合、
複数の細胞の発光画像を撮像する発光画像撮像ステップ、
をさらに含み、
前記蛍光画像撮像ステップは、前記複数の細胞の蛍光画像を撮像し、
前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、
前記ステージ同定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、
を特徴とする請求項13に記載の発現量測定方法。
【請求項15】
前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、
をさらに含み、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、
を特徴とする請求項14に記載の発現量測定方法。
【請求項16】
前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、
を特徴とする請求項15に記載の発現量測定方法。
【請求項17】
微弱光を発する発光標識および励起されて蛍光を発する蛍光標識が付与されて保持手段に保持される標本の標本像を結像する結像光学系と、該標本像を撮像する撮像手段とを備える測定装置において、
前記結像光学系は、
前記発光標識からの微弱光を前記標本像としての微弱光標本像を結像する微弱光結像光学系と、
前記蛍光標識からの蛍光を前記標本像としての蛍光標本像を結像する蛍光結像光学系と、
を備え、
前記撮像手段は、前記微弱光標本像と前記蛍光標本像とを撮像することを特徴とする測定装置。
【請求項18】
前記蛍光結像光学系は、前記標本を照明する照明手段を備えることを特徴とする請求項17に記載の測定装置。
【請求項19】
前記撮像手段によって撮像された微弱光標本像の像特性をもとに、該微弱光標本像の撮像と前記蛍光標本像の撮像とを切り換える制御を行う撮像切換制御手段を備えたことを特徴とする請求項17に記載の測定装置。
【請求項20】
前記像特性は、前記微弱光標本像の像強度であり、
前記撮像切換制御手段は、前記像強度が所定のしきい値より大きい場合、前記微弱光標本像の撮像から前記蛍光標本像の撮像に切り換えることを特徴とする請求項19に記載の測定装置。
【請求項21】
前記像強度は、前記微弱光標本像の全体または部分の像強度であって、所定時点から現時点までの累積の像強度または現時点の像強度であることを特徴とする請求項20に記載の測定装置。
【請求項22】
前記蛍光結像光学系は、
前記蛍光標識の各点からの蛍光を略平行光束に変換する蛍光対物レンズと、
前記蛍光対物レンズによって略平行光束に変換された蛍光を集光して前記蛍光標本像を結像する蛍光結像レンズと、
前記蛍光標識を励起する励起光を選択的に透過させる励起光透過フィルター、前記蛍光標識からの蛍光を選択的に透過させる蛍光透過フィルターおよび前記励起光を反射し前記蛍光を透過させるダイクロイックミラーを有し、前記蛍光対物レンズと前記蛍光結像レンズとの間に配置される蛍光ユニットと、
前記励起光を発する励起光源を有し、該励起光源からの励起光を前記ダイクロイックミラーによって反射させ前記標本に照射させる励起光照射手段と、
を備えたことを特徴とする請求項19〜21のいずれか一つに記載の測定装置。
【請求項23】
前記微弱光結像光学系は、
前記発光標識の各点からの微弱光を略平行光束に変換する微弱光対物レンズと、
前記微弱光対物レンズによって略平行光束に変換された微弱光を集光して前記微弱光標本像を結像する微弱光結像レンズと、
を備えたことを特徴とする請求項22に記載の測定装置。
【請求項24】
前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して互いに反対側に配置され、
前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする請求項22または23に記載の測定装置。
【請求項25】
前記微弱光結像光学系および前記蛍光結像光学系の各視野を相対的に平行移動させる視野移動手段を備えることを特徴とする請求項24に記載の測定装置。
【請求項26】
前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有することを特徴とする請求項24または25に記載の測定装置。
【請求項27】
前記微弱光対物レンズおよび前記蛍光対物レンズは、同一の対物レンズであり、
前記微弱光結像光学系および前記蛍光結像光学系は、前記対物レンズを共用することを特徴とする請求項23に記載の測定装置。
【請求項28】
前記対物レンズと前記蛍光ユニットとの間の瞳空間に挿脱可能に配置され、該瞳空間に配置された場合、前記対物レンズからの微弱光を前記微弱光結像レンズに向けて反射させるミラーを備え、
前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記ミラーを瞳空間に配置するとともに前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記ミラーを瞳空間に未配置にするとともに前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする請求項27に記載の測定装置。
【請求項29】
前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、
前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有し、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記微弱光結像光学系の視野内に移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記蛍光結像光学系の視野内に移動させる制御を行うことを特徴とする請求項22または23に記載の測定装置。
【請求項30】
前記微弱光結像光学系および前記蛍光結像光学系の各視野が前記標本を含むように前記微弱光結像光学系および前記蛍光結像光学系を移動させる光学系移動手段を備え、
前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記微弱光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該微弱光結像光学系を移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記蛍光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該蛍光結像光学系を移動させる制御を行うことを特徴とする請求項22または23に記載の測定装置。
【請求項31】
前記光学系移動手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野の略中心点を結ぶ線分の中点を通り前記微弱光結像光学系および前記蛍光結像光学系の各光軸に略平行な回転軸を有し、該回転軸を中心に前記微弱光結像光学系および前記蛍光結像光学系を回転移動させることを特徴とする請求項30に記載の測定装置。
【請求項32】
前記撮像手段は、
前記微弱光標本像を撮像する微弱光撮像手段と、
前記蛍光標本像を撮像する蛍光撮像手段と、
を備えることを特徴とする請求項17および請求項19〜29のいずれか一つに記載の測定装置。
【請求項33】
前記撮像手段は、
前記微弱光標本像を撮像する微弱光撮像手段と、
前記蛍光標本像を撮像する蛍光撮像手段と、
を備え、
前記光学系移動手段は、前記微弱光結像光学系および前記微弱光撮像手段と、前記蛍光結像光学系および前記蛍光撮像手段と、をそれぞれ一体に移動させることを特徴とする請求項30または31に記載の測定装置。
【請求項34】
前記微弱光標本像および前記蛍光標本像は、それぞれ前記微弱光結像レンズおよび前記蛍光結像レンズによって略同じ位置に結像され、
前記撮像手段は、前記微弱光標本像および前記蛍光標本像が結像される位置に略一致して固定されることを特徴とする請求項30または31に記載の測定装置。
【請求項35】
前記微弱光結像光学系および前記蛍光結像光学系の少なくとも一方に対応し、前記標本に対して透過照明を行う照明手段を備えることを特徴とする請求項27〜31のいずれか一つに記載の測定装置。
【請求項36】
前記透過照明は、明視野観察用照明、暗視野観察用照明、微分干渉観察用照明および位相差観察用照明の少なくとも1つであることを特徴とする請求項35に記載の測定装置。
【請求項37】
前記微弱光結像光学系は、該微弱光結像光学系の標本側の開口数をNAoとし、前記微弱光標本像を結像する倍率をβとして、(NAo/β)2によって演算される値が0.01以上であることを特徴とする請求項17および請求項19〜35のいずれか一つに記載の測定装置。
【請求項1】
発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定方法であって、
前記融合遺伝子は、前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合したものであり、
当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像ステップと、
前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定ステップと、
前記判定ステップの判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定ステップと、
を含むことを特徴とする所定部位発光量測定方法。
【請求項2】
前記融合遺伝子が導入された生きたサンプルが撮像範囲中に複数存在する場合、
複数の前記サンプルの発光画像を撮る発光画像撮像ステップと、
前記蛍光画像撮像ステップで撮像した蛍光画像および前記発光画像撮像ステップで撮像した発光画像を重ね合わせることで、前記判定ステップの判定結果が局在すると判定されたサンプルの中から測定対象のサンプルを選定する選定ステップと、
をさらに含み、
前記蛍光画像撮像ステップは、複数の前記サンプルの蛍光画像を撮り、
前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かをサンプルごとに判定し、
前記発光量測定ステップは、前記選定ステップで選定したサンプルからの発光量を測定すること、
を特徴とする請求項1に記載の所定部位発光量測定方法。
【請求項3】
前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップを繰り返し実行することで、サンプル内の所定の部位からの発光量を経時的に得ること、
を特徴とする請求項2に記載の所定部位発光量測定方法。
【請求項4】
前記サンプルからの発光を発光色別に分離する発光分離ステップ、
をさらに含み、
前記サンプルに導入される融合遺伝子は、複数存在し、前記移行塩基配列で移行させる発光タンパク質の移行先の部位と、前記発光タンパク質から発せられる発光の発光色と、前記蛍光タンパク質から発せられる蛍光の蛍光色との組み合わせがそれぞれ異なるように予め作製され、
前記判定ステップは、前記蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを蛍光色ごとに判定し、
前記発光量測定ステップは、前記判定ステップの判定結果が局在すると判定された場合、前記発光分離ステップで分離した複数の発光のうち当該局在すると判定された部位からの発光を特定し、特定した発光の発光量を測定すること、
を特徴とする請求項1に記載の所定部位発光量測定方法。
【請求項5】
前記サンプルは、試料、組織、細胞、個体のいずれか1つであること、
を特徴とする請求項1から4のいずれか1つに記載の所定部位発光量測定方法。
【請求項6】
前記発光量測定ステップで測定した発光量に基づいて、前記選定ステップで選定したサンプル内の所定の部位におけるATPを定量するATP定量ステップ、
をさらに含み、
前記サンプルは細胞であり、前記所定の部位はミトコンドリアであり、前記移行塩基配列はミトコンドリア移行シグナルであり、前記発光タンパク質はルシフェラーゼであり、前記蛍光タンパク質は緑色蛍光タンパク質であり、
前記蛍光画像撮像ステップ、前記判定ステップ、前記発光画像撮像ステップ、前記選定ステップ、前記発光量測定ステップに加えてさらに前記ATP定量ステップを繰り返し実行することで、サンプル内の所定の部位からのATPを経時的に定量すること、
を特徴とする請求項3に記載の所定部位発光量測定方法。
【請求項7】
発光タンパク質をサンプル内の所定の部位に移行させる移行塩基配列と、当該発光タンパク質を発現する発光関連遺伝子と、を融合した融合遺伝子が導入された生きたサンプルからの発光量を測定することにより、前記所定の部位からの発光量を得る所定部位発光量測定装置であって、
前記移行塩基配列および前記発光関連遺伝子に加えてさらに蛍光タンパク質を発現する蛍光関連遺伝子を融合した融合遺伝子を用い、
当該融合遺伝子が導入されたサンプルの蛍光画像を撮る蛍光画像撮像手段と、
前記蛍光画像撮像手段で撮像した蛍光画像に基づいて所定の部位に発光タンパク質が局在するか否かを判定する判定手段と、
前記判定手段の判定結果が局在すると判定された場合、サンプルからの発光量を測定する発光量測定手段と、
を備えたことを特徴とする所定部位発光量測定装置。
【請求項8】
発光タンパク質を発現する発光関連遺伝子と蛍光タンパク質を発現する蛍光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、細胞から発せられた蛍光の蛍光強度を測定する蛍光測定ステップと、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、
前記細胞は、前記発光関連遺伝子、前記蛍光関連遺伝子および前記解析対象の遺伝子に加えてさらに、細胞周期の所定のステージで発現する細胞周期関連遺伝子を導入したものであり、
前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を判定することで、細胞周期のステージを同定するステージ同定ステップ、
をさらに含むことを特徴とする発現量測定方法。
【請求項9】
前記細胞が撮像範囲中に複数存在する場合、
複数の細胞の蛍光画像を撮像する蛍光画像撮像ステップと、
前記複数の細胞の発光画像を撮像する発光画像撮像ステップと、
をさらに含み、
前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、
前記蛍光測定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて、各細胞から発せられた蛍光の蛍光強度をそれぞれ測定し、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、
前記ステージ同定ステップは、前記発現量測定ステップで発光強度を用いる場合には前記蛍光測定ステップで測定した蛍光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定し、前記発現量測定ステップで蛍光強度を用いる場合には前記発光測定ステップで測定した発光強度に基づいて細胞周期関連遺伝子の発現の有無を細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、
を特徴とする請求項8に記載の発現量測定方法。
【請求項10】
前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、
をさらに含み、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度または前記蛍光測定ステップで測定した蛍光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、
を特徴とする請求項9に記載の発現量測定方法。
【請求項11】
前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記蛍光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、
を特徴とする請求項10に記載の発現量測定方法。
【請求項12】
前記発現量測定ステップは、前記選択ステップで選択した細胞を対象として、前記蛍光測定ステップで測定した蛍光強度に基づいて前記解析対象の遺伝子の発現量を測定すると共に、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて前記解析対象の遺伝子の細胞内における発現部位を同定すること、
を特徴とする請求項11に記載の発現量測定方法。
【請求項13】
発光タンパク質を発現する発光関連遺伝子と解析対象の遺伝子とを導入した生きた細胞を対象として、細胞から発せられた発光の発光強度を測定する発光測定ステップと、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を測定する発現量測定ステップと、を含む発現量測定方法であって、
前記細胞は、その所定の部位を蛍光物質で染色したものであり、
当該細胞の蛍光画像を撮像する蛍光画像撮像ステップと、
前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを判定することで、細胞周期のステージを同定するステージ同定ステップと、
をさらに含むことを特徴とする発現量測定方法。
【請求項14】
前記細胞が撮像範囲中に複数存在する場合、
複数の細胞の発光画像を撮像する発光画像撮像ステップ、
をさらに含み、
前記蛍光画像撮像ステップは、前記複数の細胞の蛍光画像を撮像し、
前記発光測定ステップは、前記発光画像撮像ステップで撮像した発光画像に基づいて、各細胞から発せられた発光の発光強度をそれぞれ測定し、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて前記解析対象の遺伝子の発現量を細胞ごとに測定し、
前記ステージ同定ステップは、前記蛍光画像撮像ステップで撮像した蛍光画像に基づいて細胞の形状が変化したか否かを細胞ごとに判定することで、細胞周期のステージを細胞ごとに同定すること、
を特徴とする請求項13に記載の発現量測定方法。
【請求項15】
前記ステージ同定ステップでステージが同定された細胞の中から測定対象の細胞を選択する選択ステップ、
をさらに含み、
前記発現量測定ステップは、前記発光測定ステップで測定した発光強度に基づいて、前記選択ステップで選択した細胞に導入された解析対象の遺伝子の発現量を測定すること、
を特徴とする請求項14に記載の発現量測定方法。
【請求項16】
前記発光画像撮像ステップ、前記蛍光画像撮像ステップ、前記発光測定ステップ、前記ステージ同定ステップ、前記選択ステップ、前記発現量測定ステップを繰り返し実行することで、前記選択ステップで選択した細胞を対象として、細胞周期のステージを同定しながら前記解析対象の遺伝子の発現量を経時的に測定すること、
を特徴とする請求項15に記載の発現量測定方法。
【請求項17】
微弱光を発する発光標識および励起されて蛍光を発する蛍光標識が付与されて保持手段に保持される標本の標本像を結像する結像光学系と、該標本像を撮像する撮像手段とを備える測定装置において、
前記結像光学系は、
前記発光標識からの微弱光を前記標本像としての微弱光標本像を結像する微弱光結像光学系と、
前記蛍光標識からの蛍光を前記標本像としての蛍光標本像を結像する蛍光結像光学系と、
を備え、
前記撮像手段は、前記微弱光標本像と前記蛍光標本像とを撮像することを特徴とする測定装置。
【請求項18】
前記蛍光結像光学系は、前記標本を照明する照明手段を備えることを特徴とする請求項17に記載の測定装置。
【請求項19】
前記撮像手段によって撮像された微弱光標本像の像特性をもとに、該微弱光標本像の撮像と前記蛍光標本像の撮像とを切り換える制御を行う撮像切換制御手段を備えたことを特徴とする請求項17に記載の測定装置。
【請求項20】
前記像特性は、前記微弱光標本像の像強度であり、
前記撮像切換制御手段は、前記像強度が所定のしきい値より大きい場合、前記微弱光標本像の撮像から前記蛍光標本像の撮像に切り換えることを特徴とする請求項19に記載の測定装置。
【請求項21】
前記像強度は、前記微弱光標本像の全体または部分の像強度であって、所定時点から現時点までの累積の像強度または現時点の像強度であることを特徴とする請求項20に記載の測定装置。
【請求項22】
前記蛍光結像光学系は、
前記蛍光標識の各点からの蛍光を略平行光束に変換する蛍光対物レンズと、
前記蛍光対物レンズによって略平行光束に変換された蛍光を集光して前記蛍光標本像を結像する蛍光結像レンズと、
前記蛍光標識を励起する励起光を選択的に透過させる励起光透過フィルター、前記蛍光標識からの蛍光を選択的に透過させる蛍光透過フィルターおよび前記励起光を反射し前記蛍光を透過させるダイクロイックミラーを有し、前記蛍光対物レンズと前記蛍光結像レンズとの間に配置される蛍光ユニットと、
前記励起光を発する励起光源を有し、該励起光源からの励起光を前記ダイクロイックミラーによって反射させ前記標本に照射させる励起光照射手段と、
を備えたことを特徴とする請求項19〜21のいずれか一つに記載の測定装置。
【請求項23】
前記微弱光結像光学系は、
前記発光標識の各点からの微弱光を略平行光束に変換する微弱光対物レンズと、
前記微弱光対物レンズによって略平行光束に変換された微弱光を集光して前記微弱光標本像を結像する微弱光結像レンズと、
を備えたことを特徴とする請求項22に記載の測定装置。
【請求項24】
前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して互いに反対側に配置され、
前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする請求項22または23に記載の測定装置。
【請求項25】
前記微弱光結像光学系および前記蛍光結像光学系の各視野を相対的に平行移動させる視野移動手段を備えることを特徴とする請求項24に記載の測定装置。
【請求項26】
前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有することを特徴とする請求項24または25に記載の測定装置。
【請求項27】
前記微弱光対物レンズおよび前記蛍光対物レンズは、同一の対物レンズであり、
前記微弱光結像光学系および前記蛍光結像光学系は、前記対物レンズを共用することを特徴とする請求項23に記載の測定装置。
【請求項28】
前記対物レンズと前記蛍光ユニットとの間の瞳空間に挿脱可能に配置され、該瞳空間に配置された場合、前記対物レンズからの微弱光を前記微弱光結像レンズに向けて反射させるミラーを備え、
前記励起光照射手段は、前記標本に対して励起光を未照射にする未照射手段を有し、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記ミラーを瞳空間に配置するとともに前記未照射手段に励起光を未照射にさせ、前記撮像手段に蛍光標本像を撮像させる場合、前記ミラーを瞳空間に未配置にするとともに前記励起光照射手段に励起光を照射させる制御を行うことを特徴とする請求項27に記載の測定装置。
【請求項29】
前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、
前記保持手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野内に前記標本を移動させる標本移動手段を有し、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記微弱光結像光学系の視野内に移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記標本移動手段によって前記標本を前記蛍光結像光学系の視野内に移動させる制御を行うことを特徴とする請求項22または23に記載の測定装置。
【請求項30】
前記微弱光結像光学系および前記蛍光結像光学系の各視野が前記標本を含むように前記微弱光結像光学系および前記蛍光結像光学系を移動させる光学系移動手段を備え、
前記微弱光結像光学系および前記蛍光結像光学系は、前記標本に対して同じ側に配置され、
前記撮像切換制御手段は、前記撮像手段に微弱光標本像を撮像させる場合、前記微弱光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該微弱光結像光学系を移動させ、前記撮像手段に蛍光標本像を撮像させる場合、前記蛍光結像光学系の視野が前記標本を含むように前記光学系移動手段によって該蛍光結像光学系を移動させる制御を行うことを特徴とする請求項22または23に記載の測定装置。
【請求項31】
前記光学系移動手段は、前記微弱光結像光学系および前記蛍光結像光学系の各視野の略中心点を結ぶ線分の中点を通り前記微弱光結像光学系および前記蛍光結像光学系の各光軸に略平行な回転軸を有し、該回転軸を中心に前記微弱光結像光学系および前記蛍光結像光学系を回転移動させることを特徴とする請求項30に記載の測定装置。
【請求項32】
前記撮像手段は、
前記微弱光標本像を撮像する微弱光撮像手段と、
前記蛍光標本像を撮像する蛍光撮像手段と、
を備えることを特徴とする請求項17および請求項19〜29のいずれか一つに記載の測定装置。
【請求項33】
前記撮像手段は、
前記微弱光標本像を撮像する微弱光撮像手段と、
前記蛍光標本像を撮像する蛍光撮像手段と、
を備え、
前記光学系移動手段は、前記微弱光結像光学系および前記微弱光撮像手段と、前記蛍光結像光学系および前記蛍光撮像手段と、をそれぞれ一体に移動させることを特徴とする請求項30または31に記載の測定装置。
【請求項34】
前記微弱光標本像および前記蛍光標本像は、それぞれ前記微弱光結像レンズおよび前記蛍光結像レンズによって略同じ位置に結像され、
前記撮像手段は、前記微弱光標本像および前記蛍光標本像が結像される位置に略一致して固定されることを特徴とする請求項30または31に記載の測定装置。
【請求項35】
前記微弱光結像光学系および前記蛍光結像光学系の少なくとも一方に対応し、前記標本に対して透過照明を行う照明手段を備えることを特徴とする請求項27〜31のいずれか一つに記載の測定装置。
【請求項36】
前記透過照明は、明視野観察用照明、暗視野観察用照明、微分干渉観察用照明および位相差観察用照明の少なくとも1つであることを特徴とする請求項35に記載の測定装置。
【請求項37】
前記微弱光結像光学系は、該微弱光結像光学系の標本側の開口数をNAoとし、前記微弱光標本像を結像する倍率をβとして、(NAo/β)2によって演算される値が0.01以上であることを特徴とする請求項17および請求項19〜35のいずれか一つに記載の測定装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図17】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図17】


【図18】


【図19】


【公開番号】特開2012−165757(P2012−165757A)
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2012−110845(P2012−110845)
【出願日】平成24年5月14日(2012.5.14)
【分割の表示】特願2007−512900(P2007−512900)の分割
【原出願日】平成18年3月30日(2006.3.30)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成24年5月14日(2012.5.14)
【分割の表示】特願2007−512900(P2007−512900)の分割
【原出願日】平成18年3月30日(2006.3.30)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

