扁平上皮癌組織の放射線感受性マーカー
【課題】新規の信頼性の高い扁平上皮癌細胞の放射線感受性のマーカーを提供すること、即ち、扁平上皮癌組織の放射線感受性を検査するための方法、並びに、当該方法を実施するために用いられる試薬及びキットを提供することを課題とする。
【解決手段】本発明者らは、網羅的解析により、扁平上皮癌細胞の放射線感受性を高めるマーカーとして新たにBAG1 (BAG-1) を同定した。本件発明の検査方法、試薬、又はキットを使用することにより、個々の患者が放射線化学療法を選択すべきか否かの判断が容易になり、患者のQOLの向上を図ることができる。
【解決手段】本発明者らは、網羅的解析により、扁平上皮癌細胞の放射線感受性を高めるマーカーとして新たにBAG1 (BAG-1) を同定した。本件発明の検査方法、試薬、又はキットを使用することにより、個々の患者が放射線化学療法を選択すべきか否かの判断が容易になり、患者のQOLの向上を図ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本願発明は扁平上皮癌組織の放射線感受性を検査するための方法、並びに、当該方法を実施するために用いられる試薬及びキットに関する。
【背景技術】
【0002】
癌の放射線療法の近年の進歩により、患者は第一に選択すべき処置として、根治的な放射線化学療法を選択できるようなった。しかし、癌がある程度の放射線感受性 (放射線照射により癌細胞が死ぬこと) を示すことは間違いないが、個々の腫瘍の感受性には大きなばらつきがある。即ち、放射線療法は一部の患者には効果的であるが、他の患者には効果が無いか又は有害作用を及ぼす。後者の患者にとっては、放射線治療は貴重な時間の浪費であり、また、治療効果のある外科的処置を受ける機会を失わせるものであったかもしれない。従って、信頼性の高い癌細胞の放射線感受性のマーカーの同定が強く望まれてきた。
【0003】
今日までに、変異型p53を発現するヒト乳癌培養細胞株 (T47D) にインスリン様増殖因子結合タンパク質3 (IGFBP-3) のcDNAをトランスフェクションすると、当該細胞株の放射線感受性が増加することが報告されている (非特許文献1) 。
【0004】
特許文献1においては、脳癌患者の放射線感受性 (放射線療法で効果があること:患者の処置後の生存率などから判断する。厳密には、癌細胞の放射線感受性とは全く異なる概念であるが、文脈上明らかなので、以後特に区別しない場合がある。) のマーカーとして、60種の細胞株の網羅的解析で相関が検出された他の190個のマーカーと共にIGFBP3が列挙されている (Table 12, Figure 9) 。しかし、IGFBP3が単独で癌患者の放射線感受性マーカー又は癌細胞の放射線感受性マーカーとして利用できるか否かの検証はされていない。
【0005】
特許文献2においては、神経膠芽腫患者の化学療法又は放射線療法後の予後不良のマーカーとして、網羅的解析で相関が検出された他の38個のマーカーと共にIGFBP3が列挙されている (Table 4) 。この知見は非特許文献1、特許文献1、及び本発明者らの結果と矛盾するように思われるが、その原因は明らかでない。
【0006】
また、ヒト食道扁平上皮癌由来細胞株 (TE-5及びTE-9) にREG-Iα及びREG-Iβをトランスフェクションにより発現させると、化学療法感受性及び放射線感受性が増加することが報告されている (非特許文献2) 。
【0007】
BAG1 (BCL2-associated athanogene) 遺伝子は、BCL-2タンパク質に相互作用する抗アポトーシスタンパク質をコードする遺伝子として同定された (Cell. 1995 Jan 27; 80(2): 279-84.) 。BAG1タンパク質の発現とある種の癌患者の放射線感受性又はある種の癌細胞の放射線感受性の関係について、これまでに幾つかの報告が発表されている。
【0008】
非特許文献3では、乳腺腫瘍摘出術を受けた後さらに放射線療法を受けた初期の乳癌女性患者のうち、腫瘍生検のBAG1発現が上方制御されている患者では無遠隔転移生存率及び全生存率が高まることが報告されている。しかし、122人の乳癌患者の全てが放射線療法を受ける前に乳腺腫瘍摘出術を受けているので、観察された無遠隔転移生存率及び全生存率の上昇が癌細胞の放射線感受性の増加によるものであるかは明らかではなかった。
【0009】
その後の研究により (非特許文献4) 、BAG-1の過剰発現により放射線照射によるMCF7乳癌細胞のアポトーシスが抑制されることが示された。非特許文献5及び非特許文献6は、BAG-1タンパク質の核内発現により、放射線照射による結腸直腸腺腫由来S/RG/C2株化細胞のアポトーシスが抑制されることを示した。これらの結果は、少なくとも乳癌や結腸直腸癌などの腺癌においては、BAG-1発現は癌細胞の放射線感受性を低下させることを強く示しており、非特許文献3で観察された無遠隔転移生存率及び全生存率の上昇は癌細胞の放射線感受性の増加によるものではないと結論付けることができる。
【0010】
ヒトパピローマウイルスの感染によりp53が抑制されており、かつ、放射線抵抗性を示すヒトケラチノサイト細胞株HK18-IRにおいては、NFκBと共にBAG-1遺伝子が活性化されていることが示された (非特許文献7) 。ここで、HK18-IR細胞株はHK18細胞株から放射線抵抗性を指標にして選択されたものである。HK18株化細胞は、ヌードマウスの皮下に注射すると扁平上皮癌を生じることが報告されている (Virology. 1993 Oct; 196(2): 855-60.) 。
【0011】
非特許文献7の結果は一見すると本発明者らの結果と矛盾するようにも思われるが、HK18-IR細胞株はHK18株化細胞に電離放射線を照射することにより樹立されていることに注意すべきである。電離放射線はNFκBの発現を誘導することが知られており (J Clin Invest. 1991 Aug; 88(2): 691-5.) 、NFκBがIAP、Bcl-XL、Bcl-2などの抗アポトーシスタンパク質をコードする遺伝子の発現を誘導することも広く知られている (http://www.genome.jp/kegg-bin/show_pathway?hsa04210) 。実際、HK18-IR株化細胞におけるBAG-1遺伝子の活性化は、HK18株化細胞と比較して活性化されているということであり (Table 3) 、これは放射線照射それ自体により誘導された可能性が高い。
【0012】
また、HK18-IR (及びHK18) 株化細胞はヒトパピローマウイルスの感染によりp53が抑制されていることに注意すべきである。電離放射線によって形成される染色体DNAの二重鎖切断が、野生型p53を活性化させ、標的遺伝子の発現等を介してアポトーシスを引き起こすことは広く知られている (The Biology of Cancer, Robert A. Weinberg, June 2006, Garland Science, pp.307-356) 。また、ヒト癌組織におけるp53の状態は、「不活性化されている」、「変異されている」、又は、「野生型である」のいずれでもあり得て、更に、同一癌組織の中でも不均一な可能性がある。従って、放射線誘導アポトーシスのマスター遺伝子p53が抑制された細胞株における放射線感受性についての実験結果は、臨床応用のための限定的な示唆を与えるにとどまる。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】国際公開WO 2008/138578 A2号公報
【特許文献2】国際公開WO 2008/109423 A1号公報
【非特許文献】
【0014】
【非特許文献1】Butt AJ, Firth SM, King MA, Baxter RC. Insulin-like growth factor-binding protein-3 modulates expression of Bax and Bcl-2 and potentiates p53-independent radiation-induced apoptosis in human breast cancer cells. J Biol Chem. 2000 Dec 15;275(50):39174-81.
【非特許文献2】Hayashi K, Motoyama S, Koyota S, Koizumi Y, Wang J, Takasawa S, Itaya-Hironaka A, Sakuramoto-Tsuchida S, Maruyama K, Saito H, Minamiya Y, Ogawa J, Sugiyama T. REG I enhances chemo- and radiosensitivity in squamous cell esophageal cancer cells. Cancer Sci. 2008 Dec;99(12):2491-5.
【非特許文献3】Turner BC, Krajewski S, Krajewska M, Takayama S, Gumbs AA, Carter D, Rebbeck TR, Haffty BG, Reed JC. BAG-1: a novel biomarker predicting long-term survival in early-stage breast cancer. J Clin Oncol. 2001 Feb 15;19(4):992-1000.
【非特許文献4】Townsend PA, Cutress RI, Sharp A, Brimmell M, Packham G. BAG-1 prevents stress-induced long-term growth inhibition in breast cancer cells via a chaperone-dependent pathway. Cancer Res. 2003 Jul 15;63(14):4150-7.
【非特許文献5】Barnes JD, Arhel NJ, Lee SS, Sharp A, Al-Okail M, Packham G, Hague A, Paraskeva C, Williams AC. Nuclear BAG-1 expression inhibits apoptosis in colorectal adenoma-derived epithelial cells. Apoptosis. 2005 Mar;10(2):301-11.
【非特許文献6】Clemo NK, Arhel NJ, Barnes JD, Baker J, Moorghen M, Packham GK, Paraskeva C, Williams AC. The role of the retinoblastoma protein (Rb) in the nuclear localization of BAG-1: implications for colorectal tumour cell survival. Biochem Soc Trans. 2005 Aug;33(Pt 4):676-8.
【非特許文献7】Chen X, Shen B, Xia L, Khaletzkiy A, Chu D, Wong JY, Li JJ. Activation of nuclear factor kappaB in radioresistance of TP53-inactive human keratinocytes. Cancer Res. 2002 Feb 15;62(4):1213-21.
【発明の概要】
【発明が解決しようとする課題】
【0015】
一般的に、扁平上皮癌は他の癌と比較して放射線感受性が高く、第一に選択すべき処置として、放射線化学療法が選択されることが多い。しかし、同じ扁平上皮癌の患者であっても、患者ごとに腫瘍の放射線感受性には大きなばらつきがあり、治療方針の決定を助ける信頼性の高い扁平上皮癌細胞の放射線感受性のマーカーの同定が強く望まれてきた。即ち、本件発明が解決しようとする課題は、新規の信頼性の高い扁平上皮癌細胞の放射線感受性のマーカーを提供することである。
【課題を解決するための手段】
【0016】
本発明者らは、網羅的解析により、扁平上皮癌細胞の放射線感受性を高めるマーカーとして新たにBAG1 (BAG-1) を同定した。驚くべきことに、この結果は、腺癌についての非特許文献4、非特許文献5、及び非特許文献6の結果と全く逆である。一般的に、腺癌の放射線感受性は扁平上皮癌よりも低いことが知られており (放射線治療科学概論 改訂, 渡部 洋一 他, 医療科学社 2008, pp.3-4 / Aging and the Gastrointestinal Tract (Interdisciplinary Topics in Gerontology), A. Pilotto et al., S Karger Publishers 2003, p.89-91) 、BAG1発現の放射線感受性への影響も両者で異なることが分かった。
【0017】
本発明は、以下の検査方法、試薬、及びキットを提供する。
[1]
以下の工程を含む、被験者の扁平上皮癌組織の放射線感受性を検査するための方法:
当該被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量Ecancerを測定する工程;及び、当該発現量Ecancerを被験者の扁平上皮癌組織の放射線感受性と関連付ける工程;
ここで、当該発現量Ecancerが基準Sと比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していると判断される。
[2]
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのプライマー。
[3]
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのハイブリダイゼーションプローブ。
[4]
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する抗体を含有する、扁平上皮癌組織の放射線感受性を検査するための試薬。
[5]
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
[6]
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
[7]
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する1又は複数の抗体、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【0018】
配列番号:1に記載された核酸配列は、GenBankにgi|288915524|ref| NM_004323.5| Homo sapiens BCL2-associated athanogene (BAG1), transcript variant 1, mRNA として登録されている配列と同一である。また、配列番号:2に記載されたアミノ酸配列は、GenBankに gi|288915525|ref|NP_004314.5| BAG family molecular chaperone regulator 1 isoform BAG-1L [Homo sapiens] として登録されている配列と同一である。
【発明の効果】
【0019】
本件発明の検査方法、試薬、又はキットを使用することにより、個々の患者が放射線化学療法を選択すべきか否かの判断が容易になり、患者のQOLの向上を図ることができる。
【図面の簡単な説明】
【0020】
【図1A】TE-5、TE-9及びTE-12 cloneA1 細胞の増殖をWST-8の切断を指標として評価した結果を示す (n=5)。横軸は培養日数。縦軸は450nmにおける吸光度。
【図1B】細胞生存率をMTSアッセイを使用して評価した結果を示す(n=5)。横軸は放射線量 (Gy) 。縦軸は各細胞について放射線照射なし (0Gy) の場合を1とする相対的な細胞生存率。星印は有意な差を表す (P < 0.01) 。
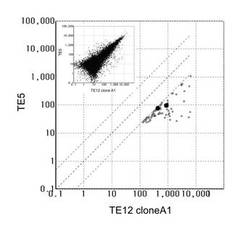
【図2】TE-12 cloneA1 及びTE-5 細胞においてDNAマイクロアレイで検出された54,359個の遺伝子を示す (左上隅の挿入図) 。横軸はTE-12 cloneA1 細胞の発現レベル。縦軸はTE-5 細胞の発現レベル。TE-12 cloneA1 細胞において、TE-5 細胞と比較して5倍以上発現していた71個の遺伝子を小さい白丸で示す。IGFBP3 及びBAG1を大きな黒丸で示す。
【図3A】TE-5、TE-9又はTE-12 cloneA1細胞におけるIGFBP3 mRNAの発現レベルを棒グラフで示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した (β-actinのmRNAの発現量を1として表した) 。星印は有意な差を表す (P < 0.01) 。
【図3B】TE-5、TE-9又はTE-12 cloneA1細胞におけるBAG1 mRNAの発現レベルを棒グラフで示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。星印は有意な差を表す (P < 0.01) 。
【図3C】TE-5、TE-9又はTE-12 cloneA1細胞における、IGFBP3及びBAG1のタンパク質の発現レベルをウェスタン解析で調べた結果を示す。
【図4A】IGFBP3 siRNAをトランスフェクトしたTE-12 cloneA1 細胞における、IGFBP3 mRNAの発現レベルを示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。星印は有意な差を表す (P < 0.01) 。
【図4B】BAG1 siRNAをトランスフェクトしたTE-12 cloneA1 細胞における、BAG1 mRNAの発現レベルを示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。星印は有意な差を表す (P < 0.01) 。
【図4C】IGFBP3 siRNA 又はBAG1 siRNA でトランスフェクトしたTE-12 cloneA1 細胞に放射線を照射し(5Gy及び10Gy)、細胞生存率を調べた結果を示す。横軸は放射線量 (Gy) 。縦軸は各サンプルについて放射線照射なし (0Gy) の場合を1とする相対的な細胞生存率。星印は有意な差を表す (P < 0.01) 。
【発明を実施するための形態】
【0021】
被験者:本願明細書で「被験者」というときは、哺乳類、特にヒトを意味する。
【0022】
扁平上皮癌:「扁平上皮癌」という用語は、腺癌及び非上皮性癌に対する概念として用いる。本願発明の方法、試薬、及びキットは、口腔、咽頭、喉頭、肺及び食道の扁平上皮癌に好適に用いることができ、特に食道扁平上皮癌に好適に用いることができる。
【0023】
組織:本願明細書で「組織」というときは、癌細胞を含む組織を意味する。ただし、本願発明に関して「組織」というときは、乳癌、脳癌、神経膠芽腫、結腸直腸癌、及びヒトパピローマウイルスの感染によりp53が抑制されている癌由来の癌細胞を含む組織は意味しない。
【0024】
放射線感受性:本願明細書 (背景技術の欄を除く) で「放射線感受性」が高い又は増加しているというときは、同一線量の放射線照射によって、より大きい割合の癌細胞が死ぬことを意味する。反対に、「放射線感受性」が低い又は減少しているというときは、同一線量の放射線照射によって、より小さい割合の癌細胞が死ぬことを意味する。なお、「ある遺伝子を発現している癌細胞が放射線治療で死にやすいこと」は、「当該遺伝子を癌組織で発現している患者で放射線治療が効果があること又は放射線治療後の予後が良いこと」に貢献するが、「ある遺伝子を癌組織で発現している患者で放射線治療が効果がある又は放射線治療後の予後が良い」からといって、「当該遺伝子を発現している癌細胞が放射線治療で死にやすい」とは限らない。ある遺伝子を癌組織で発現していることそれ自体が良好な予後に貢献している可能性もあるからである (例えば、転移しにくいなど) 。
【0025】
生体試料:本願明細書で「生体試料」というときは、生きている被験者から隔離されたインビトロ (生体外) の試料を意味する。
【0026】
発現量:本願明細書で「発現量」というときは、着目する遺伝子の発現量を意味し、具体的には、当該遺伝子からのmRNA又はタンパク質の発現量を意味する。発現量の絶対値、即ちmRNA又はタンパク質の分子数、を測定することは通常困難であるので、本願明細書で「発現量」というときは発現量の相対値を意味する。「発現レベル」という用語は「発現量」と同義で用いる。
【0027】
測定:本願明細書で「測定」というときは、定量的な測定のみならず定性的な検出も含む。mRNAの発現量を測定するための手段としては、ノーザンブロット法、RT-PCR法、マイクロアレイ法、などを好適に用いることができる。タンパク質の発現量を測定するための手段としては、ウェスタンブロット法、免疫組織化学染色法、などを好適に用いることができる。
【0028】
基準:本願明細書で発現量に関して「基準」というときは、発現量を表す換算又は計算された数値、あるいは、発現量を示す色素の濃度、蛍光の強度などを意味する。
mRNAの発現量の基準としては、BAG1 mRNAの発現量を測定した生体試料のハウスキーピング遺伝子 (β-actinやグリセルアルデヒド3リン酸脱水素酵素など) のmRNAの発現量の値と適当な数値との積を好適に用いることができる。例えば、BAG1 mRNAの発現量がβ-actin mRNAの発現量と比較して、0.0020倍、0.0025倍、好ましくは、0.0030倍、0.0035倍、0.0040倍、0.0045倍、更に好ましくは、0.0050倍、0.0055倍、0.0060倍、0.0065倍、0.0070倍、0.0075倍、最も好ましくは、0.0080倍、0.0085倍、0.0090倍、0.0095倍、又は、0.0100倍、よりも多い場合に「BAG1遺伝子 (mRNA) の発現量が基準と比較して増加している」ということができる。
タンパク質の発現量の基準としては、例えば、BAG1抗体を用いて免疫組織化学染色法を行った生体試料における、BAG1タンパク質を発現する細胞の割合を好適に用いることができる。例えば、測定領域の、5%、10%、15%、好ましくは、20%、25%、30%、35%、更に好ましくは、40%、45%、50%、55%、最も好ましくは、60%、65%、70%、75%、80%、85%、90%、又は95%、よりも多く、あるいは、100%の細胞がBAG1タンパク質を発現している場合に「BAG1遺伝子 (タンパク質) の発現量が基準と比較して増加している」ということができる。
【0029】
ポリヌクレオチド:本願発明を実施するために用いられるポリヌクレオチドは、例えば、着目するmRNAの配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含むポリヌクレオチドである。本願明細書では「ポリヌクレオチド」と「オリゴヌクレオチド」は同義で用いる。連続するヌクレオチドの数としては、例えば、少なくとも、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、又は50個、が好ましい。
また、本願発明を実施するためには、例えば、着目するmRNAの配列又はその相補配列と80%以上の同一性を有するヌクレオチド配列を含むポリヌクレオチドを利用することができる。同一性のレベルとしては、例えば、少なくとも、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、あるいは100%、が好ましい。
RT-PCRに用いる場合には、ポリヌクレオチドの長さは、50ヌクレオチド、45ヌクレオチド、40ヌクレオチド、35ヌクレオチド、30ヌクレオチド、又は25ヌクレオチド、以下が好ましい。一般的に言って、ポリヌクレオチドをPCRプライマーとして用いる場合には、プライマーの5’末端側の変異は鋳型DNAへのハイブリダイゼーションに影響しにくい。従って、例えば、プライマーの3’末端側の15個の連続するヌクレオチド配列が鋳型DNAの標的配列と完全に相補的であれば、プライマーの5’末端側の配列は比較的自由に変更することができる。プライマーの5’末端側に各種酵素の認識配列や分子内ヘアピン構造を形成させる配列を導入することは、当業者が日常的に行っていることである。
ハイブリダイゼーションプローブとして用いる場合には、ポリヌクレオチドの長さは、少なくとも、20ヌクレオチド、30ヌクレオチド、50ヌクレオチド、70ヌクレオチド、100ヌクレオチド、150ヌクレオチド、200ヌクレオチド、350ヌクレオチド、500ヌクレオチド、750ヌクレオチド、又は1000ヌクレオチド、が好ましい。一般的に言って、ポリヌクレオチドをハイブリダイゼーションプローブとして用いる場合には、プローブの何れの領域においても変異を導入することができる。好ましい同一性のレベルは上に述べた通りである。
【0030】
抗体:本願発明を実施するために用いられる抗体としては、ポリクローナル抗体、モノクローナル抗体のいずれも好適に用いることができるが、モノクローナル抗体が特に好ましい。
【0031】
試薬:本願発明の「抗体を含有する試薬」は、抗体そのものでも良いが、Fab断片やF(ab')2断片などの当業者に良く知られた断片でも良い。また、抗体はペルオキシダーゼ、アルカリホスファターゼ、ビオチン、金属コロイド、FITCなどの当業者に良く知られたラベルと結合していてもよい。また、「抗体を含有する試薬」が適当な塩、緩衝剤、保存料、界面活性剤、還元剤、凍結保護物質などを含有しても良いことは言うまでもない。
【実施例】
【0032】
[実験材料及び実験方法]
株化細胞及び培養
我々は、食道扁平上皮癌の株化細胞であるTE-5、-9及び-12細胞株を、東北大学加齢医学研究所及び理化学研究所バイオリソースセンター細胞バンクから2006年に入手した。TE-12株化細胞は近年汚染が報告されているので (東北大学加齢医学研究所医用細胞資源センター) 、我々は4つのクローナルなTE-12株化細胞を樹立し、それぞれ、TE-12クローンA1からA4 (TE-12 cloneA1-4) と名づけた。本研究のために、我々はTE-5、TE-9及びTE-12 cloneA1細胞を用いた。これらの細胞は、10%の熱失活ウシ胎仔血清及び抗生物質(ペニシリンG/ストレプトマイシン/アンホテリシンB; GIBCO社)を追加したRPMI-1640培地(シグマ-アルドリッチ社、セントルイス、ミズーリ州、米国)中で培養し、5%CO2/95%大気雰囲気下、37℃の加湿恒温器内で維持した。
【0033】
細胞増殖アッセイ
細胞増殖はCell Counting Kit-8 ((株) 同仁化学研究所、熊本、日本) を用いて評価した。細胞は96穴プレートに1×103細胞/ウェルの密度で蒔き、0、1、2、3又は4日間保温した。適切な時期に10μlのCell Counting Kit-8試薬を細胞に加えた。細胞は、その後1時間保温し、更にその後、プレートの450nmでの光学密度をModel 550 Microplate Reader (Bio-Rad Laboratories社、Herucoles、カリフォルニア州、米国) を用いて読み取った。
【0034】
放射線療法に関する細胞生存率
細胞は96穴プレートに1×103細胞/ウェルの密度で蒔き、24時間37℃で保温した。細胞はその後、SOFTEX M-100WE (ソフテックス株式会社、東京、日本) を用いて0, 5又は10Gyで照射された。照射条件は、100kV、5mAであり、これは2.695Gy/分の線量に相当する。更に72時間培養した後、細胞生存率を比色MTSアッセイで評価した (CellTiter 96 AQueous One Solution Cell Proliferation Assay、Promega社、Madison、ウィスコンシン州、米国) 。手短に述べると、20μlのMTSを培養液に加え、37℃で4時間保温した。その後、490 nmにおける光学密度をマイクロプレート読み取り装置を用いて測定することにより、細胞生存率を決定した。
【0035】
マイクロアレイ解析
TE-12 cloneA1及びTE5細胞は、CodeLinkTM Human Whole Genome Bioarray (Applied Microarrays、Inc.社、Tempe、アリゾナ州、米国) を用いて解析した。マイクロアレイ解析はフィルジェン株式会社 (名古屋市、日本) に委託した。手短に述べると、それぞれのバイオアレイについて、10μgのcRNA (総容積25μl中) に5μlの5×断片化バッファーを加え、94℃で20分間保温した。その後、当該10μgの断片化されたcRNAに、78μlのハイブリダイゼーション・バッファー・コンポーネントA及び130μlのハイブリダイゼーション・バッファー・コンポーネントBを加え、最終容積を水で260μlに合わせた。このようにして得られたハイブリダイゼーション反応混合液を90℃で5分間保温した。その後、250μlをゆっくりとそれぞれのアレイのインプット・ポートに注入し、ポートをシーリング・ストリップで封着した。バイオアレイは、その後、300 rpmで振盪しながら37℃で18時間保温した。比較実験のためにハイブリダイゼーションの時間を一定に保った。保温に引き続いて、バイオアレイは0.75×TNTバッファー (0.10M Tris-HCl、pH 7.6、0.15M NaCl、0.05% Tween 20) で洗浄した。この洗浄は、46℃で正確に1時間保温することにより行った。スモール・リエージント・リザーバーのそれぞれのスロットに3.4mlのCy5-ストレプトアビジン・ワーキング・ソリューションを満たし、アレイを25℃でもう30分間保温した。その後、25℃の1×TNTバッファーを用いてバイオアレイを5分間ずつ4回洗浄し、さらに、0.1×SSC (Ambion社、Austin、テキサス州、米国) / 0.05% Tween 20で30秒間ずつ2回リンスし、25℃で3分間の遠心分離により直ちに乾燥させた。最後に、アレイはGenePix4000B Array Scanner (Molecular Devices社、Sunnyvale、カリフォルニア州、米国) を用いてスキャンし、MicroArray Data Analysis Tool Ver3.2 (フィルジェン株式会社)を用いてデータを解析した。
【0036】
リアルタイム逆転写酵素-ポリメラーゼ連鎖反応法
それぞれの細胞型から、TRIzol試薬 (Invitrogen社、Grand Island、ニューヨーク州、米国)及びPure-Link RNA Mini Kit (Invitrogen社) を用いて、製造者の説明書に従って全RNAを単離した。単離したRNAを分光光度計を用いて定量した後、2μg 分割量のRNAからTranscriptor First Strand cDNA Synthesis Kit (Roche Diagnostics社、Mannhein、ドイツ国) を用いて逆転写した。インスリン様増殖因子結合タンパク質3 (insulin-like growth factor binding protein 3; IGFBP3) 及びBcl-2-associated athanogene 1 (BAG1) を増幅するためのプライマー配列は表1に示した。リアルタイム逆転写酵素-ポリメラーゼ連鎖反応法 (RT-PCR法) は、LightCycler 480 Kit (Roche Diagnostics社) を用いてLightCycler 480 (Roche Diagnostics社) 上で行った。増幅プロトコールは、95℃で5分間インキュベーションした後、95℃で10秒間、60℃で30秒間、及び、50℃で30秒間を45サイクル繰り返すものであった。IGFBP3及びBAG1のmRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。
【0037】
【表1】

【0038】
免疫ブロット解析
細胞は、10cm皿で24時間培養した後、無血清RPMI-1640培養液を加え、更に48時間培養した。その後、上清を回収し、タンパク質の濃度を測定した。20μgのタンパク質を含む試料をドデシル硫酸ナトリウム・ポリアクリルアミドゲル電気泳動 (sodium dodecylsulfate-polyacrylamide gel electrophoresis; SDS-PAGE) にかけて、分離されたタンパク質をニトロセルロース膜 (Trans-Blot Transfer Medium, Bio-Rad Laboratories社) にトランスファーした。その後、これを5%脱脂乳及び0.1% Tween 20を含むリン酸緩衝食塩水 (PBS) でブロックした。ブロッキングの後、上記膜を初めに抗ヒトIGFBP3抗体 (anti-human IGFBP3 antibody; Santa Cruz Biotechnology社、Santa Cruz, カリフォルニア州、米国、1:200希釈) 又はBAG1抗体 (BAG1 antibody; Santa Cruz Biotechnology社、1:1000希釈) と共に一晩 4℃で保温し、それから、ペルオキシダーゼ抱合型二次抗マウスIgG (peroxidase-conjugated secondary anti-mouse IgG; Dako社、Glostrup、デンマーク、Tween20-PBS中で 1:1000希釈) と共に1時間保温した。免疫検出はECL Plusウエスタンブロット検出試薬及び解析システム (ECL Plus Western blotting detection reagents and analysis system; GE Healthcare社、 Waukesha、ウィスコンシン州、米国)を用いて行った。最後に、膜をX線フィルムに露光した。
【0039】
低分子干渉RNA (small interfering RNA, siRNA) を用いたIGFBP3及びBAG1のノックダウン
Silencer (登録商標) Select Pre-designed siRNA (Ambion社) は、製造者の説明書に従ってLipofectamine 2000 (Invitrogen社) を用いてTE-5、TE-9及びTE-12 cloneA1細胞に導入した。IGFBP3及び/又はBAG1を標的とする12.5 pmolのsiRNA (Silencer Select Pre-designed siRNA; Ambion社) 又はネガティブコントロールのsiRNA (silencer Negative Control #1 siRNA; Ambion社) を5μlのリポフェクタミン2000と共に、500μlのOpti-MEM I medium (Invitrogen社) に混ぜた。本研究で使用したsiRNAの配列は表2に示す。結果として生じた混合液を2mLの培養液に加え、6穴培養プレートのウェルに蒔かれた細胞に接触させた。24時間保温した後、培養液を新鮮な培養液と交換した。更に24時間経った後、細胞の一部を回収し、MTSアッセイのために1×104 細胞/ウェルの密度で96穴プレートに蒔いた。あるいは、細胞は48時間保温した後、全RNAを単離した。全RNAは、IGFBP3及びBAG1のmRNA発現をRT-PCR法で解析するために用いた。
【0040】
【表2】

【0041】
統計解析
二群の有意差はスチューデントのt検定を用いて評価した。全ての解析はJMP8 (SAS社、Cary、ノースカロライナ州、米国) を用いて行い、両側性のP値を生成した。0.01より小さいP値 (P < 0.01) の場合に、有意と判断した。
【0042】
[結果]
TE株化細胞の放射線感受性
WST-8の切断の水準で示される細胞増殖は、調査した全ての時点において (0、1、2、3及び4日目) 、TE-5、TE-9及びTE-12 cloneA1細胞間で違いが無かった(図1A) 。一方で、5及び10 Gyの放射線を照射した細胞の生存率を測定することにより、TE-5又はTE-9細胞と比較して、TE-12 cloneA1細胞は有意に放射線感受性が高いことが示された (図1B) 。
【0043】
DNAマイクロアレイ解析
TE-12 cloneA1及びTE-5細胞の54,359個の遺伝子の発現レベルについてDNAマイクロアレイ解析を行い、図2の左上隅の挿入図に示した。我々は、71個の遺伝子の発現レベルがTE-12 cloneA1細胞においてはTE-5細胞よりも5倍以上高いことを見出した (図2の小さい白丸及び大きい黒丸) 。これらを表3−1から3−4に示す。これらの71個の遺伝子のうち、我々はIGFBP3及びBAG1 (図2の大きい黒丸) が実際に癌細胞の放射線感受性に関与することを証明した。結果を以下に示す。マイクロアレイのデータはRT-PCR法及びウェスタン解析で確認した。それによると、IGFBP3及びBAG1のmRNA及びタンパク質の発現レベルは、いずれも、TE-5又はTE-9株化細胞の場合と比較して、TE-12 cloneA1株化細胞では有意に高かった (図3A、3B、3C) 。
【0044】
【表3−1】

【0045】
【表3−2】

【0046】
【表3−3】

【0047】
【表3−4】

【0048】
IGFBP3及び/又はBAG1のノックダウンにより誘発される放射線感受性の変化
次に、我々は、TE-12 cloneA1細胞におけるIGFBP3及び/又はBAG1のノックダウンの影響を調べた。IGFBP3又はBAG1を標的とするsiRNAを細胞にトランスフェクトすることによって、それぞれのmRNAの発現量が減少した (図4A及び4B) 。IGFBP3については、ノックダウンの効率の平均値は75% (IGFBP3 siRNA-1) 及び59% (IGFBP3 siRNA-2) であった (表2及び図4A参照) 。BAG1については、ノックダウンの効率の平均値は73% (BAG1 siRNA-1) 及び78% (BAG1 siRNA-2) であった(表2及び図4B参照)。放射線照射(5Gy及び10Gy) 後72時間の時点での細胞生存率を調べることにより、IGFBP3又はBAG1をノックダウンした細胞は、ネガティブコントロールの細胞と比較して、有意に放射線感受性が低いことが示された (図4C) 。これらの結果は、IGFBP3及び/又はBAG1をノックダウンすることによって、TE-12 cloneA1細胞の放射線感受性が減少することを示している。
【産業上の利用可能性】
【0049】
本件発明は、検査機関における扁平上皮癌組織の放射線感受性の検査、及び、扁平上皮癌組織の放射線感受性を検査するための試薬又はキットの製造に利用することができる。
【技術分野】
【0001】
本願発明は扁平上皮癌組織の放射線感受性を検査するための方法、並びに、当該方法を実施するために用いられる試薬及びキットに関する。
【背景技術】
【0002】
癌の放射線療法の近年の進歩により、患者は第一に選択すべき処置として、根治的な放射線化学療法を選択できるようなった。しかし、癌がある程度の放射線感受性 (放射線照射により癌細胞が死ぬこと) を示すことは間違いないが、個々の腫瘍の感受性には大きなばらつきがある。即ち、放射線療法は一部の患者には効果的であるが、他の患者には効果が無いか又は有害作用を及ぼす。後者の患者にとっては、放射線治療は貴重な時間の浪費であり、また、治療効果のある外科的処置を受ける機会を失わせるものであったかもしれない。従って、信頼性の高い癌細胞の放射線感受性のマーカーの同定が強く望まれてきた。
【0003】
今日までに、変異型p53を発現するヒト乳癌培養細胞株 (T47D) にインスリン様増殖因子結合タンパク質3 (IGFBP-3) のcDNAをトランスフェクションすると、当該細胞株の放射線感受性が増加することが報告されている (非特許文献1) 。
【0004】
特許文献1においては、脳癌患者の放射線感受性 (放射線療法で効果があること:患者の処置後の生存率などから判断する。厳密には、癌細胞の放射線感受性とは全く異なる概念であるが、文脈上明らかなので、以後特に区別しない場合がある。) のマーカーとして、60種の細胞株の網羅的解析で相関が検出された他の190個のマーカーと共にIGFBP3が列挙されている (Table 12, Figure 9) 。しかし、IGFBP3が単独で癌患者の放射線感受性マーカー又は癌細胞の放射線感受性マーカーとして利用できるか否かの検証はされていない。
【0005】
特許文献2においては、神経膠芽腫患者の化学療法又は放射線療法後の予後不良のマーカーとして、網羅的解析で相関が検出された他の38個のマーカーと共にIGFBP3が列挙されている (Table 4) 。この知見は非特許文献1、特許文献1、及び本発明者らの結果と矛盾するように思われるが、その原因は明らかでない。
【0006】
また、ヒト食道扁平上皮癌由来細胞株 (TE-5及びTE-9) にREG-Iα及びREG-Iβをトランスフェクションにより発現させると、化学療法感受性及び放射線感受性が増加することが報告されている (非特許文献2) 。
【0007】
BAG1 (BCL2-associated athanogene) 遺伝子は、BCL-2タンパク質に相互作用する抗アポトーシスタンパク質をコードする遺伝子として同定された (Cell. 1995 Jan 27; 80(2): 279-84.) 。BAG1タンパク質の発現とある種の癌患者の放射線感受性又はある種の癌細胞の放射線感受性の関係について、これまでに幾つかの報告が発表されている。
【0008】
非特許文献3では、乳腺腫瘍摘出術を受けた後さらに放射線療法を受けた初期の乳癌女性患者のうち、腫瘍生検のBAG1発現が上方制御されている患者では無遠隔転移生存率及び全生存率が高まることが報告されている。しかし、122人の乳癌患者の全てが放射線療法を受ける前に乳腺腫瘍摘出術を受けているので、観察された無遠隔転移生存率及び全生存率の上昇が癌細胞の放射線感受性の増加によるものであるかは明らかではなかった。
【0009】
その後の研究により (非特許文献4) 、BAG-1の過剰発現により放射線照射によるMCF7乳癌細胞のアポトーシスが抑制されることが示された。非特許文献5及び非特許文献6は、BAG-1タンパク質の核内発現により、放射線照射による結腸直腸腺腫由来S/RG/C2株化細胞のアポトーシスが抑制されることを示した。これらの結果は、少なくとも乳癌や結腸直腸癌などの腺癌においては、BAG-1発現は癌細胞の放射線感受性を低下させることを強く示しており、非特許文献3で観察された無遠隔転移生存率及び全生存率の上昇は癌細胞の放射線感受性の増加によるものではないと結論付けることができる。
【0010】
ヒトパピローマウイルスの感染によりp53が抑制されており、かつ、放射線抵抗性を示すヒトケラチノサイト細胞株HK18-IRにおいては、NFκBと共にBAG-1遺伝子が活性化されていることが示された (非特許文献7) 。ここで、HK18-IR細胞株はHK18細胞株から放射線抵抗性を指標にして選択されたものである。HK18株化細胞は、ヌードマウスの皮下に注射すると扁平上皮癌を生じることが報告されている (Virology. 1993 Oct; 196(2): 855-60.) 。
【0011】
非特許文献7の結果は一見すると本発明者らの結果と矛盾するようにも思われるが、HK18-IR細胞株はHK18株化細胞に電離放射線を照射することにより樹立されていることに注意すべきである。電離放射線はNFκBの発現を誘導することが知られており (J Clin Invest. 1991 Aug; 88(2): 691-5.) 、NFκBがIAP、Bcl-XL、Bcl-2などの抗アポトーシスタンパク質をコードする遺伝子の発現を誘導することも広く知られている (http://www.genome.jp/kegg-bin/show_pathway?hsa04210) 。実際、HK18-IR株化細胞におけるBAG-1遺伝子の活性化は、HK18株化細胞と比較して活性化されているということであり (Table 3) 、これは放射線照射それ自体により誘導された可能性が高い。
【0012】
また、HK18-IR (及びHK18) 株化細胞はヒトパピローマウイルスの感染によりp53が抑制されていることに注意すべきである。電離放射線によって形成される染色体DNAの二重鎖切断が、野生型p53を活性化させ、標的遺伝子の発現等を介してアポトーシスを引き起こすことは広く知られている (The Biology of Cancer, Robert A. Weinberg, June 2006, Garland Science, pp.307-356) 。また、ヒト癌組織におけるp53の状態は、「不活性化されている」、「変異されている」、又は、「野生型である」のいずれでもあり得て、更に、同一癌組織の中でも不均一な可能性がある。従って、放射線誘導アポトーシスのマスター遺伝子p53が抑制された細胞株における放射線感受性についての実験結果は、臨床応用のための限定的な示唆を与えるにとどまる。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】国際公開WO 2008/138578 A2号公報
【特許文献2】国際公開WO 2008/109423 A1号公報
【非特許文献】
【0014】
【非特許文献1】Butt AJ, Firth SM, King MA, Baxter RC. Insulin-like growth factor-binding protein-3 modulates expression of Bax and Bcl-2 and potentiates p53-independent radiation-induced apoptosis in human breast cancer cells. J Biol Chem. 2000 Dec 15;275(50):39174-81.
【非特許文献2】Hayashi K, Motoyama S, Koyota S, Koizumi Y, Wang J, Takasawa S, Itaya-Hironaka A, Sakuramoto-Tsuchida S, Maruyama K, Saito H, Minamiya Y, Ogawa J, Sugiyama T. REG I enhances chemo- and radiosensitivity in squamous cell esophageal cancer cells. Cancer Sci. 2008 Dec;99(12):2491-5.
【非特許文献3】Turner BC, Krajewski S, Krajewska M, Takayama S, Gumbs AA, Carter D, Rebbeck TR, Haffty BG, Reed JC. BAG-1: a novel biomarker predicting long-term survival in early-stage breast cancer. J Clin Oncol. 2001 Feb 15;19(4):992-1000.
【非特許文献4】Townsend PA, Cutress RI, Sharp A, Brimmell M, Packham G. BAG-1 prevents stress-induced long-term growth inhibition in breast cancer cells via a chaperone-dependent pathway. Cancer Res. 2003 Jul 15;63(14):4150-7.
【非特許文献5】Barnes JD, Arhel NJ, Lee SS, Sharp A, Al-Okail M, Packham G, Hague A, Paraskeva C, Williams AC. Nuclear BAG-1 expression inhibits apoptosis in colorectal adenoma-derived epithelial cells. Apoptosis. 2005 Mar;10(2):301-11.
【非特許文献6】Clemo NK, Arhel NJ, Barnes JD, Baker J, Moorghen M, Packham GK, Paraskeva C, Williams AC. The role of the retinoblastoma protein (Rb) in the nuclear localization of BAG-1: implications for colorectal tumour cell survival. Biochem Soc Trans. 2005 Aug;33(Pt 4):676-8.
【非特許文献7】Chen X, Shen B, Xia L, Khaletzkiy A, Chu D, Wong JY, Li JJ. Activation of nuclear factor kappaB in radioresistance of TP53-inactive human keratinocytes. Cancer Res. 2002 Feb 15;62(4):1213-21.
【発明の概要】
【発明が解決しようとする課題】
【0015】
一般的に、扁平上皮癌は他の癌と比較して放射線感受性が高く、第一に選択すべき処置として、放射線化学療法が選択されることが多い。しかし、同じ扁平上皮癌の患者であっても、患者ごとに腫瘍の放射線感受性には大きなばらつきがあり、治療方針の決定を助ける信頼性の高い扁平上皮癌細胞の放射線感受性のマーカーの同定が強く望まれてきた。即ち、本件発明が解決しようとする課題は、新規の信頼性の高い扁平上皮癌細胞の放射線感受性のマーカーを提供することである。
【課題を解決するための手段】
【0016】
本発明者らは、網羅的解析により、扁平上皮癌細胞の放射線感受性を高めるマーカーとして新たにBAG1 (BAG-1) を同定した。驚くべきことに、この結果は、腺癌についての非特許文献4、非特許文献5、及び非特許文献6の結果と全く逆である。一般的に、腺癌の放射線感受性は扁平上皮癌よりも低いことが知られており (放射線治療科学概論 改訂, 渡部 洋一 他, 医療科学社 2008, pp.3-4 / Aging and the Gastrointestinal Tract (Interdisciplinary Topics in Gerontology), A. Pilotto et al., S Karger Publishers 2003, p.89-91) 、BAG1発現の放射線感受性への影響も両者で異なることが分かった。
【0017】
本発明は、以下の検査方法、試薬、及びキットを提供する。
[1]
以下の工程を含む、被験者の扁平上皮癌組織の放射線感受性を検査するための方法:
当該被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量Ecancerを測定する工程;及び、当該発現量Ecancerを被験者の扁平上皮癌組織の放射線感受性と関連付ける工程;
ここで、当該発現量Ecancerが基準Sと比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していると判断される。
[2]
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのプライマー。
[3]
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのハイブリダイゼーションプローブ。
[4]
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する抗体を含有する、扁平上皮癌組織の放射線感受性を検査するための試薬。
[5]
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
[6]
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
[7]
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する1又は複数の抗体、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【0018】
配列番号:1に記載された核酸配列は、GenBankにgi|288915524|ref| NM_004323.5| Homo sapiens BCL2-associated athanogene (BAG1), transcript variant 1, mRNA として登録されている配列と同一である。また、配列番号:2に記載されたアミノ酸配列は、GenBankに gi|288915525|ref|NP_004314.5| BAG family molecular chaperone regulator 1 isoform BAG-1L [Homo sapiens] として登録されている配列と同一である。
【発明の効果】
【0019】
本件発明の検査方法、試薬、又はキットを使用することにより、個々の患者が放射線化学療法を選択すべきか否かの判断が容易になり、患者のQOLの向上を図ることができる。
【図面の簡単な説明】
【0020】
【図1A】TE-5、TE-9及びTE-12 cloneA1 細胞の増殖をWST-8の切断を指標として評価した結果を示す (n=5)。横軸は培養日数。縦軸は450nmにおける吸光度。
【図1B】細胞生存率をMTSアッセイを使用して評価した結果を示す(n=5)。横軸は放射線量 (Gy) 。縦軸は各細胞について放射線照射なし (0Gy) の場合を1とする相対的な細胞生存率。星印は有意な差を表す (P < 0.01) 。
【図2】TE-12 cloneA1 及びTE-5 細胞においてDNAマイクロアレイで検出された54,359個の遺伝子を示す (左上隅の挿入図) 。横軸はTE-12 cloneA1 細胞の発現レベル。縦軸はTE-5 細胞の発現レベル。TE-12 cloneA1 細胞において、TE-5 細胞と比較して5倍以上発現していた71個の遺伝子を小さい白丸で示す。IGFBP3 及びBAG1を大きな黒丸で示す。
【図3A】TE-5、TE-9又はTE-12 cloneA1細胞におけるIGFBP3 mRNAの発現レベルを棒グラフで示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した (β-actinのmRNAの発現量を1として表した) 。星印は有意な差を表す (P < 0.01) 。
【図3B】TE-5、TE-9又はTE-12 cloneA1細胞におけるBAG1 mRNAの発現レベルを棒グラフで示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。星印は有意な差を表す (P < 0.01) 。
【図3C】TE-5、TE-9又はTE-12 cloneA1細胞における、IGFBP3及びBAG1のタンパク質の発現レベルをウェスタン解析で調べた結果を示す。
【図4A】IGFBP3 siRNAをトランスフェクトしたTE-12 cloneA1 細胞における、IGFBP3 mRNAの発現レベルを示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。星印は有意な差を表す (P < 0.01) 。
【図4B】BAG1 siRNAをトランスフェクトしたTE-12 cloneA1 細胞における、BAG1 mRNAの発現レベルを示す (n=5)。mRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。星印は有意な差を表す (P < 0.01) 。
【図4C】IGFBP3 siRNA 又はBAG1 siRNA でトランスフェクトしたTE-12 cloneA1 細胞に放射線を照射し(5Gy及び10Gy)、細胞生存率を調べた結果を示す。横軸は放射線量 (Gy) 。縦軸は各サンプルについて放射線照射なし (0Gy) の場合を1とする相対的な細胞生存率。星印は有意な差を表す (P < 0.01) 。
【発明を実施するための形態】
【0021】
被験者:本願明細書で「被験者」というときは、哺乳類、特にヒトを意味する。
【0022】
扁平上皮癌:「扁平上皮癌」という用語は、腺癌及び非上皮性癌に対する概念として用いる。本願発明の方法、試薬、及びキットは、口腔、咽頭、喉頭、肺及び食道の扁平上皮癌に好適に用いることができ、特に食道扁平上皮癌に好適に用いることができる。
【0023】
組織:本願明細書で「組織」というときは、癌細胞を含む組織を意味する。ただし、本願発明に関して「組織」というときは、乳癌、脳癌、神経膠芽腫、結腸直腸癌、及びヒトパピローマウイルスの感染によりp53が抑制されている癌由来の癌細胞を含む組織は意味しない。
【0024】
放射線感受性:本願明細書 (背景技術の欄を除く) で「放射線感受性」が高い又は増加しているというときは、同一線量の放射線照射によって、より大きい割合の癌細胞が死ぬことを意味する。反対に、「放射線感受性」が低い又は減少しているというときは、同一線量の放射線照射によって、より小さい割合の癌細胞が死ぬことを意味する。なお、「ある遺伝子を発現している癌細胞が放射線治療で死にやすいこと」は、「当該遺伝子を癌組織で発現している患者で放射線治療が効果があること又は放射線治療後の予後が良いこと」に貢献するが、「ある遺伝子を癌組織で発現している患者で放射線治療が効果がある又は放射線治療後の予後が良い」からといって、「当該遺伝子を発現している癌細胞が放射線治療で死にやすい」とは限らない。ある遺伝子を癌組織で発現していることそれ自体が良好な予後に貢献している可能性もあるからである (例えば、転移しにくいなど) 。
【0025】
生体試料:本願明細書で「生体試料」というときは、生きている被験者から隔離されたインビトロ (生体外) の試料を意味する。
【0026】
発現量:本願明細書で「発現量」というときは、着目する遺伝子の発現量を意味し、具体的には、当該遺伝子からのmRNA又はタンパク質の発現量を意味する。発現量の絶対値、即ちmRNA又はタンパク質の分子数、を測定することは通常困難であるので、本願明細書で「発現量」というときは発現量の相対値を意味する。「発現レベル」という用語は「発現量」と同義で用いる。
【0027】
測定:本願明細書で「測定」というときは、定量的な測定のみならず定性的な検出も含む。mRNAの発現量を測定するための手段としては、ノーザンブロット法、RT-PCR法、マイクロアレイ法、などを好適に用いることができる。タンパク質の発現量を測定するための手段としては、ウェスタンブロット法、免疫組織化学染色法、などを好適に用いることができる。
【0028】
基準:本願明細書で発現量に関して「基準」というときは、発現量を表す換算又は計算された数値、あるいは、発現量を示す色素の濃度、蛍光の強度などを意味する。
mRNAの発現量の基準としては、BAG1 mRNAの発現量を測定した生体試料のハウスキーピング遺伝子 (β-actinやグリセルアルデヒド3リン酸脱水素酵素など) のmRNAの発現量の値と適当な数値との積を好適に用いることができる。例えば、BAG1 mRNAの発現量がβ-actin mRNAの発現量と比較して、0.0020倍、0.0025倍、好ましくは、0.0030倍、0.0035倍、0.0040倍、0.0045倍、更に好ましくは、0.0050倍、0.0055倍、0.0060倍、0.0065倍、0.0070倍、0.0075倍、最も好ましくは、0.0080倍、0.0085倍、0.0090倍、0.0095倍、又は、0.0100倍、よりも多い場合に「BAG1遺伝子 (mRNA) の発現量が基準と比較して増加している」ということができる。
タンパク質の発現量の基準としては、例えば、BAG1抗体を用いて免疫組織化学染色法を行った生体試料における、BAG1タンパク質を発現する細胞の割合を好適に用いることができる。例えば、測定領域の、5%、10%、15%、好ましくは、20%、25%、30%、35%、更に好ましくは、40%、45%、50%、55%、最も好ましくは、60%、65%、70%、75%、80%、85%、90%、又は95%、よりも多く、あるいは、100%の細胞がBAG1タンパク質を発現している場合に「BAG1遺伝子 (タンパク質) の発現量が基準と比較して増加している」ということができる。
【0029】
ポリヌクレオチド:本願発明を実施するために用いられるポリヌクレオチドは、例えば、着目するmRNAの配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含むポリヌクレオチドである。本願明細書では「ポリヌクレオチド」と「オリゴヌクレオチド」は同義で用いる。連続するヌクレオチドの数としては、例えば、少なくとも、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、又は50個、が好ましい。
また、本願発明を実施するためには、例えば、着目するmRNAの配列又はその相補配列と80%以上の同一性を有するヌクレオチド配列を含むポリヌクレオチドを利用することができる。同一性のレベルとしては、例えば、少なくとも、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、あるいは100%、が好ましい。
RT-PCRに用いる場合には、ポリヌクレオチドの長さは、50ヌクレオチド、45ヌクレオチド、40ヌクレオチド、35ヌクレオチド、30ヌクレオチド、又は25ヌクレオチド、以下が好ましい。一般的に言って、ポリヌクレオチドをPCRプライマーとして用いる場合には、プライマーの5’末端側の変異は鋳型DNAへのハイブリダイゼーションに影響しにくい。従って、例えば、プライマーの3’末端側の15個の連続するヌクレオチド配列が鋳型DNAの標的配列と完全に相補的であれば、プライマーの5’末端側の配列は比較的自由に変更することができる。プライマーの5’末端側に各種酵素の認識配列や分子内ヘアピン構造を形成させる配列を導入することは、当業者が日常的に行っていることである。
ハイブリダイゼーションプローブとして用いる場合には、ポリヌクレオチドの長さは、少なくとも、20ヌクレオチド、30ヌクレオチド、50ヌクレオチド、70ヌクレオチド、100ヌクレオチド、150ヌクレオチド、200ヌクレオチド、350ヌクレオチド、500ヌクレオチド、750ヌクレオチド、又は1000ヌクレオチド、が好ましい。一般的に言って、ポリヌクレオチドをハイブリダイゼーションプローブとして用いる場合には、プローブの何れの領域においても変異を導入することができる。好ましい同一性のレベルは上に述べた通りである。
【0030】
抗体:本願発明を実施するために用いられる抗体としては、ポリクローナル抗体、モノクローナル抗体のいずれも好適に用いることができるが、モノクローナル抗体が特に好ましい。
【0031】
試薬:本願発明の「抗体を含有する試薬」は、抗体そのものでも良いが、Fab断片やF(ab')2断片などの当業者に良く知られた断片でも良い。また、抗体はペルオキシダーゼ、アルカリホスファターゼ、ビオチン、金属コロイド、FITCなどの当業者に良く知られたラベルと結合していてもよい。また、「抗体を含有する試薬」が適当な塩、緩衝剤、保存料、界面活性剤、還元剤、凍結保護物質などを含有しても良いことは言うまでもない。
【実施例】
【0032】
[実験材料及び実験方法]
株化細胞及び培養
我々は、食道扁平上皮癌の株化細胞であるTE-5、-9及び-12細胞株を、東北大学加齢医学研究所及び理化学研究所バイオリソースセンター細胞バンクから2006年に入手した。TE-12株化細胞は近年汚染が報告されているので (東北大学加齢医学研究所医用細胞資源センター) 、我々は4つのクローナルなTE-12株化細胞を樹立し、それぞれ、TE-12クローンA1からA4 (TE-12 cloneA1-4) と名づけた。本研究のために、我々はTE-5、TE-9及びTE-12 cloneA1細胞を用いた。これらの細胞は、10%の熱失活ウシ胎仔血清及び抗生物質(ペニシリンG/ストレプトマイシン/アンホテリシンB; GIBCO社)を追加したRPMI-1640培地(シグマ-アルドリッチ社、セントルイス、ミズーリ州、米国)中で培養し、5%CO2/95%大気雰囲気下、37℃の加湿恒温器内で維持した。
【0033】
細胞増殖アッセイ
細胞増殖はCell Counting Kit-8 ((株) 同仁化学研究所、熊本、日本) を用いて評価した。細胞は96穴プレートに1×103細胞/ウェルの密度で蒔き、0、1、2、3又は4日間保温した。適切な時期に10μlのCell Counting Kit-8試薬を細胞に加えた。細胞は、その後1時間保温し、更にその後、プレートの450nmでの光学密度をModel 550 Microplate Reader (Bio-Rad Laboratories社、Herucoles、カリフォルニア州、米国) を用いて読み取った。
【0034】
放射線療法に関する細胞生存率
細胞は96穴プレートに1×103細胞/ウェルの密度で蒔き、24時間37℃で保温した。細胞はその後、SOFTEX M-100WE (ソフテックス株式会社、東京、日本) を用いて0, 5又は10Gyで照射された。照射条件は、100kV、5mAであり、これは2.695Gy/分の線量に相当する。更に72時間培養した後、細胞生存率を比色MTSアッセイで評価した (CellTiter 96 AQueous One Solution Cell Proliferation Assay、Promega社、Madison、ウィスコンシン州、米国) 。手短に述べると、20μlのMTSを培養液に加え、37℃で4時間保温した。その後、490 nmにおける光学密度をマイクロプレート読み取り装置を用いて測定することにより、細胞生存率を決定した。
【0035】
マイクロアレイ解析
TE-12 cloneA1及びTE5細胞は、CodeLinkTM Human Whole Genome Bioarray (Applied Microarrays、Inc.社、Tempe、アリゾナ州、米国) を用いて解析した。マイクロアレイ解析はフィルジェン株式会社 (名古屋市、日本) に委託した。手短に述べると、それぞれのバイオアレイについて、10μgのcRNA (総容積25μl中) に5μlの5×断片化バッファーを加え、94℃で20分間保温した。その後、当該10μgの断片化されたcRNAに、78μlのハイブリダイゼーション・バッファー・コンポーネントA及び130μlのハイブリダイゼーション・バッファー・コンポーネントBを加え、最終容積を水で260μlに合わせた。このようにして得られたハイブリダイゼーション反応混合液を90℃で5分間保温した。その後、250μlをゆっくりとそれぞれのアレイのインプット・ポートに注入し、ポートをシーリング・ストリップで封着した。バイオアレイは、その後、300 rpmで振盪しながら37℃で18時間保温した。比較実験のためにハイブリダイゼーションの時間を一定に保った。保温に引き続いて、バイオアレイは0.75×TNTバッファー (0.10M Tris-HCl、pH 7.6、0.15M NaCl、0.05% Tween 20) で洗浄した。この洗浄は、46℃で正確に1時間保温することにより行った。スモール・リエージント・リザーバーのそれぞれのスロットに3.4mlのCy5-ストレプトアビジン・ワーキング・ソリューションを満たし、アレイを25℃でもう30分間保温した。その後、25℃の1×TNTバッファーを用いてバイオアレイを5分間ずつ4回洗浄し、さらに、0.1×SSC (Ambion社、Austin、テキサス州、米国) / 0.05% Tween 20で30秒間ずつ2回リンスし、25℃で3分間の遠心分離により直ちに乾燥させた。最後に、アレイはGenePix4000B Array Scanner (Molecular Devices社、Sunnyvale、カリフォルニア州、米国) を用いてスキャンし、MicroArray Data Analysis Tool Ver3.2 (フィルジェン株式会社)を用いてデータを解析した。
【0036】
リアルタイム逆転写酵素-ポリメラーゼ連鎖反応法
それぞれの細胞型から、TRIzol試薬 (Invitrogen社、Grand Island、ニューヨーク州、米国)及びPure-Link RNA Mini Kit (Invitrogen社) を用いて、製造者の説明書に従って全RNAを単離した。単離したRNAを分光光度計を用いて定量した後、2μg 分割量のRNAからTranscriptor First Strand cDNA Synthesis Kit (Roche Diagnostics社、Mannhein、ドイツ国) を用いて逆転写した。インスリン様増殖因子結合タンパク質3 (insulin-like growth factor binding protein 3; IGFBP3) 及びBcl-2-associated athanogene 1 (BAG1) を増幅するためのプライマー配列は表1に示した。リアルタイム逆転写酵素-ポリメラーゼ連鎖反応法 (RT-PCR法) は、LightCycler 480 Kit (Roche Diagnostics社) を用いてLightCycler 480 (Roche Diagnostics社) 上で行った。増幅プロトコールは、95℃で5分間インキュベーションした後、95℃で10秒間、60℃で30秒間、及び、50℃で30秒間を45サイクル繰り返すものであった。IGFBP3及びBAG1のmRNAの発現量は、β-actinのmRNAの発現量に対して標準化した。
【0037】
【表1】

【0038】
免疫ブロット解析
細胞は、10cm皿で24時間培養した後、無血清RPMI-1640培養液を加え、更に48時間培養した。その後、上清を回収し、タンパク質の濃度を測定した。20μgのタンパク質を含む試料をドデシル硫酸ナトリウム・ポリアクリルアミドゲル電気泳動 (sodium dodecylsulfate-polyacrylamide gel electrophoresis; SDS-PAGE) にかけて、分離されたタンパク質をニトロセルロース膜 (Trans-Blot Transfer Medium, Bio-Rad Laboratories社) にトランスファーした。その後、これを5%脱脂乳及び0.1% Tween 20を含むリン酸緩衝食塩水 (PBS) でブロックした。ブロッキングの後、上記膜を初めに抗ヒトIGFBP3抗体 (anti-human IGFBP3 antibody; Santa Cruz Biotechnology社、Santa Cruz, カリフォルニア州、米国、1:200希釈) 又はBAG1抗体 (BAG1 antibody; Santa Cruz Biotechnology社、1:1000希釈) と共に一晩 4℃で保温し、それから、ペルオキシダーゼ抱合型二次抗マウスIgG (peroxidase-conjugated secondary anti-mouse IgG; Dako社、Glostrup、デンマーク、Tween20-PBS中で 1:1000希釈) と共に1時間保温した。免疫検出はECL Plusウエスタンブロット検出試薬及び解析システム (ECL Plus Western blotting detection reagents and analysis system; GE Healthcare社、 Waukesha、ウィスコンシン州、米国)を用いて行った。最後に、膜をX線フィルムに露光した。
【0039】
低分子干渉RNA (small interfering RNA, siRNA) を用いたIGFBP3及びBAG1のノックダウン
Silencer (登録商標) Select Pre-designed siRNA (Ambion社) は、製造者の説明書に従ってLipofectamine 2000 (Invitrogen社) を用いてTE-5、TE-9及びTE-12 cloneA1細胞に導入した。IGFBP3及び/又はBAG1を標的とする12.5 pmolのsiRNA (Silencer Select Pre-designed siRNA; Ambion社) 又はネガティブコントロールのsiRNA (silencer Negative Control #1 siRNA; Ambion社) を5μlのリポフェクタミン2000と共に、500μlのOpti-MEM I medium (Invitrogen社) に混ぜた。本研究で使用したsiRNAの配列は表2に示す。結果として生じた混合液を2mLの培養液に加え、6穴培養プレートのウェルに蒔かれた細胞に接触させた。24時間保温した後、培養液を新鮮な培養液と交換した。更に24時間経った後、細胞の一部を回収し、MTSアッセイのために1×104 細胞/ウェルの密度で96穴プレートに蒔いた。あるいは、細胞は48時間保温した後、全RNAを単離した。全RNAは、IGFBP3及びBAG1のmRNA発現をRT-PCR法で解析するために用いた。
【0040】
【表2】

【0041】
統計解析
二群の有意差はスチューデントのt検定を用いて評価した。全ての解析はJMP8 (SAS社、Cary、ノースカロライナ州、米国) を用いて行い、両側性のP値を生成した。0.01より小さいP値 (P < 0.01) の場合に、有意と判断した。
【0042】
[結果]
TE株化細胞の放射線感受性
WST-8の切断の水準で示される細胞増殖は、調査した全ての時点において (0、1、2、3及び4日目) 、TE-5、TE-9及びTE-12 cloneA1細胞間で違いが無かった(図1A) 。一方で、5及び10 Gyの放射線を照射した細胞の生存率を測定することにより、TE-5又はTE-9細胞と比較して、TE-12 cloneA1細胞は有意に放射線感受性が高いことが示された (図1B) 。
【0043】
DNAマイクロアレイ解析
TE-12 cloneA1及びTE-5細胞の54,359個の遺伝子の発現レベルについてDNAマイクロアレイ解析を行い、図2の左上隅の挿入図に示した。我々は、71個の遺伝子の発現レベルがTE-12 cloneA1細胞においてはTE-5細胞よりも5倍以上高いことを見出した (図2の小さい白丸及び大きい黒丸) 。これらを表3−1から3−4に示す。これらの71個の遺伝子のうち、我々はIGFBP3及びBAG1 (図2の大きい黒丸) が実際に癌細胞の放射線感受性に関与することを証明した。結果を以下に示す。マイクロアレイのデータはRT-PCR法及びウェスタン解析で確認した。それによると、IGFBP3及びBAG1のmRNA及びタンパク質の発現レベルは、いずれも、TE-5又はTE-9株化細胞の場合と比較して、TE-12 cloneA1株化細胞では有意に高かった (図3A、3B、3C) 。
【0044】
【表3−1】

【0045】
【表3−2】

【0046】
【表3−3】

【0047】
【表3−4】

【0048】
IGFBP3及び/又はBAG1のノックダウンにより誘発される放射線感受性の変化
次に、我々は、TE-12 cloneA1細胞におけるIGFBP3及び/又はBAG1のノックダウンの影響を調べた。IGFBP3又はBAG1を標的とするsiRNAを細胞にトランスフェクトすることによって、それぞれのmRNAの発現量が減少した (図4A及び4B) 。IGFBP3については、ノックダウンの効率の平均値は75% (IGFBP3 siRNA-1) 及び59% (IGFBP3 siRNA-2) であった (表2及び図4A参照) 。BAG1については、ノックダウンの効率の平均値は73% (BAG1 siRNA-1) 及び78% (BAG1 siRNA-2) であった(表2及び図4B参照)。放射線照射(5Gy及び10Gy) 後72時間の時点での細胞生存率を調べることにより、IGFBP3又はBAG1をノックダウンした細胞は、ネガティブコントロールの細胞と比較して、有意に放射線感受性が低いことが示された (図4C) 。これらの結果は、IGFBP3及び/又はBAG1をノックダウンすることによって、TE-12 cloneA1細胞の放射線感受性が減少することを示している。
【産業上の利用可能性】
【0049】
本件発明は、検査機関における扁平上皮癌組織の放射線感受性の検査、及び、扁平上皮癌組織の放射線感受性を検査するための試薬又はキットの製造に利用することができる。
【特許請求の範囲】
【請求項1】
以下の工程を含む、被験者の扁平上皮癌組織の放射線感受性を検査するための方法:
当該被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量Ecancerを測定する工程;及び、当該発現量Ecancerを被験者の扁平上皮癌組織の放射線感受性と関連付ける工程;
ここで、当該発現量Ecancerが基準Sと比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していると判断される。
【請求項2】
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのプライマー。
【請求項3】
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのハイブリダイゼーションプローブ。
【請求項4】
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する抗体を含有する、扁平上皮癌組織の放射線感受性を検査するための試薬。
【請求項5】
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【請求項6】
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【請求項7】
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する1又は複数の抗体、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【請求項1】
以下の工程を含む、被験者の扁平上皮癌組織の放射線感受性を検査するための方法:
当該被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量Ecancerを測定する工程;及び、当該発現量Ecancerを被験者の扁平上皮癌組織の放射線感受性と関連付ける工程;
ここで、当該発現量Ecancerが基準Sと比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していると判断される。
【請求項2】
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのプライマー。
【請求項3】
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含むポリヌクレオチドからなる、扁平上皮癌組織の放射線感受性を検査するためのハイブリダイゼーションプローブ。
【請求項4】
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する抗体を含有する、扁平上皮癌組織の放射線感受性を検査するための試薬。
【請求項5】
配列番号:1に記載された核酸配列又はその相補配列の少なくとも15個の連続するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【請求項6】
配列番号:1に記載された核酸配列又はその相補配列と少なくとも80%の同一性を有するヌクレオチド配列を含む1又は複数のポリヌクレオチド、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【請求項7】
配列番号:2に記載されたアミノ酸配列を含むポリペプチドを認識する1又は複数の抗体、及び、被験者の扁平上皮癌組織から取得した生体試料におけるBAG1遺伝子の発現量が基準と比較して増加している場合に当該被験者の扁平上皮癌組織の放射線感受性は増加していることを教示する使用説明書を含む、扁平上皮癌組織の放射線感受性を検査するためのキット。
【図1A】


【図1B】


【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図4C】




【図1B】


【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図4C】


【公開番号】特開2012−165666(P2012−165666A)
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2011−27348(P2011−27348)
【出願日】平成23年2月10日(2011.2.10)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 「Biochemical and Biophysical Research Communications 第404巻」(平成22年12月30日 Elsevier社 発行)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成23年2月10日(2011.2.10)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 「Biochemical and Biophysical Research Communications 第404巻」(平成22年12月30日 Elsevier社 発行)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
[ Back to top ]

