抗うつ作用物質のスクリーニング方法
【課題】 抗うつ作用物質を迅速且つ簡便にスクリーニングできる方法を提供する。
【解決手段】 本発明に係る抗うつ作用物質のスクリーニング方法は、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する工程と、前記準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、前記準備された細胞に対して、うつ関連物質を接触させて、当該細胞における前記電気生理学的応答の変化を測定する対照処理工程と、前記候補物質処理工程において前記候補物質とうつ関連物質とを接触させた細胞において、前記対照処理工程においてうつ関連物質を接触させた細胞において測定された前記電気生理学的応答の変化が抑制されるか否かを評価する評価工程と、を含むものとする。
【解決手段】 本発明に係る抗うつ作用物質のスクリーニング方法は、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する工程と、前記準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、前記準備された細胞に対して、うつ関連物質を接触させて、当該細胞における前記電気生理学的応答の変化を測定する対照処理工程と、前記候補物質処理工程において前記候補物質とうつ関連物質とを接触させた細胞において、前記対照処理工程においてうつ関連物質を接触させた細胞において測定された前記電気生理学的応答の変化が抑制されるか否かを評価する評価工程と、を含むものとする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗うつ作用物質をスクリーニングする方法に関し、特に、細胞の電気生理学的応答の評価に関する。
【背景技術】
【0002】
ストレスの多い現代社会において、うつ病と診断される患者数は増加傾向にある。このため、うつの症状を改善できる、いわゆる抗うつ薬の開発が望まれている。
【0003】
この抗うつ薬としては、例えば、うつ病患者の脳内においてセロトニン等のモノアミン系神経伝達物質の量が不足しているとの知見に基づき、セロトニン濃度を上げるものや、セロトニン受容体を活性化するもの等が主に開発されている。
【0004】
また、このような抗うつ薬として利用できる有効物質をスクリーニングする方法としては、従来、例えば、いわゆる強制水泳法や尾懸垂法等によってストレスを与え、うつ症状を引き起こさせたマウス等の実験動物に対して、有効物質の候補を投与し、その抗うつ効果(うつ症状の改善効果)を調べる方法が用いられている。
【非特許文献1】Karolewicz B, Paul IA. Europian Journal of Pharmacology 415, 197−201 (2001)
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、近年、例えば、モノアミン系神経伝達物質の他にも、副腎皮質ホルモンの一種であるコルチコイド等、うつ病に関連する物質の存在が報告され、抗うつ作用を示す物質のスクリーニング対象は広範なものとなってきている。
【0006】
このような現状において、上記従来の実験動物を用いたスクリーニング方法は、多くの時間やコストを要してしまい、効率的ではない。
【0007】
本発明は、上記問題に鑑みて為されたものであって、抗うつ作用物質を迅速且つ簡便にスクリーニングできる方法を提供することをその目的の一つとする。
【課題を解決するための手段】
【0008】
上記従来の課題を解決するため、本発明の一実施形態に係る抗うつ作用物質のスクリーニング方法は、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する工程と、前記準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、前記準備された細胞に対して、うつ関連物質を接触させて、当該細胞における前記電気生理学的応答の変化を測定する対照処理工程と、前記候補物質処理工程で得られた測定結果において、前記対照処理工程で測定された前記電気生理学的応答の変化が抑制されているか否かを評価する評価工程と、を含むことを特徴とする。
【0009】
また、前記生理学的応答は、前記所定の刺激に基づく前記細胞の膜電位変化であることとしてもよい。
【0010】
また、前記細胞は、神経細胞であることとしてもよい。
【0011】
また、前記神経細胞は、動物の脳組織切片に含まれる神経細胞であることとしてもよい。
【0012】
また、前記脳組織切片は、海馬領域の切片であることとしてもよい。
【0013】
また、前記所定の刺激は電気刺激であり、前記電気生理学的応答は、当該電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化であることとしてもよい。
【0014】
また、前記ストレス関連物質による電気生理学的応答の変化は、前記電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化に基づいて評価される長期増強の程度の低下であり、前記評価工程においては、前記候補物質処理工程で前記候補物質とストレス関連物質とを接触させた細胞において、前記対照処理工程でストレス関連物質を接触させた細胞において測定された前記長期増強の程度の低下が抑制されるか否かを評価することとしてもよい。
【0015】
また、前記うつ関連物質は、ストレスホルモンであることとしてもよい。
【0016】
また、前記ストレスホルモンは、コルチコイド又はその誘導体であることとしてもよい。
【発明の効果】
【0017】
本発明によれば、うつ関連物質によって細胞に引き起こされる電気生理学的応答の変化が抑制されるか否かを評価することによって、抗うつ作用物質を迅速且つ簡便にスクリーニングできる。
【発明を実施するための最良の形態】
【0018】
以下に、本発明の一実施の形態に係る抗うつ作用物質のスクリーニング方法(以下、本スクリーニング方法)について説明する。なお、本発明に係る抗うつ作用物質のスクリーニング方法は、以下に示す例に限られるものではない。
【0019】
まず、本スクリーニング方法の概要について説明する。本スクリーニング方法は、本発明者らによって独自に見出された知見に基づいて為されたものである。
【0020】
すなわち、本発明者らは、鋭意研究を重ねた結果、例えば、いわゆる糖質コルチコイド(コルチコステロン、コルチゾール等)を、コルチコイド受容体(糖質コルチコイド受容体、鉱質コルチコイド受容体等)を有する細胞に接触させると、接触させない場合に比べて、接触後ごく短時間のうちに、当該細胞において電気生理学的応答が変化する急性作用が引き起こされることを見出した。これは、ストレス応答時に体内で糖質コルチコイドの濃度が上昇することによりうつ状態が引き起こされる現象を細胞レベルで再現したものであると考えられる。
【0021】
さらに、本発明者らは、例えば、いわゆる女性ホルモン(エストロゲン)を、糖質コルチコイドによりその電気生理学的応答が変化する、上記ホルモン受容体を有する細胞に接触させると、接触後ごく短時間のうちに、当該細胞において、糖質コルチコイドによる電気生理学的応答の変化が解消されることを見出した。これは、従来提唱されている女性ホルモンの抗うつ作用を再現したものであると考えられる。
【0022】
本スクリーニング方法は、このように、所定の刺激によって一定の電気生理学的応答を示す細胞において、うつ関連物質との接触により当該電気生理学的応答が変化する一方で、抗うつ作用物質との接触によって当該うつ関連物質による電気生理学的応答の変化が抑制される、との本発明者らによる新たな知見に基づき、当該うつ関連物質による電気生理学的応答の変化を抑制するか否かを評価することによって、スクリーニング対象となった候補物質が抗うつ作用物質であるか否かを評価するものである。
【0023】
なお、うつ関連物質としては、うつ症状に関連する生体由来の物質又はその誘導体であって、細胞の電気生理学的応答を変化させる作用を示すものであれば特に限られず用いることができ、例えば、生体がストレスを受けた場合に、分泌が亢進されたり、血液中や組織中において濃度が増減する、いわゆるストレスホルモンを用いることができる。
【0024】
具体的に、例えば、このうつ関連物質として、副腎皮質ホルモンの一種である糖質コルチコイド(glucocorticoid)や鉱質コルチコイド(mineral corticoid)等のコルチコイドを用いることができ、特に、コルチコステロンやコルチゾール等を好適に用いることができる。
【0025】
また、抗うつ作用物質とは、うつ関連物質と接触した場合に細胞において引き起こされる電気生理学的応答の変化を抑制する、すなわち、そのような変化を解消する作用を示す物質を意味し、本実施形態においては、エストラジオール、エストロン、エストリオール等のエストロゲンを含む女性ホルモンや、女性ホルモンと同様の生理学的作用を示すヘキセストロールやスチルベストロール等も含むものとする。
【0026】
次に、本スクリーニング方法の具体的内容について説明する。本スクリーニング方法は、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する細胞準備工程と、細胞準備工程において準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、細胞準備工程において準備された細胞に対して、うつ関連物質を接触させて、当該細胞における上記電気生理学的応答の変化を測定する対照処理工程と、候補物質処理工程で候補物質とうつ関連物質とを接触させた細胞において、対照処理工程でうつ関連物質を接触させた細胞において測定された電気生理学的応答の変化が抑制されるか否かを評価する評価工程と、を含む。
【0027】
細胞準備工程においては、うつ関連物質や候補物質を接触させて、その電気生理学的応答を評価する対象として用いる細胞を準備する。すなわち、この細胞準備工程においては、ヒトや動物から採取した組織や、単離した初代細胞、樹立された株化細胞、又はこれらの細胞に遺伝子組み換え操作等の人為的処理を施した細胞等を準備する。
【0028】
この細胞としては、うつ関連物質に接触した場合に、接触しない場合に比べて電気生理学的応答が変化し、且つ抗うつ作用物質と接触した場合には当該電気生理学的応答の変化が抑制される細胞であれば特に限られず用いることができ、例えば、うつ関連物質や抗うつ作用物質に対する受容体を有する細胞を用いることができる。
【0029】
具体的に、この細胞としては、例えば、脳組織その他の神経組織に含まれる神経細胞を好適に用いることができる。脳組織を用いる場合には、例えば、ラットやマウス等の小動物のものを好適に用いることができ、特に、ビブラトーム等の切片作成装置を用いて、脳海馬領域を、その長軸に対して垂直に切断した長軸横断切片の海馬アンモン角(Cornu Ammonis;CA)に含まれる錐体細胞や海馬歯状回に含まれる顆粒細胞等を好適に用いることができる。
【0030】
また、この脳組織切片としては、150〜400μm程度の範囲の厚さのものを好ましく用いることができ、特に400μm程度の厚さのものを好適に用いることができる。これは、脳組織切片の厚さが150μm程度より小さい場合には、当該脳組織切片に含まれる神経細胞のほとんどが、切片の作製時にその細胞体や樹状突起に大きな損傷を受けたものとなるため、健常組織として用いることが困難となり、また、脳組織切片の厚さが400μm程度より大きい場合には、当該脳組織切片の外部の溶液中から、当該脳組織切片の内部の神経細胞への酸素供給が不十分となり、やはり健常組織として用いることが困難となるためである。また、単離された神経細胞を用いる場合には、例えば、所定の組成の培養液中、市販のプラスチックディッシュ等の所定の培養基材上で所定期間培養された神経細胞を準備する。
【0031】
候補物質処理工程においては、細胞準備工程において準備された細胞に対して、スクリーニングの対象となった候補物質とうつ関連物質とを接触させるとともに、当該候補物質とうつ関連物質とを接触させた細胞における所定の刺激に対する電気生理学的応答を測定する。
【0032】
ここで、候補物質としては、抗うつ作用を示すか否かを評価するスクリーニングの対象とする物質であれば、特に制限されず用いることができ、例えば、動物実験において何らかの抗うつ作用を示すことが報告されている物質や、これらの誘導体等、化学構造や性質(生体又は細胞への作用等)が既知であるか否か又は天然の物質か人工的に合成されたものかを問わず、任意の化合物を用いることができる。
【0033】
この候補物質処理工程においては、まず、細胞に対して、候補物質とうつ関連物質とを同時に接触させる。具体的に、例えば、所定の容器内において、組織切片や単離細胞を、候補物質とうつ関連物質との両方を含む溶液(以下、刺激溶液)中に所定時間浸漬し、又はガラスピペット等を用いて組織切片に含まれる細胞や単離細胞の近傍に(すなわち、局所的に)刺激溶液を噴射すること等により、当該組織切片に含まれる細胞や単離細胞に当該候補物質とうつ関連物質とを接触させる。この候補物質やうつ関連物質を細胞に接触させる時間は、目的に応じて適宜選択することができるが、例えば、遺伝子発現を介した比較的緩除な応答を評価する場合には数時間(例えば、3時間)以上が好ましく、遺伝子発現を介さない急性の応答を評価する場合には数十分(例えば、30分程度)が好ましい。
【0034】
この刺激溶液を用いる場合、当該刺激溶液中の候補物質の濃度については特に制限はなく、適宜選択することができるが、例えば、当該候補物質が生体内に存在する物質である場合には、当該生体内における濃度(いわゆる生理的濃度)付近を好適に用いることができる。また、うつ関連物質についても、その種類に応じて適切な濃度を適宜選択することができるが、例えば、コルチコステロンを用いる場合には、比較的高い濃度が好ましく、1μM以上を好適に用いることができる。コルチコステロンは、比較的低い濃度では、うつ関連物質としての作用に比べて、例えば、神経栄養因子としての作用を強く示す傾向があるためである。また、これら候補物質やうつ関連物質の濃度は、結合する受容体との親和性に基づいて決定することもでき、例えば、受容体との解離定数(いわゆるKd値)等に近い濃度等を好適に用いることもできる。
【0035】
また、この刺激溶液及び以下に示す他の溶液は、例えば、所定のポンプ装置等を用いて、組織切片や単離細胞を保持する所定の容器内を循環(灌流)させてもよいし、循環させることなく、当該所定容器内にバッチ方式で保持してもよい。
【0036】
なお、候補物質とうつ関連物質とを溶解する溶媒としては、細胞の生存状態を維持できるものであれば特に制限されず用いることができ、例えば、適切な浸透圧を示すよう塩類(ナトリウムやカリウム等)の組成や濃度等を調製し、又は細胞の代謝に必要な栄養成分(グルコースやアミノ酸類等)の組成や濃度等を調製した水溶液を好適に用いることができる。
【0037】
次に、この候補物質処理工程においては、候補物質とうつ関連物質とを接触させた細胞に対して、所定の刺激を与えるとともに、当該細胞の当該刺激に対する電気生理学的応答を測定する。
【0038】
ここで、細胞に対する刺激方法としては、細胞の電気生理学的応答を引き起こすものであれば特に限られず用いることができ、例えば、電気刺激や、所定の物質と接触させる化学的刺激等、反復して行うことのできる方法を好適に用いることができる。
【0039】
具体的に、神経細胞を用いる場合には、例えば、細胞にガラス電極を刺し込んで行う電気刺激や、ガラスピペットを用いて細胞近傍において神経伝達物質を噴射する局所的刺激等を用いることができ、特に、脳組織切片を用いる場合には、修練をあまり必要とせず、安定して実施できるという観点から、当該脳組織切片に含まれる神経細胞に投射するシナプス前線維に対する電気刺激を好適に用いることができる。
【0040】
また、電気生理学的応答としては、細胞膜の電位の変化等、所定の刺激に対して、生存している細胞が示す電気的特性であれば特に限られず測定することができ、例えば、脳組織切片を用いる場合には、シナプス前線維への電気刺激に対するシナプス後電位や、その変化等を測定することができる。
【0041】
具体的に、脳組織切片を用いる場合には、例えば、電気生理学的応答として、所定頻度の電気刺激に対する、脳組織切片に含まれる神経細胞に係る興奮性シナプス後電位(Excitatory PostSynaptic Potential;EPSP)の変化特性を表す、いわゆる長期増強(Long−Term Potentiation)や長期抑制(Long−Term Depression)等を測定することができる。
【0042】
なお、電気生理学的応答として長期増強を測定する場合において、長期増強を誘発する方法に特に制限はなく、適宜選択することができ、例えば、神経細胞に投射しているシナプス前線維に対する様々な高頻度電気刺激パターンを用いることができるが、特に、比較的簡便で再現性がよいという点および、過去の報告で実際に使用された頻度が高いという点で、1秒間に100回という高頻度刺激方法を好適に用いることができる。
【0043】
また、電気生理学的応答の測定方法としては、例えば、ガラス電極を細胞に刺し込むガラス電極刺入法や、ガラス電極を用いたパッチクランプ法等、単一の細胞の細胞内電位を測定する方法を用いることができる。
【0044】
具体的に、脳組織切片を用いる場合には、例えば、複数の電極を有する多電極測定装置やガラス電極等を用いて、当該脳組織切片に含まれる神経細胞の集合電位を測定する方法等を用いることができ、特に、効率よくシナプス前線維を刺激でき、シナプス後電位を高い感度で測定できるガラス電極を用いた集合電位を測定する方法を好適に用いることができる。なお、ガラス電極による測定方法として、単一電極計測装置を用いて集合電位を測定する方法を選択した場合、単一電極計測装置は適宜作製したものであってもよいし、市販品でもよい。
【0045】
また、刺激電極と記録電極との距離については特に制限はなく、目的に応じて適宜選択することができるが、例えば、ラット脳海馬を用いる場合には、300〜400μm程度の範囲を好適な電極間距離として用いることができ、特に300μmが好適である。これは、刺激電極と記録電極とを海馬CA1領域内に配置する必要があるとともに、当該電極間距離がこの範囲よりも小さい場合には、例えば、測定結果が刺激電極そのものの影響を受ける場合があるためである。
【0046】
対照処理工程においては、細胞準備工程において準備された細胞に対して、候補物質処理工程において細胞に接触させたものと同じうつ関連物質を接触させるとともに、当該うつ関連物質を接触させた細胞における所定の刺激に対する電気生理学的応答を測定する。
【0047】
すなわち、この対照処理工程においては、うつ関連物質に接触しない場合には、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触した場合には、当該電気生理学的応答が変化するという、細胞準備工程において準備された細胞における、うつ関連物質による電気生理学的応答の変化を確認する。
【0048】
具体的に、この対照処理工程においては、例えば、所定の容器内において、組織切片や単離細胞を、候補物質処理工程において用いられた刺激溶液から候補物質のみを除いた(すなわち、候補物質を含まず、当該刺激溶液と同じ濃度のうつ関連物質を含む)溶液(以下、対照溶液)中に所定時間浸漬し、又はガラスピペット等を用いて、当該対照溶液を組織切片に含まれる細胞や単離細胞の近傍に噴射すること等により、当該組織切片に含まれる細胞や単離細胞に当該うつ関連物質を接触させる。
【0049】
そして、この対照処理工程においては、上述の候補物質処理工程における場合と同様に、うつ関連物質を接触させた細胞に対して、所定の刺激を与えるとともに、当該細胞の当該刺激に対する電気生理学的応答を測定する。
【0050】
また、この対照処理工程においては、候補物質、うつ関連物質のいずれをも接触させていない細胞について、その電気生理学的応答を測定することとしてもよい。具体的に、この対照処理工程においては、例えば、候補物質処理工程において用いられた刺激溶液から候補物質とうつ関連物質との両方を除いた(すなわち、候補物質、うつ関連物質のいずれをも含まない溶媒のみからなる)溶液中に所定時間浸漬し、又はガラスピペット等を用いて、当該溶液を組織切片に含まれる細胞や単離細胞の近傍に噴射した後、当該組織切片に含まれる細胞や単離細胞について電気生理学的応答をさらに測定することとしてもよい。
【0051】
評価工程においては、候補物質処理工程における電気生理学的応答の測定結果と、対照処理工程における電気生理学的応答の測定結果と、を比較して、うつ関連物質を接触させた細胞における電気生理学的応答の変化が、候補物質とうつ関連物質との両方を接触させた細胞において抑制されるか否かを評価する。
【0052】
すなわち、この評価工程においては、例えば、うつ関連物質を接触させた細胞における電気生理学的応答の程度と、接触させない細胞における電気生理学的応答の程度と、の差異が、候補物質とうつ関連物質との両方を接触させた細胞においては低減又は解消されるか否か、すなわち、候補物質又はうつ関連物質のいずれも接触させない場合により近い電気生理学的応答を示すようになるか否かを評価する。
【0053】
具体的に、例えば、候補物質又はうつ関連物質のいずれも接触させない場合に比べて、うつ関連物質を接触させた場合に細胞膜電位が所定量だけ変化する場合には、候補物質とうつ関連物質との両方を接触させた場合に、当該所定の変化量が低減又は解消するか否か、すなわち、細胞膜電位が、候補物質又はうつ関連物質のいずれも接触させない場合の細胞膜電位に回復するか否かを評価する。
【0054】
また、例えば、脳組織切片を用いて長期増強を測定した場合であって、候補物質又はうつ関連物質のいずれも接触させない場合に比べて、うつ関連物質を接触させると長期増強の程度が所定量だけ低下する場合には、候補物質とうつ関連物質との両方を接触させることによって当該長期増強の程度の低下が抑制され又は解消されるか否か、すなわち、長期増強の程度が回復するか否かを評価する。
【0055】
また、本スクリーニング方法においては、候補物質とうつ関連物質との両方を接触させる候補物質処理を施す候補物質処理グループと、候補物質とは接触させず、うつ関連物質と接触させる対照処理を施す対照処理グループと、候補物質又はうつ関連物質のいずれも接触させない無処理グループと、を準備することとしてもよい。
【0056】
すなわち、この場合、例えば、細胞準備工程において、マウスの1個体から採取した脳組織から複数の脳組織切片を作製した場合には、一部の脳組織切片には候補物質処理を施し、他の一部の脳組織切片には対照処理を施し、さらに他の一部の脳組織切片には候補物質処理又は対照処理のいずれも施さず、評価工程において、これら3つのグループの脳組織切片について、電気生理学的応答の測定結果を互いに比較し、評価する。
【0057】
また、単離細胞を用いる場合には、例えば、細胞準備工程において、動物や組織の由来等に基づく性質や、継代数、培養期間等の培養条件等が同一となるよう培養細胞を準備し、当該培養細胞のうち、一部の培養細胞には候補物質処理を施し、他の一部の培養細胞には対照処理を施し、さらに他の一部の培養細胞には候補物質処理又は対照処理のいずも施さず、評価工程において、これら3つのグループの培養細胞について、電気生理学的応答の測定結果を互いに比較し、評価する。
【0058】
次に、本スクリーニング方法を用いて抗うつ作用物質の評価を行った具体例について説明する。本実施例に係る細胞準備工程においては、ビブラトーム(DSK ZERO1、堂阪イーエム株式会社製)を用いて、成獣ラットの脳海馬を、その長軸に対して垂直に切断し、厚さ400μmの長軸横断切片を複数作製した。
【0059】
本実施例においては、この得られた複数の海馬切片のうち、一部の海馬切片を候補物質処理グループとして、他の一部の海馬切片を対照処理グループとして、さらに他の一部の海馬切片を無処理グループとして、それぞれ準備した。
【0060】
これらの海馬切片は、酸素・二酸化炭素混合ガス(95%酸素ガス、5%二酸化炭素ガス)で十分に飽和させた人工脳脊髄液中に浸漬し、当該海馬切片に上部から当該混合ガスを吹き付けながら室温で1時間30分以上静置した後に、後述する電気生理学的応答の測定に用いた。
【0061】
なお、この人工脳脊髄液としては、124mMのNaCl、1.25mMのNaH2PO4・2H2O、5mMのKCl、2mMのMgSO4・7H2O、2mMのCaCl2、22mMのNaHCO3、10mMのGlucoseを含む水溶液を用いた。
【0062】
また、この細胞準備工程においては、作製した海馬切片を、所定の測定用チャンバー内に静置し、当該海馬切片の周囲に上記混合ガスで十分に飽和させた人工脳脊髄液を満たして、所定の単一電極測定装置に装着した。この単一電極装置としては、キャピラリーと銀/塩化銀電極とを組み合わせたガラス電極(Sutter Instrument社製)と、所定の増幅器(アンプ)(DAM80、World Precision Instrument社製)と、を備えたものを用いた。
【0063】
すなわち、各海馬切片について、所定の双極電極を刺激電極として海馬切片の海馬CA1領域のシナプス前線維に配置するとともに、上記ガラス電極を測定電極としてシナプス後細胞の樹状突起上に配置した。
【0064】
なお、以下の工程においては、海馬切片を載置したチャンバー内に、上記混合ガスで十分に飽和させた人工脳脊髄液を流速毎分約2mlで灌流しながら全ての処理及び測定を行った。
【0065】
また、この細胞準備工程においては、刺激電極を用いて海馬切片のCA1領域のシナプス前線維を20秒間隔で繰り返し刺激するとともに、測定電極を用いて、当該電気刺激によって誘発される興奮性シナプス後電位を集合電位として約30分間に亘って記録した。
【0066】
ここで、図1には、上記20秒間隔で行う電気刺激のうち1回の刺激に対して記録される集合電位の変化を表す波形の一例を示す。図1において、横軸は測定時間、縦軸は集合電位を示す。
【0067】
図1に示すように、記録される集合電位は、波形の高さ(すなわち、ベース値と、頂点の極値との差分)の絶対値Hとして測定されるが、当該集合電位は集合活動電位であるため、後述するような高頻度刺激を与えた後は正確な値を示さない場合がある。そこで、図1に示す波形のうち、刺激によって集合電位が最も急激に変化している部分Mの勾配(すなわち、集合電位波形の測定時間が早い側(左側)の最大勾配)の大きさ(以下、集合電位最大勾配値)を評価することとした。
【0068】
上記細胞準備工程においては、測定される集合電位最大勾配値が安定したことを確認した後、負荷する電気刺激の大きさを弱い強度から徐々に増加させつつ、集合電位最大勾配値を測定し、測定される集合電位最大勾配値が飽和した(すなわち一定となった)時点で、当該飽和した集合電位最大勾配値を最大値(100%)とした場合に、この最大値に対して50%の値になるように、刺激電極から海馬切片に負荷する電気刺激の強度を設定した。
【0069】
候補物質処理工程においては、候補物質処理グループに係る海馬切片について、細胞準備工程において設定した電気刺激強度を用いて、上記の一定間隔の反復刺激方法で20分間に亘って集合電位を記録した後、灌流液を、ジメチルスルフォオキシド(DiMethyl SulfOxide;DMSO)に溶解したコルチコステロン(うつ関連物質)を終濃度1μMで含むとともに、エストラジオール(抗うつ作用物質)を終濃度1nNで含む人工脳脊髄溶液(すなわち、刺激溶液)に交換し、さらに集合電位を30分間記録し続けた。
【0070】
そして、さらに集合電位の記録を続けながら、海馬切片に対して、1秒間に100回(すなわち、100Hz)の高頻度刺激を1秒間与え、長期増強を誘発し、その後さらに60分間に亘って集合電位を記録し続けた。
【0071】
対照処理工程においては、候補物質処理工程と同様に、対照処理グループに係る海馬切片について、細胞準備工程において設定した電気刺激強度を用いて、上記の20秒間隔の刺激方法で20分間に亘って集合電位を応答を記録した後、灌流液を、エストラジオールを含まず、ジメチルスルフォオキシド(DiMethyl SulfOxide;DMSO)に溶解したコルチコステロンを最終濃度1μMで含む人工脳脊髄溶液(すなわち、対照溶液)に交換し、さらに集合電位を30分間記録し、さらに100Hzの高頻度刺激を1秒間与えて誘発された長期増強を60分間に亘って集合電位を記録し続けた。
【0072】
また、この対照処理工程においては、無処理グループに係る海馬切片についても、細胞準備工程において設定した電気刺激強度を用いて、上記の20秒間隔の刺激方法で20分間に亘って集合電位を記録した後、灌流液を、コルチコステロン又はエストラジオールのいずれも含まず、刺激溶液及び対照溶液と同じ量のDMSOを含む人工脳脊髄溶液に交換し、さらに集合電位を30分間記録し、さらに100Hzの高頻度刺激を1秒間与えて誘発された長期増強を60分間に亘って集合電位を記録し続けた。
【0073】
評価工程においては、候補物質処理工程における集合電位の測定結果と、対照処理工程における集合電位の測定結果と、を解析し、互いに比較し評価した。なお、この評価肯定においては、上記20分間に亘って測定された各集合電位の最大勾配値を平均して、当該複数の最大勾配値の平均値を基準勾配値として100%と設定し、各工程において測定された集合電位最大勾配値の当該基準勾配値に対する割合を評価した。
【0074】
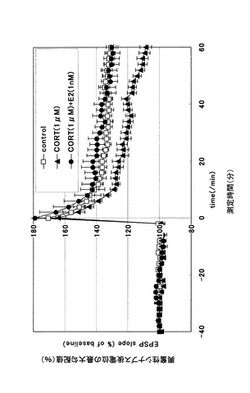
図2に、対照処理工程において、無処理グループと対照処理グループとについて、高頻度刺激により引き起こされた興奮性シナプス後電位(以下、EPSP)の長期増強を測定した結果を示す。
【0075】
図2において、横軸は測定時間(分)、縦軸は、上記100%と設定した基準勾配値に対する、各測定時間において測定された集合電位の最大勾配値の割合(%)を示す。白抜き四角印(control)は、無処理グループに係る測定結果を示し、黒塗り三角印(CORT)は、対照処理グループに係る測定結果を示す。図2における測定時間「0」の時点から100Hzの電気刺激を1秒間することにより長期増強を誘発した。
【0076】
図2に示すように、無処理グループに係る海馬切片、対照処理グループに係る海馬切片のいずれにおいても、測定時間「0」の時点から海馬CA1におけるEPSP反応の増強が観察された。
【0077】
また、無処理グループに係る海馬切片(白抜き四角印)においては、高頻度刺激後60分(すなわち、図2において測定時間60分)の時点で、EPSP反応は130%程度に増強した。これに対し、高頻度刺激前に30分間コルチコステロン(1μM)を含む対照溶液を灌流した対照処理グループに係る海馬切片(黒塗り三角印)においては、高頻度刺激後60分の時点で、EPSP反応は、無処理グループの海馬切片に比べて減少し、110%程度となった。
【0078】
すなわち、本実施例で用いた海馬切片に含まれる神経細胞をコルチコステロンに接触させることによって、長期増強の程度(EPSP反応の大きさ(%))が約20%低下した。
【0079】
図3には、候補物質処理工程において、候補物質処理グループについて、高頻度刺激により引き起こされたEPSPの長期増強を測定した結果を、図2に示す測定結果と対比させて示す。図3において、黒塗り丸印は、候補物質処理グループに係る測定結果を示す。
【0080】
図3に示すように、高頻度刺激前に30分間に亘って(すなわち、図3において測定時間−30分から0分まで)コルチコステロン(1μM)とエストラジオール(1nM)との両方を含む刺激溶液を灌流した候補物質処理グループに係る海馬切片(黒塗り丸印)においては、高頻度刺激後60分の時点におけるEPSP反応が、無処理グループのEPSP反応と比べてほとんど差がなく、130%程度となった。
【0081】
すなわち、対照処理グループに係る海馬切片において確認された、コルチコステロンのみを接触させた場合の長期増強の程度の低下は、コルチコステロンとエストラジオールとを同時に接触させた候補物質処理グループに係る海馬切片においては、略完全に抑制(すなわち、解消)され、当該候補物質処理グループに係る海馬切片における長期増強の程度は、無処理グループに係る海馬切片と同程度まで回復した。
【図面の簡単な説明】
【0082】
【図1】本発明の一実施形態に係るスクリーニング方法において測定される集合電位の波形の一例を示す説明図である。
【図2】本発明の一実施形態に係るスクリーニング方法を用いて測定されたうつ関連物質による長期増強の程度を低下させる効果の一例を示すグラフである。
【図3】本発明の一実施形態に係るスクリーニング方法を用いて測定された抗うつ作用物質による長期増強の程度を回復させる効果の一例を示すグラフである。
【技術分野】
【0001】
本発明は、抗うつ作用物質をスクリーニングする方法に関し、特に、細胞の電気生理学的応答の評価に関する。
【背景技術】
【0002】
ストレスの多い現代社会において、うつ病と診断される患者数は増加傾向にある。このため、うつの症状を改善できる、いわゆる抗うつ薬の開発が望まれている。
【0003】
この抗うつ薬としては、例えば、うつ病患者の脳内においてセロトニン等のモノアミン系神経伝達物質の量が不足しているとの知見に基づき、セロトニン濃度を上げるものや、セロトニン受容体を活性化するもの等が主に開発されている。
【0004】
また、このような抗うつ薬として利用できる有効物質をスクリーニングする方法としては、従来、例えば、いわゆる強制水泳法や尾懸垂法等によってストレスを与え、うつ症状を引き起こさせたマウス等の実験動物に対して、有効物質の候補を投与し、その抗うつ効果(うつ症状の改善効果)を調べる方法が用いられている。
【非特許文献1】Karolewicz B, Paul IA. Europian Journal of Pharmacology 415, 197−201 (2001)
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、近年、例えば、モノアミン系神経伝達物質の他にも、副腎皮質ホルモンの一種であるコルチコイド等、うつ病に関連する物質の存在が報告され、抗うつ作用を示す物質のスクリーニング対象は広範なものとなってきている。
【0006】
このような現状において、上記従来の実験動物を用いたスクリーニング方法は、多くの時間やコストを要してしまい、効率的ではない。
【0007】
本発明は、上記問題に鑑みて為されたものであって、抗うつ作用物質を迅速且つ簡便にスクリーニングできる方法を提供することをその目的の一つとする。
【課題を解決するための手段】
【0008】
上記従来の課題を解決するため、本発明の一実施形態に係る抗うつ作用物質のスクリーニング方法は、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する工程と、前記準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、前記準備された細胞に対して、うつ関連物質を接触させて、当該細胞における前記電気生理学的応答の変化を測定する対照処理工程と、前記候補物質処理工程で得られた測定結果において、前記対照処理工程で測定された前記電気生理学的応答の変化が抑制されているか否かを評価する評価工程と、を含むことを特徴とする。
【0009】
また、前記生理学的応答は、前記所定の刺激に基づく前記細胞の膜電位変化であることとしてもよい。
【0010】
また、前記細胞は、神経細胞であることとしてもよい。
【0011】
また、前記神経細胞は、動物の脳組織切片に含まれる神経細胞であることとしてもよい。
【0012】
また、前記脳組織切片は、海馬領域の切片であることとしてもよい。
【0013】
また、前記所定の刺激は電気刺激であり、前記電気生理学的応答は、当該電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化であることとしてもよい。
【0014】
また、前記ストレス関連物質による電気生理学的応答の変化は、前記電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化に基づいて評価される長期増強の程度の低下であり、前記評価工程においては、前記候補物質処理工程で前記候補物質とストレス関連物質とを接触させた細胞において、前記対照処理工程でストレス関連物質を接触させた細胞において測定された前記長期増強の程度の低下が抑制されるか否かを評価することとしてもよい。
【0015】
また、前記うつ関連物質は、ストレスホルモンであることとしてもよい。
【0016】
また、前記ストレスホルモンは、コルチコイド又はその誘導体であることとしてもよい。
【発明の効果】
【0017】
本発明によれば、うつ関連物質によって細胞に引き起こされる電気生理学的応答の変化が抑制されるか否かを評価することによって、抗うつ作用物質を迅速且つ簡便にスクリーニングできる。
【発明を実施するための最良の形態】
【0018】
以下に、本発明の一実施の形態に係る抗うつ作用物質のスクリーニング方法(以下、本スクリーニング方法)について説明する。なお、本発明に係る抗うつ作用物質のスクリーニング方法は、以下に示す例に限られるものではない。
【0019】
まず、本スクリーニング方法の概要について説明する。本スクリーニング方法は、本発明者らによって独自に見出された知見に基づいて為されたものである。
【0020】
すなわち、本発明者らは、鋭意研究を重ねた結果、例えば、いわゆる糖質コルチコイド(コルチコステロン、コルチゾール等)を、コルチコイド受容体(糖質コルチコイド受容体、鉱質コルチコイド受容体等)を有する細胞に接触させると、接触させない場合に比べて、接触後ごく短時間のうちに、当該細胞において電気生理学的応答が変化する急性作用が引き起こされることを見出した。これは、ストレス応答時に体内で糖質コルチコイドの濃度が上昇することによりうつ状態が引き起こされる現象を細胞レベルで再現したものであると考えられる。
【0021】
さらに、本発明者らは、例えば、いわゆる女性ホルモン(エストロゲン)を、糖質コルチコイドによりその電気生理学的応答が変化する、上記ホルモン受容体を有する細胞に接触させると、接触後ごく短時間のうちに、当該細胞において、糖質コルチコイドによる電気生理学的応答の変化が解消されることを見出した。これは、従来提唱されている女性ホルモンの抗うつ作用を再現したものであると考えられる。
【0022】
本スクリーニング方法は、このように、所定の刺激によって一定の電気生理学的応答を示す細胞において、うつ関連物質との接触により当該電気生理学的応答が変化する一方で、抗うつ作用物質との接触によって当該うつ関連物質による電気生理学的応答の変化が抑制される、との本発明者らによる新たな知見に基づき、当該うつ関連物質による電気生理学的応答の変化を抑制するか否かを評価することによって、スクリーニング対象となった候補物質が抗うつ作用物質であるか否かを評価するものである。
【0023】
なお、うつ関連物質としては、うつ症状に関連する生体由来の物質又はその誘導体であって、細胞の電気生理学的応答を変化させる作用を示すものであれば特に限られず用いることができ、例えば、生体がストレスを受けた場合に、分泌が亢進されたり、血液中や組織中において濃度が増減する、いわゆるストレスホルモンを用いることができる。
【0024】
具体的に、例えば、このうつ関連物質として、副腎皮質ホルモンの一種である糖質コルチコイド(glucocorticoid)や鉱質コルチコイド(mineral corticoid)等のコルチコイドを用いることができ、特に、コルチコステロンやコルチゾール等を好適に用いることができる。
【0025】
また、抗うつ作用物質とは、うつ関連物質と接触した場合に細胞において引き起こされる電気生理学的応答の変化を抑制する、すなわち、そのような変化を解消する作用を示す物質を意味し、本実施形態においては、エストラジオール、エストロン、エストリオール等のエストロゲンを含む女性ホルモンや、女性ホルモンと同様の生理学的作用を示すヘキセストロールやスチルベストロール等も含むものとする。
【0026】
次に、本スクリーニング方法の具体的内容について説明する。本スクリーニング方法は、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する細胞準備工程と、細胞準備工程において準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、細胞準備工程において準備された細胞に対して、うつ関連物質を接触させて、当該細胞における上記電気生理学的応答の変化を測定する対照処理工程と、候補物質処理工程で候補物質とうつ関連物質とを接触させた細胞において、対照処理工程でうつ関連物質を接触させた細胞において測定された電気生理学的応答の変化が抑制されるか否かを評価する評価工程と、を含む。
【0027】
細胞準備工程においては、うつ関連物質や候補物質を接触させて、その電気生理学的応答を評価する対象として用いる細胞を準備する。すなわち、この細胞準備工程においては、ヒトや動物から採取した組織や、単離した初代細胞、樹立された株化細胞、又はこれらの細胞に遺伝子組み換え操作等の人為的処理を施した細胞等を準備する。
【0028】
この細胞としては、うつ関連物質に接触した場合に、接触しない場合に比べて電気生理学的応答が変化し、且つ抗うつ作用物質と接触した場合には当該電気生理学的応答の変化が抑制される細胞であれば特に限られず用いることができ、例えば、うつ関連物質や抗うつ作用物質に対する受容体を有する細胞を用いることができる。
【0029】
具体的に、この細胞としては、例えば、脳組織その他の神経組織に含まれる神経細胞を好適に用いることができる。脳組織を用いる場合には、例えば、ラットやマウス等の小動物のものを好適に用いることができ、特に、ビブラトーム等の切片作成装置を用いて、脳海馬領域を、その長軸に対して垂直に切断した長軸横断切片の海馬アンモン角(Cornu Ammonis;CA)に含まれる錐体細胞や海馬歯状回に含まれる顆粒細胞等を好適に用いることができる。
【0030】
また、この脳組織切片としては、150〜400μm程度の範囲の厚さのものを好ましく用いることができ、特に400μm程度の厚さのものを好適に用いることができる。これは、脳組織切片の厚さが150μm程度より小さい場合には、当該脳組織切片に含まれる神経細胞のほとんどが、切片の作製時にその細胞体や樹状突起に大きな損傷を受けたものとなるため、健常組織として用いることが困難となり、また、脳組織切片の厚さが400μm程度より大きい場合には、当該脳組織切片の外部の溶液中から、当該脳組織切片の内部の神経細胞への酸素供給が不十分となり、やはり健常組織として用いることが困難となるためである。また、単離された神経細胞を用いる場合には、例えば、所定の組成の培養液中、市販のプラスチックディッシュ等の所定の培養基材上で所定期間培養された神経細胞を準備する。
【0031】
候補物質処理工程においては、細胞準備工程において準備された細胞に対して、スクリーニングの対象となった候補物質とうつ関連物質とを接触させるとともに、当該候補物質とうつ関連物質とを接触させた細胞における所定の刺激に対する電気生理学的応答を測定する。
【0032】
ここで、候補物質としては、抗うつ作用を示すか否かを評価するスクリーニングの対象とする物質であれば、特に制限されず用いることができ、例えば、動物実験において何らかの抗うつ作用を示すことが報告されている物質や、これらの誘導体等、化学構造や性質(生体又は細胞への作用等)が既知であるか否か又は天然の物質か人工的に合成されたものかを問わず、任意の化合物を用いることができる。
【0033】
この候補物質処理工程においては、まず、細胞に対して、候補物質とうつ関連物質とを同時に接触させる。具体的に、例えば、所定の容器内において、組織切片や単離細胞を、候補物質とうつ関連物質との両方を含む溶液(以下、刺激溶液)中に所定時間浸漬し、又はガラスピペット等を用いて組織切片に含まれる細胞や単離細胞の近傍に(すなわち、局所的に)刺激溶液を噴射すること等により、当該組織切片に含まれる細胞や単離細胞に当該候補物質とうつ関連物質とを接触させる。この候補物質やうつ関連物質を細胞に接触させる時間は、目的に応じて適宜選択することができるが、例えば、遺伝子発現を介した比較的緩除な応答を評価する場合には数時間(例えば、3時間)以上が好ましく、遺伝子発現を介さない急性の応答を評価する場合には数十分(例えば、30分程度)が好ましい。
【0034】
この刺激溶液を用いる場合、当該刺激溶液中の候補物質の濃度については特に制限はなく、適宜選択することができるが、例えば、当該候補物質が生体内に存在する物質である場合には、当該生体内における濃度(いわゆる生理的濃度)付近を好適に用いることができる。また、うつ関連物質についても、その種類に応じて適切な濃度を適宜選択することができるが、例えば、コルチコステロンを用いる場合には、比較的高い濃度が好ましく、1μM以上を好適に用いることができる。コルチコステロンは、比較的低い濃度では、うつ関連物質としての作用に比べて、例えば、神経栄養因子としての作用を強く示す傾向があるためである。また、これら候補物質やうつ関連物質の濃度は、結合する受容体との親和性に基づいて決定することもでき、例えば、受容体との解離定数(いわゆるKd値)等に近い濃度等を好適に用いることもできる。
【0035】
また、この刺激溶液及び以下に示す他の溶液は、例えば、所定のポンプ装置等を用いて、組織切片や単離細胞を保持する所定の容器内を循環(灌流)させてもよいし、循環させることなく、当該所定容器内にバッチ方式で保持してもよい。
【0036】
なお、候補物質とうつ関連物質とを溶解する溶媒としては、細胞の生存状態を維持できるものであれば特に制限されず用いることができ、例えば、適切な浸透圧を示すよう塩類(ナトリウムやカリウム等)の組成や濃度等を調製し、又は細胞の代謝に必要な栄養成分(グルコースやアミノ酸類等)の組成や濃度等を調製した水溶液を好適に用いることができる。
【0037】
次に、この候補物質処理工程においては、候補物質とうつ関連物質とを接触させた細胞に対して、所定の刺激を与えるとともに、当該細胞の当該刺激に対する電気生理学的応答を測定する。
【0038】
ここで、細胞に対する刺激方法としては、細胞の電気生理学的応答を引き起こすものであれば特に限られず用いることができ、例えば、電気刺激や、所定の物質と接触させる化学的刺激等、反復して行うことのできる方法を好適に用いることができる。
【0039】
具体的に、神経細胞を用いる場合には、例えば、細胞にガラス電極を刺し込んで行う電気刺激や、ガラスピペットを用いて細胞近傍において神経伝達物質を噴射する局所的刺激等を用いることができ、特に、脳組織切片を用いる場合には、修練をあまり必要とせず、安定して実施できるという観点から、当該脳組織切片に含まれる神経細胞に投射するシナプス前線維に対する電気刺激を好適に用いることができる。
【0040】
また、電気生理学的応答としては、細胞膜の電位の変化等、所定の刺激に対して、生存している細胞が示す電気的特性であれば特に限られず測定することができ、例えば、脳組織切片を用いる場合には、シナプス前線維への電気刺激に対するシナプス後電位や、その変化等を測定することができる。
【0041】
具体的に、脳組織切片を用いる場合には、例えば、電気生理学的応答として、所定頻度の電気刺激に対する、脳組織切片に含まれる神経細胞に係る興奮性シナプス後電位(Excitatory PostSynaptic Potential;EPSP)の変化特性を表す、いわゆる長期増強(Long−Term Potentiation)や長期抑制(Long−Term Depression)等を測定することができる。
【0042】
なお、電気生理学的応答として長期増強を測定する場合において、長期増強を誘発する方法に特に制限はなく、適宜選択することができ、例えば、神経細胞に投射しているシナプス前線維に対する様々な高頻度電気刺激パターンを用いることができるが、特に、比較的簡便で再現性がよいという点および、過去の報告で実際に使用された頻度が高いという点で、1秒間に100回という高頻度刺激方法を好適に用いることができる。
【0043】
また、電気生理学的応答の測定方法としては、例えば、ガラス電極を細胞に刺し込むガラス電極刺入法や、ガラス電極を用いたパッチクランプ法等、単一の細胞の細胞内電位を測定する方法を用いることができる。
【0044】
具体的に、脳組織切片を用いる場合には、例えば、複数の電極を有する多電極測定装置やガラス電極等を用いて、当該脳組織切片に含まれる神経細胞の集合電位を測定する方法等を用いることができ、特に、効率よくシナプス前線維を刺激でき、シナプス後電位を高い感度で測定できるガラス電極を用いた集合電位を測定する方法を好適に用いることができる。なお、ガラス電極による測定方法として、単一電極計測装置を用いて集合電位を測定する方法を選択した場合、単一電極計測装置は適宜作製したものであってもよいし、市販品でもよい。
【0045】
また、刺激電極と記録電極との距離については特に制限はなく、目的に応じて適宜選択することができるが、例えば、ラット脳海馬を用いる場合には、300〜400μm程度の範囲を好適な電極間距離として用いることができ、特に300μmが好適である。これは、刺激電極と記録電極とを海馬CA1領域内に配置する必要があるとともに、当該電極間距離がこの範囲よりも小さい場合には、例えば、測定結果が刺激電極そのものの影響を受ける場合があるためである。
【0046】
対照処理工程においては、細胞準備工程において準備された細胞に対して、候補物質処理工程において細胞に接触させたものと同じうつ関連物質を接触させるとともに、当該うつ関連物質を接触させた細胞における所定の刺激に対する電気生理学的応答を測定する。
【0047】
すなわち、この対照処理工程においては、うつ関連物質に接触しない場合には、所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触した場合には、当該電気生理学的応答が変化するという、細胞準備工程において準備された細胞における、うつ関連物質による電気生理学的応答の変化を確認する。
【0048】
具体的に、この対照処理工程においては、例えば、所定の容器内において、組織切片や単離細胞を、候補物質処理工程において用いられた刺激溶液から候補物質のみを除いた(すなわち、候補物質を含まず、当該刺激溶液と同じ濃度のうつ関連物質を含む)溶液(以下、対照溶液)中に所定時間浸漬し、又はガラスピペット等を用いて、当該対照溶液を組織切片に含まれる細胞や単離細胞の近傍に噴射すること等により、当該組織切片に含まれる細胞や単離細胞に当該うつ関連物質を接触させる。
【0049】
そして、この対照処理工程においては、上述の候補物質処理工程における場合と同様に、うつ関連物質を接触させた細胞に対して、所定の刺激を与えるとともに、当該細胞の当該刺激に対する電気生理学的応答を測定する。
【0050】
また、この対照処理工程においては、候補物質、うつ関連物質のいずれをも接触させていない細胞について、その電気生理学的応答を測定することとしてもよい。具体的に、この対照処理工程においては、例えば、候補物質処理工程において用いられた刺激溶液から候補物質とうつ関連物質との両方を除いた(すなわち、候補物質、うつ関連物質のいずれをも含まない溶媒のみからなる)溶液中に所定時間浸漬し、又はガラスピペット等を用いて、当該溶液を組織切片に含まれる細胞や単離細胞の近傍に噴射した後、当該組織切片に含まれる細胞や単離細胞について電気生理学的応答をさらに測定することとしてもよい。
【0051】
評価工程においては、候補物質処理工程における電気生理学的応答の測定結果と、対照処理工程における電気生理学的応答の測定結果と、を比較して、うつ関連物質を接触させた細胞における電気生理学的応答の変化が、候補物質とうつ関連物質との両方を接触させた細胞において抑制されるか否かを評価する。
【0052】
すなわち、この評価工程においては、例えば、うつ関連物質を接触させた細胞における電気生理学的応答の程度と、接触させない細胞における電気生理学的応答の程度と、の差異が、候補物質とうつ関連物質との両方を接触させた細胞においては低減又は解消されるか否か、すなわち、候補物質又はうつ関連物質のいずれも接触させない場合により近い電気生理学的応答を示すようになるか否かを評価する。
【0053】
具体的に、例えば、候補物質又はうつ関連物質のいずれも接触させない場合に比べて、うつ関連物質を接触させた場合に細胞膜電位が所定量だけ変化する場合には、候補物質とうつ関連物質との両方を接触させた場合に、当該所定の変化量が低減又は解消するか否か、すなわち、細胞膜電位が、候補物質又はうつ関連物質のいずれも接触させない場合の細胞膜電位に回復するか否かを評価する。
【0054】
また、例えば、脳組織切片を用いて長期増強を測定した場合であって、候補物質又はうつ関連物質のいずれも接触させない場合に比べて、うつ関連物質を接触させると長期増強の程度が所定量だけ低下する場合には、候補物質とうつ関連物質との両方を接触させることによって当該長期増強の程度の低下が抑制され又は解消されるか否か、すなわち、長期増強の程度が回復するか否かを評価する。
【0055】
また、本スクリーニング方法においては、候補物質とうつ関連物質との両方を接触させる候補物質処理を施す候補物質処理グループと、候補物質とは接触させず、うつ関連物質と接触させる対照処理を施す対照処理グループと、候補物質又はうつ関連物質のいずれも接触させない無処理グループと、を準備することとしてもよい。
【0056】
すなわち、この場合、例えば、細胞準備工程において、マウスの1個体から採取した脳組織から複数の脳組織切片を作製した場合には、一部の脳組織切片には候補物質処理を施し、他の一部の脳組織切片には対照処理を施し、さらに他の一部の脳組織切片には候補物質処理又は対照処理のいずれも施さず、評価工程において、これら3つのグループの脳組織切片について、電気生理学的応答の測定結果を互いに比較し、評価する。
【0057】
また、単離細胞を用いる場合には、例えば、細胞準備工程において、動物や組織の由来等に基づく性質や、継代数、培養期間等の培養条件等が同一となるよう培養細胞を準備し、当該培養細胞のうち、一部の培養細胞には候補物質処理を施し、他の一部の培養細胞には対照処理を施し、さらに他の一部の培養細胞には候補物質処理又は対照処理のいずも施さず、評価工程において、これら3つのグループの培養細胞について、電気生理学的応答の測定結果を互いに比較し、評価する。
【0058】
次に、本スクリーニング方法を用いて抗うつ作用物質の評価を行った具体例について説明する。本実施例に係る細胞準備工程においては、ビブラトーム(DSK ZERO1、堂阪イーエム株式会社製)を用いて、成獣ラットの脳海馬を、その長軸に対して垂直に切断し、厚さ400μmの長軸横断切片を複数作製した。
【0059】
本実施例においては、この得られた複数の海馬切片のうち、一部の海馬切片を候補物質処理グループとして、他の一部の海馬切片を対照処理グループとして、さらに他の一部の海馬切片を無処理グループとして、それぞれ準備した。
【0060】
これらの海馬切片は、酸素・二酸化炭素混合ガス(95%酸素ガス、5%二酸化炭素ガス)で十分に飽和させた人工脳脊髄液中に浸漬し、当該海馬切片に上部から当該混合ガスを吹き付けながら室温で1時間30分以上静置した後に、後述する電気生理学的応答の測定に用いた。
【0061】
なお、この人工脳脊髄液としては、124mMのNaCl、1.25mMのNaH2PO4・2H2O、5mMのKCl、2mMのMgSO4・7H2O、2mMのCaCl2、22mMのNaHCO3、10mMのGlucoseを含む水溶液を用いた。
【0062】
また、この細胞準備工程においては、作製した海馬切片を、所定の測定用チャンバー内に静置し、当該海馬切片の周囲に上記混合ガスで十分に飽和させた人工脳脊髄液を満たして、所定の単一電極測定装置に装着した。この単一電極装置としては、キャピラリーと銀/塩化銀電極とを組み合わせたガラス電極(Sutter Instrument社製)と、所定の増幅器(アンプ)(DAM80、World Precision Instrument社製)と、を備えたものを用いた。
【0063】
すなわち、各海馬切片について、所定の双極電極を刺激電極として海馬切片の海馬CA1領域のシナプス前線維に配置するとともに、上記ガラス電極を測定電極としてシナプス後細胞の樹状突起上に配置した。
【0064】
なお、以下の工程においては、海馬切片を載置したチャンバー内に、上記混合ガスで十分に飽和させた人工脳脊髄液を流速毎分約2mlで灌流しながら全ての処理及び測定を行った。
【0065】
また、この細胞準備工程においては、刺激電極を用いて海馬切片のCA1領域のシナプス前線維を20秒間隔で繰り返し刺激するとともに、測定電極を用いて、当該電気刺激によって誘発される興奮性シナプス後電位を集合電位として約30分間に亘って記録した。
【0066】
ここで、図1には、上記20秒間隔で行う電気刺激のうち1回の刺激に対して記録される集合電位の変化を表す波形の一例を示す。図1において、横軸は測定時間、縦軸は集合電位を示す。
【0067】
図1に示すように、記録される集合電位は、波形の高さ(すなわち、ベース値と、頂点の極値との差分)の絶対値Hとして測定されるが、当該集合電位は集合活動電位であるため、後述するような高頻度刺激を与えた後は正確な値を示さない場合がある。そこで、図1に示す波形のうち、刺激によって集合電位が最も急激に変化している部分Mの勾配(すなわち、集合電位波形の測定時間が早い側(左側)の最大勾配)の大きさ(以下、集合電位最大勾配値)を評価することとした。
【0068】
上記細胞準備工程においては、測定される集合電位最大勾配値が安定したことを確認した後、負荷する電気刺激の大きさを弱い強度から徐々に増加させつつ、集合電位最大勾配値を測定し、測定される集合電位最大勾配値が飽和した(すなわち一定となった)時点で、当該飽和した集合電位最大勾配値を最大値(100%)とした場合に、この最大値に対して50%の値になるように、刺激電極から海馬切片に負荷する電気刺激の強度を設定した。
【0069】
候補物質処理工程においては、候補物質処理グループに係る海馬切片について、細胞準備工程において設定した電気刺激強度を用いて、上記の一定間隔の反復刺激方法で20分間に亘って集合電位を記録した後、灌流液を、ジメチルスルフォオキシド(DiMethyl SulfOxide;DMSO)に溶解したコルチコステロン(うつ関連物質)を終濃度1μMで含むとともに、エストラジオール(抗うつ作用物質)を終濃度1nNで含む人工脳脊髄溶液(すなわち、刺激溶液)に交換し、さらに集合電位を30分間記録し続けた。
【0070】
そして、さらに集合電位の記録を続けながら、海馬切片に対して、1秒間に100回(すなわち、100Hz)の高頻度刺激を1秒間与え、長期増強を誘発し、その後さらに60分間に亘って集合電位を記録し続けた。
【0071】
対照処理工程においては、候補物質処理工程と同様に、対照処理グループに係る海馬切片について、細胞準備工程において設定した電気刺激強度を用いて、上記の20秒間隔の刺激方法で20分間に亘って集合電位を応答を記録した後、灌流液を、エストラジオールを含まず、ジメチルスルフォオキシド(DiMethyl SulfOxide;DMSO)に溶解したコルチコステロンを最終濃度1μMで含む人工脳脊髄溶液(すなわち、対照溶液)に交換し、さらに集合電位を30分間記録し、さらに100Hzの高頻度刺激を1秒間与えて誘発された長期増強を60分間に亘って集合電位を記録し続けた。
【0072】
また、この対照処理工程においては、無処理グループに係る海馬切片についても、細胞準備工程において設定した電気刺激強度を用いて、上記の20秒間隔の刺激方法で20分間に亘って集合電位を記録した後、灌流液を、コルチコステロン又はエストラジオールのいずれも含まず、刺激溶液及び対照溶液と同じ量のDMSOを含む人工脳脊髄溶液に交換し、さらに集合電位を30分間記録し、さらに100Hzの高頻度刺激を1秒間与えて誘発された長期増強を60分間に亘って集合電位を記録し続けた。
【0073】
評価工程においては、候補物質処理工程における集合電位の測定結果と、対照処理工程における集合電位の測定結果と、を解析し、互いに比較し評価した。なお、この評価肯定においては、上記20分間に亘って測定された各集合電位の最大勾配値を平均して、当該複数の最大勾配値の平均値を基準勾配値として100%と設定し、各工程において測定された集合電位最大勾配値の当該基準勾配値に対する割合を評価した。
【0074】
図2に、対照処理工程において、無処理グループと対照処理グループとについて、高頻度刺激により引き起こされた興奮性シナプス後電位(以下、EPSP)の長期増強を測定した結果を示す。
【0075】
図2において、横軸は測定時間(分)、縦軸は、上記100%と設定した基準勾配値に対する、各測定時間において測定された集合電位の最大勾配値の割合(%)を示す。白抜き四角印(control)は、無処理グループに係る測定結果を示し、黒塗り三角印(CORT)は、対照処理グループに係る測定結果を示す。図2における測定時間「0」の時点から100Hzの電気刺激を1秒間することにより長期増強を誘発した。
【0076】
図2に示すように、無処理グループに係る海馬切片、対照処理グループに係る海馬切片のいずれにおいても、測定時間「0」の時点から海馬CA1におけるEPSP反応の増強が観察された。
【0077】
また、無処理グループに係る海馬切片(白抜き四角印)においては、高頻度刺激後60分(すなわち、図2において測定時間60分)の時点で、EPSP反応は130%程度に増強した。これに対し、高頻度刺激前に30分間コルチコステロン(1μM)を含む対照溶液を灌流した対照処理グループに係る海馬切片(黒塗り三角印)においては、高頻度刺激後60分の時点で、EPSP反応は、無処理グループの海馬切片に比べて減少し、110%程度となった。
【0078】
すなわち、本実施例で用いた海馬切片に含まれる神経細胞をコルチコステロンに接触させることによって、長期増強の程度(EPSP反応の大きさ(%))が約20%低下した。
【0079】
図3には、候補物質処理工程において、候補物質処理グループについて、高頻度刺激により引き起こされたEPSPの長期増強を測定した結果を、図2に示す測定結果と対比させて示す。図3において、黒塗り丸印は、候補物質処理グループに係る測定結果を示す。
【0080】
図3に示すように、高頻度刺激前に30分間に亘って(すなわち、図3において測定時間−30分から0分まで)コルチコステロン(1μM)とエストラジオール(1nM)との両方を含む刺激溶液を灌流した候補物質処理グループに係る海馬切片(黒塗り丸印)においては、高頻度刺激後60分の時点におけるEPSP反応が、無処理グループのEPSP反応と比べてほとんど差がなく、130%程度となった。
【0081】
すなわち、対照処理グループに係る海馬切片において確認された、コルチコステロンのみを接触させた場合の長期増強の程度の低下は、コルチコステロンとエストラジオールとを同時に接触させた候補物質処理グループに係る海馬切片においては、略完全に抑制(すなわち、解消)され、当該候補物質処理グループに係る海馬切片における長期増強の程度は、無処理グループに係る海馬切片と同程度まで回復した。
【図面の簡単な説明】
【0082】
【図1】本発明の一実施形態に係るスクリーニング方法において測定される集合電位の波形の一例を示す説明図である。
【図2】本発明の一実施形態に係るスクリーニング方法を用いて測定されたうつ関連物質による長期増強の程度を低下させる効果の一例を示すグラフである。
【図3】本発明の一実施形態に係るスクリーニング方法を用いて測定された抗うつ作用物質による長期増強の程度を回復させる効果の一例を示すグラフである。
【特許請求の範囲】
【請求項1】
抗うつ作用物質のスクリーニング方法であって、
所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する工程と、
前記準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、
前記準備された細胞に対して、うつ関連物質を接触させて、当該細胞における前記電気生理学的応答の変化を測定する対照処理工程と、
前記候補物質処理工程で得られた測定結果において、前記対照処理工程で測定された前記電気生理学的応答の変化が抑制されているか否かを評価する評価工程と、を含む
ことを特徴とする抗うつ作用物質スクリーニング方法。
【請求項2】
前記生理学的応答は、前記所定の刺激に基づく前記細胞の膜電位変化である
ことを特徴とする請求項1に記載の抗うつ作用物質スクリーニング方法。
【請求項3】
前記細胞は、神経細胞である
ことを特徴とする請求項1又は2に記載の抗うつ作用物質スクリーニング方法。
【請求項4】
前記神経細胞は、動物の脳組織切片に含まれる神経細胞である
ことを特徴とする請求項3に記載の抗うつ作用物質スクリーニング方法。
【請求項5】
前記脳組織切片は、海馬領域の切片である
ことを特徴とする請求項4に記載の抗うつ作用物質スクリーニング方法。
【請求項6】
前記所定の刺激は電気刺激であり、前記電気生理学的応答は、当該電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化である
ことを特徴とする請求項3乃至5のいずれか一項に記載の抗うつ作用物質スクリーニング方法。
【請求項7】
前記ストレス関連物質による電気生理学的応答の変化は、前記電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化に基づいて評価される長期増強の程度の低下であり、
前記評価工程においては、前記候補物質処理工程で前記候補物質とストレス関連物質とを接触させた細胞において、前記対照処理工程でストレス関連物質を接触させた細胞において測定された前記長期増強の程度の低下が抑制されるか否かを評価する
ことを特徴とする請求項6に記載の抗うつ作用物質スクリーニング方法。
【請求項8】
前記うつ関連物質は、ストレスホルモンである
ことを特徴とする請求項1乃至7のいずれか一項に記載の抗うつ作用物質スクリーニング方法。
【請求項9】
前記ストレスホルモンは、コルチコイド又はその誘導体である
ことを特徴とする請求項8に記載の抗うつ作用物質スクリーニング方法。
【請求項1】
抗うつ作用物質のスクリーニング方法であって、
所定の刺激によって一定の電気生理学的応答を示し、うつ関連物質と接触することによって当該電気生理学的応答が変化する細胞を準備する工程と、
前記準備された細胞に対して、スクリーニングの対象となった候補物質と、うつ関連物質と、を接触させて、当該細胞における電気生理学的応答を測定する候補物質処理工程と、
前記準備された細胞に対して、うつ関連物質を接触させて、当該細胞における前記電気生理学的応答の変化を測定する対照処理工程と、
前記候補物質処理工程で得られた測定結果において、前記対照処理工程で測定された前記電気生理学的応答の変化が抑制されているか否かを評価する評価工程と、を含む
ことを特徴とする抗うつ作用物質スクリーニング方法。
【請求項2】
前記生理学的応答は、前記所定の刺激に基づく前記細胞の膜電位変化である
ことを特徴とする請求項1に記載の抗うつ作用物質スクリーニング方法。
【請求項3】
前記細胞は、神経細胞である
ことを特徴とする請求項1又は2に記載の抗うつ作用物質スクリーニング方法。
【請求項4】
前記神経細胞は、動物の脳組織切片に含まれる神経細胞である
ことを特徴とする請求項3に記載の抗うつ作用物質スクリーニング方法。
【請求項5】
前記脳組織切片は、海馬領域の切片である
ことを特徴とする請求項4に記載の抗うつ作用物質スクリーニング方法。
【請求項6】
前記所定の刺激は電気刺激であり、前記電気生理学的応答は、当該電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化である
ことを特徴とする請求項3乃至5のいずれか一項に記載の抗うつ作用物質スクリーニング方法。
【請求項7】
前記ストレス関連物質による電気生理学的応答の変化は、前記電気刺激に基づく前記神経細胞に係る興奮性シナプス後電位の変化に基づいて評価される長期増強の程度の低下であり、
前記評価工程においては、前記候補物質処理工程で前記候補物質とストレス関連物質とを接触させた細胞において、前記対照処理工程でストレス関連物質を接触させた細胞において測定された前記長期増強の程度の低下が抑制されるか否かを評価する
ことを特徴とする請求項6に記載の抗うつ作用物質スクリーニング方法。
【請求項8】
前記うつ関連物質は、ストレスホルモンである
ことを特徴とする請求項1乃至7のいずれか一項に記載の抗うつ作用物質スクリーニング方法。
【請求項9】
前記ストレスホルモンは、コルチコイド又はその誘導体である
ことを特徴とする請求項8に記載の抗うつ作用物質スクリーニング方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2006−329672(P2006−329672A)
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【出願番号】特願2005−149864(P2005−149864)
【出願日】平成17年5月23日(2005.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 研究集会名 日本生物物理学会第42回年会 主催者 日本生物物理学会 開催日 2004年12月13日、14日、15日 研究集会名 平成16年度大学院理学系研究科物理学専攻(修士論文)発表会 主催者 国立大学法人東京大学 開催日 2005年1月24日
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【出願日】平成17年5月23日(2005.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 研究集会名 日本生物物理学会第42回年会 主催者 日本生物物理学会 開催日 2004年12月13日、14日、15日 研究集会名 平成16年度大学院理学系研究科物理学専攻(修士論文)発表会 主催者 国立大学法人東京大学 開催日 2005年1月24日
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

