抗ウィルス剤
【課題】エンベロープを有するウィルスに対して有効であり、かつ細胞毒性の少ない抗ウィルス剤を提供する。
【解決手段】抗ウィルス活性を有するフェノキサジン誘導体のうち、下記式1

で表される3−アミノフェノキサジン−2−オン誘導体又はその薬理学的に許容される塩若しくはエステルを有効成分として含有し、エンベロープを有するウィルスに対して有効である抗ウィルス剤。
【解決手段】抗ウィルス活性を有するフェノキサジン誘導体のうち、下記式1

で表される3−アミノフェノキサジン−2−オン誘導体又はその薬理学的に許容される塩若しくはエステルを有効成分として含有し、エンベロープを有するウィルスに対して有効である抗ウィルス剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒト又は動物のためのウィルス性疾患の治療、発症予防、感染予防に有用であり、エンベロープを有するウィルスに対して有効である抗ウィルス剤に関する。
【背景技術】
【0002】
エンベロープを有するウィルスには、例えば単純ヘルペスウィルス(以下、「HSV」とする。)及びヒトサイトメガロウィルス(以下、「HCMV」とする。)がある。
【0003】
HSVは、神経節細胞に潜伏感染するヘルペスウィルスファミリーの一つであり、日和見病原体である。抗HSV剤としてアシクロビル及びガンシクロビルが用いられており、特にアシクロビルが多用されている。しかし、アシクロビル耐性HSVが増加しているため、他の有効な薬剤が必要とされている。
【0004】
HCMVは、リンパ芽球や繊維芽細胞などに潜伏感染するヘルペスウィルスファミリーの一つであり、HSVと同様に日和見病原体である。HCMVは、とりわけ免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者に、日和見間質性肺炎、網膜炎及び輸血後症候群等を起因し、そして死亡に到らしめる。抗HCMV剤として、ガンシクロビルが用いられている。ガンシクロビルは、ウィルスのDNAポリメラーゼを阻害しウィルスの増殖を抑える。しかし、ガンシクロビルは宿主細胞のDNAポリメラーゼにも反応しうるために、骨髄抑制を含む副作用を有する。一方、HSVに対して用いられているアシクロビルは、HCMVに対して用いることができない。HCMVはHSVと異なり、アシクロビルの作用対象となるチミジンキナーゼを有さないためである。
【0005】
これまで、エンベロープを有する広範囲のウィルスに対して効果がある抗ウィルス剤は知られていない。
抗ウィルス活性を示す薬剤として、フェノキサジン誘導体である、2−アミノフェノキサジン−3−オン誘導体及び3−アミノフェノキサジン−2−オン誘導体が知られている(例えば、特許文献1を参照)。上記特許文献において、上記誘導体はウィルスに対して有効であることが述べられているが、副作用の問題について述べられていない。
【0006】
【特許文献1】特許第3957188号明細書
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、エンベロープを有するウィルスに対して有効であり、かつ細胞毒性の少ない抗ウィルス剤を提供する。
【課題を解決するための手段】
【0008】
本発明は、抗ウィルス活性を有するフェノキサジン誘導体のうち、下記式1で表される3−アミノフェノキサジン−2−オン誘導体又はその薬理学的に許容される塩若しくはエステルを有効成分として含有し、エンベロープを有するウィルスに対して有効である抗ウィルス剤を提供する。なお、以下「本発明の抗ウィルス剤」とはエンベロープを有するウィルスに対して有効である抗ウィルス剤を言う。
【0009】
式1
【化2】

【発明の効果】
【0010】
本発明の抗ウィルス剤は、エンベロープを有するウィルスに対して有効である。更に、本発明の抗ウィルス剤は細胞毒性が弱いために副作用が少ない。
【発明を実施するための最良の形態】
【0011】
本発明の抗ウィルス剤は、下記式1で表される3−アミノフェノキサジン−2−オン誘導体又はその薬理学的に許容される塩若しくはエステルを有効成分として含む。ここで式1中、Rは、炭素原子数1〜4の低級アルキル基、炭素原子数1〜4のアシル基及び炭素原子数1〜4のアシルオキシ基から成る群から任意に選択される。好ましくは、Rがメチル基、エチル基、プロピル基、イソプロピル基、ヒドロキシメチル基、ヒドロキシエチル基、メトキシ基、エトキシ基、メトキシメチル基、エトキシメチル基から選択される。さらに好ましくは、Rがメチル基である。Rがメチル基のものは、3−アミノ−1,4α−ジヒドロ−4α−8−ジメチル−2H−フェノキサジン−2−オンである。
【0012】
式1
【化3】

【0013】
本発明でいうエンベロープを有するウィルスの種は特に限定されないが、以下に示す分類に含まれるウィルスを包含する。以下、本発明でいうエンベロープを有するウィルスについて説明する。
【0014】
ウィルスは、エンベロープの有無により二分される。エンベロープを有するウィルスは、該ウィルスが有する核酸の性状、すなわち核酸がDNAかRNAかにより分けられる。夫々、DNAウィルス及びRNAウィルスと呼ばれる。
【0015】
1)DNAウィルスではDNAが2本鎖として存在する。DNAウィルスには、単純ヘルペスウィルス1型(Herpes simplex virus 1)、単純ヘルペスウィルス2型(Herpes simplex virus 2)、水痘帯状疱疹ウィルス(varicella-zoster virus)を含むαヘルペスウィルス亜科、サイトメガロウィルス(cytomegalo virus)、ヒトヘルペスウィルス6(human herpes virus 6)、ヒトヘルペスウィルス7(human herpes virus 7)を含むβヘルペスウィルス亜科、EBウィルス(Epstein-Barr virus)、ヒトヘルペスウィルス8(human herpes virus 8)などを含むγヘルペスウィルス亜科などから構成されるヘルペスウィルス科(Herpesviridae)、ワクチニアウィルス(vaccinia virus)、伝染性軟属腫ウィルス(Molluscum contagiosum virus)などを含むポックスウィルス科(Poxviridae)、及びイリドウィルス科(Iridoviridae)などが含まれる。
【0016】
2)RNAウィルスには1本鎖RNAウィルス及びRNA−DNAウィルスが含まれる。このうち、1本鎖RNAウィルスにはプラス鎖RNAウィルス及びマイナス鎖RNAウィルスに分けられる。プラス鎖RNAウィルスには、シンドビスウィルス(Sindbis virus)、風疹ウィルス(Rubella virus)などを含むトガウィルス科(Toga viridae)、日本脳炎ウィルス(Japanese encephalitis virus)、黄熱ウィルス(Yellow fever virus)、C型肝炎ウィルス(Hepatitis C virus)などを含むフラビウィルス科(Flaviviridae)、及びコロナウィルス科(Coronaviridae)などが含まれる。マイナス鎖RNAウィルスには、狂犬病ウィルス(Rabies virus)、水疱性口内炎ウィルス(Vesicular stomatitis virus)などを含むラブドウィルス科(Rhabdoviridae)、エボラウィルス(Ebola virus)、マルブルグウィルス(Marburg virus)などを含むフィロウィルス科(Filoviridae)、センダイウィルス(Hemagglutinating virus of Japan)、はしかウィルス(Measles virus)、RSウィルス(RS virus)、おたふくかぜウィルス(Mumpus virus)などを含むパラミキソウィルス科(Paramyxoviridae)、インフルエンザウィルス(Human influenza virus) などを含むオルソミキソウィルス科(Orthomyxoviridae)、腎症候性出血熱ウィルス(Hantaan virus)などを含むブニヤウィルス科(Bunyaviridae)、及びリンパ性脈絡髄膜炎ウィルス(Lymphocytic choriomeningitis virus)などを含むアレナウィルス科(Arenaviridae)などが含まれる。RNA−DNAウィルスには、ヒトT細胞白血病ウィルスI型(Human T-cell leukemia virus type I)、ヒト後天性免疫不全ウィルス(Human immunodeficiency syndrome virus)などを含むレトロウィルス科(Retroviridae)などが含まれる。
【0017】
本発明の抗ウィルス剤は、エンベロープを有するウィルスに対して有効であり、特に、二本鎖DNAを有しかつエンベロープを有するウィルスに対して有効である。特に、ヘルペスウィルス科に属するウィルスに有効である。さらに特には、HCMV並びにHSVのうち1型及び2型(以下、夫々「HSV−1」及び「HSV−2」という。)に対して有効である。
【0018】
本発明の抗ウィルス剤によるウィルスの感染を阻止する作用機構は明らかではないが、ウィルスエンベロープに作用することでウィルスの増殖、複製を阻止することによると考えられる。
【0019】
本発明の抗ウィルス剤は、ウィルスの感染を阻害する効果がある。本発明でいう「抗ウィルス剤」は、ウィルス性疾患の治療、発症予防、感染予防の目的に使用される薬剤を包含する。
【0020】
更に、本発明の抗ウィルス剤は、他の薬剤とのセットで用いられる。該薬剤として、本発明の抗ウィルス剤以外の抗ウィルス剤、免疫抑制剤、抗癌剤、抗HIV薬、抗生物質、抗真菌薬、酵素剤、酵素阻害剤、抗酸化剤、脂質取り込み阻害剤、ホルモン剤、抗炎症剤、免疫賦活剤、プロテアーゼ阻害剤、逆転写酵素阻害剤、ヒト成長ホルモン、ステロイド剤、血管拡張剤、アンジオテンシン変換酵素阻害剤、アンジオテンシン受容体拮抗剤、平滑筋細胞の増殖・遊走阻害剤、血小板凝集阻害剤、抗凝固剤、ケミカルメデイエーターの遊離抑制剤、血管内皮細胞の増殖または抑制剤、アルドース還元酵素阻害剤、メサンギウム細胞増殖阻害剤、リポキシゲナーゼ阻害剤、メイラード反応抑制剤、アミロイドーシス阻害剤、NOS阻害剤、AGEs阻害剤あるいはラジカルスカベンジャーなどが挙げられる。特に、本発明の抗ウィルス剤は、免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者に対する治療のために用いられる、免疫抑制剤、抗癌剤及び抗HIV薬とのセット(組み合わせ)で用いられうる。
【0021】
下記実施例1及び2の結果より、3−アミノ−1,4α−ジヒドロ−4α−8−ジメチル−2H−フェノキサジン−2−オン(以下、「Phx−2」という。)は、その抗ウィルス活性が2−アミノ−4,4α−ジヒドロ−4α−7−ジメチル−3H−フェノキサジン−3−オン(以下、「Phx−1」という。)及び2−アミノ−フェノキサジン−3−オン(以下、「Phx−3」という。)よりも高く、かつその細胞毒性がPhx−1及びPhx−3よりも低い。従って、Phx−2はエンベロープを有するウィルスに対して有効な抗ウィルス剤である。このため、ヒトサイトメガロウィルス及び単純ヘルペスウィルス等の日和見病原体の脅威にさらされる可能性が高い免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者に対して有効である。従って、Phx−2はこれら患者に対して用いられる免疫抑制剤、抗癌剤又は抗HIV薬とセットの医薬品として用いられうる。
【0022】
現在、抗ウィルス剤として用いられているガンシクロビル及びアシクロビルは、HCMVやHSV−1のようなヘルペスウィルスファミリーに対して低濃度で強力な抗ウィルス活性を示す。
ガンシクロビルは、インビトロにおいて約2.5μg/mlの濃度でHCMVの複製を阻害することが示されている(Jarvis MA, Nelson JA. Human cytomegalovirus persistence and latency in endothelial cells and macrophages. Curr Opin Microbiol. 2002年; 第5巻: 第403-407頁)。本試験で用いたPhx−2、Phx−1及びPhx−3はいずれも抗ウィルス活性を有する。なかでも特にPhx−2は、ガンシクロビルよりも低濃度で効果を有し、かつ細胞毒性が低いため、副作用の少ない抗ウィルス剤として有効である。特にHCMVに対して有効である。
また、アシクロビルのHSV−1に対する抗ウィルス活性は約0.15μg/mlであり(Tang J, Colacino JM, Larsen SH, Spizer W. Virucidal activity of hypericin against enveloped and non-enveloped DNA and RNA viruses. Antiviral Res. 1990年; 第13巻: 第313-326頁)、このデータと比較するとPhx−2のHSV−1に対する抗ウィルス活性はアシクロビルより弱いものの、HSV−1の増殖を6.1μg/mlの濃度で阻害する。Phx−2はHSV−2の増殖も2.4μg/mlで阻害した。従って、これらの結果は、Phx−2がHSV−1及びHSV−2のいずれに対しても抗ウィルス活性を有することを示す。
【0023】
下記実施例3の結果より、Phx−2は、直接的にHCMVを不活性化する。
他方、ポリオウィルス及びブタパルボウィルスの複製活性について、宿主細胞への感染前にPhx−1又はPhx−3でこれらウィルスを処理し、その後感染させても複製活性は阻害されなかったが、宿主細胞がこれらフェノキサジン誘導体によりあらかじめ処理された場合は複製活性が阻害された、ということが以前報告されている(Iwata A, Yamaguchi T, Sato K, Yoshitake N, Tomoda A. Suppression of proliferation of poliovirus and porcine parvovirus by novel phenoxazines, 2-amino-4,4α-dihydro-4α-7-dimethyl-3H-phenoxazine-3-one, a novel antitumor agent. Biorg Med Chem Lett. 2002年; 第11巻: 第1057-1058頁)。
これらから、Phx−2によるHCMV活性の阻害メカニズムはフェノキサジン誘導体がウィルスエンベロープを構成する脂質二重層の撹乱を引き起こすためであり、他方、ポリオウィルス阻害のメカニズムはフェノキサジン誘導体が宿主細胞の細胞膜を構成する脂質二重層の撹乱を引き起こすためと考えられる。フェノキサジン誘導体分子が脂質二重層の極性/非極性接触面の付近に配置され、脂質二重層の特性に変質をもたらす(Hendrich AB, Stanczak K, Momorowska M, Motohashi N, Kawase M, Michalak K. A study on the perturbation of model lipid membranes by phenoxazines. Biorg med Chem. 2006年; 第14巻: 第5948-5954頁)。そして、この変質のため、脂質二重層により媒介される生物学的現象が調節される。
【0024】
エンベロープウィルスの膜内環境がフェノキサジン誘導体による脂質二重層の特性の調節を通じて変化されるということから、フェノキサジン誘導体はHCMV、HSV−1及びHSV−2のようなエンベロープウィルスを直接的に不活性化する一方で、ポリオウィルスやブタパルボウィルスのような非エンベロープウィルスには直接的に影響をしない。そして、宿主細胞のフェノキサジン誘導体処理による、ポリオウィルス及びブタパルボウィルスに対する防御活性の増強は宿主細胞の細胞内恒常性がフェノキサジン誘導体により調節された結果と考えられる。ただし、現在のところ詳細なメカニズムは不明である。
【0025】
ポリオウィルス、パルボウィルス、HSV−1、HSV−2及びHCMVは神経系に高い親和性を有し、脳において脳炎や脊髄炎を引き起こすことが知られている。1)ポリオウィルス及びブタパルボウィルスはPhx−1及びPhx−2に感受性があること、2)HCMV、HSV−1及びHSV−2のようなヘルペスウィルスはPhx−2 、Phx−1及びPhx−3に感受性があること、3)用いられたフェノキサジン誘導体は血液脳関門を通過すること、さらに4)Phx−1及びPhx−3を含むフェノキサジン誘導体はマウスに対して副作用を発揮しないことから、フェノキサジン誘導体は神経系に高い親和性を有するウィルスに対する治療に有効である。さらに、HCMVはとりわけ免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者の生命をしばしば脅かすので、Phx−2はこれら患者の治療薬の候補としてふさわしい。
【0026】
本発明の抗ウィルス剤は、ヒト又は動物(イヌ、ネコなどのペット;ウシ、ウマ、ブタなどの家畜;ニワトリなどの家禽;マグロ、ハマチなどの魚類など)のために使用される。
【0027】
本発明の抗ウィルス剤で使用しうる塩は、例えば無機塩として、ナトリウム塩、カリウム塩などのアルカリ金属塩;マグネシウム塩などのアルカリ土類金属塩;銅塩、亜鉛塩などの金属塩類;有機塩として、ジエタノールアミン塩、2−アミノ−2−エチル−1,3−プロパンジオール塩、トリエタノールアミン塩などのアルカノールアミン塩;モルホリン塩、ピペラジン塩、ピペリジン塩などのヘテロ環アミン塩;アンモニウム塩、アルギニン塩、リジン塩、ヒスチジン塩などの塩基性アミノ酸塩を挙げることができる。ここで、塩基性アミノ酸は、D−体、L−体或いはこれらの混合物であってもよい。
【0028】
本発明の抗ウィルス剤で使用しうるエステルとして、例えば、蟻酸エステル、酢酸エステル、プロピオン酸エステルを挙げることができる。
【0029】
式1で表される化合物は、好ましくは特許第3290172号公報、特開平02−193984号公報に記載の方法に従い製造されるが、これらに限定されない。
【0030】
本発明の抗ウィルス剤は、一般的な医薬製剤の形態として用いられうる。該製剤に、通常使用される充填剤、増量剤、結合剤、付湿剤、崩壊剤、表面活性剤、滑沢剤などの希釈剤、或いは賦形剤を配合することができる。本発明の抗ウィルス剤は、各種の形態が治療目的に応じて選択でき、その代表的なものとして、錠剤、丸剤、散剤、液剤、懸濁剤、乳剤、顆粒剤、カプセル剤、坐剤、液剤、懸濁剤などの注射剤、点眼剤、または軟膏剤が挙げられる。
【0031】
錠剤の形態に成形する担体として、慣用されている各種の担体を使用することができる。例えば、乳糖、白糖、ブドウ糖、塩化ナトリウム、尿素、デンプン、炭酸カルシウム、カオリン、結晶セルロース、ケイ酸などの賦形剤;水、エタノール、プロパノール、単シロップ、ブドウ糖液、デンプン液、ゼラチン溶液、カルボキシメチルセルロース、セラック、メチルセルロース、リン酸カリウム、ポリビニルピロリドンなどの結合剤;乾燥デンプン、アルギン酸ナトリウム、カンテン末、ラミナラン末、炭酸水素ナトリウム、炭酸カルシウム、ポリオキシエチレンソルビタン脂肪酸エステル類、ラウリル硫酸ナトリウム、ステアリン酸モノグリセリド、デンプン、乳糖などの崩壊剤;白糖、ステアリン、カカオバター、水素添加油などの崩壊抑制剤;第4級アンモニウム塩基、ラウリル硫酸ナトリウムなどの吸収促進剤、グリセリン、デンプンなどの保湿剤;デンプン、乳糖、カオリン、ベントナイト、コロイド状ケイ酸などの吸着剤;精製タルク、ステアリン酸塩、ホウ酸末、ポリエチレングリコールなどの滑沢剤を使用できる。さらに錠剤は必要に応じ通常の剤皮を施した錠剤、例えば糖衣錠、ゼラチン被包錠、腸溶被錠、フィルムコーティング錠或いは二重錠、多層錠とすることができる。
【0032】
丸剤の形態に成形するに際して、担体としてこの分野で従来公知のものを広く使用できる。その例として、ブドウ糖、乳糖、デンプン、カカオ脂、硬化植物油、カオリン、タルクなどの賦形剤;アラビアゴム末、トラガント末、ゼラチン、エタノールなどの結合剤;ラミナラン、カンテンなどの崩壊剤を使用できる。
【0033】
カプセル剤は、常法に従い、通常有効成分化合物を上記で例示した各種の担体と混合して硬質ゼラチンカプセル、軟質カプセルなどに充填して調製される。
【0034】
坐剤の形態に成形するに際して、担体として従来公知のものを広く使用できる。その例として、ポリエチレングリコール、カカオ脂、高級アルコール、高級アルコールのエステル類、ゼラチン、半合成グリセライドなどを挙げることができる。
【0035】
注射剤として調製される場合、液剤、乳剤及び懸濁剤は殺菌され、かつ血液と等張であるのが好ましい。これらの形態に成形するに際して、希釈剤としてこの分野において慣用されているものをすべて使用できる。例えば、水、エタノール、マクロゴール、プロピレングリコール、エトキシ化イソステアリルアルコール、ポリオキシ化イソステアリルアルコール、ポリオキシエチレンソルビタン脂肪酸エステル類などを使用できる。なお、この場合等張性の溶液を調製するに充分な量の食塩、ブドウ糖またはグリセリンを医薬製剤中に含有せしめてもよく、また通常の溶解補助剤、緩衝剤、無痛化剤などを添加してもよい。
【0036】
軟膏剤として調製される場合、この分野で従来公知の油性基剤を広く使用することができる。例えば、ラッカセイ油、ゴマ油、ダイズ油、サフラワー油、アボカド油、ヒマワリ油、トウモロコシ油、ナタネ油、メンジツ油、ヒマシ油、ツバキ油、ヤシ油、オリーブ油、ケシ油、カカオ油、牛脂、豚脂、羊毛油などの油脂類;ワセリン、パラフィン、シリコン油、スクワランなどの鉱物油;イソプロピルミリステート、n−ブチルミリステート、イソプロピルリノレート、アセチルリシノレート、ステアリルリシノレート、ジエチルセバケート、ジイソプロピルアジペート、セチルアルコール、ステアリルアルコール、サラシミツロウ、鯨ロウ、木ロウなどの高級脂肪酸エステル、高級脂肪族アルコール及びワックス類、ステアリン酸、オレイン酸、パルミチン酸などの高級脂肪酸;炭素原子数12〜18の飽和又は不飽和脂肪酸のモノ−、ジ−、トリグリセライド混合物である。本発明の抗ウィルス剤では、これら基剤を1種単独で或いは2種以上混合して使用してもよい。
【0037】
本発明の抗ウィルス剤に、慣用の添加剤、例えば金属石鹸、動物・植物抽出物、ビタミン剤、ホルモン剤、アミノ酸などの薬効剤、界面活性剤、色素、染料、顔料、香料、紫外線吸収剤、保湿剤、増粘剤、酸化防止剤、金属イオン封鎖剤、pH調整剤を必要に応じて適宜配合することができる。
【0038】
また、本発明の抗ウィルス剤は、洗浄液中に配合することができ、例えば口腔洗浄剤、眼洗浄剤、膣洗浄剤として有用である。
【0039】
洗浄剤として調製する場合、この分野で通常用いられているものを配合することができ、例えば陽イオン性、陰イオン性、両イオン性、非イオン性の各種の界面活性剤;高級アルコールなどの油剤;カチオン化セルロースなどの毛髪柔軟剤;グリセリン、プロピレングリコール、ソルビット、マルチトールなどの保湿剤;メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、カルボキシビニルポリマー、ポリビニルアルコールなどの粘度調整剤;加水分解コラーゲンなどの皮膜形成剤;エタノールなどの溶剤;クエン酸、塩酸などのpH調整剤;酸化防止剤;金属封鎖剤;殺菌剤;防腐剤;無機塩;抗フケ剤;ビタミン剤;色素;香料を任意に組み合わせて使用できる。
【0040】
本発明の抗ウィルス剤は、スプレー塗布、刷毛塗りなどの方法や布雑巾、ウェットティッシュ、ペーパータオル、おしぼりなどに含浸させ或いはエアゾールとして用いるなどして、医療用具、医療器具、壁、床、日用品・一般用具類(例えば、家具類、メガネ、食器など)の清拭に用いることができる。本発明の抗ウィルス剤は、衣類、食品、食器、ガーゼ、シーツ、おむつ、カーテンなどの洗浄剤、仕上げ剤、柔軟剤、漂白剤などに添加することによって、抗ウィルス効果を発揮することもできる。また本発明の抗ウィルス剤は、石鹸、シャンプー、リンスなどの浴用剤に添加することによって、抗ウィルス効果を発揮することもできる。
【0041】
本発明の抗ウィルス剤を、カーペット、カーテン、衣類などの繊維に予め塗布することにより、抗ウィルス作用を持つカーペット、カーテン、衣類などを製造できる。また本発明の抗ウィルス剤を、空気清浄機などの機械内部或いは活性炭に含有させることにより抗ウィルス作用を有する空気清浄機などを製造できる。
【0042】
本発明の抗ウィルス剤の配合量は、その効能効果を有する限り特に限定されないが、通常、本発明の抗ウィルス剤を含む組成物中に0.0001〜10重量%程度、好ましくは0.001〜10重量%程度、より好ましくは0.01%〜10%程度、特に好ましくは0.1〜5%程度含有させるのがよい。また、本発明の抗ウィルス剤を含む洗浄剤組成物として用いる場合には、適宜希釈して用いても良いため、有効成分化合物の含有量を0.0001〜90重量%程度とすることができ、好ましくは0.001〜10重量%程度、より好ましくは0.01〜10%程度、特に好ましくは0.1〜5%程度とするのがよい。
【0043】
本発明の抗ウィルス剤の使用方法は、特に制限はなく、各種製剤形態、患者又は使用者の年齢、性別その他の条件、疾患の程度などに応じた方法で使用される。例えば錠剤、丸剤、液剤、懸濁剤、乳剤、顆粒剤及びカプセル剤の場合は、経口投与されうる。また、液剤、噴霧剤、エアゾール剤、乳剤、軟膏剤の場合は、経鼻投与又は点眼投与されうる。さらに、噴霧剤、エアゾール剤の場合は吸入投与されうる。また、注射剤の場合は単独で又はブドウ糖、アミノ酸などの通常の補液と混合して静脈内投与され、更に必要に応じて単独で筋肉内、皮内、皮下もしくは腹腔内投与されうる。坐剤の場合には直腸内投与されうる。外用剤の場合には患部に塗布されうる。洗浄剤として用いる場合には、その種類及び形態に応じて、常法に従って使用されうる。
【0044】
本発明の抗ウィルス剤の使用量は、用法、対象となる患者又は動物或いは、使用者或いは動物の年齢、性別その他の条件、疾患の程度などにより適宜選択されるが通常、有効成分化合物の量が、一日当たり体重1kg当たり、約1〜20mg程度となるようにするのがよく、1日に1〜3回程度に分けて使用されるのがよい。
【0045】
以下、本発明を実施例により更に詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【0046】
実施例で使用した化合物の製造法を以下に示す。
Phx−2、Phx−1及びPhx−3が、ウシヘモグロビンを用いて既出の方法により製造された(特許第3957188号公報、Shimizu S, Suzuki M, Tomoda A, Arai S, Taguchi H, Hanawa T, Kamiya S. Phenoxazine compounds produced by the reactions with bovine hemoglobin showantimicrobial activity against non-tuberculosis mycobacteria. Tohoku J Exp Med. 2004年; 第203巻: 第47-52頁、Tomoda A,Arai S, Ishida R, Shimamoto T, Ohyashiki K. An improved method for the rapid preparation of 2-amino-4,4α-dihydro-4α-7-dimethyl-3H-phenoxazine-3-one, a novel antitumor agent. Biorg Med Chem Lett. 2002年; 第11巻: 第1057-1058頁)。Phx−2の構造は、上記式1においてRをメチル基としたものであり、下記式2で表される。Phx−1及びPhx−3は夫々下記式3及び式4で表される。
【0047】
式2
【化4】

【0048】
式3
【化5】

【0049】
式4
【化6】

【実施例1】
【0050】
上記により製造された3種のフェノキサジン誘導体が夫々、DMSO及びエタノールの3:1(体積比)混合物に、4mg/mlになるように溶解された。
【0051】
MRC−5細胞(JCRB細胞バンクより入手)を、5%(g/培地ml)の胎児ウシ血清(FBS:米国、シグマ社製)を含むイーグルMEM培地(MEM:日水製薬社製)中に懸濁し増殖させた。HCMV(Towne株)は該MEM培地中で増殖させた。
【0052】
細胞毒性試験
該MEM培地中のMRC−5細胞0.1ml(細胞数2×104)を、96ウェルプレート(デンマーク国、ヌンク社(NUNK)製)上に播種し、37℃で24時間、静置培養した。そして、Phx−2を0.5、1、5、10、及び20μg/mlの濃度で添加してさらに5日間静置培養した。生存細胞の収量をトリパンブルー排除試験により測定し(Lee JB, Hayashi K, Hirata M, Kuroda E, Suzuki E, Hayashi T. Antiviral sulfated polysaccharide from Navicula directa, a diatom collected from deep-sea water in Toyama bay. Biol Pharm Bull. 2006年; 第29巻: 第2135-2139頁)、濃度反応曲線からCC50値を得た。なお、CC50値は3重測定の平均とした。
Phx−1及びPhx−3についても夫々同様の試験を行った。
【0053】
抗ウィルス性試験
抗ウィルス性試験を、既出の方法に従って実施した(Lee JB, Hayashi K, Hirata M, Kuroda E, Suzuki E, Hayashi T. Antiviral sulfated polysaccharide from Navicula directa, a diatom collected from deep-sea water in Toyama bay. Biol Pharm Bull. 2006年; 第29巻: 第2135-2139頁、Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)。
対照実験群では、細胞単層に対し、室温で一時間、0.1プラークフォーミングユニット(PFU)でHCMVを感染させ、その後維持培地(MEM培地に2%(g/培地ml)でFBSを加えたもの)中で5日間静置培養された。
Phx−2の添加実験群では、Phx−2を0.5、1、4、及び20μg/mlの濃度で、上記と同様のHCMV感染と同時に添加し、上記同様5日間静置培養した。
5日間の静置培養後に、上記実験群の夫々に対するプラーク検定(Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)によりウィルスの収量が測定された。測定された収量による用量濃度曲線からIC50値が得られた。
そして、上記CC50とIC50の値から選択指数(CC50/IC50)を算出した。
Phx−1及びPhx−3についても夫々同様の試験を行った。
【0054】
抗ウィルス性試験の結果、図1に示されるように、Phx−2は1μg/ml未満の濃度でHCMVの活性を阻害する一方、Phx−1及びPhx−3は夫々4μg/ml未満及び20μg/ml未満の濃度で夫々HCMVの活性を阻害した(▲:Phx−2、●:Phx−1、■:Phx−3)。HCMVに対するIC50値はPhx−2、Phx−1、Phx−3において夫々0.34μg/ml、1.6μg/ml、8.2μg/mlであった(表1、左欄)。従って、Phx−2はHCMVの活性を有意に阻害した。
また、これらフェノキサジン誘導体の細胞毒性試験の結果から得られたCC50値は、Phx−2、Phx−1、Phx−3において夫々68μg/ml、5.0μg/ml、2.7μg/mlであった(表1、中欄)。従って、Phx−2は宿主細胞にほぼ細胞毒性を及ぼさない。
他方、一般的に数マイクログラム程度のCC50値を示す物質は細胞毒性があると考えられるため、Phx−1及びPhx−3はこれら細胞に対して細胞毒性を発揮すると思われる。
【0055】
薬剤の実効的な抗ウィルス活性は、IC50値及びCC50値を用いて選択指数を算出することにより評価される。Phx−2のHCMVに対する選択指数は200であった(表1、右欄)。抗ウィルス剤の選択指数は、一般的に8以上で有用であるといえる(Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)。従って、Phx−2はHCMVに対し強力な抗ウィルス活性を有する。
他方、Phx−1及びPhx−3のHCMVに対する選択指数は夫々3.1または0.33であった。従って、これら薬剤は抗ウィルス活性を示すものの、Phx−2に比べると細胞毒性があることから、医薬としての使用に当たっては注意を要する。
【0056】
また、既存のガンシクロビルはインビトロ試験において約2.5μg/mlでHCMVの増殖を阻害したのに対し、Phx−2は0.34μg/mlの濃度でHCMVの増殖を阻害する。従って、Phx−2はガンシクロビルよりも少量で効果を有するので、より有効な薬剤である。
【0057】
【表1】

【実施例2】
【0058】
実施例1の対象ウィルスを単純ヘルペスウィルス1型(HF株:以下、「HSV−1」という。)及び単純ヘルペスウィルス2型(UW268株:以下、「HSV−1」という。)に変えて試験した。本試験では、MRC−5細胞をベロ細胞(JCRB細胞バンクより入手)に変え、細胞毒性試験におけるフェノキサジン誘導体添加後の培養期間を3日間に変え、さらに抗ウィルス性試験における維持培地中での培養期間を24時間に変えた以外は実施例1に従った。
【0059】
抗ウィルス性試験の結果、HSV−1に対するIC50値はPhx−2、Phx−1、Phx−3において夫々6.1μg/ml、9.1μg/ml、3.1μg/mlであった(表1、左欄)。従って、Phx−2はHSV−1の活性を阻害する。
同様に、HSV−2に対するIC50値はPhx−2、Phx−1、Phx−3において夫々2.4μg/ml、8.5μg/ml、28μg/mlであった(表1、左欄)。従って、Phx−2はHSV−2の活性を阻害する。
また、これらフェノキサジン誘導体の細胞毒性試験の結果から得られたCC50値は、Phx−2、Phx−1、Phx−3において夫々41μg/ml、5.6μg/ml、4.3μg/mlであった(表1、中欄)。従って、Phx−2は宿主細胞にほとんど細胞毒性を及ぼさない。他方、ベロ細胞に対するCC50値から判断すると、Phx−1及びPhx−3はこれら細胞に対して細胞毒性を発揮すると思われる。
【0060】
Phx−2のHSV−1に対するCC50/IC50値は6.7であった(表1、右欄)。他方、Phx−1及びPhx−3のHSV−1に対する選択指数は0.62及び0.07であった。また、Phx−2のHSV−2に対するCC50/IC50値は17であった(表1、右欄)。他方、Phx−1及びPhx−3のHSV−2に対する選択指数は夫々0.66及び0.11であった。
従って、Phx−2はHSV−1及びHSV−2に対して高い抗ウィルス活性を有する。
【実施例3】
【0061】
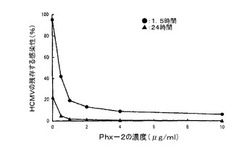
4×105PFU/mlのHCMV懸濁液(2%(g/培地ml)でFBSを含むMEM培地にHCMVを懸濁したもの)が、Phx−2を1、2、4、8及び20μg/mlの濃度で含む上記2%FBSのMEM培地、並びにPhx−2を含まない同量の上記2%FBSのMEM培地と共に、1.5時間又は24時間、37℃でインキュベートされた。そして、MRC−5細胞に対するPhx−2の影響を排除するために100倍体積のPBS(80mMリン酸水素ナトリウム、20mMリン酸二水素ナトリウム、100mM塩化ナトリウム)でこれを希釈したのち、MRC−5細胞を予め含んだ培養液に添加し、5日間培養を行った。しかるのちに上記のプラーク検定(Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)を行い、HCMVの残存する感染性の測定を行った。
【0062】
図2に見られるように、上記1.5時間のインキュベートの場合、Phx−2は0.5μg/ml超でHCMVの感染性を著しく減少した(●:1.5時間のインキュベート)。これは、Phx−2がHCMVに対して直接的に活性を抑制し、MRC−5細胞への感染を阻害するということを支持する。また、同様の結果が、上記24時間のインキュベートの場合にも得られた(図2の▲)。この場合、ウィルス活性は極端に消失している。
【図面の簡単な説明】
【0063】
【図1】フェノキサジン誘導体の濃度とHCMVのウィルス収量の関係を示すグラフである。
【図2】Phx−2の濃度とHCMVの残存する感染性の関係を示すグラフである。
【技術分野】
【0001】
本発明は、ヒト又は動物のためのウィルス性疾患の治療、発症予防、感染予防に有用であり、エンベロープを有するウィルスに対して有効である抗ウィルス剤に関する。
【背景技術】
【0002】
エンベロープを有するウィルスには、例えば単純ヘルペスウィルス(以下、「HSV」とする。)及びヒトサイトメガロウィルス(以下、「HCMV」とする。)がある。
【0003】
HSVは、神経節細胞に潜伏感染するヘルペスウィルスファミリーの一つであり、日和見病原体である。抗HSV剤としてアシクロビル及びガンシクロビルが用いられており、特にアシクロビルが多用されている。しかし、アシクロビル耐性HSVが増加しているため、他の有効な薬剤が必要とされている。
【0004】
HCMVは、リンパ芽球や繊維芽細胞などに潜伏感染するヘルペスウィルスファミリーの一つであり、HSVと同様に日和見病原体である。HCMVは、とりわけ免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者に、日和見間質性肺炎、網膜炎及び輸血後症候群等を起因し、そして死亡に到らしめる。抗HCMV剤として、ガンシクロビルが用いられている。ガンシクロビルは、ウィルスのDNAポリメラーゼを阻害しウィルスの増殖を抑える。しかし、ガンシクロビルは宿主細胞のDNAポリメラーゼにも反応しうるために、骨髄抑制を含む副作用を有する。一方、HSVに対して用いられているアシクロビルは、HCMVに対して用いることができない。HCMVはHSVと異なり、アシクロビルの作用対象となるチミジンキナーゼを有さないためである。
【0005】
これまで、エンベロープを有する広範囲のウィルスに対して効果がある抗ウィルス剤は知られていない。
抗ウィルス活性を示す薬剤として、フェノキサジン誘導体である、2−アミノフェノキサジン−3−オン誘導体及び3−アミノフェノキサジン−2−オン誘導体が知られている(例えば、特許文献1を参照)。上記特許文献において、上記誘導体はウィルスに対して有効であることが述べられているが、副作用の問題について述べられていない。
【0006】
【特許文献1】特許第3957188号明細書
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、エンベロープを有するウィルスに対して有効であり、かつ細胞毒性の少ない抗ウィルス剤を提供する。
【課題を解決するための手段】
【0008】
本発明は、抗ウィルス活性を有するフェノキサジン誘導体のうち、下記式1で表される3−アミノフェノキサジン−2−オン誘導体又はその薬理学的に許容される塩若しくはエステルを有効成分として含有し、エンベロープを有するウィルスに対して有効である抗ウィルス剤を提供する。なお、以下「本発明の抗ウィルス剤」とはエンベロープを有するウィルスに対して有効である抗ウィルス剤を言う。
【0009】
式1
【化2】

【発明の効果】
【0010】
本発明の抗ウィルス剤は、エンベロープを有するウィルスに対して有効である。更に、本発明の抗ウィルス剤は細胞毒性が弱いために副作用が少ない。
【発明を実施するための最良の形態】
【0011】
本発明の抗ウィルス剤は、下記式1で表される3−アミノフェノキサジン−2−オン誘導体又はその薬理学的に許容される塩若しくはエステルを有効成分として含む。ここで式1中、Rは、炭素原子数1〜4の低級アルキル基、炭素原子数1〜4のアシル基及び炭素原子数1〜4のアシルオキシ基から成る群から任意に選択される。好ましくは、Rがメチル基、エチル基、プロピル基、イソプロピル基、ヒドロキシメチル基、ヒドロキシエチル基、メトキシ基、エトキシ基、メトキシメチル基、エトキシメチル基から選択される。さらに好ましくは、Rがメチル基である。Rがメチル基のものは、3−アミノ−1,4α−ジヒドロ−4α−8−ジメチル−2H−フェノキサジン−2−オンである。
【0012】
式1
【化3】

【0013】
本発明でいうエンベロープを有するウィルスの種は特に限定されないが、以下に示す分類に含まれるウィルスを包含する。以下、本発明でいうエンベロープを有するウィルスについて説明する。
【0014】
ウィルスは、エンベロープの有無により二分される。エンベロープを有するウィルスは、該ウィルスが有する核酸の性状、すなわち核酸がDNAかRNAかにより分けられる。夫々、DNAウィルス及びRNAウィルスと呼ばれる。
【0015】
1)DNAウィルスではDNAが2本鎖として存在する。DNAウィルスには、単純ヘルペスウィルス1型(Herpes simplex virus 1)、単純ヘルペスウィルス2型(Herpes simplex virus 2)、水痘帯状疱疹ウィルス(varicella-zoster virus)を含むαヘルペスウィルス亜科、サイトメガロウィルス(cytomegalo virus)、ヒトヘルペスウィルス6(human herpes virus 6)、ヒトヘルペスウィルス7(human herpes virus 7)を含むβヘルペスウィルス亜科、EBウィルス(Epstein-Barr virus)、ヒトヘルペスウィルス8(human herpes virus 8)などを含むγヘルペスウィルス亜科などから構成されるヘルペスウィルス科(Herpesviridae)、ワクチニアウィルス(vaccinia virus)、伝染性軟属腫ウィルス(Molluscum contagiosum virus)などを含むポックスウィルス科(Poxviridae)、及びイリドウィルス科(Iridoviridae)などが含まれる。
【0016】
2)RNAウィルスには1本鎖RNAウィルス及びRNA−DNAウィルスが含まれる。このうち、1本鎖RNAウィルスにはプラス鎖RNAウィルス及びマイナス鎖RNAウィルスに分けられる。プラス鎖RNAウィルスには、シンドビスウィルス(Sindbis virus)、風疹ウィルス(Rubella virus)などを含むトガウィルス科(Toga viridae)、日本脳炎ウィルス(Japanese encephalitis virus)、黄熱ウィルス(Yellow fever virus)、C型肝炎ウィルス(Hepatitis C virus)などを含むフラビウィルス科(Flaviviridae)、及びコロナウィルス科(Coronaviridae)などが含まれる。マイナス鎖RNAウィルスには、狂犬病ウィルス(Rabies virus)、水疱性口内炎ウィルス(Vesicular stomatitis virus)などを含むラブドウィルス科(Rhabdoviridae)、エボラウィルス(Ebola virus)、マルブルグウィルス(Marburg virus)などを含むフィロウィルス科(Filoviridae)、センダイウィルス(Hemagglutinating virus of Japan)、はしかウィルス(Measles virus)、RSウィルス(RS virus)、おたふくかぜウィルス(Mumpus virus)などを含むパラミキソウィルス科(Paramyxoviridae)、インフルエンザウィルス(Human influenza virus) などを含むオルソミキソウィルス科(Orthomyxoviridae)、腎症候性出血熱ウィルス(Hantaan virus)などを含むブニヤウィルス科(Bunyaviridae)、及びリンパ性脈絡髄膜炎ウィルス(Lymphocytic choriomeningitis virus)などを含むアレナウィルス科(Arenaviridae)などが含まれる。RNA−DNAウィルスには、ヒトT細胞白血病ウィルスI型(Human T-cell leukemia virus type I)、ヒト後天性免疫不全ウィルス(Human immunodeficiency syndrome virus)などを含むレトロウィルス科(Retroviridae)などが含まれる。
【0017】
本発明の抗ウィルス剤は、エンベロープを有するウィルスに対して有効であり、特に、二本鎖DNAを有しかつエンベロープを有するウィルスに対して有効である。特に、ヘルペスウィルス科に属するウィルスに有効である。さらに特には、HCMV並びにHSVのうち1型及び2型(以下、夫々「HSV−1」及び「HSV−2」という。)に対して有効である。
【0018】
本発明の抗ウィルス剤によるウィルスの感染を阻止する作用機構は明らかではないが、ウィルスエンベロープに作用することでウィルスの増殖、複製を阻止することによると考えられる。
【0019】
本発明の抗ウィルス剤は、ウィルスの感染を阻害する効果がある。本発明でいう「抗ウィルス剤」は、ウィルス性疾患の治療、発症予防、感染予防の目的に使用される薬剤を包含する。
【0020】
更に、本発明の抗ウィルス剤は、他の薬剤とのセットで用いられる。該薬剤として、本発明の抗ウィルス剤以外の抗ウィルス剤、免疫抑制剤、抗癌剤、抗HIV薬、抗生物質、抗真菌薬、酵素剤、酵素阻害剤、抗酸化剤、脂質取り込み阻害剤、ホルモン剤、抗炎症剤、免疫賦活剤、プロテアーゼ阻害剤、逆転写酵素阻害剤、ヒト成長ホルモン、ステロイド剤、血管拡張剤、アンジオテンシン変換酵素阻害剤、アンジオテンシン受容体拮抗剤、平滑筋細胞の増殖・遊走阻害剤、血小板凝集阻害剤、抗凝固剤、ケミカルメデイエーターの遊離抑制剤、血管内皮細胞の増殖または抑制剤、アルドース還元酵素阻害剤、メサンギウム細胞増殖阻害剤、リポキシゲナーゼ阻害剤、メイラード反応抑制剤、アミロイドーシス阻害剤、NOS阻害剤、AGEs阻害剤あるいはラジカルスカベンジャーなどが挙げられる。特に、本発明の抗ウィルス剤は、免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者に対する治療のために用いられる、免疫抑制剤、抗癌剤及び抗HIV薬とのセット(組み合わせ)で用いられうる。
【0021】
下記実施例1及び2の結果より、3−アミノ−1,4α−ジヒドロ−4α−8−ジメチル−2H−フェノキサジン−2−オン(以下、「Phx−2」という。)は、その抗ウィルス活性が2−アミノ−4,4α−ジヒドロ−4α−7−ジメチル−3H−フェノキサジン−3−オン(以下、「Phx−1」という。)及び2−アミノ−フェノキサジン−3−オン(以下、「Phx−3」という。)よりも高く、かつその細胞毒性がPhx−1及びPhx−3よりも低い。従って、Phx−2はエンベロープを有するウィルスに対して有効な抗ウィルス剤である。このため、ヒトサイトメガロウィルス及び単純ヘルペスウィルス等の日和見病原体の脅威にさらされる可能性が高い免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者に対して有効である。従って、Phx−2はこれら患者に対して用いられる免疫抑制剤、抗癌剤又は抗HIV薬とセットの医薬品として用いられうる。
【0022】
現在、抗ウィルス剤として用いられているガンシクロビル及びアシクロビルは、HCMVやHSV−1のようなヘルペスウィルスファミリーに対して低濃度で強力な抗ウィルス活性を示す。
ガンシクロビルは、インビトロにおいて約2.5μg/mlの濃度でHCMVの複製を阻害することが示されている(Jarvis MA, Nelson JA. Human cytomegalovirus persistence and latency in endothelial cells and macrophages. Curr Opin Microbiol. 2002年; 第5巻: 第403-407頁)。本試験で用いたPhx−2、Phx−1及びPhx−3はいずれも抗ウィルス活性を有する。なかでも特にPhx−2は、ガンシクロビルよりも低濃度で効果を有し、かつ細胞毒性が低いため、副作用の少ない抗ウィルス剤として有効である。特にHCMVに対して有効である。
また、アシクロビルのHSV−1に対する抗ウィルス活性は約0.15μg/mlであり(Tang J, Colacino JM, Larsen SH, Spizer W. Virucidal activity of hypericin against enveloped and non-enveloped DNA and RNA viruses. Antiviral Res. 1990年; 第13巻: 第313-326頁)、このデータと比較するとPhx−2のHSV−1に対する抗ウィルス活性はアシクロビルより弱いものの、HSV−1の増殖を6.1μg/mlの濃度で阻害する。Phx−2はHSV−2の増殖も2.4μg/mlで阻害した。従って、これらの結果は、Phx−2がHSV−1及びHSV−2のいずれに対しても抗ウィルス活性を有することを示す。
【0023】
下記実施例3の結果より、Phx−2は、直接的にHCMVを不活性化する。
他方、ポリオウィルス及びブタパルボウィルスの複製活性について、宿主細胞への感染前にPhx−1又はPhx−3でこれらウィルスを処理し、その後感染させても複製活性は阻害されなかったが、宿主細胞がこれらフェノキサジン誘導体によりあらかじめ処理された場合は複製活性が阻害された、ということが以前報告されている(Iwata A, Yamaguchi T, Sato K, Yoshitake N, Tomoda A. Suppression of proliferation of poliovirus and porcine parvovirus by novel phenoxazines, 2-amino-4,4α-dihydro-4α-7-dimethyl-3H-phenoxazine-3-one, a novel antitumor agent. Biorg Med Chem Lett. 2002年; 第11巻: 第1057-1058頁)。
これらから、Phx−2によるHCMV活性の阻害メカニズムはフェノキサジン誘導体がウィルスエンベロープを構成する脂質二重層の撹乱を引き起こすためであり、他方、ポリオウィルス阻害のメカニズムはフェノキサジン誘導体が宿主細胞の細胞膜を構成する脂質二重層の撹乱を引き起こすためと考えられる。フェノキサジン誘導体分子が脂質二重層の極性/非極性接触面の付近に配置され、脂質二重層の特性に変質をもたらす(Hendrich AB, Stanczak K, Momorowska M, Motohashi N, Kawase M, Michalak K. A study on the perturbation of model lipid membranes by phenoxazines. Biorg med Chem. 2006年; 第14巻: 第5948-5954頁)。そして、この変質のため、脂質二重層により媒介される生物学的現象が調節される。
【0024】
エンベロープウィルスの膜内環境がフェノキサジン誘導体による脂質二重層の特性の調節を通じて変化されるということから、フェノキサジン誘導体はHCMV、HSV−1及びHSV−2のようなエンベロープウィルスを直接的に不活性化する一方で、ポリオウィルスやブタパルボウィルスのような非エンベロープウィルスには直接的に影響をしない。そして、宿主細胞のフェノキサジン誘導体処理による、ポリオウィルス及びブタパルボウィルスに対する防御活性の増強は宿主細胞の細胞内恒常性がフェノキサジン誘導体により調節された結果と考えられる。ただし、現在のところ詳細なメカニズムは不明である。
【0025】
ポリオウィルス、パルボウィルス、HSV−1、HSV−2及びHCMVは神経系に高い親和性を有し、脳において脳炎や脊髄炎を引き起こすことが知られている。1)ポリオウィルス及びブタパルボウィルスはPhx−1及びPhx−2に感受性があること、2)HCMV、HSV−1及びHSV−2のようなヘルペスウィルスはPhx−2 、Phx−1及びPhx−3に感受性があること、3)用いられたフェノキサジン誘導体は血液脳関門を通過すること、さらに4)Phx−1及びPhx−3を含むフェノキサジン誘導体はマウスに対して副作用を発揮しないことから、フェノキサジン誘導体は神経系に高い親和性を有するウィルスに対する治療に有効である。さらに、HCMVはとりわけ免疫システムが機能しない状態の患者、特に臓器移植を受けた患者、化学療法中の癌患者及びAIDS患者の生命をしばしば脅かすので、Phx−2はこれら患者の治療薬の候補としてふさわしい。
【0026】
本発明の抗ウィルス剤は、ヒト又は動物(イヌ、ネコなどのペット;ウシ、ウマ、ブタなどの家畜;ニワトリなどの家禽;マグロ、ハマチなどの魚類など)のために使用される。
【0027】
本発明の抗ウィルス剤で使用しうる塩は、例えば無機塩として、ナトリウム塩、カリウム塩などのアルカリ金属塩;マグネシウム塩などのアルカリ土類金属塩;銅塩、亜鉛塩などの金属塩類;有機塩として、ジエタノールアミン塩、2−アミノ−2−エチル−1,3−プロパンジオール塩、トリエタノールアミン塩などのアルカノールアミン塩;モルホリン塩、ピペラジン塩、ピペリジン塩などのヘテロ環アミン塩;アンモニウム塩、アルギニン塩、リジン塩、ヒスチジン塩などの塩基性アミノ酸塩を挙げることができる。ここで、塩基性アミノ酸は、D−体、L−体或いはこれらの混合物であってもよい。
【0028】
本発明の抗ウィルス剤で使用しうるエステルとして、例えば、蟻酸エステル、酢酸エステル、プロピオン酸エステルを挙げることができる。
【0029】
式1で表される化合物は、好ましくは特許第3290172号公報、特開平02−193984号公報に記載の方法に従い製造されるが、これらに限定されない。
【0030】
本発明の抗ウィルス剤は、一般的な医薬製剤の形態として用いられうる。該製剤に、通常使用される充填剤、増量剤、結合剤、付湿剤、崩壊剤、表面活性剤、滑沢剤などの希釈剤、或いは賦形剤を配合することができる。本発明の抗ウィルス剤は、各種の形態が治療目的に応じて選択でき、その代表的なものとして、錠剤、丸剤、散剤、液剤、懸濁剤、乳剤、顆粒剤、カプセル剤、坐剤、液剤、懸濁剤などの注射剤、点眼剤、または軟膏剤が挙げられる。
【0031】
錠剤の形態に成形する担体として、慣用されている各種の担体を使用することができる。例えば、乳糖、白糖、ブドウ糖、塩化ナトリウム、尿素、デンプン、炭酸カルシウム、カオリン、結晶セルロース、ケイ酸などの賦形剤;水、エタノール、プロパノール、単シロップ、ブドウ糖液、デンプン液、ゼラチン溶液、カルボキシメチルセルロース、セラック、メチルセルロース、リン酸カリウム、ポリビニルピロリドンなどの結合剤;乾燥デンプン、アルギン酸ナトリウム、カンテン末、ラミナラン末、炭酸水素ナトリウム、炭酸カルシウム、ポリオキシエチレンソルビタン脂肪酸エステル類、ラウリル硫酸ナトリウム、ステアリン酸モノグリセリド、デンプン、乳糖などの崩壊剤;白糖、ステアリン、カカオバター、水素添加油などの崩壊抑制剤;第4級アンモニウム塩基、ラウリル硫酸ナトリウムなどの吸収促進剤、グリセリン、デンプンなどの保湿剤;デンプン、乳糖、カオリン、ベントナイト、コロイド状ケイ酸などの吸着剤;精製タルク、ステアリン酸塩、ホウ酸末、ポリエチレングリコールなどの滑沢剤を使用できる。さらに錠剤は必要に応じ通常の剤皮を施した錠剤、例えば糖衣錠、ゼラチン被包錠、腸溶被錠、フィルムコーティング錠或いは二重錠、多層錠とすることができる。
【0032】
丸剤の形態に成形するに際して、担体としてこの分野で従来公知のものを広く使用できる。その例として、ブドウ糖、乳糖、デンプン、カカオ脂、硬化植物油、カオリン、タルクなどの賦形剤;アラビアゴム末、トラガント末、ゼラチン、エタノールなどの結合剤;ラミナラン、カンテンなどの崩壊剤を使用できる。
【0033】
カプセル剤は、常法に従い、通常有効成分化合物を上記で例示した各種の担体と混合して硬質ゼラチンカプセル、軟質カプセルなどに充填して調製される。
【0034】
坐剤の形態に成形するに際して、担体として従来公知のものを広く使用できる。その例として、ポリエチレングリコール、カカオ脂、高級アルコール、高級アルコールのエステル類、ゼラチン、半合成グリセライドなどを挙げることができる。
【0035】
注射剤として調製される場合、液剤、乳剤及び懸濁剤は殺菌され、かつ血液と等張であるのが好ましい。これらの形態に成形するに際して、希釈剤としてこの分野において慣用されているものをすべて使用できる。例えば、水、エタノール、マクロゴール、プロピレングリコール、エトキシ化イソステアリルアルコール、ポリオキシ化イソステアリルアルコール、ポリオキシエチレンソルビタン脂肪酸エステル類などを使用できる。なお、この場合等張性の溶液を調製するに充分な量の食塩、ブドウ糖またはグリセリンを医薬製剤中に含有せしめてもよく、また通常の溶解補助剤、緩衝剤、無痛化剤などを添加してもよい。
【0036】
軟膏剤として調製される場合、この分野で従来公知の油性基剤を広く使用することができる。例えば、ラッカセイ油、ゴマ油、ダイズ油、サフラワー油、アボカド油、ヒマワリ油、トウモロコシ油、ナタネ油、メンジツ油、ヒマシ油、ツバキ油、ヤシ油、オリーブ油、ケシ油、カカオ油、牛脂、豚脂、羊毛油などの油脂類;ワセリン、パラフィン、シリコン油、スクワランなどの鉱物油;イソプロピルミリステート、n−ブチルミリステート、イソプロピルリノレート、アセチルリシノレート、ステアリルリシノレート、ジエチルセバケート、ジイソプロピルアジペート、セチルアルコール、ステアリルアルコール、サラシミツロウ、鯨ロウ、木ロウなどの高級脂肪酸エステル、高級脂肪族アルコール及びワックス類、ステアリン酸、オレイン酸、パルミチン酸などの高級脂肪酸;炭素原子数12〜18の飽和又は不飽和脂肪酸のモノ−、ジ−、トリグリセライド混合物である。本発明の抗ウィルス剤では、これら基剤を1種単独で或いは2種以上混合して使用してもよい。
【0037】
本発明の抗ウィルス剤に、慣用の添加剤、例えば金属石鹸、動物・植物抽出物、ビタミン剤、ホルモン剤、アミノ酸などの薬効剤、界面活性剤、色素、染料、顔料、香料、紫外線吸収剤、保湿剤、増粘剤、酸化防止剤、金属イオン封鎖剤、pH調整剤を必要に応じて適宜配合することができる。
【0038】
また、本発明の抗ウィルス剤は、洗浄液中に配合することができ、例えば口腔洗浄剤、眼洗浄剤、膣洗浄剤として有用である。
【0039】
洗浄剤として調製する場合、この分野で通常用いられているものを配合することができ、例えば陽イオン性、陰イオン性、両イオン性、非イオン性の各種の界面活性剤;高級アルコールなどの油剤;カチオン化セルロースなどの毛髪柔軟剤;グリセリン、プロピレングリコール、ソルビット、マルチトールなどの保湿剤;メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、カルボキシビニルポリマー、ポリビニルアルコールなどの粘度調整剤;加水分解コラーゲンなどの皮膜形成剤;エタノールなどの溶剤;クエン酸、塩酸などのpH調整剤;酸化防止剤;金属封鎖剤;殺菌剤;防腐剤;無機塩;抗フケ剤;ビタミン剤;色素;香料を任意に組み合わせて使用できる。
【0040】
本発明の抗ウィルス剤は、スプレー塗布、刷毛塗りなどの方法や布雑巾、ウェットティッシュ、ペーパータオル、おしぼりなどに含浸させ或いはエアゾールとして用いるなどして、医療用具、医療器具、壁、床、日用品・一般用具類(例えば、家具類、メガネ、食器など)の清拭に用いることができる。本発明の抗ウィルス剤は、衣類、食品、食器、ガーゼ、シーツ、おむつ、カーテンなどの洗浄剤、仕上げ剤、柔軟剤、漂白剤などに添加することによって、抗ウィルス効果を発揮することもできる。また本発明の抗ウィルス剤は、石鹸、シャンプー、リンスなどの浴用剤に添加することによって、抗ウィルス効果を発揮することもできる。
【0041】
本発明の抗ウィルス剤を、カーペット、カーテン、衣類などの繊維に予め塗布することにより、抗ウィルス作用を持つカーペット、カーテン、衣類などを製造できる。また本発明の抗ウィルス剤を、空気清浄機などの機械内部或いは活性炭に含有させることにより抗ウィルス作用を有する空気清浄機などを製造できる。
【0042】
本発明の抗ウィルス剤の配合量は、その効能効果を有する限り特に限定されないが、通常、本発明の抗ウィルス剤を含む組成物中に0.0001〜10重量%程度、好ましくは0.001〜10重量%程度、より好ましくは0.01%〜10%程度、特に好ましくは0.1〜5%程度含有させるのがよい。また、本発明の抗ウィルス剤を含む洗浄剤組成物として用いる場合には、適宜希釈して用いても良いため、有効成分化合物の含有量を0.0001〜90重量%程度とすることができ、好ましくは0.001〜10重量%程度、より好ましくは0.01〜10%程度、特に好ましくは0.1〜5%程度とするのがよい。
【0043】
本発明の抗ウィルス剤の使用方法は、特に制限はなく、各種製剤形態、患者又は使用者の年齢、性別その他の条件、疾患の程度などに応じた方法で使用される。例えば錠剤、丸剤、液剤、懸濁剤、乳剤、顆粒剤及びカプセル剤の場合は、経口投与されうる。また、液剤、噴霧剤、エアゾール剤、乳剤、軟膏剤の場合は、経鼻投与又は点眼投与されうる。さらに、噴霧剤、エアゾール剤の場合は吸入投与されうる。また、注射剤の場合は単独で又はブドウ糖、アミノ酸などの通常の補液と混合して静脈内投与され、更に必要に応じて単独で筋肉内、皮内、皮下もしくは腹腔内投与されうる。坐剤の場合には直腸内投与されうる。外用剤の場合には患部に塗布されうる。洗浄剤として用いる場合には、その種類及び形態に応じて、常法に従って使用されうる。
【0044】
本発明の抗ウィルス剤の使用量は、用法、対象となる患者又は動物或いは、使用者或いは動物の年齢、性別その他の条件、疾患の程度などにより適宜選択されるが通常、有効成分化合物の量が、一日当たり体重1kg当たり、約1〜20mg程度となるようにするのがよく、1日に1〜3回程度に分けて使用されるのがよい。
【0045】
以下、本発明を実施例により更に詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【0046】
実施例で使用した化合物の製造法を以下に示す。
Phx−2、Phx−1及びPhx−3が、ウシヘモグロビンを用いて既出の方法により製造された(特許第3957188号公報、Shimizu S, Suzuki M, Tomoda A, Arai S, Taguchi H, Hanawa T, Kamiya S. Phenoxazine compounds produced by the reactions with bovine hemoglobin showantimicrobial activity against non-tuberculosis mycobacteria. Tohoku J Exp Med. 2004年; 第203巻: 第47-52頁、Tomoda A,Arai S, Ishida R, Shimamoto T, Ohyashiki K. An improved method for the rapid preparation of 2-amino-4,4α-dihydro-4α-7-dimethyl-3H-phenoxazine-3-one, a novel antitumor agent. Biorg Med Chem Lett. 2002年; 第11巻: 第1057-1058頁)。Phx−2の構造は、上記式1においてRをメチル基としたものであり、下記式2で表される。Phx−1及びPhx−3は夫々下記式3及び式4で表される。
【0047】
式2
【化4】

【0048】
式3
【化5】

【0049】
式4
【化6】

【実施例1】
【0050】
上記により製造された3種のフェノキサジン誘導体が夫々、DMSO及びエタノールの3:1(体積比)混合物に、4mg/mlになるように溶解された。
【0051】
MRC−5細胞(JCRB細胞バンクより入手)を、5%(g/培地ml)の胎児ウシ血清(FBS:米国、シグマ社製)を含むイーグルMEM培地(MEM:日水製薬社製)中に懸濁し増殖させた。HCMV(Towne株)は該MEM培地中で増殖させた。
【0052】
細胞毒性試験
該MEM培地中のMRC−5細胞0.1ml(細胞数2×104)を、96ウェルプレート(デンマーク国、ヌンク社(NUNK)製)上に播種し、37℃で24時間、静置培養した。そして、Phx−2を0.5、1、5、10、及び20μg/mlの濃度で添加してさらに5日間静置培養した。生存細胞の収量をトリパンブルー排除試験により測定し(Lee JB, Hayashi K, Hirata M, Kuroda E, Suzuki E, Hayashi T. Antiviral sulfated polysaccharide from Navicula directa, a diatom collected from deep-sea water in Toyama bay. Biol Pharm Bull. 2006年; 第29巻: 第2135-2139頁)、濃度反応曲線からCC50値を得た。なお、CC50値は3重測定の平均とした。
Phx−1及びPhx−3についても夫々同様の試験を行った。
【0053】
抗ウィルス性試験
抗ウィルス性試験を、既出の方法に従って実施した(Lee JB, Hayashi K, Hirata M, Kuroda E, Suzuki E, Hayashi T. Antiviral sulfated polysaccharide from Navicula directa, a diatom collected from deep-sea water in Toyama bay. Biol Pharm Bull. 2006年; 第29巻: 第2135-2139頁、Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)。
対照実験群では、細胞単層に対し、室温で一時間、0.1プラークフォーミングユニット(PFU)でHCMVを感染させ、その後維持培地(MEM培地に2%(g/培地ml)でFBSを加えたもの)中で5日間静置培養された。
Phx−2の添加実験群では、Phx−2を0.5、1、4、及び20μg/mlの濃度で、上記と同様のHCMV感染と同時に添加し、上記同様5日間静置培養した。
5日間の静置培養後に、上記実験群の夫々に対するプラーク検定(Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)によりウィルスの収量が測定された。測定された収量による用量濃度曲線からIC50値が得られた。
そして、上記CC50とIC50の値から選択指数(CC50/IC50)を算出した。
Phx−1及びPhx−3についても夫々同様の試験を行った。
【0054】
抗ウィルス性試験の結果、図1に示されるように、Phx−2は1μg/ml未満の濃度でHCMVの活性を阻害する一方、Phx−1及びPhx−3は夫々4μg/ml未満及び20μg/ml未満の濃度で夫々HCMVの活性を阻害した(▲:Phx−2、●:Phx−1、■:Phx−3)。HCMVに対するIC50値はPhx−2、Phx−1、Phx−3において夫々0.34μg/ml、1.6μg/ml、8.2μg/mlであった(表1、左欄)。従って、Phx−2はHCMVの活性を有意に阻害した。
また、これらフェノキサジン誘導体の細胞毒性試験の結果から得られたCC50値は、Phx−2、Phx−1、Phx−3において夫々68μg/ml、5.0μg/ml、2.7μg/mlであった(表1、中欄)。従って、Phx−2は宿主細胞にほぼ細胞毒性を及ぼさない。
他方、一般的に数マイクログラム程度のCC50値を示す物質は細胞毒性があると考えられるため、Phx−1及びPhx−3はこれら細胞に対して細胞毒性を発揮すると思われる。
【0055】
薬剤の実効的な抗ウィルス活性は、IC50値及びCC50値を用いて選択指数を算出することにより評価される。Phx−2のHCMVに対する選択指数は200であった(表1、右欄)。抗ウィルス剤の選択指数は、一般的に8以上で有用であるといえる(Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)。従って、Phx−2はHCMVに対し強力な抗ウィルス活性を有する。
他方、Phx−1及びPhx−3のHCMVに対する選択指数は夫々3.1または0.33であった。従って、これら薬剤は抗ウィルス活性を示すものの、Phx−2に比べると細胞毒性があることから、医薬としての使用に当たっては注意を要する。
【0056】
また、既存のガンシクロビルはインビトロ試験において約2.5μg/mlでHCMVの増殖を阻害したのに対し、Phx−2は0.34μg/mlの濃度でHCMVの増殖を阻害する。従って、Phx−2はガンシクロビルよりも少量で効果を有するので、より有効な薬剤である。
【0057】
【表1】

【実施例2】
【0058】
実施例1の対象ウィルスを単純ヘルペスウィルス1型(HF株:以下、「HSV−1」という。)及び単純ヘルペスウィルス2型(UW268株:以下、「HSV−1」という。)に変えて試験した。本試験では、MRC−5細胞をベロ細胞(JCRB細胞バンクより入手)に変え、細胞毒性試験におけるフェノキサジン誘導体添加後の培養期間を3日間に変え、さらに抗ウィルス性試験における維持培地中での培養期間を24時間に変えた以外は実施例1に従った。
【0059】
抗ウィルス性試験の結果、HSV−1に対するIC50値はPhx−2、Phx−1、Phx−3において夫々6.1μg/ml、9.1μg/ml、3.1μg/mlであった(表1、左欄)。従って、Phx−2はHSV−1の活性を阻害する。
同様に、HSV−2に対するIC50値はPhx−2、Phx−1、Phx−3において夫々2.4μg/ml、8.5μg/ml、28μg/mlであった(表1、左欄)。従って、Phx−2はHSV−2の活性を阻害する。
また、これらフェノキサジン誘導体の細胞毒性試験の結果から得られたCC50値は、Phx−2、Phx−1、Phx−3において夫々41μg/ml、5.6μg/ml、4.3μg/mlであった(表1、中欄)。従って、Phx−2は宿主細胞にほとんど細胞毒性を及ぼさない。他方、ベロ細胞に対するCC50値から判断すると、Phx−1及びPhx−3はこれら細胞に対して細胞毒性を発揮すると思われる。
【0060】
Phx−2のHSV−1に対するCC50/IC50値は6.7であった(表1、右欄)。他方、Phx−1及びPhx−3のHSV−1に対する選択指数は0.62及び0.07であった。また、Phx−2のHSV−2に対するCC50/IC50値は17であった(表1、右欄)。他方、Phx−1及びPhx−3のHSV−2に対する選択指数は夫々0.66及び0.11であった。
従って、Phx−2はHSV−1及びHSV−2に対して高い抗ウィルス活性を有する。
【実施例3】
【0061】
4×105PFU/mlのHCMV懸濁液(2%(g/培地ml)でFBSを含むMEM培地にHCMVを懸濁したもの)が、Phx−2を1、2、4、8及び20μg/mlの濃度で含む上記2%FBSのMEM培地、並びにPhx−2を含まない同量の上記2%FBSのMEM培地と共に、1.5時間又は24時間、37℃でインキュベートされた。そして、MRC−5細胞に対するPhx−2の影響を排除するために100倍体積のPBS(80mMリン酸水素ナトリウム、20mMリン酸二水素ナトリウム、100mM塩化ナトリウム)でこれを希釈したのち、MRC−5細胞を予め含んだ培養液に添加し、5日間培養を行った。しかるのちに上記のプラーク検定(Hayashi K, Mori J, Saito H, Hayashi T. Antiviral targets of a Chromene derivative from Sargassum micracanthum in the replication of human cytomegalovirus. Biol Pharm Bull. 2006年; 第29巻: 第1843-1847頁)を行い、HCMVの残存する感染性の測定を行った。
【0062】
図2に見られるように、上記1.5時間のインキュベートの場合、Phx−2は0.5μg/ml超でHCMVの感染性を著しく減少した(●:1.5時間のインキュベート)。これは、Phx−2がHCMVに対して直接的に活性を抑制し、MRC−5細胞への感染を阻害するということを支持する。また、同様の結果が、上記24時間のインキュベートの場合にも得られた(図2の▲)。この場合、ウィルス活性は極端に消失している。
【図面の簡単な説明】
【0063】
【図1】フェノキサジン誘導体の濃度とHCMVのウィルス収量の関係を示すグラフである。
【図2】Phx−2の濃度とHCMVの残存する感染性の関係を示すグラフである。
【特許請求の範囲】
【請求項1】
式1
【化1】

(ここで式1中、Rは、炭素原子数1〜4の低級アルキル基、炭素原子数1〜4のアシル基及び炭素原子数1〜4のアシルオキシ基から成る群から任意に選択される)で表される化合物又はその薬理学的に許容される塩若しくはエステルを有効成分として含有し、エンベロープを有するウィルスに対して有効である抗ウィルス剤。
【請求項2】
Rがメチル基である、請求項1に記載の抗ウィルス剤。
【請求項3】
エンベロープを有するウィルスが二本鎖DNAを有する、請求項1又は2に記載の抗ウィルス剤。
【請求項4】
エンベロープを有するウィルスが、ヘルペスウィルス科に属するウィルスである、請求項1又は2に記載の抗ウィルス剤。
【請求項5】
エンベロープを有するウィルスがヒトサイトメガロウィルスである、請求項1又は2に記載の抗ウィルス剤。
【請求項6】
エンベロープを有するウィルスが単純ヘルペスウィルス1型である、請求項1又は2に記載の抗ウィルス剤。
【請求項7】
エンベロープを有するウィルスが単純ヘルペスウィルス2型である、請求項1又は2に記載の抗ウィルス剤。
【請求項8】
抗癌剤と請求項1乃至7のいずれか1項に記載の抗ウィルス剤とのセットからなる医薬品。
【請求項9】
抗HIV薬と請求項1乃至7のいずれか1項に記載の抗ウィルス剤とのセットからなる医薬品。
【請求項10】
免疫抑制剤と請求項1乃至7のいずれか1項に記載の抗ウィルス剤とのセットからなる医薬品。
【請求項1】
式1
【化1】

(ここで式1中、Rは、炭素原子数1〜4の低級アルキル基、炭素原子数1〜4のアシル基及び炭素原子数1〜4のアシルオキシ基から成る群から任意に選択される)で表される化合物又はその薬理学的に許容される塩若しくはエステルを有効成分として含有し、エンベロープを有するウィルスに対して有効である抗ウィルス剤。
【請求項2】
Rがメチル基である、請求項1に記載の抗ウィルス剤。
【請求項3】
エンベロープを有するウィルスが二本鎖DNAを有する、請求項1又は2に記載の抗ウィルス剤。
【請求項4】
エンベロープを有するウィルスが、ヘルペスウィルス科に属するウィルスである、請求項1又は2に記載の抗ウィルス剤。
【請求項5】
エンベロープを有するウィルスがヒトサイトメガロウィルスである、請求項1又は2に記載の抗ウィルス剤。
【請求項6】
エンベロープを有するウィルスが単純ヘルペスウィルス1型である、請求項1又は2に記載の抗ウィルス剤。
【請求項7】
エンベロープを有するウィルスが単純ヘルペスウィルス2型である、請求項1又は2に記載の抗ウィルス剤。
【請求項8】
抗癌剤と請求項1乃至7のいずれか1項に記載の抗ウィルス剤とのセットからなる医薬品。
【請求項9】
抗HIV薬と請求項1乃至7のいずれか1項に記載の抗ウィルス剤とのセットからなる医薬品。
【請求項10】
免疫抑制剤と請求項1乃至7のいずれか1項に記載の抗ウィルス剤とのセットからなる医薬品。
【図1】


【図2】




【図2】


【公開番号】特開2009−120516(P2009−120516A)
【公開日】平成21年6月4日(2009.6.4)
【国際特許分類】
【出願番号】特願2007−294774(P2007−294774)
【出願日】平成19年11月13日(2007.11.13)
【出願人】(505457994)学校法人東京医科大学 (6)
【Fターム(参考)】
【公開日】平成21年6月4日(2009.6.4)
【国際特許分類】
【出願日】平成19年11月13日(2007.11.13)
【出願人】(505457994)学校法人東京医科大学 (6)
【Fターム(参考)】
[ Back to top ]

