抗オルソポックスウイルス剤としての4’−チオ−2’−デオキシヌクレオシドの使用
【課題】抗オルソポックスウイルス剤としての4’−チオ−2’−デオキシヌクレオシドの使用。
【解決手段】下記式によって表わされる化合物:
[化1]

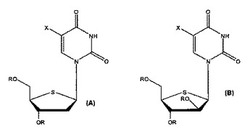
(式中、Rはそれぞれ独立にH、又は脂肪族アシル基、又は芳香族アシル基;Xは、水素、フルオロ基、クロロ基、ブロモ基、ヨード基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物を、オルソポックスウイルスの阻害剤として、及び、特に限定されないが、天然痘、牛痘、サル痘、ラクダ痘等のオルソポックスウイルス感染症を患う患者又は患畜の治療のために使用する。
【解決手段】下記式によって表わされる化合物:
[化1]

(式中、Rはそれぞれ独立にH、又は脂肪族アシル基、又は芳香族アシル基;Xは、水素、フルオロ基、クロロ基、ブロモ基、ヨード基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物を、オルソポックスウイルスの阻害剤として、及び、特に限定されないが、天然痘、牛痘、サル痘、ラクダ痘等のオルソポックスウイルス感染症を患う患者又は患畜の治療のために使用する。
【発明の詳細な説明】
【技術分野】
【0001】
(連邦政府により委託された研究開発)
本発明はアメリカ国立衛生研究所からグラントAI057175によって支援されていたものである。また米国連邦政府は本発明における所定の権利を有している。
【0002】
(技術分野)
本開示は、限定されないが、天然痘等のオルソポックスウイルスの阻害剤として有用な、あるピリミジンヌクレオシドに関する。本開示は、オルソポックスウイルスの感染によって引き起こされる疾患を患う患者又は患畜の治療のために該化合物を使用する方法に関する。
【背景技術】
【0003】
オルソポックスウイルス属には天然痘、牛痘、サル痘やラクダ痘が含まれる。オルソポックスウイルス属の中でも、天然痘の病原体である天然痘ウイルスは、人から人への空気感染力が強い。世界中において、大部分の人々に対しこのウイルスは感染性が高い。天然痘の罹病率は高く、死亡率は約30%である。少なくとも20年間にわたりこの疾病は発生していないことから、特に大流行した場合には診断は非常に難しいと考えられる。現在、流行初期の数日間であれば有効であり得るワクチンは存在する。しかし、天然痘を治療するための認可薬は存在しない。いわゆる9.11以降、我々はテロリズムの危険と向かい合わせで暮らしている。ポックスウイルスや、その感染の複雑さを利用した、起こり得るバイオテロ攻撃のシナリオでは、ワクチンよりも、有効な抗オルソポックスウイルス剤の開発に大きな注目が集まっている。
【発明の概要】
【課題を解決するための手段】
【0004】
具体的には、本願の開示は、下記式によって表される化合物:
【0005】
【化1】

【0006】
(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物のうち少なくとも一種を、ポックスウイルスを阻害するのに有効な量で患者又は患畜に投与することにより、患者又は患畜においてオルソポックスウイルスを阻害する方法に関する。
【0007】
本開示のさらに別の態様は、上述のとおり開示した化合物のうち少なくとも一種を、オルソポックスウイルス感染症を患う患者又は患畜に有効な量投与することを含む、オルソポックスウイルス感染症を患う患者又は患畜を治療する方法に関する。
【0008】
本開示のさらに他の目的及び利点は、以下の詳細な説明により、当業者において容易に明白となるであろう。詳細な説明では好ましい実施形態を示し、説明しているが、これは考えられる最良の形態を単に例示したものである。理解されるように、本開示は他の異なる実施形態もとることができる。また開示内容から外れない範囲で、詳細部分については、種々の明白な点において改変することができる。従って、本開示は本質的に例示的なものとして取り扱われるべきであり、限定的なものではない。
【発明を実施するための形態】
【0009】
具体的には、本開示は、下記式によって表わされる化合物:
【0010】
【化2】

【0011】
(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物の使用に関する。
【0012】
本発明を説明するために使用される様々な用語の定義を以下に列挙する。これらの定義は特定の例において別途限定しない限り、独立に、又はより大きなグループの一部として、明細書全体を通して使用される用語に適用される。
【0013】
典型的な脂肪族アシル基は1〜6の炭素原子を含んでおり、その例としてはホルミル基、アセチル基及びプロピオニル基が挙げられる。
【0014】
典型的な芳香族アシル基としては、芳香環に7〜10の炭素原子を含んでいる、無置換の、又はアルキル基で置換された芳香族基が挙げられる。置換されている場合、アルキル基は典型的には1〜6の炭素原子を含んでいる。典型的な芳香族アシル基としては、例えばベンゾイル基やパラ−トルオイル基が挙げられる。
【0015】
「アルキル(基)」という語は、典型的には炭素数1〜22の、より典型的には炭素数1〜8の、さらにより典型的には炭素数1〜4の、直鎖又は分岐鎖を有する無置換炭化水素基のことをいう。
【0016】
好適なアルキル基の例としては、メチル基、エチル基、及びプロピル基が挙げられる。分岐アルキル基の例としてはイソプロピル基やt−ブチル基が挙げられる。
【0017】
アルコキシ基は典型的には1〜6の炭素原子を含んでいる。好適なアルコキシ基は典型的には1〜6の炭素原子を含んでおり、例えばメトキシ基、エトキシ基、プロポキシ基、及びブトキシ基が挙げられる。
【0018】
好適なハロアルキル基は典型的には1〜6の炭素原子を含んでおり、直鎖でも分岐鎖でもよい。また例として、Cl、Br、F、又はIで置換されたアルキル基が挙げられ、そのアルキル基としては、上で具体的に開示したアルキル基が挙げられる。
【0019】
好適なアルケニル基は典型的には2〜6の炭素原子を含んでおり、例えばエテニル基やプロペニル基が挙げられる。
【0020】
好適なハロアルケニル基は典型的には1〜6の炭素原子を含んでおり、例として、Cl、Br、F、又はIで置換されたアルケニル基が挙げられ、そのアルケニル基としては、上で具体的に開示したアルケニル基が挙げられる。
【0021】
好適なアルキニル基は典型的には1〜6の炭素原子を含んでおり、例えばエチニル基やプロピニル基が挙げられる。
【0022】
Xとして好適なモノアルキルアミノ基は1〜6の炭素原子を含んでいる。上記モノアルキルアミノ基の例としては、モノメチルアミノ基、モノエチルアミノ基、モノ−イソプロピルアミノ基、モノ−n−プロピルアミノ基、モノ−イソブチル−アミノ基、モノ−n−ブチルアミノ基及びモノ−n−ヘキシルアミノ基が挙げられる。アルキル部分は直鎖でも分岐鎖でもよい。
【0023】
好適なジアルキルアミノ基は、それぞれのアルキル基に1〜6の炭素原子を含んでいる。2つのアルキル基は同一でも異なっていてもよく、また直鎖でも分岐鎖でもよい。好適な基の例としては、ジメチルアミノ基、ジエチルアミノ基、エチルメチルアミノ基、ジプロピルアミノ基、ジブチルアミノ基、ジペンチルアミノ基、ジヘキシルアミノ基、メチルペンチルアミノ基、エチルプロピルアミノ基、及びエチルヘキシルアミノ基が挙げられる。
【0024】
ハロ基の例はCl、F、Br、及びIである。
【0025】
「アリール(基)」という語は、環状部分に6〜12の炭素原子を有する、単環又は2環の芳香族炭化水素基をいう。例えばフェニル基、ナフチル基、ビフェニル基、及びジフェニル基等である。これらの基は、それぞれハロ基やアルキル基等の置換基で置換されていてもよい。
【0026】
特に断りの無い限り、本開示の化合物は、光学異性体や立体異性体が生じうる、分子内の種々の原子における光学異性体及び立体異性体の全てに関するということは当然に理解される。
【0027】
本開示の化合物は、プロドラッグ形成基としてアルコキシ基やアミノ酸基などを使用して、ヒドロキシル基又はアミノ基においてプロドラッグを形成してもよい。例えば、ヒドロキシメチル位でモノ−、ジ−又はトリ−ホスフェートを形成してもよく、さらにこのホスフェートからプロドラッグを形成してもよい。例えばMeier,CycloSal Phosphates as Chemical Trojan Horses for Intracellular Nucleotide Glycosyl−Monophosphate Delivery − Chemistry Meets Biology,,European Journal of Organic Chemistry(2006),(5),1081−1102,Wiley−VCH Verlag GmbH & Co.KGaA,Chemical Abstracts 144:391234;Drontle et al,Designing a Pronucleotide Stratagem:Lessons from Amino Acid Phosphoramidates of Anticancer and Antiviral Pyrimidines,,Mini−Reviews in Medicinal Chemistry(2004),4(4),409−419,Bentham Science Publishers Ltd.,Chemical Abstracts 141:230392;Cahard et al,Aryloxy Phosphoramidate Triesters as Protides,,Mini−Reviews in Medicinal Chemistry(2004),4(4),371−381,Bentham Science Publishers Ltd.,Chemical Abstracts,141:218130、及びMeier,CycloSal−Pronucleotides − Design of the Concept,Chemistry,and Antiviral activity,,Advances in Antiviral Drug Design(2004),4,147−213,Elsevier B.V,Chemical Abstracts 141:133365を参照されたい。
【0028】
上記プロドラッグ誘導体の調製は、種々の文献において議論されている(例えばAlexanderら,J.Med.Chem.1988,31,318;Aligas−MartinらのPCT WO pp/41531,p.30)。これらの誘導体を調製する際に変換された窒素官能基は、本開示の化合物に含まれる窒素原子のうちの1つ(又は2つ以上)である。
【0029】
本開示の化合物の薬学的に許容可能な塩には、薬学的に許容可能な無機酸又は有機酸由来の塩が含まれる。好適な酸の例としては、塩化水素酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン−2−スルホン酸、トリフルオロ酢酸、及びベンゼンスルホン酸等が挙げられる。好適な塩基に由来する塩は、ナトリウムやアンモニア等のアルカリを含んでいる。
【0030】
<化合物の合成>
本開示の化合物は、Secrist IIIらの“Synthesis and Biological Activity of 2’−Deoxy−4’−thio Pyrimidine Nucleotides”,J.Med.Chem.1991,34,2361 2366;Rahim,“Synthesis and Anti−Herpes Virus Activity of 2’−Deoxy−4’−thiopyrimidine Nucleotides”,J.Med.Chem.1996,39,789−795、Montgomeryらの米国特許第5,591,722号(この特許の譲受人は、本願の譲受人でもあるサザン リサーチ インスティテュートである)、及びWalkerらの欧州特許第0,421,777号(B1)に説明されている方法に従って調製することができる。なお、これら文献の開示の全体を、本願に引用して援用する。例示として、5−ヨード−4’−チオ−2’−デオキシウリジンを用いる以下のスキームは本開示の理解をさらに促進するために示されたものである。
【0031】
【化3】

【0032】
本開示は、オルソポックスウイルスの阻害、及び、オルソポックスウイルスによる感染症を患う患者又は患畜の治療に関する。オルソポックスウイルスの一例は天然痘ウイルスである。天然痘ウイルスは天然痘を引き起こす。オルソポックスウイルス感染症の例としては天然痘、牛痘、サル痘、及びラクダ痘等が挙げられる。
【0033】
以下に本開示をさらに具体的に説明するために実施例を示すが、本発明はこれらに限定されるものではない。
【実施例】
【0034】
細胞培養では、5−ヨード−4’−チオ−2’−デオキシウリジンは、野生型のVV(ワクシニアウイルス)及びCV(牛痘ウイルス)に対し1.0μM未満の濃度でも有効であった。さらに、5−ヨード−4’−チオ−2’−デオキシウリジンは、チミジンキナーゼ欠損変異株やdUTPase欠損変異株、さらにはシドフォビル耐性株やST−246耐性株等、VVのいくつかの突然変異株に対して抗ウイルス活性を保持した。生体外の細胞毒性をニュートラルレッド取り込み試験及びCellTiter−Glo<R>細胞生存率測定アッセイにより測定したところ、いずれの方法を用いても、この化合物に対する細胞毒性(CC50)値は100μMを超えた。
【0035】
この化合物が生体内で活性を示すかどうかを判断するために、マウスにVVかCVのいずれかを鼻腔内で致死的感染させた。最初の実験では、VV感染から24時間経った後、5、15、又は50mg/kgの量で、5−ヨード−4’−チオ−2’−デオキシウリジンを1日2回腹腔内投与し、それを5日間続けた。5−ヨード−4’−チオ−2’−デオキシウリジンで治療すると、全ての処方量においてVV−感染マウスは完全に死を免れた(P<0.001)。2つ目の実験では、CVによる感染から24時間経った後、1.5、5、又は15mg/kgの量で、5−ヨード−4’−チオ−2’−デオキシウリジンを1日2回腹腔内投与し、それを5日間続けた。その結果、やはり全ての処方量においてマウスは完全に死を免れた(P<0.001)。
【0036】
経口投与時に5−ヨード−4’−チオ−2’−デオキシウリジンが活性を示すかどうかを判断するために、該化合物を5、15及び50mg/kgの量で、1日2回、強制経口投与により与えた。この場合もやはり全ての処方量において死亡率の著しい減少が観察された(P<0.001)。
【0037】
上記結果は、5−ヨード−4’−チオ−2’−デオキシウリジンにより、種痘による有害反応や、サル痘又は天然痘疾患に対する治療効果が見込めることを示している。
【0038】
下記の表は、牛痘ウイルスBR株を鼻腔内に接種したBalb/Cマウスに5−ヨード−4’−チオ−2’−デオキシウリジンを1日2回経口投与した場合の死亡率に与える影響を示している。
【0039】
【表1】

【0040】
<剤形>
本開示の化合物は、医薬品と共に使用することが可能な任意の従来手段により投与することができ、単一の治療剤としてもよく、治療剤を組み合わせてもよい。上記化合物は単独で投与することができるが、一般的には選ばれた投与経路及び標準の薬学的プラクティスに基づいて選択された薬学的担体と共に投与される。上記化合物は、インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサス・インターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)、及びグリチルリチン等の他の治療剤や、オルソポックスウイルス感染症の治療用に考えられる他の薬剤と共に投与することもできる。
【0041】
本願明細書で述べる薬学的に許容可能な担体、例えばビヒクル、佐剤、賦形剤、又は希釈剤等は、当業者に周知のものである。典型的には、薬学的に許容可能な担体は、活性化合物に対し化学的に不活性で、使用条件下で有害な副作用や毒性を有していない。薬学的に許容可能な担体はポリマーやポリマーマトリクスを含んでいてもよい。
【0042】
本開示の化合物は、医薬品と共に使用することが可能な任意の従来方法により投与することができ、単一の治療剤としてもよく、治療剤を組み合わせてもよい。
【0043】
投与される量は、当然ながら、公知の要因、例えば、個々の薬剤の薬力学的特性や、その投与形式及び投与経路;受容者(レシピエント)の年齢、健康状態、及び体重;症状の性質及び範囲;同時に行う治療の種類;治療頻度;並びに所望の作用等によって異なる。有効成分の1日の投与量は体重1キログラム(kg)当たり約0.001〜1000ミリグラム(mg)、好ましくは0.1〜約30mg/kgであると予想される。
【0044】
投与形態(投与に適した組成物)は、典型的には1単位当たり約1mg〜約500mgの有効成分を含んでいる。このような医薬組成物において、有効成分の量は、通常、組成物の全重量を基準として約0.5〜95重量%となるであろう。
【0045】
有効成分は、カプセル剤、タブレット、及び粉末のような固体の投与形態、又はエリキシル剤、シロップ剤、及び懸濁液等の液体の投与形態の状態で経口投与することができる。有効成分は、無菌の液体の投与形態の状態で、非経口的に投与することもできる。有効成分は、鼻腔内投与(点鼻剤)、又は薬粉ミストの吸入によって投与することもできる。他の投与形態としては、パッチ機構や軟膏によって、経皮的に投与することなども場合によっては可能である。
【0046】
経口投与に適している剤形としては、(a)水、食塩水、又はオレンジジュース等の希釈剤中に有効量の化合物を溶解させたような液体溶液;(b)カプセル剤、サッシェ剤、タブレット、ロゼンジ(lozenge;菱形錠)、及びトローチ(それぞれ、固体又は顆粒として、有効成分を所定量含んでいる);(c)粉末;(d)適当な液体との懸濁液;及び(e)好適な乳液等が挙げられる。液剤は、水やアルコール(例えばエタノール、ベンジルアルコール、プロピレングリコール、グリセリン、及びポリエチレンアルコール)等の希釈剤を含んでいてもよい。さらに、薬学的に許容可能な界面活性剤、懸濁化剤、又は乳化剤を追加で含んでいてもよく、含んでいなくてもよい。カプセル形態は通常ハードシェル又はソフトシェルのゼラチンタイプで、界面活性剤、滑沢剤、及び不活性充填剤等、例えば、ラクトース、スクロース、リン酸カルシウム、及びコーンスターチ等を含んでいてもよい。タブレット形態は、下記のうち1つ以上を含んでいてもよい:ラクトース、スクロース、マンニトール、コーンスターチ、バレイショデンプン、アルギン酸、微結晶セルロース、アラビアゴム、ゼラチン、グアーガム、コロイド状二酸化ケイ素、クロスカルメロースナトリウム、滑石、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリン酸、及びその他の賦形剤、着色剤、希釈剤、緩衝剤、崩壊剤、湿潤剤、防腐剤、フレーバー付与剤、及び薬理学的に適合性のある担体。ロゼンジ形態は、フレーバー、通常はスクロースやアラビアゴム又はトラガント中に有効成分を含ませることができる。同様に、パステル剤は、不活性なベース、例えばゼラチンやグリセリン、又はスクロースやアラビアゴム中に有効成分を含んでいてもよい。また、乳液やゲルの場合も、上記有効成分に加えて関連技術分野において知られている担体等を含んでいてもよい。
【0047】
本開示の化合物は、単独で、又は他の好適な成分と組み合わせて、エアロゾル剤に調製して、吸入によって投与できるようにしてもよい。このエアロゾル剤は、ジクロロジフルオロメタン、プロパン、及び窒素等の、加圧された受容可能な充填ガス中に含ませることができる。さらに、上記化合物は、ネブライザーやアトマイザーのような、非加圧の調剤用の薬剤として製剤化されてもよい。
【0048】
非経口投与に適している剤形としては、水性及び非水性の等張無菌注射用溶液が挙げられる。この注射用溶液は酸化防止剤、緩衝剤、静菌薬、及び調合物を投与対象の受容者の血液と等張にする溶質を含んでいてもよい。また、他には、水性及び非水性の無菌懸濁液が挙げられる。この懸濁液は、懸濁化剤、溶解化剤、増粘剤、安定化剤、及び防腐剤を含んでいてもよい。上記化合物は、薬学的担体中、生理学的に許容可能な希釈剤(例えば無菌液体又は液体の混合物)に添加した状態で投与することができる。それら液体としては、水、食塩水、デキストロース水溶液、及び関連の糖溶液、エタノール、イソプロパノール、若しくはヘキサデシルアルコール等のアルコール類、プロピレングリコール若しくはポリエチレングリコール(例えばポリエチレングリコール400)等のグリコール類、2,2−ジメチル−1,3−ジオキソラン−4−メタノール等のグリセロールケタール、エーテル類、油類、脂肪酸、脂肪酸エステル若しくはグリセリド、又はアセチル化脂肪酸グリセリドが挙げられる。これらは、石鹸若しくは洗剤等の薬学的に許容可能な界面活性剤、ペクチン、カルボマー、メチルセルロース、ヒドロキシプロピルメチルセルロース、若しくはカルボキシメチルセルロース等の懸濁化剤、又は乳化剤、及び他の薬学的佐剤をさらに含んでいてもよく、含んでいなくてもよい。
【0049】
非経口剤形中で使用することができる油類の例としては、石油、動物油、植物油、又は合成油が挙げられる。油類の具体的な例としては、ピーナッツ油、大豆油、ごま油、綿実油、トウモロコシ油、オリーブ油、ペトロラタム及び鉱物油が挙げられる。非経口剤形中で使用するのに好適な脂肪酸としては、オレイン酸、ステアリン酸、及びイソステアリン酸が挙げられる。オレイン酸エチル及びミリスチン酸イソプロピルは好適な脂肪酸エステルの例である。非経口剤形中で使用するのに好適な石鹸としては、脂肪酸のアルカリ金属塩、アンモニウム塩、及びトリエタノールアミン塩が挙げられる。また、好適な界面活性剤としては、(a)例えばジメチルジアルキルアンモニウムハライド、及びアルキルピリジニウムハライド等のカチオン性界面活性剤、(b)例えばアルキル−、アリール−、及びオレフィン−スルホナート、アルキル−、オレフィン−、エーテル−、及びモノグリセリド−硫酸塩、並びにスルホコハク酸エステル塩等のアニオン性界面活性剤、(c)例えば脂肪族アミンオキシド、脂肪酸アルカノールアミド、及びポリオキシエチレン・ポリプロピレン共重合体等の非イオン性界面活性剤、(d)例えばアルキルβ−アミノプロピオネート、及び2−アルキルイミダゾリン四級アンモニウム塩等の両性界面活性剤、並びに(e)それらの混合物等が挙げられる。
【0050】
非経口剤形は、典型的には、溶液中に約0.5重量%〜約25重量%の有効成分を含有している。好適な防腐剤及び緩衝剤はそのような剤形中で使用することができる。注射部位での刺激を最小限にするか取り除くために、そのような組成物は親水性親油性バランス(HLB)が約12〜約17の非イオン性界面活性剤を1つ以上含んでいてもよい。上記剤形中の界面活性剤の量は、約5重量%〜約15重量%である。好適な界面活性剤としては、ポリエチレン・ソルビタン脂肪酸エステル(ソルビタンモノオレアート等)や、プロピレンオキシドとプロピレングリコールとのの縮合によって形成される疎水性ベースとのエチレンオキシドの高分子量付加物が挙げられる。
【0051】
薬学的に許容可能な賦形剤もまた、当業者に周知のものである。賦形剤の選択は、化合物の種類や、その組成物を投与するのに用いる具体的な方法を幾分か考慮して決定される。従って、本開示の医薬組成物には、種々の好適な配合例がある。下記方法及び賦形剤は単なる例示であって、全くこれらに限定されるものではない。薬学的に許容可能な賦形剤は、好ましくは有効成分の作用に干渉せず、有害な副作用を引き起こさないものである。好適な担体及び賦形剤としては、水、アルコール、及びプロピレングリコールのような溶剤、固体の吸収剤及び希釈剤、界面活性剤、懸濁化剤、錠剤用結合剤、滑沢剤、フレーバー、並びに着色剤等が挙げられる。
【0052】
上記剤形は、アンプルやバイアルのような単位用量又は複数回用量の密封容器中に封入することができ、フリーズドライ(凍結乾燥)状態で保存することができる。この場合、注射に使用する直前に無菌の液体賦形剤、例えば水、を添加するだけで使用できる。即時調製できる注射用溶液及び懸濁液は、無菌の粉末、顆粒及びタブレットから調製することができる。注射可能な組成物用として有効な薬学的担体に必要な条件は、当業者にとって周知である。Pharmaceutics and Pharmacy Practice,J.B.Lippincott Co.,Philadelphia,PA,Banker and Chalmers,Eds.,238−250(1982)、及びASHP Handbook on Injectable Drugs,Toissel,4th ed.,622−630(1986)を参照のこと。
【0053】
局所投与に好適な剤形としては、フレーバー、通常はスクロースやアラビアゴム又はトラガント中に有効成分を含むロゼンジ;不活性なベース、例えばゼラチンやグリセリン、又はスクロースやアラビアゴム中に有効成分を含むパステル剤;好適な液体担体中に有効成分を含む口内洗浄液;並びに、上記有効成分に加えて、関連技術分野において知られているような担体を含むクリーム、乳液、及びゲル等が挙げられる。
【0054】
さらに、直腸内投与に適している剤形としては、乳化性ベース又は水溶性ベース等の種々のベースと混合することによって得られる坐剤が挙げられる。膣投与に適している剤形としては、有効成分に加えて、関連技術分野において好適であることが知られているような担体を含有する膣坐薬、タンポン、クリーム、ゲル、ペースト、フォーム、又はスプレー等が挙げられる。
【0055】
好適な薬学的担体は、この分野における標準の参照用テキストである、Remington’s Pharmaceutical Sciences,Mack Publishing Companyにおいて説明されている。
【0056】
本開示の中で、動物、特にヒトに投与される投与量は、合理的な期間に渡って、動物の体内での治療反応に影響を与えるのに充分な量とすべきである。当業者は、投与量が動物の状態、動物の体重、さらに治療対象となる症状の重症度及びステージ等の種々の要因によって異なることを認識できるであろう。
【0057】
好適な投与量は、患者又は患畜体内の有効成分の濃度が、最終的に、所望の反応に影響することが知られている濃度になると推定される量である。好ましい投与量は、統制が困難な副作用もなく、治療される症状が最も効果的に抑制されることとなる量である。
【0058】
また、投与量は、投与経路、投与のタイミング、及び投与頻度、並びに、化合物の投与及び所望の生理的作用に伴って発生するおそれのある有害な副作用の存在、その特性、及びその程度によっても決定されるであろう。
【0059】
本開示の化合物を投与するのに有用な薬学的投与形態は、以下のように例示することができる。
【0060】
<ハードシェルカプセル剤>
標準的なツーピースハードゼラチンカプセルそれぞれに、粉末状有効成分100mg、ラクトース150mg、セルロース50mg、及びステアリン酸マグネシウム6mgを充填することにより、大量のカプセル単位を調製する。
【0061】
<ソフトゼラチンカプセル剤>
大豆油、綿実油、又はオリーブオイル等の可消化油中に有効成分を混合した混合物を調製し、容積式ポンプによって溶解ゼラチン中へ注入し、有効成分100mgを含むソフトゼラチンカプセル剤を形成する。カプセル剤を洗浄し、乾燥する。有効成分は、ポリエチレングリコール、グリセリン及びソルビトールの混合物中に溶解させて、水混和性の薬剤混合物を調製してもよい。
【0062】
<タブレット>
投与単位が、有効成分100mg、コロイド状二酸化ケイ素0.2mg、ステアリン酸マグネシウム5mg、微結晶セルロース275mg、デンプン11mg、及びラクトース98.8mgとなるように、従来の手順で大量のタブレットを調製する。適当な水性・非水性のコーティングを施して、嗜好性を増加させたり、外観や安定性を改善したり、吸収を遅らせてもよい。
【0063】
<即時放出タブレット/カプセル剤>
これらは従来のプロセスや新規なプロセスによって調製される固体の経口投与形態である。この投与単位は、薬剤を素早く溶解させて送達させるために、水なしで経口摂取できる。有効成分は、糖、ゼラチン、ペクチン、及び甘味料等の成分を含有する液体中に混合する。これらの液体は凍結乾燥や固相抽出技術によって固化させ、固形のタブレットやカプレットにする。薬剤混合物は粘弾性でかつ熱弾性の糖や高分子材料、又は発泡性成分と共に打錠して、水の必要がない、即放性をねらった多孔性マトリクスを製造することもできる。
【0064】
さらに、本開示の化合物は、点鼻剤や、定量吸入器や、鼻腔用又は口腔用吸入器の形態で投与することもできる。薬剤は、微細ミストとして点鼻液で、又はエアロゾルとして粉末で送達される。
【0065】
「含有する(又は「含む」、又は「包含する」)(comrising)」という語は(その文法的な変形も含めて)、本願明細書においては「有する(having)」や「含む・含まれる(including)」のような開放的な(inclusive)意味として用いており、「のみからなる(consisting only of)」のような排他的な意味としては使用していない。本願明細書においては、冠詞“a”や“the”は、単数と複数のいずれをも包含すると理解される。
【0066】
本願明細書において引用される出版物、特許、及び公開特許公報(特許出願)全てを、本明細書に引用して援用し、いかなる又はあらゆる目的のために、あたかも個々の出版物、特許、又は公開特許公報(特許出願)がそれぞれ具体的に、かつ独自に示されて、参照により援用されるものとする。矛盾が生じる場合には、本開示が優先される。
【0067】
本開示における上記説明は、本開示を例証し、説明したものである。さらに本開示は、好ましい実施形態のみを示し、説明したものである。しかしながら、上述の通り、本開示は他に様々に組み合わせて、又は改変して、又は他の様々な環境下で使用することができると理解されるべきものである。また本願明細書において示した概念の範囲を逸脱しない範囲で、上記教示及び/又は関連分野のスキルや知識に応じて変更や改変を行うこともできると理解されるべきものである。
【0068】
さらに、上述された実施形態は、それを実施する場合に分かっている最良の形態について説明し、かつ他の当業者がその実施形態、又は他の実施形態において、具体的な応用例や用途によって要求される種々の改変を施しつつ本開示を利用できるようにしたものである。従って、本開示は、ここに開示された形態に制限されることを意図したものではない。また、添付の特許請求の範囲は、代替の実施形態をも含むものと解釈されるべきものである。
【技術分野】
【0001】
(連邦政府により委託された研究開発)
本発明はアメリカ国立衛生研究所からグラントAI057175によって支援されていたものである。また米国連邦政府は本発明における所定の権利を有している。
【0002】
(技術分野)
本開示は、限定されないが、天然痘等のオルソポックスウイルスの阻害剤として有用な、あるピリミジンヌクレオシドに関する。本開示は、オルソポックスウイルスの感染によって引き起こされる疾患を患う患者又は患畜の治療のために該化合物を使用する方法に関する。
【背景技術】
【0003】
オルソポックスウイルス属には天然痘、牛痘、サル痘やラクダ痘が含まれる。オルソポックスウイルス属の中でも、天然痘の病原体である天然痘ウイルスは、人から人への空気感染力が強い。世界中において、大部分の人々に対しこのウイルスは感染性が高い。天然痘の罹病率は高く、死亡率は約30%である。少なくとも20年間にわたりこの疾病は発生していないことから、特に大流行した場合には診断は非常に難しいと考えられる。現在、流行初期の数日間であれば有効であり得るワクチンは存在する。しかし、天然痘を治療するための認可薬は存在しない。いわゆる9.11以降、我々はテロリズムの危険と向かい合わせで暮らしている。ポックスウイルスや、その感染の複雑さを利用した、起こり得るバイオテロ攻撃のシナリオでは、ワクチンよりも、有効な抗オルソポックスウイルス剤の開発に大きな注目が集まっている。
【発明の概要】
【課題を解決するための手段】
【0004】
具体的には、本願の開示は、下記式によって表される化合物:
【0005】
【化1】

【0006】
(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物のうち少なくとも一種を、ポックスウイルスを阻害するのに有効な量で患者又は患畜に投与することにより、患者又は患畜においてオルソポックスウイルスを阻害する方法に関する。
【0007】
本開示のさらに別の態様は、上述のとおり開示した化合物のうち少なくとも一種を、オルソポックスウイルス感染症を患う患者又は患畜に有効な量投与することを含む、オルソポックスウイルス感染症を患う患者又は患畜を治療する方法に関する。
【0008】
本開示のさらに他の目的及び利点は、以下の詳細な説明により、当業者において容易に明白となるであろう。詳細な説明では好ましい実施形態を示し、説明しているが、これは考えられる最良の形態を単に例示したものである。理解されるように、本開示は他の異なる実施形態もとることができる。また開示内容から外れない範囲で、詳細部分については、種々の明白な点において改変することができる。従って、本開示は本質的に例示的なものとして取り扱われるべきであり、限定的なものではない。
【発明を実施するための形態】
【0009】
具体的には、本開示は、下記式によって表わされる化合物:
【0010】
【化2】

【0011】
(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物の使用に関する。
【0012】
本発明を説明するために使用される様々な用語の定義を以下に列挙する。これらの定義は特定の例において別途限定しない限り、独立に、又はより大きなグループの一部として、明細書全体を通して使用される用語に適用される。
【0013】
典型的な脂肪族アシル基は1〜6の炭素原子を含んでおり、その例としてはホルミル基、アセチル基及びプロピオニル基が挙げられる。
【0014】
典型的な芳香族アシル基としては、芳香環に7〜10の炭素原子を含んでいる、無置換の、又はアルキル基で置換された芳香族基が挙げられる。置換されている場合、アルキル基は典型的には1〜6の炭素原子を含んでいる。典型的な芳香族アシル基としては、例えばベンゾイル基やパラ−トルオイル基が挙げられる。
【0015】
「アルキル(基)」という語は、典型的には炭素数1〜22の、より典型的には炭素数1〜8の、さらにより典型的には炭素数1〜4の、直鎖又は分岐鎖を有する無置換炭化水素基のことをいう。
【0016】
好適なアルキル基の例としては、メチル基、エチル基、及びプロピル基が挙げられる。分岐アルキル基の例としてはイソプロピル基やt−ブチル基が挙げられる。
【0017】
アルコキシ基は典型的には1〜6の炭素原子を含んでいる。好適なアルコキシ基は典型的には1〜6の炭素原子を含んでおり、例えばメトキシ基、エトキシ基、プロポキシ基、及びブトキシ基が挙げられる。
【0018】
好適なハロアルキル基は典型的には1〜6の炭素原子を含んでおり、直鎖でも分岐鎖でもよい。また例として、Cl、Br、F、又はIで置換されたアルキル基が挙げられ、そのアルキル基としては、上で具体的に開示したアルキル基が挙げられる。
【0019】
好適なアルケニル基は典型的には2〜6の炭素原子を含んでおり、例えばエテニル基やプロペニル基が挙げられる。
【0020】
好適なハロアルケニル基は典型的には1〜6の炭素原子を含んでおり、例として、Cl、Br、F、又はIで置換されたアルケニル基が挙げられ、そのアルケニル基としては、上で具体的に開示したアルケニル基が挙げられる。
【0021】
好適なアルキニル基は典型的には1〜6の炭素原子を含んでおり、例えばエチニル基やプロピニル基が挙げられる。
【0022】
Xとして好適なモノアルキルアミノ基は1〜6の炭素原子を含んでいる。上記モノアルキルアミノ基の例としては、モノメチルアミノ基、モノエチルアミノ基、モノ−イソプロピルアミノ基、モノ−n−プロピルアミノ基、モノ−イソブチル−アミノ基、モノ−n−ブチルアミノ基及びモノ−n−ヘキシルアミノ基が挙げられる。アルキル部分は直鎖でも分岐鎖でもよい。
【0023】
好適なジアルキルアミノ基は、それぞれのアルキル基に1〜6の炭素原子を含んでいる。2つのアルキル基は同一でも異なっていてもよく、また直鎖でも分岐鎖でもよい。好適な基の例としては、ジメチルアミノ基、ジエチルアミノ基、エチルメチルアミノ基、ジプロピルアミノ基、ジブチルアミノ基、ジペンチルアミノ基、ジヘキシルアミノ基、メチルペンチルアミノ基、エチルプロピルアミノ基、及びエチルヘキシルアミノ基が挙げられる。
【0024】
ハロ基の例はCl、F、Br、及びIである。
【0025】
「アリール(基)」という語は、環状部分に6〜12の炭素原子を有する、単環又は2環の芳香族炭化水素基をいう。例えばフェニル基、ナフチル基、ビフェニル基、及びジフェニル基等である。これらの基は、それぞれハロ基やアルキル基等の置換基で置換されていてもよい。
【0026】
特に断りの無い限り、本開示の化合物は、光学異性体や立体異性体が生じうる、分子内の種々の原子における光学異性体及び立体異性体の全てに関するということは当然に理解される。
【0027】
本開示の化合物は、プロドラッグ形成基としてアルコキシ基やアミノ酸基などを使用して、ヒドロキシル基又はアミノ基においてプロドラッグを形成してもよい。例えば、ヒドロキシメチル位でモノ−、ジ−又はトリ−ホスフェートを形成してもよく、さらにこのホスフェートからプロドラッグを形成してもよい。例えばMeier,CycloSal Phosphates as Chemical Trojan Horses for Intracellular Nucleotide Glycosyl−Monophosphate Delivery − Chemistry Meets Biology,,European Journal of Organic Chemistry(2006),(5),1081−1102,Wiley−VCH Verlag GmbH & Co.KGaA,Chemical Abstracts 144:391234;Drontle et al,Designing a Pronucleotide Stratagem:Lessons from Amino Acid Phosphoramidates of Anticancer and Antiviral Pyrimidines,,Mini−Reviews in Medicinal Chemistry(2004),4(4),409−419,Bentham Science Publishers Ltd.,Chemical Abstracts 141:230392;Cahard et al,Aryloxy Phosphoramidate Triesters as Protides,,Mini−Reviews in Medicinal Chemistry(2004),4(4),371−381,Bentham Science Publishers Ltd.,Chemical Abstracts,141:218130、及びMeier,CycloSal−Pronucleotides − Design of the Concept,Chemistry,and Antiviral activity,,Advances in Antiviral Drug Design(2004),4,147−213,Elsevier B.V,Chemical Abstracts 141:133365を参照されたい。
【0028】
上記プロドラッグ誘導体の調製は、種々の文献において議論されている(例えばAlexanderら,J.Med.Chem.1988,31,318;Aligas−MartinらのPCT WO pp/41531,p.30)。これらの誘導体を調製する際に変換された窒素官能基は、本開示の化合物に含まれる窒素原子のうちの1つ(又は2つ以上)である。
【0029】
本開示の化合物の薬学的に許容可能な塩には、薬学的に許容可能な無機酸又は有機酸由来の塩が含まれる。好適な酸の例としては、塩化水素酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン−2−スルホン酸、トリフルオロ酢酸、及びベンゼンスルホン酸等が挙げられる。好適な塩基に由来する塩は、ナトリウムやアンモニア等のアルカリを含んでいる。
【0030】
<化合物の合成>
本開示の化合物は、Secrist IIIらの“Synthesis and Biological Activity of 2’−Deoxy−4’−thio Pyrimidine Nucleotides”,J.Med.Chem.1991,34,2361 2366;Rahim,“Synthesis and Anti−Herpes Virus Activity of 2’−Deoxy−4’−thiopyrimidine Nucleotides”,J.Med.Chem.1996,39,789−795、Montgomeryらの米国特許第5,591,722号(この特許の譲受人は、本願の譲受人でもあるサザン リサーチ インスティテュートである)、及びWalkerらの欧州特許第0,421,777号(B1)に説明されている方法に従って調製することができる。なお、これら文献の開示の全体を、本願に引用して援用する。例示として、5−ヨード−4’−チオ−2’−デオキシウリジンを用いる以下のスキームは本開示の理解をさらに促進するために示されたものである。
【0031】
【化3】

【0032】
本開示は、オルソポックスウイルスの阻害、及び、オルソポックスウイルスによる感染症を患う患者又は患畜の治療に関する。オルソポックスウイルスの一例は天然痘ウイルスである。天然痘ウイルスは天然痘を引き起こす。オルソポックスウイルス感染症の例としては天然痘、牛痘、サル痘、及びラクダ痘等が挙げられる。
【0033】
以下に本開示をさらに具体的に説明するために実施例を示すが、本発明はこれらに限定されるものではない。
【実施例】
【0034】
細胞培養では、5−ヨード−4’−チオ−2’−デオキシウリジンは、野生型のVV(ワクシニアウイルス)及びCV(牛痘ウイルス)に対し1.0μM未満の濃度でも有効であった。さらに、5−ヨード−4’−チオ−2’−デオキシウリジンは、チミジンキナーゼ欠損変異株やdUTPase欠損変異株、さらにはシドフォビル耐性株やST−246耐性株等、VVのいくつかの突然変異株に対して抗ウイルス活性を保持した。生体外の細胞毒性をニュートラルレッド取り込み試験及びCellTiter−Glo<R>細胞生存率測定アッセイにより測定したところ、いずれの方法を用いても、この化合物に対する細胞毒性(CC50)値は100μMを超えた。
【0035】
この化合物が生体内で活性を示すかどうかを判断するために、マウスにVVかCVのいずれかを鼻腔内で致死的感染させた。最初の実験では、VV感染から24時間経った後、5、15、又は50mg/kgの量で、5−ヨード−4’−チオ−2’−デオキシウリジンを1日2回腹腔内投与し、それを5日間続けた。5−ヨード−4’−チオ−2’−デオキシウリジンで治療すると、全ての処方量においてVV−感染マウスは完全に死を免れた(P<0.001)。2つ目の実験では、CVによる感染から24時間経った後、1.5、5、又は15mg/kgの量で、5−ヨード−4’−チオ−2’−デオキシウリジンを1日2回腹腔内投与し、それを5日間続けた。その結果、やはり全ての処方量においてマウスは完全に死を免れた(P<0.001)。
【0036】
経口投与時に5−ヨード−4’−チオ−2’−デオキシウリジンが活性を示すかどうかを判断するために、該化合物を5、15及び50mg/kgの量で、1日2回、強制経口投与により与えた。この場合もやはり全ての処方量において死亡率の著しい減少が観察された(P<0.001)。
【0037】
上記結果は、5−ヨード−4’−チオ−2’−デオキシウリジンにより、種痘による有害反応や、サル痘又は天然痘疾患に対する治療効果が見込めることを示している。
【0038】
下記の表は、牛痘ウイルスBR株を鼻腔内に接種したBalb/Cマウスに5−ヨード−4’−チオ−2’−デオキシウリジンを1日2回経口投与した場合の死亡率に与える影響を示している。
【0039】
【表1】

【0040】
<剤形>
本開示の化合物は、医薬品と共に使用することが可能な任意の従来手段により投与することができ、単一の治療剤としてもよく、治療剤を組み合わせてもよい。上記化合物は単独で投与することができるが、一般的には選ばれた投与経路及び標準の薬学的プラクティスに基づいて選択された薬学的担体と共に投与される。上記化合物は、インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサス・インターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)、及びグリチルリチン等の他の治療剤や、オルソポックスウイルス感染症の治療用に考えられる他の薬剤と共に投与することもできる。
【0041】
本願明細書で述べる薬学的に許容可能な担体、例えばビヒクル、佐剤、賦形剤、又は希釈剤等は、当業者に周知のものである。典型的には、薬学的に許容可能な担体は、活性化合物に対し化学的に不活性で、使用条件下で有害な副作用や毒性を有していない。薬学的に許容可能な担体はポリマーやポリマーマトリクスを含んでいてもよい。
【0042】
本開示の化合物は、医薬品と共に使用することが可能な任意の従来方法により投与することができ、単一の治療剤としてもよく、治療剤を組み合わせてもよい。
【0043】
投与される量は、当然ながら、公知の要因、例えば、個々の薬剤の薬力学的特性や、その投与形式及び投与経路;受容者(レシピエント)の年齢、健康状態、及び体重;症状の性質及び範囲;同時に行う治療の種類;治療頻度;並びに所望の作用等によって異なる。有効成分の1日の投与量は体重1キログラム(kg)当たり約0.001〜1000ミリグラム(mg)、好ましくは0.1〜約30mg/kgであると予想される。
【0044】
投与形態(投与に適した組成物)は、典型的には1単位当たり約1mg〜約500mgの有効成分を含んでいる。このような医薬組成物において、有効成分の量は、通常、組成物の全重量を基準として約0.5〜95重量%となるであろう。
【0045】
有効成分は、カプセル剤、タブレット、及び粉末のような固体の投与形態、又はエリキシル剤、シロップ剤、及び懸濁液等の液体の投与形態の状態で経口投与することができる。有効成分は、無菌の液体の投与形態の状態で、非経口的に投与することもできる。有効成分は、鼻腔内投与(点鼻剤)、又は薬粉ミストの吸入によって投与することもできる。他の投与形態としては、パッチ機構や軟膏によって、経皮的に投与することなども場合によっては可能である。
【0046】
経口投与に適している剤形としては、(a)水、食塩水、又はオレンジジュース等の希釈剤中に有効量の化合物を溶解させたような液体溶液;(b)カプセル剤、サッシェ剤、タブレット、ロゼンジ(lozenge;菱形錠)、及びトローチ(それぞれ、固体又は顆粒として、有効成分を所定量含んでいる);(c)粉末;(d)適当な液体との懸濁液;及び(e)好適な乳液等が挙げられる。液剤は、水やアルコール(例えばエタノール、ベンジルアルコール、プロピレングリコール、グリセリン、及びポリエチレンアルコール)等の希釈剤を含んでいてもよい。さらに、薬学的に許容可能な界面活性剤、懸濁化剤、又は乳化剤を追加で含んでいてもよく、含んでいなくてもよい。カプセル形態は通常ハードシェル又はソフトシェルのゼラチンタイプで、界面活性剤、滑沢剤、及び不活性充填剤等、例えば、ラクトース、スクロース、リン酸カルシウム、及びコーンスターチ等を含んでいてもよい。タブレット形態は、下記のうち1つ以上を含んでいてもよい:ラクトース、スクロース、マンニトール、コーンスターチ、バレイショデンプン、アルギン酸、微結晶セルロース、アラビアゴム、ゼラチン、グアーガム、コロイド状二酸化ケイ素、クロスカルメロースナトリウム、滑石、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリン酸、及びその他の賦形剤、着色剤、希釈剤、緩衝剤、崩壊剤、湿潤剤、防腐剤、フレーバー付与剤、及び薬理学的に適合性のある担体。ロゼンジ形態は、フレーバー、通常はスクロースやアラビアゴム又はトラガント中に有効成分を含ませることができる。同様に、パステル剤は、不活性なベース、例えばゼラチンやグリセリン、又はスクロースやアラビアゴム中に有効成分を含んでいてもよい。また、乳液やゲルの場合も、上記有効成分に加えて関連技術分野において知られている担体等を含んでいてもよい。
【0047】
本開示の化合物は、単独で、又は他の好適な成分と組み合わせて、エアロゾル剤に調製して、吸入によって投与できるようにしてもよい。このエアロゾル剤は、ジクロロジフルオロメタン、プロパン、及び窒素等の、加圧された受容可能な充填ガス中に含ませることができる。さらに、上記化合物は、ネブライザーやアトマイザーのような、非加圧の調剤用の薬剤として製剤化されてもよい。
【0048】
非経口投与に適している剤形としては、水性及び非水性の等張無菌注射用溶液が挙げられる。この注射用溶液は酸化防止剤、緩衝剤、静菌薬、及び調合物を投与対象の受容者の血液と等張にする溶質を含んでいてもよい。また、他には、水性及び非水性の無菌懸濁液が挙げられる。この懸濁液は、懸濁化剤、溶解化剤、増粘剤、安定化剤、及び防腐剤を含んでいてもよい。上記化合物は、薬学的担体中、生理学的に許容可能な希釈剤(例えば無菌液体又は液体の混合物)に添加した状態で投与することができる。それら液体としては、水、食塩水、デキストロース水溶液、及び関連の糖溶液、エタノール、イソプロパノール、若しくはヘキサデシルアルコール等のアルコール類、プロピレングリコール若しくはポリエチレングリコール(例えばポリエチレングリコール400)等のグリコール類、2,2−ジメチル−1,3−ジオキソラン−4−メタノール等のグリセロールケタール、エーテル類、油類、脂肪酸、脂肪酸エステル若しくはグリセリド、又はアセチル化脂肪酸グリセリドが挙げられる。これらは、石鹸若しくは洗剤等の薬学的に許容可能な界面活性剤、ペクチン、カルボマー、メチルセルロース、ヒドロキシプロピルメチルセルロース、若しくはカルボキシメチルセルロース等の懸濁化剤、又は乳化剤、及び他の薬学的佐剤をさらに含んでいてもよく、含んでいなくてもよい。
【0049】
非経口剤形中で使用することができる油類の例としては、石油、動物油、植物油、又は合成油が挙げられる。油類の具体的な例としては、ピーナッツ油、大豆油、ごま油、綿実油、トウモロコシ油、オリーブ油、ペトロラタム及び鉱物油が挙げられる。非経口剤形中で使用するのに好適な脂肪酸としては、オレイン酸、ステアリン酸、及びイソステアリン酸が挙げられる。オレイン酸エチル及びミリスチン酸イソプロピルは好適な脂肪酸エステルの例である。非経口剤形中で使用するのに好適な石鹸としては、脂肪酸のアルカリ金属塩、アンモニウム塩、及びトリエタノールアミン塩が挙げられる。また、好適な界面活性剤としては、(a)例えばジメチルジアルキルアンモニウムハライド、及びアルキルピリジニウムハライド等のカチオン性界面活性剤、(b)例えばアルキル−、アリール−、及びオレフィン−スルホナート、アルキル−、オレフィン−、エーテル−、及びモノグリセリド−硫酸塩、並びにスルホコハク酸エステル塩等のアニオン性界面活性剤、(c)例えば脂肪族アミンオキシド、脂肪酸アルカノールアミド、及びポリオキシエチレン・ポリプロピレン共重合体等の非イオン性界面活性剤、(d)例えばアルキルβ−アミノプロピオネート、及び2−アルキルイミダゾリン四級アンモニウム塩等の両性界面活性剤、並びに(e)それらの混合物等が挙げられる。
【0050】
非経口剤形は、典型的には、溶液中に約0.5重量%〜約25重量%の有効成分を含有している。好適な防腐剤及び緩衝剤はそのような剤形中で使用することができる。注射部位での刺激を最小限にするか取り除くために、そのような組成物は親水性親油性バランス(HLB)が約12〜約17の非イオン性界面活性剤を1つ以上含んでいてもよい。上記剤形中の界面活性剤の量は、約5重量%〜約15重量%である。好適な界面活性剤としては、ポリエチレン・ソルビタン脂肪酸エステル(ソルビタンモノオレアート等)や、プロピレンオキシドとプロピレングリコールとのの縮合によって形成される疎水性ベースとのエチレンオキシドの高分子量付加物が挙げられる。
【0051】
薬学的に許容可能な賦形剤もまた、当業者に周知のものである。賦形剤の選択は、化合物の種類や、その組成物を投与するのに用いる具体的な方法を幾分か考慮して決定される。従って、本開示の医薬組成物には、種々の好適な配合例がある。下記方法及び賦形剤は単なる例示であって、全くこれらに限定されるものではない。薬学的に許容可能な賦形剤は、好ましくは有効成分の作用に干渉せず、有害な副作用を引き起こさないものである。好適な担体及び賦形剤としては、水、アルコール、及びプロピレングリコールのような溶剤、固体の吸収剤及び希釈剤、界面活性剤、懸濁化剤、錠剤用結合剤、滑沢剤、フレーバー、並びに着色剤等が挙げられる。
【0052】
上記剤形は、アンプルやバイアルのような単位用量又は複数回用量の密封容器中に封入することができ、フリーズドライ(凍結乾燥)状態で保存することができる。この場合、注射に使用する直前に無菌の液体賦形剤、例えば水、を添加するだけで使用できる。即時調製できる注射用溶液及び懸濁液は、無菌の粉末、顆粒及びタブレットから調製することができる。注射可能な組成物用として有効な薬学的担体に必要な条件は、当業者にとって周知である。Pharmaceutics and Pharmacy Practice,J.B.Lippincott Co.,Philadelphia,PA,Banker and Chalmers,Eds.,238−250(1982)、及びASHP Handbook on Injectable Drugs,Toissel,4th ed.,622−630(1986)を参照のこと。
【0053】
局所投与に好適な剤形としては、フレーバー、通常はスクロースやアラビアゴム又はトラガント中に有効成分を含むロゼンジ;不活性なベース、例えばゼラチンやグリセリン、又はスクロースやアラビアゴム中に有効成分を含むパステル剤;好適な液体担体中に有効成分を含む口内洗浄液;並びに、上記有効成分に加えて、関連技術分野において知られているような担体を含むクリーム、乳液、及びゲル等が挙げられる。
【0054】
さらに、直腸内投与に適している剤形としては、乳化性ベース又は水溶性ベース等の種々のベースと混合することによって得られる坐剤が挙げられる。膣投与に適している剤形としては、有効成分に加えて、関連技術分野において好適であることが知られているような担体を含有する膣坐薬、タンポン、クリーム、ゲル、ペースト、フォーム、又はスプレー等が挙げられる。
【0055】
好適な薬学的担体は、この分野における標準の参照用テキストである、Remington’s Pharmaceutical Sciences,Mack Publishing Companyにおいて説明されている。
【0056】
本開示の中で、動物、特にヒトに投与される投与量は、合理的な期間に渡って、動物の体内での治療反応に影響を与えるのに充分な量とすべきである。当業者は、投与量が動物の状態、動物の体重、さらに治療対象となる症状の重症度及びステージ等の種々の要因によって異なることを認識できるであろう。
【0057】
好適な投与量は、患者又は患畜体内の有効成分の濃度が、最終的に、所望の反応に影響することが知られている濃度になると推定される量である。好ましい投与量は、統制が困難な副作用もなく、治療される症状が最も効果的に抑制されることとなる量である。
【0058】
また、投与量は、投与経路、投与のタイミング、及び投与頻度、並びに、化合物の投与及び所望の生理的作用に伴って発生するおそれのある有害な副作用の存在、その特性、及びその程度によっても決定されるであろう。
【0059】
本開示の化合物を投与するのに有用な薬学的投与形態は、以下のように例示することができる。
【0060】
<ハードシェルカプセル剤>
標準的なツーピースハードゼラチンカプセルそれぞれに、粉末状有効成分100mg、ラクトース150mg、セルロース50mg、及びステアリン酸マグネシウム6mgを充填することにより、大量のカプセル単位を調製する。
【0061】
<ソフトゼラチンカプセル剤>
大豆油、綿実油、又はオリーブオイル等の可消化油中に有効成分を混合した混合物を調製し、容積式ポンプによって溶解ゼラチン中へ注入し、有効成分100mgを含むソフトゼラチンカプセル剤を形成する。カプセル剤を洗浄し、乾燥する。有効成分は、ポリエチレングリコール、グリセリン及びソルビトールの混合物中に溶解させて、水混和性の薬剤混合物を調製してもよい。
【0062】
<タブレット>
投与単位が、有効成分100mg、コロイド状二酸化ケイ素0.2mg、ステアリン酸マグネシウム5mg、微結晶セルロース275mg、デンプン11mg、及びラクトース98.8mgとなるように、従来の手順で大量のタブレットを調製する。適当な水性・非水性のコーティングを施して、嗜好性を増加させたり、外観や安定性を改善したり、吸収を遅らせてもよい。
【0063】
<即時放出タブレット/カプセル剤>
これらは従来のプロセスや新規なプロセスによって調製される固体の経口投与形態である。この投与単位は、薬剤を素早く溶解させて送達させるために、水なしで経口摂取できる。有効成分は、糖、ゼラチン、ペクチン、及び甘味料等の成分を含有する液体中に混合する。これらの液体は凍結乾燥や固相抽出技術によって固化させ、固形のタブレットやカプレットにする。薬剤混合物は粘弾性でかつ熱弾性の糖や高分子材料、又は発泡性成分と共に打錠して、水の必要がない、即放性をねらった多孔性マトリクスを製造することもできる。
【0064】
さらに、本開示の化合物は、点鼻剤や、定量吸入器や、鼻腔用又は口腔用吸入器の形態で投与することもできる。薬剤は、微細ミストとして点鼻液で、又はエアロゾルとして粉末で送達される。
【0065】
「含有する(又は「含む」、又は「包含する」)(comrising)」という語は(その文法的な変形も含めて)、本願明細書においては「有する(having)」や「含む・含まれる(including)」のような開放的な(inclusive)意味として用いており、「のみからなる(consisting only of)」のような排他的な意味としては使用していない。本願明細書においては、冠詞“a”や“the”は、単数と複数のいずれをも包含すると理解される。
【0066】
本願明細書において引用される出版物、特許、及び公開特許公報(特許出願)全てを、本明細書に引用して援用し、いかなる又はあらゆる目的のために、あたかも個々の出版物、特許、又は公開特許公報(特許出願)がそれぞれ具体的に、かつ独自に示されて、参照により援用されるものとする。矛盾が生じる場合には、本開示が優先される。
【0067】
本開示における上記説明は、本開示を例証し、説明したものである。さらに本開示は、好ましい実施形態のみを示し、説明したものである。しかしながら、上述の通り、本開示は他に様々に組み合わせて、又は改変して、又は他の様々な環境下で使用することができると理解されるべきものである。また本願明細書において示した概念の範囲を逸脱しない範囲で、上記教示及び/又は関連分野のスキルや知識に応じて変更や改変を行うこともできると理解されるべきものである。
【0068】
さらに、上述された実施形態は、それを実施する場合に分かっている最良の形態について説明し、かつ他の当業者がその実施形態、又は他の実施形態において、具体的な応用例や用途によって要求される種々の改変を施しつつ本開示を利用できるようにしたものである。従って、本開示は、ここに開示された形態に制限されることを意図したものではない。また、添付の特許請求の範囲は、代替の実施形態をも含むものと解釈されるべきものである。
【特許請求の範囲】
【請求項1】
下記式によって表される化合物:
【化1】

(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物のうち少なくとも一種を、患者又は患畜に投与することにより、患者又は患畜のオルソポックスウイルス感染を阻害する方法。
【請求項2】
前記オルソポックスウイルスが天然痘ウイルスを包含する、請求項1記載の方法。
【請求項3】
下記式によって表される化合物:
【化2】

(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物のうち少なくとも一種を、オルソポックスウイルス感染症を患う患者又は患畜に有効な量投与することを含む、オルソポックスウイルス感染症を患う患者又は患畜を治療する方法。
【請求項4】
前記患者又は患畜が天然痘、牛痘、サル痘又はラクダ痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項5】
前記患者又は患畜が天然痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項6】
前記患者又は患畜がサル痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項7】
前記患者又は患畜が牛痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項8】
前記患者又は患畜がラクダ痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項9】
前記少なくとも一種の化合物に加えて、さらに治療剤を投与することを含む、請求項1記載の方法。
【請求項10】
前記少なくとも一種の化合物に加えて、さらに治療剤を投与することを含む、請求項3記載の方法。
【請求項1】
下記式によって表される化合物:
【化1】

(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物のうち少なくとも一種を、患者又は患畜に投与することにより、患者又は患畜のオルソポックスウイルス感染を阻害する方法。
【請求項2】
前記オルソポックスウイルスが天然痘ウイルスを包含する、請求項1記載の方法。
【請求項3】
下記式によって表される化合物:
【化2】

(式中、Rはそれぞれ、H、脂肪族アシル基、及び芳香族アシル基からなる群から独立に選択され;
Xは、水素、ハロ基、アルコキシ基、アルキル基、ハロアルキル基、アルケニル基、ハロアルケニル基、アルキニル基、アミノ基、モノアルキルアミノ基、ジアルキルアミノ基、シアノ基、アリール基、及びニトロ基からなる群から選択される)、
その薬学的に許容可能な塩、そのプロドラッグ、及びその混合物のうち少なくとも一種を、オルソポックスウイルス感染症を患う患者又は患畜に有効な量投与することを含む、オルソポックスウイルス感染症を患う患者又は患畜を治療する方法。
【請求項4】
前記患者又は患畜が天然痘、牛痘、サル痘又はラクダ痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項5】
前記患者又は患畜が天然痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項6】
前記患者又は患畜がサル痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項7】
前記患者又は患畜が牛痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項8】
前記患者又は患畜がラクダ痘を患っている患者又は患畜である、請求項3記載の方法。
【請求項9】
前記少なくとも一種の化合物に加えて、さらに治療剤を投与することを含む、請求項1記載の方法。
【請求項10】
前記少なくとも一種の化合物に加えて、さらに治療剤を投与することを含む、請求項3記載の方法。
【公表番号】特表2011−526242(P2011−526242A)
【公表日】平成23年10月6日(2011.10.6)
【国際特許分類】
【出願番号】特願2010−550847(P2010−550847)
【出願日】平成21年3月12日(2009.3.12)
【国際出願番号】PCT/US2009/036869
【国際公開番号】WO2009/114651
【国際公開日】平成21年9月17日(2009.9.17)
【出願人】(507258674)サザン リサーチ インスティテュート (11)
【Fターム(参考)】
【公表日】平成23年10月6日(2011.10.6)
【国際特許分類】
【出願日】平成21年3月12日(2009.3.12)
【国際出願番号】PCT/US2009/036869
【国際公開番号】WO2009/114651
【国際公開日】平成21年9月17日(2009.9.17)
【出願人】(507258674)サザン リサーチ インスティテュート (11)
【Fターム(参考)】
[ Back to top ]

