抗グリピカン3抗体
【課題】抗体依存性細胞障害(ADCC)活性および補体依存性細胞障害(CDC)活性の高い抗グリピカン抗体を提供する。
【解決手段】グリピカン3(GPC3)の特定の領域に結合することができる、特定の配列を有する重鎖および軽鎖可変領域を含む抗体、ならびにこの抗体に基づいて作製されたヒト化抗体であって、前記抗GPC3抗体は、従来の抗体と比較して高いADCC活性およびCDC活性を有し、細胞増殖抑制剤として、抗癌剤として、および癌の診断薬として有用である。
【解決手段】グリピカン3(GPC3)の特定の領域に結合することができる、特定の配列を有する重鎖および軽鎖可変領域を含む抗体、ならびにこの抗体に基づいて作製されたヒト化抗体であって、前記抗GPC3抗体は、従来の抗体と比較して高いADCC活性およびCDC活性を有し、細胞増殖抑制剤として、抗癌剤として、および癌の診断薬として有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗グリピカン3抗体、ならびにかかる抗体を有効成分とする細胞増殖抑制剤および抗癌剤に関する。
【背景技術】
【0002】
グリピカン3(GPC3)は、細胞表面上に存在するヘパラン硫酸プロテオグリカンのファミリーの1つであり、発生における細胞分裂や、癌細胞の増殖に関与している可能性があることが示唆されているが、その機能はまだよく解明されていない。
【0003】
GPC3に結合するある種の抗体が、ADCC(抗体依存性細胞障害)活性およびCDC(補体依存性細胞障害)活性により細胞増殖抑制作用を有することが見いだされている(WO2003/000883)。また、GPC3が生体内で切断されて分泌型GPC3として血中に分泌され、これを検出しうる抗体を用いて癌の診断が可能であることが示唆されている(WO2004/022739、WO03/100429、WO2004018667)。
【0004】
抗体の細胞傷害活性を利用した抗癌剤を開発する場合、用いられる抗体は高いADCC活性又はCDC活性を有していることが好ましい為、GPC3を認識する抗体として高い細胞傷害活性を有する抗GPC3抗体が望まれていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2003/000883
【特許文献2】WO2004/022739
【特許文献3】WO03/100429
【特許文献4】WO2004/018667
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、従来の抗体と比較して高いADCC活性およびCDC活性を有する抗GPC3抗体を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは従来の抗グリピカン3抗体と比較して高い細胞傷害活性を有する抗体の取得に成功した。さらに、それらの抗体のエピトープを解析することにより、高い細胞傷害活性を発揮する抗体が認識するGPC3上の部位を見出すことに成功した。
【0008】
本発明は、以下の(1)−(12)のいずれか;
(1) 配列番号123に記載されるアミノ酸配列を含むCDR1,配列番号124に記載されるアミノ酸配列を含むCDR2,および配列番号125に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号109に記載されるアミノ酸配列を含むCDR1,配列番号110に記載されるアミノ酸配列を含むCDR2,および配列番号111に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号107に記載されるアミノ酸配列を含むCDR2,および配列番号108に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号132に記載されるアミノ酸配列を含むCDR1,配列番号133に記載されるアミノ酸配列を含むCDR2,および配列番号134に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号135に記載されるアミノ酸配列を含むCDR2,および配列番号136に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号126に記載されるアミノ酸配列を含むCDR1,配列番号127に記載されるアミノ酸配列を含むCDR2,および配列番号128に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号129に記載されるアミノ酸配列を含むCDR1,配列番号130に記載されるアミノ酸配列を含むCDR2,および配列番号131に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号103に記載されるアミノ酸配列を含むCDR1,配列番号104に記載されるアミノ酸配列を含むCDR2,および配列番号105に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号121に記載されるアミノ酸配列を含むCDR2,および配列番号122に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号115に記載されるアミノ酸配列を含むCDR1,配列番号116に記載されるアミノ酸配列を含むCDR2,および配列番号117に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号112に記載されるアミノ酸配列を含むCDR1,配列番号113に記載されるアミノ酸配列を含むCDR2,および配列番号114に記載されるアミノ酸配列を含むCDR3;または
(12) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号119に記載されるアミノ酸配列を含むCDR2,および120配列番号に記載されるアミノ酸配列を含むCDR3
を有する重鎖可変領域を含む抗体を提供する。
【0009】
別の観点においては、本発明は、以下の(1)−(13)のいずれか:
(1) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号145に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号140に記載されるアミノ酸配列を含むCDR1,配列番号141に記載されるアミノ酸配列を含むCDR2,および配列番号142に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号167に記載されるアミノ酸配列を含むCDR1,配列番号168に記載されるアミノ酸配列を含むCDR2,および配列番号169に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号170に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号171に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号159に記載されるアミノ酸配列を含むCDR1,配列番号160に記載されるアミノ酸配列を含むCDR2,および配列番号161に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号162に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号163に記載されるアミノ酸配列
を含むCDR3;
(8) 配列番号164に記載されるアミノ酸配列を含むCDR1,配列番号165に記載されるアミノ酸配列を含むCDR2,および配列番号166に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号137に記載されるアミノ酸配列を含むCDR1,配列番号138に記載されるアミノ酸配列を含むCDR2,および配列番号139に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号155に記載されるアミノ酸配列を含むCDR1,配列番号156に記載されるアミノ酸配列を含むCDR2,および配列番号157に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号149に記載されるアミノ酸配列を含むCDR1,配列番号150に記載されるアミノ酸配列を含むCDR2,および配列番号151に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号146に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号148に記載されるアミノ酸配列を含むCDR3;または
(13) 配列番号152に記載されるアミノ酸配列を含むCDR1,配列番号153に記載されるアミノ酸配列を含むCDR2,および配列番号154に記載されるアミノ酸配列を含むCDR3
を有する軽鎖可変領域を含む抗体を提供する。
【0010】
好ましくは、本発明の抗体は、以下の(1)−(13):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号109,110および111に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および145に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号106,107および108に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号140,141および142に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号132,133および134に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号167,168および169に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号106,135および136に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号170,144および171に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号126,127および128に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号159,160および161に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号162,147および163に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号164,165および166に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(9) それぞれ配列番号103,104および105に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号137,138および139に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号118,121および122に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号155,156および157に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号115,116および117に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号149,150および151に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(12) それぞれ配列番号112,113および114に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号146,147および148に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(13) それぞれ配列番号118,119および120に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号152,153および154に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体
からなる群より選択される。
【0011】
さらに別の観点においては、本発明は、以下の(1)〜(7)のいずれかに記載の重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;または
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体を提供する。
【0012】
また別の観点においては、本発明は、配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体を提供する。
【0013】
好ましくは、本発明の抗体は、以下の(1)〜(7)の抗体:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記
載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
からなる群より選択される。
【0014】
さらに別の観点においては、本発明は以下の(1)−(15)のいずれか:
(1) 配列番号174に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号175に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号176に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号177に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号178に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号179に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号180に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号181に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号182に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号183に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号184に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号185に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(13) 配列番号186に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(14) 配列番号187に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;または
(15) 配列番号188に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
を有する軽鎖可変領域を含む抗体を提供する。
【0015】
さらに別の観点においては、本発明は以下の(1)−(15):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号174,144および158,に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号175,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号176,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号177,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号178,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号179,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号180,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号181,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(9) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号182,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号183,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号184,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(12) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号185,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(13) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号186,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(14) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号187,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(15) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号188,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体,
からなる群より選択される抗体を提供する。
【0016】
さらに別の観点においては、本発明は以下の(1)〜(15):
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
からなる群より選択される軽鎖可変領域を有する抗体を提供する。
【0017】
さらに別の観点においては、本発明は、以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
および、以下の(1)〜(7)からなる群より選択される重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体を提供する。
【0018】
本発明の好ましい抗体の重鎖可変領域および軽鎖可変領域、ならびにこれらのCDR1,2および3のアミノ酸配列と、配列番号との対応を以下の一覧表に示す。
【0019】
【表1】

【0020】
【表2】

【0021】
【表3】

【0022】
また、上述のいずれかに記載の抗体のアミノ酸配列において1または複数のアミノ酸が置換、欠失、付加および/または挿入され、かつその抗体と同等の活性を有する抗体も本発明の範囲内である。好ましくは、本発明の抗体はヒト化抗体である。すなわち、別の観点においては、本発明はグリピカン3に結合するヒト化抗体を提供する。
【0023】
さらに別の観点においては、本発明は、グリピカン3のアミノ酸残基524〜563の配列を有するペプチドに結合する抗体を提供する。好ましくは、本発明の抗体は、グリピ
カン3のアミノ酸残基537〜563の配列を有するペプチドに結合する。また好ましくは、本発明の抗体は、グリピカン3のアミノ酸残基550〜563の配列からなるペプチドに結合しないことを特徴とする。好ましくは、本発明の抗体は、グリピカン3のアミノ酸残基544〜553の配列を有するペプチドに結合し、また好ましくは、グリピカン3のアミノ酸残基546〜551の配列を有するペプチドに結合する。
【0024】
また別の観点においては、本発明は、それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体が結合しうるエピトープに結合することができる抗体、すなわち、抗原との結合において競合する抗体を提供する。
【0025】
さらに別の観点においては、本発明は、グリピカン3に結合し、かつグリピカン3を発現する細胞に対して高いCDC活性を有する抗体、ならびに、グリピカン3に結合し、かつグリピカン3を発現する細胞に対して高いADCC活性を有する抗体を提供する。
【0026】
さらに別の観点においては、本発明は、上述の本発明のいずれかの抗体の重鎖可変領域または軽鎖可変領域をコードするポリヌクレオチドを提供する。本発明のポリヌクレオチドは、好ましくは、配列番号11−21、33−43、55−59、65−70、77−83のいずれかに記載の塩基配列を有する。
【0027】
別の観点においては、本発明は、上述の本発明の抗体を有効成分とする細胞増殖抑制剤および抗癌剤を提供する。好ましくは、本発明の抗癌剤は、肝細胞癌を治療するために用いられる。
【0028】
さらに別の観点においては、グリピカン3のアミノ酸残基524〜563のアミノ酸配列からなるペプチド、グリピカン3のアミノ酸残基537〜563のアミノ酸配列からなるペプチド、グリピカン3のアミノ酸残基544〜553のアミノ酸配列からなるペプチド、又はグリピカン3のアミノ酸残基546〜551のアミノ酸配列からなるペプチドを提供する。
【図面の簡単な説明】
【0029】
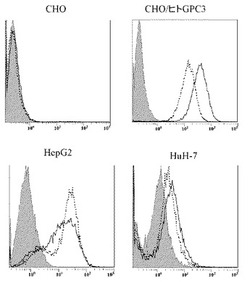
【図1】図1は、CHO細胞、全長GPC3発現CHO細胞、HepG2、HuH-7に対する抗GPC3抗体の結合活性をフローサイトメトリーにより評価した図である。M1E7(実線)、M11F1(破線)はそれぞれ5μg/mL濃度で使用した。
【図2】図2は、競合ELISAによるエピトープ分類の結果を示した表である。ビオチン化した抗GPC3抗体の結合に対する競合的な阻害の程度を%表示し、競合的阻害のパターンに従いaからeまでの5つのグループに分類された。
【図3】図3は、抗GPC3抗体が可溶型GPC3コアタンパク質の40kDaのN端断片に結合するか、30kDaのC端断片に結合するかウエスタンブロッティングにより評価した結果である。L9G11はN端断片に結合し、M3C11はC端断片に結合する事が判明した。
【図4】図4は、HepG2の培養上清中に分泌型GPC3が存在する事をサンドイッチELISAにより検出した結果である。M6B1、M18D4、M19B11等のN端断片に結合する抗体の組み合わせで高度に検出され、M3C11、M13B3、M3B8等のC端断片に結合する抗体では強くは検出されなかった。
【図5】図5は、抗GPC3抗体を用いてHepG2の培養上清の免疫沈降を行い、分泌型GPC3を検出した結果である。コントロールとして培地(レーン1、3)若しくはHepG2の培養上清(レーン2,4)をM1E7(レーン1,2)、M10D2(レーン3、4)を用いて免疫沈降を行った。N端断片に結合するM10D2により分泌型GPC3が検出された。
【図6】図6は、GPC3C末端ペプチドとGSTの融合タンパク質を利用して、GPC3C末端断片に結合する抗体のエピトープをウエスタンブロッティングにより分析した結果である。可溶型GPC3コアタンパク質(レーン1)、GST(レーン2)、GC-1(レーン3)、GC-2(レーン4)、GC-3(レーン5)、GC-4(レーン6)、GC-5(レーン7)を還元条件下にてSDS電気泳動後、M3C11、M11F1を用いてウエスタンブロッティングにより検出した。
【図7】図7は、抗GPC3マウス−ヒトキメラ抗体の、GPC3発現CHO細胞に対するCDC活性を評価した結果である。
【図8】図8は、抗GPC3マウス−ヒトキメラ抗体の、GPC3発現CHO細胞、およびHepG2に対するADCC活性を評価した結果である。
【図9】図9は、マウス骨髄由来エフェクター細胞を用いて、GC33のヒト肝癌細胞株HuH-7に対するADCC活性を評価した結果である。
【図10】図10は、GC33抗体のヒト肝癌移植マウスモデルに対する抗腫瘍活性を評価した結果である。
【図11】図11は、GC33のマウス−ヒトキメラ抗体の、GPC3発現CHO細胞に対するCDC活性を評価した結果である。
【図12】図12は、GC33のマウス−ヒトキメラ抗体の、HepG2に対するADCC活性を評価した結果である。
【図13】図13は、GC33のエピトープ解析用に作製したGST融合タンパク質(GC-4、5、6、7、8、9、11、12、13、14)に含まれるGPC3由来配列を示した図である。
【図14】図14は、GST、GC-7、8、9、11、12、13、14を還元条件下にてSDS-PAGEにより分離後、GC33を用いてウエスタンブロッティングを行った結果である。
【図15】図15は、ヒト化GC33のGPC3に対する結合活性をELISAにより評価した結果である。
【図16】図16は、可溶型GPC3免疫マウス由来クローンについて、アイソタイプ、ELISA、BIAcore、FACS、エピトープ解析、免疫沈降実験の結果をまとめた抗体パネルである。
【図17】図17は、GC-3免疫マウス由来クローンについて、アイソタイプ、ELISA、FACS、エピトープ解析の結果をまとめた抗体パネルである。
【図18】図18は、ヒト化GC33L鎖可変領域CDR1に位置するGly34をCys、Metを除く他の17アミノ酸に置換した改変型抗体の、可溶型GPC3コア蛋白質に対する結合活性をELISAにより評価した結果である。
【図19】図19は、GC33、M3C11、およびM1E7マウス−ヒトキメラ抗体の、全長GPC3発現CHO細胞に対するCDC活性を評価した結果である。
【図20】図20は、GC33、M3C11、およびM1E7マウス−ヒトキメラ抗体の、全長GPC3発現ヒト肝癌細胞株SK-03に対するADCC活性を評価した結果である。
【発明を実施するための形態】
【0030】
抗体
本発明は、下記の(I)〜(XI)に記載の抗体を提供する。
(I) 以下の(1)〜(12)のいずれかの配列番号に記載のアミノ酸配列からなるCDR1、2
、3を有する重鎖可変領域を含む抗体:
(1) 配列番号123、124、125(GC33)
(2) 配列番号109、110、111(M11F1)
(3) 配列番号106、107、108(M3B8)
(4) 配列番号132、133、134(GC199)
(5) 配列番号106、135、136(GC202)
(6) 配列番号126、127、128(GC179)
(7) 配列番号129、130、131(GC194)
(8) 配列番号103、104、105(M13B3)
(9) 配列番号118、121、122(L9G11)
(10) 配列番号115、116、117(M6B1)
(11) 配列番号112、113、114(M5B9)
(12) 配列番号118、119、120(M10D2)。
【0031】
上記(1)〜(12)の抗体の中で好ましいものは(1)〜(8)の抗体であり、さらに好ましいも
のは(1)〜(5)の抗体であり、特に好ましい抗体は(1)の抗体である。上記(1)〜(8)の抗体
はグリピカン3のC末端側ペプチド(グリピカン3の374番目のアミノ酸から580番目のアミノ酸までのペプチド)を認識し、治療用抗体として有用である。また、上記(9)
〜(12)の抗体はグリピカン3のN末端側ペプチド(グリピカン3の1番目のアミノ酸から373番目のアミノ酸までのペプチド)を認識し、診断用抗体として有用である。
【0032】
(II) 以下の(1)〜(13)のいずれかの配列番号に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体:
(1) 配列番号143、144、158(GC33)
(2) 配列番号143、144、145(M11F1)
(3) 配列番号140、141、142(M3B8)
(4) 配列番号167、168、169(GC199)
(5) 配列番号170、144、171(GC202)
(6) 配列番号159、160、161(GC179)
(7) 配列番号162、147、163(GC194(1))
(8) 配列番号164、165、166(GC194(2))
(9) 配列番号137、138、139(M13B3)
(10) 配列番号155、156、157(L9G11)
(11) 配列番号149、150、151(M6B1)
(12) 配列番号146、147、148(M5B9)
(13) 配列番号152、153、154(M10D2)。
【0033】
上記(1)〜(13)の抗体の中で好ましいものは(1)〜(8)の抗体であり、さらに好ましいも
のは(1)〜(5)の抗体であり、特に好ましい抗体は(1)の抗体である。上記(1)〜(8)の抗体
はグリピカン3のC末端側ペプチド(グリピカン3の374番目のアミノ酸から580番目のアミノ酸までのペプチド)を認識し、治療用抗体として有用である。また、上記(9)
〜(13)の抗体はグリピカン3のN末端側ペプチド(グリピカン3の1番目のアミノ酸から373番目のアミノ酸までのペプチド)を認識し、診断用抗体として有用である。
【0034】
(III) 以下の(1)〜(13)の抗体:
(1) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号143、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC33)
(2) 配列番号109、110、111に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号143、144、145に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M11F1)
(3) 配列番号106、107、108に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号140、141、142に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M3B8)
(4) 配列番号132、133、134に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号167、168、169に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC199)
(5) 配列番号106、135、136に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号170、144、171に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC202)
(6) 配列番号126、127、128に記載のアミノ酸配列からなるCDR1、2、3を有する
重鎖可変領域、および配列番号159、160、161に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC179)
(7) 配列番号129、130、131に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号162、147、163に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC194(1))
(8) 配列番号129、130、131に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号164、165、166に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC194(2))
(9) 配列番号103、104、105に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号137、138、139に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M13B3)
(10) 配列番号118、121、122に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号155、156、157に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(L9G11)
(11) 配列番号115、116、117に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号149、150、151に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M6B1)
(12) 配列番号112、113、114に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号146、147、148に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M5B9)
(13) 配列番号118、119、120に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号152、153、154に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M10D2)からなる群より選択される抗体。
【0035】
上記(1)〜(13)の抗体の中で好ましいものは(1)〜(8)の抗体であり、さらに好ましいも
のは(1)〜(5)の抗体であり、特に好ましい抗体は(1)の抗体である。上記(1)〜(8)の抗体
はグリピカン3のC末端側ペプチド(グリピカン3の374番目のアミノ酸から580番目のアミノ酸までのペプチド)を認識し、治療用抗体として有用である。また、上記(9)
〜(13)の抗体はグリピカン3のN末端側ペプチド(グリピカン3の1番目のアミノ酸から373番目のアミノ酸までのペプチド)を認識し、診断用抗体として有用である。
【0036】
(IV) 以下の(1)〜(7)のいずれかに記載の重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.a);
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.c);
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.f);
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.h);
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.i);
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.j);
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.k);
を有する抗体。
【0037】
上記(1)〜(7)の抗体の中で特に好ましい抗体は(2)〜(7)の抗体である。
【0038】
(V) 配列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する
抗体。
【0039】
(VI) 以下の(1)〜(7)の抗体:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.a)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.c)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.f)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.h)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.i)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.j)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を含む抗体;
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.k)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を含む抗体;
からなる群より選択される抗体。
【0040】
上記(1)〜(7)の抗体の中で特に好ましい抗体は(2)〜(7)の抗体である。
(VII) 以下の(1)〜(15)のいずれかの抗体:
(1) 配列番号174、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(2) 配列番号175、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(3) 配列番号176、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(4) 配列番号177、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(5) 配列番号178、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(6) 配列番号179、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(7) 配列番号180、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(8) 配列番号181、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(9) 配列番号182、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(10) 配列番号183、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(11) 配列番号184、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(12) 配列番号185、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(13) 配列番号186、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(14) 配列番号187、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(15) 配列番号188、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体。
【0041】
上記(1)〜(15)の抗体の中で好ましい抗体は(15)の抗体である。
(VIII) 以下の(1)〜(15)いずれかの抗体:
(1) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する
重鎖可変領域、および配列番号174、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(2) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号175、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(3) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号176、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(4) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号177、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(5) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号178、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(6) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号179、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(7) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号180、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(8) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号181、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(9) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号182、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(10) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号183、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(11) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号184、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(12) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号185、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(13) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号186、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(14) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号187、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(15) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号188、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体。
【0042】
上記(1)〜(15)の抗体の中で好ましい抗体は(15)の抗体である。
(IX) 以下の(1)〜(15)のいずれかに記載の抗体:
(1)配列番号191に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(2)配列番号192に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(3)配列番号193に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(4)配列番号194に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(5)配列番号195に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(6)配列番号196に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(7)配列番号197に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(8)配列番号198に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(9)配列番号199に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(10)配列番号200に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(11)配列番号201に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(12)配列番号202に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(13)配列番号203に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(14)配列番号204に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(15)配列番号205に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体。
【0043】
上記(1)〜(15)の抗体の中で好ましい抗体は(15)の抗体である。
(X) 以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1)配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2)配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3)配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4)配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5)配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6)配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7)配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8)配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9)配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10)配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11)配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12)配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13)配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14)配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;
(15)配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
および、以下の(1)〜(7)からなる群より選択される重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体。
【0044】
上記の抗体の中で好ましい抗体は、配列番号205に記載のアミノ酸配列を含む軽鎖可変領域および配列番号90に記載のアミノ酸配列を含む重鎖可変領域を有する抗体である。
【0045】
(XI) 上記の(I)〜(X)のいずれかに記載のアミノ酸配列において1または複数のアミノ酸
が置換、欠失、付加および/または挿入され、かつ(I)〜(X)のいずれかに記載の抗体と同等の活性を有する抗体。
【0046】
本発明において、(I)〜(X)のいずれかに記載の抗体と同等の活性とは、ヒトグリピカン3抗体への結合活性、またはヒトグリピカン3を発現する細胞(例えば、HepG2またはヒ
トグリピカン3発現組換えCHO細胞、など)への細胞傷害活性が同等であることをいう。
【0047】
ヒト化抗体
本発明における抗体の好ましい態様の一つとして、グリピカン3に結合するヒト化抗体を挙げることができる。ヒト化抗体は既知の方法を用いて製造することができる。
【0048】
ヒト化抗体は、再構成(reshaped)ヒト抗体とも称され、これは、ヒト以外の哺乳動物、例えばマウス抗体の相補性決定領域(CDR; complementarity determining region)を
ヒト抗体の相補性決定領域へ移植したものであり、その一般的な遺伝子組換え手法も知られている(欧州特許出願公開番号EP 125023号公報、WO 96/02576 号公報参照)。
【0049】
具体的には、例えばCDRがマウス抗体由来である場合には、マウス抗体のCDRとヒト抗体のフレームワーク領域(framework region;FR)とを連結するように設計したDNA配列を
、CDRおよびFR両方の末端領域にオーバーラップする部分を有するように作製した数個の
オリゴヌクレオチドをプライマーとして用いてPCR法により合成する(WO98/13388号公報に記載の方法を参照)。
【0050】
CDRと連結されるヒト抗体のフレームワーク領域は、相補性決定領域が良好な抗原結合
部位を形成するものが選択される。必要に応じ、再構成ヒト抗体の相補性決定領域が適切な抗原結合部位を形成するように、抗体の可変領域におけるフレームワーク領域のアミノ酸を置換してもよい(Sato, K.etal., CancerRes.(1993)53, 851-856)。
【0051】
キメラ抗体およびヒト化抗体のC領域には、ヒト抗体のものが使用され、例えばH鎖では、Cγ1、Cγ2、Cγ3、Cγ4を、L鎖ではCκ、Cλを使用することができる。また、抗体またはその産生の安定性を改善するために、ヒト抗体C領域を修飾してもよい。ヒト化の際
に用いられるヒト抗体は、IgG、IgM、IgA、IgE、IgDなど如何なるアイソタイプのヒト抗
体でもよいが、本発明においてはIgGを用いることが好ましく、さらにIgG1又はIgG3が好
ましく、特にIgG1が好ましい。IgG1は高い細胞傷害活性を有している点で抗体を抗癌剤として利用する場合に有効である(Chemical immunology, 65:88 (1997))。
【0052】
なお、ヒト化抗体を作製した後に、可変領域(例えば、FR)や定常領域中のアミノ酸を他のアミノ酸で置換等してもよい。
【0053】
ヒト化抗体におけるCDRの由来は特に限定されず、どのような動物由来でもよい。例え
ば、マウス抗体、ラット抗体、ウサギ抗体、ラクダ抗体などの配列を用いることが可能であるが、好ましくはマウス抗体のCDR配列である。
【0054】
抗体のヒト化において、通常、由来となった抗体のアゴニスト活性を維持したままヒト化を行うことは困難であるが、本発明においては、由来となったマウス抗体と同等のアゴニスト活性を有するヒト化抗体の取得に成功した。ヒト化抗体はヒト体内における抗原性が低下しているため、治療目的などでヒトに投与する場合に有用である。
【0055】
本発明においてヒト化抗グリピカン3抗体の好ましい例としては、例えば、配列番号84(GC33 VH ver.a)、配列番号85(GC33 VH ver.c)、配列番号86(GC33 VH ver.f
)、配列番号87(GC33 VH ver.h)、配列番号88(GC33 VH ver.i)、配列番号89(GC33 VH ver.j)または配列番号90(GC33 VH ver.k)に記載の重鎖可変領域を有する抗体、または配列番号92(GC33 VL ver.a)に記載の軽鎖可変領域を有する抗体を挙げる
ことができる。特に好ましい例としては、配列番号84(GC33 VH ver.a)、配列番号8
5(GC33 VH ver.c)、配列番号86(GC33 VH ver.f)、配列番号87(GC33 VH ver.h
)、配列番号88(GC33 VH ver.i)、配列番号89(GC33 VH ver.j)または配列番号90(GC33 VH ver.k)に記載の重鎖可変領域と、配列番号92(GC33 VL ver.a)に記載の軽鎖可変領域とを有する抗体を挙げることができる。
【0056】
さらに、本発明のヒト化抗グリピカン3抗体の好ましい例としては、配列番号90に記載の重鎖可変領域と配列番号205に記載の軽鎖可変領域とを有する抗体を挙げることができる。
【0057】
本発明における抗体の好ましい態様の一つとして、以下の(1)〜(8)のいずれかに記載の抗体:
(1) 配列番号62に記載のアミノ酸配列を有する重鎖可変領域、および配列番号73に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体(GC33);
(2) 配列番号26に記載のアミノ酸配列を有する重鎖可変領域、および配列番号48に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体((M11F1);
(3) 配列番号25に記載のアミノ酸配列を有する重鎖可変領域、および配列番号47に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体((M3B8);
(4) 配列番号60に記載のアミノ酸配列を有する重鎖可変領域、および配列番号71に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体((GC199);
(5) 配列番号61に記載のアミノ酸配列を有する重鎖可変領域、および配列番号72に記載のアミノ酸配列を有する軽鎖可変領域(GC202);
(6) 配列番号63に記載のアミノ酸配列を有する重鎖可変領域、および配列番号74に記載のアミノ酸配列を有する軽鎖可変領域(GC179);
(7) 配列番号64に記載のアミノ酸配列を有する重鎖可変領域、および配列番号75に記載のアミノ酸配列を有する軽鎖可変領域(GC194(1));
(8) 配列番号64に記載のアミノ酸配列を有する重鎖可変領域、および配列番号76に記載のアミノ酸配列を有する軽鎖可変領域(GC194(2));
が結合するエピトープに結合する抗体を挙げることができる。さらに好ましくは(1)〜(5)のいずれかに記載の抗体が結合するエピトープに結合する抗体であり、特に好ましくは(1)に記載の抗体が結合するエピトープに結合する抗体である。
【0058】
上記いずれかの抗体が結合するエピトープに結合する抗体は、特に高い細胞傷害活性を有する点で有用である。
【0059】
上記(1)〜(7)いずれかに記載の抗体はヒトグリピカン3の524番目のアミノ酸から580番目のアミノ酸までの領域に結合し、特に524番目のアミノ酸から563番目のアミノ酸までの領域に結合する。上記(1)〜(5)いずれかに記載の抗体はヒトグリピカン3の537番目のアミノ酸から563番目の領域に結合する。上記(1)に記載の抗体は、54
4番目のアミノ酸から553番目のアミノ酸の領域に結合し、特に546番目のアミノ酸から551番目の領域に結合する。
【0060】
上記エピトープを認識する抗体は、高い細胞傷害活性を有するので癌などの疾患の治療用として有用である。特に、546番目のアミノ酸から551番目の領域に結合する抗体は特に細胞傷害活性が高いので有用である。
【0061】
従って、本発明は、ヒトグリピカン3の524番目のアミノ酸から580番目のアミノ酸までの領域、好ましくは524番目のアミノ酸から563番目のアミノ酸までの領域、さらに好ましくは537番目のアミノ酸から563番目のアミノ酸までの領域、さらに好ましくは544番目のアミノ酸から553番目のアミノ酸までの領域、特に好ましくは546番目のアミノ酸から551番目のアミノ酸までの領域をエピトープとして、それらの領域に結合する抗体を含む。
【0062】
本発明において好ましい他の態様としては、ヒトグリピカン3の524番目のアミノ酸から563番目のアミノ酸までの領域を認識し、かつ、537番目のアミノ酸から563番目のアミノ酸までの領域を認識しない抗体を挙げることができる。
【0063】
さらに、本発明において好ましい他の態様としては、ヒトグリピカン3の537番目のアミノ酸から563番目のアミノ酸までの領域を認識し、かつ、550番目のアミノ酸から563番目のアミノ酸までの領域を認識しない抗体を挙げることができる。
【0064】
抗体が認識するエピトープの解析は当業者に公知の方法により行うことが可能であり、例えば実施例記載のウェスタンブロッティング法などにより行うことが可能である。
【0065】
上記の領域をエピトープとして認識する抗体は、当業者に公知の方法により得ることが可能であり、例えば、ヒトグリピカン3のアミノ酸配列を基に目的の領域のアミノ酸配列を含むペプチドを作製し、該ペプチドを免疫原として抗体を作製することにより、または、通常の方法で抗体を作製した後、得られた抗体が認識するエピトープを決定し、目的のエピトープを認識する抗体を選択することにより得ることが可能である。
【0066】
本発明の抗グリピカン3抗体の好ましい例としては、グリピカン3を発現する細胞に対して高いADCC活性を有する抗体または高いCDC活性を有する抗体を挙げることができる。
【0067】
本発明において高いADCC活性または高いCDC活性とは、公知の抗グリピカン3抗体よりも高いADCC活性または高いCDC活性を有することをいう。公知のグリピカン3抗体としては、WO2004/22739に記載されているM3C11またはM1E07を挙げることができる。
【0068】
ADCC活性またはCDC活性の測定方法は、当業者に公知の方法により行うことが可能であり、例えば、クロム遊離試験により行うことが可能である。ADCC活性を測定する際のクロム遊離試験の具体的な条件としては、特に限定されないが、例えば、実施例記載の条件を用いて測定することができる。
【0069】
グリピカン3を発現する細胞としては、例えば、HepG2などの肝癌細胞、グリピカン3
をコードする遺伝子を組み込まれたCHO細胞などを挙げることができる。ADCC活性を測定する場合にはHepG2細胞を用いることが好ましく、CDC活性を測定する場合には
GPC3発現組換えCHO細胞を用いることが好ましい。GPC3発現組換えCHO細胞
は如何なる方法により作製されてもよいが、例えば実施例に記載の方法により作製することが可能である。
【0070】
抗グリピカン3抗体を抗癌剤として用いる場合には、配列番号62に記載のアミノ酸配列を有する重鎖可変領域、および配列番号73に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体(GC33)と同程度のADCC活性を有していることが好ましい。抗グリピカン3抗体を抗癌剤として用いる場合には、配列番号62に記載のアミノ酸配列を有する重鎖可変領域、および配列番号73に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体(GC33)と同程度のCDC活性を有していることが好ましい。
【0071】
さらに本発明はグリピカン3への結合活性が高い抗体を含む。
【0072】
本発明において、グリピカン3への結合活性は、当業者に公知の手段を使用して測定することができる。例えば、BIAcoreを用いた表面プラズモン共鳴を利用して測定すること
が可能である。すなわちセンサーチップ上にグリピカン3タンパク質を固定して抗体と反応させ、測定値から抗体とグリピカン3の相互作用を反応速度定数として算出することができる。また、結合活性の評価には、ELISA(酵素結合免疫吸着検定法)、EIA(酵素免疫測定法)、RIA(放射免疫測定法)あるいは蛍光抗体法を用いることができる。例えば、
酵素免疫測定法を用いる場合、被験抗体が結合する抗原をコーティングしたプレートに、被験抗体を含む試料、例えば、被験抗体産生細胞の培養上清や精製抗体を加える。アルカリフォスファターゼ等の酵素で標識した二次抗体を添加し、プレートをインキュベートし、洗浄した後、p-ニトロフェニル燐酸などの酵素基質を加えて吸光度を測定することで抗原結合活性を評価することができる。結合活性の上限は特に限定されないが、例えば、当業者が技術的に作製可能な範囲の上限を設定することができる。しかしながら、技術的に作製可能な範囲は、技術の進歩により拡大されることが理解されるであろう。
【0073】
さらに、本発明においては、抗体の安定性を増加させる等の目的で脱アミド化されるアミノ酸若しくは脱アミド化されるアミノ酸に隣接するアミノ酸を他のアミノ酸に置換することにより脱アミド化を抑制してもよい。脱アミド化されるアミノ酸としてはアスパラギン、グルタミンを挙げることができるが、好ましくはアスパラギンである。アスパラギンに隣接するアミノ酸としては、特に限定されずどのようなアミノ酸でもよいが、アスパラギン−グリシン配列は特に脱アミド化されやすいことが知られているので、アスパラギンに隣接するアミノ酸としてはグリシンが好ましい。置換後のアミノ酸としては、アスパラギンおよびグルタミン以外であれば特に限定されず、如何なるアミノ酸でもよいが、好ましくはバリン、プロリン以外のアミノ酸であることが好ましい。従って、本発明においては、抗体の脱アミド化を目的とする場合には、アスパラギン、グルタミン、バリン、プロリン以外のアミノ酸に置換することが好ましい。アミノ酸置換による脱アミド化の抑制については、例えばWO03/057881を参考に行うことが可能である。脱アミド化抑制を目的にアミノ酸置換を行う場合には、置換前の抗原結合活性を維持していることが好ましい。
【0074】
さらに、抗体安定化の他の態様として、グルタミン酸の他のアミノ酸への置換を挙げることができる。また、本発明では、抗体重鎖の6番目がグルタミン酸である場合、該グルタミン酸をグルタミンに置換することにより、顕著に抗体を安定化できることを見いだした。したがって、本発明は、抗体重鎖の6番目のグルタミン酸をグルタミンに置換することにより抗体を安定化する方法に関する。抗体中のアミノ酸番号は当業者に公知である(例えば、Kabat, E. A. et al., "Sequences of Proteins of Immunological Interest", US Dept. Health and Human Services 1983)。
【0075】
本発明の抗体は、ポリエチレングリコール(PEG)、放射性物質、トキシン等の各種分
子と結合したコンジュゲート抗体でもよい。このようなコンジュゲート抗体は、得られた抗体に化学的な修飾を施すことによって得ることができる。なお、抗体の修飾方法はこの分野においてすでに確立されている。本発明における抗体にはこれらのコンジュゲート抗体も包含される。
【0076】
又、本発明に使用する抗体は二種特異性抗体(bispecific antibody)でもよい(例え
ば、Journal of Immunology, 1994, 152, 5368-5374、など)。二種特異性抗体は一方が
グリピカン3を認識し、他方が他の抗原を認識してもよいし、グリピカン3分子上の異なるエピトープを認識してもよい。
【0077】
また本発明の抗体は、そのN末端あるいはC末端に他のタンパク質を融合してもよい(Clinical Cancer Research, 2004, 10, 1274-1281)。融合するタンパク質は当業者が適宜
選択することができる。
【0078】
さらに、本発明の抗体は細胞障害活性が増強された抗体でもよい。細胞障害活性が増強された抗体としては、例えば、フコースが欠損した抗体、糖鎖にバイセクティング(bisecting)N−アセチルグルコサミン(GlcNAc)が付加した抗体、Fc領域のアミノ酸を置換することによりFcγ受容体との結合活性を変化させた抗体などを挙げることができる。これら細胞障害活性が増強された抗体は当業者に公知の方法で作製することができる。
【0079】
抗体の作成方法
グリピカン3に結合する抗体は当業者に公知の方法により作成することができる。例えば、モノクローナル抗体産生ハイブリドーマは、基本的には公知技術を使用し、以下のようにして作製できる。すなわち、グリピカン3タンパク質またはグリピカン3発現細胞を感作抗原として使用して、これを通常の免疫方法にしたがって哺乳動物を免疫する。得られる免疫細胞を通常の細胞融合法によって公知の親細胞と融合させ、通常のスクリーニング法により、モノクローナルな抗体産生細胞を選択することができる。
【0080】
具体的には、モノクローナル抗体を作製するには次のようにすればよい。まず、配列番号3および4に示されるグリピカン3遺伝子/アミノ酸配列にしたがってグリピカン3タンパク質を取得し、これを抗体取得の感作抗原として使用する。すなわち、グリピカン3をコードする遺伝子配列を公知の発現ベクター系に挿入して適当な宿主細胞を形質転換させた後、その宿主細胞中または培養上清中から目的のヒトグリピカン3タンパク質を公知の方法で精製する。
【0081】
次に、この精製グリピカン3タンパク質を感作抗原として用いる。あるいは、グリピカン3の部分ペプチドを感作抗原として使用することもできる。この際、部分ペプチドはヒトグリピカン3のアミノ酸配列にしたがって化学合成により得ることも可能である。
【0082】
本発明の抗グリピカン3抗体の認識するグリピカン3分子上のエピトープは特定のものに限定されず、グリピカン3分子上に存在するエピトープならばどのエピトープを認識してもよい。従って、本発明の抗グリピカン3抗体を作製するための抗原は、グリピカン3分子上に存在するエピトープを含む断片ならば、如何なる断片も用いることが可能である。
【0083】
感作抗原で免疫される哺乳動物としては、特に限定されるものではないが、細胞融合に使用する親細胞との適合性を考慮して選択するのが好ましく、一般的にはげっ歯類の動物、例えば、マウス、ラット、ハムスター、あるいはウサギ、サル等が使用される。
【0084】
感作抗原を動物に免疫するには、公知の方法にしたがって行われる。例えば、一般的方法として、感作抗原を哺乳動物の腹腔内または皮下に注射することにより行われる。具体的には、感作抗原をPBS(Phosphate-Buffered Saline)や生理食塩水等で適当量に希釈、懸濁したものに所望により通常のアジュバント、例えばフロイント完全アジュバントを適量混合し、乳化後、哺乳動物に4-21日毎に数回投与する。また、感作抗原免疫時に適当な担体を使用することもできる。
【0085】
このように哺乳動物を免疫し、血清中に所望の抗体レベルが上昇するのを確認した後に、哺乳動物から免疫細胞を採取し、細胞融合に付される。好ましい免疫細胞としては、特に脾細胞が挙げられる。
【0086】
前記免疫細胞と融合すべき親細胞として、哺乳動物のミエローマ細胞を用いる。このミエローマ細胞は、公知の種々の細胞株、例えば、P3(P3x63Ag8.653)(J. Immnol.(1979)123, 1548-1550)、 P3x63Ag8U.1(Current Topics in Microbiology and Immunology
(1978)81, 1-7)、 NS-1 (Kohler. G. and Milstein, C. Eur. J. Immunol.(1976)6
, 511-519)、MPC-11(Margulies. D.H. et al., Cell(1976)8, 405-415)、SP2/0 (Shulman, M. et al., Nature(1978)276, 269-270)、FO(deSt. Groth, S. F. et al., J. Immunol. Methods(1980)35, 1-21)、S194(Trowbridge, I. S. J. Exp. Med.(1978)148, 313-323)、R210(Galfre, G. et al., Nature(1979)277, 131-133)等が好適に使用される。
【0087】
前記免疫細胞とミエローマ細胞との細胞融合は、基本的には公知の方法、たとえば、ケーラーとミルステインらの方法(Kohler. G. and Milstein, C.、Methods Enzymol.(1981)73, 3-46)等に準じて行うことができる。
【0088】
より具体的には、前記細胞融合は、例えば細胞融合促進剤の存在下に通常の栄養培養液中で実施される。融合促進剤としては、例えばポリエチレングリコール(PEG)、センダ
イウイルス(HVJ)等が使用され、更に所望により融合効率を高めるためにジメチルスル
ホキシド等の補助剤を添加使用することもできる。
【0089】
免疫細胞とミエローマ細胞との使用割合は任意に設定することができる。例えば、ミエローマ細胞に対して免疫細胞を1-10倍とするのが好ましい。前記細胞融合に用いる培養液としては、例えば、前記ミエローマ細胞株の増殖に好適なRPMI1640培養液、MEM培養液、
その他、この種の細胞培養に用いられる通常の培養液が使用可能であり、さらに、牛胎児血清(FCS)等の血清補液を併用することもできる。
【0090】
細胞融合は、前記免疫細胞とミエローマ細胞との所定量を前記培養液中でよく混合し、予め37℃程度に加温したPEG溶液(例えば平均分子量1000-6000程度)を通常30-60%(w/v)の濃度で添加し、混合することによって目的とする融合細胞(ハイブリドーマ)を形成する。続いて、適当な培養液を逐次添加し、遠心して上清を除去する操作を繰り返すことによりハイブリドーマの生育に好ましくない細胞融合剤等を除去する。
【0091】
このようにして得られたハイブリドーマは、通常の選択培養液、例えばHAT培養液(ヒ
ポキサンチン、アミノプテリンおよびチミジンを含む培養液)で培養することにより選択される。上記HAT培養液での培養は、目的とするハイブリドーマ以外の細胞(非融合細胞
)が死滅するのに十分な時間(通常、数日〜数週間)継続する。ついで、通常の限界希釈法を実施し、目的とする抗体を産生するハイブリドーマのスクリーニングおよび単一クローニングを行う。
【0092】
また、ヒト以外の動物に抗原を免疫してハイブリドーマを得る方法の他に、ヒトリンパ球をin vitroでグリピカン3に感作し、感作リンパ球をヒト由来の永久分裂能を有するミエローマ細胞と融合させ、グリピカン3への結合活性を有する所望のヒト抗体を得ることもできる(特公平1-59878号公報参照)。さらに別の方法では、ヒト抗体遺伝子の全ての
レパートリーを有するトランスジェニック動物に抗原となるグリピカン3を投与して抗グリピカン3抗体産生細胞を取得し、これを不死化させ、その細胞からグリピカン3に対するヒト抗体を取得することができる(国際特許出願公開番号WO 94/25585 号公報、WO 93/12227 号公報、WO92/03918号公報、WO 94/02602 号公報参照)。
【0093】
このようにして作製されるモノクローナル抗体を産生するハイブリドーマは、通常の培養液中で継代培養することが可能であり、また、液体窒素中で長期保存することが可能である。
【0094】
当該ハイブリドーマからモノクローナル抗体を取得するには、当該ハイブリドーマを通常の方法にしたがい培養し、その培養上清として得る方法、あるいはハイブリドーマをこれと適合性がある哺乳動物に投与して増殖させ、その腹水として得る方法などが採用され
る。前者の方法は、高純度の抗体を得るのに適しており、一方、後者の方法は、抗体の大量生産に適している。
【0095】
抗体遺伝子をハイブリドーマからクローニングし、適当なベクターに組み込んで、これを宿主に導入し、遺伝子組換え技術を用いて産生させた組換え型の抗体を作製することも可能である(例えば、Vandamme, A. M. et al., Eur. J. Biochem.(1990)192, 767-775, 1990参照)。
【0096】
具体的には、抗グリピカン3抗体を産生するハイブリドーマから、抗グリピカン3抗体の可変(V)領域をコードするmRNAを単離する。mRNAの単離は、公知の方法、例えば、グ
アニジン超遠心法(Chirgwin, J. M. et al., Biochemistry(1979)18, 5294-5299)、AGPC法(Chomczynski, P.et al., Anal. Biochem.(1987)162, 156-159)等により行って全RNAを調製し、mRNA Purification Kit (Pharmacia製)等を使用して目的のmRNAを調製する。また、QuickPrep mRNA Purification Kit (Pharmacia製)を用いることによりmRNAを直接調製することもできる。
【0097】
得られたmRNAから逆転写酵素を用いて抗体V領域のcDNAを合成する。cDNAの合成は、AMVReverse Transcriptase First-strand cDNA Synthesis Kit(生化学工業社製)等を用い
て行う。また、cDNAの合成および増幅を行うには、5'-Ampli FINDER RACE Kit(Clontech製)およびPCRを用いた5'-RACE法(Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA(1988)85, 8998-9002、Belyavsky, A.et al., Nucleic Acids Res.(1989)17, 2919-2932)等を使用することができる。
【0098】
得られたPCR産物から目的とするDNA断片を精製し、ベクターDNAと連結する。さらに、
これより組換えベクターを作製し、大腸菌等に導入してコロニーを選択して所望の組換えベクターを調製する。そして、目的とするDNAの塩基配列を公知の方法、例えば、ジデオ
キシヌクレオチドチェインターミネーション法等により確認する。
【0099】
目的とする抗グリピカン3抗体のV領域をコードするDNAを得たのち、これを、所望の抗体定常領域(C領域)をコードするDNAを含有する発現ベクターへ組み込む。
【0100】
本発明で使用される抗グリピカン3抗体を製造するには、抗体遺伝子を発現制御領域、例えば、エンハンサー、プロモーターの制御のもとで発現するよう発現ベクターに組み込む。次に、この発現ベクターにより、宿主細胞を形質転換し、抗体を発現させる。
【0101】
抗体遺伝子の発現は、H鎖またはL鎖をコードするポリヌクレオチドを別々に発現ベクターに組み込んで宿主細胞を同時形質転換させてもよいし、あるいはH鎖およびL鎖をコードするポリヌクレオチドを単一の発現ベクターに組み込んで宿主細胞を形質転換させてもよい(WO 94/11523 号公報参照)。
【0102】
ポリヌクレオチド
別の観点においては、本発明は、本発明の抗体の重鎖可変領域または軽鎖可変領域をコードするポリヌクレオチドを提供する。好ましくは、本発明のポリヌクレオチドは、配列番号11−21、33−43、55−59、65−70、77−83のいずれかに記載の塩基配列を有する。また、該ポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、かつ本発明の抗体と同等の活性を有する抗体をコードするポリヌクレオチドも本発明の範囲内である。
【0103】
本発明のポリヌクレオチドは、本発明の抗体をコードする限り、特に限定されず、複数のデオキシリボ核酸(DNA)またはリボ核酸(RNA)等のヌクレオチドからなる重合体であ
る。天然以外の塩基を含んでいてよい。本発明のポリヌクレオチドは、抗体を遺伝子工学的な手法により製造するために使用することができる。また本発明の抗体と同等な機能を有する抗体をスクリーニングするために、プローブとして用いることもできる。即ち本発明の抗体をコードするポリヌクレオチド、またはその一部をプローブとして用い、ハイブリダイゼーション、遺伝子増幅技術(例えばPCR)等の技術により、該ポリヌクレオチド
とストリンジェントな条件下でハイブリダイズし、かつ本発明の抗体と同等の活性を有する抗体をコードするDNAを得ることができる。このようなDNAも本発明のポリヌクレオチドに含まれる。
【0104】
ハイブリダイゼーション技術(Sambrook,J et al., Molecular Cloning 2nd ed., 9.47-9.58, Cold Spring Harbor Lab. press, 1989)は当業者によく知られた技術である。ハイブリダイゼーションの条件としては、例えば、低ストリンジェントな条件が挙げられる。低ストリンジェントな条件とは、ハイブリダイゼーション後の洗浄において、例えば42℃、0.1×SSC、0.1%SDSの条件であり、好ましくは50℃、0.1×SSC 、0.1%SDSの条件で
ある。より好ましいハイブリダイゼーションの条件としては、高ストリンジェントな条件が挙げられる。高ストリンジェントな条件とは、例えば65℃、5×SSCおよび0.1%SDSの条件である。これらの条件において、温度を上げる程に高い相同性を有するポリヌクレオチドが効率的に得られることが期待できる。但し、ハイブリダイゼーションのストリンジェンシーに影響する要素としては温度や塩濃度など複数の要素が考えられ、当業者であればこれら要素を適宜選択することで同様のストリンジェンシーを実現することが可能である。
【0105】
これらハイブリダイゼーション技術や遺伝子増幅技術により得られるポリヌクレオチドがコードする、本発明の抗体と機能的に同等な抗体は、通常、これら抗体とアミノ酸配列において高い相同性を有する。本発明の抗体には、本発明の抗体と機能的に同等であり、かつ該抗体のアミノ酸配列と高い相同性を有する抗体も含まれる。高い相同性とは、アミノ酸レベルにおいて、通常、少なくとも50%以上の同一性、好ましくは75%以上の同一性、さらに好ましくは85%以上の同一性、さらに好ましくは95%以上の同一性を指す。ポリペプチドの相同性を決定するには、文献(Wilbur, W. J. and Lipman, D. J. Proc. Natl. Acad. Sci. USA (1983) 80, 726-730)に記載のアルゴリズムにしたがえばよい。
【0106】
本発明はまた、本発明のポリヌクレオチドを含むベクターを提供する。このようなベクターは、本発明の抗体を製造するために用いることができる。本発明のベクターとしては、例えば、大腸菌を宿主とする場合には、ベクターを大腸菌(例えば、JM109、DH5α、HB101、XL1Blue)などで大量に増幅させ大量調製するために、大腸菌で増幅されるための「ori」をもち、さらに形質転換された大腸菌の選抜遺伝子(例えば、なんらかの薬剤(ア
ンピシリンやテトラサイクリン、カナマイシン、クロラムフェニコール)により判別できるような薬剤耐性遺伝子)を有すれば特に制限はない。ベクターの例としては、M13系ベ
クター、pUC系ベクター、pBR322、pBluescript、pCR-Scriptなどが挙げられる。また、cDNAのサブクローニング、切り出しを目的とした場合、上記ベクターの他に、例えば、pGEM-T、pDIRECT、pT7などが挙げられる。
【0107】
本発明のベクターとしては、特に、発現ベクターが有用である。発現ベクターとしては、例えば、大腸菌での発現を目的とした場合は、ベクターが大腸菌で増幅されるような上記特徴を持つほかに、宿主をJM109、DH5α、HB101、XL1-Blueなどの大腸菌とした場合に
おいては、大腸菌で効率よく発現できるようなプロモーター、例えば、lacZプロモーター(Wardら, Nature (1989) 341, 544-546;FASEB J. (1992) 6, 2422-2427)、araBプロモーター(Betterら, Science (1988) 240, 1041-1043 )、またはT7プロモーターなどを持っていることが不可欠である。このようなベクターとしては、上記ベクターの他にpGEX-5X-1(ファルマシア社製)、「QIAexpress system」(キアゲン社製)、pEGFP、またはpET
(この場合、宿主はT7 RNAポリメラーゼを発現しているBL21が好ましい)などが挙げられる。
【0108】
また、ベクターには、ポリペプチド分泌のためのシグナル配列が含まれていてもよい。タンパク質分泌のためのシグナル配列としては、大腸菌のペリプラズムに産生させる場合、pelBシグナル配列(Lei, S. P. et al J. Bacteriol. (1987) 169, 4379)を使用すれ
ばよい。宿主細胞へのベクターの導入は、例えば塩化カルシウム法、エレクトロポレーション法を用いて行うことができる。
【0109】
大腸菌以外にも、例えば、本発明のベクターとしては、哺乳動物由来の発現ベクター(例えば、pcDNA3 (インビトロゲン社製)や、pEGF-BOS (Nucleic Acids. Res.1990, 18(17),p5322)、pEF 、pCDM8)、昆虫細胞由来の発現ベクター(例えば「Bac-to-BAC baculovirus expression system」(ギブコBRL社製)、pBacPAK8)、植物由来の発現ベクター(例えばpMH1、pMH2)、動物ウィルス由来の発現ベクター(例えば、pHSV、pMV、pAdexLcw)
、レトロウィルス由来の発現ベクター(例えば、pZIPneo)、酵母由来の発現ベクター(
例えば、「Pichia Expression Kit」(インビトロゲン社製)、pNV11、SP-Q01)、枯草菌由来の発現ベクター(例えば、pPL608、pKTH50)が挙げられる。
【0110】
CHO細胞、COS細胞、NIH3T3細胞等の動物細胞での発現を目的とした場合には、細胞内で発現させるために必要なプロモーター、例えばSV40プロモーター(Mulliganら, Nature (1979) 277, 108)、MMTV-LTRプロモーター、EF1αプロモーター(Mizushimaら, Nucleic Acids Res. (1990) 18, 5322)、CMVプロモーターなどを持っていることが不可欠であり
、細胞への形質転換を選抜するための遺伝子(例えば、薬剤(ネオマイシン、G418など)により判別できるような薬剤耐性遺伝子)を有すればさらに好ましい。このような特性を有するベクターとしては、例えば、pMAM、pDR2、pBK-RSV、pBK-CMV、pOPRSV、pOP13など
が挙げられる。
【0111】
さらに、遺伝子を安定的に発現させ、かつ、細胞内での遺伝子のコピー数の増幅を目的とする場合には、核酸合成経路を欠損したCHO細胞にそれを相補するDHFR遺伝子を有する
ベクター(例えば、pCHOIなど)を導入し、メトトレキセート(MTX)により増幅させることができる。また、遺伝子の一過性の発現を目的とする場合には、SV40 T抗原を発現する遺伝子を染色体上に持つCOS細胞を用いてSV40の複製起点を持つベクター(pcDなど)で形質転換することができる。複製開始点としては、また、ポリオーマウィルス、アデノウィルス、ウシパピローマウィルス(BPV)等の由来のものを用いることもできる。さらに、
宿主細胞系で遺伝子コピー数増幅のため、発現ベクターは選択マーカーとして、アミノグリコシドトランスフェラーゼ(APH)遺伝子、チミジンキナーゼ(TK)遺伝子、大腸菌キ
サンチングアニンホスホリボシルトランスフェラーゼ(Ecogpt)遺伝子、ジヒドロ葉酸還元酵素(dhfr)遺伝子等を含むことができる。
【0112】
本発明の抗体を製造するためには、該ベクターを宿主細胞に導入する。ベクターが導入される宿主細胞としては特に制限はなく、例えば、大腸菌や種々の動物細胞などを用いることが可能である。宿主細胞は、例えば、本発明の抗体の製造や発現のための産生系として使用することができる。ポリペプチド製造のための産生系は、in vitroおよびin vivo
の産生系がある。in vitroの産生系としては、真核細胞を使用する産生系や原核細胞を使用する産生系が挙げられる。
【0113】
真核細胞を使用する場合、例えば、動物細胞、植物細胞、真菌細胞を宿主に用いることができる。動物細胞としては、哺乳類細胞、例えば、CHO(J. Exp. Med. (1995) 108, 945)、COS、3T3、ミエローマ、BHK(baby hamster kidney)、HeLa、Vero、両生類細胞、
例えばアフリカツメガエル卵母細胞(Valle, et al., Nature (1981) 291, 358-340)、
あるいは昆虫細胞、例えば、Sf9、Sf21、Tn5が挙げられる。本発明においては、CHO-DG44、CHO-DXB11、COS7細胞、BHK細胞が好適に用いられる。動物細胞において、大量発現を目的とする場合には特にCHO細胞が好ましい。宿主細胞へのベクターの導入は、例えば、リ
ン酸カルシウム法、DEAEデキストラン法、カチオニックリボソームDOTAP(ベーリンガー
マンハイム社製)を用いた方法、エレクトロポーレーション法、リポフェクションなどの方法で行うことが可能である。
【0114】
植物細胞としては、例えば、ニコチアナ・タバカム(Nicotiana tabacum)由来の細胞
がタンパク質生産系として知られており、これをカルス培養すればよい。真菌細胞としては、酵母、例えば、サッカロミセス(Saccharomyces)属、例えば、サッカロミセス・セ
レビシエ(Saccharomyces cerevisiae)、サッカロミセス・ポンベ(Saccharomyces pombe)糸状菌、例えば、アスペルギルス(Aspergillus)属、例えば、アスペルギルス・ニガー(Aspergillus niger)が挙げられる。
【0115】
原核細胞を使用する場合、細菌細胞を用いる産生系を使用することができる。細菌細胞としては、大腸菌(E. coli)、例えば、JM109、DH5α、HB101等、および枯草菌が挙げられる。
【0116】
組換え抗体の製造
本発明の抗体は、上記宿主細胞を培養することにより製造することができる。目的とするポリヌクレオチドにより形質転換された細胞をin vitroで培養することにより、抗体が得られる。培養は、公知の方法に従い行うことができる。例えば、動物細胞の培養液として、例えば、DMEM、MEM、RPMI1640、IMDMを使用することができる。その際、FBS、牛胎児血清(FCS)等の血清補液を併用することもできるし、無血清培養してもよい。培養時のpHは、約6〜8であるのが好ましい。培養は、通常、約30〜40℃で約15〜200時間行い、必要に応じて培地の交換、通気、攪拌を加える。
【0117】
一方、in vivoでポリペプチドを産生させる系としては、例えば、動物を使用する産生
系や植物を使用する産生系が挙げられる。これらの動物または植物に目的とするポリヌクレオチドを導入し、動物または植物の体内でポリペプチドを産生させ、回収する。本発明における「宿主」とは、これらの動物、植物を包含する。
【0118】
動物を使用する場合、哺乳類動物、昆虫を用いる産生系がある。哺乳類動物としては、ヤギ、ブタ、ヒツジ、マウス、ウシを用いることができる(Vicki Glaser, SPECTRUM Biotechnology Applications, 1993)。また、哺乳類動物としてトランスジェニック動物を
用いることができる。
【0119】
例えば、目的とするポリヌクレオチドを、ヤギβカゼインのような乳汁中に固有に産生されるポリペプチドをコードする遺伝子との融合遺伝子として調製する。次いで、この融合遺伝子を含むDNA断片をヤギの胚へ注入し、この胚を雌のヤギへ移植する。胚を受容し
たヤギから生まれるトランスジェニックヤギまたはその子孫が産生する乳汁から、目的の抗体を得ることができる。トランスジェニックヤギから産生される抗体を含む乳汁量を増加させるために、適宜ホルモンをトランスジェニックヤギに使用してもよい(Ebert, K.M. et al., Bio/Technology (1994) 12, 699-702)。
【0120】
また、昆虫としては、例えばカイコを用いることができる。カイコを用いる場合、目的の抗体をコードするポリヌクレオチドを挿入したバキュロウィルスをカイコに感染させることにより、このカイコの体液から目的の抗体を得ることができる(Susumu, M. et al.,Nature (1985) 315, 592-594)。
【0121】
さらに、植物を使用する場合、例えばタバコを用いることができる。タバコを用いる場合、目的とする抗体をコードするポリヌクレオチドを植物発現用ベクター、例えばpMON 530に挿入し、このベクターをアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)のようなバクテリアに導入する。このバクテリアをタバコ、例えば、ニコチ
アナ・タバカム(Nicotiana tabacum)に感染させ、本タバコの葉より所望の抗体を得る
ことができる(Julian K.-C. Ma et al., Eur. J. Immunol. (1994) 24, 131-138)。
【0122】
以上のようにして得られた抗体は、宿主細胞内または細胞外(培地など)から単離し、実質的に純粋で均一な抗体として精製することができる。抗体の分離、精製は、通常のポリペプチドの精製で使用されている分離、精製方法を使用すればよい。例えば、クロマトグラフィーカラム、フィルター、限外濾過、塩析、溶媒沈殿、溶媒抽出、蒸留、免疫沈降、SDS-ポリアクリルアミドゲル電気泳動、等電点電気泳動法、透析、再結晶等を適宜選択、組み合わせればポリペプチドを分離、精製することができる。
【0123】
クロマトグラフィーとしては、例えばアフィニティークロマトグラフィー、イオン交換クロマトグラフィー、疎水性クロマトグラフィー、ゲル濾過、逆相クロマトグラフィー、吸着クロマトグラフィー等が挙げられる(Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press, 1996)。これらのクロマトグラフィーは、液相クロマトグラフィー、例えばHPLC、FPLC等の液相クロマトグラフィーを用いて行うことができる。アフィニティークロマトグラフィーに用いるカラムとしては、プロテインAカラム、プロ
テインGカラムが挙げられる。例えば、プロテインAを用いたカラムとして、Hyper D, POROS, Sepharose F. F. (Pharmacia)等が挙げられる。
【0124】
なお、抗体の精製前または精製後に適当なタンパク質修飾酵素を作用させることにより、任意に修飾を加えたり部分的にペプチドを除去することもできる。タンパク質修飾酵素としては、例えば、トリプシン、キモトリプシン、リシルエンドペプチダーゼ、プロテインキナーゼ、グルコシダーゼなどが用いられる。
【0125】
診断方法
別の観点においては、本発明は、本発明の抗体を用いて被検試料中のGPC3タンパク質を検出し、癌などの疾患の診断を行う方法を提供する。
【0126】
検出とは、定量的または非定量的な検出を含み、例えば、非定量的な検出としては、単にGPC3タンパク質が存在するか否かの測定、GPC3タンパク質が一定の量以上存在するか否かの測定、GPC3タンパク質の量を他の試料(例えば、コントロール試料など)と比較する測定などを挙げることができ、定量的な検出としては、GPC3タンパク質の濃度の測定、GPC3タンパク質の量の測定などを挙げることができる。
【0127】
被検試料とは、GPC3タンパク質が含まれる可能性のある試料であれば特に制限されないが、哺乳類などの生物の体から採取された試料が好ましく、さらに好ましくはヒトから採取された試料である。被検試料の具体的な例としては、例えば、血液、間質液、血漿、血管外液、脳脊髄液、滑液、胸膜液、血清、リンパ液、唾液、などを挙げることができるが、好ましいものは血液、血清、血漿である。また、生物の体から採取された細胞の培養液などの、被検試料から得られる試料も本発明の被検試料に含まれる。
【0128】
診断される癌は、特に制限されず、具体的には、肝癌、膵臓癌、肺癌、大腸癌、乳癌、前立腺癌、白血病、リンパ腫などを挙げることができるが、好ましいものは肝癌である。検出するGPC3は、特に限定されず、全長GPC3でも、その断片でもよい。GPC3断片を検出する場合には、N端断片でもC端断片でもよいが、好ましくはN端断片である。また、ヘパ
ラン硫酸などが付加されたGPC3タンパク質でも、GPC3コアタンパク質でもよい。
【0129】
被検試料に含まれるGPC3タンパク質の検出方法は特に限定されないが、抗GPC3抗体を
用いた免疫学的方法により検出することが好ましい。免疫学的方法としては、例えば、ラジオイムノアッセイ、エンザイムイムノアッセイ、蛍光イムノアッセイ、発光イムノアッセイ、免疫沈降法、免疫比濁法などを挙げることができるが、好ましくはエンザイムイムノアッセイであり、特に好ましいものは酵素結合免疫吸着定量法(enzyme-linked immunosorbent assay:ELISA)(例えば、sandwich ELISA)である。ELISAなどの上述した免疫学
的方法は当業者に公知の方法により行うことが可能である。
【0130】
抗GPC3抗体を用いた一般的な検出方法としては、例えば、抗GPC3抗体を支持体に固定し、ここに被検試料を加え、インキュベートを行い抗GPC3抗体とGPC3タンパク質を結合させた後に洗浄して、抗GPC3抗体を介して支持体に結合したGPC3タンパク質を検出することにより、被検試料中のGPC3タンパク質の検出を行う方法を挙げることができる。
【0131】
抗GPC3抗体とGPC3タンパク質との結合は、通常、緩衝液中で行われる。緩衝液としては、例えば、リン酸緩衝液、Tris緩衝液などが使用される。また、インキュベーションの条件としては、すでによく用いられている条件、例えば、4℃〜室温にて1時間〜24時間のインキュベーションが行われる。インキュベート後の洗浄は、GPC3タンパク質と抗GPC3抗体の結合を妨げないものであれば何でもよく、例えば、Tween20等の界面活性剤を含む
緩衝液などが使用される。
【0132】
本発明のGPC3タンパク質検出方法においては、GPC3タンパク質を検出したい被検試料の他に、コントロール試料を設置してもよい。コントロール試料としては、GPC3タンパク質を含まない陰性コントロール試料やGPC3タンパク質を含む陽性コントロール試料などがある。この場合、GPC3タンパク質を含まない陰性コントロール試料で得られた結果、GPC3タンパク質を含む陽性コントロール試料で得られた結果と比較することにより、被検試料中のGPC3タンパク質を検出することが可能である。また、コントロール試料および被検試料の検出結果を数値として得、それらの数値を比較することにより、被検試料に含まれるGPC3タンパク質を定量的に検出することも可能である。
【0133】
抗GPC3抗体を介して支持体に結合したGPC3タンパク質の検出の好ましい態様として、標識物質で標識された抗GPC3抗体を用いる方法を挙げることができる。例えば、支持体に固定された抗GPC3抗体に被検試料を接触させ、洗浄後に、GPC3タンパク質を特異的に結合する標識抗体を用いてGPC3を検出することができる。
【0134】
抗GPC3抗体の標識は通常知られている方法により行うことが可能である。標識物質としては、蛍光色素、酵素、補酵素、化学発光物質、放射性物質などの当業者に公知の標識物質を用いることが可能であり、具体的な例としては、ラジオアイソトープ(32P、14C、125I、3H、131Iなど)、フルオレセイン、ローダミン、ダンシルクロリド、ウンベリフェロン、ルシフェラーゼ、ペルオキシダーゼ、アルカリホスファターゼ、β-ガラクトシダーゼ
、β-グルコシダーゼ、ホースラディッシュパーオキシダーゼ、グルコアミラーゼ、リゾ
チーム、サッカリドオキシダーゼ、マイクロペルオキシダーゼ、ビオチンなどを挙げることができる。標識物質としてビオチンを用いる場合には、ビオチン標識抗体を添加後に、アルカリホスファターゼなどの酵素を結合させたアビジンをさらに添加することが好ましい。
【0135】
具体的には、抗GPC3抗体を含む溶液をプレートなどの支持体に加え、抗GPC3抗体を固定する。プレートを洗浄後、タンパク質の非特異的な結合を防ぐため、例えばBSAなどでブ
ロッキングする。再び洗浄し、被検試料をプレートに加える。インキュベートの後、洗浄
し、標識抗GPC3抗体を加える。適度なインキュベーションの後、プレートを洗浄し、プレートに残った標識抗GPC3抗体を検出する。タンパク質の検出は当業者に公知の方法により行うことができ、例えば、放射性物質による標識の場合には液体シンチレーションやRIA
法により検出することができる。酵素による標識の場合には基質を加え、基質の酵素的変化、例えば発色を吸光度計により検出することができる。蛍光物質の場合には蛍光光度計により検出することができる。
【0136】
本発明のGPC3タンパク質検出方法の特に好ましい態様として、ビオチンで標識された抗GPC3抗体およびアビジンを用いる方法を挙げることができる。具体的には、抗GPC3抗体を含む溶液をプレートなどの支持体に加え、抗GPC3抗体を固定する。プレートを洗浄後、タンパク質の非特異的な結合を防ぐため、例えばBSAなどでブロッキングする。再び洗浄し
、被検試料をプレートに加える。インキュベートの後、洗浄し、ビオチン標識抗GPC3抗体を加える。適度なインキュベーションの後、プレートを洗浄し、アルカリホスファターゼ、ペルオキシダーゼなどの酵素と結合したアビジンを加える。インキュベーション後、プレートを洗浄し、アビジンに結合している酵素に対応した基質を加え、基質の酵素的変化などを指標にGPC3タンパク質を検出する。
【0137】
本発明のGPC3タンパク質検出方法の他の態様として、GPC3タンパク質を特異的に結合する一次抗体、および該一次抗体を特異的に結合する二次抗体を用いる方法を挙げることができる。例えば、支持体に固定された抗GPC3抗体に被検試料を接触させ、インキュベーションした後、洗浄し、洗浄後に結合しているGPC3タンパク質を、一次抗GPC3抗体および該一次抗体を特異的に結合する二次抗体により検出する。この場合、二次抗体は好ましくは標識物質により標識されている。
【0138】
具体的には、抗GPC3抗体を含む溶液をプレートなどの支持体に加え、抗GPC3抗体を固定する。プレートを洗浄後、タンパク質の非特異的な結合を防ぐため、例えばBSAなどでブ
ロッキングする。再び洗浄し、被検試料をプレートに加える。インキュベートの後、洗浄し、一次抗GPC3抗体を加える。適度なインキュベーションの後、プレートを洗浄し、次いで一次抗体を特異的に結合する二次抗体を加える。適度なインキュベーションの後、洗浄して、プレートに残った二次抗体を検出する。二次抗体の検出は前述の方法により行うことができる。
【0139】
医薬組成物
別の観点においては、本発明は、本発明の抗体を含有する医薬組成物を提供する。本発明の抗体を含有する医薬組成物は癌などの細胞増殖に関連する疾患の治療および/または予防に有用であり、特に肝癌の治療および/または予防に有用である。本発明の抗体を医薬組成物として用いる場合には、当業者に公知の方法で製剤化することが可能である。例えば、水もしくはそれ以外の薬学的に許容し得る液との無菌性溶液、または懸濁液剤の注射剤の形で非経口的に使用できる。例えば、薬理学上許容される担体もしくは媒体、具体的には、滅菌水や生理食塩水、植物油、乳化剤、懸濁剤、界面活性剤、安定剤、香味剤、賦形剤、ベヒクル、防腐剤、結合剤などと適宜組み合わせて、一般に認められた製薬実施に要求される単位用量形態で混和することによって製剤化することが考えられる。これら製剤における有効成分量は指示された範囲の適当な用量を投与しうるよう選択する。
【0140】
注射のための無菌組成物は注射用蒸留水のようなベヒクルを用いて通常の製剤実施に従って処方することができる。
【0141】
注射用の水溶液としては、例えば生理食塩水、ブドウ糖やその他の補助薬を含む等張液、例えばD-ソルビトール、D-マンノース、D-マンニトール、塩化ナトリウムが挙げられ、適当な溶解補助剤、例えばアルコール、具体的にはエタノール、ポリアルコール、例えば
プロピレングリコール、ポリエチレングリコール、非イオン性界面活性剤、例えばポリソルベート80(TM)、HCO-50と併用してもよい。
【0142】
油性液としてはゴマ油、大豆油があげられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコールと併用してもよい。また、緩衝剤、例えばリン酸塩緩衝液、酢酸ナトリウム緩衝液、無痛化剤、例えば、塩酸プロカイン、安定剤、例えばベンジルアルコール、フェノール、酸化防止剤と配合してもよい。調製された注射液は通常、適当なアンプルに充填させる。
【0143】
投与は好ましくは非経口投与であり、具体的には、注射剤型、経鼻投与剤型、経肺投与剤型、経皮投与型などが挙げられる。注射剤型の処方は、例えば、静脈内注射、筋肉内注射、腹腔内注射、皮下注射などにより全身または局部的に投与することができる。
【0144】
また、患者の年齢、症状により適宜投与方法を選択することができる。抗体または抗体をコードするポリヌクレオチドを含有する医薬組成物の投与量としては、例えば、一回につき体重1kgあたり0.0001mgから1000mgの範囲で選ぶことが可能である。あるいは、例え
ば、患者あたり0.001〜100000mg/bodyの範囲で投与量を選ぶことができるが、これらの数値に必ずしも制限されるものではない。投与量、投与方法は、患者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。
【0145】
本明細書において明示的に引用される全ての特許および参考文献の内容は全て本明細書の一部としてここに引用する。また,本出願が有する優先権主張の基礎となる出願である日本特許出願2004−203637号の明細書および図面に記載の内容は全て本明細書の一部としてここに引用する。
【0146】
以下に実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【実施例】
【0147】
以下に実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【0148】
実施例1
ヒトグリピカン3(GPC3)のcDNAクローニング
ヒトGPC3をコードする全長cDNAは、大腸癌細胞株Caco2より常法により調製した1st strand cDNAを鋳型とし、Advantage2 kit(CLONTECH社)を用いたPCR反応により増幅した。
【0149】
すなわち、2 μlのCaco2由来cDNA、1μlのセンスプライマー(GATATC-ATGGCCGGGACCGTGCGCACCGCGT:配列番号1)、1μlのアンチセンスプライマー(GCTAGC-TCAGTGCACCAGGAAGAAGAAGCAC:配列番号2)、5μlのAdvantage2 10xPCR buffer、8μlのdNTP mix (1.25 mM)
、1.0μlのAdvantage polymerase Mixを含む50μlの反応液を、94 ℃で1分、63 ℃で30秒、68 ℃で3分からなるサイクルを35回行った。PCR反応による増幅産物はpGEM-T Easy VectorSystem I(Promega社)を用いてTAベクターpGEM-T easyに挿入した。ABI3100 DNAシーケンサーを用い配列の確認を行った結果、ヒトGPC3の全長をコードするcDNAを単離した。配列番号3で表される配列はヒトGPC3遺伝子の塩基配列を、配列番号4で表される配列はヒトGPC3タンパク質のアミノ酸配列を示す。
【0150】
実施例2
可溶型GPC3の作製
抗GPC3抗体作製のための免疫タンパク質として、C末端側の疎水性領域(564-580アミ
ノ酸)を欠損させた可溶型GPC3タンパク質を作製した。
【0151】
完全長ヒトGPC3 cDNAを鋳型としてアンチセンスプライマー(ATA GAA TTC CAC CAT GGCCGG GAC CGT GCG C:配列番号5)とEcoRI認識配列、Kozak配列を加えたセンスプライマ
ー(ATA GGA TCC CTT CAG CGG GGA ATG AAC GTT C:配列番号6)を用いてPCRを行った。得られたPCR断片(1711bp)をpCXND2-Flagにクローニングした。pCXND2-Flagは、pCXN2(Niwaら、Gene 1991;108;193-199)のHindIII部位にpCHOI(Hirataら、FEBS letter 1994;356;244−248)のDHFR遺伝子発現領域を挿入し、また、マルチクローニングサイトの下流にFlagタグ配列を付加し、Flagタグ付加タンパクとして発現されるよう設計した。作製された発現プラスミドDNAをCHO細胞DXB11株へ導入し、500μg/mL Geneticin での選抜によ
り、可溶型GPC3高発現CHO株を得た。1700 cm2ローラーボトルを用い可溶型GPC3高発現CHO株の大量培養を行い、培養上清を回収し精製を行った。培養上清をDEAE sepharose Fast Flow (Amersham社)にチャージし、洗浄後、500mM NaClを含むバッファにより溶出した。
次に、Anti-Flag M2 agarose affinity gel(SIGMA社)を用いてアフィニティー精製を行った。溶出は200μg/mLのFLAGペプチドにより行った。Centriprep-10(Millipore社)によ
る濃縮後、Superdex 200 HR 10/30(Amersham社)によるゲルろ過を行いFLAGペプチドを除
去した。最後にDEAE sepharose Fast Flowカラムを用いて濃縮し、同時にTween20を含ま
ないPBS(500mMのNaClを含む)で溶出を行うことによりバッファ置換を行った。
【0152】
実施例3
可溶型GPC3コアタンパク質の作製
GPC3はヘパラン硫酸による修飾を受け巨大分子となる。抗GPC3抗体のスクリーニングにおいてヘパラン硫酸に対する抗体を排除する為、ヘパラン硫酸付加部位に点変異を導入した可溶型GPC3コアタンパク質を作製し、スクリーニングに用いた。
【0153】
上記可溶型GPC3(1-563)を鋳型とし、アッセンブリーPCR法によって495番目と509番目のSerをAlaに置換させたcDNAを作製した。この際、C末端にHisタグが付加されるようにプライマーを設計し、得られたcDNAをpCXND3ベクターにクローニングした。pCXND3は、pCXN2のHindIII部位にpCHOIのDHFR遺伝子発現部位を挿入して作製した。作製された発現プラ
スミドDNAをDXB11株へ導入し、500μg/mL Geneticin での選抜により、可溶型GPC3コアタンパク質高発現CHO株を得た。
【0154】
1700 cm2ローラーボトルを用い大量培養を行い、培養上清を回収し精製を行った。培養上清をQ sepharose Fast Flow (Amersham社)にチャージし、洗浄後、500mM NaClを含むリン酸バッファにより溶出した。次に、Chelating sepharose Fast Flow (Amersham社)を
用いてアフィニティー精製を行った。10〜150mMのイミダゾールでグラジエント溶出を行
った。最後にQ sepharose Fast Flow を用いて濃縮し、500mM NaClを含むリン酸バッファにより溶出した。
【0155】
還元条件下にてSDSポリアクリルアミドゲル電気泳動の結果、70kDa、40kDa、30kDaの3
つのバンドが得られた。ABI492 protein sequencer(Applied Biosystems社)を用いてアミノ酸シークエンスを行った結果、30kDaのバンドはGPC3の359番目以降、もしくは375番
目以降のアミノ酸配列と一致し、GPC3はArg358とSer359の間、若しくはLys374とVal375の間で切断を受け、40kDaのN末端断片と30kDaのC末端側断片に分割していることが判明し
た。
【0156】
実施例4
全長ヒトGPC3発現CHO細胞株の作製
フローサイトメトリを用いた結合活性評価用の細胞株を得るために、全長GPC3を発現するCHO細胞株の樹立を行った。
【0157】
10μgの全長ヒトGPC3遺伝子発現ベクターと60μLのSuperFect(QIAGEN社)を混合し
、複合体を形成させた後に、CHO細胞DXB11株に添加することにより、遺伝子導入を行った。CO2インキュベーターで24時間培養後、終濃度0.5mg/mLのGeneticinおよび10% FBSを
含むαMEM(GIBCO BRL社)を用いて、選抜を開始した。得られたGeneticin耐性コロニー
を集め、限界希釈法により細胞のクローニングを行った。それぞれの細胞クローンを可溶化し、抗GPC3抗体を用いたウエスタンブロットにより全長ヒトGPC3の発現を確認し、安定発現細胞株を取得した。
【0158】
実施例5
ELISAによる結合活性の評価
可溶型GPC3コアタンパク質を1μg/mLとなるようにコーティングバッファ(0.1mol/L NaHCO3 (pH9.6), 0.02%(w/v) NaN3)で希釈したものをイムノプレートに加え、4℃にて一晩放置しコーティングした。希釈バッファ (50 mmol/L Tris-HCl(pH8.1), 1 mmol/L MgCl2,150 mmol/L NaCl, 0.05%(v/v) Tween 20, 0.02%(w/v) NaN3, 1%(w/v) BSA)にてブロッキン
グ処理を行った後、抗GPC3抗体を加え、室温で1時間放置した。リンスバッファ(0.05%(v/v) Tween 20, PBS)にて洗浄後、アルカリホスファターゼ標識した抗マウスIgG抗体(ZYMED社)を加え、室温で1時間放置した。リンスバッファにて洗浄後、SIGMA104(SIGMA社)を1 mg/mLとなるように基質バッファ(50mmol/L NaHCO3(pH9.8), 10 mmol/L MgCl2)に希釈したものを添加し、室温で1時間発色させた後、Benchmark Plus (BIO-RAD)を用いて吸光
度(405nm, 参照波長655nm)を測定した。
【0159】
実施例6
可溶型GPC3の免疫およびハイブリドーマの選抜
ヒトGPC3とマウスGPC3のホモロジーはアミノ酸レベルで94%の高い相同性を示すため、
通常のマウスに免疫しても抗GPC3抗体を得難い可能性を考え、自己免疫疾患マウスであるMRL/MpJUmmCrj-lpr/lprマウス(以下、MRL/lprマウス、日本チャールズ・リバーより購入)を免疫動物として用いた。7週齢、もしくは8週齢より免疫を開始し、初回免疫には可溶型GPC3を100μg/headとなるように調製し、フロイント完全アジュバント(FCA、ベクトンディッキンソン社)を用いてエマルジョン化したものを皮下に投与した。2週間後に50μg/headとなるように調製したものをフロイント不完全アジュバント(FIA、ベクトンディッキンソン社)でエマルジョン化したものを皮下に投与した。以降1週間間隔で追加免疫を合計5回行った。その内2匹に対し、最終免疫として50μg/headとなるようにPBSに希釈し尾静脈内に投与した。最終免疫の4日後、脾臓細胞を摘出し、マウスミエローマ細胞P3-X63Ag8U1(P3U1、ATCCより購入)と2:1になるように混合し、PEG1500(ロシュ・ダイアグ
ノスティック社)を徐々に加える事により細胞融合を行った。慎重にRPMI1640培地(GIBCO BRL社)を加えPEG1500を希釈し、遠心操作によりPEG1500を除去した後、10%FBS入りRPMI1640にて懸濁したものを100μL /ウエルとなるように96穴培養プレートに播種した。翌日、100μL /ウエルとなるように10%FBS、1 x HAT media supplement (SIGMA社)、0.5 x BM-Condimed H1 Hybridoma cloning supplement (ロシュ・ダイアグノスティック社)
を含むRPMI1640 (以降、HAT培地)を添加した。2, 3, 5日後に培養液の半分をHAT培地に
置き換え、7日後の培養上清を用いてスクリーニングを行った。スクリーニングは可溶型GPC3コアタンパク質を固相化したイムノプレートを用いたELISAにより行った。陽性クローンについては限界希釈法によりモノクローン化した。その結果、GPC3に対して強い結合活性を有する抗体を11クローン(M3C11、M13B3、M1E7、M3B8、M11F1、L9G11、M19B11、M6B1、M18D4、M5B9、M10D2)取得した。
【0160】
実施例7
抗GPC3抗体のアイソタイプの決定、および精製
アイソタイプは、Immunopure Monoclonal Antibody Isotyping Kit I (PIERCE社)を用
いた抗原依存的ELISAにより決定した。抗体の精製は、FBS(Ultra low IgG)(GIBCO BRL社)を添加したHAT培地にて培養したハイブリドーマの培養上清を、Hi Trap ProteinG HP(Amersham社)に吸着させた後、結合バッファ(20mM Sodium phosphate (pH7.0))にて洗浄
後、溶出バッファ(0.1M Glycine-HCl (pH2.7))で溶出した。溶出液は直ちに中和バッファ(1M Tris-HCl(pH9.0))で中和した。PBSで一昼夜透析を行いバッファ置換した。
【0161】
実施例8
ELISAによる結合活性の評価
取得された抗GPC3抗体の結合活性を簡便に評価する為、可溶型GPC3コアタンパク質を固相化したイムノプレートに対する抗体濃度依存的な結合を検出した。精製抗体を10μg/mLから3倍ずつ12段階に希釈したものを加え、2次抗体として抗マウスIgG抗体を添加し、SIGMA104による発色を行った。発色の程度は発色時間により変化するので、データは正確に1時間後に測定したものを解析した。各抗体は全て濃度依存的な発色を示した。抗体濃
度と発色の程度との相関をプロットし、解析ソフトGraphPad Prismを用いて近似曲線を作成し、そのEC50値を結合活性の指標として決定した。図16に全クローンのEC50値を示した。
【0162】
実施例9
フローサイトメトリによる結合活性の評価
1mM EDTA pH8.0 (GIBCO社)/ PBSにて細胞を剥離し、1x106細胞/mLになるようにFACS バッファ (1% FBS/PBS)に懸濁した。100μL/ウエルとなるようにMultiscreen - HV Filter Plates (Millipor社)に分注し、遠心操作にて上清を除去した。適当な濃度に希釈した抗GPC3抗体を加え、氷上にて30分間反応させた。細胞をFACS バッファにて1回洗浄し、FITC
標識抗マウスIgG抗体を添加し、氷上にて30分間反応させた。反応後、500rpmで1分間遠
心し、上清を除き、FACS バッファ 400μLに懸濁し、フローサイトメトリーに供した。フローサイトメーターはEPICS ELITE ESP (Beckman Coulter)を用いた。前方散乱光(forward scatter)および側方散乱光(side scatter)のヒストグラムにて生細胞集団にゲートを設定した。図1に示すように抗GPC3抗体(M3C11、M11F1)はGPC3を発現させたCHO細胞
に強く結合し、親株であるCHO細胞には結合しない事から、細胞膜上に提示されたGPC3に
特異的に結合する事が判明した。また、肝癌細胞株であるHepG2(ATCCより購入)、HuH-7(ヒューマンサイエンス研究資源バンクより購入)に対して結合を示したことから、肝細胞癌を特異的に認識する可能性が示された。可溶型GPC3免疫マウス由来クローンのフローサイトメトリによる結合活性については抗体濃度5μg/mLにおけるヒストグラムのX-mode
値を図16に示す。
【0163】
実施例10
競合ELISAによるエピトープ分類
得られた抗体についてエピトープによる分類を行う為、競合ELISAを実施した。抗体の
ビオチン化はBiotin Labeling Kit(Roche社)を用いて行った。可溶型GPC3コアタンパク質を1μg/mLとなるようにコーティングバッファで希釈したものを100μL/ウエルとなるように加え、一晩4℃で保管しコーティングした。翌日200μLの基質バッファを加えブロッ
キングを行った。4℃で一晩以上放置したプレートへ抗GPC3抗体を100μL/ウエルとなるように加え、室温で1時間反応させた。その後プレートの洗浄なしに10μg/mLのビオチン標
識した抗GPC3抗体10μLを加えさらに1時間反応させた。300μL/ウエルのリンスバッファ
で3回洗浄し、希釈バッファで1000倍に希釈したAP-ストレプトアビジンコンジュゲート(ZYMED社)を100μL/ウエルとなるように加え、室温で1時間反応させた。300μL/ウエルのリンスバッファで5回洗浄し、SIGMA104を1mg/mLとなるように基質バッファで希釈したもの
を100μL/ウエルとなるように加えた。1時間室温でインキュベートした後、吸光度(405nm, 参照波長 655nm)を測定した。
【0164】
図2に競合ELISAの結果を示す。ビオチン化抗体の結合を50%以上競合的に阻害した抗体については、エピトープが立体的に近傍であると判断した。8種類のビオチン化抗体の結合に対する競合的な発色の阻害のパターンによりグループ分けした結果、可溶型GPC3免疫マウス由来の11クローンは5つのグループ(a, b, c, d, e)に分類された(図16)。
【0165】
実施例11
ウエスタンブロッティングによるエピトープ分類
可溶型GPC3コアタンパク質を還元条件下にて10%SDS-PAGE mini (TEFCO社)にチャージし電気泳動後、Trans−Blot SD Semi-Dry Electrophoretic Transfer Cell (BIO-RAD社)を
用いてイモビロン-P(Millipore社)へ移した。膜をTBS-T(0.05% Tween20, TBS)で軽く洗った後、5%スキムミルク入りTBS-Tで1時間振とうした。TBS-Tで約10分間振とうした後
、1%スキムミルク入りTBS-Tで希釈した各抗GPC3抗体を加え1時間振とうした。TBS-Tで洗った後1%スキムミルク入りTBS-Tで希釈したHRP-抗マウスIgG抗体(Amersham社)で1時間
振とう後、TBS-Tで洗った。発色はECL-Plus (Amersham社)を用いて行い、Hyperfilm ECL
(Amersham社)を用いて検出した。
【0166】
図3に示すように、L9G11は40kDa付近のバンドに結合することからN端側結合抗体であ
ると判断された。M3C11は30kDa付近のバンドに結合することからC端側に結合する抗体と
判断した。競合ELISAでc, d, eに属する抗体は全てN末端に結合し、a、bは全てC末端に結合した(図16)。L9G11は他のN端側結合抗体と比較してウエスタンブロッティングの検出感度が高く、N端側断片をウエスタンブロッティングにより検出するにあたって有用な
抗体であると考えられた。
【0167】
実施例12
分泌型GPC3の検出
GPC3が358番目のアミノ酸部位、若しくは374番目のアミノ酸部位で切断される事実を見出し、分泌型GPC3が肝癌患者の血中に分泌されるという仮説を立てた。そこで分泌型GPC3を検出する為、GPC3サンドイッチELISA系を構築した。
【0168】
イムノプレートに10μg/mLとなるように抗GPC3抗体をコートし、基質バッファを用いてブロッキングを行った。室温で数時間後、あるいは4℃で一晩保管後、HepG2の培養上清を加え1時間室温でインキュベートした。300μL/ウェルのリンスバッファで3回洗浄後、10
μg/mLとなるように希釈したビオチン標識した抗GPC3抗体を加え1時間室温でインキュベ
ートした。300μL/ウェルのリンスバッファで3回洗浄後、AP-ストレプトアビジンを加え
、1時間室温でインキュベートした。300μL/ウエルのリンスバッファで5回洗浄した後、添付のプロトコールに従いAMPAK(DAKO社)を用いて発色させ、マイクロプレートリーダ
ーで吸光度を測定した。N端断片に結合する抗体(M6B1、M19B11、M18D4)とC端断片に結
合する抗体(M3C11、M13B3、M3B8)を組み合わせ5種類のサンドイッチELISA系を構築した。いずれの組み合わせも分泌型GPC3を用いたスタンダード曲線では同等の感度を示した。HepG2の培養上清を用いて評価した結果、N端断片に結合する抗体の組み合わせで1μg/mL
程度と高濃度で分泌型GPC3が検出された(図4)。C端に結合する抗体の組み合わせでは
検出濃度が低かった事から、分泌型GPC3ではN端断片が優位に存在すると考えられた。
【0169】
次に、抗GPC3抗体を用いてHepG2の培養上清の免疫沈降を行い、分泌型GPC3の検出を行った。N端断片に結合するM10D2を用いた場合、40kDaの分泌型GPC3が検出された(図5)
。それに対しC端断片に結合するM1E7を用いた場合、分泌型GPC3は検出されなかった。取
得した全GPC3抗体について免疫沈降実験を行った結果、N端断片に結合する全ての抗体は
分泌型GPC3を強く検出し、C端断片に結合する抗体では検出されないか、弱く検出された
(図16)。免疫沈降により分泌型GPC3を検出し得る抗体は肝細胞癌の診断用抗体として有用であると考えられる。また、分泌型GPC3を検出しにくい抗体は、ADCC活性、CDC活性
を有する治療用抗体として開発する上で、血液中の分泌型GPC3にトラップされずに肝細胞癌へ移行し得る点で有用であると考えられた。
【0170】
実施例13
抗GPC3抗体可変領域のクローニング
抗GPC3抗体産生ハイブリドーマより抽出したTotal RNAを用いて、抗GPC3抗体可変領域
をRT-PCR法によって増幅した。Total RNAは、RNeasy Plant Mini Kits(QIAGEN社)を用
いて1×107細胞のハイブリドーマより抽出した。1μgのTotal RNAを使用して、SMART RACE cDNA Amplification Kit(CLONTECH社)、以下の合成オリゴヌクレオチド:マウ
スIgG1定常領域配列に相補的な合成オリゴヌクレオチドMHC-IgG1GGG CCA GTG GAT AGACAG
ATG(配列番号7)マウスIgG2a定常領域配列に相補的な合成オリゴヌクレオチドMHC-IgG2aCAG GGG CCA GTG GAT AGA CCG ATG(配列番号8)マウスIgG2b定常領域配列に相補的な合成オリゴヌクレオチドMHC-IgG2bCAG GGG CCA GTG GAT AGA CTG ATG(配列番号9)またはマウスκ鎖定常領域塩基配列に相補的な合成オリゴヌクレオチドkappaGCT CAC TGG ATG
GTG GGA AGA TG(配列番号10)を用い、5’末端側遺伝子断片を増幅した。
【0171】
逆転写反応は42℃で1時間30分間反応した。PCR溶液50μLは、5μLの10×Advantage 2PCR Buffer、5μLの10×Universal Primer A Mix、0.2mM dNTPs(dATP,dGTP,dCTP,dTTP)、1μLのAdvantage 2 Polymerase Mix(以上、CLONTECH社製)、2.5μLの逆転写反
応産物、10 pmoleの合成オリゴヌクレオチドMHC-IgG1、MHC-IgG2a、MHC-IgG2bまたはkappaを含有した。PCRは、94℃の初期温度にて30秒間そして94℃にて5秒間、72℃にて3分間のサイクルを5回反復し、94℃にて5秒間、70℃にて10秒間、72℃にて3分間のサイクルを5回反復し、さらに94℃にて5秒間、68℃にて10秒間、72℃にて3分間のサイクルを25回反復した。最後に反応産物を72℃で7分間加熱した。各PCR産物はQIAquick Gel Extraction Kit(QIAGEN社製)を用いて、アガロースゲルから精製した後、pGEM-T Easyベクタ
ー(Promega社製)へクローニングし、塩基配列を決定した。
【0172】
M3C11、M13B3、M1E7、M3B8、M11F1、M19B11、M6B1、M18D4、M5B9、M10D2、L9G11のH鎖可変領域の塩基配列をそれぞれ配列番号11、12、13、14、15、16、17、18、19、20、21に、アミノ酸配列をそれぞれ配列番号22、23、24、25、26、27、28、29、30、31、32に、L鎖可変領域の塩基配列を配列番号33、
34、35、36、37、38、39、40、41、42、43に、アミノ酸配列をそれぞれ配列番号44、45、46、47、48、49、50、51、52、53、54に示す。
【0173】
実施例14
GST融合蛋白を用いたエピトープ分類
C端断片に結合する抗体についてはエピトープの詳細な解析を行う為、段階的に短くし
たGPC3C端断片ペプチドとGSTの融合タンパク質GC-1(Ser495からLys563)、GC-2(Gly510からLys563)、GC-3(Ala524からLys563)GC-4(Gly537からLys563)、GC-5(Ser550からLys563)を作製した。GPC3 C末端領域をpGEX-4T-3(Amersham社)へクローニングしGSTのC末端側にGPC3 C末端領域を連結したプラスミドDNAを構築した。プラスミドDNAをDH5αへ導入し形質転換体を得、対数増殖期にある形質転換体の培養物に1mMとなるようにIPTGを
加えることによりGST融合タンパク質の発現を誘導し、2時間培養後に菌体を回収した。
超音波処理により破砕後、XL-80 超遠心分離機(Beckman, ロータ 70.1Ti)を用い35,000rpmで30分遠心後の培養上清を回収し、GST Purification Modules (Amersham社)を用いて精製した。このようにして精製したGST融合タンパク質を還元条件下にてSDS-PAGEにより分
離後、抗GPC3抗体を用いてウエスタンブロッティングを行った(図6)。M3C11、M1E7はGC-1、2を検出し、GC-3、4、5を検出しなかった。これら抗体のエピトープは、GC-2の領域
に含まれており、GC-3の領域では不十分な領域であるといえる。M3B8、M11F1はGC-1、2、
3、4を検出し、GC-5を検出しなかった。これら抗体のエピトープは、GC-4の領域に含まれており、GC-5の領域では不十分な領域であるといえる。各抗体の結合し得るGST融合蛋白
の最小領域について図16のウエスタンブロッティングの項に記載した。
【0174】
実施例15
抗GPC3マウス−ヒトキメラ抗体の作製
抗GPC3抗体のH鎖およびL鎖可変領域配列をヒトIgG1およびκ鎖定常領域配列に連結した。各抗体のH鎖可変領域の5’末端側塩基配列に相補的でコザック配列を有する合成オリゴヌクレオチドおよびNheI部位を有する3’末端側塩基配列に相補的な合成オリゴヌクレオチドを用いてPCRを行い、得られたPCR産物をヒトIgG1定常領域がpBluescript KS+ベクター(東洋紡社)に挿入されているpB-CHベクターにクローニングした。NheI部位によ
り、マウスH鎖可変領域とヒトH鎖(γ1鎖)定常領域が連結している。作製されたH鎖遺伝子断片を発現ベクターpCXND3にクローニングした。また、各抗体のL鎖可変領域の5’末端側塩基配列に相補的でコザック配列を有する合成オリゴヌクレオチドおよびBsiWI
部位を有する3’末端側塩基配列に相補的な合成オリゴヌクレオチドを用いてPCRを行い
、得られたPCR産物をヒトkappa鎖定常領域がpBluescript KS+ベクター(東洋紡社)に挿入されているpB-CLベクターにクローニングした。BsiWI部位により、ヒトL鎖可変領域と定常領域が連結している。作製されたL鎖遺伝子断片を発現ベクターpUCAGクローニング
した。本ベクターpUCAGは、pCXN(Niwaら、Gene 1991;108:193-200)を制限酵素BamHIで
消化して得られる2.6kbpの断片をpUC19ベクター(東洋紡社)の制限酵素BamHI部位に連結し、クローニングしたベクターである。
【0175】
抗GPC3マウス―ヒトキメラ抗体発現ベクターを作製するために、L鎖遺伝子断片が挿入されたpUCAGベクターを制限酵素HindIII(宝酒造社)で消化して得られる遺伝子断片をH鎖遺伝子が挿入されたpCXND3の制限酵素HindIII切断部位に連結し、クローニングした。
本プラスミドは動物細胞内でネオマイシン耐性遺伝子、DHFR遺伝子、抗GPC3マウス―ヒトキメラ抗体遺伝子を発現する。
【0176】
抗体を安定に発現するCHO細胞(DG44株)の作製は次のようにして行った。Gene PulserII(Bio Rad社製)を用いたエレクトロポレーション法により細胞に遺伝子を導入した。25μgの各抗GPC3マウス―ヒトキメラ抗体発現ベクターとPBSに懸濁したCHO細胞(1×1
07細胞/ml)の0.75mlを混合したものを氷上で10分間冷却し、キュベットに移した後
に1.5kV、25μFDの容量にてパルスを与えた。室温にて10分間の回復期間の後、エレクト
ロポレーション処理された細胞を、HT supplement(Invitrogen社)を1倍濃度で含むCHO-S-SFMII培地(Invitrogen社)40mLに懸濁した。同様の培地で50倍希釈溶液を作製し、96ウェル培養用プレートに100μl/ウェルで分注した。CO2インキュベーター(5%CO2)
で24時間培養後、Geneticin(Invitrogen社)を0.5mg/mLになるように添加して2週間培
養した。Geneticin耐性を示す形質転換細胞のコロニーが観察されたウェルの培養上清中
を取り出し、IgG量について以下に示す濃度定量法で測定した。高産生細胞株を順次拡大
培養し、抗GPC3マウス―ヒトキメラ抗体安定発現細胞株を取得し、大量培養を行い、培養上清を得た。各抗GPC3マウス―ヒトキメラ抗体の精製は、Hi Trap ProteinG HP(Amersham社)を用いて行った。
【0177】
実施例16
補体依存性細胞障害活性(CDC活性)の測定16.1 ヒトアルブミン・ベロナール・バッ
ファ(HAVB)の作製
NaCl(特級、和光純薬工業株式会社)12.75 g、Na-バルビタール(特級、和光純薬工業株式会社)0.5625 g、バルビタール(特級、和光純薬工業株式会社)0.8625 gをミリQ水に溶解し200 mLとした後、オートクレーブ処理(121℃、20分間)した。オートクレーブ
処理した100 mLの温ミリQ水を加え、pH7.43を確認した(推奨pH7.5)。これを5×ベロナ
ールバッファとした。CaCl2・2H2O(特級、純正化学株式会社)0.2205 gを50 mLミリQ水に溶解し0.03 mol/Lとし、CaCl2溶液とした。MgCl2・6H2O(特級、純正化学株式会社)1.0165 gを50 mLミリQ水に溶解し0.1 mol/Lとし、MgCl2溶液とした。5×ベロナールバッファ100 mL、ヒト血清アルブミン(ブミネート(登録商標)25%、ヒト血清アルブミン濃度250 mg/mL、バクスター株式会社)4 mL、CaCl2溶液2.5 mL、MgCl2溶液 2.5 mL、KCl(特級、純正化学株式会社)0.1 g、グルコース (D(+)-グルコース、ブドウ糖無水、特級、和光純薬工業株式会社) 0.5 gをミリQ水に溶解し500 mLとした。これをHAVBとした。ろ過滅
菌後、設定温度5℃にて保存した。
【0178】
16.2 標的細胞の調製
実施例4で作製された全長ヒトGPC3発現CHO細胞は、10%FBSと0.5mg/mL Geneticin(GIBCO)を添加したα-MEM核酸(+)培地(GIBCO)で培養し、細胞剥離緩衝液(InvitrogenCorp)を用いてディッシュから剥離して、96ウェル平底プレート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、3日間培養した。培養後、5.55MBqのクロム-51を加え、5%炭酸
ガスインキュベータ中37℃ 1時間培養し、この細胞をHAVBで2回洗浄し、50μLのHAVBを
加え標的細胞とした。
【0179】
16.3 クロム遊離試験(CDC活性)
各キメラ抗体をHAVBで希釈して40μg/mLの抗体溶液とした。標的細胞に抗体溶液を50
μLずつ添加し、氷上にて15分間静置した。続いて、各ウェルにHAVBにて希釈した、健常
者ボランティア末梢血由来ヒト血清を終濃度25%になるよう100 μLずつ添加し(抗体の終濃度10μg/mL)、5%炭酸ガスインキュベーター中に37℃で90分間静置した。プレートを遠心分離後、各ウェルより上清を100μLずつ回収し、ガンマカウンターにて放射活性を測定した。下式により特異的クロム遊離率を求めた。
特異的クロム遊離率(%)= (A-C)×100/(B-C)
Aは各ウェルにおける放射活性(cpm)、Bは標的細胞に2% NP-40水溶液(Nonidet P-40、Code No.252-23、ナカライテスク株式会社)を100 μL、HAVBを50 μL添加したウェルにおける放射活性(cpm)の平均値、Cは標的細胞にHAVBを150 μL添加したウェルにおける放
射活性(cpm)の平均値を示す。試験は三重に行い、CDC活性(%)について平均値および
標準偏差を算出した。
【0180】
その結果を図7に示した。9種類の抗GPC3キメラ抗体のうち、C末端認識抗体であるM3B8とM11F1がGPC3発現CHO細胞に対し強いCDC活性を示したのに対し、その他の抗体ではCDC活性が認められなかった。M3B8とM11F1はCompetition ELISAにおいて「b」と呼ばれるグル
ープに属しており、強いCDC活性を示すのに重要なエピトープを見出す事ができた。
【0181】
実施例17
ヒト末梢血由来PBMCを用いたADCC活性の測定17.1 ヒトPBMC溶液の調製
健常人よりヘパリン加採血した末梢血を、PBS(-)で2倍に希釈し、Ficoll-Paque TM PLUS (Amersham社)に重層した。これを遠心(500×g、30分間、20℃)した後、単核球画分である中間層を分取した。3回洗浄後、10% FBS/RPMIに懸濁し、ヒトPBMC溶液とした。
【0182】
17.2 標的細胞の調製
10%FBS/RPMI1640培地で培養したHepG2細胞を、トリプシン-EDTA(Invitrogen社)を用い
てディッシュから剥離し、96ウェルU字底プレート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、2日間培養した。実施例4で作製された全長ヒトGPC3発現CHO細胞は、10%FBSと0.5mg/mL Geneticin(GIBCO)を添加したα-MEM核酸(+)培地(GIBCO)で培養し、細胞剥離緩衝液(Invitrogen Corp)を用いてディッシュから剥離して、96ウェル平底プレ
ート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、3日間培養した。両細胞は培養後、それぞれ5.55MBqのクロム-51を加え、5%炭酸ガスインキュベータ中37℃で1時間培養し
、この細胞を培地で1回洗浄し、50μLの10% FBS/RPMI 1640培地を加え標的細胞とした。
【0183】
17.3 クロム遊離試験(ADCC活性)
標的細胞に各濃度に調製した抗体溶液50μLを添加し、氷上で15分反応させた後に、ヒ
トPBMC溶液100μL(5×105細胞/ウェル)を加え、5%炭酸ガスインキュベータ中37℃4
時間培養し、培養後、プレートを遠心分離し、培養上清100μL中の放射活性をガンマカウンターで測定した。下式により特異的クロム遊離率を求めた。
特異的クロム遊離率(%)=(A-C)×100/(B-C)
Aは各ウェルにおける放射活性(cpm)の平均値、Bは標的細胞に2% NP-40水溶液(Nonidet P-40、Code No.252-23、ナカライテスク株式会社)を100 μL、10%FBS/RPMI培地を50 μL添加したウェルにおける放射活性(cpm)の平均値、Cは標的細胞に10%FBS/RPMI培地を150 μL添加したウェルにおける放射活性(cpm)の平均値を示す。試験は三重に行い、ADCC活性(%)について平均値および標準偏差を算出した。その結果を図8に示した。9種類の抗GPC3キメラ抗体のうち、C末端認識抗体が強いADCC活性を示す傾向が認められた。
【0184】
実施例18
GC-3の免疫およびハイブリドーマの選抜
得られた抗GPC3抗体のうち、M11F1、M3B8のみが強いCDC活性を示したことから、CDC活
性にはエピトープ依存性があることが判明した。ADCC活性、CDC活性を併せもつ抗体の取
得を目的とし、M11F1、M3B8のエピトープを含むGST融合タンパク質であるGC-3を用いて免疫を行った。GC-3は上記方法により大量に精製し、Superdex75(Amersham社)を用いてゲルろ過を行い、バッファをPBSに置換したものを免疫蛋白として使用した。Balb/c (日本チャールズリバーより購入)3匹、MRL/lpr 3匹を、上記方法に従いGC-3で免疫した。初回免疫にはGC-3を100μg/headとなるように調製し、FCAを用いてエマルジョン化したものを皮下に投与した。2週間後に50μg/headとなるように調製したものをFIAでエマルジョン化したものを皮下に投与した。5回免疫の後、全マウスに対し最終免疫(50μg/head)を尾
静脈内に行った。細胞融合を行い、可溶型GPC3コアタンパク質を固相化したイムノプレートを用いたELISAによりスクリーニングを行った。陽性クローンについては限界希釈法に
よりモノクローン化した。その結果、GPC3に対して強い結合活性を有する抗体を5クローン(GC199、GC202、GC33、GC179、GC194)取得した。
【0185】
ハイブリドーマの培養上清よりHi Trap ProteinG HPを用いて抗体を精製し、上記方法
に従い解析を行った。可溶型GPC3コアタンパク質を固相化したイムノプレートを用いたELISAによりEC50値を算出し、フローサイトメトリにより5μg/mLでのヒストグラムのX-mode値を測定した(図17)。競合ELISAによるエピトープ分類の結果、bに属するもの(GC199、GC202、GC33)と新しいエピトープグループf(GC179、GC194)に分類された。GST融合タンパク質を用いたエピトープ分類の結果、GC199、GC202、GC33はGC-1、2、3、4を検出
し、GC-5を検出しなかった。これら抗体のエピトープは、M11F1、M3B8のエピトープと同
様に、GC-4の領域に含まれており、GC-5の領域では不十分な領域であるといえる。一方、GC179、GC194はGC-1、2、3を検出し、GC-4、5を検出しなかった。これら抗体のエピトー
プは、GC-3の領域に含まれており、GC-4の領域では不十分な領域であるといえる。各抗体の結合し得るGST融合蛋白の最小領域について図17のウエスタンブロッティングの項に
記載した。
【0186】
GC199、GC202、GC33、GC179、GC194について上記方法に従いH鎖、L鎖の可変領域をクローニングし、配列を決定した。GC194のL鎖については2種類の配列がクローニングされた
。GC199、GC202、GC33、GC179、GC194のH鎖可変領域の塩基配列をそれぞれ配列番号55
、56、57、58、59に、アミノ酸配列をそれぞれ配列番号60、61、62、63、64に示す。GC199、GC202、GC33、GC179、GC194(1)、GC194(2)のL鎖可変領域の塩基配列をそれぞれ配列番号65、66、67、68、69、70に、アミノ酸配列をそれぞれ
配列番号71、72、73、74、75、76に示す。
【0187】
さらに、これらのアミノ酸配列を既知の抗体のアミノ酸配列のデータベースと比較して相同性を調べることにより、CDR領域を以下のとおり決定した。
【0188】
【表4】

【0189】
【表5】

【0190】
実施例19
マウス骨髄由来エフェクター細胞を用いたADCC活性の測定19.1 マウス骨髄由来エフェクター細胞溶液の調製
SCIDマウス(日本クレア・オス・10週齢)の大腿骨から骨髄細胞を採取し、10% FBS/RPMI 1640培地中5×105個/mLとなるよう懸濁し、マウスGM-CSF(PeproTech)およびヒトIL-2(PeproTech)をそれぞれ10ng/mL、50ng/mLとなるよう添加し、5%炭酸ガスインキュベータ中37℃で5日培養した。培養後スクレーパーではがして培地で1回洗浄し、10% FBS/RPMI 1640培地中5×106/mLとなるよう懸濁し、マウス骨髄由来エフェクター細胞
溶液とした。
【0191】
19.2 標的細胞の調製
ヒト肝癌細胞株HuH-7は10%FBS(ThermoTrace社製)を含むDMEM培地(SIGMA社製)にて
維持継代し、Cell Dissociation Buffer (Invitrogen社)を用いてディッシュから剥離し
、96ウェルU字底プレート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、1日間培養した。培養後、5.55MBqのクロム-51を加え、5%炭酸ガスインキュベータ中37℃で1時間培
養し、この細胞を培地で1回洗浄し、50μLの10%FBS/RPMI1640培地を加え標的細胞とした
。
【0192】
19.3 クロム遊離試験(ADCC活性)
標的細胞に各濃度に調製した抗体溶液50μLを添加し、氷上で15分反応させた後に、マ
ウス骨髄由来エフェクター細胞溶液100μL(5×105 細胞/ウェル)を加え、5%炭酸ガス
インキュベータ中37℃4時間培養し、培養後、プレートを遠心分離し、培養上清100μL中
の放射活性をガンマカウンターで測定した。下式により特異的クロム遊離率を求めた。
特異的クロム遊離率(%)=(A-C)×100/(B-C)
Aは各ウェルにおける放射活性(cpm)の平均値、Bは標的細胞に2% NP-40水溶液(Nonidet P-40、Code No.252-23、ナカライテスク株式会社)を100 μL、10%FBS/RPMI培地を50 μL添加したウェルにおける放射活性(cpm)の平均値、Cは標的細胞に10%FBS/RPMI培地を150 μL添加したウェルにおける放射活性(cpm)の平均値を示す。試験は三重に行い、ADCC活性(%)について平均値および標準偏差を算出した。
【0193】
その結果を図9に示した。GC33抗体は0.1μg/mL以上の抗体濃度においてADCC活性を示
し、GC199抗体と比較して強い活性を示すことが明らかとなった。
【0194】
実施例20
GC33抗体のヒト肝癌移植マウスモデルに対する抗腫瘍活性20.1 ヒト肝癌移植マウスモデルの作製
ヒト肝癌細胞株HuH-7は、DMEM培地とMATRIGEL(BD Bioscience社製)を1:1で含む溶液
にて5×107個/mLになるように調製した。前日に抗アシアロGM1抗体(和光純薬社製、1バイアルを1mLの注射用蒸留水で溶解後4mLの生理的食塩水を添加)100μL
を腹腔内へ投与したSCIDマウス(オス、5週齢)(日本クレア)の腹部皮下へ上記細
胞懸濁液100μL(5×106個/マウス)を移植した。
【0195】
20.2 抗体調製および投与
ヒト肝癌移植マウスモデルに対し、投与当日にPBS(−)で0.5 mg/mL(5 mg/kg投与群)および0.1 mg/mL(1 mg/kg投与群)になるように調製した抗体溶液を、細胞移植後20日目より、週に1回、3週間、10 mL/kgにて、尾静脈より投与した。陰性対照として、P
BS(−)(Vehicle)を同様に週に1回、3週間、10 mL/kgにて、尾静脈より投与した。いずれの群も、1群6匹で行った。
【0196】
20.3 抗腫瘍効果の評価
GC33抗体のヒト肝癌移植マウスモデルにおける抗腫瘍効果については腫瘍体積の経時変化および最終投与日より一週間後の腫瘍重量で評価した。腫瘍体積は以下の式にて算出した。
腫瘍体積=長径×短径×短径/2
その結果、図10に示すとおり、GC33抗体投与群ではVehicle投与群と比較して有意な
腫瘍増殖の抑制が認められた。
以上より、GC33抗体がヒト肝癌移植マウスモデルに対して、抗腫瘍効果を有することが示された。
【0197】
実施例21
GC33マウス−ヒトキメラ抗体の作製
GC33のH鎖、L鎖は、5’末端側塩基配列に相補的でコザック配列、HindIII部位を有す
る合成オリゴヌクレオチド、および3’末端側塩基配列に相補的でBamHI部位を有する合
成オリゴヌクレオチドを用いてPCRにより増幅した。得られたPCR産物をHindIII、BamHI消化後、ヒトIgG1定常領域がクローニングされた発現ベクターHEFgγ1、およびヒトκ鎖定
常領域がクローニングされた発現ベクターHEFgκへクローニングした(Satoら、Mol Immunol. 1994;371-381)。上記方法に従いCHO細胞(DG44株)へ導入し安定発現細胞株を樹
立した。培養上清よりHi Trap ProteinG HP(Amersham社)を用いて抗体を精製した。培
養上清中のIgG濃度の測定は、ヤギ抗ヒトIgG (BIOSOURCE社)とヤギ抗ヒトIgG アルカリ
ホスファターゼコンジュゲート(BIOSOURCE社)を用いたヒトIgGサンドイッチELISAを行い、市販の精製ヒトIgG(Cappel社)との比較により定量した。
【0198】
実施例22
GC33マウス−ヒトキメラ抗体を用いたCDC活性、ADCC活性の測定
実施例16および17に記載した方法に従ってGC33、 M3C11、およびM1E7マウス−ヒトキメラ抗体のCDC活性およびADCC活性測定を行った。標的細胞として、CDC活性は全長GPC3発現CHO細胞を、ADCC活性はHepG2をそれぞれ用いた。それぞれの結果を図11、図12に示す。いずれの実験系においてもGC33は他2抗体と比較して強いCDC活性およびADCC活性を示すことが明らかとなった。
【0199】
実施例23
GC33のエピトープ解析
GC33についてはエピトープを詳細に決定するため、さらに短いGPC3C末端ペプチドとGSTの融合タンパク質を作製し、ウエスタンブロッティングにより解析した。作製したGST融
合タンパク質に含まれるGPC3由来ペプチド配列を図13に示す。GC33はGC-4 (aa 537-563)に結合し、GC-5 (aa 550-563)に結合できない事から、エピトープがaa 537 - 550の領域を少なくとも一部含む領域であると考えられた。始めにGC-6(G N S Q Q A T P K D N E I S(配列番号93))、GC-7(G N S Q Q A T P(配列番号94))、GC-8(Q Q A T P K D N(配列番号95))、GC-9(T P K D N E I S(配列番号96))を作製した。5'端にEcoRI、3'端にSalI認識配列の切断端が付加されるように設計したフォワードオリゴDNAとリバースオリゴDNAを作製した。オリゴDNAはエスペックオリゴ株式会社に合成を委託し、C-18カートリッジ精製され、5'末端リン酸化したものを使用した。10μMのフォワードオリゴDNA 25μLと10μMのリバースオリゴDNA 25μLを混合し、94°Cで5分間の後、37°Cで10分間、室温で15分間反応させた後、4°Cで10分放置し、フォワードオリゴDNAとリバースオリゴDNAをアニールさせた。吸光度測定により濃度を決定した後、インサート:
ベクターのモル比が3:1となるように、EcoRI、SalI消化したpGEX4T-3にクローニングした。塩基配列を確認した後、上記方法に従いGST融合タンパク質を調製し、Gluthatione Sepharose 4Bを用いて精製した。これを還元条件下にてSDS-PAGEにより分離し、GC33を用い
るウエスタンブロッティングにより解析した。いずれのGST融合タンパク質も強くは検出
できず、GC33による結合はさらにC末端側の配列が必要である事が予想された(図14)
。そこで、GC-11(A T P K D N E I S T(配列番号97))、GC-12(P K D N E IS T F H(配列番号98))、GC-13(D N E I S T F H NL(配列番号99))、GC-14(E I S T
F H N L G N(配列番号100))を作製し同様に評価した結果、GC-11、GC-12、GC-13
がGC33により強く結合された。この結果より、GC33はGPC3のC末端544番目から553番目の
配列(P K D N E I S T F H)内にそのエピトープが存在すると考えられる。
【0200】
実施例24
GC33のヒト化
公開されているKabat Database (ftp://ftp.ebi.ac.uk/pub/databases/kabat/) 、およびImMunoGeneTics Database (IMGT)より抗体の配列データを入手し、H鎖可変領域、L鎖可
変領域に分けてホモロジー検索を行った。その結果、H鎖可変領域はDN13(Smithsonら、Mol Immunol. 1999;36:113-124)と高い相同性を持つことが分かった。また、L鎖可変領域はAccession number AB064105のhomo sapiens IGK mRNA for immunoglobulin kappa light chain VLJ region, partial cds, clone:K64と高い相同性を持つことが分かった。また、L鎖のシグナル配列についてはAB064105と相同性の高いAccession Number S40357のシグナル配列を利用した。これらのヒト抗体のフレームワーク領域(以下、FR)にGC33の相補性抗原決定領域(以下、CDR)を移植して、ヒト化抗体を作製した。
【0201】
具体的には、50base程度の合成オリゴDNAを約20base程度ハイブリダイズするように設
計し、これらの合成オリゴDNAをPCR法によりアッセンブリさせて各可変領域をコードする遺伝子を作製した。5’端の合成オリゴDNAの末端に挿入したHindIII部位、および3’端の合成オリゴDNAの末端に挿入したBamHI部位で切断し、ヒトIgG1定常領域がクローニングされた発現ベクターHEFgγ1、ヒトκ鎖定常領域がクローニングされた発現ベクターHEFg
κへクローニングした(Satoら、Mol Immunol. 1994;371-381)。このようにして作製したヒト化GC33はH鎖、L鎖それぞれver.aと命名した。H鎖、L鎖ともにver.aのヒト化GC33(ver.a / ver.a)はマウスGC33可変領域の抗体(mouse / mouse)と比較して結合活性が低くかった(図15)。H鎖とL鎖についてマウスGC33配列とver.a配列をキメラに組み合わ
せた抗体(mouse / ver.a、ver.a / mouse)を作製し結合活性を評価した結果、ver.a / mouseで結合活性の低下が認められ、アミノ酸置換による結合活性の低下はH鎖に起因する事が判明した。そこで、H鎖の改変体ver.c、ver.f、ver.h、ver.i、ver.j、ver.kを作製
した。これらの全てのヒト化GC33はマウスGC33可変領域を有するキメラ抗体と同等の結合活性を示した(図15)。ヒト化GC33H鎖可変領域ver.a、ver.c、ver.f、ver.h、ver.i、ver.j、ver.kの塩基配列を配列番号77、78、79、80、81、82、83に、アミノ酸配列を配列番号84、85、86、87、88、89、90に示す。ヒト化GC33L鎖
可変領域ver.aの塩基配列を配列番号91に、アミノ酸配列を配列番号92に示す。ヒト
化GC33H鎖可変領域ver.i、ver.j、ver.kでは、6番目のグルタミン酸がグルタミンに置換されているが、これらの抗体は熱安定性が顕著に増加していた。
【0202】
実施例25
ヒト化GC33L鎖の改変
蛋白質の脱アミド化については一次配列依存的な脱アミド化の反応速度定数が知られており、Asn-Glyが特に脱アミド化し易い配列として知られている(Rocinsonら、Proc. Natl. Acad. Sci. USA 2001;98;944-949.)。配列番号91に示されるヒト化GC33L鎖ver.a可変領域のCDR1内にあるAsn33については、一次配列がAsn-Glyであることから、脱アミド化が容易に起きやすい配列である事が予想された。
【0203】
Asn33の脱アミド化による結合活性に対する影響を評価する為に、Asn33をAspに置換し
た改変抗体を作製した。点変異の導入には、Quick Change Site-Directed Mutagenesis Kit(Stratagene社)を使用した。すなわち、125ngのセンスプライマー(CTT GTA CAC AGTGAC GGA AAC ACC TAT:配列番号172)、125ngのアンチセンスプライマー(ATA GGT GTT TCC GTC ACT GTG TAC AAG:配列番号173)、5μLの10x reaction buffer、1μLのdNTP mix、10ngのヒト化GC33L鎖ver.aがクローニングされたHEFgκ、1μLのPfu Turbo DNA Polymeraseを含む50uLの反応液を用い、95℃で30秒、55℃で1分、68℃で9分からなるサイクルを12回のPCRを行った。その後制限酵素DpnIを加え37℃で2時間消化したものをキットに添付のXL1-Blueコンピテント細胞に導入し形質転換体を得た。正しく変異の導入されたクローンについて、可変領域を切り出し、再度HEFgκへクローニングし直した。これをヒト化GC33H鎖ver.kがクローニングされたHEFgγ1と共にFugene6(Roche社)を用いてCOS7細胞へ導入し、一過性に発現させた抗体を培養上清から回収した。抗ヒトIgG抗体を用
いたサンドイッチELISAにより抗体濃度を定量し、可溶型GPC3コア蛋白質を固相化したイ
ムノプレートを用いたELISAにより改変抗体の結合活性を評価した。図18に示すようにA
sn33をAspに置換した改変抗体(N33D)では結合活性が消失しており、Asn33で脱アミド化が起きた場合結合活性に与える影響は大きいと考えられた。
【0204】
Asn33の脱アミド化を抑制する方法として、Gly34を他のアミノ酸に改変する方法が報告されている(WO03057881A1)。上記方法に従い、Quick Change Site-Directed Mutagenesis Kitを用い、Gly34をCys、Metを除く他の17アミノ酸に置換して、一連の改変抗体G34A
、G34D、G34E、G34F、G34H、G34N、G34P、G34Q、G34I、G34K、G34L、G34V、G34W、G34Y、G34R、G34S、G34Tを作製した。これをCOS7細胞で一過性に発現させ、その培養上清を用
いて結合活性の評価を行った。その結果、Pro(G34P)、Val(G34V)以外ではG34を他のア
ミノ酸に置換しても結合活性が維持されている事が判明した。
【0205】
上述の改変抗体の軽鎖CDR1のアミノ酸配列を、それぞれ配列番号174(G34A)
、配列番号175(G34D)、配列番号176(G34E)、配列番号177(G34F)、配列番号178(G34H)、配列番号179(G34N)、配列番号180(G34T)、配
列番号181(G34Q)、配列番号182(G34I)、配列番号183(G34K)、配列番号184(G34L)、配列番号185(G34S)、配列番号186(G34W)、配列番
号187(G34Y)、配列番号188(G34R)、配列番号189(G34V)、配列番号
190(G34P)に記載する。また、上述の改変抗体の軽鎖可変領域のアミノ酸配列を、
それぞれ配列番号191(G34A)、配列番号192(G34D)、配列番号193(G34
E)、配列番号194(G34F)、配列番号195(G34H)、配列番号196(G34N)、配列番号197(G34T)、配列番号198(G34Q)、配列番号199(G34I)、配列番号200(G34K)、配列番号201(G34L)、配列番号202(G34S)、配列番号203(G34W)、配列番号204(G34Y)、配列番号205(G34R)、配列番号206(G34V)、配列番号207(G34P)に記載する。
【0206】
実施例26
全長ヒトGPC3発現ヒト肝癌細胞株(SK−03)の作製
抗GPC3抗体の生物活性評価用の細胞株を得るために、全長GPC3を発現するヒト肝癌細胞株の樹立を行った。
【0207】
PvuIで処理した1μgの全長ヒトGPC3遺伝子発現ベクターを、2μLのFuGENE(Roche社)と混合し、複合体を形成させた後に、SK-HEP-1細胞(ATCCより購入)に添加することにより、遺伝子導入を行った。CO2インキュベーターで24時間培養後、終濃度1 mg/mLのGeneticinおよび10% FBSを含むダルベッコMEM(D-MEM, SIGMA社)を用いて、GPC3発現株を選抜した。得られたGeneticin耐性コロニーを集め、限界希釈法により細胞のクローニング
を行った。それぞれの細胞クローンのヒトGPC3の発現はキメラGC33抗体とFITC標識ヤギ抗ヒトIgG抗体(ICN社)を用いたフローサイトメトリにより確認し、安定発現細胞株SK-03を
取得した。
【0208】
実施例27
マウス−ヒトキメラ抗体を用いたCDC活性、ADCC活性の比較
実施例22で示したGC33、M3C11、およびM1E7マウス−ヒトキメラ抗体のCDC活性およびADCC活性を直接比較する目的で、3抗体のADCC、CDC活性の測定を同一実験系で実施例16および17に記載した方法に従って行った。標的細胞として、CDC活性は全長GPC3発現CHO細胞を、ADCC活性はSK-03をそれぞれ用いた。それぞれの結果を図19、図20に示す。い
ずれの実験系においてもGC33は他2抗体と比較して強いCDC活性およびADCC活性を示すことが確認された。
【産業上の利用可能性】
【0209】
本発明の抗体は、細胞増殖抑制剤として、抗癌剤として、および癌の診断薬として用い
ることができる。
【技術分野】
【0001】
本発明は、抗グリピカン3抗体、ならびにかかる抗体を有効成分とする細胞増殖抑制剤および抗癌剤に関する。
【背景技術】
【0002】
グリピカン3(GPC3)は、細胞表面上に存在するヘパラン硫酸プロテオグリカンのファミリーの1つであり、発生における細胞分裂や、癌細胞の増殖に関与している可能性があることが示唆されているが、その機能はまだよく解明されていない。
【0003】
GPC3に結合するある種の抗体が、ADCC(抗体依存性細胞障害)活性およびCDC(補体依存性細胞障害)活性により細胞増殖抑制作用を有することが見いだされている(WO2003/000883)。また、GPC3が生体内で切断されて分泌型GPC3として血中に分泌され、これを検出しうる抗体を用いて癌の診断が可能であることが示唆されている(WO2004/022739、WO03/100429、WO2004018667)。
【0004】
抗体の細胞傷害活性を利用した抗癌剤を開発する場合、用いられる抗体は高いADCC活性又はCDC活性を有していることが好ましい為、GPC3を認識する抗体として高い細胞傷害活性を有する抗GPC3抗体が望まれていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2003/000883
【特許文献2】WO2004/022739
【特許文献3】WO03/100429
【特許文献4】WO2004/018667
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、従来の抗体と比較して高いADCC活性およびCDC活性を有する抗GPC3抗体を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは従来の抗グリピカン3抗体と比較して高い細胞傷害活性を有する抗体の取得に成功した。さらに、それらの抗体のエピトープを解析することにより、高い細胞傷害活性を発揮する抗体が認識するGPC3上の部位を見出すことに成功した。
【0008】
本発明は、以下の(1)−(12)のいずれか;
(1) 配列番号123に記載されるアミノ酸配列を含むCDR1,配列番号124に記載されるアミノ酸配列を含むCDR2,および配列番号125に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号109に記載されるアミノ酸配列を含むCDR1,配列番号110に記載されるアミノ酸配列を含むCDR2,および配列番号111に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号107に記載されるアミノ酸配列を含むCDR2,および配列番号108に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号132に記載されるアミノ酸配列を含むCDR1,配列番号133に記載されるアミノ酸配列を含むCDR2,および配列番号134に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号135に記載されるアミノ酸配列を含むCDR2,および配列番号136に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号126に記載されるアミノ酸配列を含むCDR1,配列番号127に記載されるアミノ酸配列を含むCDR2,および配列番号128に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号129に記載されるアミノ酸配列を含むCDR1,配列番号130に記載されるアミノ酸配列を含むCDR2,および配列番号131に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号103に記載されるアミノ酸配列を含むCDR1,配列番号104に記載されるアミノ酸配列を含むCDR2,および配列番号105に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号121に記載されるアミノ酸配列を含むCDR2,および配列番号122に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号115に記載されるアミノ酸配列を含むCDR1,配列番号116に記載されるアミノ酸配列を含むCDR2,および配列番号117に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号112に記載されるアミノ酸配列を含むCDR1,配列番号113に記載されるアミノ酸配列を含むCDR2,および配列番号114に記載されるアミノ酸配列を含むCDR3;または
(12) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号119に記載されるアミノ酸配列を含むCDR2,および120配列番号に記載されるアミノ酸配列を含むCDR3
を有する重鎖可変領域を含む抗体を提供する。
【0009】
別の観点においては、本発明は、以下の(1)−(13)のいずれか:
(1) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号145に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号140に記載されるアミノ酸配列を含むCDR1,配列番号141に記載されるアミノ酸配列を含むCDR2,および配列番号142に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号167に記載されるアミノ酸配列を含むCDR1,配列番号168に記載されるアミノ酸配列を含むCDR2,および配列番号169に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号170に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号171に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号159に記載されるアミノ酸配列を含むCDR1,配列番号160に記載されるアミノ酸配列を含むCDR2,および配列番号161に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号162に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号163に記載されるアミノ酸配列
を含むCDR3;
(8) 配列番号164に記載されるアミノ酸配列を含むCDR1,配列番号165に記載されるアミノ酸配列を含むCDR2,および配列番号166に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号137に記載されるアミノ酸配列を含むCDR1,配列番号138に記載されるアミノ酸配列を含むCDR2,および配列番号139に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号155に記載されるアミノ酸配列を含むCDR1,配列番号156に記載されるアミノ酸配列を含むCDR2,および配列番号157に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号149に記載されるアミノ酸配列を含むCDR1,配列番号150に記載されるアミノ酸配列を含むCDR2,および配列番号151に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号146に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号148に記載されるアミノ酸配列を含むCDR3;または
(13) 配列番号152に記載されるアミノ酸配列を含むCDR1,配列番号153に記載されるアミノ酸配列を含むCDR2,および配列番号154に記載されるアミノ酸配列を含むCDR3
を有する軽鎖可変領域を含む抗体を提供する。
【0010】
好ましくは、本発明の抗体は、以下の(1)−(13):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号109,110および111に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および145に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号106,107および108に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号140,141および142に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号132,133および134に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号167,168および169に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号106,135および136に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号170,144および171に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号126,127および128に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号159,160および161に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号162,147および163に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号164,165および166に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(9) それぞれ配列番号103,104および105に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号137,138および139に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号118,121および122に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号155,156および157に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号115,116および117に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号149,150および151に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(12) それぞれ配列番号112,113および114に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号146,147および148に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(13) それぞれ配列番号118,119および120に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号152,153および154に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体
からなる群より選択される。
【0011】
さらに別の観点においては、本発明は、以下の(1)〜(7)のいずれかに記載の重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;または
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体を提供する。
【0012】
また別の観点においては、本発明は、配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体を提供する。
【0013】
好ましくは、本発明の抗体は、以下の(1)〜(7)の抗体:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記
載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
からなる群より選択される。
【0014】
さらに別の観点においては、本発明は以下の(1)−(15)のいずれか:
(1) 配列番号174に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号175に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号176に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号177に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号178に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号179に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号180に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号181に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号182に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号183に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号184に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号185に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(13) 配列番号186に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(14) 配列番号187に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;または
(15) 配列番号188に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
を有する軽鎖可変領域を含む抗体を提供する。
【0015】
さらに別の観点においては、本発明は以下の(1)−(15):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号174,144および158,に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号175,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号176,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号177,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号178,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号179,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号180,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号181,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(9) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号182,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号183,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号184,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(12) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号185,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(13) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号186,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(14) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号187,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(15) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号188,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体,
からなる群より選択される抗体を提供する。
【0016】
さらに別の観点においては、本発明は以下の(1)〜(15):
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
からなる群より選択される軽鎖可変領域を有する抗体を提供する。
【0017】
さらに別の観点においては、本発明は、以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
および、以下の(1)〜(7)からなる群より選択される重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体を提供する。
【0018】
本発明の好ましい抗体の重鎖可変領域および軽鎖可変領域、ならびにこれらのCDR1,2および3のアミノ酸配列と、配列番号との対応を以下の一覧表に示す。
【0019】
【表1】

【0020】
【表2】

【0021】
【表3】

【0022】
また、上述のいずれかに記載の抗体のアミノ酸配列において1または複数のアミノ酸が置換、欠失、付加および/または挿入され、かつその抗体と同等の活性を有する抗体も本発明の範囲内である。好ましくは、本発明の抗体はヒト化抗体である。すなわち、別の観点においては、本発明はグリピカン3に結合するヒト化抗体を提供する。
【0023】
さらに別の観点においては、本発明は、グリピカン3のアミノ酸残基524〜563の配列を有するペプチドに結合する抗体を提供する。好ましくは、本発明の抗体は、グリピ
カン3のアミノ酸残基537〜563の配列を有するペプチドに結合する。また好ましくは、本発明の抗体は、グリピカン3のアミノ酸残基550〜563の配列からなるペプチドに結合しないことを特徴とする。好ましくは、本発明の抗体は、グリピカン3のアミノ酸残基544〜553の配列を有するペプチドに結合し、また好ましくは、グリピカン3のアミノ酸残基546〜551の配列を有するペプチドに結合する。
【0024】
また別の観点においては、本発明は、それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体が結合しうるエピトープに結合することができる抗体、すなわち、抗原との結合において競合する抗体を提供する。
【0025】
さらに別の観点においては、本発明は、グリピカン3に結合し、かつグリピカン3を発現する細胞に対して高いCDC活性を有する抗体、ならびに、グリピカン3に結合し、かつグリピカン3を発現する細胞に対して高いADCC活性を有する抗体を提供する。
【0026】
さらに別の観点においては、本発明は、上述の本発明のいずれかの抗体の重鎖可変領域または軽鎖可変領域をコードするポリヌクレオチドを提供する。本発明のポリヌクレオチドは、好ましくは、配列番号11−21、33−43、55−59、65−70、77−83のいずれかに記載の塩基配列を有する。
【0027】
別の観点においては、本発明は、上述の本発明の抗体を有効成分とする細胞増殖抑制剤および抗癌剤を提供する。好ましくは、本発明の抗癌剤は、肝細胞癌を治療するために用いられる。
【0028】
さらに別の観点においては、グリピカン3のアミノ酸残基524〜563のアミノ酸配列からなるペプチド、グリピカン3のアミノ酸残基537〜563のアミノ酸配列からなるペプチド、グリピカン3のアミノ酸残基544〜553のアミノ酸配列からなるペプチド、又はグリピカン3のアミノ酸残基546〜551のアミノ酸配列からなるペプチドを提供する。
【図面の簡単な説明】
【0029】
【図1】図1は、CHO細胞、全長GPC3発現CHO細胞、HepG2、HuH-7に対する抗GPC3抗体の結合活性をフローサイトメトリーにより評価した図である。M1E7(実線)、M11F1(破線)はそれぞれ5μg/mL濃度で使用した。
【図2】図2は、競合ELISAによるエピトープ分類の結果を示した表である。ビオチン化した抗GPC3抗体の結合に対する競合的な阻害の程度を%表示し、競合的阻害のパターンに従いaからeまでの5つのグループに分類された。
【図3】図3は、抗GPC3抗体が可溶型GPC3コアタンパク質の40kDaのN端断片に結合するか、30kDaのC端断片に結合するかウエスタンブロッティングにより評価した結果である。L9G11はN端断片に結合し、M3C11はC端断片に結合する事が判明した。
【図4】図4は、HepG2の培養上清中に分泌型GPC3が存在する事をサンドイッチELISAにより検出した結果である。M6B1、M18D4、M19B11等のN端断片に結合する抗体の組み合わせで高度に検出され、M3C11、M13B3、M3B8等のC端断片に結合する抗体では強くは検出されなかった。
【図5】図5は、抗GPC3抗体を用いてHepG2の培養上清の免疫沈降を行い、分泌型GPC3を検出した結果である。コントロールとして培地(レーン1、3)若しくはHepG2の培養上清(レーン2,4)をM1E7(レーン1,2)、M10D2(レーン3、4)を用いて免疫沈降を行った。N端断片に結合するM10D2により分泌型GPC3が検出された。
【図6】図6は、GPC3C末端ペプチドとGSTの融合タンパク質を利用して、GPC3C末端断片に結合する抗体のエピトープをウエスタンブロッティングにより分析した結果である。可溶型GPC3コアタンパク質(レーン1)、GST(レーン2)、GC-1(レーン3)、GC-2(レーン4)、GC-3(レーン5)、GC-4(レーン6)、GC-5(レーン7)を還元条件下にてSDS電気泳動後、M3C11、M11F1を用いてウエスタンブロッティングにより検出した。
【図7】図7は、抗GPC3マウス−ヒトキメラ抗体の、GPC3発現CHO細胞に対するCDC活性を評価した結果である。
【図8】図8は、抗GPC3マウス−ヒトキメラ抗体の、GPC3発現CHO細胞、およびHepG2に対するADCC活性を評価した結果である。
【図9】図9は、マウス骨髄由来エフェクター細胞を用いて、GC33のヒト肝癌細胞株HuH-7に対するADCC活性を評価した結果である。
【図10】図10は、GC33抗体のヒト肝癌移植マウスモデルに対する抗腫瘍活性を評価した結果である。
【図11】図11は、GC33のマウス−ヒトキメラ抗体の、GPC3発現CHO細胞に対するCDC活性を評価した結果である。
【図12】図12は、GC33のマウス−ヒトキメラ抗体の、HepG2に対するADCC活性を評価した結果である。
【図13】図13は、GC33のエピトープ解析用に作製したGST融合タンパク質(GC-4、5、6、7、8、9、11、12、13、14)に含まれるGPC3由来配列を示した図である。
【図14】図14は、GST、GC-7、8、9、11、12、13、14を還元条件下にてSDS-PAGEにより分離後、GC33を用いてウエスタンブロッティングを行った結果である。
【図15】図15は、ヒト化GC33のGPC3に対する結合活性をELISAにより評価した結果である。
【図16】図16は、可溶型GPC3免疫マウス由来クローンについて、アイソタイプ、ELISA、BIAcore、FACS、エピトープ解析、免疫沈降実験の結果をまとめた抗体パネルである。
【図17】図17は、GC-3免疫マウス由来クローンについて、アイソタイプ、ELISA、FACS、エピトープ解析の結果をまとめた抗体パネルである。
【図18】図18は、ヒト化GC33L鎖可変領域CDR1に位置するGly34をCys、Metを除く他の17アミノ酸に置換した改変型抗体の、可溶型GPC3コア蛋白質に対する結合活性をELISAにより評価した結果である。
【図19】図19は、GC33、M3C11、およびM1E7マウス−ヒトキメラ抗体の、全長GPC3発現CHO細胞に対するCDC活性を評価した結果である。
【図20】図20は、GC33、M3C11、およびM1E7マウス−ヒトキメラ抗体の、全長GPC3発現ヒト肝癌細胞株SK-03に対するADCC活性を評価した結果である。
【発明を実施するための形態】
【0030】
抗体
本発明は、下記の(I)〜(XI)に記載の抗体を提供する。
(I) 以下の(1)〜(12)のいずれかの配列番号に記載のアミノ酸配列からなるCDR1、2
、3を有する重鎖可変領域を含む抗体:
(1) 配列番号123、124、125(GC33)
(2) 配列番号109、110、111(M11F1)
(3) 配列番号106、107、108(M3B8)
(4) 配列番号132、133、134(GC199)
(5) 配列番号106、135、136(GC202)
(6) 配列番号126、127、128(GC179)
(7) 配列番号129、130、131(GC194)
(8) 配列番号103、104、105(M13B3)
(9) 配列番号118、121、122(L9G11)
(10) 配列番号115、116、117(M6B1)
(11) 配列番号112、113、114(M5B9)
(12) 配列番号118、119、120(M10D2)。
【0031】
上記(1)〜(12)の抗体の中で好ましいものは(1)〜(8)の抗体であり、さらに好ましいも
のは(1)〜(5)の抗体であり、特に好ましい抗体は(1)の抗体である。上記(1)〜(8)の抗体
はグリピカン3のC末端側ペプチド(グリピカン3の374番目のアミノ酸から580番目のアミノ酸までのペプチド)を認識し、治療用抗体として有用である。また、上記(9)
〜(12)の抗体はグリピカン3のN末端側ペプチド(グリピカン3の1番目のアミノ酸から373番目のアミノ酸までのペプチド)を認識し、診断用抗体として有用である。
【0032】
(II) 以下の(1)〜(13)のいずれかの配列番号に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体:
(1) 配列番号143、144、158(GC33)
(2) 配列番号143、144、145(M11F1)
(3) 配列番号140、141、142(M3B8)
(4) 配列番号167、168、169(GC199)
(5) 配列番号170、144、171(GC202)
(6) 配列番号159、160、161(GC179)
(7) 配列番号162、147、163(GC194(1))
(8) 配列番号164、165、166(GC194(2))
(9) 配列番号137、138、139(M13B3)
(10) 配列番号155、156、157(L9G11)
(11) 配列番号149、150、151(M6B1)
(12) 配列番号146、147、148(M5B9)
(13) 配列番号152、153、154(M10D2)。
【0033】
上記(1)〜(13)の抗体の中で好ましいものは(1)〜(8)の抗体であり、さらに好ましいも
のは(1)〜(5)の抗体であり、特に好ましい抗体は(1)の抗体である。上記(1)〜(8)の抗体
はグリピカン3のC末端側ペプチド(グリピカン3の374番目のアミノ酸から580番目のアミノ酸までのペプチド)を認識し、治療用抗体として有用である。また、上記(9)
〜(13)の抗体はグリピカン3のN末端側ペプチド(グリピカン3の1番目のアミノ酸から373番目のアミノ酸までのペプチド)を認識し、診断用抗体として有用である。
【0034】
(III) 以下の(1)〜(13)の抗体:
(1) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号143、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC33)
(2) 配列番号109、110、111に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号143、144、145に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M11F1)
(3) 配列番号106、107、108に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号140、141、142に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M3B8)
(4) 配列番号132、133、134に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号167、168、169に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC199)
(5) 配列番号106、135、136に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号170、144、171に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC202)
(6) 配列番号126、127、128に記載のアミノ酸配列からなるCDR1、2、3を有する
重鎖可変領域、および配列番号159、160、161に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC179)
(7) 配列番号129、130、131に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号162、147、163に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC194(1))
(8) 配列番号129、130、131に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号164、165、166に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(GC194(2))
(9) 配列番号103、104、105に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号137、138、139に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M13B3)
(10) 配列番号118、121、122に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号155、156、157に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(L9G11)
(11) 配列番号115、116、117に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号149、150、151に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M6B1)
(12) 配列番号112、113、114に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号146、147、148に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M5B9)
(13) 配列番号118、119、120に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号152、153、154に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体(M10D2)からなる群より選択される抗体。
【0035】
上記(1)〜(13)の抗体の中で好ましいものは(1)〜(8)の抗体であり、さらに好ましいも
のは(1)〜(5)の抗体であり、特に好ましい抗体は(1)の抗体である。上記(1)〜(8)の抗体
はグリピカン3のC末端側ペプチド(グリピカン3の374番目のアミノ酸から580番目のアミノ酸までのペプチド)を認識し、治療用抗体として有用である。また、上記(9)
〜(13)の抗体はグリピカン3のN末端側ペプチド(グリピカン3の1番目のアミノ酸から373番目のアミノ酸までのペプチド)を認識し、診断用抗体として有用である。
【0036】
(IV) 以下の(1)〜(7)のいずれかに記載の重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.a);
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.c);
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.f);
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.h);
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.i);
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.j);
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.k);
を有する抗体。
【0037】
上記(1)〜(7)の抗体の中で特に好ましい抗体は(2)〜(7)の抗体である。
【0038】
(V) 配列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する
抗体。
【0039】
(VI) 以下の(1)〜(7)の抗体:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.a)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.c)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.f)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.h)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.i)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を有する抗体;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.j)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を含む抗体;
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域(GC33 VH ver.k)および配
列番号92に記載のアミノ酸配列を含む軽鎖可変領域(GC33 VL ver.a)を含む抗体;
からなる群より選択される抗体。
【0040】
上記(1)〜(7)の抗体の中で特に好ましい抗体は(2)〜(7)の抗体である。
(VII) 以下の(1)〜(15)のいずれかの抗体:
(1) 配列番号174、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(2) 配列番号175、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(3) 配列番号176、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(4) 配列番号177、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(5) 配列番号178、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(6) 配列番号179、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(7) 配列番号180、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(8) 配列番号181、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(9) 配列番号182、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(10) 配列番号183、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(11) 配列番号184、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(12) 配列番号185、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(13) 配列番号186、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(14) 配列番号187、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体;
(15) 配列番号188、144、158に記載のアミノ酸配列からなるCDR1、2、3
を有する軽鎖可変領域を含む抗体。
【0041】
上記(1)〜(15)の抗体の中で好ましい抗体は(15)の抗体である。
(VIII) 以下の(1)〜(15)いずれかの抗体:
(1) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する
重鎖可変領域、および配列番号174、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(2) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号175、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(3) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号176、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(4) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号177、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(5) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号178、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(6) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号179、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(7) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号180、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(8) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号181、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(9) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有する重鎖可変領域、および配列番号182、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(10) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号183、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(11) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号184、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(12) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号185、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(13) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号186、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(14) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号187、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体;
(15) 配列番号123、124、125に記載のアミノ酸配列からなるCDR1、2、3を有す
る重鎖可変領域、および配列番号188、144、158に記載のアミノ酸配列からなるCDR1、2、3を有する軽鎖可変領域を含む抗体。
【0042】
上記(1)〜(15)の抗体の中で好ましい抗体は(15)の抗体である。
(IX) 以下の(1)〜(15)のいずれかに記載の抗体:
(1)配列番号191に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(2)配列番号192に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(3)配列番号193に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(4)配列番号194に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(5)配列番号195に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(6)配列番号196に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(7)配列番号197に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(8)配列番号198に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(9)配列番号199に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(10)配列番号200に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(11)配列番号201に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(12)配列番号202に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(13)配列番号203に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(14)配列番号204に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体;
(15)配列番号205に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体。
【0043】
上記(1)〜(15)の抗体の中で好ましい抗体は(15)の抗体である。
(X) 以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1)配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2)配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3)配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4)配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5)配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6)配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7)配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8)配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9)配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10)配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11)配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12)配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13)配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14)配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;
(15)配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
および、以下の(1)〜(7)からなる群より選択される重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体。
【0044】
上記の抗体の中で好ましい抗体は、配列番号205に記載のアミノ酸配列を含む軽鎖可変領域および配列番号90に記載のアミノ酸配列を含む重鎖可変領域を有する抗体である。
【0045】
(XI) 上記の(I)〜(X)のいずれかに記載のアミノ酸配列において1または複数のアミノ酸
が置換、欠失、付加および/または挿入され、かつ(I)〜(X)のいずれかに記載の抗体と同等の活性を有する抗体。
【0046】
本発明において、(I)〜(X)のいずれかに記載の抗体と同等の活性とは、ヒトグリピカン3抗体への結合活性、またはヒトグリピカン3を発現する細胞(例えば、HepG2またはヒ
トグリピカン3発現組換えCHO細胞、など)への細胞傷害活性が同等であることをいう。
【0047】
ヒト化抗体
本発明における抗体の好ましい態様の一つとして、グリピカン3に結合するヒト化抗体を挙げることができる。ヒト化抗体は既知の方法を用いて製造することができる。
【0048】
ヒト化抗体は、再構成(reshaped)ヒト抗体とも称され、これは、ヒト以外の哺乳動物、例えばマウス抗体の相補性決定領域(CDR; complementarity determining region)を
ヒト抗体の相補性決定領域へ移植したものであり、その一般的な遺伝子組換え手法も知られている(欧州特許出願公開番号EP 125023号公報、WO 96/02576 号公報参照)。
【0049】
具体的には、例えばCDRがマウス抗体由来である場合には、マウス抗体のCDRとヒト抗体のフレームワーク領域(framework region;FR)とを連結するように設計したDNA配列を
、CDRおよびFR両方の末端領域にオーバーラップする部分を有するように作製した数個の
オリゴヌクレオチドをプライマーとして用いてPCR法により合成する(WO98/13388号公報に記載の方法を参照)。
【0050】
CDRと連結されるヒト抗体のフレームワーク領域は、相補性決定領域が良好な抗原結合
部位を形成するものが選択される。必要に応じ、再構成ヒト抗体の相補性決定領域が適切な抗原結合部位を形成するように、抗体の可変領域におけるフレームワーク領域のアミノ酸を置換してもよい(Sato, K.etal., CancerRes.(1993)53, 851-856)。
【0051】
キメラ抗体およびヒト化抗体のC領域には、ヒト抗体のものが使用され、例えばH鎖では、Cγ1、Cγ2、Cγ3、Cγ4を、L鎖ではCκ、Cλを使用することができる。また、抗体またはその産生の安定性を改善するために、ヒト抗体C領域を修飾してもよい。ヒト化の際
に用いられるヒト抗体は、IgG、IgM、IgA、IgE、IgDなど如何なるアイソタイプのヒト抗
体でもよいが、本発明においてはIgGを用いることが好ましく、さらにIgG1又はIgG3が好
ましく、特にIgG1が好ましい。IgG1は高い細胞傷害活性を有している点で抗体を抗癌剤として利用する場合に有効である(Chemical immunology, 65:88 (1997))。
【0052】
なお、ヒト化抗体を作製した後に、可変領域(例えば、FR)や定常領域中のアミノ酸を他のアミノ酸で置換等してもよい。
【0053】
ヒト化抗体におけるCDRの由来は特に限定されず、どのような動物由来でもよい。例え
ば、マウス抗体、ラット抗体、ウサギ抗体、ラクダ抗体などの配列を用いることが可能であるが、好ましくはマウス抗体のCDR配列である。
【0054】
抗体のヒト化において、通常、由来となった抗体のアゴニスト活性を維持したままヒト化を行うことは困難であるが、本発明においては、由来となったマウス抗体と同等のアゴニスト活性を有するヒト化抗体の取得に成功した。ヒト化抗体はヒト体内における抗原性が低下しているため、治療目的などでヒトに投与する場合に有用である。
【0055】
本発明においてヒト化抗グリピカン3抗体の好ましい例としては、例えば、配列番号84(GC33 VH ver.a)、配列番号85(GC33 VH ver.c)、配列番号86(GC33 VH ver.f
)、配列番号87(GC33 VH ver.h)、配列番号88(GC33 VH ver.i)、配列番号89(GC33 VH ver.j)または配列番号90(GC33 VH ver.k)に記載の重鎖可変領域を有する抗体、または配列番号92(GC33 VL ver.a)に記載の軽鎖可変領域を有する抗体を挙げる
ことができる。特に好ましい例としては、配列番号84(GC33 VH ver.a)、配列番号8
5(GC33 VH ver.c)、配列番号86(GC33 VH ver.f)、配列番号87(GC33 VH ver.h
)、配列番号88(GC33 VH ver.i)、配列番号89(GC33 VH ver.j)または配列番号90(GC33 VH ver.k)に記載の重鎖可変領域と、配列番号92(GC33 VL ver.a)に記載の軽鎖可変領域とを有する抗体を挙げることができる。
【0056】
さらに、本発明のヒト化抗グリピカン3抗体の好ましい例としては、配列番号90に記載の重鎖可変領域と配列番号205に記載の軽鎖可変領域とを有する抗体を挙げることができる。
【0057】
本発明における抗体の好ましい態様の一つとして、以下の(1)〜(8)のいずれかに記載の抗体:
(1) 配列番号62に記載のアミノ酸配列を有する重鎖可変領域、および配列番号73に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体(GC33);
(2) 配列番号26に記載のアミノ酸配列を有する重鎖可変領域、および配列番号48に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体((M11F1);
(3) 配列番号25に記載のアミノ酸配列を有する重鎖可変領域、および配列番号47に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体((M3B8);
(4) 配列番号60に記載のアミノ酸配列を有する重鎖可変領域、および配列番号71に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体((GC199);
(5) 配列番号61に記載のアミノ酸配列を有する重鎖可変領域、および配列番号72に記載のアミノ酸配列を有する軽鎖可変領域(GC202);
(6) 配列番号63に記載のアミノ酸配列を有する重鎖可変領域、および配列番号74に記載のアミノ酸配列を有する軽鎖可変領域(GC179);
(7) 配列番号64に記載のアミノ酸配列を有する重鎖可変領域、および配列番号75に記載のアミノ酸配列を有する軽鎖可変領域(GC194(1));
(8) 配列番号64に記載のアミノ酸配列を有する重鎖可変領域、および配列番号76に記載のアミノ酸配列を有する軽鎖可変領域(GC194(2));
が結合するエピトープに結合する抗体を挙げることができる。さらに好ましくは(1)〜(5)のいずれかに記載の抗体が結合するエピトープに結合する抗体であり、特に好ましくは(1)に記載の抗体が結合するエピトープに結合する抗体である。
【0058】
上記いずれかの抗体が結合するエピトープに結合する抗体は、特に高い細胞傷害活性を有する点で有用である。
【0059】
上記(1)〜(7)いずれかに記載の抗体はヒトグリピカン3の524番目のアミノ酸から580番目のアミノ酸までの領域に結合し、特に524番目のアミノ酸から563番目のアミノ酸までの領域に結合する。上記(1)〜(5)いずれかに記載の抗体はヒトグリピカン3の537番目のアミノ酸から563番目の領域に結合する。上記(1)に記載の抗体は、54
4番目のアミノ酸から553番目のアミノ酸の領域に結合し、特に546番目のアミノ酸から551番目の領域に結合する。
【0060】
上記エピトープを認識する抗体は、高い細胞傷害活性を有するので癌などの疾患の治療用として有用である。特に、546番目のアミノ酸から551番目の領域に結合する抗体は特に細胞傷害活性が高いので有用である。
【0061】
従って、本発明は、ヒトグリピカン3の524番目のアミノ酸から580番目のアミノ酸までの領域、好ましくは524番目のアミノ酸から563番目のアミノ酸までの領域、さらに好ましくは537番目のアミノ酸から563番目のアミノ酸までの領域、さらに好ましくは544番目のアミノ酸から553番目のアミノ酸までの領域、特に好ましくは546番目のアミノ酸から551番目のアミノ酸までの領域をエピトープとして、それらの領域に結合する抗体を含む。
【0062】
本発明において好ましい他の態様としては、ヒトグリピカン3の524番目のアミノ酸から563番目のアミノ酸までの領域を認識し、かつ、537番目のアミノ酸から563番目のアミノ酸までの領域を認識しない抗体を挙げることができる。
【0063】
さらに、本発明において好ましい他の態様としては、ヒトグリピカン3の537番目のアミノ酸から563番目のアミノ酸までの領域を認識し、かつ、550番目のアミノ酸から563番目のアミノ酸までの領域を認識しない抗体を挙げることができる。
【0064】
抗体が認識するエピトープの解析は当業者に公知の方法により行うことが可能であり、例えば実施例記載のウェスタンブロッティング法などにより行うことが可能である。
【0065】
上記の領域をエピトープとして認識する抗体は、当業者に公知の方法により得ることが可能であり、例えば、ヒトグリピカン3のアミノ酸配列を基に目的の領域のアミノ酸配列を含むペプチドを作製し、該ペプチドを免疫原として抗体を作製することにより、または、通常の方法で抗体を作製した後、得られた抗体が認識するエピトープを決定し、目的のエピトープを認識する抗体を選択することにより得ることが可能である。
【0066】
本発明の抗グリピカン3抗体の好ましい例としては、グリピカン3を発現する細胞に対して高いADCC活性を有する抗体または高いCDC活性を有する抗体を挙げることができる。
【0067】
本発明において高いADCC活性または高いCDC活性とは、公知の抗グリピカン3抗体よりも高いADCC活性または高いCDC活性を有することをいう。公知のグリピカン3抗体としては、WO2004/22739に記載されているM3C11またはM1E07を挙げることができる。
【0068】
ADCC活性またはCDC活性の測定方法は、当業者に公知の方法により行うことが可能であり、例えば、クロム遊離試験により行うことが可能である。ADCC活性を測定する際のクロム遊離試験の具体的な条件としては、特に限定されないが、例えば、実施例記載の条件を用いて測定することができる。
【0069】
グリピカン3を発現する細胞としては、例えば、HepG2などの肝癌細胞、グリピカン3
をコードする遺伝子を組み込まれたCHO細胞などを挙げることができる。ADCC活性を測定する場合にはHepG2細胞を用いることが好ましく、CDC活性を測定する場合には
GPC3発現組換えCHO細胞を用いることが好ましい。GPC3発現組換えCHO細胞
は如何なる方法により作製されてもよいが、例えば実施例に記載の方法により作製することが可能である。
【0070】
抗グリピカン3抗体を抗癌剤として用いる場合には、配列番号62に記載のアミノ酸配列を有する重鎖可変領域、および配列番号73に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体(GC33)と同程度のADCC活性を有していることが好ましい。抗グリピカン3抗体を抗癌剤として用いる場合には、配列番号62に記載のアミノ酸配列を有する重鎖可変領域、および配列番号73に記載のアミノ酸配列を有する軽鎖可変領域を有する抗体(GC33)と同程度のCDC活性を有していることが好ましい。
【0071】
さらに本発明はグリピカン3への結合活性が高い抗体を含む。
【0072】
本発明において、グリピカン3への結合活性は、当業者に公知の手段を使用して測定することができる。例えば、BIAcoreを用いた表面プラズモン共鳴を利用して測定すること
が可能である。すなわちセンサーチップ上にグリピカン3タンパク質を固定して抗体と反応させ、測定値から抗体とグリピカン3の相互作用を反応速度定数として算出することができる。また、結合活性の評価には、ELISA(酵素結合免疫吸着検定法)、EIA(酵素免疫測定法)、RIA(放射免疫測定法)あるいは蛍光抗体法を用いることができる。例えば、
酵素免疫測定法を用いる場合、被験抗体が結合する抗原をコーティングしたプレートに、被験抗体を含む試料、例えば、被験抗体産生細胞の培養上清や精製抗体を加える。アルカリフォスファターゼ等の酵素で標識した二次抗体を添加し、プレートをインキュベートし、洗浄した後、p-ニトロフェニル燐酸などの酵素基質を加えて吸光度を測定することで抗原結合活性を評価することができる。結合活性の上限は特に限定されないが、例えば、当業者が技術的に作製可能な範囲の上限を設定することができる。しかしながら、技術的に作製可能な範囲は、技術の進歩により拡大されることが理解されるであろう。
【0073】
さらに、本発明においては、抗体の安定性を増加させる等の目的で脱アミド化されるアミノ酸若しくは脱アミド化されるアミノ酸に隣接するアミノ酸を他のアミノ酸に置換することにより脱アミド化を抑制してもよい。脱アミド化されるアミノ酸としてはアスパラギン、グルタミンを挙げることができるが、好ましくはアスパラギンである。アスパラギンに隣接するアミノ酸としては、特に限定されずどのようなアミノ酸でもよいが、アスパラギン−グリシン配列は特に脱アミド化されやすいことが知られているので、アスパラギンに隣接するアミノ酸としてはグリシンが好ましい。置換後のアミノ酸としては、アスパラギンおよびグルタミン以外であれば特に限定されず、如何なるアミノ酸でもよいが、好ましくはバリン、プロリン以外のアミノ酸であることが好ましい。従って、本発明においては、抗体の脱アミド化を目的とする場合には、アスパラギン、グルタミン、バリン、プロリン以外のアミノ酸に置換することが好ましい。アミノ酸置換による脱アミド化の抑制については、例えばWO03/057881を参考に行うことが可能である。脱アミド化抑制を目的にアミノ酸置換を行う場合には、置換前の抗原結合活性を維持していることが好ましい。
【0074】
さらに、抗体安定化の他の態様として、グルタミン酸の他のアミノ酸への置換を挙げることができる。また、本発明では、抗体重鎖の6番目がグルタミン酸である場合、該グルタミン酸をグルタミンに置換することにより、顕著に抗体を安定化できることを見いだした。したがって、本発明は、抗体重鎖の6番目のグルタミン酸をグルタミンに置換することにより抗体を安定化する方法に関する。抗体中のアミノ酸番号は当業者に公知である(例えば、Kabat, E. A. et al., "Sequences of Proteins of Immunological Interest", US Dept. Health and Human Services 1983)。
【0075】
本発明の抗体は、ポリエチレングリコール(PEG)、放射性物質、トキシン等の各種分
子と結合したコンジュゲート抗体でもよい。このようなコンジュゲート抗体は、得られた抗体に化学的な修飾を施すことによって得ることができる。なお、抗体の修飾方法はこの分野においてすでに確立されている。本発明における抗体にはこれらのコンジュゲート抗体も包含される。
【0076】
又、本発明に使用する抗体は二種特異性抗体(bispecific antibody)でもよい(例え
ば、Journal of Immunology, 1994, 152, 5368-5374、など)。二種特異性抗体は一方が
グリピカン3を認識し、他方が他の抗原を認識してもよいし、グリピカン3分子上の異なるエピトープを認識してもよい。
【0077】
また本発明の抗体は、そのN末端あるいはC末端に他のタンパク質を融合してもよい(Clinical Cancer Research, 2004, 10, 1274-1281)。融合するタンパク質は当業者が適宜
選択することができる。
【0078】
さらに、本発明の抗体は細胞障害活性が増強された抗体でもよい。細胞障害活性が増強された抗体としては、例えば、フコースが欠損した抗体、糖鎖にバイセクティング(bisecting)N−アセチルグルコサミン(GlcNAc)が付加した抗体、Fc領域のアミノ酸を置換することによりFcγ受容体との結合活性を変化させた抗体などを挙げることができる。これら細胞障害活性が増強された抗体は当業者に公知の方法で作製することができる。
【0079】
抗体の作成方法
グリピカン3に結合する抗体は当業者に公知の方法により作成することができる。例えば、モノクローナル抗体産生ハイブリドーマは、基本的には公知技術を使用し、以下のようにして作製できる。すなわち、グリピカン3タンパク質またはグリピカン3発現細胞を感作抗原として使用して、これを通常の免疫方法にしたがって哺乳動物を免疫する。得られる免疫細胞を通常の細胞融合法によって公知の親細胞と融合させ、通常のスクリーニング法により、モノクローナルな抗体産生細胞を選択することができる。
【0080】
具体的には、モノクローナル抗体を作製するには次のようにすればよい。まず、配列番号3および4に示されるグリピカン3遺伝子/アミノ酸配列にしたがってグリピカン3タンパク質を取得し、これを抗体取得の感作抗原として使用する。すなわち、グリピカン3をコードする遺伝子配列を公知の発現ベクター系に挿入して適当な宿主細胞を形質転換させた後、その宿主細胞中または培養上清中から目的のヒトグリピカン3タンパク質を公知の方法で精製する。
【0081】
次に、この精製グリピカン3タンパク質を感作抗原として用いる。あるいは、グリピカン3の部分ペプチドを感作抗原として使用することもできる。この際、部分ペプチドはヒトグリピカン3のアミノ酸配列にしたがって化学合成により得ることも可能である。
【0082】
本発明の抗グリピカン3抗体の認識するグリピカン3分子上のエピトープは特定のものに限定されず、グリピカン3分子上に存在するエピトープならばどのエピトープを認識してもよい。従って、本発明の抗グリピカン3抗体を作製するための抗原は、グリピカン3分子上に存在するエピトープを含む断片ならば、如何なる断片も用いることが可能である。
【0083】
感作抗原で免疫される哺乳動物としては、特に限定されるものではないが、細胞融合に使用する親細胞との適合性を考慮して選択するのが好ましく、一般的にはげっ歯類の動物、例えば、マウス、ラット、ハムスター、あるいはウサギ、サル等が使用される。
【0084】
感作抗原を動物に免疫するには、公知の方法にしたがって行われる。例えば、一般的方法として、感作抗原を哺乳動物の腹腔内または皮下に注射することにより行われる。具体的には、感作抗原をPBS(Phosphate-Buffered Saline)や生理食塩水等で適当量に希釈、懸濁したものに所望により通常のアジュバント、例えばフロイント完全アジュバントを適量混合し、乳化後、哺乳動物に4-21日毎に数回投与する。また、感作抗原免疫時に適当な担体を使用することもできる。
【0085】
このように哺乳動物を免疫し、血清中に所望の抗体レベルが上昇するのを確認した後に、哺乳動物から免疫細胞を採取し、細胞融合に付される。好ましい免疫細胞としては、特に脾細胞が挙げられる。
【0086】
前記免疫細胞と融合すべき親細胞として、哺乳動物のミエローマ細胞を用いる。このミエローマ細胞は、公知の種々の細胞株、例えば、P3(P3x63Ag8.653)(J. Immnol.(1979)123, 1548-1550)、 P3x63Ag8U.1(Current Topics in Microbiology and Immunology
(1978)81, 1-7)、 NS-1 (Kohler. G. and Milstein, C. Eur. J. Immunol.(1976)6
, 511-519)、MPC-11(Margulies. D.H. et al., Cell(1976)8, 405-415)、SP2/0 (Shulman, M. et al., Nature(1978)276, 269-270)、FO(deSt. Groth, S. F. et al., J. Immunol. Methods(1980)35, 1-21)、S194(Trowbridge, I. S. J. Exp. Med.(1978)148, 313-323)、R210(Galfre, G. et al., Nature(1979)277, 131-133)等が好適に使用される。
【0087】
前記免疫細胞とミエローマ細胞との細胞融合は、基本的には公知の方法、たとえば、ケーラーとミルステインらの方法(Kohler. G. and Milstein, C.、Methods Enzymol.(1981)73, 3-46)等に準じて行うことができる。
【0088】
より具体的には、前記細胞融合は、例えば細胞融合促進剤の存在下に通常の栄養培養液中で実施される。融合促進剤としては、例えばポリエチレングリコール(PEG)、センダ
イウイルス(HVJ)等が使用され、更に所望により融合効率を高めるためにジメチルスル
ホキシド等の補助剤を添加使用することもできる。
【0089】
免疫細胞とミエローマ細胞との使用割合は任意に設定することができる。例えば、ミエローマ細胞に対して免疫細胞を1-10倍とするのが好ましい。前記細胞融合に用いる培養液としては、例えば、前記ミエローマ細胞株の増殖に好適なRPMI1640培養液、MEM培養液、
その他、この種の細胞培養に用いられる通常の培養液が使用可能であり、さらに、牛胎児血清(FCS)等の血清補液を併用することもできる。
【0090】
細胞融合は、前記免疫細胞とミエローマ細胞との所定量を前記培養液中でよく混合し、予め37℃程度に加温したPEG溶液(例えば平均分子量1000-6000程度)を通常30-60%(w/v)の濃度で添加し、混合することによって目的とする融合細胞(ハイブリドーマ)を形成する。続いて、適当な培養液を逐次添加し、遠心して上清を除去する操作を繰り返すことによりハイブリドーマの生育に好ましくない細胞融合剤等を除去する。
【0091】
このようにして得られたハイブリドーマは、通常の選択培養液、例えばHAT培養液(ヒ
ポキサンチン、アミノプテリンおよびチミジンを含む培養液)で培養することにより選択される。上記HAT培養液での培養は、目的とするハイブリドーマ以外の細胞(非融合細胞
)が死滅するのに十分な時間(通常、数日〜数週間)継続する。ついで、通常の限界希釈法を実施し、目的とする抗体を産生するハイブリドーマのスクリーニングおよび単一クローニングを行う。
【0092】
また、ヒト以外の動物に抗原を免疫してハイブリドーマを得る方法の他に、ヒトリンパ球をin vitroでグリピカン3に感作し、感作リンパ球をヒト由来の永久分裂能を有するミエローマ細胞と融合させ、グリピカン3への結合活性を有する所望のヒト抗体を得ることもできる(特公平1-59878号公報参照)。さらに別の方法では、ヒト抗体遺伝子の全ての
レパートリーを有するトランスジェニック動物に抗原となるグリピカン3を投与して抗グリピカン3抗体産生細胞を取得し、これを不死化させ、その細胞からグリピカン3に対するヒト抗体を取得することができる(国際特許出願公開番号WO 94/25585 号公報、WO 93/12227 号公報、WO92/03918号公報、WO 94/02602 号公報参照)。
【0093】
このようにして作製されるモノクローナル抗体を産生するハイブリドーマは、通常の培養液中で継代培養することが可能であり、また、液体窒素中で長期保存することが可能である。
【0094】
当該ハイブリドーマからモノクローナル抗体を取得するには、当該ハイブリドーマを通常の方法にしたがい培養し、その培養上清として得る方法、あるいはハイブリドーマをこれと適合性がある哺乳動物に投与して増殖させ、その腹水として得る方法などが採用され
る。前者の方法は、高純度の抗体を得るのに適しており、一方、後者の方法は、抗体の大量生産に適している。
【0095】
抗体遺伝子をハイブリドーマからクローニングし、適当なベクターに組み込んで、これを宿主に導入し、遺伝子組換え技術を用いて産生させた組換え型の抗体を作製することも可能である(例えば、Vandamme, A. M. et al., Eur. J. Biochem.(1990)192, 767-775, 1990参照)。
【0096】
具体的には、抗グリピカン3抗体を産生するハイブリドーマから、抗グリピカン3抗体の可変(V)領域をコードするmRNAを単離する。mRNAの単離は、公知の方法、例えば、グ
アニジン超遠心法(Chirgwin, J. M. et al., Biochemistry(1979)18, 5294-5299)、AGPC法(Chomczynski, P.et al., Anal. Biochem.(1987)162, 156-159)等により行って全RNAを調製し、mRNA Purification Kit (Pharmacia製)等を使用して目的のmRNAを調製する。また、QuickPrep mRNA Purification Kit (Pharmacia製)を用いることによりmRNAを直接調製することもできる。
【0097】
得られたmRNAから逆転写酵素を用いて抗体V領域のcDNAを合成する。cDNAの合成は、AMVReverse Transcriptase First-strand cDNA Synthesis Kit(生化学工業社製)等を用い
て行う。また、cDNAの合成および増幅を行うには、5'-Ampli FINDER RACE Kit(Clontech製)およびPCRを用いた5'-RACE法(Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA(1988)85, 8998-9002、Belyavsky, A.et al., Nucleic Acids Res.(1989)17, 2919-2932)等を使用することができる。
【0098】
得られたPCR産物から目的とするDNA断片を精製し、ベクターDNAと連結する。さらに、
これより組換えベクターを作製し、大腸菌等に導入してコロニーを選択して所望の組換えベクターを調製する。そして、目的とするDNAの塩基配列を公知の方法、例えば、ジデオ
キシヌクレオチドチェインターミネーション法等により確認する。
【0099】
目的とする抗グリピカン3抗体のV領域をコードするDNAを得たのち、これを、所望の抗体定常領域(C領域)をコードするDNAを含有する発現ベクターへ組み込む。
【0100】
本発明で使用される抗グリピカン3抗体を製造するには、抗体遺伝子を発現制御領域、例えば、エンハンサー、プロモーターの制御のもとで発現するよう発現ベクターに組み込む。次に、この発現ベクターにより、宿主細胞を形質転換し、抗体を発現させる。
【0101】
抗体遺伝子の発現は、H鎖またはL鎖をコードするポリヌクレオチドを別々に発現ベクターに組み込んで宿主細胞を同時形質転換させてもよいし、あるいはH鎖およびL鎖をコードするポリヌクレオチドを単一の発現ベクターに組み込んで宿主細胞を形質転換させてもよい(WO 94/11523 号公報参照)。
【0102】
ポリヌクレオチド
別の観点においては、本発明は、本発明の抗体の重鎖可変領域または軽鎖可変領域をコードするポリヌクレオチドを提供する。好ましくは、本発明のポリヌクレオチドは、配列番号11−21、33−43、55−59、65−70、77−83のいずれかに記載の塩基配列を有する。また、該ポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、かつ本発明の抗体と同等の活性を有する抗体をコードするポリヌクレオチドも本発明の範囲内である。
【0103】
本発明のポリヌクレオチドは、本発明の抗体をコードする限り、特に限定されず、複数のデオキシリボ核酸(DNA)またはリボ核酸(RNA)等のヌクレオチドからなる重合体であ
る。天然以外の塩基を含んでいてよい。本発明のポリヌクレオチドは、抗体を遺伝子工学的な手法により製造するために使用することができる。また本発明の抗体と同等な機能を有する抗体をスクリーニングするために、プローブとして用いることもできる。即ち本発明の抗体をコードするポリヌクレオチド、またはその一部をプローブとして用い、ハイブリダイゼーション、遺伝子増幅技術(例えばPCR)等の技術により、該ポリヌクレオチド
とストリンジェントな条件下でハイブリダイズし、かつ本発明の抗体と同等の活性を有する抗体をコードするDNAを得ることができる。このようなDNAも本発明のポリヌクレオチドに含まれる。
【0104】
ハイブリダイゼーション技術(Sambrook,J et al., Molecular Cloning 2nd ed., 9.47-9.58, Cold Spring Harbor Lab. press, 1989)は当業者によく知られた技術である。ハイブリダイゼーションの条件としては、例えば、低ストリンジェントな条件が挙げられる。低ストリンジェントな条件とは、ハイブリダイゼーション後の洗浄において、例えば42℃、0.1×SSC、0.1%SDSの条件であり、好ましくは50℃、0.1×SSC 、0.1%SDSの条件で
ある。より好ましいハイブリダイゼーションの条件としては、高ストリンジェントな条件が挙げられる。高ストリンジェントな条件とは、例えば65℃、5×SSCおよび0.1%SDSの条件である。これらの条件において、温度を上げる程に高い相同性を有するポリヌクレオチドが効率的に得られることが期待できる。但し、ハイブリダイゼーションのストリンジェンシーに影響する要素としては温度や塩濃度など複数の要素が考えられ、当業者であればこれら要素を適宜選択することで同様のストリンジェンシーを実現することが可能である。
【0105】
これらハイブリダイゼーション技術や遺伝子増幅技術により得られるポリヌクレオチドがコードする、本発明の抗体と機能的に同等な抗体は、通常、これら抗体とアミノ酸配列において高い相同性を有する。本発明の抗体には、本発明の抗体と機能的に同等であり、かつ該抗体のアミノ酸配列と高い相同性を有する抗体も含まれる。高い相同性とは、アミノ酸レベルにおいて、通常、少なくとも50%以上の同一性、好ましくは75%以上の同一性、さらに好ましくは85%以上の同一性、さらに好ましくは95%以上の同一性を指す。ポリペプチドの相同性を決定するには、文献(Wilbur, W. J. and Lipman, D. J. Proc. Natl. Acad. Sci. USA (1983) 80, 726-730)に記載のアルゴリズムにしたがえばよい。
【0106】
本発明はまた、本発明のポリヌクレオチドを含むベクターを提供する。このようなベクターは、本発明の抗体を製造するために用いることができる。本発明のベクターとしては、例えば、大腸菌を宿主とする場合には、ベクターを大腸菌(例えば、JM109、DH5α、HB101、XL1Blue)などで大量に増幅させ大量調製するために、大腸菌で増幅されるための「ori」をもち、さらに形質転換された大腸菌の選抜遺伝子(例えば、なんらかの薬剤(ア
ンピシリンやテトラサイクリン、カナマイシン、クロラムフェニコール)により判別できるような薬剤耐性遺伝子)を有すれば特に制限はない。ベクターの例としては、M13系ベ
クター、pUC系ベクター、pBR322、pBluescript、pCR-Scriptなどが挙げられる。また、cDNAのサブクローニング、切り出しを目的とした場合、上記ベクターの他に、例えば、pGEM-T、pDIRECT、pT7などが挙げられる。
【0107】
本発明のベクターとしては、特に、発現ベクターが有用である。発現ベクターとしては、例えば、大腸菌での発現を目的とした場合は、ベクターが大腸菌で増幅されるような上記特徴を持つほかに、宿主をJM109、DH5α、HB101、XL1-Blueなどの大腸菌とした場合に
おいては、大腸菌で効率よく発現できるようなプロモーター、例えば、lacZプロモーター(Wardら, Nature (1989) 341, 544-546;FASEB J. (1992) 6, 2422-2427)、araBプロモーター(Betterら, Science (1988) 240, 1041-1043 )、またはT7プロモーターなどを持っていることが不可欠である。このようなベクターとしては、上記ベクターの他にpGEX-5X-1(ファルマシア社製)、「QIAexpress system」(キアゲン社製)、pEGFP、またはpET
(この場合、宿主はT7 RNAポリメラーゼを発現しているBL21が好ましい)などが挙げられる。
【0108】
また、ベクターには、ポリペプチド分泌のためのシグナル配列が含まれていてもよい。タンパク質分泌のためのシグナル配列としては、大腸菌のペリプラズムに産生させる場合、pelBシグナル配列(Lei, S. P. et al J. Bacteriol. (1987) 169, 4379)を使用すれ
ばよい。宿主細胞へのベクターの導入は、例えば塩化カルシウム法、エレクトロポレーション法を用いて行うことができる。
【0109】
大腸菌以外にも、例えば、本発明のベクターとしては、哺乳動物由来の発現ベクター(例えば、pcDNA3 (インビトロゲン社製)や、pEGF-BOS (Nucleic Acids. Res.1990, 18(17),p5322)、pEF 、pCDM8)、昆虫細胞由来の発現ベクター(例えば「Bac-to-BAC baculovirus expression system」(ギブコBRL社製)、pBacPAK8)、植物由来の発現ベクター(例えばpMH1、pMH2)、動物ウィルス由来の発現ベクター(例えば、pHSV、pMV、pAdexLcw)
、レトロウィルス由来の発現ベクター(例えば、pZIPneo)、酵母由来の発現ベクター(
例えば、「Pichia Expression Kit」(インビトロゲン社製)、pNV11、SP-Q01)、枯草菌由来の発現ベクター(例えば、pPL608、pKTH50)が挙げられる。
【0110】
CHO細胞、COS細胞、NIH3T3細胞等の動物細胞での発現を目的とした場合には、細胞内で発現させるために必要なプロモーター、例えばSV40プロモーター(Mulliganら, Nature (1979) 277, 108)、MMTV-LTRプロモーター、EF1αプロモーター(Mizushimaら, Nucleic Acids Res. (1990) 18, 5322)、CMVプロモーターなどを持っていることが不可欠であり
、細胞への形質転換を選抜するための遺伝子(例えば、薬剤(ネオマイシン、G418など)により判別できるような薬剤耐性遺伝子)を有すればさらに好ましい。このような特性を有するベクターとしては、例えば、pMAM、pDR2、pBK-RSV、pBK-CMV、pOPRSV、pOP13など
が挙げられる。
【0111】
さらに、遺伝子を安定的に発現させ、かつ、細胞内での遺伝子のコピー数の増幅を目的とする場合には、核酸合成経路を欠損したCHO細胞にそれを相補するDHFR遺伝子を有する
ベクター(例えば、pCHOIなど)を導入し、メトトレキセート(MTX)により増幅させることができる。また、遺伝子の一過性の発現を目的とする場合には、SV40 T抗原を発現する遺伝子を染色体上に持つCOS細胞を用いてSV40の複製起点を持つベクター(pcDなど)で形質転換することができる。複製開始点としては、また、ポリオーマウィルス、アデノウィルス、ウシパピローマウィルス(BPV)等の由来のものを用いることもできる。さらに、
宿主細胞系で遺伝子コピー数増幅のため、発現ベクターは選択マーカーとして、アミノグリコシドトランスフェラーゼ(APH)遺伝子、チミジンキナーゼ(TK)遺伝子、大腸菌キ
サンチングアニンホスホリボシルトランスフェラーゼ(Ecogpt)遺伝子、ジヒドロ葉酸還元酵素(dhfr)遺伝子等を含むことができる。
【0112】
本発明の抗体を製造するためには、該ベクターを宿主細胞に導入する。ベクターが導入される宿主細胞としては特に制限はなく、例えば、大腸菌や種々の動物細胞などを用いることが可能である。宿主細胞は、例えば、本発明の抗体の製造や発現のための産生系として使用することができる。ポリペプチド製造のための産生系は、in vitroおよびin vivo
の産生系がある。in vitroの産生系としては、真核細胞を使用する産生系や原核細胞を使用する産生系が挙げられる。
【0113】
真核細胞を使用する場合、例えば、動物細胞、植物細胞、真菌細胞を宿主に用いることができる。動物細胞としては、哺乳類細胞、例えば、CHO(J. Exp. Med. (1995) 108, 945)、COS、3T3、ミエローマ、BHK(baby hamster kidney)、HeLa、Vero、両生類細胞、
例えばアフリカツメガエル卵母細胞(Valle, et al., Nature (1981) 291, 358-340)、
あるいは昆虫細胞、例えば、Sf9、Sf21、Tn5が挙げられる。本発明においては、CHO-DG44、CHO-DXB11、COS7細胞、BHK細胞が好適に用いられる。動物細胞において、大量発現を目的とする場合には特にCHO細胞が好ましい。宿主細胞へのベクターの導入は、例えば、リ
ン酸カルシウム法、DEAEデキストラン法、カチオニックリボソームDOTAP(ベーリンガー
マンハイム社製)を用いた方法、エレクトロポーレーション法、リポフェクションなどの方法で行うことが可能である。
【0114】
植物細胞としては、例えば、ニコチアナ・タバカム(Nicotiana tabacum)由来の細胞
がタンパク質生産系として知られており、これをカルス培養すればよい。真菌細胞としては、酵母、例えば、サッカロミセス(Saccharomyces)属、例えば、サッカロミセス・セ
レビシエ(Saccharomyces cerevisiae)、サッカロミセス・ポンベ(Saccharomyces pombe)糸状菌、例えば、アスペルギルス(Aspergillus)属、例えば、アスペルギルス・ニガー(Aspergillus niger)が挙げられる。
【0115】
原核細胞を使用する場合、細菌細胞を用いる産生系を使用することができる。細菌細胞としては、大腸菌(E. coli)、例えば、JM109、DH5α、HB101等、および枯草菌が挙げられる。
【0116】
組換え抗体の製造
本発明の抗体は、上記宿主細胞を培養することにより製造することができる。目的とするポリヌクレオチドにより形質転換された細胞をin vitroで培養することにより、抗体が得られる。培養は、公知の方法に従い行うことができる。例えば、動物細胞の培養液として、例えば、DMEM、MEM、RPMI1640、IMDMを使用することができる。その際、FBS、牛胎児血清(FCS)等の血清補液を併用することもできるし、無血清培養してもよい。培養時のpHは、約6〜8であるのが好ましい。培養は、通常、約30〜40℃で約15〜200時間行い、必要に応じて培地の交換、通気、攪拌を加える。
【0117】
一方、in vivoでポリペプチドを産生させる系としては、例えば、動物を使用する産生
系や植物を使用する産生系が挙げられる。これらの動物または植物に目的とするポリヌクレオチドを導入し、動物または植物の体内でポリペプチドを産生させ、回収する。本発明における「宿主」とは、これらの動物、植物を包含する。
【0118】
動物を使用する場合、哺乳類動物、昆虫を用いる産生系がある。哺乳類動物としては、ヤギ、ブタ、ヒツジ、マウス、ウシを用いることができる(Vicki Glaser, SPECTRUM Biotechnology Applications, 1993)。また、哺乳類動物としてトランスジェニック動物を
用いることができる。
【0119】
例えば、目的とするポリヌクレオチドを、ヤギβカゼインのような乳汁中に固有に産生されるポリペプチドをコードする遺伝子との融合遺伝子として調製する。次いで、この融合遺伝子を含むDNA断片をヤギの胚へ注入し、この胚を雌のヤギへ移植する。胚を受容し
たヤギから生まれるトランスジェニックヤギまたはその子孫が産生する乳汁から、目的の抗体を得ることができる。トランスジェニックヤギから産生される抗体を含む乳汁量を増加させるために、適宜ホルモンをトランスジェニックヤギに使用してもよい(Ebert, K.M. et al., Bio/Technology (1994) 12, 699-702)。
【0120】
また、昆虫としては、例えばカイコを用いることができる。カイコを用いる場合、目的の抗体をコードするポリヌクレオチドを挿入したバキュロウィルスをカイコに感染させることにより、このカイコの体液から目的の抗体を得ることができる(Susumu, M. et al.,Nature (1985) 315, 592-594)。
【0121】
さらに、植物を使用する場合、例えばタバコを用いることができる。タバコを用いる場合、目的とする抗体をコードするポリヌクレオチドを植物発現用ベクター、例えばpMON 530に挿入し、このベクターをアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)のようなバクテリアに導入する。このバクテリアをタバコ、例えば、ニコチ
アナ・タバカム(Nicotiana tabacum)に感染させ、本タバコの葉より所望の抗体を得る
ことができる(Julian K.-C. Ma et al., Eur. J. Immunol. (1994) 24, 131-138)。
【0122】
以上のようにして得られた抗体は、宿主細胞内または細胞外(培地など)から単離し、実質的に純粋で均一な抗体として精製することができる。抗体の分離、精製は、通常のポリペプチドの精製で使用されている分離、精製方法を使用すればよい。例えば、クロマトグラフィーカラム、フィルター、限外濾過、塩析、溶媒沈殿、溶媒抽出、蒸留、免疫沈降、SDS-ポリアクリルアミドゲル電気泳動、等電点電気泳動法、透析、再結晶等を適宜選択、組み合わせればポリペプチドを分離、精製することができる。
【0123】
クロマトグラフィーとしては、例えばアフィニティークロマトグラフィー、イオン交換クロマトグラフィー、疎水性クロマトグラフィー、ゲル濾過、逆相クロマトグラフィー、吸着クロマトグラフィー等が挙げられる(Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press, 1996)。これらのクロマトグラフィーは、液相クロマトグラフィー、例えばHPLC、FPLC等の液相クロマトグラフィーを用いて行うことができる。アフィニティークロマトグラフィーに用いるカラムとしては、プロテインAカラム、プロ
テインGカラムが挙げられる。例えば、プロテインAを用いたカラムとして、Hyper D, POROS, Sepharose F. F. (Pharmacia)等が挙げられる。
【0124】
なお、抗体の精製前または精製後に適当なタンパク質修飾酵素を作用させることにより、任意に修飾を加えたり部分的にペプチドを除去することもできる。タンパク質修飾酵素としては、例えば、トリプシン、キモトリプシン、リシルエンドペプチダーゼ、プロテインキナーゼ、グルコシダーゼなどが用いられる。
【0125】
診断方法
別の観点においては、本発明は、本発明の抗体を用いて被検試料中のGPC3タンパク質を検出し、癌などの疾患の診断を行う方法を提供する。
【0126】
検出とは、定量的または非定量的な検出を含み、例えば、非定量的な検出としては、単にGPC3タンパク質が存在するか否かの測定、GPC3タンパク質が一定の量以上存在するか否かの測定、GPC3タンパク質の量を他の試料(例えば、コントロール試料など)と比較する測定などを挙げることができ、定量的な検出としては、GPC3タンパク質の濃度の測定、GPC3タンパク質の量の測定などを挙げることができる。
【0127】
被検試料とは、GPC3タンパク質が含まれる可能性のある試料であれば特に制限されないが、哺乳類などの生物の体から採取された試料が好ましく、さらに好ましくはヒトから採取された試料である。被検試料の具体的な例としては、例えば、血液、間質液、血漿、血管外液、脳脊髄液、滑液、胸膜液、血清、リンパ液、唾液、などを挙げることができるが、好ましいものは血液、血清、血漿である。また、生物の体から採取された細胞の培養液などの、被検試料から得られる試料も本発明の被検試料に含まれる。
【0128】
診断される癌は、特に制限されず、具体的には、肝癌、膵臓癌、肺癌、大腸癌、乳癌、前立腺癌、白血病、リンパ腫などを挙げることができるが、好ましいものは肝癌である。検出するGPC3は、特に限定されず、全長GPC3でも、その断片でもよい。GPC3断片を検出する場合には、N端断片でもC端断片でもよいが、好ましくはN端断片である。また、ヘパ
ラン硫酸などが付加されたGPC3タンパク質でも、GPC3コアタンパク質でもよい。
【0129】
被検試料に含まれるGPC3タンパク質の検出方法は特に限定されないが、抗GPC3抗体を
用いた免疫学的方法により検出することが好ましい。免疫学的方法としては、例えば、ラジオイムノアッセイ、エンザイムイムノアッセイ、蛍光イムノアッセイ、発光イムノアッセイ、免疫沈降法、免疫比濁法などを挙げることができるが、好ましくはエンザイムイムノアッセイであり、特に好ましいものは酵素結合免疫吸着定量法(enzyme-linked immunosorbent assay:ELISA)(例えば、sandwich ELISA)である。ELISAなどの上述した免疫学
的方法は当業者に公知の方法により行うことが可能である。
【0130】
抗GPC3抗体を用いた一般的な検出方法としては、例えば、抗GPC3抗体を支持体に固定し、ここに被検試料を加え、インキュベートを行い抗GPC3抗体とGPC3タンパク質を結合させた後に洗浄して、抗GPC3抗体を介して支持体に結合したGPC3タンパク質を検出することにより、被検試料中のGPC3タンパク質の検出を行う方法を挙げることができる。
【0131】
抗GPC3抗体とGPC3タンパク質との結合は、通常、緩衝液中で行われる。緩衝液としては、例えば、リン酸緩衝液、Tris緩衝液などが使用される。また、インキュベーションの条件としては、すでによく用いられている条件、例えば、4℃〜室温にて1時間〜24時間のインキュベーションが行われる。インキュベート後の洗浄は、GPC3タンパク質と抗GPC3抗体の結合を妨げないものであれば何でもよく、例えば、Tween20等の界面活性剤を含む
緩衝液などが使用される。
【0132】
本発明のGPC3タンパク質検出方法においては、GPC3タンパク質を検出したい被検試料の他に、コントロール試料を設置してもよい。コントロール試料としては、GPC3タンパク質を含まない陰性コントロール試料やGPC3タンパク質を含む陽性コントロール試料などがある。この場合、GPC3タンパク質を含まない陰性コントロール試料で得られた結果、GPC3タンパク質を含む陽性コントロール試料で得られた結果と比較することにより、被検試料中のGPC3タンパク質を検出することが可能である。また、コントロール試料および被検試料の検出結果を数値として得、それらの数値を比較することにより、被検試料に含まれるGPC3タンパク質を定量的に検出することも可能である。
【0133】
抗GPC3抗体を介して支持体に結合したGPC3タンパク質の検出の好ましい態様として、標識物質で標識された抗GPC3抗体を用いる方法を挙げることができる。例えば、支持体に固定された抗GPC3抗体に被検試料を接触させ、洗浄後に、GPC3タンパク質を特異的に結合する標識抗体を用いてGPC3を検出することができる。
【0134】
抗GPC3抗体の標識は通常知られている方法により行うことが可能である。標識物質としては、蛍光色素、酵素、補酵素、化学発光物質、放射性物質などの当業者に公知の標識物質を用いることが可能であり、具体的な例としては、ラジオアイソトープ(32P、14C、125I、3H、131Iなど)、フルオレセイン、ローダミン、ダンシルクロリド、ウンベリフェロン、ルシフェラーゼ、ペルオキシダーゼ、アルカリホスファターゼ、β-ガラクトシダーゼ
、β-グルコシダーゼ、ホースラディッシュパーオキシダーゼ、グルコアミラーゼ、リゾ
チーム、サッカリドオキシダーゼ、マイクロペルオキシダーゼ、ビオチンなどを挙げることができる。標識物質としてビオチンを用いる場合には、ビオチン標識抗体を添加後に、アルカリホスファターゼなどの酵素を結合させたアビジンをさらに添加することが好ましい。
【0135】
具体的には、抗GPC3抗体を含む溶液をプレートなどの支持体に加え、抗GPC3抗体を固定する。プレートを洗浄後、タンパク質の非特異的な結合を防ぐため、例えばBSAなどでブ
ロッキングする。再び洗浄し、被検試料をプレートに加える。インキュベートの後、洗浄
し、標識抗GPC3抗体を加える。適度なインキュベーションの後、プレートを洗浄し、プレートに残った標識抗GPC3抗体を検出する。タンパク質の検出は当業者に公知の方法により行うことができ、例えば、放射性物質による標識の場合には液体シンチレーションやRIA
法により検出することができる。酵素による標識の場合には基質を加え、基質の酵素的変化、例えば発色を吸光度計により検出することができる。蛍光物質の場合には蛍光光度計により検出することができる。
【0136】
本発明のGPC3タンパク質検出方法の特に好ましい態様として、ビオチンで標識された抗GPC3抗体およびアビジンを用いる方法を挙げることができる。具体的には、抗GPC3抗体を含む溶液をプレートなどの支持体に加え、抗GPC3抗体を固定する。プレートを洗浄後、タンパク質の非特異的な結合を防ぐため、例えばBSAなどでブロッキングする。再び洗浄し
、被検試料をプレートに加える。インキュベートの後、洗浄し、ビオチン標識抗GPC3抗体を加える。適度なインキュベーションの後、プレートを洗浄し、アルカリホスファターゼ、ペルオキシダーゼなどの酵素と結合したアビジンを加える。インキュベーション後、プレートを洗浄し、アビジンに結合している酵素に対応した基質を加え、基質の酵素的変化などを指標にGPC3タンパク質を検出する。
【0137】
本発明のGPC3タンパク質検出方法の他の態様として、GPC3タンパク質を特異的に結合する一次抗体、および該一次抗体を特異的に結合する二次抗体を用いる方法を挙げることができる。例えば、支持体に固定された抗GPC3抗体に被検試料を接触させ、インキュベーションした後、洗浄し、洗浄後に結合しているGPC3タンパク質を、一次抗GPC3抗体および該一次抗体を特異的に結合する二次抗体により検出する。この場合、二次抗体は好ましくは標識物質により標識されている。
【0138】
具体的には、抗GPC3抗体を含む溶液をプレートなどの支持体に加え、抗GPC3抗体を固定する。プレートを洗浄後、タンパク質の非特異的な結合を防ぐため、例えばBSAなどでブ
ロッキングする。再び洗浄し、被検試料をプレートに加える。インキュベートの後、洗浄し、一次抗GPC3抗体を加える。適度なインキュベーションの後、プレートを洗浄し、次いで一次抗体を特異的に結合する二次抗体を加える。適度なインキュベーションの後、洗浄して、プレートに残った二次抗体を検出する。二次抗体の検出は前述の方法により行うことができる。
【0139】
医薬組成物
別の観点においては、本発明は、本発明の抗体を含有する医薬組成物を提供する。本発明の抗体を含有する医薬組成物は癌などの細胞増殖に関連する疾患の治療および/または予防に有用であり、特に肝癌の治療および/または予防に有用である。本発明の抗体を医薬組成物として用いる場合には、当業者に公知の方法で製剤化することが可能である。例えば、水もしくはそれ以外の薬学的に許容し得る液との無菌性溶液、または懸濁液剤の注射剤の形で非経口的に使用できる。例えば、薬理学上許容される担体もしくは媒体、具体的には、滅菌水や生理食塩水、植物油、乳化剤、懸濁剤、界面活性剤、安定剤、香味剤、賦形剤、ベヒクル、防腐剤、結合剤などと適宜組み合わせて、一般に認められた製薬実施に要求される単位用量形態で混和することによって製剤化することが考えられる。これら製剤における有効成分量は指示された範囲の適当な用量を投与しうるよう選択する。
【0140】
注射のための無菌組成物は注射用蒸留水のようなベヒクルを用いて通常の製剤実施に従って処方することができる。
【0141】
注射用の水溶液としては、例えば生理食塩水、ブドウ糖やその他の補助薬を含む等張液、例えばD-ソルビトール、D-マンノース、D-マンニトール、塩化ナトリウムが挙げられ、適当な溶解補助剤、例えばアルコール、具体的にはエタノール、ポリアルコール、例えば
プロピレングリコール、ポリエチレングリコール、非イオン性界面活性剤、例えばポリソルベート80(TM)、HCO-50と併用してもよい。
【0142】
油性液としてはゴマ油、大豆油があげられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコールと併用してもよい。また、緩衝剤、例えばリン酸塩緩衝液、酢酸ナトリウム緩衝液、無痛化剤、例えば、塩酸プロカイン、安定剤、例えばベンジルアルコール、フェノール、酸化防止剤と配合してもよい。調製された注射液は通常、適当なアンプルに充填させる。
【0143】
投与は好ましくは非経口投与であり、具体的には、注射剤型、経鼻投与剤型、経肺投与剤型、経皮投与型などが挙げられる。注射剤型の処方は、例えば、静脈内注射、筋肉内注射、腹腔内注射、皮下注射などにより全身または局部的に投与することができる。
【0144】
また、患者の年齢、症状により適宜投与方法を選択することができる。抗体または抗体をコードするポリヌクレオチドを含有する医薬組成物の投与量としては、例えば、一回につき体重1kgあたり0.0001mgから1000mgの範囲で選ぶことが可能である。あるいは、例え
ば、患者あたり0.001〜100000mg/bodyの範囲で投与量を選ぶことができるが、これらの数値に必ずしも制限されるものではない。投与量、投与方法は、患者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。
【0145】
本明細書において明示的に引用される全ての特許および参考文献の内容は全て本明細書の一部としてここに引用する。また,本出願が有する優先権主張の基礎となる出願である日本特許出願2004−203637号の明細書および図面に記載の内容は全て本明細書の一部としてここに引用する。
【0146】
以下に実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【実施例】
【0147】
以下に実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【0148】
実施例1
ヒトグリピカン3(GPC3)のcDNAクローニング
ヒトGPC3をコードする全長cDNAは、大腸癌細胞株Caco2より常法により調製した1st strand cDNAを鋳型とし、Advantage2 kit(CLONTECH社)を用いたPCR反応により増幅した。
【0149】
すなわち、2 μlのCaco2由来cDNA、1μlのセンスプライマー(GATATC-ATGGCCGGGACCGTGCGCACCGCGT:配列番号1)、1μlのアンチセンスプライマー(GCTAGC-TCAGTGCACCAGGAAGAAGAAGCAC:配列番号2)、5μlのAdvantage2 10xPCR buffer、8μlのdNTP mix (1.25 mM)
、1.0μlのAdvantage polymerase Mixを含む50μlの反応液を、94 ℃で1分、63 ℃で30秒、68 ℃で3分からなるサイクルを35回行った。PCR反応による増幅産物はpGEM-T Easy VectorSystem I(Promega社)を用いてTAベクターpGEM-T easyに挿入した。ABI3100 DNAシーケンサーを用い配列の確認を行った結果、ヒトGPC3の全長をコードするcDNAを単離した。配列番号3で表される配列はヒトGPC3遺伝子の塩基配列を、配列番号4で表される配列はヒトGPC3タンパク質のアミノ酸配列を示す。
【0150】
実施例2
可溶型GPC3の作製
抗GPC3抗体作製のための免疫タンパク質として、C末端側の疎水性領域(564-580アミ
ノ酸)を欠損させた可溶型GPC3タンパク質を作製した。
【0151】
完全長ヒトGPC3 cDNAを鋳型としてアンチセンスプライマー(ATA GAA TTC CAC CAT GGCCGG GAC CGT GCG C:配列番号5)とEcoRI認識配列、Kozak配列を加えたセンスプライマ
ー(ATA GGA TCC CTT CAG CGG GGA ATG AAC GTT C:配列番号6)を用いてPCRを行った。得られたPCR断片(1711bp)をpCXND2-Flagにクローニングした。pCXND2-Flagは、pCXN2(Niwaら、Gene 1991;108;193-199)のHindIII部位にpCHOI(Hirataら、FEBS letter 1994;356;244−248)のDHFR遺伝子発現領域を挿入し、また、マルチクローニングサイトの下流にFlagタグ配列を付加し、Flagタグ付加タンパクとして発現されるよう設計した。作製された発現プラスミドDNAをCHO細胞DXB11株へ導入し、500μg/mL Geneticin での選抜によ
り、可溶型GPC3高発現CHO株を得た。1700 cm2ローラーボトルを用い可溶型GPC3高発現CHO株の大量培養を行い、培養上清を回収し精製を行った。培養上清をDEAE sepharose Fast Flow (Amersham社)にチャージし、洗浄後、500mM NaClを含むバッファにより溶出した。
次に、Anti-Flag M2 agarose affinity gel(SIGMA社)を用いてアフィニティー精製を行った。溶出は200μg/mLのFLAGペプチドにより行った。Centriprep-10(Millipore社)によ
る濃縮後、Superdex 200 HR 10/30(Amersham社)によるゲルろ過を行いFLAGペプチドを除
去した。最後にDEAE sepharose Fast Flowカラムを用いて濃縮し、同時にTween20を含ま
ないPBS(500mMのNaClを含む)で溶出を行うことによりバッファ置換を行った。
【0152】
実施例3
可溶型GPC3コアタンパク質の作製
GPC3はヘパラン硫酸による修飾を受け巨大分子となる。抗GPC3抗体のスクリーニングにおいてヘパラン硫酸に対する抗体を排除する為、ヘパラン硫酸付加部位に点変異を導入した可溶型GPC3コアタンパク質を作製し、スクリーニングに用いた。
【0153】
上記可溶型GPC3(1-563)を鋳型とし、アッセンブリーPCR法によって495番目と509番目のSerをAlaに置換させたcDNAを作製した。この際、C末端にHisタグが付加されるようにプライマーを設計し、得られたcDNAをpCXND3ベクターにクローニングした。pCXND3は、pCXN2のHindIII部位にpCHOIのDHFR遺伝子発現部位を挿入して作製した。作製された発現プラ
スミドDNAをDXB11株へ導入し、500μg/mL Geneticin での選抜により、可溶型GPC3コアタンパク質高発現CHO株を得た。
【0154】
1700 cm2ローラーボトルを用い大量培養を行い、培養上清を回収し精製を行った。培養上清をQ sepharose Fast Flow (Amersham社)にチャージし、洗浄後、500mM NaClを含むリン酸バッファにより溶出した。次に、Chelating sepharose Fast Flow (Amersham社)を
用いてアフィニティー精製を行った。10〜150mMのイミダゾールでグラジエント溶出を行
った。最後にQ sepharose Fast Flow を用いて濃縮し、500mM NaClを含むリン酸バッファにより溶出した。
【0155】
還元条件下にてSDSポリアクリルアミドゲル電気泳動の結果、70kDa、40kDa、30kDaの3
つのバンドが得られた。ABI492 protein sequencer(Applied Biosystems社)を用いてアミノ酸シークエンスを行った結果、30kDaのバンドはGPC3の359番目以降、もしくは375番
目以降のアミノ酸配列と一致し、GPC3はArg358とSer359の間、若しくはLys374とVal375の間で切断を受け、40kDaのN末端断片と30kDaのC末端側断片に分割していることが判明し
た。
【0156】
実施例4
全長ヒトGPC3発現CHO細胞株の作製
フローサイトメトリを用いた結合活性評価用の細胞株を得るために、全長GPC3を発現するCHO細胞株の樹立を行った。
【0157】
10μgの全長ヒトGPC3遺伝子発現ベクターと60μLのSuperFect(QIAGEN社)を混合し
、複合体を形成させた後に、CHO細胞DXB11株に添加することにより、遺伝子導入を行った。CO2インキュベーターで24時間培養後、終濃度0.5mg/mLのGeneticinおよび10% FBSを
含むαMEM(GIBCO BRL社)を用いて、選抜を開始した。得られたGeneticin耐性コロニー
を集め、限界希釈法により細胞のクローニングを行った。それぞれの細胞クローンを可溶化し、抗GPC3抗体を用いたウエスタンブロットにより全長ヒトGPC3の発現を確認し、安定発現細胞株を取得した。
【0158】
実施例5
ELISAによる結合活性の評価
可溶型GPC3コアタンパク質を1μg/mLとなるようにコーティングバッファ(0.1mol/L NaHCO3 (pH9.6), 0.02%(w/v) NaN3)で希釈したものをイムノプレートに加え、4℃にて一晩放置しコーティングした。希釈バッファ (50 mmol/L Tris-HCl(pH8.1), 1 mmol/L MgCl2,150 mmol/L NaCl, 0.05%(v/v) Tween 20, 0.02%(w/v) NaN3, 1%(w/v) BSA)にてブロッキン
グ処理を行った後、抗GPC3抗体を加え、室温で1時間放置した。リンスバッファ(0.05%(v/v) Tween 20, PBS)にて洗浄後、アルカリホスファターゼ標識した抗マウスIgG抗体(ZYMED社)を加え、室温で1時間放置した。リンスバッファにて洗浄後、SIGMA104(SIGMA社)を1 mg/mLとなるように基質バッファ(50mmol/L NaHCO3(pH9.8), 10 mmol/L MgCl2)に希釈したものを添加し、室温で1時間発色させた後、Benchmark Plus (BIO-RAD)を用いて吸光
度(405nm, 参照波長655nm)を測定した。
【0159】
実施例6
可溶型GPC3の免疫およびハイブリドーマの選抜
ヒトGPC3とマウスGPC3のホモロジーはアミノ酸レベルで94%の高い相同性を示すため、
通常のマウスに免疫しても抗GPC3抗体を得難い可能性を考え、自己免疫疾患マウスであるMRL/MpJUmmCrj-lpr/lprマウス(以下、MRL/lprマウス、日本チャールズ・リバーより購入)を免疫動物として用いた。7週齢、もしくは8週齢より免疫を開始し、初回免疫には可溶型GPC3を100μg/headとなるように調製し、フロイント完全アジュバント(FCA、ベクトンディッキンソン社)を用いてエマルジョン化したものを皮下に投与した。2週間後に50μg/headとなるように調製したものをフロイント不完全アジュバント(FIA、ベクトンディッキンソン社)でエマルジョン化したものを皮下に投与した。以降1週間間隔で追加免疫を合計5回行った。その内2匹に対し、最終免疫として50μg/headとなるようにPBSに希釈し尾静脈内に投与した。最終免疫の4日後、脾臓細胞を摘出し、マウスミエローマ細胞P3-X63Ag8U1(P3U1、ATCCより購入)と2:1になるように混合し、PEG1500(ロシュ・ダイアグ
ノスティック社)を徐々に加える事により細胞融合を行った。慎重にRPMI1640培地(GIBCO BRL社)を加えPEG1500を希釈し、遠心操作によりPEG1500を除去した後、10%FBS入りRPMI1640にて懸濁したものを100μL /ウエルとなるように96穴培養プレートに播種した。翌日、100μL /ウエルとなるように10%FBS、1 x HAT media supplement (SIGMA社)、0.5 x BM-Condimed H1 Hybridoma cloning supplement (ロシュ・ダイアグノスティック社)
を含むRPMI1640 (以降、HAT培地)を添加した。2, 3, 5日後に培養液の半分をHAT培地に
置き換え、7日後の培養上清を用いてスクリーニングを行った。スクリーニングは可溶型GPC3コアタンパク質を固相化したイムノプレートを用いたELISAにより行った。陽性クローンについては限界希釈法によりモノクローン化した。その結果、GPC3に対して強い結合活性を有する抗体を11クローン(M3C11、M13B3、M1E7、M3B8、M11F1、L9G11、M19B11、M6B1、M18D4、M5B9、M10D2)取得した。
【0160】
実施例7
抗GPC3抗体のアイソタイプの決定、および精製
アイソタイプは、Immunopure Monoclonal Antibody Isotyping Kit I (PIERCE社)を用
いた抗原依存的ELISAにより決定した。抗体の精製は、FBS(Ultra low IgG)(GIBCO BRL社)を添加したHAT培地にて培養したハイブリドーマの培養上清を、Hi Trap ProteinG HP(Amersham社)に吸着させた後、結合バッファ(20mM Sodium phosphate (pH7.0))にて洗浄
後、溶出バッファ(0.1M Glycine-HCl (pH2.7))で溶出した。溶出液は直ちに中和バッファ(1M Tris-HCl(pH9.0))で中和した。PBSで一昼夜透析を行いバッファ置換した。
【0161】
実施例8
ELISAによる結合活性の評価
取得された抗GPC3抗体の結合活性を簡便に評価する為、可溶型GPC3コアタンパク質を固相化したイムノプレートに対する抗体濃度依存的な結合を検出した。精製抗体を10μg/mLから3倍ずつ12段階に希釈したものを加え、2次抗体として抗マウスIgG抗体を添加し、SIGMA104による発色を行った。発色の程度は発色時間により変化するので、データは正確に1時間後に測定したものを解析した。各抗体は全て濃度依存的な発色を示した。抗体濃
度と発色の程度との相関をプロットし、解析ソフトGraphPad Prismを用いて近似曲線を作成し、そのEC50値を結合活性の指標として決定した。図16に全クローンのEC50値を示した。
【0162】
実施例9
フローサイトメトリによる結合活性の評価
1mM EDTA pH8.0 (GIBCO社)/ PBSにて細胞を剥離し、1x106細胞/mLになるようにFACS バッファ (1% FBS/PBS)に懸濁した。100μL/ウエルとなるようにMultiscreen - HV Filter Plates (Millipor社)に分注し、遠心操作にて上清を除去した。適当な濃度に希釈した抗GPC3抗体を加え、氷上にて30分間反応させた。細胞をFACS バッファにて1回洗浄し、FITC
標識抗マウスIgG抗体を添加し、氷上にて30分間反応させた。反応後、500rpmで1分間遠
心し、上清を除き、FACS バッファ 400μLに懸濁し、フローサイトメトリーに供した。フローサイトメーターはEPICS ELITE ESP (Beckman Coulter)を用いた。前方散乱光(forward scatter)および側方散乱光(side scatter)のヒストグラムにて生細胞集団にゲートを設定した。図1に示すように抗GPC3抗体(M3C11、M11F1)はGPC3を発現させたCHO細胞
に強く結合し、親株であるCHO細胞には結合しない事から、細胞膜上に提示されたGPC3に
特異的に結合する事が判明した。また、肝癌細胞株であるHepG2(ATCCより購入)、HuH-7(ヒューマンサイエンス研究資源バンクより購入)に対して結合を示したことから、肝細胞癌を特異的に認識する可能性が示された。可溶型GPC3免疫マウス由来クローンのフローサイトメトリによる結合活性については抗体濃度5μg/mLにおけるヒストグラムのX-mode
値を図16に示す。
【0163】
実施例10
競合ELISAによるエピトープ分類
得られた抗体についてエピトープによる分類を行う為、競合ELISAを実施した。抗体の
ビオチン化はBiotin Labeling Kit(Roche社)を用いて行った。可溶型GPC3コアタンパク質を1μg/mLとなるようにコーティングバッファで希釈したものを100μL/ウエルとなるように加え、一晩4℃で保管しコーティングした。翌日200μLの基質バッファを加えブロッ
キングを行った。4℃で一晩以上放置したプレートへ抗GPC3抗体を100μL/ウエルとなるように加え、室温で1時間反応させた。その後プレートの洗浄なしに10μg/mLのビオチン標
識した抗GPC3抗体10μLを加えさらに1時間反応させた。300μL/ウエルのリンスバッファ
で3回洗浄し、希釈バッファで1000倍に希釈したAP-ストレプトアビジンコンジュゲート(ZYMED社)を100μL/ウエルとなるように加え、室温で1時間反応させた。300μL/ウエルのリンスバッファで5回洗浄し、SIGMA104を1mg/mLとなるように基質バッファで希釈したもの
を100μL/ウエルとなるように加えた。1時間室温でインキュベートした後、吸光度(405nm, 参照波長 655nm)を測定した。
【0164】
図2に競合ELISAの結果を示す。ビオチン化抗体の結合を50%以上競合的に阻害した抗体については、エピトープが立体的に近傍であると判断した。8種類のビオチン化抗体の結合に対する競合的な発色の阻害のパターンによりグループ分けした結果、可溶型GPC3免疫マウス由来の11クローンは5つのグループ(a, b, c, d, e)に分類された(図16)。
【0165】
実施例11
ウエスタンブロッティングによるエピトープ分類
可溶型GPC3コアタンパク質を還元条件下にて10%SDS-PAGE mini (TEFCO社)にチャージし電気泳動後、Trans−Blot SD Semi-Dry Electrophoretic Transfer Cell (BIO-RAD社)を
用いてイモビロン-P(Millipore社)へ移した。膜をTBS-T(0.05% Tween20, TBS)で軽く洗った後、5%スキムミルク入りTBS-Tで1時間振とうした。TBS-Tで約10分間振とうした後
、1%スキムミルク入りTBS-Tで希釈した各抗GPC3抗体を加え1時間振とうした。TBS-Tで洗った後1%スキムミルク入りTBS-Tで希釈したHRP-抗マウスIgG抗体(Amersham社)で1時間
振とう後、TBS-Tで洗った。発色はECL-Plus (Amersham社)を用いて行い、Hyperfilm ECL
(Amersham社)を用いて検出した。
【0166】
図3に示すように、L9G11は40kDa付近のバンドに結合することからN端側結合抗体であ
ると判断された。M3C11は30kDa付近のバンドに結合することからC端側に結合する抗体と
判断した。競合ELISAでc, d, eに属する抗体は全てN末端に結合し、a、bは全てC末端に結合した(図16)。L9G11は他のN端側結合抗体と比較してウエスタンブロッティングの検出感度が高く、N端側断片をウエスタンブロッティングにより検出するにあたって有用な
抗体であると考えられた。
【0167】
実施例12
分泌型GPC3の検出
GPC3が358番目のアミノ酸部位、若しくは374番目のアミノ酸部位で切断される事実を見出し、分泌型GPC3が肝癌患者の血中に分泌されるという仮説を立てた。そこで分泌型GPC3を検出する為、GPC3サンドイッチELISA系を構築した。
【0168】
イムノプレートに10μg/mLとなるように抗GPC3抗体をコートし、基質バッファを用いてブロッキングを行った。室温で数時間後、あるいは4℃で一晩保管後、HepG2の培養上清を加え1時間室温でインキュベートした。300μL/ウェルのリンスバッファで3回洗浄後、10
μg/mLとなるように希釈したビオチン標識した抗GPC3抗体を加え1時間室温でインキュベ
ートした。300μL/ウェルのリンスバッファで3回洗浄後、AP-ストレプトアビジンを加え
、1時間室温でインキュベートした。300μL/ウエルのリンスバッファで5回洗浄した後、添付のプロトコールに従いAMPAK(DAKO社)を用いて発色させ、マイクロプレートリーダ
ーで吸光度を測定した。N端断片に結合する抗体(M6B1、M19B11、M18D4)とC端断片に結
合する抗体(M3C11、M13B3、M3B8)を組み合わせ5種類のサンドイッチELISA系を構築した。いずれの組み合わせも分泌型GPC3を用いたスタンダード曲線では同等の感度を示した。HepG2の培養上清を用いて評価した結果、N端断片に結合する抗体の組み合わせで1μg/mL
程度と高濃度で分泌型GPC3が検出された(図4)。C端に結合する抗体の組み合わせでは
検出濃度が低かった事から、分泌型GPC3ではN端断片が優位に存在すると考えられた。
【0169】
次に、抗GPC3抗体を用いてHepG2の培養上清の免疫沈降を行い、分泌型GPC3の検出を行った。N端断片に結合するM10D2を用いた場合、40kDaの分泌型GPC3が検出された(図5)
。それに対しC端断片に結合するM1E7を用いた場合、分泌型GPC3は検出されなかった。取
得した全GPC3抗体について免疫沈降実験を行った結果、N端断片に結合する全ての抗体は
分泌型GPC3を強く検出し、C端断片に結合する抗体では検出されないか、弱く検出された
(図16)。免疫沈降により分泌型GPC3を検出し得る抗体は肝細胞癌の診断用抗体として有用であると考えられる。また、分泌型GPC3を検出しにくい抗体は、ADCC活性、CDC活性
を有する治療用抗体として開発する上で、血液中の分泌型GPC3にトラップされずに肝細胞癌へ移行し得る点で有用であると考えられた。
【0170】
実施例13
抗GPC3抗体可変領域のクローニング
抗GPC3抗体産生ハイブリドーマより抽出したTotal RNAを用いて、抗GPC3抗体可変領域
をRT-PCR法によって増幅した。Total RNAは、RNeasy Plant Mini Kits(QIAGEN社)を用
いて1×107細胞のハイブリドーマより抽出した。1μgのTotal RNAを使用して、SMART RACE cDNA Amplification Kit(CLONTECH社)、以下の合成オリゴヌクレオチド:マウ
スIgG1定常領域配列に相補的な合成オリゴヌクレオチドMHC-IgG1GGG CCA GTG GAT AGACAG
ATG(配列番号7)マウスIgG2a定常領域配列に相補的な合成オリゴヌクレオチドMHC-IgG2aCAG GGG CCA GTG GAT AGA CCG ATG(配列番号8)マウスIgG2b定常領域配列に相補的な合成オリゴヌクレオチドMHC-IgG2bCAG GGG CCA GTG GAT AGA CTG ATG(配列番号9)またはマウスκ鎖定常領域塩基配列に相補的な合成オリゴヌクレオチドkappaGCT CAC TGG ATG
GTG GGA AGA TG(配列番号10)を用い、5’末端側遺伝子断片を増幅した。
【0171】
逆転写反応は42℃で1時間30分間反応した。PCR溶液50μLは、5μLの10×Advantage 2PCR Buffer、5μLの10×Universal Primer A Mix、0.2mM dNTPs(dATP,dGTP,dCTP,dTTP)、1μLのAdvantage 2 Polymerase Mix(以上、CLONTECH社製)、2.5μLの逆転写反
応産物、10 pmoleの合成オリゴヌクレオチドMHC-IgG1、MHC-IgG2a、MHC-IgG2bまたはkappaを含有した。PCRは、94℃の初期温度にて30秒間そして94℃にて5秒間、72℃にて3分間のサイクルを5回反復し、94℃にて5秒間、70℃にて10秒間、72℃にて3分間のサイクルを5回反復し、さらに94℃にて5秒間、68℃にて10秒間、72℃にて3分間のサイクルを25回反復した。最後に反応産物を72℃で7分間加熱した。各PCR産物はQIAquick Gel Extraction Kit(QIAGEN社製)を用いて、アガロースゲルから精製した後、pGEM-T Easyベクタ
ー(Promega社製)へクローニングし、塩基配列を決定した。
【0172】
M3C11、M13B3、M1E7、M3B8、M11F1、M19B11、M6B1、M18D4、M5B9、M10D2、L9G11のH鎖可変領域の塩基配列をそれぞれ配列番号11、12、13、14、15、16、17、18、19、20、21に、アミノ酸配列をそれぞれ配列番号22、23、24、25、26、27、28、29、30、31、32に、L鎖可変領域の塩基配列を配列番号33、
34、35、36、37、38、39、40、41、42、43に、アミノ酸配列をそれぞれ配列番号44、45、46、47、48、49、50、51、52、53、54に示す。
【0173】
実施例14
GST融合蛋白を用いたエピトープ分類
C端断片に結合する抗体についてはエピトープの詳細な解析を行う為、段階的に短くし
たGPC3C端断片ペプチドとGSTの融合タンパク質GC-1(Ser495からLys563)、GC-2(Gly510からLys563)、GC-3(Ala524からLys563)GC-4(Gly537からLys563)、GC-5(Ser550からLys563)を作製した。GPC3 C末端領域をpGEX-4T-3(Amersham社)へクローニングしGSTのC末端側にGPC3 C末端領域を連結したプラスミドDNAを構築した。プラスミドDNAをDH5αへ導入し形質転換体を得、対数増殖期にある形質転換体の培養物に1mMとなるようにIPTGを
加えることによりGST融合タンパク質の発現を誘導し、2時間培養後に菌体を回収した。
超音波処理により破砕後、XL-80 超遠心分離機(Beckman, ロータ 70.1Ti)を用い35,000rpmで30分遠心後の培養上清を回収し、GST Purification Modules (Amersham社)を用いて精製した。このようにして精製したGST融合タンパク質を還元条件下にてSDS-PAGEにより分
離後、抗GPC3抗体を用いてウエスタンブロッティングを行った(図6)。M3C11、M1E7はGC-1、2を検出し、GC-3、4、5を検出しなかった。これら抗体のエピトープは、GC-2の領域
に含まれており、GC-3の領域では不十分な領域であるといえる。M3B8、M11F1はGC-1、2、
3、4を検出し、GC-5を検出しなかった。これら抗体のエピトープは、GC-4の領域に含まれており、GC-5の領域では不十分な領域であるといえる。各抗体の結合し得るGST融合蛋白
の最小領域について図16のウエスタンブロッティングの項に記載した。
【0174】
実施例15
抗GPC3マウス−ヒトキメラ抗体の作製
抗GPC3抗体のH鎖およびL鎖可変領域配列をヒトIgG1およびκ鎖定常領域配列に連結した。各抗体のH鎖可変領域の5’末端側塩基配列に相補的でコザック配列を有する合成オリゴヌクレオチドおよびNheI部位を有する3’末端側塩基配列に相補的な合成オリゴヌクレオチドを用いてPCRを行い、得られたPCR産物をヒトIgG1定常領域がpBluescript KS+ベクター(東洋紡社)に挿入されているpB-CHベクターにクローニングした。NheI部位によ
り、マウスH鎖可変領域とヒトH鎖(γ1鎖)定常領域が連結している。作製されたH鎖遺伝子断片を発現ベクターpCXND3にクローニングした。また、各抗体のL鎖可変領域の5’末端側塩基配列に相補的でコザック配列を有する合成オリゴヌクレオチドおよびBsiWI
部位を有する3’末端側塩基配列に相補的な合成オリゴヌクレオチドを用いてPCRを行い
、得られたPCR産物をヒトkappa鎖定常領域がpBluescript KS+ベクター(東洋紡社)に挿入されているpB-CLベクターにクローニングした。BsiWI部位により、ヒトL鎖可変領域と定常領域が連結している。作製されたL鎖遺伝子断片を発現ベクターpUCAGクローニング
した。本ベクターpUCAGは、pCXN(Niwaら、Gene 1991;108:193-200)を制限酵素BamHIで
消化して得られる2.6kbpの断片をpUC19ベクター(東洋紡社)の制限酵素BamHI部位に連結し、クローニングしたベクターである。
【0175】
抗GPC3マウス―ヒトキメラ抗体発現ベクターを作製するために、L鎖遺伝子断片が挿入されたpUCAGベクターを制限酵素HindIII(宝酒造社)で消化して得られる遺伝子断片をH鎖遺伝子が挿入されたpCXND3の制限酵素HindIII切断部位に連結し、クローニングした。
本プラスミドは動物細胞内でネオマイシン耐性遺伝子、DHFR遺伝子、抗GPC3マウス―ヒトキメラ抗体遺伝子を発現する。
【0176】
抗体を安定に発現するCHO細胞(DG44株)の作製は次のようにして行った。Gene PulserII(Bio Rad社製)を用いたエレクトロポレーション法により細胞に遺伝子を導入した。25μgの各抗GPC3マウス―ヒトキメラ抗体発現ベクターとPBSに懸濁したCHO細胞(1×1
07細胞/ml)の0.75mlを混合したものを氷上で10分間冷却し、キュベットに移した後
に1.5kV、25μFDの容量にてパルスを与えた。室温にて10分間の回復期間の後、エレクト
ロポレーション処理された細胞を、HT supplement(Invitrogen社)を1倍濃度で含むCHO-S-SFMII培地(Invitrogen社)40mLに懸濁した。同様の培地で50倍希釈溶液を作製し、96ウェル培養用プレートに100μl/ウェルで分注した。CO2インキュベーター(5%CO2)
で24時間培養後、Geneticin(Invitrogen社)を0.5mg/mLになるように添加して2週間培
養した。Geneticin耐性を示す形質転換細胞のコロニーが観察されたウェルの培養上清中
を取り出し、IgG量について以下に示す濃度定量法で測定した。高産生細胞株を順次拡大
培養し、抗GPC3マウス―ヒトキメラ抗体安定発現細胞株を取得し、大量培養を行い、培養上清を得た。各抗GPC3マウス―ヒトキメラ抗体の精製は、Hi Trap ProteinG HP(Amersham社)を用いて行った。
【0177】
実施例16
補体依存性細胞障害活性(CDC活性)の測定16.1 ヒトアルブミン・ベロナール・バッ
ファ(HAVB)の作製
NaCl(特級、和光純薬工業株式会社)12.75 g、Na-バルビタール(特級、和光純薬工業株式会社)0.5625 g、バルビタール(特級、和光純薬工業株式会社)0.8625 gをミリQ水に溶解し200 mLとした後、オートクレーブ処理(121℃、20分間)した。オートクレーブ
処理した100 mLの温ミリQ水を加え、pH7.43を確認した(推奨pH7.5)。これを5×ベロナ
ールバッファとした。CaCl2・2H2O(特級、純正化学株式会社)0.2205 gを50 mLミリQ水に溶解し0.03 mol/Lとし、CaCl2溶液とした。MgCl2・6H2O(特級、純正化学株式会社)1.0165 gを50 mLミリQ水に溶解し0.1 mol/Lとし、MgCl2溶液とした。5×ベロナールバッファ100 mL、ヒト血清アルブミン(ブミネート(登録商標)25%、ヒト血清アルブミン濃度250 mg/mL、バクスター株式会社)4 mL、CaCl2溶液2.5 mL、MgCl2溶液 2.5 mL、KCl(特級、純正化学株式会社)0.1 g、グルコース (D(+)-グルコース、ブドウ糖無水、特級、和光純薬工業株式会社) 0.5 gをミリQ水に溶解し500 mLとした。これをHAVBとした。ろ過滅
菌後、設定温度5℃にて保存した。
【0178】
16.2 標的細胞の調製
実施例4で作製された全長ヒトGPC3発現CHO細胞は、10%FBSと0.5mg/mL Geneticin(GIBCO)を添加したα-MEM核酸(+)培地(GIBCO)で培養し、細胞剥離緩衝液(InvitrogenCorp)を用いてディッシュから剥離して、96ウェル平底プレート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、3日間培養した。培養後、5.55MBqのクロム-51を加え、5%炭酸
ガスインキュベータ中37℃ 1時間培養し、この細胞をHAVBで2回洗浄し、50μLのHAVBを
加え標的細胞とした。
【0179】
16.3 クロム遊離試験(CDC活性)
各キメラ抗体をHAVBで希釈して40μg/mLの抗体溶液とした。標的細胞に抗体溶液を50
μLずつ添加し、氷上にて15分間静置した。続いて、各ウェルにHAVBにて希釈した、健常
者ボランティア末梢血由来ヒト血清を終濃度25%になるよう100 μLずつ添加し(抗体の終濃度10μg/mL)、5%炭酸ガスインキュベーター中に37℃で90分間静置した。プレートを遠心分離後、各ウェルより上清を100μLずつ回収し、ガンマカウンターにて放射活性を測定した。下式により特異的クロム遊離率を求めた。
特異的クロム遊離率(%)= (A-C)×100/(B-C)
Aは各ウェルにおける放射活性(cpm)、Bは標的細胞に2% NP-40水溶液(Nonidet P-40、Code No.252-23、ナカライテスク株式会社)を100 μL、HAVBを50 μL添加したウェルにおける放射活性(cpm)の平均値、Cは標的細胞にHAVBを150 μL添加したウェルにおける放
射活性(cpm)の平均値を示す。試験は三重に行い、CDC活性(%)について平均値および
標準偏差を算出した。
【0180】
その結果を図7に示した。9種類の抗GPC3キメラ抗体のうち、C末端認識抗体であるM3B8とM11F1がGPC3発現CHO細胞に対し強いCDC活性を示したのに対し、その他の抗体ではCDC活性が認められなかった。M3B8とM11F1はCompetition ELISAにおいて「b」と呼ばれるグル
ープに属しており、強いCDC活性を示すのに重要なエピトープを見出す事ができた。
【0181】
実施例17
ヒト末梢血由来PBMCを用いたADCC活性の測定17.1 ヒトPBMC溶液の調製
健常人よりヘパリン加採血した末梢血を、PBS(-)で2倍に希釈し、Ficoll-Paque TM PLUS (Amersham社)に重層した。これを遠心(500×g、30分間、20℃)した後、単核球画分である中間層を分取した。3回洗浄後、10% FBS/RPMIに懸濁し、ヒトPBMC溶液とした。
【0182】
17.2 標的細胞の調製
10%FBS/RPMI1640培地で培養したHepG2細胞を、トリプシン-EDTA(Invitrogen社)を用い
てディッシュから剥離し、96ウェルU字底プレート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、2日間培養した。実施例4で作製された全長ヒトGPC3発現CHO細胞は、10%FBSと0.5mg/mL Geneticin(GIBCO)を添加したα-MEM核酸(+)培地(GIBCO)で培養し、細胞剥離緩衝液(Invitrogen Corp)を用いてディッシュから剥離して、96ウェル平底プレ
ート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、3日間培養した。両細胞は培養後、それぞれ5.55MBqのクロム-51を加え、5%炭酸ガスインキュベータ中37℃で1時間培養し
、この細胞を培地で1回洗浄し、50μLの10% FBS/RPMI 1640培地を加え標的細胞とした。
【0183】
17.3 クロム遊離試験(ADCC活性)
標的細胞に各濃度に調製した抗体溶液50μLを添加し、氷上で15分反応させた後に、ヒ
トPBMC溶液100μL(5×105細胞/ウェル)を加え、5%炭酸ガスインキュベータ中37℃4
時間培養し、培養後、プレートを遠心分離し、培養上清100μL中の放射活性をガンマカウンターで測定した。下式により特異的クロム遊離率を求めた。
特異的クロム遊離率(%)=(A-C)×100/(B-C)
Aは各ウェルにおける放射活性(cpm)の平均値、Bは標的細胞に2% NP-40水溶液(Nonidet P-40、Code No.252-23、ナカライテスク株式会社)を100 μL、10%FBS/RPMI培地を50 μL添加したウェルにおける放射活性(cpm)の平均値、Cは標的細胞に10%FBS/RPMI培地を150 μL添加したウェルにおける放射活性(cpm)の平均値を示す。試験は三重に行い、ADCC活性(%)について平均値および標準偏差を算出した。その結果を図8に示した。9種類の抗GPC3キメラ抗体のうち、C末端認識抗体が強いADCC活性を示す傾向が認められた。
【0184】
実施例18
GC-3の免疫およびハイブリドーマの選抜
得られた抗GPC3抗体のうち、M11F1、M3B8のみが強いCDC活性を示したことから、CDC活
性にはエピトープ依存性があることが判明した。ADCC活性、CDC活性を併せもつ抗体の取
得を目的とし、M11F1、M3B8のエピトープを含むGST融合タンパク質であるGC-3を用いて免疫を行った。GC-3は上記方法により大量に精製し、Superdex75(Amersham社)を用いてゲルろ過を行い、バッファをPBSに置換したものを免疫蛋白として使用した。Balb/c (日本チャールズリバーより購入)3匹、MRL/lpr 3匹を、上記方法に従いGC-3で免疫した。初回免疫にはGC-3を100μg/headとなるように調製し、FCAを用いてエマルジョン化したものを皮下に投与した。2週間後に50μg/headとなるように調製したものをFIAでエマルジョン化したものを皮下に投与した。5回免疫の後、全マウスに対し最終免疫(50μg/head)を尾
静脈内に行った。細胞融合を行い、可溶型GPC3コアタンパク質を固相化したイムノプレートを用いたELISAによりスクリーニングを行った。陽性クローンについては限界希釈法に
よりモノクローン化した。その結果、GPC3に対して強い結合活性を有する抗体を5クローン(GC199、GC202、GC33、GC179、GC194)取得した。
【0185】
ハイブリドーマの培養上清よりHi Trap ProteinG HPを用いて抗体を精製し、上記方法
に従い解析を行った。可溶型GPC3コアタンパク質を固相化したイムノプレートを用いたELISAによりEC50値を算出し、フローサイトメトリにより5μg/mLでのヒストグラムのX-mode値を測定した(図17)。競合ELISAによるエピトープ分類の結果、bに属するもの(GC199、GC202、GC33)と新しいエピトープグループf(GC179、GC194)に分類された。GST融合タンパク質を用いたエピトープ分類の結果、GC199、GC202、GC33はGC-1、2、3、4を検出
し、GC-5を検出しなかった。これら抗体のエピトープは、M11F1、M3B8のエピトープと同
様に、GC-4の領域に含まれており、GC-5の領域では不十分な領域であるといえる。一方、GC179、GC194はGC-1、2、3を検出し、GC-4、5を検出しなかった。これら抗体のエピトー
プは、GC-3の領域に含まれており、GC-4の領域では不十分な領域であるといえる。各抗体の結合し得るGST融合蛋白の最小領域について図17のウエスタンブロッティングの項に
記載した。
【0186】
GC199、GC202、GC33、GC179、GC194について上記方法に従いH鎖、L鎖の可変領域をクローニングし、配列を決定した。GC194のL鎖については2種類の配列がクローニングされた
。GC199、GC202、GC33、GC179、GC194のH鎖可変領域の塩基配列をそれぞれ配列番号55
、56、57、58、59に、アミノ酸配列をそれぞれ配列番号60、61、62、63、64に示す。GC199、GC202、GC33、GC179、GC194(1)、GC194(2)のL鎖可変領域の塩基配列をそれぞれ配列番号65、66、67、68、69、70に、アミノ酸配列をそれぞれ
配列番号71、72、73、74、75、76に示す。
【0187】
さらに、これらのアミノ酸配列を既知の抗体のアミノ酸配列のデータベースと比較して相同性を調べることにより、CDR領域を以下のとおり決定した。
【0188】
【表4】

【0189】
【表5】

【0190】
実施例19
マウス骨髄由来エフェクター細胞を用いたADCC活性の測定19.1 マウス骨髄由来エフェクター細胞溶液の調製
SCIDマウス(日本クレア・オス・10週齢)の大腿骨から骨髄細胞を採取し、10% FBS/RPMI 1640培地中5×105個/mLとなるよう懸濁し、マウスGM-CSF(PeproTech)およびヒトIL-2(PeproTech)をそれぞれ10ng/mL、50ng/mLとなるよう添加し、5%炭酸ガスインキュベータ中37℃で5日培養した。培養後スクレーパーではがして培地で1回洗浄し、10% FBS/RPMI 1640培地中5×106/mLとなるよう懸濁し、マウス骨髄由来エフェクター細胞
溶液とした。
【0191】
19.2 標的細胞の調製
ヒト肝癌細胞株HuH-7は10%FBS(ThermoTrace社製)を含むDMEM培地(SIGMA社製)にて
維持継代し、Cell Dissociation Buffer (Invitrogen社)を用いてディッシュから剥離し
、96ウェルU字底プレート(Falcon)の各ウェルに1×104細胞/ウェルで分注し、1日間培養した。培養後、5.55MBqのクロム-51を加え、5%炭酸ガスインキュベータ中37℃で1時間培
養し、この細胞を培地で1回洗浄し、50μLの10%FBS/RPMI1640培地を加え標的細胞とした
。
【0192】
19.3 クロム遊離試験(ADCC活性)
標的細胞に各濃度に調製した抗体溶液50μLを添加し、氷上で15分反応させた後に、マ
ウス骨髄由来エフェクター細胞溶液100μL(5×105 細胞/ウェル)を加え、5%炭酸ガス
インキュベータ中37℃4時間培養し、培養後、プレートを遠心分離し、培養上清100μL中
の放射活性をガンマカウンターで測定した。下式により特異的クロム遊離率を求めた。
特異的クロム遊離率(%)=(A-C)×100/(B-C)
Aは各ウェルにおける放射活性(cpm)の平均値、Bは標的細胞に2% NP-40水溶液(Nonidet P-40、Code No.252-23、ナカライテスク株式会社)を100 μL、10%FBS/RPMI培地を50 μL添加したウェルにおける放射活性(cpm)の平均値、Cは標的細胞に10%FBS/RPMI培地を150 μL添加したウェルにおける放射活性(cpm)の平均値を示す。試験は三重に行い、ADCC活性(%)について平均値および標準偏差を算出した。
【0193】
その結果を図9に示した。GC33抗体は0.1μg/mL以上の抗体濃度においてADCC活性を示
し、GC199抗体と比較して強い活性を示すことが明らかとなった。
【0194】
実施例20
GC33抗体のヒト肝癌移植マウスモデルに対する抗腫瘍活性20.1 ヒト肝癌移植マウスモデルの作製
ヒト肝癌細胞株HuH-7は、DMEM培地とMATRIGEL(BD Bioscience社製)を1:1で含む溶液
にて5×107個/mLになるように調製した。前日に抗アシアロGM1抗体(和光純薬社製、1バイアルを1mLの注射用蒸留水で溶解後4mLの生理的食塩水を添加)100μL
を腹腔内へ投与したSCIDマウス(オス、5週齢)(日本クレア)の腹部皮下へ上記細
胞懸濁液100μL(5×106個/マウス)を移植した。
【0195】
20.2 抗体調製および投与
ヒト肝癌移植マウスモデルに対し、投与当日にPBS(−)で0.5 mg/mL(5 mg/kg投与群)および0.1 mg/mL(1 mg/kg投与群)になるように調製した抗体溶液を、細胞移植後20日目より、週に1回、3週間、10 mL/kgにて、尾静脈より投与した。陰性対照として、P
BS(−)(Vehicle)を同様に週に1回、3週間、10 mL/kgにて、尾静脈より投与した。いずれの群も、1群6匹で行った。
【0196】
20.3 抗腫瘍効果の評価
GC33抗体のヒト肝癌移植マウスモデルにおける抗腫瘍効果については腫瘍体積の経時変化および最終投与日より一週間後の腫瘍重量で評価した。腫瘍体積は以下の式にて算出した。
腫瘍体積=長径×短径×短径/2
その結果、図10に示すとおり、GC33抗体投与群ではVehicle投与群と比較して有意な
腫瘍増殖の抑制が認められた。
以上より、GC33抗体がヒト肝癌移植マウスモデルに対して、抗腫瘍効果を有することが示された。
【0197】
実施例21
GC33マウス−ヒトキメラ抗体の作製
GC33のH鎖、L鎖は、5’末端側塩基配列に相補的でコザック配列、HindIII部位を有す
る合成オリゴヌクレオチド、および3’末端側塩基配列に相補的でBamHI部位を有する合
成オリゴヌクレオチドを用いてPCRにより増幅した。得られたPCR産物をHindIII、BamHI消化後、ヒトIgG1定常領域がクローニングされた発現ベクターHEFgγ1、およびヒトκ鎖定
常領域がクローニングされた発現ベクターHEFgκへクローニングした(Satoら、Mol Immunol. 1994;371-381)。上記方法に従いCHO細胞(DG44株)へ導入し安定発現細胞株を樹
立した。培養上清よりHi Trap ProteinG HP(Amersham社)を用いて抗体を精製した。培
養上清中のIgG濃度の測定は、ヤギ抗ヒトIgG (BIOSOURCE社)とヤギ抗ヒトIgG アルカリ
ホスファターゼコンジュゲート(BIOSOURCE社)を用いたヒトIgGサンドイッチELISAを行い、市販の精製ヒトIgG(Cappel社)との比較により定量した。
【0198】
実施例22
GC33マウス−ヒトキメラ抗体を用いたCDC活性、ADCC活性の測定
実施例16および17に記載した方法に従ってGC33、 M3C11、およびM1E7マウス−ヒトキメラ抗体のCDC活性およびADCC活性測定を行った。標的細胞として、CDC活性は全長GPC3発現CHO細胞を、ADCC活性はHepG2をそれぞれ用いた。それぞれの結果を図11、図12に示す。いずれの実験系においてもGC33は他2抗体と比較して強いCDC活性およびADCC活性を示すことが明らかとなった。
【0199】
実施例23
GC33のエピトープ解析
GC33についてはエピトープを詳細に決定するため、さらに短いGPC3C末端ペプチドとGSTの融合タンパク質を作製し、ウエスタンブロッティングにより解析した。作製したGST融
合タンパク質に含まれるGPC3由来ペプチド配列を図13に示す。GC33はGC-4 (aa 537-563)に結合し、GC-5 (aa 550-563)に結合できない事から、エピトープがaa 537 - 550の領域を少なくとも一部含む領域であると考えられた。始めにGC-6(G N S Q Q A T P K D N E I S(配列番号93))、GC-7(G N S Q Q A T P(配列番号94))、GC-8(Q Q A T P K D N(配列番号95))、GC-9(T P K D N E I S(配列番号96))を作製した。5'端にEcoRI、3'端にSalI認識配列の切断端が付加されるように設計したフォワードオリゴDNAとリバースオリゴDNAを作製した。オリゴDNAはエスペックオリゴ株式会社に合成を委託し、C-18カートリッジ精製され、5'末端リン酸化したものを使用した。10μMのフォワードオリゴDNA 25μLと10μMのリバースオリゴDNA 25μLを混合し、94°Cで5分間の後、37°Cで10分間、室温で15分間反応させた後、4°Cで10分放置し、フォワードオリゴDNAとリバースオリゴDNAをアニールさせた。吸光度測定により濃度を決定した後、インサート:
ベクターのモル比が3:1となるように、EcoRI、SalI消化したpGEX4T-3にクローニングした。塩基配列を確認した後、上記方法に従いGST融合タンパク質を調製し、Gluthatione Sepharose 4Bを用いて精製した。これを還元条件下にてSDS-PAGEにより分離し、GC33を用い
るウエスタンブロッティングにより解析した。いずれのGST融合タンパク質も強くは検出
できず、GC33による結合はさらにC末端側の配列が必要である事が予想された(図14)
。そこで、GC-11(A T P K D N E I S T(配列番号97))、GC-12(P K D N E IS T F H(配列番号98))、GC-13(D N E I S T F H NL(配列番号99))、GC-14(E I S T
F H N L G N(配列番号100))を作製し同様に評価した結果、GC-11、GC-12、GC-13
がGC33により強く結合された。この結果より、GC33はGPC3のC末端544番目から553番目の
配列(P K D N E I S T F H)内にそのエピトープが存在すると考えられる。
【0200】
実施例24
GC33のヒト化
公開されているKabat Database (ftp://ftp.ebi.ac.uk/pub/databases/kabat/) 、およびImMunoGeneTics Database (IMGT)より抗体の配列データを入手し、H鎖可変領域、L鎖可
変領域に分けてホモロジー検索を行った。その結果、H鎖可変領域はDN13(Smithsonら、Mol Immunol. 1999;36:113-124)と高い相同性を持つことが分かった。また、L鎖可変領域はAccession number AB064105のhomo sapiens IGK mRNA for immunoglobulin kappa light chain VLJ region, partial cds, clone:K64と高い相同性を持つことが分かった。また、L鎖のシグナル配列についてはAB064105と相同性の高いAccession Number S40357のシグナル配列を利用した。これらのヒト抗体のフレームワーク領域(以下、FR)にGC33の相補性抗原決定領域(以下、CDR)を移植して、ヒト化抗体を作製した。
【0201】
具体的には、50base程度の合成オリゴDNAを約20base程度ハイブリダイズするように設
計し、これらの合成オリゴDNAをPCR法によりアッセンブリさせて各可変領域をコードする遺伝子を作製した。5’端の合成オリゴDNAの末端に挿入したHindIII部位、および3’端の合成オリゴDNAの末端に挿入したBamHI部位で切断し、ヒトIgG1定常領域がクローニングされた発現ベクターHEFgγ1、ヒトκ鎖定常領域がクローニングされた発現ベクターHEFg
κへクローニングした(Satoら、Mol Immunol. 1994;371-381)。このようにして作製したヒト化GC33はH鎖、L鎖それぞれver.aと命名した。H鎖、L鎖ともにver.aのヒト化GC33(ver.a / ver.a)はマウスGC33可変領域の抗体(mouse / mouse)と比較して結合活性が低くかった(図15)。H鎖とL鎖についてマウスGC33配列とver.a配列をキメラに組み合わ
せた抗体(mouse / ver.a、ver.a / mouse)を作製し結合活性を評価した結果、ver.a / mouseで結合活性の低下が認められ、アミノ酸置換による結合活性の低下はH鎖に起因する事が判明した。そこで、H鎖の改変体ver.c、ver.f、ver.h、ver.i、ver.j、ver.kを作製
した。これらの全てのヒト化GC33はマウスGC33可変領域を有するキメラ抗体と同等の結合活性を示した(図15)。ヒト化GC33H鎖可変領域ver.a、ver.c、ver.f、ver.h、ver.i、ver.j、ver.kの塩基配列を配列番号77、78、79、80、81、82、83に、アミノ酸配列を配列番号84、85、86、87、88、89、90に示す。ヒト化GC33L鎖
可変領域ver.aの塩基配列を配列番号91に、アミノ酸配列を配列番号92に示す。ヒト
化GC33H鎖可変領域ver.i、ver.j、ver.kでは、6番目のグルタミン酸がグルタミンに置換されているが、これらの抗体は熱安定性が顕著に増加していた。
【0202】
実施例25
ヒト化GC33L鎖の改変
蛋白質の脱アミド化については一次配列依存的な脱アミド化の反応速度定数が知られており、Asn-Glyが特に脱アミド化し易い配列として知られている(Rocinsonら、Proc. Natl. Acad. Sci. USA 2001;98;944-949.)。配列番号91に示されるヒト化GC33L鎖ver.a可変領域のCDR1内にあるAsn33については、一次配列がAsn-Glyであることから、脱アミド化が容易に起きやすい配列である事が予想された。
【0203】
Asn33の脱アミド化による結合活性に対する影響を評価する為に、Asn33をAspに置換し
た改変抗体を作製した。点変異の導入には、Quick Change Site-Directed Mutagenesis Kit(Stratagene社)を使用した。すなわち、125ngのセンスプライマー(CTT GTA CAC AGTGAC GGA AAC ACC TAT:配列番号172)、125ngのアンチセンスプライマー(ATA GGT GTT TCC GTC ACT GTG TAC AAG:配列番号173)、5μLの10x reaction buffer、1μLのdNTP mix、10ngのヒト化GC33L鎖ver.aがクローニングされたHEFgκ、1μLのPfu Turbo DNA Polymeraseを含む50uLの反応液を用い、95℃で30秒、55℃で1分、68℃で9分からなるサイクルを12回のPCRを行った。その後制限酵素DpnIを加え37℃で2時間消化したものをキットに添付のXL1-Blueコンピテント細胞に導入し形質転換体を得た。正しく変異の導入されたクローンについて、可変領域を切り出し、再度HEFgκへクローニングし直した。これをヒト化GC33H鎖ver.kがクローニングされたHEFgγ1と共にFugene6(Roche社)を用いてCOS7細胞へ導入し、一過性に発現させた抗体を培養上清から回収した。抗ヒトIgG抗体を用
いたサンドイッチELISAにより抗体濃度を定量し、可溶型GPC3コア蛋白質を固相化したイ
ムノプレートを用いたELISAにより改変抗体の結合活性を評価した。図18に示すようにA
sn33をAspに置換した改変抗体(N33D)では結合活性が消失しており、Asn33で脱アミド化が起きた場合結合活性に与える影響は大きいと考えられた。
【0204】
Asn33の脱アミド化を抑制する方法として、Gly34を他のアミノ酸に改変する方法が報告されている(WO03057881A1)。上記方法に従い、Quick Change Site-Directed Mutagenesis Kitを用い、Gly34をCys、Metを除く他の17アミノ酸に置換して、一連の改変抗体G34A
、G34D、G34E、G34F、G34H、G34N、G34P、G34Q、G34I、G34K、G34L、G34V、G34W、G34Y、G34R、G34S、G34Tを作製した。これをCOS7細胞で一過性に発現させ、その培養上清を用
いて結合活性の評価を行った。その結果、Pro(G34P)、Val(G34V)以外ではG34を他のア
ミノ酸に置換しても結合活性が維持されている事が判明した。
【0205】
上述の改変抗体の軽鎖CDR1のアミノ酸配列を、それぞれ配列番号174(G34A)
、配列番号175(G34D)、配列番号176(G34E)、配列番号177(G34F)、配列番号178(G34H)、配列番号179(G34N)、配列番号180(G34T)、配
列番号181(G34Q)、配列番号182(G34I)、配列番号183(G34K)、配列番号184(G34L)、配列番号185(G34S)、配列番号186(G34W)、配列番
号187(G34Y)、配列番号188(G34R)、配列番号189(G34V)、配列番号
190(G34P)に記載する。また、上述の改変抗体の軽鎖可変領域のアミノ酸配列を、
それぞれ配列番号191(G34A)、配列番号192(G34D)、配列番号193(G34
E)、配列番号194(G34F)、配列番号195(G34H)、配列番号196(G34N)、配列番号197(G34T)、配列番号198(G34Q)、配列番号199(G34I)、配列番号200(G34K)、配列番号201(G34L)、配列番号202(G34S)、配列番号203(G34W)、配列番号204(G34Y)、配列番号205(G34R)、配列番号206(G34V)、配列番号207(G34P)に記載する。
【0206】
実施例26
全長ヒトGPC3発現ヒト肝癌細胞株(SK−03)の作製
抗GPC3抗体の生物活性評価用の細胞株を得るために、全長GPC3を発現するヒト肝癌細胞株の樹立を行った。
【0207】
PvuIで処理した1μgの全長ヒトGPC3遺伝子発現ベクターを、2μLのFuGENE(Roche社)と混合し、複合体を形成させた後に、SK-HEP-1細胞(ATCCより購入)に添加することにより、遺伝子導入を行った。CO2インキュベーターで24時間培養後、終濃度1 mg/mLのGeneticinおよび10% FBSを含むダルベッコMEM(D-MEM, SIGMA社)を用いて、GPC3発現株を選抜した。得られたGeneticin耐性コロニーを集め、限界希釈法により細胞のクローニング
を行った。それぞれの細胞クローンのヒトGPC3の発現はキメラGC33抗体とFITC標識ヤギ抗ヒトIgG抗体(ICN社)を用いたフローサイトメトリにより確認し、安定発現細胞株SK-03を
取得した。
【0208】
実施例27
マウス−ヒトキメラ抗体を用いたCDC活性、ADCC活性の比較
実施例22で示したGC33、M3C11、およびM1E7マウス−ヒトキメラ抗体のCDC活性およびADCC活性を直接比較する目的で、3抗体のADCC、CDC活性の測定を同一実験系で実施例16および17に記載した方法に従って行った。標的細胞として、CDC活性は全長GPC3発現CHO細胞を、ADCC活性はSK-03をそれぞれ用いた。それぞれの結果を図19、図20に示す。い
ずれの実験系においてもGC33は他2抗体と比較して強いCDC活性およびADCC活性を示すことが確認された。
【産業上の利用可能性】
【0209】
本発明の抗体は、細胞増殖抑制剤として、抗癌剤として、および癌の診断薬として用い
ることができる。
【特許請求の範囲】
【請求項1】
以下の(1)−(12)のいずれか;
(1) 配列番号123に記載されるアミノ酸配列を含むCDR1,配列番号124に記載されるアミノ酸配列を含むCDR2,および配列番号125に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号109に記載されるアミノ酸配列を含むCDR1,配列番号110に記載されるアミノ酸配列を含むCDR2,および配列番号111に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号107に記載されるアミノ酸配列を含むCDR2,および配列番号108に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号132に記載されるアミノ酸配列を含むCDR1,配列番号133に記載されるアミノ酸配列を含むCDR2,および配列番号134に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号135に記載されるアミノ酸配列を含むCDR2,および配列番号136に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号126に記載されるアミノ酸配列を含むCDR1,配列番号127に記載されるアミノ酸配列を含むCDR2,および配列番号128に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号129に記載されるアミノ酸配列を含むCDR1,配列番号130に記載されるアミノ酸配列を含むCDR2,および配列番号131に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号103に記載されるアミノ酸配列を含むCDR1,配列番号104に記載されるアミノ酸配列を含むCDR2,および配列番号105に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号121に記載されるアミノ酸配列を含むCDR2,および配列番号122に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号115に記載されるアミノ酸配列を含むCDR1,配列番号116に記載されるアミノ酸配列を含むCDR2,および配列番号117に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号112に記載されるアミノ酸配列を含むCDR1,配列番号113に記載されるアミノ酸配列を含むCDR2,および配列番号114に記載されるアミノ酸配列を含むCDR3;または
(12) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号119に記載されるアミノ酸配列を含むCDR2,および配列番号120に記載されるアミノ酸配列を含むCDR3
のCDR1,2および3を有する重鎖可変領域を含む抗体。
【請求項2】
以下の(1)−(13)のいずれか:
(1) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号145に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号140に記載されるアミノ酸配列を含むCDR1,配列番号141に記載されるアミノ酸配列を含むCDR2,および配列番号142に記載されるアミノ酸配列
を含むCDR3;
(4) 配列番号167に記載されるアミノ酸配列を含むCDR1,配列番号168に記載されるアミノ酸配列を含むCDR2,および配列番号169に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号170に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号171に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号159に記載されるアミノ酸配列を含むCDR1,配列番号160に記載されるアミノ酸配列を含むCDR2,および配列番号161に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号162に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号163に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号164に記載されるアミノ酸配列を含むCDR1,配列番号165に記載されるアミノ酸配列を含むCDR2,および配列番号166に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号137に記載されるアミノ酸配列を含むCDR1,配列番号138に記載されるアミノ酸配列を含むCDR2,および配列番号139に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号155に記載されるアミノ酸配列を含むCDR1,配列番号156に記載されるアミノ酸配列を含むCDR2,および配列番号157に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号149に記載されるアミノ酸配列を含むCDR1,配列番号150に記載されるアミノ酸配列を含むCDR2,および配列番号151に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号146に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号148に記載されるアミノ酸配列を含むCDR3;または
(13) 配列番号152に記載されるアミノ酸配列を含むCDR1,配列番号153に記載されるアミノ酸配列を含むCDR2,および配列番号154に記載されるアミノ酸配列を含むCDR3
のCDR1,2および3を有する軽鎖可変領域を含む抗体。
【請求項3】
以下の(1)−(13):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号109,110および111に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および145に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号106,107および108に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号140,141および142に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号132,133および134に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号167,168および169に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号106,135および136に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号170,144および171に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号126,127および128に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号159,160および161に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号162,147および163に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号164,165および166に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(9) それぞれ配列番号103,104および105に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号137,138および139に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号118,121および122に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号155,156および157に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号115,116および117に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号149,150および151に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(12) それぞれ配列番号112,113および114に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号146,147および148に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(13) それぞれ配列番号118,119および120に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号152,153および154に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体
からなる群より選択される抗体。
【請求項4】
以下の(1)〜(7)のいずれかに記載の重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;または
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体。
【請求項5】
配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体。
【請求項6】
以下の(1)〜(7)の抗体:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
からなる群より選択される抗体。
【請求項7】
請求項1−6のいずれかに記載のアミノ酸配列において1または複数のアミノ酸が置換、欠失、付加および/または挿入され、かつ請求項1−6のいずれかに記載の抗体と同等の活性を有する抗体。
【請求項8】
ヒト化抗体である請求項1−7のいずれかに記載の抗体。
【請求項9】
グリピカン3に結合するヒト化抗体。
【請求項10】
グリピカン3のアミノ酸残基524〜563の配列からなるペプチドに結合する抗体。
【請求項11】
グリピカン3のアミノ酸残基537〜563の配列からなるペプチドに結合する抗体。
【請求項12】
グリピカン3のアミノ酸残基550〜563の配列からなるペプチドに結合しないことを特徴とする請求項10または11に記載の抗体。
【請求項13】
グリピカン3のアミノ酸残基544〜553の配列からなるペプチドに結合する抗体。
【請求項14】
グリピカン3のアミノ酸残基546〜551の配列からなるペプチドに結合する抗体。
【請求項15】
ヒト化抗体である請求項9−14のいずれかに記載の抗体。
【請求項16】
第2の抗体が結合しうるエピトープに結合することができる抗体であって、前記第2の抗体は、それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含むことを特徴とする抗体。
【請求項17】
グリピカン3に結合し、グリピカン3を発現する細胞に対して高いCDC活性を有する抗体。
【請求項18】
グリピカン3に結合し、グリピカン3を発現する細胞に対して高いADCC活性を有する抗体。
【請求項19】
請求項1−18のいずれかに記載の抗体の重鎖可変領域または軽鎖可変領域をコードするポリヌクレオチド。
【請求項20】
配列番号11−21、33−43、55−59、65−70、77−83のいずれかに記載の塩基配列を有する、請求項18記載のポリヌクレオチド。
【請求項21】
請求項1−18のいずれかに記載の抗体を有効成分とする細胞増殖抑制剤。
【請求項22】
請求項1−18のいずれかに記載の抗体を有効成分とする抗癌剤。
【請求項23】
肝細胞癌を治療するための請求項22記載の抗癌剤。
【請求項24】
グリピカン3のアミノ酸残基524〜563のアミノ酸配列からなるペプチド。
【請求項25】
グリピカン3のアミノ酸残基537〜563のアミノ酸配列からなるペプチド。
【請求項26】
グリピカン3のアミノ酸残基544〜553のアミノ酸配列からなるペプチド。
【請求項27】
グリピカン3のアミノ酸残基546〜551のアミノ酸配列からなるペプチド。
【請求項28】
以下の(1)−(15)のいずれか:
(1) 配列番号174に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号175に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号176に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号177に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号178に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号179に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号180に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号181に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号182に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号183に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配
列を含むCDR3;
(11) 配列番号184に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号185に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(13) 配列番号186に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(14) 配列番号187に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;または
(15) 配列番号188に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
のCDR1,2および3を有する軽鎖可変領域を含む抗体。
【請求項29】
以下の(1)−(15):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号174,144および158,に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号175,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号176,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号177,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号178,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号179,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号180,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号181,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域
を含む抗体;
(9) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号182,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号183,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号184,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(12) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号185,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(13) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号186,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(14) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号187,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(15) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号188,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体,
からなる群より選択される抗体。
【請求項30】
以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
を有する抗体。
【請求項31】
以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
および、以下の(1)〜(7)からなる群より選択される重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体。
【請求項32】
ヒト化抗体である請求項28〜31のいずれかに記載の抗体。
【請求項1】
以下の(1)−(12)のいずれか;
(1) 配列番号123に記載されるアミノ酸配列を含むCDR1,配列番号124に記載されるアミノ酸配列を含むCDR2,および配列番号125に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号109に記載されるアミノ酸配列を含むCDR1,配列番号110に記載されるアミノ酸配列を含むCDR2,および配列番号111に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号107に記載されるアミノ酸配列を含むCDR2,および配列番号108に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号132に記載されるアミノ酸配列を含むCDR1,配列番号133に記載されるアミノ酸配列を含むCDR2,および配列番号134に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号106に記載されるアミノ酸配列を含むCDR1,配列番号135に記載されるアミノ酸配列を含むCDR2,および配列番号136に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号126に記載されるアミノ酸配列を含むCDR1,配列番号127に記載されるアミノ酸配列を含むCDR2,および配列番号128に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号129に記載されるアミノ酸配列を含むCDR1,配列番号130に記載されるアミノ酸配列を含むCDR2,および配列番号131に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号103に記載されるアミノ酸配列を含むCDR1,配列番号104に記載されるアミノ酸配列を含むCDR2,および配列番号105に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号121に記載されるアミノ酸配列を含むCDR2,および配列番号122に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号115に記載されるアミノ酸配列を含むCDR1,配列番号116に記載されるアミノ酸配列を含むCDR2,および配列番号117に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号112に記載されるアミノ酸配列を含むCDR1,配列番号113に記載されるアミノ酸配列を含むCDR2,および配列番号114に記載されるアミノ酸配列を含むCDR3;または
(12) 配列番号118に記載されるアミノ酸配列を含むCDR1,配列番号119に記載されるアミノ酸配列を含むCDR2,および配列番号120に記載されるアミノ酸配列を含むCDR3
のCDR1,2および3を有する重鎖可変領域を含む抗体。
【請求項2】
以下の(1)−(13)のいずれか:
(1) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号143に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号145に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号140に記載されるアミノ酸配列を含むCDR1,配列番号141に記載されるアミノ酸配列を含むCDR2,および配列番号142に記載されるアミノ酸配列
を含むCDR3;
(4) 配列番号167に記載されるアミノ酸配列を含むCDR1,配列番号168に記載されるアミノ酸配列を含むCDR2,および配列番号169に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号170に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号171に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号159に記載されるアミノ酸配列を含むCDR1,配列番号160に記載されるアミノ酸配列を含むCDR2,および配列番号161に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号162に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号163に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号164に記載されるアミノ酸配列を含むCDR1,配列番号165に記載されるアミノ酸配列を含むCDR2,および配列番号166に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号137に記載されるアミノ酸配列を含むCDR1,配列番号138に記載されるアミノ酸配列を含むCDR2,および配列番号139に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号155に記載されるアミノ酸配列を含むCDR1,配列番号156に記載されるアミノ酸配列を含むCDR2,および配列番号157に記載されるアミノ酸配列を含むCDR3;
(11) 配列番号149に記載されるアミノ酸配列を含むCDR1,配列番号150に記載されるアミノ酸配列を含むCDR2,および配列番号151に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号146に記載されるアミノ酸配列を含むCDR1,配列番号147に記載されるアミノ酸配列を含むCDR2,および配列番号148に記載されるアミノ酸配列を含むCDR3;または
(13) 配列番号152に記載されるアミノ酸配列を含むCDR1,配列番号153に記載されるアミノ酸配列を含むCDR2,および配列番号154に記載されるアミノ酸配列を含むCDR3
のCDR1,2および3を有する軽鎖可変領域を含む抗体。
【請求項3】
以下の(1)−(13):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号109,110および111に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および145に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号106,107および108に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号140,141および142に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号132,133および134に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号167,168および169に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号106,135および136に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号170,144および171に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号126,127および128に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号159,160および161に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号162,147および163に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号129,130および131に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号164,165および166に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(9) それぞれ配列番号103,104および105に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号137,138および139に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号118,121および122に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号155,156および157に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号115,116および117に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号149,150および151に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(12) それぞれ配列番号112,113および114に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号146,147および148に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(13) それぞれ配列番号118,119および120に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号152,153および154に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体
からなる群より選択される抗体。
【請求項4】
以下の(1)〜(7)のいずれかに記載の重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;または
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体。
【請求項5】
配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を有する抗体。
【請求項6】
以下の(1)〜(7)の抗体:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域および配列番号92に記載のアミノ酸配列を含む軽鎖可変領域を含む抗体;
からなる群より選択される抗体。
【請求項7】
請求項1−6のいずれかに記載のアミノ酸配列において1または複数のアミノ酸が置換、欠失、付加および/または挿入され、かつ請求項1−6のいずれかに記載の抗体と同等の活性を有する抗体。
【請求項8】
ヒト化抗体である請求項1−7のいずれかに記載の抗体。
【請求項9】
グリピカン3に結合するヒト化抗体。
【請求項10】
グリピカン3のアミノ酸残基524〜563の配列からなるペプチドに結合する抗体。
【請求項11】
グリピカン3のアミノ酸残基537〜563の配列からなるペプチドに結合する抗体。
【請求項12】
グリピカン3のアミノ酸残基550〜563の配列からなるペプチドに結合しないことを特徴とする請求項10または11に記載の抗体。
【請求項13】
グリピカン3のアミノ酸残基544〜553の配列からなるペプチドに結合する抗体。
【請求項14】
グリピカン3のアミノ酸残基546〜551の配列からなるペプチドに結合する抗体。
【請求項15】
ヒト化抗体である請求項9−14のいずれかに記載の抗体。
【請求項16】
第2の抗体が結合しうるエピトープに結合することができる抗体であって、前記第2の抗体は、それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号143,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含むことを特徴とする抗体。
【請求項17】
グリピカン3に結合し、グリピカン3を発現する細胞に対して高いCDC活性を有する抗体。
【請求項18】
グリピカン3に結合し、グリピカン3を発現する細胞に対して高いADCC活性を有する抗体。
【請求項19】
請求項1−18のいずれかに記載の抗体の重鎖可変領域または軽鎖可変領域をコードするポリヌクレオチド。
【請求項20】
配列番号11−21、33−43、55−59、65−70、77−83のいずれかに記載の塩基配列を有する、請求項18記載のポリヌクレオチド。
【請求項21】
請求項1−18のいずれかに記載の抗体を有効成分とする細胞増殖抑制剤。
【請求項22】
請求項1−18のいずれかに記載の抗体を有効成分とする抗癌剤。
【請求項23】
肝細胞癌を治療するための請求項22記載の抗癌剤。
【請求項24】
グリピカン3のアミノ酸残基524〜563のアミノ酸配列からなるペプチド。
【請求項25】
グリピカン3のアミノ酸残基537〜563のアミノ酸配列からなるペプチド。
【請求項26】
グリピカン3のアミノ酸残基544〜553のアミノ酸配列からなるペプチド。
【請求項27】
グリピカン3のアミノ酸残基546〜551のアミノ酸配列からなるペプチド。
【請求項28】
以下の(1)−(15)のいずれか:
(1) 配列番号174に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(2) 配列番号175に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(3) 配列番号176に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(4) 配列番号177に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(5) 配列番号178に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(6) 配列番号179に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(7) 配列番号180に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(8) 配列番号181に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(9) 配列番号182に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(10) 配列番号183に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配
列を含むCDR3;
(11) 配列番号184に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(12) 配列番号185に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(13) 配列番号186に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
(14) 配列番号187に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;または
(15) 配列番号188に記載されるアミノ酸配列を含むCDR1,配列番号144に記載されるアミノ酸配列を含むCDR2,および配列番号158に記載されるアミノ酸配列を含むCDR3;
のCDR1,2および3を有する軽鎖可変領域を含む抗体。
【請求項29】
以下の(1)−(15):
(1) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号174,144および158,に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(2) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号175,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(3) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号176,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(4) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号177,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(5) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号178,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(6) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号179,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(7) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号180,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(8) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号181,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域
を含む抗体;
(9) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号182,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(10) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号183,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(11) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号184,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(12) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号185,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域,を含む抗体;
(13) それぞれ配列番号123,124,および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号186,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;
(14) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号187,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体;および
(15) それぞれ配列番号123,124および125に記載されるアミノ酸配列を含むCDR1,2および3を有する重鎖可変領域,およびそれぞれ配列番号188,144および158に記載されるアミノ酸配列を含むCDR1,2および3を有する軽鎖可変領域を含む抗体,
からなる群より選択される抗体。
【請求項30】
以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
を有する抗体。
【請求項31】
以下の(1)〜(15)からなる群より選択される軽鎖可変領域:
(1) 配列番号191に記載のアミノ酸配列を含む軽鎖可変領域;
(2) 配列番号192に記載のアミノ酸配列を含む軽鎖可変領域;
(3) 配列番号193に記載のアミノ酸配列を含む軽鎖可変領域;
(4) 配列番号194に記載のアミノ酸配列を含む軽鎖可変領域;
(5) 配列番号195に記載のアミノ酸配列を含む軽鎖可変領域;
(6) 配列番号196に記載のアミノ酸配列を含む軽鎖可変領域;
(7) 配列番号197に記載のアミノ酸配列を含む軽鎖可変領域;
(8) 配列番号198に記載のアミノ酸配列を含む軽鎖可変領域;
(9) 配列番号199に記載のアミノ酸配列を含む軽鎖可変領域;
(10) 配列番号200に記載のアミノ酸配列を含む軽鎖可変領域;
(11) 配列番号201に記載のアミノ酸配列を含む軽鎖可変領域;
(12) 配列番号202に記載のアミノ酸配列を含む軽鎖可変領域;
(13) 配列番号203に記載のアミノ酸配列を含む軽鎖可変領域;
(14) 配列番号204に記載のアミノ酸配列を含む軽鎖可変領域;および
(15) 配列番号205に記載のアミノ酸配列を含む軽鎖可変領域;
および、以下の(1)〜(7)からなる群より選択される重鎖可変領域:
(1) 配列番号84に記載のアミノ酸配列を含む重鎖可変領域;
(2) 配列番号85に記載のアミノ酸配列を含む重鎖可変領域;
(3) 配列番号86に記載のアミノ酸配列を含む重鎖可変領域;
(4) 配列番号87に記載のアミノ酸配列を含む重鎖可変領域;
(5) 配列番号88に記載のアミノ酸配列を含む重鎖可変領域;
(6) 配列番号89に記載のアミノ酸配列を含む重鎖可変領域;および
(7) 配列番号90に記載のアミノ酸配列を含む重鎖可変領域;
を有する抗体。
【請求項32】
ヒト化抗体である請求項28〜31のいずれかに記載の抗体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公開番号】特開2013−39131(P2013−39131A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2012−198364(P2012−198364)
【出願日】平成24年9月10日(2012.9.10)
【分割の表示】特願2009−113159(P2009−113159)の分割
【原出願日】平成21年5月8日(2009.5.8)
【出願人】(000003311)中外製薬株式会社 (228)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成24年9月10日(2012.9.10)
【分割の表示】特願2009−113159(P2009−113159)の分割
【原出願日】平成21年5月8日(2009.5.8)
【出願人】(000003311)中外製薬株式会社 (228)
【Fターム(参考)】
[ Back to top ]

