抗コリン作用薬のための透過性増強組成物
オキシブチニンなどの抗コリン作用薬、尿素-含有化合物及び担体システムを含有する、経皮的又は局所的組成物。尿失禁の対象を治療すると同時に、薬物のピーク濃度及び望ましくない副作用の発生を低下する方法が、明らかにされている。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
技術分野
本発明は、概して抗コリン作用薬又は鎮痙薬を含有する組成物に関し、及びより詳細に述べると局所的又は経皮的に適用された抗コリン作用薬又は鎮痙薬、特にオキシブチニンに対する皮膚又は粘膜組織の透過性を増強する組成物に関する。本発明は、局所的又は経皮的組成物の投与により、過活動膀胱及び尿失禁を治療する方法にも関する。
【0002】
発明の背景
薬物投与のための局所的又は経皮的送達システムは、それらの薬物の経口送達に勝るいくつかの利点を提供することは現在公知である。一般に、薬物の局所的又は経皮的送達の利点は、薬物動態に関連している。より詳細に述べると、薬物の経口送達に関連したひとつの一般的問題点は、薬物の血清レベルにおけるピークの発生、それに続くその消失及び可能性のある代謝に起因した薬物の血清レベルの下落である。従って経口投与された薬物の血清レベル濃度は、摂取後にピーク及び谷を有する。薬物の血清レベル濃度のこれらの高位及び低位は、望ましくない副作用へつながることが多い。
【0003】
対照的に、薬物の局所的及び経皮的送達は、薬物の比較的遅い及び定常的な送達を提供する。従って、経口投与された薬物とは異なり、局所的又は経皮的に送達された薬物の血清濃度は実質的に維持され、経口送達に関連したピークを有さない。
局所的又は経皮的薬物送達に関連した維持された血清濃度は、薬物の経口投与での全身性副作用を避ける。特に肝臓による薬物の初回通過代謝は、薬物投与のための経皮的又は局所的送達ビヒクルの利用により、回避される。
【0004】
経口薬物送達と比較した場合の、局所的又は経皮的薬物送達ビヒクルの利点は、一般に様々な薬物について周知である。例えば、Powersらは、経皮的エストラジオールの経口エストラジオールに勝る利点を明らかにした。Powers MS、Schenkel L、Darkey PE、Good WR、Balestra JC、Place VAの論文;「Pharmacokinetics and pharmacodynamics of transdermal dosage forms of 17β-estradiol: Comparison with conventional oral estrogens for hormone replacement」、Am. J. Obstet. Gynecol.、152:1099 (1985)を参照のこと。Van Seventerらは、患者評価は、経皮的フェンタニル治療が、問題の多い副作用の有意に低い割合及びより少ない日常活動の妨げの点で、徐放性モルヒネよりも好ましいことを報告した。Van Seventer R、Smit JM、Schipper RM、Wicks MA、Zuurmond WWの論文、「Comparison of TTS-fentanyl with sustained-release orally morphine in the treatment of patients not using opioids for mild-to-moderate pain」;Curr Med Res Opin.、19(6):457-69 (2003)を参照のこと。
【0005】
加えてHeynemanらは、局所的に適用された非ステロイド系抗炎症薬(NSAID)は、経口製剤に対して、優れた安全性プロファイルを有することを報告した。同じく局所的NSAID適用に随伴する有害作用が、患者の約10〜15%で発生し、及び事実上主に皮膚反応(適用部位での発疹及び掻痒)であり;胃腸管の有害な薬物反応は、経口NSAIDについて報告された発生率15%と比べ、局所的に適用されたNSAIDでは稀であることも報告した。Heyneman CA、Lawless-Liday C、Wall GCの論文、「Oral versus topical NSAIDs in rheumatic diseases: a comparison」、Drugs、2000年9月;60(3): 555-74を参照のこと。
【0006】
Barrettらは、経皮的適用後、セレギリンの血漿濃度は、経口セレギリンにより得られるものよりも50倍大きいことを認めた。経口により得られるものの70%未満に低下される代謝産物の形成を代償とした、セレギリン全身性血漿濃度のこの増加は、様々な神経変性疾患及び精神障害の患者において、治療的価値があると仮定された。Barrett JS、Hochadel TJ、Morales RJ、Rohatagi S、DeWitt KE、Watson SK、DiSanto ARの論文;「Pharmacokinetics and Safety of a Selegiline Transdermal System Relative to Single-Dose Oral Administration in the Elderly」;Am J Ther.、1996年10月;3(10): 688-698を参照のこと。
【0007】
同様に、オキシブチニンの経皮的送達に関連した有害作用の有意な減少が存在することも一般に公知である。経口オキシブチニンは、無抑制神経因性膀胱又は反射性神経因性膀胱、すなわち尿意切迫、頻尿、尿漏れ、急迫尿失禁、及び排尿困難を伴う患者の排尿に関連した不安定膀胱の症状を緩和することが示されている。
オキシブチニンは、平滑筋に対する直接的鎮痙作用を有し、及び平滑筋に対するアセチルコリンのムスカリン様作用を阻害するが、アトロピン性排尿筋の抗コリン活性のわずかに1/5のみ(ウサギにおいて観察された作用)及びその鎮痙活性の4〜10倍を示すこともわかっている。オキシブチニンが、骨格筋の神経筋接合部又は自律神経節での遮断作用(抗ニコチン性作用)を有することは不明である。
【0008】
更にオキシブチニンは、膀胱平滑筋を弛緩することがわかっている。不随意膀胱収縮により特徴付けられる状態を伴う患者において、膀胱内圧測定試験は、オキシブチニンが、膀胱(嚢)容積を増大し、排尿筋の無抑制収縮頻度を減少し、かつ初発尿意を遅延することを明らかにしている。従ってオキシブチニンは、尿意切迫並びに失禁のエピソード及び随意排尿の両方の頻度を減少する。抗ムスカリン様活性は、主にR-異性体に存在することも報告されている。
【0009】
しかしオキシブチニン療法に関連した有害反応は、動悸、頻脈又は血管拡張のような心臓血管系の症状発現;減少した発汗、発疹のような、皮膚科学的症状発現;便秘、減少した胃腸管運動、ドライマウス、悪心、ためらい排尿及び尿貯留のような、胃腸/泌尿生殖器の症状発現;無力感、眩暈、嗜眠、幻覚、不眠、不穏のような、神経系の症状発現;弱視、毛様体筋麻痺、低下した涙液分泌、瞳孔散大のような、眼科的症状発現を含み得る。経口オキシブチニンに関連した最も一般的な副作用は、ドライマウス、眩暈、視界不良、及び便秘である。これらの有害な経験は、患者が治療の中断を促すのに十分な不快感であることがある。
【0010】
オキシブチニンの経皮的送達と経口送達を比較する試験において、オキシブチニン及びその代謝産物N-デスエチルオキシブチニンの血漿濃度の実質的により低い変動が、経皮的に投与されたオキシブチニンで明らかにされた。加えて投薬期間中の低下したN-デスエチルオキシブチニン形成、及びより大きい唾液分泌が、経口オキシブチニン投与と比較して報告された。更に、過活動膀胱の患者におけるドライマウスのより低い発生率が報告された。Appel RA、Chancellor MB、Zobrist RH、Thomas H、Sanders SWの論文、「Pharmacokinetics, Metabolism, and Saliva Output during Transdermal and Extended-Release Oral Oxybutynin Administration in Healthy Subjects」、Mayo Clin. Proc.、78: 696-702 (2003)を参照のこと。
【0011】
更にDmochowskyらは、経皮的オキシブチニンで治療された患者における、経口オキシブチニン療法と比較した、過活動膀胱症状及び生活の質(LOQ)(ドライマウス発生の低下)の改善を確認した。Dmochowski RR、Davila GW、Zinner NR、Gittelman MC、Saltzstein DR、Lyttle S、Sanders SWの論文、The Transdermal Oxybutynin Study Group;「Efficacy and safety of transdermal oxybutynin in patients with urge and mixed urinary incontinence」、The Journal of Urology、168: 580-586 (2002年8月)を参照のこと。従ってオキシブチニンの経皮的送達はより多くの利点があり、更にはオキシブチニンの経口送達よりも好ましいことを容易に認めることができる。
【0012】
当該技術分野において公知のように、薬物の経皮的投与は、皮膚障壁を越える薬物浸透に関連したある欠点を有する。皮膚は、厚さの合計が2〜3mmの構造的に複雑な多層臓器である。従って薬物の皮膚への浸透は、皮膚障壁を越えた場合にのみ有効である。皮膚を通る浸透及び透過に対する抵抗の主な原因は、皮膚の角質層(stratum corneum layer)であり、これは「角層(horny layer)」としても公知である。
【0013】
角質層は、高度に平らなケラチンで満たされた細胞の層からなり、ほぼ全身を覆う厚さ約10〜15μmの稠密な薄層である。従って多くの薬物の皮膚を通る透過率は、極めて低い。その結果、化合物の経皮吸収に対する皮膚障壁を変更する戦略の開発に関する興味が依然存在している。
経皮吸収の速度論及び/又は程度の著しい改善を得ることにより、皮膚障壁機能の低下は、皮膚科用製剤及び経皮的用具の治療効能を増大すると予想される。薬物が皮膚を通り浸透する割合を増大するために、薬物と共に投与される、又は場合によっては薬物が皮膚へ適用される前に投与される(「処置前」)ような、物理的浸透増強剤(イオントフォレーシス、ソノフォレーシス、加熱)又は化学的浸透増強剤のいずれかの使用に関連している、様々な戦略が採り入れられている。
【0014】
一般に多くの薬物の経皮吸収を促進する適当な透過性増強剤が、公知である。これらの透過性増強剤は、それらの作用機序に従い分類される。Sinha VR、Kaur MPの論文、「Permeation Enhancers for Transdermal Drug Delivery」、Drug Dev Ind Pharm.、26(11): 1131-40 (2000年11月)を参照のこと。
透過性増強剤が、薬物の経皮的又は局所的送達において広範に使用され始めているが、ひとつの問題点は、前述のように、具体的な透過性増強剤は、全ての薬物に適しているとは考えられないことである。更に特定の薬物に関する最も効率的透過性増強剤の選択は、経験的技術、普遍性からは離れた応用性に頼っており、及びその結果は余りにも予測不可能である。例えば、適当な透過性増強剤の選択は、以下を含む多くのパラメータによって左右されるであろう:
(1)投与される具体的薬物。ひとつの具体的薬物に関して確定された透過性増強剤は、別の薬物には効果的ではないことがある;
(2)透過性増強剤の濃度。増強作用は、透過性増強剤の所定の濃度で最適であり、かつこの濃度を下回るか又は上回る場合、より低いかもしくはマイナスであることさえある;
(3)ビヒクル又は担体。透過性増強剤は、例えば水性ビヒクル中では効果的であるが、有機ビヒクル中では効果的でないことがある;並びに
(4)システムの成分。透過性増強剤は、薬物それ自身と相互作用することがあり、その結果薬物の特徴及び安定性をかなり変更するか、又はポリマー、酸化防止薬などと相互作用することがある。
【0015】
局所的システムへ製剤される増強剤を選択するいくつかの方法は、Pfister、Yum及びGhoshの論文、「Transdermal and Topical Drug Delivery Systems」、11章:「Chemical means of transdermal drug permeation enhancement」(Interpharm Press, Inc. 1997)により公開されている。しかしかなりの量の試験において明らかにされているように、透過性増強剤の選択を支配する主な原理は、「試行錯誤」である。従って最適化された経皮的製剤は、多くの実験を行った後に実現されるのみである。
【0016】
オキシブチニンの経皮的又は局所的送達のための様々な透過性増強剤が報告されている。例えば、米国特許第5,411,740号、米国特許第5,500,222号、米国特許第5,614,211号は、各々、オキシブチニン経皮的治療システムのための好ましい透過性増強剤としての、モノグリセリド又は脂肪酸のモノグリセリドの混合物を開示している。米国特許第5,736,577号は、透過性増強剤を含有する、(S)-オキシブチニンの経皮的投与のための医薬単位剤形を開示している。米国特許第5,834,010号及び米国特許第6,555,129号は両方共、オキシブチニンの透過性増強剤としてのトリアセチンを開示している。米国特許第5,747,065号は、オキシブチニンのための透過性を増強する混合物としての、モノグリセリド及び乳酸エステルを開示している。
【0017】
更に米国特許第5,843,468号は、オキシブチニンの経皮的投与のための、酢酸ラウリル及びグリセロールモノラウレートの二重透過性増強剤混合物を開示している。米国特許第6,004,578号は、オキシブチニンを含有する経皮的マトリックス薬物送達用具のための、ポリエチレングリコールモノアルキルエーテルのアルキル又はアリールカルボン酸エステル、並びにポリエチレングリコールアルキルカルボキシメチルエーテルからなる群より選択された透過性増強剤を開示している。その一方で、米国特許第6,267,984号は、オキシブチニンの経皮的送達のためのモノグリセリド及びパルミチン酸エチルを含有する皮膚透過性増強組成物を開示している。米国特許第6,562,368号は、経皮的に投与されたオキシブチニンに対する皮膚又は粘膜組織の透過性を増加するための水酸化物-放出剤の使用を開示している。前述のように、現時点での、特定の薬物に関する適当な透過性増強剤を見つける方法は、試行錯誤による。
【0018】
尿素は、天然の物質であり、体内におけるタンパク質の最終代謝産物である。医薬及び化粧調製物における尿素の価値は、初期の民間療法(folk medicine)の頃から認められており、例えば尿素は、濃度約10〜15%で使用される場合に、デブリドマンを補助し、凝塊を溶解し、及び上皮形成を促進し;より高い濃度、例えば40%以上の場合、尿素は、タンパク質分解性であり、従って爪の破壊(destruction)及び溶解の治療に通常使用され、尿素は、浸透圧性利尿薬としても使用される。
ひとつの顕著な尿素の特性は、尿素存在下での角質層の増加した水分保持能である。尿素は、軽度に角質溶解性であり、及び角質層中への水の取込みを増加する。このことは、角質層に高い水結合能をもたらす。従って尿素は頻繁に、皮膚保湿剤として使用される。
【0019】
尿素は一般に、ある種の薬物のための透過性増強剤としても公知である。しかし、尿素による経皮吸収増強は、使用される共溶媒に強く左右される。例えばKimらは、ケトプロフェンの浸透は、水溶液中の尿素の存在下で増強されるのに対し、プロピレングリコール又はプロピレングリコール-エタノール混合物中では、増強は報告されないことを認めた。更にKimは、多量の尿素の添加は、ケトプロフェンの拡散性を増大することを認めた。
同様の相乗作用は、Luらによっても明らかにされており、彼等は、ヒト死体皮膚、無毛マウス皮膚、及び脱皮したヘビ皮膚からのロイプロリドの吸収は、尿素及びテルペンの存在下で増強されることを明らかにした。しかしこれらの増強剤は単独で、すなわち溶媒を伴わずには、透過性を著しく増強しなかった。Lu MY、Lee D.、Rao GSの論文、「Percutaneous absorption enhancement of leuprolide」、Pharm. Res.、9(12): 1575-9 (1992年12月)。先に引用した試験と同様に、尿素の混入は、薬物の拡散性を著しく増大した。この種の溶媒依存性は、Williamsの論文「Percutaneous Penetration Enhancers」、10.1章:「Urea and its derivatives as penetration enhancers」、Smithら編集、CRC Press、1995年にも列記されている。
【0020】
更に米国特許第5,696,164号及び米国特許第6,042,845号は両方共、透過性増強剤として尿素をスルフヒドリル含有アミノ酸又はそれらの誘導体と組合せて含有する、爪の抗真菌治療のための組成物を開示している。米国特許第4,996,193号は、尿素が透過性増強剤として使用される、皮膚組織へのシクロスポリンの局所的適用のための製剤を開示している。米国特許第5,015,470号は、尿素を透過性増強剤として含有する、毛髪成長を誘導、維持又は増大する化粧及び医薬組成物を開示している。米国特許5,654,337号は、ゲル形成を促進するために尿素が使用される、抗炎症薬又は抗新生物薬の局所送達のための局所的製剤を開示している。米国特許第5,874,463号及び第6,300,369号は両方共、皮膚-浸透剤として尿素を含有する、ヒドロキシ-コウジ酸皮膚剥離組成物を開示している。米国特許第5,879,690号は、尿素を含有する経皮浸透増強剤を使用する、皮下筋肉組織へのカテコールアミン及び関連化合物の局所的投与のための組成物を開示している。米国特許第6,132,760号は、コポリマー系感圧式皮膚接着剤の単量体成分として尿素を含有する、経皮的送達用具を開示している。米国特許第6,162,419号は、尿素又はオレイン酸の透過性増強剤を含有する、皮膚科学的に安定されたアスコルビル組成物を開示している。
【0021】
同様に、米国特許第6,214,374号は、尿素又は尿素誘導体の、ホルモンの透過性増強剤としての使用を開示している。米国特許第4,699,777号は、アルブテロールの経皮的フラックスに対する尿素及び1-ドデシル-アザシクロヘプタン-2-オンの組合せの相乗作用を開示している。米国特許第4,895,727号は、局所的に適用された治療用及び化粧用の薬理活性のある物質の浸透及び保持を増強し、並びに経皮的フラックスを減少するために皮膚及び粘膜中に貯蔵作用を誘導する、尿素及び水溶性亜鉛-含有化合物を含む組成物を開示している。米国特許第5,446,025号は、ロイプロリドの経皮投与のための皮膚膜(cutaneous membrane)浸透増強する混合物としての、尿素、メントール、サリチル酸メチル、及び樟脳の組合せを開示している。
【0022】
尿素は、可溶性湿潤剤、すなわち皮膚内で大量の水(それらの質量に対して)を保持することが可能であり、これにより皮膚の滑らかさ及びしなやかさを維持することを助ける、水結合物質としても使用される。尿素は、ある種のアミノ酸、表皮の脂質及びタンパク質と共に、角質化プロセス時に生成される天然保湿因子NMFの構成物質として公知である。Brian W. Barryの著書「Dermatological Formulations: Percutaneous Absorption」第4章、147頁、Marcel Dekker, ISBN: 0-8247-1729-5を参照のこと。尿素は、角質化プロセス時に、タンパク質の構成単位であるアミノ酸アルギニンの分解の最終生成物として、角層へ入り込む。尿素は、角層におけるNMFの7%を表している。尿素は、角質層へ浸透し再水和する。
皮膚科用調製物への尿素の添加は、尿素の適用後の皮膚水和を増加する能力に帰する、コルチコステロイドの浸透を増大することが知られている。これは、局所麻酔作用を基にした抗-掻痒活性(かゆみの停止)も有する。
【0023】
尿素のタンパク質分解性の特徴も、よく認められており、ここで尿素は、濃度に応じて、ポリペプチドに加えアミノ鎖の構造を修飾する。このことは、皮膚の含水量とアミノ酸含量の間に相関関係が存在する−皮膚が乾くと、溶解したアミノ酸の割合が低下する−ので、皮膚の保湿にとって重要である。尿素は、比較的高い濃度(10%)で、鱗屑及び皮膚硬結(calluse)の減少を補助する。
【0024】
尿素が透過性増強作用を示した多くの研究が、Ghosh、Pfister及びYumの論文「Transdermal and Topical Drug Delivery Systems」、11章:「Chemical means of transdermal drug permeation enhancement」(Interpharm Press, Inc.1997)において明らかにされている。尿素が適当な透過性増強剤であることが明らかにされている具体的物質を以下に示す。
【0025】

a 特に記さない限りはin vitro;b 対照と比較した相対増強因子(RE);c 拡散性を比較;d データなし
注記:PG=プロピレングリコール
【0026】
興味深いことに、Ghosh、Pfister及びYumは、他の化学クラスの浸透増強剤、すなわち炭化水素、アルカノール及びアルケノール、酸、エステル、アルキルアミノエステル、アミド、スルホキシド、シクロデキストリン、テルペン、ピロリドン、Azone(登録商標)及びアナログ、リン脂質、及び界面活性剤についても同様の研究を行った。これらの比較表の試験は、ある特定の活性化合物は、様々な透過性増強剤と接触する場合に、増強された経皮的透過性を示すことができることを明らかにしている。例えば、インドメタシンは、例として尿素により増強されるが、ノナン、1-ノナノール、オレイン酸デシル-(N,N-ジメチルアミノ)イソプロピオネート、テトラヒドロチオフェン-1-オキシド及びアナログ、d-リモネン、ピロリドンアナログ、Azone(登録商標)及びアナログによっても増強される。
以下の一覧表からわかるように、様々な増強剤は、特定の薬物の浸透増強に有効であるが、増強因子及び効能は大きく変動し得る。
【0027】
増強因子a

a増強因子=増強剤を伴う(正規化された皮膚透過率)/増強剤を伴わない(正規化された皮膚透過率)
【0028】
Chienの論文「Developmental Concepts and Practice in Transdermal Therapeutic Systems」、Transdermal Controlled Systemic Medications, Marcel Dekker Inc., ニューヨーク, 1987, 25-81頁を参照し、これは本願明細書に参照として組入れられている。
【0029】
これらの結果を考慮し、浸透増強剤は、様々な化合物の透過性を異なる程度に増大することがわかっている。例えば特定の透過性増強剤は、特定の薬物に非常に適しているが、異なる薬物の透過性は増大しない。このことは、経皮的透過性は、浸透物(permeant)の増強剤との相互作用、及び浸透物の物理化学的特性の両方により、主に影響を受けるという事実により説明される。これらの知見の例として、Chienは、「Transdermal Controlled Systemic Medications」において、飽和脂肪酸のアルキル鎖長に対するプロゲステロンの皮膚透過に関する増強因子の依存性を公開した。彼は、カプロン酸(C8)を使用する大きい増強作用を発見したが、同じ筆者は米国特許第5,145,682号において、エストラジオールのより良い増強剤はデカン酸(C10)であることを開示している。従って特定の活性物質に関する皮膚浸透増強剤の有効性は、種類、濃度、及び浸透増強剤が用具から放出される方式の関数である。
【0030】
当該技術分野におけるひとつの問題点は、活性物質又は薬物に関する経皮的浸透増強作用の「普遍的」増強剤の概念は、存在しないことである。従って透過性増強剤の選択は、通常は薬物特異性であり、実験を通じた試行錯誤で決定される。経皮的用具から送達される特定の薬物のための適当な増強剤の選択が成功することを保証する一般的指針は存在しない(Hsieh 1994)。
更に、局所的製剤を最適化する科学は、ひとつの薬物から別のものへ予測されず、及び透過性増強剤は、異なる物理化学特性を有する薬物を超えた広範な増強因子を生じることができる。むしろこれは、過度の実験作業を必要とするプロセスであり:皮膚を超える適切な透過率は、様々な種類の化合物の様々な濃度での試験によってのみ実現され得る。
【0031】
この「試行錯誤」法の記述として、オキシブチニンの経皮的吸収を促進するために試験される様々な可能性のある透過性増強剤を例示する一覧表を以下に記す。
【0032】

LA:ラウリルアルコール;OA:オレイルアルコール;EO:オレイン酸エチル;DBP:パルミチン酸ジブチル;GML:グリセロールモノラウレート;PGML:プロピレングリコールモノラウレート;AG:アセチルグリセロール;NMP:N-メチルピロリドン
【0033】
認められるように、これらの浸透増強剤に関する吸収率、増強比、及び定常状態フラックスは、大きく変動する。従ってオキシブチニンのような抗コリン作用薬を適切に送達し、及び皮膚又は粘膜障壁を越えて抗コリン作用薬の透過性を増強する改善された局所的又は経皮的組成物が必要である。
【発明の開示】
【0034】
発明の概要
本発明の目的及び利点は、以下の説明に示されかつそれから明らかであることに加え、本発明の実践により学習されるであろう。本発明の追加の利点は、記載された説明及び「特許請求の範囲」、更には添付図面において特に指摘された組成物及び方法の実践により、認められかつ達成されるであろう。
これら及び他の利点を実現するために、本発明に従い、治療的に有効な抗コリン作用薬又は鎮痙薬の局所的又は経皮的投与のための組成物をもたらす。特に本発明は、哺乳類対象の皮膚又は粘膜表面を超える抗コリン作用薬又は鎮痙薬の透過又は浸透を増強する組成物を提供する。驚くべきことに、尿素-含有化合物を含む組成物は、抗コリン作用薬の対象の皮膚又は粘膜表面を超える浸透を増大することがわかった。本発明の組成物は、薬物の定常的血漿濃度を提供し、及びピーク濃度を避けることもわかった。有利なことに、ピーク濃度の回避は、好ましくも望ましくもない副作用の発生を低下することに関連している。
【0035】
本発明のひとつの局面において、治療的有効量の抗コリン作用薬又は鎮痙薬又はそれらの機能性誘導体、抗コリン作用薬の透過を増強するのに十分な量の尿素-含有化合物、及び局所的又は経皮的薬物送達に適した担体システムを含有する、局所的又は経皮的投与のための組成物が提供される。語句「治療的有効」は、所望の治療作用を提供するための、化合物の無毒であるが、十分な量を意味する。
【0036】
尿素含有化合物は、下記一般式を有する:
【0037】
【化1】

【0038】
(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結(ether linkage)、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せを含む群より選択された官能基である。)。
【0039】
例証するが限定しない目的で、尿素-含有化合物は、尿素、又は1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸を含む、それらの誘導体もしくはアナログであることができる。
【0040】
抗コリン作用薬は、オキシブチニン又はそれらの医薬として許容できる塩であることができる。例えば、オキシブチニンの塩は、酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩(mucate)、ナプシル酸塩(napsylate)、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩である。
あるいは、トルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、ボトックス、フラボキセート、プロパンテリン、ジシクロミン、フェニルプロパノラミンなどの、他の抗コリン作用薬又は鎮痙薬を使用することもできる。
あるいは、フルビプロフェン(プロスタグランジン合成阻害薬)及びイミプラミン(顕著な全身性抗ムスカリン様作用を伴う抗欝薬)の一酸化窒素誘導体のような他の物質を、使用することができる。
【0041】
本発明の担体は、抗コリン作用薬又は鎮痙薬の経皮的又は局所的投与又は送達に適している。担体は、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテル、テトラグリコールフロール、又は水の少なくとも1種を含む。好ましくは担体は、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せ、又は多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せを含む。
ジエチレングリコールのモノアルキルエーテルは、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル又はそれらの混合物であることができる。多価アルコールは、プロピレングリコール、ジプロピレングリコール又はそれらの混合物であることができ、並びに、アルコールは、エタノール、プロパノール、イソプロパノール、1-ブタノール、2-ブタノール又はそれらの混合物であることができる。テトラグリコールフロールは、グリコフロールであることができる。
【0042】
この組成物は、経皮的又は経粘膜的投与に適した形である。好ましくはこの製剤は、ゲル剤の形である。しかしあるいは製剤は、スプレー剤、軟膏剤、ローション剤、乳剤、エアゾール剤、貼付剤、フォーム(foam)、ミクロスフェア、ナノスフェア、マイクロカプセル剤、ナノカプセル剤、リポソーム、ミセル、又はクリーム剤であってよい。この組成物は、口内錠及び舌下錠、坐剤、経膣投与剤形、又は皮膚もしくは粘膜表面を通し吸収するための他の受動的もしくは能動的経皮的用具により投与されてもよい。
別の本発明の局面において、対象における尿失禁を治療する方法が提供される。本発明は、抗コリン作用薬又は鎮痙薬、尿素又はそれらの誘導体もしくはアナログ含む透過性増強剤、水性アルコール(hydroalcoholic)担体を含有する、治療用組成物を投与することを提供する。本願明細書において使用される語句「透過性増強剤」は、局所的適用もしくは全身性送達のいずれかについて、皮膚を超えた活性物質の経皮輸送の割合、又は活性物質の動物のような生物への使用及び送達を改善する物質を意味する。
【0043】
抗コリン作用薬又は鎮痙薬は、例えばオキシブチニン又はそれらの塩であることができる。オキシブチニンは、ラセミ体、S-エナンチオマー、又はR-エナンチオマーであることができる。一般にラセミ体オキシブチニンの一日量は、24時間にわたり約1〜20mgであり、オキシブチニンの個々のエナンチオマーの一日量は、対応するラセミ体投与量よりも少ないことが好ましい。より好ましくは、オキシブチニンのエナンチオマーの一日量は、24時間にわたり約0.5〜約15mgである。
本発明に有用である他の物質は、抗コリン作用薬又は鎮痙薬、例えばトルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、ボトックス、フラボキセート、プロパンテリン、ジシクロミン、又はフェニルプロパノラミン、イミプラミン、フルビプロフェンの一酸化窒素誘導体を含む。
【0044】
本発明に従い、本方法は、排尿筋の過活動、頻回の尿意切迫、低下した膀胱容積、増大した夜間排尿、尿意切迫、尿意切迫を伴う又は伴わない不随意排尿、及び/又は排尿痛もしくは排尿困難を含む不安定膀胱及び尿失禁の症候性治療を提供する。
有利なことに、本発明の組成物及び方法は、抗コリン作用薬又は鎮痙薬の定常的血漿濃度を提供し、望ましくない薬物濃度のピークを回避し、並びに/又はドライマウス、調節障害、悪心及び眩暈のような、好ましくも望ましくもない副作用を低下する。
【0045】
好ましい態様の詳細な説明
本発明のひとつの局面において、治療的に有効な抗コリン作用薬又は鎮痙薬を含有する新規局所的又は経皮的組成物が提供される。特に本発明は、哺乳類対象の皮膚又は粘膜の表面を超える抗コリン作用薬又は鎮痙薬の透過又は浸透を増強する組成物を提供する。本願明細書において使用される用語「経皮的(transdermal)」は、経皮的(又は「皮膚を通した(percutaneous)」)及び経粘膜的投与の両方、すなわち皮膚又は粘膜組織を通り及び血流への薬物の通過による送達を含むことを意図している。
驚くべきことに、尿素-含有化合物を含有する組成物は、対象の皮膚又は粘膜の表面を超える抗コリン作用薬又は鎮痙薬の浸透を増加することがわかった。
【0046】
本発明の組成物は、薬物の定常的血漿濃度を提供し、及び薬物のピーク濃度を回避することもわかった。有利なことに、ピーク濃度の回避は、好ましくも望ましくもない副作用の低下した発生に関連している。
本発明のひとつの局面において、治療的有効量の抗コリン作用薬もしくは鎮痙薬又はそれらの機能性誘導体、抗コリン作用薬の透過を増強するのに十分な量の尿素-含有化合物、及び局所的又は経皮的薬物送達に適した担体システムを含有する、局所的又は経皮的投与のための組成物が、提供される。
【0047】
尿素含有化合物は、下記一般式を有する:
【0048】
【化2】

【0049】
(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せを含む群から選択される官能基である。)。
【0050】
例証するが限定しない目的で、尿素-含有化合物は、下記表1に示されたような、尿素、それらの誘導体又はアナログで、1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸をもしくはそれらの誘導体含むものであることができる。
【0051】
【表1】

【0052】
好ましくは、尿素-含有化合物は、組成物の約1%〜20%の量で組成物中に存在する。
抗コリン作用薬又は鎮痙薬は、オキシブチニン又はそれらの医薬として許容できる塩であることができる。いくつかのオキシブチニン塩の例は、酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩、ナプシル酸塩、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩である。オキシブチニンは、ラセミ体又はS-エナンチオマーもしくはR-エナンチオマーのような単独の異性体として存在することができる。
【0053】
あるいは、トルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、ボトックス、フラボキセート、プロパンテリン、ジシクロミン、フェニルプロパノラミンなどの、他の抗コリン作用薬又は鎮痙薬が、使用されてもよく;フルビプロフェン(プロスタグランジン合成阻害薬)及びイミプラミン(顕著な全身性抗ムスカリン様作用を伴う抗欝薬)の一酸化窒素誘導体のような、他の物質を、以下の表2に示したように、使用することができる。好ましくは、抗コリン作用薬又は鎮痙薬は、オキシブチニンである。
【0054】
有利なことに、オキシブチニンに加えこれらの薬物は、対で言及される(to mention a couple)過活動膀胱及び尿失禁を含む状態に適応がある。従ってこれらの薬物の透過を増大することがわかっている尿素-含有化合物を含む本発明の組成物は、単に新規であるのみではなく、より少ない量の薬物を含有する組成物をここで製剤することができるので望ましくもある。
【0055】
オキシブチニン又は前記物質のような、抗コリン作用薬又は鎮痙薬を含有する経皮的又は局所的組成物は、非常に望ましい。経皮的及び局所的組成物は、胃腸管を迂回し、及び「初回通過作用」を受けないので、抗コリン作用薬又は鎮痙薬の血中濃度ピークが避けられる。オキシブチニンのような物質の血中濃度ピークは、ドライマウス、調節障害、悪心及び眩暈などの望ましくない副作用の発生に繋がることが多いことはわかっている。従って、肝臓における初回通過代謝を迂回することのひとつの利点は、薬物の経口投与と比べて増大した薬物のバイオアベイラビリティである。バイオアベイラビリティは、経皮的又は局所的に投与された薬物について増大されるので、望ましい治療作用に到達するために必要な総一日量は減少される。更に、抗コリン作用薬又は鎮痙薬及び尿素-含有化合物を含有する本組成物の増強された透過、相対的にその薬物のより大きい透過性、従ってバイオアベイラビリティと組合せて、本発明の経皮的又は局所的組成物の利点はより大きくさえなる。
【0056】
一般に、この組成物は、必要とする対象への適当な1日量を提供するのに十分な量で、抗コリン作用薬又は鎮痙薬を含有する。従って組成物中の抗コリン作用薬又は鎮痙薬の量は、変動することができ、並びに治療される疾患又は状態、特定の活性物質の性質及び活性、望ましい作用、可能性のある有害反応、活性物質がその意図された標的へ到達する能力及び速度、更には患者及び医師の具体的知識内である他の要因を含む、様々な要因により左右されるであろう。しかし好ましい組成物は、抗コリン作用薬又は鎮痙薬を、約0.1質量%〜20質量%、より好ましくは約0.5質量%〜10%、最も好ましくは約1質量%〜5質量%含有するであろう。
ひとつの好ましい本発明の態様において、ラセミ体オキシブチニンの1日量は、24時間にわたり約1〜20mgである。別の好ましい態様において、オキシブチニンの個々のエナンチオマーの1日量は、24時間にわたり約0.5〜約15mgである。
【0057】
本発明に従い、担体は、抗コリン作用薬又は鎮痙薬の経皮的又は局所的投与又は送達に適している。担体は、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテル、テトラグリコールフロール、又は水の少なくとも1種を含む。語句「ジエチレングリコールのモノアルキルエーテル」は、一般式C4H10O3(CnH2n+1)を有する物質を意味する(式中、nは1〜4である)。用語「テトラグリコール」は、グリコフロール、又はテトラヒドロフルフリルアルコールを意味する。更に用語「グリコール」は、プロピレングリコール、ジプロピレングリコール、ブチレングリコール、及び一般式HOCH2(CH2OH)nCH2OHを有するポリエチレングリコール(ここでエチレン基の数を表すnは、4〜200の間である)を含むが、これらに限定されるものではない、広範な化学物質を包含している。
【0058】
好ましくは、ジエチレングリコールのモノアルキルエーテルは、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル又はそれらの混合物であることができ、より好ましくはジエチレングリコールモノエチルエーテルである。好ましくは、多価アルコールは、プロピレングリコール、ジプロピレングリコール又はそれらの混合物であることができ、より好ましくはプロピレングリコールである。好ましくは、アルコールは、エタノール、プロパノール、イソプロパノール、1-ブタノール、2-ブタノール又はそれらの混合物であることができ、より好ましくはエタノールである。好ましくはジエチレングリコールのモノアルキルエーテルは、製剤の約1〜15%の量で存在し、多価アルコールは、製剤の約1〜15%の量で存在し、及びアルコールは、製剤の約5〜80%の量で存在する。この担体の平衡を構成するために、水を添加することができる。
【0059】
他の有用な担体は、多価アルコールと、ジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールいずれかの組合せを含む。好ましい多価アルコールは、プロピレングリコールである。この担体において、多価アルコールの、ジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールに対する相対比は、約1:1〜10:1であり、好ましくは2.5:1〜7:1である。多価アルコールの量は、担体の1〜50質量%であることができ、ジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールは、1〜50%、好ましくは2.5〜25%の量で存在する。本願明細書に明らかにされた種類の他の溶媒を、望ましいならば、これらの担体に添加することができるが、平衡を構成する水に加え、担体中に3又は4種よりも多い成分を有することは必要ではない。これらの担体の透過能は、本願明細書に明らかにされた尿素又は尿素誘導体の存在により増強することができる。
【0060】
この組成物は、経皮的又は経粘膜的投与に適した形である。好ましくは、この製剤はゲル剤である。しかしあるいはこの製剤は、スプレー剤、軟膏剤、エアゾール剤、ローション剤、液剤、乳剤、フォーム、ミクロスフェア、ナノスフェア、マイクロカプセル剤、ナノカプセル剤、リポソーム、ミセル、クリーム剤、貼付剤の形、更には他の当該技術分野において公知の局所的又は経皮的の形状であってもよい。
この組成物は、例えば口内錠及び舌下錠、坐剤、経膣投与剤形、経皮的貼付剤、救急絆、又は他の閉鎖もしくは非-閉鎖包帯、又は対象の皮膚又は粘膜の表面を通り吸収するための他の受動的もしくは能動的経皮的用具などであるが、これらに限定されないものにより、皮膚又は粘膜の表面へ、直接又は間接に適用することができる。本願明細書において使用される語句「非-閉鎖」は、例えば長期間適用部位で皮膚上に留まる貼付剤用具、固定された貯蔵庫、アプリケーションチャンバー、テープ、救急絆、粘着性膏薬などにより、大気から皮膚を閉じ込めることも隔離することもしないシステムを意味する。
【0061】
本発明の組成物は、様々な形であることができる。例証するが限定しない目的で、本発明の組成物の様々な可能性のある形は、ゲル剤、軟膏剤、クリーム剤、ローション剤、ミクロスフェア、リポソーム、ミセル、及び経皮的貼付剤を含む。
軟膏剤は一般に、典型的にはワセリン又は他の石油系誘導体を基にした半固形調製物である。語句「半固形」製剤は、ひとつの固相が、第二の液相中に分散されている不均質なシステムを意味する。これらは一般には、最適な薬物送達、及び好ましくは皮膚軟化性を提供する。油性軟膏基剤は、例えば、植物油、動物から得られる脂肪、及びワセリンから得られる半固形炭化水素を含む。乳化可能な軟膏基剤は水をほとんど又は全く含まず、無水ラノリン又は親水性ワセリンを含むことができる。エマルション軟膏基剤は、油中水型(W/O)乳剤又は水中油型(O/W)エマルションのいずれかであり、例えばセチルアルコール、グリセリルモノステアレート、ラノリン及びステアリン酸を含むことができる。好ましい水溶性軟膏基剤は、様々な分子量のポリエチレングリコールから調製される。
【0062】
クリーム剤は一般に、粘度のある液体又は半固形の乳剤、例えば水中油型又は油中水型である。クリーム基剤は典型的には、水で洗浄可能であり、油相、乳化剤及び水相を含む。油相は、「内相」とも称され、一般にワセリン及び脂肪族アルコール、例えばセチルアルコール又はステアリルアルコールで構成される。水相は通常容積が油相よりも多くはなく、一般に湿潤剤を含有するが必ずしもではない。クリーム製剤中の乳化剤は一般に、非イオン性、アニオン性、カチオン性又は両性界面活性剤である。
【0063】
ゲル剤は、半固形の懸濁型システムである。単相ゲル剤は、典型的には水性である、担体液体全体に実質的に均質に分散された高分子(ポリマー)を含有する。しかしゲル剤は、アルコール及び任意に油分を含むことが好ましい。ゲル化剤としても公知である好ましいポリマーは、架橋したアクリル酸ポリマー、ポリエチレンオキシド、ポリオキシエチレン-ポリオキシプロピレンコポリマー及びポリビニルアルコール;セルロース系ポリマー(ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルメチルセルロースフタレート、メチルセルロース);トラガカントガム及びキサンタンガムなどのガム類;アルギン酸ナトリウム;並びに、ゼラチンである。均質なゲル剤を調製するために、アルコールもしくはグリセリンのような分散剤を添加するか、又はゲル化剤を、摩砕、機械的混合もしくは攪拌、又はそれらの組合せにより分散することができる。
【0064】
ローション剤は一般に、摩擦を伴わずに皮膚表面へ適用される調製物と定義される。これらは典型的には、活性成分を含有する固形粒子が水又はアルコール基剤中に存在するような、液体又は半液体調製物である。ローション剤は通常、固形物の懸濁剤であり、本目的のためには好ましくは、水中油型の液体油状乳剤を含む。ローション剤は、より流動性(more fluid)の組成物を適用することは容易であるので、大きい体表面積を処置するために好ましい。一般に、ローション剤中の不溶性物質は、細かく分割されることが必要である。ローション剤は典型的には、より良い分散を作製するための懸濁化剤に加え、皮膚と接触する活性物質を局在化し及び保持するのに有用な化合物、例えばメチルセルロース、カルボキシメチル-セルロースナトリウムなどを含有するであろう。
【0065】
リポソームは、脂質二重層により構成された脂質壁を有する微視的ベシクルであり、ここで薬物送達システムとしても使用することができる。一般にリポソーム製剤は、溶けにくい又はほとんど溶けない医薬物質にとって好ましい。本発明で使用するためのリポソーム調製物は、カチオン性(正帯電した)、アニオン性(負帯電した)及び中性の調製物を含む。カチオン性及びアニオン性リポソームは、容易に入手可能であるか、又は容易に入手可能な材料、中でもホスファチジルコリン、コレステロール、ホスファチジルエタノールアミン、ジオレイルホスファチジルコリン(DOPC)、ジオレイルホスファチジルグリセロール(DOPG)、ジパルミトイル(diopalmitoyl)ホスファチジルコリン(DPPC)、ジパルミトイルホスファチジルグリセロール(DPPG)、ジオレイルホスファチジルエタノールアミン(DOPE)を含む材料などを使用し、容易に調製することができる。これらの材料を使用するリポソームの作製法は、当該技術分野において周知である。
【0066】
当該技術分野において公知のようにミセルは、それらの極性ヘッド基が外側の球状シェルを形成すると同時に、それらの疎水性炭化水素基はその球の中心を向き、コアを形成するように配列された、界面活性剤分子を含む。ミセルは、ミセルが自然に生じるのに十分に高い濃度で界面活性剤を含有する水溶液中に形成される。ミセルの形成に有用な界面活性剤は、ラウリン酸カリウム、オクタンスルホン酸ナトリウム、デカンスルホン酸ナトリウム、ドデカンスルホン酸ナトリウム、ラウリル硫酸ナトリウム、ドキュセートナトリウム、デシルトリメチルアンモニウムブロミド、ドデシルトリメチルアンモニウムブロミド、テトラデシルトリメチルアンモニウムブロミド、テトラデシルトリメチル-アンモニウムクロリド、ドデシルアンモニウムクロリド、ポリオキシル8ドデシルエーテル、ポリオキシル12ドデシルエーテル、ノノキシノール10及びノノキシノール30を含むが、これらに限定されるものではない。ミセル製剤は、局所的又は経皮的送達システムの貯蔵庫、又は体表表面に適用される製剤のいずれかへ混入することにより、本発明と組合せて使用することができる。
【0067】
ミクロスフェアは一般に、薬物又は薬物-含有製剤をカプセル封入している。これらは一般に脂質、好ましくはリン脂質のような帯電した脂質から形成されているが、しかし必ずしもではない。脂質ミクロスフェアの調製は、当該技術分野において周知であり、関連した書籍及び文献に説明されている。
前述のように、本組成物は、経皮的貼付剤の形であることができる。一般に経皮的貼付剤は、組成物又は製剤を含有する接着層又はマトリックス、組成物又は製剤及び接着剤が非透過性である裏当て層、並びに保護的ライナーが貼付剤使用者により剥離されるまで、組成物又は製剤がライナーにより被覆され及び露出されないようにする接着層に剥離可能に接着された保護的ライナーを備える。典型的には貼付剤接着層又はマトリックスは、貼付剤使用者へ投与されるべき1種又は複数の活性物質のための担体として利用される。あるいは、追加の活性物質、又は薬物を運搬するかもしくは速度制御膜として作用するように使用される当該技術分野において周知の無毒のポリマーを含むために、追加層が、貼付剤の接着層又はマトリックス層と、裏当て層の間に備えられてもよい。
【0068】
本発明の組成物は、当業者に公知のように、様々な添加剤も含有することができる。例えば、溶媒、湿潤剤、乳白剤、酸化防止剤、香料、着色剤、ゲル化剤、増粘剤、安定化剤、界面活性剤、抗微生物薬などを、組成物に添加することができる。
例証する目的で、適当な溶媒は、エタノール、イソプロパノール、グリコール、グリコフロール、ジメチルイソソルビド、ジエチレングリコールアルキルエーテル、ポリエチレングリコール、及びエトキシル化されたアルコールを含むが、これらに限定されるものではない。
抗微生物薬が、貯蔵時の腐敗を防止するため、すなわち酵母及びカビのような微生物の増殖を阻害するために、本発明に添加されてもよい。適当な抗微生物薬は、典型的にはp-ヒドロキシ安息香酸のメチル及びプロピルエステル(すなわち、メチル及びプロピルパラベン)、安息香酸ナトリウム、ソルビン酸、イミド尿素、及びそれらの組合せからなる群より選択される。
【0069】
ゲル化剤は、例えばカルボマー、カルボキシエチレン又はポリアクリル酸、例えばカルボマー980又は940 NF、981又は941 NF、1382又は1342 NF、5984又は934 NF、ETD 2020、2050、934P NF、971P NF、974P NF及びカルボマー誘導体;セルロース誘導体、例えばエチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、エチル-ヒドロキシエチルセルロース(EHEC)、カルボキシメチルセルロース(CMC)、ヒドロキシプロピルセルロース(HPC)、ヒドロキシエチルセルロース(HEC)、天然ゴム、例えばアラビアゴム、キサンタンゴム、グアールガム、アルギン酸塩、ポリビニルピロリドン誘導体;ポリオキシエチレンポリオキシプロピレンコポリマーなど;その他、キトサン、ポリビニルアルコール、ペクチン、ビーガムグレードなどを含むことができる。他の本発明に適用するのに適したゲル化剤は、カルボマーを含むが、これに限定されるものではない。あるいは当業者に公知の他のゲル化剤又は増粘剤(viscosant)も、使用することができる。ゲル化剤又は濃厚剤は、当業者に公知のように、ポリマーの種類に応じて約0.2〜約30質量%で存在することができる。
【0070】
保存剤は、塩化ベンザルコニウム及び誘導体、安息香酸、ベンジルアルコール及び誘導体、ブロノポール、パラベン、セントリミド、クロルヘキシジン、クレゾール及び誘導体、イミド尿素、フェノール、フェノキシエタノール、フェニルエチルアルコール、フェニル第二水銀塩、チメロサール、ソルビン酸及び誘導体などである。保存剤は、化合物の種類に応じて約0.01〜約10質量%で存在する。
酸化防止薬は、トコフェロール及び誘導体、アスコルビン酸及び誘導体、ブチル化されたヒドロキシアニソール、ブチル化されたヒドロキシトルエン、フマル酸、リンゴ酸、没食子酸プロピル、メタビススルフェート及び誘導体などであるが、これらに限定されるものではない。酸化防止薬は、化合物の種類に応じ、約0.001〜約5.0質量%で存在する。
【0071】
緩衝剤は、例えば炭酸緩衝剤、クエン酸緩衝剤、リン酸緩衝剤、酢酸緩衝剤、塩酸、乳酸、酒石酸、ジエチルアミン、トリエチルアミン、ジイソプロピルアミン、アミノメチルアミンなどである。しかし当該技術分野において公知の他の緩衝剤も含まれて良い。緩衝剤は、製剤中の水の量の最大100%と交換することができる。
湿潤剤は、グリセリン、プロピレングリコール、ソルビトールなどである。湿潤剤は、化合物の種類に応じて約1〜10質量%で存在する。
金属イオン封鎖剤は、エデト酸などである。金属イオン封鎖剤は、化合物の種類に応じて約0.001〜約5質量%で存在する。
【0072】
保湿剤は、ドキュセートナトリウム、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンひまし油誘導体、ポリオキシエチレンステアレート、ポリオキシエチレンソルビタン脂肪酸エステル、ラウリル硫酸ナトリウムなどである。保湿剤は、化合物の種類に応じて約1.0〜約5質量%で存在する。
界面活性剤は、アニオン性、非イオン性、又はカチオン性界面活性剤を含む。界面活性剤は、化合物の種類に応じて約0.1〜約30質量%で存在する。
皮膚軟化剤は、セトステアリルアルコール、セチルエステルワックス、コレステロール、グリセリン、グリセロールの脂肪酸エステル、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、レシチン、軽質鉱油、鉱油、ワセリン、ラノリン、及びそれらの組合せなどであるが、これらに限定されるものではない。皮膚軟化剤は、化合物の種類に応じて約1.0〜約30.0質量%で存在する。
【0073】
追加の透過性増強剤(複数)を、この製剤に混入することができるが、好ましい態様において、尿素は、あらゆる他の透過性増強剤を伴わずに投与される。適当な二次的増強剤(又は「共-増強剤」)の例は、「Percutaneous Penetration Enhancers」Smithら編集の著書(CRC Press, 1995)に列記された化合物を含むが、これらに限定されるものではなく、その内容は本願明細書に参照として組入れられている。
例えば、ジメチルスルホキシド及びデシルメチルスルホキシドなどの、スルホキシド;ラウリン酸ナトリウム、ラウリル硫酸ナトリウム、セチルトリメチルアンモニウムブロミド、塩化ベンザルコニウム、ポロキサマー(231, 182, 184)、ツイーン(20, 40, 60, 80)及びレシチンなどの、界面活性剤;1-置換されたアザシクロヘプタン-2-オン、特に1-n-ドデシルシクロアザシクロヘプタン-2-オン;ラウリルアルコール、ミリスチルアルコール、オレイルアルコールなどの、脂肪族アルコール;ラウリン酸、オレイン酸及び吉草酸などの、脂肪酸;ミリスチン酸イソプロピル、パルミチン酸イソプロピル、プロピオン酸メチル、及びオレイン酸エチルなどの、脂肪酸エステル;プロピレングリコール、エチレングリコール、グリセロール、ブタンジオール、ポリエチレングリコール、及びポリエチレングリコールモノラウレート、アミド及び他の窒素系化合物、例えばジメチルアセトアミド(DMA)、ジメチルホルムアミド(DMF)、2-ピロリドン、1-メチル-2-ピロリドン、エタノールアミン、ジエタノールアミン及びトリエタノールアミン、テルペンなどの、ポリオール及びそれらのエステル;アルカノン、及び有機酸、特にサリチル酸及びサリチル酸塩、クエン酸及びコハク酸である。
【0074】
あるいは本発明での使用に適している他の透過性増強剤(複数)は、当業者に公知であることができる。透過性増強剤は、化合物の種類に応じて約0.1〜約30.0質量%で存在する。好ましくは二次的透過性増強剤は、脂肪族アルコール及び脂肪酸であり、より好ましくは脂肪族アルコールである。好ましい脂肪族アルコールは、式CH3(CH2)n(CH)mCH2OHを有する(式中、nは(8-m)〜(16-m)であり、及びm=0〜2である。)。
【0075】
本発明の組成物は、当業者の技術の範囲内である、薬物製剤、特に局所的及び経皮的薬物製剤の通常の技術により製造することができる。このような技術は、「Encyclopedia of Pharmaceutical Technology」第2版、J. Swarbrick及びJ. C. Boylan編集、Marcel Dekker, Inc., 2002に明らかにされており、その内容は本願明細書に参照として組入れられている。
前述のように、好ましい態様のひとつにおいて、本発明は、抗コリン作用薬又は鎮痙薬、好ましくはオキシブチニンの経皮的投与の組成物を提供する。先に指摘したように、これらの組成物は、当業者に容易に理解されるように、様々な状況において有用であろう。例えば好ましい物質、オキシブチニンは、頻回の尿意切迫、増大した夜間排尿、尿意切迫、尿意切迫を伴う又は伴わない不随意排尿(尿失禁)、排尿痛もしくは排尿困難を伴う、排尿筋の過活動(膀胱筋の過活動)の治療に適応である。一般に、しかし必ずしもではないが、これらの障害は、神経因性膀胱により引き起こされる。Guittardらの米国特許第5,674,895号を参照し、その内容は本願明細書に参照として組入れられている。加えてオキシブチニンは、排尿筋反射亢進(hyperreflexia)及び不安定排尿筋などの、オキシブチニンの経皮的投与に反応する他の状態及び障害を治療することができる。他の抗コリン作用薬又は鎮痙薬も、過活動膀胱及び/又は尿失禁の症候性治療に適応である。従って、本発明の別の局面において、対象における過活動膀胱又は尿失禁の治療の方法を提供する。
【0076】
ひとつの態様において、この方法は、抗コリン作用薬又は鎮痙薬を含有する治療的組成物、尿素-含有化合物を含む透過性増強剤、及び局所的又は経皮的送達に適した水性アルコール担体を、必要な対象へ投与することを含む。
抗コリン作用薬又は鎮痙薬は、例えば、オキシブチニン又はそれらの塩である。オキシブチニンは、ラセミ体、S-エナンチオマー、又はR-エナンチオマーの形であることができる。本発明において有用な他の抗コリン作用薬又は鎮痙薬は、下記表2に例示されており、これはトルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、フルビプロフェンの一酸化窒素誘導体、ボトックス、フラボキセート、イミプラミン、プロパンテリン、ジシクロミン、フェニルプロパノラミンを含む。好ましくは、この組成物は、オキシブチニンを含有する。
【0077】
【表2】

【表3】

【0078】
好ましくは、抗コリン作用薬又は鎮痙薬の量は、組成物の質量で約0.1〜約20%、より好ましくは約0.5%〜約10%、最も好ましくは約1%〜約5%である。好ましくはこの物質は、オキシブチニン又はそれらの医薬として許容できる塩である。好ましくは、ラセミ体オキシブチニンの一日量は、24時間にわたり約1〜20mg、好ましくはオキシブチニンの個々のエナンチオマーの一日量は、好ましくは対応するラセミ体投与量よりも少なく、24時間にわたり約0.5〜約15mgである。
【0079】
対象における過活動膀胱又は急迫尿失禁を治療するための本方法は、より多くの患者の服薬遵守を提供する。本方法は、尿素-含有化合物の透過性増強剤に関連した薬物のより大きいバイオアベイラビリティを提供するのみでなはく、定常的血漿薬物濃度も提供することがわかっている。従って患者へ投与される組成物は、治療的作用、すなわちより大きいバイオアベイラビリティを実現するためにより少ない量の薬物を含有し、及び血漿薬物濃度の一般的ピークを避ける。加えて、このオキシブチニン:代謝産物の比は、他のオキシブチニン組成物よりも高いことがわかっている。従って本発明の方法は、オキシブチニン投与された組成物に関連した一般に望ましくない副作用の発生の数及び/又は強度を有利に低下する。いくつかの一般的な望ましくない副作用は、ドライマウス、調節障害、悪心及び眩暈を含む。従って本発明の方法は、より多くの患者の服薬遵守を提供するであろう。
【0080】
有利なことに、本発明の方法は、排尿筋の過活動、頻回の尿意切迫、低下した膀胱容積、増大した夜間排尿、尿意切迫、尿意切迫を伴う又は伴わない不随意の排尿(尿失禁)、及び/又は排尿痛もしくは排尿困難を含む、多くの状態の症候性治療を提供する。
本発明は、それらの好ましい特異的態様と組合せて説明されるが、前記説明は、本発明の範囲を例証するが、限定するものではないことを意図することが理解されるべきである。他の局面、利点及び修飾は、本発明が関連する技術分野の業者には明らかであろう。
【0081】
実施例
下記実施例は、本発明を単に例証するものであり、これらはいかなる意味においても本発明の範囲を限定するとは考えられず、これらの実施例及びそれらの他の同等物は、本発明の開示及び添付された「特許請求の範囲」を考慮し、当業者に明らかであろう。
【0082】
実施例1
オキシブチニン主薬(base)3.00質量%、エタノール54.22質量%、精製水17.23質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 6.00%で構成されたゲル剤、エタノール/プロピレングリコール/ジエチレングリコールモノエチルエーテル/BHT混合液中にオキシブチニン主薬を溶解することにより調製した。その後精製水を添加し、0.1N塩酸でpHを調節した。次にヒドロキシプロピルセルロースを、水性アルコール溶液中に、製剤の良好な均質化を確実にする一方で、完全に膨潤するまでの塊形成及び空気の捕獲を避けるのに適当な速度で室温で機械的に攪拌しながら、完全に分散した。
【0083】
実施例2
オキシブチニン主薬3.00質量%、エタノール50.72質量%、精製水14.73質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、尿素5.00%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 7.00%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
実施例3
オキシブチニン主薬3.00質量%、エタノール34.22質量%、イソプロパノール20.00質量%、精製水20.23質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 3.00%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
【0084】
実施例4
オキシブチニン主薬3.00質量%、エタノール66.50質量%、精製水22.39質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、塩酸(HCl)0.1M 6.11%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
実施例5
オキシブチニン主薬3.00質量%、エタノール30.72質量%、イソプロパノール20.00質量%、精製水19.15質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、尿素5.00質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 2.58%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
【0085】
実施例6
オキシブチニン主薬3.00質量%、エタノール70.00質量%、精製水8.19質量%、尿素5.00質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 11.76%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
【0086】
In Vitro比較試験
ブタ耳皮膚を通るin vitro薬物透過及び生態分布実験を、Franz Vertical Diffusion Cell拡散チャンバーを用いて行った。ヒト皮膚を通るin vitro皮膚浸透試験は、ヒト皮膚を入手することができないために制限されている。ブタの耳の皮膚は、化学物質の経皮吸収の評価におけるヒト皮膚に最も近いモデルとして使用することができることが文献に広範説明されている。
【0087】
In Vitro透過実験
食肉処理場から入手した新鮮なブタ死体の耳の皮膚を、標準の操作手法に従い処理した。これらの耳を、それらの完全性(咬傷、擦過傷又は発赤の不在)及び状態について評価した。皮膚は、外科用メスを使用し耳から切出し、穿孔又は損傷を避けた。切出した皮膚試料を、PBS溶液ですすぎ、皮膚ディスクをうまく穿孔するために表面上に配置した。皮膚ディスク片を、表面積1.77cm2を有する垂直拡散セルの区画の間に搭載し、表皮面を上側にした。先に例示された経皮的用具の10又は50mgを、表皮層の上に適用し、他方で真皮層を受容体溶液と接触する:2.0質量/容量%ポリオキシエチレン20オレイルエーテル(Oleth 20)、PBSでpH7.4。受容体チャンバーは、35℃で維持し、本試験を、非-閉鎖条件下及び攪拌速度600rpmで行った。所定の時点で、試料を、受容体溶液から採取し、受容体チャンバーを、新鮮な溶液で直ぐに満たした。受容体溶液(透過した薬物)から採取した全ての試料を、高速液体クロマトグラフィー(HPLC)法を用いて分析した。試験期間中に透過した薬物の総量(mcg/cm2)及び経皮的フラックス(mcg/cm2/h)を、各試験について決定した。
【0088】
先に説明した「Drug Permeation Studies」の全てを、以下の条件下で実行した:Franz Vertical Diffusion Cells (Hanson Research Inc.)を用い、ブタ耳皮膚を、実験モデルとして使用した。受容体溶液は、2質量%ポリオキシエチレン20オレイルエーテル(Oleth 20)、PBS 10mMでpH7.4であった。実験を、非-閉鎖条件下で、35℃で攪拌速度600rpmで行った。試験の開始前に、皮膚片を、透過セルに搭載し、受容体溶液と接触しながら35℃で維持した。製剤を皮膚上に負荷した後に、指定した時点で、受容体溶液1mlを採取し、その受容体チャンバーを、新鮮な溶液で直ぐに満たした。
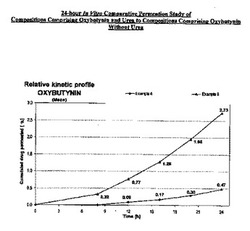
添付図は、本願明細書に説明された発明を更に例証する試験を表している。図面は、例証を目的とし、及び本発明を限定するものではない。図1に関して、尿素を含有する組成物は、24時間後に蓄積され透過されたオキシブチニンの量を6.7倍増加する、すなわち、5%尿素を含有する実施例6については2.73%に対し、尿素を含有しない参照製剤である実施例4については0.47%であることを明らかにするグラフが提供される。
【0089】
図2に関して、グラフは、オキシブチニン、水性アルコール担体、追加の溶媒、すなわちジエチレングリコールモノエチルエーテル及びプロピレングリコールを含み、及び尿素を含まない組成物を、オキシブチニン、水性アルコール担体、追加の溶媒、及び尿素を含む組成物と比較する、24-時間in vitro比較透過試験の結果を例示している。示されたように、24時間透過後に、蓄積され透過されたオキシブチニンの量は、尿素を含まない参照組成物の実施例1よりも5%量の尿素を含む実施例2について、有意に高い。これは尿素を含む。これらの結果は、各々、11.4%、対、5.5%の透過性を示している。
【0090】
図3は、最大経皮的オキシブチニンフラックスは、実施例2において、実施例1よりもほぼ2倍高く、各々、1.17μg/cm2h、対、0.59μg/cm2hであることを示している。加えてこれらの結果は、尿素を含まない実施例1については、最大経皮的オキシブチニンフラックスに16時間後に到達し、実施例2については、最大経皮的オキシブチニンフラックスに少なくとも20時間後に到達することを示している。従って、組成物中の尿素の存在は、経皮的オキシブチニン透過を増強し、同じくオキシブチニン最大経皮的即時フラックス(instant flux)を遅延し、及びオキシブチニン最大経皮的即時フラックスを持続する。これは、本発明の組成物の反復適用後のin vivoにおける持続されたオキシブチニン血漿レベルに寄与する。
【0091】
ここで図4に関して、グラフは、先に説明された実施例3、5、及び2を比較する透過試験の結果を例示している。24時間後に相対蓄積され透過されたオキシブチニンの量は、各実施例について類似しており、すなわちほぼ8%であった。ここで図5に関して、3種の組成物は、図4に示されたオキシブチニンの蓄積され透過された量に類似性を示すが、図5は、実施例3、5、及び2は、同様の最大経皮的オキシブチニンフラックス(0.80μg/cm2hに近い)を示すこと、しかし最大経皮的オキシブチニンフラックスは、尿素を含まない実施例3について、12時間後に到達すること、両方とも尿素を含む実施例5については16時間後に、実施例2については20時間後に到達することを例示している。従って尿素を含有する両組成物、実施例2及び5は、より長期間(「定常状態」)維持された経皮的オキシブチニンフラックスを有する。
【0092】
健常志願者におけるオキシブチニンゲル剤製剤のパイロット薬物動態試験
パイロット試験は、2004年1月22日から2月12日の間にScope International (ハンブルグ, 独国)で行い、オキシブチニン及びその代謝産物N-デスエチルオキシブチニンの薬物動態を決定した。本試験及びその結果を以下に示す。
【0093】
対象及び方法
健常な白人女性で年齢20〜55歳を、本試験のために募集した。対象は、体格指数20〜28kg/m2(体重(kg)を身長(m)の二乗で除算)、非-喫煙者及び慢性の医学的疾患の既応又はアルコールもしくは薬物耽溺の病歴のないものであった。対象は、試験期間中にリスクをもたらすような、状態を予め経験した又は試験前実験の所見を基に除外した。書面によるインフォームドコンセントを、本試験の議論及び説明後に、いずれかの試験-関連した手法に参加する前に、各対象から得た。
【0094】
処置は、オープンラベル式反復投与用量漸増決定パイロット薬物動態試験に従い投与し、経皮的オキシブチニンゲル剤を含んだ。一日量を7日間投与することにより、定常状態を実現した。対象は、被験投薬(経皮的ゲル剤)が1日1回適用される2試験期間に参加した。ゲル剤2g(オキシブチニン投与量60mgに相当)は、第一の試験期間中は毎日適用し(処置A)、その後1g(オキシブチニン投与量30mgに相当)を、第二試験期間中適用した(処置B)。7日間の休薬期間を、ふたつの試験期間の間に認めた。両投与量を、同じ対象において試験した。このデザインは、対象内の同じ製剤の異なる用量間の比較を可能にし、対象間変動を排除する。この試験において投与されるオキシブチニンゲル剤は、オキシブチニン主薬3.00質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、尿素5.00質量%、エタノール50.7質量%、ヒドロプロピルセルロースKLUCEL HF 2.00質量%、塩酸0.1N 8.50質量%、ブチルヒドロキシトルエン0.05質量%、及び精製水適量を含有した。
本試験の主な目的は、8名の健常女性志願者に製品を投与し、2種の異なる投与量で投与される、オキシブチニンゲル製剤の薬物動態パラメータを評価することである。ピーク時の物質濃度(Cmax)、ピーク到達時間(tmax)及び濃度/時間曲線下面積(AUC)に関するデータを、オキシブチニン及びN-デスエチルオキシブチニンの両方について計算した。
本試験の第二の目的は、有害事象、皮膚の忍容性、生命徴候、例えば血圧及び心拍数などの安全性パラメータを記録することであった。
【0095】
薬物動態試験結果
図6に関して、このグラフは、処置A及び処置Bからの平均オキシブチニン血漿濃度プロファイルを例示している。24時と168時の間に認められるように、オキシブチニン投与量の半量への、すなわち2gから1gへのゲル剤の減量は、平均オキシブチニン血漿レベルの1.93-倍の低下(SD 1.08)、すなわち、約4.3ng/ml(SD 2.6)から約2.6ng/ml(SD 1.9)への低下を示した。認められるように、適用されたオキシブチニン用量と得られるオキシブチニン血漿レベルの間にほぼ直線の相関関係が存在する。これに関して、下記表10、11、及び12は、各々、個別の採取時点で採取された、処置A及びBに関するオキシブチニン:代謝産物の血漿比、オキシブチニン処置A:オキシブチニン処置Bの血漿比、及び代謝産物処置A対代謝産物処置Bの血漿比を示している。
【0096】
ここで図7に関して、グラフは、処置A及び処置BのN-デスエチルオキシブチニン血漿濃度プロファイルを例示している。図6同様に、オキシブチニン投与量の半量への、すなわち2gから1gへのゲル剤の減量は、平均N-デスエチルオキシブチニン血漿レベルの2.06-倍の低下(SD 1.17)、すなわち約4.7ng/ml (SD 3.3)から約2.4ng/ml(SD 1.2)への低下を生じた。従って、適用されたオキシブチニン用量と得られるN-デスエチルオキシブチニン血漿レベルの間にはほぼ直線の相関関係が存在する。
オキシブチニンの一日量の低下は、試験期間(各7日間)を通じた、平均血漿オキシブチニン及び平均血漿N-デスエチルオキシブチニンレベルのより低い変動性を生じた。いかにして処置B(オキシブチニン一日量30mgに相当)で得られたN-デスエチルオキシブチニンのプロファイルは顕著に「平坦化」するか、及びN-デスエチルオキシブチニン平均血漿濃度がいかに低いかも注目に値する。結果的に、これらの組成物及び方法は、オキシブチニン-関連した副作用発生率の低下を提供するか、又はより低い-強度のオキシブチニン-関連した副作用を提供する。
【0097】
図8は、処置A時のオキシブチニン及びN-デスエチルオキシブチニンの展開(evolution)を示している。下記表3に示されるように、平均オキシブチニン血漿濃度の平均N-デスエチルオキシブチニン血漿濃度に対する比は、一定であり、1に近い(平均1.10;SD 0.67)。これに関して、下記表6及び8は、各々個別の試料採取時点での、処置Aのオキシブチニン濃度及び処置Aの代謝産物濃度を示している。
【0098】

【0099】
図9に関して、グラフは、処置Bの間のオキシブチニン及びその代謝産物N-デスエチルオキシブチニンの展開を明らかにしている。処置A同様に、並びに下記表5及び表6に示されるように、平均オキシブチニン血漿濃度の平均N-デスエチルオキシブチニン血漿濃度に対する比は、一定であり、及び1に近い(平均1.14;SD 0.57)。
【0100】

【0101】
従って、オキシブチニン1日量の減少は、試験期間(各7日間)中を通じて、平均オキシブチニンのN-デスエチルオキシブチニン平均血漿濃度に対するより高い及びより低い変動比を生じた。これに関して、下記表7及び9は、各々個別の試料採取時点での、処置Bのオキシブチニン濃度、及び処置Bの代謝産物濃度を示している。
【0102】
結論として、得られたオキシブチニン:N-デスエチルオキシブチニン比は、オキシブチニンの経口投与に関連した比よりも、両方の処置において投与されるオキシブチニンゲル剤についてはるかに高かった。Zobristらの論文(Mayo Clin Proc, June 2003, Vol 78)を参照し、これは本願明細書に参照として組入れられている。従って、経皮的投与により提供されるより高い比は、オキシブチニン-関連した副作用のより少ない発生及び/又はオキシブチニン-関連した副作用のより少ない強度に寄与すると考えられる。
【0103】
更に、オキシブチニンゲル剤に関する得られたオキシブチニン:N-デスエチルオキシブチニン比は、当該技術分野において公知であり及び下記表5に示されたような、マトリックス-型経皮的システムによるオキシブチニンの投与後に得られた比と同等であるか又はこれよりも更に高い。Zobristらの論文(Mayo Clin Proc, June 2003, Vol 78)を参照し、これは本願明細書に参照として組入れられている。
【0104】

【0105】
透過性比較試験
尿素のオキシブチニンに対する優れた透過作用を例証するために、尿素は、ふたつの公知のオキシブチニンの透過性増強剤、すなわちミリスチン酸イソプロピル及びラウリン酸と比較した。これらの製剤は、以下に表される。
【0106】

量は、質量%として表している。
【0107】
比較試験の結果は、図10及び11に示している。図10のグラフにより例示されたように、尿素含有する製剤は、オキシブチニンの透過性をラウリン酸と比べ63%増強する。同じく図10に例示したように、ミリスチン酸イソプロピルを含有する製剤は、尿素製剤のものに類似した蓄積されたオキシブチニン透過量を示す。しかしミリスチン酸イソプロピルを含有する製剤は、その製剤の不安定性のために、医薬として好ましくないことがわかった。ミリスチン酸イソプロピルの必要量は、本発明の水性アルコールビヒクル中に溶解することが困難である。従って、ミリスチン酸イソプロピルは、わずかに数時間内で、コアレッセンスとして公知の現象である迅速かつ広範な相分離を示す。
【0108】
図11に示されたように、フラックスプロファイルグラフは、最大フラックスは、尿素含有製剤について、ラウリン酸及びミリスチン酸イソプロピルを含有する製剤よりも、各々、80%及び22%より高いことを示している。更に最大フラックスは、ラウリン酸製剤については24時間後に到達せず、及びミリスチン酸イソプロピル製剤に関しては12時間後には到達しない。まとめると、より高い透過量及びより高い最大フラックスにより例証されるように、尿素は、オキシブチニンについてラウリン酸よりも優れた透過性増強剤である。更に、より高い最大フラックス及び優れた物理的安定性により示されるように、尿素は、オキシブチニンについてミリスチン酸イソプロピルよりも優れた透過性増強剤である。
【0109】
本発明の製剤は、他の公知の透過性増強剤、すなわちトリアセチン及びグリセロールモノオレエートを含有する2種の他の製剤とも比較した。比較製剤は以下に示している。
【0110】

量は、質量%として表している。
【0111】
本比較例の結果は、図12及び13に示している。図12関して、尿素含有する製剤は、トリアセチン含有する製剤及びグリセロールモノオレエート含有する製剤と比べ、オキシブチニンの絶対経皮吸収を各々、38%及び57%増大している。24時間後の相対経皮的吸収も、尿素含有する製剤について、トリアセチン含有する製剤及びグリセロールモノオレエート含有する製剤と比べ、各々41%及び56%増大される。
【0112】
ここで図13に関して、最大及び定常状態フラックスも、尿素含有する製剤についてより高い。尿素含有する製剤についての定常-状態フラックスは、トリアセチン含有する製剤及びグリセロールモノオレエート含有する製剤よりも、90%より高い。更に最大フラックスは、グリセロールモノオレエートについてのように、20-時間で到達するが、トリアセチン含有する製剤よりも8-時間遅い。例証されたように、トリアセチン製剤は、その最大フラックスに12-時間で到達する。この比較は、20時間から24時間の間に、最大フラックスは、グリセロールモノオレエートについて27%(24時の0.104μg/cm2h、対、20時の0.143μg/cm2h)、及び尿素についてわずかに4%(24時の0.190μg/cm2h、対、20時の0.198μg/cm2h)減少するので、オキシブチニンの持続放出能は、尿素含有する製剤について、グリセロールモノオレエート含有する製剤よりもより高いことを示している。従って本試験は、24-時間の蓄積したオキシブチニン透過した量及びより高い最大フラックスにより明らかにされるように、尿素は、グリセロールモノオレエート又はトリアセチンのいずれかよりもより良い透過性増強剤であることを例示している。更に尿素含有する製剤は、in vivoにおいてオキシブチニン血中レベルのより少ない変動、及び結果的に望ましくない副作用のより少ない発生に寄与する持続した定常-状態を示す。
【0113】
図14は、オキシブチニンに関する尿素の優れた透過作用に加え、単純な水性アルコール製剤への、単独で又は他の共溶媒の存在下での尿素の添加は、オキシブチニン以外の抗コリン作用薬の透過性を増強することを例示している。本試験において、酒石酸水素トルテロジンの透過性増強剤としての尿素を調べた。比較製剤は、以下に表している。
【0114】

【0115】
この比較試験の結果は、図14に示している。図14に例示したように、尿素含有する製剤は、尿素を含有しない参照製剤と比較し、トルテロジンの透過性を、24時間後に85%増強した。加えて及び図14に示したように、尿素及び共溶媒2.5%ジエチレングリコールモノエチルエーテル及び15%プロピレングリコールを含有する製剤は、トルテロジンの皮膚透過性を19%更に増大する。従って本試験は、尿素単独の添加又は共溶媒の存在下での添加は、他の抗コリン作用薬に対する増強された透過性を可能にすることを明らかにしている。
【0116】
図15は、オキシブチニン及びトルテロジンを含む抗コリン作用薬に対する尿素の優れた透過作用に加え、トルテロジンの単純な水性アルコール製剤へのジメチル尿素のような、尿素-含有誘導体の添加は、優れた薬物の皮膚透過性を示すことを例示している。比較製剤は、以下に示す。
【0117】

(図は、質量%として表している)
【0118】
本試験の結果は、図15及び16に示している。図15を関して、トルテロジン及びジメチル尿素を含有する製剤は、トルテロジンの透過性を、ジメチル尿素を含有しない参照製剤の実施例10と比べ、4倍増強する。更に、ジメチル尿素及び共溶媒、プロピレングリコール及びジエチレングリコールモノエチルエーテルを含有する製剤(実施例16)は更に、この薬物の透過性を7.7倍又は66%増大する。従って本試験は、単独で又は共溶媒の存在下で、ジメチル尿素などの尿素含有する誘導体は、抗コリン作用薬の透過性を増大する。
【0119】
図16に関して、ジメチル尿素を含有する製剤は、参照製剤と比較して4倍、トルテロジンの薬物フラックスを増強する。示されたように、定常状態は、ジメチル尿素を含有する製剤及び実施例10の参照製剤の各々について16時間後に到達される。しかしジメチル尿素及び共溶媒を含有する製剤の定常-状態は、24時間後であっても到達しない。まとめると、この比較試験は、尿素誘導体の抗コリン作用薬の透過性増強剤としての有効性を例示している。
【0120】
前述の実施例は、本発明の好ましい態様の単に例証ではないことは理解されるであろう。多くの修飾及び変更の配置は、本発明の精神及び範囲を逸脱しない限りは、当業者により考案され、並びに添付された「特許請求の範囲」は、そのような変更及び配置を対象とすることが意図されている。
【0121】
【表4】

【0122】
【表5】

【0123】
【表6】

【0124】
【表7】

【0125】
【表8】

【0126】
【表9】

【0127】
【表10】

【0128】
本発明は、それらの機能的態様を参照し詳細に説明され及び指摘されているが、当業者は、本発明の精神から逸脱しない限りは、様々な変更、修飾、置換、及び省略を行うことができることを理解するであろう。従って本発明は、「特許請求の範囲」内のそのような同等物を包括することを意図している。
【図面の簡単な説明】
【0129】
【図1】図1は、オキシブチニン、尿素、及び担体を含有する組成物、並びにオキシブチニン、担体を含有するが尿素を含有しない組成物の透過を比較する、in-vitro 24-時間比較透過試験の結果を図示するグラフである;
【図2】図2は、オキシブチニン、水性アルコール担体、及び溶媒を含有する組成物、並びにオキシブチニン、尿素、水性アルコール担体及び溶媒を含有する組成物の透過を比較する、in-vitro 24-時間比較透過試験の結果を図示するグラフである;
【図3】図3は、図2の組成物の薬物フラックスプロファイルを図示するグラフである;
【図4】図4は、オキシブチニン、及び担体を含有する組成物、並びにオキシブチニン、尿素及び担体を含有する組成物;並びに、オキシブチニン、尿素、担体及び追加の溶媒を含有する組成物の透過を比較する、in-vitro 24-時間比較透過試験の結果を図示するグラフである;
【図5】図5は、図4の組成物の薬物フラックスプロファイルを図示するグラフである;
【図6】図6は、7-日間にわたる平均血漿オキシブチニン濃度(ng/ml)の薬物動態試験の結果を図示するグラフである;
【図7】図7は、7-日間にわたる平均血漿N-デスエチルオキシブチニン濃度(ng/ml)の薬物動態試験の結果を図示するグラフである;
【図8】図8は、7-日間にわたる平均血漿オキシブチニン/N-デスエチルオキシブチニン比の薬物動態試験からの結果を図示するグラフである;
【図9】図9は、7-日間にわたる平均血漿オキシブチニン/N-デスエチルオキシブチニン比の薬物動態試験の結果を図示するグラフである;
【図10】図10は、オキシブチニン及び尿素を含有する製剤、オキシブチニン及びラウリン酸を含有する製剤、並びにオキシブチニン及びミリスチン酸イソプロピルを含有する製剤の絶対速度論プロファイルを比較する、比較試験の結果を図示するグラフである;
【図11】図11は、図10の製剤のフラックスプロファイルを図示するグラフである;
【図12】図12は、オキシブチニン及び尿素を含有する製剤、オキシブチニン及びトリアセチンを含有する製剤、並びにオキシブチニン及びグリセロールモノオレエートを含有する製剤の絶対速度論プロファイルを比較する、比較試験の結果を図示するグラフである;
【図13】図13は、図12の製剤のフラックスプロファイルを図示するグラフである;
【図14】図14は、透過性増強剤として尿素を含有するトルテロジン製剤の相対速度論プロファイルを図示するグラフである;
【図15】図15は、尿素誘導体を含有するトルテロジン製剤の相対速度論プロファイルを図示するグラフである;
【図16】図16は、図15の製剤の薬物フラックスプロファイルを図示するグラフである。
【発明の詳細な説明】
【0001】
技術分野
本発明は、概して抗コリン作用薬又は鎮痙薬を含有する組成物に関し、及びより詳細に述べると局所的又は経皮的に適用された抗コリン作用薬又は鎮痙薬、特にオキシブチニンに対する皮膚又は粘膜組織の透過性を増強する組成物に関する。本発明は、局所的又は経皮的組成物の投与により、過活動膀胱及び尿失禁を治療する方法にも関する。
【0002】
発明の背景
薬物投与のための局所的又は経皮的送達システムは、それらの薬物の経口送達に勝るいくつかの利点を提供することは現在公知である。一般に、薬物の局所的又は経皮的送達の利点は、薬物動態に関連している。より詳細に述べると、薬物の経口送達に関連したひとつの一般的問題点は、薬物の血清レベルにおけるピークの発生、それに続くその消失及び可能性のある代謝に起因した薬物の血清レベルの下落である。従って経口投与された薬物の血清レベル濃度は、摂取後にピーク及び谷を有する。薬物の血清レベル濃度のこれらの高位及び低位は、望ましくない副作用へつながることが多い。
【0003】
対照的に、薬物の局所的及び経皮的送達は、薬物の比較的遅い及び定常的な送達を提供する。従って、経口投与された薬物とは異なり、局所的又は経皮的に送達された薬物の血清濃度は実質的に維持され、経口送達に関連したピークを有さない。
局所的又は経皮的薬物送達に関連した維持された血清濃度は、薬物の経口投与での全身性副作用を避ける。特に肝臓による薬物の初回通過代謝は、薬物投与のための経皮的又は局所的送達ビヒクルの利用により、回避される。
【0004】
経口薬物送達と比較した場合の、局所的又は経皮的薬物送達ビヒクルの利点は、一般に様々な薬物について周知である。例えば、Powersらは、経皮的エストラジオールの経口エストラジオールに勝る利点を明らかにした。Powers MS、Schenkel L、Darkey PE、Good WR、Balestra JC、Place VAの論文;「Pharmacokinetics and pharmacodynamics of transdermal dosage forms of 17β-estradiol: Comparison with conventional oral estrogens for hormone replacement」、Am. J. Obstet. Gynecol.、152:1099 (1985)を参照のこと。Van Seventerらは、患者評価は、経皮的フェンタニル治療が、問題の多い副作用の有意に低い割合及びより少ない日常活動の妨げの点で、徐放性モルヒネよりも好ましいことを報告した。Van Seventer R、Smit JM、Schipper RM、Wicks MA、Zuurmond WWの論文、「Comparison of TTS-fentanyl with sustained-release orally morphine in the treatment of patients not using opioids for mild-to-moderate pain」;Curr Med Res Opin.、19(6):457-69 (2003)を参照のこと。
【0005】
加えてHeynemanらは、局所的に適用された非ステロイド系抗炎症薬(NSAID)は、経口製剤に対して、優れた安全性プロファイルを有することを報告した。同じく局所的NSAID適用に随伴する有害作用が、患者の約10〜15%で発生し、及び事実上主に皮膚反応(適用部位での発疹及び掻痒)であり;胃腸管の有害な薬物反応は、経口NSAIDについて報告された発生率15%と比べ、局所的に適用されたNSAIDでは稀であることも報告した。Heyneman CA、Lawless-Liday C、Wall GCの論文、「Oral versus topical NSAIDs in rheumatic diseases: a comparison」、Drugs、2000年9月;60(3): 555-74を参照のこと。
【0006】
Barrettらは、経皮的適用後、セレギリンの血漿濃度は、経口セレギリンにより得られるものよりも50倍大きいことを認めた。経口により得られるものの70%未満に低下される代謝産物の形成を代償とした、セレギリン全身性血漿濃度のこの増加は、様々な神経変性疾患及び精神障害の患者において、治療的価値があると仮定された。Barrett JS、Hochadel TJ、Morales RJ、Rohatagi S、DeWitt KE、Watson SK、DiSanto ARの論文;「Pharmacokinetics and Safety of a Selegiline Transdermal System Relative to Single-Dose Oral Administration in the Elderly」;Am J Ther.、1996年10月;3(10): 688-698を参照のこと。
【0007】
同様に、オキシブチニンの経皮的送達に関連した有害作用の有意な減少が存在することも一般に公知である。経口オキシブチニンは、無抑制神経因性膀胱又は反射性神経因性膀胱、すなわち尿意切迫、頻尿、尿漏れ、急迫尿失禁、及び排尿困難を伴う患者の排尿に関連した不安定膀胱の症状を緩和することが示されている。
オキシブチニンは、平滑筋に対する直接的鎮痙作用を有し、及び平滑筋に対するアセチルコリンのムスカリン様作用を阻害するが、アトロピン性排尿筋の抗コリン活性のわずかに1/5のみ(ウサギにおいて観察された作用)及びその鎮痙活性の4〜10倍を示すこともわかっている。オキシブチニンが、骨格筋の神経筋接合部又は自律神経節での遮断作用(抗ニコチン性作用)を有することは不明である。
【0008】
更にオキシブチニンは、膀胱平滑筋を弛緩することがわかっている。不随意膀胱収縮により特徴付けられる状態を伴う患者において、膀胱内圧測定試験は、オキシブチニンが、膀胱(嚢)容積を増大し、排尿筋の無抑制収縮頻度を減少し、かつ初発尿意を遅延することを明らかにしている。従ってオキシブチニンは、尿意切迫並びに失禁のエピソード及び随意排尿の両方の頻度を減少する。抗ムスカリン様活性は、主にR-異性体に存在することも報告されている。
【0009】
しかしオキシブチニン療法に関連した有害反応は、動悸、頻脈又は血管拡張のような心臓血管系の症状発現;減少した発汗、発疹のような、皮膚科学的症状発現;便秘、減少した胃腸管運動、ドライマウス、悪心、ためらい排尿及び尿貯留のような、胃腸/泌尿生殖器の症状発現;無力感、眩暈、嗜眠、幻覚、不眠、不穏のような、神経系の症状発現;弱視、毛様体筋麻痺、低下した涙液分泌、瞳孔散大のような、眼科的症状発現を含み得る。経口オキシブチニンに関連した最も一般的な副作用は、ドライマウス、眩暈、視界不良、及び便秘である。これらの有害な経験は、患者が治療の中断を促すのに十分な不快感であることがある。
【0010】
オキシブチニンの経皮的送達と経口送達を比較する試験において、オキシブチニン及びその代謝産物N-デスエチルオキシブチニンの血漿濃度の実質的により低い変動が、経皮的に投与されたオキシブチニンで明らかにされた。加えて投薬期間中の低下したN-デスエチルオキシブチニン形成、及びより大きい唾液分泌が、経口オキシブチニン投与と比較して報告された。更に、過活動膀胱の患者におけるドライマウスのより低い発生率が報告された。Appel RA、Chancellor MB、Zobrist RH、Thomas H、Sanders SWの論文、「Pharmacokinetics, Metabolism, and Saliva Output during Transdermal and Extended-Release Oral Oxybutynin Administration in Healthy Subjects」、Mayo Clin. Proc.、78: 696-702 (2003)を参照のこと。
【0011】
更にDmochowskyらは、経皮的オキシブチニンで治療された患者における、経口オキシブチニン療法と比較した、過活動膀胱症状及び生活の質(LOQ)(ドライマウス発生の低下)の改善を確認した。Dmochowski RR、Davila GW、Zinner NR、Gittelman MC、Saltzstein DR、Lyttle S、Sanders SWの論文、The Transdermal Oxybutynin Study Group;「Efficacy and safety of transdermal oxybutynin in patients with urge and mixed urinary incontinence」、The Journal of Urology、168: 580-586 (2002年8月)を参照のこと。従ってオキシブチニンの経皮的送達はより多くの利点があり、更にはオキシブチニンの経口送達よりも好ましいことを容易に認めることができる。
【0012】
当該技術分野において公知のように、薬物の経皮的投与は、皮膚障壁を越える薬物浸透に関連したある欠点を有する。皮膚は、厚さの合計が2〜3mmの構造的に複雑な多層臓器である。従って薬物の皮膚への浸透は、皮膚障壁を越えた場合にのみ有効である。皮膚を通る浸透及び透過に対する抵抗の主な原因は、皮膚の角質層(stratum corneum layer)であり、これは「角層(horny layer)」としても公知である。
【0013】
角質層は、高度に平らなケラチンで満たされた細胞の層からなり、ほぼ全身を覆う厚さ約10〜15μmの稠密な薄層である。従って多くの薬物の皮膚を通る透過率は、極めて低い。その結果、化合物の経皮吸収に対する皮膚障壁を変更する戦略の開発に関する興味が依然存在している。
経皮吸収の速度論及び/又は程度の著しい改善を得ることにより、皮膚障壁機能の低下は、皮膚科用製剤及び経皮的用具の治療効能を増大すると予想される。薬物が皮膚を通り浸透する割合を増大するために、薬物と共に投与される、又は場合によっては薬物が皮膚へ適用される前に投与される(「処置前」)ような、物理的浸透増強剤(イオントフォレーシス、ソノフォレーシス、加熱)又は化学的浸透増強剤のいずれかの使用に関連している、様々な戦略が採り入れられている。
【0014】
一般に多くの薬物の経皮吸収を促進する適当な透過性増強剤が、公知である。これらの透過性増強剤は、それらの作用機序に従い分類される。Sinha VR、Kaur MPの論文、「Permeation Enhancers for Transdermal Drug Delivery」、Drug Dev Ind Pharm.、26(11): 1131-40 (2000年11月)を参照のこと。
透過性増強剤が、薬物の経皮的又は局所的送達において広範に使用され始めているが、ひとつの問題点は、前述のように、具体的な透過性増強剤は、全ての薬物に適しているとは考えられないことである。更に特定の薬物に関する最も効率的透過性増強剤の選択は、経験的技術、普遍性からは離れた応用性に頼っており、及びその結果は余りにも予測不可能である。例えば、適当な透過性増強剤の選択は、以下を含む多くのパラメータによって左右されるであろう:
(1)投与される具体的薬物。ひとつの具体的薬物に関して確定された透過性増強剤は、別の薬物には効果的ではないことがある;
(2)透過性増強剤の濃度。増強作用は、透過性増強剤の所定の濃度で最適であり、かつこの濃度を下回るか又は上回る場合、より低いかもしくはマイナスであることさえある;
(3)ビヒクル又は担体。透過性増強剤は、例えば水性ビヒクル中では効果的であるが、有機ビヒクル中では効果的でないことがある;並びに
(4)システムの成分。透過性増強剤は、薬物それ自身と相互作用することがあり、その結果薬物の特徴及び安定性をかなり変更するか、又はポリマー、酸化防止薬などと相互作用することがある。
【0015】
局所的システムへ製剤される増強剤を選択するいくつかの方法は、Pfister、Yum及びGhoshの論文、「Transdermal and Topical Drug Delivery Systems」、11章:「Chemical means of transdermal drug permeation enhancement」(Interpharm Press, Inc. 1997)により公開されている。しかしかなりの量の試験において明らかにされているように、透過性増強剤の選択を支配する主な原理は、「試行錯誤」である。従って最適化された経皮的製剤は、多くの実験を行った後に実現されるのみである。
【0016】
オキシブチニンの経皮的又は局所的送達のための様々な透過性増強剤が報告されている。例えば、米国特許第5,411,740号、米国特許第5,500,222号、米国特許第5,614,211号は、各々、オキシブチニン経皮的治療システムのための好ましい透過性増強剤としての、モノグリセリド又は脂肪酸のモノグリセリドの混合物を開示している。米国特許第5,736,577号は、透過性増強剤を含有する、(S)-オキシブチニンの経皮的投与のための医薬単位剤形を開示している。米国特許第5,834,010号及び米国特許第6,555,129号は両方共、オキシブチニンの透過性増強剤としてのトリアセチンを開示している。米国特許第5,747,065号は、オキシブチニンのための透過性を増強する混合物としての、モノグリセリド及び乳酸エステルを開示している。
【0017】
更に米国特許第5,843,468号は、オキシブチニンの経皮的投与のための、酢酸ラウリル及びグリセロールモノラウレートの二重透過性増強剤混合物を開示している。米国特許第6,004,578号は、オキシブチニンを含有する経皮的マトリックス薬物送達用具のための、ポリエチレングリコールモノアルキルエーテルのアルキル又はアリールカルボン酸エステル、並びにポリエチレングリコールアルキルカルボキシメチルエーテルからなる群より選択された透過性増強剤を開示している。その一方で、米国特許第6,267,984号は、オキシブチニンの経皮的送達のためのモノグリセリド及びパルミチン酸エチルを含有する皮膚透過性増強組成物を開示している。米国特許第6,562,368号は、経皮的に投与されたオキシブチニンに対する皮膚又は粘膜組織の透過性を増加するための水酸化物-放出剤の使用を開示している。前述のように、現時点での、特定の薬物に関する適当な透過性増強剤を見つける方法は、試行錯誤による。
【0018】
尿素は、天然の物質であり、体内におけるタンパク質の最終代謝産物である。医薬及び化粧調製物における尿素の価値は、初期の民間療法(folk medicine)の頃から認められており、例えば尿素は、濃度約10〜15%で使用される場合に、デブリドマンを補助し、凝塊を溶解し、及び上皮形成を促進し;より高い濃度、例えば40%以上の場合、尿素は、タンパク質分解性であり、従って爪の破壊(destruction)及び溶解の治療に通常使用され、尿素は、浸透圧性利尿薬としても使用される。
ひとつの顕著な尿素の特性は、尿素存在下での角質層の増加した水分保持能である。尿素は、軽度に角質溶解性であり、及び角質層中への水の取込みを増加する。このことは、角質層に高い水結合能をもたらす。従って尿素は頻繁に、皮膚保湿剤として使用される。
【0019】
尿素は一般に、ある種の薬物のための透過性増強剤としても公知である。しかし、尿素による経皮吸収増強は、使用される共溶媒に強く左右される。例えばKimらは、ケトプロフェンの浸透は、水溶液中の尿素の存在下で増強されるのに対し、プロピレングリコール又はプロピレングリコール-エタノール混合物中では、増強は報告されないことを認めた。更にKimは、多量の尿素の添加は、ケトプロフェンの拡散性を増大することを認めた。
同様の相乗作用は、Luらによっても明らかにされており、彼等は、ヒト死体皮膚、無毛マウス皮膚、及び脱皮したヘビ皮膚からのロイプロリドの吸収は、尿素及びテルペンの存在下で増強されることを明らかにした。しかしこれらの増強剤は単独で、すなわち溶媒を伴わずには、透過性を著しく増強しなかった。Lu MY、Lee D.、Rao GSの論文、「Percutaneous absorption enhancement of leuprolide」、Pharm. Res.、9(12): 1575-9 (1992年12月)。先に引用した試験と同様に、尿素の混入は、薬物の拡散性を著しく増大した。この種の溶媒依存性は、Williamsの論文「Percutaneous Penetration Enhancers」、10.1章:「Urea and its derivatives as penetration enhancers」、Smithら編集、CRC Press、1995年にも列記されている。
【0020】
更に米国特許第5,696,164号及び米国特許第6,042,845号は両方共、透過性増強剤として尿素をスルフヒドリル含有アミノ酸又はそれらの誘導体と組合せて含有する、爪の抗真菌治療のための組成物を開示している。米国特許第4,996,193号は、尿素が透過性増強剤として使用される、皮膚組織へのシクロスポリンの局所的適用のための製剤を開示している。米国特許第5,015,470号は、尿素を透過性増強剤として含有する、毛髪成長を誘導、維持又は増大する化粧及び医薬組成物を開示している。米国特許5,654,337号は、ゲル形成を促進するために尿素が使用される、抗炎症薬又は抗新生物薬の局所送達のための局所的製剤を開示している。米国特許第5,874,463号及び第6,300,369号は両方共、皮膚-浸透剤として尿素を含有する、ヒドロキシ-コウジ酸皮膚剥離組成物を開示している。米国特許第5,879,690号は、尿素を含有する経皮浸透増強剤を使用する、皮下筋肉組織へのカテコールアミン及び関連化合物の局所的投与のための組成物を開示している。米国特許第6,132,760号は、コポリマー系感圧式皮膚接着剤の単量体成分として尿素を含有する、経皮的送達用具を開示している。米国特許第6,162,419号は、尿素又はオレイン酸の透過性増強剤を含有する、皮膚科学的に安定されたアスコルビル組成物を開示している。
【0021】
同様に、米国特許第6,214,374号は、尿素又は尿素誘導体の、ホルモンの透過性増強剤としての使用を開示している。米国特許第4,699,777号は、アルブテロールの経皮的フラックスに対する尿素及び1-ドデシル-アザシクロヘプタン-2-オンの組合せの相乗作用を開示している。米国特許第4,895,727号は、局所的に適用された治療用及び化粧用の薬理活性のある物質の浸透及び保持を増強し、並びに経皮的フラックスを減少するために皮膚及び粘膜中に貯蔵作用を誘導する、尿素及び水溶性亜鉛-含有化合物を含む組成物を開示している。米国特許第5,446,025号は、ロイプロリドの経皮投与のための皮膚膜(cutaneous membrane)浸透増強する混合物としての、尿素、メントール、サリチル酸メチル、及び樟脳の組合せを開示している。
【0022】
尿素は、可溶性湿潤剤、すなわち皮膚内で大量の水(それらの質量に対して)を保持することが可能であり、これにより皮膚の滑らかさ及びしなやかさを維持することを助ける、水結合物質としても使用される。尿素は、ある種のアミノ酸、表皮の脂質及びタンパク質と共に、角質化プロセス時に生成される天然保湿因子NMFの構成物質として公知である。Brian W. Barryの著書「Dermatological Formulations: Percutaneous Absorption」第4章、147頁、Marcel Dekker, ISBN: 0-8247-1729-5を参照のこと。尿素は、角質化プロセス時に、タンパク質の構成単位であるアミノ酸アルギニンの分解の最終生成物として、角層へ入り込む。尿素は、角層におけるNMFの7%を表している。尿素は、角質層へ浸透し再水和する。
皮膚科用調製物への尿素の添加は、尿素の適用後の皮膚水和を増加する能力に帰する、コルチコステロイドの浸透を増大することが知られている。これは、局所麻酔作用を基にした抗-掻痒活性(かゆみの停止)も有する。
【0023】
尿素のタンパク質分解性の特徴も、よく認められており、ここで尿素は、濃度に応じて、ポリペプチドに加えアミノ鎖の構造を修飾する。このことは、皮膚の含水量とアミノ酸含量の間に相関関係が存在する−皮膚が乾くと、溶解したアミノ酸の割合が低下する−ので、皮膚の保湿にとって重要である。尿素は、比較的高い濃度(10%)で、鱗屑及び皮膚硬結(calluse)の減少を補助する。
【0024】
尿素が透過性増強作用を示した多くの研究が、Ghosh、Pfister及びYumの論文「Transdermal and Topical Drug Delivery Systems」、11章:「Chemical means of transdermal drug permeation enhancement」(Interpharm Press, Inc.1997)において明らかにされている。尿素が適当な透過性増強剤であることが明らかにされている具体的物質を以下に示す。
【0025】

a 特に記さない限りはin vitro;b 対照と比較した相対増強因子(RE);c 拡散性を比較;d データなし
注記:PG=プロピレングリコール
【0026】
興味深いことに、Ghosh、Pfister及びYumは、他の化学クラスの浸透増強剤、すなわち炭化水素、アルカノール及びアルケノール、酸、エステル、アルキルアミノエステル、アミド、スルホキシド、シクロデキストリン、テルペン、ピロリドン、Azone(登録商標)及びアナログ、リン脂質、及び界面活性剤についても同様の研究を行った。これらの比較表の試験は、ある特定の活性化合物は、様々な透過性増強剤と接触する場合に、増強された経皮的透過性を示すことができることを明らかにしている。例えば、インドメタシンは、例として尿素により増強されるが、ノナン、1-ノナノール、オレイン酸デシル-(N,N-ジメチルアミノ)イソプロピオネート、テトラヒドロチオフェン-1-オキシド及びアナログ、d-リモネン、ピロリドンアナログ、Azone(登録商標)及びアナログによっても増強される。
以下の一覧表からわかるように、様々な増強剤は、特定の薬物の浸透増強に有効であるが、増強因子及び効能は大きく変動し得る。
【0027】
増強因子a

a増強因子=増強剤を伴う(正規化された皮膚透過率)/増強剤を伴わない(正規化された皮膚透過率)
【0028】
Chienの論文「Developmental Concepts and Practice in Transdermal Therapeutic Systems」、Transdermal Controlled Systemic Medications, Marcel Dekker Inc., ニューヨーク, 1987, 25-81頁を参照し、これは本願明細書に参照として組入れられている。
【0029】
これらの結果を考慮し、浸透増強剤は、様々な化合物の透過性を異なる程度に増大することがわかっている。例えば特定の透過性増強剤は、特定の薬物に非常に適しているが、異なる薬物の透過性は増大しない。このことは、経皮的透過性は、浸透物(permeant)の増強剤との相互作用、及び浸透物の物理化学的特性の両方により、主に影響を受けるという事実により説明される。これらの知見の例として、Chienは、「Transdermal Controlled Systemic Medications」において、飽和脂肪酸のアルキル鎖長に対するプロゲステロンの皮膚透過に関する増強因子の依存性を公開した。彼は、カプロン酸(C8)を使用する大きい増強作用を発見したが、同じ筆者は米国特許第5,145,682号において、エストラジオールのより良い増強剤はデカン酸(C10)であることを開示している。従って特定の活性物質に関する皮膚浸透増強剤の有効性は、種類、濃度、及び浸透増強剤が用具から放出される方式の関数である。
【0030】
当該技術分野におけるひとつの問題点は、活性物質又は薬物に関する経皮的浸透増強作用の「普遍的」増強剤の概念は、存在しないことである。従って透過性増強剤の選択は、通常は薬物特異性であり、実験を通じた試行錯誤で決定される。経皮的用具から送達される特定の薬物のための適当な増強剤の選択が成功することを保証する一般的指針は存在しない(Hsieh 1994)。
更に、局所的製剤を最適化する科学は、ひとつの薬物から別のものへ予測されず、及び透過性増強剤は、異なる物理化学特性を有する薬物を超えた広範な増強因子を生じることができる。むしろこれは、過度の実験作業を必要とするプロセスであり:皮膚を超える適切な透過率は、様々な種類の化合物の様々な濃度での試験によってのみ実現され得る。
【0031】
この「試行錯誤」法の記述として、オキシブチニンの経皮的吸収を促進するために試験される様々な可能性のある透過性増強剤を例示する一覧表を以下に記す。
【0032】

LA:ラウリルアルコール;OA:オレイルアルコール;EO:オレイン酸エチル;DBP:パルミチン酸ジブチル;GML:グリセロールモノラウレート;PGML:プロピレングリコールモノラウレート;AG:アセチルグリセロール;NMP:N-メチルピロリドン
【0033】
認められるように、これらの浸透増強剤に関する吸収率、増強比、及び定常状態フラックスは、大きく変動する。従ってオキシブチニンのような抗コリン作用薬を適切に送達し、及び皮膚又は粘膜障壁を越えて抗コリン作用薬の透過性を増強する改善された局所的又は経皮的組成物が必要である。
【発明の開示】
【0034】
発明の概要
本発明の目的及び利点は、以下の説明に示されかつそれから明らかであることに加え、本発明の実践により学習されるであろう。本発明の追加の利点は、記載された説明及び「特許請求の範囲」、更には添付図面において特に指摘された組成物及び方法の実践により、認められかつ達成されるであろう。
これら及び他の利点を実現するために、本発明に従い、治療的に有効な抗コリン作用薬又は鎮痙薬の局所的又は経皮的投与のための組成物をもたらす。特に本発明は、哺乳類対象の皮膚又は粘膜表面を超える抗コリン作用薬又は鎮痙薬の透過又は浸透を増強する組成物を提供する。驚くべきことに、尿素-含有化合物を含む組成物は、抗コリン作用薬の対象の皮膚又は粘膜表面を超える浸透を増大することがわかった。本発明の組成物は、薬物の定常的血漿濃度を提供し、及びピーク濃度を避けることもわかった。有利なことに、ピーク濃度の回避は、好ましくも望ましくもない副作用の発生を低下することに関連している。
【0035】
本発明のひとつの局面において、治療的有効量の抗コリン作用薬又は鎮痙薬又はそれらの機能性誘導体、抗コリン作用薬の透過を増強するのに十分な量の尿素-含有化合物、及び局所的又は経皮的薬物送達に適した担体システムを含有する、局所的又は経皮的投与のための組成物が提供される。語句「治療的有効」は、所望の治療作用を提供するための、化合物の無毒であるが、十分な量を意味する。
【0036】
尿素含有化合物は、下記一般式を有する:
【0037】
【化1】

【0038】
(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結(ether linkage)、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せを含む群より選択された官能基である。)。
【0039】
例証するが限定しない目的で、尿素-含有化合物は、尿素、又は1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸を含む、それらの誘導体もしくはアナログであることができる。
【0040】
抗コリン作用薬は、オキシブチニン又はそれらの医薬として許容できる塩であることができる。例えば、オキシブチニンの塩は、酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩(mucate)、ナプシル酸塩(napsylate)、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩である。
あるいは、トルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、ボトックス、フラボキセート、プロパンテリン、ジシクロミン、フェニルプロパノラミンなどの、他の抗コリン作用薬又は鎮痙薬を使用することもできる。
あるいは、フルビプロフェン(プロスタグランジン合成阻害薬)及びイミプラミン(顕著な全身性抗ムスカリン様作用を伴う抗欝薬)の一酸化窒素誘導体のような他の物質を、使用することができる。
【0041】
本発明の担体は、抗コリン作用薬又は鎮痙薬の経皮的又は局所的投与又は送達に適している。担体は、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテル、テトラグリコールフロール、又は水の少なくとも1種を含む。好ましくは担体は、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せ、又は多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せを含む。
ジエチレングリコールのモノアルキルエーテルは、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル又はそれらの混合物であることができる。多価アルコールは、プロピレングリコール、ジプロピレングリコール又はそれらの混合物であることができ、並びに、アルコールは、エタノール、プロパノール、イソプロパノール、1-ブタノール、2-ブタノール又はそれらの混合物であることができる。テトラグリコールフロールは、グリコフロールであることができる。
【0042】
この組成物は、経皮的又は経粘膜的投与に適した形である。好ましくはこの製剤は、ゲル剤の形である。しかしあるいは製剤は、スプレー剤、軟膏剤、ローション剤、乳剤、エアゾール剤、貼付剤、フォーム(foam)、ミクロスフェア、ナノスフェア、マイクロカプセル剤、ナノカプセル剤、リポソーム、ミセル、又はクリーム剤であってよい。この組成物は、口内錠及び舌下錠、坐剤、経膣投与剤形、又は皮膚もしくは粘膜表面を通し吸収するための他の受動的もしくは能動的経皮的用具により投与されてもよい。
別の本発明の局面において、対象における尿失禁を治療する方法が提供される。本発明は、抗コリン作用薬又は鎮痙薬、尿素又はそれらの誘導体もしくはアナログ含む透過性増強剤、水性アルコール(hydroalcoholic)担体を含有する、治療用組成物を投与することを提供する。本願明細書において使用される語句「透過性増強剤」は、局所的適用もしくは全身性送達のいずれかについて、皮膚を超えた活性物質の経皮輸送の割合、又は活性物質の動物のような生物への使用及び送達を改善する物質を意味する。
【0043】
抗コリン作用薬又は鎮痙薬は、例えばオキシブチニン又はそれらの塩であることができる。オキシブチニンは、ラセミ体、S-エナンチオマー、又はR-エナンチオマーであることができる。一般にラセミ体オキシブチニンの一日量は、24時間にわたり約1〜20mgであり、オキシブチニンの個々のエナンチオマーの一日量は、対応するラセミ体投与量よりも少ないことが好ましい。より好ましくは、オキシブチニンのエナンチオマーの一日量は、24時間にわたり約0.5〜約15mgである。
本発明に有用である他の物質は、抗コリン作用薬又は鎮痙薬、例えばトルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、ボトックス、フラボキセート、プロパンテリン、ジシクロミン、又はフェニルプロパノラミン、イミプラミン、フルビプロフェンの一酸化窒素誘導体を含む。
【0044】
本発明に従い、本方法は、排尿筋の過活動、頻回の尿意切迫、低下した膀胱容積、増大した夜間排尿、尿意切迫、尿意切迫を伴う又は伴わない不随意排尿、及び/又は排尿痛もしくは排尿困難を含む不安定膀胱及び尿失禁の症候性治療を提供する。
有利なことに、本発明の組成物及び方法は、抗コリン作用薬又は鎮痙薬の定常的血漿濃度を提供し、望ましくない薬物濃度のピークを回避し、並びに/又はドライマウス、調節障害、悪心及び眩暈のような、好ましくも望ましくもない副作用を低下する。
【0045】
好ましい態様の詳細な説明
本発明のひとつの局面において、治療的に有効な抗コリン作用薬又は鎮痙薬を含有する新規局所的又は経皮的組成物が提供される。特に本発明は、哺乳類対象の皮膚又は粘膜の表面を超える抗コリン作用薬又は鎮痙薬の透過又は浸透を増強する組成物を提供する。本願明細書において使用される用語「経皮的(transdermal)」は、経皮的(又は「皮膚を通した(percutaneous)」)及び経粘膜的投与の両方、すなわち皮膚又は粘膜組織を通り及び血流への薬物の通過による送達を含むことを意図している。
驚くべきことに、尿素-含有化合物を含有する組成物は、対象の皮膚又は粘膜の表面を超える抗コリン作用薬又は鎮痙薬の浸透を増加することがわかった。
【0046】
本発明の組成物は、薬物の定常的血漿濃度を提供し、及び薬物のピーク濃度を回避することもわかった。有利なことに、ピーク濃度の回避は、好ましくも望ましくもない副作用の低下した発生に関連している。
本発明のひとつの局面において、治療的有効量の抗コリン作用薬もしくは鎮痙薬又はそれらの機能性誘導体、抗コリン作用薬の透過を増強するのに十分な量の尿素-含有化合物、及び局所的又は経皮的薬物送達に適した担体システムを含有する、局所的又は経皮的投与のための組成物が、提供される。
【0047】
尿素含有化合物は、下記一般式を有する:
【0048】
【化2】

【0049】
(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せを含む群から選択される官能基である。)。
【0050】
例証するが限定しない目的で、尿素-含有化合物は、下記表1に示されたような、尿素、それらの誘導体又はアナログで、1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸をもしくはそれらの誘導体含むものであることができる。
【0051】
【表1】

【0052】
好ましくは、尿素-含有化合物は、組成物の約1%〜20%の量で組成物中に存在する。
抗コリン作用薬又は鎮痙薬は、オキシブチニン又はそれらの医薬として許容できる塩であることができる。いくつかのオキシブチニン塩の例は、酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩、ナプシル酸塩、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩である。オキシブチニンは、ラセミ体又はS-エナンチオマーもしくはR-エナンチオマーのような単独の異性体として存在することができる。
【0053】
あるいは、トルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、ボトックス、フラボキセート、プロパンテリン、ジシクロミン、フェニルプロパノラミンなどの、他の抗コリン作用薬又は鎮痙薬が、使用されてもよく;フルビプロフェン(プロスタグランジン合成阻害薬)及びイミプラミン(顕著な全身性抗ムスカリン様作用を伴う抗欝薬)の一酸化窒素誘導体のような、他の物質を、以下の表2に示したように、使用することができる。好ましくは、抗コリン作用薬又は鎮痙薬は、オキシブチニンである。
【0054】
有利なことに、オキシブチニンに加えこれらの薬物は、対で言及される(to mention a couple)過活動膀胱及び尿失禁を含む状態に適応がある。従ってこれらの薬物の透過を増大することがわかっている尿素-含有化合物を含む本発明の組成物は、単に新規であるのみではなく、より少ない量の薬物を含有する組成物をここで製剤することができるので望ましくもある。
【0055】
オキシブチニン又は前記物質のような、抗コリン作用薬又は鎮痙薬を含有する経皮的又は局所的組成物は、非常に望ましい。経皮的及び局所的組成物は、胃腸管を迂回し、及び「初回通過作用」を受けないので、抗コリン作用薬又は鎮痙薬の血中濃度ピークが避けられる。オキシブチニンのような物質の血中濃度ピークは、ドライマウス、調節障害、悪心及び眩暈などの望ましくない副作用の発生に繋がることが多いことはわかっている。従って、肝臓における初回通過代謝を迂回することのひとつの利点は、薬物の経口投与と比べて増大した薬物のバイオアベイラビリティである。バイオアベイラビリティは、経皮的又は局所的に投与された薬物について増大されるので、望ましい治療作用に到達するために必要な総一日量は減少される。更に、抗コリン作用薬又は鎮痙薬及び尿素-含有化合物を含有する本組成物の増強された透過、相対的にその薬物のより大きい透過性、従ってバイオアベイラビリティと組合せて、本発明の経皮的又は局所的組成物の利点はより大きくさえなる。
【0056】
一般に、この組成物は、必要とする対象への適当な1日量を提供するのに十分な量で、抗コリン作用薬又は鎮痙薬を含有する。従って組成物中の抗コリン作用薬又は鎮痙薬の量は、変動することができ、並びに治療される疾患又は状態、特定の活性物質の性質及び活性、望ましい作用、可能性のある有害反応、活性物質がその意図された標的へ到達する能力及び速度、更には患者及び医師の具体的知識内である他の要因を含む、様々な要因により左右されるであろう。しかし好ましい組成物は、抗コリン作用薬又は鎮痙薬を、約0.1質量%〜20質量%、より好ましくは約0.5質量%〜10%、最も好ましくは約1質量%〜5質量%含有するであろう。
ひとつの好ましい本発明の態様において、ラセミ体オキシブチニンの1日量は、24時間にわたり約1〜20mgである。別の好ましい態様において、オキシブチニンの個々のエナンチオマーの1日量は、24時間にわたり約0.5〜約15mgである。
【0057】
本発明に従い、担体は、抗コリン作用薬又は鎮痙薬の経皮的又は局所的投与又は送達に適している。担体は、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテル、テトラグリコールフロール、又は水の少なくとも1種を含む。語句「ジエチレングリコールのモノアルキルエーテル」は、一般式C4H10O3(CnH2n+1)を有する物質を意味する(式中、nは1〜4である)。用語「テトラグリコール」は、グリコフロール、又はテトラヒドロフルフリルアルコールを意味する。更に用語「グリコール」は、プロピレングリコール、ジプロピレングリコール、ブチレングリコール、及び一般式HOCH2(CH2OH)nCH2OHを有するポリエチレングリコール(ここでエチレン基の数を表すnは、4〜200の間である)を含むが、これらに限定されるものではない、広範な化学物質を包含している。
【0058】
好ましくは、ジエチレングリコールのモノアルキルエーテルは、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル又はそれらの混合物であることができ、より好ましくはジエチレングリコールモノエチルエーテルである。好ましくは、多価アルコールは、プロピレングリコール、ジプロピレングリコール又はそれらの混合物であることができ、より好ましくはプロピレングリコールである。好ましくは、アルコールは、エタノール、プロパノール、イソプロパノール、1-ブタノール、2-ブタノール又はそれらの混合物であることができ、より好ましくはエタノールである。好ましくはジエチレングリコールのモノアルキルエーテルは、製剤の約1〜15%の量で存在し、多価アルコールは、製剤の約1〜15%の量で存在し、及びアルコールは、製剤の約5〜80%の量で存在する。この担体の平衡を構成するために、水を添加することができる。
【0059】
他の有用な担体は、多価アルコールと、ジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールいずれかの組合せを含む。好ましい多価アルコールは、プロピレングリコールである。この担体において、多価アルコールの、ジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールに対する相対比は、約1:1〜10:1であり、好ましくは2.5:1〜7:1である。多価アルコールの量は、担体の1〜50質量%であることができ、ジエチレングリコールのモノアルキルエーテル又はテトラグリコールフロールは、1〜50%、好ましくは2.5〜25%の量で存在する。本願明細書に明らかにされた種類の他の溶媒を、望ましいならば、これらの担体に添加することができるが、平衡を構成する水に加え、担体中に3又は4種よりも多い成分を有することは必要ではない。これらの担体の透過能は、本願明細書に明らかにされた尿素又は尿素誘導体の存在により増強することができる。
【0060】
この組成物は、経皮的又は経粘膜的投与に適した形である。好ましくは、この製剤はゲル剤である。しかしあるいはこの製剤は、スプレー剤、軟膏剤、エアゾール剤、ローション剤、液剤、乳剤、フォーム、ミクロスフェア、ナノスフェア、マイクロカプセル剤、ナノカプセル剤、リポソーム、ミセル、クリーム剤、貼付剤の形、更には他の当該技術分野において公知の局所的又は経皮的の形状であってもよい。
この組成物は、例えば口内錠及び舌下錠、坐剤、経膣投与剤形、経皮的貼付剤、救急絆、又は他の閉鎖もしくは非-閉鎖包帯、又は対象の皮膚又は粘膜の表面を通り吸収するための他の受動的もしくは能動的経皮的用具などであるが、これらに限定されないものにより、皮膚又は粘膜の表面へ、直接又は間接に適用することができる。本願明細書において使用される語句「非-閉鎖」は、例えば長期間適用部位で皮膚上に留まる貼付剤用具、固定された貯蔵庫、アプリケーションチャンバー、テープ、救急絆、粘着性膏薬などにより、大気から皮膚を閉じ込めることも隔離することもしないシステムを意味する。
【0061】
本発明の組成物は、様々な形であることができる。例証するが限定しない目的で、本発明の組成物の様々な可能性のある形は、ゲル剤、軟膏剤、クリーム剤、ローション剤、ミクロスフェア、リポソーム、ミセル、及び経皮的貼付剤を含む。
軟膏剤は一般に、典型的にはワセリン又は他の石油系誘導体を基にした半固形調製物である。語句「半固形」製剤は、ひとつの固相が、第二の液相中に分散されている不均質なシステムを意味する。これらは一般には、最適な薬物送達、及び好ましくは皮膚軟化性を提供する。油性軟膏基剤は、例えば、植物油、動物から得られる脂肪、及びワセリンから得られる半固形炭化水素を含む。乳化可能な軟膏基剤は水をほとんど又は全く含まず、無水ラノリン又は親水性ワセリンを含むことができる。エマルション軟膏基剤は、油中水型(W/O)乳剤又は水中油型(O/W)エマルションのいずれかであり、例えばセチルアルコール、グリセリルモノステアレート、ラノリン及びステアリン酸を含むことができる。好ましい水溶性軟膏基剤は、様々な分子量のポリエチレングリコールから調製される。
【0062】
クリーム剤は一般に、粘度のある液体又は半固形の乳剤、例えば水中油型又は油中水型である。クリーム基剤は典型的には、水で洗浄可能であり、油相、乳化剤及び水相を含む。油相は、「内相」とも称され、一般にワセリン及び脂肪族アルコール、例えばセチルアルコール又はステアリルアルコールで構成される。水相は通常容積が油相よりも多くはなく、一般に湿潤剤を含有するが必ずしもではない。クリーム製剤中の乳化剤は一般に、非イオン性、アニオン性、カチオン性又は両性界面活性剤である。
【0063】
ゲル剤は、半固形の懸濁型システムである。単相ゲル剤は、典型的には水性である、担体液体全体に実質的に均質に分散された高分子(ポリマー)を含有する。しかしゲル剤は、アルコール及び任意に油分を含むことが好ましい。ゲル化剤としても公知である好ましいポリマーは、架橋したアクリル酸ポリマー、ポリエチレンオキシド、ポリオキシエチレン-ポリオキシプロピレンコポリマー及びポリビニルアルコール;セルロース系ポリマー(ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルメチルセルロースフタレート、メチルセルロース);トラガカントガム及びキサンタンガムなどのガム類;アルギン酸ナトリウム;並びに、ゼラチンである。均質なゲル剤を調製するために、アルコールもしくはグリセリンのような分散剤を添加するか、又はゲル化剤を、摩砕、機械的混合もしくは攪拌、又はそれらの組合せにより分散することができる。
【0064】
ローション剤は一般に、摩擦を伴わずに皮膚表面へ適用される調製物と定義される。これらは典型的には、活性成分を含有する固形粒子が水又はアルコール基剤中に存在するような、液体又は半液体調製物である。ローション剤は通常、固形物の懸濁剤であり、本目的のためには好ましくは、水中油型の液体油状乳剤を含む。ローション剤は、より流動性(more fluid)の組成物を適用することは容易であるので、大きい体表面積を処置するために好ましい。一般に、ローション剤中の不溶性物質は、細かく分割されることが必要である。ローション剤は典型的には、より良い分散を作製するための懸濁化剤に加え、皮膚と接触する活性物質を局在化し及び保持するのに有用な化合物、例えばメチルセルロース、カルボキシメチル-セルロースナトリウムなどを含有するであろう。
【0065】
リポソームは、脂質二重層により構成された脂質壁を有する微視的ベシクルであり、ここで薬物送達システムとしても使用することができる。一般にリポソーム製剤は、溶けにくい又はほとんど溶けない医薬物質にとって好ましい。本発明で使用するためのリポソーム調製物は、カチオン性(正帯電した)、アニオン性(負帯電した)及び中性の調製物を含む。カチオン性及びアニオン性リポソームは、容易に入手可能であるか、又は容易に入手可能な材料、中でもホスファチジルコリン、コレステロール、ホスファチジルエタノールアミン、ジオレイルホスファチジルコリン(DOPC)、ジオレイルホスファチジルグリセロール(DOPG)、ジパルミトイル(diopalmitoyl)ホスファチジルコリン(DPPC)、ジパルミトイルホスファチジルグリセロール(DPPG)、ジオレイルホスファチジルエタノールアミン(DOPE)を含む材料などを使用し、容易に調製することができる。これらの材料を使用するリポソームの作製法は、当該技術分野において周知である。
【0066】
当該技術分野において公知のようにミセルは、それらの極性ヘッド基が外側の球状シェルを形成すると同時に、それらの疎水性炭化水素基はその球の中心を向き、コアを形成するように配列された、界面活性剤分子を含む。ミセルは、ミセルが自然に生じるのに十分に高い濃度で界面活性剤を含有する水溶液中に形成される。ミセルの形成に有用な界面活性剤は、ラウリン酸カリウム、オクタンスルホン酸ナトリウム、デカンスルホン酸ナトリウム、ドデカンスルホン酸ナトリウム、ラウリル硫酸ナトリウム、ドキュセートナトリウム、デシルトリメチルアンモニウムブロミド、ドデシルトリメチルアンモニウムブロミド、テトラデシルトリメチルアンモニウムブロミド、テトラデシルトリメチル-アンモニウムクロリド、ドデシルアンモニウムクロリド、ポリオキシル8ドデシルエーテル、ポリオキシル12ドデシルエーテル、ノノキシノール10及びノノキシノール30を含むが、これらに限定されるものではない。ミセル製剤は、局所的又は経皮的送達システムの貯蔵庫、又は体表表面に適用される製剤のいずれかへ混入することにより、本発明と組合せて使用することができる。
【0067】
ミクロスフェアは一般に、薬物又は薬物-含有製剤をカプセル封入している。これらは一般に脂質、好ましくはリン脂質のような帯電した脂質から形成されているが、しかし必ずしもではない。脂質ミクロスフェアの調製は、当該技術分野において周知であり、関連した書籍及び文献に説明されている。
前述のように、本組成物は、経皮的貼付剤の形であることができる。一般に経皮的貼付剤は、組成物又は製剤を含有する接着層又はマトリックス、組成物又は製剤及び接着剤が非透過性である裏当て層、並びに保護的ライナーが貼付剤使用者により剥離されるまで、組成物又は製剤がライナーにより被覆され及び露出されないようにする接着層に剥離可能に接着された保護的ライナーを備える。典型的には貼付剤接着層又はマトリックスは、貼付剤使用者へ投与されるべき1種又は複数の活性物質のための担体として利用される。あるいは、追加の活性物質、又は薬物を運搬するかもしくは速度制御膜として作用するように使用される当該技術分野において周知の無毒のポリマーを含むために、追加層が、貼付剤の接着層又はマトリックス層と、裏当て層の間に備えられてもよい。
【0068】
本発明の組成物は、当業者に公知のように、様々な添加剤も含有することができる。例えば、溶媒、湿潤剤、乳白剤、酸化防止剤、香料、着色剤、ゲル化剤、増粘剤、安定化剤、界面活性剤、抗微生物薬などを、組成物に添加することができる。
例証する目的で、適当な溶媒は、エタノール、イソプロパノール、グリコール、グリコフロール、ジメチルイソソルビド、ジエチレングリコールアルキルエーテル、ポリエチレングリコール、及びエトキシル化されたアルコールを含むが、これらに限定されるものではない。
抗微生物薬が、貯蔵時の腐敗を防止するため、すなわち酵母及びカビのような微生物の増殖を阻害するために、本発明に添加されてもよい。適当な抗微生物薬は、典型的にはp-ヒドロキシ安息香酸のメチル及びプロピルエステル(すなわち、メチル及びプロピルパラベン)、安息香酸ナトリウム、ソルビン酸、イミド尿素、及びそれらの組合せからなる群より選択される。
【0069】
ゲル化剤は、例えばカルボマー、カルボキシエチレン又はポリアクリル酸、例えばカルボマー980又は940 NF、981又は941 NF、1382又は1342 NF、5984又は934 NF、ETD 2020、2050、934P NF、971P NF、974P NF及びカルボマー誘導体;セルロース誘導体、例えばエチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、エチル-ヒドロキシエチルセルロース(EHEC)、カルボキシメチルセルロース(CMC)、ヒドロキシプロピルセルロース(HPC)、ヒドロキシエチルセルロース(HEC)、天然ゴム、例えばアラビアゴム、キサンタンゴム、グアールガム、アルギン酸塩、ポリビニルピロリドン誘導体;ポリオキシエチレンポリオキシプロピレンコポリマーなど;その他、キトサン、ポリビニルアルコール、ペクチン、ビーガムグレードなどを含むことができる。他の本発明に適用するのに適したゲル化剤は、カルボマーを含むが、これに限定されるものではない。あるいは当業者に公知の他のゲル化剤又は増粘剤(viscosant)も、使用することができる。ゲル化剤又は濃厚剤は、当業者に公知のように、ポリマーの種類に応じて約0.2〜約30質量%で存在することができる。
【0070】
保存剤は、塩化ベンザルコニウム及び誘導体、安息香酸、ベンジルアルコール及び誘導体、ブロノポール、パラベン、セントリミド、クロルヘキシジン、クレゾール及び誘導体、イミド尿素、フェノール、フェノキシエタノール、フェニルエチルアルコール、フェニル第二水銀塩、チメロサール、ソルビン酸及び誘導体などである。保存剤は、化合物の種類に応じて約0.01〜約10質量%で存在する。
酸化防止薬は、トコフェロール及び誘導体、アスコルビン酸及び誘導体、ブチル化されたヒドロキシアニソール、ブチル化されたヒドロキシトルエン、フマル酸、リンゴ酸、没食子酸プロピル、メタビススルフェート及び誘導体などであるが、これらに限定されるものではない。酸化防止薬は、化合物の種類に応じ、約0.001〜約5.0質量%で存在する。
【0071】
緩衝剤は、例えば炭酸緩衝剤、クエン酸緩衝剤、リン酸緩衝剤、酢酸緩衝剤、塩酸、乳酸、酒石酸、ジエチルアミン、トリエチルアミン、ジイソプロピルアミン、アミノメチルアミンなどである。しかし当該技術分野において公知の他の緩衝剤も含まれて良い。緩衝剤は、製剤中の水の量の最大100%と交換することができる。
湿潤剤は、グリセリン、プロピレングリコール、ソルビトールなどである。湿潤剤は、化合物の種類に応じて約1〜10質量%で存在する。
金属イオン封鎖剤は、エデト酸などである。金属イオン封鎖剤は、化合物の種類に応じて約0.001〜約5質量%で存在する。
【0072】
保湿剤は、ドキュセートナトリウム、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンひまし油誘導体、ポリオキシエチレンステアレート、ポリオキシエチレンソルビタン脂肪酸エステル、ラウリル硫酸ナトリウムなどである。保湿剤は、化合物の種類に応じて約1.0〜約5質量%で存在する。
界面活性剤は、アニオン性、非イオン性、又はカチオン性界面活性剤を含む。界面活性剤は、化合物の種類に応じて約0.1〜約30質量%で存在する。
皮膚軟化剤は、セトステアリルアルコール、セチルエステルワックス、コレステロール、グリセリン、グリセロールの脂肪酸エステル、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、レシチン、軽質鉱油、鉱油、ワセリン、ラノリン、及びそれらの組合せなどであるが、これらに限定されるものではない。皮膚軟化剤は、化合物の種類に応じて約1.0〜約30.0質量%で存在する。
【0073】
追加の透過性増強剤(複数)を、この製剤に混入することができるが、好ましい態様において、尿素は、あらゆる他の透過性増強剤を伴わずに投与される。適当な二次的増強剤(又は「共-増強剤」)の例は、「Percutaneous Penetration Enhancers」Smithら編集の著書(CRC Press, 1995)に列記された化合物を含むが、これらに限定されるものではなく、その内容は本願明細書に参照として組入れられている。
例えば、ジメチルスルホキシド及びデシルメチルスルホキシドなどの、スルホキシド;ラウリン酸ナトリウム、ラウリル硫酸ナトリウム、セチルトリメチルアンモニウムブロミド、塩化ベンザルコニウム、ポロキサマー(231, 182, 184)、ツイーン(20, 40, 60, 80)及びレシチンなどの、界面活性剤;1-置換されたアザシクロヘプタン-2-オン、特に1-n-ドデシルシクロアザシクロヘプタン-2-オン;ラウリルアルコール、ミリスチルアルコール、オレイルアルコールなどの、脂肪族アルコール;ラウリン酸、オレイン酸及び吉草酸などの、脂肪酸;ミリスチン酸イソプロピル、パルミチン酸イソプロピル、プロピオン酸メチル、及びオレイン酸エチルなどの、脂肪酸エステル;プロピレングリコール、エチレングリコール、グリセロール、ブタンジオール、ポリエチレングリコール、及びポリエチレングリコールモノラウレート、アミド及び他の窒素系化合物、例えばジメチルアセトアミド(DMA)、ジメチルホルムアミド(DMF)、2-ピロリドン、1-メチル-2-ピロリドン、エタノールアミン、ジエタノールアミン及びトリエタノールアミン、テルペンなどの、ポリオール及びそれらのエステル;アルカノン、及び有機酸、特にサリチル酸及びサリチル酸塩、クエン酸及びコハク酸である。
【0074】
あるいは本発明での使用に適している他の透過性増強剤(複数)は、当業者に公知であることができる。透過性増強剤は、化合物の種類に応じて約0.1〜約30.0質量%で存在する。好ましくは二次的透過性増強剤は、脂肪族アルコール及び脂肪酸であり、より好ましくは脂肪族アルコールである。好ましい脂肪族アルコールは、式CH3(CH2)n(CH)mCH2OHを有する(式中、nは(8-m)〜(16-m)であり、及びm=0〜2である。)。
【0075】
本発明の組成物は、当業者の技術の範囲内である、薬物製剤、特に局所的及び経皮的薬物製剤の通常の技術により製造することができる。このような技術は、「Encyclopedia of Pharmaceutical Technology」第2版、J. Swarbrick及びJ. C. Boylan編集、Marcel Dekker, Inc., 2002に明らかにされており、その内容は本願明細書に参照として組入れられている。
前述のように、好ましい態様のひとつにおいて、本発明は、抗コリン作用薬又は鎮痙薬、好ましくはオキシブチニンの経皮的投与の組成物を提供する。先に指摘したように、これらの組成物は、当業者に容易に理解されるように、様々な状況において有用であろう。例えば好ましい物質、オキシブチニンは、頻回の尿意切迫、増大した夜間排尿、尿意切迫、尿意切迫を伴う又は伴わない不随意排尿(尿失禁)、排尿痛もしくは排尿困難を伴う、排尿筋の過活動(膀胱筋の過活動)の治療に適応である。一般に、しかし必ずしもではないが、これらの障害は、神経因性膀胱により引き起こされる。Guittardらの米国特許第5,674,895号を参照し、その内容は本願明細書に参照として組入れられている。加えてオキシブチニンは、排尿筋反射亢進(hyperreflexia)及び不安定排尿筋などの、オキシブチニンの経皮的投与に反応する他の状態及び障害を治療することができる。他の抗コリン作用薬又は鎮痙薬も、過活動膀胱及び/又は尿失禁の症候性治療に適応である。従って、本発明の別の局面において、対象における過活動膀胱又は尿失禁の治療の方法を提供する。
【0076】
ひとつの態様において、この方法は、抗コリン作用薬又は鎮痙薬を含有する治療的組成物、尿素-含有化合物を含む透過性増強剤、及び局所的又は経皮的送達に適した水性アルコール担体を、必要な対象へ投与することを含む。
抗コリン作用薬又は鎮痙薬は、例えば、オキシブチニン又はそれらの塩である。オキシブチニンは、ラセミ体、S-エナンチオマー、又はR-エナンチオマーの形であることができる。本発明において有用な他の抗コリン作用薬又は鎮痙薬は、下記表2に例示されており、これはトルテロジン、フェソテロジン、デュロキセチン、ソリフェナシン、トロスピウム、フルビプロフェンの一酸化窒素誘導体、ボトックス、フラボキセート、イミプラミン、プロパンテリン、ジシクロミン、フェニルプロパノラミンを含む。好ましくは、この組成物は、オキシブチニンを含有する。
【0077】
【表2】

【表3】

【0078】
好ましくは、抗コリン作用薬又は鎮痙薬の量は、組成物の質量で約0.1〜約20%、より好ましくは約0.5%〜約10%、最も好ましくは約1%〜約5%である。好ましくはこの物質は、オキシブチニン又はそれらの医薬として許容できる塩である。好ましくは、ラセミ体オキシブチニンの一日量は、24時間にわたり約1〜20mg、好ましくはオキシブチニンの個々のエナンチオマーの一日量は、好ましくは対応するラセミ体投与量よりも少なく、24時間にわたり約0.5〜約15mgである。
【0079】
対象における過活動膀胱又は急迫尿失禁を治療するための本方法は、より多くの患者の服薬遵守を提供する。本方法は、尿素-含有化合物の透過性増強剤に関連した薬物のより大きいバイオアベイラビリティを提供するのみでなはく、定常的血漿薬物濃度も提供することがわかっている。従って患者へ投与される組成物は、治療的作用、すなわちより大きいバイオアベイラビリティを実現するためにより少ない量の薬物を含有し、及び血漿薬物濃度の一般的ピークを避ける。加えて、このオキシブチニン:代謝産物の比は、他のオキシブチニン組成物よりも高いことがわかっている。従って本発明の方法は、オキシブチニン投与された組成物に関連した一般に望ましくない副作用の発生の数及び/又は強度を有利に低下する。いくつかの一般的な望ましくない副作用は、ドライマウス、調節障害、悪心及び眩暈を含む。従って本発明の方法は、より多くの患者の服薬遵守を提供するであろう。
【0080】
有利なことに、本発明の方法は、排尿筋の過活動、頻回の尿意切迫、低下した膀胱容積、増大した夜間排尿、尿意切迫、尿意切迫を伴う又は伴わない不随意の排尿(尿失禁)、及び/又は排尿痛もしくは排尿困難を含む、多くの状態の症候性治療を提供する。
本発明は、それらの好ましい特異的態様と組合せて説明されるが、前記説明は、本発明の範囲を例証するが、限定するものではないことを意図することが理解されるべきである。他の局面、利点及び修飾は、本発明が関連する技術分野の業者には明らかであろう。
【0081】
実施例
下記実施例は、本発明を単に例証するものであり、これらはいかなる意味においても本発明の範囲を限定するとは考えられず、これらの実施例及びそれらの他の同等物は、本発明の開示及び添付された「特許請求の範囲」を考慮し、当業者に明らかであろう。
【0082】
実施例1
オキシブチニン主薬(base)3.00質量%、エタノール54.22質量%、精製水17.23質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 6.00%で構成されたゲル剤、エタノール/プロピレングリコール/ジエチレングリコールモノエチルエーテル/BHT混合液中にオキシブチニン主薬を溶解することにより調製した。その後精製水を添加し、0.1N塩酸でpHを調節した。次にヒドロキシプロピルセルロースを、水性アルコール溶液中に、製剤の良好な均質化を確実にする一方で、完全に膨潤するまでの塊形成及び空気の捕獲を避けるのに適当な速度で室温で機械的に攪拌しながら、完全に分散した。
【0083】
実施例2
オキシブチニン主薬3.00質量%、エタノール50.72質量%、精製水14.73質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、尿素5.00%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 7.00%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
実施例3
オキシブチニン主薬3.00質量%、エタノール34.22質量%、イソプロパノール20.00質量%、精製水20.23質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 3.00%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
【0084】
実施例4
オキシブチニン主薬3.00質量%、エタノール66.50質量%、精製水22.39質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、塩酸(HCl)0.1M 6.11%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
実施例5
オキシブチニン主薬3.00質量%、エタノール30.72質量%、イソプロパノール20.00質量%、精製水19.15質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、尿素5.00質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 2.58%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
【0085】
実施例6
オキシブチニン主薬3.00質量%、エタノール70.00質量%、精製水8.19質量%、尿素5.00質量%、ヒドロキシプロピルセルロース(KLUCEL(商標)MF Pharm)2.00質量%、ブチルヒドロキシトルエン(BHT)0.05質量%、塩酸(HCl)0.1M 11.76%で構成されたゲル剤を、実施例1に説明された製造法に従い調製した。
【0086】
In Vitro比較試験
ブタ耳皮膚を通るin vitro薬物透過及び生態分布実験を、Franz Vertical Diffusion Cell拡散チャンバーを用いて行った。ヒト皮膚を通るin vitro皮膚浸透試験は、ヒト皮膚を入手することができないために制限されている。ブタの耳の皮膚は、化学物質の経皮吸収の評価におけるヒト皮膚に最も近いモデルとして使用することができることが文献に広範説明されている。
【0087】
In Vitro透過実験
食肉処理場から入手した新鮮なブタ死体の耳の皮膚を、標準の操作手法に従い処理した。これらの耳を、それらの完全性(咬傷、擦過傷又は発赤の不在)及び状態について評価した。皮膚は、外科用メスを使用し耳から切出し、穿孔又は損傷を避けた。切出した皮膚試料を、PBS溶液ですすぎ、皮膚ディスクをうまく穿孔するために表面上に配置した。皮膚ディスク片を、表面積1.77cm2を有する垂直拡散セルの区画の間に搭載し、表皮面を上側にした。先に例示された経皮的用具の10又は50mgを、表皮層の上に適用し、他方で真皮層を受容体溶液と接触する:2.0質量/容量%ポリオキシエチレン20オレイルエーテル(Oleth 20)、PBSでpH7.4。受容体チャンバーは、35℃で維持し、本試験を、非-閉鎖条件下及び攪拌速度600rpmで行った。所定の時点で、試料を、受容体溶液から採取し、受容体チャンバーを、新鮮な溶液で直ぐに満たした。受容体溶液(透過した薬物)から採取した全ての試料を、高速液体クロマトグラフィー(HPLC)法を用いて分析した。試験期間中に透過した薬物の総量(mcg/cm2)及び経皮的フラックス(mcg/cm2/h)を、各試験について決定した。
【0088】
先に説明した「Drug Permeation Studies」の全てを、以下の条件下で実行した:Franz Vertical Diffusion Cells (Hanson Research Inc.)を用い、ブタ耳皮膚を、実験モデルとして使用した。受容体溶液は、2質量%ポリオキシエチレン20オレイルエーテル(Oleth 20)、PBS 10mMでpH7.4であった。実験を、非-閉鎖条件下で、35℃で攪拌速度600rpmで行った。試験の開始前に、皮膚片を、透過セルに搭載し、受容体溶液と接触しながら35℃で維持した。製剤を皮膚上に負荷した後に、指定した時点で、受容体溶液1mlを採取し、その受容体チャンバーを、新鮮な溶液で直ぐに満たした。
添付図は、本願明細書に説明された発明を更に例証する試験を表している。図面は、例証を目的とし、及び本発明を限定するものではない。図1に関して、尿素を含有する組成物は、24時間後に蓄積され透過されたオキシブチニンの量を6.7倍増加する、すなわち、5%尿素を含有する実施例6については2.73%に対し、尿素を含有しない参照製剤である実施例4については0.47%であることを明らかにするグラフが提供される。
【0089】
図2に関して、グラフは、オキシブチニン、水性アルコール担体、追加の溶媒、すなわちジエチレングリコールモノエチルエーテル及びプロピレングリコールを含み、及び尿素を含まない組成物を、オキシブチニン、水性アルコール担体、追加の溶媒、及び尿素を含む組成物と比較する、24-時間in vitro比較透過試験の結果を例示している。示されたように、24時間透過後に、蓄積され透過されたオキシブチニンの量は、尿素を含まない参照組成物の実施例1よりも5%量の尿素を含む実施例2について、有意に高い。これは尿素を含む。これらの結果は、各々、11.4%、対、5.5%の透過性を示している。
【0090】
図3は、最大経皮的オキシブチニンフラックスは、実施例2において、実施例1よりもほぼ2倍高く、各々、1.17μg/cm2h、対、0.59μg/cm2hであることを示している。加えてこれらの結果は、尿素を含まない実施例1については、最大経皮的オキシブチニンフラックスに16時間後に到達し、実施例2については、最大経皮的オキシブチニンフラックスに少なくとも20時間後に到達することを示している。従って、組成物中の尿素の存在は、経皮的オキシブチニン透過を増強し、同じくオキシブチニン最大経皮的即時フラックス(instant flux)を遅延し、及びオキシブチニン最大経皮的即時フラックスを持続する。これは、本発明の組成物の反復適用後のin vivoにおける持続されたオキシブチニン血漿レベルに寄与する。
【0091】
ここで図4に関して、グラフは、先に説明された実施例3、5、及び2を比較する透過試験の結果を例示している。24時間後に相対蓄積され透過されたオキシブチニンの量は、各実施例について類似しており、すなわちほぼ8%であった。ここで図5に関して、3種の組成物は、図4に示されたオキシブチニンの蓄積され透過された量に類似性を示すが、図5は、実施例3、5、及び2は、同様の最大経皮的オキシブチニンフラックス(0.80μg/cm2hに近い)を示すこと、しかし最大経皮的オキシブチニンフラックスは、尿素を含まない実施例3について、12時間後に到達すること、両方とも尿素を含む実施例5については16時間後に、実施例2については20時間後に到達することを例示している。従って尿素を含有する両組成物、実施例2及び5は、より長期間(「定常状態」)維持された経皮的オキシブチニンフラックスを有する。
【0092】
健常志願者におけるオキシブチニンゲル剤製剤のパイロット薬物動態試験
パイロット試験は、2004年1月22日から2月12日の間にScope International (ハンブルグ, 独国)で行い、オキシブチニン及びその代謝産物N-デスエチルオキシブチニンの薬物動態を決定した。本試験及びその結果を以下に示す。
【0093】
対象及び方法
健常な白人女性で年齢20〜55歳を、本試験のために募集した。対象は、体格指数20〜28kg/m2(体重(kg)を身長(m)の二乗で除算)、非-喫煙者及び慢性の医学的疾患の既応又はアルコールもしくは薬物耽溺の病歴のないものであった。対象は、試験期間中にリスクをもたらすような、状態を予め経験した又は試験前実験の所見を基に除外した。書面によるインフォームドコンセントを、本試験の議論及び説明後に、いずれかの試験-関連した手法に参加する前に、各対象から得た。
【0094】
処置は、オープンラベル式反復投与用量漸増決定パイロット薬物動態試験に従い投与し、経皮的オキシブチニンゲル剤を含んだ。一日量を7日間投与することにより、定常状態を実現した。対象は、被験投薬(経皮的ゲル剤)が1日1回適用される2試験期間に参加した。ゲル剤2g(オキシブチニン投与量60mgに相当)は、第一の試験期間中は毎日適用し(処置A)、その後1g(オキシブチニン投与量30mgに相当)を、第二試験期間中適用した(処置B)。7日間の休薬期間を、ふたつの試験期間の間に認めた。両投与量を、同じ対象において試験した。このデザインは、対象内の同じ製剤の異なる用量間の比較を可能にし、対象間変動を排除する。この試験において投与されるオキシブチニンゲル剤は、オキシブチニン主薬3.00質量%、ジエチレングリコールモノエチルエーテル2.50質量%、プロピレングリコール15.0質量%、尿素5.00質量%、エタノール50.7質量%、ヒドロプロピルセルロースKLUCEL HF 2.00質量%、塩酸0.1N 8.50質量%、ブチルヒドロキシトルエン0.05質量%、及び精製水適量を含有した。
本試験の主な目的は、8名の健常女性志願者に製品を投与し、2種の異なる投与量で投与される、オキシブチニンゲル製剤の薬物動態パラメータを評価することである。ピーク時の物質濃度(Cmax)、ピーク到達時間(tmax)及び濃度/時間曲線下面積(AUC)に関するデータを、オキシブチニン及びN-デスエチルオキシブチニンの両方について計算した。
本試験の第二の目的は、有害事象、皮膚の忍容性、生命徴候、例えば血圧及び心拍数などの安全性パラメータを記録することであった。
【0095】
薬物動態試験結果
図6に関して、このグラフは、処置A及び処置Bからの平均オキシブチニン血漿濃度プロファイルを例示している。24時と168時の間に認められるように、オキシブチニン投与量の半量への、すなわち2gから1gへのゲル剤の減量は、平均オキシブチニン血漿レベルの1.93-倍の低下(SD 1.08)、すなわち、約4.3ng/ml(SD 2.6)から約2.6ng/ml(SD 1.9)への低下を示した。認められるように、適用されたオキシブチニン用量と得られるオキシブチニン血漿レベルの間にほぼ直線の相関関係が存在する。これに関して、下記表10、11、及び12は、各々、個別の採取時点で採取された、処置A及びBに関するオキシブチニン:代謝産物の血漿比、オキシブチニン処置A:オキシブチニン処置Bの血漿比、及び代謝産物処置A対代謝産物処置Bの血漿比を示している。
【0096】
ここで図7に関して、グラフは、処置A及び処置BのN-デスエチルオキシブチニン血漿濃度プロファイルを例示している。図6同様に、オキシブチニン投与量の半量への、すなわち2gから1gへのゲル剤の減量は、平均N-デスエチルオキシブチニン血漿レベルの2.06-倍の低下(SD 1.17)、すなわち約4.7ng/ml (SD 3.3)から約2.4ng/ml(SD 1.2)への低下を生じた。従って、適用されたオキシブチニン用量と得られるN-デスエチルオキシブチニン血漿レベルの間にはほぼ直線の相関関係が存在する。
オキシブチニンの一日量の低下は、試験期間(各7日間)を通じた、平均血漿オキシブチニン及び平均血漿N-デスエチルオキシブチニンレベルのより低い変動性を生じた。いかにして処置B(オキシブチニン一日量30mgに相当)で得られたN-デスエチルオキシブチニンのプロファイルは顕著に「平坦化」するか、及びN-デスエチルオキシブチニン平均血漿濃度がいかに低いかも注目に値する。結果的に、これらの組成物及び方法は、オキシブチニン-関連した副作用発生率の低下を提供するか、又はより低い-強度のオキシブチニン-関連した副作用を提供する。
【0097】
図8は、処置A時のオキシブチニン及びN-デスエチルオキシブチニンの展開(evolution)を示している。下記表3に示されるように、平均オキシブチニン血漿濃度の平均N-デスエチルオキシブチニン血漿濃度に対する比は、一定であり、1に近い(平均1.10;SD 0.67)。これに関して、下記表6及び8は、各々個別の試料採取時点での、処置Aのオキシブチニン濃度及び処置Aの代謝産物濃度を示している。
【0098】

【0099】
図9に関して、グラフは、処置Bの間のオキシブチニン及びその代謝産物N-デスエチルオキシブチニンの展開を明らかにしている。処置A同様に、並びに下記表5及び表6に示されるように、平均オキシブチニン血漿濃度の平均N-デスエチルオキシブチニン血漿濃度に対する比は、一定であり、及び1に近い(平均1.14;SD 0.57)。
【0100】

【0101】
従って、オキシブチニン1日量の減少は、試験期間(各7日間)中を通じて、平均オキシブチニンのN-デスエチルオキシブチニン平均血漿濃度に対するより高い及びより低い変動比を生じた。これに関して、下記表7及び9は、各々個別の試料採取時点での、処置Bのオキシブチニン濃度、及び処置Bの代謝産物濃度を示している。
【0102】
結論として、得られたオキシブチニン:N-デスエチルオキシブチニン比は、オキシブチニンの経口投与に関連した比よりも、両方の処置において投与されるオキシブチニンゲル剤についてはるかに高かった。Zobristらの論文(Mayo Clin Proc, June 2003, Vol 78)を参照し、これは本願明細書に参照として組入れられている。従って、経皮的投与により提供されるより高い比は、オキシブチニン-関連した副作用のより少ない発生及び/又はオキシブチニン-関連した副作用のより少ない強度に寄与すると考えられる。
【0103】
更に、オキシブチニンゲル剤に関する得られたオキシブチニン:N-デスエチルオキシブチニン比は、当該技術分野において公知であり及び下記表5に示されたような、マトリックス-型経皮的システムによるオキシブチニンの投与後に得られた比と同等であるか又はこれよりも更に高い。Zobristらの論文(Mayo Clin Proc, June 2003, Vol 78)を参照し、これは本願明細書に参照として組入れられている。
【0104】

【0105】
透過性比較試験
尿素のオキシブチニンに対する優れた透過作用を例証するために、尿素は、ふたつの公知のオキシブチニンの透過性増強剤、すなわちミリスチン酸イソプロピル及びラウリン酸と比較した。これらの製剤は、以下に表される。
【0106】

量は、質量%として表している。
【0107】
比較試験の結果は、図10及び11に示している。図10のグラフにより例示されたように、尿素含有する製剤は、オキシブチニンの透過性をラウリン酸と比べ63%増強する。同じく図10に例示したように、ミリスチン酸イソプロピルを含有する製剤は、尿素製剤のものに類似した蓄積されたオキシブチニン透過量を示す。しかしミリスチン酸イソプロピルを含有する製剤は、その製剤の不安定性のために、医薬として好ましくないことがわかった。ミリスチン酸イソプロピルの必要量は、本発明の水性アルコールビヒクル中に溶解することが困難である。従って、ミリスチン酸イソプロピルは、わずかに数時間内で、コアレッセンスとして公知の現象である迅速かつ広範な相分離を示す。
【0108】
図11に示されたように、フラックスプロファイルグラフは、最大フラックスは、尿素含有製剤について、ラウリン酸及びミリスチン酸イソプロピルを含有する製剤よりも、各々、80%及び22%より高いことを示している。更に最大フラックスは、ラウリン酸製剤については24時間後に到達せず、及びミリスチン酸イソプロピル製剤に関しては12時間後には到達しない。まとめると、より高い透過量及びより高い最大フラックスにより例証されるように、尿素は、オキシブチニンについてラウリン酸よりも優れた透過性増強剤である。更に、より高い最大フラックス及び優れた物理的安定性により示されるように、尿素は、オキシブチニンについてミリスチン酸イソプロピルよりも優れた透過性増強剤である。
【0109】
本発明の製剤は、他の公知の透過性増強剤、すなわちトリアセチン及びグリセロールモノオレエートを含有する2種の他の製剤とも比較した。比較製剤は以下に示している。
【0110】

量は、質量%として表している。
【0111】
本比較例の結果は、図12及び13に示している。図12関して、尿素含有する製剤は、トリアセチン含有する製剤及びグリセロールモノオレエート含有する製剤と比べ、オキシブチニンの絶対経皮吸収を各々、38%及び57%増大している。24時間後の相対経皮的吸収も、尿素含有する製剤について、トリアセチン含有する製剤及びグリセロールモノオレエート含有する製剤と比べ、各々41%及び56%増大される。
【0112】
ここで図13に関して、最大及び定常状態フラックスも、尿素含有する製剤についてより高い。尿素含有する製剤についての定常-状態フラックスは、トリアセチン含有する製剤及びグリセロールモノオレエート含有する製剤よりも、90%より高い。更に最大フラックスは、グリセロールモノオレエートについてのように、20-時間で到達するが、トリアセチン含有する製剤よりも8-時間遅い。例証されたように、トリアセチン製剤は、その最大フラックスに12-時間で到達する。この比較は、20時間から24時間の間に、最大フラックスは、グリセロールモノオレエートについて27%(24時の0.104μg/cm2h、対、20時の0.143μg/cm2h)、及び尿素についてわずかに4%(24時の0.190μg/cm2h、対、20時の0.198μg/cm2h)減少するので、オキシブチニンの持続放出能は、尿素含有する製剤について、グリセロールモノオレエート含有する製剤よりもより高いことを示している。従って本試験は、24-時間の蓄積したオキシブチニン透過した量及びより高い最大フラックスにより明らかにされるように、尿素は、グリセロールモノオレエート又はトリアセチンのいずれかよりもより良い透過性増強剤であることを例示している。更に尿素含有する製剤は、in vivoにおいてオキシブチニン血中レベルのより少ない変動、及び結果的に望ましくない副作用のより少ない発生に寄与する持続した定常-状態を示す。
【0113】
図14は、オキシブチニンに関する尿素の優れた透過作用に加え、単純な水性アルコール製剤への、単独で又は他の共溶媒の存在下での尿素の添加は、オキシブチニン以外の抗コリン作用薬の透過性を増強することを例示している。本試験において、酒石酸水素トルテロジンの透過性増強剤としての尿素を調べた。比較製剤は、以下に表している。
【0114】

【0115】
この比較試験の結果は、図14に示している。図14に例示したように、尿素含有する製剤は、尿素を含有しない参照製剤と比較し、トルテロジンの透過性を、24時間後に85%増強した。加えて及び図14に示したように、尿素及び共溶媒2.5%ジエチレングリコールモノエチルエーテル及び15%プロピレングリコールを含有する製剤は、トルテロジンの皮膚透過性を19%更に増大する。従って本試験は、尿素単独の添加又は共溶媒の存在下での添加は、他の抗コリン作用薬に対する増強された透過性を可能にすることを明らかにしている。
【0116】
図15は、オキシブチニン及びトルテロジンを含む抗コリン作用薬に対する尿素の優れた透過作用に加え、トルテロジンの単純な水性アルコール製剤へのジメチル尿素のような、尿素-含有誘導体の添加は、優れた薬物の皮膚透過性を示すことを例示している。比較製剤は、以下に示す。
【0117】

(図は、質量%として表している)
【0118】
本試験の結果は、図15及び16に示している。図15を関して、トルテロジン及びジメチル尿素を含有する製剤は、トルテロジンの透過性を、ジメチル尿素を含有しない参照製剤の実施例10と比べ、4倍増強する。更に、ジメチル尿素及び共溶媒、プロピレングリコール及びジエチレングリコールモノエチルエーテルを含有する製剤(実施例16)は更に、この薬物の透過性を7.7倍又は66%増大する。従って本試験は、単独で又は共溶媒の存在下で、ジメチル尿素などの尿素含有する誘導体は、抗コリン作用薬の透過性を増大する。
【0119】
図16に関して、ジメチル尿素を含有する製剤は、参照製剤と比較して4倍、トルテロジンの薬物フラックスを増強する。示されたように、定常状態は、ジメチル尿素を含有する製剤及び実施例10の参照製剤の各々について16時間後に到達される。しかしジメチル尿素及び共溶媒を含有する製剤の定常-状態は、24時間後であっても到達しない。まとめると、この比較試験は、尿素誘導体の抗コリン作用薬の透過性増強剤としての有効性を例示している。
【0120】
前述の実施例は、本発明の好ましい態様の単に例証ではないことは理解されるであろう。多くの修飾及び変更の配置は、本発明の精神及び範囲を逸脱しない限りは、当業者により考案され、並びに添付された「特許請求の範囲」は、そのような変更及び配置を対象とすることが意図されている。
【0121】
【表4】

【0122】
【表5】

【0123】
【表6】

【0124】
【表7】

【0125】
【表8】

【0126】
【表9】

【0127】
【表10】

【0128】
本発明は、それらの機能的態様を参照し詳細に説明され及び指摘されているが、当業者は、本発明の精神から逸脱しない限りは、様々な変更、修飾、置換、及び省略を行うことができることを理解するであろう。従って本発明は、「特許請求の範囲」内のそのような同等物を包括することを意図している。
【図面の簡単な説明】
【0129】
【図1】図1は、オキシブチニン、尿素、及び担体を含有する組成物、並びにオキシブチニン、担体を含有するが尿素を含有しない組成物の透過を比較する、in-vitro 24-時間比較透過試験の結果を図示するグラフである;
【図2】図2は、オキシブチニン、水性アルコール担体、及び溶媒を含有する組成物、並びにオキシブチニン、尿素、水性アルコール担体及び溶媒を含有する組成物の透過を比較する、in-vitro 24-時間比較透過試験の結果を図示するグラフである;
【図3】図3は、図2の組成物の薬物フラックスプロファイルを図示するグラフである;
【図4】図4は、オキシブチニン、及び担体を含有する組成物、並びにオキシブチニン、尿素及び担体を含有する組成物;並びに、オキシブチニン、尿素、担体及び追加の溶媒を含有する組成物の透過を比較する、in-vitro 24-時間比較透過試験の結果を図示するグラフである;
【図5】図5は、図4の組成物の薬物フラックスプロファイルを図示するグラフである;
【図6】図6は、7-日間にわたる平均血漿オキシブチニン濃度(ng/ml)の薬物動態試験の結果を図示するグラフである;
【図7】図7は、7-日間にわたる平均血漿N-デスエチルオキシブチニン濃度(ng/ml)の薬物動態試験の結果を図示するグラフである;
【図8】図8は、7-日間にわたる平均血漿オキシブチニン/N-デスエチルオキシブチニン比の薬物動態試験からの結果を図示するグラフである;
【図9】図9は、7-日間にわたる平均血漿オキシブチニン/N-デスエチルオキシブチニン比の薬物動態試験の結果を図示するグラフである;
【図10】図10は、オキシブチニン及び尿素を含有する製剤、オキシブチニン及びラウリン酸を含有する製剤、並びにオキシブチニン及びミリスチン酸イソプロピルを含有する製剤の絶対速度論プロファイルを比較する、比較試験の結果を図示するグラフである;
【図11】図11は、図10の製剤のフラックスプロファイルを図示するグラフである;
【図12】図12は、オキシブチニン及び尿素を含有する製剤、オキシブチニン及びトリアセチンを含有する製剤、並びにオキシブチニン及びグリセロールモノオレエートを含有する製剤の絶対速度論プロファイルを比較する、比較試験の結果を図示するグラフである;
【図13】図13は、図12の製剤のフラックスプロファイルを図示するグラフである;
【図14】図14は、透過性増強剤として尿素を含有するトルテロジン製剤の相対速度論プロファイルを図示するグラフである;
【図15】図15は、尿素誘導体を含有するトルテロジン製剤の相対速度論プロファイルを図示するグラフである;
【図16】図16は、図15の製剤の薬物フラックスプロファイルを図示するグラフである。
【特許請求の範囲】
【請求項1】
抗コリン作用薬又は鎮痙薬の局所的又は経皮的投与のための組成物であって:
治療的有効量の少なくとも1種の抗コリン作用薬もしくは鎮痙薬又はそれらの機能性誘導体;
抗コリン作用薬又は鎮痙薬の透過性を増強するのに十分な量の尿素-含有化合物であって、下記一般式を有する尿素-含有化合物:
【化1】

(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せである);並びに
経皮的又は局所的投与に適した担体;を含有する、組成物。
【請求項2】
尿素-含有化合物が、1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸、並びにそれらのアナログ又は誘導体からなる群より選択される、請求項1記載の組成物。
【請求項3】
尿素-含有化合物が、製剤の約1〜20質量%の量で存在する、請求項1記載の組成物。
【請求項4】
抗コリン作用薬又は鎮痙薬が、オキシブチニン、フラボキセート、イミプラミン、プロパンテリン、フェニルプロパノラミン、ダリフェナシン、デュロキセチン、酒石酸トルテロジン、又はコハク酸ソリフェナシンの少なくとも1種を含む、請求項1記載の組成物。
【請求項5】
抗コリン作用薬又は鎮痙薬が、製剤の約0.1〜20質量%の量で存在する、請求項1記載の組成物。
【請求項6】
担体が、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテル、テトラグリコールフロール、又は水の少なくとも1種を含む、請求項1記載の組成物。
【請求項7】
ジエチレングリコールのモノアルキルエーテルが、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル又はそれらの混合物であり、多価アルコールが、プロピレングリコール、ジプロピレングリコール又はそれらの混合物であり;並びに、アルコールが、エタノール、プロパノール、イソプロパノール、1-ブタノール、2-ブタノール又はそれらの混合物であり、テトラグリコールがグリコフロールである、請求項6記載の組成物。
【請求項8】
担体が、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せ、又は多価アルコール、ジエチレングリコールのモノアルキルエーテル、もしくはテトラグリコールフロール及び水の組合せを含む、請求項6記載の組成物。
【請求項9】
抗コリン作用薬又は鎮痙薬が、オキシブチニン又はそれらの医薬として許容できる塩であり、尿素-含有化合物が尿素であり、並びに担体がエタノール及び水を含む、請求項4記載の組成物。
【請求項10】
組成物が更に、ジエチレングリコールモノエチルエーテル、プロピレングリコール又はそれらの組合せを含有する、請求項9記載の組成物。
【請求項11】
オキシブチニンが、ラセミ体又は異性体である、請求項9記載の組成物。
【請求項12】
オキシブチニンの医薬として許容できる塩が、酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩、ナプシル酸塩、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩からなる群より選択される、請求項9記載の組成物。
【請求項13】
組成物が、オキシブチニンの定常的血漿濃度を、組成物が投与された対象へ提供する、請求項9記載の組成物。
【請求項14】
組成物が、約1の血漿オキシブチニン対N-デスエチルオキシブチニン比を、組成物が投与された対象へ提供する、請求項9記載の組成物。
【請求項15】
ゲル化剤、溶媒、抗微生物薬、保存剤、酸化防止剤、緩衝剤、湿潤剤、金属イオン封鎖剤、保湿剤、皮膚軟化剤、又は追加の透過性増強剤を更に含有する、請求項1記載の組成物。
【請求項16】
組成物が、軟膏剤、クリーム剤、ゲル剤、フォーム、ローション剤、リポソーム、ミセル、ミクロスフェア、ラッカー、貼付剤、救急絆、閉鎖もしくは非閉鎖包帯又はそれらの組合せの形状である、請求項1記載の組成物。
【請求項17】
抗コリン作用薬又は鎮痙薬の局所的又は経皮的投与のための組成物であって:
製剤の約1〜5%の量で存在するオキシブチニン;
製剤の約1〜10%の量で存在する尿素;及び
製剤の約40〜80%の量で存在する担体;
任意に水の添加を含有する、組成物。
【請求項18】
担体が、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せ、又は多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せを含む、請求項17記載の組成物。
【請求項19】
組成物が更に、約1〜10%の量で存在するゲル化剤を含有する、請求項16記載の組成物。
【請求項20】
組成物が、約1.17μg/cm2hの経皮的オキシブチニンフラックスを提供する、請求項19記載の組成物。
【請求項21】
経皮的オキシブチニンフラックスが、組成物の使用者への適用後約16時間得られる、請求項20記載の組成物。
【請求項22】
対象における過活動膀胱又は尿意切迫及び尿失禁の治療に有用な、局所的又は経皮的組成物の調製における透過性増強薬としての、下記一般式を有する尿素-含有化合物の使用:
【化2】

(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せである)であり、該組成物が、抗コリン作用薬又は鎮痙薬及び経皮的もしくは局所的投与に適した担体を含有する、使用。
【請求項23】
薬物が、オキシブチニン、フラボキセート、イミプラミン、プロパンテリン、フェニルプロパノラミン、ダリフェナシン、デュロキセチン、酒石酸トルテロジン、もしくはコハク酸ソリフェナシン、又はそれらの治療的に有効な塩の少なくとも1種を含む、請求項22記載の使用。
【請求項24】
尿素-含有化合物が、1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸、並びにそれらのアナログ又は誘導体からなる群より選択される、請求項22記載の使用。
【請求項25】
尿素-含有化合物が、組成物の約1%〜20質量%の量で存在する、請求項22記載の使用。
【請求項26】
抗コリン作用薬又は鎮痙薬が、組成物の約0.1%〜20質量%の量で存在する、請求項22記載の使用。
【請求項27】
抗コリン作用薬又は鎮痙薬が、オキシブチニン、又は酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩、ナプシル酸塩、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩からなる群より選択される尿素の医薬として許容できる塩である、請求項22記載の使用。
【請求項28】
組成物が、オキシブチニンのピーク血漿濃度を低下する使用であり、更にここでこの使用が、オキシブチニン-関連した副作用の発生数を低下するか又は強度を低下する、請求項27記載の使用。
【請求項29】
組成物が、定常的血漿オキシブチニン濃度を提供する、請求項27記載の使用。
【請求項30】
オキシブチニンの一日量が、24時間にわたって約30〜60mgであり、更にここで組成物がゲル剤の形である、請求項27記載の使用。
【請求項31】
オキシブチニンの用量が、平均約1の血漿オキシブチニン対N-デスエチルオキシブチニン比を、対象へ提供する、請求項27記載の使用。
【請求項32】
抗コリン作用薬が、ラセミ体オキシブチニンであり、更にここで対象に、24時間にわたって約1〜約20mgで投薬される、請求項22記載の使用。
【請求項33】
抗コリン作用薬が、オキシブチニンのエナンチオマーであり、更にここで対象に、24時間にわたって約0.5〜約15mgで投薬される、請求項22記載の使用。
【請求項34】
組成物が、ゲル化剤、溶媒、抗微生物薬、保存剤、酸化防止剤、緩衝剤、湿潤剤、金属イオン封鎖剤、保湿剤、皮膚軟化剤、又は追加の透過性増強剤を更に含有する、請求項22記載の使用。
【請求項35】
組成物が、軟膏剤、クリーム剤、ゲル剤、フォーム、ローション剤、リポソーム、ミセル、ミクロスフェア、ラッカー、貼付剤、救急絆、閉鎖もしくは非閉鎖包帯又はそれらの組合せの形状で、対象へ投与される、請求項22記載の使用。
【請求項1】
抗コリン作用薬又は鎮痙薬の局所的又は経皮的投与のための組成物であって:
治療的有効量の少なくとも1種の抗コリン作用薬もしくは鎮痙薬又はそれらの機能性誘導体;
抗コリン作用薬又は鎮痙薬の透過性を増強するのに十分な量の尿素-含有化合物であって、下記一般式を有する尿素-含有化合物:
【化1】

(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せである);並びに
経皮的又は局所的投与に適した担体;を含有する、組成物。
【請求項2】
尿素-含有化合物が、1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸、並びにそれらのアナログ又は誘導体からなる群より選択される、請求項1記載の組成物。
【請求項3】
尿素-含有化合物が、製剤の約1〜20質量%の量で存在する、請求項1記載の組成物。
【請求項4】
抗コリン作用薬又は鎮痙薬が、オキシブチニン、フラボキセート、イミプラミン、プロパンテリン、フェニルプロパノラミン、ダリフェナシン、デュロキセチン、酒石酸トルテロジン、又はコハク酸ソリフェナシンの少なくとも1種を含む、請求項1記載の組成物。
【請求項5】
抗コリン作用薬又は鎮痙薬が、製剤の約0.1〜20質量%の量で存在する、請求項1記載の組成物。
【請求項6】
担体が、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテル、テトラグリコールフロール、又は水の少なくとも1種を含む、請求項1記載の組成物。
【請求項7】
ジエチレングリコールのモノアルキルエーテルが、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル又はそれらの混合物であり、多価アルコールが、プロピレングリコール、ジプロピレングリコール又はそれらの混合物であり;並びに、アルコールが、エタノール、プロパノール、イソプロパノール、1-ブタノール、2-ブタノール又はそれらの混合物であり、テトラグリコールがグリコフロールである、請求項6記載の組成物。
【請求項8】
担体が、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せ、又は多価アルコール、ジエチレングリコールのモノアルキルエーテル、もしくはテトラグリコールフロール及び水の組合せを含む、請求項6記載の組成物。
【請求項9】
抗コリン作用薬又は鎮痙薬が、オキシブチニン又はそれらの医薬として許容できる塩であり、尿素-含有化合物が尿素であり、並びに担体がエタノール及び水を含む、請求項4記載の組成物。
【請求項10】
組成物が更に、ジエチレングリコールモノエチルエーテル、プロピレングリコール又はそれらの組合せを含有する、請求項9記載の組成物。
【請求項11】
オキシブチニンが、ラセミ体又は異性体である、請求項9記載の組成物。
【請求項12】
オキシブチニンの医薬として許容できる塩が、酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩、ナプシル酸塩、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩からなる群より選択される、請求項9記載の組成物。
【請求項13】
組成物が、オキシブチニンの定常的血漿濃度を、組成物が投与された対象へ提供する、請求項9記載の組成物。
【請求項14】
組成物が、約1の血漿オキシブチニン対N-デスエチルオキシブチニン比を、組成物が投与された対象へ提供する、請求項9記載の組成物。
【請求項15】
ゲル化剤、溶媒、抗微生物薬、保存剤、酸化防止剤、緩衝剤、湿潤剤、金属イオン封鎖剤、保湿剤、皮膚軟化剤、又は追加の透過性増強剤を更に含有する、請求項1記載の組成物。
【請求項16】
組成物が、軟膏剤、クリーム剤、ゲル剤、フォーム、ローション剤、リポソーム、ミセル、ミクロスフェア、ラッカー、貼付剤、救急絆、閉鎖もしくは非閉鎖包帯又はそれらの組合せの形状である、請求項1記載の組成物。
【請求項17】
抗コリン作用薬又は鎮痙薬の局所的又は経皮的投与のための組成物であって:
製剤の約1〜5%の量で存在するオキシブチニン;
製剤の約1〜10%の量で存在する尿素;及び
製剤の約40〜80%の量で存在する担体;
任意に水の添加を含有する、組成物。
【請求項18】
担体が、アルコール、多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せ、又は多価アルコール、ジエチレングリコールのモノアルキルエーテルもしくはテトラグリコールフロール、及び水の組合せを含む、請求項17記載の組成物。
【請求項19】
組成物が更に、約1〜10%の量で存在するゲル化剤を含有する、請求項16記載の組成物。
【請求項20】
組成物が、約1.17μg/cm2hの経皮的オキシブチニンフラックスを提供する、請求項19記載の組成物。
【請求項21】
経皮的オキシブチニンフラックスが、組成物の使用者への適用後約16時間得られる、請求項20記載の組成物。
【請求項22】
対象における過活動膀胱又は尿意切迫及び尿失禁の治療に有用な、局所的又は経皮的組成物の調製における透過性増強薬としての、下記一般式を有する尿素-含有化合物の使用:
【化2】

(式中、R1、R2、R3、及びR4は、水素、アルキル基、チオール基、芳香族基、カルボキシル基、カルボニル基、エーテル連結、エステル基、アミン基、アロファナミド、グリコリル基、炭酸、又はそれらの任意の組合せである)であり、該組成物が、抗コリン作用薬又は鎮痙薬及び経皮的もしくは局所的投与に適した担体を含有する、使用。
【請求項23】
薬物が、オキシブチニン、フラボキセート、イミプラミン、プロパンテリン、フェニルプロパノラミン、ダリフェナシン、デュロキセチン、酒石酸トルテロジン、もしくはコハク酸ソリフェナシン、又はそれらの治療的に有効な塩の少なくとも1種を含む、請求項22記載の使用。
【請求項24】
尿素-含有化合物が、1,3-ジメチル尿素、1,1-ジエチル尿素、1-アセチル-1-フェニル尿素、イソプロピリデン尿素、アロファン酸、ヒダントイン酸、アロファノイル、ピロリドンカルボン酸、ビウレット、チオビウレット、ジチオビウレット、トリウレット及び2-(3-メチルウレイド)-1-ナフトエ酸、並びにそれらのアナログ又は誘導体からなる群より選択される、請求項22記載の使用。
【請求項25】
尿素-含有化合物が、組成物の約1%〜20質量%の量で存在する、請求項22記載の使用。
【請求項26】
抗コリン作用薬又は鎮痙薬が、組成物の約0.1%〜20質量%の量で存在する、請求項22記載の使用。
【請求項27】
抗コリン作用薬又は鎮痙薬が、オキシブチニン、又は酢酸塩、酒石酸水素塩、クエン酸塩、エデト酸塩、エジシル酸塩、エストレート、エシラート、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、臭化水素酸塩、塩酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硝酸塩、ムコ酸塩、ナプシル酸塩、硝酸塩、パモ酸塩、パントテン酸塩、リン酸塩、サリチル酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、タンニン酸塩及び酒石酸塩からなる群より選択される尿素の医薬として許容できる塩である、請求項22記載の使用。
【請求項28】
組成物が、オキシブチニンのピーク血漿濃度を低下する使用であり、更にここでこの使用が、オキシブチニン-関連した副作用の発生数を低下するか又は強度を低下する、請求項27記載の使用。
【請求項29】
組成物が、定常的血漿オキシブチニン濃度を提供する、請求項27記載の使用。
【請求項30】
オキシブチニンの一日量が、24時間にわたって約30〜60mgであり、更にここで組成物がゲル剤の形である、請求項27記載の使用。
【請求項31】
オキシブチニンの用量が、平均約1の血漿オキシブチニン対N-デスエチルオキシブチニン比を、対象へ提供する、請求項27記載の使用。
【請求項32】
抗コリン作用薬が、ラセミ体オキシブチニンであり、更にここで対象に、24時間にわたって約1〜約20mgで投薬される、請求項22記載の使用。
【請求項33】
抗コリン作用薬が、オキシブチニンのエナンチオマーであり、更にここで対象に、24時間にわたって約0.5〜約15mgで投薬される、請求項22記載の使用。
【請求項34】
組成物が、ゲル化剤、溶媒、抗微生物薬、保存剤、酸化防止剤、緩衝剤、湿潤剤、金属イオン封鎖剤、保湿剤、皮膚軟化剤、又は追加の透過性増強剤を更に含有する、請求項22記載の使用。
【請求項35】
組成物が、軟膏剤、クリーム剤、ゲル剤、フォーム、ローション剤、リポソーム、ミセル、ミクロスフェア、ラッカー、貼付剤、救急絆、閉鎖もしくは非閉鎖包帯又はそれらの組合せの形状で、対象へ投与される、請求項22記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公表番号】特表2007−536312(P2007−536312A)
【公表日】平成19年12月13日(2007.12.13)
【国際特許分類】
【出願番号】特願2007−512003(P2007−512003)
【出願日】平成17年5月3日(2005.5.3)
【国際出願番号】PCT/EP2005/004799
【国際公開番号】WO2005/107812
【国際公開日】平成17年11月17日(2005.11.17)
【出願人】(505343929)アンタレス ファルマ イーペーエル アクチェンゲゼルシャフト (3)
【Fターム(参考)】
【公表日】平成19年12月13日(2007.12.13)
【国際特許分類】
【出願日】平成17年5月3日(2005.5.3)
【国際出願番号】PCT/EP2005/004799
【国際公開番号】WO2005/107812
【国際公開日】平成17年11月17日(2005.11.17)
【出願人】(505343929)アンタレス ファルマ イーペーエル アクチェンゲゼルシャフト (3)
【Fターム(参考)】
[ Back to top ]

