抗コリン薬を具える放出制御組成物
本発明は、ジサイクロミン又は塩、及び/又は溶媒和物を具える組成物と、腸運動過剰又は過敏症腸症候群(IBS)を治療する組成物の生成及び使用方法を提供する。本発明はまた、本発明の組成物を具える口腔内崩壊の1日1回の投与形態を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
[関連出願の相互参照]
本出願は、2009年2月23日出願の米国暫定出願第61/154,504号の優先権を主張し、全ての目的のためにその全体が参照により本明細書に組み込まれている。本発明は、ジサイクロミンなどの抗コリン薬を具える組成物、及びかかる組成物の生成若しくは使用方法に関する。
【背景技術】
【0002】
抗コリン薬は、平滑筋細胞の表面上のコリン作動性受容体上のアセチルコリン活性を阻害し、例えば、平滑筋弛緩薬、鎮痙薬、抗動揺病薬、抗ヒスタミン、気管支拡張薬など、分類としてさまざまな臨床応用の有用性を有する。
【0003】
用量依存性の副作用を最小限にしながら、抗コリン薬を、1日1回の服薬スケジュールを用いて24時間にわたり薬の治療レベルを提供する放出制御製剤を形成するのは困難な場合がある。その薬の薬物速度論的特性や物理的特性のため、1日1回の持続放出製剤の設計が更に困難となる。例えば、ビシクロヘキシル−1−カルボン酸、2−ジエチルアミノエステル(ジシクロベリンとしても知られる、ジサイクロミン)は、平滑弛緩特性を有する典型的な抗コリン薬である。現在市販されているジサイクロミンの製剤を投与後間もなく(最高血中濃度到達時間が約1.5−3時間)、血漿内の薬の濃度が急上昇し、1.8時間の半減期(t1/2)で素速く除去される、非常に速い溶解プロファイルを有する。この迅速な最高血中濃度到達時間と短い半減期の組み合わせた場合は、24時間にわたる許容血清レベルを維持するために、1日に複数回投与する従来のジサイクロミン製剤が必要である。
【0004】
中程度乃至重度の過敏性腸症候群に関連する腹部の攣縮や疼痛の治療に塩酸ジサイクロミンなどの抗コリン薬を用いる。平滑筋弛緩薬として作用し、過敏性腸症候群(IBS)に関連する結腸の攣縮により腹部の疼痛及び膨満を緩和するためにジサイクロミン、ムスカリン性M1アセチルコリン受容体拮抗薬を鎮痙薬として用いる。自律性ニューロパシーがIBSを引き起こし、交感神経の増進が下痢に関連する一方、迷走神経緊張の低下が便秘を引き起こす。IBSの症例の大部分は、心理的な病的状態と内臓過敏の相互関係の結果である。IBS患者は、不安神経症、鬱病及び睡眠障害の発生率がより高い。拡張基底上、即効型治療薬を1日に数回服用する中程度乃至重度のIBS患者は、ドライマウス、目まい、視力障害、吐き気など典型的な抗コリン薬の副作用が問題となる。深刻な症状により頻繁に、強烈に、及び慢性的に日常の機能が妨げられる。中程度乃至重度の症状は更に、長旅や外出を避ける傾向があるので、社会的生活に影響を及ぼす(Drossman,D.2006 Gastroenterology 20(5):121−132 and Smith,D.G.2005 Am J Manag Care 11:S43−S50)。Bentyl(登録商標)(即効型塩酸ジサイクロミンカプセル)の添付文書によると、臨床試験の100人の患者のうち46人は、副作用が原因で推奨された160mgの1日量を摂取することが出来なかった。米国のIBSの罹患率は、一般人口の15−20%である。というわけで、患者の服薬順守だけでなく、ドライマウス、目まい、視力障害、吐き気など共通の副作用に関連し最高血中濃度(Cmax)にまで血清濃度が急上昇するので、従来のジサイクロミン製剤は、決して臨床的に最適とはいえない。
【0005】
従って、単回の、1日1回の投与スケジュールで、臨床的に有効な効果を提供する抗コリン薬の放出制御処方が必要である。更に詳細には、例えば、腸運動過剰の治療で、24時間にわたり1日1回の投薬を可能にする、臨床的に有効な治療的に薬の血清中濃度を維持する抗コリン薬の製剤が必要となる。
【発明の概要】
【0006】
一の実施例では、本発明は、複数の抗コリン薬含有粒子を具える放出制御組成物に関するものであって、この粒子が:
(a)抗コリン薬を具えるコアと;
(b)少なくとも1つの非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わせた腸溶性ポリマーを具え第1コーティングを覆って配置される第2コーティングと;を具えることを特徴とする組成物。
【0007】
別の実施例では、本発明は、製剤に関するものであって:
(a)抗コリン薬を具えるコアと;
(b)少なくとも1つの非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わせた腸溶性ポリマーを具え第1コーティングを覆って配置される第2コーティングと;
(d)各々400μm以下の平均粒径を有する複数の迅速に分散する微粒剤とを具え、該微粒剤が、
(i)崩壊剤と
(ii)糖アルコール及び/又はサッカリドを具え、
該糖アルコール及び/又はサッカリドが、30μm以下の平均粒径を有し、前記製剤が、口腔内崩壊錠剤であることを特徴とするものである。
【0008】
更に別の実施例では、本発明が、放出制御組成物の調整法に関するものであって、
(a)抗コリン薬を具える複数のコアを調整するステップと;
(b)選択的に腸溶性ポリマーと組み合わせる少なくとも1つの非水溶性ポリマーを具える第1コーティングで前記コアをコーティングするステップと;
(c)選択的に非水溶性ポリマーと組み合わせる腸溶性ポリマーを具える前記第2コーティングであって、ステップ(b)から得られる前記コーティングされたコアを覆って配置される第2コーティングを適用するステップと;
(d)ステップ(a)の抗コリン薬及びステップ(c)の前記コーティングされたコアを臨床的に有効な量カプセルに充填するステップと;を具える調整法である。
【0009】
更に別の実施例では、本発明が、放出制御組成物の調整法に関するものであって、
(a)抗コリン薬を具える複数のコアを調整するステップと;
(b)少なくとも1つの非水溶性ポリマーを具える第1コーティングで前記コアをコーティングするステップと;
(c)選択的に非水溶性ポリマーと組み合わせる腸溶性ポリマーを具える前記第2コーティングであって、コーティングされた前記コアを覆って配置される第2コーティングを適用するステップと;
(d)各々平均粒径が400μm以下の迅速に分散する微粒剤であって、
(i)崩壊剤と
(ii)糖アルコール及び/又はサッカリドを具え、該糖アルコール及び/又はサッカリドが、各々30μm以下の平均粒径を有する微粒剤を調整するステップと;
(e)ステップ(a)のコアの臨床的に有効な量とステップ(c)の一部の前記コーティングされる薬を具える混合物を(d)の前記迅速に分散する微粒剤と共に口腔内崩壊錠剤へ圧縮するステップと;を具える調整方法である。
【0010】
更に別の実施例では、それを必要とする患者に本発明の組成物の治療量を投与するステップを具える、腸運動過剰又は過敏性腸症群の治療法に関する。
【図面の簡単な説明】
【0011】
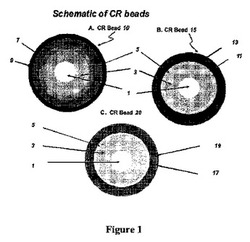
【図1】図1は、CR(放出制御)ビーズの実施例の断面図である。図1Aは、SRコーティングされたIRビーズ(抗コリン薬層(3)、シールコート(5)、及びSRコーティング(7)でコーティングされた不活性コア(1))を覆って配置されるTPR(周期的パルス放出)コーティング(9)を具えるCRビーズ(10)を示す。図1Bは、SRコーティングされたIRビーズ(抗コリン薬層(3)、シールコート(5)、及びSRコーティング(11)でコーティングされた不活性コア(1))を覆って配置されるDRコーティング(13)を具えるCRビーズ(15)を示す。図1Cは、TPRコーティングされたIRビーズ(抗コリン薬層(3)、シールコート(5)、及びTPRコーティング(17)でコーティングされた不活性コア(1))を覆って配置されるDRコーティング(19)を具えるCRビーズ(20)を示す。
【図2】図2は、実施例1のSR(持続放出)ビーズのジサイクロミン放出特性を示す。
【図3】図3は、実施例2のSRビーズのジサイクロミン放出特性を示す。
【図4】図4は、実施例3のTPR(周期的パルス放出)ビーズ及びCR(放出制御)のジサイクロミン放出特性を示す。
【図5】図5は、実施例4のSRビーズとCRビーズのジサイクロミン放出特性を示す。
【図6】図6は、実施例5のSRビーズとCRビーズのジサイクロミン放出特性を示す。
【発明を実施するための形態】
【0012】
以下の記述は、本発明の理解に関する有用な情報を含む。これは、本明細書に提供される情報のいずれかが、先行技術であること、又は黙示的に参照されるいずれかの刊行物が先行技術であると認めるものではない。
【0013】
個々の文献が特に、個別に参照により組み込まれているのと同程度に、本明細書で引用された全ての文献は、全ての目的のためにその全体が参照により組み込まれている。
【0014】
本明細書で用いられる用語「薬剤」、「活性」、「活性剤」又は「原薬」は、薬学的に許容で治療効果のある化合物、薬学的に許容な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形体、及び/又はそれらのエステルを含む。本発明の様々な実施例の記述において薬剤に言及するときは、他に指示のない限り、その言及は塩基性薬剤、薬学的に許容な塩、立体異性体及び溶媒和物(水和物を含む)、多形体、及び/又はそれらのエステルを含む。
【0015】
用語「塩」は、薬剤の「遊離塩基」の形で適切な無機酸又は有機酸が反応し形成する生成物を意味する。適切な酸は、例えば毒性の低い酸、ヒトや動物で使用が認可された塩のように、安定な塩を形成するのに十分な酸性度を有するものを含んでいる。ジサイクロミンの塩を形成するのに用いる酸の非限定的な例は、HF、HCl、HBr、HI、H2SO4、H3PO4などの無機酸を含み、有機酸の非限定的な例は、フェニル、αナフチル、βナフチル、(S)カンファ、メチル、エチル、n−プロピル、i−プロピル、n−ブチル、s−ブチル、i−ブチル、t−ブチル、ペンチル及ヘキシルスルホン酸などのC6−16アリルスルホン酸、C6−16ヘテロアリールスルホン酸、C1−16アルキルスルホン酸を含み、有機酸の非限定的な例は、酢酸、グリコール酸、乳酸、ピルピン酸、マロン酸、グルタル酸、酒石酸、クエン酸、フマル酸、コハク酸、リンゴ酸、マレイン酸、ヒドロキシマレイン酸、安息香酸、ヒドロキシ安息香酸、フェニル酢酸、桂皮酸、サリチル酸、及び2−フェノキシ安息香酸などのカルボン酸C1−16アルキル、C6−16アリルカルボン酸及びC4−16ヘテロアリールカルボン酸を含み、有機酸の非限定的な例は、リジン、アルギニン、グルタミン酸、グリシン、セリン、トレオニン、アラニン、イソロイシン、ロイシンなど天然アミノ酸を含む。他の適切な塩は、例えば、S.M.Birgeら,J.Pharm.Sci.,1977,66,1−19頁に記載されている(全ての目的のため参照により本明細書に組み込まれている)。多くの実施例では、「塩」とは、特に哺乳類細胞にとって、生物学的に適合な又は薬学的に許容なあるいは毒性のない塩を意味する。本発明で有用な薬剤の塩は、結晶性あるいは非結晶性、又は様々な結晶形の混合物、及び/又は結晶形と非晶形の混合物である。
【0016】
用語「口腔内崩壊錠剤」又は「ODT」は、投与後に噛む必要なく、患者の口腔内で迅速に崩壊する錠剤を意味する。本明細書で記載した(例えば、the USP<701>検査法)検査したところ、この壊変率はばらつきがあるものの、投与後直ちに飲み込むことを目的した従来の固形の剤形(例えば、錠剤又はカプセル)の壊変率よりも高く、チュアブルタイプの固形の剤形の壊変率よりも高い。
【0017】
本明細書で使用する用語「約」は数量を意味し、「ちょうど」を含む。例えば、「約60秒」は、60秒に近い値(例えば、50秒、55秒、59秒、61秒、65秒、70秒など)だけでなく、ちょうど60秒も含む。
【0018】
本明細書で用いられる用語「放出制御コーティング」や「放出制御」は、放出を遅延し、放出を持続し、放出を阻止するコーティング、及び/又はその他放出制御コーティングでコーティングされた粒子でできた薬剤の放出を引き延ばすコーティングを含む。用語「放出制御」は、「維持放出」、「周期的パルス放出」、及び「遅延時間」を含む。従って、「放出制御」は維持放出コーティング、周期的パルス放出コーティング、又は「遅延時間」コーティングを含む。
【0019】
本明細書で用いられる用語「pH感受性の」は、溶解度に依存するpHを示すポリマーを意味する。
【0020】
本明細書で用いられる用語「腸溶性ポリマー」は、胃液に耐性があり(即ち、胃の中で見られる低pH値において比較的不溶性)腸管中で見られるより高いpH値で溶解するpH感受性ポリマーを意味する。
【0021】
本明細書で用いられる用語「即効型」(製剤又は製剤の成分になり得る医薬組成物に関する)は、製剤の投与後約2時間以内又は約1時間以内で、一の実施例では、約50%活性より高い又はこれに等しい放出をする医薬組成物、別の実施例では、約75%活性より高い放出をする医薬組成物、別の実施例では、約90%活性より高い放出をする医薬組成物、及び別の実施例では、約95%活性より高い放出をする医薬組成物を意味する。この用語はまた「遅延時間」(活性の少ししか放出が生じない又は活性の放出が生じない)の後に比較的迅速に活性の放出が生じる医薬組成物を意味する。
【0022】
用語「即効型(IR)ビーズ」又は「即効型粒子」は、広く、本明細書で記載される抗コリン薬に関する「即効性」特性を示す抗コリン薬含有ビーズ又は粒子を意味する。
【0023】
用語「持続放出(SR)ビーズ」又は「持続放出粒子」は広く、本明細書で記載されるSRコーティングでコーティングされたコアを含む抗コリン薬を覆って配置される本明細書で記載されるSRコーティングを具えるビーズ又は粒子を意味する。
【0024】
用語「SRコーティング」は、本明細書に記載される非水溶性ポリマーを具える持続放出コーティングを意味する。それ自身によるSRコーティングは、持続放出プロファイルを提供する。
【0025】
用語「遅延時間コーティング」又は「TPRコーティング」は、本明細書で使用される非水溶性ポリマーと腸溶性ポリマーの組み合わせを具える制御放出コーティングを意味する。それ自身によるTPRコーティングは、事前に決定された遅延時間後に、薬剤の即効型パルス又は持続薬剤放出プロファイルを提供する。
【0026】
用語「遅延時間(TPR)ビーズ」又は、「遅延時間粒子」は、広く、本明細書に記載されるコアを具える抗コリン薬を覆って配置されるTPRコーティングを具えるビーズ又は粒子を意味する。
【0027】
用語「遅延放出(DR)ビーズ」又は「遅延放出粒子」は、広く、本明細書で記載されるDRコーティングでコーティングされたコアを含んだ抗コリン薬を意味する。
【0028】
用語「DRコ−ティング」は、本明細書で記載される腸溶性ポリマーを具える遅延放出コーティングを意味する。それ自身によるDRコーティングは、遅延放出プロファイルを提供する。
【0029】
用語「放出制御(CR)ビーズ」又は「放出制御粒子」は、広く、本明細書で記載される内部SR又はTPRコーティングと外部SR、DR、又はTPRコーティングを有するコアを含んだ抗コリン薬を意味する。
【0030】
本明細書で用いられる用語「遅延時間」は、医薬組成物(又は医薬組成物を具える製剤)の摂取後又は医薬組成物あるいは医薬組成物を具える製剤の擬似体液への暴露後に、医薬組成物から放出される活性が約10%未満である又は期間を意味するものであり、これは、例えば、2段階溶解溶媒を用いたUSP装置で評価(最初の2時間は、37℃の0.1NのHClを700mL中で、その後pH調整剤の200mL添加によりpH=6.8にして溶解検査する)される。
【0031】
用語「覆って配置される」は、例えば基質上のコーティングに関して、コーティングの相対的な位置を意味するが、基質に直接接触するコーティングである必要はない。例えば、基質を「覆って配置される」第1コーティングは、基質に直接接触してもよく、あるいは1又はそれ以上の介在材料又はコーティングを第1コーティングと基質の間に置いてもよい。つまり、例えば、コアを含んだ薬剤を覆って配置されるSRコーティングは、コアを含んだ薬剤に直接蒸着されるSRコーティングを意味するとも言え、あるいは、コアを含んだ薬剤に蒸着される保護シールコーティングに蒸着されるSRコーティングを意味するとも言える。
【0032】
用語「血漿濃度−時間プロファイル」、「最高血中濃度(Cmax)」、「AUC」、「最高血中濃度到達時間(Tmax)」、及び「排出半減期」は、一般に食品医薬品局の産業の手引きで定義されるような意義を有する:Bioavailability and Bioequivalence Studies for Orally Administered Drug Products−General Considerations(2003年3月発行)。
【0033】
特に明記しない限り、本明細書に記載される様々なコーティングの量又は層の量(「コーティング重量」)は、コーティング前の粒子又はビーズの初期重量と比較してドライコーティングによって与えられた粒子又はビーズの増加した重量をパーセントで表す。従って、10%コーティング重量は、10%粒子の重量が増加するドライコーティングを意味する。
【0034】
多くの実施例では、複数の抗コリン薬含有粒子を具える放出制御組成物を対象とする。抗コリン薬含有粒子は、抗コリン薬を含むコアを具える。このコアは、所望の拡張放出特性を示す2又はそれ以上のコーティングでコーティングされる。コアを覆って配置される第1コーティングは、少なくとも1つの非水溶性ポリマーを具え、コアを覆って配置される第2コーティングは、腸溶性ポリマーと選択的な非水溶性ポリマーを具える。第1及び第2コーティングを、任意の順序で塗布してもよい。即ち、コア粒子を含んだ抗コリン薬を覆って第1コーティングを塗布し、続けて第2コーティングをしてもよく、コア粒子を含んだ抗コリン薬を覆って第2コーティングを塗布して、続けて第1コーティングをしてもよい。第1及び第2コーティングに加えて任意の順序で、即ち第1及び第2コーティングの前、間、又はそれらの後に、他のコーティングを塗布してもよい。
【0035】
適切な抗コリン薬は、例えば、アトロピン、ベナクチジン、ベンズトロピン、ビベリデン、臭化ブチルスコポラミン、シクロペントレートダリフェナシン、デキセチミド、ジサイクロミン、エメプロニウム、グリコピロレート、ヘキサヒドロシラジフェニドール、オクチロニウム、オルフェナドリン、オキシブチニン、オキシフェノニウム、ピレンゼピン、プロシクリジン、プロパンテリン、プロピルベンジルコリン、キニジン、キヌクリジニルベンジラート、スコポラミン、トルテロジントリヘキシフェニジル、トロピカミド、ミバクリウム、アトラクリウム、ドキサクリウム、シスアトラクリウム、ベクロニウム、ロクロニウム、パンクロニウム、ツボクラリン(tabocurarine)、ガラミン、ピペクロニウム、ヘキサメトニウム、メカミラミン、トリメタファン、スクシニルコリン、スキサメトニウム、デカメトニウム、メトキシコロナリジン、メカミラミン、イミダファナシンなどである。
【0036】
特定の実施例では、本発明の抗コリン薬組成物は、ジサイクロミン又はその塩、及び/又は溶媒和物を具える。ジサイクロミン(ビシクロヘキシル−1−カルボン酸,2−(ジエチルアミノ)エチルエステル)は、以下の構造を有する化合物又はその塩、及び/又は溶媒和物を意味する。

【0037】
一の実施例では、抗コリン薬含有コアは、層状ビーズ、ペレット(例えば、少なくとも1つの抗コリン薬を含んだ押し出し及び球状化組成物)の抗コリン薬、抗コリン薬含有顆粒、又は抗コリン薬の結晶の形をとることができる。
【0038】
別の実施例では、抗コリン薬含有コアは、層状ビーズの薬剤である。層状ビーズの薬剤は、薬剤層、例えば抗コリン薬層でコーティングされた不活性ビーズ(例えば、砂糖球)を意味する。別の実施例では、本発明の不活性ビーズは、微結晶性セルロース、マンニトール−微結晶性セルロース、又は二酸化ケイ素を具えてもよい。不活性ビーズは、一般的に20−80メッシュ、例えば25−30メッシュ又は60−80メッシュの粒径を有する。
【0039】
このように薬層でコーティングされ、持続放出コーティングを欠く不活性コアを、即効型特性を有して、「IRビーズ」と呼ぶことがある。特異的な抗コリン薬の特徴に応じて、この薬剤は結合剤を用いずに直接に溶液から不活性コアに蒸着することができる。多くの実施例では、薬層は、抗コリン薬と不活性砂糖球の結合を促進させる結合剤(一般的に薬学的に許容な水溶性ポリマー)を含む。
【0040】
適切な結合剤の例は、ポリビニルピロリドン(PVP)、ポリエチレンオキシド、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、及び多糖類を含むが、これに限定されるものではない。この結合剤は、薬層の全重量に基づき約0.5重量%乃至約10重量%に及ぶ量存在することがある。
【0041】
一般的に、例えば、流動層コーティング装置を用いて、不活性コアへ薬剤と溶液を含んだ結合剤を任意に吹き付けることにより薬層を蒸着する。薬剤を層状化する溶液は、抗コリン薬と選択的な結合剤が溶解している薬学的に許容な溶媒を具える。いくつかの実施例では、抗コリン薬は、懸濁液の形で存在する場合がある。粘度に応じて、薬剤を層状化する溶液の固形成分は、例えば、約10重量%、約15重量%、約20重量%、約25重量%、約30重量%など約35重量%までがよい。薬学的に許容な溶媒は、水、アルコール(エタノールなど)、アセトンなどを含む。
【0042】
代替として、コアを含む抗コリン薬は、1又はそれ以上の薬学的に許容な添加剤(例えば、ラクトース、マンニトール、微結晶性セルロースなど)と組み合わさる抗コリン薬を具える顆粒でよい。この顆粒は、従来の造粒法により調整され、上記のような適切な結合剤を選択的に含む。
【0043】
いくつかの実施例では、本発明の抗コリン薬含有コアは、約400μm以下、別の実施例では300μm以下、更に別の実施例では200μm以下の平均粒径を有する。
【0044】
用語「シーラント層」は、薬剤含有コア粒子を覆って配置される保護膜を意味する。シーラント層は、操作の間、粒子を剥離と摩耗から保護する。
【0045】
用語「実質的に崩壊する」は、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、又は約100%の崩壊に相当する崩壊のレベルを意味する。「溶解」が、液体中の固体の可溶化(例えば、溶媒中又は胃液中の薬剤の可溶化)を意味するのに対し、「崩壊」が、錠剤を具える構成粒子などの構造的凝集の破壊又は損失を意味する点で、用語「崩壊」と用語「溶解」を区別する。
【0046】
本明細書に記載した本発明の組成物は、第1又は第2コーティングでコーティングされた抗コリン薬含有コアを含む複数の抗コリン薬含有粒子を具えるものであり、この第1コーティングは、少なくとも1つの水溶性ポリマーを具える。例えば、抗コリン薬含有コア上に直接この第1コーティングを配置してもよく、薬剤含有コアを覆って配置されたシーラント層上にコーティングしてもよく、第2コーティング上にコーティングしてもよく、第2コーティングを覆って配置されたシーラント層上にコーティングしてもよい。
【0047】
用語「非水溶性ポリマー」は、pHに関係なく、又は広範なpH範囲(例えば、pH1.0乃至pH14)における、水媒体中で不溶性又は非常に難溶性のポリマーを意味する。本明細書で使用するときは、水媒体中で膨張するものの溶解しないポリマーは、「非水溶性」である。
【0048】
用語「水溶性ポリマー」は、pHに関係なく、水媒体中で溶性である(即ち、相当量溶解する)ポリマーを意味する。
【0049】
用語「腸溶性ポリマー」は、腸の条件下(即ち、アルカリ性に対して中性である条件下の水媒体中で)で溶性(即ち、相当量溶解する)であり、酸性条件下(即ち、低pH)で非水溶性であることを意味する。
【0050】
用語「逆腸溶性ポリマー」は、酸性条件下で溶性であり、中性及びアルカリ性条件下では不溶性であることを意味する。
【0051】
一の実施例では、非水溶性ポリマー(任意の腸溶性ポリマーではないが)を具える第1コーティングを、抗コリン薬含有コア(このコアは任意にシーラント層でコーティングされる)の上にコーティングし、その結果として、維持放出(SR)コーティングを提供する。
【0052】
適切な水溶性ポリマーの非限定的な例は、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、アクリル酸エステル/メタクリル酸エステルの中性共重合体(例えば、アクリル酸エチル及びメタクリル酸メチルの共重合体であるEudragit NE)、ワックス、及びこれらの混合物である。特定の実施例では、水溶性ポリマーは、エチルセルロースを具える。別の特定の実施例では、非水溶性ポリマーは、ウベローデ粘度計で5%の80/20のトルエン/アルコール溶液中25℃で測定された10cpsの平均粘度を有するエチルセルロースを具える。
【0053】
水溶性ポリマーを具える第1コーティング用の適切なコーティング重量は、約3%、約5%、約7%、約10%。約12%、約15%、約17%、約20%、約22%、約25%、約27%、約30%、約35%、約40%を含み、これらの全ての範囲及びこれらの部分的な範囲を含んだ、約3%乃至約40%に及ぶ。
【0054】
いくつかの実施例では、SRコーティングの非水溶性ポリマーは、可塑剤の必要なく、適切な特性(例えば、拡張放出特徴、メカニカル特性、及びコーティング特性)を提供する。例えば、ポリ酢酸ビニル(PVA)、アクリル酸エステル/メタクリル酸エステルの中性共重合体、エチルセルロース、ワックスなどを具えるコーティングを、可塑剤なしで塗布できる。
【0055】
更に別の実施例では、SRコーティングの非水溶性ポリマーが、可塑剤を含む場合がある。必要とする可塑剤の量は、可塑剤、非水溶性ポリマーの特性、及び最終的に所望なコーティングの特性に応じて異なる。可塑剤の適切な濃度は、コーティングの全重量に対して約1重量%乃至約20重量%、約3重量%乃至約20重量%、約3重量%乃至約5重量%、約7重量%乃至約10重量%、約12重量%乃至約15重量%、約17重量%乃至約20重量%又は約1重量%、約2重量%、約3重量%、約4重量%、約5重量%、約6重量%、約7重量%、約8重量%、約9重量%、約10重量%、約15重量%、又は約20重量%であり、これらの全ての範囲及びこれらの部分的な範囲を含む。
【0056】
適切な可塑剤の非限定的な例は、トリアセチン、クエン酸エステル、クエン酸トリエチル、クエン酸アセチルトリエチル、クエン酸トリブチル、アセチルクエン酸トリnブチル、フタル酸ジエチル、フタル酸ジブチル、フタル酸ジオクチル、メチルパラベン、プロピルパラベン、ブチルパラベン、セバシン酸ジブチル、置換トリグリセリド及びグリセリド、モノアセチル化及びジアセチル化グリセリド(例えば、Myvacet(登録商標)9−45)、モノステアリン酸グリセリン、グリセロールトリブチレート、ポリソルベート80、ポリエチレングリコール、プロピレングリコール、油(例えば、ヒマシ油、水素化ヒマシ油、菜種油、ゴマ油、オリーブ油など)、グリセリンソルビトール、シュウ酸ジエチル、リンゴ酸ジエチル、フマル酸ジエチル、マロン酸ジエチル、コハク酸ジブチル、脂肪酸、及びこれらの混合物を含む。
【0057】
更なる適切な可塑剤の非限定的な例は、グリセロールとそのエステル(例えば、モノアセチル化グリセリド、アセチル化モノ−又はジグリセリド(例えば、Myvacet(登録商標)9−45))、モノステアリン酸グリセリン、トリ酢酸グリセリン、グリセリルトリブチレート、フタル酸類(例えば、フタル酸ジブチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジオクチル)、クエン酸類(例えば、アセチルクエン酸トリブチルエステル、アセチルクエン酸トリエチルエステル、クエン酸トリブチル、クエン酸アセチルトリブチル、クエン酸トリエチル)、グリセロールトリブチレート、セバシン酸類(例えば、セバシン酸ジエチル、セバシン酸ジブチル)、アビシン酸塩類、アゼライン酸類、安息香酸塩類、クロロブタノール、ポリエチレングリコール、植物油、フマル酸類(例えば、フマル酸ジエチル)、リンゴ酸塩類(例えば、リンゴ酸ジエチル)、シュウ酸類(例えば、シュウ酸ジエチル)、コハク酸塩類(例えば、コハク酸ジブチル)、酪酸塩類、セチルアルコールエステル、マロン酸塩類(例えば、マロン酸ジエチル)、ヒマシ油、及びこれらの混合物を含む。本発明の実施例に用いる場合、可塑剤が、放出制御コーティングにおけるポリマーの約3重量%乃至30重量%を構成することがある。更なる別の実施例では、放出制御コーティングにおけるポリマーの重量に対する可塑剤の量は、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、及び約30%であり、これらの全ての範囲及びこれらの部分的な範囲を含むものである。当業者の一人は、可塑剤の存在、又は可塑剤のタイプや量を、ポリマーやコーティングシステムの性質(例えば、水溶液又は溶媒ベース又は分散ベース、及び全固形物)に基づいて選択することができる。
【0058】
更なる別の実施例では、第1コーティングが、非水溶性ポリマーと水溶性ポリマーの組み合わせを具えるものであってもよい。一の実施例では、水溶性ポリマーに対する非水溶性ポリマーの比率は、約90:10乃至約60:40、又は約90:10、約85:15、約80:20、約75:25、約70:30、約65:35、約60:40、約55:45、約50:50、又はこれらの全ての値、範囲及びこれらの部分的な範囲を含んだ約95:5:乃至50:50に分布する。
【0059】
一の実施例では、非水溶性及び水溶性ポリマーの結合を具える第1コーティングのコーティング重量は、約3重量%乃至約50重量%に及び、これは、約10%乃至約40%、約20%乃至約30%、又は約3%、約4%、約5%、約6%、約7%、約8%、約9%、約10%、約12%、約14%、約60%、約18%、約20%、約25%、約30%、約35%、約40%、約45%、又は約50%を含むものであり、これらの全ての範囲及びこれらの部分的な範囲を含む。別の実施例では、非水溶性及び水溶性ポリマーの結合を具える第1コーティングのコーティング重量は、コーティングされたコアの重量の約3%乃至約5%、約7%乃至約10%、約12乃至約15%、約17%乃至約20%、約22%乃至約25%、約27%乃至約30%、約35乃至約40%、又は約45%乃至約50%であり、これらの全ての値、範囲及びこれらの部分的な範囲を含む。
【0060】
適切な水溶性ポリマーは、ポリビニルピロリドン(例えば、Povidone K−25)、ポリエチレングリコール(例えば、PEG 400)、ヒドロキシプロピルメチルセルロース、及びヒドロキシプロピルセルロースを含むが、これらに限定されない。
【0061】
多くの実施例では、第2コーティング層は、任意の非水溶性ポリマーと組み合わせてなる腸溶性ポリマーを具える。第2コーティングが、腸溶性ポリマーと非水溶性ポリマーの両方を具える場合は、周期的パルス放出(TPR)コーティングを提供する。更に別の実施例では、第2コーティングが、抗コリン薬含有粒子上に配置される腸溶性ポリマー(水溶性ポリマーを有さない)を具える場合は、遅延放出(DR)コーティングが提供される。
【0062】
適切な腸溶性ポリマーの非限定的な例は、酢酸フタル酸セルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルアセテートフタレート、pH感受性のメタクリル酸/メタクリル酸メチル共重合体(例えば、Eudragit(登録商標)L,S and FS ポリマー)、セラック、及びこれらの混合物を含む。特定の実施例では、腸溶性ポリマーに関連するpH感受性溶解度を有する場合は、非ポリマーワックス及び脂肪酸組成物のなどの非ポリマー腸溶材料を、腸溶性ポリマーの代わりに用いてもよい。これらの腸溶性ポリマーを溶媒混合液又は水分散液の溶液として用いてもよい。いくつかの使用される市販の材料は、ロームフェルマ社よりEudragit(L100,S100,L30D)の商標で販売されるメタクリル酸共重合体、イーストマンケミカル社製のセラセフェート(酢酸フタル酸セルロース)、FMCコーポレーション製のAquateric(酢酸フタル酸セルロース水分散液)、信越株式会社製のAqoat(ヒドロキシプロピルメチルセルロースアセテートサクシネート水分散液)である。
【0063】
第2コーティングは、腸溶性ポリマー(例えば、TPRコーティング)と組み合わせた非水溶性ポリマーを具え、腸溶性ポリマーに対する非水溶性の比率は、約9:1乃至約3:1、及び約3:1乃至約1:1など、約10:1乃至約1:1に及ぶ。特定の実施例では、腸溶性ポリマーに対する非水溶性の比率は、約1:1、約1.5:1、約2:1、約2.5:1、約3:1、約3.5:1、約4:1、約4.5:1、約5:1、約5.5:1約6:1、約6.5:1、約7:1、約7.5:1、約8:1、約8.5:1、約9:1、約9.5:1、又は約10:1であり、これらの全ての値、範囲、及びこれらの部分的範囲を含む。
【0064】
TPRコーティングを有する本発明の組成物の多くの実施例では、TPRコーティングは、約5重量%乃至約60重量%のコーティング重量で塗布され、これは、約10%乃至約50%、約20%乃至約40%、約25%乃至約35%の範囲、又は約5%、約6%、約7%、約8%、約9%、約10%、約12%、約14%、約16%、約18%、約20%、約25%、約30%、約35%、約40%、約45%、又は約50%のコーティング重量であり、これらの全ての値、範囲、及び部分的な範囲を含む。
【0065】
特定の実施例では、TPRコーティングは、非水溶性ポリマーとしてエチルセルロース(例えば、EC−10)と腸溶性ポリマーとしてヒプロメタロースフタレート(例えば、HP−55)を具える。
【0066】
SRコーティングと同様に、DRとTPRコーティングは、可塑剤なし若しくは1又はそれ以上の任意の可塑剤(例えば、本明細書に記載した可塑剤のいずれか)を含んでもよい。必要とされる可塑剤の量は、存在するときには、可塑剤、非水溶性及び又は腸溶性ポリマーの特性、及び最終的に所望なコーティングの特性に依存する。適切な可塑剤の濃度は、約1重量%乃至約20重量%、約3重量%乃至約20重量%、約3重量%乃至5重量%、約7重量%乃至約10重量%、約12重量%乃至約15重量%、約17重量%乃至約20重量%に及び、又はコーティングの全重量に対して約1重量%、約2重量%、約3重量%、約4重量%、約5重量%、約6重量%、約7重量%、約8重量%、約9重量%、約10重量%、約15重量%、又は約20重量%であり、これらの全ての値、範囲、及びこれらの部分的な範囲を含む。
【0067】
本明細書で記載する多くの実施例では、本発明の放出制御組成物は、SR層(非水溶性ポリマー、又は非水溶性ポリマーと水溶性ポリマーの結合物を具える)の第1コーティングでコーティングされ、次いでDR又はTPR層(各々腸溶性ポリマー又は腸溶性ポリマーと非水溶性ポリマーの結合物を具える)の第2コーティングでコーティングした、複数の抗コリン薬含有粒子を具える。様々な代替の実施例では、本発明の放出制御組成物は、SR層(本明細書に記載した)又はTPR層(非水溶性ポリマーと腸溶性ポリマーを具える)の第1コーティングでコーティングされ、次いで、DR層(水溶性ポリマーを有さない腸溶性ポリマーを具える)の第2コーティングでコーティングした、複数の抗コリン薬含有粒子を具える。特定の実施例では、本発明の放出制御組成物は、TPR層(非水溶性ポリマーと腸溶性ポリマーを具える)の第1コーティングでコーティングされ、次いで、DR層(水溶性ポリマーを有さない腸溶性ポリマーを具える)の第2コーティングでコーティングされた、複数の抗コリン薬含有粒子を具える。
【0068】
別の特定の実施例では、本発明の放出制御組成物は、複数のコア粒子を含む薬剤を含む。本明細書に記載のこの薬剤は、抗コリン薬でよいが、別の特定の実施例では、本明細書で記載の抗コリン薬に制限されず、薬学技術分野で知られる別の適切な種類の薬剤を含んでもよい。この特定の実施例では、コア粒子は、本明細書に記載されるコア粒子のタイプ(例えば、顆粒、層状化したビーズの薬剤、薬剤結晶など、選択的に本明細書に記載したシーラント層でコーティングされたシール)のいずれかを具えるものであり、このコア粒子は、内SR層(例えば、エチルセルロース、任意に可塑化された)と外DR層(例えば、任意に可塑化されたヒドロキシプロピルメチルセルロースフタレート)でコーティングされる。
【0069】
別の特定の実施例では、本発明の放出制御組成物は、以下非限定的な例の薬剤分類:鎮痛剤(例えば、イブプロフェン、スリンダク、セレコキシブ、メロキシカム)、鎮痙剤(例えば、ロラゼパム、プレガバリン、ritagabine)、抗糖尿病薬(例えば、グリピジド、ripaglinide、ピオグリタゾン)、抗感染症薬(例えば、メフロキン、cifrofloxacine、セフロキシム、セフトリアキソン、メタロニダゾール)、抗パーキンソン病剤(例えば、セレギレン、プラミペキソール、ロピニロール)、抗リウマチ剤(例えば、アザチオプリン)、心・血管作用薬(例えば、カルベジロール、ソタロール、ピンドール)、中枢神経(CNS)興奮剤(例えば、アルプラゾラム、メチルフェニデート、アンフェタミン)、ドーパミン受容体作用薬(例えば、アリピプラゾール、オランザピン、ジプラシドン)、制吐薬(例えば、オンダンセトロン、ミルタザピン、ドラセトロン、ドンペリドン)、胃腸薬(例えば、シサプリド、パントプラゾール、ラニチジン)、精神治療薬(例えば、クロザピン、イロペリドン、パーフェナジンなどの抗精神病薬)、オピオイド作用薬(例えば、パパベリン、オキシモルホン、ヒドロモルフォン)、オピオイド拮抗薬(例えば、オキシコドン、ブプレノルフィン)、抗てんかん薬(ラモトリジン、ミダゾラム、チアガビン)、ヒスタミンH2拮抗剤(例えば、ファモチジン)、抗ぜんそく薬(例えば、メタプロテレノール、サルブタモール、テオフィリン)、及び骨格筋弛緩薬(例えば、シクロベンザプリン、メタキサロン、クロニジン)から選択された原薬を具える。
【0070】
更に別の特定の実施例では、本発明の放出制御組成物は、内SR層(例えば、エチルセルロース、選択的に可塑化された)及び外TPR層(例えば、エチルセルロース及びヒドロキシプロピルメチルセルロースフタレート、選択的に可塑化された)でコーティングされた複数の抗コリン薬含有粒子(例えば、不活性コアに層状化した薬剤、選択的に本明細書に記載されたシーラント層でコーティングされたシール)を具える。
【0071】
更にまた別の特定の実施例では、本発明の放出制御組成物は、内TPR層(例えば、エチルセルロース及びヒドロキシプロピルメチルセルロースフタレート、選択的に可塑化された)及び外DR層(例えば、ヒドロキシプロピルメチルセルロースフタレート、選択的に可塑化された)でコーティングされた複数の抗コリン薬含有粒子(例えば、不活性コアに層状化した薬剤、選択的に本明細書に記載されたようにシーラント層でコーティングされたシール)を具える。
【0072】
特定の実施例では、DR層は、可塑化ヒドロキシプロピルメチルセルロースフタレート(例えば、HP−55やクエン酸トリエチル)を具える。更なる実施例では、DR層は、約90/10のHP−55/クエン酸トリエチルを具える。
【0073】
特定の実施例では、SR層は、可塑化エチルセルロース(例えば、EC−10やクエン酸トリエチル)を具える。更に特定の実施例では、SR層は、約90/10のEC−10とクエン酸トリエチルを具える。
【0074】
特定な実施例では、TPR層は、ヒドロキシメチルセルロースフタレートやエチルセルロースの可塑化混合物(例えば、HP−55/EC−10及びクエン酸トリエチル)を具える。更なる実施例では、TPR層は、約10%のクエン酸トリエチルを含むHP−55/EC−10を具える。
【0075】
本発明の持続放出組成物は更に、例えば第1及び第2コーティングの間に、第1及び第2コーティングの下に、及び/又は第1と第2コーティングの両方の上に、処理及び操作中に静的及び又は粒子の摩擦を防止(又は最小限)すべく、抗コリン薬含有粒子上に配置されるシーラント層を具えてもよい。
【0076】
一の実施例では、シーラント層は、親水性ポリマーを具える。親水性ポリマーの適切な非限定的な例は、親水性ヒドロキシプロピルセルロース(例えば、Klucel(登録商標)LF)、ヒドロキシプロピルメチルセルロース又はヒプロメロース(例えば、Opadry(登録商標)Clear又はPharmacoat(商標)603)、ビニルピロリド酢酸ビニル共重合体(例えば、BASF社のKollidon(登録商標)VA64)、及び低粘度エチルセルロースなどのエチルセルロースを含む。シーラント層は、例えば、約1%、約2%、約3%、約4%、約5%、約6%、約7%、約8%、約9%、又は10%である約1%乃至約10%、これらの全ての範囲及びこれらの部分的な範囲を含むコーティング重量で塗布してもよい。
【0077】
一の実施例では、本発明の放出制御組成物は、単一又は複合の放出制御コーティングでコーティングされた抗コリン薬層状化不活性シュガービーズを含む。
【0078】
別の実施例では、本発明の組成物は更に、放出制御コーティングを覆って配置される(又は放出制御コーティングが、更に腸溶性ポリマーを有するコーティングでコーティングされる最外コーティング上に配置される)圧縮性コーティングを具える。圧縮性コーティングは、ヒドロキシプロピルセルロース、ポリ(酢酸ビニル−ビニルピロリドン)、酢酸ポリビニル、エチルセルロース(例えば、可塑化された低粘度エチルセルロースラテックス分散)などのポリマーを具えるが、これに限定されない。圧縮性コーティングは、可塑化されても可塑化されなくてもよく、圧縮中に放出制御コーティングの完全性を促進する。
【0079】
別の実施例では、本発明の放出制御組成物は、崩壊剤と組み合わせてなるサッカリド及び/又は糖アルコールを具える、迅速に崩壊する顆粒を更に具える。適切な崩壊剤は、例えば、クロスポビドン、グリコール酸でん粉ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換ヒドロキシプロピルセルロース、増粘剤(例えば、ジェランガム)、及びそれらの組み合わせなどからなる群から選択される崩壊剤を含むが、これらに限定されない。適切なサッカリド及び/又は糖アルコールは、アラビトール、エリトリトール、グリセロール、水素化でん粉加水分解物、イソマルト、ラクチトール、ラクトース、マルチトール、マンニトール、ソルビトール、キシリトール、サッカロース、マルトース、及びそれらの組み合わせからなる群から選択してもよい。サッカリド及び/又は糖アルコールは、スクラロースなどの人口甘味料を補充しても又はこれに置き換えてもよい。迅速に崩壊する微粒剤中のサッカリド及び/又は糖アルコールに対する錠剤分解物質の比率は、重量ベースで約1:99乃至約10:90、約5:95乃至約10:90であり、それらの間の全ての範囲及び部分的範囲を含む。多くの実施例では、崩壊剤又はサッカリド及び/又は糖アルコール、又はその両方は、約30μm又はそれ未満の平均粒径を有する粒子の形で存在する。迅速に崩壊する粒子に対するビーズを含む抗コリン薬の比率は、約1:6乃至約1:2、約1:5乃至約1:3、又は約1:6、約1:5、約1:4、約1:3、又は約1:2であり、これらの全ての範囲及びこれらの部分的な範囲を含む。
【0080】
本発明の組成物の多重放出制御コーティングは、薬剤インターフェースにおける溶解の制御に寄与し、従って、本発明の放出制御組成物の粒子から抗コリン薬(例えば、ジサイクロミン又は塩、及び/又はその溶媒和物)の放出を制御する。達成可能な遅延時間、遅延放出時間、又は持続放出特性は、放出制御コーティングの組成物と厚さに依存する。最適な1日1回の製剤の達成に影響を及ぼす特異的因子は、抗コリン薬のpKaと例えば、胃腸液(GI fluids)中の溶解度を含むが、これらに限定されない。
【0081】
本明細書に記載される多剤放出制御コーティングでコーティングされた粒子から得たインビトロ薬剤の放出データは、1日1回又は2回投与方式に適した薬物動態プロファイルを提供する抗コリン薬の放出プロファイルを提供する。一の実施例では、1日1回又は2回投与方式に適した2段階溶解法(最初の2時間は、0.1NのHClを700mL(塩酸)で、次にpH調整剤を200mL添加することにより得たpH6.8の900mLで)を検査したとき、持続放出コーティングは、約8−12時間(1日2回)乃至約16−20時間(1日1回)持続する抗コリン薬の放出を提供する。例えば、2段階溶解培地(最初の2時間は、0.1NのHClを700mL、続いてpH調整剤を添加することにより得たpH6.8のバッファ900mL中で検査される)において、37℃で米国薬局方装置2(攪拌速度@50rpm)を用いて溶解を検査すると、本発明の放出制御粒子のための適切な放出プロファイルは、実質的に以下のパターンに該当する:
4時間後、全抗コリン薬の約40±20%が放出し;
8時間後、全抗コリン薬の65±25%が放出し;及び
12時間後、全抗コリン薬の70±30%が放出した。
【0082】
本発明の放出制御組成物は、任意の薬学的に許容な添加物(結合剤、崩壊剤)、充填剤、圧縮助剤(例えば、微結晶性セルロース/融合二酸化ケイ素)で処方され、例えば、小袋、錠剤、カプセル、又は口腔内崩壊錠剤(ODTs)などの適切な経口剤形となる。一の実施例では、この剤形は、例えば、約1%未満のもろさを有する錠剤などの錠剤である。別の実施例では、この剤形は、少なくとも1つの本発明の放出制御組成物を具える粒子の集団で充填されたカプセルである。このカプセルは、例えば、ゼラチンカプセル、又はHPMCP(ヒドロキシプロピルメチルセルロース)カプセルである。
【0083】
別の実施例では、この製剤はODTである。本発明のODTは、口腔内で崩壊し、水なしで容易に飲み込むことができる。例えば、本発明のODTは、口腔内で唾液と接触又は人工唾液と接触した後60秒以内に実質上崩壊する。別の実施例では、ODTは約30秒以内に実質上崩壊する。崩壊は、USP<701>崩壊検査(全ての目的のためその全体が参照により本明細書に組み込まれている)により検査される。多くの実施例では、このODTは、ザラザラしない舌ざわり又は後味である、滑らかで飲み込み易い懸濁液を形成して、患者の口腔内で実質上崩壊し、1日1回又は2回の投与方法に適した抗コリン薬(例えば、ジサイクロミン)の標的PKプロファイル(例えば、血漿濃度対時間プロット)を提供する。例えば、このODTは、特定の実施例では、4、8、及び12時間においてはいくぶん広範な放出範囲が適切であるが、8−20時間にわたり上記のパターンと実質的に一致する抗コリン薬の持続放出を提供する。
【0084】
本発明のODT製剤は、高齢患者(従来の錠剤やカプセルを飲み込むことが大抵困難である)を治療又は精神病患者(彼等の投薬療法に大抵抵抗し又は「不満」を持っている)を治療するのに特に有用である。高齢患者および/又は精神病患者に対するODTの投与は、投薬頻度を減少させ、患者の服薬不履行を軽減する。
【0085】
特定の実施例では、本発明のODTは、治療的に有効な量のジサイクロミン又はそれらの塩及び/又は溶媒和物を具える。投与後にこのODTは、ザラザラしない舌ざわり又は後味である、滑らかで飲み込み易い懸濁液を形成して、患者の口腔内で実質上崩壊し、1日1回又は2回の投与方法に適した抗コリン薬(例えば、ジサイクロミン)の標的PKプロファイル(例えば、血漿濃度対時間プロット)を提供する。本発明の放出制御組成物と迅速に崩壊する顆粒に加えて、本発明のODTは、選択的に、圧縮性希釈剤、充填剤、着色剤、及び選択的に潤滑油など薬学的に許容な添加剤を選択的に含む。
【0086】
本発明の製剤は、上述の通り少なくとも1の放出制御粒子の集団を含む、2又はそれ以上の粒子を含む抗コリン薬の集団を具える場合がある。例えば、この製剤は、上記の通り放出制御粒子の集団を具え、更に、即効型(IR)粒子、例えば、抗コリン薬を具えるコーティングされないコアを具えることができる。一の実施例では、粒子を含む2又はそれ以上の抗コリン薬の集団を具える製剤はODTである。製剤がODTであるとき、2又はそれ以上の抗コリン薬含有粒子の集団は、迅速に崩壊する微粒剤と組み合わされ、粒子を含む抗コリン薬と迅速に崩壊する微粒剤は、口腔内でODTが崩壊した後に滑らかでザラザラしない舌ざわりを提供する粒径を有する。一の実施例では、本発明のODTは、SR、DR又はCR粒子集団の一つを具え、もう一つの実施例では、ODTは、IR粒子とSR粒子の組み合わせを具え、更に別の実施例では、ODTは、腸溶性のTPR粒子と組み合わせてなるSR粒子、及び選択的に(迅速に微粒剤を崩壊するに加え)IR粒子と組み合わせてなるSR粒子(選択的に味をマスクされた)を具える。更に別の実施例では、本発明のODTは、圧縮性コーティングの有無にかかわらず、迅速に崩壊する顆粒(例えば、マンニトール−クロスポピドン微粒剤)を具える。
【0087】
本発明のODTが、IR粒子を含んだ場合は、抗コリン薬の放出が直ちになされても、口腔内での放出を防ぐ味をマスクするコーティングでこのIR粒子をコーティングするので、抗コリン薬の後味が残らない。即ち、人工唾液(pH〜6.8)で溶解検査をすると、味をマスクされたIR粒子は、IR粒子中に含まれる抗コリン薬の全量の約10%以下を3分(口腔内中、ODTで想定される最も長いタイプの滞留時間)以内で放出するのに対し、0.1NのHCl中で溶解検査すると、IR粒子中の抗コリン薬の全量の約75%以下を約60分以内に放出する。
【0088】
本発明の様々な実施例では、この製剤が、放出制御粒子に加えてIR粒子を具えるとき、SR及び/又はTPR粒子に対するIR粒子の比率は、例えば、約10:90乃至約20:80、約30:70乃至約40:60、又は約5:95、約10:90、約15:85、約20:80、約25:75、約30:70、約35:65、約40:60、約45:55、又は約50:50など約0:100(即ち、IR粒子なし)乃至約50:50に及び、これらの全ての範囲及びこれらの部分的な範囲を含む。
【0089】
本発明の製剤の特定の実施例では、この製剤は、ジサイクロミン又はその塩、多形体、及び/又は溶媒和物(水和物を含む)を具える。
【0090】
本発明の別の実施例では、製剤の複数のビースは、様々な所望の抗コリン薬(例えば、ジサイクロミン)の放出プロファイルを得ることができる。一の実施例では、例えば、約2時間の排出半減期を有するジサイクロミンを具える1日1回の投与形態は、約8−20時間にわたり標的放出プロファイルを提示する味をマスクされたIR粒子の集団の混合物(抗コリン薬の即効型パルス、腸溶性又はTPRコーティングを有するSR粒子を提供する)を含み、12−24時間で抗コリン薬の臨床的に効果的な血漿濃度を維持する。
【0091】
別の実施例では、本発明は、放出制御組成物の調整法に関するものであって、抗コリン薬含有コアを調整するステップ(a)と;コアを覆う少なくとも1の非水溶性ポリマーを具える第1コーティングを塗布するステップ(b)と;選択的に非水溶性ポリマーに結合する腸溶性ポリマーを具える第2コーティングを塗布するステップ(c)と;を具え、この第1及び第2コーティングは、いかなる順序で塗布してもよい。
【0092】
コアを調整するステップは、例えば、不活性ビーズ(例えば、糖、微結晶性セルロース、マンニトール微結晶性セルロース、二酸化ケイ素など)を薬剤及び選択的にポリマー結合剤(例えば、流動層又はパンコーティング)を具える溶液で層状化するステップ又は選択的な添加剤で薬剤の粒子を粒状化するステップ、又は押し出し及び球状化など当該技術分野で知られた方法のいずれかによで達成する。代替として、「コアを調整する」は、所望の粒径(例えば、約50−500μm、100−250μmを含む)の薬剤又は結晶を得るステップ又は調整するステップを具えてもよい。
【0093】
いくつかの実施例では、抗コリン薬(本明細書に記載)具えるコア粒子を調整するステップと、SRコーティング(本明細書で記載)でコア粒子をコーティングするステップと、続くTPRコーティング(本明細書に記載)又はDRコーティング(本明細書に記載)するステップとを具える。別の実施例では、抗コリン薬を具えるコア粒子を調整するステップ及び次いでTPR又はDRコーティング、続いてSRコーティングでコア粒子をコーティングするステップを具える。更に別の実施例では、この方法は、抗コリン薬を具えるコア粒子を調整するステップ、次いでSR又はTPRコーティング、続いてDRコーティングでコア粒子をコーティングするステップを具える。これらの実施例の各々に対して、選択的なシーラント層を放出制御層の下、上、及び/又は間に塗布してもよい。
【0094】
更に別の実施例では、本発明の方法は更に、本明細書に記載された迅速に崩壊する顆粒を有する本明細書に記載した放出制御組成物を混合するステップ、及びブレンドされた放出制御組成物を圧縮するステップ、及び顆粒をODTへ迅速に崩壊するステップを具える。
【0095】
別の実施例では、この方法は更に、ODTへ圧縮する間に持続放出粒子の持続放出コーティングへのダメージを除去/最小にする放出制御層を覆う親水性ポリマー(例えば、ヒドロキシプロピルセルロース)を具える圧縮性ポリマーをコーティングするステップを具える。
【0096】
更に別の実施例では、本発明の方法は更に、本明細書に記載した放出制御組成物と選択的な添加剤をブレンドするステップと、ブレンドされた組成物と選択的な添加剤を錠剤に圧縮するステップを具える。
【0097】
更に別の実施例では、本発明の方法は更に、本明細書に記載された放出制御組成物と選択的な添加剤をカプセルに充填するステップを具える。適切なカプセルは、例えば、硬いゼラチンカプセル及びHPMCPカプセルを含む。
【0098】
特定の実施例では、本発明の方法は、
(a)ジサイクロミン又はその塩、多形体及び/又は溶媒和物を具える抗コリン薬剤粒子(結晶、微粒剤、ビーズを層状化した薬剤、又は50−400μm、又は約100−300μmの平均粒径のペレット)調整し、選択的に層状化された粒子に保護シールコートを塗布し、そしてIRビーズを形成するステップと;
(b)約15%乃至30%のコーティング重量でIRビーズ上に非水溶性ポリマーを具える持続放出(SR)コーティングを塗布し、SRビーズを形成するステップと;
(c1)約10%乃至30%のコーティング重量でSRビーズ上に腸溶性ポリマーを具える遅延放出(DR)コーティングを塗布するステップで、これにより放出制御(CR)ビーズを形成するステップ;及び/又は
(c2)重量比がSRビーズ上で約10:1乃至1:4、約10%乃至60%のコーティング重量で、非水溶性ポリマーと腸溶性ポリマーの結合物を具える遅延時間(TPR)コーティングを塗布するステップで、これにより放出制御ビーズを形成するステップと;
(d)糖アルコール、サッカリド、又はこれらの混合物と崩壊剤を具える迅速に崩壊する顆粒を調整するステップと;
(e)ステップ(c1)及び/又はステップ(c2)の放出制御ビーズとステップ(d)の迅速に崩壊する顆粒とブレンドするステップと;
(f)ステップ(e)のブレンドを圧縮するステップ、それによりODTを形成するステップと;を具える。
【0099】
いくつかの実施例では、ブレンドするステップ(e)は、選択的な薬学的に許容な添加剤(例えば、調味料、甘味料、崩壊剤、微結晶性セルロース)でステップ(c1)及び/又はステップ(c2)の放出制御ビーズをブレンドするステップを含む。
【0100】
別の実施例では、ブレンドするステップ(e)は、非水溶性ポリマーを具える、又は胃で溶ける有機、無機、又はポリマーポア形成と結合する非水溶性ポリマーを具える味をマスクするコーティングで選択的に味をマスクされるIRビーズでステップ(c1)及び/又はステップ(c2)の放出制御ビーズをブレンドするステップを含み、この味をマスクする層は、実質的にIRビーズの味をマスクする。
【0101】
別の実施例では、上記に記載された方法によると、調整されたODTは、口腔内の唾液又は人工唾液に触れた後、約60秒以内に実質的に崩壊する。別の実施例では、上記に記載された方法によると、調整されたODTは、口腔内の唾液又は人工唾液に触れた後、約30秒以内に実質的に崩壊する。
【0102】
IR粒子(存在するとき)の味をマスクする層に関連する用語「実質的に味をマスクする」は、患者の口腔内で苦い味の薬剤の放出を実質的に防止する味をマスクする層の能力を意味する。薬剤の味を「実質的にマスクする」味をマスクする層は、患者の口腔内で薬剤の約10%未満を通常放出し、別の実施例では、薬剤の約5%未満、約1%未満、約0.5%未満、約0.1%未満、約0.05%未満、約0.03%未満、約0.01%未満である。本発明の組成物の味をマスクする層の味をマスクする特性は、インビボ(例えば、当該技術分野で知られている従来の官能検査を用いて)又はインビトロ(例えば、本明細書で記載されるような溶解検査を用いて)で測定することができることである。薬剤の味を「実質的にマスクする」より味をマスクする層に関連する薬剤放出の量多いことは、本明細書に明確に開示された範囲に限定されるものではないことは、当業者は理解するところであり、組成物中の薬剤の苦味や他の香料添加剤の存在など別の要因によって変化する場合がある。
【0103】
本発明は、以下の節でより詳しく説明する。以下の実施例は、本発明を説明するために用いる。
【0104】
当然のことながら、本明細書に記載された実施例及び態様は、目的を説明するためだけのものであり、それらを踏まえての様々な変形又は変更が、当業者に示唆され、この出願の精神と範囲内に含まれる。
【実施例1】
【0105】
実施例1A
[IRビーズ(薬物負荷:塩酸ジサイクロミンとして約20%)]: エタノール(2100g)に塩酸ジサイクロミン(700g)をゆっくりと加えて、溶解するまで10分以上常に撹拌し、次いで、出来上がりの溶液のエタノール対水の比率が75/25になるように水(700g)を添加した。7”ボトムスプレーWurster8”ハイカラム、200メッシュ生成物保持ふるい(0.8mmポートノズル)でカバーされた「B」ボトム空気分散プレートから15mmの分配カラムギャップを装備したGlatt GPCG3を、60−80メッシュの砂糖球2800gで充満させ、製品温度を37±3℃を維持しながら、初速度5g/分を階段的に増加させ15.5g/分で、流入空気量90−105m3/時、空気噴霧圧1.50バールでジサイクロミン溶液(固形分20%)をスプレーした。50gのエタノールでスプレーシステムをすすいだ後、層状化したビーズの薬剤をGlattユニット中で50分乾燥させて、残留溶媒(蒸気を含む)を取り出した。結果として生じるジサイクロミンIRビーズを、35及び120メッシュのふるいを通してふるいにかけ、大き過ぎる粒子と微粒子を除去した。
【0106】
実施例1B
[IRビーズ(薬物負荷:結合剤を具えた塩酸ジサイクロミンとして約20%)]: ポビドン(PVP K30;100.0g)を75/25の比率の95%エタノール/水(2325.0gの95%エタノールと775.0gの水)にゆっくりと加えて、溶解するまで10分以上常に撹拌した。塩酸ジサイクロミン(800.0g)をゆっくりと加えて溶解するまで撹拌した。IRビーズを上記のように調整した。結合剤(2.5重量%)を具えるIRビーズバッチは、ポリマー結合剤(実施例1A)なしのIRビーズバッチと比べて高い効能(>19.2重量%)を有する。更に3つのビーズバッチを4.0重量%の結合剤を用いて調整した。IRビーズに19.7重量%の塩酸ジサイクロミンの平均効能を提供するために、結合剤を含む4つのビーズバッチを共にブレンドした。
【0107】
実施例1C
[SRビーズ(薬物負荷:塩酸ジサイクロミンとして約20%)]: エチルセルロース(Dow Chemicals社のEC−10、Ethocel Premium 10;159.1g)を95%エタノールにゆっくりと加えて、溶解するまで常に撹拌した。クエン酸トリエチル(TEC;15.9g)を溶解するまでゆっくりと加えた。6”ボトムスプレーWurster6”ハイカラム、0.8mmポートノズルを有する200メッシュ生成物保持ふるいでカバーされた「B」ボトム空気分散プレートを具えるGlatt GPCG1を、上記実施例1AのIRビーズ700gで充満させた。製品温度33±3℃、噴霧空気圧1.50バール、流入空気流50−75m3/時、及び20%のSRコーティング重量にすべく初流速1g/分を階段的に増加させて6g/分で、SR機能性ポリマーコーティング製剤(固形分10%)でIRビーズをスプレーした。スプレー後、コーティングされたビーズをGlattユニット中で30分乾燥させ、残留溶媒(蒸気を含む)を取り出した。500μm未満の平均粒径を有する粒子を提供するために、結果として生じるSRビーズをふるいにかけた。
【0108】
図2は、酸性のpH5.0バッファ中で検査したSRビーズの薬剤放出のプロファイルを示す。最大24時間の溶解時間において、SRビーズの放出プロファイルの違いは見られなかった。4時間で薬剤の約70%が放出された。
【実施例2】
【0109】
[SRビーズ(コーティングレベル:約30%)]: エチルセルロース(214.3g)を90/10のアセトン(1716.5g)と水(190.8g)の混合物にゆっくりと加え、溶解するまで常に撹拌した。クエン酸トリエチル(21.4g)をゆっくりと加えて溶解した。製品温度33±3℃、噴霧空気圧1.50バール、流入空気流50−75m3/時、及び30%のSRコーティング重量にすべくスプレー流速3.0−6.0g/分で、機能性ポリマー溶液(固形分11%)で上記1AのIRビーズ(500g)を、流動層コートした(15cm高さの4”Wurster insertを具えたGllatt1)。結果として生じるSRビーズをGlattユニット中で30分乾燥させ、残留溶媒を取り出した。コーティングされたビーズの約85重量%は、約355μm未満の平均粒径を有する(実施例2A)。SRビーズの別のバッチ(実施例2B)を、IRビーズ(上記実施例1Aの500g)を用いて、より濃度の低いポリマー溶液(即ち、固形分5.5%)をスプレーすることにより同様に調整したふるいにかけて収集したコーティングされたペレットの約99%は、約355μm未満の平均粒径を有する。いずれにしても、分析的検査(例えば、分析及び薬剤放出)のため、20%のコーティング重量のサンプルを取り出した。
【0110】
図3は、コーティング重量が30%の実施例2AのSRビーズ、及びコーティング重量が20%及び30%の実施例2BのSRビーズの薬剤放出プロファイルを示す。
【実施例3】
【0111】
実施例3A
[TPRビーズ(55/30/15のEC−10/HP−55/TEC)]: エチルセルロース(EC−10;93.0g)を90/10(1876.4gのアセトンと208.5gの水)のアセトン/水にゆっくりと加えて溶解するまで徹底的に撹拌した。ヒプロメロースフタレート(信越化学株式会社のHP−55;50.7g)をEC−10溶液に加えて、溶解するまでしっかり撹拌した。均一に溶解/分散するまで溶液にTEC(25.4g)を加え、これによりTPRコーティング製剤を形成する。4”Wurster insertを具えたGlatt1中で、製品温度33±2℃、噴霧空気圧1.50バール、流入空気量70−90m3/時、及び30重量%のTPRコーティングレベルにすべくスプレー流速3−6g/分で、実施例1Aで調整したIRビーズ(395g)をTPRコーティング製剤(固形分7.5%)で流動層コートした。薬剤放出検査をするため、15重量%、20重量%及び25重量%のコーティンレベルのサンプルを取り出した。約355μm未満の平均粒径を有する乾燥ビーズをふるいにかけて収集した。
【0112】
実施例3B
[CRビーズ]: 実施例1Cで記載したような20%のコーティング重量にすべく、実施例1Bで調整したIRビーズ(440g)をEC−10/TEC(比率:10/1)溶液(固形分5.5%)で流動層コートした。上記実施例3Aで記載したような20%のTPRコーティング重量にすべく、Glatt1中でこれらのSRビーズを更にTPRコーティング製剤(55/30/15のEC−10/HP−55TEC;固形分7.5%)でコートした。薬剤放出検査をするため、10%と15%のコーティング重量のサンプルを取り出した。このように調整され、355μm未満の平均粒径を有する乾燥CRビーズをふるいにかけて収集した。
【0113】
図4は、TPRビーズ(実施例3A)と上記実施例3Bで調整されたCRビーズの薬剤放出プロファイルを示しており、平均粒径355μm未満のコーティングされたビーズからの薬剤放出における非水溶性ポリマーを具える内部障壁層の顕著な効果を説明する。
【実施例4】
【0114】
実施例4A
[SRビーズ(20%SRコーティング)]: 上記実施例1BのIRビーズ(550g)を20%のコーティング重量にすべく、90/10のアセトン/水中で溶解させた(固形分5.5%)SR機能性ポリマーコーティング(10/1のEC−10/TEC)で流動層コートした。
【0115】
実施例4B
[CRビーズ(20%SRコーティング上に20%DRコーティング)]: 上記実施例4Aの多くのSRビーズを20%のDR(遅延放出)コーティング重量にすべく、アセトン(2278g)/水(255g)中で溶解させた10/1の比率のHP−55/TECの溶液(固形分5.5%)で、更にコートした。結果として生じるCRビーズをGlattユニット中で20分乾燥させ、残留溶媒を取り出した。平均粒径355μm未満の乾燥ビーズをふるいにかけて収集した。
【0116】
実施例4C
[CRビーズ(20%TPRコーティング上に20%DRコーティング)]: 実施例1Bで調整されたIRビーズ(550g)を20%の増量にすべく、90/10のアセトン/水中で溶解させた(固形分7.5%)TPR機能性ポリマーコーティング(60/25/15のEC−10/HP−55/TEC)で最初にコートした。更にこのTPRビーズの550gの多くを20%のSRコーティング重量にすべく、アセトン(2278g)/水(255g)中で溶解させた10/1の比率のHP−55/TEC(固形分5.5%)の溶液でコートした。結果として生じるCRビーズをGlattユニット中で20分乾燥させ、残留溶媒を取り出した。平均粒径355μm未満の乾燥ビーズをふるいにかけて収集した。
【0117】
図5は、実施例4AのSRビーズ(IRビーズをSRでコーティングした)及び実施例4Bと4Cの異なる二重膜を具えるCRビーズの薬剤放出プロファイルを示す。
【実施例5】
【0118】
実施例5A
[MCC不活性コアを具えるIRビーズ]: 75/25の95%エタノール/水(855gの95%エタノールと285gの水)にポビドン(PVP K30;60g)をゆっくりと加えて、10分以上溶解するまで常に撹拌した。塩酸ジサイクロミン(300g)をゆっくりと加えて溶解するまで撹拌した。6”ボトムスプレーWurster15cmハイカラム、200メッシュ生成物保持ふるい(0.8mmポートノズル)でカバーされた「B」ボトム分散プレートから15mmの分配カラムギャップを具えるGlatt GPCG1を、微結晶セルロース球(Glatt社の平均粒径100μmのCellets100)1140gで充満させ、製品温度34±3℃を維持しながら、スプレー速度3−9g/分、流入空気量80−100m3/時、空気噴霧圧1.5バールで塩酸ジサイクロミン溶液(固形分20%)をスプレーした。50gのエタノールでスプレーシステムをすすいだ後、層状化したビーズの薬剤をGlattユニット中で30分乾燥させて、残留溶媒(蒸気を含む)を取り出した。結果として生じるジサイクロミンIRビーズを、125及び250μmのふるいを通してふるいにかけ、大き過ぎる粒子と微粒子を除去した。
【0119】
実施例5B
[SRビーズ(EC−10/TECで20%がコーティングされた)]: 実施例5AのIRビーズ(550g)を上記実施例2に記載した20%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。
【0120】
実施例5C
[CRビーズ(20%SR(EC−10/TEC)上に30%TPR(60/25/15)]: 実施例5AのIRビーズ(550g)を上記実施例2に記載した20%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。このたくさんのSRビーズを30%のコーティング重量にすべく、90/10のアセトン/水中で溶解させた60/25/15の比率のEC−10/HP−55/TECの溶液(固形分7.5%)でコートした。結果として生じるCRビーズをGlatt中で5分間乾燥させ、残留溶媒を取り出した。約355μm未満の平均粒径を有する粒径の約90%を含む及び約425μm未満の平均粒径を有する粒径の約99%を含む乾燥ビーズをふるいにかけて収集した。
【0121】
図6は、60−80メッシュ砂糖球(177−250μmの平均直径)を具えるCRビーズ(実施例3B)と比較したSRビーズ(実施例5B)とCellets100(100μmの平均直径を有する微結晶セルロース球)を具えるCRビーズ(実施例5C)の薬剤放出プロファイルを示す。
【実施例6】
【0122】
実施例6A
[CRビーズ(17.5%SR(EC−10/TEC)上に22.5%TPR(60/30/10)]: 上記実施例5AのIRビーズを上記実施例2に記載した15%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。このたくさんのSRビーズを20%のTPRコーティング重量にすべく、90/10のアセトン/水中で溶解させた比率60/30/10のEC−10/HP−55/TECの溶液(固形分7.5%)で、更にコートした。結果として生じたCRビーズをGlatt内で15分乾燥させ、残留溶媒を取り出した。平均粒径が約355μm未満の粒子を含む乾燥ビーズをふるいにかけて収集した。
【0123】
実施例6B
[CRビーズ17.5%SR(EC−10/TEC)上に25%DR(90/10)]: 実施例5AのIRビーズを上記実施例2に記載した17.5%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。このたくさんのSRビーズを20重量%のDRコーティング重量にすべく、90/10のアセトン/水中で溶解させた比率90/10のHP−55/TECの溶液(固形分7.5%)でコートした。結果として生じるCRビーズをGlatt内で15分乾燥させて、残留溶媒を取り出した。約355μm未満の平均粒径を有する粒子を含む乾燥ビーズをふるいにかけて収集した。
【0124】
実施例6C
[迅速に崩壊する微粒剤]: その全体が参照により本明細書に組み込まれている、2003年11月20日に公開された同時係属の米国特許出願公開第2003/0215500号に開示された手順に従って迅速に崩壊する微粒剤を調整した。特に、平均粒径が約20μm又はそれ未満(フランス、Roquette社のPearlitol25)のD−マンニトール(152kg)を8kgの架橋ポビドン(ISP社のCrospovidone XL−10)を高せん断造粒機(Vector社のGMX 600)でブレンドし、精製水(約32kg)で顆粒化し、Quadro社のComilを用いて湿式粉砕し、及び最後に約0.8%未満のLOD(乾燥減量)を有する微粒剤を提供するためにトレイ乾燥した。乾燥顆粒をふるいにかけ、約175−300μmの平均粒径を有する迅速に崩壊する微粒剤を生成すべく、大きすぎる材料を再度粉砕した。
【0125】
実施例6D
[塩酸ジサイクロミン CR ODT、40−mgと80−mg]: 表1は実施例6AのCRビーズとして40−mg又は80−mg塩酸ジサイクロミンを具える口腔内崩壊錠剤の組成物をリストアップした。薬学的に許容な成分(即ち、1の香料(例えば、ペパーミント、サクランボ、又はウィンターグリーン)、0.35の甘味料(スクラロース)、5の崩壊剤(例えば、クロスポビドン、でん粉グリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換ヒドロキシプロピルセルロース)、及び10の微結晶セルロース(Avicel PH101又はCeolus KG−802)を、最初に44.59の迅速に崩壊する微粒剤(上記実施例6Cに記載されるように調整された)予混合剤をブレンドしたVブレンダー中で均一になるようにブレンドし、39.06の塩酸ジサイクロミンCRビーズ(上記実施例6A)をブレンドし、ツインシェルVブレンダー中で均一なブレンドされた圧縮混合物を得るために十分な時間予混合物を事前に調整した。40−mg又は80−mgの塩酸ジサイクロミンを具えるODTを、外部潤滑システム(Matsui Ex−Lube System)を装備した生成スケール秦タブレットプレスを用いて、HDPEボトル中にパックするのに適した許容される錠剤化特性、裏紙をはがすAclar200ブリスター、及び/又はAclarブリスターパックを「押し通す」を提供するために最適化された錠剤条件化で圧縮した。例えば、CRビーズとして塩酸ジサイクロミン40mgを具えるODTは、以下の条件:−ツーリング:14mmの円、平らな表面、半円状の縁;圧縮力:12−16kN;平均重量:800mg;平均硬度:〜30−60N;及び破砕性:0.2−0.4%で圧縮した。そのように生成される塩酸ジサイクロミン CR ODT(40mg又は80mg)は、飲み込むのを容易に、簡単にする懸濁液を作り、コーティングされた塩酸ジサイクロミンビーズを具えて、1日1回又は2回の投与方式に適した放出プロファイルを有し、口腔内で迅速に崩壊する。迅速に崩壊する顆粒がより多く含まれるODT錠は、わずかに口当たりがよく、崩壊時間がより短い。
【0126】
【表1】

【実施例7】
【0127】
実施例7A
[塩酸ジサイクロミンIRビーズ(薬物負荷:30%w/w)]: 上記実施例1Bに記載されるように、塩酸ジサイクロミンをゆっくりと加えて、結合剤(プロビン(PVP K30)4重量%)と溶媒(95%エタノールと水の比率75/25)の溶液を、溶解するまで撹拌した。7”ボトムスプレーWurster8”ハイカラム、200メッシュ生成物ふるい、1.2mmポートノズル、でカバーされた「B」ボトム空気分散プレートを装備したGlatt GPCG3をCellets100(微結晶セルロース球)2500gで充満させ、次いで、製品温度33±3℃を維持しながら、ジサイクロミン溶液(固形分20%)を噴霧圧1.8バール、スプレー速度10−15g/分、流入空気量80−125m3/時、及び空気噴霧圧1.8バールでスプレーした。50gのアセトンですすいだ後、シールコート溶液(85/15のアセトン/水中でKlucel LFを溶解させた、固形分7.5%)を初速度10g/分でスプレーし、Glattユニット内で5分間乾燥させ、残留溶媒(蒸気を含む)を取り出した。結果として生じるIRビーズをふるいにかけ、大きすぎる(355μm又は50メッシュより大きい)ビーズと微粒子(100メッシュ未満)を除去した。
【0128】
実施例7B
[ジサイクロミンCRビーズ(15%SR(EC−10/TEC)上に20%TPR(60/30/10)]: 上記実施例2に記載されるように、エチルセルロース(EC−10)を90/10のアセトン/水混合物にゆっくりと加えて溶解するまで撹拌し、続いて可塑剤(TEC)を加えて、SRコーティング溶液を調整した。上記実施例7Aの塩酸ジサイクロミンIRビーズを、6”ボトムスプレーWurster8”ハイカラム、1.0mmノズルポート、及び「C」分散プレートを装備するGlatt GPCG1に充満させ、流体化空気量80−100m3/時、噴霧空気圧1.25バール、目標製品温度33℃、及び15重量%の重量増加するためスプレー速度約6−10g/分でSRコーティング溶液をコーティングした。
【0129】
Glattユニットでの20%のコーティング重量と同じく、60/30/10の比率でEC−10、HP−55、及びTECを具えるTPRコーティング溶液で上記SRビーズをスプレーし、90/10のアセトン/水混合物中で溶解させた(固形分7.5%)。実施例7Aに記載のように、アセトンですすいだ後、85/15のアセトン/水中で溶解させたヒドロキシプロピルセルロース(Klucel LF)の圧縮コーティング(固形分7.5%)を塗布し、次いで、Glattユニットで15分乾燥させ、残留溶媒(蒸気を含む)を取り出した。
【0130】
実施例7C
[塩酸ジサイクロミン ODT CR、40−mg及び80−mg]: 微粒剤(上記実施例6Cに記載されるように調整された)と実施例7Bの塩酸ジサイクロミンCRビーズを迅速に分散させる適切な量を、圧縮に適した均一に分散されたブレンドを提供するのに十分な時間、ツインシェルVブレンダー中で、予めブレンドされた薬学的に許容な成分(成分と量に関して表1、実施例7を参照されたい)とブレンドした。最適化された打錠条件下で許容な打錠特性(例えば、一般的に0.5%未満の破砕性)を提供する、外部潤滑システム(Matsui Ex−Lube System)を装備した生成スケール秦タブレットプレスを用いて、CRビーズとして40−mg又は80−mgの塩酸ジサイクロミンを具えるODTを圧縮した。このように生成した塩酸ジサイクロミン CR ODT(40mg又は80mg)は、1日1回又は2回の投与方法に適した放出プロファイルを有し、コーティングされた塩酸ジサイクロミンCRビーズを具え、滑らかで、簡単に飲み込むことのできる懸濁液を生成して口腔内で迅速に崩壊する。
【実施例8】
【0131】
実施例8A
[チアガビンIRビーズ(薬物負荷:30%w/w)]: 上記実施例1Bで開示した手続きと同様に結合剤(4重量%のKlucel LF)の溶液にチアガビンをゆっくりと加えて、溶解するまで撹拌した。2500gのCellets100(微結晶セルロース球)で、Glatt GPCG3を充満させ、ステップ7.Aで記載したチアガビン溶液でスプレーした。50gのアセトンですすいだ後、シールコート溶液(85/15のアセトン/水中で溶解されたKlucel LF、固形分7.5%)を、初速度10g/分でスプレーし、Glattユニットで5分間乾燥させ、残留溶媒(蒸気を含む)を取り出した。結果として生じるIRビーズをふるいにかけ、大きすぎる(355μm又は50メッシュより大きい)ビーズと微粒子(100メッシュ未満)を除去した。
【0132】
実施例8B
[チアガビンCRビーズ(10%SR(EC−10/TEC)上に90/10の25%DR(HP−55/TEC)]: Glatt GPCG3に上記実施例8AのIRビーズを充満させ、10重量%の重量を増加すべくEC−10とクエン酸トリエチルを具えるSRコーティング溶液でスプレーした。
【0133】
25%のコーティング重量への同じGlattユニットで、90/10のアセトン/水の混合物中で溶解させた90/10の比率のHP−55とTECを具えるDRコーティング溶液(固形分7.5%)で上記のSRビーズをスプレーした。実施例7Aに記載したようにアセトンですすいだ後、85/15のアセトン/水で溶解させたヒドロキシプロピルセルロース(Klucel LF)、7.5%の固形分の圧縮コーティングを塗布し、次いで、Glattユニットで15分乾燥させ、残留溶媒(蒸気を含む)を取り出した。
【0134】
実施例8C
[チアガビンOPT CR、20mg及び40mg]: 微粒剤(上記実施例6Cに記載されるように調整された)と実施例8BのチアガビンCRビーズを迅速に分散させる適切な量が、圧縮に適した均一に分散されたブレンドを提供するのに十分な時間、ツインシェルVブレンダー中で、予めブレンドされた薬学的に許容な成分(成分と量に関して表1、実施例7を参照されたい)とブレンドされた。最適化された打錠条件下で許容な打錠特性(例えば、一般的に0.5%未満の破砕性)を提供する、外部潤滑システム(Matsui Ex−Lube System)を装備した生成スケール秦タブレットプレスを用いて、CRビーズとしての20mg又は40mgのチアガビンを具えるODTを圧縮した。 このように生成されたチアガビンCR ODT(20mg又は40mg)は、1日1回又は2回の投与方法に適した放出プロファイルを有し、コーティングされたチアガビンCRビーズを具え、滑らかで、簡単に飲み込むことのできる懸濁液を生成して口腔内で迅速に崩壊する。
【0135】
本明細書に特定の実施例に関連して本発明を説明したが、当然のことながら、更なる変更が可能であり、この出願は、一般に本願の原理に従い、そして、本願の関連する技術内の刊行及び知識内にあるような本開示からの逸脱を含む発明の任意の変形、用法、又は適合をカバーすることを意図する。
【技術分野】
【0001】
[関連出願の相互参照]
本出願は、2009年2月23日出願の米国暫定出願第61/154,504号の優先権を主張し、全ての目的のためにその全体が参照により本明細書に組み込まれている。本発明は、ジサイクロミンなどの抗コリン薬を具える組成物、及びかかる組成物の生成若しくは使用方法に関する。
【背景技術】
【0002】
抗コリン薬は、平滑筋細胞の表面上のコリン作動性受容体上のアセチルコリン活性を阻害し、例えば、平滑筋弛緩薬、鎮痙薬、抗動揺病薬、抗ヒスタミン、気管支拡張薬など、分類としてさまざまな臨床応用の有用性を有する。
【0003】
用量依存性の副作用を最小限にしながら、抗コリン薬を、1日1回の服薬スケジュールを用いて24時間にわたり薬の治療レベルを提供する放出制御製剤を形成するのは困難な場合がある。その薬の薬物速度論的特性や物理的特性のため、1日1回の持続放出製剤の設計が更に困難となる。例えば、ビシクロヘキシル−1−カルボン酸、2−ジエチルアミノエステル(ジシクロベリンとしても知られる、ジサイクロミン)は、平滑弛緩特性を有する典型的な抗コリン薬である。現在市販されているジサイクロミンの製剤を投与後間もなく(最高血中濃度到達時間が約1.5−3時間)、血漿内の薬の濃度が急上昇し、1.8時間の半減期(t1/2)で素速く除去される、非常に速い溶解プロファイルを有する。この迅速な最高血中濃度到達時間と短い半減期の組み合わせた場合は、24時間にわたる許容血清レベルを維持するために、1日に複数回投与する従来のジサイクロミン製剤が必要である。
【0004】
中程度乃至重度の過敏性腸症候群に関連する腹部の攣縮や疼痛の治療に塩酸ジサイクロミンなどの抗コリン薬を用いる。平滑筋弛緩薬として作用し、過敏性腸症候群(IBS)に関連する結腸の攣縮により腹部の疼痛及び膨満を緩和するためにジサイクロミン、ムスカリン性M1アセチルコリン受容体拮抗薬を鎮痙薬として用いる。自律性ニューロパシーがIBSを引き起こし、交感神経の増進が下痢に関連する一方、迷走神経緊張の低下が便秘を引き起こす。IBSの症例の大部分は、心理的な病的状態と内臓過敏の相互関係の結果である。IBS患者は、不安神経症、鬱病及び睡眠障害の発生率がより高い。拡張基底上、即効型治療薬を1日に数回服用する中程度乃至重度のIBS患者は、ドライマウス、目まい、視力障害、吐き気など典型的な抗コリン薬の副作用が問題となる。深刻な症状により頻繁に、強烈に、及び慢性的に日常の機能が妨げられる。中程度乃至重度の症状は更に、長旅や外出を避ける傾向があるので、社会的生活に影響を及ぼす(Drossman,D.2006 Gastroenterology 20(5):121−132 and Smith,D.G.2005 Am J Manag Care 11:S43−S50)。Bentyl(登録商標)(即効型塩酸ジサイクロミンカプセル)の添付文書によると、臨床試験の100人の患者のうち46人は、副作用が原因で推奨された160mgの1日量を摂取することが出来なかった。米国のIBSの罹患率は、一般人口の15−20%である。というわけで、患者の服薬順守だけでなく、ドライマウス、目まい、視力障害、吐き気など共通の副作用に関連し最高血中濃度(Cmax)にまで血清濃度が急上昇するので、従来のジサイクロミン製剤は、決して臨床的に最適とはいえない。
【0005】
従って、単回の、1日1回の投与スケジュールで、臨床的に有効な効果を提供する抗コリン薬の放出制御処方が必要である。更に詳細には、例えば、腸運動過剰の治療で、24時間にわたり1日1回の投薬を可能にする、臨床的に有効な治療的に薬の血清中濃度を維持する抗コリン薬の製剤が必要となる。
【発明の概要】
【0006】
一の実施例では、本発明は、複数の抗コリン薬含有粒子を具える放出制御組成物に関するものであって、この粒子が:
(a)抗コリン薬を具えるコアと;
(b)少なくとも1つの非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わせた腸溶性ポリマーを具え第1コーティングを覆って配置される第2コーティングと;を具えることを特徴とする組成物。
【0007】
別の実施例では、本発明は、製剤に関するものであって:
(a)抗コリン薬を具えるコアと;
(b)少なくとも1つの非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わせた腸溶性ポリマーを具え第1コーティングを覆って配置される第2コーティングと;
(d)各々400μm以下の平均粒径を有する複数の迅速に分散する微粒剤とを具え、該微粒剤が、
(i)崩壊剤と
(ii)糖アルコール及び/又はサッカリドを具え、
該糖アルコール及び/又はサッカリドが、30μm以下の平均粒径を有し、前記製剤が、口腔内崩壊錠剤であることを特徴とするものである。
【0008】
更に別の実施例では、本発明が、放出制御組成物の調整法に関するものであって、
(a)抗コリン薬を具える複数のコアを調整するステップと;
(b)選択的に腸溶性ポリマーと組み合わせる少なくとも1つの非水溶性ポリマーを具える第1コーティングで前記コアをコーティングするステップと;
(c)選択的に非水溶性ポリマーと組み合わせる腸溶性ポリマーを具える前記第2コーティングであって、ステップ(b)から得られる前記コーティングされたコアを覆って配置される第2コーティングを適用するステップと;
(d)ステップ(a)の抗コリン薬及びステップ(c)の前記コーティングされたコアを臨床的に有効な量カプセルに充填するステップと;を具える調整法である。
【0009】
更に別の実施例では、本発明が、放出制御組成物の調整法に関するものであって、
(a)抗コリン薬を具える複数のコアを調整するステップと;
(b)少なくとも1つの非水溶性ポリマーを具える第1コーティングで前記コアをコーティングするステップと;
(c)選択的に非水溶性ポリマーと組み合わせる腸溶性ポリマーを具える前記第2コーティングであって、コーティングされた前記コアを覆って配置される第2コーティングを適用するステップと;
(d)各々平均粒径が400μm以下の迅速に分散する微粒剤であって、
(i)崩壊剤と
(ii)糖アルコール及び/又はサッカリドを具え、該糖アルコール及び/又はサッカリドが、各々30μm以下の平均粒径を有する微粒剤を調整するステップと;
(e)ステップ(a)のコアの臨床的に有効な量とステップ(c)の一部の前記コーティングされる薬を具える混合物を(d)の前記迅速に分散する微粒剤と共に口腔内崩壊錠剤へ圧縮するステップと;を具える調整方法である。
【0010】
更に別の実施例では、それを必要とする患者に本発明の組成物の治療量を投与するステップを具える、腸運動過剰又は過敏性腸症群の治療法に関する。
【図面の簡単な説明】
【0011】
【図1】図1は、CR(放出制御)ビーズの実施例の断面図である。図1Aは、SRコーティングされたIRビーズ(抗コリン薬層(3)、シールコート(5)、及びSRコーティング(7)でコーティングされた不活性コア(1))を覆って配置されるTPR(周期的パルス放出)コーティング(9)を具えるCRビーズ(10)を示す。図1Bは、SRコーティングされたIRビーズ(抗コリン薬層(3)、シールコート(5)、及びSRコーティング(11)でコーティングされた不活性コア(1))を覆って配置されるDRコーティング(13)を具えるCRビーズ(15)を示す。図1Cは、TPRコーティングされたIRビーズ(抗コリン薬層(3)、シールコート(5)、及びTPRコーティング(17)でコーティングされた不活性コア(1))を覆って配置されるDRコーティング(19)を具えるCRビーズ(20)を示す。
【図2】図2は、実施例1のSR(持続放出)ビーズのジサイクロミン放出特性を示す。
【図3】図3は、実施例2のSRビーズのジサイクロミン放出特性を示す。
【図4】図4は、実施例3のTPR(周期的パルス放出)ビーズ及びCR(放出制御)のジサイクロミン放出特性を示す。
【図5】図5は、実施例4のSRビーズとCRビーズのジサイクロミン放出特性を示す。
【図6】図6は、実施例5のSRビーズとCRビーズのジサイクロミン放出特性を示す。
【発明を実施するための形態】
【0012】
以下の記述は、本発明の理解に関する有用な情報を含む。これは、本明細書に提供される情報のいずれかが、先行技術であること、又は黙示的に参照されるいずれかの刊行物が先行技術であると認めるものではない。
【0013】
個々の文献が特に、個別に参照により組み込まれているのと同程度に、本明細書で引用された全ての文献は、全ての目的のためにその全体が参照により組み込まれている。
【0014】
本明細書で用いられる用語「薬剤」、「活性」、「活性剤」又は「原薬」は、薬学的に許容で治療効果のある化合物、薬学的に許容な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形体、及び/又はそれらのエステルを含む。本発明の様々な実施例の記述において薬剤に言及するときは、他に指示のない限り、その言及は塩基性薬剤、薬学的に許容な塩、立体異性体及び溶媒和物(水和物を含む)、多形体、及び/又はそれらのエステルを含む。
【0015】
用語「塩」は、薬剤の「遊離塩基」の形で適切な無機酸又は有機酸が反応し形成する生成物を意味する。適切な酸は、例えば毒性の低い酸、ヒトや動物で使用が認可された塩のように、安定な塩を形成するのに十分な酸性度を有するものを含んでいる。ジサイクロミンの塩を形成するのに用いる酸の非限定的な例は、HF、HCl、HBr、HI、H2SO4、H3PO4などの無機酸を含み、有機酸の非限定的な例は、フェニル、αナフチル、βナフチル、(S)カンファ、メチル、エチル、n−プロピル、i−プロピル、n−ブチル、s−ブチル、i−ブチル、t−ブチル、ペンチル及ヘキシルスルホン酸などのC6−16アリルスルホン酸、C6−16ヘテロアリールスルホン酸、C1−16アルキルスルホン酸を含み、有機酸の非限定的な例は、酢酸、グリコール酸、乳酸、ピルピン酸、マロン酸、グルタル酸、酒石酸、クエン酸、フマル酸、コハク酸、リンゴ酸、マレイン酸、ヒドロキシマレイン酸、安息香酸、ヒドロキシ安息香酸、フェニル酢酸、桂皮酸、サリチル酸、及び2−フェノキシ安息香酸などのカルボン酸C1−16アルキル、C6−16アリルカルボン酸及びC4−16ヘテロアリールカルボン酸を含み、有機酸の非限定的な例は、リジン、アルギニン、グルタミン酸、グリシン、セリン、トレオニン、アラニン、イソロイシン、ロイシンなど天然アミノ酸を含む。他の適切な塩は、例えば、S.M.Birgeら,J.Pharm.Sci.,1977,66,1−19頁に記載されている(全ての目的のため参照により本明細書に組み込まれている)。多くの実施例では、「塩」とは、特に哺乳類細胞にとって、生物学的に適合な又は薬学的に許容なあるいは毒性のない塩を意味する。本発明で有用な薬剤の塩は、結晶性あるいは非結晶性、又は様々な結晶形の混合物、及び/又は結晶形と非晶形の混合物である。
【0016】
用語「口腔内崩壊錠剤」又は「ODT」は、投与後に噛む必要なく、患者の口腔内で迅速に崩壊する錠剤を意味する。本明細書で記載した(例えば、the USP<701>検査法)検査したところ、この壊変率はばらつきがあるものの、投与後直ちに飲み込むことを目的した従来の固形の剤形(例えば、錠剤又はカプセル)の壊変率よりも高く、チュアブルタイプの固形の剤形の壊変率よりも高い。
【0017】
本明細書で使用する用語「約」は数量を意味し、「ちょうど」を含む。例えば、「約60秒」は、60秒に近い値(例えば、50秒、55秒、59秒、61秒、65秒、70秒など)だけでなく、ちょうど60秒も含む。
【0018】
本明細書で用いられる用語「放出制御コーティング」や「放出制御」は、放出を遅延し、放出を持続し、放出を阻止するコーティング、及び/又はその他放出制御コーティングでコーティングされた粒子でできた薬剤の放出を引き延ばすコーティングを含む。用語「放出制御」は、「維持放出」、「周期的パルス放出」、及び「遅延時間」を含む。従って、「放出制御」は維持放出コーティング、周期的パルス放出コーティング、又は「遅延時間」コーティングを含む。
【0019】
本明細書で用いられる用語「pH感受性の」は、溶解度に依存するpHを示すポリマーを意味する。
【0020】
本明細書で用いられる用語「腸溶性ポリマー」は、胃液に耐性があり(即ち、胃の中で見られる低pH値において比較的不溶性)腸管中で見られるより高いpH値で溶解するpH感受性ポリマーを意味する。
【0021】
本明細書で用いられる用語「即効型」(製剤又は製剤の成分になり得る医薬組成物に関する)は、製剤の投与後約2時間以内又は約1時間以内で、一の実施例では、約50%活性より高い又はこれに等しい放出をする医薬組成物、別の実施例では、約75%活性より高い放出をする医薬組成物、別の実施例では、約90%活性より高い放出をする医薬組成物、及び別の実施例では、約95%活性より高い放出をする医薬組成物を意味する。この用語はまた「遅延時間」(活性の少ししか放出が生じない又は活性の放出が生じない)の後に比較的迅速に活性の放出が生じる医薬組成物を意味する。
【0022】
用語「即効型(IR)ビーズ」又は「即効型粒子」は、広く、本明細書で記載される抗コリン薬に関する「即効性」特性を示す抗コリン薬含有ビーズ又は粒子を意味する。
【0023】
用語「持続放出(SR)ビーズ」又は「持続放出粒子」は広く、本明細書で記載されるSRコーティングでコーティングされたコアを含む抗コリン薬を覆って配置される本明細書で記載されるSRコーティングを具えるビーズ又は粒子を意味する。
【0024】
用語「SRコーティング」は、本明細書に記載される非水溶性ポリマーを具える持続放出コーティングを意味する。それ自身によるSRコーティングは、持続放出プロファイルを提供する。
【0025】
用語「遅延時間コーティング」又は「TPRコーティング」は、本明細書で使用される非水溶性ポリマーと腸溶性ポリマーの組み合わせを具える制御放出コーティングを意味する。それ自身によるTPRコーティングは、事前に決定された遅延時間後に、薬剤の即効型パルス又は持続薬剤放出プロファイルを提供する。
【0026】
用語「遅延時間(TPR)ビーズ」又は、「遅延時間粒子」は、広く、本明細書に記載されるコアを具える抗コリン薬を覆って配置されるTPRコーティングを具えるビーズ又は粒子を意味する。
【0027】
用語「遅延放出(DR)ビーズ」又は「遅延放出粒子」は、広く、本明細書で記載されるDRコーティングでコーティングされたコアを含んだ抗コリン薬を意味する。
【0028】
用語「DRコ−ティング」は、本明細書で記載される腸溶性ポリマーを具える遅延放出コーティングを意味する。それ自身によるDRコーティングは、遅延放出プロファイルを提供する。
【0029】
用語「放出制御(CR)ビーズ」又は「放出制御粒子」は、広く、本明細書で記載される内部SR又はTPRコーティングと外部SR、DR、又はTPRコーティングを有するコアを含んだ抗コリン薬を意味する。
【0030】
本明細書で用いられる用語「遅延時間」は、医薬組成物(又は医薬組成物を具える製剤)の摂取後又は医薬組成物あるいは医薬組成物を具える製剤の擬似体液への暴露後に、医薬組成物から放出される活性が約10%未満である又は期間を意味するものであり、これは、例えば、2段階溶解溶媒を用いたUSP装置で評価(最初の2時間は、37℃の0.1NのHClを700mL中で、その後pH調整剤の200mL添加によりpH=6.8にして溶解検査する)される。
【0031】
用語「覆って配置される」は、例えば基質上のコーティングに関して、コーティングの相対的な位置を意味するが、基質に直接接触するコーティングである必要はない。例えば、基質を「覆って配置される」第1コーティングは、基質に直接接触してもよく、あるいは1又はそれ以上の介在材料又はコーティングを第1コーティングと基質の間に置いてもよい。つまり、例えば、コアを含んだ薬剤を覆って配置されるSRコーティングは、コアを含んだ薬剤に直接蒸着されるSRコーティングを意味するとも言え、あるいは、コアを含んだ薬剤に蒸着される保護シールコーティングに蒸着されるSRコーティングを意味するとも言える。
【0032】
用語「血漿濃度−時間プロファイル」、「最高血中濃度(Cmax)」、「AUC」、「最高血中濃度到達時間(Tmax)」、及び「排出半減期」は、一般に食品医薬品局の産業の手引きで定義されるような意義を有する:Bioavailability and Bioequivalence Studies for Orally Administered Drug Products−General Considerations(2003年3月発行)。
【0033】
特に明記しない限り、本明細書に記載される様々なコーティングの量又は層の量(「コーティング重量」)は、コーティング前の粒子又はビーズの初期重量と比較してドライコーティングによって与えられた粒子又はビーズの増加した重量をパーセントで表す。従って、10%コーティング重量は、10%粒子の重量が増加するドライコーティングを意味する。
【0034】
多くの実施例では、複数の抗コリン薬含有粒子を具える放出制御組成物を対象とする。抗コリン薬含有粒子は、抗コリン薬を含むコアを具える。このコアは、所望の拡張放出特性を示す2又はそれ以上のコーティングでコーティングされる。コアを覆って配置される第1コーティングは、少なくとも1つの非水溶性ポリマーを具え、コアを覆って配置される第2コーティングは、腸溶性ポリマーと選択的な非水溶性ポリマーを具える。第1及び第2コーティングを、任意の順序で塗布してもよい。即ち、コア粒子を含んだ抗コリン薬を覆って第1コーティングを塗布し、続けて第2コーティングをしてもよく、コア粒子を含んだ抗コリン薬を覆って第2コーティングを塗布して、続けて第1コーティングをしてもよい。第1及び第2コーティングに加えて任意の順序で、即ち第1及び第2コーティングの前、間、又はそれらの後に、他のコーティングを塗布してもよい。
【0035】
適切な抗コリン薬は、例えば、アトロピン、ベナクチジン、ベンズトロピン、ビベリデン、臭化ブチルスコポラミン、シクロペントレートダリフェナシン、デキセチミド、ジサイクロミン、エメプロニウム、グリコピロレート、ヘキサヒドロシラジフェニドール、オクチロニウム、オルフェナドリン、オキシブチニン、オキシフェノニウム、ピレンゼピン、プロシクリジン、プロパンテリン、プロピルベンジルコリン、キニジン、キヌクリジニルベンジラート、スコポラミン、トルテロジントリヘキシフェニジル、トロピカミド、ミバクリウム、アトラクリウム、ドキサクリウム、シスアトラクリウム、ベクロニウム、ロクロニウム、パンクロニウム、ツボクラリン(tabocurarine)、ガラミン、ピペクロニウム、ヘキサメトニウム、メカミラミン、トリメタファン、スクシニルコリン、スキサメトニウム、デカメトニウム、メトキシコロナリジン、メカミラミン、イミダファナシンなどである。
【0036】
特定の実施例では、本発明の抗コリン薬組成物は、ジサイクロミン又はその塩、及び/又は溶媒和物を具える。ジサイクロミン(ビシクロヘキシル−1−カルボン酸,2−(ジエチルアミノ)エチルエステル)は、以下の構造を有する化合物又はその塩、及び/又は溶媒和物を意味する。

【0037】
一の実施例では、抗コリン薬含有コアは、層状ビーズ、ペレット(例えば、少なくとも1つの抗コリン薬を含んだ押し出し及び球状化組成物)の抗コリン薬、抗コリン薬含有顆粒、又は抗コリン薬の結晶の形をとることができる。
【0038】
別の実施例では、抗コリン薬含有コアは、層状ビーズの薬剤である。層状ビーズの薬剤は、薬剤層、例えば抗コリン薬層でコーティングされた不活性ビーズ(例えば、砂糖球)を意味する。別の実施例では、本発明の不活性ビーズは、微結晶性セルロース、マンニトール−微結晶性セルロース、又は二酸化ケイ素を具えてもよい。不活性ビーズは、一般的に20−80メッシュ、例えば25−30メッシュ又は60−80メッシュの粒径を有する。
【0039】
このように薬層でコーティングされ、持続放出コーティングを欠く不活性コアを、即効型特性を有して、「IRビーズ」と呼ぶことがある。特異的な抗コリン薬の特徴に応じて、この薬剤は結合剤を用いずに直接に溶液から不活性コアに蒸着することができる。多くの実施例では、薬層は、抗コリン薬と不活性砂糖球の結合を促進させる結合剤(一般的に薬学的に許容な水溶性ポリマー)を含む。
【0040】
適切な結合剤の例は、ポリビニルピロリドン(PVP)、ポリエチレンオキシド、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、及び多糖類を含むが、これに限定されるものではない。この結合剤は、薬層の全重量に基づき約0.5重量%乃至約10重量%に及ぶ量存在することがある。
【0041】
一般的に、例えば、流動層コーティング装置を用いて、不活性コアへ薬剤と溶液を含んだ結合剤を任意に吹き付けることにより薬層を蒸着する。薬剤を層状化する溶液は、抗コリン薬と選択的な結合剤が溶解している薬学的に許容な溶媒を具える。いくつかの実施例では、抗コリン薬は、懸濁液の形で存在する場合がある。粘度に応じて、薬剤を層状化する溶液の固形成分は、例えば、約10重量%、約15重量%、約20重量%、約25重量%、約30重量%など約35重量%までがよい。薬学的に許容な溶媒は、水、アルコール(エタノールなど)、アセトンなどを含む。
【0042】
代替として、コアを含む抗コリン薬は、1又はそれ以上の薬学的に許容な添加剤(例えば、ラクトース、マンニトール、微結晶性セルロースなど)と組み合わさる抗コリン薬を具える顆粒でよい。この顆粒は、従来の造粒法により調整され、上記のような適切な結合剤を選択的に含む。
【0043】
いくつかの実施例では、本発明の抗コリン薬含有コアは、約400μm以下、別の実施例では300μm以下、更に別の実施例では200μm以下の平均粒径を有する。
【0044】
用語「シーラント層」は、薬剤含有コア粒子を覆って配置される保護膜を意味する。シーラント層は、操作の間、粒子を剥離と摩耗から保護する。
【0045】
用語「実質的に崩壊する」は、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、又は約100%の崩壊に相当する崩壊のレベルを意味する。「溶解」が、液体中の固体の可溶化(例えば、溶媒中又は胃液中の薬剤の可溶化)を意味するのに対し、「崩壊」が、錠剤を具える構成粒子などの構造的凝集の破壊又は損失を意味する点で、用語「崩壊」と用語「溶解」を区別する。
【0046】
本明細書に記載した本発明の組成物は、第1又は第2コーティングでコーティングされた抗コリン薬含有コアを含む複数の抗コリン薬含有粒子を具えるものであり、この第1コーティングは、少なくとも1つの水溶性ポリマーを具える。例えば、抗コリン薬含有コア上に直接この第1コーティングを配置してもよく、薬剤含有コアを覆って配置されたシーラント層上にコーティングしてもよく、第2コーティング上にコーティングしてもよく、第2コーティングを覆って配置されたシーラント層上にコーティングしてもよい。
【0047】
用語「非水溶性ポリマー」は、pHに関係なく、又は広範なpH範囲(例えば、pH1.0乃至pH14)における、水媒体中で不溶性又は非常に難溶性のポリマーを意味する。本明細書で使用するときは、水媒体中で膨張するものの溶解しないポリマーは、「非水溶性」である。
【0048】
用語「水溶性ポリマー」は、pHに関係なく、水媒体中で溶性である(即ち、相当量溶解する)ポリマーを意味する。
【0049】
用語「腸溶性ポリマー」は、腸の条件下(即ち、アルカリ性に対して中性である条件下の水媒体中で)で溶性(即ち、相当量溶解する)であり、酸性条件下(即ち、低pH)で非水溶性であることを意味する。
【0050】
用語「逆腸溶性ポリマー」は、酸性条件下で溶性であり、中性及びアルカリ性条件下では不溶性であることを意味する。
【0051】
一の実施例では、非水溶性ポリマー(任意の腸溶性ポリマーではないが)を具える第1コーティングを、抗コリン薬含有コア(このコアは任意にシーラント層でコーティングされる)の上にコーティングし、その結果として、維持放出(SR)コーティングを提供する。
【0052】
適切な水溶性ポリマーの非限定的な例は、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、アクリル酸エステル/メタクリル酸エステルの中性共重合体(例えば、アクリル酸エチル及びメタクリル酸メチルの共重合体であるEudragit NE)、ワックス、及びこれらの混合物である。特定の実施例では、水溶性ポリマーは、エチルセルロースを具える。別の特定の実施例では、非水溶性ポリマーは、ウベローデ粘度計で5%の80/20のトルエン/アルコール溶液中25℃で測定された10cpsの平均粘度を有するエチルセルロースを具える。
【0053】
水溶性ポリマーを具える第1コーティング用の適切なコーティング重量は、約3%、約5%、約7%、約10%。約12%、約15%、約17%、約20%、約22%、約25%、約27%、約30%、約35%、約40%を含み、これらの全ての範囲及びこれらの部分的な範囲を含んだ、約3%乃至約40%に及ぶ。
【0054】
いくつかの実施例では、SRコーティングの非水溶性ポリマーは、可塑剤の必要なく、適切な特性(例えば、拡張放出特徴、メカニカル特性、及びコーティング特性)を提供する。例えば、ポリ酢酸ビニル(PVA)、アクリル酸エステル/メタクリル酸エステルの中性共重合体、エチルセルロース、ワックスなどを具えるコーティングを、可塑剤なしで塗布できる。
【0055】
更に別の実施例では、SRコーティングの非水溶性ポリマーが、可塑剤を含む場合がある。必要とする可塑剤の量は、可塑剤、非水溶性ポリマーの特性、及び最終的に所望なコーティングの特性に応じて異なる。可塑剤の適切な濃度は、コーティングの全重量に対して約1重量%乃至約20重量%、約3重量%乃至約20重量%、約3重量%乃至約5重量%、約7重量%乃至約10重量%、約12重量%乃至約15重量%、約17重量%乃至約20重量%又は約1重量%、約2重量%、約3重量%、約4重量%、約5重量%、約6重量%、約7重量%、約8重量%、約9重量%、約10重量%、約15重量%、又は約20重量%であり、これらの全ての範囲及びこれらの部分的な範囲を含む。
【0056】
適切な可塑剤の非限定的な例は、トリアセチン、クエン酸エステル、クエン酸トリエチル、クエン酸アセチルトリエチル、クエン酸トリブチル、アセチルクエン酸トリnブチル、フタル酸ジエチル、フタル酸ジブチル、フタル酸ジオクチル、メチルパラベン、プロピルパラベン、ブチルパラベン、セバシン酸ジブチル、置換トリグリセリド及びグリセリド、モノアセチル化及びジアセチル化グリセリド(例えば、Myvacet(登録商標)9−45)、モノステアリン酸グリセリン、グリセロールトリブチレート、ポリソルベート80、ポリエチレングリコール、プロピレングリコール、油(例えば、ヒマシ油、水素化ヒマシ油、菜種油、ゴマ油、オリーブ油など)、グリセリンソルビトール、シュウ酸ジエチル、リンゴ酸ジエチル、フマル酸ジエチル、マロン酸ジエチル、コハク酸ジブチル、脂肪酸、及びこれらの混合物を含む。
【0057】
更なる適切な可塑剤の非限定的な例は、グリセロールとそのエステル(例えば、モノアセチル化グリセリド、アセチル化モノ−又はジグリセリド(例えば、Myvacet(登録商標)9−45))、モノステアリン酸グリセリン、トリ酢酸グリセリン、グリセリルトリブチレート、フタル酸類(例えば、フタル酸ジブチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジオクチル)、クエン酸類(例えば、アセチルクエン酸トリブチルエステル、アセチルクエン酸トリエチルエステル、クエン酸トリブチル、クエン酸アセチルトリブチル、クエン酸トリエチル)、グリセロールトリブチレート、セバシン酸類(例えば、セバシン酸ジエチル、セバシン酸ジブチル)、アビシン酸塩類、アゼライン酸類、安息香酸塩類、クロロブタノール、ポリエチレングリコール、植物油、フマル酸類(例えば、フマル酸ジエチル)、リンゴ酸塩類(例えば、リンゴ酸ジエチル)、シュウ酸類(例えば、シュウ酸ジエチル)、コハク酸塩類(例えば、コハク酸ジブチル)、酪酸塩類、セチルアルコールエステル、マロン酸塩類(例えば、マロン酸ジエチル)、ヒマシ油、及びこれらの混合物を含む。本発明の実施例に用いる場合、可塑剤が、放出制御コーティングにおけるポリマーの約3重量%乃至30重量%を構成することがある。更なる別の実施例では、放出制御コーティングにおけるポリマーの重量に対する可塑剤の量は、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、及び約30%であり、これらの全ての範囲及びこれらの部分的な範囲を含むものである。当業者の一人は、可塑剤の存在、又は可塑剤のタイプや量を、ポリマーやコーティングシステムの性質(例えば、水溶液又は溶媒ベース又は分散ベース、及び全固形物)に基づいて選択することができる。
【0058】
更なる別の実施例では、第1コーティングが、非水溶性ポリマーと水溶性ポリマーの組み合わせを具えるものであってもよい。一の実施例では、水溶性ポリマーに対する非水溶性ポリマーの比率は、約90:10乃至約60:40、又は約90:10、約85:15、約80:20、約75:25、約70:30、約65:35、約60:40、約55:45、約50:50、又はこれらの全ての値、範囲及びこれらの部分的な範囲を含んだ約95:5:乃至50:50に分布する。
【0059】
一の実施例では、非水溶性及び水溶性ポリマーの結合を具える第1コーティングのコーティング重量は、約3重量%乃至約50重量%に及び、これは、約10%乃至約40%、約20%乃至約30%、又は約3%、約4%、約5%、約6%、約7%、約8%、約9%、約10%、約12%、約14%、約60%、約18%、約20%、約25%、約30%、約35%、約40%、約45%、又は約50%を含むものであり、これらの全ての範囲及びこれらの部分的な範囲を含む。別の実施例では、非水溶性及び水溶性ポリマーの結合を具える第1コーティングのコーティング重量は、コーティングされたコアの重量の約3%乃至約5%、約7%乃至約10%、約12乃至約15%、約17%乃至約20%、約22%乃至約25%、約27%乃至約30%、約35乃至約40%、又は約45%乃至約50%であり、これらの全ての値、範囲及びこれらの部分的な範囲を含む。
【0060】
適切な水溶性ポリマーは、ポリビニルピロリドン(例えば、Povidone K−25)、ポリエチレングリコール(例えば、PEG 400)、ヒドロキシプロピルメチルセルロース、及びヒドロキシプロピルセルロースを含むが、これらに限定されない。
【0061】
多くの実施例では、第2コーティング層は、任意の非水溶性ポリマーと組み合わせてなる腸溶性ポリマーを具える。第2コーティングが、腸溶性ポリマーと非水溶性ポリマーの両方を具える場合は、周期的パルス放出(TPR)コーティングを提供する。更に別の実施例では、第2コーティングが、抗コリン薬含有粒子上に配置される腸溶性ポリマー(水溶性ポリマーを有さない)を具える場合は、遅延放出(DR)コーティングが提供される。
【0062】
適切な腸溶性ポリマーの非限定的な例は、酢酸フタル酸セルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルアセテートフタレート、pH感受性のメタクリル酸/メタクリル酸メチル共重合体(例えば、Eudragit(登録商標)L,S and FS ポリマー)、セラック、及びこれらの混合物を含む。特定の実施例では、腸溶性ポリマーに関連するpH感受性溶解度を有する場合は、非ポリマーワックス及び脂肪酸組成物のなどの非ポリマー腸溶材料を、腸溶性ポリマーの代わりに用いてもよい。これらの腸溶性ポリマーを溶媒混合液又は水分散液の溶液として用いてもよい。いくつかの使用される市販の材料は、ロームフェルマ社よりEudragit(L100,S100,L30D)の商標で販売されるメタクリル酸共重合体、イーストマンケミカル社製のセラセフェート(酢酸フタル酸セルロース)、FMCコーポレーション製のAquateric(酢酸フタル酸セルロース水分散液)、信越株式会社製のAqoat(ヒドロキシプロピルメチルセルロースアセテートサクシネート水分散液)である。
【0063】
第2コーティングは、腸溶性ポリマー(例えば、TPRコーティング)と組み合わせた非水溶性ポリマーを具え、腸溶性ポリマーに対する非水溶性の比率は、約9:1乃至約3:1、及び約3:1乃至約1:1など、約10:1乃至約1:1に及ぶ。特定の実施例では、腸溶性ポリマーに対する非水溶性の比率は、約1:1、約1.5:1、約2:1、約2.5:1、約3:1、約3.5:1、約4:1、約4.5:1、約5:1、約5.5:1約6:1、約6.5:1、約7:1、約7.5:1、約8:1、約8.5:1、約9:1、約9.5:1、又は約10:1であり、これらの全ての値、範囲、及びこれらの部分的範囲を含む。
【0064】
TPRコーティングを有する本発明の組成物の多くの実施例では、TPRコーティングは、約5重量%乃至約60重量%のコーティング重量で塗布され、これは、約10%乃至約50%、約20%乃至約40%、約25%乃至約35%の範囲、又は約5%、約6%、約7%、約8%、約9%、約10%、約12%、約14%、約16%、約18%、約20%、約25%、約30%、約35%、約40%、約45%、又は約50%のコーティング重量であり、これらの全ての値、範囲、及び部分的な範囲を含む。
【0065】
特定の実施例では、TPRコーティングは、非水溶性ポリマーとしてエチルセルロース(例えば、EC−10)と腸溶性ポリマーとしてヒプロメタロースフタレート(例えば、HP−55)を具える。
【0066】
SRコーティングと同様に、DRとTPRコーティングは、可塑剤なし若しくは1又はそれ以上の任意の可塑剤(例えば、本明細書に記載した可塑剤のいずれか)を含んでもよい。必要とされる可塑剤の量は、存在するときには、可塑剤、非水溶性及び又は腸溶性ポリマーの特性、及び最終的に所望なコーティングの特性に依存する。適切な可塑剤の濃度は、約1重量%乃至約20重量%、約3重量%乃至約20重量%、約3重量%乃至5重量%、約7重量%乃至約10重量%、約12重量%乃至約15重量%、約17重量%乃至約20重量%に及び、又はコーティングの全重量に対して約1重量%、約2重量%、約3重量%、約4重量%、約5重量%、約6重量%、約7重量%、約8重量%、約9重量%、約10重量%、約15重量%、又は約20重量%であり、これらの全ての値、範囲、及びこれらの部分的な範囲を含む。
【0067】
本明細書で記載する多くの実施例では、本発明の放出制御組成物は、SR層(非水溶性ポリマー、又は非水溶性ポリマーと水溶性ポリマーの結合物を具える)の第1コーティングでコーティングされ、次いでDR又はTPR層(各々腸溶性ポリマー又は腸溶性ポリマーと非水溶性ポリマーの結合物を具える)の第2コーティングでコーティングした、複数の抗コリン薬含有粒子を具える。様々な代替の実施例では、本発明の放出制御組成物は、SR層(本明細書に記載した)又はTPR層(非水溶性ポリマーと腸溶性ポリマーを具える)の第1コーティングでコーティングされ、次いで、DR層(水溶性ポリマーを有さない腸溶性ポリマーを具える)の第2コーティングでコーティングした、複数の抗コリン薬含有粒子を具える。特定の実施例では、本発明の放出制御組成物は、TPR層(非水溶性ポリマーと腸溶性ポリマーを具える)の第1コーティングでコーティングされ、次いで、DR層(水溶性ポリマーを有さない腸溶性ポリマーを具える)の第2コーティングでコーティングされた、複数の抗コリン薬含有粒子を具える。
【0068】
別の特定の実施例では、本発明の放出制御組成物は、複数のコア粒子を含む薬剤を含む。本明細書に記載のこの薬剤は、抗コリン薬でよいが、別の特定の実施例では、本明細書で記載の抗コリン薬に制限されず、薬学技術分野で知られる別の適切な種類の薬剤を含んでもよい。この特定の実施例では、コア粒子は、本明細書に記載されるコア粒子のタイプ(例えば、顆粒、層状化したビーズの薬剤、薬剤結晶など、選択的に本明細書に記載したシーラント層でコーティングされたシール)のいずれかを具えるものであり、このコア粒子は、内SR層(例えば、エチルセルロース、任意に可塑化された)と外DR層(例えば、任意に可塑化されたヒドロキシプロピルメチルセルロースフタレート)でコーティングされる。
【0069】
別の特定の実施例では、本発明の放出制御組成物は、以下非限定的な例の薬剤分類:鎮痛剤(例えば、イブプロフェン、スリンダク、セレコキシブ、メロキシカム)、鎮痙剤(例えば、ロラゼパム、プレガバリン、ritagabine)、抗糖尿病薬(例えば、グリピジド、ripaglinide、ピオグリタゾン)、抗感染症薬(例えば、メフロキン、cifrofloxacine、セフロキシム、セフトリアキソン、メタロニダゾール)、抗パーキンソン病剤(例えば、セレギレン、プラミペキソール、ロピニロール)、抗リウマチ剤(例えば、アザチオプリン)、心・血管作用薬(例えば、カルベジロール、ソタロール、ピンドール)、中枢神経(CNS)興奮剤(例えば、アルプラゾラム、メチルフェニデート、アンフェタミン)、ドーパミン受容体作用薬(例えば、アリピプラゾール、オランザピン、ジプラシドン)、制吐薬(例えば、オンダンセトロン、ミルタザピン、ドラセトロン、ドンペリドン)、胃腸薬(例えば、シサプリド、パントプラゾール、ラニチジン)、精神治療薬(例えば、クロザピン、イロペリドン、パーフェナジンなどの抗精神病薬)、オピオイド作用薬(例えば、パパベリン、オキシモルホン、ヒドロモルフォン)、オピオイド拮抗薬(例えば、オキシコドン、ブプレノルフィン)、抗てんかん薬(ラモトリジン、ミダゾラム、チアガビン)、ヒスタミンH2拮抗剤(例えば、ファモチジン)、抗ぜんそく薬(例えば、メタプロテレノール、サルブタモール、テオフィリン)、及び骨格筋弛緩薬(例えば、シクロベンザプリン、メタキサロン、クロニジン)から選択された原薬を具える。
【0070】
更に別の特定の実施例では、本発明の放出制御組成物は、内SR層(例えば、エチルセルロース、選択的に可塑化された)及び外TPR層(例えば、エチルセルロース及びヒドロキシプロピルメチルセルロースフタレート、選択的に可塑化された)でコーティングされた複数の抗コリン薬含有粒子(例えば、不活性コアに層状化した薬剤、選択的に本明細書に記載されたシーラント層でコーティングされたシール)を具える。
【0071】
更にまた別の特定の実施例では、本発明の放出制御組成物は、内TPR層(例えば、エチルセルロース及びヒドロキシプロピルメチルセルロースフタレート、選択的に可塑化された)及び外DR層(例えば、ヒドロキシプロピルメチルセルロースフタレート、選択的に可塑化された)でコーティングされた複数の抗コリン薬含有粒子(例えば、不活性コアに層状化した薬剤、選択的に本明細書に記載されたようにシーラント層でコーティングされたシール)を具える。
【0072】
特定の実施例では、DR層は、可塑化ヒドロキシプロピルメチルセルロースフタレート(例えば、HP−55やクエン酸トリエチル)を具える。更なる実施例では、DR層は、約90/10のHP−55/クエン酸トリエチルを具える。
【0073】
特定の実施例では、SR層は、可塑化エチルセルロース(例えば、EC−10やクエン酸トリエチル)を具える。更に特定の実施例では、SR層は、約90/10のEC−10とクエン酸トリエチルを具える。
【0074】
特定な実施例では、TPR層は、ヒドロキシメチルセルロースフタレートやエチルセルロースの可塑化混合物(例えば、HP−55/EC−10及びクエン酸トリエチル)を具える。更なる実施例では、TPR層は、約10%のクエン酸トリエチルを含むHP−55/EC−10を具える。
【0075】
本発明の持続放出組成物は更に、例えば第1及び第2コーティングの間に、第1及び第2コーティングの下に、及び/又は第1と第2コーティングの両方の上に、処理及び操作中に静的及び又は粒子の摩擦を防止(又は最小限)すべく、抗コリン薬含有粒子上に配置されるシーラント層を具えてもよい。
【0076】
一の実施例では、シーラント層は、親水性ポリマーを具える。親水性ポリマーの適切な非限定的な例は、親水性ヒドロキシプロピルセルロース(例えば、Klucel(登録商標)LF)、ヒドロキシプロピルメチルセルロース又はヒプロメロース(例えば、Opadry(登録商標)Clear又はPharmacoat(商標)603)、ビニルピロリド酢酸ビニル共重合体(例えば、BASF社のKollidon(登録商標)VA64)、及び低粘度エチルセルロースなどのエチルセルロースを含む。シーラント層は、例えば、約1%、約2%、約3%、約4%、約5%、約6%、約7%、約8%、約9%、又は10%である約1%乃至約10%、これらの全ての範囲及びこれらの部分的な範囲を含むコーティング重量で塗布してもよい。
【0077】
一の実施例では、本発明の放出制御組成物は、単一又は複合の放出制御コーティングでコーティングされた抗コリン薬層状化不活性シュガービーズを含む。
【0078】
別の実施例では、本発明の組成物は更に、放出制御コーティングを覆って配置される(又は放出制御コーティングが、更に腸溶性ポリマーを有するコーティングでコーティングされる最外コーティング上に配置される)圧縮性コーティングを具える。圧縮性コーティングは、ヒドロキシプロピルセルロース、ポリ(酢酸ビニル−ビニルピロリドン)、酢酸ポリビニル、エチルセルロース(例えば、可塑化された低粘度エチルセルロースラテックス分散)などのポリマーを具えるが、これに限定されない。圧縮性コーティングは、可塑化されても可塑化されなくてもよく、圧縮中に放出制御コーティングの完全性を促進する。
【0079】
別の実施例では、本発明の放出制御組成物は、崩壊剤と組み合わせてなるサッカリド及び/又は糖アルコールを具える、迅速に崩壊する顆粒を更に具える。適切な崩壊剤は、例えば、クロスポビドン、グリコール酸でん粉ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換ヒドロキシプロピルセルロース、増粘剤(例えば、ジェランガム)、及びそれらの組み合わせなどからなる群から選択される崩壊剤を含むが、これらに限定されない。適切なサッカリド及び/又は糖アルコールは、アラビトール、エリトリトール、グリセロール、水素化でん粉加水分解物、イソマルト、ラクチトール、ラクトース、マルチトール、マンニトール、ソルビトール、キシリトール、サッカロース、マルトース、及びそれらの組み合わせからなる群から選択してもよい。サッカリド及び/又は糖アルコールは、スクラロースなどの人口甘味料を補充しても又はこれに置き換えてもよい。迅速に崩壊する微粒剤中のサッカリド及び/又は糖アルコールに対する錠剤分解物質の比率は、重量ベースで約1:99乃至約10:90、約5:95乃至約10:90であり、それらの間の全ての範囲及び部分的範囲を含む。多くの実施例では、崩壊剤又はサッカリド及び/又は糖アルコール、又はその両方は、約30μm又はそれ未満の平均粒径を有する粒子の形で存在する。迅速に崩壊する粒子に対するビーズを含む抗コリン薬の比率は、約1:6乃至約1:2、約1:5乃至約1:3、又は約1:6、約1:5、約1:4、約1:3、又は約1:2であり、これらの全ての範囲及びこれらの部分的な範囲を含む。
【0080】
本発明の組成物の多重放出制御コーティングは、薬剤インターフェースにおける溶解の制御に寄与し、従って、本発明の放出制御組成物の粒子から抗コリン薬(例えば、ジサイクロミン又は塩、及び/又はその溶媒和物)の放出を制御する。達成可能な遅延時間、遅延放出時間、又は持続放出特性は、放出制御コーティングの組成物と厚さに依存する。最適な1日1回の製剤の達成に影響を及ぼす特異的因子は、抗コリン薬のpKaと例えば、胃腸液(GI fluids)中の溶解度を含むが、これらに限定されない。
【0081】
本明細書に記載される多剤放出制御コーティングでコーティングされた粒子から得たインビトロ薬剤の放出データは、1日1回又は2回投与方式に適した薬物動態プロファイルを提供する抗コリン薬の放出プロファイルを提供する。一の実施例では、1日1回又は2回投与方式に適した2段階溶解法(最初の2時間は、0.1NのHClを700mL(塩酸)で、次にpH調整剤を200mL添加することにより得たpH6.8の900mLで)を検査したとき、持続放出コーティングは、約8−12時間(1日2回)乃至約16−20時間(1日1回)持続する抗コリン薬の放出を提供する。例えば、2段階溶解培地(最初の2時間は、0.1NのHClを700mL、続いてpH調整剤を添加することにより得たpH6.8のバッファ900mL中で検査される)において、37℃で米国薬局方装置2(攪拌速度@50rpm)を用いて溶解を検査すると、本発明の放出制御粒子のための適切な放出プロファイルは、実質的に以下のパターンに該当する:
4時間後、全抗コリン薬の約40±20%が放出し;
8時間後、全抗コリン薬の65±25%が放出し;及び
12時間後、全抗コリン薬の70±30%が放出した。
【0082】
本発明の放出制御組成物は、任意の薬学的に許容な添加物(結合剤、崩壊剤)、充填剤、圧縮助剤(例えば、微結晶性セルロース/融合二酸化ケイ素)で処方され、例えば、小袋、錠剤、カプセル、又は口腔内崩壊錠剤(ODTs)などの適切な経口剤形となる。一の実施例では、この剤形は、例えば、約1%未満のもろさを有する錠剤などの錠剤である。別の実施例では、この剤形は、少なくとも1つの本発明の放出制御組成物を具える粒子の集団で充填されたカプセルである。このカプセルは、例えば、ゼラチンカプセル、又はHPMCP(ヒドロキシプロピルメチルセルロース)カプセルである。
【0083】
別の実施例では、この製剤はODTである。本発明のODTは、口腔内で崩壊し、水なしで容易に飲み込むことができる。例えば、本発明のODTは、口腔内で唾液と接触又は人工唾液と接触した後60秒以内に実質上崩壊する。別の実施例では、ODTは約30秒以内に実質上崩壊する。崩壊は、USP<701>崩壊検査(全ての目的のためその全体が参照により本明細書に組み込まれている)により検査される。多くの実施例では、このODTは、ザラザラしない舌ざわり又は後味である、滑らかで飲み込み易い懸濁液を形成して、患者の口腔内で実質上崩壊し、1日1回又は2回の投与方法に適した抗コリン薬(例えば、ジサイクロミン)の標的PKプロファイル(例えば、血漿濃度対時間プロット)を提供する。例えば、このODTは、特定の実施例では、4、8、及び12時間においてはいくぶん広範な放出範囲が適切であるが、8−20時間にわたり上記のパターンと実質的に一致する抗コリン薬の持続放出を提供する。
【0084】
本発明のODT製剤は、高齢患者(従来の錠剤やカプセルを飲み込むことが大抵困難である)を治療又は精神病患者(彼等の投薬療法に大抵抵抗し又は「不満」を持っている)を治療するのに特に有用である。高齢患者および/又は精神病患者に対するODTの投与は、投薬頻度を減少させ、患者の服薬不履行を軽減する。
【0085】
特定の実施例では、本発明のODTは、治療的に有効な量のジサイクロミン又はそれらの塩及び/又は溶媒和物を具える。投与後にこのODTは、ザラザラしない舌ざわり又は後味である、滑らかで飲み込み易い懸濁液を形成して、患者の口腔内で実質上崩壊し、1日1回又は2回の投与方法に適した抗コリン薬(例えば、ジサイクロミン)の標的PKプロファイル(例えば、血漿濃度対時間プロット)を提供する。本発明の放出制御組成物と迅速に崩壊する顆粒に加えて、本発明のODTは、選択的に、圧縮性希釈剤、充填剤、着色剤、及び選択的に潤滑油など薬学的に許容な添加剤を選択的に含む。
【0086】
本発明の製剤は、上述の通り少なくとも1の放出制御粒子の集団を含む、2又はそれ以上の粒子を含む抗コリン薬の集団を具える場合がある。例えば、この製剤は、上記の通り放出制御粒子の集団を具え、更に、即効型(IR)粒子、例えば、抗コリン薬を具えるコーティングされないコアを具えることができる。一の実施例では、粒子を含む2又はそれ以上の抗コリン薬の集団を具える製剤はODTである。製剤がODTであるとき、2又はそれ以上の抗コリン薬含有粒子の集団は、迅速に崩壊する微粒剤と組み合わされ、粒子を含む抗コリン薬と迅速に崩壊する微粒剤は、口腔内でODTが崩壊した後に滑らかでザラザラしない舌ざわりを提供する粒径を有する。一の実施例では、本発明のODTは、SR、DR又はCR粒子集団の一つを具え、もう一つの実施例では、ODTは、IR粒子とSR粒子の組み合わせを具え、更に別の実施例では、ODTは、腸溶性のTPR粒子と組み合わせてなるSR粒子、及び選択的に(迅速に微粒剤を崩壊するに加え)IR粒子と組み合わせてなるSR粒子(選択的に味をマスクされた)を具える。更に別の実施例では、本発明のODTは、圧縮性コーティングの有無にかかわらず、迅速に崩壊する顆粒(例えば、マンニトール−クロスポピドン微粒剤)を具える。
【0087】
本発明のODTが、IR粒子を含んだ場合は、抗コリン薬の放出が直ちになされても、口腔内での放出を防ぐ味をマスクするコーティングでこのIR粒子をコーティングするので、抗コリン薬の後味が残らない。即ち、人工唾液(pH〜6.8)で溶解検査をすると、味をマスクされたIR粒子は、IR粒子中に含まれる抗コリン薬の全量の約10%以下を3分(口腔内中、ODTで想定される最も長いタイプの滞留時間)以内で放出するのに対し、0.1NのHCl中で溶解検査すると、IR粒子中の抗コリン薬の全量の約75%以下を約60分以内に放出する。
【0088】
本発明の様々な実施例では、この製剤が、放出制御粒子に加えてIR粒子を具えるとき、SR及び/又はTPR粒子に対するIR粒子の比率は、例えば、約10:90乃至約20:80、約30:70乃至約40:60、又は約5:95、約10:90、約15:85、約20:80、約25:75、約30:70、約35:65、約40:60、約45:55、又は約50:50など約0:100(即ち、IR粒子なし)乃至約50:50に及び、これらの全ての範囲及びこれらの部分的な範囲を含む。
【0089】
本発明の製剤の特定の実施例では、この製剤は、ジサイクロミン又はその塩、多形体、及び/又は溶媒和物(水和物を含む)を具える。
【0090】
本発明の別の実施例では、製剤の複数のビースは、様々な所望の抗コリン薬(例えば、ジサイクロミン)の放出プロファイルを得ることができる。一の実施例では、例えば、約2時間の排出半減期を有するジサイクロミンを具える1日1回の投与形態は、約8−20時間にわたり標的放出プロファイルを提示する味をマスクされたIR粒子の集団の混合物(抗コリン薬の即効型パルス、腸溶性又はTPRコーティングを有するSR粒子を提供する)を含み、12−24時間で抗コリン薬の臨床的に効果的な血漿濃度を維持する。
【0091】
別の実施例では、本発明は、放出制御組成物の調整法に関するものであって、抗コリン薬含有コアを調整するステップ(a)と;コアを覆う少なくとも1の非水溶性ポリマーを具える第1コーティングを塗布するステップ(b)と;選択的に非水溶性ポリマーに結合する腸溶性ポリマーを具える第2コーティングを塗布するステップ(c)と;を具え、この第1及び第2コーティングは、いかなる順序で塗布してもよい。
【0092】
コアを調整するステップは、例えば、不活性ビーズ(例えば、糖、微結晶性セルロース、マンニトール微結晶性セルロース、二酸化ケイ素など)を薬剤及び選択的にポリマー結合剤(例えば、流動層又はパンコーティング)を具える溶液で層状化するステップ又は選択的な添加剤で薬剤の粒子を粒状化するステップ、又は押し出し及び球状化など当該技術分野で知られた方法のいずれかによで達成する。代替として、「コアを調整する」は、所望の粒径(例えば、約50−500μm、100−250μmを含む)の薬剤又は結晶を得るステップ又は調整するステップを具えてもよい。
【0093】
いくつかの実施例では、抗コリン薬(本明細書に記載)具えるコア粒子を調整するステップと、SRコーティング(本明細書で記載)でコア粒子をコーティングするステップと、続くTPRコーティング(本明細書に記載)又はDRコーティング(本明細書に記載)するステップとを具える。別の実施例では、抗コリン薬を具えるコア粒子を調整するステップ及び次いでTPR又はDRコーティング、続いてSRコーティングでコア粒子をコーティングするステップを具える。更に別の実施例では、この方法は、抗コリン薬を具えるコア粒子を調整するステップ、次いでSR又はTPRコーティング、続いてDRコーティングでコア粒子をコーティングするステップを具える。これらの実施例の各々に対して、選択的なシーラント層を放出制御層の下、上、及び/又は間に塗布してもよい。
【0094】
更に別の実施例では、本発明の方法は更に、本明細書に記載された迅速に崩壊する顆粒を有する本明細書に記載した放出制御組成物を混合するステップ、及びブレンドされた放出制御組成物を圧縮するステップ、及び顆粒をODTへ迅速に崩壊するステップを具える。
【0095】
別の実施例では、この方法は更に、ODTへ圧縮する間に持続放出粒子の持続放出コーティングへのダメージを除去/最小にする放出制御層を覆う親水性ポリマー(例えば、ヒドロキシプロピルセルロース)を具える圧縮性ポリマーをコーティングするステップを具える。
【0096】
更に別の実施例では、本発明の方法は更に、本明細書に記載した放出制御組成物と選択的な添加剤をブレンドするステップと、ブレンドされた組成物と選択的な添加剤を錠剤に圧縮するステップを具える。
【0097】
更に別の実施例では、本発明の方法は更に、本明細書に記載された放出制御組成物と選択的な添加剤をカプセルに充填するステップを具える。適切なカプセルは、例えば、硬いゼラチンカプセル及びHPMCPカプセルを含む。
【0098】
特定の実施例では、本発明の方法は、
(a)ジサイクロミン又はその塩、多形体及び/又は溶媒和物を具える抗コリン薬剤粒子(結晶、微粒剤、ビーズを層状化した薬剤、又は50−400μm、又は約100−300μmの平均粒径のペレット)調整し、選択的に層状化された粒子に保護シールコートを塗布し、そしてIRビーズを形成するステップと;
(b)約15%乃至30%のコーティング重量でIRビーズ上に非水溶性ポリマーを具える持続放出(SR)コーティングを塗布し、SRビーズを形成するステップと;
(c1)約10%乃至30%のコーティング重量でSRビーズ上に腸溶性ポリマーを具える遅延放出(DR)コーティングを塗布するステップで、これにより放出制御(CR)ビーズを形成するステップ;及び/又は
(c2)重量比がSRビーズ上で約10:1乃至1:4、約10%乃至60%のコーティング重量で、非水溶性ポリマーと腸溶性ポリマーの結合物を具える遅延時間(TPR)コーティングを塗布するステップで、これにより放出制御ビーズを形成するステップと;
(d)糖アルコール、サッカリド、又はこれらの混合物と崩壊剤を具える迅速に崩壊する顆粒を調整するステップと;
(e)ステップ(c1)及び/又はステップ(c2)の放出制御ビーズとステップ(d)の迅速に崩壊する顆粒とブレンドするステップと;
(f)ステップ(e)のブレンドを圧縮するステップ、それによりODTを形成するステップと;を具える。
【0099】
いくつかの実施例では、ブレンドするステップ(e)は、選択的な薬学的に許容な添加剤(例えば、調味料、甘味料、崩壊剤、微結晶性セルロース)でステップ(c1)及び/又はステップ(c2)の放出制御ビーズをブレンドするステップを含む。
【0100】
別の実施例では、ブレンドするステップ(e)は、非水溶性ポリマーを具える、又は胃で溶ける有機、無機、又はポリマーポア形成と結合する非水溶性ポリマーを具える味をマスクするコーティングで選択的に味をマスクされるIRビーズでステップ(c1)及び/又はステップ(c2)の放出制御ビーズをブレンドするステップを含み、この味をマスクする層は、実質的にIRビーズの味をマスクする。
【0101】
別の実施例では、上記に記載された方法によると、調整されたODTは、口腔内の唾液又は人工唾液に触れた後、約60秒以内に実質的に崩壊する。別の実施例では、上記に記載された方法によると、調整されたODTは、口腔内の唾液又は人工唾液に触れた後、約30秒以内に実質的に崩壊する。
【0102】
IR粒子(存在するとき)の味をマスクする層に関連する用語「実質的に味をマスクする」は、患者の口腔内で苦い味の薬剤の放出を実質的に防止する味をマスクする層の能力を意味する。薬剤の味を「実質的にマスクする」味をマスクする層は、患者の口腔内で薬剤の約10%未満を通常放出し、別の実施例では、薬剤の約5%未満、約1%未満、約0.5%未満、約0.1%未満、約0.05%未満、約0.03%未満、約0.01%未満である。本発明の組成物の味をマスクする層の味をマスクする特性は、インビボ(例えば、当該技術分野で知られている従来の官能検査を用いて)又はインビトロ(例えば、本明細書で記載されるような溶解検査を用いて)で測定することができることである。薬剤の味を「実質的にマスクする」より味をマスクする層に関連する薬剤放出の量多いことは、本明細書に明確に開示された範囲に限定されるものではないことは、当業者は理解するところであり、組成物中の薬剤の苦味や他の香料添加剤の存在など別の要因によって変化する場合がある。
【0103】
本発明は、以下の節でより詳しく説明する。以下の実施例は、本発明を説明するために用いる。
【0104】
当然のことながら、本明細書に記載された実施例及び態様は、目的を説明するためだけのものであり、それらを踏まえての様々な変形又は変更が、当業者に示唆され、この出願の精神と範囲内に含まれる。
【実施例1】
【0105】
実施例1A
[IRビーズ(薬物負荷:塩酸ジサイクロミンとして約20%)]: エタノール(2100g)に塩酸ジサイクロミン(700g)をゆっくりと加えて、溶解するまで10分以上常に撹拌し、次いで、出来上がりの溶液のエタノール対水の比率が75/25になるように水(700g)を添加した。7”ボトムスプレーWurster8”ハイカラム、200メッシュ生成物保持ふるい(0.8mmポートノズル)でカバーされた「B」ボトム空気分散プレートから15mmの分配カラムギャップを装備したGlatt GPCG3を、60−80メッシュの砂糖球2800gで充満させ、製品温度を37±3℃を維持しながら、初速度5g/分を階段的に増加させ15.5g/分で、流入空気量90−105m3/時、空気噴霧圧1.50バールでジサイクロミン溶液(固形分20%)をスプレーした。50gのエタノールでスプレーシステムをすすいだ後、層状化したビーズの薬剤をGlattユニット中で50分乾燥させて、残留溶媒(蒸気を含む)を取り出した。結果として生じるジサイクロミンIRビーズを、35及び120メッシュのふるいを通してふるいにかけ、大き過ぎる粒子と微粒子を除去した。
【0106】
実施例1B
[IRビーズ(薬物負荷:結合剤を具えた塩酸ジサイクロミンとして約20%)]: ポビドン(PVP K30;100.0g)を75/25の比率の95%エタノール/水(2325.0gの95%エタノールと775.0gの水)にゆっくりと加えて、溶解するまで10分以上常に撹拌した。塩酸ジサイクロミン(800.0g)をゆっくりと加えて溶解するまで撹拌した。IRビーズを上記のように調整した。結合剤(2.5重量%)を具えるIRビーズバッチは、ポリマー結合剤(実施例1A)なしのIRビーズバッチと比べて高い効能(>19.2重量%)を有する。更に3つのビーズバッチを4.0重量%の結合剤を用いて調整した。IRビーズに19.7重量%の塩酸ジサイクロミンの平均効能を提供するために、結合剤を含む4つのビーズバッチを共にブレンドした。
【0107】
実施例1C
[SRビーズ(薬物負荷:塩酸ジサイクロミンとして約20%)]: エチルセルロース(Dow Chemicals社のEC−10、Ethocel Premium 10;159.1g)を95%エタノールにゆっくりと加えて、溶解するまで常に撹拌した。クエン酸トリエチル(TEC;15.9g)を溶解するまでゆっくりと加えた。6”ボトムスプレーWurster6”ハイカラム、0.8mmポートノズルを有する200メッシュ生成物保持ふるいでカバーされた「B」ボトム空気分散プレートを具えるGlatt GPCG1を、上記実施例1AのIRビーズ700gで充満させた。製品温度33±3℃、噴霧空気圧1.50バール、流入空気流50−75m3/時、及び20%のSRコーティング重量にすべく初流速1g/分を階段的に増加させて6g/分で、SR機能性ポリマーコーティング製剤(固形分10%)でIRビーズをスプレーした。スプレー後、コーティングされたビーズをGlattユニット中で30分乾燥させ、残留溶媒(蒸気を含む)を取り出した。500μm未満の平均粒径を有する粒子を提供するために、結果として生じるSRビーズをふるいにかけた。
【0108】
図2は、酸性のpH5.0バッファ中で検査したSRビーズの薬剤放出のプロファイルを示す。最大24時間の溶解時間において、SRビーズの放出プロファイルの違いは見られなかった。4時間で薬剤の約70%が放出された。
【実施例2】
【0109】
[SRビーズ(コーティングレベル:約30%)]: エチルセルロース(214.3g)を90/10のアセトン(1716.5g)と水(190.8g)の混合物にゆっくりと加え、溶解するまで常に撹拌した。クエン酸トリエチル(21.4g)をゆっくりと加えて溶解した。製品温度33±3℃、噴霧空気圧1.50バール、流入空気流50−75m3/時、及び30%のSRコーティング重量にすべくスプレー流速3.0−6.0g/分で、機能性ポリマー溶液(固形分11%)で上記1AのIRビーズ(500g)を、流動層コートした(15cm高さの4”Wurster insertを具えたGllatt1)。結果として生じるSRビーズをGlattユニット中で30分乾燥させ、残留溶媒を取り出した。コーティングされたビーズの約85重量%は、約355μm未満の平均粒径を有する(実施例2A)。SRビーズの別のバッチ(実施例2B)を、IRビーズ(上記実施例1Aの500g)を用いて、より濃度の低いポリマー溶液(即ち、固形分5.5%)をスプレーすることにより同様に調整したふるいにかけて収集したコーティングされたペレットの約99%は、約355μm未満の平均粒径を有する。いずれにしても、分析的検査(例えば、分析及び薬剤放出)のため、20%のコーティング重量のサンプルを取り出した。
【0110】
図3は、コーティング重量が30%の実施例2AのSRビーズ、及びコーティング重量が20%及び30%の実施例2BのSRビーズの薬剤放出プロファイルを示す。
【実施例3】
【0111】
実施例3A
[TPRビーズ(55/30/15のEC−10/HP−55/TEC)]: エチルセルロース(EC−10;93.0g)を90/10(1876.4gのアセトンと208.5gの水)のアセトン/水にゆっくりと加えて溶解するまで徹底的に撹拌した。ヒプロメロースフタレート(信越化学株式会社のHP−55;50.7g)をEC−10溶液に加えて、溶解するまでしっかり撹拌した。均一に溶解/分散するまで溶液にTEC(25.4g)を加え、これによりTPRコーティング製剤を形成する。4”Wurster insertを具えたGlatt1中で、製品温度33±2℃、噴霧空気圧1.50バール、流入空気量70−90m3/時、及び30重量%のTPRコーティングレベルにすべくスプレー流速3−6g/分で、実施例1Aで調整したIRビーズ(395g)をTPRコーティング製剤(固形分7.5%)で流動層コートした。薬剤放出検査をするため、15重量%、20重量%及び25重量%のコーティンレベルのサンプルを取り出した。約355μm未満の平均粒径を有する乾燥ビーズをふるいにかけて収集した。
【0112】
実施例3B
[CRビーズ]: 実施例1Cで記載したような20%のコーティング重量にすべく、実施例1Bで調整したIRビーズ(440g)をEC−10/TEC(比率:10/1)溶液(固形分5.5%)で流動層コートした。上記実施例3Aで記載したような20%のTPRコーティング重量にすべく、Glatt1中でこれらのSRビーズを更にTPRコーティング製剤(55/30/15のEC−10/HP−55TEC;固形分7.5%)でコートした。薬剤放出検査をするため、10%と15%のコーティング重量のサンプルを取り出した。このように調整され、355μm未満の平均粒径を有する乾燥CRビーズをふるいにかけて収集した。
【0113】
図4は、TPRビーズ(実施例3A)と上記実施例3Bで調整されたCRビーズの薬剤放出プロファイルを示しており、平均粒径355μm未満のコーティングされたビーズからの薬剤放出における非水溶性ポリマーを具える内部障壁層の顕著な効果を説明する。
【実施例4】
【0114】
実施例4A
[SRビーズ(20%SRコーティング)]: 上記実施例1BのIRビーズ(550g)を20%のコーティング重量にすべく、90/10のアセトン/水中で溶解させた(固形分5.5%)SR機能性ポリマーコーティング(10/1のEC−10/TEC)で流動層コートした。
【0115】
実施例4B
[CRビーズ(20%SRコーティング上に20%DRコーティング)]: 上記実施例4Aの多くのSRビーズを20%のDR(遅延放出)コーティング重量にすべく、アセトン(2278g)/水(255g)中で溶解させた10/1の比率のHP−55/TECの溶液(固形分5.5%)で、更にコートした。結果として生じるCRビーズをGlattユニット中で20分乾燥させ、残留溶媒を取り出した。平均粒径355μm未満の乾燥ビーズをふるいにかけて収集した。
【0116】
実施例4C
[CRビーズ(20%TPRコーティング上に20%DRコーティング)]: 実施例1Bで調整されたIRビーズ(550g)を20%の増量にすべく、90/10のアセトン/水中で溶解させた(固形分7.5%)TPR機能性ポリマーコーティング(60/25/15のEC−10/HP−55/TEC)で最初にコートした。更にこのTPRビーズの550gの多くを20%のSRコーティング重量にすべく、アセトン(2278g)/水(255g)中で溶解させた10/1の比率のHP−55/TEC(固形分5.5%)の溶液でコートした。結果として生じるCRビーズをGlattユニット中で20分乾燥させ、残留溶媒を取り出した。平均粒径355μm未満の乾燥ビーズをふるいにかけて収集した。
【0117】
図5は、実施例4AのSRビーズ(IRビーズをSRでコーティングした)及び実施例4Bと4Cの異なる二重膜を具えるCRビーズの薬剤放出プロファイルを示す。
【実施例5】
【0118】
実施例5A
[MCC不活性コアを具えるIRビーズ]: 75/25の95%エタノール/水(855gの95%エタノールと285gの水)にポビドン(PVP K30;60g)をゆっくりと加えて、10分以上溶解するまで常に撹拌した。塩酸ジサイクロミン(300g)をゆっくりと加えて溶解するまで撹拌した。6”ボトムスプレーWurster15cmハイカラム、200メッシュ生成物保持ふるい(0.8mmポートノズル)でカバーされた「B」ボトム分散プレートから15mmの分配カラムギャップを具えるGlatt GPCG1を、微結晶セルロース球(Glatt社の平均粒径100μmのCellets100)1140gで充満させ、製品温度34±3℃を維持しながら、スプレー速度3−9g/分、流入空気量80−100m3/時、空気噴霧圧1.5バールで塩酸ジサイクロミン溶液(固形分20%)をスプレーした。50gのエタノールでスプレーシステムをすすいだ後、層状化したビーズの薬剤をGlattユニット中で30分乾燥させて、残留溶媒(蒸気を含む)を取り出した。結果として生じるジサイクロミンIRビーズを、125及び250μmのふるいを通してふるいにかけ、大き過ぎる粒子と微粒子を除去した。
【0119】
実施例5B
[SRビーズ(EC−10/TECで20%がコーティングされた)]: 実施例5AのIRビーズ(550g)を上記実施例2に記載した20%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。
【0120】
実施例5C
[CRビーズ(20%SR(EC−10/TEC)上に30%TPR(60/25/15)]: 実施例5AのIRビーズ(550g)を上記実施例2に記載した20%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。このたくさんのSRビーズを30%のコーティング重量にすべく、90/10のアセトン/水中で溶解させた60/25/15の比率のEC−10/HP−55/TECの溶液(固形分7.5%)でコートした。結果として生じるCRビーズをGlatt中で5分間乾燥させ、残留溶媒を取り出した。約355μm未満の平均粒径を有する粒径の約90%を含む及び約425μm未満の平均粒径を有する粒径の約99%を含む乾燥ビーズをふるいにかけて収集した。
【0121】
図6は、60−80メッシュ砂糖球(177−250μmの平均直径)を具えるCRビーズ(実施例3B)と比較したSRビーズ(実施例5B)とCellets100(100μmの平均直径を有する微結晶セルロース球)を具えるCRビーズ(実施例5C)の薬剤放出プロファイルを示す。
【実施例6】
【0122】
実施例6A
[CRビーズ(17.5%SR(EC−10/TEC)上に22.5%TPR(60/30/10)]: 上記実施例5AのIRビーズを上記実施例2に記載した15%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。このたくさんのSRビーズを20%のTPRコーティング重量にすべく、90/10のアセトン/水中で溶解させた比率60/30/10のEC−10/HP−55/TECの溶液(固形分7.5%)で、更にコートした。結果として生じたCRビーズをGlatt内で15分乾燥させ、残留溶媒を取り出した。平均粒径が約355μm未満の粒子を含む乾燥ビーズをふるいにかけて収集した。
【0123】
実施例6B
[CRビーズ17.5%SR(EC−10/TEC)上に25%DR(90/10)]: 実施例5AのIRビーズを上記実施例2に記載した17.5%のコーティング重量で、90/10混合物のアセトン/水中で溶解させた(固形分5.5%)SRコーティング(10/1のEC−10/TEC)で流動層コートした。このたくさんのSRビーズを20重量%のDRコーティング重量にすべく、90/10のアセトン/水中で溶解させた比率90/10のHP−55/TECの溶液(固形分7.5%)でコートした。結果として生じるCRビーズをGlatt内で15分乾燥させて、残留溶媒を取り出した。約355μm未満の平均粒径を有する粒子を含む乾燥ビーズをふるいにかけて収集した。
【0124】
実施例6C
[迅速に崩壊する微粒剤]: その全体が参照により本明細書に組み込まれている、2003年11月20日に公開された同時係属の米国特許出願公開第2003/0215500号に開示された手順に従って迅速に崩壊する微粒剤を調整した。特に、平均粒径が約20μm又はそれ未満(フランス、Roquette社のPearlitol25)のD−マンニトール(152kg)を8kgの架橋ポビドン(ISP社のCrospovidone XL−10)を高せん断造粒機(Vector社のGMX 600)でブレンドし、精製水(約32kg)で顆粒化し、Quadro社のComilを用いて湿式粉砕し、及び最後に約0.8%未満のLOD(乾燥減量)を有する微粒剤を提供するためにトレイ乾燥した。乾燥顆粒をふるいにかけ、約175−300μmの平均粒径を有する迅速に崩壊する微粒剤を生成すべく、大きすぎる材料を再度粉砕した。
【0125】
実施例6D
[塩酸ジサイクロミン CR ODT、40−mgと80−mg]: 表1は実施例6AのCRビーズとして40−mg又は80−mg塩酸ジサイクロミンを具える口腔内崩壊錠剤の組成物をリストアップした。薬学的に許容な成分(即ち、1の香料(例えば、ペパーミント、サクランボ、又はウィンターグリーン)、0.35の甘味料(スクラロース)、5の崩壊剤(例えば、クロスポビドン、でん粉グリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換ヒドロキシプロピルセルロース)、及び10の微結晶セルロース(Avicel PH101又はCeolus KG−802)を、最初に44.59の迅速に崩壊する微粒剤(上記実施例6Cに記載されるように調整された)予混合剤をブレンドしたVブレンダー中で均一になるようにブレンドし、39.06の塩酸ジサイクロミンCRビーズ(上記実施例6A)をブレンドし、ツインシェルVブレンダー中で均一なブレンドされた圧縮混合物を得るために十分な時間予混合物を事前に調整した。40−mg又は80−mgの塩酸ジサイクロミンを具えるODTを、外部潤滑システム(Matsui Ex−Lube System)を装備した生成スケール秦タブレットプレスを用いて、HDPEボトル中にパックするのに適した許容される錠剤化特性、裏紙をはがすAclar200ブリスター、及び/又はAclarブリスターパックを「押し通す」を提供するために最適化された錠剤条件化で圧縮した。例えば、CRビーズとして塩酸ジサイクロミン40mgを具えるODTは、以下の条件:−ツーリング:14mmの円、平らな表面、半円状の縁;圧縮力:12−16kN;平均重量:800mg;平均硬度:〜30−60N;及び破砕性:0.2−0.4%で圧縮した。そのように生成される塩酸ジサイクロミン CR ODT(40mg又は80mg)は、飲み込むのを容易に、簡単にする懸濁液を作り、コーティングされた塩酸ジサイクロミンビーズを具えて、1日1回又は2回の投与方式に適した放出プロファイルを有し、口腔内で迅速に崩壊する。迅速に崩壊する顆粒がより多く含まれるODT錠は、わずかに口当たりがよく、崩壊時間がより短い。
【0126】
【表1】

【実施例7】
【0127】
実施例7A
[塩酸ジサイクロミンIRビーズ(薬物負荷:30%w/w)]: 上記実施例1Bに記載されるように、塩酸ジサイクロミンをゆっくりと加えて、結合剤(プロビン(PVP K30)4重量%)と溶媒(95%エタノールと水の比率75/25)の溶液を、溶解するまで撹拌した。7”ボトムスプレーWurster8”ハイカラム、200メッシュ生成物ふるい、1.2mmポートノズル、でカバーされた「B」ボトム空気分散プレートを装備したGlatt GPCG3をCellets100(微結晶セルロース球)2500gで充満させ、次いで、製品温度33±3℃を維持しながら、ジサイクロミン溶液(固形分20%)を噴霧圧1.8バール、スプレー速度10−15g/分、流入空気量80−125m3/時、及び空気噴霧圧1.8バールでスプレーした。50gのアセトンですすいだ後、シールコート溶液(85/15のアセトン/水中でKlucel LFを溶解させた、固形分7.5%)を初速度10g/分でスプレーし、Glattユニット内で5分間乾燥させ、残留溶媒(蒸気を含む)を取り出した。結果として生じるIRビーズをふるいにかけ、大きすぎる(355μm又は50メッシュより大きい)ビーズと微粒子(100メッシュ未満)を除去した。
【0128】
実施例7B
[ジサイクロミンCRビーズ(15%SR(EC−10/TEC)上に20%TPR(60/30/10)]: 上記実施例2に記載されるように、エチルセルロース(EC−10)を90/10のアセトン/水混合物にゆっくりと加えて溶解するまで撹拌し、続いて可塑剤(TEC)を加えて、SRコーティング溶液を調整した。上記実施例7Aの塩酸ジサイクロミンIRビーズを、6”ボトムスプレーWurster8”ハイカラム、1.0mmノズルポート、及び「C」分散プレートを装備するGlatt GPCG1に充満させ、流体化空気量80−100m3/時、噴霧空気圧1.25バール、目標製品温度33℃、及び15重量%の重量増加するためスプレー速度約6−10g/分でSRコーティング溶液をコーティングした。
【0129】
Glattユニットでの20%のコーティング重量と同じく、60/30/10の比率でEC−10、HP−55、及びTECを具えるTPRコーティング溶液で上記SRビーズをスプレーし、90/10のアセトン/水混合物中で溶解させた(固形分7.5%)。実施例7Aに記載のように、アセトンですすいだ後、85/15のアセトン/水中で溶解させたヒドロキシプロピルセルロース(Klucel LF)の圧縮コーティング(固形分7.5%)を塗布し、次いで、Glattユニットで15分乾燥させ、残留溶媒(蒸気を含む)を取り出した。
【0130】
実施例7C
[塩酸ジサイクロミン ODT CR、40−mg及び80−mg]: 微粒剤(上記実施例6Cに記載されるように調整された)と実施例7Bの塩酸ジサイクロミンCRビーズを迅速に分散させる適切な量を、圧縮に適した均一に分散されたブレンドを提供するのに十分な時間、ツインシェルVブレンダー中で、予めブレンドされた薬学的に許容な成分(成分と量に関して表1、実施例7を参照されたい)とブレンドした。最適化された打錠条件下で許容な打錠特性(例えば、一般的に0.5%未満の破砕性)を提供する、外部潤滑システム(Matsui Ex−Lube System)を装備した生成スケール秦タブレットプレスを用いて、CRビーズとして40−mg又は80−mgの塩酸ジサイクロミンを具えるODTを圧縮した。このように生成した塩酸ジサイクロミン CR ODT(40mg又は80mg)は、1日1回又は2回の投与方法に適した放出プロファイルを有し、コーティングされた塩酸ジサイクロミンCRビーズを具え、滑らかで、簡単に飲み込むことのできる懸濁液を生成して口腔内で迅速に崩壊する。
【実施例8】
【0131】
実施例8A
[チアガビンIRビーズ(薬物負荷:30%w/w)]: 上記実施例1Bで開示した手続きと同様に結合剤(4重量%のKlucel LF)の溶液にチアガビンをゆっくりと加えて、溶解するまで撹拌した。2500gのCellets100(微結晶セルロース球)で、Glatt GPCG3を充満させ、ステップ7.Aで記載したチアガビン溶液でスプレーした。50gのアセトンですすいだ後、シールコート溶液(85/15のアセトン/水中で溶解されたKlucel LF、固形分7.5%)を、初速度10g/分でスプレーし、Glattユニットで5分間乾燥させ、残留溶媒(蒸気を含む)を取り出した。結果として生じるIRビーズをふるいにかけ、大きすぎる(355μm又は50メッシュより大きい)ビーズと微粒子(100メッシュ未満)を除去した。
【0132】
実施例8B
[チアガビンCRビーズ(10%SR(EC−10/TEC)上に90/10の25%DR(HP−55/TEC)]: Glatt GPCG3に上記実施例8AのIRビーズを充満させ、10重量%の重量を増加すべくEC−10とクエン酸トリエチルを具えるSRコーティング溶液でスプレーした。
【0133】
25%のコーティング重量への同じGlattユニットで、90/10のアセトン/水の混合物中で溶解させた90/10の比率のHP−55とTECを具えるDRコーティング溶液(固形分7.5%)で上記のSRビーズをスプレーした。実施例7Aに記載したようにアセトンですすいだ後、85/15のアセトン/水で溶解させたヒドロキシプロピルセルロース(Klucel LF)、7.5%の固形分の圧縮コーティングを塗布し、次いで、Glattユニットで15分乾燥させ、残留溶媒(蒸気を含む)を取り出した。
【0134】
実施例8C
[チアガビンOPT CR、20mg及び40mg]: 微粒剤(上記実施例6Cに記載されるように調整された)と実施例8BのチアガビンCRビーズを迅速に分散させる適切な量が、圧縮に適した均一に分散されたブレンドを提供するのに十分な時間、ツインシェルVブレンダー中で、予めブレンドされた薬学的に許容な成分(成分と量に関して表1、実施例7を参照されたい)とブレンドされた。最適化された打錠条件下で許容な打錠特性(例えば、一般的に0.5%未満の破砕性)を提供する、外部潤滑システム(Matsui Ex−Lube System)を装備した生成スケール秦タブレットプレスを用いて、CRビーズとしての20mg又は40mgのチアガビンを具えるODTを圧縮した。 このように生成されたチアガビンCR ODT(20mg又は40mg)は、1日1回又は2回の投与方法に適した放出プロファイルを有し、コーティングされたチアガビンCRビーズを具え、滑らかで、簡単に飲み込むことのできる懸濁液を生成して口腔内で迅速に崩壊する。
【0135】
本明細書に特定の実施例に関連して本発明を説明したが、当然のことながら、更なる変更が可能であり、この出願は、一般に本願の原理に従い、そして、本願の関連する技術内の刊行及び知識内にあるような本開示からの逸脱を含む発明の任意の変形、用法、又は適合をカバーすることを意図する。
【特許請求の範囲】
【請求項1】
複数の抗コリン薬含有粒子を具える放出制御組成物であって、前記粒子が、
(a)抗コリン薬を具えるコアと;
(b)少なくとも1つの非水溶性ポリマーを具え前記コアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わせた腸溶性ポリマーを具え、前記コアを覆って配置される第2コーティングと;を具えることを特徴とする放出制御組成物。
【請求項2】
請求項1に記載の放出制御組成物であって、前記第2コーティングが、腸溶性ポリマーと組み合わせた非水溶性ポリマーを具えることを特徴とする組成物。
【請求項3】
請求項1に記載の放出制御組成物であって、前記第2コーティングが、前記第1コーティングを覆って配置されることを特徴とする組成物。
【請求項4】
請求項3に記載の放出制御組成物であって、前記第1コーティングが、非水溶性ポリマーと腸溶性ポリマーの組み合わせを具え、前記第2コーティングが、腸溶性ポリマーを具えることを特徴とする組成物。
【請求項5】
請求項2に記載の放出制御組成物であって、前記第2コーティングが、前記第1コーティングを覆って配置されることを特徴とする組成物。
【請求項6】
請求項2に記載の組成物であって、前記非水溶性ポリマーと前記腸溶性ポリマーの比率が、約10:1乃至約1:1であることを特徴とする組成物。
【請求項7】
請求項1に記載の放出制御組成物であって、前記第1及び第2コーティングの少なくとも一方が、更に可塑剤を具えることを特徴とする組成物。
【請求項8】
請求項5に記載の放出制御組成物であって、前記第1及び第2コーティングの少なくとも一方が、更に可塑剤を具えることを特徴とする組成物。
【請求項9】
請求項8に記載の放出制御組成物であって、前記第1及び第2コーティングが、更に可塑剤を具えることを特徴とする組成物。
【請求項10】
請求項1に記載の放出制御組成物であって、前記コアが、不活性コアの上にコーティングされた抗コリン薬を具えることを特徴とする組成物。
【請求項11】
請求項9に記載の放出制御組成物であって、前記コアが、不活性コアの上にコーティングされた抗コリン薬を具えることを特徴とする組成物。
【請求項12】
請求項1に記載の組成物であって、前記コアが更に、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン及びそれらの混合物からなる群から選択されるポリマー結合剤を具えることを特徴とする組成物。
【請求項13】
請求項1に記載の組成物が更に:
(d)複数の迅速に崩壊する微粒剤を具え、その各々が、約400μm未満の平均粒径を有し、(i)崩壊剤と(ii)糖アルコール及び/又はサッカリドとを具え、該糖アルコール及び/又はサッカリドの各々が、約30μm未満の平均粒径を有することを特徴とする請求項1に記載の組成物。
【請求項14】
請求項13に記載の組成物であって、迅速に崩壊する微粒剤と抗コリン薬含有粒子の比率が、約6:1乃至約1:2に及ぶことを特徴とする組成物。
【請求項15】
請求項13に記載の組成物であって、前記迅速に崩壊する微粒剤が、架橋ポリビニルピロリドン、グリコール酸でん粉ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換ヒドロキシプロピルセルロース、及びそれらの混合物からなる群から選択される崩壊剤を具えることを特徴とする組成物。
【請求項16】
請求項2に記載の組成物であって、前記第2コーティングが、抗コリン薬含有粒子の全重量に対して約5乃至約60重量%を具えることを特徴とする組成物。
【請求項17】
請求項1に記載の組成物であって、前記抗コリン薬が、アトロピン、ベナクチジン、ベンズトロピン、ビベリデン、臭化ブチルスコポラミン、シクロペントレートダリフェナシン、デキセチミド、ジサイクロミン、エメプロニウム、グリコピロレート、ヘキサヒドロシラジフェニドール、オクチロニウム、オルフェナドリン、オキシブチニン、オキシフェノニウム、ピレンゼピン、プロシクリジン、プロパンテリン、プロピルベンジルコリン、キニジン、スコポラミン、トルテロジントリヘキシフェニジル、トロピカミド、ミバクリウム、アトラクリウム、ドキサクリウム、シスアトラクリウム、ベクロニウム、ロクロニウム、パンクロニウム、ツボクラリン(tabocurarine)、ガラミン、ピペクロニウム、ヘキサメトニウム、メカミラミン、トリメタファン、スクシニルコリン、スキサメトニウム、デカメトニウム、メトキシコロナリジン、メカミラミン、イミダファナシン、及びそれらの薬学的に許容な塩、水和物、多形体、及び/又は溶媒和物からなる群から選択されることを特徴とする組成物。
【請求項18】
請求項1に記載の組成物であって、前記抗コリン薬が、ジサイクロミン又はその塩、多形体、及び/又は溶媒和物であることを特徴とする組成物。
【請求項19】
請求項9に記載の組成物であって、前記抗コリン薬が、ジサイクロミン又はその塩、及び/又は水和物であることを特徴とする組成物。
【請求項20】
請求項1に記載の組成物であって、前記非水溶性ポリマーが、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、メタクリル酸/メタクリル酸メチルの中性共重合体、及びそれらの混合物からなる群から選択されることを特徴とする組成物。
【請求項21】
請求項1に記載の組成物であって、前記腸溶性ポリマーが、酢酸フタル酸セルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルアセテートフタレート、pH感受性のメタクリル酸/メタクリル酸メチル共重合体、セラック、及びそれらの混合物からなる群から選択されることを特徴とする組成物。
【請求項22】
請求項1に記載の組成物であって、前記非水溶性ポリマーがエチルセルロースであり、前記腸溶性ポリマーがヒドロキシプロピルメチルセルロースフタレートであることを特徴とする組成物。
【請求項23】
請求項19に記載の組成物であって、前記非水溶性ポリマーがエチルセルロースであり、前記腸溶性ポリマーがヒドロキシプロピルメチルセルロースフタレートであることを特徴とする組成物。
【請求項24】
請求項1に記載の組成物であって、前記抗コリン薬含有粒子が、2段階溶解培地(最初の2時間は、0.1NのHClを700mL、続いて200mLのpH調整剤を添加することにより得たpH6.8のバッファ900mL中で検査した)において、37℃で米国薬局方装置2(攪拌速度@50rpm)を用いて溶解を検査したとき、実質的に以下のパターンに該当する放出プロファイル:
4時間後、全抗コリン薬の約40±20%が放出され;
8時間後、全抗コリン薬の65±25%が放出され;
12時間後、全抗コリン薬の70±30%が放出されたことを示すことを特徴とする組成物。
【請求項25】
請求項1の放出制御組成物を具える製剤。
【請求項26】
請求項19の放出制御組成物を具える製剤。
【請求項27】
請求項26の製剤が更に:
(d)複数の迅速に崩壊する微粒剤を具え、その各々が、約400μm未満の平均粒径を有し、(i)崩壊剤と(ii)糖アルコール及び/又はサッカリドとを具え、該糖アルコール及び/又はサッカリドの各々が、約30μm未満の平均粒径を有し;前記製剤が口腔内崩壊錠剤であることを特徴とする製剤。
【請求項28】
請求項27に記載の製剤であって、前記口腔内崩壊錠剤が、口腔内の唾液又は人工唾液に接触後、約60秒以内に実質的に崩壊することを特徴とする製剤。
【請求項29】
請求項27に記載の製剤であって、前記口腔内崩壊錠剤が、崩壊をUSP<701>崩壊検査により検査したとき、約30秒以内に実質的に崩壊することを特徴とする製剤。
【請求項30】
請求項1の放出制御組成物の調整法であって:
(a)抗コリン薬を具える複数のコアを調整するステップと;
(b)前記第1コーティングで前記コアをコーティングするステップと;
(c)前記第2コーティングで前記コアをコーティングするステップと;を具えることを特徴とする調整法。
【請求項31】
請求項30に記載の方法であって、前記ステップ(c)のコーティングをする前に前記ステップ(b)のコーティングを行うことを特徴とする方法。
【請求項32】
請求項30の方法であって:
(d)各々約30μm以下の平均粒径を有する糖アルコール及び/又はサッカリドと崩壊剤とを顆粒化して、約400μm以下の平均粒径を有し、を迅速に崩壊する微粒剤を生成するステップと;
(e)コーティングされたコア粒子と迅速に崩壊する微粒剤をブレンドするステップと;
(f)前記コーティングされたコア粒子と迅速に崩壊する微粒剤のブレンドを圧縮することにより口腔内崩壊錠剤を形成するステップと;を具えることを特徴とする方法。
【請求項33】
前記抗コリン薬が、アトロピン、ベナクチジン、ベンズトロピン、ビベリデン、臭化ブチルスコポラミン、シクロペントレートダリフェナシン、デキセチミド、ジサイクロミン、エメプロニウム、グリコピロレート、ヘキサヒドロシラジフェニドール、オクチロニウム、オルフェナドリン、オキシブチニン、オキシフェノニウム、ピレンゼピン、プロシクリジン、プロパンテリン、プロピルベンジルコリン、キニジン、キヌクリジニルベンジラート、スコポラミン、トルテロジントリヘキシフェニジル、トロピカミド、ミバクリウム、アトラクリウム、ドキサクリウム、シスアトラクリウム、ベクロニウム、ロクロニウム、パンクロニウム、ツボクラリン(tabocurarine)、ガラミン、ピペクロニウム、ヘキサメトニウム、メカミラミン、トリメタファン、スクシニルコリン、スキサメトニウム、デカメトニウム、メトキシコロナリジン、メカミラミン、イミダファナシンからなる群から選択されることを特徴とする、請求項30に記載の方法。
【請求項34】
前記抗コリン薬が、ジサイクロミン又はその塩、多形体、及び/又は水和物であることを特徴とする、請求項33に記載の方法。
【請求項35】
前記口腔内崩壊錠剤が、口腔内の唾液又は人工唾液に接触後、約60秒以内に実質的に崩壊することを特徴とする、請求項32に記載の方法。
【請求項36】
前記口腔内崩壊錠剤が、口腔内の唾液又は人工唾液に接触後、約30秒以内に実質的に崩壊することを特徴とする、請求項32に記載の方法。
【請求項37】
必要とする患者に請求項1の組成物の治療量を投与するステップを具えることを特徴とする、腸運動過剰又は過敏症腸症候群の治療法。
【請求項38】
必要とする患者に請求項27の剤形の治療量を投与するステップを具えることを特徴とする、腸運動過剰又は過敏症腸症候群の治療法。
【請求項39】
腸運動過剰又は過敏症腸症候群を患う患者の服薬順守を増進させる方法であって、それを必要とする患者に請求項27の製剤の治療量を投与するステップを具えることを特徴とする、服薬順守を増進させる方法。
【請求項40】
複数の薬剤含有粒子を具える放出制御組成物であって、前記粒子が:
(a)薬剤を具えるコアと;
(b)少なくとも1の非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わされる腸溶性ポリマーを具えコアを覆って配置される第2コーティングと;を具え、
(d)前記薬剤の血漿排出半減期が短く、有害事象を最小限にするため頻回の投与を必要とすることを特徴とする組成物。
【請求項41】
複数の薬剤含有粒子を具える放出制御組成物であって、該粒子が:
(a)前記薬剤を具えるコアと;
(b)非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)腸溶性ポリマーを具え第1コーティングを覆って配置される第2コーティングと;を具えることを特徴とする組成物。
【請求項42】
請求項41に記載の放出制御組成物であって、前記薬剤が、鎮痛剤、鎮痙剤、抗糖尿病薬、抗感染症薬、抗パーキンソン病剤、抗リウマチ剤、心・血管作用薬、中枢神経(CNS)興奮剤、ドーパミン受容体作用薬、制吐薬、胃腸薬、精神治療薬、オピオイド作用薬、オピオイド拮抗薬、抗てんかん薬、ヒスタミンH2拮抗剤、抗ぜんそく薬、及び骨格筋弛緩薬からなる群から選択されることを特徴とする組成物。
【請求項1】
複数の抗コリン薬含有粒子を具える放出制御組成物であって、前記粒子が、
(a)抗コリン薬を具えるコアと;
(b)少なくとも1つの非水溶性ポリマーを具え前記コアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わせた腸溶性ポリマーを具え、前記コアを覆って配置される第2コーティングと;を具えることを特徴とする放出制御組成物。
【請求項2】
請求項1に記載の放出制御組成物であって、前記第2コーティングが、腸溶性ポリマーと組み合わせた非水溶性ポリマーを具えることを特徴とする組成物。
【請求項3】
請求項1に記載の放出制御組成物であって、前記第2コーティングが、前記第1コーティングを覆って配置されることを特徴とする組成物。
【請求項4】
請求項3に記載の放出制御組成物であって、前記第1コーティングが、非水溶性ポリマーと腸溶性ポリマーの組み合わせを具え、前記第2コーティングが、腸溶性ポリマーを具えることを特徴とする組成物。
【請求項5】
請求項2に記載の放出制御組成物であって、前記第2コーティングが、前記第1コーティングを覆って配置されることを特徴とする組成物。
【請求項6】
請求項2に記載の組成物であって、前記非水溶性ポリマーと前記腸溶性ポリマーの比率が、約10:1乃至約1:1であることを特徴とする組成物。
【請求項7】
請求項1に記載の放出制御組成物であって、前記第1及び第2コーティングの少なくとも一方が、更に可塑剤を具えることを特徴とする組成物。
【請求項8】
請求項5に記載の放出制御組成物であって、前記第1及び第2コーティングの少なくとも一方が、更に可塑剤を具えることを特徴とする組成物。
【請求項9】
請求項8に記載の放出制御組成物であって、前記第1及び第2コーティングが、更に可塑剤を具えることを特徴とする組成物。
【請求項10】
請求項1に記載の放出制御組成物であって、前記コアが、不活性コアの上にコーティングされた抗コリン薬を具えることを特徴とする組成物。
【請求項11】
請求項9に記載の放出制御組成物であって、前記コアが、不活性コアの上にコーティングされた抗コリン薬を具えることを特徴とする組成物。
【請求項12】
請求項1に記載の組成物であって、前記コアが更に、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン及びそれらの混合物からなる群から選択されるポリマー結合剤を具えることを特徴とする組成物。
【請求項13】
請求項1に記載の組成物が更に:
(d)複数の迅速に崩壊する微粒剤を具え、その各々が、約400μm未満の平均粒径を有し、(i)崩壊剤と(ii)糖アルコール及び/又はサッカリドとを具え、該糖アルコール及び/又はサッカリドの各々が、約30μm未満の平均粒径を有することを特徴とする請求項1に記載の組成物。
【請求項14】
請求項13に記載の組成物であって、迅速に崩壊する微粒剤と抗コリン薬含有粒子の比率が、約6:1乃至約1:2に及ぶことを特徴とする組成物。
【請求項15】
請求項13に記載の組成物であって、前記迅速に崩壊する微粒剤が、架橋ポリビニルピロリドン、グリコール酸でん粉ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換ヒドロキシプロピルセルロース、及びそれらの混合物からなる群から選択される崩壊剤を具えることを特徴とする組成物。
【請求項16】
請求項2に記載の組成物であって、前記第2コーティングが、抗コリン薬含有粒子の全重量に対して約5乃至約60重量%を具えることを特徴とする組成物。
【請求項17】
請求項1に記載の組成物であって、前記抗コリン薬が、アトロピン、ベナクチジン、ベンズトロピン、ビベリデン、臭化ブチルスコポラミン、シクロペントレートダリフェナシン、デキセチミド、ジサイクロミン、エメプロニウム、グリコピロレート、ヘキサヒドロシラジフェニドール、オクチロニウム、オルフェナドリン、オキシブチニン、オキシフェノニウム、ピレンゼピン、プロシクリジン、プロパンテリン、プロピルベンジルコリン、キニジン、スコポラミン、トルテロジントリヘキシフェニジル、トロピカミド、ミバクリウム、アトラクリウム、ドキサクリウム、シスアトラクリウム、ベクロニウム、ロクロニウム、パンクロニウム、ツボクラリン(tabocurarine)、ガラミン、ピペクロニウム、ヘキサメトニウム、メカミラミン、トリメタファン、スクシニルコリン、スキサメトニウム、デカメトニウム、メトキシコロナリジン、メカミラミン、イミダファナシン、及びそれらの薬学的に許容な塩、水和物、多形体、及び/又は溶媒和物からなる群から選択されることを特徴とする組成物。
【請求項18】
請求項1に記載の組成物であって、前記抗コリン薬が、ジサイクロミン又はその塩、多形体、及び/又は溶媒和物であることを特徴とする組成物。
【請求項19】
請求項9に記載の組成物であって、前記抗コリン薬が、ジサイクロミン又はその塩、及び/又は水和物であることを特徴とする組成物。
【請求項20】
請求項1に記載の組成物であって、前記非水溶性ポリマーが、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、メタクリル酸/メタクリル酸メチルの中性共重合体、及びそれらの混合物からなる群から選択されることを特徴とする組成物。
【請求項21】
請求項1に記載の組成物であって、前記腸溶性ポリマーが、酢酸フタル酸セルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルアセテートフタレート、pH感受性のメタクリル酸/メタクリル酸メチル共重合体、セラック、及びそれらの混合物からなる群から選択されることを特徴とする組成物。
【請求項22】
請求項1に記載の組成物であって、前記非水溶性ポリマーがエチルセルロースであり、前記腸溶性ポリマーがヒドロキシプロピルメチルセルロースフタレートであることを特徴とする組成物。
【請求項23】
請求項19に記載の組成物であって、前記非水溶性ポリマーがエチルセルロースであり、前記腸溶性ポリマーがヒドロキシプロピルメチルセルロースフタレートであることを特徴とする組成物。
【請求項24】
請求項1に記載の組成物であって、前記抗コリン薬含有粒子が、2段階溶解培地(最初の2時間は、0.1NのHClを700mL、続いて200mLのpH調整剤を添加することにより得たpH6.8のバッファ900mL中で検査した)において、37℃で米国薬局方装置2(攪拌速度@50rpm)を用いて溶解を検査したとき、実質的に以下のパターンに該当する放出プロファイル:
4時間後、全抗コリン薬の約40±20%が放出され;
8時間後、全抗コリン薬の65±25%が放出され;
12時間後、全抗コリン薬の70±30%が放出されたことを示すことを特徴とする組成物。
【請求項25】
請求項1の放出制御組成物を具える製剤。
【請求項26】
請求項19の放出制御組成物を具える製剤。
【請求項27】
請求項26の製剤が更に:
(d)複数の迅速に崩壊する微粒剤を具え、その各々が、約400μm未満の平均粒径を有し、(i)崩壊剤と(ii)糖アルコール及び/又はサッカリドとを具え、該糖アルコール及び/又はサッカリドの各々が、約30μm未満の平均粒径を有し;前記製剤が口腔内崩壊錠剤であることを特徴とする製剤。
【請求項28】
請求項27に記載の製剤であって、前記口腔内崩壊錠剤が、口腔内の唾液又は人工唾液に接触後、約60秒以内に実質的に崩壊することを特徴とする製剤。
【請求項29】
請求項27に記載の製剤であって、前記口腔内崩壊錠剤が、崩壊をUSP<701>崩壊検査により検査したとき、約30秒以内に実質的に崩壊することを特徴とする製剤。
【請求項30】
請求項1の放出制御組成物の調整法であって:
(a)抗コリン薬を具える複数のコアを調整するステップと;
(b)前記第1コーティングで前記コアをコーティングするステップと;
(c)前記第2コーティングで前記コアをコーティングするステップと;を具えることを特徴とする調整法。
【請求項31】
請求項30に記載の方法であって、前記ステップ(c)のコーティングをする前に前記ステップ(b)のコーティングを行うことを特徴とする方法。
【請求項32】
請求項30の方法であって:
(d)各々約30μm以下の平均粒径を有する糖アルコール及び/又はサッカリドと崩壊剤とを顆粒化して、約400μm以下の平均粒径を有し、を迅速に崩壊する微粒剤を生成するステップと;
(e)コーティングされたコア粒子と迅速に崩壊する微粒剤をブレンドするステップと;
(f)前記コーティングされたコア粒子と迅速に崩壊する微粒剤のブレンドを圧縮することにより口腔内崩壊錠剤を形成するステップと;を具えることを特徴とする方法。
【請求項33】
前記抗コリン薬が、アトロピン、ベナクチジン、ベンズトロピン、ビベリデン、臭化ブチルスコポラミン、シクロペントレートダリフェナシン、デキセチミド、ジサイクロミン、エメプロニウム、グリコピロレート、ヘキサヒドロシラジフェニドール、オクチロニウム、オルフェナドリン、オキシブチニン、オキシフェノニウム、ピレンゼピン、プロシクリジン、プロパンテリン、プロピルベンジルコリン、キニジン、キヌクリジニルベンジラート、スコポラミン、トルテロジントリヘキシフェニジル、トロピカミド、ミバクリウム、アトラクリウム、ドキサクリウム、シスアトラクリウム、ベクロニウム、ロクロニウム、パンクロニウム、ツボクラリン(tabocurarine)、ガラミン、ピペクロニウム、ヘキサメトニウム、メカミラミン、トリメタファン、スクシニルコリン、スキサメトニウム、デカメトニウム、メトキシコロナリジン、メカミラミン、イミダファナシンからなる群から選択されることを特徴とする、請求項30に記載の方法。
【請求項34】
前記抗コリン薬が、ジサイクロミン又はその塩、多形体、及び/又は水和物であることを特徴とする、請求項33に記載の方法。
【請求項35】
前記口腔内崩壊錠剤が、口腔内の唾液又は人工唾液に接触後、約60秒以内に実質的に崩壊することを特徴とする、請求項32に記載の方法。
【請求項36】
前記口腔内崩壊錠剤が、口腔内の唾液又は人工唾液に接触後、約30秒以内に実質的に崩壊することを特徴とする、請求項32に記載の方法。
【請求項37】
必要とする患者に請求項1の組成物の治療量を投与するステップを具えることを特徴とする、腸運動過剰又は過敏症腸症候群の治療法。
【請求項38】
必要とする患者に請求項27の剤形の治療量を投与するステップを具えることを特徴とする、腸運動過剰又は過敏症腸症候群の治療法。
【請求項39】
腸運動過剰又は過敏症腸症候群を患う患者の服薬順守を増進させる方法であって、それを必要とする患者に請求項27の製剤の治療量を投与するステップを具えることを特徴とする、服薬順守を増進させる方法。
【請求項40】
複数の薬剤含有粒子を具える放出制御組成物であって、前記粒子が:
(a)薬剤を具えるコアと;
(b)少なくとも1の非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)非水溶性ポリマーと選択的に組み合わされる腸溶性ポリマーを具えコアを覆って配置される第2コーティングと;を具え、
(d)前記薬剤の血漿排出半減期が短く、有害事象を最小限にするため頻回の投与を必要とすることを特徴とする組成物。
【請求項41】
複数の薬剤含有粒子を具える放出制御組成物であって、該粒子が:
(a)前記薬剤を具えるコアと;
(b)非水溶性ポリマーを具えコアを覆って配置される第1コーティングと;
(c)腸溶性ポリマーを具え第1コーティングを覆って配置される第2コーティングと;を具えることを特徴とする組成物。
【請求項42】
請求項41に記載の放出制御組成物であって、前記薬剤が、鎮痛剤、鎮痙剤、抗糖尿病薬、抗感染症薬、抗パーキンソン病剤、抗リウマチ剤、心・血管作用薬、中枢神経(CNS)興奮剤、ドーパミン受容体作用薬、制吐薬、胃腸薬、精神治療薬、オピオイド作用薬、オピオイド拮抗薬、抗てんかん薬、ヒスタミンH2拮抗剤、抗ぜんそく薬、及び骨格筋弛緩薬からなる群から選択されることを特徴とする組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2012−518656(P2012−518656A)
【公表日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願番号】特願2011−551299(P2011−551299)
【出願日】平成22年2月23日(2010.2.23)
【国際出願番号】PCT/US2010/025083
【国際公開番号】WO2010/096820
【国際公開日】平成22年8月26日(2010.8.26)
【出願人】(506295780)アプタリス ファーマテック インコーポレイテッド (5)
【Fターム(参考)】
【公表日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願日】平成22年2月23日(2010.2.23)
【国際出願番号】PCT/US2010/025083
【国際公開番号】WO2010/096820
【国際公開日】平成22年8月26日(2010.8.26)
【出願人】(506295780)アプタリス ファーマテック インコーポレイテッド (5)
【Fターム(参考)】
[ Back to top ]

