抗チクングンヤモノクローナル抗体及びその使用
本発明は、チクングンヤウイルス(CHIK)により引き起こされるアルボウイルス症の分野に関する。本発明は、具体的には、抗CHIKモノクローナル抗体(MAb)、より具体的には抗CHIK.E2 MAb、及びCHIK株の存在又は非存在を検出するための方法における診断物質としてのそれらの使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、チクングンヤ(Chikungunya)ウイルス(CHIK)により引き起こされるアルボウイルス症(arbovirosis)の分野に関する。本発明は、具体的には、抗CHIKモノクローナル抗体(MAb)、より具体的には抗CHIK.E2 MAb、及びCHIK株の存在又は非存在を検出するための方法における診断物質としてのそれらの使用に関する。
【背景技術】
【0002】
チクングンヤ(CHIK)ウイルスは、アフリカ、インド及び東南アジアにおける爆発的な流行病を引き起こす能力を有する(Epstein, 2007; Powers及びLogueによる概説, 2007)。このウイルスは、アエデス属(Aedes (Ae.))の蚊により伝達される。CHIKウイルスは、2005年からのレユニオン島及びインド洋、並びに2006年に1.4百万の住民が感染したと見積もられるインドにおける空前の規模の大発生の原因である(Schuffeneckerら, 2006; Staikowskyら, 2006; Arankalleら, 2007; Pialouxらによる概説, 2007)。
【0003】
CHIKウイルスに感染したヒトは、典型的には、無能力化、多発性関節痛、重篤な筋肉痛、及び斑状丘疹状皮疹がときに後に続く関節の硬直を伴う急性疾病を経験する(Johnston及びPeters, 1996; Borgheriniら, 2007; Pialouxらによる概説, 2007; Rulliら, 2007)。CHIKウイルス感染は、ほとんど全ての場合に筋肉痛を伴う。筋肉内の衛星細胞のCHIKウイルス感染は、部分的に、臨床上の徴候のいくつかの特徴を説明できた(Ozdenら, 2007)。チクングンヤウイルス感染の臨床症状は、西アフリカからのイグボ-オラウイルス、中央アフリカからのオニョンニョン(ONN)ウイルス、オーストラリア及び太平洋からのロスリバー及びバーマウイルス、及び南アメリカからのマヤロウイルス、ならびに普遍種のシンドビス(SIN)ウイルスのようなその他の関節炎誘発性のアルファウイルスのために、しばしば、アルボウイルス疾患と誤診される。
【0004】
CHIKウイルスは、アルファウイルス(Alphavirus)属、トガウイルス(Togaviridae)科のメンバーである(Strauss及びStraussによる概説, 1994)。アルファウイルスは、大細胞親和性を示す、小さい、エンベロープ一本鎖プラス鎖RNAウイルスである。ウイルス表面は、エンベロープE1及びE2糖タンパク質のヘテロ二量体のトリプレットで形成される膜につなぎとめられたスパイクで覆われている。ウイルススパイクタンパク質は、細胞表面への接着及びウイルスの侵入を容易にする。E1エンベロープ糖タンパク質は、ウイルス感染の間の低pHにより惹起される膜融合を媒介するクラスII融合タンパク質である。E2は、50 kDaのI型膜貫通糖タンパク質である:最初の260アミノ酸はエクトドメインを構成し、その後に、ステム領域を形成する約100アミノ酸と、30アミノ酸のスパン領域と、30アミノ酸の短い細胞質エンドドメインとが続く(Pletnevら, 2001; Mukhopadhyayら, 2006)。pE2 (E3及びE2タンパク質の62-kDa前駆体)及びE1は、小胞体内でヘテロ二量体として組み立てられる(Strauss及びStraussによる概説, 1994)。ゴルジ体でpE2が切断されてE3及びE2が形成された後に、E1-E2複合体は細胞質膜(PM)に運ばれる。細胞質E2エンドドメインと、予め組み立てられたヌクレオカプシドとの相互作用は、PMでのウイルスのエンベロープへの封入過程の最初のステップの1つである。ビリオンの完全性は、E1とE2との直接の相互作用により維持される(Strauss及びStrauss, 1994)。アルファウイルスの生活環の経過の間に、E2糖タンパク質は受容体結合を担う。ほとんどの中和抗体は、E1よりもむしろE2におけるエピトープを認識する(Strauss及びStraussによる概説, 1994)。E2の外表面上の高次構造(conformational)エピトープを認識する抗体は、アルファウイルス感染を中和する可能性を有する。
【0005】
CHIKウイルス感染の生物学的診断は、初期ウイルス血症期中の定量的リアルタイムRT-PCRに基づく方法に実質的に基づく(Edwardsら, 2007; Laurentら, 2007; Santhoshら, 2007)。血清学的方法は、最初の臨床的症状発現の後の早期に抗CHIK IgMを、そして2週間後に特異的IgGを検出する(Pialouxらによる概説, 2007)。しかし、ELISA及び免疫検出アッセイは、特異性及び感度が乏しい。なぜなら、CHIKウイルスが、セムリキ森林(SF)抗原群の関連するメンバーと交差反応性を有するからである(Greiser-Wilkeら, 1991)。
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明者らは、CHIKウイルスの生態及びCHIK関連疾患の病因を研究するのに特に有用であるモノクローナル抗体(MAb)を開発し、特徴決定した。
当業者が認識するように、本発明の独自性は、CHIKウイルス全体又はCHIK E2糖タンパク質に、その可溶性形態にさえも特異的に結合するモノクローナル抗体(MAb)のパネルを本発明者らが実際に作製し、特徴決定したということにある。
【課題を解決するための手段】
【0007】
この関係において、本発明は、CNCM (Collection Nationale de Cultures de Microorganismes)、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託されたもののような、CHIKウイルスの外表面上にあるエピトープに特異的に結合するモノクローナル抗体を提供する。
【図面の簡単な説明】
【0008】
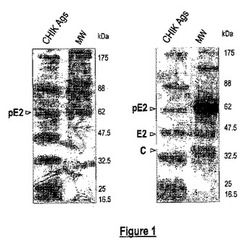
【図1】CHIKタンパク質組成及びウイルス調製物の抗原特異性。CHIK抗原(CHIK Ag)を、4〜12% SDS-PAGEにより、変性条件下で分け、クーマシーブルー染色によりすぐに視覚化したか(左)、又は抗CHIK HMAFを用いるイムノブロット分析のためにPVDFメンブレンにエレクトロブロッティングした(右)。分子量マーカー(MW)の位置は、kDaで示す。
【図2】組換え可溶性CHIK sE2糖タンパク質の抗原性。イムノブロット分析を、精製組換え可溶性CHIK.sE2タンパク質及びDEN-1 sE、抗CHIK HMAF (CHIK HMAF)、正常ヒト血清(neg.血清)並びにCHIK陽性患者の血清(CHIK pos.血清)を用いて行った。
【図3】抗体生成ハイブリドーマ上清に対する動態順位付け(ranking)アッセイ。曲線は、抗体生成ハイブリドーマ上清3C3、3E4、5A8、6F2、8A4及び9B5への50 mM CHIK.sE2タンパク質のモニターされた経時的な結合(レゾナンスユニット(RU)での)を示す。
【図4】抗CHIK.E2 MAbを用いるE2検出の感度。スクロース精製されたCHIKウイルスを用いて、ELISAプレートを、105 FFU/ウェルで被覆し、漸増濃度のMAb 3C3 (▲)、3E4 (○)及び8A4 (■)を加えた。MAbの反応性を、「方法」に記載されるようにして間接ELISAにより試験した。
【図5】抗CHIK.E2 MAbの、感染細胞で内生的に合成されたE2との反応性。ベロ細胞を24時間、CHIK.06-49ウイルスに、0.4 MOIにて感染させた。(A)では、抗CHIK.E2 MAbを用いるIFアッセイによるE2の検出。固定細胞を透過(+ TX-100)又は非透過(- TX-100)にし、次いで、2.5μg.mL-1のMAb 3C3、3E4又は8A4を用いて免疫染色した。抗CHIK HMAF (希釈1:500)を対照として用いた。(B)では、抗CHIK.E2 MAbを用いるCHIKウイルス感染細胞のフローサイトメトリー分析。固定された感染細胞(連続線)又は擬似感染細胞(点線)を、サポニンを用いて透過(黒色の線)にするか又は透過にせず(灰色の線)、次いで、2.5μg.mL-1 MAb 3C3、3E4又は8A4を用いて免疫染色した。抗CHIK HMAF (希釈1:500)を陽性対照として用いた。
【図6】抗CHIK.E2 MAbの還元E2タンパク質との反応性を、イムノブロット分析により決定した。100 ngの精製CHIK.sE2タンパク質(レーン1)又は105 FFUのスクロース精製CHIKウイルス(レーン2)をブロットしたメンブレンを、「方法」に記載されるようにして、個別に、MAb 3C3、3E4又は8A4とインキュベートした。抗CHIK HMAFを陽性対照として用いた。
【図7】CHIK (配列番号1)、イグボ-オラ(配列番号2)及びONNウイルス(配列番号3)のE2配列のアラインメント。残基E2-1〜E2-364の領域を示す。アスパラギン-結合グリコシル化部位に(◆)で印を付す。オープンフレームは、CHIK及びイグボ-オラウイルスと比較して、ONNウイルスに3つの特定のアミノ酸の違いがあることを示す。
【図8】抗CHIK E2 MAbを用いる抗原捕捉ELISAの感度。定量分析を、捕捉抗体としてMAb 8A4を、検出抗体としてMAb 3E4を用い、ウイルス培養上清(A)及び組換え可溶化CHIK.sE2糖タンパク質(B)をウイルス抗原として用いて行った。(A)では、蚊AP61細胞(●)又はヒト293A細胞(□)で成長させた系列希釈CHIK.06-49ウイルス。(B)では、精製組換え可溶化CHIK.sE2タンパク質の漸増濃度。
【発明を実施するための形態】
【0009】
本明細書で用いる場合、用語「特異的に結合する」とは、本発明により意図されるCHIKタンパク質、例えばE2糖タンパク質に比較的高い親和性で結合するが、CHIK E2糖タンパク質以外の分子を実質的に認識せず、結合しない抗体のことをいう。本明細書で用いる場合、用語「比較的高い親和性」とは、少なくとも10-6 M、好ましくは少なくとも約10-7 M、さらにより好ましくは10-8 M〜10-10 Mの抗体と興味対象のタンパク質との間の結合親和性を意味する。このような親和性の測定は、当業者に公知の標準的な競合結合イムノアッセイ条件下で行われることが好ましい。
【0010】
本明細書で用いる場合、用語「抗体」は、免疫原での刺激に応答してリンパ球により生成される糖タンパク質のことをいう。抗体は、インビトロ及びインビボにおいて、特異的かつ選択的に、それらの生成を惹起する抗原決定基、すなわちエピトープ、又は同種抗原と密接に関連する抗原決定基と反応する能力を有する。用語「抗体」は、そのような抗体の結合(可変)領域を用いた構築物及びその他の抗体改変を包含することを意味する。つまり、本発明の方法で有用な抗体は、抗体全体、抗体フラグメント、多機能性抗体凝集体又は一般的に抗体からの1つ以上の特異的結合部位を含む物質を含み得る。抗体フラグメントは、Fv、Fab又はF(ab')2フラグメントのようなフラグメント、又は単鎖Fvフラグメントのようなそれらの誘導体であり得る。抗体又は抗体フラグメントは、非組換え、組換え又はヒト化であり得る。抗体は、免疫グロブリンアイソタイプのもの、例えばIgG、IgMなどであり得る。さらに、免疫グロブリン又はそのフラグメントの凝集体、ポリマー、誘導体及びコンジュゲートは、適切であれば用いることができる。
【0011】
本発明のモノクローナル抗体又はその組み合わせは、特に、診断試薬として、及び/又はCHIK感染のスクリーニングのために、その感染が無症状であっても、用いられる。本発明のモノクローナル抗体は、限定されないが、免疫蛍光、イムノブロット及びELISAアッセイを含み得る診断法においても用いられる。
【0012】
この関係において、本発明は、
a) サンプルを、本発明の抗CHIKモノクローナル抗体又は本発明の抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出する方法を提供する。
【0013】
より具体的には、本発明は、
a) サンプルを、本発明の抗CHIK E2モノクローナル抗体又は本発明の抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤ(CHIK) E2ポリペプチドからのエンベロープE2ポリペプチド若しくは機能的誘導体又はその前駆体E3E2 (p62)の存在又は非存在を検出する方法に関する。
【0014】
本明細書で用いる場合、用語「機能的誘導体」とは、本発明のモノクローナル抗体により認識される能力をまだ保持しているE2糖タンパク質のフラグメント、例えばE2エクトドメインのことをいう。用語「エピトープ」とは、特異的抗体分子、例えば本発明のモノクローナル抗体が結合する抗原、例えばE2糖タンパク質上の部位のことをいう。本明細書で用いる場合、用語「サンプル」は、個体から得られ、本発明に従って診断又は検出アッセイに用いることができる多様な種類のサンプルのことをいう。定義は、血液及び生物学的起源のその他の液体サンプル、生検材料又は組織培養若しくはそれに由来する細胞及びその継代物(progeny)のような固体組織サンプルを含む。
【0015】
認識されるように、抗CHIKモノクローナル抗体の組み合わせを用いる場合、1つ目のモノクローナル抗体が8A4のように捕捉抗体となり、2つ目のモノクローナル抗体が3E4のように検出抗体となり得る。このような捕捉抗体及び検出抗体は、例えば、ELISAアッセイにおいて有利に用いられるだろう。
【0016】
本発明は、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出するため、より具体的には、サンプル中のチクングンヤウイルス(CHIK) E2ポリペプチドの存在又は非存在を検出するためのキットにも関する。キットは、CNCM (Collection Nationale de Cultures de Microorganismes)、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択される少なくとも1種のモノクローナル抗体を含む。本発明のこの実施形態によるキットは、それぞれの診断試験を行うために必要な1種以上の上記のモノクローナル抗体(典型的には濃縮された形態で)をそれぞれが含有するパッケージを含み得る。
【実施例】
【0017】
チクングンヤエンベロープE2糖タンパク質と反応性を有するマウスモノクローナル抗体の作製及び特徴決定
チクングンヤ熱は、アジア及びアフリカにおいて公衆衛生において大きい影響を有するアルボウイルス症である。チクングンヤ(CHIK)ウイルスは、アルファウイルス属のメンバーであり、セムリキ森林(SF)抗原群に属する。本発明者らは、CHIKエンベロープE2糖タンパク質と反応性を有するモノクローナル抗体(MAb)のパネルについて、初めて記載している。E2特異的MAbのスクリーニングのために、本発明者らは、組換え可溶性CHIK E2タンパク質を、ショウジョウバエ属(Drosophila) S2細胞において発現させた。免疫学的方法により分析して、MAb 3C3、3E4及び8A4をその反応性に基づいて選択した。エピトープは、CHIKビリオンの外表面に存在する。これらのMAbは、イグボ-オラウイルスの著しい例外を有して、SF抗原群の関連するメンバーと交差反応性を有さない。抗CHIK E2 MAb 3C3、3E4及び8A4は、CHIKウイルスの生態及び疾患の病因の研究のために役立つ。8A4と3E4の組み合わせは、特異的抗原捕捉ELISAを開発するために適する。
【0018】
材料及び方法
株化細胞及びCHIKウイルス
ベロ細胞は、5%熱失活胎児ウシ血清(FBS)及び2mM L-グルタミンを補ったダルベッコの改変イーグル成長培地(DMEM) (Invitrogen)で成長させた。293A細胞(Quantum)は、10% FBS及び2mM L-グルタミンを補ったピルベート含有DMEM成長培地(Invitrogen)で成長させた。ベロ細胞及び293A細胞は、37℃にてCO2の下でインキュベートした。アエデス・シュードスクテラリス(Aedes pseudoscutellaris) AP61蚊細胞は、10% FBS及び1%トリプトース-ホスフェートブロス(Eurobio)を補ったLeibovitz L-15成長培地で成長させた。キイロショウジョウバエ(Drosophila melanogaster) シュナイダー2 (S2)株化細胞は、Invitrogenから購入した。S2細胞を、10% FBSを含むシュナイダーの成長培地(Invitrogen)で成長させた。無脊椎AP61及びS2細胞は、27℃でインキュベートした。全ての培地は、ペニシリン及びストレプトマイシン抗生物質を補った。
【0019】
CHIK.06-49ウイルス(ジェノタイプ4)は、レユニオン島でのチクングンヤ熱の2006年の発生の間に若い成人から単離された(Schuffeneckerら, 2006)。このウイルスは、蚊の株化細胞で2代継代された。ウイルスストックを、標準化したAP61細胞フォーカスイムノアッセイ(FIA)により、抗CHIK HMAFを用いて力価決定し、力価をFFU.mL-1として表した(Schuffeneckerら, 2006)。高濃度の精製CHIK.06-49を、感染蚊細胞から得た。簡単に、AP61細胞単層のフラスコ20本に、CHIKウイルスを、細胞あたり0.4 FFUの感染多重度(MOI)で接種した。感染細胞の上清流体を感染後2日で採集し、浄化した(clarify)。ウイルスは、0.5 M NaCl中の10% (wt:vol)のポリエチレングリコール(PEG) 8,000 (Fluka)を4℃にて4時間用いて沈殿させた。遠心分離の後に、ペレットをTNEバッファー(20 mM Tris-Cl [pH 8.0]、150 mM NaCl、2 mM EDTA)に再懸濁し、60% (wt:wt)及び30% (wt:vol)のスクロースで構成される不連続スクロース勾配上で、39,000 rpmにて、4℃で2時間遠心分離した。界面に見えるバンドを採集し、TNEバッファーで希釈した。ウイルスは、連続11〜52% (w/v)スクロース勾配上で、35,000 rpmにて、4℃で18時間さらに精製した。見られるバンドを採集し、一定量に分け、-80℃で貯蔵した。
【0020】
CHIK抗原の生成
高濃度のCHIK抗原を、ウイルス粒子から作製した。40本のフラスコのAP61細胞単層に、CHIK.06-49ウイルスを0.4 MOIで接種した。感染細胞の上清流体を感染の2日後に採集し、浄化した。ウイルス粒子を、PEG 8,000を用いて0.5 M NaClの存在下で上記のようにして沈殿させた。TNEバッファーに再懸濁したペレットに、20 mMトリエタノールアミン(Sigma)を補充し、2% Triton X-100 (Sigma)とともに氷上で10分間インキュベートした。懸濁物を1分間、2,000 rpmにて遠心分離し、浄化した調製物を10〜30%の連続スクロース勾配に供し、35,000 rpmにて16時間、4℃にて遠心分離した。画分を頂部から回収し、SDS-PAGEでのクーマシーブルー染色及びイムノブロッティングにより評価した。CHIK抗原を含有するプールした画分(ウイルス調製物)は、UVにより不活性化し、残存感染性をFIAにより確認した。
【0021】
抗体生成ハイブリドーマクローンの作製
3μgのウイルス調製物を、等しい比のフロイントの完全アジュバント(Sigma)と乳化した。4匹の11週齢BALB/cマウス(Charles River)を、皮下注射により免疫化した。2回のブースター注射を、同じ用量で3週間間隔で投与した。マウスから、それぞれのブースター注射の10日後に採血した。融合前ブースター注射を、融合の4日前に投与した(同じ用量を4回の注射に分けた。2回の皮下注射、次いで2回の腹腔内注射)。
Sp2/0Ag14骨髄腫株化細胞を、標準的なプロトコルに従って免疫化マウスからの脾細胞と融合した。抗体生成ハイブリドーマを、2回サブクローニングし、液体窒素中で凍結させた。モノクローナル抗体を、インビトロにて、高濃縮上清を回収することにより作製した。精製は、n-プロテインAセファロース(GE Healthcare)での親和性クロマトグラフィーにより行った。MAbのアイソタイプを、マウスmAbアイソタイピングテストキット(AbD Serotec)を製造業者の推奨に従って用いて調べた。
【0022】
組換え可溶性CHIK sE2タンパク質の構築及び発現
E2のステム領域(残基E2-4〜E2-364)の後にエクトドメインをコードするCHIK.06-49配列(Genbank受理番号AM258994)を、CHIK.06-49 pE2遺伝子を含有するTOPOプラスミドから、フォワードプライマー5'AAAAAAGATCTGACAACTTCAATGTCTATAAAGCCACAAGACC-3' (配列番号4)及びリバースプライマー5' TTTTTGCGGCCGCGTCATAGTGGGGTACAGCTCATAATAATACAG-3' (配列番号5)を用いるPCRを用いて増幅した。PCR生成物を、Bgl II及びNot Iで消化し、pMT/Bip/V5-HisAプラスミド(Invitrogen)のユニークBgl II及びNot I部位に挿入して、pMT/BiP/CHIK.sE2を作製した。CHIK sE2配列を、組換えタンパク質を分泌経路に指向させるBiP配列とインフレームに配置した。発現ベクターにおいて、CHIK sE2配列のC-末端にて、V5エピトープとニッケルキレート親和性クロマトグラフィーを用いる親和性精製のための6ヒスチジンとが続く。ショウジョウバエ属S2細胞(Invitrogen)を、組換えプラスミドpMT/BiP/CHIK.sE2で、リン酸カルシウムトランスフェクションキット(Invitrogen)を用いてトランスフェクションさせた。安定にトランスフェクションされた細胞を、25μg/mlのブラスチシジンを数週間にわたって加えることにより選択した。CHIK.sE2タンパク質を発現する培養S2細胞を、10μg/mlのブラスチシジンを含有する無血清成長培地に順応させた。CuSO4を、500μMの最終濃度で加えて、組換え可溶性CHIK.E2タンパク質の合成及び分泌を誘発した。培養培地中でのCHIK.sE2の蓄積は、CuSO4の添加の10日後に最大であった。細胞培養上清を、0.2μMのフィルタに通した。タンパク質サンプルを、10,000-MWCo Vivaspinカラム(Vivasciences)を通して濃縮し、次いでPBS中で透析した。或いは、組換えCHIK.sE2タンパク質を、細胞培養上清から、平衡化したキレートカラムクロマトグラフィー(HiTrap Chelating HP, Amersham)で精製した。カラムを、洗浄バッファー(0.5 M NaCl、50 mMリン酸ナトリウムバッファー、[pH 8.0])を用いて数回洗浄し、結合したCHIK.sE2を漸増濃度のイミダゾールを用いて溶出した。CHIK.sE2タンパク質を含有する画分をプールし、PBS中で透析した。DEN-1の可溶性の形であるE糖タンパク質(DEN-1 sE)も、ショウジョウバエ属S2細胞で作製した。
【0023】
動態順位付けアッセイ
動態順位付けアッセイは、ProteOn XPR 36装置(Bio-Rad)で行い、データ分析は、ProteOn Managerソフトウェア(Bio-Rad)を用いて行った。抗マウスIgG (Sigma)を、GLMセンサチップ(Bio-Rad)上に、標準的なアミンカップリング化学を用いて固定化した。流出バッファーTPBS (PBS中の0.005% Tween-20)を、実験全体を通して25℃にて連続的に用いた。簡単に、0.2 mLの0.2 M EDC及び0.05 M スルホ-NHS混液を、0.030 mL.分-1の流速にて、続いて10 mM Na-酢酸バッファー、pH 4.5中で希釈した抗マウスIgG 0.2 mLを0.075 mg.mL-1にて注入した。次いで、表面を、0.15 mLの1 MエタノールアミンpH 8.5を用いて不活性化した。1 mg.mL-1のアルジネートを補ったTPBS中で1:2に希釈したハイブリドーマ上清を、0.2 mL下で0.025 mL.min-1の流速にて、続いて、0.2 mLの漸増濃度の組換え可溶性CHIK.sE2タンパク質を注入した。
【0024】
間接ELISA
間接ELISAのために、Maxisorpプレート(Nalgen Nunc)を、D-PBS (Invitrogen)で希釈した105 FFUのスクロース精製CHIKビリオン、50 ngの免疫化に用いたCHIK抗原又は50 ngの組換え可溶性CHIK.sE2タンパク質で被覆し、4℃にて一晩インキュベートした。非特異的タンパク質結合部位は、PBS中の3%ミルクを用いて、1時間、37℃にてブロックした。プレートを、0.1% Tween-20を含有するPBS (PBST)で洗浄した。PBSTで系列希釈した免疫化マウスからの血清、ミルク0.1%及び同じバッファーで希釈した細胞培養上清1:2を加え、被覆されたプレート中で37℃にて2時間インキュベートした。PBSTで洗浄した後に、1%ミルクを含有する1:5,000希釈ペルオキシダーゼコンジュゲートAffiniPureヤギ抗マウスIgG (H+L) (Jackson ImmunoResearch)を1時間、37℃にて加えた。洗浄の後に、3,3',5,5'-テトラメチルベンジジン塩基性基質(TMB, KPL)を加えた。色の反応を、0.1 mLの1M H3PO4をそれぞれのウェルに用いて停止し、プレートを、450 nmにて、OpsysMR ELISAリーダー(Dinex Technologies)中で分析した。
【0025】
抗原捕捉ELISA
検出MAbを調製するために、以前に記載されたようにして(Nakane及びKawaoi,1974)、精製MAbを、ペルオキシドオキシドレダクターゼ(POD)で、抗体のアミン基に標識した。抗原捕捉のための精製MAbを、Maxisorpプレート(Nalgen Nunc)に、 0.1 mLカーボネートバッファー[pH 9.2]中の2μg.mL-1抗体を室温にて一晩インキュベートすることにより固定化した。次いで、ウェルをTPBSで2回洗浄し、3%スキムミルクを補ったPBS中の8% (wt/vol.)スクロースを用いて37℃にて1時間ブロッキングした。ブロッキング剤を除去した後に、プレートを10分間、50℃にて乾燥させ、ウェルを乾燥させて使用時まで4℃にて貯蔵した。1%スキムミルク含有PBSTで希釈したウイルス培養上清又は組換え可溶性CHIK.sE2タンパク質をウェルに加え(0.1 mL/ウェル)、1時間、37℃にてインキュベートした。数回の洗浄の後に、ウェルを1時間、37℃にて、ウェルあたり1μg.mL-1の1%スキムミルク含有PBST中のPODコンジュゲートMAb (0.1 mL/ウェル)とインキュベートした。洗浄の後に、TMB基質を加え、プレートを、暗所で8分間さらにインキュベートした。酵素活性を、上記のようにして測定した。
【0026】
イムノブロット分析
Laemmliサンプルバッファーと室温にて混合したタンパク質サンプルを、4〜12% SDS-PAGE (NuPage, Invitrogen)に載せた。サンプルを、PVDFメンブレン(invitrogen)にエレクトロトランスファーし、PBST中の5%ミルクでブロックした。メンブレンを、1次抗体でプローブし、結合した抗体を、1:10,000希釈のPOD-コンジュゲート2次抗体、次いで、ECL基質溶液(Amersham)により検出した。
【0027】
IFアッセイ及びフローサイトメトリー分析
間接免疫蛍光(IF)アッセイのために、Permanox Labtekチャンバ(Nunc)上で成長した細胞を、PBS中の3.2%パラホルムアルデヒド(PFA)で20分間固定し、次いで、PBS中の50 mM NH4Clと10分間インキュベートした。細胞を、PBS中の0.1% Triton X-100を4分間用いて透過にするか又は透過にせず、次いで、PBS/0.2%ゼラチン中の1次抗体と、37℃にて30分間インキュベートした。PBSを用いて充分に洗浄した後に、細胞を、PBS/0.2%ゼラチン中で1:100希釈のフルオレセインコンジュゲートヤギ抗マウスIgG (Pierce)と、37℃にて30分間、さらにインキュベートした。サンプルを、蛍光顕微鏡により観察した。
【0028】
フローサイトメトリーフラックスのために、細胞をはがし、PBS中の3.2% PFAで固定した。固定された細胞を、染色バッファーSB (1% FBS中の0.1% [w/v)アジ化ナトリウム; pH 7.5)で充分に洗浄し、SB又は透過バッファーPB (1% [wt./vol.]サポニンを補ったSBバッファー)で希釈した1次抗体と37℃にて90分間インキュベートした。充分に洗浄した後に、細胞を、SB又はPBで1:100希釈したフルオレセインコンジュゲート2次抗体(Pierce)と、37℃にて1時間インキュベートした。充分に洗浄した後に、細胞を、CellQuest Proソフトウェア(BD Biosciences)を備えたFACSCalibur (Becton Dickinson)を用いるフローサイトメトリーにより分析した。
【0029】
結果
CHIK E2抗原の作製
ウイルス抗原を作製するために、CHIKビリオンを、CHIKウイルスのレユニオン島株06-49 (CHIK.06-49)に感染させた蚊細胞の上清から沈殿させた。高濃度のウイルス粒子を、2% Triton X-100とインキュベートし、ウイルス懸濁物をスクロース勾配に供した。遠心分離の後に、画分をイムノブロット分析により評価した。抗CHIK抗体はpE2、C及びより低い程度で約15〜20%のスクロース濃度でのE2を検出した。pE2、E2及びCに富む画分をプールし、BSL-2実験室内でマウス免疫化を行うためにU.V.で処理した。SDS-PAGEのクーマシーブルー染色及びイムノブロッティングにより評価されるように(図1)、ウイルス抗原の分離の後に観察された主要なバンドは、pE2に相当した。ウイルス調製物の抗原性は、抗CHIK高度免疫マウス腹水(HMAF)を用いる間接ELISAにより確認した(データ示さず)。陰性対照として、デング(DEN)又は西ナイルウイルスに対して指向されたマウス免疫血清は反応性を示さなかった。
【0030】
ショウジョウバエ属S2細胞で生成されたアルボウイルス抗原は、それらの蚊の天然対応物と類似し得るので、我々は、ショウジョウバエ属発現系(Invitrogen)を用いてCHIK E2糖タンパク質を発現させた。エクトドメインとその後にCHIK.06-49ウイルスからのE2のステム(以下、CHIK.sE2という)とを発現する安定的にトランスフェクションされたS2株化細胞を確立した。培養培地へのCuSO4の添加は、組換え可溶性CHIK.sE2タンパク質の合成及び分泌を誘発した。培養培地中でのCHIK.sE2の蓄積は、誘発の2週間後に最大であった。間接ELISAのために、分泌されたCHIK.sE2タンパク質を上清から直接濃縮し、ELISAプレートの被覆に用いた。イムノブロット分析及び抗原捕捉ELISAのために、組換え可溶性CHIK.sE2タンパク質を、細胞培養培地から、ニッケルキレート親和性クロマトグラフィーを用いて精製した。
【0031】
イムノブロット分析は、組換え可溶性CHIK.sE2タンパク質(42 kDaの見かけの分子量)が、抗CHIK HMAF及びCHIK陽性患者の血清により認識されたことを示す(図2)。同様の結果が、間接ELISAを用いて観察された(データ示さず)。これらの結果は、S2細胞から分泌された組換え可溶性CHIK.sE2タンパク質が、CHIK E2糖タンパク質の天然の形により近い高次構造を有することを示唆する。
【0032】
CHIK E2タンパク質に指向されたMAbの作製
2回の成功した融合を、「材料及び方法」のセクションに記載したようなウイルス調製物を用いて免疫化したBALB/cマウスからの脾臓細胞を用いて行った。抗体生成ハイブリドーマクローンのスクリーニングのために、ウイルス調製物及び組換え可溶性CHIK.sE2タンパク質を、間接ELISAにおいてCHIK抗原として用いた。およそ60の抗体生成ハイブリドーマクローンが、胎児ウシ血清(FBS)のバックグラウンドレベル反応性より少なくとも4倍高い抗体結合性を有するとして同定された。60個のハイブリドーマクローンのうち12個が、スクロース精製CHIKビリオン及び組換え可溶性CHIK.sE2と、間接ELISAにより反応できた(データ示さず)。IFアッセイによりスクリーニングすると、5個の抗体生成ハイブリドーマクローン(3C3、3E4、5A8、6F2及び8A4)が、CHIKウイルス感染細胞に対して強い陽性反応を示した(データ示さず)。ProteOnバイオセンサ分析は、5個のクローンが、高い見かけの結合親和性でCHIK.sE2を認識したことを示した(図3)。5個の抗体生成ハイブリドーマクローンのうち3個(3C3、3E4及び8A4)が、組換え可溶性CHIK.sE2タンパク質の迅速な会合及び遅い解離を示した(データ示さず)。これらの結果により、抗体生成ハイブリドーマクローン3C3、3E4及び8A4をサブクローニングし、次いで増殖させた。その後の実験を、ハイブリドーマクローン上清からの精製抗CHIK.E2 MAbを用いて行った。
MAb 3C3、3E4及び8A4の特徴を、表1にまとめる。
【0033】
【表1】

【0034】
3個の抗CHIK.E2 MAbは、サブクラスIgG1,κのものであった。フォーカス低減中和試験(Focus reduction neutralization tests; FRNT)を用いて、精製抗CHIK.E2 MAbが培養ベロ細胞においてCHIKウイルス複製を阻害する能力について評価した。終点力価は、AP61細胞上のおよそ100フォーカス形成単位(FFU)のCHIK.06-49ウイルスを少なくとも90%低減させる、試験した最高の抗体希釈として算出した(FRNT90)。抗CHIK HMAFは、平均で希釈1:2,500のFRNT90を与えたが、MAb 3C3、MAb 3E4及びMAb 8A4はいずれも、10μg.mL-1ほどの高い濃度にてCHIKウイルスを中和しなかった(データ示さず)。
【0035】
CHIK E2糖タンパク質の天然型との抗CHIK.E2 MAbの反応性
間接ELISA試験をCHIKウイルスに対して行って、選択された抗CHIK.E2 MAbがビリオンの表面を認識するかを評価した。この目的において、スクロース精製CHIK.06-49ウイルスを用いて、ELISAプレートをウェルあたり105 FFUにて被覆し、漸増濃度のMAbを加えた。MAb 3C3、3E4及び8A4は間接ELISAにおいて天然ウイルス粒子と反応し(図4)、このことは、それらのエピトープがCHIKウイルスの外表面上に曝されていることを示唆する。洗剤条件下での3つの抗CHIK.E2 MAbの結合能力を分析するために、CHIKウイルスを、2% Triton X-100とインキュベートし、ELISAプレートを被覆した。MAb 8A4のみが、変性条件下でCHIKウイルスとの著しい反応性を示し(データ示さず)、このことは、MAb 8A4が非イオン界面活性剤の存在下でCHIK E2糖タンパク質を認識できることを示す。
【0036】
間接ELISAにおいて、用量曲線応答は、MAb 8A4及び3E4が、MAb 3C3が結合するよりもCHIKによりよく結合したことを示した(図4)。この抗原検出試験により推定されるように、MAb 3C3の反応性は、MAb 8A4及び3E4と比較して10倍より低かった。抗CHIK E2 MAbの対がサンドイッチアッセイに有用であり得るかを評価するために、相補性研究を、組換え可溶性CHIK.sE2タンパク質に対して、ProteOnバイオセンサ分析により行った。MAb 3C3及び3E4は、MAb 8A4と結合したCHIK.sE2と著しい反応性を示し、最良の結果は、MAb 3E4を検出抗体として用いたときに得られた(データ示さず)。つまり、抗CHIK.E2 MAb 8A4 (捕捉抗体)と3E4 (検出抗体)との組み合わせが、抗原捕捉ELISAの開発に適する。
【0037】
MAbがCHIK E2糖タンパク質に結合する能力を、IFアッセイ(図5A)及びフローサイトメトリー分析(図5B)によりさらに調べた。抗CHIK HMAFを、陽性対照として用いた。IFアッセイにおいて、MAb 3C3、3E4及び8A4は、CHIKウイルス感染ベロ細胞内で内生的に合成されたE2タンパク質と強く反応した(図5A)。陰性対照として、抗DEN E MAb 4E11は反応性を示さなかった(データ示さず)。3個の抗CHIK.E2 MAbは全て、PMに輸送されたCHIK E2糖タンパク質を認識し(図5A、- TX-100)、このことは、それらのエピトープがE2の外面上でアクセスされ得ることを示唆する。フローサイトメトリー分析により、MAb 3C3及び3E4は、サポニンで透過にしたか又はしていないCHIKウイルス感染ベロ細胞に対して類似の蛍光強度の平均値を示した(図5B)。つまり、抗CHIK.E2 MAbはともに、新しく合成されたE2分子とPM-関連E2とを同様に認識できる。
【0038】
フローサイトメトリー分析により、抗CHIK.E2 MAb 8A4の反応性が、MAb 3C3及び3E4とは異なることが明らかになった。実際に、MAb 8A4は、サポニンの存在下ではCHIKウイルス感染細胞とのより弱い反応性を示した(図5B)。MAb 8A4はPM-関連E2を優先的に標的にするので、そのエピトープは、E2の天然型の外面上に主に曝されているようである。
【0039】
抗CHIK.E2 MAbのイムノブロット反応性
イムノブロッティングを、抗CHIK.E2 MAbが線状エピトープと結合したかを決定するために、スクロース精製CHIKビリオン及び組換え可溶性CHIK.sE2タンパク質を用いて行った(図6)。陽性対照として、抗CHIK HMAFは、CHIKウイルス-関連E2及びCHIK.sE2をプローブした。本発明者らは、MAb 3C3及び3E4が還元条件下でE2と反応できたことを観察した。これらのMAbが線状ペプチドエピトープを認識するかを決定するために、CHIK.sE2のアミノ酸配列全体をカバーするオーバーラップ15マー固定化ペプチドのアレイを、SPOT技術により調製した。線状合成ペプチドは、2つの抗CHIK.E2 MAbについてのエピトープを形成できなかった(データ示さず)。これらの結果は、MAb 3C3及び3E4が部分線状のエピトープを認識したことを示唆する。
【0040】
抗CHIK.E2 MAb 8A4は、イムノブロット分析においてCHIKウイルス-関連E2タンパク質と反応できず(図6)、このことは、このMAbが高次構造エピトープを認識できたことを示唆する。MAb 8A4は、MAb 3C3及び3E4と比較して、還元条件下でCHIK.sE2とより弱く反応するが、これは、約100及び150 kDaの推定分子量の2つのさらなるタンパク質バンドと反応性を示した(図6、MAb 8A4、レーン1)。このような知見は、MAb 8A4が可溶性E2の二量体及び三量体の形態を検出する能力を有することを示唆する。
【0041】
抗CHIK.E2 MAbの、旧世界のアルファウイルスとの交差反応性
IFアッセイを、感染蚊細胞に対して行って、3個の抗CHIK.E2 MAbが、SINウイルス及びSF、イグボ-オラ、ONN、ババンキ(Babanki)、ジンジラモ(Zingilamo)、ミデルブルグ(Middelburg)、ヌドゥム(Ndumu)及びArv9/71の各ウイルスのような旧世界で単離されたSF血清型群の関連するメンバーを認識するかを評価した。表2に、MAbの交差反応性をまとめる:抗CHIK HMAFは、CHIK S27株、イグボ-オラIBH10964株、ONN Gulu (ONN-59)株、ジンジラモAnB1245d株及びSF IPD/A株と強い反応性を示し、SIN Ar399株と中程度の反応性を示し、ババンキArY251株と弱い反応性を示し、ミデルブルグSAAr749株、ヌドゥムSAAr2204株及びArv9/71ウイルスと交差反応性を示さなかった。蛍光抗体試験における抗CHIK.E2 MAbの反応性は、抗CHIK HMAFのものとは異なっていた。IFアッセイの結果により示されるように、MAb 3C3、3E4及び8A4は、CHIKウイルスと反応し、より低い程度でイグボ-オラウイルスと反応した(表2)。IFアッセイにおいて、MAb 8A4は、CHIKウイルス又はイグボ-オラウイルスに感染した蚊細胞に対して同様の反応性を示した。
【0042】
【表2】

【0043】
CHIK.06-49ウイルス、ONN-59ウイルス(Genbank受理番号M20303)、及びイグボ-オラIBH 10964株(Genbank受理番号AF079457)についてのエクトドメイン及びE2のステム領域(E2-1〜E2-364)のアミノ酸配列のアラインメントを図7に示す。263位及び345位の2つの同定されたN-結合グリコシル化部位は、CHIK、ONN及びイグボ-オラウイルスで保存されている。E2の最初の365残基の遺伝子分析は、イグボ-オラウイルス株とONNウイルス株との間に5アミノ酸ほど少ない違いを示した(98.5%同一性) (図7)。CHIKウイルスとSF抗原群の2つの他の関連するメンバーとの間には、45アミノ酸の違い(87.5%同一性)がある。E2配列の比較分析は、ONN-59がCHIK.06-49及びイグボ-オラ IBH 10964ウイルスとはE2-130位、E2-164位及びE2-288位が異なることを示した(図7、オープンフレーム)。興味深いことに、置換Thr164Alaは、CHIK及びイグボ-オラウイルス内の厳密に保存された領域E2 160〜177に位置づけられる。このプロリンリッチ領域は、アルファビリオンのE2スパイクの表面上に曝露されているのだろう(Mukhopadhyayら, 2006)。
【0044】
抗CHIK E2 MAbに基づく抗原捕捉ELISA
上記で論じたように、抗CHIK.E2 MAb 8A4及び3E4は、サンドイッチELISAにおけるCHIKウイルスの検出に適する。MAb 8A4 (2μg.mL-1)を捕捉抗体としてELISAプレート上で、そしてペルオキシダーゼコンジュゲートMAb 3E4 (1μg.mL-1)を検出抗体として用いた。抗原捕捉ELISAの感度を決定するために、AP61蚊細胞又はヒト293A細胞で成長したCHIK.06-49の系列希釈を用いて、標準曲線を決定した(図8A)。DPBST/1%ミルクを用いて、450 nmでの光学密度0.15での抗原-捕捉についてのベースラインを決定した。つまり、DPBST/1%ミルクで希釈されたCHIKウイルスの検出についてのカットオフ値は0.45に設定され、これは、DPBST/1%ミルクについてのOD450の平均+3標準偏差(S.D.)と等しい。カットオフ閾値に従って、ELISAの検出限界は、およそ106.0 AP61FFUの蚊細胞由来CHIKウイルス及び104.3 FFUのヒト細胞由来CHIKウイルスであった(図8A)。抗原捕捉ELISAは、可溶性の形態のE2 (CHIK.sE2)も検出でき、最小限の検出可能な質量はおよそ5 ngであった(図8B)。抗CHIK.E2 MAbの対は、蚊細胞と比較して、293A細胞において成長したCHIKウイルスとより高いレベルの反応性を有する(図8A)。これは、細胞変性CHIKウイルスに感染したヒト細胞の上清中への個別化されたE2糖タンパク質の放出に関係するのであろう。これらの結果は、MAb 8A4及び3E4を組み合わせて用いて、可溶性CHIK E2タンパク質及びウイルス培養上清中のビリオン-関連E2タンパク質を検出できるであろうことを示す。
【0045】
アフリカでは2つの異なるCHIKウイルスジェノタイプがある(Powers及びLogueによる概説, 2007)。第1のジェノタイプは、西アフリカからのCHIKウイルス単離株を含んでいた。第2のジェノタイプは、東/中央/南アフリカからのCHIKウイルス単離株の群をなしていた。抗CHIK.E2 MAbの対の特異性を決定するために、抗原捕捉ELISA試験を、中央/東アフリカ(中央アフリカ共和国、1978; インド洋、2005〜06)及び西アフリカ(コートジボワール、1999; セネガル1965〜66及び2005)から得られたCHIKウイルスの臨床単離株のパネルに対して行った。蚊細胞で成長したCHIKウイルスの全ての試験したアフリカ株が認識された(データ示さず)。つまり、MAb 8A4と3E4の組み合わせは、西アフリカ及び中央/東アフリカのCHIKウイルスジェノタイプにわたって保存されたE2のエピトープを認識できる。抗CHIK.E2 MAbの組み合わせの特異性をさらに規定するために、抗原捕捉ELISAを、関連するアルファウイルスに対して行った。結果は、間接ELISAのものと同様であった。サンドイッチにしたMAb 8A4及び3E4は、CHIK.06-49株に結合し、より低い程度でイグボ-オラ IBH 10964株にも結合したが、ONN-59株又はアフリカ若しくはアジアで単離されたSF抗原群のその他の関連するメンバーとは交差反応しなかった(データ示さず)。まとめると、これらのデータは、抗CHIK.E2 MAb 8A4及び3E4が、CHIKウイルス、及びより低い程度でイグボ-オラウイルスの検出のためのサンドイッチアッセイの設計に適することを示す。
【0046】
考察
この研究において、2006年にレユニオン島で単離されたCHIKウイルス株06-49を用いて、免疫にされたマウスにおけるCHIK E2糖タンパク質に対するMAbのパネルを作製した。この報告は、新規な組換え可溶性CHIK E2糖タンパク質についても記載する。本発明者らは、CHIK.06-49 E2エクトドメイン及びその後のそのステム領域に相当するCHIK.sE2を、ショウジョウバエ属S2細胞で発現させた。この発現系において、CHIK.sE2は、誘発された安定なS2細胞クローンの上清に蓄積した。間接ELISA及びイムノブロットアッセイは、CHIK.sE2が、CHIKウイルスに対する特異的抗体により認識されたことを示した。本発明者らは、高度に精製されたCHIK.sE2抗原を生成する精製手順を開発できた。S2細胞培養上清からの精製CHIK.sE2タンパク質は、間接ELISA及びイムノブロット分析において、CHIKウイルスに特異的な抗体の容易な検出のために適切である。
【0047】
本発明者らは、3個の抗CHIK E2 MAb (3C3、3E4及び8A4)が、CHIKウイルス-関連E2糖タンパク質と、間接ELISAにおいて著しい反応性を有することを示した。MAb 3C3、3E4及び8A4は、インタクトなCHIKビリオンの状況においてE2と反応するので、これらのエピトープは、おそらく、ウイルス表面に存在するだろう。しかし、3個のMAbは全て、インビトロにて霊長類のCHIKウイルス感染を中和できなかった。抗CHIK.E2 MAbのウイルス全体への結合は、宿主細胞とのウイルスの相互作用を阻害しなかったので、それらのエピトープは、CHIK E2糖タンパク質の主要な中和ドメインに位置付けられていないようである。
【0048】
イムノブロッティング分析の結果は、MAb 3C3及び3E4が、CHIKウイルス-関連E2及び組換え可溶性CHIK E2糖タンパク質と、還元条件下で著しい反応性を有することを示す。免疫蛍光研究は、2個の抗CHIK E2 MAbが、新しく合成されたE2及びPM-関連E2を、感染霊長類細胞においてうまく検出できることを示した。CHIK抗原とのそれらの反応性に基づいて、MAb 3C3及び3E4により認識されるエピトープは、E2の外面上で最も少なく部分的に線状であると考えられる。MAb 3C3及び3E4と反応できる可溶性CHIK.sE2タンパク質は、エピトープマッピング分析に有用であり得る。競合結合実験についてのCHIK.sE2に由来するサブフラグメントの評価が計画される。ファージディスプレイランダムペプチドライブラリーも、抗CHIK.E2 MAbのエピトープの同定に用いることができそうである(Davisら, 2000)。イムノブロット分析において、MAb 8A4は、CHIKビリオン-関連E2を認識できず、還元条件下で、MAb 3C3又は3E4と比較して、CHIK.sE2とのより低い反応性を示した。フローサイトメトリー分析の結果は、MAb 8A4が、CHIKウイルス感染細胞において、PM-関連E2を主に標的にすることを示した。イムノブロット分析の結果は、MAb 8A4が、可溶化E2タンパク質のホモオリゴマー形態を認識できたことを示した。CHIK E2糖タンパク質の原子構造はまだ決定されていないが、MAb 8A4により認識されるエピトープは、E2の天然型の外面において高次構造を有するようである。
【0049】
3個の抗CHIK.E2 MAbは、IFアッセイにより決定されるように、イグボ-オラウイルスと交差反応性を示したが、ONN-59株とは示さなかった。CHIK、ONN及びイグボ-オラウイルスは、血清学的に、SF抗原群に分類される(Strauss及びStraussによる概説, 1994)。ONNウイルスは、1959年のウガンダのヒトサンプルから単離され(Haddowら, 1960)、イグボ-オラウイルスは、1966年にナイジェリアのヒトから単離された(Olaleyeら, 1988, 1990)。イグボ-オラウイルスがONNの株であることが最近提唱されている(Lanciottiら, 1998; Powersら, 2000)。
【0050】
E2アミノ酸レベルでのパーセント配列同一性の値は、イグボ-オラBH10964株が、2006年にレユニオン島で単離されたCHIK.06-49株よりもONN-59株により近接に関連することを示した(図7)。E2残基Thr164が1959年に単離されたONNウイルス株GuluにおいてAlaに変異されていることに鑑みて、CHIK及びイグボ-オラウイルスでの厳密な保存領域E2 160-177 (図7)は、これらの抗CHIK.E2 MAbの抗原性ドメインの部分を形成しているはずである。実際に、この領域の残基は、アルファビリオンの表面を覆うE1-E2へテロ二量体のE2スパイクの先端に参加している(Mukhopadhyayら, 2006)。1995年に単離されたONN株SG650 (ONN-95)は、E2-164位にスレオニン残基を有するので(Lanciottiら, 1998)、ONN-95を用いるさらなる研究は、抗CHIK.E2 MAbの結合における領域E2 160-177の役割についての洞察を提供できる可能性がある。
【0051】
ウイルス培養上清中のウイルス粒子の高い力価の存在、並びにビリオン外表面上及び細胞膜のE2の存在は、CHIKウイルス感染の検出が、ウイルス抗原に基づくべきであることを示唆する。モノクローナル抗体8A4は、天然CHIKビリオン及びCHIK E2糖タンパク質の可溶性の形態の検出に利用可能である。抗原捕捉ELISAにおいて、MAb 8A4 (捕捉抗体)とMAb 3E4 (検出抗体)との対は、少なくとも104.5 FFUの、ヒト細胞で成長したCHIKウイルスを検出できた。この試験の検出限界は、約5 ngの可溶性E2分子であった。抗CHIK E2 MAbの対は、CHIKウイルスの中央/東アフリカ株及び西アフリカ株について交差反応性を有し、イグボ-オラウイルスの顕著な例外があるが、SF群の関連するメンバーとの交差反応性はない。
【0052】
結論として、本発明者らは、CHIK E2糖タンパク質に対して反応性がある3つのMAb 3C3、3E4及び8A4を作製して、特徴決定した。このようなMAbは、CHIKウイルスの生態及びチクングンヤ熱の病因を研究するために有用である(Borgheriniら, 2007; Ozdenら, 2007; Sourisseauら, 2007)。3個の抗CHIK E2 MAbは、CHIKウイルス感染の診断に有用であり、診断法は、イムノブロット及び免疫蛍光アッセイを含み得る(Powers及びLogueによる概説, 2007)。今回のデータは、MAb 8A4及び3E4を組み合わせて用いて、CHIKウイルス全体及び可溶性CHIK E2糖タンパク質を抗原検出ELISAにおいて認識することを示した。血液及び組織における感染性ウイルスの力価は、チクングンヤ熱の早期の診断を導くために充分高いので(Santhoshら, 2007)、抗CHIK E2 MAb 8A4 (捕捉抗体)及び3E4 (検出抗体)の組み合わせが、特異的かつ感度が高い抗原検出系を開発するために適切であることは明らかである。
【0053】
【表3】

【0054】
【表4】

【0055】
【表5】

【受託番号】
【0056】
CNCM I-3822
CNCM I-3824
CNCM I-3823
【技術分野】
【0001】
本発明は、チクングンヤ(Chikungunya)ウイルス(CHIK)により引き起こされるアルボウイルス症(arbovirosis)の分野に関する。本発明は、具体的には、抗CHIKモノクローナル抗体(MAb)、より具体的には抗CHIK.E2 MAb、及びCHIK株の存在又は非存在を検出するための方法における診断物質としてのそれらの使用に関する。
【背景技術】
【0002】
チクングンヤ(CHIK)ウイルスは、アフリカ、インド及び東南アジアにおける爆発的な流行病を引き起こす能力を有する(Epstein, 2007; Powers及びLogueによる概説, 2007)。このウイルスは、アエデス属(Aedes (Ae.))の蚊により伝達される。CHIKウイルスは、2005年からのレユニオン島及びインド洋、並びに2006年に1.4百万の住民が感染したと見積もられるインドにおける空前の規模の大発生の原因である(Schuffeneckerら, 2006; Staikowskyら, 2006; Arankalleら, 2007; Pialouxらによる概説, 2007)。
【0003】
CHIKウイルスに感染したヒトは、典型的には、無能力化、多発性関節痛、重篤な筋肉痛、及び斑状丘疹状皮疹がときに後に続く関節の硬直を伴う急性疾病を経験する(Johnston及びPeters, 1996; Borgheriniら, 2007; Pialouxらによる概説, 2007; Rulliら, 2007)。CHIKウイルス感染は、ほとんど全ての場合に筋肉痛を伴う。筋肉内の衛星細胞のCHIKウイルス感染は、部分的に、臨床上の徴候のいくつかの特徴を説明できた(Ozdenら, 2007)。チクングンヤウイルス感染の臨床症状は、西アフリカからのイグボ-オラウイルス、中央アフリカからのオニョンニョン(ONN)ウイルス、オーストラリア及び太平洋からのロスリバー及びバーマウイルス、及び南アメリカからのマヤロウイルス、ならびに普遍種のシンドビス(SIN)ウイルスのようなその他の関節炎誘発性のアルファウイルスのために、しばしば、アルボウイルス疾患と誤診される。
【0004】
CHIKウイルスは、アルファウイルス(Alphavirus)属、トガウイルス(Togaviridae)科のメンバーである(Strauss及びStraussによる概説, 1994)。アルファウイルスは、大細胞親和性を示す、小さい、エンベロープ一本鎖プラス鎖RNAウイルスである。ウイルス表面は、エンベロープE1及びE2糖タンパク質のヘテロ二量体のトリプレットで形成される膜につなぎとめられたスパイクで覆われている。ウイルススパイクタンパク質は、細胞表面への接着及びウイルスの侵入を容易にする。E1エンベロープ糖タンパク質は、ウイルス感染の間の低pHにより惹起される膜融合を媒介するクラスII融合タンパク質である。E2は、50 kDaのI型膜貫通糖タンパク質である:最初の260アミノ酸はエクトドメインを構成し、その後に、ステム領域を形成する約100アミノ酸と、30アミノ酸のスパン領域と、30アミノ酸の短い細胞質エンドドメインとが続く(Pletnevら, 2001; Mukhopadhyayら, 2006)。pE2 (E3及びE2タンパク質の62-kDa前駆体)及びE1は、小胞体内でヘテロ二量体として組み立てられる(Strauss及びStraussによる概説, 1994)。ゴルジ体でpE2が切断されてE3及びE2が形成された後に、E1-E2複合体は細胞質膜(PM)に運ばれる。細胞質E2エンドドメインと、予め組み立てられたヌクレオカプシドとの相互作用は、PMでのウイルスのエンベロープへの封入過程の最初のステップの1つである。ビリオンの完全性は、E1とE2との直接の相互作用により維持される(Strauss及びStrauss, 1994)。アルファウイルスの生活環の経過の間に、E2糖タンパク質は受容体結合を担う。ほとんどの中和抗体は、E1よりもむしろE2におけるエピトープを認識する(Strauss及びStraussによる概説, 1994)。E2の外表面上の高次構造(conformational)エピトープを認識する抗体は、アルファウイルス感染を中和する可能性を有する。
【0005】
CHIKウイルス感染の生物学的診断は、初期ウイルス血症期中の定量的リアルタイムRT-PCRに基づく方法に実質的に基づく(Edwardsら, 2007; Laurentら, 2007; Santhoshら, 2007)。血清学的方法は、最初の臨床的症状発現の後の早期に抗CHIK IgMを、そして2週間後に特異的IgGを検出する(Pialouxらによる概説, 2007)。しかし、ELISA及び免疫検出アッセイは、特異性及び感度が乏しい。なぜなら、CHIKウイルスが、セムリキ森林(SF)抗原群の関連するメンバーと交差反応性を有するからである(Greiser-Wilkeら, 1991)。
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明者らは、CHIKウイルスの生態及びCHIK関連疾患の病因を研究するのに特に有用であるモノクローナル抗体(MAb)を開発し、特徴決定した。
当業者が認識するように、本発明の独自性は、CHIKウイルス全体又はCHIK E2糖タンパク質に、その可溶性形態にさえも特異的に結合するモノクローナル抗体(MAb)のパネルを本発明者らが実際に作製し、特徴決定したということにある。
【課題を解決するための手段】
【0007】
この関係において、本発明は、CNCM (Collection Nationale de Cultures de Microorganismes)、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託されたもののような、CHIKウイルスの外表面上にあるエピトープに特異的に結合するモノクローナル抗体を提供する。
【図面の簡単な説明】
【0008】
【図1】CHIKタンパク質組成及びウイルス調製物の抗原特異性。CHIK抗原(CHIK Ag)を、4〜12% SDS-PAGEにより、変性条件下で分け、クーマシーブルー染色によりすぐに視覚化したか(左)、又は抗CHIK HMAFを用いるイムノブロット分析のためにPVDFメンブレンにエレクトロブロッティングした(右)。分子量マーカー(MW)の位置は、kDaで示す。
【図2】組換え可溶性CHIK sE2糖タンパク質の抗原性。イムノブロット分析を、精製組換え可溶性CHIK.sE2タンパク質及びDEN-1 sE、抗CHIK HMAF (CHIK HMAF)、正常ヒト血清(neg.血清)並びにCHIK陽性患者の血清(CHIK pos.血清)を用いて行った。
【図3】抗体生成ハイブリドーマ上清に対する動態順位付け(ranking)アッセイ。曲線は、抗体生成ハイブリドーマ上清3C3、3E4、5A8、6F2、8A4及び9B5への50 mM CHIK.sE2タンパク質のモニターされた経時的な結合(レゾナンスユニット(RU)での)を示す。
【図4】抗CHIK.E2 MAbを用いるE2検出の感度。スクロース精製されたCHIKウイルスを用いて、ELISAプレートを、105 FFU/ウェルで被覆し、漸増濃度のMAb 3C3 (▲)、3E4 (○)及び8A4 (■)を加えた。MAbの反応性を、「方法」に記載されるようにして間接ELISAにより試験した。
【図5】抗CHIK.E2 MAbの、感染細胞で内生的に合成されたE2との反応性。ベロ細胞を24時間、CHIK.06-49ウイルスに、0.4 MOIにて感染させた。(A)では、抗CHIK.E2 MAbを用いるIFアッセイによるE2の検出。固定細胞を透過(+ TX-100)又は非透過(- TX-100)にし、次いで、2.5μg.mL-1のMAb 3C3、3E4又は8A4を用いて免疫染色した。抗CHIK HMAF (希釈1:500)を対照として用いた。(B)では、抗CHIK.E2 MAbを用いるCHIKウイルス感染細胞のフローサイトメトリー分析。固定された感染細胞(連続線)又は擬似感染細胞(点線)を、サポニンを用いて透過(黒色の線)にするか又は透過にせず(灰色の線)、次いで、2.5μg.mL-1 MAb 3C3、3E4又は8A4を用いて免疫染色した。抗CHIK HMAF (希釈1:500)を陽性対照として用いた。
【図6】抗CHIK.E2 MAbの還元E2タンパク質との反応性を、イムノブロット分析により決定した。100 ngの精製CHIK.sE2タンパク質(レーン1)又は105 FFUのスクロース精製CHIKウイルス(レーン2)をブロットしたメンブレンを、「方法」に記載されるようにして、個別に、MAb 3C3、3E4又は8A4とインキュベートした。抗CHIK HMAFを陽性対照として用いた。
【図7】CHIK (配列番号1)、イグボ-オラ(配列番号2)及びONNウイルス(配列番号3)のE2配列のアラインメント。残基E2-1〜E2-364の領域を示す。アスパラギン-結合グリコシル化部位に(◆)で印を付す。オープンフレームは、CHIK及びイグボ-オラウイルスと比較して、ONNウイルスに3つの特定のアミノ酸の違いがあることを示す。
【図8】抗CHIK E2 MAbを用いる抗原捕捉ELISAの感度。定量分析を、捕捉抗体としてMAb 8A4を、検出抗体としてMAb 3E4を用い、ウイルス培養上清(A)及び組換え可溶化CHIK.sE2糖タンパク質(B)をウイルス抗原として用いて行った。(A)では、蚊AP61細胞(●)又はヒト293A細胞(□)で成長させた系列希釈CHIK.06-49ウイルス。(B)では、精製組換え可溶化CHIK.sE2タンパク質の漸増濃度。
【発明を実施するための形態】
【0009】
本明細書で用いる場合、用語「特異的に結合する」とは、本発明により意図されるCHIKタンパク質、例えばE2糖タンパク質に比較的高い親和性で結合するが、CHIK E2糖タンパク質以外の分子を実質的に認識せず、結合しない抗体のことをいう。本明細書で用いる場合、用語「比較的高い親和性」とは、少なくとも10-6 M、好ましくは少なくとも約10-7 M、さらにより好ましくは10-8 M〜10-10 Mの抗体と興味対象のタンパク質との間の結合親和性を意味する。このような親和性の測定は、当業者に公知の標準的な競合結合イムノアッセイ条件下で行われることが好ましい。
【0010】
本明細書で用いる場合、用語「抗体」は、免疫原での刺激に応答してリンパ球により生成される糖タンパク質のことをいう。抗体は、インビトロ及びインビボにおいて、特異的かつ選択的に、それらの生成を惹起する抗原決定基、すなわちエピトープ、又は同種抗原と密接に関連する抗原決定基と反応する能力を有する。用語「抗体」は、そのような抗体の結合(可変)領域を用いた構築物及びその他の抗体改変を包含することを意味する。つまり、本発明の方法で有用な抗体は、抗体全体、抗体フラグメント、多機能性抗体凝集体又は一般的に抗体からの1つ以上の特異的結合部位を含む物質を含み得る。抗体フラグメントは、Fv、Fab又はF(ab')2フラグメントのようなフラグメント、又は単鎖Fvフラグメントのようなそれらの誘導体であり得る。抗体又は抗体フラグメントは、非組換え、組換え又はヒト化であり得る。抗体は、免疫グロブリンアイソタイプのもの、例えばIgG、IgMなどであり得る。さらに、免疫グロブリン又はそのフラグメントの凝集体、ポリマー、誘導体及びコンジュゲートは、適切であれば用いることができる。
【0011】
本発明のモノクローナル抗体又はその組み合わせは、特に、診断試薬として、及び/又はCHIK感染のスクリーニングのために、その感染が無症状であっても、用いられる。本発明のモノクローナル抗体は、限定されないが、免疫蛍光、イムノブロット及びELISAアッセイを含み得る診断法においても用いられる。
【0012】
この関係において、本発明は、
a) サンプルを、本発明の抗CHIKモノクローナル抗体又は本発明の抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出する方法を提供する。
【0013】
より具体的には、本発明は、
a) サンプルを、本発明の抗CHIK E2モノクローナル抗体又は本発明の抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤ(CHIK) E2ポリペプチドからのエンベロープE2ポリペプチド若しくは機能的誘導体又はその前駆体E3E2 (p62)の存在又は非存在を検出する方法に関する。
【0014】
本明細書で用いる場合、用語「機能的誘導体」とは、本発明のモノクローナル抗体により認識される能力をまだ保持しているE2糖タンパク質のフラグメント、例えばE2エクトドメインのことをいう。用語「エピトープ」とは、特異的抗体分子、例えば本発明のモノクローナル抗体が結合する抗原、例えばE2糖タンパク質上の部位のことをいう。本明細書で用いる場合、用語「サンプル」は、個体から得られ、本発明に従って診断又は検出アッセイに用いることができる多様な種類のサンプルのことをいう。定義は、血液及び生物学的起源のその他の液体サンプル、生検材料又は組織培養若しくはそれに由来する細胞及びその継代物(progeny)のような固体組織サンプルを含む。
【0015】
認識されるように、抗CHIKモノクローナル抗体の組み合わせを用いる場合、1つ目のモノクローナル抗体が8A4のように捕捉抗体となり、2つ目のモノクローナル抗体が3E4のように検出抗体となり得る。このような捕捉抗体及び検出抗体は、例えば、ELISAアッセイにおいて有利に用いられるだろう。
【0016】
本発明は、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出するため、より具体的には、サンプル中のチクングンヤウイルス(CHIK) E2ポリペプチドの存在又は非存在を検出するためのキットにも関する。キットは、CNCM (Collection Nationale de Cultures de Microorganismes)、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択される少なくとも1種のモノクローナル抗体を含む。本発明のこの実施形態によるキットは、それぞれの診断試験を行うために必要な1種以上の上記のモノクローナル抗体(典型的には濃縮された形態で)をそれぞれが含有するパッケージを含み得る。
【実施例】
【0017】
チクングンヤエンベロープE2糖タンパク質と反応性を有するマウスモノクローナル抗体の作製及び特徴決定
チクングンヤ熱は、アジア及びアフリカにおいて公衆衛生において大きい影響を有するアルボウイルス症である。チクングンヤ(CHIK)ウイルスは、アルファウイルス属のメンバーであり、セムリキ森林(SF)抗原群に属する。本発明者らは、CHIKエンベロープE2糖タンパク質と反応性を有するモノクローナル抗体(MAb)のパネルについて、初めて記載している。E2特異的MAbのスクリーニングのために、本発明者らは、組換え可溶性CHIK E2タンパク質を、ショウジョウバエ属(Drosophila) S2細胞において発現させた。免疫学的方法により分析して、MAb 3C3、3E4及び8A4をその反応性に基づいて選択した。エピトープは、CHIKビリオンの外表面に存在する。これらのMAbは、イグボ-オラウイルスの著しい例外を有して、SF抗原群の関連するメンバーと交差反応性を有さない。抗CHIK E2 MAb 3C3、3E4及び8A4は、CHIKウイルスの生態及び疾患の病因の研究のために役立つ。8A4と3E4の組み合わせは、特異的抗原捕捉ELISAを開発するために適する。
【0018】
材料及び方法
株化細胞及びCHIKウイルス
ベロ細胞は、5%熱失活胎児ウシ血清(FBS)及び2mM L-グルタミンを補ったダルベッコの改変イーグル成長培地(DMEM) (Invitrogen)で成長させた。293A細胞(Quantum)は、10% FBS及び2mM L-グルタミンを補ったピルベート含有DMEM成長培地(Invitrogen)で成長させた。ベロ細胞及び293A細胞は、37℃にてCO2の下でインキュベートした。アエデス・シュードスクテラリス(Aedes pseudoscutellaris) AP61蚊細胞は、10% FBS及び1%トリプトース-ホスフェートブロス(Eurobio)を補ったLeibovitz L-15成長培地で成長させた。キイロショウジョウバエ(Drosophila melanogaster) シュナイダー2 (S2)株化細胞は、Invitrogenから購入した。S2細胞を、10% FBSを含むシュナイダーの成長培地(Invitrogen)で成長させた。無脊椎AP61及びS2細胞は、27℃でインキュベートした。全ての培地は、ペニシリン及びストレプトマイシン抗生物質を補った。
【0019】
CHIK.06-49ウイルス(ジェノタイプ4)は、レユニオン島でのチクングンヤ熱の2006年の発生の間に若い成人から単離された(Schuffeneckerら, 2006)。このウイルスは、蚊の株化細胞で2代継代された。ウイルスストックを、標準化したAP61細胞フォーカスイムノアッセイ(FIA)により、抗CHIK HMAFを用いて力価決定し、力価をFFU.mL-1として表した(Schuffeneckerら, 2006)。高濃度の精製CHIK.06-49を、感染蚊細胞から得た。簡単に、AP61細胞単層のフラスコ20本に、CHIKウイルスを、細胞あたり0.4 FFUの感染多重度(MOI)で接種した。感染細胞の上清流体を感染後2日で採集し、浄化した(clarify)。ウイルスは、0.5 M NaCl中の10% (wt:vol)のポリエチレングリコール(PEG) 8,000 (Fluka)を4℃にて4時間用いて沈殿させた。遠心分離の後に、ペレットをTNEバッファー(20 mM Tris-Cl [pH 8.0]、150 mM NaCl、2 mM EDTA)に再懸濁し、60% (wt:wt)及び30% (wt:vol)のスクロースで構成される不連続スクロース勾配上で、39,000 rpmにて、4℃で2時間遠心分離した。界面に見えるバンドを採集し、TNEバッファーで希釈した。ウイルスは、連続11〜52% (w/v)スクロース勾配上で、35,000 rpmにて、4℃で18時間さらに精製した。見られるバンドを採集し、一定量に分け、-80℃で貯蔵した。
【0020】
CHIK抗原の生成
高濃度のCHIK抗原を、ウイルス粒子から作製した。40本のフラスコのAP61細胞単層に、CHIK.06-49ウイルスを0.4 MOIで接種した。感染細胞の上清流体を感染の2日後に採集し、浄化した。ウイルス粒子を、PEG 8,000を用いて0.5 M NaClの存在下で上記のようにして沈殿させた。TNEバッファーに再懸濁したペレットに、20 mMトリエタノールアミン(Sigma)を補充し、2% Triton X-100 (Sigma)とともに氷上で10分間インキュベートした。懸濁物を1分間、2,000 rpmにて遠心分離し、浄化した調製物を10〜30%の連続スクロース勾配に供し、35,000 rpmにて16時間、4℃にて遠心分離した。画分を頂部から回収し、SDS-PAGEでのクーマシーブルー染色及びイムノブロッティングにより評価した。CHIK抗原を含有するプールした画分(ウイルス調製物)は、UVにより不活性化し、残存感染性をFIAにより確認した。
【0021】
抗体生成ハイブリドーマクローンの作製
3μgのウイルス調製物を、等しい比のフロイントの完全アジュバント(Sigma)と乳化した。4匹の11週齢BALB/cマウス(Charles River)を、皮下注射により免疫化した。2回のブースター注射を、同じ用量で3週間間隔で投与した。マウスから、それぞれのブースター注射の10日後に採血した。融合前ブースター注射を、融合の4日前に投与した(同じ用量を4回の注射に分けた。2回の皮下注射、次いで2回の腹腔内注射)。
Sp2/0Ag14骨髄腫株化細胞を、標準的なプロトコルに従って免疫化マウスからの脾細胞と融合した。抗体生成ハイブリドーマを、2回サブクローニングし、液体窒素中で凍結させた。モノクローナル抗体を、インビトロにて、高濃縮上清を回収することにより作製した。精製は、n-プロテインAセファロース(GE Healthcare)での親和性クロマトグラフィーにより行った。MAbのアイソタイプを、マウスmAbアイソタイピングテストキット(AbD Serotec)を製造業者の推奨に従って用いて調べた。
【0022】
組換え可溶性CHIK sE2タンパク質の構築及び発現
E2のステム領域(残基E2-4〜E2-364)の後にエクトドメインをコードするCHIK.06-49配列(Genbank受理番号AM258994)を、CHIK.06-49 pE2遺伝子を含有するTOPOプラスミドから、フォワードプライマー5'AAAAAAGATCTGACAACTTCAATGTCTATAAAGCCACAAGACC-3' (配列番号4)及びリバースプライマー5' TTTTTGCGGCCGCGTCATAGTGGGGTACAGCTCATAATAATACAG-3' (配列番号5)を用いるPCRを用いて増幅した。PCR生成物を、Bgl II及びNot Iで消化し、pMT/Bip/V5-HisAプラスミド(Invitrogen)のユニークBgl II及びNot I部位に挿入して、pMT/BiP/CHIK.sE2を作製した。CHIK sE2配列を、組換えタンパク質を分泌経路に指向させるBiP配列とインフレームに配置した。発現ベクターにおいて、CHIK sE2配列のC-末端にて、V5エピトープとニッケルキレート親和性クロマトグラフィーを用いる親和性精製のための6ヒスチジンとが続く。ショウジョウバエ属S2細胞(Invitrogen)を、組換えプラスミドpMT/BiP/CHIK.sE2で、リン酸カルシウムトランスフェクションキット(Invitrogen)を用いてトランスフェクションさせた。安定にトランスフェクションされた細胞を、25μg/mlのブラスチシジンを数週間にわたって加えることにより選択した。CHIK.sE2タンパク質を発現する培養S2細胞を、10μg/mlのブラスチシジンを含有する無血清成長培地に順応させた。CuSO4を、500μMの最終濃度で加えて、組換え可溶性CHIK.E2タンパク質の合成及び分泌を誘発した。培養培地中でのCHIK.sE2の蓄積は、CuSO4の添加の10日後に最大であった。細胞培養上清を、0.2μMのフィルタに通した。タンパク質サンプルを、10,000-MWCo Vivaspinカラム(Vivasciences)を通して濃縮し、次いでPBS中で透析した。或いは、組換えCHIK.sE2タンパク質を、細胞培養上清から、平衡化したキレートカラムクロマトグラフィー(HiTrap Chelating HP, Amersham)で精製した。カラムを、洗浄バッファー(0.5 M NaCl、50 mMリン酸ナトリウムバッファー、[pH 8.0])を用いて数回洗浄し、結合したCHIK.sE2を漸増濃度のイミダゾールを用いて溶出した。CHIK.sE2タンパク質を含有する画分をプールし、PBS中で透析した。DEN-1の可溶性の形であるE糖タンパク質(DEN-1 sE)も、ショウジョウバエ属S2細胞で作製した。
【0023】
動態順位付けアッセイ
動態順位付けアッセイは、ProteOn XPR 36装置(Bio-Rad)で行い、データ分析は、ProteOn Managerソフトウェア(Bio-Rad)を用いて行った。抗マウスIgG (Sigma)を、GLMセンサチップ(Bio-Rad)上に、標準的なアミンカップリング化学を用いて固定化した。流出バッファーTPBS (PBS中の0.005% Tween-20)を、実験全体を通して25℃にて連続的に用いた。簡単に、0.2 mLの0.2 M EDC及び0.05 M スルホ-NHS混液を、0.030 mL.分-1の流速にて、続いて10 mM Na-酢酸バッファー、pH 4.5中で希釈した抗マウスIgG 0.2 mLを0.075 mg.mL-1にて注入した。次いで、表面を、0.15 mLの1 MエタノールアミンpH 8.5を用いて不活性化した。1 mg.mL-1のアルジネートを補ったTPBS中で1:2に希釈したハイブリドーマ上清を、0.2 mL下で0.025 mL.min-1の流速にて、続いて、0.2 mLの漸増濃度の組換え可溶性CHIK.sE2タンパク質を注入した。
【0024】
間接ELISA
間接ELISAのために、Maxisorpプレート(Nalgen Nunc)を、D-PBS (Invitrogen)で希釈した105 FFUのスクロース精製CHIKビリオン、50 ngの免疫化に用いたCHIK抗原又は50 ngの組換え可溶性CHIK.sE2タンパク質で被覆し、4℃にて一晩インキュベートした。非特異的タンパク質結合部位は、PBS中の3%ミルクを用いて、1時間、37℃にてブロックした。プレートを、0.1% Tween-20を含有するPBS (PBST)で洗浄した。PBSTで系列希釈した免疫化マウスからの血清、ミルク0.1%及び同じバッファーで希釈した細胞培養上清1:2を加え、被覆されたプレート中で37℃にて2時間インキュベートした。PBSTで洗浄した後に、1%ミルクを含有する1:5,000希釈ペルオキシダーゼコンジュゲートAffiniPureヤギ抗マウスIgG (H+L) (Jackson ImmunoResearch)を1時間、37℃にて加えた。洗浄の後に、3,3',5,5'-テトラメチルベンジジン塩基性基質(TMB, KPL)を加えた。色の反応を、0.1 mLの1M H3PO4をそれぞれのウェルに用いて停止し、プレートを、450 nmにて、OpsysMR ELISAリーダー(Dinex Technologies)中で分析した。
【0025】
抗原捕捉ELISA
検出MAbを調製するために、以前に記載されたようにして(Nakane及びKawaoi,1974)、精製MAbを、ペルオキシドオキシドレダクターゼ(POD)で、抗体のアミン基に標識した。抗原捕捉のための精製MAbを、Maxisorpプレート(Nalgen Nunc)に、 0.1 mLカーボネートバッファー[pH 9.2]中の2μg.mL-1抗体を室温にて一晩インキュベートすることにより固定化した。次いで、ウェルをTPBSで2回洗浄し、3%スキムミルクを補ったPBS中の8% (wt/vol.)スクロースを用いて37℃にて1時間ブロッキングした。ブロッキング剤を除去した後に、プレートを10分間、50℃にて乾燥させ、ウェルを乾燥させて使用時まで4℃にて貯蔵した。1%スキムミルク含有PBSTで希釈したウイルス培養上清又は組換え可溶性CHIK.sE2タンパク質をウェルに加え(0.1 mL/ウェル)、1時間、37℃にてインキュベートした。数回の洗浄の後に、ウェルを1時間、37℃にて、ウェルあたり1μg.mL-1の1%スキムミルク含有PBST中のPODコンジュゲートMAb (0.1 mL/ウェル)とインキュベートした。洗浄の後に、TMB基質を加え、プレートを、暗所で8分間さらにインキュベートした。酵素活性を、上記のようにして測定した。
【0026】
イムノブロット分析
Laemmliサンプルバッファーと室温にて混合したタンパク質サンプルを、4〜12% SDS-PAGE (NuPage, Invitrogen)に載せた。サンプルを、PVDFメンブレン(invitrogen)にエレクトロトランスファーし、PBST中の5%ミルクでブロックした。メンブレンを、1次抗体でプローブし、結合した抗体を、1:10,000希釈のPOD-コンジュゲート2次抗体、次いで、ECL基質溶液(Amersham)により検出した。
【0027】
IFアッセイ及びフローサイトメトリー分析
間接免疫蛍光(IF)アッセイのために、Permanox Labtekチャンバ(Nunc)上で成長した細胞を、PBS中の3.2%パラホルムアルデヒド(PFA)で20分間固定し、次いで、PBS中の50 mM NH4Clと10分間インキュベートした。細胞を、PBS中の0.1% Triton X-100を4分間用いて透過にするか又は透過にせず、次いで、PBS/0.2%ゼラチン中の1次抗体と、37℃にて30分間インキュベートした。PBSを用いて充分に洗浄した後に、細胞を、PBS/0.2%ゼラチン中で1:100希釈のフルオレセインコンジュゲートヤギ抗マウスIgG (Pierce)と、37℃にて30分間、さらにインキュベートした。サンプルを、蛍光顕微鏡により観察した。
【0028】
フローサイトメトリーフラックスのために、細胞をはがし、PBS中の3.2% PFAで固定した。固定された細胞を、染色バッファーSB (1% FBS中の0.1% [w/v)アジ化ナトリウム; pH 7.5)で充分に洗浄し、SB又は透過バッファーPB (1% [wt./vol.]サポニンを補ったSBバッファー)で希釈した1次抗体と37℃にて90分間インキュベートした。充分に洗浄した後に、細胞を、SB又はPBで1:100希釈したフルオレセインコンジュゲート2次抗体(Pierce)と、37℃にて1時間インキュベートした。充分に洗浄した後に、細胞を、CellQuest Proソフトウェア(BD Biosciences)を備えたFACSCalibur (Becton Dickinson)を用いるフローサイトメトリーにより分析した。
【0029】
結果
CHIK E2抗原の作製
ウイルス抗原を作製するために、CHIKビリオンを、CHIKウイルスのレユニオン島株06-49 (CHIK.06-49)に感染させた蚊細胞の上清から沈殿させた。高濃度のウイルス粒子を、2% Triton X-100とインキュベートし、ウイルス懸濁物をスクロース勾配に供した。遠心分離の後に、画分をイムノブロット分析により評価した。抗CHIK抗体はpE2、C及びより低い程度で約15〜20%のスクロース濃度でのE2を検出した。pE2、E2及びCに富む画分をプールし、BSL-2実験室内でマウス免疫化を行うためにU.V.で処理した。SDS-PAGEのクーマシーブルー染色及びイムノブロッティングにより評価されるように(図1)、ウイルス抗原の分離の後に観察された主要なバンドは、pE2に相当した。ウイルス調製物の抗原性は、抗CHIK高度免疫マウス腹水(HMAF)を用いる間接ELISAにより確認した(データ示さず)。陰性対照として、デング(DEN)又は西ナイルウイルスに対して指向されたマウス免疫血清は反応性を示さなかった。
【0030】
ショウジョウバエ属S2細胞で生成されたアルボウイルス抗原は、それらの蚊の天然対応物と類似し得るので、我々は、ショウジョウバエ属発現系(Invitrogen)を用いてCHIK E2糖タンパク質を発現させた。エクトドメインとその後にCHIK.06-49ウイルスからのE2のステム(以下、CHIK.sE2という)とを発現する安定的にトランスフェクションされたS2株化細胞を確立した。培養培地へのCuSO4の添加は、組換え可溶性CHIK.sE2タンパク質の合成及び分泌を誘発した。培養培地中でのCHIK.sE2の蓄積は、誘発の2週間後に最大であった。間接ELISAのために、分泌されたCHIK.sE2タンパク質を上清から直接濃縮し、ELISAプレートの被覆に用いた。イムノブロット分析及び抗原捕捉ELISAのために、組換え可溶性CHIK.sE2タンパク質を、細胞培養培地から、ニッケルキレート親和性クロマトグラフィーを用いて精製した。
【0031】
イムノブロット分析は、組換え可溶性CHIK.sE2タンパク質(42 kDaの見かけの分子量)が、抗CHIK HMAF及びCHIK陽性患者の血清により認識されたことを示す(図2)。同様の結果が、間接ELISAを用いて観察された(データ示さず)。これらの結果は、S2細胞から分泌された組換え可溶性CHIK.sE2タンパク質が、CHIK E2糖タンパク質の天然の形により近い高次構造を有することを示唆する。
【0032】
CHIK E2タンパク質に指向されたMAbの作製
2回の成功した融合を、「材料及び方法」のセクションに記載したようなウイルス調製物を用いて免疫化したBALB/cマウスからの脾臓細胞を用いて行った。抗体生成ハイブリドーマクローンのスクリーニングのために、ウイルス調製物及び組換え可溶性CHIK.sE2タンパク質を、間接ELISAにおいてCHIK抗原として用いた。およそ60の抗体生成ハイブリドーマクローンが、胎児ウシ血清(FBS)のバックグラウンドレベル反応性より少なくとも4倍高い抗体結合性を有するとして同定された。60個のハイブリドーマクローンのうち12個が、スクロース精製CHIKビリオン及び組換え可溶性CHIK.sE2と、間接ELISAにより反応できた(データ示さず)。IFアッセイによりスクリーニングすると、5個の抗体生成ハイブリドーマクローン(3C3、3E4、5A8、6F2及び8A4)が、CHIKウイルス感染細胞に対して強い陽性反応を示した(データ示さず)。ProteOnバイオセンサ分析は、5個のクローンが、高い見かけの結合親和性でCHIK.sE2を認識したことを示した(図3)。5個の抗体生成ハイブリドーマクローンのうち3個(3C3、3E4及び8A4)が、組換え可溶性CHIK.sE2タンパク質の迅速な会合及び遅い解離を示した(データ示さず)。これらの結果により、抗体生成ハイブリドーマクローン3C3、3E4及び8A4をサブクローニングし、次いで増殖させた。その後の実験を、ハイブリドーマクローン上清からの精製抗CHIK.E2 MAbを用いて行った。
MAb 3C3、3E4及び8A4の特徴を、表1にまとめる。
【0033】
【表1】

【0034】
3個の抗CHIK.E2 MAbは、サブクラスIgG1,κのものであった。フォーカス低減中和試験(Focus reduction neutralization tests; FRNT)を用いて、精製抗CHIK.E2 MAbが培養ベロ細胞においてCHIKウイルス複製を阻害する能力について評価した。終点力価は、AP61細胞上のおよそ100フォーカス形成単位(FFU)のCHIK.06-49ウイルスを少なくとも90%低減させる、試験した最高の抗体希釈として算出した(FRNT90)。抗CHIK HMAFは、平均で希釈1:2,500のFRNT90を与えたが、MAb 3C3、MAb 3E4及びMAb 8A4はいずれも、10μg.mL-1ほどの高い濃度にてCHIKウイルスを中和しなかった(データ示さず)。
【0035】
CHIK E2糖タンパク質の天然型との抗CHIK.E2 MAbの反応性
間接ELISA試験をCHIKウイルスに対して行って、選択された抗CHIK.E2 MAbがビリオンの表面を認識するかを評価した。この目的において、スクロース精製CHIK.06-49ウイルスを用いて、ELISAプレートをウェルあたり105 FFUにて被覆し、漸増濃度のMAbを加えた。MAb 3C3、3E4及び8A4は間接ELISAにおいて天然ウイルス粒子と反応し(図4)、このことは、それらのエピトープがCHIKウイルスの外表面上に曝されていることを示唆する。洗剤条件下での3つの抗CHIK.E2 MAbの結合能力を分析するために、CHIKウイルスを、2% Triton X-100とインキュベートし、ELISAプレートを被覆した。MAb 8A4のみが、変性条件下でCHIKウイルスとの著しい反応性を示し(データ示さず)、このことは、MAb 8A4が非イオン界面活性剤の存在下でCHIK E2糖タンパク質を認識できることを示す。
【0036】
間接ELISAにおいて、用量曲線応答は、MAb 8A4及び3E4が、MAb 3C3が結合するよりもCHIKによりよく結合したことを示した(図4)。この抗原検出試験により推定されるように、MAb 3C3の反応性は、MAb 8A4及び3E4と比較して10倍より低かった。抗CHIK E2 MAbの対がサンドイッチアッセイに有用であり得るかを評価するために、相補性研究を、組換え可溶性CHIK.sE2タンパク質に対して、ProteOnバイオセンサ分析により行った。MAb 3C3及び3E4は、MAb 8A4と結合したCHIK.sE2と著しい反応性を示し、最良の結果は、MAb 3E4を検出抗体として用いたときに得られた(データ示さず)。つまり、抗CHIK.E2 MAb 8A4 (捕捉抗体)と3E4 (検出抗体)との組み合わせが、抗原捕捉ELISAの開発に適する。
【0037】
MAbがCHIK E2糖タンパク質に結合する能力を、IFアッセイ(図5A)及びフローサイトメトリー分析(図5B)によりさらに調べた。抗CHIK HMAFを、陽性対照として用いた。IFアッセイにおいて、MAb 3C3、3E4及び8A4は、CHIKウイルス感染ベロ細胞内で内生的に合成されたE2タンパク質と強く反応した(図5A)。陰性対照として、抗DEN E MAb 4E11は反応性を示さなかった(データ示さず)。3個の抗CHIK.E2 MAbは全て、PMに輸送されたCHIK E2糖タンパク質を認識し(図5A、- TX-100)、このことは、それらのエピトープがE2の外面上でアクセスされ得ることを示唆する。フローサイトメトリー分析により、MAb 3C3及び3E4は、サポニンで透過にしたか又はしていないCHIKウイルス感染ベロ細胞に対して類似の蛍光強度の平均値を示した(図5B)。つまり、抗CHIK.E2 MAbはともに、新しく合成されたE2分子とPM-関連E2とを同様に認識できる。
【0038】
フローサイトメトリー分析により、抗CHIK.E2 MAb 8A4の反応性が、MAb 3C3及び3E4とは異なることが明らかになった。実際に、MAb 8A4は、サポニンの存在下ではCHIKウイルス感染細胞とのより弱い反応性を示した(図5B)。MAb 8A4はPM-関連E2を優先的に標的にするので、そのエピトープは、E2の天然型の外面上に主に曝されているようである。
【0039】
抗CHIK.E2 MAbのイムノブロット反応性
イムノブロッティングを、抗CHIK.E2 MAbが線状エピトープと結合したかを決定するために、スクロース精製CHIKビリオン及び組換え可溶性CHIK.sE2タンパク質を用いて行った(図6)。陽性対照として、抗CHIK HMAFは、CHIKウイルス-関連E2及びCHIK.sE2をプローブした。本発明者らは、MAb 3C3及び3E4が還元条件下でE2と反応できたことを観察した。これらのMAbが線状ペプチドエピトープを認識するかを決定するために、CHIK.sE2のアミノ酸配列全体をカバーするオーバーラップ15マー固定化ペプチドのアレイを、SPOT技術により調製した。線状合成ペプチドは、2つの抗CHIK.E2 MAbについてのエピトープを形成できなかった(データ示さず)。これらの結果は、MAb 3C3及び3E4が部分線状のエピトープを認識したことを示唆する。
【0040】
抗CHIK.E2 MAb 8A4は、イムノブロット分析においてCHIKウイルス-関連E2タンパク質と反応できず(図6)、このことは、このMAbが高次構造エピトープを認識できたことを示唆する。MAb 8A4は、MAb 3C3及び3E4と比較して、還元条件下でCHIK.sE2とより弱く反応するが、これは、約100及び150 kDaの推定分子量の2つのさらなるタンパク質バンドと反応性を示した(図6、MAb 8A4、レーン1)。このような知見は、MAb 8A4が可溶性E2の二量体及び三量体の形態を検出する能力を有することを示唆する。
【0041】
抗CHIK.E2 MAbの、旧世界のアルファウイルスとの交差反応性
IFアッセイを、感染蚊細胞に対して行って、3個の抗CHIK.E2 MAbが、SINウイルス及びSF、イグボ-オラ、ONN、ババンキ(Babanki)、ジンジラモ(Zingilamo)、ミデルブルグ(Middelburg)、ヌドゥム(Ndumu)及びArv9/71の各ウイルスのような旧世界で単離されたSF血清型群の関連するメンバーを認識するかを評価した。表2に、MAbの交差反応性をまとめる:抗CHIK HMAFは、CHIK S27株、イグボ-オラIBH10964株、ONN Gulu (ONN-59)株、ジンジラモAnB1245d株及びSF IPD/A株と強い反応性を示し、SIN Ar399株と中程度の反応性を示し、ババンキArY251株と弱い反応性を示し、ミデルブルグSAAr749株、ヌドゥムSAAr2204株及びArv9/71ウイルスと交差反応性を示さなかった。蛍光抗体試験における抗CHIK.E2 MAbの反応性は、抗CHIK HMAFのものとは異なっていた。IFアッセイの結果により示されるように、MAb 3C3、3E4及び8A4は、CHIKウイルスと反応し、より低い程度でイグボ-オラウイルスと反応した(表2)。IFアッセイにおいて、MAb 8A4は、CHIKウイルス又はイグボ-オラウイルスに感染した蚊細胞に対して同様の反応性を示した。
【0042】
【表2】

【0043】
CHIK.06-49ウイルス、ONN-59ウイルス(Genbank受理番号M20303)、及びイグボ-オラIBH 10964株(Genbank受理番号AF079457)についてのエクトドメイン及びE2のステム領域(E2-1〜E2-364)のアミノ酸配列のアラインメントを図7に示す。263位及び345位の2つの同定されたN-結合グリコシル化部位は、CHIK、ONN及びイグボ-オラウイルスで保存されている。E2の最初の365残基の遺伝子分析は、イグボ-オラウイルス株とONNウイルス株との間に5アミノ酸ほど少ない違いを示した(98.5%同一性) (図7)。CHIKウイルスとSF抗原群の2つの他の関連するメンバーとの間には、45アミノ酸の違い(87.5%同一性)がある。E2配列の比較分析は、ONN-59がCHIK.06-49及びイグボ-オラ IBH 10964ウイルスとはE2-130位、E2-164位及びE2-288位が異なることを示した(図7、オープンフレーム)。興味深いことに、置換Thr164Alaは、CHIK及びイグボ-オラウイルス内の厳密に保存された領域E2 160〜177に位置づけられる。このプロリンリッチ領域は、アルファビリオンのE2スパイクの表面上に曝露されているのだろう(Mukhopadhyayら, 2006)。
【0044】
抗CHIK E2 MAbに基づく抗原捕捉ELISA
上記で論じたように、抗CHIK.E2 MAb 8A4及び3E4は、サンドイッチELISAにおけるCHIKウイルスの検出に適する。MAb 8A4 (2μg.mL-1)を捕捉抗体としてELISAプレート上で、そしてペルオキシダーゼコンジュゲートMAb 3E4 (1μg.mL-1)を検出抗体として用いた。抗原捕捉ELISAの感度を決定するために、AP61蚊細胞又はヒト293A細胞で成長したCHIK.06-49の系列希釈を用いて、標準曲線を決定した(図8A)。DPBST/1%ミルクを用いて、450 nmでの光学密度0.15での抗原-捕捉についてのベースラインを決定した。つまり、DPBST/1%ミルクで希釈されたCHIKウイルスの検出についてのカットオフ値は0.45に設定され、これは、DPBST/1%ミルクについてのOD450の平均+3標準偏差(S.D.)と等しい。カットオフ閾値に従って、ELISAの検出限界は、およそ106.0 AP61FFUの蚊細胞由来CHIKウイルス及び104.3 FFUのヒト細胞由来CHIKウイルスであった(図8A)。抗原捕捉ELISAは、可溶性の形態のE2 (CHIK.sE2)も検出でき、最小限の検出可能な質量はおよそ5 ngであった(図8B)。抗CHIK.E2 MAbの対は、蚊細胞と比較して、293A細胞において成長したCHIKウイルスとより高いレベルの反応性を有する(図8A)。これは、細胞変性CHIKウイルスに感染したヒト細胞の上清中への個別化されたE2糖タンパク質の放出に関係するのであろう。これらの結果は、MAb 8A4及び3E4を組み合わせて用いて、可溶性CHIK E2タンパク質及びウイルス培養上清中のビリオン-関連E2タンパク質を検出できるであろうことを示す。
【0045】
アフリカでは2つの異なるCHIKウイルスジェノタイプがある(Powers及びLogueによる概説, 2007)。第1のジェノタイプは、西アフリカからのCHIKウイルス単離株を含んでいた。第2のジェノタイプは、東/中央/南アフリカからのCHIKウイルス単離株の群をなしていた。抗CHIK.E2 MAbの対の特異性を決定するために、抗原捕捉ELISA試験を、中央/東アフリカ(中央アフリカ共和国、1978; インド洋、2005〜06)及び西アフリカ(コートジボワール、1999; セネガル1965〜66及び2005)から得られたCHIKウイルスの臨床単離株のパネルに対して行った。蚊細胞で成長したCHIKウイルスの全ての試験したアフリカ株が認識された(データ示さず)。つまり、MAb 8A4と3E4の組み合わせは、西アフリカ及び中央/東アフリカのCHIKウイルスジェノタイプにわたって保存されたE2のエピトープを認識できる。抗CHIK.E2 MAbの組み合わせの特異性をさらに規定するために、抗原捕捉ELISAを、関連するアルファウイルスに対して行った。結果は、間接ELISAのものと同様であった。サンドイッチにしたMAb 8A4及び3E4は、CHIK.06-49株に結合し、より低い程度でイグボ-オラ IBH 10964株にも結合したが、ONN-59株又はアフリカ若しくはアジアで単離されたSF抗原群のその他の関連するメンバーとは交差反応しなかった(データ示さず)。まとめると、これらのデータは、抗CHIK.E2 MAb 8A4及び3E4が、CHIKウイルス、及びより低い程度でイグボ-オラウイルスの検出のためのサンドイッチアッセイの設計に適することを示す。
【0046】
考察
この研究において、2006年にレユニオン島で単離されたCHIKウイルス株06-49を用いて、免疫にされたマウスにおけるCHIK E2糖タンパク質に対するMAbのパネルを作製した。この報告は、新規な組換え可溶性CHIK E2糖タンパク質についても記載する。本発明者らは、CHIK.06-49 E2エクトドメイン及びその後のそのステム領域に相当するCHIK.sE2を、ショウジョウバエ属S2細胞で発現させた。この発現系において、CHIK.sE2は、誘発された安定なS2細胞クローンの上清に蓄積した。間接ELISA及びイムノブロットアッセイは、CHIK.sE2が、CHIKウイルスに対する特異的抗体により認識されたことを示した。本発明者らは、高度に精製されたCHIK.sE2抗原を生成する精製手順を開発できた。S2細胞培養上清からの精製CHIK.sE2タンパク質は、間接ELISA及びイムノブロット分析において、CHIKウイルスに特異的な抗体の容易な検出のために適切である。
【0047】
本発明者らは、3個の抗CHIK E2 MAb (3C3、3E4及び8A4)が、CHIKウイルス-関連E2糖タンパク質と、間接ELISAにおいて著しい反応性を有することを示した。MAb 3C3、3E4及び8A4は、インタクトなCHIKビリオンの状況においてE2と反応するので、これらのエピトープは、おそらく、ウイルス表面に存在するだろう。しかし、3個のMAbは全て、インビトロにて霊長類のCHIKウイルス感染を中和できなかった。抗CHIK.E2 MAbのウイルス全体への結合は、宿主細胞とのウイルスの相互作用を阻害しなかったので、それらのエピトープは、CHIK E2糖タンパク質の主要な中和ドメインに位置付けられていないようである。
【0048】
イムノブロッティング分析の結果は、MAb 3C3及び3E4が、CHIKウイルス-関連E2及び組換え可溶性CHIK E2糖タンパク質と、還元条件下で著しい反応性を有することを示す。免疫蛍光研究は、2個の抗CHIK E2 MAbが、新しく合成されたE2及びPM-関連E2を、感染霊長類細胞においてうまく検出できることを示した。CHIK抗原とのそれらの反応性に基づいて、MAb 3C3及び3E4により認識されるエピトープは、E2の外面上で最も少なく部分的に線状であると考えられる。MAb 3C3及び3E4と反応できる可溶性CHIK.sE2タンパク質は、エピトープマッピング分析に有用であり得る。競合結合実験についてのCHIK.sE2に由来するサブフラグメントの評価が計画される。ファージディスプレイランダムペプチドライブラリーも、抗CHIK.E2 MAbのエピトープの同定に用いることができそうである(Davisら, 2000)。イムノブロット分析において、MAb 8A4は、CHIKビリオン-関連E2を認識できず、還元条件下で、MAb 3C3又は3E4と比較して、CHIK.sE2とのより低い反応性を示した。フローサイトメトリー分析の結果は、MAb 8A4が、CHIKウイルス感染細胞において、PM-関連E2を主に標的にすることを示した。イムノブロット分析の結果は、MAb 8A4が、可溶化E2タンパク質のホモオリゴマー形態を認識できたことを示した。CHIK E2糖タンパク質の原子構造はまだ決定されていないが、MAb 8A4により認識されるエピトープは、E2の天然型の外面において高次構造を有するようである。
【0049】
3個の抗CHIK.E2 MAbは、IFアッセイにより決定されるように、イグボ-オラウイルスと交差反応性を示したが、ONN-59株とは示さなかった。CHIK、ONN及びイグボ-オラウイルスは、血清学的に、SF抗原群に分類される(Strauss及びStraussによる概説, 1994)。ONNウイルスは、1959年のウガンダのヒトサンプルから単離され(Haddowら, 1960)、イグボ-オラウイルスは、1966年にナイジェリアのヒトから単離された(Olaleyeら, 1988, 1990)。イグボ-オラウイルスがONNの株であることが最近提唱されている(Lanciottiら, 1998; Powersら, 2000)。
【0050】
E2アミノ酸レベルでのパーセント配列同一性の値は、イグボ-オラBH10964株が、2006年にレユニオン島で単離されたCHIK.06-49株よりもONN-59株により近接に関連することを示した(図7)。E2残基Thr164が1959年に単離されたONNウイルス株GuluにおいてAlaに変異されていることに鑑みて、CHIK及びイグボ-オラウイルスでの厳密な保存領域E2 160-177 (図7)は、これらの抗CHIK.E2 MAbの抗原性ドメインの部分を形成しているはずである。実際に、この領域の残基は、アルファビリオンの表面を覆うE1-E2へテロ二量体のE2スパイクの先端に参加している(Mukhopadhyayら, 2006)。1995年に単離されたONN株SG650 (ONN-95)は、E2-164位にスレオニン残基を有するので(Lanciottiら, 1998)、ONN-95を用いるさらなる研究は、抗CHIK.E2 MAbの結合における領域E2 160-177の役割についての洞察を提供できる可能性がある。
【0051】
ウイルス培養上清中のウイルス粒子の高い力価の存在、並びにビリオン外表面上及び細胞膜のE2の存在は、CHIKウイルス感染の検出が、ウイルス抗原に基づくべきであることを示唆する。モノクローナル抗体8A4は、天然CHIKビリオン及びCHIK E2糖タンパク質の可溶性の形態の検出に利用可能である。抗原捕捉ELISAにおいて、MAb 8A4 (捕捉抗体)とMAb 3E4 (検出抗体)との対は、少なくとも104.5 FFUの、ヒト細胞で成長したCHIKウイルスを検出できた。この試験の検出限界は、約5 ngの可溶性E2分子であった。抗CHIK E2 MAbの対は、CHIKウイルスの中央/東アフリカ株及び西アフリカ株について交差反応性を有し、イグボ-オラウイルスの顕著な例外があるが、SF群の関連するメンバーとの交差反応性はない。
【0052】
結論として、本発明者らは、CHIK E2糖タンパク質に対して反応性がある3つのMAb 3C3、3E4及び8A4を作製して、特徴決定した。このようなMAbは、CHIKウイルスの生態及びチクングンヤ熱の病因を研究するために有用である(Borgheriniら, 2007; Ozdenら, 2007; Sourisseauら, 2007)。3個の抗CHIK E2 MAbは、CHIKウイルス感染の診断に有用であり、診断法は、イムノブロット及び免疫蛍光アッセイを含み得る(Powers及びLogueによる概説, 2007)。今回のデータは、MAb 8A4及び3E4を組み合わせて用いて、CHIKウイルス全体及び可溶性CHIK E2糖タンパク質を抗原検出ELISAにおいて認識することを示した。血液及び組織における感染性ウイルスの力価は、チクングンヤ熱の早期の診断を導くために充分高いので(Santhoshら, 2007)、抗CHIK E2 MAb 8A4 (捕捉抗体)及び3E4 (検出抗体)の組み合わせが、特異的かつ感度が高い抗原検出系を開発するために適切であることは明らかである。
【0053】
【表3】

【0054】
【表4】

【0055】
【表5】

【受託番号】
【0056】
CNCM I-3822
CNCM I-3824
CNCM I-3823
【特許請求の範囲】
【請求項1】
a) サンプルを、抗チクングンヤウイルス(CHIK)モノクローナル抗体又は抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出する方法。
【請求項2】
a) サンプルを、抗チクングンヤ(CHIK) E2モノクローナル抗体又は抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤ(CHIK) E2ポリペプチドからのエンベロープE2ポリペプチド若しくは機能的誘導体又はその前駆体E3E2 (p62)の存在又は非存在を検出する方法。
【請求項3】
前記抗CHIK抗体が、前記CHIKウイルスの外表面上にあるエピトープと特異的に結合する抗CHIKモノクローナル抗体である請求項1又は2に記載の方法。
【請求項4】
前記抗CHIK抗体が、CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託されたモノクローナル抗体の群から選択される請求項1〜3のいずれか1項に記載の方法。
【請求項5】
抗CHIKモノクローナル抗体の前記組み合わせが、捕捉モノクローナル抗体と検出モノクローナル抗体とからなる請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記捕捉モノクローナル抗体が8A4からなる請求項5に記載の方法。
【請求項7】
前記検出モノクローナル抗体が3E4からなる請求項5に記載の方法。
【請求項8】
CHIKウイルスの外表面上にあるエピトープに特異的に結合するモノクローナル抗体。
【請求項9】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択される請求項8に記載のモノクローナル抗体。
【請求項10】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択される、CHIKウイルスに特異的に結合するモノクローナル抗体。
【請求項11】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択されるモノクローナル抗体を含む、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出するためのキット。
【請求項12】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択されるモノクローナル抗体を含む、サンプル中のチクングンヤウイルス(CHIK) E2ポリペプチドの存在又は非存在を検出するためのキット。
【請求項13】
請求項8〜10のいずれか1項で定義されるモノクローナル抗体、又はその組み合わせの、CHIKウイルスによる感染の診断試薬及び/又はCHIKウイルスによる感染のスクリーニングのための使用。
【請求項14】
CHIKウイルスによる前記感染が無症状である請求項13に記載の使用。
【請求項1】
a) サンプルを、抗チクングンヤウイルス(CHIK)モノクローナル抗体又は抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出する方法。
【請求項2】
a) サンプルを、抗チクングンヤ(CHIK) E2モノクローナル抗体又は抗CHIKモノクローナル抗体の組み合わせと接触させて、免疫複合体を形成する工程と、
b) a)で形成された免疫複合体の存在又は非存在を検出する工程と
を含む、サンプル中のチクングンヤ(CHIK) E2ポリペプチドからのエンベロープE2ポリペプチド若しくは機能的誘導体又はその前駆体E3E2 (p62)の存在又は非存在を検出する方法。
【請求項3】
前記抗CHIK抗体が、前記CHIKウイルスの外表面上にあるエピトープと特異的に結合する抗CHIKモノクローナル抗体である請求項1又は2に記載の方法。
【請求項4】
前記抗CHIK抗体が、CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託されたモノクローナル抗体の群から選択される請求項1〜3のいずれか1項に記載の方法。
【請求項5】
抗CHIKモノクローナル抗体の前記組み合わせが、捕捉モノクローナル抗体と検出モノクローナル抗体とからなる請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記捕捉モノクローナル抗体が8A4からなる請求項5に記載の方法。
【請求項7】
前記検出モノクローナル抗体が3E4からなる請求項5に記載の方法。
【請求項8】
CHIKウイルスの外表面上にあるエピトープに特異的に結合するモノクローナル抗体。
【請求項9】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択される請求項8に記載のモノクローナル抗体。
【請求項10】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択される、CHIKウイルスに特異的に結合するモノクローナル抗体。
【請求項11】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択されるモノクローナル抗体を含む、サンプル中のチクングンヤウイルス(CHIK)株の存在又は非存在を検出するためのキット。
【請求項12】
CNCM、75724 パリ セデックス 15、リュ デュ ドクトール ル 28に、2007年9月6日に、受理番号I-3822 (3C3)、I-3824 (3E4)及びI-3823 (8A4)の下で寄託された群から選択されるモノクローナル抗体を含む、サンプル中のチクングンヤウイルス(CHIK) E2ポリペプチドの存在又は非存在を検出するためのキット。
【請求項13】
請求項8〜10のいずれか1項で定義されるモノクローナル抗体、又はその組み合わせの、CHIKウイルスによる感染の診断試薬及び/又はCHIKウイルスによる感染のスクリーニングのための使用。
【請求項14】
CHIKウイルスによる前記感染が無症状である請求項13に記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2010−538291(P2010−538291A)
【公表日】平成22年12月9日(2010.12.9)
【国際特許分類】
【出願番号】特願2010−523609(P2010−523609)
【出願日】平成20年9月4日(2008.9.4)
【国際出願番号】PCT/IB2008/003092
【国際公開番号】WO2009/031045
【国際公開日】平成21年3月12日(2009.3.12)
【出願人】(501474748)インスティティ・パスツール (27)
【氏名又は名称原語表記】INSTITUT PASTEUR
【住所又は居所原語表記】28,rue du Docteur Roux,F−75724 Paris Cedex 15 FRANCE
【Fターム(参考)】
【公表日】平成22年12月9日(2010.12.9)
【国際特許分類】
【出願日】平成20年9月4日(2008.9.4)
【国際出願番号】PCT/IB2008/003092
【国際公開番号】WO2009/031045
【国際公開日】平成21年3月12日(2009.3.12)
【出願人】(501474748)インスティティ・パスツール (27)
【氏名又は名称原語表記】INSTITUT PASTEUR
【住所又は居所原語表記】28,rue du Docteur Roux,F−75724 Paris Cedex 15 FRANCE
【Fターム(参考)】
[ Back to top ]

