抗ヒトアデノシンA2a受容体モノクローナル抗体
【課題】 効率よくアデノシンA2a受容体と反応する抗アデノシンA2a受容体抗体を取得する。また、アデノシンA2a受容体の機能を阻害する、抗アデノシンA2a受容体抗体を取得する。
【解決手段】 A2a受容体の立体構造を認識して結合する抗体を取得した。また、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤を取得した。
【解決手段】 A2a受容体の立体構造を認識して結合する抗体を取得した。また、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤を取得した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アデノシンA2a受容体結合性抗体に関する。
【背景技術】
【0002】
アデノシンA2a受容体(A2a受容体)は、G蛋白質共役受容体(GPCR)に分類される7回膜貫通型の受容体である。ほ乳類の神経節、血管、血小板の細胞膜等に発現し、主に中枢神経系や循環器系において特定の細胞外リガンドを認識して、細胞内へシグナルを伝達する重要な役割を果たす。例えば、リガンドの結合によりGsの結合およびアデニル酸シクラーゼの活性化を促し、細胞内cAMPレベルを上昇させる。
【0003】
また、A2a受容体は大脳基底核中の線条体、側坐核、嗅結節のほか、免疫系細胞、心臓、肺、血管といった多くの部位で機能しており、それに対応して神経変性疾患(パーキンソン病、ハンチントン舞踏病等)、偏頭痛、睡眠障害、呼吸障害、再灌流傷害、血栓、高血圧、心虚血、腎虚血、リューマチ、各種炎症での関連性が報告されている。そのため、新規の治療薬や診断薬を創製するために重要なターゲットといえる。実際に、A2a受容体の拮抗作用を有する低分子化合物において、パーキンソン病のフェーズ3臨床試験が実施されている(非特許文献1)。
【0004】
しかし、A2a受容体を含めてGPCRは一般に細胞内において微小な発現量しか示さず、さらに組織毎に発現特異性があるため、その詳細な機能は未だ明らかになっていない。
【0005】
A2a受容体の発現および細胞内局在の研究に関しては、非特許文献2にA2a受容体のポリクローナル抗体をプローブとして利用して調査したことが記載されている。A2a受容体を含めた抗GPCR抗体作成の戦略としては、非特許文献2および3のように、部分ペプチドを化学合成したものを免疫原とする方法が広く採用されている。このことはGPCRの細胞上での発現量が抗原性を有するほど高くないこと、天然に機能する形態ではその多くが細胞膜に埋没しており抗体の接触可能な領域が少ないことに起因する。また糖鎖、脂質など多くの翻訳後修飾を受けているため、翻訳後修飾の比較的少ないC-末端側ペプチドの利用が好まれることが多く、抗アデノシンA2a受容体抗体(以下、アデノシンA2a受容体結合性抗体と記載することもある)に関しても同様に、現在入手可能な抗体のほとんどすべてがC-末ペプチドを認識する抗体である。
【0006】
C-末ペプチド以外の部分を認識している抗体としては、非特許文献4に培養細胞株で強制発現させたA2a受容体全長タンパクを免疫して得られた、モノクローナル抗体が記載されている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Kanda., Folia Pharmacol. Jpn. Vol. 131 (2008), No.4 275-80
【非特許文献2】Lynge et al., Acta Physiol Scand. 2000 Aug;169(4):283-90.
【非特許文献3】Karoor et al., J Biol Chem. 1998 Dec 4;273(49):33035-41.
【非特許文献4】Rosin et al., J Comp Neurol. 1998 Nov 16;401(2):163-86.
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
非特許文献1には、A2a受容体への拮抗作用を持つ低分子化合物が記載されているが、A2a受容体への拮抗作用を持つ抗体は記載されていない。一般的に低分子化合物はターゲットへの結合特異性において抗体に劣る。また、低分子化合物はヒトや動物に投与したときに副作用をひき起こす恐れがある。一方、抗体はターゲットへの結合特異性に優れており、組換えDNA技術等により適切に設計すれば副作用が少ない。また、低分子化合物と抗体では作用機序が異なるために、それぞれの奏する効果は異なると考えられる。さらに、抗体であれば、診断薬や研究用の試薬等に容易に応用できる。そのため、抗体を用いたA2a受容体への拮抗剤が必要であった。
【0009】
非特許文献2では、抗アデノシンA2a受容体抗体が記載されているが、ペプチドを免疫原とすることから、獲得される抗アデノシンA2a受容体抗体のエピトープは、A2a受容体の一次配列によって規定されるもの(リニアエピトープ)となる。これはA2a受容体の天然構造と変性構造を区別なく認識する性質を有するということであり、必ずしも生体細胞膜に発現するA2a受容体について普遍的かつ効率的に認識できるものではなかった。また、非特許文献4は、A2a受容体全長タンパクを免疫して得られているが、リニアエピトープ性の抗体であり、天然のA2a受容体と効率的に反応できる抗体ではなかった。
【0010】
従って、より効率よくA2a受容体と反応する抗アデノシンA2a受容体抗体を取得する必要があった。効率良く反応する抗アデノシンA2a受容体抗体が得られれば、治療薬、診断薬、研究試薬等の開発コストを抑えることができる。また、抗アデノシンA2a受容体抗体を用いた各種研究の精度が向上し、治療薬等の開発成功率および開発スピードの上昇につながる。加えて、治療薬の開発においては被験者の体力的な負担を軽減できる。
【0011】
さらに、上記文献記載の抗アデノシンA2a受容体抗体においては、A2a受容体の機能阻害活性について何ら記載されていない。A2a受容体は、種々の疾患に関与している蛋白質であるため、A2a受容体の機能を阻害する抗体は、A2a受容体の関与する疾患において極めて優れた治療薬となりうる。このことは、診断薬、研究試薬など他の用途においても同様であり、A2a受容体の機能を阻害する抗体は優れた診断薬、研究試薬となりうる。従って、新規の治療薬等を開発するために、A2a受容体の機能を阻害する抗アデノシンA2a受容体抗体を取得する必要があった。
【0012】
本発明は上記事情に鑑みてなされたものであり、A2a受容体と効率的に反応できる抗アデノシンA2a受容体抗体を提供することを目的とする。また、本発明の別の目的は、アデノシンA2a受容体の機能を阻害する効果を有す抗アデノシンA2a受容体抗体を提供することである。
【課題を解決するための手段】
【0013】
本発明によれば、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤が提供される。
【0014】
このアデノシンA2a受容体機能阻害剤は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体を含む。また、アデノシンA2a受容体の立体構造を認識するアデノシンA2a受容体結合性抗体を含む。そのため、このアデノシンA2a受容体機能阻害剤によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0015】
また、本発明によれば、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬が提供される。
【0016】
この治療薬は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体を含む。アデノシンA2a受容体へのアゴニスト阻害作用は、in vivoで神経変性疾患の疾患モデル動物に治療効果を発揮することが[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]に記載されている。また、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には癌の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。そのため、この治療薬によると、上記疾患の治療効果が得られる。
【0017】
また、本発明によれば、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、診断薬が提供される。
【0018】
この診断薬は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体を含む。ここで、上述の通り、アデノシンA2a受容体へのアゴニスト阻害作用は、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーのモデル動物にin vivoで治療効果があったことが文献に記載されている。そのため、この診断薬を用いて、さらに当該技術分野で公知の診断手法を利用すれば、上記疾患の診断が可能になる
【0019】
本発明によれば、重鎖CDR1が配列番号1のアミノ酸配列を含み、重鎖CDR2が配列番号2のアミノ酸配列を含み、重鎖CDR3が配列番号3のアミノ酸配列を含む抗体が提供される。
【0020】
この抗体は、後述する実施例で、アデノシンA2a受容体の立体構造を認識して結合することが実証されている。また、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されている。そのため、この抗体によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0021】
また、この抗体を含む、アデノシンA2a受容体結合性抗体またはアデノシンA2a受容体機能阻害剤が提供される。または、この抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬もしくは診断薬が提供される。これらは、後述する実施例で、アデノシンA2a受容体への結合すること、または顕著なアゴニスト阻害作用を奏することが実証されている抗体を含む。加えて、上述のとおり、アデノシンA2a受容体へのアゴニスト阻害作用は、上記疾患のモデル動物にin vivoで治療効果があったことが文献に記載されている。そのため、この抗体によると、アデノシンA2a受容体結合性抗体、アデノシンA2a受容体の機能阻害効果、上記疾患の治療効果、または上記疾患の診断効果が得られる。
【0022】
また、この抗体をコードする塩基配列を含む、ポリヌクレオチドが提供される。このポリヌクレオチドは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列含む。また、アデノシンA2a受容体の立体構造を認識するアデノシンA2a受容体結合性抗体をコードする塩基配列含む。そのため、このポリヌクレオチドに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0023】
また、この抗体をコードする塩基配列またはその一部を含む、ベクターが提供される。このベクターは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列、またはその一部を含む。また、アデノシンA2a受容体の立体構造を認識するアデノシンA2a受容体結合性抗体をコードする塩基配列、またはその一部含む。そのため、このベクターに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0024】
なお、重鎖CDR1が、配列番号1において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2が、配列番号2において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3が、配列番号3において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含むアミノ酸配列であっても、当業者であれば当然同様の作用効果が得られることが容易に想定できる。
【0025】
本発明によれば、重鎖CDR1が配列番号7のアミノ酸配列を含み、重鎖CDR2が配列番号8のアミノ酸配列を含み、重鎖CDR3が配列番号9のアミノ酸配列を含む抗体が提供される。
【0026】
この抗体は、後述する実施例で、アデノシンA2a受容体の立体構造を認識して結合することが実証されている。また、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されている。そのため、この抗体によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0027】
また、この抗体を含む、アデノシンA2a受容体結合性抗体またはアデノシンA2a受容体機能阻害剤が提供される。または、この抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬もしくは診断薬が提供される。これらは、後述する実施例で、アデノシンA2a受容体への結合すること、または顕著なアゴニスト阻害作用を奏することが実証されている抗体を含む。加えて、上述の通り、アデノシンA2a受容体へのアゴニスト阻害作用は、上記疾患のモデル動物にin vivoで治療効果があったことが文献に記載されている。そのため、この抗体によると、アデノシンA2a受容体結合性抗体、アデノシンA2a受容体の機能阻害効果、上記疾患の治療効果、または上記疾患の診断効果が得られる。
【0028】
また、この抗体をコードする塩基配列を含む、ポリヌクレオチドが提供される。このポリヌクレオチドは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏すること、またはアデノシンA2a受容体の立体構造を認識することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列含む。そのため、このポリヌクレオチドに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0029】
また、この抗体をコードする塩基配列またはその一部を含む、ベクターが提供される。このベクターは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏すること、またはアデノシンA2a受容体の立体構造を認識することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列、またはその一部を含む。そのため、このベクターに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0030】
なお、重鎖CDR1が、配列番号7において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2が、配列番号8において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3が、配列番号9において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含むアミノ酸配列であっても、当業者であれば当然同様の作用効果が得られることが容易に想定できる。
【0031】
本発明によれば、受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体が提供される。
【0032】
このアデノシンA2a受容体結合性抗体は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されている。また、アデノシンA2a受容体の立体構造を認識することが実証されている。そのため、このアデノシンA2a受容体結合性抗体によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0033】
本発明によれば、固相担体と、上記固相担体に結合しているリポソームと、上記リポソームに埋め込まれているアデノシンA2a受容体とを備え、上記アデノシンA2a受容体の少なくとも一部が、リポソームの外側表面に露出している、アデノシンA2a受容体結合性抗体をスクリーニングする際に使用するリポソーム/アデノシンA2a受容体複合体が提供される。
【0034】
このリポソーム/アデノシンA2a受容体複合体は、後述する実施例で、アデノシンA2a受容体の立体構造を認識する抗体、またはアデノシンA2a受容体のループ部分の立体構造を認識する抗体をスクリーニングする際に使用できることが実証されている。そのため、このリポソーム/アデノシンA2a受容体複合体によると、アデノシンA2a受容体への結合特異性が高い抗体を好適にスクリーニングできる。
【0035】
本発明によれば、リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程と、アデノシンA2a受容体を変性させる工程と、前工程で変性した変性型のアデノシンA2a受容体に被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程とを含む、アデノシンA2a受容体結合性抗体のスクリーニング方法が提供される。
【0036】
このスクリーニング方法によると、後述する実施例で、アデノシンA2a受容体の立体構造を認識する抗体、またはアデノシンA2a受容体のループ部分の立体構造を認識する抗体をスクリーニングできることが実証されている。そのため、スクリーニング方法によると、アデノシンA2a受容体への結合特異性が高い抗体を好適にスクリーニングできる。
【発明の効果】
【0037】
本発明によれば、アデノシンA2a受容体への結合性に優れた抗体、またはアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤が得られる。または、特定のアミノ酸配列のCDRを有するため、アデノシンA2a受容体への結合性に優れた抗体、もしくは顕著なアデノシンA2a受容体機能阻害活性を有す抗体が得られる。または、特定のハイブリドーマにより生産されるため、アデノシンA2a受容体への結合性に優れた抗体、または顕著なアデノシンA2a受容体機能阻害活性を有す抗体が得られる。
【図面の簡単な説明】
【0038】
【図1】図1はリポソーム-ELISA法の概念図である。
【図2】図2はアデノシンA2a受容体結合性抗体によるリガンド飽和結合活性変化の結果である。
【図3】図3はエンドポイント測定での、アデノシンA2a受容体結合性抗体によるリガンド飽和結合活性変化の結果である。
【図4】図4はC2838-190およびC40010-A6の抗体をプローブとして用いた、マウス脳切片の免疫染色の結果である。
【発明を実施するための最良の形態】
【0039】
<発明の経緯>
本願発明者らは、治療薬、診断薬、または研究試薬(材料)の開発のために、A2aの機能解析や、抗アデノシンA2a受容体抗体の作用効果や機能性の向上を目指した研究を行っている。
【0040】
A2a受容体はG蛋白質共役受容体(GPCR)に分類される受容体である。GPCRは、シグナル情報を細胞内に伝える際に、G蛋白質と呼ばれる三量体蛋白質を介してシグナル伝達を行う受容体の総称であり、現在の基礎研究、創薬研究において最も注目されている蛋白質群であるといえる。しかしながら、その必要性とは裏腹に、ヒト由来のGPCRはマウスの免疫反応を引き起こし難く、良好なモノクローナル抗体の作成は難しいことが知られており、抗GPCR抗体の研究開発は極めて困難である。
【0041】
そのような中、本願発明者らは様々な手法を検討し、天然状態を損なわないようにして分離調製された組換えA2a受容体を抗原として免疫を開始することで、抗体価の上昇した中途クローンを多数得ることに成功した。さらにリポソームELISA等、各種キャラクタリゼーションを実施することにより、上記クローンが産生する抗体の多くが、従来の抗アデノシンA2a受容体抗体にはみられない新規な機能性を有することを確認した。新規な機能性とは、A2a受容体の機能性立体構造に対する選択的な結合性、高い親和性(解離平衡定数 KD=10nM 未満)、またはエピトープが末端ペプチド配列のみに制限されないことなどである。
【0042】
さらに、得られた細胞のうち25種についてモノクローナル抗体産生株を樹立し、A2a受容体のリガンド結合活性を測定すると、驚くべきことに、アゴニスト(NECA)の結合を著しく抑える機能性抗体が得られていることが判明し、本発明を完成した。
【0043】
<用語の説明>
本明細書および特許明細書の範囲において、各種用語の意味を以下の通り定義する。
【0044】
(1)アデノシンA2a受容体(A2a受容体、adenosine A2a receptor)
アデノシンA2a受容体(本明細書中ではA2a受容体と記載することもある)は、G蛋白質共役受容体(GPCR)に分類される7回膜貫通型の受容体である。ほ乳類の神経節、血管、血小板の細胞膜等に発現し、主に中枢神経系や循環器系において特定の細胞外リガンドを認識して、細胞内へシグナルを伝達する重要な役割を果たす。例えば、リガンドの結合によりGsの結合およびアデニル酸シクラーゼの活性化を促し、細胞内cAMPレベルを上昇させる。代表的なリガンドにはアデノシンが挙げられる。
【0045】
(2)重鎖
重鎖は抗体の主な構成要素であり、典型的には、軽鎖とジスルフィド結合および非共有結合によって結合している。重鎖のN末端側のドメインには、同種の同一クラスの抗体でもアミノ酸配列が一定しない可変領域(VH)と呼ばれる領域が存在し、一般的に、VHが抗原に対する特異性、親和性に最も大きく寄与していることが知られている。例えば、リゾチームで免疫化したマウス脾臓からVH遺伝子を抽出増殖し、大腸菌でVHのみを単独で発現させたところ、その断片は顕著な抗原に対する親和性を保持していることが報告されている(Ward et al., Nature. 1989 Oct 12;341(6242):544-546.)。さらには、ラクダの抗体の中には、軽鎖を持たない重鎖の2量体として存在している分子種が存在していることが報告されている(Wolfson W, Chem Biol. 2006 Dec;13(12):1243-1244.)。
【0046】
(3)CDR(相補性決定領域、complementarity determining region)
CDRは、抗体分子のFv(可変領域。重鎖のV領域(VH)と軽鎖のV領域(VL)とから構成されている)上で、実際に抗原に直接接触して結合部位を形成している領域であり、重鎖と軽鎖に、それぞれ約5〜10アミノ酸残基からなるCDR1、CDR2、CDR3が存在する。一般的にはCDR3が結合における寄与が最も高い。CDRは、抗原に対する特異性を決定する領域であるため、抗体間でアミノ酸配列が大きく異なり、超可変領域ともよばれている。それ以外のFv領域はフレームワーク領域(FR)と呼ばれ、FR1、FR2、FR3およびFR4からなり、抗体間で比較的よく保存されている(Kabat et al.,「Sequence of Proteins of Immunological Interest」US Dept. Health and Human Services, 1983.)。
【0047】
以下、本発明の実施の形態について、詳細に説明する。なお、同様な内容については、
繰り返しの煩雑を避けるために、適宜説明を省略する。
【0048】
<実施形態1:アデノシンA2a受容体結合性抗体>
本実施形態に係るアデノシンA2a受容体結合性抗体は、後述する実施例で、アデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている。また、アデノシンA2a受容体の立体構造を認識することが実証されている。3次元である立体構造を認識するということは、1次元であるアミノ酸配列のみを認識するよりも特異的に結合することであり、効率的に作用することを表す。そのため、A2a受容体の関与するシグナル伝達等の種々の機能、例えば、cAMPの増加(Chern et al., Mol Pharmacol. 1993 Nov;44(5):950-8.)や、MAPKの活性化(Schulte et al., Int J Biochem Cell Biol. 2003 Apr;35(4):410-4. Review.)などを効率的に、また著しく阻害すると考えられる。ここで、MAPKの機能阻害は、胃癌や肝癌等のモデル動物にin vivoで治療効果があることが、[Yang et al., Mol Cancer Ther. 2009 Sep;8(9):2537-45. Epub 2009 Sep 1.]および[Huynh et al., Mol Cancer Ther. 2007 Sep;6(9):2468-76.]に記載されている。即ち、このアデノシンA2a受容体結合性抗体は、MAPKのようなA2aと連関するシグナル伝達分子の機能阻害を通して、各種疾患の治療や予防に効果を発揮できると考えられる。
【0049】
ここで、アデノシンA2a受容体結合性抗体によるA2a受容体の機能阻害は、アゴニスト阻害、またはアンタゴニスト阻害を含むが、アゴニスト阻害であることが好ましい。なぜならば、後述の実施例において、アンタゴニスト阻害よりもアゴニスト阻害活性が強いことが示されているからである。また、アデノシンA2a受容体へのアゴニスト阻害作用は、in vivoで種々の疾患の疾患モデル動物に治療効果を発揮することが知られているため、各種疾患の治療、診断に有用だからである。例えば、in vivoで神経変性疾患の疾患モデル動物に治療効果を発揮することが[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]に記載されている。また、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には肺腫瘍および乳房腫瘍の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。このことは、アゴニスト阻害作用を有すアデノシンA2a受容体結合性抗体においても同様に期待でき、上記アデノシンA2a受容体結合性抗体は、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーの疾患の治療薬、診断薬に好適に使用できると考えられる。
【0050】
本明細書において、「アゴニスト」とは、受容体と結合して生理作用を発現する物質のことを示す。
【0051】
また、このアデノシンA2a受容体結合性抗体は、後述する実施例で、解離平衡定数KDが10nM未満であることが実証されているため、A2a受容体に高い親和性を有している抗体である。そのため、このアデノシンA2a受容体結合性抗体は、治療薬、診断薬、研究試薬等の各種用途において優れた効果を発揮すると考えられる。
【0052】
また、アデノシンA2a受容体結合性抗体のA2a受容体への結合部位は、N末端、C末端、ループ部分、または細胞膜内部分などを含む。一般的に膜蛋白質の蛋白質N末端(やC末端)は、溶媒中において膜貫通領域に対する相対位置や方位に揺らぎが大きいことが多い。そのため、膜蛋白質のN末端領域を認識して結合する抗体は、立体構造ではなく、アミノ酸配列を認識している可能性が極めて高い。対して、ループ部分を認識する抗体は、A2a受容体の立体構造を認識している可能性が高い。立体構造を認識するということは、アミノ酸配列のみを認識する抗体に比べて、抗体の結合特異性が高く、効率的に作用することを意味する。
【0053】
また、ループ部分に結合することは、抗体をA2a受容体との共結晶化に使用する場合においても有利に働く。通常、膜蛋白質の蛋白質N末端(やC末端)に存在する親水性領域に抗体が結合したとしても、結晶中で規則的に並んだ定まった結晶格子を形成し得えず、蛋白質N末端(やC末端)近くに結合する抗体は結晶化に適さないということがいえる。従って、膜蛋白質との共結晶化に使用する抗体は、本実施例で得られた抗体のようにループ部分に対して結合特異性の高い抗体が適している。従って、アデノシンA2a受容体結合性抗体のA2a受容体への結合部位は、A2a受容体のループ部分であることが特に好ましい。
【0054】
本明細書において、「膜蛋白質のループ部分」とは、膜蛋白質内に存在する2つの膜貫通領域間をつなぐ領域のことで、かつ、膜に埋もれていない領域のことを表す。
【0055】
本明細書において「結合する」とは、物質間の連結を意味する。連結は共有結合また
は非共有結合のいずれであってもよく、たとえば、イオン結合、水素結合、疎水性相互作
用、または親水性相互作用が挙げられる。
【0056】
ここで、アデノシンA2a受容体結合性抗体が結合するA2a受容体は、種が異なる複数種類の哺乳動物由来のA2a受容体を含む。種が異なる複数種類の哺乳動物は、好ましくは、マウス、ラット、ウサギ、ブタ、ヒツジ、ウシ、ウマ、ネコ、イヌ、サル、およびチンパンジーのいずれか1種以上、およびヒトである。なぜならば、ヒトの疾患の治療薬や診断薬の開発を行う際に、マウス、ラット、ウサギ、ブタ、ヒツジ、ウシ、ウマ、ネコ、イヌ、サル、またはチンパンジーが典型的な疾患モデル動物として使用できる哺乳類であるためである。また、該哺乳動物は、より好ましくはマウス、ラット、サル、およびチンパンジーのいずれか1種以上、およびヒトである。なぜならば、マウス、ラット、サル、およびチンパンジーは、世界中で研究用のモデル動物として汎用され多くの特性が明らかになっているためである。その中でも、マウスは遺伝的背景が明らかになっている系統が多く、また世代あたりの時間が短いという特性を持ち、さらにはヒトの疾患と類似の疾患を発症しやすいために好ましい。
【0057】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体結合性抗体をコードするポリヌクレオチド、アデノシンA2a受容体結合性抗体をコードする塩基配列を含むベクター、またはアデノシンA2a受容体結合性抗体をコードする塩基配列の一部を含むベクターのいずれかを導入された、ヒトや他の哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)の細胞から生産した組換え蛋白質であってもよい。哺乳動物細胞としては、例えば、サル細胞COS-7、Vero、チャイニーズハムスター細胞CHO(CHO細胞)、dhfr遺伝子欠損チャイニーズハムスター細胞CHO(CHO(dhfr)細胞)、マウスL細胞,マウスAtT-20、マウスミエローマ細胞、ラットGH3、ヒトFL細胞、ヒトHEK293細胞などが挙げられる。または、Escherichia属菌、Bacillus属菌、酵母、鳥類細胞、または昆虫細胞から生産した組換え蛋白質であってもよい。最も取り扱いが容易で、コストが低く抑えられることから、生産に使用する細胞としてはEscherichia属菌が好ましい。
【0058】
また、上記のベクターは、大腸菌由来のプラスミド(例、pBR322、pBR325、pUC12、pUC13)、枯草菌由来のプラスミド(例、pUB110、pTP5、pC194)、酵母由来プラスミド(例、pSH19、pSH15)、λファージなどのバクテリオファージ、レトロウイルス、ワクシニアウイルス、バキュロウイルスなどの動物ウイルスなどの他、pA1-11、pXT1、pRc/CMV、pRc/RSV、pcDNAI/Neoなどを用いることができる。
【0059】
また、上記のポリヌクレオチドまたはベクターの細胞への導入と抗体の生産は、当該技術分野で公知の方法に従って行うことができる。ポリヌクレオチドまたはベクターの細胞への導入方法として例えば、リン酸カルシウム法、リポフェクション法、エレクトロポレーション法、アデノウイルスによる方法、レトロウイルスによる方法、またはマイクロインジェクションなどを使用できる[改訂第4版 新 遺伝子工学ハンドブック, 羊土社(2003):152-179.]。抗体の細胞を用いた生産方法としては、例えば、[タンパク質実験ハンドブック,羊土社(2003):128-142.]、[Shimamoto et al., Biologicals. 2005 Sep;33(3):169-174.]に記載の方法を使用できる。なお、アデノシンA2a受容体結合性抗体は、化学合成もしくは無細胞翻訳系で合成された蛋白質であってもよい。
【0060】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体結合性抗体を産生する細胞から、当該技術分野において公知の方法を用いて精製することができる。抗体の精製方法は、例えば、硫酸アンモニウムまたはエタノール沈殿、プロテインA、プロテインG、ゲルろ過クロマトグラフィー、陰イオンまたは陽イオン交換クロマトグラフィー、ホスホセルロースクロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィー、ヒドロキシルアパタイトクロマトグラフィー、およびレクチンクロマトグラフィーなどを用いて達成され得る(タンパク質実験ハンドブック, 羊土社(2003):27-52.)。
【0061】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体の野生型または変異型に結合する抗体を含む。ここで、変異型とは、個体間のDNA配列の差異に起因するものを含む。また、アデノシンA2a受容体結合性抗体は野生型であることが好ましいが、変異型の場合は野生型に対し、好ましくは80%の相同性を有し、より好ましくは90%の相同性を有し、特に95%の相同性を有していることが好ましい。なぜならば、野生型に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例において、アデノシンA2a受容体結合性抗体によってアゴニストとの結合が阻害されることが実証されている、アデノシンA2a受容体に近い機能が得られるためである。
【0062】
本明細書において「相同性」とは、2つ、もしくは複数間のアミノ酸配列の同一のアミノ酸数の割合を、当該技術分野で公知の方法に従って算定したものである。割合を算定する前には、比較するアミノ酸配列群のアミノ酸配列を整列させ、同一の割合を最大にするために必要である場合はアミノ酸配列の一部に間隙を導入する。また、いかなる保存的置換も同一と考えない。また、最適に整列した状態において、オーバーラップするアミノ酸を含めた全アミノ酸残基に対する、同一のアミノ酸数の割合を意味する。整列のための方法、割合の算定方法、およびそれらに関連するコンピュータプログラムは、当該技術分野で従来からよく知られており、一般的な配列分析プログラム(例えば、GENETYX、GeneChip Sequence Analysisなど)を使用して測定することができる。
【0063】
なお、A2a受容体のDNA配列およびアミノ酸配列は公知である。例えば、National Center for Biotechnology Information(NCBI)のデータベースから入手できる。
【0064】
また、アデノシンA2a受容体結合性抗体は、重鎖CDR1が配列番号1のアミノ酸配列を含み、重鎖CDR2が配列番号2のアミノ酸配列を含み、重鎖CDR3が配列番号3のアミノ酸配列を含む抗体を含む。ここで、重鎖CDR1のアミノ酸配列は、配列番号1に対して1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、重鎖CDR2のアミノ酸配列は、配列番号2に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、重鎖CDR3のアミノ酸配列は、配列番号3に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1または2個は、好ましくは1個である。また、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、重鎖CDR1、2、および3が、それぞれ配列番号1、2、および3に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、重鎖CDR1が配列番号1のアミノ酸配列を含み、重鎖CDR2が配列番号2のアミノ酸配列を含み、重鎖CDR3が配列番号3のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0065】
また、アデノシンA2a受容体結合性抗体は、軽鎖CDR1が配列番号4のアミノ酸配列を含み、軽鎖CDR2が配列番号5のアミノ酸配列を含み、軽鎖CDR3が配列番号6のアミノ酸配列を含む抗体を含む。ここで、軽鎖CDR1のアミノ酸配列は、配列番号4に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、軽鎖CDR2のアミノ酸配列は、配列番号5に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、軽鎖CDR3のアミノ酸配列は、配列番号6に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、軽鎖CDR1、2、および3が、それぞれ配列番号4、5、および6に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、軽鎖CDR1が配列番号4のアミノ酸配列を含み、軽鎖CDR2が配列番号5のアミノ酸配列を含み、軽鎖CDR3が配列番号6のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0066】
また、アデノシンA2a受容体結合性抗体は、重鎖CDR1が配列番号7のアミノ酸配列を含み、重鎖CDR2が配列番号8のアミノ酸配列を含み、重鎖CDR3が配列番号9のアミノ酸配列を含む抗体を含む。ここで、重鎖CDR1のアミノ酸配列は、配列番号7に対して1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、重鎖CDR2のアミノ酸配列は、配列番号8に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、重鎖CDR3のアミノ酸配列は、配列番号9に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1または2個は、好ましくは1個である。また、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、重鎖CDR1、2、および3が、それぞれ配列番号7、8、および9に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、重鎖CDR1が配列番号7のアミノ酸配列を含み、重鎖CDR2が配列番号8のアミノ酸配列を含み、重鎖CDR3が配列番号9のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0067】
また、アデノシンA2a受容体結合性抗体は、軽鎖CDR1が配列番号10のアミノ酸配列を含み、軽鎖CDR2が配列番号11のアミノ酸配列を含み、軽鎖CDR3が配列番号12のアミノ酸配列を含む抗体を含む。ここで、軽鎖CDR1のアミノ酸配列は、配列番号10に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、軽鎖CDR2のアミノ酸配列は、配列番号11に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、軽鎖CDR3のアミノ酸配列は、配列番号12に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、軽鎖CDR1、2、および3が、それぞれ配列番号10、11、および12に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、軽鎖CDR1が配列番号10のアミノ酸配列を含み、軽鎖CDR2が配列番号11のアミノ酸配列を含み、軽鎖CDR3が配列番号12のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0068】
また、アデノシンA2a受容体結合性抗体は、受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体を含む。さらに、アデノシンA2a受容体結合性抗体は、上記いずれかのハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片であっても良い。
【0069】
また、アデノシンA2a受容体結合性抗体のスクリーニングには、リポソーム/A2a受容体複合体を用いることができる。このリポソーム/A2a受容体複合体は、固相担体と、上記固相担体に結合しているリポソームと、上記リポソームに埋め込まれているA2a受容体と、を備え、上記膜蛋白質の少なくとも一部が、リポソームの外側表面に露出しているリポソーム/アデノシンA2a受容体複合体である。このリポソーム/A2a受容体複合体を用いてリポソーム-ELISA法を行えば、A2a受容体の天然型の立体構造を認識するモノクローナル抗体をスクリーニングできる効果がある。なぜならば、リポソーム中でA2a受容体は天然型の立体構造を保っていると考えられるため、スクリーニングの過程で被検抗体がA2a受容体の天然型の立体構造に接触しやすく、その結果天然型の立体構造を認識する抗体が得られる可能性が高いと考えられるためである。また、さらに変性ドットブロッティング法のようなA2a受容体の変性を伴う検出操作を行い比較することにより、より高い精度でスクリーニングできると考えられる。
【0070】
なお、リポソーム-ELISA法とは、一般的なELISA法(Enzyme-Linked ImmunoSorbent Assay)の原理を応用し、リポソーム/膜蛋白質複合体を固相担体に固定し、該膜蛋白質に反応する非検化合物をスクリーニングする方法である。概念図を図1に示す。アデノシンA2a受容体結合性抗体のスクリーニングにおいては、リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程と、アデノシンA2a受容体を変性させる工程と、前工程で変性した変性型のアデノシンA2a受容体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程とを含む方法でスクリーニングできる。
【0071】
本明細書において抗体は、抗原上の特定のエピトープに特異的に結合することができる分子を指し、ポリクローナル抗体、モノクローナル抗体を含む。また、抗体は様々な形態で存在することができ、例えば、Fv、Fab、F(ab’)2、Fab’、diabody、一本鎖抗体(例えば、scFv、dsFv)、CDRを含むペプチド、多価特異的抗体(例えば、二価特異的抗体)、キメラ抗体、ヒト化抗体、またはヒト抗体などが挙げられる。また、既存の化学合成医薬品原体または医薬品製剤に結合した低分子抗体、もしくは糖鎖改変抗体の形態であってもよい。なお、抗体は、治療薬として使用する際に免疫原性を低減させるために、ヒト由来のアミノ酸配列の割合が多いことが好ましい。つまり、抗体は、好ましくはヒトとのキメラ抗体であり、より好ましくはヒト化抗体であり、最も好ましくはヒト抗体である。また、抗体は、治療薬として使用する際に免疫原性を低減させるために、または安定性を高めるために、所望の機能を有している限り、より低分子であることが好ましい。さらには、抗体は、所望の効果を持つ限り、RNAもしくはDNAを含む核酸アプタマーに置き換えても良い。
【0072】
本明細書においてポリクローナル抗体は、例えば、抗原に特異的なポリクローナル抗体を含む血清の産生を誘導するために、哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)や鳥類等に、目的の抗原を含む免疫原を投与することによって抗体を生成することが可能である。免疫原の投与は、1つ以上の免疫剤、および所望の場合にはアジュバントの注入を必要とすることもある。アジュバントは、免疫応答を増加させるために使用されることもあり、フロイントアジュバント(完全または不完全)、ミネラルゲル(水酸化アルミニウム等)、界面活性物質(リゾレシチン、プルロニックポリオール、ポリアニオン、ペプチド、油乳剤、キーホールリンペットヘモシアニン、ジニトロフェノール等)、または潜在的に有用なヒトアジュバント(カルメット−ゲラン桿菌(BCG)またはコリネバクテリウムパルバム)を含む。その他、MPL-TDMアジュバント(モノホスホリルリピドA、合成トレハロースジコリノミコレート)を含む。免疫プロトコルは、当該技術分野で公知であり、選択する動物宿主に伴い、免疫応答を誘発する任意の方法によって実施される場合がある[タンパク質実験ハンドブック, 羊土社(2003):86-91.]。
【0073】
本明細書においてモノクローナル抗体は、実質的に均一な抗体の集団から得られる抗体を指す。すなわち、集団を構成する個々の抗体が、少量存在しうる自然に生じることが可能な突然変異を除いて、同一である。モノクローナル抗体は高度に特異的であり、一つの抗原部位に対応する。さらに、異なるエピトープ(抗原決定基)に対応する異なる抗体を典型的に含む、通常のポリクローナル抗体とは異なり、各モノクローナル抗体は抗原の単一のエピトープに対応する。その特異性に加えて、モノクローナル抗体は、他の免疫グロブリンによって汚染されていないハイブリドーマ培養から合成される点で有用である。「モノクローナル」という形容は、実質的に均一な抗体集団から得られたという抗体の特徴を示し、抗体を何か特定の方法で生産しなければならないことを意味するものではない。例えば、本明細書におけるモノクローナル抗体は、[Kohler G, Milstein C., Nature. 1975 Aug 7;256(5517):495-497.]に掲載されているようなハイブリドーマ法と同様の方法によって作ることができる。あるいは、本発明で使用されるモノクローナル抗体は、米国特許第4816567号に記載されているような組換え法と同様の方法によって作ることができる。または、本明細書におけるモノクローナル抗体は、[Clackson et al., Nature. 1991 Aug 15;352(6336):624-628.]または[Marks et al., J Mol Biol. 1991 Dec 5;222(3):581-597.]に記載されているような技術と同様の方法を用いてファージ抗体ライブラリから単離してもよい。または、[タンパク質実験ハンドブック, 羊土社(2003):92-96.]に掲載されている一般的な生産方法によって作ることができる。なお、本明細書におけるモノクローナル抗体は、後述する実施例に記載の方法で作製することが好ましい。
【0074】
なお、Fvは、完全な抗原認識及び結合部位を含む抗体フラグメントである。この領域は、密接な非共有結合による1つの重鎖および1つの軽鎖可変ドメインの二量体からなる。この配置において、各可変ドメインの3つのCDRは相互に作用してVH-VL二量体の表面に抗原結合部位を形成する。そして、6つのCDRが抗体に抗原結合特異性を付与する。なお、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のFvをコードするDNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該ベクターを原核生物あるいは真核生物へ導入することにより発現させ、Fvを生産することができる。
【0075】
また、Fabは、IgGを蛋白質分解酵素パパインで処理して得られる断片のうち、H鎖のN末端側約半分とL鎖全体がジスルフィド結合で結合した、抗原結合活性を有する抗体断片である。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体を蛋白質分解酵素パパインで処理して得ることができる。または、アデノシンA2a受容体結合性抗体のFabをコードするDNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該ベクターを原核生物あるいは真核生物へ導入することにより発現させ、Fabを生産することができる。
【0076】
また、F(ab’)2は、IgGを蛋白質分解酵素ペプシンで処理して得られる断片のうち、Fabがヒンジ領域のジスルフィド結合を介して結合されたものよりやや大きい、抗原結合活性を有する抗体断片である。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体を蛋白質分解酵素ペプシンで処理して得ることができる。または、下記のFab’をチオエーテル結合あるいはジスルフィド結合させ、作製することができる。
【0077】
また、Fab’は、F(ab’)2のヒンジ領域のジスルフィド結合を切断した、抗原結合活性を有する抗体断片である。F(ab’)2を還元剤ジチオスレイトール処理して得ることができる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のFab’断片をコードするDNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該ベクターを原核生物あるいは真核生物へ導入することにより発現させ、Fab’を製造することができる。
【0078】
また、scFvは、1本のVHと1本のVLとを適当なペプチドリンカーを用いて連結したポリペプチドで、抗原結合活性を有する抗体断片である。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHおよびVLをコードするcDNAを取得し、scFvをコードするDNAを構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、scFvを製造することができる。
【0079】
また、diabodyは、scFvが二量体化した抗体断片で、二価の抗原結合活性を有する抗体断片である。二価の抗原結合活性は、同一であることもできるし、一方を異なる抗原結合活性とすることもできる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHおよびVLをコードするcDNAを取得し、scFvをコードするDNAをペプチドリンカーのアミノ酸配列の長さが8残基以下となるように構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、diabodyを製造することができる。
【0080】
また、dsFvは、VHおよびVL中のそれぞれ1アミノ酸残基をシステイン残基に置換したポリペプチドを該システイン残基間のジスルフィド結合を介して結合させたものの総称である。システイン残基に置換するアミノ酸残基はReiterらにより示された方法(Reiter et al., Protein Eng. 1994 May;7(5):697-704.)に従って、抗体の立体構造予測に基づいて選択することができる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHおよびVLをコードするcDNAを取得し、dsFvをコードするDNAを構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、dsFvを製造することができる。
【0081】
また、CDRを含むペプチドは、VHまたはVLのCDRの少なくとも1領域以上を含んで構成される。複数のCDRを含むペプチドは、直接または適当なペプチドリンカーを介して結合させることができる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHまたはVLのCDRをコードするDNAを構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、CDRを含むペプチドを製造することができる。また、CDRを含むペプチドは、Fmoc法(フルオレニルメチルオキシカルボニル法)、tBOC法(t-ブチルオキシカルボニル法)などの化学合成法によって製造することもできる。
【0082】
また、キメラ抗体は、非ヒト種由来の抗体の可変領域を、ヒト抗体の定常領域に連結したもので、遺伝子組換え技術によって容易に構築できる。キメラ抗体を生成する方法は、当該技術分野で公知である。例えば、マウス-ヒトキメラ抗体は、[Roguska et al., Proc Natl Acad Sci U S A. 1994 Feb 1;91(3):969-973.]に記載の方法で作製できる。標的抗原に対するマウスモノクローナル抗体の、マウス軽鎖V領域およびマウス重鎖V領域をコードするDNA断片をクローニングし、これらのマウスV領域をコードするDNAを、ヒト抗体定常領域をコードするDNAと連結して発現させることによってマウス-ヒトキメラ抗体が得られる。マウス-ヒトキメラ抗体を作製するための基本的な方法は、クローン化されたcDNAに存在するマウスリーダー配列及びV領域配列を、哺乳類細胞の発現ベクター中にすでに存在するヒト抗体C領域をコードする配列に連結する。あるいは、クローン化されたcDNAに存在するマウスリーダー配列及びV領域配列をヒト抗体C領域をコードする配列に連結した後、哺乳類細胞発現ベクターに連結する。ヒト抗体C領域の断片は、任意のヒト抗体のH鎖C領域及びヒト抗体のL鎖C領域のものとすることができ、例えばヒトH鎖のものについてはCγ1、Cγ2、Cγ3又はCγ4、及びL鎖のものについてはCλ又はCκを各々挙げることができる。
【0083】
また、ヒト化抗体は、非ヒト種由来の1つ以上の相補性決定領域(CDR)およびヒト免疫グロブリン由来のフレームワーク(FR)領域、さらにヒト免疫グロブリン由来の定常領域を有し、所望の抗原に結合する。抗原結合を改変する、好ましくは、改善するために、ヒトフレームワーク領域のアミノ酸残基は、CDRドナー抗体からの対応する残基と置換されることが多い。これらのフレームワーク置換は、当該技術分野で周知の方法(例えば、抗原結合に重要なフレームワーク残基を同定するために、CDRとフレームワーク残基の相互作用のモデリングによって、および特定の位置で異常なフレームワーク残基を同定するための配列比較)によって実施される(Riechmann et al., Nature. 1988 Mar 24;332(6162):323-327.)。抗体は、当該技術分野で既知の種々の手法を使用してヒト化することが可能である(Almagro et al., FRont Biosci. 2008 Jan 1;13:1619-1633.)。例えば、CDRグラフティング(Ozaki et al., Blood. 1999 Jun 1;93(11):3922-3930.、Re-surfacing (roguska et al., Proc Natl Acad Sci U S A. 1994 Feb 1;91(3):969-973.)、およびFRシャッフル(Damschroder et al., Mol Immunol. 2007 Apr;44(11):3049-3060. Epub 2007 Jan 22.)などが挙げられる。
【0084】
また、ヒト抗体は、典型的には、抗体を構成する重鎖の可変領域、重鎖の定常領域、軽鎖の可変領域、および軽鎖の定常領域を含む全ての領域がヒトイムノグロブリンをコードする遺伝子に由来する抗体である。ヒトに投与した際に免疫原性が少なく、ヒトの疾患治療に使用する際に好適に使用できる。主な作成方法としてはヒト抗体作製用トランスジェニックマウス法、ファージディスプレイ法などがある。ヒト抗体作製用トランスジェニックマウス法は、内因性Igをノックアウトしたマウスに機能的なヒトのIg遺伝子を導入すれば、マウス抗体の代わりに多様な抗原結合能を持つヒト抗体が産生される。さらにこのマウスを免疫すればヒトモノクローナル抗体を従来のハイブリドーマ法で得ることが可能である。例えば、[Lonberg et al., Int Rev Immunol. 1995;13(1):65-93.]に記載の方法で作成できる。ファージディスプレイ法は大腸菌ウイルスの一つであるM13やT7などの繊維状ファージのコート蛋白質(g3pやg10pなど)のN末端側にファージの感染性を失わないよう外来遺伝子を融合蛋白質として発現させるシステムである。例えば、[Vaughan et al., Nat Biotechnol. 1996 Mar;14(3):309-314.]に記載の方法で作成できる。
【0085】
また、アデノシンA2a受容体結合性抗体は、1若しくは数個のアミノ酸が別のアミノ酸に置換していてもよい。この場合には、アミノ酸側鎖の性質が保存されている別のアミノ酸に置換していることが好ましい。例えばアミノ酸側鎖の性質としては、疎水性アミノ酸(A、I、L、M、F、P、W、Y、V)、親水性アミノ酸(R、D、N、C、E、Q、G、H、K、S、T)、脂肪族側鎖を有するアミノ酸(G、A、V、L、I、P)、水酸基含有側鎖を有するアミノ酸(S、T、Y)、硫黄原子含有側鎖を有するアミノ酸(C、M)、カルボン酸及びアミド含有側鎖を有するアミノ酸(D、N、E、Q)、塩基含有側鎖を有するアミノ離(R、K、H)、および、芳香族含有側鎖を有するアミノ酸(H、F、Y、W)を挙げることができる(括弧内はいずれもアミノ酸の一文字標記を表す)。これらの各グループ内のアミノ酸同士の置換は保存的置換と総称される。あるアミノ酸配列に対する1または複数個のアミノ酸残基の欠失、付加、または他のアミノ酸による置換により修飾されたアミノ酸配列を有するポリペプチドがその生物学的活性を維持することはすでに知られている(Mark et al., Proc Natl Acad Sci U S A. 1984 Sep;81(18):5662-5666.、Zoller et al., Nucleic Acids Res. 1982 Oct 25;10(20):6487-6500.、Wang et al., Science. 1984 Jun 29;224(4656):1431-1433.)。
【0086】
また、アデノシンA2a受容体結合性抗体は、既知の選択または突然変異誘発法を使用し、親和成熟させてもよい。好ましい親和成熟抗体は、成熟抗体が出発抗体のものよりも、5倍、より好ましくは10倍、さらに好ましくは20または30倍の親和性を有する。例えば、抗体ファージライブラリを用いたバイオパニングを使用できる。この方法の典型的な操作は、固定化した標的蛋白質に抗体ファージライブラリを反応させ、結合しなかったファージ抗体を洗浄により除去した後に、結合したファージ抗体を溶出し大腸菌に感染させて増殖させる、という操作を数回行うことで標的蛋白質に特異的なファージ抗体を取得することである(改訂版 抗体実験マニュアル, 羊土社(2008):211-221.)。
【0087】
また、アデノシンA2a受容体結合性抗体のクラスは、IgM、IgD、IgG、IgA、IgE、IgX、IgY、IgW、IgNARを含む。なお、該クラスは、IgM、IgD、IgG、IgA、IgEであることが好ましい。なぜならば、IgM、IgD、IgG、IgA、IgEはヒト由来の抗体が有するクラスであるため、抗体を治療薬として使用した際に、免疫原性が低減される可能性が高いと考えられるためである。
【0088】
また、アデノシンA2a受容体結合性抗体の重鎖CDR1、重鎖CDR2、または重鎖CDR3は、例えば、ヒトまたは他の哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)由来や鳥類等由来の抗体であってもよいが、特にヒトまたはマウスであることが好ましい。なぜならば、ヒトであればヒトに投与した際に免疫原性を低減することができ、マウスであれば抗体作成において最も汎用されているために情報が蓄積されており、抗体の扱いがより容易になるためである。
【0089】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体結合性抗体の重鎖CDR領域をコードするDNAと、公知のヒトまたはヒト以外の生物由来の抗体の、重鎖CDR領域を除く領域をコードするDNAとを、当該技術分野で公知の方法に従って、ベクターに連結後、発現させることによって得ることができる。なお、このとき、該抗体の標的抗原への作用効率を上げることができるため、当該分野で公知の方法(例えば、抗体のアミノ酸残基をランダムに変異させ、反応性の高いものをスクリーニングする方法、またはファージディスプレイ法など)を用いて、該抗体の重鎖CDR領域を除く領域を最適化することが好ましい。特に、該抗体の標的抗原への作用効率を上げることができるため、当該分野で公知の方法、例えば、FRシャッフル(Damschroder et al., Mol Immunol. 2007 Apr;44(11):3049-3060. Epub 2007 Jan 22.)、またはバーニヤゾーンのアミノ酸残基および/またはパッケージング残基を置換する方法(特開2006-241026、またはFoote et al., J Mol Biol. 1992 Mar 20;224(2):487-499.)を用いて、FR領域を最適化することが好ましい。
【0090】
本明細書において「重鎖CDR3」とは、抗体の重鎖のCDRに存在していて、抗原に直接接触して結合部位を形成している領域である。一般的に、重鎖CDRには重鎖CDR1、重鎖CDR2、重鎖CDR3が存在し、重鎖CDR3が結合における寄与が最も高い。CDRの定義およびその位置を決定する方法は複数報告されており、これらの何れも採用し得る。例えば、Kabatの定義(Sequences of proteins of immunological interest, 5th ed.,U.S. Department of Health and Human Services,1991)、またはChothiaの定義(Chothia et al., J. Mol. Biol.,1987;196:901-917)を採用してもよい。本明細書においては、Kabatの定義を好適な例として採用するが、必ずしもこれに限定されない。また、場合によっては、Kabatの定義とChothiaの定義の両方を考慮して決定しても良く、例えば、各々の定義によるCDRの重複部分を、または、各々の定義によるCDRの両方を含んだ部分をCDRとすることもできる。そのような方法の具体例としては、Kabatの定義とChothia aの定義の折衷案である、Oxford Molecular's AbM antibody modeling softwareを用いたMartinらの方法(Proc.Natl.Acad.Sci.USA,1989;86:9268-9272)がある。
【0091】
<実施形態2:アデノシンA2a受容体結合性抗体の作用効果>
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤である。アデノシンA2a受容体の機能を阻害することは、A2a受容体の関与するシグナル伝達等の種々の機能、例えば、cAMPの増加(Chern et al., Mol Pharmacol. 1993 Nov;44(5):950-8.)や、MAPKの活性化(Schulte et al., Int J Biochem Cell Biol. 2003 Apr;35(4):410-4. Review.)などを阻害すると考えられる。ここで、MAPKの機能阻害は、胃癌や肝癌等のモデル動物にin vivoで治療効果があることが、[Yang et al., Mol Cancer Ther. 2009 Sep;8(9):2537-45. Epub 2009 Sep 1.]および[Huynh et al., Mol Cancer Ther. 2007 Sep;6(9):2468-76.]に記載されている。従って、このアデノシンA2a受容体機能阻害剤は、MAPKのようなA2a受容体と連関するシグナル伝達分子の機能阻害を通して、各種疾患の治療や予防に効果を発揮できる。
【0092】
このアデノシンA2a受容体機能阻害剤は、アゴニスト、アンタゴニストなど種々のリガンドの結合阻害剤を含むが、アゴニストの結合阻害剤であることが好ましい。なぜならば、後述の実施例において、顕著に高いアゴニスト阻害活性が示されているからである。また、アデノシンA2a受容体へのアゴニスト阻害作用は、in vivoで種々の疾患の疾患モデル動物に治療効果を発揮することが知られているため、各種疾患の治療、診断に有用だからである。例えば、in vivoで神経変性疾患の疾患モデル動物に治療効果を発揮することが[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]に記載されている。また、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には肺腫瘍および乳房腫瘍の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。そして、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤はアゴニストの結合阻害剤を含むため、アゴニスト阻害活性を通して上記疾患を治療できると考えられる。
【0093】
即ち、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤は、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーの疾患の治療薬、または診断薬として好適に使用できる。また、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤は、A2a受容体と連関するシグナル伝達分子の機能阻害を通して、研究用の試薬や、再生医療における細胞または組織の機能や生存率を維持するための添加剤、または畜産において動物の成育を補助するための添加剤として使用できる。
【0094】
ここで、アゴニストはA2a受容体にアゴニスト作用を相する物質であれば限定しないが、アデノシンまたはアデノシン誘導体が好ましい。アデノシンまたはアデノシン誘導体であれば、A2a受容体へのアゴニスト作用を奏すことが良く知られており、続くA2a受容体を介した細胞内シグナル伝達機構も比較的解明されているためである。なお、アデノシン誘導体の中でも、5’‐(N‐エチルカルボキサミド)アデノシンが好ましい。後述する実施例で、実際にアデノシンA2a受容体結合性抗体によるA2a受容体への結合阻害が実際に見られているためである。
【0095】
ここで、結合阻害効果の測定には、ELISA法、FACS分析、BIACOREを用いた方法など、当該技術分野で公知の方法をいずれも使用できる。A2a受容体とリガンドが共存するときの結合を、アデノシンA2a受容体結合性抗体で競合阻害した結果を測定しても良く、またはA2a受容体にアデノシンA2a受容体結合性抗体が結合する様態を、A2a受容体およびリガンドの結合阻害の指標として測定しても良い。なお、結合阻害効果の測定は、後述する実施例に記載の方法で測定することが好ましい。
【0096】
また、A2a受容体にアデノシンA2a受容体結合性抗体が結合する様態は、解離平衡定数(KD)、結合定数(Ka)、結合速度定数(ka)、または解離速度定数(kd)で表すことができる。測定には、ELISA法(Enzyme Linked Immuno-Sorbent Assay)またはBIACOREシステムを使用できる。ELISA法は比較的低コストで導入でき、最も典型的な手法である。ELISA法は、測定したい物質と特異的に反応する抗体もしくは既知量の抗原を固相化したマイクロプレートに、測定したい物質と酵素標識抗原とを同時に加えて反応させ、プレートに結合した酵素標識物の酵素活性を比色法や蛍光法により計測して、特異的相互作用を測定する方法である。抗体の高い結合能と分子認識能を利用するため、HPLC法等と比較して非常に高感度な検出が可能である。
【0097】
BIACOREシステムは、動的なパラメータを測定できる優れた測定方法で、センサー表面に生体分子を固定化して、相互作用の相手となる分子を添加することでセンサー表面における特異的相互作用をリアルタイムに測定する。分子標識の必要なしに、特異的相互作用について結合反応から平衡状態および解離反応までをリアルタイムに測定することが可能である。測定操作は、リガンドをセンサー表面に固定化した後、マイクロ流路系を介して反応物質を含む試料溶液を添加することにより、センサー表面でおこる特異的相互作用を微細な質量変化として測定する。その測定原理に表面プラズモン共鳴(Surface plasmonresonance、SPR)とよばれる光学現象を採用することで信頼性のある測定が行える。直接得られた反応速度をもとに、結合速度定数(ka)および解離速度定(kd)を算定でき詳細な解析が可能である[Jonsson et al., Biotechniques. 1991 Nov;11(5):620-7.、Fivash et al., Curr Opin Biotechnol. 1998 Feb;9(1):97-101.、生命科学のための機器分析実験ハンドブック, 羊土社(2007):243-248.]。
【0098】
また、本明細書において治療とは、疾患または疾患に伴う1つ以上の症状の、予防あるいは症状改善効果を発揮しうることをいう。
【0099】
神経変性疾患とは、神経組織の変性を伴う疾患で、パーキンソン病、アルツハイマー病、認知症、プリオン病、クロイツフェルトーヤコブ病、ハンチントン病 、ポリグルタミン病、筋萎縮性側索硬化症(ALS) 、脊髄小脳変性症(SCD) 、進行性核上性麻痺(PSP) 、多系統萎縮症(MSA)、黒質線状体変性症(SND)、シャイ・ドレーガー症候群(Shy-Drager症候群)、またはオリーブ橋小脳萎縮症(OPCA)を含む。
【0100】
うつ病とは、抑うつ気分や不安、焦燥、精神活動の低下、食欲低下、または不眠症などを特徴とする疾患である。世界保健機構(World Health Organization)が発表している[ICD10 国際疾病分類第10版]でうつ病関連に分類されている疾患を含む。
【0101】
脳虚血性障害とは、脳組織に十分な酸素または栄養が供給されない状態になり、その結果、代謝障害を起こして、脳神経細胞の機能低下、または細胞死に至る状態である。例えば、脳梗塞、一過性脳虚血障害、心停止、低血圧、貧血、脱血、または各種ガス中毒等による脳障害や、低酸素による脳障害が挙げられる。
【0102】
睡眠障害とは、睡眠に関わるあらゆる異常な症状であり、睡眠異常、睡眠時随伴症、内科・精神科的障害に伴う睡眠障害など、アメリカ睡眠障害連合会(American Sleep Disorders Association;ASDA)が発表している睡眠障害国際分類(International Classification of Sleep Disorders;ICSD)で睡眠障害関連に分類されている疾患を含む。
【0103】
癌とは、正常な細胞が突然変異を起こして増殖を続けることで起こる疾患である。悪性の癌細胞は全身のあらゆる臓器や組織から生じ、癌細胞が増殖すると、癌組織のかたまりとなって周囲の正常な組織に侵入し破壊する。癌は、乳癌、結腸直腸癌、肺癌、前立腺癌、肝細胞癌、胃癌、膵臓癌、子宮頸癌、卵巣癌、肝臓癌、膀胱癌、尿管癌、甲状腺癌、腎臓癌、癌腫、メラノーマ、または脳腫瘍などを含む。
【0104】
貧血とは、血液中の赤血球や、赤血球に含まれる血色素の量が少なくなった状態、またはそれにより起こる諸症状である。世界保健機構が発表している[ICD10 国際疾病分類第10版]で貧血関連に分類されている疾患を含む。
【0105】
カタレプシーとは、受動的にとらされた姿勢を保ち続け、自分から元に戻そうとしない症状のことである。強硬症ともいわれる。高度になると筋緊張が高まり、四肢を思いのままの形にあたかも蝋細工のように曲げて不自然な姿勢をとらせることができるので、蝋屈症(flexibilitas cerea)ともいわれる。
【0106】
また、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を治療薬または予防薬として使用する場合、単独で投与することも可能ではあるが、通常は薬理学的に許容される1つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野においてよく知られる任意の方法により製造した医薬製剤として提供するのが好ましい。
【0107】
また、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を生体に投与する際の投与経路は、治療に際して最も効果的なものを使用するのが好ましく、経口投与、または口腔内、気道内、直腸内、皮下、筋肉内、眼内および静脈内などの非経口投与をあげることができ、全身または局部的に投与することができる。投与経路は、好ましくは静脈内投与をあげることができる。アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤が、経口投与後に患部で所望の機能を発揮できる場合には、経口投与が好ましい。
【0108】
また、アデノシンA2a受容体結合性抗体を直接使用せずに、アデノシンA2a受容体結合性抗体をコードするポリヌクレオチド、またはベクターを投与することも可能である。または、アデノシンA2a受容体結合性抗体をA2a受容体発現細胞内で機能するように投与しても良い。抗体を細胞内に導入場合には、上記ベクターをA2a受容体発現細胞内の遺伝子に組み込む手法や、抗体を改変する手法、抗体と膜透過ペプチドとの複合体形成による方法(JBS Transduction Kit(Jena Bioscience))、細胞導入用の封入剤を利用した方法(Kondo et al., J Immunol Methods. 2008 Mar 20;332(1-2):10-7. Epub 2008 Jan 11.)等、当該技術分野で公知の方法を用いて実施可能である。
【0109】
投与形態としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、軟膏、テープ剤などがあげられる。経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤などがあげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖などの糖類、ポリエチレングリコール、プロピレングリコールなどのグリコール類、ゴマ油、オリーブ油、大豆油などの油類、p−ヒドロキシ安息香酸エステル類などの防腐剤、ストロベリーフレーバー、ペパーミントなどのフレーバー類などを添加剤として用いて製造できる。さらに、カプセル剤、錠剤、散剤、顆粒剤などは、乳糖、ブドウ糖、ショ糖、マンニトールなどの賦形剤、デンプン、アルギン酸ナトリウムなどの崩壊剤、ステアリン酸マグネシウム、タルクなどの滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチンなどの結合剤、脂肪酸エステルなどの界面活性剤、グリセリンなどの可塑剤などを添加剤として用いて製造できる。
【0110】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤などがあげられる。注射用の水溶液としては、例えば生理食塩水、ブドウ糖やその他の補助薬を含む等張液、例えばD-ソルビトール、D-マンノース、D-マンニトール、塩化ナトリウムが挙げられ、適当な溶解補助剤、例えばアルコール、具体的にはエタノール、ポリアルコール、例えばプロピレングリコール、ポリエチレングリコール、非イオン性界面活性剤、例えばポリソルベート80(TM)、HCO-50と併用してもよい。座剤はカカオ脂、水素化脂肪またはカルボン酸などの担体を用いて調製される。また、噴霧剤はアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤、ないしは受容者の口腔および気道粘膜を刺激せず、かつアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を微細な粒子として分散させ吸収を容易にさせる担体、などを用いて調製される。この担体としては具体的には乳糖、グリセリンなどが例示できる。アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤と、用いる担体の性質により、エアロゾル、ドライパウダーなどの製剤化が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0111】
また、上記予防薬または治療薬は、緩衝剤(例えば、リン酸塩緩衝液、酢酸ナトリウム緩衝液)、無痛化剤(例えば、塩化ベンザルコニウム、塩酸プロカインなど)、安定剤(例えば、ヒト血清アルブミン、ポリエチレングリコールなど)、保存剤(例えば、ベンジルアルコール、フェノールなど)、酸化防止剤などと配合してもよい。調製された注射液は通常、適当なアンプルに充填される。このようにして得られる製剤は安全で低毒性であるので、例えば、ヒトや哺乳動物(例えば、ラット、マウス、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して投与することができる。
【0112】
また、投与方法は患者の年齢、症状、対象臓器等などにより適宜選択することができる。アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤、もしくはアデノシンA2a受容体結合性抗体をコードするポリヌクレオチドを含有する医薬組成物の投与量としては、例えば、一回につき体重1kgあたり0.0001mgから1000mgの範囲で選ぶことが可能である。あるいは、例えば、患者あたり0.001〜100000mg/bodyの範囲で投与量を選ぶことができるが、これらの数値に必ずしも制限されるものではない。目的とする治療効果、投与方法、治療期間、年齢、体重などにより異なる。投与量、投与方法は、患者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。また、適切な化学療法薬と併用で投与してもよい。
【0113】
また、治療対象が脳内にあり、治療薬が血液脳関門(blood-brain barrier:BBB)を通過する必要があるときには、BBBを通過する製剤設計、投与経路、または投与方法を採用することが好ましい。もしくはアデノシンA2a受容体結合性抗体をBBBを通過する形態に改変していても良い。それらの方法は、当該技術分野において公知の方法を用いて可能であり、例えば、BBBの間隙を広げる方法、BBBに発現する膜蛋白質を利用する方法、CED法(Convection-enhanced Delivery)などが挙げられる(Bidros et al., Neurotherapeutics. 2009 Jul;6(3):539-46. Review.)。
【0114】
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体、またはアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、診断薬である。この診断薬は、アデノシンA2a受容体結合性抗体を含むため、アデノシンA2a受容体の連関する種々の疾患の診断に好適に使用できる。
【0115】
ここで、診断薬の使用方法は特に限定しないが、例えば、上記いずれかの疾患における細胞、血液、血清、体液、または病理切片等と、標準的な細胞等において、A2a受容体への抗体の結合の様態を検査、比較することで上記疾患の診断が可能になると考えられる。例えば、疾患がアデノシンA2a受容体の高発現に起因しているときには、抗体の結合量が増加し、リガンドの高発現に起因しているときには、リガンドと拮抗することで、抗体の結合量が減少すると考えられる。
【0116】
ここで、診断薬として使用する際の検出方法は特に限定されないが、例えば、ラジオイムノアッセイ、エンザイムイムノアッセイ、蛍光イムノアッセイ、発光イムノアッセイ、免疫沈降法、免疫比濁法などを挙げることができる。好ましくはエンザイムイムノアッセイであり、特に好ましいものはELISA(sandwich ELISA等)である。ELISAなどの上述した免疫学的方法は当業者に公知の方法により行うことが可能である。また、診断薬にはPET(Positron Emission Tomography)のための試薬、実験に使用する試薬または材料も含む。
【0117】
アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を用いた典型的な検出方法としては、例えば、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を支持体に固定し、ここに被検試料を加え、インキュベートを行いアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤と被検試料中のA2a受容体を結合させた後に洗浄して、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を介して支持体に結合したA2a受容体を検出することにより、被検試料中のA2a受容体の検出を行う方法を挙げることができる。
【0118】
アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を介して支持体に結合したA2a受容体の検出の好ましい態様として、標識物質で標識されたアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を用いる方法を挙げることができる。例えば、支持体に固定されたアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤に被検試料を接触させ、洗浄後に、標識物質で標識されたアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を接触させ、さらに標識抗体を用いて標識物質を検出し、A2a受容体の指標とする。
【0119】
アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤の標識は通常知られている方法により行うことが可能である。標識物質としては、蛍光色素、酵素、補酵素、化学発光物質、放射性物質などの当業者に公知の標識物質を用いることが可能であり、具体的な例としては、ラジオアイソトープ(32P、14C、125I、3H、131Iなど)、フルオレセイン、ローダミン、ダンシルクロリド、ウンベリフェロン、ルシフェラーゼ、ペルオキシダーゼ、アルカリホスファターゼ、β-ガラクトシダーゼ、β-グルコシダーゼ、ホースラディッシュパーオキシダーゼ、グルコアミラーゼ、リゾチーム、サッカリドオキシダーゼ、マイクロペルオキシダーゼ、ビオチンなどを挙げることができる。標識物質としてビオチンを用いる場合には、ビオチン標識抗体を添加後に、アルカリホスファターゼなどの酵素を結合させたアビジンをさらに添加することが好ましい。
【0120】
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体、またはアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、試薬である。ここで、試薬には、ELASAやFACS分析等の基礎研究のための材料や、蛋白質との共結晶化のための結晶化リガンド(crystallizing ligand)等を含む。特に、上記アデノシンA2a受容体結合性抗体は後述する実施例において、A2a受容体の立体構造を認識していることから、極めて優れた結晶化リガンドであるといえる。
【0121】
本明細書において、「結晶化」とは、蛋白質を結晶として析出させることである。結晶化によって得られる結晶は、X線結晶構造解析を行うことで、X線を当て散乱したX線の回折像から該蛋白質の3次元構造を解析できる。蛋白質の3次元構造の解析に用いる結晶は、一般的に純度が高いことが好ましい(Ferre-D'Amare AR, Burley SK, Structure, 357-359 (1994))。蛋白質の3次元構造を解析した結果は、たとえば、蛋白質立体構造に基づく薬剤設計(SBDD;Structure Based Drug Design)に使用できる。そして、一般的に、SBDDの多くは蛋白質の天然型の構造から薬剤設計を行うので、結晶に含まれる蛋白質は、天然型の構造であることが好ましい。なお、蛋白質の結晶化法には、静止バッチ法、自由界面拡散法、微量透析法、蒸気拡散法などを含む。
【0122】
本明細書において、「共結晶化」とは、蛋白質に化合物を結合させた状態で、または蛋白質が含まれる水溶液中に化合物を混在させた状態で、蛋白質と該化合物をともに結晶化させることを含む。たとえば、膜蛋白質に該膜蛋白質に対する抗体を結合させた状態で、ともに結晶化させることを含む。
【0123】
以下、実施形態1および2に係る作用効果について説明する。
【0124】
本発明の実施形態は、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤である。このアデノシンA2a受容体機能阻害剤を用いれば、A2a受容体に結合し、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0125】
また、このアデノシンA2a受容体機能阻害剤において機能阻害は、アゴニスト阻害であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、A2a受容体へのアゴニストの結合を阻害し、A2a受容体がアゴニストから受ける作用を阻害できる。また、A2a受容体へのアゴニスト阻害作用が関与する各種疾患の治療、診断ができる。
【0126】
また、このアデノシンA2a受容体機能阻害剤においてアゴニストは、アデノシンまたはアデノシン誘導体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、A2a受容体へのアデノシンまたはアデノシン誘導体の結合を阻害し、A2a受容体がアデノシンまたはアデノシン誘導体から受ける作用を阻害できる。また、A2a受容体へのアデノシンまたはアデノシン誘導体の結合阻害作用が関与する各種疾患の治療、診断ができる。
【0127】
また、このアデノシンA2a受容体機能阻害剤においてアデノシンA2a受容体結合性抗体は、アデノシンA2a受容体のループ部分に特異的に結合しても良い。この場合、上記アデノシンA2a受容体機能阻害剤は、A2a受容体への結合特異性が高く、効率的に作用できる。
【0128】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体はマウス抗体、キメラ抗体、ヒト化抗体、ヒト抗体からなる群から選ばれる1種以上の抗体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤に含まれるアデノシンA2a受容体結合性抗体は、ヒト化されているアミノ酸配列を含むため、治療薬として使用した場合においてヒトへの免疫原性を低減させることができる。また、マウスのアミノ酸配列を含むため、マウスへ使用した場合においても免疫原性を低減させることができる。
【0129】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体は抗体断片であってもよい。この場合、上記アデノシンA2a受容体機能阻害剤に含まれるアデノシンA2a受容体結合性抗体は抗体全長より小さいため、生体に投与した場合の免疫原性を低減できる、生体に投与した場合の安定性が上昇する、または生産効率が上昇する効果が得られる。
【0130】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体はモノクローナル抗体であってもよい。この場合、上記アデノシンA2a受容体機能阻害剤に含まれるアデノシンA2a受容体結合性抗体は、アデノシンA2a受容体を高い特異性で認識するため、効率的にアデノシンA2a受容体の機能を阻害できる。
【0131】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体はアデノシンA2a受容体の野生型または変異型に結合しても良い。この場合、上記アデノシンA2a受容体機能阻害剤は、野生型とアミノ酸配列の異なるアデノシンA2a受容体へのアゴニストの結合を阻害できる。
【0132】
また、このアデノシンA2a受容体機能阻害剤においてアデノシンA2a受容体は、哺乳動物由来のA2a受容体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、哺乳動物のA2a受容体が関与するシグナル伝達等の種々の機能を阻害する効果や、哺乳動物のA2a受容体が関与する疾患の治療薬または診断薬が得られる。また、アデノシンA2a受容体機能阻害剤を治療薬等として開発する場合において、A2a受容体が関与する疾患のモデル生物に哺乳動物を採用できる。
【0133】
また、このアデノシンA2a受容体機能阻害剤においてアデノシンA2a受容体は、ヒト由来のA2a受容体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、ヒトのA2a受容体が関与するシグナル伝達等の種々の機能を阻害する効果や、ヒトのA2a受容体が関与する疾患の治療薬または診断薬が得られる。
【0134】
本発明の他の実施形態は、上記アデノシンA2a受容体機能阻害剤を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の治療薬である。この治療薬を用いれば、上記疾患の治療効果が得られる。
【0135】
また、この治療薬において疾患は哺乳動物の疾患であっても良い。この場合、上記治療薬を用いれば、哺乳動物において上記疾患の治療効果が得られる。
【0136】
本発明の他の実施形態は、上記アデノシンA2a受容体機能阻害剤を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の診断薬である。この診断薬を用いれば、上記疾患の診断効果が得られる。
【0137】
また、この診断薬において疾患は哺乳動物の疾患であっても良い。この場合、上記診断薬を用いれば、哺乳動物において上記疾患の診断効果が得られる。
【0138】
本発明の他の実施形態は、抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、配列番号1のアミノ酸配列、または配列番号1において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2のアミノ酸配列が、配列番号2のアミノ酸配列、または配列番号2において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3のアミノ酸配列が、配列番号3のアミノ酸配列、または配列番号3において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含む、抗体である。この抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0139】
また、この抗体は、抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、配列番号4のアミノ酸配列、または配列番号4において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR2のアミノ酸配列が、配列番号5のアミノ酸配列、または配列番号5において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR3のアミノ酸配列が、配列番号6のアミノ酸配列、または配列番号6において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。この場合、上記抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0140】
本発明の他の実施形態は、抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、配列番号7のアミノ酸配列、または配列番号7において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2のアミノ酸配列が、配列番号8のアミノ酸配列、または配列番号8において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3のアミノ酸配列が、配列番号9のアミノ酸配列、または配列番号9において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含む、抗体である。この抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0141】
また、この抗体は、抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、配列番号10のアミノ酸配列、または配列番号10において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR2のアミノ酸配列が、配列番号11のアミノ酸配列、または配列番号11において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR3のアミノ酸配列が、配列番号12のアミノ酸配列、または配列番号12において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。この場合、上記抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0142】
また、上記の特定のアミノ酸配列を含む抗体は、アデノシンA2a受容体結合性抗体であっても良い。この場合、上記抗体を用いれば、アデノシンA2a受容体に結合し、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0143】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体を含む、アデノシン受容体機能阻害剤である。このアデノシン受容体機能阻害剤を用いれば、A2a受容体に結合し、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0144】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の治療薬である。この治療薬を用いれば、上記疾患の治療効果が得られる。
【0145】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の診断薬である。この診断薬を用いれば、上記疾患の診断効果が得られる。
【0146】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体をコードする塩基配列を含む、ポリヌクレオチドである。この場合、上記ポリヌクレオチドを用いれば、当該技術分野で公知の方法によって、上記の特定のアミノ酸配列を含む抗体を作製できる。
【0147】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体をコードする塩基配列またはその一部を含む、ベクターである。この場合、上記ベクターを用いれば、当該技術分野で公知の方法によって、上記の特定のアミノ酸配列を含む抗体を作製できる。
【0148】
本発明の他の実施形態は、受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産される、アデノシンA2a受容体結合性抗体である。このアデノシンA2a受容体結合性抗体を用いれば、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0149】
本発明の他の実施形態は、上記のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片である。上記の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片を用いれば、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0150】
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体をスクリーニングする際に使用するリポソーム/アデノシンA2a受容体複合体であって、固相担体と、上記固相担体に結合しているリポソームと、上記リポソームに埋め込まれているアデノシンA2a受容体とを備え、上記アデノシンA2a受容体の少なくとも一部が、リポソームの外側表面に露出している、リポソーム/アデノシンA2a受容体複合体である。このリポソーム/アデノシンA2a受容体複合体を用いれば、A2a受容体の天然型の立体構造を認識するモノクローナル抗体をスクリーニングできる。
【0151】
本発明の他の実施形態は、リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程と、アデノシンA2a受容体を変性させる工程と、前工程で変性した変性型のアデノシンA2a受容体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程とを含むスクリーニング方法である。このスクリーニング方法を用いれば、A2a受容体の天然型の立体構造を認識するモノクローナル抗体をスクリーニングできる。
【実施例】
【0152】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0153】
<実施例1:免疫および抗体産生ハイブリドーマのサブクローニング>
マウスにメタノール資化酵母で組換え発現させたヒト由来A2a受容体を皮下注射することを数回繰り返し免疫応答を惹起し、抗血清価の上昇したマウスから脾臓細胞を摘出し、ミエローマ細胞と融合することで抗体産生ハイブリドーマを作成した。
【0154】
免疫原のヒト由来A2a受容体は、(i)界面活性剤で可溶化してミセルに覆われた精製標品、(ii)それを脂質2重膜に埋め込んだプロテオリポソームの形状、または(iii)エンベロープ上にA2a受容体が発現されたバキュロウィルスの形態で使用し、それぞれアンタゴニストである4-(2-[7-amino-2-(2-furyl)[1,2,4]triazolo[2,3-a][1,3,5]triazin-5-ylamino]ethyl)phenol(ZM241385)添加/非添加条件下で別個に免疫を行った。抗体価の上昇は段階希釈系列に対してELISAを行い検定した。
【0155】
<実施例2:融合細胞サブクローン株のスクリーニング>
(2−1)融合細胞サブクローン株の一次スクリーニング
サブクローン株を96穴細胞培養プレート内に分種して培養し、その培養上清に対してELISAを行い抗体産生能を確認した。このとき、A2a受容体の機能的立体構造を保持した条件で検定するために、A2a受容体精製標品を固定化して行うELISA、A2a受容体包埋リポソームを固定化して行うELASA、またはエンベロープタンパク上にA2a受容体が発現されたバキュロウィルスを固定化して行うELISA(BV ELISA)のうち1種類以上を併用した。この時点で計211の抗体産生細胞株が樹立された。
【0156】
(2−2)結果の考察
検定クローン数に対する、一次スクリーニング陽性クローン数の割合は、バキュロウィルス+精製抗原による免疫では2/1536(0.13%)、精製抗原による免疫では26/1728(1.5%)、プロテオリポソームによる免疫では183/3953(4.6%)であった。このことは、プロテオリポソームによる免疫が、ELASA(一次スクリーニング)に陽性の抗体を効率よく取得するための優れた方法であることを示唆している。
【0157】
(2−3)融合細胞サブクローン株の二次スクリーニング
一次スクリーニング後の培養上清について、以下の手法を用いて、それぞれの抗体のキャラクタリゼーションを行った。
【0158】
(2−3−1)A2a受容体-抗体結合におけるカイネティクス測定
表面プラズモン共鳴測定装置(Biacore T100;GE社)を用いた。抗マウスFc抗体が共有結合で固定化されたセンサーチップ(CM5)に該培養上清を送液したのちA2a受容体精製標品を送液することで、A2a受容体-抗体複合体がチップ表面上で形成され、次いで緩衝液を通すことでA2a受容体が脱着する。この全過程におけるレスポンス変化から複合体の形成能を確認し、形成能を有するものについてはさらに結合速度定数と解離速度定数をレスポンスカーブのカーブフィッティング(1:1結合モデル)により算出した。
ア
(2−3−2)ウエスタンブロッティング
A2a受容体 1μg をSDS-ポリアクリルアミドゲルで電気泳動し、展開されたゲルをニトロセルロース膜に転写して培養上清希釈液で一次反応を、HRP標識した抗マウスIgG抗体で二次反応を行い、変性したA2a受容体に対する抗体の結合性を調査した。
【0159】
1レーンあたり50ngのA2a受容体を電気泳動し、一次抗体溶液(抗体量が等量になるように培養上清を希釈したもの)およびHRP標識二次抗体溶液を作用させ、HRP発光試薬で検出したもの。陽性コントロールとして、市販の抗アデノシンA2a受容体抗体(Sc-32661)を用いた。
【0160】
(2−3−3)リポソームELISAとドットブロットとの比較解析
抗体の非変性状態および変性状態認識性を簡便に見分けるために、96ウェルプレートにA2a受容体包埋リポソームを固定化したELISA(リポソームELISA:図1)と、96ウェルのスロットを用いて作成されたドットブロットを並列して実施した。前者から得られるシグナルは非変性構造認識性を示し、後者から得られるシグナルは変性構造または特定の構造を持たない膜外ループ認識性であることを示す。
【0161】
ここで、A2a受容体包埋リポソームの調製例を以下に記す。まず、A2a受容体を、1%オクチルグルコシドを含むPBSにより可溶化した5μg/mlの16:0 biotinyl CAP-PEを含む1mg/mlの鶏卵由来フォスファチジルコリン溶液に最終濃度0.1mg/mlとなるように加え30分氷上で静置した。次いで1mlに対し30mgのBio-Beadsを加え、4℃で1時間撹拌する作業を2度行った。さらに1mlに対し100mgのBio-Beadsを加え1晩撹拌し、Bio-Beadsを取り除くことでビオチン化脂質含有A2a受容体再構成リポソームを作成した。加えて、再構成されたA2a受容体が天然構造を保っていることを、トリチウムラベルされたリガンドの結合活性を測定することにより確認した。
【0162】
そして、リポソームELISAに際しては、A2a受容体包埋リポソームをImmobilizer streptavidin coat plateに固定し、一次抗体として培養上清、二次抗体としてanti-mouse IgG-HRP conjugateを作用させ、HRP反応基質ABTS(Roche)の産物を405nmの吸光度で検出した。
【0163】
また、ドットブロットに際してはBio-dot(Bio-Rad)をもちいてA2a受容体溶液をニトロセルロース膜に吸引させたあと、1%SDS含有SDS溶液で変性させた。次いで一次抗体として培養上清希釈液を、二次抗体としてanti-mouse IgG-HRP conjugateをスロットから吸引させた。各ステップの前後において膜を1%BSA含有PBST溶液で洗浄し、Immobilon Western HRP substrate(Millipore)を用いたときの化学発光を、LAS-1000 plus (富士フィルム)で検出し、各ドットの面積強度を測定した。陽性コントロールとして、一次抗体としてFLAG-M2抗体(Sigma)を用い、希釈系列を作成して測定した。
【0164】
(2−3−4)エピトープ解析
A2a受容体の一次配列上8カ所存在する膜外領域のアミノ酸残基をそれぞれ置換したキメラ変異体を出芽酵母を用いて組換え発現し、その膜画分を用いてELISAあるいはウエスタンブロットのシグナル出現/消滅パターンを確認することで、抗体のA2a受容体上での結合領域を推定した。
【0165】
(2−3−5)細胞内側第三ループ変異体に対する結合性解析
上記(2−3−1)の測定中A2a受容体精製標品に代えて、A2a受容体の細胞内側第三ループに相当する配列(209-KQMESQPLPGERA-221(配列番号17))をT4リゾチーム(NIFEMLRIDEGLRLKIYKDTEGYYTIGIGHLLTKSPSLNAAKSELDKAIGRNTNGVITKDEAEKLFNQDVDAAVRGILRNAKLKPVYDSLDAVRRAALINMVFQMGETGVAGFTNSLRMLQQKRWDEAAVNLAKSRWYNQTPNRAKRVITTFRTGTWDAY(配列番号18))に置換した変異体を送液した場合のレスポンスの有無から、抗体の細胞内側第三ループ結合性を調査した。
【0166】
(2−4)結果の考察
上記(2−3−1)の結果では、抗体の解離平衡定数KDが10nM未満であり、顕著に低い値であった。このことから、本実施例で得られた抗体はA2a受容体に高い親和性を有していることがわかる。従って、この抗体を用いれば、細胞等におけるA2a受容体の存在を効率的に調べることが可能となる。
【0167】
上記(2−3−2)の結果では、ウエスタンブロッティング陽性と陰性のクローンが見られた。このうち陰性のクローンは、ウエスタンブロッティングの実験過程でA2a受容体の立体構造が崩れていたためにA2a受容体を認識できなかったと考えられる。即ち、ウエスタンブロッティング陰性の抗体はA2a受容体の立体構造を特異的に認識していることがわかる。
【0168】
また、上記(2−3−3)の結果では、リポソームELISA陽性でかつドットブロット陰性の抗体がみられた。このドットブロット陰性の抗体は、ドットブロットの実験過程でA2a受容体の立体構造が崩れていたためにA2a受容体を認識できなかったと考えられる。即ち、本実施例で得られた抗体はA2a受容体の立体構造を特異的に認識していることがわかる。立体構造を認識するということは、アミノ酸配列の一次配列のみを認識する抗体に比べて、抗体の結合特異性が高く、効率的に作用することを意味する。
【0169】
上記(2−3−4)では、A2a受容体のループ部分に結合する抗体が得られた。一般的に膜蛋白質の蛋白質N末端(やC末端)は、溶媒中において膜貫通領域に対する相対位置や方位に揺らぎが大きいことが多い。そのため、膜蛋白質のN末端領域を認識して結合する抗体は、立体構造ではなく、アミノ酸配列を認識している可能性が極めて高い。対して、本実施例で用いた抗体は、ループ部分を認識しているため、A2a受容体の立体構造を認識している可能性が高い。立体構造を認識するということは、アミノ酸配列の一次配列のみを認識する抗体に比べて、抗体の結合特異性が高く、効率的に作用することを意味する。
【0170】
また、ループ部分に結合することは、本実施例で得られた抗体をA2a受容体との共結晶化に使用する場合においても有利に働く。通常、膜蛋白質の蛋白質N末端(やC末端)に存在する親水性領域に抗体が結合したとしても、結晶中で規則的に並んだ定まった結晶格子を形成し得えず、蛋白質N末端(やC末端)近くに結合する抗体は結晶化に適さないということがいえる。従って、膜蛋白質との共結晶化に使用する抗体は、本実施例で得られた抗体のようにループ部分に対して結合特異性の高い抗体が適している。
【0171】
<実施例3:A2a受容体機能阻害活性の検定>
(3−1)A2a受容体機能阻害活性の検定
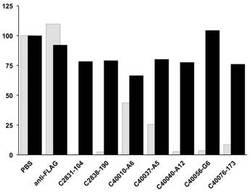
以上の諸解析において良好な特性を示したモノクローナル抗体25株を選抜し、限界希釈法によりモノクローン株が樹立された。この培養上清をそれぞれスピンカラム(Ab spin trap; GE)を用いて精製し、A2a受容体と作用させた後、トリチウム標識されたアンタゴニスト(ZM241385; Ki=3 nM)およびアゴニスト(5'-N-Ethylcarboxamideadenosine(NECA); Ki=158 nM)を添加し、リガンド結合活性に変化を及ぼし得るかどうかを測定した。その結果を、図2、図3、表1に示す。
【0172】
以上の検討より、C2831-104、C2838-190、C40010-A6、C40037-A5、C40040-A12、C40056-G6、C40076-173の7種の抗体はアゴニスト結合活性をそれぞれ100%、98%、56%、75%、97%、97%、92%抑制する活性を有することが判明した。
【0173】
なお、図2は、モノクローナル抗体によるリガンド飽和結合活性測定を表す。A2a受容体と抗体を等モル量混合した後、放射能標識したアンタゴニスト(ZM241385)およびアゴニスト(NECA)を作用させたのち、Sephadex-50(GE)を充填したスピンカラムを用いて遊離のリガンドを除去し、A2a受容体結合分のリガンドに由来する放射線カウント数をシンチレーションカウンターで測定し、リガンド結合量を算出した。非結合リガンド量、結合リガンド量、に対してプロットし、KdおよびBmaxを計算した。抗体非添加条件下は(a)(b)、抗体添加条件下は(c)(d)(e)である。
【0174】
図3は、エンドポイント測定での、得られたモノクローナル抗体によるによるリガンド飽和結合活性変化の結果である。グレーはA2a受容体へのアゴニスト結合活性(NECA)、黒はアンタゴニスト結合活性(ZM241385)を示す。これらの結合活性は以下の手順で調査した。アンタゴニストにおいては、A2a受容体および抗体を5nM混合した後、3-Hラベル化ZM241385 4nMを作用させることで、アゴニストについては、A2a受容体および抗体を20nMずつ混合した後、トリチウムラベル化NECA 200nMを作用させることで結合反応を行った。 リガンド溶液の代わりにPBSを添加したときのリガンド結合量を100%として、各抗体を用いた場合の結合活性を相対比率で表した。
【0175】
上記測定によって計算されたKdおよびBmax値を表1に記す。
【0176】
【表1】

【0177】
以上によって得られた結果の要約を表2に記す。表2のELISA応答性の判定基準は、++は1.5以上、+は0.5以上、(+)は0.2以上、-は0.2未満を表す。また、得られた7種の抗体それぞれを産生するハイブリドーマを、独立行政法人 産業技術総合研究所 特許生物寄託センター(茨城県つくば市東1-1-1 つくばセンター 中央第6)に、受領日2009年10月29日にて寄託した。受領番号は、C2831-104のハイブリドーマが受領番号FERM AP-21859、C2838-190のハイブリドーマが受領番号FERM AP-21860、C40010-A6のハイブリドーマが受領番号FERM AP-21861、C40037-A5のハイブリドーマが受領番号FERM AP-21862、C40040-A12のハイブリドーマが受領番号FERM AP-21863、C40056-G6のハイブリドーマが受領番号FERM AP-21864、C40076-173のハイブリドーマが受領番号FERM AP-21865である。
【0178】
【表2】

【0179】
(3−2)結果の考察
A2a受容体を特異的に認識する7種の抗体、およびその抗体を産生するハイブリドーマ細胞株を得た。この一群の抗体は、A2a受容体の選択的アゴニスト結合活性を顕著に抑制する新規の活性を持っている。このことは、A2a受容体およびアゴニストの相互作用が関連する各種疾患の治療薬として、上記抗体が極めて有効な材料となり得ることを示している。また、C2831-104、C2838-190、C40010-A6、C40037-A5、C40040-A12、C40076-173の抗体は、A2a受容体の選択的アンタゴニスト結合活性を抑制する活性をある程度持っている。このことは、A2a受容体およびアンタゴニストの相互作用が関連する各種疾患の治療薬として、上記抗体がある程度有効な材料となり得ることを示している。
【0180】
<実施例4:モノクローナル抗体の取得と追加評価>
(4−1)A2a受容体との複合体形成能の評価
各モノクローン株をマウスに腹腔注射し、モノクローナル抗体が量産された腹水を獲得した。獲得された抗体はFabフラグメント化し、A2a受容体との複合体形成能をゲル濾過クロマトグラフィーにより確認した。このうち1種類の抗体(C2838-190)においては、蒸気拡散法によりA2a受容体との共結晶を作成できることを確認した。
【0181】
(4−2)マウス脳切片標品への特異的結合の評価
また、C2838-190、C40010-A6の抗体について、マウス脳切片標品への特異的結合の有無を組織染色により確認した。その組織染色の結果を図4に示す。図4において、Strは線条体を示し、CCは大脳皮質を示す。また、DAPIは細胞核の特異的染色試薬である。そして、C2838-190はA2a受容体が多く発現している線条体を強く染めていることがわかる(1st Ab)。即ち、C2838-190の抗体は線条体に強く結合することが判明した。
【0182】
(4−3)抗体の遺伝子配列の解読
C2831-104およびC2838-190については、ハイブリドーマから抽出されたmRNAからcDNAを作成し、VHおよびVL領域をコードする遺伝子配列の解読を行うことにより、同領域のアミノ酸配列を決定した。
【0183】
C2831-104の抗体において重鎖可変領域であるVH領域のアミノ酸配列(配列番号13)は、EVQLQQSGAELVKPGASAKISCKASGYSFTGYNMNWVKQSRGKSLEWIGNINSYFGSTNYNQKFKGKATLTVDKSSSTAYMQLNGLTSEDSAVYYCTREGNYYDGSYVRYFDYWGQGTTLTVSSAであり、そのうち重鎖CDR1のアミノ酸配列(配列番号1)はGYNMNであり、重鎖CDR2のアミノ酸配列(配列番号2)はNINSYFGSTNYNQKFKGであり、重鎖CDR3のアミノ酸配列(配列番号3)はEGNYYDGSYVRYFDYであった。
【0184】
また、C2831-104の抗体において軽鎖可変領域であるVL領域のアミノ酸配列(配列番号14)は、DIQMTQSPASLSASVGETVTITCRASEDIYSSLAWYQQRQGKSPQLLVYATTHLADGVPSRFSGSGSGTQFSLKINSLQPEDFGNYYCQHFYGTTWTFGGGTRLEIKRAであり、そのうち軽鎖CDR1のアミノ酸配列(配列番号4)はRASEDIYSSLAであり、軽鎖CDR2のアミノ酸配列(配列番号5)はTTHLADGであり、軽鎖CDR3のアミノ酸配列(配列番号6)はQHFYGTTWTであった。
【0185】
また、C2838-190の抗体において重鎖可変領域であるVH領域のアミノ酸配列(配列番号15)は、EVQLQQSGAELVKPGSSVKISCKTSGDSFTAYNMNWVKQSHGKSLEWIGNINPYYGSTRYNQKFKGKATLTVDKSSSTAYIQLNSLTSEDSAVYYCAREGNYYDGGSVRYFDYWGQGTTLTVSSAであり、そのうち重鎖CDR1のアミノ酸配列(配列番号7)はAYNMNであり、重鎖CDR2のアミノ酸配列(配列番号8)はNINPYYGSTRYNQKFKGであり、重鎖CDR3のアミノ酸配列(配列番号9)はEGNYYDGGSVRYFDYであった。
【0186】
また、C2838-190の抗体において軽鎖可変領域であるVL領域のアミノ酸配列(配列番号16)はDIVMTQSPASLSASVGDTVTITCRASEFIYSSLTWYQQKQGGSPQLLVYAATNLADAVPSRFSGSGSGTQFSLKINRLQPEDFGTYYCQHFYGSTWAFGGGTKLEIKRAであり、そのうち軽鎖CDR1のアミノ酸配列(配列番号10)はRASEFIYSSLTであり、軽鎖CDR2のアミノ酸配列(配列番号11)はATNLADAであり、軽鎖CDR3のアミノ酸配列(配列番号12)はQHFYGSTWAFであった。
【0187】
(4−4)結果の考察
得られた抗体が線条体に強く結合したことは、本願発明の抗体が線条体におけるA2a受容体の発現様態を調査するために使用できることを表している。加えて上記(3−1)でA2a受容体の機能阻害が見られたことから、線条体においてA2a受容体の機能阻害が可能であることがわかる。線条体は、神経変性疾患において変性の見られる部位であり、神経変性疾患の治療薬や診断薬開発の重要な標的部位である。例えば、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]には、ハンチントン病のモデル動物の線条体において、A2a受容体のアゴニスト阻害作用がin vivoの治療効果を示すことが記載されている。したがって、本願発明の抗体は線条体の変性に関連するハンチントン病のような神経変性疾患の治療薬または診断薬として好適に使用できると考えられる。
【0188】
また、C2838-190およびC40010-A6の抗体間において、VH領域、重鎖CDR1、重鎖CDR2、重鎖CDR3、VL領域、軽鎖CDR1、軽鎖CDR2、または軽鎖CDR3のアミノ酸配列は高い相同性を有していた。またそれらは、C2838-190およびC40010-A6の抗体間で異なるアミノ酸残基をそれぞれ数個含んでいた。加えて、一般的に抗体においてある程度のアミノ酸残基の欠失、置換、付加等の変化は抗体の機能をほとんど損なわないことが知られている。したがって、C2838-190またはC40010-A6の抗体は、VH領域、重鎖CDR1、重鎖CDR2、重鎖CDR3、VL領域、軽鎖CDR1、軽鎖CDR2、または軽鎖CDR3にある程度の欠失、置換、付加等が生じた場合でも機能がほとんど損なわれないと考えられる。
【0189】
また、一般的に重鎖の可変領域であるVH領域が抗原に対する特異性、親和性に大きく寄与していることが知られている。例えば、リゾチームで免疫化したマウス脾臓からVH領域遺伝子を抽出増殖し、大腸菌でVH領域のみを単独で発現させたところ、その断片はVL領域がなくても顕著な抗原に対する親和性を保持していることが報告されている(Ward et al., Nature. 1989 Oct 12;341(6242):544-546.)。さらに、VH領域の中でもその構成要素である重鎖CDRが、抗原に対する特異性を決定する上で最も重要な領域であることが知られている。CDRは抗原に対する特異性を決定する領域であるため、抗体間でアミノ酸配列が大きく異なり、超可変領域ともよばれている。なお、重鎖CDRを除くVH領域はフレームワーク領域(FR)と呼ばれ、抗体間で比較的よく保存されている(Kabat et al.,「Sequence of Proteins of Immunological Interest」US Dept. Health and Human Services, 1983.)。加えて、近年ではマウス抗体のCDRのみをヒト抗体Fvに移植した、ヒト化抗体(Immunol. Today, 14, 243, 1993, Int Rev Immunol 10, 241, 1993.)が様々な研究所で作製されており、実際に抗体医薬品として製造販売されている抗体が複数存在する。このことからも、CDR領域が、抗体の機能を特徴付ける上で極めて重要な領域であることがわかる。
【0190】
したがって、同様にC2831-104およびC2838-190の抗体についても、重鎖CDRまたはCDRのアミノ酸配列によってA2a受容体に対する反応性が特徴付けられていると考えられる。
【0191】
<結果の考察>
上記の実施例1〜4によると、1)A2a受容体に高い親和性を持つ、2)A2a受容体の立体構造を認識する、3)A2a受容体のループ部分に結合する、4)A2a受容体へのアゴニスト結合を顕著に阻害する活性を持つ、または5)線条体に強く結合するアデノシンA2a受容体結合性抗体が得られた。これらの性質は、実施例1〜4で得られた抗体が、A2a受容体へのアゴニスト結合阻害活性を持つ抗体として、極めて優れていることを示している。
【0192】
A2a受容体のアゴニスト結合の阻害については、[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]や、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]において、パーキンソン病のモデル動物にin vivoで治療効果があったことが記載されている。また、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]にはハンチントン病の、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には肺腫瘍および乳房腫瘍の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。加えて、[Martinez-Mir et al., Neuroscience. 1991;42(3):697-706.]にはハンチントン病ではA2a受容体の発現量が低下していることが記載されている。
【0193】
従って、優れたA2a受容体へのアゴニスト結合阻害効果を有す、実施例1〜4で得られた抗体は、神経変性疾患(パーキンソン病、ハンチントン病等)、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーの治療薬や診断薬として顕著な効果を奏する極めて有効な抗体であると考えられる。
【0194】
また、A2a受容体はcAMPの増加(Chern et al., Mol Pharmacol. 1993 Nov;44(5):950-8.)や、MAPKの活性化(Schulte et al., Int J Biochem Cell Biol. 2003 Apr;35(4):410-4. Review.)に関与していることが知られている。ここで、MAPKの機能阻害は、胃癌や肝癌等のモデル動物にin vivoで治療効果があることが、[Yang et al., Mol Cancer Ther. 2009 Sep;8(9):2537-45. Epub 2009 Sep 1.]および[Huynh et al., Mol Cancer Ther. 2007 Sep;6(9):2468-76.]に記載されている。従って、実施例1〜4で得られた抗体は、A2a受容体の機能阻害とその結果起こるMAPKの機能阻害により、胃癌や肝癌等の治療薬や診断薬として好適に使用できると考えられる。
【0195】
また、診断薬として使用する場合は、当該技術分野において公知の手法、例えば、被験者の細胞、血液、血清、体液、または病理切片等と、標準的な細胞等において、A2a受容体への抗体の結合の様態を検査、比較することで疾患の診断が可能になると考えられる。例えば、疾患がアデノシンA2a受容体の高発現に起因しているときには、実施例1〜4で得られた抗体の結合量が増加し、リガンドの高発現に起因しているときには、リガンドと拮抗することで上記抗体の結合量が減少すると考えられる。
【0196】
その他、A2a受容体関連の基礎研究等に使用する試薬や、A2a受容体との共結晶化等においても、実施例1〜4で得られた抗体が極めて有効な材料になると考えられる。
【0197】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【技術分野】
【0001】
本発明は、アデノシンA2a受容体結合性抗体に関する。
【背景技術】
【0002】
アデノシンA2a受容体(A2a受容体)は、G蛋白質共役受容体(GPCR)に分類される7回膜貫通型の受容体である。ほ乳類の神経節、血管、血小板の細胞膜等に発現し、主に中枢神経系や循環器系において特定の細胞外リガンドを認識して、細胞内へシグナルを伝達する重要な役割を果たす。例えば、リガンドの結合によりGsの結合およびアデニル酸シクラーゼの活性化を促し、細胞内cAMPレベルを上昇させる。
【0003】
また、A2a受容体は大脳基底核中の線条体、側坐核、嗅結節のほか、免疫系細胞、心臓、肺、血管といった多くの部位で機能しており、それに対応して神経変性疾患(パーキンソン病、ハンチントン舞踏病等)、偏頭痛、睡眠障害、呼吸障害、再灌流傷害、血栓、高血圧、心虚血、腎虚血、リューマチ、各種炎症での関連性が報告されている。そのため、新規の治療薬や診断薬を創製するために重要なターゲットといえる。実際に、A2a受容体の拮抗作用を有する低分子化合物において、パーキンソン病のフェーズ3臨床試験が実施されている(非特許文献1)。
【0004】
しかし、A2a受容体を含めてGPCRは一般に細胞内において微小な発現量しか示さず、さらに組織毎に発現特異性があるため、その詳細な機能は未だ明らかになっていない。
【0005】
A2a受容体の発現および細胞内局在の研究に関しては、非特許文献2にA2a受容体のポリクローナル抗体をプローブとして利用して調査したことが記載されている。A2a受容体を含めた抗GPCR抗体作成の戦略としては、非特許文献2および3のように、部分ペプチドを化学合成したものを免疫原とする方法が広く採用されている。このことはGPCRの細胞上での発現量が抗原性を有するほど高くないこと、天然に機能する形態ではその多くが細胞膜に埋没しており抗体の接触可能な領域が少ないことに起因する。また糖鎖、脂質など多くの翻訳後修飾を受けているため、翻訳後修飾の比較的少ないC-末端側ペプチドの利用が好まれることが多く、抗アデノシンA2a受容体抗体(以下、アデノシンA2a受容体結合性抗体と記載することもある)に関しても同様に、現在入手可能な抗体のほとんどすべてがC-末ペプチドを認識する抗体である。
【0006】
C-末ペプチド以外の部分を認識している抗体としては、非特許文献4に培養細胞株で強制発現させたA2a受容体全長タンパクを免疫して得られた、モノクローナル抗体が記載されている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Kanda., Folia Pharmacol. Jpn. Vol. 131 (2008), No.4 275-80
【非特許文献2】Lynge et al., Acta Physiol Scand. 2000 Aug;169(4):283-90.
【非特許文献3】Karoor et al., J Biol Chem. 1998 Dec 4;273(49):33035-41.
【非特許文献4】Rosin et al., J Comp Neurol. 1998 Nov 16;401(2):163-86.
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
非特許文献1には、A2a受容体への拮抗作用を持つ低分子化合物が記載されているが、A2a受容体への拮抗作用を持つ抗体は記載されていない。一般的に低分子化合物はターゲットへの結合特異性において抗体に劣る。また、低分子化合物はヒトや動物に投与したときに副作用をひき起こす恐れがある。一方、抗体はターゲットへの結合特異性に優れており、組換えDNA技術等により適切に設計すれば副作用が少ない。また、低分子化合物と抗体では作用機序が異なるために、それぞれの奏する効果は異なると考えられる。さらに、抗体であれば、診断薬や研究用の試薬等に容易に応用できる。そのため、抗体を用いたA2a受容体への拮抗剤が必要であった。
【0009】
非特許文献2では、抗アデノシンA2a受容体抗体が記載されているが、ペプチドを免疫原とすることから、獲得される抗アデノシンA2a受容体抗体のエピトープは、A2a受容体の一次配列によって規定されるもの(リニアエピトープ)となる。これはA2a受容体の天然構造と変性構造を区別なく認識する性質を有するということであり、必ずしも生体細胞膜に発現するA2a受容体について普遍的かつ効率的に認識できるものではなかった。また、非特許文献4は、A2a受容体全長タンパクを免疫して得られているが、リニアエピトープ性の抗体であり、天然のA2a受容体と効率的に反応できる抗体ではなかった。
【0010】
従って、より効率よくA2a受容体と反応する抗アデノシンA2a受容体抗体を取得する必要があった。効率良く反応する抗アデノシンA2a受容体抗体が得られれば、治療薬、診断薬、研究試薬等の開発コストを抑えることができる。また、抗アデノシンA2a受容体抗体を用いた各種研究の精度が向上し、治療薬等の開発成功率および開発スピードの上昇につながる。加えて、治療薬の開発においては被験者の体力的な負担を軽減できる。
【0011】
さらに、上記文献記載の抗アデノシンA2a受容体抗体においては、A2a受容体の機能阻害活性について何ら記載されていない。A2a受容体は、種々の疾患に関与している蛋白質であるため、A2a受容体の機能を阻害する抗体は、A2a受容体の関与する疾患において極めて優れた治療薬となりうる。このことは、診断薬、研究試薬など他の用途においても同様であり、A2a受容体の機能を阻害する抗体は優れた診断薬、研究試薬となりうる。従って、新規の治療薬等を開発するために、A2a受容体の機能を阻害する抗アデノシンA2a受容体抗体を取得する必要があった。
【0012】
本発明は上記事情に鑑みてなされたものであり、A2a受容体と効率的に反応できる抗アデノシンA2a受容体抗体を提供することを目的とする。また、本発明の別の目的は、アデノシンA2a受容体の機能を阻害する効果を有す抗アデノシンA2a受容体抗体を提供することである。
【課題を解決するための手段】
【0013】
本発明によれば、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤が提供される。
【0014】
このアデノシンA2a受容体機能阻害剤は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体を含む。また、アデノシンA2a受容体の立体構造を認識するアデノシンA2a受容体結合性抗体を含む。そのため、このアデノシンA2a受容体機能阻害剤によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0015】
また、本発明によれば、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬が提供される。
【0016】
この治療薬は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体を含む。アデノシンA2a受容体へのアゴニスト阻害作用は、in vivoで神経変性疾患の疾患モデル動物に治療効果を発揮することが[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]に記載されている。また、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には癌の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。そのため、この治療薬によると、上記疾患の治療効果が得られる。
【0017】
また、本発明によれば、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、診断薬が提供される。
【0018】
この診断薬は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体を含む。ここで、上述の通り、アデノシンA2a受容体へのアゴニスト阻害作用は、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーのモデル動物にin vivoで治療効果があったことが文献に記載されている。そのため、この診断薬を用いて、さらに当該技術分野で公知の診断手法を利用すれば、上記疾患の診断が可能になる
【0019】
本発明によれば、重鎖CDR1が配列番号1のアミノ酸配列を含み、重鎖CDR2が配列番号2のアミノ酸配列を含み、重鎖CDR3が配列番号3のアミノ酸配列を含む抗体が提供される。
【0020】
この抗体は、後述する実施例で、アデノシンA2a受容体の立体構造を認識して結合することが実証されている。また、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されている。そのため、この抗体によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0021】
また、この抗体を含む、アデノシンA2a受容体結合性抗体またはアデノシンA2a受容体機能阻害剤が提供される。または、この抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬もしくは診断薬が提供される。これらは、後述する実施例で、アデノシンA2a受容体への結合すること、または顕著なアゴニスト阻害作用を奏することが実証されている抗体を含む。加えて、上述のとおり、アデノシンA2a受容体へのアゴニスト阻害作用は、上記疾患のモデル動物にin vivoで治療効果があったことが文献に記載されている。そのため、この抗体によると、アデノシンA2a受容体結合性抗体、アデノシンA2a受容体の機能阻害効果、上記疾患の治療効果、または上記疾患の診断効果が得られる。
【0022】
また、この抗体をコードする塩基配列を含む、ポリヌクレオチドが提供される。このポリヌクレオチドは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列含む。また、アデノシンA2a受容体の立体構造を認識するアデノシンA2a受容体結合性抗体をコードする塩基配列含む。そのため、このポリヌクレオチドに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0023】
また、この抗体をコードする塩基配列またはその一部を含む、ベクターが提供される。このベクターは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列、またはその一部を含む。また、アデノシンA2a受容体の立体構造を認識するアデノシンA2a受容体結合性抗体をコードする塩基配列、またはその一部含む。そのため、このベクターに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0024】
なお、重鎖CDR1が、配列番号1において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2が、配列番号2において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3が、配列番号3において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含むアミノ酸配列であっても、当業者であれば当然同様の作用効果が得られることが容易に想定できる。
【0025】
本発明によれば、重鎖CDR1が配列番号7のアミノ酸配列を含み、重鎖CDR2が配列番号8のアミノ酸配列を含み、重鎖CDR3が配列番号9のアミノ酸配列を含む抗体が提供される。
【0026】
この抗体は、後述する実施例で、アデノシンA2a受容体の立体構造を認識して結合することが実証されている。また、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されている。そのため、この抗体によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0027】
また、この抗体を含む、アデノシンA2a受容体結合性抗体またはアデノシンA2a受容体機能阻害剤が提供される。または、この抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬もしくは診断薬が提供される。これらは、後述する実施例で、アデノシンA2a受容体への結合すること、または顕著なアゴニスト阻害作用を奏することが実証されている抗体を含む。加えて、上述の通り、アデノシンA2a受容体へのアゴニスト阻害作用は、上記疾患のモデル動物にin vivoで治療効果があったことが文献に記載されている。そのため、この抗体によると、アデノシンA2a受容体結合性抗体、アデノシンA2a受容体の機能阻害効果、上記疾患の治療効果、または上記疾患の診断効果が得られる。
【0028】
また、この抗体をコードする塩基配列を含む、ポリヌクレオチドが提供される。このポリヌクレオチドは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏すること、またはアデノシンA2a受容体の立体構造を認識することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列含む。そのため、このポリヌクレオチドに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0029】
また、この抗体をコードする塩基配列またはその一部を含む、ベクターが提供される。このベクターは、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏すること、またはアデノシンA2a受容体の立体構造を認識することが実証されているアデノシンA2a受容体結合性抗体をコードする塩基配列、またはその一部を含む。そのため、このベクターに基づいて作製した抗体から、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0030】
なお、重鎖CDR1が、配列番号7において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2が、配列番号8において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3が、配列番号9において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含むアミノ酸配列であっても、当業者であれば当然同様の作用効果が得られることが容易に想定できる。
【0031】
本発明によれば、受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体が提供される。
【0032】
このアデノシンA2a受容体結合性抗体は、後述する実施例で、アデノシンA2a受容体への顕著なアゴニスト阻害作用を奏することが実証されている。また、アデノシンA2a受容体の立体構造を認識することが実証されている。そのため、このアデノシンA2a受容体結合性抗体によると、アデノシンA2a受容体の機能を効率的に、また著しく阻害する効果が得られる。
【0033】
本発明によれば、固相担体と、上記固相担体に結合しているリポソームと、上記リポソームに埋め込まれているアデノシンA2a受容体とを備え、上記アデノシンA2a受容体の少なくとも一部が、リポソームの外側表面に露出している、アデノシンA2a受容体結合性抗体をスクリーニングする際に使用するリポソーム/アデノシンA2a受容体複合体が提供される。
【0034】
このリポソーム/アデノシンA2a受容体複合体は、後述する実施例で、アデノシンA2a受容体の立体構造を認識する抗体、またはアデノシンA2a受容体のループ部分の立体構造を認識する抗体をスクリーニングする際に使用できることが実証されている。そのため、このリポソーム/アデノシンA2a受容体複合体によると、アデノシンA2a受容体への結合特異性が高い抗体を好適にスクリーニングできる。
【0035】
本発明によれば、リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程と、アデノシンA2a受容体を変性させる工程と、前工程で変性した変性型のアデノシンA2a受容体に被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程とを含む、アデノシンA2a受容体結合性抗体のスクリーニング方法が提供される。
【0036】
このスクリーニング方法によると、後述する実施例で、アデノシンA2a受容体の立体構造を認識する抗体、またはアデノシンA2a受容体のループ部分の立体構造を認識する抗体をスクリーニングできることが実証されている。そのため、スクリーニング方法によると、アデノシンA2a受容体への結合特異性が高い抗体を好適にスクリーニングできる。
【発明の効果】
【0037】
本発明によれば、アデノシンA2a受容体への結合性に優れた抗体、またはアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤が得られる。または、特定のアミノ酸配列のCDRを有するため、アデノシンA2a受容体への結合性に優れた抗体、もしくは顕著なアデノシンA2a受容体機能阻害活性を有す抗体が得られる。または、特定のハイブリドーマにより生産されるため、アデノシンA2a受容体への結合性に優れた抗体、または顕著なアデノシンA2a受容体機能阻害活性を有す抗体が得られる。
【図面の簡単な説明】
【0038】
【図1】図1はリポソーム-ELISA法の概念図である。
【図2】図2はアデノシンA2a受容体結合性抗体によるリガンド飽和結合活性変化の結果である。
【図3】図3はエンドポイント測定での、アデノシンA2a受容体結合性抗体によるリガンド飽和結合活性変化の結果である。
【図4】図4はC2838-190およびC40010-A6の抗体をプローブとして用いた、マウス脳切片の免疫染色の結果である。
【発明を実施するための最良の形態】
【0039】
<発明の経緯>
本願発明者らは、治療薬、診断薬、または研究試薬(材料)の開発のために、A2aの機能解析や、抗アデノシンA2a受容体抗体の作用効果や機能性の向上を目指した研究を行っている。
【0040】
A2a受容体はG蛋白質共役受容体(GPCR)に分類される受容体である。GPCRは、シグナル情報を細胞内に伝える際に、G蛋白質と呼ばれる三量体蛋白質を介してシグナル伝達を行う受容体の総称であり、現在の基礎研究、創薬研究において最も注目されている蛋白質群であるといえる。しかしながら、その必要性とは裏腹に、ヒト由来のGPCRはマウスの免疫反応を引き起こし難く、良好なモノクローナル抗体の作成は難しいことが知られており、抗GPCR抗体の研究開発は極めて困難である。
【0041】
そのような中、本願発明者らは様々な手法を検討し、天然状態を損なわないようにして分離調製された組換えA2a受容体を抗原として免疫を開始することで、抗体価の上昇した中途クローンを多数得ることに成功した。さらにリポソームELISA等、各種キャラクタリゼーションを実施することにより、上記クローンが産生する抗体の多くが、従来の抗アデノシンA2a受容体抗体にはみられない新規な機能性を有することを確認した。新規な機能性とは、A2a受容体の機能性立体構造に対する選択的な結合性、高い親和性(解離平衡定数 KD=10nM 未満)、またはエピトープが末端ペプチド配列のみに制限されないことなどである。
【0042】
さらに、得られた細胞のうち25種についてモノクローナル抗体産生株を樹立し、A2a受容体のリガンド結合活性を測定すると、驚くべきことに、アゴニスト(NECA)の結合を著しく抑える機能性抗体が得られていることが判明し、本発明を完成した。
【0043】
<用語の説明>
本明細書および特許明細書の範囲において、各種用語の意味を以下の通り定義する。
【0044】
(1)アデノシンA2a受容体(A2a受容体、adenosine A2a receptor)
アデノシンA2a受容体(本明細書中ではA2a受容体と記載することもある)は、G蛋白質共役受容体(GPCR)に分類される7回膜貫通型の受容体である。ほ乳類の神経節、血管、血小板の細胞膜等に発現し、主に中枢神経系や循環器系において特定の細胞外リガンドを認識して、細胞内へシグナルを伝達する重要な役割を果たす。例えば、リガンドの結合によりGsの結合およびアデニル酸シクラーゼの活性化を促し、細胞内cAMPレベルを上昇させる。代表的なリガンドにはアデノシンが挙げられる。
【0045】
(2)重鎖
重鎖は抗体の主な構成要素であり、典型的には、軽鎖とジスルフィド結合および非共有結合によって結合している。重鎖のN末端側のドメインには、同種の同一クラスの抗体でもアミノ酸配列が一定しない可変領域(VH)と呼ばれる領域が存在し、一般的に、VHが抗原に対する特異性、親和性に最も大きく寄与していることが知られている。例えば、リゾチームで免疫化したマウス脾臓からVH遺伝子を抽出増殖し、大腸菌でVHのみを単独で発現させたところ、その断片は顕著な抗原に対する親和性を保持していることが報告されている(Ward et al., Nature. 1989 Oct 12;341(6242):544-546.)。さらには、ラクダの抗体の中には、軽鎖を持たない重鎖の2量体として存在している分子種が存在していることが報告されている(Wolfson W, Chem Biol. 2006 Dec;13(12):1243-1244.)。
【0046】
(3)CDR(相補性決定領域、complementarity determining region)
CDRは、抗体分子のFv(可変領域。重鎖のV領域(VH)と軽鎖のV領域(VL)とから構成されている)上で、実際に抗原に直接接触して結合部位を形成している領域であり、重鎖と軽鎖に、それぞれ約5〜10アミノ酸残基からなるCDR1、CDR2、CDR3が存在する。一般的にはCDR3が結合における寄与が最も高い。CDRは、抗原に対する特異性を決定する領域であるため、抗体間でアミノ酸配列が大きく異なり、超可変領域ともよばれている。それ以外のFv領域はフレームワーク領域(FR)と呼ばれ、FR1、FR2、FR3およびFR4からなり、抗体間で比較的よく保存されている(Kabat et al.,「Sequence of Proteins of Immunological Interest」US Dept. Health and Human Services, 1983.)。
【0047】
以下、本発明の実施の形態について、詳細に説明する。なお、同様な内容については、
繰り返しの煩雑を避けるために、適宜説明を省略する。
【0048】
<実施形態1:アデノシンA2a受容体結合性抗体>
本実施形態に係るアデノシンA2a受容体結合性抗体は、後述する実施例で、アデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている。また、アデノシンA2a受容体の立体構造を認識することが実証されている。3次元である立体構造を認識するということは、1次元であるアミノ酸配列のみを認識するよりも特異的に結合することであり、効率的に作用することを表す。そのため、A2a受容体の関与するシグナル伝達等の種々の機能、例えば、cAMPの増加(Chern et al., Mol Pharmacol. 1993 Nov;44(5):950-8.)や、MAPKの活性化(Schulte et al., Int J Biochem Cell Biol. 2003 Apr;35(4):410-4. Review.)などを効率的に、また著しく阻害すると考えられる。ここで、MAPKの機能阻害は、胃癌や肝癌等のモデル動物にin vivoで治療効果があることが、[Yang et al., Mol Cancer Ther. 2009 Sep;8(9):2537-45. Epub 2009 Sep 1.]および[Huynh et al., Mol Cancer Ther. 2007 Sep;6(9):2468-76.]に記載されている。即ち、このアデノシンA2a受容体結合性抗体は、MAPKのようなA2aと連関するシグナル伝達分子の機能阻害を通して、各種疾患の治療や予防に効果を発揮できると考えられる。
【0049】
ここで、アデノシンA2a受容体結合性抗体によるA2a受容体の機能阻害は、アゴニスト阻害、またはアンタゴニスト阻害を含むが、アゴニスト阻害であることが好ましい。なぜならば、後述の実施例において、アンタゴニスト阻害よりもアゴニスト阻害活性が強いことが示されているからである。また、アデノシンA2a受容体へのアゴニスト阻害作用は、in vivoで種々の疾患の疾患モデル動物に治療効果を発揮することが知られているため、各種疾患の治療、診断に有用だからである。例えば、in vivoで神経変性疾患の疾患モデル動物に治療効果を発揮することが[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]に記載されている。また、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には肺腫瘍および乳房腫瘍の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。このことは、アゴニスト阻害作用を有すアデノシンA2a受容体結合性抗体においても同様に期待でき、上記アデノシンA2a受容体結合性抗体は、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーの疾患の治療薬、診断薬に好適に使用できると考えられる。
【0050】
本明細書において、「アゴニスト」とは、受容体と結合して生理作用を発現する物質のことを示す。
【0051】
また、このアデノシンA2a受容体結合性抗体は、後述する実施例で、解離平衡定数KDが10nM未満であることが実証されているため、A2a受容体に高い親和性を有している抗体である。そのため、このアデノシンA2a受容体結合性抗体は、治療薬、診断薬、研究試薬等の各種用途において優れた効果を発揮すると考えられる。
【0052】
また、アデノシンA2a受容体結合性抗体のA2a受容体への結合部位は、N末端、C末端、ループ部分、または細胞膜内部分などを含む。一般的に膜蛋白質の蛋白質N末端(やC末端)は、溶媒中において膜貫通領域に対する相対位置や方位に揺らぎが大きいことが多い。そのため、膜蛋白質のN末端領域を認識して結合する抗体は、立体構造ではなく、アミノ酸配列を認識している可能性が極めて高い。対して、ループ部分を認識する抗体は、A2a受容体の立体構造を認識している可能性が高い。立体構造を認識するということは、アミノ酸配列のみを認識する抗体に比べて、抗体の結合特異性が高く、効率的に作用することを意味する。
【0053】
また、ループ部分に結合することは、抗体をA2a受容体との共結晶化に使用する場合においても有利に働く。通常、膜蛋白質の蛋白質N末端(やC末端)に存在する親水性領域に抗体が結合したとしても、結晶中で規則的に並んだ定まった結晶格子を形成し得えず、蛋白質N末端(やC末端)近くに結合する抗体は結晶化に適さないということがいえる。従って、膜蛋白質との共結晶化に使用する抗体は、本実施例で得られた抗体のようにループ部分に対して結合特異性の高い抗体が適している。従って、アデノシンA2a受容体結合性抗体のA2a受容体への結合部位は、A2a受容体のループ部分であることが特に好ましい。
【0054】
本明細書において、「膜蛋白質のループ部分」とは、膜蛋白質内に存在する2つの膜貫通領域間をつなぐ領域のことで、かつ、膜に埋もれていない領域のことを表す。
【0055】
本明細書において「結合する」とは、物質間の連結を意味する。連結は共有結合また
は非共有結合のいずれであってもよく、たとえば、イオン結合、水素結合、疎水性相互作
用、または親水性相互作用が挙げられる。
【0056】
ここで、アデノシンA2a受容体結合性抗体が結合するA2a受容体は、種が異なる複数種類の哺乳動物由来のA2a受容体を含む。種が異なる複数種類の哺乳動物は、好ましくは、マウス、ラット、ウサギ、ブタ、ヒツジ、ウシ、ウマ、ネコ、イヌ、サル、およびチンパンジーのいずれか1種以上、およびヒトである。なぜならば、ヒトの疾患の治療薬や診断薬の開発を行う際に、マウス、ラット、ウサギ、ブタ、ヒツジ、ウシ、ウマ、ネコ、イヌ、サル、またはチンパンジーが典型的な疾患モデル動物として使用できる哺乳類であるためである。また、該哺乳動物は、より好ましくはマウス、ラット、サル、およびチンパンジーのいずれか1種以上、およびヒトである。なぜならば、マウス、ラット、サル、およびチンパンジーは、世界中で研究用のモデル動物として汎用され多くの特性が明らかになっているためである。その中でも、マウスは遺伝的背景が明らかになっている系統が多く、また世代あたりの時間が短いという特性を持ち、さらにはヒトの疾患と類似の疾患を発症しやすいために好ましい。
【0057】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体結合性抗体をコードするポリヌクレオチド、アデノシンA2a受容体結合性抗体をコードする塩基配列を含むベクター、またはアデノシンA2a受容体結合性抗体をコードする塩基配列の一部を含むベクターのいずれかを導入された、ヒトや他の哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)の細胞から生産した組換え蛋白質であってもよい。哺乳動物細胞としては、例えば、サル細胞COS-7、Vero、チャイニーズハムスター細胞CHO(CHO細胞)、dhfr遺伝子欠損チャイニーズハムスター細胞CHO(CHO(dhfr)細胞)、マウスL細胞,マウスAtT-20、マウスミエローマ細胞、ラットGH3、ヒトFL細胞、ヒトHEK293細胞などが挙げられる。または、Escherichia属菌、Bacillus属菌、酵母、鳥類細胞、または昆虫細胞から生産した組換え蛋白質であってもよい。最も取り扱いが容易で、コストが低く抑えられることから、生産に使用する細胞としてはEscherichia属菌が好ましい。
【0058】
また、上記のベクターは、大腸菌由来のプラスミド(例、pBR322、pBR325、pUC12、pUC13)、枯草菌由来のプラスミド(例、pUB110、pTP5、pC194)、酵母由来プラスミド(例、pSH19、pSH15)、λファージなどのバクテリオファージ、レトロウイルス、ワクシニアウイルス、バキュロウイルスなどの動物ウイルスなどの他、pA1-11、pXT1、pRc/CMV、pRc/RSV、pcDNAI/Neoなどを用いることができる。
【0059】
また、上記のポリヌクレオチドまたはベクターの細胞への導入と抗体の生産は、当該技術分野で公知の方法に従って行うことができる。ポリヌクレオチドまたはベクターの細胞への導入方法として例えば、リン酸カルシウム法、リポフェクション法、エレクトロポレーション法、アデノウイルスによる方法、レトロウイルスによる方法、またはマイクロインジェクションなどを使用できる[改訂第4版 新 遺伝子工学ハンドブック, 羊土社(2003):152-179.]。抗体の細胞を用いた生産方法としては、例えば、[タンパク質実験ハンドブック,羊土社(2003):128-142.]、[Shimamoto et al., Biologicals. 2005 Sep;33(3):169-174.]に記載の方法を使用できる。なお、アデノシンA2a受容体結合性抗体は、化学合成もしくは無細胞翻訳系で合成された蛋白質であってもよい。
【0060】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体結合性抗体を産生する細胞から、当該技術分野において公知の方法を用いて精製することができる。抗体の精製方法は、例えば、硫酸アンモニウムまたはエタノール沈殿、プロテインA、プロテインG、ゲルろ過クロマトグラフィー、陰イオンまたは陽イオン交換クロマトグラフィー、ホスホセルロースクロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィー、ヒドロキシルアパタイトクロマトグラフィー、およびレクチンクロマトグラフィーなどを用いて達成され得る(タンパク質実験ハンドブック, 羊土社(2003):27-52.)。
【0061】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体の野生型または変異型に結合する抗体を含む。ここで、変異型とは、個体間のDNA配列の差異に起因するものを含む。また、アデノシンA2a受容体結合性抗体は野生型であることが好ましいが、変異型の場合は野生型に対し、好ましくは80%の相同性を有し、より好ましくは90%の相同性を有し、特に95%の相同性を有していることが好ましい。なぜならば、野生型に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例において、アデノシンA2a受容体結合性抗体によってアゴニストとの結合が阻害されることが実証されている、アデノシンA2a受容体に近い機能が得られるためである。
【0062】
本明細書において「相同性」とは、2つ、もしくは複数間のアミノ酸配列の同一のアミノ酸数の割合を、当該技術分野で公知の方法に従って算定したものである。割合を算定する前には、比較するアミノ酸配列群のアミノ酸配列を整列させ、同一の割合を最大にするために必要である場合はアミノ酸配列の一部に間隙を導入する。また、いかなる保存的置換も同一と考えない。また、最適に整列した状態において、オーバーラップするアミノ酸を含めた全アミノ酸残基に対する、同一のアミノ酸数の割合を意味する。整列のための方法、割合の算定方法、およびそれらに関連するコンピュータプログラムは、当該技術分野で従来からよく知られており、一般的な配列分析プログラム(例えば、GENETYX、GeneChip Sequence Analysisなど)を使用して測定することができる。
【0063】
なお、A2a受容体のDNA配列およびアミノ酸配列は公知である。例えば、National Center for Biotechnology Information(NCBI)のデータベースから入手できる。
【0064】
また、アデノシンA2a受容体結合性抗体は、重鎖CDR1が配列番号1のアミノ酸配列を含み、重鎖CDR2が配列番号2のアミノ酸配列を含み、重鎖CDR3が配列番号3のアミノ酸配列を含む抗体を含む。ここで、重鎖CDR1のアミノ酸配列は、配列番号1に対して1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、重鎖CDR2のアミノ酸配列は、配列番号2に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、重鎖CDR3のアミノ酸配列は、配列番号3に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1または2個は、好ましくは1個である。また、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、重鎖CDR1、2、および3が、それぞれ配列番号1、2、および3に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、重鎖CDR1が配列番号1のアミノ酸配列を含み、重鎖CDR2が配列番号2のアミノ酸配列を含み、重鎖CDR3が配列番号3のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0065】
また、アデノシンA2a受容体結合性抗体は、軽鎖CDR1が配列番号4のアミノ酸配列を含み、軽鎖CDR2が配列番号5のアミノ酸配列を含み、軽鎖CDR3が配列番号6のアミノ酸配列を含む抗体を含む。ここで、軽鎖CDR1のアミノ酸配列は、配列番号4に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、軽鎖CDR2のアミノ酸配列は、配列番号5に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、軽鎖CDR3のアミノ酸配列は、配列番号6に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、軽鎖CDR1、2、および3が、それぞれ配列番号4、5、および6に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、軽鎖CDR1が配列番号4のアミノ酸配列を含み、軽鎖CDR2が配列番号5のアミノ酸配列を含み、軽鎖CDR3が配列番号6のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0066】
また、アデノシンA2a受容体結合性抗体は、重鎖CDR1が配列番号7のアミノ酸配列を含み、重鎖CDR2が配列番号8のアミノ酸配列を含み、重鎖CDR3が配列番号9のアミノ酸配列を含む抗体を含む。ここで、重鎖CDR1のアミノ酸配列は、配列番号7に対して1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、重鎖CDR2のアミノ酸配列は、配列番号8に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、重鎖CDR3のアミノ酸配列は、配列番号9に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1または2個は、好ましくは1個である。また、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、重鎖CDR1、2、および3が、それぞれ配列番号7、8、および9に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、重鎖CDR1が配列番号7のアミノ酸配列を含み、重鎖CDR2が配列番号8のアミノ酸配列を含み、重鎖CDR3が配列番号9のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0067】
また、アデノシンA2a受容体結合性抗体は、軽鎖CDR1が配列番号10のアミノ酸配列を含み、軽鎖CDR2が配列番号11のアミノ酸配列を含み、軽鎖CDR3が配列番号12のアミノ酸配列を含む抗体を含む。ここで、軽鎖CDR1のアミノ酸配列は、配列番号10に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。また、軽鎖CDR2のアミノ酸配列は、配列番号11に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良く、軽鎖CDR3のアミノ酸配列は、配列番号12に対して1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。このとき、上記1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、軽鎖CDR1、2、および3が、それぞれ配列番号10、11、および12に対してより相同性の高いアミノ酸配列を含んでいれば、後述する実施例でアデノシンA2a受容体への顕著な機能阻害作用を奏することが実証されている、軽鎖CDR1が配列番号10のアミノ酸配列を含み、軽鎖CDR2が配列番号11のアミノ酸配列を含み、軽鎖CDR3が配列番号12のアミノ酸配列を含む抗体に対して、より近い機能が得られるためである。
【0068】
また、アデノシンA2a受容体結合性抗体は、受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体を含む。さらに、アデノシンA2a受容体結合性抗体は、上記いずれかのハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片であっても良い。
【0069】
また、アデノシンA2a受容体結合性抗体のスクリーニングには、リポソーム/A2a受容体複合体を用いることができる。このリポソーム/A2a受容体複合体は、固相担体と、上記固相担体に結合しているリポソームと、上記リポソームに埋め込まれているA2a受容体と、を備え、上記膜蛋白質の少なくとも一部が、リポソームの外側表面に露出しているリポソーム/アデノシンA2a受容体複合体である。このリポソーム/A2a受容体複合体を用いてリポソーム-ELISA法を行えば、A2a受容体の天然型の立体構造を認識するモノクローナル抗体をスクリーニングできる効果がある。なぜならば、リポソーム中でA2a受容体は天然型の立体構造を保っていると考えられるため、スクリーニングの過程で被検抗体がA2a受容体の天然型の立体構造に接触しやすく、その結果天然型の立体構造を認識する抗体が得られる可能性が高いと考えられるためである。また、さらに変性ドットブロッティング法のようなA2a受容体の変性を伴う検出操作を行い比較することにより、より高い精度でスクリーニングできると考えられる。
【0070】
なお、リポソーム-ELISA法とは、一般的なELISA法(Enzyme-Linked ImmunoSorbent Assay)の原理を応用し、リポソーム/膜蛋白質複合体を固相担体に固定し、該膜蛋白質に反応する非検化合物をスクリーニングする方法である。概念図を図1に示す。アデノシンA2a受容体結合性抗体のスクリーニングにおいては、リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程と、アデノシンA2a受容体を変性させる工程と、前工程で変性した変性型のアデノシンA2a受容体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程とを含む方法でスクリーニングできる。
【0071】
本明細書において抗体は、抗原上の特定のエピトープに特異的に結合することができる分子を指し、ポリクローナル抗体、モノクローナル抗体を含む。また、抗体は様々な形態で存在することができ、例えば、Fv、Fab、F(ab’)2、Fab’、diabody、一本鎖抗体(例えば、scFv、dsFv)、CDRを含むペプチド、多価特異的抗体(例えば、二価特異的抗体)、キメラ抗体、ヒト化抗体、またはヒト抗体などが挙げられる。また、既存の化学合成医薬品原体または医薬品製剤に結合した低分子抗体、もしくは糖鎖改変抗体の形態であってもよい。なお、抗体は、治療薬として使用する際に免疫原性を低減させるために、ヒト由来のアミノ酸配列の割合が多いことが好ましい。つまり、抗体は、好ましくはヒトとのキメラ抗体であり、より好ましくはヒト化抗体であり、最も好ましくはヒト抗体である。また、抗体は、治療薬として使用する際に免疫原性を低減させるために、または安定性を高めるために、所望の機能を有している限り、より低分子であることが好ましい。さらには、抗体は、所望の効果を持つ限り、RNAもしくはDNAを含む核酸アプタマーに置き換えても良い。
【0072】
本明細書においてポリクローナル抗体は、例えば、抗原に特異的なポリクローナル抗体を含む血清の産生を誘導するために、哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)や鳥類等に、目的の抗原を含む免疫原を投与することによって抗体を生成することが可能である。免疫原の投与は、1つ以上の免疫剤、および所望の場合にはアジュバントの注入を必要とすることもある。アジュバントは、免疫応答を増加させるために使用されることもあり、フロイントアジュバント(完全または不完全)、ミネラルゲル(水酸化アルミニウム等)、界面活性物質(リゾレシチン、プルロニックポリオール、ポリアニオン、ペプチド、油乳剤、キーホールリンペットヘモシアニン、ジニトロフェノール等)、または潜在的に有用なヒトアジュバント(カルメット−ゲラン桿菌(BCG)またはコリネバクテリウムパルバム)を含む。その他、MPL-TDMアジュバント(モノホスホリルリピドA、合成トレハロースジコリノミコレート)を含む。免疫プロトコルは、当該技術分野で公知であり、選択する動物宿主に伴い、免疫応答を誘発する任意の方法によって実施される場合がある[タンパク質実験ハンドブック, 羊土社(2003):86-91.]。
【0073】
本明細書においてモノクローナル抗体は、実質的に均一な抗体の集団から得られる抗体を指す。すなわち、集団を構成する個々の抗体が、少量存在しうる自然に生じることが可能な突然変異を除いて、同一である。モノクローナル抗体は高度に特異的であり、一つの抗原部位に対応する。さらに、異なるエピトープ(抗原決定基)に対応する異なる抗体を典型的に含む、通常のポリクローナル抗体とは異なり、各モノクローナル抗体は抗原の単一のエピトープに対応する。その特異性に加えて、モノクローナル抗体は、他の免疫グロブリンによって汚染されていないハイブリドーマ培養から合成される点で有用である。「モノクローナル」という形容は、実質的に均一な抗体集団から得られたという抗体の特徴を示し、抗体を何か特定の方法で生産しなければならないことを意味するものではない。例えば、本明細書におけるモノクローナル抗体は、[Kohler G, Milstein C., Nature. 1975 Aug 7;256(5517):495-497.]に掲載されているようなハイブリドーマ法と同様の方法によって作ることができる。あるいは、本発明で使用されるモノクローナル抗体は、米国特許第4816567号に記載されているような組換え法と同様の方法によって作ることができる。または、本明細書におけるモノクローナル抗体は、[Clackson et al., Nature. 1991 Aug 15;352(6336):624-628.]または[Marks et al., J Mol Biol. 1991 Dec 5;222(3):581-597.]に記載されているような技術と同様の方法を用いてファージ抗体ライブラリから単離してもよい。または、[タンパク質実験ハンドブック, 羊土社(2003):92-96.]に掲載されている一般的な生産方法によって作ることができる。なお、本明細書におけるモノクローナル抗体は、後述する実施例に記載の方法で作製することが好ましい。
【0074】
なお、Fvは、完全な抗原認識及び結合部位を含む抗体フラグメントである。この領域は、密接な非共有結合による1つの重鎖および1つの軽鎖可変ドメインの二量体からなる。この配置において、各可変ドメインの3つのCDRは相互に作用してVH-VL二量体の表面に抗原結合部位を形成する。そして、6つのCDRが抗体に抗原結合特異性を付与する。なお、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のFvをコードするDNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該ベクターを原核生物あるいは真核生物へ導入することにより発現させ、Fvを生産することができる。
【0075】
また、Fabは、IgGを蛋白質分解酵素パパインで処理して得られる断片のうち、H鎖のN末端側約半分とL鎖全体がジスルフィド結合で結合した、抗原結合活性を有する抗体断片である。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体を蛋白質分解酵素パパインで処理して得ることができる。または、アデノシンA2a受容体結合性抗体のFabをコードするDNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該ベクターを原核生物あるいは真核生物へ導入することにより発現させ、Fabを生産することができる。
【0076】
また、F(ab’)2は、IgGを蛋白質分解酵素ペプシンで処理して得られる断片のうち、Fabがヒンジ領域のジスルフィド結合を介して結合されたものよりやや大きい、抗原結合活性を有する抗体断片である。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体を蛋白質分解酵素ペプシンで処理して得ることができる。または、下記のFab’をチオエーテル結合あるいはジスルフィド結合させ、作製することができる。
【0077】
また、Fab’は、F(ab’)2のヒンジ領域のジスルフィド結合を切断した、抗原結合活性を有する抗体断片である。F(ab’)2を還元剤ジチオスレイトール処理して得ることができる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のFab’断片をコードするDNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該ベクターを原核生物あるいは真核生物へ導入することにより発現させ、Fab’を製造することができる。
【0078】
また、scFvは、1本のVHと1本のVLとを適当なペプチドリンカーを用いて連結したポリペプチドで、抗原結合活性を有する抗体断片である。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHおよびVLをコードするcDNAを取得し、scFvをコードするDNAを構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、scFvを製造することができる。
【0079】
また、diabodyは、scFvが二量体化した抗体断片で、二価の抗原結合活性を有する抗体断片である。二価の抗原結合活性は、同一であることもできるし、一方を異なる抗原結合活性とすることもできる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHおよびVLをコードするcDNAを取得し、scFvをコードするDNAをペプチドリンカーのアミノ酸配列の長さが8残基以下となるように構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、diabodyを製造することができる。
【0080】
また、dsFvは、VHおよびVL中のそれぞれ1アミノ酸残基をシステイン残基に置換したポリペプチドを該システイン残基間のジスルフィド結合を介して結合させたものの総称である。システイン残基に置換するアミノ酸残基はReiterらにより示された方法(Reiter et al., Protein Eng. 1994 May;7(5):697-704.)に従って、抗体の立体構造予測に基づいて選択することができる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHおよびVLをコードするcDNAを取得し、dsFvをコードするDNAを構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、dsFvを製造することができる。
【0081】
また、CDRを含むペプチドは、VHまたはVLのCDRの少なくとも1領域以上を含んで構成される。複数のCDRを含むペプチドは、直接または適当なペプチドリンカーを介して結合させることができる。そして、その生産方法には公知の方法をいずれも採用できるが、例えば、本明細書におけるアデノシンA2a受容体結合性抗体のVHまたはVLのCDRをコードするDNAを構築し、該DNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該発現ベクターを原核生物あるいは真核生物へ導入することにより発現させ、CDRを含むペプチドを製造することができる。また、CDRを含むペプチドは、Fmoc法(フルオレニルメチルオキシカルボニル法)、tBOC法(t-ブチルオキシカルボニル法)などの化学合成法によって製造することもできる。
【0082】
また、キメラ抗体は、非ヒト種由来の抗体の可変領域を、ヒト抗体の定常領域に連結したもので、遺伝子組換え技術によって容易に構築できる。キメラ抗体を生成する方法は、当該技術分野で公知である。例えば、マウス-ヒトキメラ抗体は、[Roguska et al., Proc Natl Acad Sci U S A. 1994 Feb 1;91(3):969-973.]に記載の方法で作製できる。標的抗原に対するマウスモノクローナル抗体の、マウス軽鎖V領域およびマウス重鎖V領域をコードするDNA断片をクローニングし、これらのマウスV領域をコードするDNAを、ヒト抗体定常領域をコードするDNAと連結して発現させることによってマウス-ヒトキメラ抗体が得られる。マウス-ヒトキメラ抗体を作製するための基本的な方法は、クローン化されたcDNAに存在するマウスリーダー配列及びV領域配列を、哺乳類細胞の発現ベクター中にすでに存在するヒト抗体C領域をコードする配列に連結する。あるいは、クローン化されたcDNAに存在するマウスリーダー配列及びV領域配列をヒト抗体C領域をコードする配列に連結した後、哺乳類細胞発現ベクターに連結する。ヒト抗体C領域の断片は、任意のヒト抗体のH鎖C領域及びヒト抗体のL鎖C領域のものとすることができ、例えばヒトH鎖のものについてはCγ1、Cγ2、Cγ3又はCγ4、及びL鎖のものについてはCλ又はCκを各々挙げることができる。
【0083】
また、ヒト化抗体は、非ヒト種由来の1つ以上の相補性決定領域(CDR)およびヒト免疫グロブリン由来のフレームワーク(FR)領域、さらにヒト免疫グロブリン由来の定常領域を有し、所望の抗原に結合する。抗原結合を改変する、好ましくは、改善するために、ヒトフレームワーク領域のアミノ酸残基は、CDRドナー抗体からの対応する残基と置換されることが多い。これらのフレームワーク置換は、当該技術分野で周知の方法(例えば、抗原結合に重要なフレームワーク残基を同定するために、CDRとフレームワーク残基の相互作用のモデリングによって、および特定の位置で異常なフレームワーク残基を同定するための配列比較)によって実施される(Riechmann et al., Nature. 1988 Mar 24;332(6162):323-327.)。抗体は、当該技術分野で既知の種々の手法を使用してヒト化することが可能である(Almagro et al., FRont Biosci. 2008 Jan 1;13:1619-1633.)。例えば、CDRグラフティング(Ozaki et al., Blood. 1999 Jun 1;93(11):3922-3930.、Re-surfacing (roguska et al., Proc Natl Acad Sci U S A. 1994 Feb 1;91(3):969-973.)、およびFRシャッフル(Damschroder et al., Mol Immunol. 2007 Apr;44(11):3049-3060. Epub 2007 Jan 22.)などが挙げられる。
【0084】
また、ヒト抗体は、典型的には、抗体を構成する重鎖の可変領域、重鎖の定常領域、軽鎖の可変領域、および軽鎖の定常領域を含む全ての領域がヒトイムノグロブリンをコードする遺伝子に由来する抗体である。ヒトに投与した際に免疫原性が少なく、ヒトの疾患治療に使用する際に好適に使用できる。主な作成方法としてはヒト抗体作製用トランスジェニックマウス法、ファージディスプレイ法などがある。ヒト抗体作製用トランスジェニックマウス法は、内因性Igをノックアウトしたマウスに機能的なヒトのIg遺伝子を導入すれば、マウス抗体の代わりに多様な抗原結合能を持つヒト抗体が産生される。さらにこのマウスを免疫すればヒトモノクローナル抗体を従来のハイブリドーマ法で得ることが可能である。例えば、[Lonberg et al., Int Rev Immunol. 1995;13(1):65-93.]に記載の方法で作成できる。ファージディスプレイ法は大腸菌ウイルスの一つであるM13やT7などの繊維状ファージのコート蛋白質(g3pやg10pなど)のN末端側にファージの感染性を失わないよう外来遺伝子を融合蛋白質として発現させるシステムである。例えば、[Vaughan et al., Nat Biotechnol. 1996 Mar;14(3):309-314.]に記載の方法で作成できる。
【0085】
また、アデノシンA2a受容体結合性抗体は、1若しくは数個のアミノ酸が別のアミノ酸に置換していてもよい。この場合には、アミノ酸側鎖の性質が保存されている別のアミノ酸に置換していることが好ましい。例えばアミノ酸側鎖の性質としては、疎水性アミノ酸(A、I、L、M、F、P、W、Y、V)、親水性アミノ酸(R、D、N、C、E、Q、G、H、K、S、T)、脂肪族側鎖を有するアミノ酸(G、A、V、L、I、P)、水酸基含有側鎖を有するアミノ酸(S、T、Y)、硫黄原子含有側鎖を有するアミノ酸(C、M)、カルボン酸及びアミド含有側鎖を有するアミノ酸(D、N、E、Q)、塩基含有側鎖を有するアミノ離(R、K、H)、および、芳香族含有側鎖を有するアミノ酸(H、F、Y、W)を挙げることができる(括弧内はいずれもアミノ酸の一文字標記を表す)。これらの各グループ内のアミノ酸同士の置換は保存的置換と総称される。あるアミノ酸配列に対する1または複数個のアミノ酸残基の欠失、付加、または他のアミノ酸による置換により修飾されたアミノ酸配列を有するポリペプチドがその生物学的活性を維持することはすでに知られている(Mark et al., Proc Natl Acad Sci U S A. 1984 Sep;81(18):5662-5666.、Zoller et al., Nucleic Acids Res. 1982 Oct 25;10(20):6487-6500.、Wang et al., Science. 1984 Jun 29;224(4656):1431-1433.)。
【0086】
また、アデノシンA2a受容体結合性抗体は、既知の選択または突然変異誘発法を使用し、親和成熟させてもよい。好ましい親和成熟抗体は、成熟抗体が出発抗体のものよりも、5倍、より好ましくは10倍、さらに好ましくは20または30倍の親和性を有する。例えば、抗体ファージライブラリを用いたバイオパニングを使用できる。この方法の典型的な操作は、固定化した標的蛋白質に抗体ファージライブラリを反応させ、結合しなかったファージ抗体を洗浄により除去した後に、結合したファージ抗体を溶出し大腸菌に感染させて増殖させる、という操作を数回行うことで標的蛋白質に特異的なファージ抗体を取得することである(改訂版 抗体実験マニュアル, 羊土社(2008):211-221.)。
【0087】
また、アデノシンA2a受容体結合性抗体のクラスは、IgM、IgD、IgG、IgA、IgE、IgX、IgY、IgW、IgNARを含む。なお、該クラスは、IgM、IgD、IgG、IgA、IgEであることが好ましい。なぜならば、IgM、IgD、IgG、IgA、IgEはヒト由来の抗体が有するクラスであるため、抗体を治療薬として使用した際に、免疫原性が低減される可能性が高いと考えられるためである。
【0088】
また、アデノシンA2a受容体結合性抗体の重鎖CDR1、重鎖CDR2、または重鎖CDR3は、例えば、ヒトまたは他の哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)由来や鳥類等由来の抗体であってもよいが、特にヒトまたはマウスであることが好ましい。なぜならば、ヒトであればヒトに投与した際に免疫原性を低減することができ、マウスであれば抗体作成において最も汎用されているために情報が蓄積されており、抗体の扱いがより容易になるためである。
【0089】
また、アデノシンA2a受容体結合性抗体は、アデノシンA2a受容体結合性抗体の重鎖CDR領域をコードするDNAと、公知のヒトまたはヒト以外の生物由来の抗体の、重鎖CDR領域を除く領域をコードするDNAとを、当該技術分野で公知の方法に従って、ベクターに連結後、発現させることによって得ることができる。なお、このとき、該抗体の標的抗原への作用効率を上げることができるため、当該分野で公知の方法(例えば、抗体のアミノ酸残基をランダムに変異させ、反応性の高いものをスクリーニングする方法、またはファージディスプレイ法など)を用いて、該抗体の重鎖CDR領域を除く領域を最適化することが好ましい。特に、該抗体の標的抗原への作用効率を上げることができるため、当該分野で公知の方法、例えば、FRシャッフル(Damschroder et al., Mol Immunol. 2007 Apr;44(11):3049-3060. Epub 2007 Jan 22.)、またはバーニヤゾーンのアミノ酸残基および/またはパッケージング残基を置換する方法(特開2006-241026、またはFoote et al., J Mol Biol. 1992 Mar 20;224(2):487-499.)を用いて、FR領域を最適化することが好ましい。
【0090】
本明細書において「重鎖CDR3」とは、抗体の重鎖のCDRに存在していて、抗原に直接接触して結合部位を形成している領域である。一般的に、重鎖CDRには重鎖CDR1、重鎖CDR2、重鎖CDR3が存在し、重鎖CDR3が結合における寄与が最も高い。CDRの定義およびその位置を決定する方法は複数報告されており、これらの何れも採用し得る。例えば、Kabatの定義(Sequences of proteins of immunological interest, 5th ed.,U.S. Department of Health and Human Services,1991)、またはChothiaの定義(Chothia et al., J. Mol. Biol.,1987;196:901-917)を採用してもよい。本明細書においては、Kabatの定義を好適な例として採用するが、必ずしもこれに限定されない。また、場合によっては、Kabatの定義とChothiaの定義の両方を考慮して決定しても良く、例えば、各々の定義によるCDRの重複部分を、または、各々の定義によるCDRの両方を含んだ部分をCDRとすることもできる。そのような方法の具体例としては、Kabatの定義とChothia aの定義の折衷案である、Oxford Molecular's AbM antibody modeling softwareを用いたMartinらの方法(Proc.Natl.Acad.Sci.USA,1989;86:9268-9272)がある。
【0091】
<実施形態2:アデノシンA2a受容体結合性抗体の作用効果>
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤である。アデノシンA2a受容体の機能を阻害することは、A2a受容体の関与するシグナル伝達等の種々の機能、例えば、cAMPの増加(Chern et al., Mol Pharmacol. 1993 Nov;44(5):950-8.)や、MAPKの活性化(Schulte et al., Int J Biochem Cell Biol. 2003 Apr;35(4):410-4. Review.)などを阻害すると考えられる。ここで、MAPKの機能阻害は、胃癌や肝癌等のモデル動物にin vivoで治療効果があることが、[Yang et al., Mol Cancer Ther. 2009 Sep;8(9):2537-45. Epub 2009 Sep 1.]および[Huynh et al., Mol Cancer Ther. 2007 Sep;6(9):2468-76.]に記載されている。従って、このアデノシンA2a受容体機能阻害剤は、MAPKのようなA2a受容体と連関するシグナル伝達分子の機能阻害を通して、各種疾患の治療や予防に効果を発揮できる。
【0092】
このアデノシンA2a受容体機能阻害剤は、アゴニスト、アンタゴニストなど種々のリガンドの結合阻害剤を含むが、アゴニストの結合阻害剤であることが好ましい。なぜならば、後述の実施例において、顕著に高いアゴニスト阻害活性が示されているからである。また、アデノシンA2a受容体へのアゴニスト阻害作用は、in vivoで種々の疾患の疾患モデル動物に治療効果を発揮することが知られているため、各種疾患の治療、診断に有用だからである。例えば、in vivoで神経変性疾患の疾患モデル動物に治療効果を発揮することが[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]に記載されている。また、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には肺腫瘍および乳房腫瘍の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。そして、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤はアゴニストの結合阻害剤を含むため、アゴニスト阻害活性を通して上記疾患を治療できると考えられる。
【0093】
即ち、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤は、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーの疾患の治療薬、または診断薬として好適に使用できる。また、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤は、A2a受容体と連関するシグナル伝達分子の機能阻害を通して、研究用の試薬や、再生医療における細胞または組織の機能や生存率を維持するための添加剤、または畜産において動物の成育を補助するための添加剤として使用できる。
【0094】
ここで、アゴニストはA2a受容体にアゴニスト作用を相する物質であれば限定しないが、アデノシンまたはアデノシン誘導体が好ましい。アデノシンまたはアデノシン誘導体であれば、A2a受容体へのアゴニスト作用を奏すことが良く知られており、続くA2a受容体を介した細胞内シグナル伝達機構も比較的解明されているためである。なお、アデノシン誘導体の中でも、5’‐(N‐エチルカルボキサミド)アデノシンが好ましい。後述する実施例で、実際にアデノシンA2a受容体結合性抗体によるA2a受容体への結合阻害が実際に見られているためである。
【0095】
ここで、結合阻害効果の測定には、ELISA法、FACS分析、BIACOREを用いた方法など、当該技術分野で公知の方法をいずれも使用できる。A2a受容体とリガンドが共存するときの結合を、アデノシンA2a受容体結合性抗体で競合阻害した結果を測定しても良く、またはA2a受容体にアデノシンA2a受容体結合性抗体が結合する様態を、A2a受容体およびリガンドの結合阻害の指標として測定しても良い。なお、結合阻害効果の測定は、後述する実施例に記載の方法で測定することが好ましい。
【0096】
また、A2a受容体にアデノシンA2a受容体結合性抗体が結合する様態は、解離平衡定数(KD)、結合定数(Ka)、結合速度定数(ka)、または解離速度定数(kd)で表すことができる。測定には、ELISA法(Enzyme Linked Immuno-Sorbent Assay)またはBIACOREシステムを使用できる。ELISA法は比較的低コストで導入でき、最も典型的な手法である。ELISA法は、測定したい物質と特異的に反応する抗体もしくは既知量の抗原を固相化したマイクロプレートに、測定したい物質と酵素標識抗原とを同時に加えて反応させ、プレートに結合した酵素標識物の酵素活性を比色法や蛍光法により計測して、特異的相互作用を測定する方法である。抗体の高い結合能と分子認識能を利用するため、HPLC法等と比較して非常に高感度な検出が可能である。
【0097】
BIACOREシステムは、動的なパラメータを測定できる優れた測定方法で、センサー表面に生体分子を固定化して、相互作用の相手となる分子を添加することでセンサー表面における特異的相互作用をリアルタイムに測定する。分子標識の必要なしに、特異的相互作用について結合反応から平衡状態および解離反応までをリアルタイムに測定することが可能である。測定操作は、リガンドをセンサー表面に固定化した後、マイクロ流路系を介して反応物質を含む試料溶液を添加することにより、センサー表面でおこる特異的相互作用を微細な質量変化として測定する。その測定原理に表面プラズモン共鳴(Surface plasmonresonance、SPR)とよばれる光学現象を採用することで信頼性のある測定が行える。直接得られた反応速度をもとに、結合速度定数(ka)および解離速度定(kd)を算定でき詳細な解析が可能である[Jonsson et al., Biotechniques. 1991 Nov;11(5):620-7.、Fivash et al., Curr Opin Biotechnol. 1998 Feb;9(1):97-101.、生命科学のための機器分析実験ハンドブック, 羊土社(2007):243-248.]。
【0098】
また、本明細書において治療とは、疾患または疾患に伴う1つ以上の症状の、予防あるいは症状改善効果を発揮しうることをいう。
【0099】
神経変性疾患とは、神経組織の変性を伴う疾患で、パーキンソン病、アルツハイマー病、認知症、プリオン病、クロイツフェルトーヤコブ病、ハンチントン病 、ポリグルタミン病、筋萎縮性側索硬化症(ALS) 、脊髄小脳変性症(SCD) 、進行性核上性麻痺(PSP) 、多系統萎縮症(MSA)、黒質線状体変性症(SND)、シャイ・ドレーガー症候群(Shy-Drager症候群)、またはオリーブ橋小脳萎縮症(OPCA)を含む。
【0100】
うつ病とは、抑うつ気分や不安、焦燥、精神活動の低下、食欲低下、または不眠症などを特徴とする疾患である。世界保健機構(World Health Organization)が発表している[ICD10 国際疾病分類第10版]でうつ病関連に分類されている疾患を含む。
【0101】
脳虚血性障害とは、脳組織に十分な酸素または栄養が供給されない状態になり、その結果、代謝障害を起こして、脳神経細胞の機能低下、または細胞死に至る状態である。例えば、脳梗塞、一過性脳虚血障害、心停止、低血圧、貧血、脱血、または各種ガス中毒等による脳障害や、低酸素による脳障害が挙げられる。
【0102】
睡眠障害とは、睡眠に関わるあらゆる異常な症状であり、睡眠異常、睡眠時随伴症、内科・精神科的障害に伴う睡眠障害など、アメリカ睡眠障害連合会(American Sleep Disorders Association;ASDA)が発表している睡眠障害国際分類(International Classification of Sleep Disorders;ICSD)で睡眠障害関連に分類されている疾患を含む。
【0103】
癌とは、正常な細胞が突然変異を起こして増殖を続けることで起こる疾患である。悪性の癌細胞は全身のあらゆる臓器や組織から生じ、癌細胞が増殖すると、癌組織のかたまりとなって周囲の正常な組織に侵入し破壊する。癌は、乳癌、結腸直腸癌、肺癌、前立腺癌、肝細胞癌、胃癌、膵臓癌、子宮頸癌、卵巣癌、肝臓癌、膀胱癌、尿管癌、甲状腺癌、腎臓癌、癌腫、メラノーマ、または脳腫瘍などを含む。
【0104】
貧血とは、血液中の赤血球や、赤血球に含まれる血色素の量が少なくなった状態、またはそれにより起こる諸症状である。世界保健機構が発表している[ICD10 国際疾病分類第10版]で貧血関連に分類されている疾患を含む。
【0105】
カタレプシーとは、受動的にとらされた姿勢を保ち続け、自分から元に戻そうとしない症状のことである。強硬症ともいわれる。高度になると筋緊張が高まり、四肢を思いのままの形にあたかも蝋細工のように曲げて不自然な姿勢をとらせることができるので、蝋屈症(flexibilitas cerea)ともいわれる。
【0106】
また、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を治療薬または予防薬として使用する場合、単独で投与することも可能ではあるが、通常は薬理学的に許容される1つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野においてよく知られる任意の方法により製造した医薬製剤として提供するのが好ましい。
【0107】
また、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を生体に投与する際の投与経路は、治療に際して最も効果的なものを使用するのが好ましく、経口投与、または口腔内、気道内、直腸内、皮下、筋肉内、眼内および静脈内などの非経口投与をあげることができ、全身または局部的に投与することができる。投与経路は、好ましくは静脈内投与をあげることができる。アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤が、経口投与後に患部で所望の機能を発揮できる場合には、経口投与が好ましい。
【0108】
また、アデノシンA2a受容体結合性抗体を直接使用せずに、アデノシンA2a受容体結合性抗体をコードするポリヌクレオチド、またはベクターを投与することも可能である。または、アデノシンA2a受容体結合性抗体をA2a受容体発現細胞内で機能するように投与しても良い。抗体を細胞内に導入場合には、上記ベクターをA2a受容体発現細胞内の遺伝子に組み込む手法や、抗体を改変する手法、抗体と膜透過ペプチドとの複合体形成による方法(JBS Transduction Kit(Jena Bioscience))、細胞導入用の封入剤を利用した方法(Kondo et al., J Immunol Methods. 2008 Mar 20;332(1-2):10-7. Epub 2008 Jan 11.)等、当該技術分野で公知の方法を用いて実施可能である。
【0109】
投与形態としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、軟膏、テープ剤などがあげられる。経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤などがあげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖などの糖類、ポリエチレングリコール、プロピレングリコールなどのグリコール類、ゴマ油、オリーブ油、大豆油などの油類、p−ヒドロキシ安息香酸エステル類などの防腐剤、ストロベリーフレーバー、ペパーミントなどのフレーバー類などを添加剤として用いて製造できる。さらに、カプセル剤、錠剤、散剤、顆粒剤などは、乳糖、ブドウ糖、ショ糖、マンニトールなどの賦形剤、デンプン、アルギン酸ナトリウムなどの崩壊剤、ステアリン酸マグネシウム、タルクなどの滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチンなどの結合剤、脂肪酸エステルなどの界面活性剤、グリセリンなどの可塑剤などを添加剤として用いて製造できる。
【0110】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤などがあげられる。注射用の水溶液としては、例えば生理食塩水、ブドウ糖やその他の補助薬を含む等張液、例えばD-ソルビトール、D-マンノース、D-マンニトール、塩化ナトリウムが挙げられ、適当な溶解補助剤、例えばアルコール、具体的にはエタノール、ポリアルコール、例えばプロピレングリコール、ポリエチレングリコール、非イオン性界面活性剤、例えばポリソルベート80(TM)、HCO-50と併用してもよい。座剤はカカオ脂、水素化脂肪またはカルボン酸などの担体を用いて調製される。また、噴霧剤はアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤、ないしは受容者の口腔および気道粘膜を刺激せず、かつアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を微細な粒子として分散させ吸収を容易にさせる担体、などを用いて調製される。この担体としては具体的には乳糖、グリセリンなどが例示できる。アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤と、用いる担体の性質により、エアロゾル、ドライパウダーなどの製剤化が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0111】
また、上記予防薬または治療薬は、緩衝剤(例えば、リン酸塩緩衝液、酢酸ナトリウム緩衝液)、無痛化剤(例えば、塩化ベンザルコニウム、塩酸プロカインなど)、安定剤(例えば、ヒト血清アルブミン、ポリエチレングリコールなど)、保存剤(例えば、ベンジルアルコール、フェノールなど)、酸化防止剤などと配合してもよい。調製された注射液は通常、適当なアンプルに充填される。このようにして得られる製剤は安全で低毒性であるので、例えば、ヒトや哺乳動物(例えば、ラット、マウス、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して投与することができる。
【0112】
また、投与方法は患者の年齢、症状、対象臓器等などにより適宜選択することができる。アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤、もしくはアデノシンA2a受容体結合性抗体をコードするポリヌクレオチドを含有する医薬組成物の投与量としては、例えば、一回につき体重1kgあたり0.0001mgから1000mgの範囲で選ぶことが可能である。あるいは、例えば、患者あたり0.001〜100000mg/bodyの範囲で投与量を選ぶことができるが、これらの数値に必ずしも制限されるものではない。目的とする治療効果、投与方法、治療期間、年齢、体重などにより異なる。投与量、投与方法は、患者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。また、適切な化学療法薬と併用で投与してもよい。
【0113】
また、治療対象が脳内にあり、治療薬が血液脳関門(blood-brain barrier:BBB)を通過する必要があるときには、BBBを通過する製剤設計、投与経路、または投与方法を採用することが好ましい。もしくはアデノシンA2a受容体結合性抗体をBBBを通過する形態に改変していても良い。それらの方法は、当該技術分野において公知の方法を用いて可能であり、例えば、BBBの間隙を広げる方法、BBBに発現する膜蛋白質を利用する方法、CED法(Convection-enhanced Delivery)などが挙げられる(Bidros et al., Neurotherapeutics. 2009 Jul;6(3):539-46. Review.)。
【0114】
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体、またはアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、診断薬である。この診断薬は、アデノシンA2a受容体結合性抗体を含むため、アデノシンA2a受容体の連関する種々の疾患の診断に好適に使用できる。
【0115】
ここで、診断薬の使用方法は特に限定しないが、例えば、上記いずれかの疾患における細胞、血液、血清、体液、または病理切片等と、標準的な細胞等において、A2a受容体への抗体の結合の様態を検査、比較することで上記疾患の診断が可能になると考えられる。例えば、疾患がアデノシンA2a受容体の高発現に起因しているときには、抗体の結合量が増加し、リガンドの高発現に起因しているときには、リガンドと拮抗することで、抗体の結合量が減少すると考えられる。
【0116】
ここで、診断薬として使用する際の検出方法は特に限定されないが、例えば、ラジオイムノアッセイ、エンザイムイムノアッセイ、蛍光イムノアッセイ、発光イムノアッセイ、免疫沈降法、免疫比濁法などを挙げることができる。好ましくはエンザイムイムノアッセイであり、特に好ましいものはELISA(sandwich ELISA等)である。ELISAなどの上述した免疫学的方法は当業者に公知の方法により行うことが可能である。また、診断薬にはPET(Positron Emission Tomography)のための試薬、実験に使用する試薬または材料も含む。
【0117】
アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を用いた典型的な検出方法としては、例えば、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を支持体に固定し、ここに被検試料を加え、インキュベートを行いアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤と被検試料中のA2a受容体を結合させた後に洗浄して、アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を介して支持体に結合したA2a受容体を検出することにより、被検試料中のA2a受容体の検出を行う方法を挙げることができる。
【0118】
アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を介して支持体に結合したA2a受容体の検出の好ましい態様として、標識物質で標識されたアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を用いる方法を挙げることができる。例えば、支持体に固定されたアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤に被検試料を接触させ、洗浄後に、標識物質で標識されたアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を接触させ、さらに標識抗体を用いて標識物質を検出し、A2a受容体の指標とする。
【0119】
アデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤の標識は通常知られている方法により行うことが可能である。標識物質としては、蛍光色素、酵素、補酵素、化学発光物質、放射性物質などの当業者に公知の標識物質を用いることが可能であり、具体的な例としては、ラジオアイソトープ(32P、14C、125I、3H、131Iなど)、フルオレセイン、ローダミン、ダンシルクロリド、ウンベリフェロン、ルシフェラーゼ、ペルオキシダーゼ、アルカリホスファターゼ、β-ガラクトシダーゼ、β-グルコシダーゼ、ホースラディッシュパーオキシダーゼ、グルコアミラーゼ、リゾチーム、サッカリドオキシダーゼ、マイクロペルオキシダーゼ、ビオチンなどを挙げることができる。標識物質としてビオチンを用いる場合には、ビオチン標識抗体を添加後に、アルカリホスファターゼなどの酵素を結合させたアビジンをさらに添加することが好ましい。
【0120】
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体、またはアデノシンA2a受容体結合性抗体を含むアデノシンA2a受容体機能阻害剤を含有する、試薬である。ここで、試薬には、ELASAやFACS分析等の基礎研究のための材料や、蛋白質との共結晶化のための結晶化リガンド(crystallizing ligand)等を含む。特に、上記アデノシンA2a受容体結合性抗体は後述する実施例において、A2a受容体の立体構造を認識していることから、極めて優れた結晶化リガンドであるといえる。
【0121】
本明細書において、「結晶化」とは、蛋白質を結晶として析出させることである。結晶化によって得られる結晶は、X線結晶構造解析を行うことで、X線を当て散乱したX線の回折像から該蛋白質の3次元構造を解析できる。蛋白質の3次元構造の解析に用いる結晶は、一般的に純度が高いことが好ましい(Ferre-D'Amare AR, Burley SK, Structure, 357-359 (1994))。蛋白質の3次元構造を解析した結果は、たとえば、蛋白質立体構造に基づく薬剤設計(SBDD;Structure Based Drug Design)に使用できる。そして、一般的に、SBDDの多くは蛋白質の天然型の構造から薬剤設計を行うので、結晶に含まれる蛋白質は、天然型の構造であることが好ましい。なお、蛋白質の結晶化法には、静止バッチ法、自由界面拡散法、微量透析法、蒸気拡散法などを含む。
【0122】
本明細書において、「共結晶化」とは、蛋白質に化合物を結合させた状態で、または蛋白質が含まれる水溶液中に化合物を混在させた状態で、蛋白質と該化合物をともに結晶化させることを含む。たとえば、膜蛋白質に該膜蛋白質に対する抗体を結合させた状態で、ともに結晶化させることを含む。
【0123】
以下、実施形態1および2に係る作用効果について説明する。
【0124】
本発明の実施形態は、アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤である。このアデノシンA2a受容体機能阻害剤を用いれば、A2a受容体に結合し、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0125】
また、このアデノシンA2a受容体機能阻害剤において機能阻害は、アゴニスト阻害であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、A2a受容体へのアゴニストの結合を阻害し、A2a受容体がアゴニストから受ける作用を阻害できる。また、A2a受容体へのアゴニスト阻害作用が関与する各種疾患の治療、診断ができる。
【0126】
また、このアデノシンA2a受容体機能阻害剤においてアゴニストは、アデノシンまたはアデノシン誘導体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、A2a受容体へのアデノシンまたはアデノシン誘導体の結合を阻害し、A2a受容体がアデノシンまたはアデノシン誘導体から受ける作用を阻害できる。また、A2a受容体へのアデノシンまたはアデノシン誘導体の結合阻害作用が関与する各種疾患の治療、診断ができる。
【0127】
また、このアデノシンA2a受容体機能阻害剤においてアデノシンA2a受容体結合性抗体は、アデノシンA2a受容体のループ部分に特異的に結合しても良い。この場合、上記アデノシンA2a受容体機能阻害剤は、A2a受容体への結合特異性が高く、効率的に作用できる。
【0128】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体はマウス抗体、キメラ抗体、ヒト化抗体、ヒト抗体からなる群から選ばれる1種以上の抗体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤に含まれるアデノシンA2a受容体結合性抗体は、ヒト化されているアミノ酸配列を含むため、治療薬として使用した場合においてヒトへの免疫原性を低減させることができる。また、マウスのアミノ酸配列を含むため、マウスへ使用した場合においても免疫原性を低減させることができる。
【0129】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体は抗体断片であってもよい。この場合、上記アデノシンA2a受容体機能阻害剤に含まれるアデノシンA2a受容体結合性抗体は抗体全長より小さいため、生体に投与した場合の免疫原性を低減できる、生体に投与した場合の安定性が上昇する、または生産効率が上昇する効果が得られる。
【0130】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体はモノクローナル抗体であってもよい。この場合、上記アデノシンA2a受容体機能阻害剤に含まれるアデノシンA2a受容体結合性抗体は、アデノシンA2a受容体を高い特異性で認識するため、効率的にアデノシンA2a受容体の機能を阻害できる。
【0131】
また、このアデノシンA2a受容体機能阻害剤において、アデノシンA2a受容体結合性抗体はアデノシンA2a受容体の野生型または変異型に結合しても良い。この場合、上記アデノシンA2a受容体機能阻害剤は、野生型とアミノ酸配列の異なるアデノシンA2a受容体へのアゴニストの結合を阻害できる。
【0132】
また、このアデノシンA2a受容体機能阻害剤においてアデノシンA2a受容体は、哺乳動物由来のA2a受容体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、哺乳動物のA2a受容体が関与するシグナル伝達等の種々の機能を阻害する効果や、哺乳動物のA2a受容体が関与する疾患の治療薬または診断薬が得られる。また、アデノシンA2a受容体機能阻害剤を治療薬等として開発する場合において、A2a受容体が関与する疾患のモデル生物に哺乳動物を採用できる。
【0133】
また、このアデノシンA2a受容体機能阻害剤においてアデノシンA2a受容体は、ヒト由来のA2a受容体であっても良い。この場合、上記アデノシンA2a受容体機能阻害剤を用いれば、ヒトのA2a受容体が関与するシグナル伝達等の種々の機能を阻害する効果や、ヒトのA2a受容体が関与する疾患の治療薬または診断薬が得られる。
【0134】
本発明の他の実施形態は、上記アデノシンA2a受容体機能阻害剤を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の治療薬である。この治療薬を用いれば、上記疾患の治療効果が得られる。
【0135】
また、この治療薬において疾患は哺乳動物の疾患であっても良い。この場合、上記治療薬を用いれば、哺乳動物において上記疾患の治療効果が得られる。
【0136】
本発明の他の実施形態は、上記アデノシンA2a受容体機能阻害剤を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の診断薬である。この診断薬を用いれば、上記疾患の診断効果が得られる。
【0137】
また、この診断薬において疾患は哺乳動物の疾患であっても良い。この場合、上記診断薬を用いれば、哺乳動物において上記疾患の診断効果が得られる。
【0138】
本発明の他の実施形態は、抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、配列番号1のアミノ酸配列、または配列番号1において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2のアミノ酸配列が、配列番号2のアミノ酸配列、または配列番号2において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3のアミノ酸配列が、配列番号3のアミノ酸配列、または配列番号3において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含む、抗体である。この抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0139】
また、この抗体は、抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、配列番号4のアミノ酸配列、または配列番号4において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR2のアミノ酸配列が、配列番号5のアミノ酸配列、または配列番号5において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR3のアミノ酸配列が、配列番号6のアミノ酸配列、または配列番号6において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。この場合、上記抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0140】
本発明の他の実施形態は、抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、配列番号7のアミノ酸配列、または配列番号7において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR2のアミノ酸配列が、配列番号8のアミノ酸配列、または配列番号8において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、重鎖CDR3のアミノ酸配列が、配列番号9のアミノ酸配列、または配列番号9において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含む、抗体である。この抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0141】
また、この抗体は、抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、配列番号10のアミノ酸配列、または配列番号10において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR2のアミノ酸配列が、配列番号11のアミノ酸配列、または配列番号11において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含み、軽鎖CDR3のアミノ酸配列が、配列番号12のアミノ酸配列、または配列番号12において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列であっても良い。この場合、上記抗体は特定のアミノ酸配列を含むため、アデノシンA2a受容体に結合できる。また、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。加えて、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0142】
また、上記の特定のアミノ酸配列を含む抗体は、アデノシンA2a受容体結合性抗体であっても良い。この場合、上記抗体を用いれば、アデノシンA2a受容体に結合し、アデノシンA2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0143】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体を含む、アデノシン受容体機能阻害剤である。このアデノシン受容体機能阻害剤を用いれば、A2a受容体に結合し、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0144】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の治療薬である。この治療薬を用いれば、上記疾患の治療効果が得られる。
【0145】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体を含む、神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の診断薬である。この診断薬を用いれば、上記疾患の診断効果が得られる。
【0146】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体をコードする塩基配列を含む、ポリヌクレオチドである。この場合、上記ポリヌクレオチドを用いれば、当該技術分野で公知の方法によって、上記の特定のアミノ酸配列を含む抗体を作製できる。
【0147】
本発明の他の実施形態は、上記の特定のアミノ酸配列を含む抗体をコードする塩基配列またはその一部を含む、ベクターである。この場合、上記ベクターを用いれば、当該技術分野で公知の方法によって、上記の特定のアミノ酸配列を含む抗体を作製できる。
【0148】
本発明の他の実施形態は、受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産される、アデノシンA2a受容体結合性抗体である。このアデノシンA2a受容体結合性抗体を用いれば、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0149】
本発明の他の実施形態は、上記のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片である。上記の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片を用いれば、A2a受容体の関与するシグナル伝達等の種々の機能を阻害できる。また、A2a受容体の関与する疾患の、治療薬または診断薬が得られる。
【0150】
本発明の他の実施形態は、アデノシンA2a受容体結合性抗体をスクリーニングする際に使用するリポソーム/アデノシンA2a受容体複合体であって、固相担体と、上記固相担体に結合しているリポソームと、上記リポソームに埋め込まれているアデノシンA2a受容体とを備え、上記アデノシンA2a受容体の少なくとも一部が、リポソームの外側表面に露出している、リポソーム/アデノシンA2a受容体複合体である。このリポソーム/アデノシンA2a受容体複合体を用いれば、A2a受容体の天然型の立体構造を認識するモノクローナル抗体をスクリーニングできる。
【0151】
本発明の他の実施形態は、リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程と、アデノシンA2a受容体を変性させる工程と、前工程で変性した変性型のアデノシンA2a受容体に、被検抗体を接触させる工程と、前工程で結合した抗体を検出する工程とを含むスクリーニング方法である。このスクリーニング方法を用いれば、A2a受容体の天然型の立体構造を認識するモノクローナル抗体をスクリーニングできる。
【実施例】
【0152】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0153】
<実施例1:免疫および抗体産生ハイブリドーマのサブクローニング>
マウスにメタノール資化酵母で組換え発現させたヒト由来A2a受容体を皮下注射することを数回繰り返し免疫応答を惹起し、抗血清価の上昇したマウスから脾臓細胞を摘出し、ミエローマ細胞と融合することで抗体産生ハイブリドーマを作成した。
【0154】
免疫原のヒト由来A2a受容体は、(i)界面活性剤で可溶化してミセルに覆われた精製標品、(ii)それを脂質2重膜に埋め込んだプロテオリポソームの形状、または(iii)エンベロープ上にA2a受容体が発現されたバキュロウィルスの形態で使用し、それぞれアンタゴニストである4-(2-[7-amino-2-(2-furyl)[1,2,4]triazolo[2,3-a][1,3,5]triazin-5-ylamino]ethyl)phenol(ZM241385)添加/非添加条件下で別個に免疫を行った。抗体価の上昇は段階希釈系列に対してELISAを行い検定した。
【0155】
<実施例2:融合細胞サブクローン株のスクリーニング>
(2−1)融合細胞サブクローン株の一次スクリーニング
サブクローン株を96穴細胞培養プレート内に分種して培養し、その培養上清に対してELISAを行い抗体産生能を確認した。このとき、A2a受容体の機能的立体構造を保持した条件で検定するために、A2a受容体精製標品を固定化して行うELISA、A2a受容体包埋リポソームを固定化して行うELASA、またはエンベロープタンパク上にA2a受容体が発現されたバキュロウィルスを固定化して行うELISA(BV ELISA)のうち1種類以上を併用した。この時点で計211の抗体産生細胞株が樹立された。
【0156】
(2−2)結果の考察
検定クローン数に対する、一次スクリーニング陽性クローン数の割合は、バキュロウィルス+精製抗原による免疫では2/1536(0.13%)、精製抗原による免疫では26/1728(1.5%)、プロテオリポソームによる免疫では183/3953(4.6%)であった。このことは、プロテオリポソームによる免疫が、ELASA(一次スクリーニング)に陽性の抗体を効率よく取得するための優れた方法であることを示唆している。
【0157】
(2−3)融合細胞サブクローン株の二次スクリーニング
一次スクリーニング後の培養上清について、以下の手法を用いて、それぞれの抗体のキャラクタリゼーションを行った。
【0158】
(2−3−1)A2a受容体-抗体結合におけるカイネティクス測定
表面プラズモン共鳴測定装置(Biacore T100;GE社)を用いた。抗マウスFc抗体が共有結合で固定化されたセンサーチップ(CM5)に該培養上清を送液したのちA2a受容体精製標品を送液することで、A2a受容体-抗体複合体がチップ表面上で形成され、次いで緩衝液を通すことでA2a受容体が脱着する。この全過程におけるレスポンス変化から複合体の形成能を確認し、形成能を有するものについてはさらに結合速度定数と解離速度定数をレスポンスカーブのカーブフィッティング(1:1結合モデル)により算出した。
ア
(2−3−2)ウエスタンブロッティング
A2a受容体 1μg をSDS-ポリアクリルアミドゲルで電気泳動し、展開されたゲルをニトロセルロース膜に転写して培養上清希釈液で一次反応を、HRP標識した抗マウスIgG抗体で二次反応を行い、変性したA2a受容体に対する抗体の結合性を調査した。
【0159】
1レーンあたり50ngのA2a受容体を電気泳動し、一次抗体溶液(抗体量が等量になるように培養上清を希釈したもの)およびHRP標識二次抗体溶液を作用させ、HRP発光試薬で検出したもの。陽性コントロールとして、市販の抗アデノシンA2a受容体抗体(Sc-32661)を用いた。
【0160】
(2−3−3)リポソームELISAとドットブロットとの比較解析
抗体の非変性状態および変性状態認識性を簡便に見分けるために、96ウェルプレートにA2a受容体包埋リポソームを固定化したELISA(リポソームELISA:図1)と、96ウェルのスロットを用いて作成されたドットブロットを並列して実施した。前者から得られるシグナルは非変性構造認識性を示し、後者から得られるシグナルは変性構造または特定の構造を持たない膜外ループ認識性であることを示す。
【0161】
ここで、A2a受容体包埋リポソームの調製例を以下に記す。まず、A2a受容体を、1%オクチルグルコシドを含むPBSにより可溶化した5μg/mlの16:0 biotinyl CAP-PEを含む1mg/mlの鶏卵由来フォスファチジルコリン溶液に最終濃度0.1mg/mlとなるように加え30分氷上で静置した。次いで1mlに対し30mgのBio-Beadsを加え、4℃で1時間撹拌する作業を2度行った。さらに1mlに対し100mgのBio-Beadsを加え1晩撹拌し、Bio-Beadsを取り除くことでビオチン化脂質含有A2a受容体再構成リポソームを作成した。加えて、再構成されたA2a受容体が天然構造を保っていることを、トリチウムラベルされたリガンドの結合活性を測定することにより確認した。
【0162】
そして、リポソームELISAに際しては、A2a受容体包埋リポソームをImmobilizer streptavidin coat plateに固定し、一次抗体として培養上清、二次抗体としてanti-mouse IgG-HRP conjugateを作用させ、HRP反応基質ABTS(Roche)の産物を405nmの吸光度で検出した。
【0163】
また、ドットブロットに際してはBio-dot(Bio-Rad)をもちいてA2a受容体溶液をニトロセルロース膜に吸引させたあと、1%SDS含有SDS溶液で変性させた。次いで一次抗体として培養上清希釈液を、二次抗体としてanti-mouse IgG-HRP conjugateをスロットから吸引させた。各ステップの前後において膜を1%BSA含有PBST溶液で洗浄し、Immobilon Western HRP substrate(Millipore)を用いたときの化学発光を、LAS-1000 plus (富士フィルム)で検出し、各ドットの面積強度を測定した。陽性コントロールとして、一次抗体としてFLAG-M2抗体(Sigma)を用い、希釈系列を作成して測定した。
【0164】
(2−3−4)エピトープ解析
A2a受容体の一次配列上8カ所存在する膜外領域のアミノ酸残基をそれぞれ置換したキメラ変異体を出芽酵母を用いて組換え発現し、その膜画分を用いてELISAあるいはウエスタンブロットのシグナル出現/消滅パターンを確認することで、抗体のA2a受容体上での結合領域を推定した。
【0165】
(2−3−5)細胞内側第三ループ変異体に対する結合性解析
上記(2−3−1)の測定中A2a受容体精製標品に代えて、A2a受容体の細胞内側第三ループに相当する配列(209-KQMESQPLPGERA-221(配列番号17))をT4リゾチーム(NIFEMLRIDEGLRLKIYKDTEGYYTIGIGHLLTKSPSLNAAKSELDKAIGRNTNGVITKDEAEKLFNQDVDAAVRGILRNAKLKPVYDSLDAVRRAALINMVFQMGETGVAGFTNSLRMLQQKRWDEAAVNLAKSRWYNQTPNRAKRVITTFRTGTWDAY(配列番号18))に置換した変異体を送液した場合のレスポンスの有無から、抗体の細胞内側第三ループ結合性を調査した。
【0166】
(2−4)結果の考察
上記(2−3−1)の結果では、抗体の解離平衡定数KDが10nM未満であり、顕著に低い値であった。このことから、本実施例で得られた抗体はA2a受容体に高い親和性を有していることがわかる。従って、この抗体を用いれば、細胞等におけるA2a受容体の存在を効率的に調べることが可能となる。
【0167】
上記(2−3−2)の結果では、ウエスタンブロッティング陽性と陰性のクローンが見られた。このうち陰性のクローンは、ウエスタンブロッティングの実験過程でA2a受容体の立体構造が崩れていたためにA2a受容体を認識できなかったと考えられる。即ち、ウエスタンブロッティング陰性の抗体はA2a受容体の立体構造を特異的に認識していることがわかる。
【0168】
また、上記(2−3−3)の結果では、リポソームELISA陽性でかつドットブロット陰性の抗体がみられた。このドットブロット陰性の抗体は、ドットブロットの実験過程でA2a受容体の立体構造が崩れていたためにA2a受容体を認識できなかったと考えられる。即ち、本実施例で得られた抗体はA2a受容体の立体構造を特異的に認識していることがわかる。立体構造を認識するということは、アミノ酸配列の一次配列のみを認識する抗体に比べて、抗体の結合特異性が高く、効率的に作用することを意味する。
【0169】
上記(2−3−4)では、A2a受容体のループ部分に結合する抗体が得られた。一般的に膜蛋白質の蛋白質N末端(やC末端)は、溶媒中において膜貫通領域に対する相対位置や方位に揺らぎが大きいことが多い。そのため、膜蛋白質のN末端領域を認識して結合する抗体は、立体構造ではなく、アミノ酸配列を認識している可能性が極めて高い。対して、本実施例で用いた抗体は、ループ部分を認識しているため、A2a受容体の立体構造を認識している可能性が高い。立体構造を認識するということは、アミノ酸配列の一次配列のみを認識する抗体に比べて、抗体の結合特異性が高く、効率的に作用することを意味する。
【0170】
また、ループ部分に結合することは、本実施例で得られた抗体をA2a受容体との共結晶化に使用する場合においても有利に働く。通常、膜蛋白質の蛋白質N末端(やC末端)に存在する親水性領域に抗体が結合したとしても、結晶中で規則的に並んだ定まった結晶格子を形成し得えず、蛋白質N末端(やC末端)近くに結合する抗体は結晶化に適さないということがいえる。従って、膜蛋白質との共結晶化に使用する抗体は、本実施例で得られた抗体のようにループ部分に対して結合特異性の高い抗体が適している。
【0171】
<実施例3:A2a受容体機能阻害活性の検定>
(3−1)A2a受容体機能阻害活性の検定
以上の諸解析において良好な特性を示したモノクローナル抗体25株を選抜し、限界希釈法によりモノクローン株が樹立された。この培養上清をそれぞれスピンカラム(Ab spin trap; GE)を用いて精製し、A2a受容体と作用させた後、トリチウム標識されたアンタゴニスト(ZM241385; Ki=3 nM)およびアゴニスト(5'-N-Ethylcarboxamideadenosine(NECA); Ki=158 nM)を添加し、リガンド結合活性に変化を及ぼし得るかどうかを測定した。その結果を、図2、図3、表1に示す。
【0172】
以上の検討より、C2831-104、C2838-190、C40010-A6、C40037-A5、C40040-A12、C40056-G6、C40076-173の7種の抗体はアゴニスト結合活性をそれぞれ100%、98%、56%、75%、97%、97%、92%抑制する活性を有することが判明した。
【0173】
なお、図2は、モノクローナル抗体によるリガンド飽和結合活性測定を表す。A2a受容体と抗体を等モル量混合した後、放射能標識したアンタゴニスト(ZM241385)およびアゴニスト(NECA)を作用させたのち、Sephadex-50(GE)を充填したスピンカラムを用いて遊離のリガンドを除去し、A2a受容体結合分のリガンドに由来する放射線カウント数をシンチレーションカウンターで測定し、リガンド結合量を算出した。非結合リガンド量、結合リガンド量、に対してプロットし、KdおよびBmaxを計算した。抗体非添加条件下は(a)(b)、抗体添加条件下は(c)(d)(e)である。
【0174】
図3は、エンドポイント測定での、得られたモノクローナル抗体によるによるリガンド飽和結合活性変化の結果である。グレーはA2a受容体へのアゴニスト結合活性(NECA)、黒はアンタゴニスト結合活性(ZM241385)を示す。これらの結合活性は以下の手順で調査した。アンタゴニストにおいては、A2a受容体および抗体を5nM混合した後、3-Hラベル化ZM241385 4nMを作用させることで、アゴニストについては、A2a受容体および抗体を20nMずつ混合した後、トリチウムラベル化NECA 200nMを作用させることで結合反応を行った。 リガンド溶液の代わりにPBSを添加したときのリガンド結合量を100%として、各抗体を用いた場合の結合活性を相対比率で表した。
【0175】
上記測定によって計算されたKdおよびBmax値を表1に記す。
【0176】
【表1】

【0177】
以上によって得られた結果の要約を表2に記す。表2のELISA応答性の判定基準は、++は1.5以上、+は0.5以上、(+)は0.2以上、-は0.2未満を表す。また、得られた7種の抗体それぞれを産生するハイブリドーマを、独立行政法人 産業技術総合研究所 特許生物寄託センター(茨城県つくば市東1-1-1 つくばセンター 中央第6)に、受領日2009年10月29日にて寄託した。受領番号は、C2831-104のハイブリドーマが受領番号FERM AP-21859、C2838-190のハイブリドーマが受領番号FERM AP-21860、C40010-A6のハイブリドーマが受領番号FERM AP-21861、C40037-A5のハイブリドーマが受領番号FERM AP-21862、C40040-A12のハイブリドーマが受領番号FERM AP-21863、C40056-G6のハイブリドーマが受領番号FERM AP-21864、C40076-173のハイブリドーマが受領番号FERM AP-21865である。
【0178】
【表2】

【0179】
(3−2)結果の考察
A2a受容体を特異的に認識する7種の抗体、およびその抗体を産生するハイブリドーマ細胞株を得た。この一群の抗体は、A2a受容体の選択的アゴニスト結合活性を顕著に抑制する新規の活性を持っている。このことは、A2a受容体およびアゴニストの相互作用が関連する各種疾患の治療薬として、上記抗体が極めて有効な材料となり得ることを示している。また、C2831-104、C2838-190、C40010-A6、C40037-A5、C40040-A12、C40076-173の抗体は、A2a受容体の選択的アンタゴニスト結合活性を抑制する活性をある程度持っている。このことは、A2a受容体およびアンタゴニストの相互作用が関連する各種疾患の治療薬として、上記抗体がある程度有効な材料となり得ることを示している。
【0180】
<実施例4:モノクローナル抗体の取得と追加評価>
(4−1)A2a受容体との複合体形成能の評価
各モノクローン株をマウスに腹腔注射し、モノクローナル抗体が量産された腹水を獲得した。獲得された抗体はFabフラグメント化し、A2a受容体との複合体形成能をゲル濾過クロマトグラフィーにより確認した。このうち1種類の抗体(C2838-190)においては、蒸気拡散法によりA2a受容体との共結晶を作成できることを確認した。
【0181】
(4−2)マウス脳切片標品への特異的結合の評価
また、C2838-190、C40010-A6の抗体について、マウス脳切片標品への特異的結合の有無を組織染色により確認した。その組織染色の結果を図4に示す。図4において、Strは線条体を示し、CCは大脳皮質を示す。また、DAPIは細胞核の特異的染色試薬である。そして、C2838-190はA2a受容体が多く発現している線条体を強く染めていることがわかる(1st Ab)。即ち、C2838-190の抗体は線条体に強く結合することが判明した。
【0182】
(4−3)抗体の遺伝子配列の解読
C2831-104およびC2838-190については、ハイブリドーマから抽出されたmRNAからcDNAを作成し、VHおよびVL領域をコードする遺伝子配列の解読を行うことにより、同領域のアミノ酸配列を決定した。
【0183】
C2831-104の抗体において重鎖可変領域であるVH領域のアミノ酸配列(配列番号13)は、EVQLQQSGAELVKPGASAKISCKASGYSFTGYNMNWVKQSRGKSLEWIGNINSYFGSTNYNQKFKGKATLTVDKSSSTAYMQLNGLTSEDSAVYYCTREGNYYDGSYVRYFDYWGQGTTLTVSSAであり、そのうち重鎖CDR1のアミノ酸配列(配列番号1)はGYNMNであり、重鎖CDR2のアミノ酸配列(配列番号2)はNINSYFGSTNYNQKFKGであり、重鎖CDR3のアミノ酸配列(配列番号3)はEGNYYDGSYVRYFDYであった。
【0184】
また、C2831-104の抗体において軽鎖可変領域であるVL領域のアミノ酸配列(配列番号14)は、DIQMTQSPASLSASVGETVTITCRASEDIYSSLAWYQQRQGKSPQLLVYATTHLADGVPSRFSGSGSGTQFSLKINSLQPEDFGNYYCQHFYGTTWTFGGGTRLEIKRAであり、そのうち軽鎖CDR1のアミノ酸配列(配列番号4)はRASEDIYSSLAであり、軽鎖CDR2のアミノ酸配列(配列番号5)はTTHLADGであり、軽鎖CDR3のアミノ酸配列(配列番号6)はQHFYGTTWTであった。
【0185】
また、C2838-190の抗体において重鎖可変領域であるVH領域のアミノ酸配列(配列番号15)は、EVQLQQSGAELVKPGSSVKISCKTSGDSFTAYNMNWVKQSHGKSLEWIGNINPYYGSTRYNQKFKGKATLTVDKSSSTAYIQLNSLTSEDSAVYYCAREGNYYDGGSVRYFDYWGQGTTLTVSSAであり、そのうち重鎖CDR1のアミノ酸配列(配列番号7)はAYNMNであり、重鎖CDR2のアミノ酸配列(配列番号8)はNINPYYGSTRYNQKFKGであり、重鎖CDR3のアミノ酸配列(配列番号9)はEGNYYDGGSVRYFDYであった。
【0186】
また、C2838-190の抗体において軽鎖可変領域であるVL領域のアミノ酸配列(配列番号16)はDIVMTQSPASLSASVGDTVTITCRASEFIYSSLTWYQQKQGGSPQLLVYAATNLADAVPSRFSGSGSGTQFSLKINRLQPEDFGTYYCQHFYGSTWAFGGGTKLEIKRAであり、そのうち軽鎖CDR1のアミノ酸配列(配列番号10)はRASEFIYSSLTであり、軽鎖CDR2のアミノ酸配列(配列番号11)はATNLADAであり、軽鎖CDR3のアミノ酸配列(配列番号12)はQHFYGSTWAFであった。
【0187】
(4−4)結果の考察
得られた抗体が線条体に強く結合したことは、本願発明の抗体が線条体におけるA2a受容体の発現様態を調査するために使用できることを表している。加えて上記(3−1)でA2a受容体の機能阻害が見られたことから、線条体においてA2a受容体の機能阻害が可能であることがわかる。線条体は、神経変性疾患において変性の見られる部位であり、神経変性疾患の治療薬や診断薬開発の重要な標的部位である。例えば、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]には、ハンチントン病のモデル動物の線条体において、A2a受容体のアゴニスト阻害作用がin vivoの治療効果を示すことが記載されている。したがって、本願発明の抗体は線条体の変性に関連するハンチントン病のような神経変性疾患の治療薬または診断薬として好適に使用できると考えられる。
【0188】
また、C2838-190およびC40010-A6の抗体間において、VH領域、重鎖CDR1、重鎖CDR2、重鎖CDR3、VL領域、軽鎖CDR1、軽鎖CDR2、または軽鎖CDR3のアミノ酸配列は高い相同性を有していた。またそれらは、C2838-190およびC40010-A6の抗体間で異なるアミノ酸残基をそれぞれ数個含んでいた。加えて、一般的に抗体においてある程度のアミノ酸残基の欠失、置換、付加等の変化は抗体の機能をほとんど損なわないことが知られている。したがって、C2838-190またはC40010-A6の抗体は、VH領域、重鎖CDR1、重鎖CDR2、重鎖CDR3、VL領域、軽鎖CDR1、軽鎖CDR2、または軽鎖CDR3にある程度の欠失、置換、付加等が生じた場合でも機能がほとんど損なわれないと考えられる。
【0189】
また、一般的に重鎖の可変領域であるVH領域が抗原に対する特異性、親和性に大きく寄与していることが知られている。例えば、リゾチームで免疫化したマウス脾臓からVH領域遺伝子を抽出増殖し、大腸菌でVH領域のみを単独で発現させたところ、その断片はVL領域がなくても顕著な抗原に対する親和性を保持していることが報告されている(Ward et al., Nature. 1989 Oct 12;341(6242):544-546.)。さらに、VH領域の中でもその構成要素である重鎖CDRが、抗原に対する特異性を決定する上で最も重要な領域であることが知られている。CDRは抗原に対する特異性を決定する領域であるため、抗体間でアミノ酸配列が大きく異なり、超可変領域ともよばれている。なお、重鎖CDRを除くVH領域はフレームワーク領域(FR)と呼ばれ、抗体間で比較的よく保存されている(Kabat et al.,「Sequence of Proteins of Immunological Interest」US Dept. Health and Human Services, 1983.)。加えて、近年ではマウス抗体のCDRのみをヒト抗体Fvに移植した、ヒト化抗体(Immunol. Today, 14, 243, 1993, Int Rev Immunol 10, 241, 1993.)が様々な研究所で作製されており、実際に抗体医薬品として製造販売されている抗体が複数存在する。このことからも、CDR領域が、抗体の機能を特徴付ける上で極めて重要な領域であることがわかる。
【0190】
したがって、同様にC2831-104およびC2838-190の抗体についても、重鎖CDRまたはCDRのアミノ酸配列によってA2a受容体に対する反応性が特徴付けられていると考えられる。
【0191】
<結果の考察>
上記の実施例1〜4によると、1)A2a受容体に高い親和性を持つ、2)A2a受容体の立体構造を認識する、3)A2a受容体のループ部分に結合する、4)A2a受容体へのアゴニスト結合を顕著に阻害する活性を持つ、または5)線条体に強く結合するアデノシンA2a受容体結合性抗体が得られた。これらの性質は、実施例1〜4で得られた抗体が、A2a受容体へのアゴニスト結合阻害活性を持つ抗体として、極めて優れていることを示している。
【0192】
A2a受容体のアゴニスト結合の阻害については、[Bara et al., Neurology. 2003 Aug 12;61(3):293-6]や、[Hauser et al., Neurology. 2003 Aug 12;61(3):297-303.]において、パーキンソン病のモデル動物にin vivoで治療効果があったことが記載されている。また、[Popoli et al., J Neurosci. 2002 Mar 1;22(5):1967-75.]にはハンチントン病の、[El et al., Br J Pharmacol. 2001 Sep;134(1):68-77.]にはうつ病の、[Phillis et al., Brain Res. 1995 Dec 24;705(1-2):79-84]には脳虚血性障害の、[Huang et al., Nat Neurosci. 2005 Jul;8(7):858-9.]には睡眠障害の、特表2005-516917号公報には肺腫瘍および乳房腫瘍の、[Fisher et al., Am J Physiol Renal Physiol. 2001 Nov;281(5):F826-32.]には貧血の、特開2007-145875号公報にはカタレプシーのモデル動物にin vivoで治療効果があったことが記載されている。加えて、[Martinez-Mir et al., Neuroscience. 1991;42(3):697-706.]にはハンチントン病ではA2a受容体の発現量が低下していることが記載されている。
【0193】
従って、優れたA2a受容体へのアゴニスト結合阻害効果を有す、実施例1〜4で得られた抗体は、神経変性疾患(パーキンソン病、ハンチントン病等)、脳虚血性障害、睡眠障害、癌、貧血、またはカタレプシーの治療薬や診断薬として顕著な効果を奏する極めて有効な抗体であると考えられる。
【0194】
また、A2a受容体はcAMPの増加(Chern et al., Mol Pharmacol. 1993 Nov;44(5):950-8.)や、MAPKの活性化(Schulte et al., Int J Biochem Cell Biol. 2003 Apr;35(4):410-4. Review.)に関与していることが知られている。ここで、MAPKの機能阻害は、胃癌や肝癌等のモデル動物にin vivoで治療効果があることが、[Yang et al., Mol Cancer Ther. 2009 Sep;8(9):2537-45. Epub 2009 Sep 1.]および[Huynh et al., Mol Cancer Ther. 2007 Sep;6(9):2468-76.]に記載されている。従って、実施例1〜4で得られた抗体は、A2a受容体の機能阻害とその結果起こるMAPKの機能阻害により、胃癌や肝癌等の治療薬や診断薬として好適に使用できると考えられる。
【0195】
また、診断薬として使用する場合は、当該技術分野において公知の手法、例えば、被験者の細胞、血液、血清、体液、または病理切片等と、標準的な細胞等において、A2a受容体への抗体の結合の様態を検査、比較することで疾患の診断が可能になると考えられる。例えば、疾患がアデノシンA2a受容体の高発現に起因しているときには、実施例1〜4で得られた抗体の結合量が増加し、リガンドの高発現に起因しているときには、リガンドと拮抗することで上記抗体の結合量が減少すると考えられる。
【0196】
その他、A2a受容体関連の基礎研究等に使用する試薬や、A2a受容体との共結晶化等においても、実施例1〜4で得られた抗体が極めて有効な材料になると考えられる。
【0197】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【特許請求の範囲】
【請求項1】
アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤。
【請求項2】
請求項1に記載のアデノシンA2a受容体機能阻害剤であって、
前記機能阻害が、アゴニスト阻害である、
アデノシンA2a受容体機能阻害剤。
【請求項3】
請求項2に記載のアデノシンA2a受容体機能阻害剤であって、
前記アゴニストが、アデノシンまたはアデノシン誘導体である、
アデノシンA2a受容体機能阻害剤。
【請求項4】
請求項1乃至3いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、アデノシンA2a受容体のループ部分に特異的に結合する、
アデノシンA2a受容体機能阻害剤。
【請求項5】
請求項1乃至4いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、マウス抗体、キメラ抗体、ヒト化抗体、ヒト抗体からなる群から選ばれる1種以上の抗体である、
アデノシンA2a受容体機能阻害剤。
【請求項6】
請求項1乃至5いずれかに記載のA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、抗体断片である、
アデノシンA2a受容体機能阻害剤。
【請求項7】
請求項1乃至6いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、モノクローナル抗体である、
アデノシンA2a受容体機能阻害剤。
【請求項8】
請求項1乃至7いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、アデノシンA2a受容体の野生型または変異型に結合する、
アデノシンA2a受容体機能阻害剤。
【請求項9】
請求項1乃至8いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体が、哺乳動物由来のA2a受容体である、
アデノシンA2a受容体機能阻害剤。
【請求項10】
請求項9に記載のアデノシンA2a受容体機能阻害剤であって、
前記哺乳動物が、ヒトである、
アデノシンA2a受容体機能阻害剤。
【請求項11】
請求項1乃至10いずれかに記載のアデノシンA2a受容体機能阻害剤を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬。
【請求項12】
請求項11に記載の治療薬であって、
前記疾患が哺乳動物の疾患である、治療薬。
【請求項13】
請求項1乃至10いずれかに記載のアデノシンA2a受容体機能阻害剤を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、診断薬。
【請求項14】
請求項13に記載の診断薬であって、
前記疾患が哺乳動物の疾患である、診断薬。
【請求項15】
抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、
a)配列番号1のアミノ酸配列、
b)配列番号1において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR2のアミノ酸配列が、
c)配列番号2のアミノ酸配列、
d)配列番号2において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR3のアミノ酸配列が、
e)配列番号3のアミノ酸配列、
f)配列番号3において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項16】
請求項15に記載の抗体であって、
抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、
g)配列番号4のアミノ酸配列、
h)配列番号4において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR2のアミノ酸配列が、
i)配列番号5のアミノ酸配列、
j)配列番号5において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR3のアミノ酸配列が、
k)配列番号6のアミノ酸配列、
l)配列番号6において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項17】
抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、
m)配列番号7のアミノ酸配列、
n)配列番号7において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR2のアミノ酸配列が、
o)配列番号8のアミノ酸配列、
p)配列番号8において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR3のアミノ酸配列が、
q)配列番号9のアミノ酸配列、
r)配列番号9において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項18】
請求項17に記載の抗体であって、
抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、
s)配列番号10のアミノ酸配列、
t)配列番号10において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR2のアミノ酸配列が、
u)配列番号11のアミノ酸配列、
v)配列番号11において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR3のアミノ酸配列が、
w)配列番号12のアミノ酸配列、
x)配列番号12において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項19】
アデノシンA2a受容体結合性抗体である、請求項15乃至18いずれかに記載の抗体。
【請求項20】
請求項15乃至19いずれかに記載の抗体を含む、アデノシンA2a受容体機能阻害剤。
【請求項21】
請求項15乃至19いずれかに記載の抗体を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーの、治療薬。
【請求項22】
請求項15乃至19いずれかに記載の抗体を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーの、診断薬。
【請求項23】
請求項15乃至19いずれかに記載の抗体をコードする塩基配列を含む、ポリヌクレオチド。
【請求項24】
請求項15乃至19いずれかに記載の抗体をコードする塩基配列またはその一部を含む、ベクター。
【請求項25】
受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産される、
アデノシンA2a受容体結合性抗体。
【請求項26】
請求項25に記載のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片。
【請求項27】
アデノシンA2a受容体結合性抗体をスクリーニングする際に使用するリポソーム/アデノシンA2a受容体複合体であって、
固相担体と、
前記固相担体に結合しているリポソームと、
前記リポソームに埋め込まれているアデノシンA2a受容体と、
を備え、
前記アデノシンA2a受容体の少なくとも一部が、リポソームの外側表面に露出している、
リポソーム/アデノシンA2a受容体複合体。
【請求項28】
アデノシンA2a受容体結合性抗体のスクリーニング方法であって、
y)リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、
z)工程y)で結合した抗体を検出する工程と、
a’)アデノシンA2a受容体を変性させる工程と、
b’)工程a’)で変性した変性型のアデノシンA2a受容体に、被検抗体を接触させる工程と、
c’)工程b’)で結合した抗体を検出する工程と、
を含む、スクリーニング方法。
【請求項1】
アデノシンA2a受容体結合性抗体を含む、アデノシンA2a受容体機能阻害剤。
【請求項2】
請求項1に記載のアデノシンA2a受容体機能阻害剤であって、
前記機能阻害が、アゴニスト阻害である、
アデノシンA2a受容体機能阻害剤。
【請求項3】
請求項2に記載のアデノシンA2a受容体機能阻害剤であって、
前記アゴニストが、アデノシンまたはアデノシン誘導体である、
アデノシンA2a受容体機能阻害剤。
【請求項4】
請求項1乃至3いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、アデノシンA2a受容体のループ部分に特異的に結合する、
アデノシンA2a受容体機能阻害剤。
【請求項5】
請求項1乃至4いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、マウス抗体、キメラ抗体、ヒト化抗体、ヒト抗体からなる群から選ばれる1種以上の抗体である、
アデノシンA2a受容体機能阻害剤。
【請求項6】
請求項1乃至5いずれかに記載のA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、抗体断片である、
アデノシンA2a受容体機能阻害剤。
【請求項7】
請求項1乃至6いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、モノクローナル抗体である、
アデノシンA2a受容体機能阻害剤。
【請求項8】
請求項1乃至7いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体結合性抗体が、アデノシンA2a受容体の野生型または変異型に結合する、
アデノシンA2a受容体機能阻害剤。
【請求項9】
請求項1乃至8いずれかに記載のアデノシンA2a受容体機能阻害剤であって、
前記アデノシンA2a受容体が、哺乳動物由来のA2a受容体である、
アデノシンA2a受容体機能阻害剤。
【請求項10】
請求項9に記載のアデノシンA2a受容体機能阻害剤であって、
前記哺乳動物が、ヒトである、
アデノシンA2a受容体機能阻害剤。
【請求項11】
請求項1乃至10いずれかに記載のアデノシンA2a受容体機能阻害剤を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、治療薬。
【請求項12】
請求項11に記載の治療薬であって、
前記疾患が哺乳動物の疾患である、治療薬。
【請求項13】
請求項1乃至10いずれかに記載のアデノシンA2a受容体機能阻害剤を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーからなる群から選ばれる1種以上の疾患の、診断薬。
【請求項14】
請求項13に記載の診断薬であって、
前記疾患が哺乳動物の疾患である、診断薬。
【請求項15】
抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、
a)配列番号1のアミノ酸配列、
b)配列番号1において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR2のアミノ酸配列が、
c)配列番号2のアミノ酸配列、
d)配列番号2において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR3のアミノ酸配列が、
e)配列番号3のアミノ酸配列、
f)配列番号3において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項16】
請求項15に記載の抗体であって、
抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、
g)配列番号4のアミノ酸配列、
h)配列番号4において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR2のアミノ酸配列が、
i)配列番号5のアミノ酸配列、
j)配列番号5において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR3のアミノ酸配列が、
k)配列番号6のアミノ酸配列、
l)配列番号6において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項17】
抗体重鎖可変領域の重鎖CDR1のアミノ酸配列が、
m)配列番号7のアミノ酸配列、
n)配列番号7において1または2個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR2のアミノ酸配列が、
o)配列番号8のアミノ酸配列、
p)配列番号8において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
重鎖CDR3のアミノ酸配列が、
q)配列番号9のアミノ酸配列、
r)配列番号9において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項18】
請求項17に記載の抗体であって、
抗体軽鎖可変領域の軽鎖CDR1のアミノ酸配列が、
s)配列番号10のアミノ酸配列、
t)配列番号10において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR2のアミノ酸配列が、
u)配列番号11のアミノ酸配列、
v)配列番号11において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含み、
軽鎖CDR3のアミノ酸配列が、
w)配列番号12のアミノ酸配列、
x)配列番号12において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、抗体。
【請求項19】
アデノシンA2a受容体結合性抗体である、請求項15乃至18いずれかに記載の抗体。
【請求項20】
請求項15乃至19いずれかに記載の抗体を含む、アデノシンA2a受容体機能阻害剤。
【請求項21】
請求項15乃至19いずれかに記載の抗体を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーの、治療薬。
【請求項22】
請求項15乃至19いずれかに記載の抗体を含む、
神経変性疾患、うつ病、脳虚血性障害、睡眠障害、癌、貧血、およびカタレプシーの、診断薬。
【請求項23】
請求項15乃至19いずれかに記載の抗体をコードする塩基配列を含む、ポリヌクレオチド。
【請求項24】
請求項15乃至19いずれかに記載の抗体をコードする塩基配列またはその一部を含む、ベクター。
【請求項25】
受領番号FERM AP-21859、受領番号FERM AP-21860、受領番号FERM AP-21861、受領番号FERM AP-21862、受領番号FERM AP-21863、受領番号FERM AP-21864、または受領番号FERM AP-21865のハイブリドーマにより生産される、
アデノシンA2a受容体結合性抗体。
【請求項26】
請求項25に記載のハイブリドーマにより生産されるアデノシンA2a受容体結合性抗体の重鎖可変領域、および軽鎖可変領域のアミノ酸配列を含む、抗体、またはアデノシンA2a受容体のアゴニスト阻害作用を有するその機能的断片。
【請求項27】
アデノシンA2a受容体結合性抗体をスクリーニングする際に使用するリポソーム/アデノシンA2a受容体複合体であって、
固相担体と、
前記固相担体に結合しているリポソームと、
前記リポソームに埋め込まれているアデノシンA2a受容体と、
を備え、
前記アデノシンA2a受容体の少なくとも一部が、リポソームの外側表面に露出している、
リポソーム/アデノシンA2a受容体複合体。
【請求項28】
アデノシンA2a受容体結合性抗体のスクリーニング方法であって、
y)リポソーム/アデノシンA2a受容体複合体に、被検抗体を接触させる工程と、
z)工程y)で結合した抗体を検出する工程と、
a’)アデノシンA2a受容体を変性させる工程と、
b’)工程a’)で変性した変性型のアデノシンA2a受容体に、被検抗体を接触させる工程と、
c’)工程b’)で結合した抗体を検出する工程と、
を含む、スクリーニング方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−97869(P2011−97869A)
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2009−254463(P2009−254463)
【出願日】平成21年11月5日(2009.11.5)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 「第6回GPCR研究会のプログラム抄録集」の表紙と奥付のコピー,及びプログラム番号基調講演1が掲載されているページ(ivページおよび1ページ)のコピー
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願日】平成21年11月5日(2009.11.5)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 「第6回GPCR研究会のプログラム抄録集」の表紙と奥付のコピー,及びプログラム番号基調講演1が掲載されているページ(ivページおよび1ページ)のコピー
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
[ Back to top ]

