抗ラクトンシグナル分子抗体または抗ラクトン由来シグナル分子抗体による感染性細菌症の治療のための方法
【課題】細菌の細胞シグナル伝達分子の細胞外濃度を調節することによる、感染性細菌の毒性の抑制のための方法の提供。
【解決手段】対象からの試料中の細菌ラクトンシグナル分子またはラクトン由来シグナル分子の単離、および該細菌ラクトンシグナル分子を、シグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングするために用いること、およびそのようにして同定された該特異的結合分子をそれを必要とする患者に投与する、細菌感染症の治療方法。
【解決手段】対象からの試料中の細菌ラクトンシグナル分子またはラクトン由来シグナル分子の単離、および該細菌ラクトンシグナル分子を、シグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングするために用いること、およびそのようにして同定された該特異的結合分子をそれを必要とする患者に投与する、細菌感染症の治療方法。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、患者における細菌感染症の抑制および治療のための方法に関する。本発明の方法は、すべてではないにしても大半のグラム陰性菌感染症およびグラム陽性菌感染症に適用可能である。本発明は、好ましい態様において、細菌細胞間コミュニケーションのプロセスに関与するシグナル伝達分子に対する親和性および特異性を有する免疫グロブリン分子または免疫グロブリン様受容体分子に基づく治療法の適用を提供する。このような分子と結合させることにより、こららの受容体を、細菌の存在を診断するため、または患者の病状を評価するため、さらには日和見病原体および他の病原体におけるビルレント状態の誘導に関与する分子の濃度を制御するために用いることができる。
【背景技術】
【0002】
発明の背景
今日、病院で治療を受ける患者の死亡および疾病の主な原因の一つは、院内感染に起因するものである。このような感染症に対する易罹病性は、患者の受診の理由となった原疾患の結果であることもあれば、免疫抑制療法の結果であることも、または重大な皮膚損傷(例えば、熱傷)を引き起こす障害の結果であることもある。症例の最も高い割合で原因となっている細菌は緑膿菌(Pseudomonas aeruginosa)である。これはヒトの日和見病原体の典型である。この細菌は免疫低下状態にない組織を感染させることはほとんどないが、組織が何らかの様式で免疫低下状態になれば、感染させない組織はほどんどない。これは比較的少数の種からなるものの、ヒトの健康に対して深刻な脅威を与えるため、本明細書ではこれ以後、感染性細菌の代表例として用いるが、これは本発明の範囲(scope or extent)をいかなる形でも限定するものではない。
【0003】
緑膿菌は、特に重症熱傷の患者ならびに免疫抑制状態にある癌およびAIDSの患者において、尿路感染症、呼吸器系感染症、皮膚炎、軟部組織感染症、菌血症および種々の全身感染症の原因となる日和見病原体の一つである。緑膿菌によって起こる呼吸器感染症は、ほぼ例外なく、下気道が易感染状態にある個体または全身防御機構が不全状態にある個体で起こる。原発性肺炎は慢性肺疾患およびうっ血性心不全の患者で起こる。菌血症性肺炎は一般に、化学療法を受けている好中球減少性癌の患者で起こる。ムコイド型緑膿菌による嚢胞性線維症患者の下気道コロニー形成は頻度が高く、治療は不可能ではないにしても困難である。これは主として免疫低下状態の患者において菌血症を引き起こす。素因となる状態には、血液悪性腫瘍、AIDSに関連した免疫不全症、好中球減少症、糖尿病および重症熱傷が含まれる。シュードモナス菌血症の大部分は、病院および養護施設(nursing home)における院内感染として起こり、院内感染によるグラム陰性菌血症全体のうち約25%を占める。
【0004】
この細菌は、外膜LPSによってもたらされる透過性障壁のために多くの抗生物質に対して自然耐性を有することが知られており、このため、特に危険で恐ろしい病原体である。また、これはバイオフィルムの形態で表面にコロニーを形成する傾向があるため、細胞に治療濃度の抗生物質が透過しなくなる。その自然な生息環境は土壌であり、桿菌、放線菌および糸状菌に付随して生存しているため、これは天然に存在する種々の抗生物質に対する耐性を獲得している。さらに、シュードモナス属細菌は抗生物質耐性プラスミドを耐性因子(R因子)および耐性伝達因子(RTF)の両方として保持しており、これらの遺伝子を形質導入および接合という細菌プロセスによって伝達することができる。シュードモナス属に対して有効な抗生物質はフルオロキノン、ゲンタマイシンおよびイミペネムを含めて少数しかなく、これらの抗生物質でさえもすべての菌株に有効なわけではない。ゲンタマイシンとカルベニシリンとの併用は急性緑膿菌感染症の患者に有効なことが報告されている。抗生物質によるシュードモナス感染症の治療が無効であることは嚢胞性線維症患者で最も顕著に示されており、その事実上すべてが最終的には、耐性が非常に強いために治療が不可能な菌株に感染する。抗生物質耐性のため、臨床分離株の感受性試験が必須である。
【0005】
緑膿菌は通常、土壌および水から、さらには植物および動物の表面から単離することができる。これは生息地にかかわらず世界中でみられるため、極めて「普遍な」細菌である。これは時にヒトの正常細菌叢の一部として存在するが、院外の健康な個体におけるコロニー形成の頻度は比較的低い(推定値は解剖学的な位置により0〜24%の範囲)。院内ではこれは食品、流し、蛇口、モップ、呼吸機器手術器具にコロニーを形成することが知られている。コロニー形成は通常、緑膿菌による感染症の前に起こるが、この病原体は環境に普遍的に存在するため、その正確な伝染源および伝染様式はしばしば不明である。臨床的理由から感染症が疑われる集中治療下の患者のうち、感染原が特定できない者は50%にも上る。現在、世界中で毎日1,400例が緑膿菌のために集中治療室(ICU)で死亡しており、これは死因として最大である。
【0006】
緑膿菌は主として院内病原体である。CDCによれば、米国の病院における緑膿菌感染症の総発生率は平均約0.4%であり(退院1000例当たり4例)、この細菌は院内病原体のうち分離される頻度が4番目に高く、院内感染全体のうち10.1%を占める。全体的には、これは院内肺炎例の16%、後天性尿路感染の12%、手術創感染の8%および血流感染の10%の原因である。好中球減少性癌の患者および骨髄移植患者などの免疫低下患者は緑膿菌の日和見感染に罹りやすく、死亡報告例の30%の原因である。また、これは人工呼吸器関連肺炎の38%、AIDS患者の死亡の50%の原因でもある。熱傷患者における緑膿菌感染は近年減少しているが、これは治療法の改善および食事内容の変化による。しかし、死亡率は依然として高く、熱傷患者の二次感染による死亡全体のうち60%を占める。
【0007】
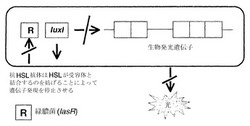
緑膿菌の多能性の1つの理由は、それが、エラスターゼ、LasAプロテアーゼ、アルカリプロテアーゼ、ラムノリピド、IV型線毛を介したトゥイッチング運動(twitching motility)、ピオベルジン(Williamsら、1996、Stintziら、1998、Glessnerら、1999)、ピオシアニン(Brint & Ohman, 1995、Reimmannら、1997)ならびに細胞毒性レクチンPA-IおよびPA-II(Winzerら、2000)を含む、多様な毒性決定因子を生じることにある。これらの毒性決定因子の多くは、クオラムセンシング(quorum sensing)による細胞密度依存的な様式で、遺伝子レベルで調節されることが知られている。緑膿菌は少なくとも2種類のクオラムセンシング系、すなわちlas系およびrhl(vsm)系を有し、これらはそれぞれLuxRI相同体であるLasRI(Gambello & Iglewski, 1991)およびRhlRI(VsmRI)によって構成される(Latifiら、1995)(図2)。LasIは3-オキソ-C12-HSLの合成を導き(Passadorら、1993、Pearsonら、1994)、一方、RhlIはC4-HSLの合成を導く(Winsonら、1995)。las系およびrhl系は、las系がRhlRに対する転写制御を行うという階層として存在すると考えられている(Williamsら、1996、Pesciら、1997)。転写活性化因子LasRは3-オキソ-C12-HSLとともに働いて、毒性決定因子であるエラスターゼ、LasAプロテアーゼ、アルカリプロテアーゼおよび外毒素A(Gambello & Iglewski, 1991、Toderら、1991、Gambelloら、1993、Pearsonら、1994)ならびにlasIをコードする遺伝子の発現を調節する。エラスターゼはコラーゲン、IgG抗体およびIgA抗体、補体を分解することができ、肺粘膜への細菌の付着を促す。アルカリプロテアーゼとの組み合わせにより、これはγインターフェロン(INF)および腫瘍壊死因子(TNF)の不活性化も引き起こす。LasIは3-オキソ-C12-HSLの合成を導き、これはLasRとともにlasIプロモーターと結合して正のフィードバックループ系を形成する。RhlR転写活性化因子は、そのコグネイトAIM(C4-HSL)とともに、rhlAB(ラムノリピド)、lasB、aprA、RpoS、シアニド、ピオシアニンならびにレクチンPA-IおよびPA-IIの発現を調節する(Ochsnerら、1994、Brint & Ohrnan, 1995、Latifiら、1995、Pearsonら、1995、Winsonら、1995、Latifiら、1996、Winzerら、2000)。これらはLasR/3-オキソ-C12-HSLがrhlRを調節する階層的な様式で存在するため(Latifiら、1996、Pesciら、1997)、この2つの系はいずれも上記の毒性決定因子すべての調節に必要である。
【0008】
緑膿菌感染症の治療または予防のための治療法を開発するためにさまざまなアプローチが活発に進められている。あるものは広範囲にわたることを意図しており、またあるものは特定の種類のシュードモナス感染症を対象にしている。従来の経路に沿ったものには、ワクチン(例えば、米国特許第6,309,651号に記載されたものなど)、およびグラム陰性菌に対して有効と考えられるが主として緑膿菌に対して作用するように設計され、エアロゾル吸入によって投与される新たな抗生物質(SLIT)の開発が含まれる。現在調査中のさらにもう1つの観察所見は、準至適(sub-optimal)増殖抑制濃度で投与された抗生物質エリスロマイシンが、緑膿菌の血球凝集素、溶血素、プロテアーゼおよびホモセリンラクトン(HSL)を同時に抑制し、このため持続的な緑膿菌感染症の治療に適用しうる可能性があることである。両親媒性ペプチドを含むクリーム製剤も、熱傷または他の重篤な皮膚創傷の感染を予防する手段として検討されている。米国特許第6,309,651号も、緑膿菌のPcrV病原性タンパク質に対する抗体が感染に対する防御を与える可能性があることを教示している。
【0009】
また、病原性を制御する手段としてのホモセリンラクトンレベルの調節にもある程度関心が寄せられている。ある種の藻類は、いくつかの陸生植物と同じように、アシル-ホモセリンラクトン(AHL)の競合阻害物質、例えばフラノン(Manefield, 1999)を産生することが示されている。これらの化合物はAHLシグナル分子をその受容体タンパク質から移動させ、AHLバイオアッセイにおけるアゴニストまたはアンタゴニストとして作用しうる(Tepletskiら、2000)。HSL濃度を低下させるために用いられる他の方法には、HSLの分解を触媒するオートインデューサー(autoinducer)不活性化酵素(AiiA)の開発が含まれる。
【0010】
現在開発中の治療法には、潜在的な問題および限界が数多く存在する。ワクチンが有効な治療法であるか否かはまだ証明されていない。緑膿菌は宿主抗体によるオプソニン作用に対して効果的な防御を行う広範なムコイド性莢膜を生成し、このことは抗シュードモナス抗体の血清価が高い持続感染患者の存在によって示される。米国特許第6,309,651号に記載されたようなワクチンおよび抗PcrV抗体などによる治療の適用性における限界は、これらのアプローチがシュードモナス感染症に限定され、他の細菌に対しては有効でないという点にある。オートインデューサー模倣物の使用は、受容体結合部位に対してHSLと効果的に拮抗するために必要な大部分のものの濃度、および副作用の可能性によって制限される。シュードモナス属および他の細菌によって放出されるHSLは、ヒトの生理機能に対してさまざまな直接効果を及ぼす。これらには、国際公開公報第01/26650号に記載されたようなヒスタミン放出の阻害が含まれる。国際公開公報第01/74801号は、HSLがリンパ球増殖を阻害し、単球およびマクロファージによるTNF-αの分泌をダウンレギュレートし、それによって全般的な免疫抑制物質としても作用しうることを記載している。このため、競合的HSL模倣物の使用を伴う治療法には、患者の免疫系のダウンレギュレーションを引き起こすという危険がある。これは一般に望ましくなく、免疫低下状態の患者では特にそうである。抗生物質の使用は、この細菌(および他のもの)が抗生物質に対する耐性を獲得する著しい能力を考えれば、せいぜい短期的戦略と見なしうる。
【0011】
緑膿菌の病原性が明らかに多因子性であることは、毒性因子が多数あること、およびこの細菌と関係のある疾患が広範囲に及ぶことによって明確に示されている。組織への侵入および播種のために必要な細胞外毒性因子の多くは、ホモセリンラクトンをベースとするシグナル分子および特定の転写活性化タンパク質がかかわる細胞間シグナル伝達系によって制御される。これらの調節系により、緑膿菌が、協調した細胞密度依存的な様式でビルレント形態をとること、および宿主防御機構を克服することが可能になる。このような細胞シグナル伝達およびそれに付随する毒性因子の産生を妨害することは、緑膿菌によって起こる疾病および死亡を減らすために有望な治療アプローチである。このようなアプローチの重要性は、同様の細胞間シグナル伝達系を利用することが判明している細菌病原体の数が増加していることによって明確に示されている。
【0012】
宿主-病原体相互作用の分子的基盤を研究するためには、ヒトにおける病原性と関連のある刺激および機序が再現されうる適したモデル系(非ヒト)を利用しうることが望ましい。多くの疾患の場合には、関係する病原体は、例えばHIVのように、1つ、または密接に関連した少数の種または群に本質的に対応付けられる。その他の生物体は、種、属および場合によっては界の障壁を越えた広範囲にわたる宿主で疾患を引き起こすことができる。緑膿菌はこのような病原体の一つであり、種々の植物種、昆虫種および動物種のいずれをも感染させることができる。
【0013】
近年、ヒトおよびマウスを感染させる能力がある複数の緑膿菌株が線虫シノラブディス・エレガンス(Caernohabtidis elegans)も死滅させうることが示されている(Tanら、1999a、Tanら、1999b、Tanら、2000)。さらに重要なことに、緑膿菌のC.エレガンス(C. elegans)に対する病原性は、ヒトにおける病原性を制御するのと同じ細胞密度依存的なクオラムセンシングシステムによって調節される。緑膿菌およびC.エレガンスの双方のゲノムの配列解読が最近完了したため、この関係は細菌性疾患の機序の研究にとって理想的なものとなった。C.エレガンスのタンパク質の36%はヒトにも相同体があり(Darbyら、1999)、C.エレガンスは実験室で容易に増殖させうるという事実から、これはヒトにおける病因および宿主防御のモデルとして広く用いられるようになっている(KurzおよびEwbank、2000)。
【0014】
緑膿菌がC.エレガンスの死滅を媒介するさまざまな機序が同定されている。Tanら、1999a;1999bおよびMahajan-Miklosら、1999は、マウスおよび植物をも感染させる臨床分離株(PA14株)の使用を記載している。この細菌の増殖条件を変化させることにより、その後にC.エレガンスに適用して、急速な死滅(数時間以内)または緩徐な死滅(3〜4日以内)のいずれかを引き起こすことができる。急速な死滅の機序はRhlクオラムセンシングシステムのみに依存する。さらに、死滅は拡散性ピオシアニン毒素によって起こるため、内部で緑膿菌を適宜増殖させた無細胞培地、または加熱死させた抽出物の使用は等しく有効である。これに対して、緩徐な死滅の機序はLas系およびRhl系の両方に依存しており、線虫の消化管に明らかな感染を引き起こす。死滅は細菌による宿主への浸潤の結果と考えられるため、このアッセイは動物における感染に関して最も有用な線虫モデルを提供する。第3の死滅機序はDarbyら(1999)によって記載されている。この場合には、脳心臓浸出物寒天培地中で増殖させた緑膿菌PA01株(既知のヒト病原体の1つ)が、C.エレガンスの急速な麻痺および死滅を引き起こす。前述の緩徐な死滅と同じく、麻痺はLas系およびRhl系の両方に依存的である。
【0015】
有害な副作用がなく、しかも近い将来のうちに病原性細菌によって回避される可能性が低い方法による、HSLおよび病原性に関与する他の細菌細胞シグナル伝達分子の濃度を調節する効果的な手段を開発することには需要が存在する。
【発明の概要】
【0016】
本発明は、ヒト、動物および植物の病原性細菌の毒性を、細菌の細胞シグナル伝達分子の細胞外濃度を調節することによって制御するための方法を提供する。他の治療法は、特定の1つの病原体もしくは病原体群に、または細菌毒性の特定の面に限定されるが、本発明は細菌毒性全般を取り扱う。
【0017】
本発明の第1の面によれば、細菌によって分泌されるラクトンシグナル分子またはラクトン由来シグナル分子に対する抗体が提供される。
【0018】
本発明による抗体はポリクローナル抗体でもモノクローナル抗体でもよい。ポリクローナル抗体は、抗原を動物に注入して、適した動物宿主(例えば、マウス、ラット、モルモット、ウサギ、ヒツジ、ニワトリ、ヤギまたはサル)における産生を賦活することによって産生させることができる。必要であればアジュバントを抗原とともに投与してもよい。続いて抗体を、抗原との結合により、または以下に述べるようにして精製することができる。モノクローナル抗体はハイブリドーマから産生させることが可能である。これらは、、不死化細胞系を作製する目的で、骨髄腫細胞および所望の抗体を産生するBリンパ球細胞を融合させることによって形成させることができる。これはよく知られたKohler & Milstein法である(Nature 256 52-55 (1975))。
【0019】
特定のタンパク質と結合するモノクローナル抗体およびポリクローナル抗体を作製するための方法は、現在、当技術分野では十分に開発されている。それらは標準的な免疫学のテキスト、例えばRoittら、「免疫学第二版(Immunology second edition)」(1989)、Churchill Livingstone, Londonで考察されている。
【0020】
完全な抗体のほかに、本発明は、抗原との結合が可能なその誘導体も含む。したがって、本発明は、抗体断片および合成構築物を含む。抗体断片および合成構築物の例は、Dougallらにより、Tibtech 12372-379(September 1994)に示されている。抗体断片には、例えば、Fab断片、F(ab)2断片およびFv断片が含まれる(Roittら[前記]参照)。Fv断片を改変して、一本鎖Fv(scFv)分子として知られる合成構築物を作製することができる。これは、分子の安定性に寄与するVH領域およびVL領域を共有結合させるペプチドリンカーを含む。本発明はこのため、一本鎖抗体またはscAbにも適用される。
【0021】
他の合成構築物にはCDRペプチドが含まれる。これらは抗原結合決定基を含む合成ペプチドである。ペプチド模倣物を用いることもできる。これらの分子は通常、CDRループの構造を模しており、抗原と総合作用する側鎖を含む、立体配座が限定された環状有機物である。合成構築物にはキメラ分子も含まれる。したがって、例えば、ヒト化(または霊長類化)抗体またはその誘導体も本発明の範囲に含まれる。ヒト化抗体の一例は、ヒトフレームワーク領域を有するが、齧歯類の超可変領域を有する抗体である。合成構築物には、抗原結合性に加えて何らかの望ましい特性を備えた分子を提供する共有結合性の部分(moiety)を含む分子も含まれる。例えば、この部分は、標識(例えば、蛍光標識または放射性標識などの検出可能な標識)または薬学的活性のある物質であってよい。
【0022】
抗細菌シグナル分子抗体を作製するためには、標的分子または適した誘導体を2つの異なる担体分子(タンパク質)と結合させることが好ましいが、単一の複合分子種を用いることもできる。細菌シグナル分子は一般に、インビボで免疫応答を賦活するには、または抗体ライブラリーから高親和性抗体を選択するための抗原の源として直接用いるためには、小さすぎる。細胞シグナル伝達分子(以下では「抗原」と称する)に対して特異的な抗体の選択は、特異的結合対(sbp)の最初のメンバーのレパートリー(ライブラリー)、例えば、糸状バクテリオファージの表面に提示された抗体のライブラリーを用いる好ましい態様において行われる。受容体のライブラリーからの特異的な受容体の選択を可能にする任意の他のシステムも、本発明の方法の方法に適用可能である。代替的な態様においては、シグナル分子特異的クローンを、抗原結合体を接種した動物から作製した、抗体を分泌する一連のハイブリドーマ細胞系から選択することができる。一般的な例示の目的には、ファージ粒子の表面に提示された抗体結合部位のライブラリーの例が用いられる。
【0023】
抗原を適した担体分子(これはタンパク質、ペプチドまたは任意の天然化合物もしくは合成化合物のいずれでもよい)または材料と結合させた結合体(以下では「結合体-1)と称する)を、「イムノチューブ(immunotube)」またはマイクロタイタープレートなどの適した固体支持体上に固定化し、コーティングされなかった表面を乾燥粉乳などの非特異的ブロック剤でブロックする。適した結合体分子には、ウシ血清アルブミン(BSA)、キーホールリンペットヘモシアニン(KLH)、ウシチログロブリン(TG)、オブアルブミン(Ova)などのタンパク質(ただしこれらには限定されない)またはビオチンなどの非タンパク質が含まれる。結合体分子の選択に関する唯一の制限は、それが何らかの様式で固定化可能であって、免疫処置に関しては免疫応答を誘発する程度に十分に大きいことである。
【0024】
特異的結合対(sbp)の最初のメンバーのライブラリー(「ライブラリー」)を、固定化した結合体に対して適用し、結合体-1を認識するsbpメンバーが結合するのに十分な時間にわたってインキュベートする。結合体を認識しないファージをストリンジェントな洗浄によって除去する。結合したまま残ったファージを、例えばトリエチルアミンまたは他の適した試薬により、中性pHに戻すための緩衝液中に溶出させる。続いて、回収したファージ粒子を大腸菌などの適した宿主生物に感染させ、選択した各メンバーの数を増幅するために培養し、それによって第2の「強化」ライブラリーを作製する。続いてこの工程を強化ライブラリーを用いて繰り返し、第2の担体タンパク質と結合した抗原(結合体-2)を認識するファージ-抗体(「ファージ」)を選択する。
【0025】
必要に応じてこれをさらに数回行い、選択工程を遊離型の抗原を認識するsbpメンバーの選択が優先されるように変更する。ファージを、最初は結合体-1を用い、次は結合体-2(入手可能な場合)というように以後のそれぞれの回で交互に用いて、以前に記載されたように抗原結合体に対して選択する。結合したファージを、遊離抗原または小型で可溶性の選択可能な部分、例えばビオチンと結合させた抗原の溶液とともに、結合型の抗原に対してより親和性の高いsbpメンバーが固定化された結合体から解離するのに十分な時間にわたってインキュベートすることによって溶出させる。遊離抗原によって溶出したファージを大腸菌細胞に感染させて増幅および再選択を行い、固定化された抗原と結合したままのものは廃棄する。または、好ましさは落ちるものの、結合体と結合するすべての抗体を、例えば低pHを用いて溶出させることもできる。
【0026】
それぞれの回の選択で選ばれた個々の(モノクローナル)ファージクローンを、所望の結合特性に関してスクリーニングする。これは、必要条件に応じて、SPR(表面プラスモン共鳴)およびELISA(固相酵素免疫アッセイ)などの技法を含む、当業者に知られた種々の方法によって行うことができる。選択基準には、結合体を形成させた誘導体の存在下で、遊離した可溶型の抗原と選好的に結合する能力が含まれると考えられる。
【0027】
本発明の好ましい態様において、抗体はナイーブなヒト抗体ファージディスプレイライブラリーから作製される(McCaffertyら、Nature 348: 552-554, 1990;および国際公開公報第92/01047号における記載の通り)。このため、抗体を診断用または透析用の試薬として用いることに加えて、患者への投与のために用いることが可能と考えられる。診断アッセイにおいては、抗体を、患者におけるHSLの有無および濃度を決定し、それによって患者の感染状態を予測するために用いることが可能と考えられる。また別の態様において、ライブラリーを、HSLと適した担体分子との1つまたは複数の結合体による前免疫処置を行った動物から構築することもできる。さらにもう1つの選択肢は、上記の通りに免疫処置を行った動物からのハイブリドーマ細胞系の作製である。後者の2つの場合には、例えば、宿主動物-ヒトキメラ抗体を作製すること、または適した抗体フレームワークスカフォールドへのCDRグラフトによる「ヒト化」により、結果として得られる抗体の免疫原性を低下させるための段階を取り入れることが好ましい。適用しうる他の方法には、抗体内部のT細胞エピトープと考えられるものを同定し、その後にこれらを位置指定変異誘発法などによって除去すること(脱免疫化(de-immunisation))が含まれると考えられる。さらにもう1つの態様において、異なるクラスのヒト免疫グロブリン(IgG、IgAなど)からの定常領域を含むように抗体を作製し、動物細胞において完全な抗体分子として産生させることもできる。特に、これらのアプローチは抗体を治療的に用いる場合に望ましい。
【0028】
本発明に関して、抗体はモノクローナル性でもポリクローナル性でもよい。抗体はヒト抗体でもヒト化抗体でもよく、透析/診断の用途には他の種からのものでもよい。Fab、F(ab').sup.2(F(ab')2とも表記される)、FvまたはscFvなどの抗体断片または誘導体を用いることもでき、Hustonら(Int. Rev. Immunol. 10: 195-217, 1993)によって記載されたような一本鎖抗体(scAb)、ドメイン抗体(dAbs)、例えば単一ドメイン抗体、または抗体様の単一ドメイン抗原結合性受容体を用いることもできる。抗体のほかに、抗体断片および免疫グロブリン様分子、ペプチド模倣物または非ペプチド性模倣物を、細胞シグナル伝達分子の結合を阻害することによって細菌感染を阻止またはモジュレートするという点で抗体の結合活性を模倣するように設計することもできる。
【0029】
適した抗体の調製後に、一般的に利用可能ないくつかの技法のいずれかにより、それを単離または精製することができる(例えば、「抗体:実験マニュアル(Antibodies: A Laboratory Manual)」、HarlowおよびLane編、Cold Spring Harbor Laboratory Press(1988))。一般的に適した技法には、ペプチドもしくはタンパク質アフィニティーカラム、HPLCもしくはRP-HPLC、プロテインAもしくはプロテインGカラムによる精製、またはこれらの技法の組み合わせが含まれる。組換え抗体は標準的な方法に従って調製し、ELISA、ABC、ドットブロットアッセイなどの一般的に利用可能な手順を用いて特異性に関してアッセイすることができる。
【0030】
ラクトンシグナル分子は、ホモセリン分子でもよく、ペプチドチオラクトン分子でもよい。
【0031】
ホモセリンラクトン分子は、以下の群からなる群より選択される一般式を有しうる。

式I
式II
式III
式中、n=0〜12である。
【0032】
一般式Iの化合物は、アシル-ホモセリンラクトン分子として記載することができる。一般式IIの化合物は3-オキソ-ホモセリンラクトンとして記載することができる。一般式IIIの化合物は3-ヒドロキシホモセリンラクトンとして記載するこ
とができる。
【0033】
一般式Iに関して好ましいホモセリンラクトン分子は、N-ブタノイル-L-ホモセリンラクトン(BHL)(式中n=0)、N-ドデカノイル-L-ホモセリンラクトン(dDHL)(式中n=8)およびn-テトラデカノイル-L-ホモセリンラクトン(tDHL)(式中n=10)である。一般式IIに関して好ましいホモセリンラクトン分子は、N-3-(オキソヘキサノイル)-L-ホモセリンラクトン(OHHL)(式中n=2)およびN-(-3-オキソドデカノイル)-L-ホモセリンラクトン(OdDHL)(式中n=8)である。一般式IIIに関して好ましいホモセリンラクトン分子は、N-(-3ヒドロキシブタノイル)-L-ホモセリンラクトン(HBHL)(式中n=0)である。
【0034】
一般に、細菌HSLはさらに2つのクラスに細分することができる:i)長鎖分子(炭素10〜12個)およびii)短鎖分子(炭素4〜8個)。シュードモナス属の場合には、これらの異なるサイズのクラスは異なるR分子と結合し、異なる遺伝子のスイッチを入れる。長鎖分子はLASとして知られるR相同体遺伝子産物と結合し、短鎖分子はRHLタンパク質相同体と結合する。
【0035】
ペプチドチオラクトンは以下の一般式(IV)を有しうる。

式中、Xは任意のアミノ酸であり、n=1〜10である。
【0036】
本明細書の上記の部分および全体を通じて、アミノ酸残基は通常のIUPAC一文字表記によって示される。一文字表記は、以下のように、アミノ酸残基の古典的な三文字表記と相互に関連付けることができる。

【0037】
好ましいペプチドチオラクトン分子は以下の構造を有しうる。

【0038】
種々の低分子量シグナル分子を用いて細胞間のコミュニケーションを行うことが判明した細胞種の数は増加しつつある。グラム陰性菌は主としてN-アシルホモセリンラクトンを用いる(表1)。後者は共通のホモセリンラクトン環構造を有する化合物の一群であり、側鎖の長さおよび構造はさまざまである(図1a)。この群にはアシル-ホモセリンラクトン、3オキソ-ホモセリンラクトンおよび3-ヒドロキシ-ホモセリンラクトンという3つのクラスがある。単一の種が、複数のクラスのメンバーを産生し、それらに対して応答することができる。
【0039】
ラクトン由来シグナル分子が、フラノシルホウ酸ジエステル、例えばオートインデューサー-2もしくはAI-2、Pro-AI-2またはPro-AI-2反応性ハプテンであってもよい(図1b)。ビブリオ・ハーヴェイ(Vibrio harveyi)および炭疽菌を含む多くのグラム陰性菌およびグラム陽性菌が第2のシグナル分子であるAI-2を産生するが、これはホモセリンラクトンと同じS-アデノシルメチオニン源に由来し、受容体LuxPと結合する(図1b)。AI-2は、多岐にわたる種によって産生および認識されて毒性を誘導する普遍的な細菌シグナル分子である可能性が高いと考えられている。

オートインデューサー-2(AI-2)
【0040】
AI-2は2,3-ジヒドロキシ-4-メチル-3,4-ホウ酸ジエステルとして記載することができる。
【0041】
また、ラクトン由来シグナル分子が、自然に環状化してPro-AI-2(これは自然にホウ酸と反応してAI-2を形成する)を形成する、4,5-ジヒドロキシ-2,3-ペンタンジオン(DPD)の誘導体であってもよい(図1b)。Pro-AI-2は2,4diヒドロキシ-4メチル-フラン-3-オンとして記載することができる。Pro-AI-2は、図1bに示したように、4-メチル位にヘプタン酸部分を付加してPro-AI-2反応性ハプテンを形成するように誘導体化することができる。他の誘導体には、メタン酸、エタン酸、プロパン酸、ペンタン酸、ヘキサン酸、ヘプタン酸、オクタン酸、ノナン酸またはデカン酸といった、他の直鎖状または分枝状の飽和または不飽和C1〜C10カルボン酸部分が含まれうる。

【0042】
黄色ブドウ球菌などのグラム陽性菌は短いペプチドを用いる(図1c)(Mayvilleら、1999)。これらの細胞は、細胞密度の低い条件ではシグナル分子の濃度が対応して低いといったように、これらの分子を局所的な細胞密度を決定するために用いる。細胞密度が高い場合には局所的なシグナル分子の濃度も高い。この濃度がある閾値レベルに達すると、これは毒性にかかわる遺伝子の転写および宿主における疾病状態の発現を誘導する。
【0043】
ブドウ球菌属によって用いられるチオラクトン誘導体化ペプチドシグナル分子には別の生物機能もある。これらは細菌に局所的な集団密度に関する情報を提供するだけでなく、異なるサブグループに属する他の黄色ブドウ球菌における毒性の抑制にも働く(Lyonら、2000)。この二機能性はペプチドの異なる構造要素に分かれており、チオラクトンC末端が他のサブグループの毒性を抑制する。改変されていないN末端は、それを合成したサブグループにおける毒性遺伝子の発現をアップレギュレートするシグナルとして作用するが、これは同じく必要なC末端を伴う場合のみである。チオラクトン結合を含むC末端の5アミノ酸を含む切断型ペプチドが存在すると、他の3つのサブグループだけでなく、それを産生した菌株も抑制される。したがって、その結果として、シグナルペプチドのN末端を認識し、それを露出した状態に保つことによってC末端を効果的に提示する抗体は、すべての黄色ブドウ球菌株における毒性を効果的に抑制すると考えられる。このため、本発明の抗体を、上記のようにチオラクトン分子またはその構造要素、例えばペプチド配列またはチオラクトン部分によって提示されるエピトープに対して産生させてもよい。
【0044】
本発明のある種の好ましい態様において、抗体はscAb、特にXL1-Blue G3H5、G3B12、G3G2および/またはG3H3と命名された大腸菌クローンから得られるscAbである。これらのクローンは、ブダペスト条約の条項に従ってNCIMB(Aberdeen, UK)に2003年3月18日に寄託されており、アクセッション番号は以下の通りである:G3H5はNCIME-41167として寄託され、G3B12はNCIMB-41168として寄託され、G3G2はNCIMB-41169として寄託され、G3H3はNCIMB-41170として寄託されている。これらの菌株は、100μg/mlアンピシリン、選択的には12.5μg/mlテトラサイクリンおよび/または1%グルコースを添加したLB培地などの適した増殖培地中において、37℃大気中という標準的な条件下で培養することができる。
【0045】
細菌シグナル伝達分子は、それらに関するスクリーニングが行われたすべての生物体で発見されている。これはあらゆる種に適用可能な偏在的な系であるように思われる。その主な違いは、グラム陰性(gram-ve)菌はいずれもホモセリンラクトンをベースにした分子を用い、グラム陽性(gram +ve)菌は(修飾された)低分子ペプチドを用いるという点である。ビブリオ・ハーヴェイおよび炭疽菌などの多くのグラム陰性菌およびグラム陽性菌(Jones, M. B.およびBlaser, M. J.)も低分子量のホウ素含有有機分子AI-2(オートインデューサー-2)を用いるが、これはホモセリンラクトンと同じくS-アデノシルメチオニンに由来する。この分野の以前の研究は、シグナル分子を、認識されるものの機能しない、すなわち病原性スイッチングを行わないものに模倣させること、または種々の受容体系をブロックすることに集中して行われてきた。これらの方法の欠点は主として、模倣またはブロックに対する耐性が生じうること、および「真の」シグナル分子が依然としてそこにあり、結合に関して競合すると考えられることにある。さらに、ある種の細菌シグナル伝達分子、例えばホモセリンラクトンは、それ自体が毒性因子であり、宿主(すなわち患者)の免疫抑制を直接引き起こす。本発明の本質は実際のシグナル分子を標的とすることであり、これはすべての細菌細胞間シグナル伝達系(グラム陰性およびグラム陽性)に適用することができる。このアプローチは、細菌が自らが攻撃されていることを認識せず、単に自らが単独で存在しているものと検知すると考えられる点で、この分野における過去のすべての取り組みを上回る主要かつ重要な利点を有する。耐性に対する選択圧は全く存在しないと考えられる。
【0046】
本発明の第2の面によれば、本発明の第1の面に定義された抗体を含む薬学的組成物が提供される。
【0047】
このような組成物は、薬学の技術分野の当業者に知られた任意の方法により、例えば、有効成分を無菌条件下で担体、希釈剤または添加剤と混合することにより、調製することができる。
【0048】
本薬学的組成物は、任意の適した経路による投与、例えば、経口的(口腔内または舌下を含む)、直腸内、鼻内、局所適用(口腔内、舌下または経皮的を含む)、腟内または避腸的(皮下、筋肉内、静脈内または皮内を含む)経路による投与に対して適合させることができる。このような組成物は、薬学の技術分野で知られた任意の方法により、例えば、有効成分を無菌条件下で担体または添加剤と混合することにより、調製することができる。
【0049】
経口投与用に適合化された薬学的組成物は、カプセル剤または錠剤などの離散的な単位;粉剤または顆粒剤;液剤、シロップ剤または懸濁剤(水性もしくは非水性の液体;または食用になる発泡体もしくはホイップ;またはエマルションの状態で)として提供することができる。
【0050】
錠剤または硬ゼラチンカプセル剤のために適した添加剤には、ラクトース、トウモロコシデンプンまたはその誘導体、ステアリン酸またはその塩が含まれる。
【0051】
軟ゼラチンカプセル剤に用いるのに適した添加剤には、例えば、野菜油、蝋状物質、脂肪、半固形状または液状のポリオールなどが含まれる。
【0052】
液剤およびシロップ剤の調製のために用いうる添加剤には、例えば、水、ポリオールおよび糖が含まれる。懸濁剤の調製のためには、水中油型または油中水型の懸濁液を得るために油(例えば、植物油)を用いることができる。
【0053】
経皮的投与のために適合化された薬学的組成物は、レシピエントの表皮と密に接触した状態を長期間にわたって維持することを意図した離散的パッチとして提供することができる。例えば、Pharmaceutical Research, 3(6), p.318 (1986)に一般的に記載されたようにして、有効成分をパッチからイオントフォレシス的に送達することができる。
【0054】
局所適用のために適合化された薬学的組成物は、軟膏、クリーム剤、懸濁剤、ローション剤、粉剤、液剤、ペースト剤、ゲル剤、噴霧剤、エアロゾル剤または油剤として製剤化することができる。眼または他の外部組織、例えば口腔および皮膚の感染症に対しては、組成物を局所用の軟膏またはクリーム剤として適用することが好ましい。軟膏として製剤化する場合には、有効成分をパラフィン基剤または水混和性基剤のいずれかとともに用いることができる。または、有効成分を水中油型クリーム基剤または油中水型基剤とともにクリーム剤として製剤化することもできる。眼に対する局所適用のために適合化された薬学的組成物には、有効成分が適した担体中、特に水性溶媒中に溶解または懸濁化された点眼薬が含まれる。口腔内への局所適用のために適合化された薬学的組成物には、バッカル錠剤、トローチ剤および含嗽剤が含まれる。
【0055】
直腸内投与のために適合化された薬学的組成物は、坐薬または浣腸剤として提供することができる。
【0056】
担体が固体である、鼻内投与のために適合化された薬学的組成物には、粒径が例えば20〜500ミクロンの範囲であって、鼻から吸入する様式で、すなわち鼻の近くに保持した粉末容器からの鼻腔を介した急速吸入によって投与される粗末が含まれる。担体が液体である、スプレー式点鼻薬または点鼻薬としての投与のために適した組成物には、有効成分の水溶液または油性溶液が含まれる。
【0057】
吸入による投与のために適合化された薬学的組成物には、さまざまな種類の定量噴霧加圧噴霧装置、ネブライザーまたは吸入器によって生成される微粒子状物質またはミストが含まれる。
【0058】
腟内投与のために適合化された薬学的組成物は、ペッサリー、タンポン、クリーム剤、ゲル剤、ペースト剤、発泡体または噴霧製剤として提供することができる。
【0059】
避腸的投与のために適合化された薬学的組成物には、水性および非水性の滅菌注射液(これは抗酸化剤、緩衝剤、静菌剤、および製剤を意図したレシピエントの血液と実質的に等張にする溶質を含みうる);ならびに水性および非水性の滅菌懸濁液(これは懸濁剤および増粘剤を含みうる)が含まれる。注射液のために用いうる添加剤には、例えば、水、アルコール、ポリオール、グリセリンおよび植物油が含まれる。組成物は、単位投薬式または多回投与用の容器、例えば密封したアンプルおよびバイアルとして提供することができ、使用の直前に滅菌液体、例えば注射用の水を添加するのみでよい凍結乾燥状態で保存することができる。即時調製による注射液および懸濁液は、滅菌した粉末、顆粒および錠剤から調製することもできる。
【0060】
本薬学的組成物は、保存料、溶解補助剤、安定化剤、湿潤剤、乳化剤、甘味料、着色料、着香料、塩(本発明の物質自体を薬学的に許容される塩の形態で提供することもできる)、緩衝剤、コーティング剤または抗酸化剤を含みうる。それらは、本発明の物質のほかに治療活性のある物質を含んでもよい。
【0061】
本発明の薬学的組成物の投与量は、治療しようとする疾患または障害、治療しようとする個体の年齢および状態などに応じて幅広い範囲にわたりうると考えられ、最終的には医師が用いるべき適切な投与量を決定すると考えられる。
【0062】
このような組成物はヒト用にも獣医学用にも製剤化することができる。本出願は、文脈において明白にそれ以外であることが示されない限り、ヒトにも動物にも等しく適用されるものと解釈されるべきである。
【0063】
本発明の第3の面によれば、対象の細菌感染症の治療のための方法であって、本発明の第1の面の抗体の対象への投与を含む方法が提供される。
【0064】
疾病状態の原因になることが判明している細菌の例は表1に示されている。したがって、本発明のこの面の方法は、対象における、表1に示された細菌の菌株による感染症の治療方法にも適用される。本発明の1つの好ましい態様においては、対象における緑膿菌感染症の治療方法が提供される。
【0065】
本発明の治療用物質は、ヒトまたは非ヒト動物の処置に用いることができる。処置は予防的でもよく、または既存の状態に関するものでもよい。
【0066】
抗体は通常、無菌性の薬学的組成物の部分として供給され、これは薬学的に許容される担体を含むことが一般的である。この薬学的組成物は、任意の適した形態であってよい(それを患者に投与する所望の方法に依存する)。
【0067】
それを単位投薬式剤形(unit dosage form)ととして提供してもよく、一般的には密封容器内にある状態で提供されると考えられ、さらにキットの部分として提供してもよい。このような部分を有するキットは通常(必然的ではない)、使用のための指示書を含むと考えられる。これが複数の前記単位投薬式剤形を含んでもよい。
【0068】
本発明の方法は、短期的または長期的、急性または慢性の病気/疾患に対して適用することができ、植物、動物(ヒトを含む)のほとんどまたはすべての細菌病原体に対して有効である。また、本発明を、病原性細菌の曝露のリスクまたはそれによるリスクのある個体における疾患の発現の予防のための予防的処置として用いることもできる。本発明にはまた、多くの感染によって起こる免疫系のダウンレギュレーションを制限または予防する能力もあり、これは癌、嚢胞性線維症、AIDSおよび他の免疫抑制状態に罹患した患者の場合に特に関心が持たれる。さらに、本発明の方法は特に細菌細胞シグナル伝達分子を対象としており、細菌細胞それ自体は主として対象とならないため、細菌集団に作用して、記載した治療に対する耐性を生じさせる選択圧は存在しないと考えられる。
【0069】
抗体は、感染した患者に対して、細菌感染症の是正および軽減を目的として投与することができる。これには、嚢胞性線維症患者による、推定寿命を延長させるためのエアロゾル中の抗体の吸入が含まれうる。
【0070】
さらにもう1つの態様において、抗体は、免疫抑制患者に対して、免疫能を高めるために投与される。
【0071】
さらにもう1つの態様において、細胞シグナル伝達分子と免疫原性タンパク質との結合体を、個体または患者に対して、シグナル伝達分子に対する免疫応答を賦活させ、中和抗体の産生を引き起こすことを目的として投与することができる。
【0072】
さらにもう1つの態様において、抗体は、例えば患者の血流または胸水における、病原体の可能性があるものの存在および/または病原性状態を検出するための免疫診断試薬として用いられる。
【0073】
さらにもう1つの態様において、抗体は、細菌細胞シグナル伝達分子を患者の血液から透析形式で選択的に除去するための免疫捕捉試薬として用いられる。
【0074】
さらにもう1つの態様において、感染性微生物の病原性および毒性を調節することを目的として、患者の血液からの細菌細胞間シグナル伝達分子の除去のために代替的な方法を適用することができる。これは、前記シグナル分子と結合する他の天然の受容体または天然の受容体をベースとする分子を用いて実現することができる。または、分子鋳型を有するポリマー(MIP)などの非天然性受容体を適用することもできる。このクラスの受容体は、薬物(Hartら、2000)およびステロイド(Whitcombeら、1995;Ramstromら、1996;Rachkovら、2000)などの低分子量生体分子と特異的に結合しうることがすでに示されている。さらにもう1つの選択肢においては、透析を、腎透析のように、患者の血液からのすべての低分子量分子の非特異的な除去によって行うことができる。
【0075】
さらにもう1つの態様において、受容体は触媒活性または酵素活性を有し、細胞シグナル伝達分子を、もはや標的生物によって認識されないような形態または病原性スイッチングを引き起こさないような形態に変換することができる。
【0076】
さらにもう1つの態様において、抗体は、相加的および増強的な治療レジメン、疾患モニタリングおよび治療管理を提供するために、以上の用途の1つまたは複数を組み合わせたもの、または他の治療法、例えば抗生物質と組み合わせたものにおいて用いられる。
【0077】
本発明の抗体(または等価物)は、細菌感染症を治療するために投与すること、または感染のリスクが高い者に対する予防的手段として用いることが可能と考えられる。感染がすでに存在する場合には、抗体を単独で、または抗細菌抗体もしくは抗生物質もしくは他の抗微生物療法と組み合わせて投与することができる。抗HSL抗体の投与を他の治療法と併用することにより、治療過程の短縮または治療薬の用量減少が可能となり、それによって耐性発生のリスクを低下させ、患者のコンプライアンスを改善することが可能になる可能性がある。
【0078】
本発明の第4の面によれば、医療に用いるための、第1の面において定義された抗体が提供される。
【0079】
本発明の第5の面によれば、細菌感染の治療のための医薬品の調製における、第1の面において定義された抗体の使用が提供される。
【0080】
本発明の第6の面によれば、特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングする方法であって、細菌ラクトンシグナル分子またはラクトン由来シグナル分子を担体分子と結合させること、およびそのようにして形成された結合体を、結合体と特異的に結合する特異的結合分子を特異的結合分子の集団から同定するために用いることを含む方法が提供される。
【0081】
このような方法は、したがって、例えば細菌感染症の治療において、抗菌薬として用いうる特異的結合分子を同定するための手段となる。特異的結合分子は、抗体またはその断片、例えばモノクローナル抗体またはポリクローナル抗体である。担体分子は上記のタンパク質であることが適している。特異的結合分子の集団は、ファージディスプレイライブラリーであってもよい。
【0082】
本発明の方法によって同定された特異的結合分子は、医療または上記の治療方法に用いることができる。特異的結合分子をさらに、細菌感染症の治療のための医薬品の調製に用いることもできる。
【0083】
このような方法は、したがって、細菌ラクトンシグナル分子を、前記細菌ラクトンシグナル分子と特異的に結合する特異的結合分子を同定する目的で、特異的結合分子の集団をスクリーニングするために用いることに対しても適用される。
【0084】
本発明の第7の面によれば、対象の細菌感染症の治療方法であって、前記対象からの試料中の細菌ラクトンシグナル分子またはラクトン由来シグナル分子の単離、および前記細菌ラクトンシグナル分子を、シグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングするために用いること、およびそのようにして同定された前記特異的結合分子をそれを必要とする患者に投与することを含む方法が提供される。
【0085】
このような方法により、試料中にシグナル伝達分子が認められる感染性細菌を標的とする特異的結合分子の同定が可能となる。試料は、血液、唾液、組織、脳脊髄液、涙液、精液、尿、便、膿汁、皮膚または粘膜分泌物のものであってよい。血液の試料は全血または分画血液、例えば血漿のものであってよい。組織試料は任意の感染した、または感染の可能性のある組織または臓器からの生検標本であってよい。試料をまた、創傷から、または損傷もしくは感染の部位もしくは感染の可能性のある部位から採取してもよい。肺または胃もしくは腸の内容物からの液体の試料を用いることもできる。
【0086】
本発明の第2および以後の面の好ましい特徴には、第1の面のものが準用される。
【0087】
植物宿主および動物宿主における関連した用途を非制限的に含む、本発明のその他の目的、特徴および利点は、本発明の明細書および特許請求の範囲を吟味することにより、当業者には明らかになると考えられる。
【0088】
本明細書中に開示した組成物および方法が、広範囲の生物にわたって、感染に起因する疾患または状態の抑制、是正、治療または診断における用途を有することは、当業者には明らかであると考えられる。本発明の組成物および方法を緑膿菌を参照しながら説明してきたが、本明細書の目的を他の種に対して適用することは当業者の技能の範囲に含まれる。
【0089】
以下では、本発明を、以下に詳述する非制限的な例および図面を参照しながらさらに説明する。
【図面の簡単な説明】
【0090】
【図1A】図1(a)は、3種類の代表的なクラスのホモセリンラクトン細菌細胞シグナル伝達分子の化学構造を示している。これらはC3位の置換に関して差があり、各クラスの内部ではアシル側鎖の長さに違いがある(代表的にはn=0〜n=10)。さらに、アシル差の内部にcis結合がある場合もある。
【図1B】図1(b)は、i)AI-2の直前の前駆体であるpro AI-2、ii)ホウ素を含む活性AI-2分子、およびiii)結合体を作るために用いた反応性pro-AI-2ハプテンの構造を示している。
【図1C】図1(c)は、i)黄色ブドウ球菌第I群、ii)黄色ブドウ球菌第II群、iii)黄色ブドウ球菌第III群、およびiv)黄色ブドウ球菌第IV群によって用いられるチオラクトンペプチドシグナル伝達分子の例を示している。
【図2】クオラムまたは細胞密度に依存的なセンシングの遺伝的調節を示している。細胞シグナル伝達機構は2つの要素からなる:1)I遺伝子(lasIおよびrhlI)相同体は増殖の間を通じて細菌細胞シグナル伝達分子(HSL)を合成するため、その量が徐々に増加する(そのためにクオラムセンシングが行われる)および2)シグナル伝達分子とコグネイトRタンパク質相同体(lasRおよびrhlRによってコードされる)との濃度依存的な結合が起こり、これは次に一連の特定遺伝子(オペロン)のスイッチを入れ、細菌が密度依存的な表現型スイッチ(例えば、毒性、遊走)を協調的にとることを可能にする。
【図3】プラスミドpSB1075を用いた生物発光性レポーター遺伝子アッセイの原理を示している。光出力の低下により、細菌の細胞シグナル伝達のブロックに成功したことが示される。
【図4】不活性カラムマトリックスに固定化されたHSL特異的一本鎖抗体およびHSLと無関係の一本鎖抗体が、免疫親和性捕捉によってHSLを溶液から除去する能力の比較を示している。カラム溶出液をビブリオ・フィシェリ(Vibrio fischeri)の大腸菌代用物(JM107-pSB401)に対して適用し、溶出液中の残留HSLが蛍光を生じさせる効果を細菌培養物のその後の刺激により、RLUによって測定した。ScAb G3B12およびG3G2はHSL特異的であり、抗VZVはウイルスタンパク質に対して特異的であり、抗パラコートおよび抗アトラジンはHSL分子と分子量が同程度の除草剤に対して特異的であり、樹脂対照は免疫固定されたscAbを含まない。データは、2つの別々のアッセイによる3つの重複した試料の平均を表している。標準誤差を示している。
【図5】生物発光出力量によって測定した、緑膿菌の大腸菌代用物(JM109 pSB1075)へのdDHLを介した刺激に対する、特異的一本鎖抗体および無関係な一本鎖抗体の阻害効果を示している。データは、HSL特異的scAb G3H5(●)、非特異的対照scAb(▼)(病原性細菌表面タンパク質に対して特異的)ならびにscAbの非存在下(○)に関して示されている。データ点は、反復アッセイによる3つの重複した試料の平均を表している。
【図6】生物発光出力量によって測定した、緑膿菌の大腸菌代用物(JM109 pSB1075)へのtDHLを介した刺激に対する、特異的一本鎖抗体および無関係な一本鎖抗体の阻害効果を示している。データは、3種類のHSL特異的scAb;G3H3(●)、G3G2(■)およびG3B12(□)、無関係な抗V scAb(○)(病原性細菌表面タンパク質に対して特異的)ならびにscAbの非存在下(▽)に関して示されている。データ点は、反復アッセイによる3つの重複した試料の平均を表している。
【図7】緑膿菌Rrhl系(短鎖HSL反応性)の大腸菌代用物(JM109 pSB406)へのBHLを介した刺激に対する、特異的一本鎖抗体および無関係(非特異的)な一本鎖抗体の阻害効果を、(a)60分後および(b)150分後の生物発光出力量によって測定したものを示している。データは、G3H5抗体、G3B12抗体およびG3H3抗体、非特異的な対照抗体(病原性細菌表面タンパク質に対して特異的)ならびにscAbの非存在下(PBS緩衝液のみ)に関して示されている。データ点は、反復アッセイによる3つの重複した試料の平均を表している。
【図8】G3H5抗体およびG3B12抗体が(a)細菌病原体である緑膿菌PA14株および(b)緑膿菌PA01株による感染に対して線虫を防御する能力を示した、線虫緩徐死滅アッセイを示している。
【図9】遊離ペプチド「YSTGGAGSGG」または遊離チオラクトンペプチドAgr-D1の存在下または非存在下における、抗ペプチドscAb YST-1のBSA対照またはBSA-ペプチド結合体との結合に関する競合ELISAのデータを示している(図1c参照)。
【発明を実施するための形態】
【実施例】
【0091】
実施例1
本明細書に記載した実施例は、ビブリオ・フィシェリ(Vibrio fischeri)および緑膿菌に関する。これらは一例として示したものに過ぎず、本発明の範囲はこれらの例には限定されず、毒性または病原性にかかわる遺伝子の発現を直接的または間接的に調節するすべての細菌細胞間シグナル伝達分子を含むほか、他のシグナル分子によって誘導される細菌細胞に対する表現型変化、例えば生物発光(ただし、これには限定されない)なども含む。
【0092】
「リンカー」として作用する炭素12個のアシル鎖を有し、カルボン酸基で終わる、HSLの誘導体を合成した(dDHL-COOHと命名)(図1)。これをカルボン酸基を介して担体タンパク質であるウシ血清アルブミン(BSA)およびキーホールリンペットヘモシアニン(KLH)と結合させて、dDHL-BSAおよびdDHL-KLHを生成した。簡潔に述べると、50mgのBSAまたはKLHを水1.67mlに溶解し、それに対して2mM KH2PO4, pH 8.5を3.3ml添加した(すべて4℃で)。これに対して乾燥ジメチルホルムアミド(DMF)1.05mlを攪拌しながら一滴ずつ添加した。dDHL-COOHの活性化N-ヒドロキシスクシンイミドエステル10mgを乾燥DMF 100μlに溶解し、これを同じく4℃の担体タンパク質溶液にゆっくりと添加した。この反応混合物を十分に攪拌して、4℃で24時間放置した。結合体を形成させた材料を次に4×1リットルの水に対して透析し、結合をMALDITOF質量分析によって確認した。
【0093】
「リンカー」という用語は、ハプテンが担体の表面から外向きに提示されるような、ハプテン(抗原)と(好ましくは)免疫原性担体分子との結合を可能にするために用いられる任意の化学基のことを指す。
【0094】
本発明の代替的な目的において、磁気ビーズまたはビオチンなどの他の担体分子、ならびに他のリンカーおよび結合法を用いることもできる。続いて、2種類の結合型dDHLを用いて抗体ファージディスプレイライブラリーのスクリーニングを行った。簡潔に述べると、ライブラリーを合計3回のバイオパニング(bio-panning)によってスクリーニングした。それぞれの回にdDHL結合体を固体支持体上に固定化し、ファージ-抗体のライブラリーと、結合体を認識するファージ-抗体が結合するのに十分な時間にわたってインキュベートした。結合しなかったファージは、PBS(リン酸緩衝食塩水)およびPBS-Tweenによるストリンジェントな洗浄によって除去し、残った結合ファージを低pHでのインキュベーションによって溶出させた(第1回)。続いて、溶出したファージを、当業者に知られた方法により、大腸菌に感染させて増幅させた。この結果得られた強化クローンの増幅ライブラリーを次の回のパニングに用いた。担体タンパク質を認識する、選択されるクローンの数を減らすために、以降の回の選択には固定化した結合物(dDHL-BSAまたはdDHL-KLH)を交互に用いた。特定のHSLを認識するクローンが優先的に選択されるように、第2回および3回には、低pHではなく選択したHSL(dDHL-COOH)を用いて、ファージ-抗体を競合的に溶出させた。第3回目に得られた個々のファージクローンをELISAによりスクリーニングした:各クローンをまずdDHL-結合体のそれぞれおよび担体タンパク質のみと結合する能力に関してアッセイした。両方の結合体と結合可能であるが担体タンパク質とは結合しなかったクローンをさらに、溶液中の遊離dDHL-COOHの存在によって結合物との結合を阻害しうるものを同定するためにアッセイした。遊離dDHL-COOHと結合することが判明したファージクローンからの抗体可変領域遺伝子を可溶性発現ベクター(pIMS 147)中にサブクローニングし、柔軟なペプチドリンカーによって連結された可変重鎖および軽鎖ドメイン、ならびにヒト抗体のκ定常ドメインを含む可溶性一本鎖抗体断片(scAb)として産生させた。可溶性scAbと遊離HSLとの結合の量は、競合阻害ELISAによって評価した。(1ml当たり1μgのdDHL-BSAに対して)一定濃度の選択した各scAbを含む試料を、ある範囲の濃度の遊離dDHL-COOH(またはdDHL結合体)とともに1時間インキュベートし、その後に、dDHL-BSAをコーティングしたELISAプレートに適用した。1時間のインキュベーション後に、結合しなかったscAbを洗い流し、固定化した結合物と結合して残ったscAbを、酵素で標識した抗ヒトκ抗体を用いて検出した。遊離dDRL-COOHに対するscAbの感度および他のHSL(tDHLおよびOHHL)との交差反応性は、scAb(遊離抗原の非存在下で)とdDHL-BSAとの結合を50%低下させる遊離抗原の濃度(IC50)により評価した(表2)。
【0095】
抗HSL scabのdDHL-BSAとの結合に関する結合動態を、BIAcore 2000(BIAcore, Sweden)を用いて評価した。CM5チップを0.2M EDC[1-3-(3-ジメチル-アミノプロピル)カルボジイミド-HCl]/0.05M NHS(N-ヒドロキシスクシンイミド)によって活性化し、dDHL-BSAまたはBSAのみをそれぞれpH 3.5または4.5の10nM酢酸ナトリウム中でチップと結合させた。一連の10種類の濃度のscAb(100〜1000nM)を2回ずつHBS緩衝液中にて流速20μl/分でアッセイした。試料の間にチップを20μlの100mM NaOHによって再生した。動態をBIAevaluation 3ソフトウエアパッケージを用いて明らかにした(表3)。
【0096】
scAb G3B12がOHHLと結合する能力を、scAbをカラム中で6×ヒスチジンタグを介してニッケル-セファロースビーズに固定化し、OHHL溶液をカラムに通すことにより、さらに評価した。scAbによって結合され、カラムに保持されたOHHLをその後に溶出させた。カラム流出液中(すなわち非結合型)のOHHLの濃度および結合して後に溶出したものの濃度を決定した。
【0097】
scAbがHSLと結合する能力およびAHLに対する細菌の応答を調節する能力を、プラスミドpSB401を含む大腸菌JM107株(ビブリオ・フィシェリの応答の代用物)ならびにプラスミドpSB406およびpSB406を含むJM109(緑膿菌の応答の代用物)を用いて評価した。これらのレポータープラスミドは、HSL応答調節因子遺伝子luxR(pSB401)、lasR(pSB1075、長鎖HSLに対して応答)またはrhlR(pSB406、短鎖HSLに対して応答)およびluxIプロモーター領域を含み、これらは外因性HSLを伴って、フォトラブダス・ルミネセンス(Photorhabdus luminescens)由来のluxCDABE遺伝子融合物(発光性構造遺伝子)の発現を活性化する。適切な増殖条件下で、これらの細胞は細胞外HSLの存在に応答して発光するように誘導され、放出された光の強度はHSLの濃度に比例する。
【0098】
ライブラリーから選択したクローンから、発表されているプロトコール(Strachanら、1998)を用いて、可溶性scAbを発現させた。固定化金属アフィニティークロマトグラフィー精製(IMAC)の際にはscAbはニッケル-セファロースカラムから溶出しなかった。無関係な抗原に対する特異性を有する一連のscAbも発現させ、対照として用いるためにニッケル-セファロースカラムに固定化した。500μlの10nM OHHLを各カラムに対して適用し、4℃で1時間インキュベートした。カラムを40gで15秒間遠心し、流出液を収集した。結合したOHHLは250μlの1M NaClによって溶出させた。最初の流出液を再び適用し、以前と同じくインキュベートし、流出液を収集した上で、結合したHSLを1M NaClにより溶出させた。
【0099】
固定化scAbカラムを通過させる前および後のHSL溶液の試料を大腸菌JM107 pSB401培養物に対して適用し、放出された光を光度計を用いて測定した。scAbを固定化していないカラム、および無関係な抗原に対する特異性を有するscAbを含む3つの別のカラムを用いて、適切な対照実験を行った。細胞をテトラサイクリンを含むLB培地中にて振盪しながら37℃で18時間増殖させた。培養物1μlを100mlのLBテトラサイクリン培地に接種し、OD 600nmが0.2となるまで37℃で増殖させた。培養物100μlを96ウェルの黒色バイオアッセイプレートのウェルに複数ずつ適用し、等容積のHSL溶液を添加した。HSL溶液は、10nM OHHL(陽性対照)、ニッケルセファロースカラムを通過させたミリQ水(樹脂対照)、または上記の固定化scAbを含むカラムに10nM OHHLを通過させた流出液とした。プレートを振盪しながら37℃で2時間インキュベートし、発光をAnthos LUCY1光度計を用いて1秒間にわたり読み取った(図4)。
【0100】
scAbが長鎖HSLに対する細菌の応答を低下させる能力は、大腸菌JM109-pSB1075株を用いる3.0時間にわたるHSL誘導性発光レポーターバイオアッセイによって評価した。この菌株は本質的にはJM107-pSB401に関して記載されたものと同じであるが、プラスミドpSB1075はビブリオ・フィシェリのluxRの代わりに緑膿菌のlasRを含む点が異なる。JM109-pSB1075の単一のコロニーを、抗生物質を含むLB培地10mlに接種し、37℃で一晩インキュベートした。この一晩培養物の200μlを10mlの新たな培地に接種し、OD 600nm 0.2となるまで振盪しながら37℃でインキュベートした。HSLをこの培養物に添加し(dDHL-COOHを最終濃度20nMで、またはtDHLを最終濃度50nMで)、培養物100μlを黒色96ウェルプレートの3つずつのウェルに添加した。陰性対照にはLB培地を添加した。PBS 50μlまたは2mg/mlのscAb 50μlのいずれかを各ウェルに添加し、プレートを振盪しながら37℃でさらに3時間インキュベートし、その後に発光を30分間隔で測定し、細胞シグナル伝達に対するscAbの効果を判定した(図5および6)。このデータは、抗HSL抗体に、構造的に異なるホモセリンラクトンシグナル分子と相互作用して、細胞外HSLに対する緑膿菌代用物の応答を低下または消失させる能力があることを示している。
【0101】
scAbが短鎖HSLに対する細菌の応答を低下させる能力を、上記のものと同様のやり方で評価した。生物発光レポーター系には、大腸菌JM109株を、rhlR応答エレメント調節因子を含むレポータープラスミドpSB406とともに用いた。シグナル分子BHL(図1中のアシル-HSLと類似しているが側鎖の炭素は4つである)を大腸菌培養物に最終濃度50nMとなるように添加し(陰性対照培養物には同じ容積のLB培地を添加した)、100μlの培養物をアッセイプレートの3つずつのウェルに添加した。続いて100nMのscAb 50μlまたはPBS 50μlを添加し、プレートを前記の通りにインキュベートした。発光の測定は60分後および150分後に行った(図7)。
【0102】
実施例2
抗HSL scabが病原性緑膿菌に対する防御を動物に対して与える能力を評価するために、線虫C.エレガンスを用いる「緩徐死滅」アッセイを行った。このアッセイは線虫の消化管に緑膿菌感染症が定着した後に線虫が死滅することに基づく。
【0103】
緑膿菌PA14株を5mlのLB培地に第1日に感染させ、37℃で一晩インキュベートした。第2日に一晩培養物の1%を、100nM scAbを100μl添加した新たなLB培地5mlに接種し、OD 600nmが0.4となるまで37℃でインキュベートした。10μlの細菌培養物を、120nMのscAb 50μlとともにNG強化ペプトン寒天平板培地(線虫増殖培地)の中央にスポッティングし、プレートを37℃で一晩インキュベートした。第3日(午後)にさらに50μlのscAb(120nM)をプレートにスポッティングし、インキュベーションを一晩続けた。第4日(午後)にプレートを室温(20℃前後)に移し、さらに50μlのscAbを添加した。第5日(午前)に50μlのscAbを以前と同じように添加し、20-5-の成虫を細菌繁殖域に直接加えた(0時間の時点)。scAbの補足的添加は26、50および76時間の時点に行った。死んだ虫体の数を以後の3日間にわたって計測した(図8a)。虫体は、移動性がなく、細いワイヤーピックで触れても反応しなければ死んだものとみなした。
【0104】
対照プレートに関しては、PBSまたは無関係なscAb(関連性のない標的抗原に対して特異的なもの)を用いるか、虫体を大腸菌OP50株上で成長させた。
【0105】
緑膿菌PA01株を用いる第2のアッセイも行った(Darbyら、1999)。この菌株は主として「麻痺性死滅」(毒素産生)のために用いられるが、これはまた、PA14よりも効果は落ちるものの、本実施例の緩徐死滅感染試験にも適している。
【0106】
アッセイは、以下の変更を加えた上で、上記と同じようにして行った。scAbの添加は全体を通じて100nMの濃度で行った。第3日の朝および午後に50μlのscAbをプレート上にスポッティングした。2回目の添加後に、プレートを室温に移し、一晩インキュベートした。虫体およびscAbを第4日に適用し(0時間の時点)、t=30時間および60時間の時点でscAbの添加を2回のみ行った(図8b)。
【0107】
実施例3
緑膿菌はいくつかの細胞外産物を産生し、これはコロニー形成後に広範な組織損傷の原因となる。これらの1つであるエラスターゼは、緑膿菌の急性感染時の毒性が最大限となるために必須である。エラスターゼの産生はlasI/Rクオラムセンシングカスケードの制御下に置かれている。このため、エラスターゼ産生の検出を、細菌集団の毒性の能力の指標として用いることができる。
【0108】
105 CFU/ml(低OD)または108 CFU/ml(高OD)の緑膿菌PA14株4μlを、1%エラスチン、0.5%lab lemco粉末、1%ペプトン、0.5%塩化ナトリウムおよび1.5%寒天を含む寒天平板培地に接種し、37℃で5日間インキュベートした。低ODでの増殖では病原性スイッチングは促されなかったが、高ODでの増殖では病原性スイッチングが促された。50μlのscAb(200nM)をこの細菌とともにプレートに添加し、アッセイ全体を通じて、さらに同じ容積の添加を24時間間隔で行った。
【0109】
細菌コロニーおよび周囲の透明帯(エラスターゼによるエラスチンの溶解を示す)の直径を毎日測定し、コロニーのエラストリシス活性を透明帯面積と細菌コロニー面積との比として評価した。この場合も各試験毎に3〜4回反復して行い、大腸菌XL1-Blueを陰性対照として用いた(表5)。
【0110】
実施例4
抗原に対する親和性がより高い抗HSL抗体を単離するため、および特定のHSLバリアントに対する特異性を導くために、クローンG3B12に対して親和性成熟処理を行った。ファージミドDNAをG3B12細菌クローンから単離し、可変軽鎖遺伝子を、45塩基対の柔軟なリンカー領域の最後の30塩基を含む5'オリゴヌクレオチドプライマーLINKER-REV

およびファージマイナーコートタンパク質遺伝子gIIIに対して特異的な3'プライマーgIII-FOR

を用いるPCRによって増幅した。正しいサイズ(380bp前後)の産物を1%アガロースゲルで電気泳動し、切り出した上で精製した。同じようにして、元のクローンを単離したヒトの全ナイーブライブラリーを含むファージミドDNAを調製した。可変重鎖遺伝子の全レパートリーは、pelBリーダー配列に対して特異的な5'プライマーAH1-REV

およびリンカー領域の最初の30塩基をコードする3'プライマーLINKER-FOR

を用いて増幅した。正しいサイズ(400bp前後)の産物を上記の通りに精製した。続いて、VH遺伝子のレパートリーとモノクローナルVL遺伝子を、両方の一次PCR産物に共通するリンカー領域の中央部の相補的な15塩基を用いる連結(linking)PCRによって組み合わせた。この新たなライブラリーを、プライマーAH1-REVおよびgIII-FORを連結PCR反応の4サイクル後に加え、さらに25サイクルを行うことによって増幅した。増幅されたDNAを制限酵素NcoIおよびNotIで消化処理し、同じように消化処理して精製したファージミドベクター中で連結させた。連結および再精製を行ったDNAを最後に電気穿孔法によって大腸菌TG1株細胞に形質転換導入し、従来のようにしてプレーティングした。
【0111】
ファージ抗体を以前のようにヘルパーファージを用いて回収し、dDHL-BSA結合体をコーティングしたイムノチューブに適用して結合させた。結合しなかったファージは流し落とし、弱い/非特異的な結合物はPBSTおよびPBSによる多数回の洗浄段階によって除去した。続いて、結合物に特異的なファージを低pHトリエチルアミンによって溶出させて中和した。これらを対数増殖期の新たなTG1細胞に感染させ、回収して再び増殖させた上で以降の選択(パニング)を行った。以降のパニングに関しては、固定化した結合物としてdDHL-BSAおよびdDHL-TGを交互に用いた。3回目のパニングの際には、シャフリングを行ったライブラリー由来の結合性ファージを、遊離dDHLまたはBHL(ブチリルホモセリンラクトン)により、重複性のパニング物から溶出させた。
【0112】
3回のパニングを行った後に、モノクローナルファージ-抗体を所望の結合特性に関してスクリーニングした。第3回目に得られた個々のファージクローンをELISAによりスクリーニングした:各クローンをまずdDHL-BSAおよびKLH結合体のそれぞれおよび担体タンパク質のみと結合する能力に関してアッセイした。両方の結合体と結合可能であるが担体タンパク質とは結合しなかったクローンをさらに、溶液中の遊離dDHLまたはHSLの存在によって結合物との結合を阻害しうるものを同定するためにアッセイした。遊離BHL/dDHLと結合することが判明したファージクローンからの抗体可変領域遺伝子を可溶性発現ベクター(pIMS 147)中にサブクローニングし、柔軟なペプチドリンカーによって連結された可変重鎖および軽鎖ドメイン、ならびにヒト抗体のκ定常ドメインを含む可溶性一本鎖抗体断片(scAb)として産生させた。可溶性scAbと遊離HSLとの結合の量は、競合阻害ELISAによって評価した。(1ml当たり1μgのdDHL-TGに対して)一定濃度の選択した各scAbを含む試料を、ある範囲の濃度の遊離HSLとともに1時間インキュベートし、その後に、dDHL-TGをコーティングしたELISAプレートに適用した。1時間のインキュベーション後に、結合しなかったscAbを洗い流し、固定化した結合物と結合して残ったscAbを、酵素標識した抗ヒトκ抗体を用いて検出した。遊離HSLに対するscAbの感度および他のHSL(tDHLおよびOHHL)との交差反応性は、scAb(遊離抗原の非存在下で)とdDHL-TGとの結合を50%低下させる遊離抗原の濃度(IC50)により評価した(表4)。
【0113】
実施例5
従来の2種類のペプチド、YST-1(YSTGGAGSGG)およびYST-2 YSTASGGASSを、末位から2番目のC末端リシン側鎖にビオチン化∧(∧はビオチン化の部位を表す)を有する第3のペプチドYST-3(YSTAGGSGAK∧S)とともに合成した。第4のチオラクトンペプチプYSTC*DFIM*(Agr-D1)も合成したが、ここで*はチオラクトン環によって結合した残基を表す(図1c参照)。従来の化学結合法により、YST-1の一部はBSAと、YST-2はウシチログロブリン(TO)と、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)を用いてC末端で結合させた。
【0114】
本質的には前記の通りに、固定化したYST-1結合体およびYST-2結合体(交互に)に対するヒトナイーブ抗体ライブラリーのパニングを4回行った。ファージ-抗体の結合を1時間行わせた後、結合しなかったファージを流し落とし、弱く結合したファージはPBSTに続いてPBSを用いる十分な洗浄によて除去した。結合したファージをトリエチルアミンで溶出させて中和し、その後に対数増殖期の大腸菌TG1細胞に感染させた。強化されたファージをヘルパーファージを用いて回収することによって増殖させた後、次の回の選択に備えてポリエチレングリコール沈殿による精製および濃縮を行った。第3回および4回でYST-1/2-結合体と結合したファージを洗浄した後に、ファージをYST-3溶液で溶出させた。このビオチン化ペプチドと結合するファージを、ストレプトアビジンでコーティングした常磁性ビーズによって捕捉して、磁石により固定化した。さらに洗浄の段階を行った後に、結合性ファージを以前の通りにTG1細胞に直接添加して感染させた。
【0115】
4回の選択を行った後に、モノクローナルファージ-抗体を、YST-1結合体およびYST-2結合体に対する結合性ならびにBSAおよびTG担体タンパク質のみに対する結合性に関して、ELISAによりスクリーニングした。両方の結合体のみと結合したクローンのscFv遺伝子を、pIMS-147scAb可溶性発現ベクター中にサブクローニングし、大腸菌XL1-Blue細胞への形質転換導入を行った。これらの細胞を発現させ、可溶性scAbを細菌のペリプラスム間隙から抽出し、ニッケルアフィニティークロマトグラフィーによって精製した。続いて精製scAbを、ELISAにより、固定化ペプチド結合体との競合下での、遊離(結合体を形成していない)ペプチドとの結合性およびチオラクトンペプチドオートインデューサーAgr-D1との結合性に関してさらにアッセイした。結合物のみとの結合と比較してペプチドの存在下の方がシグナルが低いことにより、scAbがすべてのペプチドに共通するYST-エピトープを認識することが示される(図9)。
【0116】
実施例6
AI-2標的に対する抗体を作製するためには、遊離AI-2分子および結合型のものの両方が必要である。AT-2を純粋な形態で単離することは不可能である(と考えられる)。自然下で、AI-2はpro-AI-2(図1(b))とホウ酸との(自発的な)反応によって形成される。インビトロではpro-AI-2もホウ酸と反応して活性AI-2を生成するが、これは結合および抗体選択のためには適していない。pro-AI-2の誘導体は合成可能であり、この際、メチル基はアシル鎖などのリンカーによってカルボン酸などの末端反応基に置換される。担体との化学結合または架橋に適した末端反応基を含み、コアにpro-AI-2部分が担体表面に遮られずに提示されると考えられるあらゆる構造を、リンカーとして用いることができる。「発明の概要」の項に述べたように、反応性pro-AI-2を2つの異なる担体と結合させることが好ましい。
【0117】
受容体の可能性があるもののライブラリー(例えば、ファージ上に提示された抗体ライブラリー)を、固定化されたAI-2結合体を得るために、ホウ酸の存在下(好ましくは>10μM、pH 6.0〜8.0)で、固定化された結合物に対して適用する。ファージ-抗体(「ファージ」)を結合させ、結合物を認識しないものは洗浄によって除去する。結合性ファージは高pHもしくは低pH(例えばトリエチルアミン)により、または遊離AI-2との競合的結合により、またはビオチン化AI-2などとの競合的結合の後にストレプトアビジン磁気ビーズで除去することにより、溶出させることができる。極限pHによる溶出を除くバイオパニングのすべての段階に、AI-2の正しい構造を確実に維持するためにホウ酸が存在すべきである。溶出したファージを宿主細菌(大腸菌)に再び感染させ、ファージ粒子が産生される条件下で細胞を増殖させることによって増幅し、次の回のために精製する。次の回の選択は、固定化した結合物を交互に用いることが好ましい点を除き、1回目に関して記載したのと同じように行う。
【0118】
十分な回数の選択を終えたところで、個々の(モノクローナル性)クローンを、AI-2との結合に関してアッセイする。少なくとも3回の選択が必要である可能性が高いが、AI-2結合性クローンを1回のみの後に単離することもでき、または3回を上回って行う必要がある場合も考えられる。各回の後に、何回が必要であるかを判定するために、当業者に知られた方法によってポリクローナルファージELISAを行うことができる。モノクローナルファージ抗体を前の実施例に記載した通りに作製し、選択のために用いた結合体のそれぞれ、および結合体を形成させていないそれぞれの担体に対する結合に関してアッセイする必要がある。利用可能であれば第3または第4の結合物をさらに用いることもできる。陽性クローンと推定されるものは、ホウ酸の存在下で利用可能なすべての結合体と結合するが、担体分子のみとは結合せず、好ましくはホウ酸の非存在下では結合物と結合しないものであると考えられる。
【0119】
pro-AI-2とホウ酸との反応によって複数の種が生成される可能性があるため、抗体が特に正しいAI-2構造を認識することを示すことが好ましいと考えられる。これは、遊離pro-AI-2およびホウ酸の存在下で結合物との結合に関するアッセイを行うことによって判定しうる。遊離pro-AI-2の濃度が高くなるほど結合性が低下することは競合阻害を意味する。したがって、このような抗体は、細胞外AI-2と結合してそれを細胞が利用できないようにすることにより、AI-2応答性細菌の応答を調節すると考えられる。
【0120】
適したインビボモデルには、AI-2に応答して生物発光を行う生物発光性ビブリオ・ハーヴェイ(Vibrio harveyl)がある。LuxS−であるV.ハーヴェイの菌株はDPD(pro-AI-2の前駆体)を合成することができず、このためAI-2を産生することができない。しかし、これらは外因性に添加したAI-2に対しては、ホウ酸を伴うpro-AI-2の形態で、またはLuxS+V.ハーヴェイから得られたホウ酸含有無細胞培地として、(光出力の増大によって)応答することができる。LuxS−細胞またはLuxP−細胞(天然のAT-2受容体を持たない)にホウ酸のみを添加しても発光は起こらない。このため、抗AT-2抗体(「受容体」)の可能性のあるものを、LuxS−細胞に対して添加した場合の発光の低下、またはLuxS+細胞に対して添加した場合の発光の消失/防止/低下によって判定して、以前に概要を示した結合基準を満たすものとして、さらにはAI-2を野生型V.ハーヴェイ培養液から枯渇させうるものとして同定することが可能と考えられる。
【0121】
【表1】

表1は、ある一定範囲の微生物に関して、種々の細菌表現型を、それらを調節するクオラムセンシングシステムの細胞シグナル伝達分子および調節因子とともに列挙したものである。
【0122】
【表2】

N/DはIC50値が決定不可能であったことを示す。
表2は、競合阻害ELISAによって評価した、dDHL-BSAとの競合下での、遊離抗原(dDHL-COOH)および2種類のAHL類似体(tDHLおよびOHHL)に対する抗AHL scAbの感度(IC50)をまとめたものを示している。
【0123】
【表3】

表3は、BIAcore 2000装置を用いる表面プラスモン共鳴法によって評価した、固定化したdDHL-BS結合体に対する2種類の抗AHL scAbsの結合動態の比較を示している。会合定数(ka)、解離定数(kd)および親和定数(KA、KD)が示されている。
【0124】
【表4】

表4は、種々のHSLに対するチェーンシャフリング法によって得られた抗HSLクローンの感度(IC50)をまとめたものを示している。それぞれの新たなクローンの下方に括弧で囲んでいるのは、その由来となったクローンの名称である。出発クローンとの比較による新たなクローンの抗原に対する感度の増加の程度を、該当する場合には括弧内に示した。データは、競合ELISAによって評価した、dDHL-TG結合物との競合下での、遊離HSLとの結合を比較している。
【0125】
【表5】

表5は、緑膿菌による毒性因子エラスターゼの発現を低下させる抗HSL scAbの効果を示している。データは、PBS対照(100%)と比較したパーセンテージとして表現した、透明帯とコロニー面積の比を表している。
【0126】
引用した参考文献
米国特許文献
6,309,651、2001年10月、Frankら
その他の特許文献
国際公開公報第01/26650号、2001年4月、Nottingham大学
国際公開公報第01/74801号、2001年10月、Nottingham大学
国際公開公報第92/01047号、2001年10月、Bonnertら
その他の文献










【技術分野】
【0001】
発明の分野
本発明は、患者における細菌感染症の抑制および治療のための方法に関する。本発明の方法は、すべてではないにしても大半のグラム陰性菌感染症およびグラム陽性菌感染症に適用可能である。本発明は、好ましい態様において、細菌細胞間コミュニケーションのプロセスに関与するシグナル伝達分子に対する親和性および特異性を有する免疫グロブリン分子または免疫グロブリン様受容体分子に基づく治療法の適用を提供する。このような分子と結合させることにより、こららの受容体を、細菌の存在を診断するため、または患者の病状を評価するため、さらには日和見病原体および他の病原体におけるビルレント状態の誘導に関与する分子の濃度を制御するために用いることができる。
【背景技術】
【0002】
発明の背景
今日、病院で治療を受ける患者の死亡および疾病の主な原因の一つは、院内感染に起因するものである。このような感染症に対する易罹病性は、患者の受診の理由となった原疾患の結果であることもあれば、免疫抑制療法の結果であることも、または重大な皮膚損傷(例えば、熱傷)を引き起こす障害の結果であることもある。症例の最も高い割合で原因となっている細菌は緑膿菌(Pseudomonas aeruginosa)である。これはヒトの日和見病原体の典型である。この細菌は免疫低下状態にない組織を感染させることはほとんどないが、組織が何らかの様式で免疫低下状態になれば、感染させない組織はほどんどない。これは比較的少数の種からなるものの、ヒトの健康に対して深刻な脅威を与えるため、本明細書ではこれ以後、感染性細菌の代表例として用いるが、これは本発明の範囲(scope or extent)をいかなる形でも限定するものではない。
【0003】
緑膿菌は、特に重症熱傷の患者ならびに免疫抑制状態にある癌およびAIDSの患者において、尿路感染症、呼吸器系感染症、皮膚炎、軟部組織感染症、菌血症および種々の全身感染症の原因となる日和見病原体の一つである。緑膿菌によって起こる呼吸器感染症は、ほぼ例外なく、下気道が易感染状態にある個体または全身防御機構が不全状態にある個体で起こる。原発性肺炎は慢性肺疾患およびうっ血性心不全の患者で起こる。菌血症性肺炎は一般に、化学療法を受けている好中球減少性癌の患者で起こる。ムコイド型緑膿菌による嚢胞性線維症患者の下気道コロニー形成は頻度が高く、治療は不可能ではないにしても困難である。これは主として免疫低下状態の患者において菌血症を引き起こす。素因となる状態には、血液悪性腫瘍、AIDSに関連した免疫不全症、好中球減少症、糖尿病および重症熱傷が含まれる。シュードモナス菌血症の大部分は、病院および養護施設(nursing home)における院内感染として起こり、院内感染によるグラム陰性菌血症全体のうち約25%を占める。
【0004】
この細菌は、外膜LPSによってもたらされる透過性障壁のために多くの抗生物質に対して自然耐性を有することが知られており、このため、特に危険で恐ろしい病原体である。また、これはバイオフィルムの形態で表面にコロニーを形成する傾向があるため、細胞に治療濃度の抗生物質が透過しなくなる。その自然な生息環境は土壌であり、桿菌、放線菌および糸状菌に付随して生存しているため、これは天然に存在する種々の抗生物質に対する耐性を獲得している。さらに、シュードモナス属細菌は抗生物質耐性プラスミドを耐性因子(R因子)および耐性伝達因子(RTF)の両方として保持しており、これらの遺伝子を形質導入および接合という細菌プロセスによって伝達することができる。シュードモナス属に対して有効な抗生物質はフルオロキノン、ゲンタマイシンおよびイミペネムを含めて少数しかなく、これらの抗生物質でさえもすべての菌株に有効なわけではない。ゲンタマイシンとカルベニシリンとの併用は急性緑膿菌感染症の患者に有効なことが報告されている。抗生物質によるシュードモナス感染症の治療が無効であることは嚢胞性線維症患者で最も顕著に示されており、その事実上すべてが最終的には、耐性が非常に強いために治療が不可能な菌株に感染する。抗生物質耐性のため、臨床分離株の感受性試験が必須である。
【0005】
緑膿菌は通常、土壌および水から、さらには植物および動物の表面から単離することができる。これは生息地にかかわらず世界中でみられるため、極めて「普遍な」細菌である。これは時にヒトの正常細菌叢の一部として存在するが、院外の健康な個体におけるコロニー形成の頻度は比較的低い(推定値は解剖学的な位置により0〜24%の範囲)。院内ではこれは食品、流し、蛇口、モップ、呼吸機器手術器具にコロニーを形成することが知られている。コロニー形成は通常、緑膿菌による感染症の前に起こるが、この病原体は環境に普遍的に存在するため、その正確な伝染源および伝染様式はしばしば不明である。臨床的理由から感染症が疑われる集中治療下の患者のうち、感染原が特定できない者は50%にも上る。現在、世界中で毎日1,400例が緑膿菌のために集中治療室(ICU)で死亡しており、これは死因として最大である。
【0006】
緑膿菌は主として院内病原体である。CDCによれば、米国の病院における緑膿菌感染症の総発生率は平均約0.4%であり(退院1000例当たり4例)、この細菌は院内病原体のうち分離される頻度が4番目に高く、院内感染全体のうち10.1%を占める。全体的には、これは院内肺炎例の16%、後天性尿路感染の12%、手術創感染の8%および血流感染の10%の原因である。好中球減少性癌の患者および骨髄移植患者などの免疫低下患者は緑膿菌の日和見感染に罹りやすく、死亡報告例の30%の原因である。また、これは人工呼吸器関連肺炎の38%、AIDS患者の死亡の50%の原因でもある。熱傷患者における緑膿菌感染は近年減少しているが、これは治療法の改善および食事内容の変化による。しかし、死亡率は依然として高く、熱傷患者の二次感染による死亡全体のうち60%を占める。
【0007】
緑膿菌の多能性の1つの理由は、それが、エラスターゼ、LasAプロテアーゼ、アルカリプロテアーゼ、ラムノリピド、IV型線毛を介したトゥイッチング運動(twitching motility)、ピオベルジン(Williamsら、1996、Stintziら、1998、Glessnerら、1999)、ピオシアニン(Brint & Ohman, 1995、Reimmannら、1997)ならびに細胞毒性レクチンPA-IおよびPA-II(Winzerら、2000)を含む、多様な毒性決定因子を生じることにある。これらの毒性決定因子の多くは、クオラムセンシング(quorum sensing)による細胞密度依存的な様式で、遺伝子レベルで調節されることが知られている。緑膿菌は少なくとも2種類のクオラムセンシング系、すなわちlas系およびrhl(vsm)系を有し、これらはそれぞれLuxRI相同体であるLasRI(Gambello & Iglewski, 1991)およびRhlRI(VsmRI)によって構成される(Latifiら、1995)(図2)。LasIは3-オキソ-C12-HSLの合成を導き(Passadorら、1993、Pearsonら、1994)、一方、RhlIはC4-HSLの合成を導く(Winsonら、1995)。las系およびrhl系は、las系がRhlRに対する転写制御を行うという階層として存在すると考えられている(Williamsら、1996、Pesciら、1997)。転写活性化因子LasRは3-オキソ-C12-HSLとともに働いて、毒性決定因子であるエラスターゼ、LasAプロテアーゼ、アルカリプロテアーゼおよび外毒素A(Gambello & Iglewski, 1991、Toderら、1991、Gambelloら、1993、Pearsonら、1994)ならびにlasIをコードする遺伝子の発現を調節する。エラスターゼはコラーゲン、IgG抗体およびIgA抗体、補体を分解することができ、肺粘膜への細菌の付着を促す。アルカリプロテアーゼとの組み合わせにより、これはγインターフェロン(INF)および腫瘍壊死因子(TNF)の不活性化も引き起こす。LasIは3-オキソ-C12-HSLの合成を導き、これはLasRとともにlasIプロモーターと結合して正のフィードバックループ系を形成する。RhlR転写活性化因子は、そのコグネイトAIM(C4-HSL)とともに、rhlAB(ラムノリピド)、lasB、aprA、RpoS、シアニド、ピオシアニンならびにレクチンPA-IおよびPA-IIの発現を調節する(Ochsnerら、1994、Brint & Ohrnan, 1995、Latifiら、1995、Pearsonら、1995、Winsonら、1995、Latifiら、1996、Winzerら、2000)。これらはLasR/3-オキソ-C12-HSLがrhlRを調節する階層的な様式で存在するため(Latifiら、1996、Pesciら、1997)、この2つの系はいずれも上記の毒性決定因子すべての調節に必要である。
【0008】
緑膿菌感染症の治療または予防のための治療法を開発するためにさまざまなアプローチが活発に進められている。あるものは広範囲にわたることを意図しており、またあるものは特定の種類のシュードモナス感染症を対象にしている。従来の経路に沿ったものには、ワクチン(例えば、米国特許第6,309,651号に記載されたものなど)、およびグラム陰性菌に対して有効と考えられるが主として緑膿菌に対して作用するように設計され、エアロゾル吸入によって投与される新たな抗生物質(SLIT)の開発が含まれる。現在調査中のさらにもう1つの観察所見は、準至適(sub-optimal)増殖抑制濃度で投与された抗生物質エリスロマイシンが、緑膿菌の血球凝集素、溶血素、プロテアーゼおよびホモセリンラクトン(HSL)を同時に抑制し、このため持続的な緑膿菌感染症の治療に適用しうる可能性があることである。両親媒性ペプチドを含むクリーム製剤も、熱傷または他の重篤な皮膚創傷の感染を予防する手段として検討されている。米国特許第6,309,651号も、緑膿菌のPcrV病原性タンパク質に対する抗体が感染に対する防御を与える可能性があることを教示している。
【0009】
また、病原性を制御する手段としてのホモセリンラクトンレベルの調節にもある程度関心が寄せられている。ある種の藻類は、いくつかの陸生植物と同じように、アシル-ホモセリンラクトン(AHL)の競合阻害物質、例えばフラノン(Manefield, 1999)を産生することが示されている。これらの化合物はAHLシグナル分子をその受容体タンパク質から移動させ、AHLバイオアッセイにおけるアゴニストまたはアンタゴニストとして作用しうる(Tepletskiら、2000)。HSL濃度を低下させるために用いられる他の方法には、HSLの分解を触媒するオートインデューサー(autoinducer)不活性化酵素(AiiA)の開発が含まれる。
【0010】
現在開発中の治療法には、潜在的な問題および限界が数多く存在する。ワクチンが有効な治療法であるか否かはまだ証明されていない。緑膿菌は宿主抗体によるオプソニン作用に対して効果的な防御を行う広範なムコイド性莢膜を生成し、このことは抗シュードモナス抗体の血清価が高い持続感染患者の存在によって示される。米国特許第6,309,651号に記載されたようなワクチンおよび抗PcrV抗体などによる治療の適用性における限界は、これらのアプローチがシュードモナス感染症に限定され、他の細菌に対しては有効でないという点にある。オートインデューサー模倣物の使用は、受容体結合部位に対してHSLと効果的に拮抗するために必要な大部分のものの濃度、および副作用の可能性によって制限される。シュードモナス属および他の細菌によって放出されるHSLは、ヒトの生理機能に対してさまざまな直接効果を及ぼす。これらには、国際公開公報第01/26650号に記載されたようなヒスタミン放出の阻害が含まれる。国際公開公報第01/74801号は、HSLがリンパ球増殖を阻害し、単球およびマクロファージによるTNF-αの分泌をダウンレギュレートし、それによって全般的な免疫抑制物質としても作用しうることを記載している。このため、競合的HSL模倣物の使用を伴う治療法には、患者の免疫系のダウンレギュレーションを引き起こすという危険がある。これは一般に望ましくなく、免疫低下状態の患者では特にそうである。抗生物質の使用は、この細菌(および他のもの)が抗生物質に対する耐性を獲得する著しい能力を考えれば、せいぜい短期的戦略と見なしうる。
【0011】
緑膿菌の病原性が明らかに多因子性であることは、毒性因子が多数あること、およびこの細菌と関係のある疾患が広範囲に及ぶことによって明確に示されている。組織への侵入および播種のために必要な細胞外毒性因子の多くは、ホモセリンラクトンをベースとするシグナル分子および特定の転写活性化タンパク質がかかわる細胞間シグナル伝達系によって制御される。これらの調節系により、緑膿菌が、協調した細胞密度依存的な様式でビルレント形態をとること、および宿主防御機構を克服することが可能になる。このような細胞シグナル伝達およびそれに付随する毒性因子の産生を妨害することは、緑膿菌によって起こる疾病および死亡を減らすために有望な治療アプローチである。このようなアプローチの重要性は、同様の細胞間シグナル伝達系を利用することが判明している細菌病原体の数が増加していることによって明確に示されている。
【0012】
宿主-病原体相互作用の分子的基盤を研究するためには、ヒトにおける病原性と関連のある刺激および機序が再現されうる適したモデル系(非ヒト)を利用しうることが望ましい。多くの疾患の場合には、関係する病原体は、例えばHIVのように、1つ、または密接に関連した少数の種または群に本質的に対応付けられる。その他の生物体は、種、属および場合によっては界の障壁を越えた広範囲にわたる宿主で疾患を引き起こすことができる。緑膿菌はこのような病原体の一つであり、種々の植物種、昆虫種および動物種のいずれをも感染させることができる。
【0013】
近年、ヒトおよびマウスを感染させる能力がある複数の緑膿菌株が線虫シノラブディス・エレガンス(Caernohabtidis elegans)も死滅させうることが示されている(Tanら、1999a、Tanら、1999b、Tanら、2000)。さらに重要なことに、緑膿菌のC.エレガンス(C. elegans)に対する病原性は、ヒトにおける病原性を制御するのと同じ細胞密度依存的なクオラムセンシングシステムによって調節される。緑膿菌およびC.エレガンスの双方のゲノムの配列解読が最近完了したため、この関係は細菌性疾患の機序の研究にとって理想的なものとなった。C.エレガンスのタンパク質の36%はヒトにも相同体があり(Darbyら、1999)、C.エレガンスは実験室で容易に増殖させうるという事実から、これはヒトにおける病因および宿主防御のモデルとして広く用いられるようになっている(KurzおよびEwbank、2000)。
【0014】
緑膿菌がC.エレガンスの死滅を媒介するさまざまな機序が同定されている。Tanら、1999a;1999bおよびMahajan-Miklosら、1999は、マウスおよび植物をも感染させる臨床分離株(PA14株)の使用を記載している。この細菌の増殖条件を変化させることにより、その後にC.エレガンスに適用して、急速な死滅(数時間以内)または緩徐な死滅(3〜4日以内)のいずれかを引き起こすことができる。急速な死滅の機序はRhlクオラムセンシングシステムのみに依存する。さらに、死滅は拡散性ピオシアニン毒素によって起こるため、内部で緑膿菌を適宜増殖させた無細胞培地、または加熱死させた抽出物の使用は等しく有効である。これに対して、緩徐な死滅の機序はLas系およびRhl系の両方に依存しており、線虫の消化管に明らかな感染を引き起こす。死滅は細菌による宿主への浸潤の結果と考えられるため、このアッセイは動物における感染に関して最も有用な線虫モデルを提供する。第3の死滅機序はDarbyら(1999)によって記載されている。この場合には、脳心臓浸出物寒天培地中で増殖させた緑膿菌PA01株(既知のヒト病原体の1つ)が、C.エレガンスの急速な麻痺および死滅を引き起こす。前述の緩徐な死滅と同じく、麻痺はLas系およびRhl系の両方に依存的である。
【0015】
有害な副作用がなく、しかも近い将来のうちに病原性細菌によって回避される可能性が低い方法による、HSLおよび病原性に関与する他の細菌細胞シグナル伝達分子の濃度を調節する効果的な手段を開発することには需要が存在する。
【発明の概要】
【0016】
本発明は、ヒト、動物および植物の病原性細菌の毒性を、細菌の細胞シグナル伝達分子の細胞外濃度を調節することによって制御するための方法を提供する。他の治療法は、特定の1つの病原体もしくは病原体群に、または細菌毒性の特定の面に限定されるが、本発明は細菌毒性全般を取り扱う。
【0017】
本発明の第1の面によれば、細菌によって分泌されるラクトンシグナル分子またはラクトン由来シグナル分子に対する抗体が提供される。
【0018】
本発明による抗体はポリクローナル抗体でもモノクローナル抗体でもよい。ポリクローナル抗体は、抗原を動物に注入して、適した動物宿主(例えば、マウス、ラット、モルモット、ウサギ、ヒツジ、ニワトリ、ヤギまたはサル)における産生を賦活することによって産生させることができる。必要であればアジュバントを抗原とともに投与してもよい。続いて抗体を、抗原との結合により、または以下に述べるようにして精製することができる。モノクローナル抗体はハイブリドーマから産生させることが可能である。これらは、、不死化細胞系を作製する目的で、骨髄腫細胞および所望の抗体を産生するBリンパ球細胞を融合させることによって形成させることができる。これはよく知られたKohler & Milstein法である(Nature 256 52-55 (1975))。
【0019】
特定のタンパク質と結合するモノクローナル抗体およびポリクローナル抗体を作製するための方法は、現在、当技術分野では十分に開発されている。それらは標準的な免疫学のテキスト、例えばRoittら、「免疫学第二版(Immunology second edition)」(1989)、Churchill Livingstone, Londonで考察されている。
【0020】
完全な抗体のほかに、本発明は、抗原との結合が可能なその誘導体も含む。したがって、本発明は、抗体断片および合成構築物を含む。抗体断片および合成構築物の例は、Dougallらにより、Tibtech 12372-379(September 1994)に示されている。抗体断片には、例えば、Fab断片、F(ab)2断片およびFv断片が含まれる(Roittら[前記]参照)。Fv断片を改変して、一本鎖Fv(scFv)分子として知られる合成構築物を作製することができる。これは、分子の安定性に寄与するVH領域およびVL領域を共有結合させるペプチドリンカーを含む。本発明はこのため、一本鎖抗体またはscAbにも適用される。
【0021】
他の合成構築物にはCDRペプチドが含まれる。これらは抗原結合決定基を含む合成ペプチドである。ペプチド模倣物を用いることもできる。これらの分子は通常、CDRループの構造を模しており、抗原と総合作用する側鎖を含む、立体配座が限定された環状有機物である。合成構築物にはキメラ分子も含まれる。したがって、例えば、ヒト化(または霊長類化)抗体またはその誘導体も本発明の範囲に含まれる。ヒト化抗体の一例は、ヒトフレームワーク領域を有するが、齧歯類の超可変領域を有する抗体である。合成構築物には、抗原結合性に加えて何らかの望ましい特性を備えた分子を提供する共有結合性の部分(moiety)を含む分子も含まれる。例えば、この部分は、標識(例えば、蛍光標識または放射性標識などの検出可能な標識)または薬学的活性のある物質であってよい。
【0022】
抗細菌シグナル分子抗体を作製するためには、標的分子または適した誘導体を2つの異なる担体分子(タンパク質)と結合させることが好ましいが、単一の複合分子種を用いることもできる。細菌シグナル分子は一般に、インビボで免疫応答を賦活するには、または抗体ライブラリーから高親和性抗体を選択するための抗原の源として直接用いるためには、小さすぎる。細胞シグナル伝達分子(以下では「抗原」と称する)に対して特異的な抗体の選択は、特異的結合対(sbp)の最初のメンバーのレパートリー(ライブラリー)、例えば、糸状バクテリオファージの表面に提示された抗体のライブラリーを用いる好ましい態様において行われる。受容体のライブラリーからの特異的な受容体の選択を可能にする任意の他のシステムも、本発明の方法の方法に適用可能である。代替的な態様においては、シグナル分子特異的クローンを、抗原結合体を接種した動物から作製した、抗体を分泌する一連のハイブリドーマ細胞系から選択することができる。一般的な例示の目的には、ファージ粒子の表面に提示された抗体結合部位のライブラリーの例が用いられる。
【0023】
抗原を適した担体分子(これはタンパク質、ペプチドまたは任意の天然化合物もしくは合成化合物のいずれでもよい)または材料と結合させた結合体(以下では「結合体-1)と称する)を、「イムノチューブ(immunotube)」またはマイクロタイタープレートなどの適した固体支持体上に固定化し、コーティングされなかった表面を乾燥粉乳などの非特異的ブロック剤でブロックする。適した結合体分子には、ウシ血清アルブミン(BSA)、キーホールリンペットヘモシアニン(KLH)、ウシチログロブリン(TG)、オブアルブミン(Ova)などのタンパク質(ただしこれらには限定されない)またはビオチンなどの非タンパク質が含まれる。結合体分子の選択に関する唯一の制限は、それが何らかの様式で固定化可能であって、免疫処置に関しては免疫応答を誘発する程度に十分に大きいことである。
【0024】
特異的結合対(sbp)の最初のメンバーのライブラリー(「ライブラリー」)を、固定化した結合体に対して適用し、結合体-1を認識するsbpメンバーが結合するのに十分な時間にわたってインキュベートする。結合体を認識しないファージをストリンジェントな洗浄によって除去する。結合したまま残ったファージを、例えばトリエチルアミンまたは他の適した試薬により、中性pHに戻すための緩衝液中に溶出させる。続いて、回収したファージ粒子を大腸菌などの適した宿主生物に感染させ、選択した各メンバーの数を増幅するために培養し、それによって第2の「強化」ライブラリーを作製する。続いてこの工程を強化ライブラリーを用いて繰り返し、第2の担体タンパク質と結合した抗原(結合体-2)を認識するファージ-抗体(「ファージ」)を選択する。
【0025】
必要に応じてこれをさらに数回行い、選択工程を遊離型の抗原を認識するsbpメンバーの選択が優先されるように変更する。ファージを、最初は結合体-1を用い、次は結合体-2(入手可能な場合)というように以後のそれぞれの回で交互に用いて、以前に記載されたように抗原結合体に対して選択する。結合したファージを、遊離抗原または小型で可溶性の選択可能な部分、例えばビオチンと結合させた抗原の溶液とともに、結合型の抗原に対してより親和性の高いsbpメンバーが固定化された結合体から解離するのに十分な時間にわたってインキュベートすることによって溶出させる。遊離抗原によって溶出したファージを大腸菌細胞に感染させて増幅および再選択を行い、固定化された抗原と結合したままのものは廃棄する。または、好ましさは落ちるものの、結合体と結合するすべての抗体を、例えば低pHを用いて溶出させることもできる。
【0026】
それぞれの回の選択で選ばれた個々の(モノクローナル)ファージクローンを、所望の結合特性に関してスクリーニングする。これは、必要条件に応じて、SPR(表面プラスモン共鳴)およびELISA(固相酵素免疫アッセイ)などの技法を含む、当業者に知られた種々の方法によって行うことができる。選択基準には、結合体を形成させた誘導体の存在下で、遊離した可溶型の抗原と選好的に結合する能力が含まれると考えられる。
【0027】
本発明の好ましい態様において、抗体はナイーブなヒト抗体ファージディスプレイライブラリーから作製される(McCaffertyら、Nature 348: 552-554, 1990;および国際公開公報第92/01047号における記載の通り)。このため、抗体を診断用または透析用の試薬として用いることに加えて、患者への投与のために用いることが可能と考えられる。診断アッセイにおいては、抗体を、患者におけるHSLの有無および濃度を決定し、それによって患者の感染状態を予測するために用いることが可能と考えられる。また別の態様において、ライブラリーを、HSLと適した担体分子との1つまたは複数の結合体による前免疫処置を行った動物から構築することもできる。さらにもう1つの選択肢は、上記の通りに免疫処置を行った動物からのハイブリドーマ細胞系の作製である。後者の2つの場合には、例えば、宿主動物-ヒトキメラ抗体を作製すること、または適した抗体フレームワークスカフォールドへのCDRグラフトによる「ヒト化」により、結果として得られる抗体の免疫原性を低下させるための段階を取り入れることが好ましい。適用しうる他の方法には、抗体内部のT細胞エピトープと考えられるものを同定し、その後にこれらを位置指定変異誘発法などによって除去すること(脱免疫化(de-immunisation))が含まれると考えられる。さらにもう1つの態様において、異なるクラスのヒト免疫グロブリン(IgG、IgAなど)からの定常領域を含むように抗体を作製し、動物細胞において完全な抗体分子として産生させることもできる。特に、これらのアプローチは抗体を治療的に用いる場合に望ましい。
【0028】
本発明に関して、抗体はモノクローナル性でもポリクローナル性でもよい。抗体はヒト抗体でもヒト化抗体でもよく、透析/診断の用途には他の種からのものでもよい。Fab、F(ab').sup.2(F(ab')2とも表記される)、FvまたはscFvなどの抗体断片または誘導体を用いることもでき、Hustonら(Int. Rev. Immunol. 10: 195-217, 1993)によって記載されたような一本鎖抗体(scAb)、ドメイン抗体(dAbs)、例えば単一ドメイン抗体、または抗体様の単一ドメイン抗原結合性受容体を用いることもできる。抗体のほかに、抗体断片および免疫グロブリン様分子、ペプチド模倣物または非ペプチド性模倣物を、細胞シグナル伝達分子の結合を阻害することによって細菌感染を阻止またはモジュレートするという点で抗体の結合活性を模倣するように設計することもできる。
【0029】
適した抗体の調製後に、一般的に利用可能ないくつかの技法のいずれかにより、それを単離または精製することができる(例えば、「抗体:実験マニュアル(Antibodies: A Laboratory Manual)」、HarlowおよびLane編、Cold Spring Harbor Laboratory Press(1988))。一般的に適した技法には、ペプチドもしくはタンパク質アフィニティーカラム、HPLCもしくはRP-HPLC、プロテインAもしくはプロテインGカラムによる精製、またはこれらの技法の組み合わせが含まれる。組換え抗体は標準的な方法に従って調製し、ELISA、ABC、ドットブロットアッセイなどの一般的に利用可能な手順を用いて特異性に関してアッセイすることができる。
【0030】
ラクトンシグナル分子は、ホモセリン分子でもよく、ペプチドチオラクトン分子でもよい。
【0031】
ホモセリンラクトン分子は、以下の群からなる群より選択される一般式を有しうる。

式I
式II
式III
式中、n=0〜12である。
【0032】
一般式Iの化合物は、アシル-ホモセリンラクトン分子として記載することができる。一般式IIの化合物は3-オキソ-ホモセリンラクトンとして記載することができる。一般式IIIの化合物は3-ヒドロキシホモセリンラクトンとして記載するこ
とができる。
【0033】
一般式Iに関して好ましいホモセリンラクトン分子は、N-ブタノイル-L-ホモセリンラクトン(BHL)(式中n=0)、N-ドデカノイル-L-ホモセリンラクトン(dDHL)(式中n=8)およびn-テトラデカノイル-L-ホモセリンラクトン(tDHL)(式中n=10)である。一般式IIに関して好ましいホモセリンラクトン分子は、N-3-(オキソヘキサノイル)-L-ホモセリンラクトン(OHHL)(式中n=2)およびN-(-3-オキソドデカノイル)-L-ホモセリンラクトン(OdDHL)(式中n=8)である。一般式IIIに関して好ましいホモセリンラクトン分子は、N-(-3ヒドロキシブタノイル)-L-ホモセリンラクトン(HBHL)(式中n=0)である。
【0034】
一般に、細菌HSLはさらに2つのクラスに細分することができる:i)長鎖分子(炭素10〜12個)およびii)短鎖分子(炭素4〜8個)。シュードモナス属の場合には、これらの異なるサイズのクラスは異なるR分子と結合し、異なる遺伝子のスイッチを入れる。長鎖分子はLASとして知られるR相同体遺伝子産物と結合し、短鎖分子はRHLタンパク質相同体と結合する。
【0035】
ペプチドチオラクトンは以下の一般式(IV)を有しうる。

式中、Xは任意のアミノ酸であり、n=1〜10である。
【0036】
本明細書の上記の部分および全体を通じて、アミノ酸残基は通常のIUPAC一文字表記によって示される。一文字表記は、以下のように、アミノ酸残基の古典的な三文字表記と相互に関連付けることができる。

【0037】
好ましいペプチドチオラクトン分子は以下の構造を有しうる。

【0038】
種々の低分子量シグナル分子を用いて細胞間のコミュニケーションを行うことが判明した細胞種の数は増加しつつある。グラム陰性菌は主としてN-アシルホモセリンラクトンを用いる(表1)。後者は共通のホモセリンラクトン環構造を有する化合物の一群であり、側鎖の長さおよび構造はさまざまである(図1a)。この群にはアシル-ホモセリンラクトン、3オキソ-ホモセリンラクトンおよび3-ヒドロキシ-ホモセリンラクトンという3つのクラスがある。単一の種が、複数のクラスのメンバーを産生し、それらに対して応答することができる。
【0039】
ラクトン由来シグナル分子が、フラノシルホウ酸ジエステル、例えばオートインデューサー-2もしくはAI-2、Pro-AI-2またはPro-AI-2反応性ハプテンであってもよい(図1b)。ビブリオ・ハーヴェイ(Vibrio harveyi)および炭疽菌を含む多くのグラム陰性菌およびグラム陽性菌が第2のシグナル分子であるAI-2を産生するが、これはホモセリンラクトンと同じS-アデノシルメチオニン源に由来し、受容体LuxPと結合する(図1b)。AI-2は、多岐にわたる種によって産生および認識されて毒性を誘導する普遍的な細菌シグナル分子である可能性が高いと考えられている。

オートインデューサー-2(AI-2)
【0040】
AI-2は2,3-ジヒドロキシ-4-メチル-3,4-ホウ酸ジエステルとして記載することができる。
【0041】
また、ラクトン由来シグナル分子が、自然に環状化してPro-AI-2(これは自然にホウ酸と反応してAI-2を形成する)を形成する、4,5-ジヒドロキシ-2,3-ペンタンジオン(DPD)の誘導体であってもよい(図1b)。Pro-AI-2は2,4diヒドロキシ-4メチル-フラン-3-オンとして記載することができる。Pro-AI-2は、図1bに示したように、4-メチル位にヘプタン酸部分を付加してPro-AI-2反応性ハプテンを形成するように誘導体化することができる。他の誘導体には、メタン酸、エタン酸、プロパン酸、ペンタン酸、ヘキサン酸、ヘプタン酸、オクタン酸、ノナン酸またはデカン酸といった、他の直鎖状または分枝状の飽和または不飽和C1〜C10カルボン酸部分が含まれうる。

【0042】
黄色ブドウ球菌などのグラム陽性菌は短いペプチドを用いる(図1c)(Mayvilleら、1999)。これらの細胞は、細胞密度の低い条件ではシグナル分子の濃度が対応して低いといったように、これらの分子を局所的な細胞密度を決定するために用いる。細胞密度が高い場合には局所的なシグナル分子の濃度も高い。この濃度がある閾値レベルに達すると、これは毒性にかかわる遺伝子の転写および宿主における疾病状態の発現を誘導する。
【0043】
ブドウ球菌属によって用いられるチオラクトン誘導体化ペプチドシグナル分子には別の生物機能もある。これらは細菌に局所的な集団密度に関する情報を提供するだけでなく、異なるサブグループに属する他の黄色ブドウ球菌における毒性の抑制にも働く(Lyonら、2000)。この二機能性はペプチドの異なる構造要素に分かれており、チオラクトンC末端が他のサブグループの毒性を抑制する。改変されていないN末端は、それを合成したサブグループにおける毒性遺伝子の発現をアップレギュレートするシグナルとして作用するが、これは同じく必要なC末端を伴う場合のみである。チオラクトン結合を含むC末端の5アミノ酸を含む切断型ペプチドが存在すると、他の3つのサブグループだけでなく、それを産生した菌株も抑制される。したがって、その結果として、シグナルペプチドのN末端を認識し、それを露出した状態に保つことによってC末端を効果的に提示する抗体は、すべての黄色ブドウ球菌株における毒性を効果的に抑制すると考えられる。このため、本発明の抗体を、上記のようにチオラクトン分子またはその構造要素、例えばペプチド配列またはチオラクトン部分によって提示されるエピトープに対して産生させてもよい。
【0044】
本発明のある種の好ましい態様において、抗体はscAb、特にXL1-Blue G3H5、G3B12、G3G2および/またはG3H3と命名された大腸菌クローンから得られるscAbである。これらのクローンは、ブダペスト条約の条項に従ってNCIMB(Aberdeen, UK)に2003年3月18日に寄託されており、アクセッション番号は以下の通りである:G3H5はNCIME-41167として寄託され、G3B12はNCIMB-41168として寄託され、G3G2はNCIMB-41169として寄託され、G3H3はNCIMB-41170として寄託されている。これらの菌株は、100μg/mlアンピシリン、選択的には12.5μg/mlテトラサイクリンおよび/または1%グルコースを添加したLB培地などの適した増殖培地中において、37℃大気中という標準的な条件下で培養することができる。
【0045】
細菌シグナル伝達分子は、それらに関するスクリーニングが行われたすべての生物体で発見されている。これはあらゆる種に適用可能な偏在的な系であるように思われる。その主な違いは、グラム陰性(gram-ve)菌はいずれもホモセリンラクトンをベースにした分子を用い、グラム陽性(gram +ve)菌は(修飾された)低分子ペプチドを用いるという点である。ビブリオ・ハーヴェイおよび炭疽菌などの多くのグラム陰性菌およびグラム陽性菌(Jones, M. B.およびBlaser, M. J.)も低分子量のホウ素含有有機分子AI-2(オートインデューサー-2)を用いるが、これはホモセリンラクトンと同じくS-アデノシルメチオニンに由来する。この分野の以前の研究は、シグナル分子を、認識されるものの機能しない、すなわち病原性スイッチングを行わないものに模倣させること、または種々の受容体系をブロックすることに集中して行われてきた。これらの方法の欠点は主として、模倣またはブロックに対する耐性が生じうること、および「真の」シグナル分子が依然としてそこにあり、結合に関して競合すると考えられることにある。さらに、ある種の細菌シグナル伝達分子、例えばホモセリンラクトンは、それ自体が毒性因子であり、宿主(すなわち患者)の免疫抑制を直接引き起こす。本発明の本質は実際のシグナル分子を標的とすることであり、これはすべての細菌細胞間シグナル伝達系(グラム陰性およびグラム陽性)に適用することができる。このアプローチは、細菌が自らが攻撃されていることを認識せず、単に自らが単独で存在しているものと検知すると考えられる点で、この分野における過去のすべての取り組みを上回る主要かつ重要な利点を有する。耐性に対する選択圧は全く存在しないと考えられる。
【0046】
本発明の第2の面によれば、本発明の第1の面に定義された抗体を含む薬学的組成物が提供される。
【0047】
このような組成物は、薬学の技術分野の当業者に知られた任意の方法により、例えば、有効成分を無菌条件下で担体、希釈剤または添加剤と混合することにより、調製することができる。
【0048】
本薬学的組成物は、任意の適した経路による投与、例えば、経口的(口腔内または舌下を含む)、直腸内、鼻内、局所適用(口腔内、舌下または経皮的を含む)、腟内または避腸的(皮下、筋肉内、静脈内または皮内を含む)経路による投与に対して適合させることができる。このような組成物は、薬学の技術分野で知られた任意の方法により、例えば、有効成分を無菌条件下で担体または添加剤と混合することにより、調製することができる。
【0049】
経口投与用に適合化された薬学的組成物は、カプセル剤または錠剤などの離散的な単位;粉剤または顆粒剤;液剤、シロップ剤または懸濁剤(水性もしくは非水性の液体;または食用になる発泡体もしくはホイップ;またはエマルションの状態で)として提供することができる。
【0050】
錠剤または硬ゼラチンカプセル剤のために適した添加剤には、ラクトース、トウモロコシデンプンまたはその誘導体、ステアリン酸またはその塩が含まれる。
【0051】
軟ゼラチンカプセル剤に用いるのに適した添加剤には、例えば、野菜油、蝋状物質、脂肪、半固形状または液状のポリオールなどが含まれる。
【0052】
液剤およびシロップ剤の調製のために用いうる添加剤には、例えば、水、ポリオールおよび糖が含まれる。懸濁剤の調製のためには、水中油型または油中水型の懸濁液を得るために油(例えば、植物油)を用いることができる。
【0053】
経皮的投与のために適合化された薬学的組成物は、レシピエントの表皮と密に接触した状態を長期間にわたって維持することを意図した離散的パッチとして提供することができる。例えば、Pharmaceutical Research, 3(6), p.318 (1986)に一般的に記載されたようにして、有効成分をパッチからイオントフォレシス的に送達することができる。
【0054】
局所適用のために適合化された薬学的組成物は、軟膏、クリーム剤、懸濁剤、ローション剤、粉剤、液剤、ペースト剤、ゲル剤、噴霧剤、エアロゾル剤または油剤として製剤化することができる。眼または他の外部組織、例えば口腔および皮膚の感染症に対しては、組成物を局所用の軟膏またはクリーム剤として適用することが好ましい。軟膏として製剤化する場合には、有効成分をパラフィン基剤または水混和性基剤のいずれかとともに用いることができる。または、有効成分を水中油型クリーム基剤または油中水型基剤とともにクリーム剤として製剤化することもできる。眼に対する局所適用のために適合化された薬学的組成物には、有効成分が適した担体中、特に水性溶媒中に溶解または懸濁化された点眼薬が含まれる。口腔内への局所適用のために適合化された薬学的組成物には、バッカル錠剤、トローチ剤および含嗽剤が含まれる。
【0055】
直腸内投与のために適合化された薬学的組成物は、坐薬または浣腸剤として提供することができる。
【0056】
担体が固体である、鼻内投与のために適合化された薬学的組成物には、粒径が例えば20〜500ミクロンの範囲であって、鼻から吸入する様式で、すなわち鼻の近くに保持した粉末容器からの鼻腔を介した急速吸入によって投与される粗末が含まれる。担体が液体である、スプレー式点鼻薬または点鼻薬としての投与のために適した組成物には、有効成分の水溶液または油性溶液が含まれる。
【0057】
吸入による投与のために適合化された薬学的組成物には、さまざまな種類の定量噴霧加圧噴霧装置、ネブライザーまたは吸入器によって生成される微粒子状物質またはミストが含まれる。
【0058】
腟内投与のために適合化された薬学的組成物は、ペッサリー、タンポン、クリーム剤、ゲル剤、ペースト剤、発泡体または噴霧製剤として提供することができる。
【0059】
避腸的投与のために適合化された薬学的組成物には、水性および非水性の滅菌注射液(これは抗酸化剤、緩衝剤、静菌剤、および製剤を意図したレシピエントの血液と実質的に等張にする溶質を含みうる);ならびに水性および非水性の滅菌懸濁液(これは懸濁剤および増粘剤を含みうる)が含まれる。注射液のために用いうる添加剤には、例えば、水、アルコール、ポリオール、グリセリンおよび植物油が含まれる。組成物は、単位投薬式または多回投与用の容器、例えば密封したアンプルおよびバイアルとして提供することができ、使用の直前に滅菌液体、例えば注射用の水を添加するのみでよい凍結乾燥状態で保存することができる。即時調製による注射液および懸濁液は、滅菌した粉末、顆粒および錠剤から調製することもできる。
【0060】
本薬学的組成物は、保存料、溶解補助剤、安定化剤、湿潤剤、乳化剤、甘味料、着色料、着香料、塩(本発明の物質自体を薬学的に許容される塩の形態で提供することもできる)、緩衝剤、コーティング剤または抗酸化剤を含みうる。それらは、本発明の物質のほかに治療活性のある物質を含んでもよい。
【0061】
本発明の薬学的組成物の投与量は、治療しようとする疾患または障害、治療しようとする個体の年齢および状態などに応じて幅広い範囲にわたりうると考えられ、最終的には医師が用いるべき適切な投与量を決定すると考えられる。
【0062】
このような組成物はヒト用にも獣医学用にも製剤化することができる。本出願は、文脈において明白にそれ以外であることが示されない限り、ヒトにも動物にも等しく適用されるものと解釈されるべきである。
【0063】
本発明の第3の面によれば、対象の細菌感染症の治療のための方法であって、本発明の第1の面の抗体の対象への投与を含む方法が提供される。
【0064】
疾病状態の原因になることが判明している細菌の例は表1に示されている。したがって、本発明のこの面の方法は、対象における、表1に示された細菌の菌株による感染症の治療方法にも適用される。本発明の1つの好ましい態様においては、対象における緑膿菌感染症の治療方法が提供される。
【0065】
本発明の治療用物質は、ヒトまたは非ヒト動物の処置に用いることができる。処置は予防的でもよく、または既存の状態に関するものでもよい。
【0066】
抗体は通常、無菌性の薬学的組成物の部分として供給され、これは薬学的に許容される担体を含むことが一般的である。この薬学的組成物は、任意の適した形態であってよい(それを患者に投与する所望の方法に依存する)。
【0067】
それを単位投薬式剤形(unit dosage form)ととして提供してもよく、一般的には密封容器内にある状態で提供されると考えられ、さらにキットの部分として提供してもよい。このような部分を有するキットは通常(必然的ではない)、使用のための指示書を含むと考えられる。これが複数の前記単位投薬式剤形を含んでもよい。
【0068】
本発明の方法は、短期的または長期的、急性または慢性の病気/疾患に対して適用することができ、植物、動物(ヒトを含む)のほとんどまたはすべての細菌病原体に対して有効である。また、本発明を、病原性細菌の曝露のリスクまたはそれによるリスクのある個体における疾患の発現の予防のための予防的処置として用いることもできる。本発明にはまた、多くの感染によって起こる免疫系のダウンレギュレーションを制限または予防する能力もあり、これは癌、嚢胞性線維症、AIDSおよび他の免疫抑制状態に罹患した患者の場合に特に関心が持たれる。さらに、本発明の方法は特に細菌細胞シグナル伝達分子を対象としており、細菌細胞それ自体は主として対象とならないため、細菌集団に作用して、記載した治療に対する耐性を生じさせる選択圧は存在しないと考えられる。
【0069】
抗体は、感染した患者に対して、細菌感染症の是正および軽減を目的として投与することができる。これには、嚢胞性線維症患者による、推定寿命を延長させるためのエアロゾル中の抗体の吸入が含まれうる。
【0070】
さらにもう1つの態様において、抗体は、免疫抑制患者に対して、免疫能を高めるために投与される。
【0071】
さらにもう1つの態様において、細胞シグナル伝達分子と免疫原性タンパク質との結合体を、個体または患者に対して、シグナル伝達分子に対する免疫応答を賦活させ、中和抗体の産生を引き起こすことを目的として投与することができる。
【0072】
さらにもう1つの態様において、抗体は、例えば患者の血流または胸水における、病原体の可能性があるものの存在および/または病原性状態を検出するための免疫診断試薬として用いられる。
【0073】
さらにもう1つの態様において、抗体は、細菌細胞シグナル伝達分子を患者の血液から透析形式で選択的に除去するための免疫捕捉試薬として用いられる。
【0074】
さらにもう1つの態様において、感染性微生物の病原性および毒性を調節することを目的として、患者の血液からの細菌細胞間シグナル伝達分子の除去のために代替的な方法を適用することができる。これは、前記シグナル分子と結合する他の天然の受容体または天然の受容体をベースとする分子を用いて実現することができる。または、分子鋳型を有するポリマー(MIP)などの非天然性受容体を適用することもできる。このクラスの受容体は、薬物(Hartら、2000)およびステロイド(Whitcombeら、1995;Ramstromら、1996;Rachkovら、2000)などの低分子量生体分子と特異的に結合しうることがすでに示されている。さらにもう1つの選択肢においては、透析を、腎透析のように、患者の血液からのすべての低分子量分子の非特異的な除去によって行うことができる。
【0075】
さらにもう1つの態様において、受容体は触媒活性または酵素活性を有し、細胞シグナル伝達分子を、もはや標的生物によって認識されないような形態または病原性スイッチングを引き起こさないような形態に変換することができる。
【0076】
さらにもう1つの態様において、抗体は、相加的および増強的な治療レジメン、疾患モニタリングおよび治療管理を提供するために、以上の用途の1つまたは複数を組み合わせたもの、または他の治療法、例えば抗生物質と組み合わせたものにおいて用いられる。
【0077】
本発明の抗体(または等価物)は、細菌感染症を治療するために投与すること、または感染のリスクが高い者に対する予防的手段として用いることが可能と考えられる。感染がすでに存在する場合には、抗体を単独で、または抗細菌抗体もしくは抗生物質もしくは他の抗微生物療法と組み合わせて投与することができる。抗HSL抗体の投与を他の治療法と併用することにより、治療過程の短縮または治療薬の用量減少が可能となり、それによって耐性発生のリスクを低下させ、患者のコンプライアンスを改善することが可能になる可能性がある。
【0078】
本発明の第4の面によれば、医療に用いるための、第1の面において定義された抗体が提供される。
【0079】
本発明の第5の面によれば、細菌感染の治療のための医薬品の調製における、第1の面において定義された抗体の使用が提供される。
【0080】
本発明の第6の面によれば、特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングする方法であって、細菌ラクトンシグナル分子またはラクトン由来シグナル分子を担体分子と結合させること、およびそのようにして形成された結合体を、結合体と特異的に結合する特異的結合分子を特異的結合分子の集団から同定するために用いることを含む方法が提供される。
【0081】
このような方法は、したがって、例えば細菌感染症の治療において、抗菌薬として用いうる特異的結合分子を同定するための手段となる。特異的結合分子は、抗体またはその断片、例えばモノクローナル抗体またはポリクローナル抗体である。担体分子は上記のタンパク質であることが適している。特異的結合分子の集団は、ファージディスプレイライブラリーであってもよい。
【0082】
本発明の方法によって同定された特異的結合分子は、医療または上記の治療方法に用いることができる。特異的結合分子をさらに、細菌感染症の治療のための医薬品の調製に用いることもできる。
【0083】
このような方法は、したがって、細菌ラクトンシグナル分子を、前記細菌ラクトンシグナル分子と特異的に結合する特異的結合分子を同定する目的で、特異的結合分子の集団をスクリーニングするために用いることに対しても適用される。
【0084】
本発明の第7の面によれば、対象の細菌感染症の治療方法であって、前記対象からの試料中の細菌ラクトンシグナル分子またはラクトン由来シグナル分子の単離、および前記細菌ラクトンシグナル分子を、シグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングするために用いること、およびそのようにして同定された前記特異的結合分子をそれを必要とする患者に投与することを含む方法が提供される。
【0085】
このような方法により、試料中にシグナル伝達分子が認められる感染性細菌を標的とする特異的結合分子の同定が可能となる。試料は、血液、唾液、組織、脳脊髄液、涙液、精液、尿、便、膿汁、皮膚または粘膜分泌物のものであってよい。血液の試料は全血または分画血液、例えば血漿のものであってよい。組織試料は任意の感染した、または感染の可能性のある組織または臓器からの生検標本であってよい。試料をまた、創傷から、または損傷もしくは感染の部位もしくは感染の可能性のある部位から採取してもよい。肺または胃もしくは腸の内容物からの液体の試料を用いることもできる。
【0086】
本発明の第2および以後の面の好ましい特徴には、第1の面のものが準用される。
【0087】
植物宿主および動物宿主における関連した用途を非制限的に含む、本発明のその他の目的、特徴および利点は、本発明の明細書および特許請求の範囲を吟味することにより、当業者には明らかになると考えられる。
【0088】
本明細書中に開示した組成物および方法が、広範囲の生物にわたって、感染に起因する疾患または状態の抑制、是正、治療または診断における用途を有することは、当業者には明らかであると考えられる。本発明の組成物および方法を緑膿菌を参照しながら説明してきたが、本明細書の目的を他の種に対して適用することは当業者の技能の範囲に含まれる。
【0089】
以下では、本発明を、以下に詳述する非制限的な例および図面を参照しながらさらに説明する。
【図面の簡単な説明】
【0090】
【図1A】図1(a)は、3種類の代表的なクラスのホモセリンラクトン細菌細胞シグナル伝達分子の化学構造を示している。これらはC3位の置換に関して差があり、各クラスの内部ではアシル側鎖の長さに違いがある(代表的にはn=0〜n=10)。さらに、アシル差の内部にcis結合がある場合もある。
【図1B】図1(b)は、i)AI-2の直前の前駆体であるpro AI-2、ii)ホウ素を含む活性AI-2分子、およびiii)結合体を作るために用いた反応性pro-AI-2ハプテンの構造を示している。
【図1C】図1(c)は、i)黄色ブドウ球菌第I群、ii)黄色ブドウ球菌第II群、iii)黄色ブドウ球菌第III群、およびiv)黄色ブドウ球菌第IV群によって用いられるチオラクトンペプチドシグナル伝達分子の例を示している。
【図2】クオラムまたは細胞密度に依存的なセンシングの遺伝的調節を示している。細胞シグナル伝達機構は2つの要素からなる:1)I遺伝子(lasIおよびrhlI)相同体は増殖の間を通じて細菌細胞シグナル伝達分子(HSL)を合成するため、その量が徐々に増加する(そのためにクオラムセンシングが行われる)および2)シグナル伝達分子とコグネイトRタンパク質相同体(lasRおよびrhlRによってコードされる)との濃度依存的な結合が起こり、これは次に一連の特定遺伝子(オペロン)のスイッチを入れ、細菌が密度依存的な表現型スイッチ(例えば、毒性、遊走)を協調的にとることを可能にする。
【図3】プラスミドpSB1075を用いた生物発光性レポーター遺伝子アッセイの原理を示している。光出力の低下により、細菌の細胞シグナル伝達のブロックに成功したことが示される。
【図4】不活性カラムマトリックスに固定化されたHSL特異的一本鎖抗体およびHSLと無関係の一本鎖抗体が、免疫親和性捕捉によってHSLを溶液から除去する能力の比較を示している。カラム溶出液をビブリオ・フィシェリ(Vibrio fischeri)の大腸菌代用物(JM107-pSB401)に対して適用し、溶出液中の残留HSLが蛍光を生じさせる効果を細菌培養物のその後の刺激により、RLUによって測定した。ScAb G3B12およびG3G2はHSL特異的であり、抗VZVはウイルスタンパク質に対して特異的であり、抗パラコートおよび抗アトラジンはHSL分子と分子量が同程度の除草剤に対して特異的であり、樹脂対照は免疫固定されたscAbを含まない。データは、2つの別々のアッセイによる3つの重複した試料の平均を表している。標準誤差を示している。
【図5】生物発光出力量によって測定した、緑膿菌の大腸菌代用物(JM109 pSB1075)へのdDHLを介した刺激に対する、特異的一本鎖抗体および無関係な一本鎖抗体の阻害効果を示している。データは、HSL特異的scAb G3H5(●)、非特異的対照scAb(▼)(病原性細菌表面タンパク質に対して特異的)ならびにscAbの非存在下(○)に関して示されている。データ点は、反復アッセイによる3つの重複した試料の平均を表している。
【図6】生物発光出力量によって測定した、緑膿菌の大腸菌代用物(JM109 pSB1075)へのtDHLを介した刺激に対する、特異的一本鎖抗体および無関係な一本鎖抗体の阻害効果を示している。データは、3種類のHSL特異的scAb;G3H3(●)、G3G2(■)およびG3B12(□)、無関係な抗V scAb(○)(病原性細菌表面タンパク質に対して特異的)ならびにscAbの非存在下(▽)に関して示されている。データ点は、反復アッセイによる3つの重複した試料の平均を表している。
【図7】緑膿菌Rrhl系(短鎖HSL反応性)の大腸菌代用物(JM109 pSB406)へのBHLを介した刺激に対する、特異的一本鎖抗体および無関係(非特異的)な一本鎖抗体の阻害効果を、(a)60分後および(b)150分後の生物発光出力量によって測定したものを示している。データは、G3H5抗体、G3B12抗体およびG3H3抗体、非特異的な対照抗体(病原性細菌表面タンパク質に対して特異的)ならびにscAbの非存在下(PBS緩衝液のみ)に関して示されている。データ点は、反復アッセイによる3つの重複した試料の平均を表している。
【図8】G3H5抗体およびG3B12抗体が(a)細菌病原体である緑膿菌PA14株および(b)緑膿菌PA01株による感染に対して線虫を防御する能力を示した、線虫緩徐死滅アッセイを示している。
【図9】遊離ペプチド「YSTGGAGSGG」または遊離チオラクトンペプチドAgr-D1の存在下または非存在下における、抗ペプチドscAb YST-1のBSA対照またはBSA-ペプチド結合体との結合に関する競合ELISAのデータを示している(図1c参照)。
【発明を実施するための形態】
【実施例】
【0091】
実施例1
本明細書に記載した実施例は、ビブリオ・フィシェリ(Vibrio fischeri)および緑膿菌に関する。これらは一例として示したものに過ぎず、本発明の範囲はこれらの例には限定されず、毒性または病原性にかかわる遺伝子の発現を直接的または間接的に調節するすべての細菌細胞間シグナル伝達分子を含むほか、他のシグナル分子によって誘導される細菌細胞に対する表現型変化、例えば生物発光(ただし、これには限定されない)なども含む。
【0092】
「リンカー」として作用する炭素12個のアシル鎖を有し、カルボン酸基で終わる、HSLの誘導体を合成した(dDHL-COOHと命名)(図1)。これをカルボン酸基を介して担体タンパク質であるウシ血清アルブミン(BSA)およびキーホールリンペットヘモシアニン(KLH)と結合させて、dDHL-BSAおよびdDHL-KLHを生成した。簡潔に述べると、50mgのBSAまたはKLHを水1.67mlに溶解し、それに対して2mM KH2PO4, pH 8.5を3.3ml添加した(すべて4℃で)。これに対して乾燥ジメチルホルムアミド(DMF)1.05mlを攪拌しながら一滴ずつ添加した。dDHL-COOHの活性化N-ヒドロキシスクシンイミドエステル10mgを乾燥DMF 100μlに溶解し、これを同じく4℃の担体タンパク質溶液にゆっくりと添加した。この反応混合物を十分に攪拌して、4℃で24時間放置した。結合体を形成させた材料を次に4×1リットルの水に対して透析し、結合をMALDITOF質量分析によって確認した。
【0093】
「リンカー」という用語は、ハプテンが担体の表面から外向きに提示されるような、ハプテン(抗原)と(好ましくは)免疫原性担体分子との結合を可能にするために用いられる任意の化学基のことを指す。
【0094】
本発明の代替的な目的において、磁気ビーズまたはビオチンなどの他の担体分子、ならびに他のリンカーおよび結合法を用いることもできる。続いて、2種類の結合型dDHLを用いて抗体ファージディスプレイライブラリーのスクリーニングを行った。簡潔に述べると、ライブラリーを合計3回のバイオパニング(bio-panning)によってスクリーニングした。それぞれの回にdDHL結合体を固体支持体上に固定化し、ファージ-抗体のライブラリーと、結合体を認識するファージ-抗体が結合するのに十分な時間にわたってインキュベートした。結合しなかったファージは、PBS(リン酸緩衝食塩水)およびPBS-Tweenによるストリンジェントな洗浄によって除去し、残った結合ファージを低pHでのインキュベーションによって溶出させた(第1回)。続いて、溶出したファージを、当業者に知られた方法により、大腸菌に感染させて増幅させた。この結果得られた強化クローンの増幅ライブラリーを次の回のパニングに用いた。担体タンパク質を認識する、選択されるクローンの数を減らすために、以降の回の選択には固定化した結合物(dDHL-BSAまたはdDHL-KLH)を交互に用いた。特定のHSLを認識するクローンが優先的に選択されるように、第2回および3回には、低pHではなく選択したHSL(dDHL-COOH)を用いて、ファージ-抗体を競合的に溶出させた。第3回目に得られた個々のファージクローンをELISAによりスクリーニングした:各クローンをまずdDHL-結合体のそれぞれおよび担体タンパク質のみと結合する能力に関してアッセイした。両方の結合体と結合可能であるが担体タンパク質とは結合しなかったクローンをさらに、溶液中の遊離dDHL-COOHの存在によって結合物との結合を阻害しうるものを同定するためにアッセイした。遊離dDHL-COOHと結合することが判明したファージクローンからの抗体可変領域遺伝子を可溶性発現ベクター(pIMS 147)中にサブクローニングし、柔軟なペプチドリンカーによって連結された可変重鎖および軽鎖ドメイン、ならびにヒト抗体のκ定常ドメインを含む可溶性一本鎖抗体断片(scAb)として産生させた。可溶性scAbと遊離HSLとの結合の量は、競合阻害ELISAによって評価した。(1ml当たり1μgのdDHL-BSAに対して)一定濃度の選択した各scAbを含む試料を、ある範囲の濃度の遊離dDHL-COOH(またはdDHL結合体)とともに1時間インキュベートし、その後に、dDHL-BSAをコーティングしたELISAプレートに適用した。1時間のインキュベーション後に、結合しなかったscAbを洗い流し、固定化した結合物と結合して残ったscAbを、酵素で標識した抗ヒトκ抗体を用いて検出した。遊離dDRL-COOHに対するscAbの感度および他のHSL(tDHLおよびOHHL)との交差反応性は、scAb(遊離抗原の非存在下で)とdDHL-BSAとの結合を50%低下させる遊離抗原の濃度(IC50)により評価した(表2)。
【0095】
抗HSL scabのdDHL-BSAとの結合に関する結合動態を、BIAcore 2000(BIAcore, Sweden)を用いて評価した。CM5チップを0.2M EDC[1-3-(3-ジメチル-アミノプロピル)カルボジイミド-HCl]/0.05M NHS(N-ヒドロキシスクシンイミド)によって活性化し、dDHL-BSAまたはBSAのみをそれぞれpH 3.5または4.5の10nM酢酸ナトリウム中でチップと結合させた。一連の10種類の濃度のscAb(100〜1000nM)を2回ずつHBS緩衝液中にて流速20μl/分でアッセイした。試料の間にチップを20μlの100mM NaOHによって再生した。動態をBIAevaluation 3ソフトウエアパッケージを用いて明らかにした(表3)。
【0096】
scAb G3B12がOHHLと結合する能力を、scAbをカラム中で6×ヒスチジンタグを介してニッケル-セファロースビーズに固定化し、OHHL溶液をカラムに通すことにより、さらに評価した。scAbによって結合され、カラムに保持されたOHHLをその後に溶出させた。カラム流出液中(すなわち非結合型)のOHHLの濃度および結合して後に溶出したものの濃度を決定した。
【0097】
scAbがHSLと結合する能力およびAHLに対する細菌の応答を調節する能力を、プラスミドpSB401を含む大腸菌JM107株(ビブリオ・フィシェリの応答の代用物)ならびにプラスミドpSB406およびpSB406を含むJM109(緑膿菌の応答の代用物)を用いて評価した。これらのレポータープラスミドは、HSL応答調節因子遺伝子luxR(pSB401)、lasR(pSB1075、長鎖HSLに対して応答)またはrhlR(pSB406、短鎖HSLに対して応答)およびluxIプロモーター領域を含み、これらは外因性HSLを伴って、フォトラブダス・ルミネセンス(Photorhabdus luminescens)由来のluxCDABE遺伝子融合物(発光性構造遺伝子)の発現を活性化する。適切な増殖条件下で、これらの細胞は細胞外HSLの存在に応答して発光するように誘導され、放出された光の強度はHSLの濃度に比例する。
【0098】
ライブラリーから選択したクローンから、発表されているプロトコール(Strachanら、1998)を用いて、可溶性scAbを発現させた。固定化金属アフィニティークロマトグラフィー精製(IMAC)の際にはscAbはニッケル-セファロースカラムから溶出しなかった。無関係な抗原に対する特異性を有する一連のscAbも発現させ、対照として用いるためにニッケル-セファロースカラムに固定化した。500μlの10nM OHHLを各カラムに対して適用し、4℃で1時間インキュベートした。カラムを40gで15秒間遠心し、流出液を収集した。結合したOHHLは250μlの1M NaClによって溶出させた。最初の流出液を再び適用し、以前と同じくインキュベートし、流出液を収集した上で、結合したHSLを1M NaClにより溶出させた。
【0099】
固定化scAbカラムを通過させる前および後のHSL溶液の試料を大腸菌JM107 pSB401培養物に対して適用し、放出された光を光度計を用いて測定した。scAbを固定化していないカラム、および無関係な抗原に対する特異性を有するscAbを含む3つの別のカラムを用いて、適切な対照実験を行った。細胞をテトラサイクリンを含むLB培地中にて振盪しながら37℃で18時間増殖させた。培養物1μlを100mlのLBテトラサイクリン培地に接種し、OD 600nmが0.2となるまで37℃で増殖させた。培養物100μlを96ウェルの黒色バイオアッセイプレートのウェルに複数ずつ適用し、等容積のHSL溶液を添加した。HSL溶液は、10nM OHHL(陽性対照)、ニッケルセファロースカラムを通過させたミリQ水(樹脂対照)、または上記の固定化scAbを含むカラムに10nM OHHLを通過させた流出液とした。プレートを振盪しながら37℃で2時間インキュベートし、発光をAnthos LUCY1光度計を用いて1秒間にわたり読み取った(図4)。
【0100】
scAbが長鎖HSLに対する細菌の応答を低下させる能力は、大腸菌JM109-pSB1075株を用いる3.0時間にわたるHSL誘導性発光レポーターバイオアッセイによって評価した。この菌株は本質的にはJM107-pSB401に関して記載されたものと同じであるが、プラスミドpSB1075はビブリオ・フィシェリのluxRの代わりに緑膿菌のlasRを含む点が異なる。JM109-pSB1075の単一のコロニーを、抗生物質を含むLB培地10mlに接種し、37℃で一晩インキュベートした。この一晩培養物の200μlを10mlの新たな培地に接種し、OD 600nm 0.2となるまで振盪しながら37℃でインキュベートした。HSLをこの培養物に添加し(dDHL-COOHを最終濃度20nMで、またはtDHLを最終濃度50nMで)、培養物100μlを黒色96ウェルプレートの3つずつのウェルに添加した。陰性対照にはLB培地を添加した。PBS 50μlまたは2mg/mlのscAb 50μlのいずれかを各ウェルに添加し、プレートを振盪しながら37℃でさらに3時間インキュベートし、その後に発光を30分間隔で測定し、細胞シグナル伝達に対するscAbの効果を判定した(図5および6)。このデータは、抗HSL抗体に、構造的に異なるホモセリンラクトンシグナル分子と相互作用して、細胞外HSLに対する緑膿菌代用物の応答を低下または消失させる能力があることを示している。
【0101】
scAbが短鎖HSLに対する細菌の応答を低下させる能力を、上記のものと同様のやり方で評価した。生物発光レポーター系には、大腸菌JM109株を、rhlR応答エレメント調節因子を含むレポータープラスミドpSB406とともに用いた。シグナル分子BHL(図1中のアシル-HSLと類似しているが側鎖の炭素は4つである)を大腸菌培養物に最終濃度50nMとなるように添加し(陰性対照培養物には同じ容積のLB培地を添加した)、100μlの培養物をアッセイプレートの3つずつのウェルに添加した。続いて100nMのscAb 50μlまたはPBS 50μlを添加し、プレートを前記の通りにインキュベートした。発光の測定は60分後および150分後に行った(図7)。
【0102】
実施例2
抗HSL scabが病原性緑膿菌に対する防御を動物に対して与える能力を評価するために、線虫C.エレガンスを用いる「緩徐死滅」アッセイを行った。このアッセイは線虫の消化管に緑膿菌感染症が定着した後に線虫が死滅することに基づく。
【0103】
緑膿菌PA14株を5mlのLB培地に第1日に感染させ、37℃で一晩インキュベートした。第2日に一晩培養物の1%を、100nM scAbを100μl添加した新たなLB培地5mlに接種し、OD 600nmが0.4となるまで37℃でインキュベートした。10μlの細菌培養物を、120nMのscAb 50μlとともにNG強化ペプトン寒天平板培地(線虫増殖培地)の中央にスポッティングし、プレートを37℃で一晩インキュベートした。第3日(午後)にさらに50μlのscAb(120nM)をプレートにスポッティングし、インキュベーションを一晩続けた。第4日(午後)にプレートを室温(20℃前後)に移し、さらに50μlのscAbを添加した。第5日(午前)に50μlのscAbを以前と同じように添加し、20-5-の成虫を細菌繁殖域に直接加えた(0時間の時点)。scAbの補足的添加は26、50および76時間の時点に行った。死んだ虫体の数を以後の3日間にわたって計測した(図8a)。虫体は、移動性がなく、細いワイヤーピックで触れても反応しなければ死んだものとみなした。
【0104】
対照プレートに関しては、PBSまたは無関係なscAb(関連性のない標的抗原に対して特異的なもの)を用いるか、虫体を大腸菌OP50株上で成長させた。
【0105】
緑膿菌PA01株を用いる第2のアッセイも行った(Darbyら、1999)。この菌株は主として「麻痺性死滅」(毒素産生)のために用いられるが、これはまた、PA14よりも効果は落ちるものの、本実施例の緩徐死滅感染試験にも適している。
【0106】
アッセイは、以下の変更を加えた上で、上記と同じようにして行った。scAbの添加は全体を通じて100nMの濃度で行った。第3日の朝および午後に50μlのscAbをプレート上にスポッティングした。2回目の添加後に、プレートを室温に移し、一晩インキュベートした。虫体およびscAbを第4日に適用し(0時間の時点)、t=30時間および60時間の時点でscAbの添加を2回のみ行った(図8b)。
【0107】
実施例3
緑膿菌はいくつかの細胞外産物を産生し、これはコロニー形成後に広範な組織損傷の原因となる。これらの1つであるエラスターゼは、緑膿菌の急性感染時の毒性が最大限となるために必須である。エラスターゼの産生はlasI/Rクオラムセンシングカスケードの制御下に置かれている。このため、エラスターゼ産生の検出を、細菌集団の毒性の能力の指標として用いることができる。
【0108】
105 CFU/ml(低OD)または108 CFU/ml(高OD)の緑膿菌PA14株4μlを、1%エラスチン、0.5%lab lemco粉末、1%ペプトン、0.5%塩化ナトリウムおよび1.5%寒天を含む寒天平板培地に接種し、37℃で5日間インキュベートした。低ODでの増殖では病原性スイッチングは促されなかったが、高ODでの増殖では病原性スイッチングが促された。50μlのscAb(200nM)をこの細菌とともにプレートに添加し、アッセイ全体を通じて、さらに同じ容積の添加を24時間間隔で行った。
【0109】
細菌コロニーおよび周囲の透明帯(エラスターゼによるエラスチンの溶解を示す)の直径を毎日測定し、コロニーのエラストリシス活性を透明帯面積と細菌コロニー面積との比として評価した。この場合も各試験毎に3〜4回反復して行い、大腸菌XL1-Blueを陰性対照として用いた(表5)。
【0110】
実施例4
抗原に対する親和性がより高い抗HSL抗体を単離するため、および特定のHSLバリアントに対する特異性を導くために、クローンG3B12に対して親和性成熟処理を行った。ファージミドDNAをG3B12細菌クローンから単離し、可変軽鎖遺伝子を、45塩基対の柔軟なリンカー領域の最後の30塩基を含む5'オリゴヌクレオチドプライマーLINKER-REV

およびファージマイナーコートタンパク質遺伝子gIIIに対して特異的な3'プライマーgIII-FOR

を用いるPCRによって増幅した。正しいサイズ(380bp前後)の産物を1%アガロースゲルで電気泳動し、切り出した上で精製した。同じようにして、元のクローンを単離したヒトの全ナイーブライブラリーを含むファージミドDNAを調製した。可変重鎖遺伝子の全レパートリーは、pelBリーダー配列に対して特異的な5'プライマーAH1-REV

およびリンカー領域の最初の30塩基をコードする3'プライマーLINKER-FOR

を用いて増幅した。正しいサイズ(400bp前後)の産物を上記の通りに精製した。続いて、VH遺伝子のレパートリーとモノクローナルVL遺伝子を、両方の一次PCR産物に共通するリンカー領域の中央部の相補的な15塩基を用いる連結(linking)PCRによって組み合わせた。この新たなライブラリーを、プライマーAH1-REVおよびgIII-FORを連結PCR反応の4サイクル後に加え、さらに25サイクルを行うことによって増幅した。増幅されたDNAを制限酵素NcoIおよびNotIで消化処理し、同じように消化処理して精製したファージミドベクター中で連結させた。連結および再精製を行ったDNAを最後に電気穿孔法によって大腸菌TG1株細胞に形質転換導入し、従来のようにしてプレーティングした。
【0111】
ファージ抗体を以前のようにヘルパーファージを用いて回収し、dDHL-BSA結合体をコーティングしたイムノチューブに適用して結合させた。結合しなかったファージは流し落とし、弱い/非特異的な結合物はPBSTおよびPBSによる多数回の洗浄段階によって除去した。続いて、結合物に特異的なファージを低pHトリエチルアミンによって溶出させて中和した。これらを対数増殖期の新たなTG1細胞に感染させ、回収して再び増殖させた上で以降の選択(パニング)を行った。以降のパニングに関しては、固定化した結合物としてdDHL-BSAおよびdDHL-TGを交互に用いた。3回目のパニングの際には、シャフリングを行ったライブラリー由来の結合性ファージを、遊離dDHLまたはBHL(ブチリルホモセリンラクトン)により、重複性のパニング物から溶出させた。
【0112】
3回のパニングを行った後に、モノクローナルファージ-抗体を所望の結合特性に関してスクリーニングした。第3回目に得られた個々のファージクローンをELISAによりスクリーニングした:各クローンをまずdDHL-BSAおよびKLH結合体のそれぞれおよび担体タンパク質のみと結合する能力に関してアッセイした。両方の結合体と結合可能であるが担体タンパク質とは結合しなかったクローンをさらに、溶液中の遊離dDHLまたはHSLの存在によって結合物との結合を阻害しうるものを同定するためにアッセイした。遊離BHL/dDHLと結合することが判明したファージクローンからの抗体可変領域遺伝子を可溶性発現ベクター(pIMS 147)中にサブクローニングし、柔軟なペプチドリンカーによって連結された可変重鎖および軽鎖ドメイン、ならびにヒト抗体のκ定常ドメインを含む可溶性一本鎖抗体断片(scAb)として産生させた。可溶性scAbと遊離HSLとの結合の量は、競合阻害ELISAによって評価した。(1ml当たり1μgのdDHL-TGに対して)一定濃度の選択した各scAbを含む試料を、ある範囲の濃度の遊離HSLとともに1時間インキュベートし、その後に、dDHL-TGをコーティングしたELISAプレートに適用した。1時間のインキュベーション後に、結合しなかったscAbを洗い流し、固定化した結合物と結合して残ったscAbを、酵素標識した抗ヒトκ抗体を用いて検出した。遊離HSLに対するscAbの感度および他のHSL(tDHLおよびOHHL)との交差反応性は、scAb(遊離抗原の非存在下で)とdDHL-TGとの結合を50%低下させる遊離抗原の濃度(IC50)により評価した(表4)。
【0113】
実施例5
従来の2種類のペプチド、YST-1(YSTGGAGSGG)およびYST-2 YSTASGGASSを、末位から2番目のC末端リシン側鎖にビオチン化∧(∧はビオチン化の部位を表す)を有する第3のペプチドYST-3(YSTAGGSGAK∧S)とともに合成した。第4のチオラクトンペプチプYSTC*DFIM*(Agr-D1)も合成したが、ここで*はチオラクトン環によって結合した残基を表す(図1c参照)。従来の化学結合法により、YST-1の一部はBSAと、YST-2はウシチログロブリン(TO)と、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)を用いてC末端で結合させた。
【0114】
本質的には前記の通りに、固定化したYST-1結合体およびYST-2結合体(交互に)に対するヒトナイーブ抗体ライブラリーのパニングを4回行った。ファージ-抗体の結合を1時間行わせた後、結合しなかったファージを流し落とし、弱く結合したファージはPBSTに続いてPBSを用いる十分な洗浄によて除去した。結合したファージをトリエチルアミンで溶出させて中和し、その後に対数増殖期の大腸菌TG1細胞に感染させた。強化されたファージをヘルパーファージを用いて回収することによって増殖させた後、次の回の選択に備えてポリエチレングリコール沈殿による精製および濃縮を行った。第3回および4回でYST-1/2-結合体と結合したファージを洗浄した後に、ファージをYST-3溶液で溶出させた。このビオチン化ペプチドと結合するファージを、ストレプトアビジンでコーティングした常磁性ビーズによって捕捉して、磁石により固定化した。さらに洗浄の段階を行った後に、結合性ファージを以前の通りにTG1細胞に直接添加して感染させた。
【0115】
4回の選択を行った後に、モノクローナルファージ-抗体を、YST-1結合体およびYST-2結合体に対する結合性ならびにBSAおよびTG担体タンパク質のみに対する結合性に関して、ELISAによりスクリーニングした。両方の結合体のみと結合したクローンのscFv遺伝子を、pIMS-147scAb可溶性発現ベクター中にサブクローニングし、大腸菌XL1-Blue細胞への形質転換導入を行った。これらの細胞を発現させ、可溶性scAbを細菌のペリプラスム間隙から抽出し、ニッケルアフィニティークロマトグラフィーによって精製した。続いて精製scAbを、ELISAにより、固定化ペプチド結合体との競合下での、遊離(結合体を形成していない)ペプチドとの結合性およびチオラクトンペプチドオートインデューサーAgr-D1との結合性に関してさらにアッセイした。結合物のみとの結合と比較してペプチドの存在下の方がシグナルが低いことにより、scAbがすべてのペプチドに共通するYST-エピトープを認識することが示される(図9)。
【0116】
実施例6
AI-2標的に対する抗体を作製するためには、遊離AI-2分子および結合型のものの両方が必要である。AT-2を純粋な形態で単離することは不可能である(と考えられる)。自然下で、AI-2はpro-AI-2(図1(b))とホウ酸との(自発的な)反応によって形成される。インビトロではpro-AI-2もホウ酸と反応して活性AI-2を生成するが、これは結合および抗体選択のためには適していない。pro-AI-2の誘導体は合成可能であり、この際、メチル基はアシル鎖などのリンカーによってカルボン酸などの末端反応基に置換される。担体との化学結合または架橋に適した末端反応基を含み、コアにpro-AI-2部分が担体表面に遮られずに提示されると考えられるあらゆる構造を、リンカーとして用いることができる。「発明の概要」の項に述べたように、反応性pro-AI-2を2つの異なる担体と結合させることが好ましい。
【0117】
受容体の可能性があるもののライブラリー(例えば、ファージ上に提示された抗体ライブラリー)を、固定化されたAI-2結合体を得るために、ホウ酸の存在下(好ましくは>10μM、pH 6.0〜8.0)で、固定化された結合物に対して適用する。ファージ-抗体(「ファージ」)を結合させ、結合物を認識しないものは洗浄によって除去する。結合性ファージは高pHもしくは低pH(例えばトリエチルアミン)により、または遊離AI-2との競合的結合により、またはビオチン化AI-2などとの競合的結合の後にストレプトアビジン磁気ビーズで除去することにより、溶出させることができる。極限pHによる溶出を除くバイオパニングのすべての段階に、AI-2の正しい構造を確実に維持するためにホウ酸が存在すべきである。溶出したファージを宿主細菌(大腸菌)に再び感染させ、ファージ粒子が産生される条件下で細胞を増殖させることによって増幅し、次の回のために精製する。次の回の選択は、固定化した結合物を交互に用いることが好ましい点を除き、1回目に関して記載したのと同じように行う。
【0118】
十分な回数の選択を終えたところで、個々の(モノクローナル性)クローンを、AI-2との結合に関してアッセイする。少なくとも3回の選択が必要である可能性が高いが、AI-2結合性クローンを1回のみの後に単離することもでき、または3回を上回って行う必要がある場合も考えられる。各回の後に、何回が必要であるかを判定するために、当業者に知られた方法によってポリクローナルファージELISAを行うことができる。モノクローナルファージ抗体を前の実施例に記載した通りに作製し、選択のために用いた結合体のそれぞれ、および結合体を形成させていないそれぞれの担体に対する結合に関してアッセイする必要がある。利用可能であれば第3または第4の結合物をさらに用いることもできる。陽性クローンと推定されるものは、ホウ酸の存在下で利用可能なすべての結合体と結合するが、担体分子のみとは結合せず、好ましくはホウ酸の非存在下では結合物と結合しないものであると考えられる。
【0119】
pro-AI-2とホウ酸との反応によって複数の種が生成される可能性があるため、抗体が特に正しいAI-2構造を認識することを示すことが好ましいと考えられる。これは、遊離pro-AI-2およびホウ酸の存在下で結合物との結合に関するアッセイを行うことによって判定しうる。遊離pro-AI-2の濃度が高くなるほど結合性が低下することは競合阻害を意味する。したがって、このような抗体は、細胞外AI-2と結合してそれを細胞が利用できないようにすることにより、AI-2応答性細菌の応答を調節すると考えられる。
【0120】
適したインビボモデルには、AI-2に応答して生物発光を行う生物発光性ビブリオ・ハーヴェイ(Vibrio harveyl)がある。LuxS−であるV.ハーヴェイの菌株はDPD(pro-AI-2の前駆体)を合成することができず、このためAI-2を産生することができない。しかし、これらは外因性に添加したAI-2に対しては、ホウ酸を伴うpro-AI-2の形態で、またはLuxS+V.ハーヴェイから得られたホウ酸含有無細胞培地として、(光出力の増大によって)応答することができる。LuxS−細胞またはLuxP−細胞(天然のAT-2受容体を持たない)にホウ酸のみを添加しても発光は起こらない。このため、抗AT-2抗体(「受容体」)の可能性のあるものを、LuxS−細胞に対して添加した場合の発光の低下、またはLuxS+細胞に対して添加した場合の発光の消失/防止/低下によって判定して、以前に概要を示した結合基準を満たすものとして、さらにはAI-2を野生型V.ハーヴェイ培養液から枯渇させうるものとして同定することが可能と考えられる。
【0121】
【表1】

表1は、ある一定範囲の微生物に関して、種々の細菌表現型を、それらを調節するクオラムセンシングシステムの細胞シグナル伝達分子および調節因子とともに列挙したものである。
【0122】
【表2】

N/DはIC50値が決定不可能であったことを示す。
表2は、競合阻害ELISAによって評価した、dDHL-BSAとの競合下での、遊離抗原(dDHL-COOH)および2種類のAHL類似体(tDHLおよびOHHL)に対する抗AHL scAbの感度(IC50)をまとめたものを示している。
【0123】
【表3】

表3は、BIAcore 2000装置を用いる表面プラスモン共鳴法によって評価した、固定化したdDHL-BS結合体に対する2種類の抗AHL scAbsの結合動態の比較を示している。会合定数(ka)、解離定数(kd)および親和定数(KA、KD)が示されている。
【0124】
【表4】

表4は、種々のHSLに対するチェーンシャフリング法によって得られた抗HSLクローンの感度(IC50)をまとめたものを示している。それぞれの新たなクローンの下方に括弧で囲んでいるのは、その由来となったクローンの名称である。出発クローンとの比較による新たなクローンの抗原に対する感度の増加の程度を、該当する場合には括弧内に示した。データは、競合ELISAによって評価した、dDHL-TG結合物との競合下での、遊離HSLとの結合を比較している。
【0125】
【表5】

表5は、緑膿菌による毒性因子エラスターゼの発現を低下させる抗HSL scAbの効果を示している。データは、PBS対照(100%)と比較したパーセンテージとして表現した、透明帯とコロニー面積の比を表している。
【0126】
引用した参考文献
米国特許文献
6,309,651、2001年10月、Frankら
その他の特許文献
国際公開公報第01/26650号、2001年4月、Nottingham大学
国際公開公報第01/74801号、2001年10月、Nottingham大学
国際公開公報第92/01047号、2001年10月、Bonnertら
その他の文献










【特許請求の範囲】
【請求項1】
細菌によって分泌されるラクトンシグナル分子またはラクトン由来シグナル分子に対する抗体。
【請求項2】
ラクトンシグナル分子がホモセリン分子またはペプチドチオラクトン分子である、請求項1記載の抗体。
【請求項3】
ホモセリンラクトン分子が、

(式中、n=0〜12である)
からなる群より選択される一般式を有する、請求項2記載の抗体。
【請求項4】
一般式Iのホモセリンラクトン分子が、N-ブタノイル-L-ホモセリンラクトン(BHL)(式中n=0)、N-ドデカノイル-L-ホモセリンラクトン(dDHL)(式中n=8)およびn-テトラデカノイル-L-ホモセリンラクトン(tDHL)(式中n=10)である、請求項3記載の抗体。
【請求項5】
一般式IIのホモセリンラクトン分子が、N-(-3-オキソヘキサノイル)-L-ホモセリンラクトン(OHHL)(式中n=2)およびN-(-3-オキソドデカノイル)-L-ホモセリンラクトン(OdDHL)(式中n=8)である、請求項3記載の抗体。
【請求項6】
一般式IIIのホモセリンラクトン分子が、N-(-3-ヒドロキシブタノイル)-L-ホモセリンラクトン(HBHL)(式中n=0)である、請求項3記載の抗体。
【請求項7】
ペプチドチオラクトンが、以下の一般式(IV):

(式中、Xが任意のアミノ酸であり、かつn=1〜10である)
を有する、請求項2記載の抗体。
【請求項8】
ペプチドチオラクトン分子が

または

または

または

である、請求項7記載の抗体。
【請求項9】
ラクトン由来シグナル分子がフラノシルホウ酸ジエステルである、請求項1記載の抗体。
【請求項10】
フラノシルホウ酸ジエステルがオートインデューサー2(AI-2)、

である、請求項9記載の抗体。
【請求項11】
ラクトン由来シグナル分子が、Pro-AI-2

またはそのC1〜C10飽和もしくは不飽和カルボン酸誘導体である、請求項1記載の抗体。
【請求項12】
ポリクローナル抗体である、請求項1〜11のいずれか一項記載の抗体。
【請求項13】
モノクローナル抗体である、請求項1〜11のいずれか一項記載の抗体。
【請求項14】
一本鎖抗体(scAb)である、請求項1〜11のいずれか一項記載の抗体。
【請求項15】
抗体断片である、請求項1〜11のいずれか一項記載の抗体。
【請求項16】
抗体断片が一本鎖可変領域断片(scFv)である、請求項15記載の抗体。
【請求項17】
抗体断片が単一ドメインの断片である、請求項15記載の抗体。
【請求項18】
請求項1〜17のいずれか一項に定義された抗体を含む薬学的組成物。
【請求項19】
対象の細菌感染症の治療のための方法であって、請求項1〜17のいずれか一項に定義された抗体の投与を含む方法。
【請求項20】
単位投薬式剤形して提供される、請求項1〜17のいずれか一項に定義された抗体を含む部分を有するキット。
【請求項21】
医療に用いるための、請求項1〜17のいずれか一項に定義された抗体。
【請求項22】
細菌感染症の治療のための医薬品の調製に用いるための、請求項1〜17のいずれか一項に定義された抗体の使用。
【請求項23】
特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングする方法であって、細菌ラクトンシグナル分子またはラクトン由来シグナル分子を担体分子と結合させること、およびそのようにして形成された結合体を、結合体と特異的に結合する特異的結合分子を特異的結合分子の集団から同定するために用いることを含む方法。
【請求項24】
特異的結合分子が抗体またはその断片である、請求項23記載の方法。
【請求項25】
抗体がモノクローナル抗体である、請求項24記載の方法。
【請求項26】
抗体がポリクローナル抗体である、請求項24記載の方法。
【請求項27】
担体分子がタンパク質である、請求項23〜26のいずれか一項記載の方法。
【請求項28】
細菌ラクトンシグナル分子がホモセリン分子またはペプチドチオラクトン分子である、請求項23〜27のいずれか一項記載の方法。
【請求項29】
ラクトン由来シグナル分子が、AI-2、またはPro-AI-2もしくはそのC1〜C10飽和もしくは不飽和カルボン酸誘導体などのフラノシルホウ酸ジエステルである、請求項23〜27のいずれか一項記載の方法。
【請求項30】
特異的結合分子の集団がファージディスプレイライブラリーである、請求項23〜29のいずれか一項記載の方法。
【請求項31】
医療に用いるための、請求項23〜30のいずれか一項記載の方法によって同定された特異的結合分子。
【請求項32】
細菌感染症の治療のための医薬品の調製における、請求項23〜30のいずれか一項記載の方法によって同定された特異的結合分子の使用。
【請求項33】
細菌ラクトンシグナル分子またはラクトン由来シグナル分子の使用であって、該細菌ラクトンシグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団をスクリーニングするための使用。
【請求項34】
対象の細菌感染症の治療方法であって、該対象からの試料中の細菌ラクトンシグナル分子またはラクトン由来シグナル分子の単離、および該細菌ラクトンシグナル分子を、シグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングするために用いること、およびそのようにして同定された該特異的結合分子をそれを必要とする患者に投与することを含む方法。
【請求項35】
試料が、血液、唾液、組織、脳脊髄液、涙液、精液、尿、便、膿汁、皮膚または粘膜分泌物のものである、請求項34記載の方法。
【請求項1】
細菌によって分泌されるラクトンシグナル分子またはラクトン由来シグナル分子に対する抗体。
【請求項2】
ラクトンシグナル分子がホモセリン分子またはペプチドチオラクトン分子である、請求項1記載の抗体。
【請求項3】
ホモセリンラクトン分子が、

(式中、n=0〜12である)
からなる群より選択される一般式を有する、請求項2記載の抗体。
【請求項4】
一般式Iのホモセリンラクトン分子が、N-ブタノイル-L-ホモセリンラクトン(BHL)(式中n=0)、N-ドデカノイル-L-ホモセリンラクトン(dDHL)(式中n=8)およびn-テトラデカノイル-L-ホモセリンラクトン(tDHL)(式中n=10)である、請求項3記載の抗体。
【請求項5】
一般式IIのホモセリンラクトン分子が、N-(-3-オキソヘキサノイル)-L-ホモセリンラクトン(OHHL)(式中n=2)およびN-(-3-オキソドデカノイル)-L-ホモセリンラクトン(OdDHL)(式中n=8)である、請求項3記載の抗体。
【請求項6】
一般式IIIのホモセリンラクトン分子が、N-(-3-ヒドロキシブタノイル)-L-ホモセリンラクトン(HBHL)(式中n=0)である、請求項3記載の抗体。
【請求項7】
ペプチドチオラクトンが、以下の一般式(IV):

(式中、Xが任意のアミノ酸であり、かつn=1〜10である)
を有する、請求項2記載の抗体。
【請求項8】
ペプチドチオラクトン分子が

または

または

または

である、請求項7記載の抗体。
【請求項9】
ラクトン由来シグナル分子がフラノシルホウ酸ジエステルである、請求項1記載の抗体。
【請求項10】
フラノシルホウ酸ジエステルがオートインデューサー2(AI-2)、

である、請求項9記載の抗体。
【請求項11】
ラクトン由来シグナル分子が、Pro-AI-2

またはそのC1〜C10飽和もしくは不飽和カルボン酸誘導体である、請求項1記載の抗体。
【請求項12】
ポリクローナル抗体である、請求項1〜11のいずれか一項記載の抗体。
【請求項13】
モノクローナル抗体である、請求項1〜11のいずれか一項記載の抗体。
【請求項14】
一本鎖抗体(scAb)である、請求項1〜11のいずれか一項記載の抗体。
【請求項15】
抗体断片である、請求項1〜11のいずれか一項記載の抗体。
【請求項16】
抗体断片が一本鎖可変領域断片(scFv)である、請求項15記載の抗体。
【請求項17】
抗体断片が単一ドメインの断片である、請求項15記載の抗体。
【請求項18】
請求項1〜17のいずれか一項に定義された抗体を含む薬学的組成物。
【請求項19】
対象の細菌感染症の治療のための方法であって、請求項1〜17のいずれか一項に定義された抗体の投与を含む方法。
【請求項20】
単位投薬式剤形して提供される、請求項1〜17のいずれか一項に定義された抗体を含む部分を有するキット。
【請求項21】
医療に用いるための、請求項1〜17のいずれか一項に定義された抗体。
【請求項22】
細菌感染症の治療のための医薬品の調製に用いるための、請求項1〜17のいずれか一項に定義された抗体の使用。
【請求項23】
特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングする方法であって、細菌ラクトンシグナル分子またはラクトン由来シグナル分子を担体分子と結合させること、およびそのようにして形成された結合体を、結合体と特異的に結合する特異的結合分子を特異的結合分子の集団から同定するために用いることを含む方法。
【請求項24】
特異的結合分子が抗体またはその断片である、請求項23記載の方法。
【請求項25】
抗体がモノクローナル抗体である、請求項24記載の方法。
【請求項26】
抗体がポリクローナル抗体である、請求項24記載の方法。
【請求項27】
担体分子がタンパク質である、請求項23〜26のいずれか一項記載の方法。
【請求項28】
細菌ラクトンシグナル分子がホモセリン分子またはペプチドチオラクトン分子である、請求項23〜27のいずれか一項記載の方法。
【請求項29】
ラクトン由来シグナル分子が、AI-2、またはPro-AI-2もしくはそのC1〜C10飽和もしくは不飽和カルボン酸誘導体などのフラノシルホウ酸ジエステルである、請求項23〜27のいずれか一項記載の方法。
【請求項30】
特異的結合分子の集団がファージディスプレイライブラリーである、請求項23〜29のいずれか一項記載の方法。
【請求項31】
医療に用いるための、請求項23〜30のいずれか一項記載の方法によって同定された特異的結合分子。
【請求項32】
細菌感染症の治療のための医薬品の調製における、請求項23〜30のいずれか一項記載の方法によって同定された特異的結合分子の使用。
【請求項33】
細菌ラクトンシグナル分子またはラクトン由来シグナル分子の使用であって、該細菌ラクトンシグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団をスクリーニングするための使用。
【請求項34】
対象の細菌感染症の治療方法であって、該対象からの試料中の細菌ラクトンシグナル分子またはラクトン由来シグナル分子の単離、および該細菌ラクトンシグナル分子を、シグナル分子と特異的に結合する特異的結合分子を同定する目的で特異的結合分子の集団を抗細菌特異的結合分子に関してスクリーニングするために用いること、およびそのようにして同定された該特異的結合分子をそれを必要とする患者に投与することを含む方法。
【請求項35】
試料が、血液、唾液、組織、脳脊髄液、涙液、精液、尿、便、膿汁、皮膚または粘膜分泌物のものである、請求項34記載の方法。
【図1A】


【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−46705(P2011−46705A)
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2010−186713(P2010−186713)
【出願日】平成22年8月24日(2010.8.24)
【分割の表示】特願2004−527070(P2004−527070)の分割
【原出願日】平成15年8月13日(2003.8.13)
【出願人】(505055424)ハプトゲン リミテッド (5)
【Fターム(参考)】
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成22年8月24日(2010.8.24)
【分割の表示】特願2004−527070(P2004−527070)の分割
【原出願日】平成15年8月13日(2003.8.13)
【出願人】(505055424)ハプトゲン リミテッド (5)
【Fターム(参考)】
[ Back to top ]

