抗ラミニンガンマ1抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法。
【課題】抗p200類天疱瘡に特異的で高い臨床的感度を有する抗p200抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法を提供する
【解決手段】ヒトから採取した血液検体を、ラミニンガンマ1又はその断片と反応させた後、検体のラミニンガンマ1に対する自己抗体である抗ラミニンガンマ1抗体がラミニンガンマ1に結合したか否かを測定して検体中の抗ラミニンガンマ1抗体を検出することにより、抗p200類天疱瘡を診断することが出来る。
【解決手段】ヒトから採取した血液検体を、ラミニンガンマ1又はその断片と反応させた後、検体のラミニンガンマ1に対する自己抗体である抗ラミニンガンマ1抗体がラミニンガンマ1に結合したか否かを測定して検体中の抗ラミニンガンマ1抗体を検出することにより、抗p200類天疱瘡を診断することが出来る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗ラミニンガンマ1抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法。に関する。
【背景技術】
【0002】
皮膚は光線や微生物、細菌などの外部からの刺激や、打撲、圧迫、酸・アルカリなどの化学物質による傷害を防ぐ役割(対外保護作用)を担っている。自己免疫性水疱性皮膚疾患は、皮膚を構成する細胞間接着分子に対する自己抗体が産生され、これにより細胞間の接着が失われることによって皮膚の体外保護作用が失われ、時として死に至る重篤な疾患である。
【0003】
自己免疫性水疱性疾患は、抗表皮細胞膜抗体による天疱瘡群と抗表皮基底膜部抗体による類天疱瘡群に大別され、前者では表皮細胞間接着の障害を、後者では表皮真皮間接着の障害を生じる。
【0004】
自己免疫疾患は、患者の体液中に自己抗原に対する抗体が見出されることを特徴とするが、自己免疫疾患の中でも、全身性エリテマトーデスやシェーグレン症候群などの膠原病では、自己抗体の産生が疾患の原因であるのか結果であるのかは明らかでない。しかし、天疱瘡や水疱性類天疱瘡など多くの自己免疫性水疱性皮膚疾患では、患者血清中に存在する自己抗体が疾患の原因であることが明らかにされており、従って自己抗体の検出が疾患の診断に必須で有り、その対応抗原の同定が治療法の開発に繋がると考えられている。
【0005】
現在、いくつかの自己免疫性水疱性疾患において対応抗原が明らかになっている。例えば、落葉上天疱瘡や尋常性天疱瘡では表皮細胞間接着因子であるデスモグレイン1やデスモグレイン3が病因抗体の対応抗原であり、水疱性類天疱瘡では表皮基底膜間接着因子であるBP180が対応抗原であることが明らかにされている。また、これらの情報から、リコンビナントタンパク質を用いたELISA法がその診断の用に供されている(特許文献1、および非特許文献1、2参照)。
【0006】
しかし、自己免疫性水疱性皮膚疾患には未だその自己抗原が明らかでない疾患が存在し、抗p200類天疱瘡もその一つである。抗p200類天疱瘡は、1996年に本願の一部の発明者らによって発見された疾患であり、緊満性水疱が多発し、約半数に乾癬を合併する。免疫ブロット法では、患者血清が皮膚抽出物中の200kDaの分子と反応するため、抗p200類天疱瘡と呼ばれる(非特許文献3参照)。
【0007】
抗p200類天疱瘡は、その症例の希少さと、タンパク発現量の少なさから、その分子の同定が困難であった。しかし、本願の発明者らは、自己抗原であるp200を同定するため鋭意努力し、ヒト正常皮膚抽出物を用いて二次元電気泳動を行い、免疫ブロット法により、患者血清によって特異的に染色される分画を得た。そこで、質量分析機を用いてこの分画の分析を行い、データベース上に登録された情報からこの分画が細胞外マトリックスの構成成分ラミニン1のサブユニットであるラミニンガンマ1であることを明らかにし、2009年に発表した(非特許文献4参照)。
【0008】
さらに本願発明者らは、リコンビナントラミニンガンマ1を抗原とし、患者血清を用いた免疫ブロット法により、抗p200類天疱瘡の患者の90%がラミニンガンマ1に反応すること、一方健常者及び他の自己免疫性水疱性疾患の患者血清はラミニンガンマ1に反応しないことから、ラミニンガンマ1に対する免疫学的測定法が抗p200類天疱瘡の診断に有用であることを証明した(非特許文献4参照)。
【0009】
ラミニンは、基底膜内に最も豊富に存在する糖タンパク質で、ニドゲン、IV型コラーゲンなどの基底膜のその他の成分と複合体を形成している。また、ラミニンは、3本のポリペプチドがcoiled−coilドメインを介して十字架様に会合した構造をとり、多くのアイソフォームの存在が確認されている。即ち、ラミニンは、それを構成する3つのポリペプチドであるα鎖(400kDa以下)、β鎖(200kDa以下)及びγ鎖(200kDa以下)の組み合わせによって様々なアイソフォームを形成することが可能であり、α鎖には5種類、β鎖とγ鎖には3種類ずつの異なるタイプがあることから、現在までに少なくとも12個のアイソフォームの存在が報告されている(非特許文献5および6参照)。
【0010】
たとえば、ラミニン−1(α1、β1、γ1)は、腎臓、胎児脳、網膜、血管等に存在し、メロシン(=ラミニン−2;α2、β1、γ1)は、骨格筋、心臓、胎盤に存在し、s−ラミニン(=ラミニン−3;α1、β2、γ1)は、神経筋末端プレートの接合部の基底膜、血管内皮及び子宮体基底膜に存在し、s−メロシン(=ラミニン−4;α2、β2、γ1)は、Schwann細胞、胎盤などに存在し、カリニン/ナイセイン(=ラミニン−5;α3、β3、γ2)とk−ラミニン(=ラミニン−6;α3、β1、γ1)とks−ラミニン(=ラミニン−7;α3、β2、γ1)は、皮膚の基底膜に特有なものであることが明らかとなっている。ラミニンガンマ1はラミニンを構成するγ鎖のひとつである。
【0011】
(従来の診断方法)
従来、抗p200類天疱瘡の診断は、蛍光抗体直接法で患者の表皮基底膜部にIgG、C3の沈着を認め1M食塩水で剥離した表皮を用いた間接法により真皮側に反応することの確認、及び、上記のように免疫ブロット法により患者血清が200kDaの蛋白質との反応を確認することによって行われていた。しかし、1M食塩水による剥離表皮切片や表皮抽出物の入手が、一般の病院では困難なこと、間接蛍光抗体法は定性的であり判定に熟練を要することなどから、ルーチンの検査として実施することは困難であった。
【0012】
このような状況からGrothらは、2011年に大腸菌で発現させたラミニンガンマ1を抗原とするELISA法を報告した(非特許文献7参照)。しかし、その陽性率は69%と、診断として用いるには不十分なものであった。また、尿中に存在する200kDaのラミニン分画に対する抗体の測定が、全身性エリテマトーデス(SLE)の診断に利用できる可能性が報告(特許文献2参照)されているが、抗p200類天疱瘡については言及されていない。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平8−188540号公報
【特許文献2】特開平8−036966号公報
【非特許文献1】岸本和裕ら、日皮会誌:112(6)、793−801(2002)
【非特許文献2】岸本和裕ら、日皮会誌:113(11)、1695−1710(2003)
【非特許文献3】Zillikens D, et al.(1996) A novel subepidermal blistering disease with autoantibodies to a 200−kDa antigen of the basement membrane zone.J Invest Dermatol 106:1333−1338
【非特許文献4】Dainichi T, et al.(2009) Anti−laminin gamma−1 pemphigoid.Proc Natl Acad Sci USA 106:2800−2805
【非特許文献5】Miner J et al.(1997) The laminin α Chains:Expression, Developmental Transitions, and Chromosomal Locations of α1−5、Identification of Heterotrimeric Laminins8−11, and Cloning of a Novel α3 Isoform.J Cell Biol 137:685−701
【非特許文献6】Hoch M et al(1999) Characterization and Expression of the Laminin γ3Chain:A novel, Non−Basement Membrane−associated, Laminin Chain.J Cell Biol 145:605−617
【非特許文献7】Groth S et al(2011) Development of a simple enzyme−linked immunosorbent assay for the detection of autoantibodies in anti−p200 pemphigoid.Br J Dermatol 164:76−82
【発明の概要】
【発明が解決しようとする課題】
【0014】
上述の技術では、抗p200類天疱瘡は、多くの場合水疱性類天疱瘡と区別されていなかったと考えられる。水疱性類天疱瘡の診断には現在、抗BP180抗体測定用ELISA及び抗BP230抗体測定用ELISAが開発され使われているが、抗p200類天疱瘡はこれらの試薬で診断することはできない。
【0015】
そこで、本発明の目的は、抗p200類天疱瘡に特異的で高い臨床的感度を有する抗p200抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法を提供することである。
【課題を解決するための手段】
【0016】
上記目的を達成するため、本発明の抗ラミニンガンマ1抗体の測定方法は、次の工程を有する。
(1)検体をラミニンガンマ1又はその断片と接触させる工程、
(2)ラミニンガンマ1又はその断片と検体中に存在するラミニンガンマ1を認識する抗体の結合を検出する工程、および
(3)両者の結合のレベルに基づいて検体中の抗ラミニンガンマ1抗体の量を決定する工程。
【0017】
ここで、ラミニンガンマ1の断片が、ラミニンガンマ1のC末の246アミノ酸以外のペプチド又はそのアミノ酸配列に1又は数個のアミノ酸の置換、欠失、挿入および付加の中から選ばれる少なくとも1つの変異を有するペプチドを含むペプチドであることとすることができる。
【0018】
また、ラミニンガンマ1またはその断片が、固相に固定化されたラミニンガンマ1またはその断片であることとすることができる。
【0019】
また、検体が、血液、血漿又は血清であることとすることができる。
【0020】
また、上記目的を達成するため、本発明のキット(抗p200抗体の測定試薬)は、構成試薬がラミニンガンマ1又はその断片を含み、検体中の抗ラミニンガンマ1抗体の抗体量を測定する方法に用いられる。
【0021】
ここで、ラミニンガンマ1又はその断片が、固相に固定化された固相化ラミニンガンマ1又はその断片であることとすることができる。
【0022】
また、上記目的を達成するため、本発明の皮膚科疾患を検出する方法は、上述のキットにより測定した検体中の抗ラミニンガンマ1抗体の測定値から皮膚科疾患を検出する。
【0023】
ここで、皮膚科疾患が、抗p200類天疱瘡であることとすることができる。
【発明の効果】
【0024】
本発明では、抗p200類天疱瘡に特異的で高い臨床的感度を有する抗p200抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法を提供することができる。
【図面の簡単な説明】
【0025】
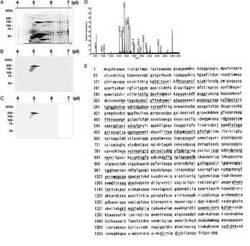
【図1】真皮抽出物を用いた二次元電気泳動の結果を示す図である。ここで、(A)は、真皮抽出物のプロテオームパターンであり、7.5%SDSゲル上で、クマーシーブリリアントブルーで染色したものである。また、(B)は、患者血清を用いた免疫ブロットであり、分子量約250kDa、等電点5.0の特定のバンドが染色されたことを示している。また、(C)は、抗ラミニンガンマ1モノクローナル抗体B−4を用いた免疫ブロットであり、(B)におけるバンドと同じバンドが染色されたことを示している。また、(D)は、ゲル上の特定の蛋白質バンドのMALDI−TOF−MSのスペクトルである(m/z値は700から3,000)。また、(E)は、ラミニンガンマ1に該当する特定のトリプシン分解ペプチドのピークを標識するm/z値であり、太字かつ下線付き文字で示したものは、データベースサーチでラミニンガンマ1と一致したトリプシン分解ペプチドであり、これらの配列は、全体の28%をカバーしている。
【図2】真皮抽出物の免疫沈降物を免疫ブロット分析した図である。ここで、(A)は、真皮抽出物を、健常者血清無し(レーン1)、健常者血清有り(レーン2)、抗p200類天疱瘡患者血清(1:20希釈、レーン3)、で免疫沈降したもの、各上清を、コントロール血清(レーン4)、あるいは患者血清(レーン5)で同様に実施したものを示している。また、マウス抗ラミニンガンマ1モノクローナル抗体B−4を用いた免疫ブロットでは、レーン3及びレーン4において未処理の真皮抽出物から得たラミニンガンマ1(レーン6)と同じバンドを検出した。また、(B)は、真皮抽出物は20μg/mlのマウスコントロールIgG(レーン1)、モノクローナル抗体B−4(5μg/ml、レーン2及び20μg/ml、レーン3)及び患者血清(1:20希釈、レーン4)と免疫沈降し、患者血清で免疫ブロットを行った図である。各上清も同様に検討した(レーン5−8)。患者血清は抗ラミニンガンマ1モノクローナル抗体による免疫沈降物と投与量依存的に反応した(レーン2,3及びレーン6,7)。
【図3】20人の抗p200類天疱瘡患者(二重線)抗ラミニンガンマ1モノクローナル抗体B−4(矢印)及び健常者9名の血清(単線)を用いた免疫ブロットの結果を示す図である。(A)は、すべての患者血清は真皮抽出物中の200kDaの蛋白質と反応したのに対し、健常者コントロール血清はいずれも反応しなかった事を示しており、それぞれのバンドは抗ラミニンガンマ1モノクローナル抗体のバンドと一致した。(B)は、ほとんどの患者血清が、JARヒト絨毛癌細胞株から精製したラミニン111と反応したことを示し、(C)は、ほとんどの患者血清が、ヒト胎盤から精製したラミニン211/221と反応したことを示し、(D)は、ほとんどの患者血清が、ラミニン111のリコンビナント産物のラミニンガンマ1と反応したことを示している。なお、健常者コントロール血清は、ラミニンガンマ1と反応しなかった。短い矢印は、p200のバンドを示し、矢頭はラミニンガンマ1を示す(6%SDS)。
【図4】抗p200類天疱瘡患者血清のラミニンガンマ1C末部分に対する反応性を示す図である。(A)は、真皮抽出物を用いた免疫ブロット法(7.5%SDS)において、患者血清のp200(黒矢印)に対する反応性は、抗ラミニンガンマ1モノクローナル抗体B−4を加えたときに(B−4、2及び10μg/ml)、この蛋白質のC末を認識して投与量依存的に減少したことを示している。また、(A)は、正常ヒトIgG、抗ラミニンガンマ1N末モノクローナル抗体(C13S)あるいは抗コラーゲンVIモノクローナル抗体(3C4、腹水)は、真皮抽出物から得たp200と患者血清の結合を阻害しなかったことを示している。なお、各示された量のIgG(μg/ml)、腹水、血清(μl)の有り、無しを、反応中セルロース膜に添加した。(B)は、抗p200類天疱瘡患者から得た血清又は精製IgGは抗ラミニンガンマ1モノクローナル抗体B−4の真皮から抽出したラミニンガンマ1抽出物への結合を減少させた(白矢印)が、健常者からの血清又はIgGは減少させなかったことを示している。
【図5】ラミニン111のE8分画を用いた免疫ブロットである(12%SDS)。(A)は、ラミニン111のリコンビナントC末E8分画の構造計画を示している。(B)の上段は、図2の患者18(左の18番目のレーン)を除くすべてのラミニンガンマ1陽性血清は、還元状態において、免疫ブロットでE8分画に陽性の反応を示したことを示している。(B)の下段は、図2の患者16と18(左の16番目及び18番目のレーン)を除くすべてのラミニンガンマ1陽性血清は、非還元状態で、ラミニンガンマ1のE8分画に陽性反応を示したことを示している。二重線は、抗p200類天疱瘡の20名の患者の血清を示している。矢印は、抗ラミニンガンマ1モノクローナル抗体B−4を示す。1本線は、9人の健常人コントロール血清を示す。矢頭は、E8のバンドを示す。NSは、非特異バンドを示す。
【図6】(A),(B)および(C)は、1M食塩水剥離皮膚を用いた間接蛍光抗体法の結果を示す図である。(A)は、抗p200類天疱瘡の患者から得た精製IgGは、剥離皮膚の真皮側に反応したことを示しており、症例#200の患者から得たIgGは真皮上層で血管に反応しなかった。一方(B)は、症例#12から得たIgGは反応したことを示している。(C)は、抗ラミニンガンマ1モノクローナル抗体C13Sは、基底膜領域の真皮側及び真皮の血管壁の両方に反応したことを示している。(D)は、真皮及び血管壁の抽出物を用いた免疫ブロットの結果を示す図である。なお、添加した抽出物の量は抗ラミニンガンマ1モノクローナル抗体B−4(一番下)との反応性で調節した。還元状態では#20の症例の患者の精製IgG(図6Aでも使用)の上皮ラミニンガンマ1に対する反応性は、血管のラミニンガンマ1に対する反応性よりもずっと高かった(上段)。#12の患者の精製IgG(図6Bでも使用)は、真皮抽出物のラミニンガンマ1と血管抽出物のラミニンガンマ1に同じような反応性を示した(中段)レーン1;JAR細胞株から得た精製ラミニン111レーン2;真皮抽出物レーン3;血管抽出物(7.5%SDS、還元状態)
【図7】患者20名の血清を用いた免疫ブロットの分析結果を示す図である。
【発明を実施するための形態】
【0026】
本発明者らの研究により、抗p200類天疱瘡の患者血清中に見出される自己抗体が認識するp200タンパク質は、ラミニンの構成成分であるラミニンガンマ1であり、そのエピトープのラミニンガンマ1のC末にあることを明らかにした。さらに、本発明者らは、患者血清中の抗ラミニンガンマ1抗体の反応性を検討したところ、皮膚のラミニンガンマ1に対して強く反応し、血管のラミニンガンマ1に対しては一部の患者血清しか反応しないことを見出した。
【0027】
本発明は、上記のような知見に基づいてなされたものであり、従来の抗ラミニンガンマ1抗体の測定法に比べてより高い臨床的感度と特異性を持った、自動機にも対応可能な抗ラミニンガンマ1抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法である。以下、本発明の実施の形態にについて、図面を参照しながら説明する。
【0028】
本発明の実施の形態はラミニンガンマ1に対する抗体を検出する方法及び試薬に関する。抗ラミニンガンマ1抗体は抗p200類天疱瘡患者の血清中に見出され、抗ラミニンガンマ1抗体の検出は抗p200類天疱瘡の診断に有用である。本発明の実施の形態の抗ラミニンガンマ1抗体の検出に用いられる抗原は、ヒトのラミニンガンマ1のC末部分、246アミノ酸以外の分画を含むことを特徴とする。
【0029】
本発明の実施の形態に係る抗ラミニンガンマ1抗体の測定方法は以下の測定方法が挙げられるが、これに限定されるものではない。
(1)検体をラミニンガンマ1のC末以外のペプチドを含む断片を固相化した不溶性担体に接触させる工程
(2)ラミニンガンマ1のC末以外の断片を含むペプチド断片と検体中に存在するラミニンガンマ1を認識する抗体の結合を検出する工程、および
(3)両者の結合のレベルに基づいて検体中の抗ラミニンガンマ1抗体の量を決定する工程。
【0030】
本発明の実施の形態には上記ラミニンガンマ1のC末以外のペプチド断片のアミノ酸配列を含むペプチド又は、そのアミノ酸に1又は数個のアミノ酸の置換、欠失、挿入および付加されたラミニンガンマ1C末以外の断片を用いる測定方法が含まれる。
【0031】
ラミニンガンマ1は、正常皮膚組織から抽出して用いることもできるが、リコンビナントタンパク質として作製することが出来る。特に、特定の分画を抗原として使用する場合、リコンビナントタンパク質として作製することが好ましい。
【0032】
一般的に、蛋白質の機能発現には特異的な修飾が必要とされることが多いことから、目的蛋白質を発現させるための宿主細胞は、導入される蛋白質遺伝子に応じて適宜選択できることが好ましい。
【0033】
使用できる宿主細胞としては、大腸菌のほか、真核細胞としてはバキュロウイルス感染細胞、CHO細胞などの哺乳類細胞である。
【0034】
抗ラミニンガンマ1抗体の量を測定するには、不溶性担体である固相にラミニンガンマ1又はその断片を結合させ、これに検体中の抗ラミニンガンマ1抗体を接触させて、ラミニンガンマ1若しくはその断片と抗ラミニンガンマ1抗体の複合体を形成し、洗浄によって検体中の他の成分を除いた後、標識した抗ヒト免疫グロブリン抗体を反応させて、ラミニンガンマ1(又はその断片)−抗ラミニンガンマ1抗体−標識化抗ヒト免疫グロブリンの複合体を形成させ、その標識物の反応量を測定することによる。
【0035】
ラミニンガンマ1又はその断片を結合させる不溶性担体としては、アガロース系、セルロース系、ポリアクリルアミド系、ポリスチレン系、アクリル酸エステル系等の有機高分子、コラーゲン、キトサン等の生体由来の天然有機高分子あるいは活性炭素、セラミック等の無機物が挙げられる。その形態としては、平板状、粒子状等様々な形態が使用しうるが、表面積を大きくとれるものが好ましい。ラミニンガンマ1分子の固相への結合は、物理吸着によっても可能であるが、共有結合によって結合することもできる。例えば、担体がその表面に有するエポキシ基やアルデヒド基等の反応性官能基に水性溶液中で直接結合することによって実施される。また、アミノ基等の官能基を表面に有する担体を用いる場合は、ラミニンガンマ1蛋白質と担体との混合水性溶液にジアルデヒドやジエポキシ化合物等の反応性多官能基を有する化合物を添加し、反応させることによっても実施することができる。
【0036】
検出方法としては、ELISA法が好適に用いられるが、抗原としてラミニンガンマ1またはその一部を使用するものであれば、他の方法も同様に使用することができる。他の方法としては蛍光免疫測定法(FIA)、化学発光免疫測定法(CLIA)、ラテックス比濁法等が挙げられる。
【0037】
標識化した抗ヒト免疫グロブリンとしては、ウサギ、ヤギその他の動物にヒトの免疫グロブリン(IgG,好ましくはIgG4)を免疫して得た抗ヒトIgGあるいはその断片を用いることができる。標識物としては、例えばペルオキシダーゼ、β−D−ガラクトシダーゼ、ミエロペルオキシダーゼ、アルカリホスファターゼ、ビオチン等の各種酵素やアイソトープを標識して使用することができる。酵素を標識した場合には、適宜適切な基質を選択することにより、その発色、発光、蛍光を測定することによって、検体中の目的物を定量することができる。
【0038】
検体としては、ヒトの血液、血漿、血清が使用でき、日常検査としては血清が最も好適に使用できるが、尿その他の体液の使用を制限するものではない。
【0039】
本発明の実施の形態に係る測定方法によれば、患者血清中の抗ラミニンガンマ1抗体を高い感度で測定でき、自動化機器によって測定することも可能なため、日常検査として実施が可能となる他、標準血清を用いて定量的に測定することにより、結果が客観的な数値として捉えることができるため、測定者による判定の差をなくすことができる。また、患者血清中の抗体量の変化を捉えることができるため、治療効果の判定や疾患の憎悪期において治療のタイミングをより早く知ることができる。
【実施例】
【0040】
(1)患者検体の入手;本検討は、久留米大学医学部の倫理委員会のガイドラインに従って実施され、臨床試験への参加者はインフォームドコンセントを提出し、ヘルシンキ宣言に沿って行われた。32人の患者(男性10人、女性6名、16名は性別不明、17歳〜87歳)は、その臨床経過と水疱形成の兆候、1M食塩水剥離ヒト皮膚切片を用いた間接蛍光抗体法は基底膜領域の真皮側にIgGの反応性を示し、真皮抽出物を用いたウエスターンブロットは200kDaのバンドを示したことから、抗p200類天疱瘡と診断された。9名の健常ボランティア及び水疱性類天疱瘡、抗ラミニン332粘膜類天疱瘡及び後天性表皮水疱症の血清は、コントロールとして用いた。
【0041】
(2)抗体の調製
マウス抗ラミニンガンマ1モノクローナル抗体B−4は、サンタクルーズバイオテクノロジーから購入した。マウス抗ラミニンガンマ1モノクローナル抗体C135は、研究室において作製した((Nishiuchi R, et al.(2006)Ligand−binding specificities of laminin−binding integrins:A comprehensive survey of laminin−integrin interactions using recombinant alpha3beta1,alpha6beta4 integrins. Matrix Biology 25:189−197、Fujiwara H, et al.(2001) Purification and Characterization of human laminin−8. Laminin−8 stimulates cell adhesion and migration through alpha3beta1 and alpha6beta1 integrins. J Biol Chem 276:17550−17558)。マウス抗コラーゲンVIモノクローナル抗体3C4及びマウスのコントロールIgGは、それぞれケミコン、ミリポア及びサンタクルーズバイオテクノロジーから購入した。第二抗体であるHRP標識抗ヒトIgG(ウサギ)及びFITC標識抗マウスIgG(ウサギ)は、ダコから購入した。患者及び健常者コントロールからのIgGは、HiTrap Protein G HPカラム(アマシャム)を用いて精製した。
【0042】
(3)真皮及び血管抽出物の調製
免疫ブロット分析に用いる真皮抽出物は、既報の方法に従って調製した(Kawahara Y, et al.(2000)Subepidermal blistering disease with autoantibodies against a novel dermal 200−kDa antigen. Journal of Dermatological Science 23:93−102)。血管抽出物は、同様の方法に若干の変更を加えて調製した。外膜を除いた腸間膜動脈は、2mM EDTAと2mM PMSFを加えたPBS中で4℃2時間インキュベートした。血管の蛋白質は、8M Urea、0.3M β−メルカプトエタノール1mM PMSFを加えた25mM Tris(pH6.8)で室温2時間抽出した。血管抽出物は、4℃で2時間精製水に透析し、等量のアセトンで沈殿させた。
【0043】
(4)ラミニンの調製
ヒトのラミニン111は、JAR絨毛癌細胞株から、ラミニン211/221は、ヒト胎盤から精製した(Nishiuchi R, et al.(2006)Ligand−binding specificities of laminin−binding integrins:A comprehensive survey of laminin−integrin interactions using recombinant alpha3beta1,alpha6beta4 integrins. Matrix Biology 25:189−197)。リコンビナントラミニン111は、ヒトα1/β1/γ1チェーンをコードする発現ベクターで形質転換したヒト293F細胞(インビトロジェン)で産生した。α1、β1、γ1のC末部分を切断したヘテロトリマーであるラミニン111のリコンビナントE8分画は、以下のように調製した。
【0044】
ヒトラミニンβ1及びγ1のリコンビナントE8分画の発現ベクター(それぞれLeu1561−Leu1786及びAsn1364−Pro1609をコードする)は、既報の通り調製した(IDO H, et al.(2007) The requirement of the glutamic acid residue at the third position from the carboxy termini of hte laminin gamma chains in integrin binding by laminins. J Biol Chem 282:11144−11154)。ラミニンα1チェーンの切断されたC末部分(Phe1878−Gln2700)をコードするcDNAは、全長ヒトラミニンα1発現ベクターをテンプレートとして用いてPCRで増幅し(Ido H, Harada K, Yagi Y, Sekiguchi K(2006) Probing the integrin site within the globular domein of laminin−511 with the function−blocking monoclonal antibody4C7. Matrix Biology 25:112−117)、発現ベクターpSecTag2A(インビトロジェン)に挿入した。ラミニン111のリコンビナントE8分画は、Free−StyleTM293発現システム(インビトロジェン)を用いて産生し、既報の通り(IDO H, et al.(2007) The requirement of the glutamic acid residue at the third position from the carboxy termini of hte laminin gamma chains in integrin binding by laminins. J Biol Chem 282:11144−11154)調製培地から精製した。即ち、調製培地は、ニッケルニトリロ三酢酸アフィニティーカラム(キアゲン)に添加し、結合した蛋白質は、200mMのイミダゾールで溶出した。溶出した蛋白質は、更に抗FLAGカラム(シグマ・アルドリッチ)で精製した。精製した蛋白質は、TBSに透析した。蛋白濃度は、BCATM Protein Assay Kit(ピアースバイオテクノロジー)で定量した。
【0045】
(5)免疫ブロット法による分析
SDS/PAGEは、既報の通り実施した(Sugi T, Hashimoto T, Hibi T, Nishikawa T(1989) Production of human monoclonal anti−basement membrane zone(BMZ) antibodies from a patient with bullous pemphigoid(BP) by Epstein−Barr virus transformatiuon. Analysis of the heterogeneity of anti−BMZ antibodies in BP sera using them. J Clin Invest 84:1050−1055)。真皮及び血管の抽出物、ヒトラミニン、及びヒトラミニンE8分画は、Laemmli‘s sample buffer(5%βメルカプトエタノール有り/無し)で煮沸し、6%、7.5%、又は12%のSDSゲルで分画した。次いで蛋白質は、ニトロセルロースに電気化学的に転写した。3%スキムミルクでブロックした後、ブロットは、1:5〜1:800に希釈した患者血清、10μg/mL又は1mg/ml、若しくは1:200に希釈した抗ヒトラミニンガンマ1モノクローナル抗体B−4(マウス)でインキュベートした。二次抗体としては、HRP標識抗ヒトIgG又は抗マウスIg抗血清を用いた。発色は、4−クロロ−1−ナフトールを用いた。
【0046】
真皮抽出物の免疫沈降は、以下のように行った。凍結乾燥した真皮抽出物を50mM Tris、150mM NaCl、2mM EDTA、1% TritonX−100 Protein Inhibitor Miature(シグマ・アルドリッチ)を含む免疫沈降用バッファーに溶解した。この溶液をProteinG−Sepharose4 Fast Flow(GEヘルスケア)と正常コントロールあるいは患者血清(1:20)の有り、無しでインキュベートし、抗ラミニンガンマ1モノクローナル抗体B−4(5又は20μg/ml)あるいはマウスコントロールIgG(20μg/ml)で4℃一晩インキュベートした。十分洗浄した後、集められた沈降物は、5%βメルカプトエタノールを含むLaemmli‘s sample bufferで煮沸した。上清は、既報の通り免疫ブロット分析で評価した。
【0047】
阻害アッセイでは、患者#12の血清(1:800)を競合物、即ち正常ヒトIgG、B−4、C13S(2又は10μg/ml)若しくは3C4(1:100又は1:20希釈)と、転写した真皮抽出物の載ったニトロセルロースストリップ上でインキュベートし、上述の通り抗ヒトIgG抗血清で発色した。他のストリップ上では、B−4(1μg/ml)を競合物、即ち血清(1:100又は1:20希釈)若しくはIgG(0.2又は1mg/ml)4℃一晩インキュベートし、抗マウスIg抗血清で発色した。
【0048】
(6)二次元電気泳動による分析
凍結乾燥した真皮抽出物を7Mウレア、2Mチオウレア、40mMトリス、1%C7デタージェント及び適量のComplete Mini EDTE−free Protease inhibitor Mixture Tablets(ロッシュ アプライド サイセンス)を含む溶解バッファーに溶かした。還元及びアルカリ化のため最終濃度5mMトリブチルフォスファイン及び最終濃度10mMのアクリルアミドを添加した。室温で90分インキュベートした後、10mM(最終濃度)のDTTを添加し、反応を停止するため室温で10分間インキュベートした。Amicon Ultra−4 100K(アミコン)で遠心ろ過した後、濃縮液は、7M Urea、2M thiourea、1%C7からなる等電点用バッファーと混合した。等電点電気泳動のためにReadyStripTM IPTG Strip
(pH4−7、11cm long、3.3mm wide厚さ0.5mm バイオラッドラボラトリーズ)を適当量のBio−Lyte3−8バッファー(バイオラッドラボラトリーズ)及びOrange G solutionを含むサンプル溶液で一晩水に戻した。
【0049】
等電点電気泳動終了の後、Precision Plus Protein Standard(バイオラッドラボラトリーズ)を含むCriterionTM Ready Gels J(4% T stracking gel、7.5% T resolving jel、Tris−HCl buffer type、13.3cm wide、8.7cm high、 and 1.0mm thickバイオラッドラボラトリーズ)を用いてSDS/PAGEを実施した。得られた二次元ゲルは、クマーシー・ブリリアントブルーで染色するか又は免疫ブロットに用いられた。
【0050】
(7)ゲル内消化
蛋白質のスポットは、切り取って50%セトニトリル/100mM炭酸アンモニウムpH8.0で脱色した。切り出したゲルをドライヤーで15分間乾燥した後、トリプシンプロテオミクスグレードソリューション(9%アセトリトリル中、0.1mM HCl/36mM炭酸アンモニウム0.2mg/ml)を添加し、2.5mM炭酸アンモニウムを含む9%アセトニトリルで37℃、一晩インキュベートした。インキュベートした液は、集めて乾燥した。
【0051】
(8)質量分析
乾燥させたトリプシン分解ペプチドは、2−5μlの0.1%TFA/50%アセトニトリルに溶解し、α−シアノ−4−ヒドロキシ桂皮酸(CHCA)溶液と混合し、AXIMA−CFR Plus(島津製作所)MALDI−TOF−MSで分析した。トリプシン分解ペプチドのモノアイソトピックm/Z値のピークは、蛋白質データベースサーチと蛋白質の同定のためにMascot Search(マトリックスサイエンス)のPeptide Mass Fingerprintで分析した。
【0052】
(9)1M食塩水剥離皮膚の免疫蛍光法
正常ヒト皮膚を48時間4℃で1mM PMSFを含む1M食塩水に浸した。皮膚サンプルは、液体窒素ですばやく凍結し、クリオスタットで薄切して患者血清(1:10希釈)、精製した患者IgG(0.08mg/ml)及びマウス抗ラミニンガンマ1モノクローナル抗体を一次抗体として反応させ、次いでFITC標識したウサギ抗ヒトIgG又は、抗マウスIgポリクローナル抗体を二次抗体として染色した。
【0053】
(10)二次元電気泳動の分析結果
真皮抽出物は、pI7と4の間の等電点電気泳動と、7.5%SDSゲル電気泳動の二次元電気泳動で分離した。抽出物は、2枚のゲルで実施し、1枚はクマーシーブルーで染め(図1A)、もう1枚はニトロセルロース膜に転写して抗p200天疱瘡患者の血清で免疫ブロットを行った(図1B)。血清は、pI5.0付近、120−125kDaの範囲で複数のバンドを検出し、最も反応性の強かったバンドは、250kDaに存在した。クマーシーで染色したゲルの同じバンドが、質量分析器で分析された(図1D)。データベースの検索の結果、このバンドは名目上の分子量184,595、計算上の等電点5.01、配列の28%をカバーするラミニンガンマ1であることが分かった(図1E)。
【0054】
特定のバンドとの同一性を確認するため、二次元電気泳動で分離した真皮抽出物を転写した膜上で抗ラミニンガンマ1モノクローナル抗体を用いた免疫ブロットを実施した。患者血清とモノクローナル抗体は、同じバンドに反応した(図1C)。更に3人の患者の血清も同じバンドを染色した。
【0055】
抗ラミニンガンマ1モノクローナル抗体は、免疫沈降法で抗p200類天疱瘡患者血清と真皮抽出物の形成した沈降物に反応したが、健常者血清の沈降物とは反応しなかった(図2A)。真皮抽出物と患者血清の免疫沈降上清は、抗ラミニンガンマ1モノクローナル抗体を用いた免疫ブロットを行い、如何なるバンドも検出できなかった。このことは、すべてのラミニンガンマ1は、患者血清によって吸収されたことを示唆している。逆に、免疫ブロットにおいて、抗ラミニンガンマ1モノクローナル抗体との免疫沈降物は、投与量依存的に患者血清と反応した(図2B)。抗ラミニンガンマ1免疫沈降の上清は、沈降に用いられた抗ラミニンガンマ1抗体の量に反比例して抗p200類天疱瘡血清と反応性を示した。抗p200類天疱瘡血清を用いた免疫ブロットの結果は、ラミニンのガンマ1チェーンがp200のバンドの真皮構成物であることを示唆している。
【0056】
(11)ラミニンガンマ1と患者血清の反応性
患者血清とラミニンガンマ1の反応性が、抗p200類天疱瘡の患者に共通するかどうかを調べるため、20人の患者の血清について、精製したラミニン111及びラミニン211/221(どちらもラミニンガンマ1チェーンを含む)に対する反応性を調査した。20の血清すべてが、真皮抽出物を用いた免疫ブロットで200kDaの蛋白質に反応し、バンドの位置は抗ラミニンガンマ1モノクローナル抗体の位置と一致した(図3A)。このことから、抗p200類天疱瘡の自己抗原がラミニンガンマ1であることを支持している。この可能性と一致するように、80%及び85%の患者血清が、それぞれ精製したラミニン111及びラミニン211/221のガンマ1チェーンと反応した(図3B,C及び表1)。合計32の患者の血清が同程度の反応性を示した。これらの結果は、更にリコンビナントラミニン111を用いた免疫ブロットによって確認された。そこでは、90%の患者血清がリコンビナントラミニンガンマ1に明確な反応性を示した(図3D及び表1)。重要なことは、健常者9名の血清は精製した/またはリコンビナントのラミニンガンマ1に対してまったく反応しなかったことである。他の水疱性疾患(例えば水疱性類天疱瘡、抗ラミニン332粘膜天疱瘡及び表皮水疱症のような)の患者血清はラミニンガンマ1に対する反応性を示さなかった。これらの結果は、若干の陰性例があるにもかかわらず、ラミニンガンマ1が抗p200類天疱瘡の唯一の自己抗原であることを示唆している。
【0057】
(12)ラミニンガンマ1上の原因エピトープ
免疫ブロットによって、患者血清の、上皮抽出物から得たp200への反応性は、抗ラミニンガンマ1C末モノクローナル抗体の添加によって競合的に阻害された(レーンB−4)が、抗ラミニンガンマ1N末モノクローナル抗体(レーンC−13S)あるいは抗コラーゲンVIモノクローナル抗体(レーン3C4)の添加によっては阻害されなかった(図4A)。抗p200類天疱瘡患者から得た血清と精製IgGは、上皮ラミニンガンマ1に対するモノクローナル抗体B−4の反応性を投与量依存的に阻害した。しかし、健常者血清又はIgGは阻害しなかった(図4B)。これらの結果は、間接的に上皮p200蛋白質上の患者血清に対する反応部位が、ラミニンガンマ1のC末にあることを示している。ラミニンガンマ1上の原因エピトープの位置をさらに限定するため、二重コイルドメインのC末の25%を占め、3つのラミニンG様モジュールからなるラミニン111の切断部分であるヒトラミニン111のE8分画(即ちLG1−3)をリコンビナントで作製した(図5A)。このリコンビナント蛋白を用いた免疫ブロット分析により、ほとんどのラミニンガンマ1陽性血清は、還元/非還元状態においてラミニンガンマ1E8分画に反応することが分かった(図5B)。患者20名の血清を用いた免疫ブロットの分析結果を図7に示す。これらの結果は、患者の自己抗体の標的である想定されるエピトープはラミニンガンマ1のC末246アミノ酸の中に存在することを示唆している。
【0058】
(13)自己抗体の臓器特異性
1M食塩水剥離ヒト皮膚切片を用いた蛍光抗体間接法により、抗p200類天疱瘡患者から得た精製IgGは、剥離片の真皮側に反応した(図6A、B)。特定の症例から得たIgGも、真皮乳頭層毛細血管の血管壁と反応した(図6B)。しかし、他の患者のIgGは、目に見えるほどの血管壁との反応性は示さなかった(図6A)。このことは、以前に報告された結果と一致している(Zillikens D, et al.(1996) A novel subepidermal blistering disease with autoantibodies to a 200−kDa antigen of the basement membrane zone.
J Invest Dermatol
106:1333−1338、Kawahara Y, et al.(2000)Subepidermal blistering disease with autoantibodies against a novel dermal 200−kDa antigen. Journal of Dermatological Science 23:93−102)。対照的に、抗ラミニンガンマ1モノクローナル抗体C13Sは、剥離皮膚の真皮側と血管壁の両方に反応した(図6C)。
【0059】
還元状態及び非還元状態での免疫ブロット法での検討により、真皮及び血管の抽出物の添加量は、抗ラミニンガンマ1モノクローナル抗体B−4の反応性により調節された(図6D下)。同じ免疫ブロットにより真皮ラミニンガンマ1に対する患者#20からの精製IgGの反応性は、血管ラミニンガンマ1に対する反応性よりはるかに高かった(図6D上)。この結果は、幾人かの患者の血清を用いて再現されている。しかし、患者#12から得た精製IgG(間接蛍光抗体法により真皮及び血管の両方の基底膜領域に反応した)は、真皮及び血管から抽出したラミニンガンマ1に同等の反応性を示した(図6D中)。この症例を除き、これらの結果は、抗p200類天疱瘡患者の循環血IgG抗体は真皮基底膜領域中のラミニンガンマ1に反応し、血管壁ラミニンに対してはずっと弱い反応性を示すことを示唆した。
【技術分野】
【0001】
本発明は、抗ラミニンガンマ1抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法。に関する。
【背景技術】
【0002】
皮膚は光線や微生物、細菌などの外部からの刺激や、打撲、圧迫、酸・アルカリなどの化学物質による傷害を防ぐ役割(対外保護作用)を担っている。自己免疫性水疱性皮膚疾患は、皮膚を構成する細胞間接着分子に対する自己抗体が産生され、これにより細胞間の接着が失われることによって皮膚の体外保護作用が失われ、時として死に至る重篤な疾患である。
【0003】
自己免疫性水疱性疾患は、抗表皮細胞膜抗体による天疱瘡群と抗表皮基底膜部抗体による類天疱瘡群に大別され、前者では表皮細胞間接着の障害を、後者では表皮真皮間接着の障害を生じる。
【0004】
自己免疫疾患は、患者の体液中に自己抗原に対する抗体が見出されることを特徴とするが、自己免疫疾患の中でも、全身性エリテマトーデスやシェーグレン症候群などの膠原病では、自己抗体の産生が疾患の原因であるのか結果であるのかは明らかでない。しかし、天疱瘡や水疱性類天疱瘡など多くの自己免疫性水疱性皮膚疾患では、患者血清中に存在する自己抗体が疾患の原因であることが明らかにされており、従って自己抗体の検出が疾患の診断に必須で有り、その対応抗原の同定が治療法の開発に繋がると考えられている。
【0005】
現在、いくつかの自己免疫性水疱性疾患において対応抗原が明らかになっている。例えば、落葉上天疱瘡や尋常性天疱瘡では表皮細胞間接着因子であるデスモグレイン1やデスモグレイン3が病因抗体の対応抗原であり、水疱性類天疱瘡では表皮基底膜間接着因子であるBP180が対応抗原であることが明らかにされている。また、これらの情報から、リコンビナントタンパク質を用いたELISA法がその診断の用に供されている(特許文献1、および非特許文献1、2参照)。
【0006】
しかし、自己免疫性水疱性皮膚疾患には未だその自己抗原が明らかでない疾患が存在し、抗p200類天疱瘡もその一つである。抗p200類天疱瘡は、1996年に本願の一部の発明者らによって発見された疾患であり、緊満性水疱が多発し、約半数に乾癬を合併する。免疫ブロット法では、患者血清が皮膚抽出物中の200kDaの分子と反応するため、抗p200類天疱瘡と呼ばれる(非特許文献3参照)。
【0007】
抗p200類天疱瘡は、その症例の希少さと、タンパク発現量の少なさから、その分子の同定が困難であった。しかし、本願の発明者らは、自己抗原であるp200を同定するため鋭意努力し、ヒト正常皮膚抽出物を用いて二次元電気泳動を行い、免疫ブロット法により、患者血清によって特異的に染色される分画を得た。そこで、質量分析機を用いてこの分画の分析を行い、データベース上に登録された情報からこの分画が細胞外マトリックスの構成成分ラミニン1のサブユニットであるラミニンガンマ1であることを明らかにし、2009年に発表した(非特許文献4参照)。
【0008】
さらに本願発明者らは、リコンビナントラミニンガンマ1を抗原とし、患者血清を用いた免疫ブロット法により、抗p200類天疱瘡の患者の90%がラミニンガンマ1に反応すること、一方健常者及び他の自己免疫性水疱性疾患の患者血清はラミニンガンマ1に反応しないことから、ラミニンガンマ1に対する免疫学的測定法が抗p200類天疱瘡の診断に有用であることを証明した(非特許文献4参照)。
【0009】
ラミニンは、基底膜内に最も豊富に存在する糖タンパク質で、ニドゲン、IV型コラーゲンなどの基底膜のその他の成分と複合体を形成している。また、ラミニンは、3本のポリペプチドがcoiled−coilドメインを介して十字架様に会合した構造をとり、多くのアイソフォームの存在が確認されている。即ち、ラミニンは、それを構成する3つのポリペプチドであるα鎖(400kDa以下)、β鎖(200kDa以下)及びγ鎖(200kDa以下)の組み合わせによって様々なアイソフォームを形成することが可能であり、α鎖には5種類、β鎖とγ鎖には3種類ずつの異なるタイプがあることから、現在までに少なくとも12個のアイソフォームの存在が報告されている(非特許文献5および6参照)。
【0010】
たとえば、ラミニン−1(α1、β1、γ1)は、腎臓、胎児脳、網膜、血管等に存在し、メロシン(=ラミニン−2;α2、β1、γ1)は、骨格筋、心臓、胎盤に存在し、s−ラミニン(=ラミニン−3;α1、β2、γ1)は、神経筋末端プレートの接合部の基底膜、血管内皮及び子宮体基底膜に存在し、s−メロシン(=ラミニン−4;α2、β2、γ1)は、Schwann細胞、胎盤などに存在し、カリニン/ナイセイン(=ラミニン−5;α3、β3、γ2)とk−ラミニン(=ラミニン−6;α3、β1、γ1)とks−ラミニン(=ラミニン−7;α3、β2、γ1)は、皮膚の基底膜に特有なものであることが明らかとなっている。ラミニンガンマ1はラミニンを構成するγ鎖のひとつである。
【0011】
(従来の診断方法)
従来、抗p200類天疱瘡の診断は、蛍光抗体直接法で患者の表皮基底膜部にIgG、C3の沈着を認め1M食塩水で剥離した表皮を用いた間接法により真皮側に反応することの確認、及び、上記のように免疫ブロット法により患者血清が200kDaの蛋白質との反応を確認することによって行われていた。しかし、1M食塩水による剥離表皮切片や表皮抽出物の入手が、一般の病院では困難なこと、間接蛍光抗体法は定性的であり判定に熟練を要することなどから、ルーチンの検査として実施することは困難であった。
【0012】
このような状況からGrothらは、2011年に大腸菌で発現させたラミニンガンマ1を抗原とするELISA法を報告した(非特許文献7参照)。しかし、その陽性率は69%と、診断として用いるには不十分なものであった。また、尿中に存在する200kDaのラミニン分画に対する抗体の測定が、全身性エリテマトーデス(SLE)の診断に利用できる可能性が報告(特許文献2参照)されているが、抗p200類天疱瘡については言及されていない。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平8−188540号公報
【特許文献2】特開平8−036966号公報
【非特許文献1】岸本和裕ら、日皮会誌:112(6)、793−801(2002)
【非特許文献2】岸本和裕ら、日皮会誌:113(11)、1695−1710(2003)
【非特許文献3】Zillikens D, et al.(1996) A novel subepidermal blistering disease with autoantibodies to a 200−kDa antigen of the basement membrane zone.J Invest Dermatol 106:1333−1338
【非特許文献4】Dainichi T, et al.(2009) Anti−laminin gamma−1 pemphigoid.Proc Natl Acad Sci USA 106:2800−2805
【非特許文献5】Miner J et al.(1997) The laminin α Chains:Expression, Developmental Transitions, and Chromosomal Locations of α1−5、Identification of Heterotrimeric Laminins8−11, and Cloning of a Novel α3 Isoform.J Cell Biol 137:685−701
【非特許文献6】Hoch M et al(1999) Characterization and Expression of the Laminin γ3Chain:A novel, Non−Basement Membrane−associated, Laminin Chain.J Cell Biol 145:605−617
【非特許文献7】Groth S et al(2011) Development of a simple enzyme−linked immunosorbent assay for the detection of autoantibodies in anti−p200 pemphigoid.Br J Dermatol 164:76−82
【発明の概要】
【発明が解決しようとする課題】
【0014】
上述の技術では、抗p200類天疱瘡は、多くの場合水疱性類天疱瘡と区別されていなかったと考えられる。水疱性類天疱瘡の診断には現在、抗BP180抗体測定用ELISA及び抗BP230抗体測定用ELISAが開発され使われているが、抗p200類天疱瘡はこれらの試薬で診断することはできない。
【0015】
そこで、本発明の目的は、抗p200類天疱瘡に特異的で高い臨床的感度を有する抗p200抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法を提供することである。
【課題を解決するための手段】
【0016】
上記目的を達成するため、本発明の抗ラミニンガンマ1抗体の測定方法は、次の工程を有する。
(1)検体をラミニンガンマ1又はその断片と接触させる工程、
(2)ラミニンガンマ1又はその断片と検体中に存在するラミニンガンマ1を認識する抗体の結合を検出する工程、および
(3)両者の結合のレベルに基づいて検体中の抗ラミニンガンマ1抗体の量を決定する工程。
【0017】
ここで、ラミニンガンマ1の断片が、ラミニンガンマ1のC末の246アミノ酸以外のペプチド又はそのアミノ酸配列に1又は数個のアミノ酸の置換、欠失、挿入および付加の中から選ばれる少なくとも1つの変異を有するペプチドを含むペプチドであることとすることができる。
【0018】
また、ラミニンガンマ1またはその断片が、固相に固定化されたラミニンガンマ1またはその断片であることとすることができる。
【0019】
また、検体が、血液、血漿又は血清であることとすることができる。
【0020】
また、上記目的を達成するため、本発明のキット(抗p200抗体の測定試薬)は、構成試薬がラミニンガンマ1又はその断片を含み、検体中の抗ラミニンガンマ1抗体の抗体量を測定する方法に用いられる。
【0021】
ここで、ラミニンガンマ1又はその断片が、固相に固定化された固相化ラミニンガンマ1又はその断片であることとすることができる。
【0022】
また、上記目的を達成するため、本発明の皮膚科疾患を検出する方法は、上述のキットにより測定した検体中の抗ラミニンガンマ1抗体の測定値から皮膚科疾患を検出する。
【0023】
ここで、皮膚科疾患が、抗p200類天疱瘡であることとすることができる。
【発明の効果】
【0024】
本発明では、抗p200類天疱瘡に特異的で高い臨床的感度を有する抗p200抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法を提供することができる。
【図面の簡単な説明】
【0025】
【図1】真皮抽出物を用いた二次元電気泳動の結果を示す図である。ここで、(A)は、真皮抽出物のプロテオームパターンであり、7.5%SDSゲル上で、クマーシーブリリアントブルーで染色したものである。また、(B)は、患者血清を用いた免疫ブロットであり、分子量約250kDa、等電点5.0の特定のバンドが染色されたことを示している。また、(C)は、抗ラミニンガンマ1モノクローナル抗体B−4を用いた免疫ブロットであり、(B)におけるバンドと同じバンドが染色されたことを示している。また、(D)は、ゲル上の特定の蛋白質バンドのMALDI−TOF−MSのスペクトルである(m/z値は700から3,000)。また、(E)は、ラミニンガンマ1に該当する特定のトリプシン分解ペプチドのピークを標識するm/z値であり、太字かつ下線付き文字で示したものは、データベースサーチでラミニンガンマ1と一致したトリプシン分解ペプチドであり、これらの配列は、全体の28%をカバーしている。
【図2】真皮抽出物の免疫沈降物を免疫ブロット分析した図である。ここで、(A)は、真皮抽出物を、健常者血清無し(レーン1)、健常者血清有り(レーン2)、抗p200類天疱瘡患者血清(1:20希釈、レーン3)、で免疫沈降したもの、各上清を、コントロール血清(レーン4)、あるいは患者血清(レーン5)で同様に実施したものを示している。また、マウス抗ラミニンガンマ1モノクローナル抗体B−4を用いた免疫ブロットでは、レーン3及びレーン4において未処理の真皮抽出物から得たラミニンガンマ1(レーン6)と同じバンドを検出した。また、(B)は、真皮抽出物は20μg/mlのマウスコントロールIgG(レーン1)、モノクローナル抗体B−4(5μg/ml、レーン2及び20μg/ml、レーン3)及び患者血清(1:20希釈、レーン4)と免疫沈降し、患者血清で免疫ブロットを行った図である。各上清も同様に検討した(レーン5−8)。患者血清は抗ラミニンガンマ1モノクローナル抗体による免疫沈降物と投与量依存的に反応した(レーン2,3及びレーン6,7)。
【図3】20人の抗p200類天疱瘡患者(二重線)抗ラミニンガンマ1モノクローナル抗体B−4(矢印)及び健常者9名の血清(単線)を用いた免疫ブロットの結果を示す図である。(A)は、すべての患者血清は真皮抽出物中の200kDaの蛋白質と反応したのに対し、健常者コントロール血清はいずれも反応しなかった事を示しており、それぞれのバンドは抗ラミニンガンマ1モノクローナル抗体のバンドと一致した。(B)は、ほとんどの患者血清が、JARヒト絨毛癌細胞株から精製したラミニン111と反応したことを示し、(C)は、ほとんどの患者血清が、ヒト胎盤から精製したラミニン211/221と反応したことを示し、(D)は、ほとんどの患者血清が、ラミニン111のリコンビナント産物のラミニンガンマ1と反応したことを示している。なお、健常者コントロール血清は、ラミニンガンマ1と反応しなかった。短い矢印は、p200のバンドを示し、矢頭はラミニンガンマ1を示す(6%SDS)。
【図4】抗p200類天疱瘡患者血清のラミニンガンマ1C末部分に対する反応性を示す図である。(A)は、真皮抽出物を用いた免疫ブロット法(7.5%SDS)において、患者血清のp200(黒矢印)に対する反応性は、抗ラミニンガンマ1モノクローナル抗体B−4を加えたときに(B−4、2及び10μg/ml)、この蛋白質のC末を認識して投与量依存的に減少したことを示している。また、(A)は、正常ヒトIgG、抗ラミニンガンマ1N末モノクローナル抗体(C13S)あるいは抗コラーゲンVIモノクローナル抗体(3C4、腹水)は、真皮抽出物から得たp200と患者血清の結合を阻害しなかったことを示している。なお、各示された量のIgG(μg/ml)、腹水、血清(μl)の有り、無しを、反応中セルロース膜に添加した。(B)は、抗p200類天疱瘡患者から得た血清又は精製IgGは抗ラミニンガンマ1モノクローナル抗体B−4の真皮から抽出したラミニンガンマ1抽出物への結合を減少させた(白矢印)が、健常者からの血清又はIgGは減少させなかったことを示している。
【図5】ラミニン111のE8分画を用いた免疫ブロットである(12%SDS)。(A)は、ラミニン111のリコンビナントC末E8分画の構造計画を示している。(B)の上段は、図2の患者18(左の18番目のレーン)を除くすべてのラミニンガンマ1陽性血清は、還元状態において、免疫ブロットでE8分画に陽性の反応を示したことを示している。(B)の下段は、図2の患者16と18(左の16番目及び18番目のレーン)を除くすべてのラミニンガンマ1陽性血清は、非還元状態で、ラミニンガンマ1のE8分画に陽性反応を示したことを示している。二重線は、抗p200類天疱瘡の20名の患者の血清を示している。矢印は、抗ラミニンガンマ1モノクローナル抗体B−4を示す。1本線は、9人の健常人コントロール血清を示す。矢頭は、E8のバンドを示す。NSは、非特異バンドを示す。
【図6】(A),(B)および(C)は、1M食塩水剥離皮膚を用いた間接蛍光抗体法の結果を示す図である。(A)は、抗p200類天疱瘡の患者から得た精製IgGは、剥離皮膚の真皮側に反応したことを示しており、症例#200の患者から得たIgGは真皮上層で血管に反応しなかった。一方(B)は、症例#12から得たIgGは反応したことを示している。(C)は、抗ラミニンガンマ1モノクローナル抗体C13Sは、基底膜領域の真皮側及び真皮の血管壁の両方に反応したことを示している。(D)は、真皮及び血管壁の抽出物を用いた免疫ブロットの結果を示す図である。なお、添加した抽出物の量は抗ラミニンガンマ1モノクローナル抗体B−4(一番下)との反応性で調節した。還元状態では#20の症例の患者の精製IgG(図6Aでも使用)の上皮ラミニンガンマ1に対する反応性は、血管のラミニンガンマ1に対する反応性よりもずっと高かった(上段)。#12の患者の精製IgG(図6Bでも使用)は、真皮抽出物のラミニンガンマ1と血管抽出物のラミニンガンマ1に同じような反応性を示した(中段)レーン1;JAR細胞株から得た精製ラミニン111レーン2;真皮抽出物レーン3;血管抽出物(7.5%SDS、還元状態)
【図7】患者20名の血清を用いた免疫ブロットの分析結果を示す図である。
【発明を実施するための形態】
【0026】
本発明者らの研究により、抗p200類天疱瘡の患者血清中に見出される自己抗体が認識するp200タンパク質は、ラミニンの構成成分であるラミニンガンマ1であり、そのエピトープのラミニンガンマ1のC末にあることを明らかにした。さらに、本発明者らは、患者血清中の抗ラミニンガンマ1抗体の反応性を検討したところ、皮膚のラミニンガンマ1に対して強く反応し、血管のラミニンガンマ1に対しては一部の患者血清しか反応しないことを見出した。
【0027】
本発明は、上記のような知見に基づいてなされたものであり、従来の抗ラミニンガンマ1抗体の測定法に比べてより高い臨床的感度と特異性を持った、自動機にも対応可能な抗ラミニンガンマ1抗体の測定方法、測定試薬およびその試薬を用いた皮膚科疾患検出方法である。以下、本発明の実施の形態にについて、図面を参照しながら説明する。
【0028】
本発明の実施の形態はラミニンガンマ1に対する抗体を検出する方法及び試薬に関する。抗ラミニンガンマ1抗体は抗p200類天疱瘡患者の血清中に見出され、抗ラミニンガンマ1抗体の検出は抗p200類天疱瘡の診断に有用である。本発明の実施の形態の抗ラミニンガンマ1抗体の検出に用いられる抗原は、ヒトのラミニンガンマ1のC末部分、246アミノ酸以外の分画を含むことを特徴とする。
【0029】
本発明の実施の形態に係る抗ラミニンガンマ1抗体の測定方法は以下の測定方法が挙げられるが、これに限定されるものではない。
(1)検体をラミニンガンマ1のC末以外のペプチドを含む断片を固相化した不溶性担体に接触させる工程
(2)ラミニンガンマ1のC末以外の断片を含むペプチド断片と検体中に存在するラミニンガンマ1を認識する抗体の結合を検出する工程、および
(3)両者の結合のレベルに基づいて検体中の抗ラミニンガンマ1抗体の量を決定する工程。
【0030】
本発明の実施の形態には上記ラミニンガンマ1のC末以外のペプチド断片のアミノ酸配列を含むペプチド又は、そのアミノ酸に1又は数個のアミノ酸の置換、欠失、挿入および付加されたラミニンガンマ1C末以外の断片を用いる測定方法が含まれる。
【0031】
ラミニンガンマ1は、正常皮膚組織から抽出して用いることもできるが、リコンビナントタンパク質として作製することが出来る。特に、特定の分画を抗原として使用する場合、リコンビナントタンパク質として作製することが好ましい。
【0032】
一般的に、蛋白質の機能発現には特異的な修飾が必要とされることが多いことから、目的蛋白質を発現させるための宿主細胞は、導入される蛋白質遺伝子に応じて適宜選択できることが好ましい。
【0033】
使用できる宿主細胞としては、大腸菌のほか、真核細胞としてはバキュロウイルス感染細胞、CHO細胞などの哺乳類細胞である。
【0034】
抗ラミニンガンマ1抗体の量を測定するには、不溶性担体である固相にラミニンガンマ1又はその断片を結合させ、これに検体中の抗ラミニンガンマ1抗体を接触させて、ラミニンガンマ1若しくはその断片と抗ラミニンガンマ1抗体の複合体を形成し、洗浄によって検体中の他の成分を除いた後、標識した抗ヒト免疫グロブリン抗体を反応させて、ラミニンガンマ1(又はその断片)−抗ラミニンガンマ1抗体−標識化抗ヒト免疫グロブリンの複合体を形成させ、その標識物の反応量を測定することによる。
【0035】
ラミニンガンマ1又はその断片を結合させる不溶性担体としては、アガロース系、セルロース系、ポリアクリルアミド系、ポリスチレン系、アクリル酸エステル系等の有機高分子、コラーゲン、キトサン等の生体由来の天然有機高分子あるいは活性炭素、セラミック等の無機物が挙げられる。その形態としては、平板状、粒子状等様々な形態が使用しうるが、表面積を大きくとれるものが好ましい。ラミニンガンマ1分子の固相への結合は、物理吸着によっても可能であるが、共有結合によって結合することもできる。例えば、担体がその表面に有するエポキシ基やアルデヒド基等の反応性官能基に水性溶液中で直接結合することによって実施される。また、アミノ基等の官能基を表面に有する担体を用いる場合は、ラミニンガンマ1蛋白質と担体との混合水性溶液にジアルデヒドやジエポキシ化合物等の反応性多官能基を有する化合物を添加し、反応させることによっても実施することができる。
【0036】
検出方法としては、ELISA法が好適に用いられるが、抗原としてラミニンガンマ1またはその一部を使用するものであれば、他の方法も同様に使用することができる。他の方法としては蛍光免疫測定法(FIA)、化学発光免疫測定法(CLIA)、ラテックス比濁法等が挙げられる。
【0037】
標識化した抗ヒト免疫グロブリンとしては、ウサギ、ヤギその他の動物にヒトの免疫グロブリン(IgG,好ましくはIgG4)を免疫して得た抗ヒトIgGあるいはその断片を用いることができる。標識物としては、例えばペルオキシダーゼ、β−D−ガラクトシダーゼ、ミエロペルオキシダーゼ、アルカリホスファターゼ、ビオチン等の各種酵素やアイソトープを標識して使用することができる。酵素を標識した場合には、適宜適切な基質を選択することにより、その発色、発光、蛍光を測定することによって、検体中の目的物を定量することができる。
【0038】
検体としては、ヒトの血液、血漿、血清が使用でき、日常検査としては血清が最も好適に使用できるが、尿その他の体液の使用を制限するものではない。
【0039】
本発明の実施の形態に係る測定方法によれば、患者血清中の抗ラミニンガンマ1抗体を高い感度で測定でき、自動化機器によって測定することも可能なため、日常検査として実施が可能となる他、標準血清を用いて定量的に測定することにより、結果が客観的な数値として捉えることができるため、測定者による判定の差をなくすことができる。また、患者血清中の抗体量の変化を捉えることができるため、治療効果の判定や疾患の憎悪期において治療のタイミングをより早く知ることができる。
【実施例】
【0040】
(1)患者検体の入手;本検討は、久留米大学医学部の倫理委員会のガイドラインに従って実施され、臨床試験への参加者はインフォームドコンセントを提出し、ヘルシンキ宣言に沿って行われた。32人の患者(男性10人、女性6名、16名は性別不明、17歳〜87歳)は、その臨床経過と水疱形成の兆候、1M食塩水剥離ヒト皮膚切片を用いた間接蛍光抗体法は基底膜領域の真皮側にIgGの反応性を示し、真皮抽出物を用いたウエスターンブロットは200kDaのバンドを示したことから、抗p200類天疱瘡と診断された。9名の健常ボランティア及び水疱性類天疱瘡、抗ラミニン332粘膜類天疱瘡及び後天性表皮水疱症の血清は、コントロールとして用いた。
【0041】
(2)抗体の調製
マウス抗ラミニンガンマ1モノクローナル抗体B−4は、サンタクルーズバイオテクノロジーから購入した。マウス抗ラミニンガンマ1モノクローナル抗体C135は、研究室において作製した((Nishiuchi R, et al.(2006)Ligand−binding specificities of laminin−binding integrins:A comprehensive survey of laminin−integrin interactions using recombinant alpha3beta1,alpha6beta4 integrins. Matrix Biology 25:189−197、Fujiwara H, et al.(2001) Purification and Characterization of human laminin−8. Laminin−8 stimulates cell adhesion and migration through alpha3beta1 and alpha6beta1 integrins. J Biol Chem 276:17550−17558)。マウス抗コラーゲンVIモノクローナル抗体3C4及びマウスのコントロールIgGは、それぞれケミコン、ミリポア及びサンタクルーズバイオテクノロジーから購入した。第二抗体であるHRP標識抗ヒトIgG(ウサギ)及びFITC標識抗マウスIgG(ウサギ)は、ダコから購入した。患者及び健常者コントロールからのIgGは、HiTrap Protein G HPカラム(アマシャム)を用いて精製した。
【0042】
(3)真皮及び血管抽出物の調製
免疫ブロット分析に用いる真皮抽出物は、既報の方法に従って調製した(Kawahara Y, et al.(2000)Subepidermal blistering disease with autoantibodies against a novel dermal 200−kDa antigen. Journal of Dermatological Science 23:93−102)。血管抽出物は、同様の方法に若干の変更を加えて調製した。外膜を除いた腸間膜動脈は、2mM EDTAと2mM PMSFを加えたPBS中で4℃2時間インキュベートした。血管の蛋白質は、8M Urea、0.3M β−メルカプトエタノール1mM PMSFを加えた25mM Tris(pH6.8)で室温2時間抽出した。血管抽出物は、4℃で2時間精製水に透析し、等量のアセトンで沈殿させた。
【0043】
(4)ラミニンの調製
ヒトのラミニン111は、JAR絨毛癌細胞株から、ラミニン211/221は、ヒト胎盤から精製した(Nishiuchi R, et al.(2006)Ligand−binding specificities of laminin−binding integrins:A comprehensive survey of laminin−integrin interactions using recombinant alpha3beta1,alpha6beta4 integrins. Matrix Biology 25:189−197)。リコンビナントラミニン111は、ヒトα1/β1/γ1チェーンをコードする発現ベクターで形質転換したヒト293F細胞(インビトロジェン)で産生した。α1、β1、γ1のC末部分を切断したヘテロトリマーであるラミニン111のリコンビナントE8分画は、以下のように調製した。
【0044】
ヒトラミニンβ1及びγ1のリコンビナントE8分画の発現ベクター(それぞれLeu1561−Leu1786及びAsn1364−Pro1609をコードする)は、既報の通り調製した(IDO H, et al.(2007) The requirement of the glutamic acid residue at the third position from the carboxy termini of hte laminin gamma chains in integrin binding by laminins. J Biol Chem 282:11144−11154)。ラミニンα1チェーンの切断されたC末部分(Phe1878−Gln2700)をコードするcDNAは、全長ヒトラミニンα1発現ベクターをテンプレートとして用いてPCRで増幅し(Ido H, Harada K, Yagi Y, Sekiguchi K(2006) Probing the integrin site within the globular domein of laminin−511 with the function−blocking monoclonal antibody4C7. Matrix Biology 25:112−117)、発現ベクターpSecTag2A(インビトロジェン)に挿入した。ラミニン111のリコンビナントE8分画は、Free−StyleTM293発現システム(インビトロジェン)を用いて産生し、既報の通り(IDO H, et al.(2007) The requirement of the glutamic acid residue at the third position from the carboxy termini of hte laminin gamma chains in integrin binding by laminins. J Biol Chem 282:11144−11154)調製培地から精製した。即ち、調製培地は、ニッケルニトリロ三酢酸アフィニティーカラム(キアゲン)に添加し、結合した蛋白質は、200mMのイミダゾールで溶出した。溶出した蛋白質は、更に抗FLAGカラム(シグマ・アルドリッチ)で精製した。精製した蛋白質は、TBSに透析した。蛋白濃度は、BCATM Protein Assay Kit(ピアースバイオテクノロジー)で定量した。
【0045】
(5)免疫ブロット法による分析
SDS/PAGEは、既報の通り実施した(Sugi T, Hashimoto T, Hibi T, Nishikawa T(1989) Production of human monoclonal anti−basement membrane zone(BMZ) antibodies from a patient with bullous pemphigoid(BP) by Epstein−Barr virus transformatiuon. Analysis of the heterogeneity of anti−BMZ antibodies in BP sera using them. J Clin Invest 84:1050−1055)。真皮及び血管の抽出物、ヒトラミニン、及びヒトラミニンE8分画は、Laemmli‘s sample buffer(5%βメルカプトエタノール有り/無し)で煮沸し、6%、7.5%、又は12%のSDSゲルで分画した。次いで蛋白質は、ニトロセルロースに電気化学的に転写した。3%スキムミルクでブロックした後、ブロットは、1:5〜1:800に希釈した患者血清、10μg/mL又は1mg/ml、若しくは1:200に希釈した抗ヒトラミニンガンマ1モノクローナル抗体B−4(マウス)でインキュベートした。二次抗体としては、HRP標識抗ヒトIgG又は抗マウスIg抗血清を用いた。発色は、4−クロロ−1−ナフトールを用いた。
【0046】
真皮抽出物の免疫沈降は、以下のように行った。凍結乾燥した真皮抽出物を50mM Tris、150mM NaCl、2mM EDTA、1% TritonX−100 Protein Inhibitor Miature(シグマ・アルドリッチ)を含む免疫沈降用バッファーに溶解した。この溶液をProteinG−Sepharose4 Fast Flow(GEヘルスケア)と正常コントロールあるいは患者血清(1:20)の有り、無しでインキュベートし、抗ラミニンガンマ1モノクローナル抗体B−4(5又は20μg/ml)あるいはマウスコントロールIgG(20μg/ml)で4℃一晩インキュベートした。十分洗浄した後、集められた沈降物は、5%βメルカプトエタノールを含むLaemmli‘s sample bufferで煮沸した。上清は、既報の通り免疫ブロット分析で評価した。
【0047】
阻害アッセイでは、患者#12の血清(1:800)を競合物、即ち正常ヒトIgG、B−4、C13S(2又は10μg/ml)若しくは3C4(1:100又は1:20希釈)と、転写した真皮抽出物の載ったニトロセルロースストリップ上でインキュベートし、上述の通り抗ヒトIgG抗血清で発色した。他のストリップ上では、B−4(1μg/ml)を競合物、即ち血清(1:100又は1:20希釈)若しくはIgG(0.2又は1mg/ml)4℃一晩インキュベートし、抗マウスIg抗血清で発色した。
【0048】
(6)二次元電気泳動による分析
凍結乾燥した真皮抽出物を7Mウレア、2Mチオウレア、40mMトリス、1%C7デタージェント及び適量のComplete Mini EDTE−free Protease inhibitor Mixture Tablets(ロッシュ アプライド サイセンス)を含む溶解バッファーに溶かした。還元及びアルカリ化のため最終濃度5mMトリブチルフォスファイン及び最終濃度10mMのアクリルアミドを添加した。室温で90分インキュベートした後、10mM(最終濃度)のDTTを添加し、反応を停止するため室温で10分間インキュベートした。Amicon Ultra−4 100K(アミコン)で遠心ろ過した後、濃縮液は、7M Urea、2M thiourea、1%C7からなる等電点用バッファーと混合した。等電点電気泳動のためにReadyStripTM IPTG Strip
(pH4−7、11cm long、3.3mm wide厚さ0.5mm バイオラッドラボラトリーズ)を適当量のBio−Lyte3−8バッファー(バイオラッドラボラトリーズ)及びOrange G solutionを含むサンプル溶液で一晩水に戻した。
【0049】
等電点電気泳動終了の後、Precision Plus Protein Standard(バイオラッドラボラトリーズ)を含むCriterionTM Ready Gels J(4% T stracking gel、7.5% T resolving jel、Tris−HCl buffer type、13.3cm wide、8.7cm high、 and 1.0mm thickバイオラッドラボラトリーズ)を用いてSDS/PAGEを実施した。得られた二次元ゲルは、クマーシー・ブリリアントブルーで染色するか又は免疫ブロットに用いられた。
【0050】
(7)ゲル内消化
蛋白質のスポットは、切り取って50%セトニトリル/100mM炭酸アンモニウムpH8.0で脱色した。切り出したゲルをドライヤーで15分間乾燥した後、トリプシンプロテオミクスグレードソリューション(9%アセトリトリル中、0.1mM HCl/36mM炭酸アンモニウム0.2mg/ml)を添加し、2.5mM炭酸アンモニウムを含む9%アセトニトリルで37℃、一晩インキュベートした。インキュベートした液は、集めて乾燥した。
【0051】
(8)質量分析
乾燥させたトリプシン分解ペプチドは、2−5μlの0.1%TFA/50%アセトニトリルに溶解し、α−シアノ−4−ヒドロキシ桂皮酸(CHCA)溶液と混合し、AXIMA−CFR Plus(島津製作所)MALDI−TOF−MSで分析した。トリプシン分解ペプチドのモノアイソトピックm/Z値のピークは、蛋白質データベースサーチと蛋白質の同定のためにMascot Search(マトリックスサイエンス)のPeptide Mass Fingerprintで分析した。
【0052】
(9)1M食塩水剥離皮膚の免疫蛍光法
正常ヒト皮膚を48時間4℃で1mM PMSFを含む1M食塩水に浸した。皮膚サンプルは、液体窒素ですばやく凍結し、クリオスタットで薄切して患者血清(1:10希釈)、精製した患者IgG(0.08mg/ml)及びマウス抗ラミニンガンマ1モノクローナル抗体を一次抗体として反応させ、次いでFITC標識したウサギ抗ヒトIgG又は、抗マウスIgポリクローナル抗体を二次抗体として染色した。
【0053】
(10)二次元電気泳動の分析結果
真皮抽出物は、pI7と4の間の等電点電気泳動と、7.5%SDSゲル電気泳動の二次元電気泳動で分離した。抽出物は、2枚のゲルで実施し、1枚はクマーシーブルーで染め(図1A)、もう1枚はニトロセルロース膜に転写して抗p200天疱瘡患者の血清で免疫ブロットを行った(図1B)。血清は、pI5.0付近、120−125kDaの範囲で複数のバンドを検出し、最も反応性の強かったバンドは、250kDaに存在した。クマーシーで染色したゲルの同じバンドが、質量分析器で分析された(図1D)。データベースの検索の結果、このバンドは名目上の分子量184,595、計算上の等電点5.01、配列の28%をカバーするラミニンガンマ1であることが分かった(図1E)。
【0054】
特定のバンドとの同一性を確認するため、二次元電気泳動で分離した真皮抽出物を転写した膜上で抗ラミニンガンマ1モノクローナル抗体を用いた免疫ブロットを実施した。患者血清とモノクローナル抗体は、同じバンドに反応した(図1C)。更に3人の患者の血清も同じバンドを染色した。
【0055】
抗ラミニンガンマ1モノクローナル抗体は、免疫沈降法で抗p200類天疱瘡患者血清と真皮抽出物の形成した沈降物に反応したが、健常者血清の沈降物とは反応しなかった(図2A)。真皮抽出物と患者血清の免疫沈降上清は、抗ラミニンガンマ1モノクローナル抗体を用いた免疫ブロットを行い、如何なるバンドも検出できなかった。このことは、すべてのラミニンガンマ1は、患者血清によって吸収されたことを示唆している。逆に、免疫ブロットにおいて、抗ラミニンガンマ1モノクローナル抗体との免疫沈降物は、投与量依存的に患者血清と反応した(図2B)。抗ラミニンガンマ1免疫沈降の上清は、沈降に用いられた抗ラミニンガンマ1抗体の量に反比例して抗p200類天疱瘡血清と反応性を示した。抗p200類天疱瘡血清を用いた免疫ブロットの結果は、ラミニンのガンマ1チェーンがp200のバンドの真皮構成物であることを示唆している。
【0056】
(11)ラミニンガンマ1と患者血清の反応性
患者血清とラミニンガンマ1の反応性が、抗p200類天疱瘡の患者に共通するかどうかを調べるため、20人の患者の血清について、精製したラミニン111及びラミニン211/221(どちらもラミニンガンマ1チェーンを含む)に対する反応性を調査した。20の血清すべてが、真皮抽出物を用いた免疫ブロットで200kDaの蛋白質に反応し、バンドの位置は抗ラミニンガンマ1モノクローナル抗体の位置と一致した(図3A)。このことから、抗p200類天疱瘡の自己抗原がラミニンガンマ1であることを支持している。この可能性と一致するように、80%及び85%の患者血清が、それぞれ精製したラミニン111及びラミニン211/221のガンマ1チェーンと反応した(図3B,C及び表1)。合計32の患者の血清が同程度の反応性を示した。これらの結果は、更にリコンビナントラミニン111を用いた免疫ブロットによって確認された。そこでは、90%の患者血清がリコンビナントラミニンガンマ1に明確な反応性を示した(図3D及び表1)。重要なことは、健常者9名の血清は精製した/またはリコンビナントのラミニンガンマ1に対してまったく反応しなかったことである。他の水疱性疾患(例えば水疱性類天疱瘡、抗ラミニン332粘膜天疱瘡及び表皮水疱症のような)の患者血清はラミニンガンマ1に対する反応性を示さなかった。これらの結果は、若干の陰性例があるにもかかわらず、ラミニンガンマ1が抗p200類天疱瘡の唯一の自己抗原であることを示唆している。
【0057】
(12)ラミニンガンマ1上の原因エピトープ
免疫ブロットによって、患者血清の、上皮抽出物から得たp200への反応性は、抗ラミニンガンマ1C末モノクローナル抗体の添加によって競合的に阻害された(レーンB−4)が、抗ラミニンガンマ1N末モノクローナル抗体(レーンC−13S)あるいは抗コラーゲンVIモノクローナル抗体(レーン3C4)の添加によっては阻害されなかった(図4A)。抗p200類天疱瘡患者から得た血清と精製IgGは、上皮ラミニンガンマ1に対するモノクローナル抗体B−4の反応性を投与量依存的に阻害した。しかし、健常者血清又はIgGは阻害しなかった(図4B)。これらの結果は、間接的に上皮p200蛋白質上の患者血清に対する反応部位が、ラミニンガンマ1のC末にあることを示している。ラミニンガンマ1上の原因エピトープの位置をさらに限定するため、二重コイルドメインのC末の25%を占め、3つのラミニンG様モジュールからなるラミニン111の切断部分であるヒトラミニン111のE8分画(即ちLG1−3)をリコンビナントで作製した(図5A)。このリコンビナント蛋白を用いた免疫ブロット分析により、ほとんどのラミニンガンマ1陽性血清は、還元/非還元状態においてラミニンガンマ1E8分画に反応することが分かった(図5B)。患者20名の血清を用いた免疫ブロットの分析結果を図7に示す。これらの結果は、患者の自己抗体の標的である想定されるエピトープはラミニンガンマ1のC末246アミノ酸の中に存在することを示唆している。
【0058】
(13)自己抗体の臓器特異性
1M食塩水剥離ヒト皮膚切片を用いた蛍光抗体間接法により、抗p200類天疱瘡患者から得た精製IgGは、剥離片の真皮側に反応した(図6A、B)。特定の症例から得たIgGも、真皮乳頭層毛細血管の血管壁と反応した(図6B)。しかし、他の患者のIgGは、目に見えるほどの血管壁との反応性は示さなかった(図6A)。このことは、以前に報告された結果と一致している(Zillikens D, et al.(1996) A novel subepidermal blistering disease with autoantibodies to a 200−kDa antigen of the basement membrane zone.
J Invest Dermatol
106:1333−1338、Kawahara Y, et al.(2000)Subepidermal blistering disease with autoantibodies against a novel dermal 200−kDa antigen. Journal of Dermatological Science 23:93−102)。対照的に、抗ラミニンガンマ1モノクローナル抗体C13Sは、剥離皮膚の真皮側と血管壁の両方に反応した(図6C)。
【0059】
還元状態及び非還元状態での免疫ブロット法での検討により、真皮及び血管の抽出物の添加量は、抗ラミニンガンマ1モノクローナル抗体B−4の反応性により調節された(図6D下)。同じ免疫ブロットにより真皮ラミニンガンマ1に対する患者#20からの精製IgGの反応性は、血管ラミニンガンマ1に対する反応性よりはるかに高かった(図6D上)。この結果は、幾人かの患者の血清を用いて再現されている。しかし、患者#12から得た精製IgG(間接蛍光抗体法により真皮及び血管の両方の基底膜領域に反応した)は、真皮及び血管から抽出したラミニンガンマ1に同等の反応性を示した(図6D中)。この症例を除き、これらの結果は、抗p200類天疱瘡患者の循環血IgG抗体は真皮基底膜領域中のラミニンガンマ1に反応し、血管壁ラミニンに対してはずっと弱い反応性を示すことを示唆した。
【特許請求の範囲】
【請求項1】
次の工程を有する、抗ラミニンガンマ1抗体の測定方法:
(1)検体をラミニンガンマ1又はその断片と接触させる工程、
(2)ラミニンガンマ1又はその断片と検体中に存在するラミニンガンマ1を認識する抗体の結合を検出する工程、および
(3)両者の結合のレベルに基づいて検体中の抗ラミニンガンマ1抗体の量を決定する工程。
【請求項2】
前記ラミニンガンマ1の断片が、前記ラミニンガンマ1のC末の246アミノ酸以外のペプチド又はそのアミノ酸配列に1又は数個のアミノ酸の置換、欠失、挿入および付加の中から選ばれる少なくとも1つの変異を有するペプチドを含む請求項1記載の測定方法。
【請求項3】
前記ラミニンガンマ1またはその断片が、固相に固定化されたラミニンガンマ1またはその断片である請求項1記載の測定方法。
【請求項4】
前記検体が、血液、血漿又は血清である、請求項1から4のいずれか1項に記載の測定方法。
【請求項5】
構成試薬がラミニンガンマ1又はその断片を含み、検体中の抗ラミニンガンマ1抗体の抗体量を測定する方法に用いられるキット。
【請求項6】
ラミニンガンマ1又はその断片が、固相に固定化された固相化ラミニンガンマ1又はその断片である請求項5記載のキット。
【請求項7】
請求項6に記載のキットにより測定した検体中の抗ラミニンガンマ1抗体の測定値から皮膚科疾患を検出する方法。
【請求項8】
皮膚科疾患が、抗p200類天疱瘡である請求項7記載の方法。
【請求項1】
次の工程を有する、抗ラミニンガンマ1抗体の測定方法:
(1)検体をラミニンガンマ1又はその断片と接触させる工程、
(2)ラミニンガンマ1又はその断片と検体中に存在するラミニンガンマ1を認識する抗体の結合を検出する工程、および
(3)両者の結合のレベルに基づいて検体中の抗ラミニンガンマ1抗体の量を決定する工程。
【請求項2】
前記ラミニンガンマ1の断片が、前記ラミニンガンマ1のC末の246アミノ酸以外のペプチド又はそのアミノ酸配列に1又は数個のアミノ酸の置換、欠失、挿入および付加の中から選ばれる少なくとも1つの変異を有するペプチドを含む請求項1記載の測定方法。
【請求項3】
前記ラミニンガンマ1またはその断片が、固相に固定化されたラミニンガンマ1またはその断片である請求項1記載の測定方法。
【請求項4】
前記検体が、血液、血漿又は血清である、請求項1から4のいずれか1項に記載の測定方法。
【請求項5】
構成試薬がラミニンガンマ1又はその断片を含み、検体中の抗ラミニンガンマ1抗体の抗体量を測定する方法に用いられるキット。
【請求項6】
ラミニンガンマ1又はその断片が、固相に固定化された固相化ラミニンガンマ1又はその断片である請求項5記載のキット。
【請求項7】
請求項6に記載のキットにより測定した検体中の抗ラミニンガンマ1抗体の測定値から皮膚科疾患を検出する方法。
【請求項8】
皮膚科疾患が、抗p200類天疱瘡である請求項7記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−233804(P2012−233804A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2011−103074(P2011−103074)
【出願日】平成23年5月2日(2011.5.2)
【出願人】(599045903)学校法人 久留米大学 (72)
【出願人】(390004097)株式会社医学生物学研究所 (41)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成23年5月2日(2011.5.2)
【出願人】(599045903)学校法人 久留米大学 (72)
【出願人】(390004097)株式会社医学生物学研究所 (41)
【Fターム(参考)】
[ Back to top ]

