抗体−抗体コンジュゲートと抗体測定系診断薬への応用
【課題】抗原特異的ヒト免疫グロブリンを測定する系において、測定結果の評価に不可欠な陽性コントロール、またはキャリブレーターであって、安定的入手が困難な抗原特異的ヒト免疫グロブリンの代替物の開発。
【解決手段】複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより、それら複数の性質を有することを特徴とする人工抗体が提供される。例えば、抗パルボウイルスB19マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲートすることにより、パルボウイルスB19抗原を認識し且つヒトIgMの性質を有する人工抗体が得られ、それは抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして有用である。
【解決手段】複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより、それら複数の性質を有することを特徴とする人工抗体が提供される。例えば、抗パルボウイルスB19マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲートすることにより、パルボウイルスB19抗原を認識し且つヒトIgMの性質を有する人工抗体が得られ、それは抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより、それら複数の性質を有することを特徴とする人工抗体に関する。特には、抗ウイルスIgG抗体とヒトIgM抗体とが化学的にコンジュゲートされている、特定のウイルス抗原を認識し且つヒトIgMの性質を有する人工抗体に関し、当該人工抗体は抗ウイルス抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして有用である。具体的には、抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして、抗パルボウイルスB19マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲートすることにより、パルボウイルスB19抗原を認識し且つヒトIgMの性質を有する人工抗体が得られることを示すものである。
【背景技術】
【0002】
抗体は抗原と結合できるタンパク質で、正常人のγグロブリン画分の大部分を占めている。抗体としての活性を担うタンパク質は免疫グロブリン(immunoglobulin)と呼ばれている。免疫グロブリンには種々の種類があるが、基本的にはすべて類似した分子構造をもっており、H鎖(heavy chain)2本とL鎖(light chain)2本によって組み立てられている。通常血清中に最も多量に存在する免疫グロブリンG(immunoglobulin G, IgG)では、H鎖のN末端側の半分にL鎖がジスルフィド結合(S-S結合)と非共有結合で結合して対をなし、このH-Lペアの2組がH鎖のほぼ中央部でS-S結合により結ばれ、さらにH鎖のC末端側同士が非共有結合で結合して対をなす構成となっている。
H鎖もL鎖もその定常領域(constant region)の配列が異なっているいくつかの種類が見出されており、それによりH鎖はμ、γ、α、ε、δの5種に、そしてL鎖はκ、λの2型(type)に大別されている。H鎖の種類により免疫グロブリンは、IgM(μ鎖)、IgG(γ鎖)、IgA(α鎖)、IgE(ε鎖)、IgD(δ鎖)のクラス(class)に分けられている。さらに、γ鎖やα鎖にはさらにわずかな構造の異なる亜種があることから、サブクラス(subclass)に分けられる。IgMは他のクラスと異なり、(μL)2の単位構造が5個連結したペンタマー、すなわち[(μL)2]5の構造となっている。
【0003】
抗原刺激によって最初に産生される免疫グロブリンであるIgMは、感染症の診断のため、感染要因に対するIgM型特異抗体として測定されることが多い。また、各種疾患の予後、重症度、経過観察などの目的でも、IgM型特異抗体は広く測定されている。例えば、抗HBcヒトIgM抗体は、感染初期に出現し急性B型肝炎例のほとんどで高値を示すため、重要な診断項目となっている。また、伝染性紅斑や胎児水腫(hydrops fetal)などを引き起こすことが知られているパルボウイルスB19(parvovirus B19)に対するIgM抗体も感染初期に出現する。献血で得られた検体中に抗パルボウイルスB19ヒトIgM抗体が検出されることは、感染初期、すなわち献血者血中にパルボウイルスB19が存在していることを意味し、従って輸血用血液や血液製剤の原料として適さないなどの判断を可能にさせる。このようにヒト血中の抗パルボウイルスB19IgM抗体の測定は、献血者血中のパルボウイルスB19存在の有無、ならびに輸血用血液や血液製剤の原料の安全性を確保する上で貢献するものである。
【0004】
パルボウイルスB19 (parvovirus B19)は、1975年にCossartらによって発見されたウイルスであり(非特許文献1: Cossart, Y.E., et al.: Parvovirous-like particles in human sera. Lancet, 1: 72-73, 1975)、パルボウイルス科のパルボウイルス属に位置する一本鎖DNAウイルスであって、20nm程度の正20面体構造でエンベロープを持たない小型のウイルスである。B19遺伝子は、非構造蛋白質(NS1)とキャプシド蛋白質(VP1、及びVP2)、及び 7.5kD、11kDなどの小蛋白質をコードしている。パルボウイルスは飛沫感染し、ウイルス血症、赤芽球で増殖する。また、症状・疾患として、(1)伝染性紅斑(りんご病)、(2)関節炎、(3)造血障害発作、(4)胎児水腫などが挙げられる。特に妊婦がB19感染症を受けると70%は無症状だが、4〜9%は子宮内胎児死亡を起こすことが知られている。その対策として、赤十字血液センターでは原料血漿へのB19負荷を減らすことを目的に、1997年よりすべての献血血液についてReceptor Mediated Hemagglutination(RHA)検査法によるB19スクリーニング検査を実施している(非特許文献2: 武田芳於他、献血血液のRHA検査による第VIII因子製剤原料血漿からのパルボウイルスB19除去効果、Japanese Journal of Transfusion Medicine, 1: 27-31, 2002)。
【0005】
RHA検査はその原理上3〜5日間のウイルス血症期には有効だが、それに続いてのB19抗体の産生が始まると(抗原抗体複合期)B19のreceptorであるP抗原と抗体が競合し、RHA反応は著しく阻害され、当該期間に献血されたパルボウイルスB19陽性検体はRHA検査では検出できない。その他のパルボウイルスB19抗原の測定法としては、PCR法によりウイルス遺伝子を増幅して測定する方法(非特許文献3:斉藤由美子他、ヒトパルボウイルスB19感染の診断へのPCRの応用及びELISAによる抗体測定、臨床病理, 2: 203-208, 1993)。また微量の抗原を抗パルボウイルスB19抗体で測定する方法として、パルボウイルスB19抗原測定方法(特許文献1: 半沢幹朗等、特願2006-106761、平成18年4月7日出願)がある。PCR法による検査は、ターゲットであるパルボウイルスB19遺伝子を増幅して測定する方法であり高感度な測定法ではあるが、測定するウイルスを抽出するための装置、増幅するための装置を必要とし、また、測定対象の検体へのコンタミネーションが問題となり、測定には多大な時間と高価な器機を必要とする。一方、微量の抗原を抗パルボウイルスB19抗体で測定する方法は極めて有用であるが、抗原抗体複合期には検体中の抗体により競合阻害される可能性があるため、この抗原測定と並行して、抗パルボウイルスB19抗原ヒトIgM抗体を測定することは、輸血用血液や血液製剤の原料の安全性を確保する上で貢献するものである。
【0006】
ところで、ヒト血中の抗パルボウイルスB19抗原ヒトIgM抗体の測定時、その診断系が機能していることを保証するためにも、対象検体の本抗体陰性/陽性の判定を下す上でも必要にとなるのが、陽性コントロール、またはキャリブレーターのソースとなる抗パルボウイルスB19ヒトIgM抗体、またはそれを高濃度に含有する陽性血清である。しかしながら、IgM抗体は、IgGなどの抗体が作られる時期になると、極端に産生量が低下し、また、その半減期も約5日と短いため感染初期に一過性の増加を示すに過ぎない。必要な陽性コントロール、またはキャリブレーターのソースを安定的に確保するために、大規模スクリーニングなどの多大な労力を要しているのが現状である。
【0007】
【特許文献1】半沢幹朗等、特願2006-106761、平成18年4月7日出願
【非特許文献1】Cossart, Y.E., et al.: Parvovirous-like particles in human sera. Lancet, 1: 72-73, 1975
【非特許文献2】武田芳於他、献血血液のRHA検査による第VIII因子製剤原料血漿からのパルボウイルスB19除去効果、Japanese Journal of Transfusion Medicine, 1: 27-31, 2002
【非特許文献3】斉藤由美子他、ヒトパルボウイルスB19感染の診断へのPCRの応用及びELISAによる抗体測定、臨床病理, 2: 203-208, 1993
【発明の開示】
【発明が解決しようとする課題】
【0008】
抗体測定系に必要な陽性コントロール、またはキャリブレーターのソースを安定的に確保するのが困難な場合が多い。例えば、抗原刺激によって最初に産生される免疫グロブリンである抗原特異的IgMは、ウイルス感染などでは感染の初期に出現するのみであり、ウイルス抗原特異的ヒトIgMを入手することは、往々にして、困難となる。同様に、IgA、IgE、IgDなどの抗体は、産生される量自体が僅かであり、生理現象のある特定の時期に出現するだけの場合もあり、そのため、それらIgA、IgE、IgDなどのクラスの抗原特異的抗体を安定的に確保するには、常に困難が伴い、抗体測定系の構築並びに実施に問題が生じる。そして、この問題を解決することは、様々なウイルス感染の有無のモニタリング、大量検体のスクリーニングについての要請が増大する中で、大きな課題となっている。
特に、抗パルボウイルスB19ヒトIgM測定系の利用が求められる中で、測定系の陽性コントロール、またはキャリブレーターとして機能する特異性をもった抗体を確保することが、強く求められている。
【課題を解決するための手段】
【0009】
本発明者らは、抗体測定系に必要な陽性コントロール、またはキャリブレーターのソースを安定的に確保するのが困難な場合が多いため、それを解決する技術を鋭意研究した結果、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得られた抗体コンジュゲートが、元の抗体のそれぞれが有していた複数の性質を有する人工抗体として機能することを見出すことに成功し、ここに本発明を完成した。
【0010】
本発明は、以下を提供する。
〔1〕抗体Aと抗体Bをコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、且つ、AとBの両者の性質を有する人工抗体、あるいは複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得られた複数種類の抗体間コンジュゲートであり、且つ、複数の性質を有する人工抗体であることを特徴とする人工抗体。
〔2〕抗体Aがある抗原X特異的IgG抗体であり、抗体Bが非特異的IgM、IgA、IgE及びIgD抗体からなる群から選択されたもので、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、ある抗原X特異的で且つIgM、IgA、IgE及びIgD抗体からなる群から選択されたものの性質を有することを特徴とする上記〔1〕に記載の人工抗体。
〔3〕抗体Aがマウス、ラット、モルモット、ウサギ、ヤギ及びヒツジからなる群から選択された抗体であり、抗体Bがヒト抗体であることを特徴とする上記〔1〕又は〔2〕に記載の人工抗体。
〔4〕抗体Aが抗パルボウイルスB19抗原マウスIgG抗体であり、抗体Bが非特異的なヒトのIgM抗体で、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートが、パルボウイルスB19抗原を認識し且つヒトIgM抗体の性質を有するものであることを特徴とする上記〔1〕〜〔3〕のいずれか一に記載の人工抗体。
〔5〕抗体Aがモノクローナルまたはポリクローナル抗体であり、抗体Bがポリクローナルであることを特徴とする上記〔1〕〜〔4〕のいずれか一に記載の人工抗体。
〔6〕免疫学的抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、上記〔1〕〜〔5〕のいずれか一に記載の人工抗体を利用すること。
〔7〕抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、上記〔4〕記載の人工抗体を利用すること。
【発明の効果】
【0011】
本発明で得られる人工抗体は、抗体測定系に必要であるが、一方、安定的に確保するのが困難な陽性コントロール、またはキャリブレーターのソースとして有用であり、これにより、陽性コントロール、またはキャリブレーターのソースの安定的確保が困難であることから、その適用が困難であった様々なウイルス感染の有無のモニタリング、大量検体のスクリーニングを可能なものとなすことに繋がる。
本発明のその他の目的、特徴、優秀性及びその有する観点は、以下の記載より当業者にとっては明白であろう。しかしながら、以下の記載及び具体的な実施例等の記載を含めた本件明細書の記載は本発明の好ましい態様を示すものであり、説明のためにのみ示されているものであることを理解されたい。本明細書に開示した本発明の意図及び範囲内で、種々の変化及び/又は改変(あるいは修飾)をなすことは、以下の記載及び本明細書のその他の部分からの知識により、当業者には容易に明らかであろう。本明細書で引用されている全ての特許文献及び参考文献は、説明の目的で引用されているもので、それらは本明細書の一部としてその内容はここに含めて解釈されるべきものである。
【発明を実施するための最良の形態】
【0012】
本明細書で、「抗体コンジュゲート」とは、抗体と抗体とが共有結合でもって結合せしめられているものであってよく、例えば、抗体と抗体とが直接共有結合せしめられているものあるいはリンカーを介して抗体と抗体とが共有結合せしめられているものが包含され、典型的な場合、抗体と抗体とがクロスリンク(化学架橋)されているものを意味してよい。
好適な態様では、共有結合は、少なくとも1つのリンカー(例えば、化学合成リンカー)を含んでいるものである。
本明細書で「人工」とは、天然に存在する構造体と区別するために使用するが、特記しない限り狭義に解釈するべきではない。抗体間の共有結合は、人工に形成されたものが好ましいが、天然に存在する型の結合を必ずしも除外して解釈すべきではない。天然に存在する型の結合とは、切断されて人工的に再結合されたものを指してもよく、さらには、例えば、組換えDNA技術などの遺伝子工学手法を適用して人工的に導入された構造を有するものを指してもよい。
【0013】
本明細書で「抗体A」とは、抗原X特異的な抗体であり、典型的な場合IgG抗体が挙げられる。抗体Aは、哺乳動物由来のもの、例えば、マウス、ラット、モルモット、ウサギ、ヤギ、ヒツジなどから得られたものが挙げられ、ポリクローナル抗体であってもよいし、モノクローナル抗体であってよい。典型的なものとしては、モノクローナル抗体が挙げられ、例えば、マウスモノクローナルIgG抗体が挙げられる。一つの具体的な態様では、抗パルボウイルスB19抗原マウスIgG抗体が挙げられ、より好適には抗パルボウイルスB19抗原マウスモノクローナルIgG抗体を使用することができる。IgGには、マウスIgG1, IgG2a, IgG2b、モルモットIgG1, IgG2などのサブクラスのものが含まれてよい。抗体Aは、これらのものを種々のタンパク質分解酵素、例えば、ペプシン、パパイン、トリプシンなどで消化して得られた抗体断片(抗体フラグメント)、還元処理されて遊離のHS-基を有する抗体フラグメント、H-Lペア抗体なども含まれてよく、例えば、Fab、F(ab')2なども含まれてよい。
【0014】
本明細書で「抗体B」とは、ヒト由来の抗体、すなわち、ヒト血液、例えば、ヒト血漿から得られたIgM、IgA、IgE、IgD抗体などが挙げられ、代表的には、非特異的IgM、IgA、IgE、IgD抗体などが挙げられる。抗体Bは、ポリクローナル抗体であってよい。一つの具体的な態様では、ヒトIgM抗体が挙げられる。抗体Bは、サブクラスのものが含まれてよいし、さらに当該抗体を種々のタンパク質分解酵素、例えば、ペプシン、パパイン、フィシン、トリプシンなどで消化して得られた抗体断片(抗体フラグメント)、還元処理されて遊離のHS-基を有する抗体フラグメントなども含まれてよく、例えば、Fc5μ-H、F(ab')2、2-アミノエタンチオール(2-Aminoethanethiol: 2-AE)で還元されているヒトIgM抗体、ヒトIgMμ鎖(70K)なども含まれてよい。
【0015】
本発明の人工抗体は、抗体−抗体コンジュゲートであり、抗体-抗体間架橋化物(クロスリンク体)が包含され、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得ることができる。複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)する方法としては、蛋白質と蛋白質を化学的にコンジュゲート(クロスリンク)する様々な方法がそのまま利用可能であり、当該分野で知られた方法から適宜選択して使用できる。従って、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)する方法は、以下に列挙した方法に限られるものではないが、例えば教科書「Bioconjugate Techniques:Greg T. Hermanson著、Academic Press, 1996, Elsevier」に記述されているクロスリンキングの手法を用いることができる。例として、EDAC(N-(3-Dimethylaminopropyl)-N'-ethyl carbodiimide hydrochloride)+Sulfo-NHS(N-hydroxysulfosuccinimide)法、Glutaraldehyde法、SMCC/SMHC/SMBC法、SMCC-Iminothiolane(Traut's Reagent)法、Imidate(Dimethyl pimelimidate)法、Bismaleimide (o-PDM, BMDB), Trismaleimide(TMEA)法などがコンジュゲート(クロスリンク)する方法として挙げられる。また、市販のクロスリンキング試薬を使用して行うことが便利である。本発明の一つの態様では、抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲート(クロスリンク)させることができる。また、クロスリンキングに際しては、抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体の混合物に上記クロスリンキング試薬を添加するOne-Step法や抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体の一方、または両方のそれぞれにクロスリンキング試薬を添加、精製後に混合するTwo-Step法を用いてもよい。
【0016】
該リンカーとしては、2価の有機基が挙げられるが、3価又はそれ以上の価数を有する有機基であってもよく、好適には化学合成リンカーが包含される。有機基としては、炭素原子の鎖を有するもの、あるいはその炭素原子の代わりに、硫黄原子、酸素原子及び窒素原子からなる群から選択されたものを含有しているものなどが挙げられ、例えば、任意に置換されていてもよい、アルキレン鎖(-O-、-S-、-NH-などからなる群から選択されたものを鎖中に含むものを包含する)、シクロアルキル部を有するもの、2価のアリール基、アルデヒドから誘導された2価の基、アミノ酸から誘導された残基、脂肪族又は芳香族のジカルボン酸から誘導された残基などや当該分野で当業者に知られているものが挙げられる。
【0017】
本発明で対象とするウイルスとしては、抗原特異的ヒト免疫グロブリン測定の対象として当業者に知られたものであれば特には限定されるものではないが、例えば、ウイルスによる感染の有無を判定する目的で行われるものが含まれる。ウイルスとしては、HIV、HTLV-1、HCV、HBs抗原、HBc抗原、HBe抗原、サイトメガロウイルス、単純ヘルペスI、水痘ヘルペス、麻疹などが挙げられる。
【0018】
本免疫学的抗ウイルス抗体測定、特には抗ウイルス抗原ヒトIgM抗体測定は、免疫検査に必要な機能を備えた全自動免疫測定装置、例えば、全自動化学発光免疫装置で行うのに適したものであることができる。該全自動化学発光免疫装置は、普通、検体の受け入れと測定部位への移送を行うサンプラートラック機構、化学発光測定を行うプロセッシング機構、消耗品である洗浄液、反応試薬などの補給と廃棄物の処理を行うサプライ機構、システム全体の操作並びに制御を行うシステムコントロール機構を備えているようなものが好ましい。該サンプラートラック機構のうちには、各種のサンプルカップや試験管に対応し、さらに様々な大きさのものに対応している形態のものとされ、少量検体についても、バーコード読み取り機構を利用して検体の同定管理が可能とされており、さらに、ランダムアクセスや継続的なアクセスによるサンプリングが可能とされ、緊急的な検体測定も可能とされているなどの機構が挙げられる。検体の追加、取り外しがいつでも、当該装置全面から行うことが可能とされ、さらに検体IDユニットを備えバーコード情報が読み取り可能とされていることが好ましく、例えば、検体ラックをセットすると直ちにバーコード情報が読み取られ、測定を開始できるようにされている装置であってよい。また、検体ラックトランスポータは、検体ラックをセットすると直ちに動作可能とされ、3次元での検体ラック搬送を実現できるような機構を備えたものが好ましく、処理効率に応じた最適検体ラックポジションへの移送、サンプリングのための検体ラックの各モジュールへの分配、優先処理の最適化を図ることが可能な機構を備えているものとすることも可能である。
【0019】
該プロセッシング機構としては、多数の試薬ボトルを同時搭載可能とされ、1モジュールで莫大な数のテストが可能とされているものが好適であり、例えば、25個の試薬ボトルを同時搭載し、500テスト用の試薬ボトルが使用可能になっていて、1モジュール最大12,500テストが可能となっている能力を備えるものとされていることもできる。該プロセッシング機構には、冷却機能付き試薬カセロールにより、試薬を搭載したまま長時間安定に保持できる機能、試薬につき、項目名、ロットナンバー、テストサイズ、使用期限、マスターキャリブレーション情報などをバーコード自動読み取りにより管理可能とされる機能、検体量不足、気泡、血餅などの異常を感知できるプレシャーモニタリング機能、キャリーオーバーを低減するサンプルピペッタなどが含まれていることができる。キャリーオーバーの低減は、サンプルプローブの洗浄を強化せしめたり、また、自動位置調整機能を備えることにより達成されるものであることができる。該プレシャーモニタリング機能では、例えば、サンプリング・分注時の液圧の常時モニタリングにより、プローブの詰まりや気泡を検知可能とされ、誤った報告を防止できるようにされることが挙げられる。該サプライ機構には、化学発光に適した試薬、例えば、多くの数のテストに対応する数のトリガー試薬(希釈緩衝液)、プレトリガー試薬(希釈緩衝液)を保管可能とする機能、固型廃棄物用の廃物コンテナを備えるとともに、廃液については検査室の廃液口に自動廃液可能とする機能などが含まれていることができる。該システムコントロール機構としては、モニター画面上のスクリーンにタッチすることで操作可能となっている機能、各モジュールの状況が一目で判別可能とされているスナップショット画面形成機能、多数のテストの測定結果並びに多数のテストのQC結果を保存する機能などが含まれているものであってよい。全自動化学発光免疫装置の例としては、免疫測定装置アーキテクトTMアナライザーシリーズ(米国アボットラボラトリーズ: Abbott Laboratories)、例えば、アボット アーキテクトTMi2000 (Abbott ARCHITECTTMi2000)などが挙げられる。
【0020】
本発明では、上記人工抗体をヒトIgM測定系の陽性コントロール、またはキャリブレーターとして使用して、免疫学的にヒト抗パルボウイルスB19 IgM型抗体を測定する方法が行われる。当該免疫学的抗パルボウイルスB19 IgM抗体測定は、検体を固相化ウイルスB19抗原で処理して、固相に抗パルボウイルスB19抗体(抗パルボウイルスB19 IgMを含む)を捕捉した後、標識された抗ヒトIgM抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)することを特徴としているものであってよい。この場合、例えば、免疫学的にヒト抗パルボウイルスB19 IgM抗体を測定する方法は、検体を固相化ウイルスB19抗原、すなわち、固相化組換えヒトパルボウイルスB19抗原で処理して、固相にヒトIgM抗体を捕捉した後、標識された抗ヒトIgM抗体、例えば、ペルオキシダーゼ標識あるいはアクリジニウム誘導体標識マウスモノクローナル抗ヒトIgM抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)できる。
【0021】
また、該免疫学的抗パルボウイルスB19 IgM抗体測定法は、検体を固相化抗ヒトIgM抗体で処理して、固相にヒトIgM(ヒト抗パルボウイルスB19 IgMを含む)を捕捉した後、ウイルス抗原、すなわち、パルボウイルス抗原を反応せしめ、次に標識された抗パルボウイルスB19抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)することを特徴としているものであってよい。当該免疫学的抗パルボウイルスB19 IgM抗体測定法は、検体を固相化抗ヒトIgM抗体、例えば、固相化マウスモノクローナル抗ヒトIgM抗体で処理して、固相にヒトIgM抗体を捕捉した後、ウイルス抗原、すなわち、組換えヒトパルボウイルスB19抗原を反応せしめ、次に標識された抗ヒトパルボウイルスB19抗体、例えば、ペルオキシダーゼ標識あるいはアクリジニウム誘導体標識マウスモノクローナル抗ヒトパルボウイルスB19抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)することを特徴としているものであってよい。または、標識された組換えヒトパルボウイルスB19抗原を反応せしめ、その標識を直接測定することも可能である。
【0022】
該ウイルス抗原としては、培養したウイルス等から精製したタンパク質や、組換えタンパク質として産生されたものが挙げられ、後者の例として、大腸菌発現系、酵母発現系、バキュロウイルス発現系などを使用して得られたものが挙げられる。
本発明で使用できるヒトパルボウイルスB19抗原としては、組換えタンパク質として産生されたものが挙げられ、例えば、大腸菌発現系、バキュロウイルス発現系などを使用して得られたものが挙げられる。組換えヒトパルボウイルスB19抗原としては、構造タンパク質VP1及びVP2、それらのN末端側あるいはC末端側ペプチド、non-structural protein-1 (NS1)、それらの任意の混合物などが挙げられる。
代表的な抗体測定用抗原としては、RIDATM LINE Parvovirus B19 IgG, IgM (Art. No. LB 6023 (IgG), LB 6033 (IgM): R-Biopharm AG, Darmstadt, Germany)のパンフレットに開示のもの、例えば、VP2, VP-2p, VP-2r, VP-N, VP-C, VP-1s, NS-1, VP1など、Dimitri Peterlana et al., Clinica Chimica Acta, 372, pp.14-23 (2006) に開示のもの、例えば、VP1, VPなど、recomBlot Parvovirus B19 IgG/IgM 及びrecomWell Parvovirus B19 IgGとrecomWell Parvovirus B19 IgM (Mikrogen GmbH, Martinsried, Germany) のパンフレットに開示のもの、例えば、VP-1, VP-2, VP-N, VP-C, VP-1S, NS-1, rVP-1/2-N, rVP-1/2-C, rVP-1-S, rNS-1などであってもよく、適宜、それらから選択されたものであってよい。好ましくは、バキュロウイルス発現抗原タンパク質を使用でき、また抗原タンパク質は、複数抗原タンパク質の混合物であってもよい。
本免疫学的抗ウイルス抗体測定、例えば、抗パルボウイルスB19 IgM抗体測定において使用する免疫測定方法は、例えば、競合法、サンドイッチ法等の公知のいずれの方法であってもよいが、特にサンドイッチ法が好ましい。化学発光免疫測定法(chemiluminescent immunoassay: CLIA)が好適に使用できる。代表的なサンドイッチ法として、例えば、2ステップサンドイッチ法が挙げられる。
【0023】
本測定方法において用いる抗ウイルス抗体(抗ヒトパルボウイルスB19抗体、さらには標識抗体、例えば、標識抗ヒトパルボウイルスB19抗体を包含する)は、ポリクローナル抗体およびモノクローナル抗体のいずれであってもよく、好適にはモノクローナル抗体、例えば、マウスモノクローナル抗体を挙げることができ、更に、好ましくはIgG抗体が挙げられる。また、これら抗体はFab、F(ab’)2等の抗体フラグメントであってもよい。
本免疫学的抗ウイルス抗体測定法(免疫学的抗パルボウイルスB19 IgM抗体測定法を含む)において使用する固相、特にはサンドイッチ法で用いる固相としては、周知のマイクロプレート、ポリスチレンビーズ、ガラスビーズ、ラテックス粒子、磁性粒子等が挙げられ、特に好ましくは磁性マイクロ粒子(磁性マイクロパーティクル:μ-P)が挙げられる。標識抗体への標識剤としては、蛍光物質、発光物質、ペルオキシダーゼなどの酵素、放射性同位元素等が挙げられ、特に好ましくはアクリジニウム誘導体、例えば、10-(3-スルホプロピル)-N-(p-トルエンスルホニル)-N-(カルボキシエチル)-9-アクリジニウムカルボキサミドなどが挙げられる。アクリジニウム誘導体は、米国特許明細書第5,468,646号、同第5,543,524号などに記載のものなどが挙げられる。固相又は標識物への抗体を結合させる方法としては、周知の物理的吸着方法、化学的な反応による結合方法が挙げられる。抗ヒトパルボウイルスB19抗体の作製用抗原として用いられるヒトパルボウイルスB19抗原は、公知の方法、例えば特開平7-147986号に記載されている方法にしたがって作製することができる。
【0024】
一つの態様において、2ステップサンドイッチ法では、パルボウイルスB19抗原(例えば、バキュロウイルス発現組換え(リコンビナント:recombinant)パルボウイルスB19抗原)を磁性マイクロパーティクル(μ-P)に結合してある固相化抗原を検体と接触せしめ、インキュベーション処理後、磁石の影響下、B/F分離及び洗浄を行い、次に該マイクロパーティクルをアクリジニウム誘導体で標識されている抗ヒトIgM抗体コンジュゲートと接触せしめ、インキュベーション処理し、その後、磁石の影響下、B/F分離及び洗浄を行い、標識を測定することにより、抗パルボウイルスB19 IgMを測定(定量測定を含む)する。標識の測定は、例えば、プレトリガー液やトリガー液を使用して標識アクリジニウムを化学発光を起こす分子種に変換するなどして達成される。プレトリガー液としては、例えば、過酸化水素を含む酸性溶液などが挙げられ、アクリジニウム標識抗体を磁性マイクロパーティクル上から切り離し、アクリジニウムを溶液中に均一に溶出させる。トリガー液としては、例えば、Triton X-100を含む水酸化ナトリウム溶液などが挙げられ、発光反応を発生させる。
本発明では、輸血用血液や血液分画製剤原料の血液に付き、ヒトパルボウイルスB19による問題とされる汚染の有無を高感度に検出することが可能であり、その操作も大量処理に適した、且つ迅速処理が可能なものであり、全自動血液スクリーニングシステムを利用できるので、非常に便利で優れている。
血液試料中のヒトパルボウイルスB19抗体測定については、例えば、Matthias F.C. Beersma et al., Journal of Clinical Virology, 34, pp.71-75 (2005)、Dimitri Peterlana et al., Clinica Chimica Acta, 372, pp.14-23 (2006)並びにそこで引用された文献を参照することができるし、それらは本明細書の一部としてその内容はここに含められてよい。
【0025】
具体的な態様の一つでは、本発明は、ヒト検体中のウイルス測定検出法、例えば、抗ウイルス抗体、特には抗ウイルス IgM測定検出法において、(1)測定検体試料を、磁性粒子に固相化されたパルボウイルスB19抗原と接触せしめる工程、磁石の影響下にB/F分離及び洗浄処理する工程、磁性粒子固相に結合しているパルボウイルスB19抗原-抗パルボウイルスIgM型抗体複合体(コンプレックス)と標識化された抗ヒトIgM抗体とを接触せしめる工程、磁石の影響下にB/F分離及び洗浄処理する工程、標識を指標にヒト抗パルボウイルスIgM型抗体を定量する工程、あるいは、(2)測定検体試料を、固相化された抗ヒトIgM抗体と接触せしめる工程、B/F分離及び洗浄処理する工程、固相に結合している抗ヒトIgM抗体-抗パルボウイルスIgM複合体(コンプレックス)とパルボウイルスB19抗原とを接触せしめる工程、B/F分離及び洗浄処理する工程、固相に結合している抗ヒトIgM抗体-抗パルボウイルスIgM-パルボウイルスB19抗原複合体(コンプレックス)と標識化された抗ヒトパルボウイルスB19抗体とを接触せしめる工程、B/F分離及び洗浄処理する工程、標識を指標にヒト抗パルボウイルスIgM型抗体を定量する工程、または、標識された組換えヒトパルボウイルスB19抗原を反応せしめ、その標識を直接的に測定して、ヒト抗パルボウイルスIgM型抗体を定量する工程、を含んでいる抗パルボウイルスIgM免疫学的測定方法を行い、または、(3)測定検体試料を、標識された組換えヒトパルボウイルスB19抗原と反応せしめ、その標識を直接的に測定して、ヒト抗パルボウイルスIgM型抗体を定量する工程、を含んでいる抗パルボウイルスB19 IgM免疫学的測定方法を行い、さらに、上記人工抗体を当該測定系の陽性コントロール、またはキャリブレーターとして使用して、ヒト抗パルボウイルスIgM型抗体の免疫学的測定結果を得て、当該検体中のパルボウイルスB19汚染の有無を決定することを特徴とするものである。
当該人工抗体を含有する検体は、上記測定検体試料と同様に処理されて、陽性コントロール、またはキャリブレーターとしての免疫学的測定結果を与えることとなる。
【0026】
以下に実施例を掲げ、本発明を具体的に説明するが、この実施例は単に本発明の説明のため、その具体的な態様の参考のために提供されているものである。これらの例示は本発明の特定の具体的な態様を説明するためのものであるが、本願で開示する発明の範囲を限定したり、あるいは制限することを表すものではない。本発明では、本明細書の思想に基づく様々な実施形態が可能であることは理解されるべきである。全ての実施例は、他に詳細に記載するもの以外は、標準的な技術を用いて実施したもの、又は実施することのできるものであり、これは当業者にとり周知で慣用的なものである。本発明の人工抗体の利用方法は、抗パルボウイルスB19ヒトIgM測定系の陽性コントロール、またはキャリブレーターに限られるものではないが、以下、抗パルボウイルスB19抗原ヒトIgM測定系の場合で、上記課題を解決するための手段を説明する。
【実施例1】
【0027】
〔抗パルボウイルスB19ヒトIgM測定〕
米国Abbott LaboratoriesのARCHITECTTMシステムを用いて実施した実施例を示す。本免疫測定装置は、システムコントロールセンター(System Control Center, SCC)、プロセッシングモジュール(Processing Module, PM)、そしてサンプルハンドラー(Sample Handler, SH)から構成され、さらにプロセッシングモジュールの主要部分はプロセッシングセンターと呼ばれ、25項目の試薬を同時搭載できる試薬カローセルを備え、その周りにプロセスパスがあって、該プロセスパス内を反応セルが移動し、周りにサンプルピペッター、試薬ピペッター、内部攪拌装置、ウオッシュゾーンなどが配置されている。反応セルは、プロセスパス内を1ステップずつ移動しながら、それぞれのポジションへ移送される。プロセッシングセンター内には1200個の反応セルを収容できる。また、ダブルトレーも利用可能とされている。本装置は、輸血用血液の安全性を向上させ、効率的な血液供給を行うに適して全自動血液スクリーニングシステムである。独自の化学発光免疫測定法による優れた感度と特異性に加え、大量検体の処理を実現する。
本システムでは、高発光量の得られるアクリジニウム誘導体を標識に使用しているので、試薬の高い安定性(検量線の安定化、日差再現性の向上)、高い発光収率(感度の向上、測定範囲の拡張)が達成できる。また、磁性マイクロパーティクルを利用しているので、固相を磁石で押さえた状態で短時間のB/F分離、洗浄が可能となっており、内部攪拌装置で簡単に磁性マイクロパーティクルを分散させるので、均一な免疫反応が得られ、さらにプラスチック性消耗品の損耗が大幅に低減し、大量のテストを連続的に行うことができ、短時間で大量の検体の測定が可能である。
【0028】
本法の原理は、検体をサンプルピペッターが反応セルに分注した後、試薬ピペッターが試薬カローセルから磁性マイクロパーティクル液をその反応セルに分注する。次に内部攪拌装置で反応セル内の混合液を攪拌した後に、適温、例えば、37℃に維持されたプロセスパス内を移動しながら所要時間インキュベーションされる。かくして、検体、検体希釈液、及び抗原あるいは抗体を固相化した磁性マイクロパーティクル懸濁液をインキュベーションして、検体中の抗体あるいは抗原を特異的にマイクロパーティクル上の抗原あるいは抗体に反応させる(一次反応)。次に反応セルはウオッシュゾーンを通過し、永久磁石などを使用しての磁場の影響下にB/F分離及び磁性マイクロパーティクルの洗浄が希釈緩衝液を使用して行われる。次にアクリジニウム誘導体で標識された特異抗体の入ったコンジュゲート溶液を反応セルに分注し、内部攪拌装置で攪拌した後に、プロセスパス内を移動しながら所要時間インキュベーションされる。標識抗体は、磁性マイクロパーティクル上の測定目的物と結合する。すなわち、反応生成物は、アクリジニウム標識コンジュゲートにより検出される(二次反応)。このコンジュゲートは、アクチベータ溶液の存在下で化学発光を引き起こし、それを光電子増倍管で検出するものである。典型的には当該アクチベータ溶液としては、プレトリガー液とトリガー液とから構成されていてよく、該プレトリガー液は、アクリジニウム標識抗体を磁性マイクロパーティクル上から切り離して、アクリジニウムを反応溶液中に均一な状態で存在するように溶出せしめる働きのものであり、該トリガー液は、アクリジニウムを活性化して、例えば、アクリジニウムを酸化して、発光反応を生ぜしめる働きを持つものが挙げられる。
【0029】
ARCHITECTTM Parvovirus B19 IgM 試薬は、化学発光免疫測定法(CLIA法)による 抗パルボウイルスB19ヒトIgM測定試薬であり、B/F分離には磁性粒子(以下、マイクロパーティクル)を用いている。
反応様式は以下の通り。
1) 検体中の抗パルボウイルスB19ヒトIgM抗体は、マイクロパーティクルに固相化された抗ヒトIgMマウスモノクローナル抗体にキャプチャーされる。そこにアクリジニウム標識リコンビナントパルボウイルスB19抗原をプローブとして結合させ、マイクロパーティクル固相化抗ヒトIgMマウスモノクローナル抗体抗パルボウイルスB19ヒトIgM抗体−アクリジニウム標識リコンビナントパルボウイルスB19抗原の複合体を形成する。
2) インキュベーション後、マイクロパーティクルは磁石によって反応セルの管壁に引きつけられる。この状態での洗浄操作により、未結合物質が除去される。
3) プレトリガー(過酸化水素水を含む酸性溶液)及びトリガー(水酸化ナトリウム溶液)の添加により、アクリジニウムが酸化され、化学発光反応が起こる。このときの発光量は、RLU(相対的化学発光ユニット)という単位で表すことができる。
【0030】
4) 抗体測定系に必要な陽性コントロール、またはキャリブレーターのソースとなりうる人工抗体は、そのヒトIgMの性質のために、抗ヒトIgMマウスモノクローナル抗体(ヒトIgMのFc領域を認識する)にキャプチャーされ、またヒトIgMにクロスリンクされた抗パルボウイルスB19抗原マウスIgG抗体によってアクリジニウム標識リコンビナントパルボウイルスB19抗原プローブと結合することにより、検体中の抗パルボウイルスB19ヒトIgM抗体と同様の複合体を形成することができる。
また、このときの発光量は、およそ人工抗体の性能(抗パルボウイルスB19ヒトIgM抗体らしさ)に比例するので、抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲート(クロスリンク)させて得られた人工抗体の性能評価が可能となる。
尚、抗ヒトIgMマウスモノクローナル抗体は、ヒトIgMのFc領域や重鎖(IgMのμH鎖)を認識してキャプチャーするので、コンジュゲート(クロスリンク)に使用可能なヒトIgMとしては、必ずしもIgM全体を必要とせず、還元して調製したIgMのμH鎖や、トリプシン消化で得られるFc-5μHで置き換えることも可能である。
【0031】
〔抗パルボウイルスB19 IgM模倣体抗体の調製と陽性コントロール活性の評価〕
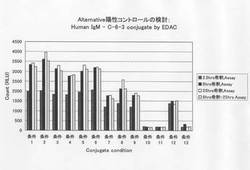
ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)のモル比を1:2.5、1:5、1:10として、ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体との混合物に、EDACとSulfo-NHSを添加して、コンジュゲート(抗パルボウイルスB19 IgM模倣体抗体)を形成した。EDACとSulfo-NHSの濃度を3条件で、コンジュゲート(抗体間クロスリンク)を実施した。一定時間(2.5, 8, 25hrs)室温で反応させた後に、本混合物をキャリブレーター(Calibrator)希釈液(1%BSA, Proclin300, Proclin950入り)で50μg/mL(IgMとC-6-3の総濃度)に希釈して、Alternative陽性コントロール試料として使用し、ARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。
EDAC / Sulfo-NHS法で調製したヒトIgMと抗パルボウイルスB19マウスIgG抗体(抗体名:C-6-3)とのコンジュゲートをARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。表1に、使用抗体のモル比、EDACとSulfo-NHSの濃度条件、コンジュゲート化反応条件、そして結果を示す。さらに図1に測定結果をグラフとして示す。
【0032】
【表1】

【0033】
上記表1において、「8hrs希釈で25hrsでAssay」とは、ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体との混合物に、EDACとSulfo-NHSを添加して、8hrs、室温で反応させた後に、得られた混合物をキャリブレーター希釈液で希釈して25hrs静置した後、Alternative陽性コントロール試料として使用し、ARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価したものである。
【実施例2】
【0034】
〔抗パルボウイルスB19 IgM模倣体抗体の調製と陽性コントロール活性の評価〕
ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)のモル比を1:5、1:10、1:20として、25%グルタルアルデヒド(Glutaraldehyde)液を1μL, 3μL添加条件で、コンジュゲート(クロスリンク)を実施した。2〜8℃で2hrs反応させた後にQuenchingを行った。本混合物をキャリブレーター希釈液(1%BSA, Proclin300, Proclin950入り)で50μg/mL(IgMとC-6-3の総濃度)に希釈して、ARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。
グルタルアルデヒドでヒトIgMと抗パルボウイルスB19マウスIgG抗体(抗体名:C-6-3)コンジュゲートを調製し、本コンジュゲートを使用して、ARCHITECTTMシステムを用い、実施例1と同様に処理し、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。結果を表2及び図2に示す。
【0035】
【表2】

【実施例3】
【0036】
ヒトIgMにSMCCによりマレイミド基を導入し、一方、抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)にIminothiolaneによりチオール基を導入した。両者のモル比を1:4.6、1:9.2、1:18.4として、コンジュゲート(クロスリンク)を実施した。2hrs反応させた後にキャリブレーター希釈液(1%BSA, Proclin300, Proclin950入り)で10倍、20倍希釈して、ARCHITECTシステムを用い、ARCHITECT Parvovirus B19 IgM 試薬で評価した。
SMCC-Iminothiolane(Traut's Reagent)法で、ヒトIgMと抗パルボウイルスB19マウスIgG抗体(抗体名:C-6-3)コンジュゲートを調製し、本コンジュゲートを使用して、ARCHITECTシステムを用い、ARCHITECT Parvovirus B19 IgM 試薬で評価した。結果を表3及び図3に示す。
【0037】
【表3】

【0038】
抗パルボウイルスB19抗原マウスIgG抗体又はそのフラグメントとヒトIgM抗体又はそのフラグメントの化学的なコンジュゲーション(クロスリンキング)を、EDAC (N-(3-Dimethylaminopropyl)-N'-ethyl carbodiimide hydrochloride) + Sulfo-NHS (N-hydroxysulfosuccinimide)法、Glutaraldehyde法、SMCC/SMHC/SMBC法、SMCC-Iminothiolane (Traut's Reagent)法、Imidate (Dimethyl pimelimidate)法、Bismaleimide (o-PDM, BMDB), Trismaleimide (TMEA)法など様々なクロスリンキングの手法を用いて実施した結果を表4にまとめた。
【0039】
【表4】

上記したように、本発明の、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートは、それら元の抗体が有していた複数の性質を有することを特徴とする人工抗体であり、抗体模倣体として機能する。例えば、抗ウイルスIgG抗体とヒトIgM抗体とが化学的にコンジュゲートされている、抗ウイルスIgG-ヒトIgM抗体コンジュゲートは、特定のウイルス抗原を認識し且つヒトIgMの性質を有する人工抗体であり、ヒト抗ウイルスIgM抗体模倣体として機能し、抗ウイルス抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして有用である。特に、抗パルボウイルスB19マウスIgG抗体(又はそのフラグメント抗体)とヒトIgM抗体(又はそのフラグメント抗体)を化学的にコンジュゲートすることにより得られる、抗パルボウイルスB19マウスIgG(又はそのフラグメント抗体)-ヒトIgM(又はそのフラグメント抗体)コンジュゲート(架橋体)は、パルボウイルスB19抗原を認識し且つヒトIgMの性質を有する人工抗体として機能し、抗パルボウイルスB19抗原ヒトIgM抗体測定方法で、陽性コントロール、またはキャリブレーターとして有用であり、抗パルボウイルスB19抗原ヒトIgM抗体の代替物として機能する。
【産業上の利用可能性】
【0040】
本発明の、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートは、それら元の抗体が有していた複数の性質を有することを特徴とする人工抗体であり、抗体模倣体として機能する。したがって、従来、陽性コントロール、またはキャリブレーターの安定確保が困難であることから、実施が困難であった抗体測定系の開発・実施に役立つ。
本発明は、前述の説明及び実施例に特に記載した以外も、実行できることは明らかである。上述の教示に鑑みて、本発明の多くの改変及び変形が可能であり、従ってそれらも本件添付の請求の範囲の範囲内のものである。
【図面の簡単な説明】
【0041】
【図1】コンジュゲート化剤(架橋化剤)としてEDACとSulfo-NHSを使用してヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートにつき、ARCHITECTTM Parvovirus B19 IgM 試薬を使用しての測定系で測定した結果(各コンジュゲート調製条件毎)を示す。
【図2】コンジュゲート化剤(架橋化剤)としてグルタルアルデヒドを使用してヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートにつき、ARCHITECTTM Parvovirus B19 IgM 試薬を使用しての測定系で測定した結果(各コンジュゲート調製条件毎)を示す。
【図3】コンジュゲート化剤(架橋化剤)としてSMCC及びIminothiolaneを使用してヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートにつき、ARCHITECTTM Parvovirus B19 IgM 試薬を使用しての測定系で測定した結果(各コンジュゲート調製条件毎)を示す。
【技術分野】
【0001】
本発明は、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより、それら複数の性質を有することを特徴とする人工抗体に関する。特には、抗ウイルスIgG抗体とヒトIgM抗体とが化学的にコンジュゲートされている、特定のウイルス抗原を認識し且つヒトIgMの性質を有する人工抗体に関し、当該人工抗体は抗ウイルス抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして有用である。具体的には、抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして、抗パルボウイルスB19マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲートすることにより、パルボウイルスB19抗原を認識し且つヒトIgMの性質を有する人工抗体が得られることを示すものである。
【背景技術】
【0002】
抗体は抗原と結合できるタンパク質で、正常人のγグロブリン画分の大部分を占めている。抗体としての活性を担うタンパク質は免疫グロブリン(immunoglobulin)と呼ばれている。免疫グロブリンには種々の種類があるが、基本的にはすべて類似した分子構造をもっており、H鎖(heavy chain)2本とL鎖(light chain)2本によって組み立てられている。通常血清中に最も多量に存在する免疫グロブリンG(immunoglobulin G, IgG)では、H鎖のN末端側の半分にL鎖がジスルフィド結合(S-S結合)と非共有結合で結合して対をなし、このH-Lペアの2組がH鎖のほぼ中央部でS-S結合により結ばれ、さらにH鎖のC末端側同士が非共有結合で結合して対をなす構成となっている。
H鎖もL鎖もその定常領域(constant region)の配列が異なっているいくつかの種類が見出されており、それによりH鎖はμ、γ、α、ε、δの5種に、そしてL鎖はκ、λの2型(type)に大別されている。H鎖の種類により免疫グロブリンは、IgM(μ鎖)、IgG(γ鎖)、IgA(α鎖)、IgE(ε鎖)、IgD(δ鎖)のクラス(class)に分けられている。さらに、γ鎖やα鎖にはさらにわずかな構造の異なる亜種があることから、サブクラス(subclass)に分けられる。IgMは他のクラスと異なり、(μL)2の単位構造が5個連結したペンタマー、すなわち[(μL)2]5の構造となっている。
【0003】
抗原刺激によって最初に産生される免疫グロブリンであるIgMは、感染症の診断のため、感染要因に対するIgM型特異抗体として測定されることが多い。また、各種疾患の予後、重症度、経過観察などの目的でも、IgM型特異抗体は広く測定されている。例えば、抗HBcヒトIgM抗体は、感染初期に出現し急性B型肝炎例のほとんどで高値を示すため、重要な診断項目となっている。また、伝染性紅斑や胎児水腫(hydrops fetal)などを引き起こすことが知られているパルボウイルスB19(parvovirus B19)に対するIgM抗体も感染初期に出現する。献血で得られた検体中に抗パルボウイルスB19ヒトIgM抗体が検出されることは、感染初期、すなわち献血者血中にパルボウイルスB19が存在していることを意味し、従って輸血用血液や血液製剤の原料として適さないなどの判断を可能にさせる。このようにヒト血中の抗パルボウイルスB19IgM抗体の測定は、献血者血中のパルボウイルスB19存在の有無、ならびに輸血用血液や血液製剤の原料の安全性を確保する上で貢献するものである。
【0004】
パルボウイルスB19 (parvovirus B19)は、1975年にCossartらによって発見されたウイルスであり(非特許文献1: Cossart, Y.E., et al.: Parvovirous-like particles in human sera. Lancet, 1: 72-73, 1975)、パルボウイルス科のパルボウイルス属に位置する一本鎖DNAウイルスであって、20nm程度の正20面体構造でエンベロープを持たない小型のウイルスである。B19遺伝子は、非構造蛋白質(NS1)とキャプシド蛋白質(VP1、及びVP2)、及び 7.5kD、11kDなどの小蛋白質をコードしている。パルボウイルスは飛沫感染し、ウイルス血症、赤芽球で増殖する。また、症状・疾患として、(1)伝染性紅斑(りんご病)、(2)関節炎、(3)造血障害発作、(4)胎児水腫などが挙げられる。特に妊婦がB19感染症を受けると70%は無症状だが、4〜9%は子宮内胎児死亡を起こすことが知られている。その対策として、赤十字血液センターでは原料血漿へのB19負荷を減らすことを目的に、1997年よりすべての献血血液についてReceptor Mediated Hemagglutination(RHA)検査法によるB19スクリーニング検査を実施している(非特許文献2: 武田芳於他、献血血液のRHA検査による第VIII因子製剤原料血漿からのパルボウイルスB19除去効果、Japanese Journal of Transfusion Medicine, 1: 27-31, 2002)。
【0005】
RHA検査はその原理上3〜5日間のウイルス血症期には有効だが、それに続いてのB19抗体の産生が始まると(抗原抗体複合期)B19のreceptorであるP抗原と抗体が競合し、RHA反応は著しく阻害され、当該期間に献血されたパルボウイルスB19陽性検体はRHA検査では検出できない。その他のパルボウイルスB19抗原の測定法としては、PCR法によりウイルス遺伝子を増幅して測定する方法(非特許文献3:斉藤由美子他、ヒトパルボウイルスB19感染の診断へのPCRの応用及びELISAによる抗体測定、臨床病理, 2: 203-208, 1993)。また微量の抗原を抗パルボウイルスB19抗体で測定する方法として、パルボウイルスB19抗原測定方法(特許文献1: 半沢幹朗等、特願2006-106761、平成18年4月7日出願)がある。PCR法による検査は、ターゲットであるパルボウイルスB19遺伝子を増幅して測定する方法であり高感度な測定法ではあるが、測定するウイルスを抽出するための装置、増幅するための装置を必要とし、また、測定対象の検体へのコンタミネーションが問題となり、測定には多大な時間と高価な器機を必要とする。一方、微量の抗原を抗パルボウイルスB19抗体で測定する方法は極めて有用であるが、抗原抗体複合期には検体中の抗体により競合阻害される可能性があるため、この抗原測定と並行して、抗パルボウイルスB19抗原ヒトIgM抗体を測定することは、輸血用血液や血液製剤の原料の安全性を確保する上で貢献するものである。
【0006】
ところで、ヒト血中の抗パルボウイルスB19抗原ヒトIgM抗体の測定時、その診断系が機能していることを保証するためにも、対象検体の本抗体陰性/陽性の判定を下す上でも必要にとなるのが、陽性コントロール、またはキャリブレーターのソースとなる抗パルボウイルスB19ヒトIgM抗体、またはそれを高濃度に含有する陽性血清である。しかしながら、IgM抗体は、IgGなどの抗体が作られる時期になると、極端に産生量が低下し、また、その半減期も約5日と短いため感染初期に一過性の増加を示すに過ぎない。必要な陽性コントロール、またはキャリブレーターのソースを安定的に確保するために、大規模スクリーニングなどの多大な労力を要しているのが現状である。
【0007】
【特許文献1】半沢幹朗等、特願2006-106761、平成18年4月7日出願
【非特許文献1】Cossart, Y.E., et al.: Parvovirous-like particles in human sera. Lancet, 1: 72-73, 1975
【非特許文献2】武田芳於他、献血血液のRHA検査による第VIII因子製剤原料血漿からのパルボウイルスB19除去効果、Japanese Journal of Transfusion Medicine, 1: 27-31, 2002
【非特許文献3】斉藤由美子他、ヒトパルボウイルスB19感染の診断へのPCRの応用及びELISAによる抗体測定、臨床病理, 2: 203-208, 1993
【発明の開示】
【発明が解決しようとする課題】
【0008】
抗体測定系に必要な陽性コントロール、またはキャリブレーターのソースを安定的に確保するのが困難な場合が多い。例えば、抗原刺激によって最初に産生される免疫グロブリンである抗原特異的IgMは、ウイルス感染などでは感染の初期に出現するのみであり、ウイルス抗原特異的ヒトIgMを入手することは、往々にして、困難となる。同様に、IgA、IgE、IgDなどの抗体は、産生される量自体が僅かであり、生理現象のある特定の時期に出現するだけの場合もあり、そのため、それらIgA、IgE、IgDなどのクラスの抗原特異的抗体を安定的に確保するには、常に困難が伴い、抗体測定系の構築並びに実施に問題が生じる。そして、この問題を解決することは、様々なウイルス感染の有無のモニタリング、大量検体のスクリーニングについての要請が増大する中で、大きな課題となっている。
特に、抗パルボウイルスB19ヒトIgM測定系の利用が求められる中で、測定系の陽性コントロール、またはキャリブレーターとして機能する特異性をもった抗体を確保することが、強く求められている。
【課題を解決するための手段】
【0009】
本発明者らは、抗体測定系に必要な陽性コントロール、またはキャリブレーターのソースを安定的に確保するのが困難な場合が多いため、それを解決する技術を鋭意研究した結果、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得られた抗体コンジュゲートが、元の抗体のそれぞれが有していた複数の性質を有する人工抗体として機能することを見出すことに成功し、ここに本発明を完成した。
【0010】
本発明は、以下を提供する。
〔1〕抗体Aと抗体Bをコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、且つ、AとBの両者の性質を有する人工抗体、あるいは複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得られた複数種類の抗体間コンジュゲートであり、且つ、複数の性質を有する人工抗体であることを特徴とする人工抗体。
〔2〕抗体Aがある抗原X特異的IgG抗体であり、抗体Bが非特異的IgM、IgA、IgE及びIgD抗体からなる群から選択されたもので、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、ある抗原X特異的で且つIgM、IgA、IgE及びIgD抗体からなる群から選択されたものの性質を有することを特徴とする上記〔1〕に記載の人工抗体。
〔3〕抗体Aがマウス、ラット、モルモット、ウサギ、ヤギ及びヒツジからなる群から選択された抗体であり、抗体Bがヒト抗体であることを特徴とする上記〔1〕又は〔2〕に記載の人工抗体。
〔4〕抗体Aが抗パルボウイルスB19抗原マウスIgG抗体であり、抗体Bが非特異的なヒトのIgM抗体で、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートが、パルボウイルスB19抗原を認識し且つヒトIgM抗体の性質を有するものであることを特徴とする上記〔1〕〜〔3〕のいずれか一に記載の人工抗体。
〔5〕抗体Aがモノクローナルまたはポリクローナル抗体であり、抗体Bがポリクローナルであることを特徴とする上記〔1〕〜〔4〕のいずれか一に記載の人工抗体。
〔6〕免疫学的抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、上記〔1〕〜〔5〕のいずれか一に記載の人工抗体を利用すること。
〔7〕抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、上記〔4〕記載の人工抗体を利用すること。
【発明の効果】
【0011】
本発明で得られる人工抗体は、抗体測定系に必要であるが、一方、安定的に確保するのが困難な陽性コントロール、またはキャリブレーターのソースとして有用であり、これにより、陽性コントロール、またはキャリブレーターのソースの安定的確保が困難であることから、その適用が困難であった様々なウイルス感染の有無のモニタリング、大量検体のスクリーニングを可能なものとなすことに繋がる。
本発明のその他の目的、特徴、優秀性及びその有する観点は、以下の記載より当業者にとっては明白であろう。しかしながら、以下の記載及び具体的な実施例等の記載を含めた本件明細書の記載は本発明の好ましい態様を示すものであり、説明のためにのみ示されているものであることを理解されたい。本明細書に開示した本発明の意図及び範囲内で、種々の変化及び/又は改変(あるいは修飾)をなすことは、以下の記載及び本明細書のその他の部分からの知識により、当業者には容易に明らかであろう。本明細書で引用されている全ての特許文献及び参考文献は、説明の目的で引用されているもので、それらは本明細書の一部としてその内容はここに含めて解釈されるべきものである。
【発明を実施するための最良の形態】
【0012】
本明細書で、「抗体コンジュゲート」とは、抗体と抗体とが共有結合でもって結合せしめられているものであってよく、例えば、抗体と抗体とが直接共有結合せしめられているものあるいはリンカーを介して抗体と抗体とが共有結合せしめられているものが包含され、典型的な場合、抗体と抗体とがクロスリンク(化学架橋)されているものを意味してよい。
好適な態様では、共有結合は、少なくとも1つのリンカー(例えば、化学合成リンカー)を含んでいるものである。
本明細書で「人工」とは、天然に存在する構造体と区別するために使用するが、特記しない限り狭義に解釈するべきではない。抗体間の共有結合は、人工に形成されたものが好ましいが、天然に存在する型の結合を必ずしも除外して解釈すべきではない。天然に存在する型の結合とは、切断されて人工的に再結合されたものを指してもよく、さらには、例えば、組換えDNA技術などの遺伝子工学手法を適用して人工的に導入された構造を有するものを指してもよい。
【0013】
本明細書で「抗体A」とは、抗原X特異的な抗体であり、典型的な場合IgG抗体が挙げられる。抗体Aは、哺乳動物由来のもの、例えば、マウス、ラット、モルモット、ウサギ、ヤギ、ヒツジなどから得られたものが挙げられ、ポリクローナル抗体であってもよいし、モノクローナル抗体であってよい。典型的なものとしては、モノクローナル抗体が挙げられ、例えば、マウスモノクローナルIgG抗体が挙げられる。一つの具体的な態様では、抗パルボウイルスB19抗原マウスIgG抗体が挙げられ、より好適には抗パルボウイルスB19抗原マウスモノクローナルIgG抗体を使用することができる。IgGには、マウスIgG1, IgG2a, IgG2b、モルモットIgG1, IgG2などのサブクラスのものが含まれてよい。抗体Aは、これらのものを種々のタンパク質分解酵素、例えば、ペプシン、パパイン、トリプシンなどで消化して得られた抗体断片(抗体フラグメント)、還元処理されて遊離のHS-基を有する抗体フラグメント、H-Lペア抗体なども含まれてよく、例えば、Fab、F(ab')2なども含まれてよい。
【0014】
本明細書で「抗体B」とは、ヒト由来の抗体、すなわち、ヒト血液、例えば、ヒト血漿から得られたIgM、IgA、IgE、IgD抗体などが挙げられ、代表的には、非特異的IgM、IgA、IgE、IgD抗体などが挙げられる。抗体Bは、ポリクローナル抗体であってよい。一つの具体的な態様では、ヒトIgM抗体が挙げられる。抗体Bは、サブクラスのものが含まれてよいし、さらに当該抗体を種々のタンパク質分解酵素、例えば、ペプシン、パパイン、フィシン、トリプシンなどで消化して得られた抗体断片(抗体フラグメント)、還元処理されて遊離のHS-基を有する抗体フラグメントなども含まれてよく、例えば、Fc5μ-H、F(ab')2、2-アミノエタンチオール(2-Aminoethanethiol: 2-AE)で還元されているヒトIgM抗体、ヒトIgMμ鎖(70K)なども含まれてよい。
【0015】
本発明の人工抗体は、抗体−抗体コンジュゲートであり、抗体-抗体間架橋化物(クロスリンク体)が包含され、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得ることができる。複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)する方法としては、蛋白質と蛋白質を化学的にコンジュゲート(クロスリンク)する様々な方法がそのまま利用可能であり、当該分野で知られた方法から適宜選択して使用できる。従って、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)する方法は、以下に列挙した方法に限られるものではないが、例えば教科書「Bioconjugate Techniques:Greg T. Hermanson著、Academic Press, 1996, Elsevier」に記述されているクロスリンキングの手法を用いることができる。例として、EDAC(N-(3-Dimethylaminopropyl)-N'-ethyl carbodiimide hydrochloride)+Sulfo-NHS(N-hydroxysulfosuccinimide)法、Glutaraldehyde法、SMCC/SMHC/SMBC法、SMCC-Iminothiolane(Traut's Reagent)法、Imidate(Dimethyl pimelimidate)法、Bismaleimide (o-PDM, BMDB), Trismaleimide(TMEA)法などがコンジュゲート(クロスリンク)する方法として挙げられる。また、市販のクロスリンキング試薬を使用して行うことが便利である。本発明の一つの態様では、抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲート(クロスリンク)させることができる。また、クロスリンキングに際しては、抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体の混合物に上記クロスリンキング試薬を添加するOne-Step法や抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体の一方、または両方のそれぞれにクロスリンキング試薬を添加、精製後に混合するTwo-Step法を用いてもよい。
【0016】
該リンカーとしては、2価の有機基が挙げられるが、3価又はそれ以上の価数を有する有機基であってもよく、好適には化学合成リンカーが包含される。有機基としては、炭素原子の鎖を有するもの、あるいはその炭素原子の代わりに、硫黄原子、酸素原子及び窒素原子からなる群から選択されたものを含有しているものなどが挙げられ、例えば、任意に置換されていてもよい、アルキレン鎖(-O-、-S-、-NH-などからなる群から選択されたものを鎖中に含むものを包含する)、シクロアルキル部を有するもの、2価のアリール基、アルデヒドから誘導された2価の基、アミノ酸から誘導された残基、脂肪族又は芳香族のジカルボン酸から誘導された残基などや当該分野で当業者に知られているものが挙げられる。
【0017】
本発明で対象とするウイルスとしては、抗原特異的ヒト免疫グロブリン測定の対象として当業者に知られたものであれば特には限定されるものではないが、例えば、ウイルスによる感染の有無を判定する目的で行われるものが含まれる。ウイルスとしては、HIV、HTLV-1、HCV、HBs抗原、HBc抗原、HBe抗原、サイトメガロウイルス、単純ヘルペスI、水痘ヘルペス、麻疹などが挙げられる。
【0018】
本免疫学的抗ウイルス抗体測定、特には抗ウイルス抗原ヒトIgM抗体測定は、免疫検査に必要な機能を備えた全自動免疫測定装置、例えば、全自動化学発光免疫装置で行うのに適したものであることができる。該全自動化学発光免疫装置は、普通、検体の受け入れと測定部位への移送を行うサンプラートラック機構、化学発光測定を行うプロセッシング機構、消耗品である洗浄液、反応試薬などの補給と廃棄物の処理を行うサプライ機構、システム全体の操作並びに制御を行うシステムコントロール機構を備えているようなものが好ましい。該サンプラートラック機構のうちには、各種のサンプルカップや試験管に対応し、さらに様々な大きさのものに対応している形態のものとされ、少量検体についても、バーコード読み取り機構を利用して検体の同定管理が可能とされており、さらに、ランダムアクセスや継続的なアクセスによるサンプリングが可能とされ、緊急的な検体測定も可能とされているなどの機構が挙げられる。検体の追加、取り外しがいつでも、当該装置全面から行うことが可能とされ、さらに検体IDユニットを備えバーコード情報が読み取り可能とされていることが好ましく、例えば、検体ラックをセットすると直ちにバーコード情報が読み取られ、測定を開始できるようにされている装置であってよい。また、検体ラックトランスポータは、検体ラックをセットすると直ちに動作可能とされ、3次元での検体ラック搬送を実現できるような機構を備えたものが好ましく、処理効率に応じた最適検体ラックポジションへの移送、サンプリングのための検体ラックの各モジュールへの分配、優先処理の最適化を図ることが可能な機構を備えているものとすることも可能である。
【0019】
該プロセッシング機構としては、多数の試薬ボトルを同時搭載可能とされ、1モジュールで莫大な数のテストが可能とされているものが好適であり、例えば、25個の試薬ボトルを同時搭載し、500テスト用の試薬ボトルが使用可能になっていて、1モジュール最大12,500テストが可能となっている能力を備えるものとされていることもできる。該プロセッシング機構には、冷却機能付き試薬カセロールにより、試薬を搭載したまま長時間安定に保持できる機能、試薬につき、項目名、ロットナンバー、テストサイズ、使用期限、マスターキャリブレーション情報などをバーコード自動読み取りにより管理可能とされる機能、検体量不足、気泡、血餅などの異常を感知できるプレシャーモニタリング機能、キャリーオーバーを低減するサンプルピペッタなどが含まれていることができる。キャリーオーバーの低減は、サンプルプローブの洗浄を強化せしめたり、また、自動位置調整機能を備えることにより達成されるものであることができる。該プレシャーモニタリング機能では、例えば、サンプリング・分注時の液圧の常時モニタリングにより、プローブの詰まりや気泡を検知可能とされ、誤った報告を防止できるようにされることが挙げられる。該サプライ機構には、化学発光に適した試薬、例えば、多くの数のテストに対応する数のトリガー試薬(希釈緩衝液)、プレトリガー試薬(希釈緩衝液)を保管可能とする機能、固型廃棄物用の廃物コンテナを備えるとともに、廃液については検査室の廃液口に自動廃液可能とする機能などが含まれていることができる。該システムコントロール機構としては、モニター画面上のスクリーンにタッチすることで操作可能となっている機能、各モジュールの状況が一目で判別可能とされているスナップショット画面形成機能、多数のテストの測定結果並びに多数のテストのQC結果を保存する機能などが含まれているものであってよい。全自動化学発光免疫装置の例としては、免疫測定装置アーキテクトTMアナライザーシリーズ(米国アボットラボラトリーズ: Abbott Laboratories)、例えば、アボット アーキテクトTMi2000 (Abbott ARCHITECTTMi2000)などが挙げられる。
【0020】
本発明では、上記人工抗体をヒトIgM測定系の陽性コントロール、またはキャリブレーターとして使用して、免疫学的にヒト抗パルボウイルスB19 IgM型抗体を測定する方法が行われる。当該免疫学的抗パルボウイルスB19 IgM抗体測定は、検体を固相化ウイルスB19抗原で処理して、固相に抗パルボウイルスB19抗体(抗パルボウイルスB19 IgMを含む)を捕捉した後、標識された抗ヒトIgM抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)することを特徴としているものであってよい。この場合、例えば、免疫学的にヒト抗パルボウイルスB19 IgM抗体を測定する方法は、検体を固相化ウイルスB19抗原、すなわち、固相化組換えヒトパルボウイルスB19抗原で処理して、固相にヒトIgM抗体を捕捉した後、標識された抗ヒトIgM抗体、例えば、ペルオキシダーゼ標識あるいはアクリジニウム誘導体標識マウスモノクローナル抗ヒトIgM抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)できる。
【0021】
また、該免疫学的抗パルボウイルスB19 IgM抗体測定法は、検体を固相化抗ヒトIgM抗体で処理して、固相にヒトIgM(ヒト抗パルボウイルスB19 IgMを含む)を捕捉した後、ウイルス抗原、すなわち、パルボウイルス抗原を反応せしめ、次に標識された抗パルボウイルスB19抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)することを特徴としているものであってよい。当該免疫学的抗パルボウイルスB19 IgM抗体測定法は、検体を固相化抗ヒトIgM抗体、例えば、固相化マウスモノクローナル抗ヒトIgM抗体で処理して、固相にヒトIgM抗体を捕捉した後、ウイルス抗原、すなわち、組換えヒトパルボウイルスB19抗原を反応せしめ、次に標識された抗ヒトパルボウイルスB19抗体、例えば、ペルオキシダーゼ標識あるいはアクリジニウム誘導体標識マウスモノクローナル抗ヒトパルボウイルスB19抗体を反応せしめ、標識を測定することにより、ヒト抗パルボウイルスB19 IgM抗体を測定(定量測定を含む)することを特徴としているものであってよい。または、標識された組換えヒトパルボウイルスB19抗原を反応せしめ、その標識を直接測定することも可能である。
【0022】
該ウイルス抗原としては、培養したウイルス等から精製したタンパク質や、組換えタンパク質として産生されたものが挙げられ、後者の例として、大腸菌発現系、酵母発現系、バキュロウイルス発現系などを使用して得られたものが挙げられる。
本発明で使用できるヒトパルボウイルスB19抗原としては、組換えタンパク質として産生されたものが挙げられ、例えば、大腸菌発現系、バキュロウイルス発現系などを使用して得られたものが挙げられる。組換えヒトパルボウイルスB19抗原としては、構造タンパク質VP1及びVP2、それらのN末端側あるいはC末端側ペプチド、non-structural protein-1 (NS1)、それらの任意の混合物などが挙げられる。
代表的な抗体測定用抗原としては、RIDATM LINE Parvovirus B19 IgG, IgM (Art. No. LB 6023 (IgG), LB 6033 (IgM): R-Biopharm AG, Darmstadt, Germany)のパンフレットに開示のもの、例えば、VP2, VP-2p, VP-2r, VP-N, VP-C, VP-1s, NS-1, VP1など、Dimitri Peterlana et al., Clinica Chimica Acta, 372, pp.14-23 (2006) に開示のもの、例えば、VP1, VPなど、recomBlot Parvovirus B19 IgG/IgM 及びrecomWell Parvovirus B19 IgGとrecomWell Parvovirus B19 IgM (Mikrogen GmbH, Martinsried, Germany) のパンフレットに開示のもの、例えば、VP-1, VP-2, VP-N, VP-C, VP-1S, NS-1, rVP-1/2-N, rVP-1/2-C, rVP-1-S, rNS-1などであってもよく、適宜、それらから選択されたものであってよい。好ましくは、バキュロウイルス発現抗原タンパク質を使用でき、また抗原タンパク質は、複数抗原タンパク質の混合物であってもよい。
本免疫学的抗ウイルス抗体測定、例えば、抗パルボウイルスB19 IgM抗体測定において使用する免疫測定方法は、例えば、競合法、サンドイッチ法等の公知のいずれの方法であってもよいが、特にサンドイッチ法が好ましい。化学発光免疫測定法(chemiluminescent immunoassay: CLIA)が好適に使用できる。代表的なサンドイッチ法として、例えば、2ステップサンドイッチ法が挙げられる。
【0023】
本測定方法において用いる抗ウイルス抗体(抗ヒトパルボウイルスB19抗体、さらには標識抗体、例えば、標識抗ヒトパルボウイルスB19抗体を包含する)は、ポリクローナル抗体およびモノクローナル抗体のいずれであってもよく、好適にはモノクローナル抗体、例えば、マウスモノクローナル抗体を挙げることができ、更に、好ましくはIgG抗体が挙げられる。また、これら抗体はFab、F(ab’)2等の抗体フラグメントであってもよい。
本免疫学的抗ウイルス抗体測定法(免疫学的抗パルボウイルスB19 IgM抗体測定法を含む)において使用する固相、特にはサンドイッチ法で用いる固相としては、周知のマイクロプレート、ポリスチレンビーズ、ガラスビーズ、ラテックス粒子、磁性粒子等が挙げられ、特に好ましくは磁性マイクロ粒子(磁性マイクロパーティクル:μ-P)が挙げられる。標識抗体への標識剤としては、蛍光物質、発光物質、ペルオキシダーゼなどの酵素、放射性同位元素等が挙げられ、特に好ましくはアクリジニウム誘導体、例えば、10-(3-スルホプロピル)-N-(p-トルエンスルホニル)-N-(カルボキシエチル)-9-アクリジニウムカルボキサミドなどが挙げられる。アクリジニウム誘導体は、米国特許明細書第5,468,646号、同第5,543,524号などに記載のものなどが挙げられる。固相又は標識物への抗体を結合させる方法としては、周知の物理的吸着方法、化学的な反応による結合方法が挙げられる。抗ヒトパルボウイルスB19抗体の作製用抗原として用いられるヒトパルボウイルスB19抗原は、公知の方法、例えば特開平7-147986号に記載されている方法にしたがって作製することができる。
【0024】
一つの態様において、2ステップサンドイッチ法では、パルボウイルスB19抗原(例えば、バキュロウイルス発現組換え(リコンビナント:recombinant)パルボウイルスB19抗原)を磁性マイクロパーティクル(μ-P)に結合してある固相化抗原を検体と接触せしめ、インキュベーション処理後、磁石の影響下、B/F分離及び洗浄を行い、次に該マイクロパーティクルをアクリジニウム誘導体で標識されている抗ヒトIgM抗体コンジュゲートと接触せしめ、インキュベーション処理し、その後、磁石の影響下、B/F分離及び洗浄を行い、標識を測定することにより、抗パルボウイルスB19 IgMを測定(定量測定を含む)する。標識の測定は、例えば、プレトリガー液やトリガー液を使用して標識アクリジニウムを化学発光を起こす分子種に変換するなどして達成される。プレトリガー液としては、例えば、過酸化水素を含む酸性溶液などが挙げられ、アクリジニウム標識抗体を磁性マイクロパーティクル上から切り離し、アクリジニウムを溶液中に均一に溶出させる。トリガー液としては、例えば、Triton X-100を含む水酸化ナトリウム溶液などが挙げられ、発光反応を発生させる。
本発明では、輸血用血液や血液分画製剤原料の血液に付き、ヒトパルボウイルスB19による問題とされる汚染の有無を高感度に検出することが可能であり、その操作も大量処理に適した、且つ迅速処理が可能なものであり、全自動血液スクリーニングシステムを利用できるので、非常に便利で優れている。
血液試料中のヒトパルボウイルスB19抗体測定については、例えば、Matthias F.C. Beersma et al., Journal of Clinical Virology, 34, pp.71-75 (2005)、Dimitri Peterlana et al., Clinica Chimica Acta, 372, pp.14-23 (2006)並びにそこで引用された文献を参照することができるし、それらは本明細書の一部としてその内容はここに含められてよい。
【0025】
具体的な態様の一つでは、本発明は、ヒト検体中のウイルス測定検出法、例えば、抗ウイルス抗体、特には抗ウイルス IgM測定検出法において、(1)測定検体試料を、磁性粒子に固相化されたパルボウイルスB19抗原と接触せしめる工程、磁石の影響下にB/F分離及び洗浄処理する工程、磁性粒子固相に結合しているパルボウイルスB19抗原-抗パルボウイルスIgM型抗体複合体(コンプレックス)と標識化された抗ヒトIgM抗体とを接触せしめる工程、磁石の影響下にB/F分離及び洗浄処理する工程、標識を指標にヒト抗パルボウイルスIgM型抗体を定量する工程、あるいは、(2)測定検体試料を、固相化された抗ヒトIgM抗体と接触せしめる工程、B/F分離及び洗浄処理する工程、固相に結合している抗ヒトIgM抗体-抗パルボウイルスIgM複合体(コンプレックス)とパルボウイルスB19抗原とを接触せしめる工程、B/F分離及び洗浄処理する工程、固相に結合している抗ヒトIgM抗体-抗パルボウイルスIgM-パルボウイルスB19抗原複合体(コンプレックス)と標識化された抗ヒトパルボウイルスB19抗体とを接触せしめる工程、B/F分離及び洗浄処理する工程、標識を指標にヒト抗パルボウイルスIgM型抗体を定量する工程、または、標識された組換えヒトパルボウイルスB19抗原を反応せしめ、その標識を直接的に測定して、ヒト抗パルボウイルスIgM型抗体を定量する工程、を含んでいる抗パルボウイルスIgM免疫学的測定方法を行い、または、(3)測定検体試料を、標識された組換えヒトパルボウイルスB19抗原と反応せしめ、その標識を直接的に測定して、ヒト抗パルボウイルスIgM型抗体を定量する工程、を含んでいる抗パルボウイルスB19 IgM免疫学的測定方法を行い、さらに、上記人工抗体を当該測定系の陽性コントロール、またはキャリブレーターとして使用して、ヒト抗パルボウイルスIgM型抗体の免疫学的測定結果を得て、当該検体中のパルボウイルスB19汚染の有無を決定することを特徴とするものである。
当該人工抗体を含有する検体は、上記測定検体試料と同様に処理されて、陽性コントロール、またはキャリブレーターとしての免疫学的測定結果を与えることとなる。
【0026】
以下に実施例を掲げ、本発明を具体的に説明するが、この実施例は単に本発明の説明のため、その具体的な態様の参考のために提供されているものである。これらの例示は本発明の特定の具体的な態様を説明するためのものであるが、本願で開示する発明の範囲を限定したり、あるいは制限することを表すものではない。本発明では、本明細書の思想に基づく様々な実施形態が可能であることは理解されるべきである。全ての実施例は、他に詳細に記載するもの以外は、標準的な技術を用いて実施したもの、又は実施することのできるものであり、これは当業者にとり周知で慣用的なものである。本発明の人工抗体の利用方法は、抗パルボウイルスB19ヒトIgM測定系の陽性コントロール、またはキャリブレーターに限られるものではないが、以下、抗パルボウイルスB19抗原ヒトIgM測定系の場合で、上記課題を解決するための手段を説明する。
【実施例1】
【0027】
〔抗パルボウイルスB19ヒトIgM測定〕
米国Abbott LaboratoriesのARCHITECTTMシステムを用いて実施した実施例を示す。本免疫測定装置は、システムコントロールセンター(System Control Center, SCC)、プロセッシングモジュール(Processing Module, PM)、そしてサンプルハンドラー(Sample Handler, SH)から構成され、さらにプロセッシングモジュールの主要部分はプロセッシングセンターと呼ばれ、25項目の試薬を同時搭載できる試薬カローセルを備え、その周りにプロセスパスがあって、該プロセスパス内を反応セルが移動し、周りにサンプルピペッター、試薬ピペッター、内部攪拌装置、ウオッシュゾーンなどが配置されている。反応セルは、プロセスパス内を1ステップずつ移動しながら、それぞれのポジションへ移送される。プロセッシングセンター内には1200個の反応セルを収容できる。また、ダブルトレーも利用可能とされている。本装置は、輸血用血液の安全性を向上させ、効率的な血液供給を行うに適して全自動血液スクリーニングシステムである。独自の化学発光免疫測定法による優れた感度と特異性に加え、大量検体の処理を実現する。
本システムでは、高発光量の得られるアクリジニウム誘導体を標識に使用しているので、試薬の高い安定性(検量線の安定化、日差再現性の向上)、高い発光収率(感度の向上、測定範囲の拡張)が達成できる。また、磁性マイクロパーティクルを利用しているので、固相を磁石で押さえた状態で短時間のB/F分離、洗浄が可能となっており、内部攪拌装置で簡単に磁性マイクロパーティクルを分散させるので、均一な免疫反応が得られ、さらにプラスチック性消耗品の損耗が大幅に低減し、大量のテストを連続的に行うことができ、短時間で大量の検体の測定が可能である。
【0028】
本法の原理は、検体をサンプルピペッターが反応セルに分注した後、試薬ピペッターが試薬カローセルから磁性マイクロパーティクル液をその反応セルに分注する。次に内部攪拌装置で反応セル内の混合液を攪拌した後に、適温、例えば、37℃に維持されたプロセスパス内を移動しながら所要時間インキュベーションされる。かくして、検体、検体希釈液、及び抗原あるいは抗体を固相化した磁性マイクロパーティクル懸濁液をインキュベーションして、検体中の抗体あるいは抗原を特異的にマイクロパーティクル上の抗原あるいは抗体に反応させる(一次反応)。次に反応セルはウオッシュゾーンを通過し、永久磁石などを使用しての磁場の影響下にB/F分離及び磁性マイクロパーティクルの洗浄が希釈緩衝液を使用して行われる。次にアクリジニウム誘導体で標識された特異抗体の入ったコンジュゲート溶液を反応セルに分注し、内部攪拌装置で攪拌した後に、プロセスパス内を移動しながら所要時間インキュベーションされる。標識抗体は、磁性マイクロパーティクル上の測定目的物と結合する。すなわち、反応生成物は、アクリジニウム標識コンジュゲートにより検出される(二次反応)。このコンジュゲートは、アクチベータ溶液の存在下で化学発光を引き起こし、それを光電子増倍管で検出するものである。典型的には当該アクチベータ溶液としては、プレトリガー液とトリガー液とから構成されていてよく、該プレトリガー液は、アクリジニウム標識抗体を磁性マイクロパーティクル上から切り離して、アクリジニウムを反応溶液中に均一な状態で存在するように溶出せしめる働きのものであり、該トリガー液は、アクリジニウムを活性化して、例えば、アクリジニウムを酸化して、発光反応を生ぜしめる働きを持つものが挙げられる。
【0029】
ARCHITECTTM Parvovirus B19 IgM 試薬は、化学発光免疫測定法(CLIA法)による 抗パルボウイルスB19ヒトIgM測定試薬であり、B/F分離には磁性粒子(以下、マイクロパーティクル)を用いている。
反応様式は以下の通り。
1) 検体中の抗パルボウイルスB19ヒトIgM抗体は、マイクロパーティクルに固相化された抗ヒトIgMマウスモノクローナル抗体にキャプチャーされる。そこにアクリジニウム標識リコンビナントパルボウイルスB19抗原をプローブとして結合させ、マイクロパーティクル固相化抗ヒトIgMマウスモノクローナル抗体抗パルボウイルスB19ヒトIgM抗体−アクリジニウム標識リコンビナントパルボウイルスB19抗原の複合体を形成する。
2) インキュベーション後、マイクロパーティクルは磁石によって反応セルの管壁に引きつけられる。この状態での洗浄操作により、未結合物質が除去される。
3) プレトリガー(過酸化水素水を含む酸性溶液)及びトリガー(水酸化ナトリウム溶液)の添加により、アクリジニウムが酸化され、化学発光反応が起こる。このときの発光量は、RLU(相対的化学発光ユニット)という単位で表すことができる。
【0030】
4) 抗体測定系に必要な陽性コントロール、またはキャリブレーターのソースとなりうる人工抗体は、そのヒトIgMの性質のために、抗ヒトIgMマウスモノクローナル抗体(ヒトIgMのFc領域を認識する)にキャプチャーされ、またヒトIgMにクロスリンクされた抗パルボウイルスB19抗原マウスIgG抗体によってアクリジニウム標識リコンビナントパルボウイルスB19抗原プローブと結合することにより、検体中の抗パルボウイルスB19ヒトIgM抗体と同様の複合体を形成することができる。
また、このときの発光量は、およそ人工抗体の性能(抗パルボウイルスB19ヒトIgM抗体らしさ)に比例するので、抗パルボウイルスB19抗原マウスIgG抗体とヒトIgM抗体を化学的にコンジュゲート(クロスリンク)させて得られた人工抗体の性能評価が可能となる。
尚、抗ヒトIgMマウスモノクローナル抗体は、ヒトIgMのFc領域や重鎖(IgMのμH鎖)を認識してキャプチャーするので、コンジュゲート(クロスリンク)に使用可能なヒトIgMとしては、必ずしもIgM全体を必要とせず、還元して調製したIgMのμH鎖や、トリプシン消化で得られるFc-5μHで置き換えることも可能である。
【0031】
〔抗パルボウイルスB19 IgM模倣体抗体の調製と陽性コントロール活性の評価〕
ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)のモル比を1:2.5、1:5、1:10として、ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体との混合物に、EDACとSulfo-NHSを添加して、コンジュゲート(抗パルボウイルスB19 IgM模倣体抗体)を形成した。EDACとSulfo-NHSの濃度を3条件で、コンジュゲート(抗体間クロスリンク)を実施した。一定時間(2.5, 8, 25hrs)室温で反応させた後に、本混合物をキャリブレーター(Calibrator)希釈液(1%BSA, Proclin300, Proclin950入り)で50μg/mL(IgMとC-6-3の総濃度)に希釈して、Alternative陽性コントロール試料として使用し、ARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。
EDAC / Sulfo-NHS法で調製したヒトIgMと抗パルボウイルスB19マウスIgG抗体(抗体名:C-6-3)とのコンジュゲートをARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。表1に、使用抗体のモル比、EDACとSulfo-NHSの濃度条件、コンジュゲート化反応条件、そして結果を示す。さらに図1に測定結果をグラフとして示す。
【0032】
【表1】

【0033】
上記表1において、「8hrs希釈で25hrsでAssay」とは、ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体との混合物に、EDACとSulfo-NHSを添加して、8hrs、室温で反応させた後に、得られた混合物をキャリブレーター希釈液で希釈して25hrs静置した後、Alternative陽性コントロール試料として使用し、ARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価したものである。
【実施例2】
【0034】
〔抗パルボウイルスB19 IgM模倣体抗体の調製と陽性コントロール活性の評価〕
ヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)のモル比を1:5、1:10、1:20として、25%グルタルアルデヒド(Glutaraldehyde)液を1μL, 3μL添加条件で、コンジュゲート(クロスリンク)を実施した。2〜8℃で2hrs反応させた後にQuenchingを行った。本混合物をキャリブレーター希釈液(1%BSA, Proclin300, Proclin950入り)で50μg/mL(IgMとC-6-3の総濃度)に希釈して、ARCHITECTTMシステムを用い、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。
グルタルアルデヒドでヒトIgMと抗パルボウイルスB19マウスIgG抗体(抗体名:C-6-3)コンジュゲートを調製し、本コンジュゲートを使用して、ARCHITECTTMシステムを用い、実施例1と同様に処理し、ARCHITECTTM Parvovirus B19 IgM 試薬で評価した。結果を表2及び図2に示す。
【0035】
【表2】

【実施例3】
【0036】
ヒトIgMにSMCCによりマレイミド基を導入し、一方、抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)にIminothiolaneによりチオール基を導入した。両者のモル比を1:4.6、1:9.2、1:18.4として、コンジュゲート(クロスリンク)を実施した。2hrs反応させた後にキャリブレーター希釈液(1%BSA, Proclin300, Proclin950入り)で10倍、20倍希釈して、ARCHITECTシステムを用い、ARCHITECT Parvovirus B19 IgM 試薬で評価した。
SMCC-Iminothiolane(Traut's Reagent)法で、ヒトIgMと抗パルボウイルスB19マウスIgG抗体(抗体名:C-6-3)コンジュゲートを調製し、本コンジュゲートを使用して、ARCHITECTシステムを用い、ARCHITECT Parvovirus B19 IgM 試薬で評価した。結果を表3及び図3に示す。
【0037】
【表3】

【0038】
抗パルボウイルスB19抗原マウスIgG抗体又はそのフラグメントとヒトIgM抗体又はそのフラグメントの化学的なコンジュゲーション(クロスリンキング)を、EDAC (N-(3-Dimethylaminopropyl)-N'-ethyl carbodiimide hydrochloride) + Sulfo-NHS (N-hydroxysulfosuccinimide)法、Glutaraldehyde法、SMCC/SMHC/SMBC法、SMCC-Iminothiolane (Traut's Reagent)法、Imidate (Dimethyl pimelimidate)法、Bismaleimide (o-PDM, BMDB), Trismaleimide (TMEA)法など様々なクロスリンキングの手法を用いて実施した結果を表4にまとめた。
【0039】
【表4】

上記したように、本発明の、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートは、それら元の抗体が有していた複数の性質を有することを特徴とする人工抗体であり、抗体模倣体として機能する。例えば、抗ウイルスIgG抗体とヒトIgM抗体とが化学的にコンジュゲートされている、抗ウイルスIgG-ヒトIgM抗体コンジュゲートは、特定のウイルス抗原を認識し且つヒトIgMの性質を有する人工抗体であり、ヒト抗ウイルスIgM抗体模倣体として機能し、抗ウイルス抗原ヒトIgM抗体測定方法で用いる陽性コントロール、またはキャリブレーターとして有用である。特に、抗パルボウイルスB19マウスIgG抗体(又はそのフラグメント抗体)とヒトIgM抗体(又はそのフラグメント抗体)を化学的にコンジュゲートすることにより得られる、抗パルボウイルスB19マウスIgG(又はそのフラグメント抗体)-ヒトIgM(又はそのフラグメント抗体)コンジュゲート(架橋体)は、パルボウイルスB19抗原を認識し且つヒトIgMの性質を有する人工抗体として機能し、抗パルボウイルスB19抗原ヒトIgM抗体測定方法で、陽性コントロール、またはキャリブレーターとして有用であり、抗パルボウイルスB19抗原ヒトIgM抗体の代替物として機能する。
【産業上の利用可能性】
【0040】
本発明の、複数種類の抗体(免疫グロブリン)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートは、それら元の抗体が有していた複数の性質を有することを特徴とする人工抗体であり、抗体模倣体として機能する。したがって、従来、陽性コントロール、またはキャリブレーターの安定確保が困難であることから、実施が困難であった抗体測定系の開発・実施に役立つ。
本発明は、前述の説明及び実施例に特に記載した以外も、実行できることは明らかである。上述の教示に鑑みて、本発明の多くの改変及び変形が可能であり、従ってそれらも本件添付の請求の範囲の範囲内のものである。
【図面の簡単な説明】
【0041】
【図1】コンジュゲート化剤(架橋化剤)としてEDACとSulfo-NHSを使用してヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートにつき、ARCHITECTTM Parvovirus B19 IgM 試薬を使用しての測定系で測定した結果(各コンジュゲート調製条件毎)を示す。
【図2】コンジュゲート化剤(架橋化剤)としてグルタルアルデヒドを使用してヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートにつき、ARCHITECTTM Parvovirus B19 IgM 試薬を使用しての測定系で測定した結果(各コンジュゲート調製条件毎)を示す。
【図3】コンジュゲート化剤(架橋化剤)としてSMCC及びIminothiolaneを使用してヒトIgMと抗パルボウイルスB19抗原マウスIgG抗体(抗体名:C-6-3)を化学的にコンジュゲートすることにより得られた抗体コンジュゲートにつき、ARCHITECTTM Parvovirus B19 IgM 試薬を使用しての測定系で測定した結果(各コンジュゲート調製条件毎)を示す。
【特許請求の範囲】
【請求項1】
抗体Aと抗体Bをコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、且つ、AとBの両者の性質を有する人工抗体、あるいは複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得られた複数種類の抗体間コンジュゲートであり、且つ、複数の性質を有する人工抗体であることを特徴とする人工抗体。
【請求項2】
抗体Aがある抗原X特異的IgG抗体であり、抗体Bが非特異的IgM、IgA、IgE及びIgD抗体からなる群から選択されたもので、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、ある抗原X特異的で且つIgM、IgA、IgE及びIgD抗体からなる群から選択されたものの性質を有することを特徴とする請求項1に記載の人工抗体。
【請求項3】
抗体Aがマウス、ラット、モルモット、ウサギ、ヤギ及びヒツジからなる群から選択された抗体であり、抗体Bがヒト抗体であることを特徴とする請求項1又は2に記載の人工抗体。
【請求項4】
抗体Aが抗パルボウイルスB19抗原マウスIgG抗体であり、抗体Bが非特異的なヒトのIgM抗体で、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートが、パルボウイルスB19抗原を認識し且つヒトIgM抗体の性質を有するものであることを特徴とする請求項1〜3のいずれか一に記載の人工抗体。
【請求項5】
抗体Aがモノクローナルまたはポリクローナル抗体であり、抗体Bがポリクローナルであることを特徴とする請求項1〜4のいずれか一に記載の人工抗体。
【請求項6】
免疫学的抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、請求項1〜5のいずれか一に記載の人工抗体を利用すること。
【請求項7】
抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、請求項4記載の人工抗体を利用すること。
【請求項1】
抗体Aと抗体Bをコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、且つ、AとBの両者の性質を有する人工抗体、あるいは複数種類の抗体(免疫グロブリン)を化学的にコンジュゲート(クロスリンク)することにより得られた複数種類の抗体間コンジュゲートであり、且つ、複数の性質を有する人工抗体であることを特徴とする人工抗体。
【請求項2】
抗体Aがある抗原X特異的IgG抗体であり、抗体Bが非特異的IgM、IgA、IgE及びIgD抗体からなる群から選択されたもので、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートであり、ある抗原X特異的で且つIgM、IgA、IgE及びIgD抗体からなる群から選択されたものの性質を有することを特徴とする請求項1に記載の人工抗体。
【請求項3】
抗体Aがマウス、ラット、モルモット、ウサギ、ヤギ及びヒツジからなる群から選択された抗体であり、抗体Bがヒト抗体であることを特徴とする請求項1又は2に記載の人工抗体。
【請求項4】
抗体Aが抗パルボウイルスB19抗原マウスIgG抗体であり、抗体Bが非特異的なヒトのIgM抗体で、両者を化学的にコンジュゲート(クロスリンク)することにより得られた抗体間コンジュゲートが、パルボウイルスB19抗原を認識し且つヒトIgM抗体の性質を有するものであることを特徴とする請求項1〜3のいずれか一に記載の人工抗体。
【請求項5】
抗体Aがモノクローナルまたはポリクローナル抗体であり、抗体Bがポリクローナルであることを特徴とする請求項1〜4のいずれか一に記載の人工抗体。
【請求項6】
免疫学的抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、請求項1〜5のいずれか一に記載の人工抗体を利用すること。
【請求項7】
抗パルボウイルスB19抗原ヒトIgM抗体測定方法で用いる陽性コントロールまたはキャリブレーターとして、請求項4記載の人工抗体を利用すること。
【図2】


【図3】


【図1】




【図3】


【図1】


【公開番号】特開2008−290964(P2008−290964A)
【公開日】平成20年12月4日(2008.12.4)
【国際特許分類】
【出願番号】特願2007−137603(P2007−137603)
【出願日】平成19年5月24日(2007.5.24)
【出願人】(000109015)アボットジャパン株式会社 (14)
【Fターム(参考)】
【公開日】平成20年12月4日(2008.12.4)
【国際特許分類】
【出願日】平成19年5月24日(2007.5.24)
【出願人】(000109015)アボットジャパン株式会社 (14)
【Fターム(参考)】
[ Back to top ]

