抗体に結合可能な蛋白質発現ミエローマおよびこれを用いる細胞融合方法並びに交雑細胞およびその選別方法
【課題】抗体に結合可能な蛋白質発現ミエローマおよびこれを用いる細胞融合方法並びに交雑細胞およびその選別方法を提供する。
【解決手段】抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる、ミエローマ細胞およびこれを用いる細胞融合方法ならびに抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる、抗体提示交雑細胞およびその選別方法を用いる。
【解決手段】抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる、ミエローマ細胞およびこれを用いる細胞融合方法ならびに抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる、抗体提示交雑細胞およびその選別方法を用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞膜表面への目的物質の提示方法に関し、詳しくは、抗体に結合可能な蛋白質発現ミエローマおよびこれを用いる細胞融合方法並びに交雑細胞およびその選別方法に関する。
【背景技術】
【0002】
これまでに、大腸菌、酵母、動物細胞等を宿主として、有用な物質を生産する技術が開発されてきた。生産された物質は、医薬品、診断試薬等、多くの分野で使用されている。生産される有用物は主に蛋白質であるが、本来各生物が持っている蛋白質のみならず、遺伝子組み換え技術によりその機能を向上あるいは変化させた組換え蛋白質も種々生産されている。
【0003】
これらの組換え蛋白質を作製する場合、その蛋白質をコードする遺伝子に変異を導入することによりその蛋白質の機能を変化させ、変異を入れた遺伝子を宿主に導入し、機能を変化させた蛋白質(変異蛋白質)を生産させる方法が行われている。その場合、変異遺伝子を導入した多数の細胞の中から有効な変異蛋白質を生産する細胞のみを選択する効率的な方法が必要となってくるが、その方法として宿主の細胞膜表層にその細胞が生産する蛋白質を提示させ、提示された蛋白質を指標にして細胞を選択回収する方法がとられている。
【0004】
これらの細胞膜表層への蛋白質の提示技術はいくつか報告されている。例えばファージディスプレー法は、繊維状ファージを宿主として、目的蛋白質をファージのコート蛋白質との融合蛋白質として発現させることにより、ファージ粒子上に提示させている(例えば、非特許文献1参照)。
【0005】
酵母表層ディスプレー法は、酵母を宿主として、目的蛋白質をGPI(グリコシルフォスファチジルイノシトール)アンカー付着シグナルであるαアグルチニンとの融合蛋白質として発現させ、GPIアンカーを介して酵母細胞壁のグルカン層に共有結合することにより酵母細胞表層に提示させている(例えば、非特許文献2参照)。
【0006】
生産される有用物質として抗体を産生する場合は、1975年にモノクローナル抗体の作製法が考案されて以来(例えば、非特許文献3参照)、動物細胞を宿主として抗体の作製が行われるようになった。これらの作製された抗体は、感染症、ガン、心臓疾患などの病気の診断のために用いられる免疫測定法による診断薬に使用されている。
【0007】
また近年では、抗体医薬として抗体を治療薬として使用するようになるにつれ、その効率的な作製法の開発が望まれるようになっている。
【0008】
モノクローナル抗体を作製する場合は、例えばマウスの脾臓細胞とマウスミエローマを細胞融合することにより抗体産生細胞(ハイブリドーマ)を作製し、作製したハイブリドーマの中から目的抗体を産生している細胞を選択する(例えば、非特許文献3参照)。その場合、作製した細胞群を限界希釈法により一つ一つの細胞に単離し、培養した各細胞の培養上清中に放出された抗体を酵素免疫測定法(ELISA:Enzyme−Linked ImmunoSorbent Assay)等により評価することにより、目的抗体を産生する細胞を選択している。
【0009】
【非特許文献1】Smith GP,“Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface.” ,Science, 228巻(4705):1, 315頁, 1985年発行
【非特許文献2】Murai et.al.,“Genetic immobilization of cellulase on the cell surface of Saccharomyces cerevisiae.” Appl. Microbiol. Biotechnol., 48巻, 499−503頁, 1997年発行
【非特許文献3】G. KOHLER(G. ケーラー) & C. MILSTEIN, “Continuous cultures of fused cells secreting antibody of predefined specificity” Nature, 256巻, 495−497頁, 1975年発行
【発明の開示】
【発明が解決しようとする課題】
【0010】
医薬品、診断試薬等に用いられる有用蛋白質を進化工学的手法による遺伝子組み換えにより作製する場合、ライブラリーと呼ばれる無作為に作製した組換え遺伝子を導入した多数の細胞の中から、目的にあった活性を保持した、あるいは遺伝子変異を導入する前の野生型よりも機能の向上した変異蛋白質を生産する細胞のみを選択しなくてはならない。通常このようなライブラリーは、百万個から1億個あるいはそれ以上の細胞群であり、膨大な細胞数であるため、1つ1つの細胞を個々に培養して調べていくことは不可能である。そのためこれらのライブラリーの中から、目的にあった蛋白質を産生する細胞を選択する効率的なスクリーニング方法が必要となるという課題があった。
【0011】
この様に、膨大な数の細胞群の中から目的蛋白質を産生している細胞を効率的にスクリーニングするには、細胞で生産される組換え蛋白質とその組換え蛋白質を産生する細胞が結合していることが望ましい。このような蛋白質とその産生細胞の対応付けがなされていれば、結合した蛋白質を評価することにより、同時にその蛋白質の産生細胞を回収することが可能だからである。
【0012】
そのような生産細胞と蛋白質の対応付けの方法として、ファージディスプレー法や酵母表層ディスプレー法が報告されている。
【0013】
しかしながら、ファージディスプレー法では、ファージ粒子上に蛋白質を発現させた時に蛋白質が活性を保持した状態で高次構造をとらず、活性が消失してしまうという課題があった。また、翻訳後修飾が行われないため、活性に必要な糖鎖の付加やリン酸化が起こらず活性が消失あるいは低減してしまう場合がある。また、高い活性を持った目的蛋白質を発現しているファージの分子数が極めて少ない場合があり、本来選択されるはずの目的細胞を逃してしまう場合があるという課題があった。
【0014】
また、酵母表層ディスプレー法では、提示された蛋白質に糖鎖が付加されるが、付加される糖鎖の構成単糖の種類、配列順序、モル比、単糖相互の結合が必ずしも元の種のそれらと同一のものではなく、活性の低下や消失が起こる場合がある。特に、発現させる蛋白質が抗体の場合、付加される糖鎖の構造の違いにより、その親和性が低下してしまうことが考えられる。
【0015】
また、先に挙げたハイブリドーマから目的抗体を産生する細胞を選択する場合、限界希釈法でそれぞれの細胞を単離し、その培養上清を用いて産生された抗体を評価することにより、目的抗体を産生する細胞を選択する必要があるため、多大な時間と労力を必要とするという課題があった。
【0016】
また、ミエローマと脾臓細胞の細胞融合により得られた細胞の数が少ない場合は、上記の方法により目的細胞を選択することは可能であるが、より高い活性を持つ抗体を生産する細胞が得られない場合があるという課題があった。逆に、細胞融合の効率が向上すれば、得られる細胞数が増加し、膨大な労力と時間がかかり、選択中に細胞の死滅等が起るため、既存の方法による目的細胞の選択は困難であるという課題があった。またこの様に取り扱う細胞数が膨大になった場合、得られた全ての細胞を網羅的に評価し、目的のハイブリドーマを選択回収することは極めて困難である。
【0017】
哺乳類由来の有用蛋白質を動物細胞により生産する方法は、翻訳後修飾、付加される糖鎖構造の観点から、大腸菌などによる生産方法よりも優位性が高い。しかしながら、これまで述べたように遺伝子組み換え蛋白質を作製する場合、大腸菌、ファージ、あるいは酵母により一度目的物質産生細胞のスクリーニングを行い、得られた細胞から目的蛋白質をコードした遺伝子を抽出し、さらにその遺伝子を動物細胞に導入するという方法をとらなくてはならない。そのため、多大な時間と労力を必要とするという課題があった。またこの場合、得られた動物細胞により産生された蛋白質の機能が、前述した翻訳後修飾が原因で、大腸菌、ファージ、あるいは酵母を用いてスクリーニングした時の機能と異なる場合があるという課題があった。
【課題を解決するための手段】
【0018】
本発明者らは上記課題に関し鋭意検討した結果、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させたミエローマ細胞を作製した。さらに該ミエローマ細胞と脾臓細胞とを細胞融合して得られる交雑細胞を培養することにより、抗体提示交雑細胞を作製することで課題を解決できることを見出し、本発明を完成するに至った。以下本発明を詳細に説明する。
【0019】
すなわち本発明は、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる、ミエローマ細胞である。
【0020】
また本発明は、ミエローマ細胞が、マウスあるいはウサギあるいはラット由来の細胞である、上記のミエローマ細胞である。
【0021】
また本発明は、上記のミエローマ細胞と脾臓細胞とを細胞融合する方法である。
【0022】
また本発明は、脾臓細胞が、マウスあるいはウサギあるいはラット由来の細胞である、上記の方法である。
【0023】
また本発明は、上記の細胞融合により得られる抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる交雑細胞である。
【0024】
また本発明は、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる、抗体提示交雑細胞である。
【0025】
また本発明は、上記の抗体提示交雑細胞を、提示された抗体の抗原に対する親和性または特異性の差により選別する、交雑細胞の選別方法である。
【0026】
また本発明は、抗体に結合可能な蛋白質がFcレセプターである、上記の方法である。
【0027】
また本発明は、抗体に結合可能な蛋白質がプロテインGまたはその改変体である、上記の方法である。
【0028】
本発明における抗体に結合可能な蛋白質とは、抗体の抗原結合部位以外の部分で抗体に結合する能力を持っている蛋白質であればよく、例えば哺乳動物のFcレセプター、細菌が作るプロテインG、プロテインA、イムノグロブリン(免疫グロブリン)を認識する抗体などが挙げられる。
【0029】
本発明における抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させる形態は、一つの形態として、細胞の膜蛋白質との融合蛋白質として発現させればよく、例えば細胞膜貫通型蛋白質をアンカー蛋白質としてその末端に目的物質に結合可能な蛋白質を結合した状態で発現させればよい。この場合、両蛋白質の結合順序は、細胞膜貫通型アンカー蛋白質のN末端と抗体に結合可能な蛋白質のC末端が結合していても又はその逆の順序でもよいが、抗体に結合可能な蛋白質が細胞外領域に出ており且つ抗体との結合部位がその結合活性を保持していることが必要である。また、両蛋白質は直接結合しても、両蛋白質の間にリンカーを介して結合してもよい。細胞膜貫通型蛋白質をアンカー蛋白質とする場合は、例えばFcレセプターの細胞膜貫通領域、イムノグロブリンの細胞膜貫通領域などを用いればよい。
【0030】
また、GPIアンカーを利用して、抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させてもよい。その場合、抗体に結合可能な蛋白質はαアグルチニンとの融合蛋白質として発現させればよく、その結合順序、リンカーの有無等は、上述の細胞膜貫通型蛋白質をアンカー蛋白質として用いた場合と同様である。ここでGPIアンカー(glycosylphosphatidylinositol:GPI)とは、真核細胞の細胞膜に結合し細胞膜の外側に蛋白質を繋ぎ止める役割を持つ糖脂質であり、小胞体でGPIアンカーと蛋白質が結合し、ゴルジ体を経て細胞表面に輸送され、細胞膜の外面に蛋白質を出すものである。
【0031】
抗体に結合可能な蛋白質を細胞外に発現させる場合は、抗体に結合可能な蛋白質が細胞外領域に出ており且つ抗体との結合部位がその結合活性を保持していることが必要である。
【0032】
本発明におけるミエローマ細胞は、マウスあるいはウサギあるいはラット由来の細胞のいずれのものでもよいが、一般的にマウスのミエローマ細胞を使用した場合は、次の工程で用いる脾臓細胞は同じ動物種であるマウスの細胞を用いることが好ましい。しかし、場合によってはウサギミエローマ細胞とマウス脾臓細胞の組合せを用いて本発明を行うことも可能である。
【0033】
上述の様に、本発明における脾臓細胞はマウスあるいはウサギあるいはラット由来の細胞のいずれの細胞でもよく、一般的には使用するミエローマ細胞と同じ動物種の細胞を使用すればよいが、異なる動物種の細胞を使用することも可能である。
【0034】
本発明における抗体に結合可能な蛋白質の細胞膜へ結合した状態での細胞外への発現方法は、該抗体に結合可能な蛋白質をコードする遺伝子と上述アンカー蛋白質としての細胞の膜蛋白質をコードする遺伝子とを連結した状態で該細胞内に遺伝子導入し、該細胞の持つ細胞外蛋白質発現機構を利用して発現させればよい。
【0035】
該抗体に結合可能な蛋白質を細胞の蛋白質発現機構を利用して細胞膜表面への発現へ発現させるために必要な遺伝子の構造は、発現プロモーター遺伝子、シグナルペプチドをコードする遺伝子、目的物質に結合可能な蛋白質をコードする遺伝子、上述のアンカー蛋白質をコードする遺伝子、ターミネーター遺伝子がこの順序で並んだ遺伝子が必要である。該発現プロモーター、該シグナルペプチド及び該ターミネーターは、遺伝子導入する宿主細胞で機能するプロモーター、該シグナルペプチド及びターミネーターであればよく、プロモーターはより強力なプロモーターが望ましい。これらの遺伝子を環状あるいは直鎖状に連結したベクターを構築し、細胞に遺伝子導入する。細胞内への遺伝子導入方法は、物理化学的手法、ウイルスベクターを用いた方法等のいずれの方法でもよく、細胞によって適宜選択すればよい。
【0036】
ミエローマ細胞と脾臓細胞とを細胞融合する方法は、一般的に行われるモノクローナル抗体作製法(前記した、G. KOHLER(G. ケーラー) & C. MILSTEIN, “Continuous cultures of fused cells secreting antibody of predefined specificity” Nature, 256巻, 495−497頁, 1975年発行
(非特許文献3))に従ってポリエチレングリコール等を用いた方法で行えばよい。該方法に従って、ミエローマ細胞と脾臓細胞との細胞融合を行うことにより、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を得ることが可能である。
【0037】
本発明における、抗体提示交雑細胞を得るための交雑細胞の培養は、上記方法により得られた交雑細胞から分泌された抗体を、該交雑細胞の細胞膜に結合した状態で細胞外に発現させた抗体に結合可能な蛋白質に結合させるため、該交雑細胞の生育に適した培地で該細胞が該目的物質の生産を開始する細胞密度まで培養すればよい。
【0038】
培養時間は、細胞から分泌された抗体が、抗体に結合可能な蛋白質に結合するために十分な量を分泌する時間であればよい。例えば細胞が対数増殖期後期から定常期に達する細胞密度までに必要な時間、あるいはそれ以上の時間培養すればよい。
【0039】
抗体に結合可能な蛋白質と抗体の結合部位は、それぞれいずれの部位で結合してもかまわないが、好ましくは抗体の結合活性をつかさどる部位以外の部位で結合することが望ましい。例えば抗体に結合可能な蛋白質がそれぞれ抗体とFcレセプターである場合は、抗体の抗原結合部位以外の部位である抗体Fc部位とFcレセプターが結合する。
【0040】
本発明において、該交雑細胞が分泌する抗体に結合可能な蛋白質を、該細胞の膜表面に結合した状態で発現させ、該蛋白質に該分泌抗体を結合させた細胞を用いて、表面に結合した抗体の親和性あるいは特異性の差を測定することにより、抗体産生交雑を選別することが可能である。その場合、細胞表面に結合している抗体の親和性あるいは特異性の差を測定する方法は、該抗体の親和性あるいは特異性を測定するために通常用いられる方法により行えばよい。
【0041】
例えば、ELISA(Enzyme−Linked ImmunoSorbent Assay)による測定や、フローサイトメーター(Flow Cytometer)を用いた測定により行えばよい。あるいは、抗原又は抗体を固定化したカラムを通すことにより、抗体提示交雑細胞上に提示された抗体の抗原に対する親和性あるいは特異性の差によって分離を行ってもよい。あるいは、抗原又は抗体を固定化したビーズと抗体提示交雑細胞上に提示された抗体を反応させ、細胞が結合した該ビーズを回収することにより抗体産生細胞を回収すればよい。
【0042】
本発明におけるFcレセプターとは、抗体重鎖のFc部分に結合する蛋白質であり、ヒト、マウス等由来のものが報告されているが、抗体Fc部分と結合能を持つものであれば、いずれのものでもよい。
【0043】
本発明におけるプロテインGとは、主に抗体重鎖のFc部分に結合する蛋白質であり、ストレプトコッカス由来のものが数種類報告されているが、抗体と結合能を持つものであれば、いずれのものでもよい。
【発明の効果】
【0044】
本発明によれば次の効果を奏することができる。
(1)交雑細胞が分泌する抗体を該交雑細胞膜表面に抗体結合活性を保持した状態で提示させることができ、抗体とそれを分泌する細胞および抗体産生にかかる遺伝子とを対応させて回収することができる。
(2)細胞を個々に単離することなく、種々の交雑細胞が混ざった状態で、該交雑細胞が分泌する抗体の親和性および特異性を測定することが可能であるため、全ての交雑細胞を網羅的に評価することができる。
(3)本発明は、親和性や特異性に優れた抗体の創出等、既存の抗体の高機能化や全く新しい機能を持った抗体の創出を、進化工学的手法に基づく遺伝子組み換えにより行う場合に有効である。
【実施例】
【0045】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0046】
本発明の全体の流れを、図1に示した。図1に示すフローチャートは、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させたミエローマ細胞の作製、該ミエローマ細胞と脾臓細胞とを細胞融合して得られる抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させた交雑細胞の作製、該抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる抗体提示交雑細胞の作製、及び該抗体提示交雑細胞の提示された抗体の抗原に対する親和性あるいは特異性の差を利用した抗体提示交雑細胞の選別までの流れを示した図である。
【0047】
(実施例1)ヒトFcレセプター発現ミエローマの作製
1−1.ヒトFcレセプターI発現ベクターの作製
ヒトFcγレセプターI(以下hFcγRI)のcDNA(human FcRI cDNA、ORIGENE社製であり、配列番号1参照)を鋳型とし、hFcγRIのcDNAをPrimeStarHS DNA Polymerase(タカラバイオ株式会社製)を用いたPCR(Polymerase Chain Reaction)により増幅し(プライマー1及び2であり、配列番号2および配列番号3参照)、これをPCR産物とした。
【0048】
上記PCR産物(Polymerase Chain Reaction産物)を制限酵素BamHI及びKpnI(タカラバイオ株式会社製)で切断し、hFcγRI−cDNA−PCR産物とした。
【0049】
発現ベクターpCMV−Script(Stratagene社製)のマルチクローニングサイトを制限酵素BamHI及びKpnI(タカラバイオ株式会社製)で切断した遺伝子を、アルカリフォスファターゼ(BAP)(タカラバイオ株式会社製)を用いて脱リン酸化した。
【0050】
上記のhFcγRI−cDNA−PCR産物と、pCMV−ScriptをBamHI及びKpnIで切断後、脱リン酸化した遺伝子を、DNA Ligation Kit<Mighty Mix>(タカラバイオ株式会社製)を用いて連結した。作製したプラスミドをヒトFcレセプターI発現ベクター(pCMVS−hFcRI)とした。
1−2.ヒトFcレセプターI発現ベクター(pCMVS−hFcRI)の調製
実施例1の1−1.で作製したヒトFcレセプターI発現ベクター(pCMVS−hFcRI)を用いて、大腸菌のコンピテントセルJM109(タカラバイオ株式会社製)100マイクロリットル(μl)を形質転換した。形質転換はコンピテントセルに添付の資料に従って行った。
【0051】
得られた形質転換体を、2mlの2XYT培地(バクトトリプトン(ベクトンアンドデッキンソン社製)16g/L、イーストエキストラクト(ベクトンアンドデッキンソン社製)10g/L、塩化ナトリウム(関東化学製)5g/L)にて37℃で18時間培養し、該培養液からQIA prep Spin Miniprep Kit(QIAGEN社製)を用いてプラスミドを抽出し、約5マイクログラム(μg)のpCMVS−hFcRIを調製した。
1−3.hFcγRI発現ベクターのミエローマへの導入
E−RDF(極東製薬社製)に10%FBS(Fetal Bovine Serum:JRH Biosciences社製)を加えた培地10mlで対数増殖期後期まで培養したマウスミエローマ(SP2/0)を、50mlの遠心チューブに入れ1500回転/分で5分間遠心分離した。上清を除去し、沈殿した細胞を5mlのPBS(リン酸緩衝食塩水)で2回洗浄した後、1x106cells/mlになるようにPBSに細胞を懸濁した。該細胞溶液500μlに、1−1で作製したヒトFcγRI発現ベクター(pCMVS−hFcRI)を10μg加えた溶液を、0.4cmのキュベット(Bio−RAD社製)に入れ、Electro Porrator ECM830(ECM社製)を用いて、735V/cm、1ms、1回パルスの条件でトランスフェクションを行った。
【0052】
また、陰性コントロールとして、hFcRI遺伝子を組み込んでいないベクター(pCMV−Scriptのみ)を同様の方法によりにトランスフェクションした。
1−4.hFcγRI発現ベクターが導入されたミエローマの培養
1−2で調製したhFcγRI遺伝子をトランスフェクションしたマウスミエローマを、E−RDF、10%FBSに400μg/mlのG418 Sulfate(Calbiochem社製)を加えた培地で2週間程度選択培養を行うことにより、hFcγRI発現ミエローマを作製した。
【0053】
また、陰性コントロールとして、上述1−2でhFcR遺伝子を組み込んでいないベクター(pCMV−Scriptのみ)をトランスフェクションしたマウスミエローマを同様の方法で培養し、hFcγRI非発現ミエローマを作製した。
【0054】
(実施例2)hFcγRI発現ハイブリドーマの作製
2−1.マウス脾臓細胞の調整
ウシ血清アルブミンにより適宜免疫したA/Jマウス(日本SLC株式会社)を解剖し、脾臓を摘出した。摘出した脾臓を10mlのE−RDF中で脂肪を除去した後、ポリエステルメッシュ(Netwell,74μm、Coster社)ですり潰し、50mlの遠心チューブに入れ1500回転/分で5分間遠心分離した。沈殿を回収し、9mlのRed Blood Cell Lysing buffer(SIGMA製)と1mlのFBSとの混合液に懸濁し、赤血球を破砕した。破砕液を1500回転/分で5分間遠心分離後、沈殿を20mlのE−RDFで2回洗浄し、細胞融合用マウス脾臓細胞とした。
2−2.FcγRI発現ミエローマとマウス脾臓細胞との細胞融合
実施例1で作製したヒトFcγRI発現ミエローマを、E−RDF、10%FBSで対数増殖期後半になるまで培養し、50mlの遠心チューブに入れ1500回転/分で5分間遠心分離した。沈殿を回収し20mlのE−RDFで2回洗浄した後、10mlのE−RDFに懸濁し、細胞融合用ヒトFcγRI発現ミエローマとした。
【0055】
該ヒトFcγRI発現ミエローマと実施例2−1で調製したマウス脾臓細胞とを、細胞数比1:1で混合し、1000回転/分で5分間遠心分離した。上清を捨て、沈殿をタッピングにより攪拌し、あらかじめ用意しておいた250μlのポリエチレングリコール1500(Roche社製)を、ゆっくり側面から加えた。軽くタッピングにより攪拌した後、5mlのE−RDFをゆっくり側面から加えた。続いて1mlのFBSをゆっくり側面から加え、1000回転/分で5分間遠心分離した。上清を捨て、10mlのE−RDFで2回洗浄し、1000回転/分で5分間遠心分離した。上清を捨て、20mlのE−RDF、10%FBS、1xHATサプリメント(GibcoBRL社製)に細胞を懸濁し、5%CO2、37℃で2週間選択培養した。得られた細胞をhFcγRI発現ハイブリドーマとした。
【0056】
また、陰性コントロールとして、実施例1の1−3で作製したhFcγRI非発現ミエローマを用いて、上述と同様の方法で、細胞融合を行い、得られた細胞をhFcγRI非発現ハイブリドーマとした。
【0057】
(実施例3)ハイブリドーマによる抗体提示
実施例2で作製したhFcγRI発現ハイブリドーマ及びhFcγRI非発現ハイブリドーマを、E−RDF、10%FBSで数日間培養することにより、抗体提示ハイブリドーマ及び抗体非提示ハイブリドーマを作製した。
【0058】
(実施例4)抗体提示ハイブリドーマの確認
実施例3で培養したハイブリドーマ2mlを1000回転/分で5分間遠心分離し、上清を除去した後1mlのPBSで2回洗浄した。洗浄後、上清を除去した後、500μlのPBSに細胞を懸濁し、1mg/mlの抗マウスIgG(H+L)−FITC(Vector社製)を2μl添加し、遮光して1時間反応させた。その後1000回転/分で5分間遠心分離し、上清を除去した後1mlのPBSで2回洗浄した。洗浄後、上清を除去した後、500μlのPBSに細胞を懸濁し、フローサイトメトリー(BD FACS Aria:ベクトンアンドデッキンソン社製)で解析した。なお、遠心分離機はトミー社製、型式EX−126を用いた。
【0059】
陰性コントロール1として、実施例1から3により作製した抗体非提示ハイブリドーマを、上記実施例4に従って抗マウスIgG(H+L)−FITCで染色し、同様にフローサイトメトリーで解析した。
【0060】
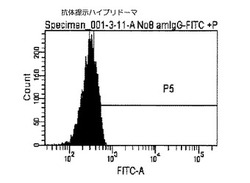
結果を図2および図3に示した。図2および図3に示すクロマトグラムは、本技術により実施例1から3により作製したハイブリドーマの細胞膜上に提示された抗体を見たものである。図2のクロマトグラムが実施例4に従って抗マウスIgG(H+L)−FITCで染色した抗体提示ハイブリドーマであり、図3のクロマトグラム)が、実施例4に従って抗マウスIgG(H+L)−FITCで染色した細胞膜上に抗体が提示されていないハイブリドーマ(陰性コントロール1)である。
【0061】
その結果、細胞膜上に抗体が提示されていない陰性コントロール1図3と比較して、細胞膜上に抗体を提示した抗体提示ハイブリドーマ細胞図2は抗マウスIgG(H+L)−FITCが結合し緑色の蛍光を発するため、ピークが右にシフトした(図2−1)。
【0062】
また、陰性コントロール2として、上記抗マウスIgG(H+L)−FITCを反応させていない実施例3で培養したハイブリドーマを同様にフローサイトメトリーで解析した。
【0063】
結果を図4および図5に示した。図4および図5に示すクロマトグラムは、本技術により実施例1から3により作製したハイブリドーマの細胞膜上に提示された抗体を見たものである。図4のクロマトグラムが、実施例4に従って抗マウスIgG(H+L)−FITCで染色したハイブリドーマであり、図5のクロマトグラムが、抗マウスIgG(H+L)−FITCで染色していないハイブリドーマ(陰性コントロール2)である。
【0064】
その結果、細胞膜上に抗体を提示した細胞は抗マウスIgG(H+L)−FITCが結合し緑色の蛍光を発するため、陰性コントロールと比較して、ピークが右にシフトした。
【0065】
これらのことは、本法により、ハイブリドーマの分泌する抗体が、ハイブリドーマ細胞膜に結合した状態で細胞外に発現したFcγRIに結合することにより、抗体を提示したハイブリドーマが作製されたことを示す。
【図面の簡単な説明】
【0066】
【図1】本発明の全体の流れを示すフローチャートである。
【図2】本発明の抗体提示ハイブリドーマを用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【図3】抗体非提示ハイブリドーマを用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【図4】本発明の抗マウスIgG(H+L)−FITCで染色された細胞を用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【図5】本発明の抗マウスIgG(H+L)−FITCで染色されなかった細胞を用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【技術分野】
【0001】
本発明は、細胞膜表面への目的物質の提示方法に関し、詳しくは、抗体に結合可能な蛋白質発現ミエローマおよびこれを用いる細胞融合方法並びに交雑細胞およびその選別方法に関する。
【背景技術】
【0002】
これまでに、大腸菌、酵母、動物細胞等を宿主として、有用な物質を生産する技術が開発されてきた。生産された物質は、医薬品、診断試薬等、多くの分野で使用されている。生産される有用物は主に蛋白質であるが、本来各生物が持っている蛋白質のみならず、遺伝子組み換え技術によりその機能を向上あるいは変化させた組換え蛋白質も種々生産されている。
【0003】
これらの組換え蛋白質を作製する場合、その蛋白質をコードする遺伝子に変異を導入することによりその蛋白質の機能を変化させ、変異を入れた遺伝子を宿主に導入し、機能を変化させた蛋白質(変異蛋白質)を生産させる方法が行われている。その場合、変異遺伝子を導入した多数の細胞の中から有効な変異蛋白質を生産する細胞のみを選択する効率的な方法が必要となってくるが、その方法として宿主の細胞膜表層にその細胞が生産する蛋白質を提示させ、提示された蛋白質を指標にして細胞を選択回収する方法がとられている。
【0004】
これらの細胞膜表層への蛋白質の提示技術はいくつか報告されている。例えばファージディスプレー法は、繊維状ファージを宿主として、目的蛋白質をファージのコート蛋白質との融合蛋白質として発現させることにより、ファージ粒子上に提示させている(例えば、非特許文献1参照)。
【0005】
酵母表層ディスプレー法は、酵母を宿主として、目的蛋白質をGPI(グリコシルフォスファチジルイノシトール)アンカー付着シグナルであるαアグルチニンとの融合蛋白質として発現させ、GPIアンカーを介して酵母細胞壁のグルカン層に共有結合することにより酵母細胞表層に提示させている(例えば、非特許文献2参照)。
【0006】
生産される有用物質として抗体を産生する場合は、1975年にモノクローナル抗体の作製法が考案されて以来(例えば、非特許文献3参照)、動物細胞を宿主として抗体の作製が行われるようになった。これらの作製された抗体は、感染症、ガン、心臓疾患などの病気の診断のために用いられる免疫測定法による診断薬に使用されている。
【0007】
また近年では、抗体医薬として抗体を治療薬として使用するようになるにつれ、その効率的な作製法の開発が望まれるようになっている。
【0008】
モノクローナル抗体を作製する場合は、例えばマウスの脾臓細胞とマウスミエローマを細胞融合することにより抗体産生細胞(ハイブリドーマ)を作製し、作製したハイブリドーマの中から目的抗体を産生している細胞を選択する(例えば、非特許文献3参照)。その場合、作製した細胞群を限界希釈法により一つ一つの細胞に単離し、培養した各細胞の培養上清中に放出された抗体を酵素免疫測定法(ELISA:Enzyme−Linked ImmunoSorbent Assay)等により評価することにより、目的抗体を産生する細胞を選択している。
【0009】
【非特許文献1】Smith GP,“Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface.” ,Science, 228巻(4705):1, 315頁, 1985年発行
【非特許文献2】Murai et.al.,“Genetic immobilization of cellulase on the cell surface of Saccharomyces cerevisiae.” Appl. Microbiol. Biotechnol., 48巻, 499−503頁, 1997年発行
【非特許文献3】G. KOHLER(G. ケーラー) & C. MILSTEIN, “Continuous cultures of fused cells secreting antibody of predefined specificity” Nature, 256巻, 495−497頁, 1975年発行
【発明の開示】
【発明が解決しようとする課題】
【0010】
医薬品、診断試薬等に用いられる有用蛋白質を進化工学的手法による遺伝子組み換えにより作製する場合、ライブラリーと呼ばれる無作為に作製した組換え遺伝子を導入した多数の細胞の中から、目的にあった活性を保持した、あるいは遺伝子変異を導入する前の野生型よりも機能の向上した変異蛋白質を生産する細胞のみを選択しなくてはならない。通常このようなライブラリーは、百万個から1億個あるいはそれ以上の細胞群であり、膨大な細胞数であるため、1つ1つの細胞を個々に培養して調べていくことは不可能である。そのためこれらのライブラリーの中から、目的にあった蛋白質を産生する細胞を選択する効率的なスクリーニング方法が必要となるという課題があった。
【0011】
この様に、膨大な数の細胞群の中から目的蛋白質を産生している細胞を効率的にスクリーニングするには、細胞で生産される組換え蛋白質とその組換え蛋白質を産生する細胞が結合していることが望ましい。このような蛋白質とその産生細胞の対応付けがなされていれば、結合した蛋白質を評価することにより、同時にその蛋白質の産生細胞を回収することが可能だからである。
【0012】
そのような生産細胞と蛋白質の対応付けの方法として、ファージディスプレー法や酵母表層ディスプレー法が報告されている。
【0013】
しかしながら、ファージディスプレー法では、ファージ粒子上に蛋白質を発現させた時に蛋白質が活性を保持した状態で高次構造をとらず、活性が消失してしまうという課題があった。また、翻訳後修飾が行われないため、活性に必要な糖鎖の付加やリン酸化が起こらず活性が消失あるいは低減してしまう場合がある。また、高い活性を持った目的蛋白質を発現しているファージの分子数が極めて少ない場合があり、本来選択されるはずの目的細胞を逃してしまう場合があるという課題があった。
【0014】
また、酵母表層ディスプレー法では、提示された蛋白質に糖鎖が付加されるが、付加される糖鎖の構成単糖の種類、配列順序、モル比、単糖相互の結合が必ずしも元の種のそれらと同一のものではなく、活性の低下や消失が起こる場合がある。特に、発現させる蛋白質が抗体の場合、付加される糖鎖の構造の違いにより、その親和性が低下してしまうことが考えられる。
【0015】
また、先に挙げたハイブリドーマから目的抗体を産生する細胞を選択する場合、限界希釈法でそれぞれの細胞を単離し、その培養上清を用いて産生された抗体を評価することにより、目的抗体を産生する細胞を選択する必要があるため、多大な時間と労力を必要とするという課題があった。
【0016】
また、ミエローマと脾臓細胞の細胞融合により得られた細胞の数が少ない場合は、上記の方法により目的細胞を選択することは可能であるが、より高い活性を持つ抗体を生産する細胞が得られない場合があるという課題があった。逆に、細胞融合の効率が向上すれば、得られる細胞数が増加し、膨大な労力と時間がかかり、選択中に細胞の死滅等が起るため、既存の方法による目的細胞の選択は困難であるという課題があった。またこの様に取り扱う細胞数が膨大になった場合、得られた全ての細胞を網羅的に評価し、目的のハイブリドーマを選択回収することは極めて困難である。
【0017】
哺乳類由来の有用蛋白質を動物細胞により生産する方法は、翻訳後修飾、付加される糖鎖構造の観点から、大腸菌などによる生産方法よりも優位性が高い。しかしながら、これまで述べたように遺伝子組み換え蛋白質を作製する場合、大腸菌、ファージ、あるいは酵母により一度目的物質産生細胞のスクリーニングを行い、得られた細胞から目的蛋白質をコードした遺伝子を抽出し、さらにその遺伝子を動物細胞に導入するという方法をとらなくてはならない。そのため、多大な時間と労力を必要とするという課題があった。またこの場合、得られた動物細胞により産生された蛋白質の機能が、前述した翻訳後修飾が原因で、大腸菌、ファージ、あるいは酵母を用いてスクリーニングした時の機能と異なる場合があるという課題があった。
【課題を解決するための手段】
【0018】
本発明者らは上記課題に関し鋭意検討した結果、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させたミエローマ細胞を作製した。さらに該ミエローマ細胞と脾臓細胞とを細胞融合して得られる交雑細胞を培養することにより、抗体提示交雑細胞を作製することで課題を解決できることを見出し、本発明を完成するに至った。以下本発明を詳細に説明する。
【0019】
すなわち本発明は、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる、ミエローマ細胞である。
【0020】
また本発明は、ミエローマ細胞が、マウスあるいはウサギあるいはラット由来の細胞である、上記のミエローマ細胞である。
【0021】
また本発明は、上記のミエローマ細胞と脾臓細胞とを細胞融合する方法である。
【0022】
また本発明は、脾臓細胞が、マウスあるいはウサギあるいはラット由来の細胞である、上記の方法である。
【0023】
また本発明は、上記の細胞融合により得られる抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる交雑細胞である。
【0024】
また本発明は、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる、抗体提示交雑細胞である。
【0025】
また本発明は、上記の抗体提示交雑細胞を、提示された抗体の抗原に対する親和性または特異性の差により選別する、交雑細胞の選別方法である。
【0026】
また本発明は、抗体に結合可能な蛋白質がFcレセプターである、上記の方法である。
【0027】
また本発明は、抗体に結合可能な蛋白質がプロテインGまたはその改変体である、上記の方法である。
【0028】
本発明における抗体に結合可能な蛋白質とは、抗体の抗原結合部位以外の部分で抗体に結合する能力を持っている蛋白質であればよく、例えば哺乳動物のFcレセプター、細菌が作るプロテインG、プロテインA、イムノグロブリン(免疫グロブリン)を認識する抗体などが挙げられる。
【0029】
本発明における抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させる形態は、一つの形態として、細胞の膜蛋白質との融合蛋白質として発現させればよく、例えば細胞膜貫通型蛋白質をアンカー蛋白質としてその末端に目的物質に結合可能な蛋白質を結合した状態で発現させればよい。この場合、両蛋白質の結合順序は、細胞膜貫通型アンカー蛋白質のN末端と抗体に結合可能な蛋白質のC末端が結合していても又はその逆の順序でもよいが、抗体に結合可能な蛋白質が細胞外領域に出ており且つ抗体との結合部位がその結合活性を保持していることが必要である。また、両蛋白質は直接結合しても、両蛋白質の間にリンカーを介して結合してもよい。細胞膜貫通型蛋白質をアンカー蛋白質とする場合は、例えばFcレセプターの細胞膜貫通領域、イムノグロブリンの細胞膜貫通領域などを用いればよい。
【0030】
また、GPIアンカーを利用して、抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させてもよい。その場合、抗体に結合可能な蛋白質はαアグルチニンとの融合蛋白質として発現させればよく、その結合順序、リンカーの有無等は、上述の細胞膜貫通型蛋白質をアンカー蛋白質として用いた場合と同様である。ここでGPIアンカー(glycosylphosphatidylinositol:GPI)とは、真核細胞の細胞膜に結合し細胞膜の外側に蛋白質を繋ぎ止める役割を持つ糖脂質であり、小胞体でGPIアンカーと蛋白質が結合し、ゴルジ体を経て細胞表面に輸送され、細胞膜の外面に蛋白質を出すものである。
【0031】
抗体に結合可能な蛋白質を細胞外に発現させる場合は、抗体に結合可能な蛋白質が細胞外領域に出ており且つ抗体との結合部位がその結合活性を保持していることが必要である。
【0032】
本発明におけるミエローマ細胞は、マウスあるいはウサギあるいはラット由来の細胞のいずれのものでもよいが、一般的にマウスのミエローマ細胞を使用した場合は、次の工程で用いる脾臓細胞は同じ動物種であるマウスの細胞を用いることが好ましい。しかし、場合によってはウサギミエローマ細胞とマウス脾臓細胞の組合せを用いて本発明を行うことも可能である。
【0033】
上述の様に、本発明における脾臓細胞はマウスあるいはウサギあるいはラット由来の細胞のいずれの細胞でもよく、一般的には使用するミエローマ細胞と同じ動物種の細胞を使用すればよいが、異なる動物種の細胞を使用することも可能である。
【0034】
本発明における抗体に結合可能な蛋白質の細胞膜へ結合した状態での細胞外への発現方法は、該抗体に結合可能な蛋白質をコードする遺伝子と上述アンカー蛋白質としての細胞の膜蛋白質をコードする遺伝子とを連結した状態で該細胞内に遺伝子導入し、該細胞の持つ細胞外蛋白質発現機構を利用して発現させればよい。
【0035】
該抗体に結合可能な蛋白質を細胞の蛋白質発現機構を利用して細胞膜表面への発現へ発現させるために必要な遺伝子の構造は、発現プロモーター遺伝子、シグナルペプチドをコードする遺伝子、目的物質に結合可能な蛋白質をコードする遺伝子、上述のアンカー蛋白質をコードする遺伝子、ターミネーター遺伝子がこの順序で並んだ遺伝子が必要である。該発現プロモーター、該シグナルペプチド及び該ターミネーターは、遺伝子導入する宿主細胞で機能するプロモーター、該シグナルペプチド及びターミネーターであればよく、プロモーターはより強力なプロモーターが望ましい。これらの遺伝子を環状あるいは直鎖状に連結したベクターを構築し、細胞に遺伝子導入する。細胞内への遺伝子導入方法は、物理化学的手法、ウイルスベクターを用いた方法等のいずれの方法でもよく、細胞によって適宜選択すればよい。
【0036】
ミエローマ細胞と脾臓細胞とを細胞融合する方法は、一般的に行われるモノクローナル抗体作製法(前記した、G. KOHLER(G. ケーラー) & C. MILSTEIN, “Continuous cultures of fused cells secreting antibody of predefined specificity” Nature, 256巻, 495−497頁, 1975年発行
(非特許文献3))に従ってポリエチレングリコール等を用いた方法で行えばよい。該方法に従って、ミエローマ細胞と脾臓細胞との細胞融合を行うことにより、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を得ることが可能である。
【0037】
本発明における、抗体提示交雑細胞を得るための交雑細胞の培養は、上記方法により得られた交雑細胞から分泌された抗体を、該交雑細胞の細胞膜に結合した状態で細胞外に発現させた抗体に結合可能な蛋白質に結合させるため、該交雑細胞の生育に適した培地で該細胞が該目的物質の生産を開始する細胞密度まで培養すればよい。
【0038】
培養時間は、細胞から分泌された抗体が、抗体に結合可能な蛋白質に結合するために十分な量を分泌する時間であればよい。例えば細胞が対数増殖期後期から定常期に達する細胞密度までに必要な時間、あるいはそれ以上の時間培養すればよい。
【0039】
抗体に結合可能な蛋白質と抗体の結合部位は、それぞれいずれの部位で結合してもかまわないが、好ましくは抗体の結合活性をつかさどる部位以外の部位で結合することが望ましい。例えば抗体に結合可能な蛋白質がそれぞれ抗体とFcレセプターである場合は、抗体の抗原結合部位以外の部位である抗体Fc部位とFcレセプターが結合する。
【0040】
本発明において、該交雑細胞が分泌する抗体に結合可能な蛋白質を、該細胞の膜表面に結合した状態で発現させ、該蛋白質に該分泌抗体を結合させた細胞を用いて、表面に結合した抗体の親和性あるいは特異性の差を測定することにより、抗体産生交雑を選別することが可能である。その場合、細胞表面に結合している抗体の親和性あるいは特異性の差を測定する方法は、該抗体の親和性あるいは特異性を測定するために通常用いられる方法により行えばよい。
【0041】
例えば、ELISA(Enzyme−Linked ImmunoSorbent Assay)による測定や、フローサイトメーター(Flow Cytometer)を用いた測定により行えばよい。あるいは、抗原又は抗体を固定化したカラムを通すことにより、抗体提示交雑細胞上に提示された抗体の抗原に対する親和性あるいは特異性の差によって分離を行ってもよい。あるいは、抗原又は抗体を固定化したビーズと抗体提示交雑細胞上に提示された抗体を反応させ、細胞が結合した該ビーズを回収することにより抗体産生細胞を回収すればよい。
【0042】
本発明におけるFcレセプターとは、抗体重鎖のFc部分に結合する蛋白質であり、ヒト、マウス等由来のものが報告されているが、抗体Fc部分と結合能を持つものであれば、いずれのものでもよい。
【0043】
本発明におけるプロテインGとは、主に抗体重鎖のFc部分に結合する蛋白質であり、ストレプトコッカス由来のものが数種類報告されているが、抗体と結合能を持つものであれば、いずれのものでもよい。
【発明の効果】
【0044】
本発明によれば次の効果を奏することができる。
(1)交雑細胞が分泌する抗体を該交雑細胞膜表面に抗体結合活性を保持した状態で提示させることができ、抗体とそれを分泌する細胞および抗体産生にかかる遺伝子とを対応させて回収することができる。
(2)細胞を個々に単離することなく、種々の交雑細胞が混ざった状態で、該交雑細胞が分泌する抗体の親和性および特異性を測定することが可能であるため、全ての交雑細胞を網羅的に評価することができる。
(3)本発明は、親和性や特異性に優れた抗体の創出等、既存の抗体の高機能化や全く新しい機能を持った抗体の創出を、進化工学的手法に基づく遺伝子組み換えにより行う場合に有効である。
【実施例】
【0045】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0046】
本発明の全体の流れを、図1に示した。図1に示すフローチャートは、抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させたミエローマ細胞の作製、該ミエローマ細胞と脾臓細胞とを細胞融合して得られる抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させた交雑細胞の作製、該抗体に結合可能な蛋白質を細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる抗体提示交雑細胞の作製、及び該抗体提示交雑細胞の提示された抗体の抗原に対する親和性あるいは特異性の差を利用した抗体提示交雑細胞の選別までの流れを示した図である。
【0047】
(実施例1)ヒトFcレセプター発現ミエローマの作製
1−1.ヒトFcレセプターI発現ベクターの作製
ヒトFcγレセプターI(以下hFcγRI)のcDNA(human FcRI cDNA、ORIGENE社製であり、配列番号1参照)を鋳型とし、hFcγRIのcDNAをPrimeStarHS DNA Polymerase(タカラバイオ株式会社製)を用いたPCR(Polymerase Chain Reaction)により増幅し(プライマー1及び2であり、配列番号2および配列番号3参照)、これをPCR産物とした。
【0048】
上記PCR産物(Polymerase Chain Reaction産物)を制限酵素BamHI及びKpnI(タカラバイオ株式会社製)で切断し、hFcγRI−cDNA−PCR産物とした。
【0049】
発現ベクターpCMV−Script(Stratagene社製)のマルチクローニングサイトを制限酵素BamHI及びKpnI(タカラバイオ株式会社製)で切断した遺伝子を、アルカリフォスファターゼ(BAP)(タカラバイオ株式会社製)を用いて脱リン酸化した。
【0050】
上記のhFcγRI−cDNA−PCR産物と、pCMV−ScriptをBamHI及びKpnIで切断後、脱リン酸化した遺伝子を、DNA Ligation Kit<Mighty Mix>(タカラバイオ株式会社製)を用いて連結した。作製したプラスミドをヒトFcレセプターI発現ベクター(pCMVS−hFcRI)とした。
1−2.ヒトFcレセプターI発現ベクター(pCMVS−hFcRI)の調製
実施例1の1−1.で作製したヒトFcレセプターI発現ベクター(pCMVS−hFcRI)を用いて、大腸菌のコンピテントセルJM109(タカラバイオ株式会社製)100マイクロリットル(μl)を形質転換した。形質転換はコンピテントセルに添付の資料に従って行った。
【0051】
得られた形質転換体を、2mlの2XYT培地(バクトトリプトン(ベクトンアンドデッキンソン社製)16g/L、イーストエキストラクト(ベクトンアンドデッキンソン社製)10g/L、塩化ナトリウム(関東化学製)5g/L)にて37℃で18時間培養し、該培養液からQIA prep Spin Miniprep Kit(QIAGEN社製)を用いてプラスミドを抽出し、約5マイクログラム(μg)のpCMVS−hFcRIを調製した。
1−3.hFcγRI発現ベクターのミエローマへの導入
E−RDF(極東製薬社製)に10%FBS(Fetal Bovine Serum:JRH Biosciences社製)を加えた培地10mlで対数増殖期後期まで培養したマウスミエローマ(SP2/0)を、50mlの遠心チューブに入れ1500回転/分で5分間遠心分離した。上清を除去し、沈殿した細胞を5mlのPBS(リン酸緩衝食塩水)で2回洗浄した後、1x106cells/mlになるようにPBSに細胞を懸濁した。該細胞溶液500μlに、1−1で作製したヒトFcγRI発現ベクター(pCMVS−hFcRI)を10μg加えた溶液を、0.4cmのキュベット(Bio−RAD社製)に入れ、Electro Porrator ECM830(ECM社製)を用いて、735V/cm、1ms、1回パルスの条件でトランスフェクションを行った。
【0052】
また、陰性コントロールとして、hFcRI遺伝子を組み込んでいないベクター(pCMV−Scriptのみ)を同様の方法によりにトランスフェクションした。
1−4.hFcγRI発現ベクターが導入されたミエローマの培養
1−2で調製したhFcγRI遺伝子をトランスフェクションしたマウスミエローマを、E−RDF、10%FBSに400μg/mlのG418 Sulfate(Calbiochem社製)を加えた培地で2週間程度選択培養を行うことにより、hFcγRI発現ミエローマを作製した。
【0053】
また、陰性コントロールとして、上述1−2でhFcR遺伝子を組み込んでいないベクター(pCMV−Scriptのみ)をトランスフェクションしたマウスミエローマを同様の方法で培養し、hFcγRI非発現ミエローマを作製した。
【0054】
(実施例2)hFcγRI発現ハイブリドーマの作製
2−1.マウス脾臓細胞の調整
ウシ血清アルブミンにより適宜免疫したA/Jマウス(日本SLC株式会社)を解剖し、脾臓を摘出した。摘出した脾臓を10mlのE−RDF中で脂肪を除去した後、ポリエステルメッシュ(Netwell,74μm、Coster社)ですり潰し、50mlの遠心チューブに入れ1500回転/分で5分間遠心分離した。沈殿を回収し、9mlのRed Blood Cell Lysing buffer(SIGMA製)と1mlのFBSとの混合液に懸濁し、赤血球を破砕した。破砕液を1500回転/分で5分間遠心分離後、沈殿を20mlのE−RDFで2回洗浄し、細胞融合用マウス脾臓細胞とした。
2−2.FcγRI発現ミエローマとマウス脾臓細胞との細胞融合
実施例1で作製したヒトFcγRI発現ミエローマを、E−RDF、10%FBSで対数増殖期後半になるまで培養し、50mlの遠心チューブに入れ1500回転/分で5分間遠心分離した。沈殿を回収し20mlのE−RDFで2回洗浄した後、10mlのE−RDFに懸濁し、細胞融合用ヒトFcγRI発現ミエローマとした。
【0055】
該ヒトFcγRI発現ミエローマと実施例2−1で調製したマウス脾臓細胞とを、細胞数比1:1で混合し、1000回転/分で5分間遠心分離した。上清を捨て、沈殿をタッピングにより攪拌し、あらかじめ用意しておいた250μlのポリエチレングリコール1500(Roche社製)を、ゆっくり側面から加えた。軽くタッピングにより攪拌した後、5mlのE−RDFをゆっくり側面から加えた。続いて1mlのFBSをゆっくり側面から加え、1000回転/分で5分間遠心分離した。上清を捨て、10mlのE−RDFで2回洗浄し、1000回転/分で5分間遠心分離した。上清を捨て、20mlのE−RDF、10%FBS、1xHATサプリメント(GibcoBRL社製)に細胞を懸濁し、5%CO2、37℃で2週間選択培養した。得られた細胞をhFcγRI発現ハイブリドーマとした。
【0056】
また、陰性コントロールとして、実施例1の1−3で作製したhFcγRI非発現ミエローマを用いて、上述と同様の方法で、細胞融合を行い、得られた細胞をhFcγRI非発現ハイブリドーマとした。
【0057】
(実施例3)ハイブリドーマによる抗体提示
実施例2で作製したhFcγRI発現ハイブリドーマ及びhFcγRI非発現ハイブリドーマを、E−RDF、10%FBSで数日間培養することにより、抗体提示ハイブリドーマ及び抗体非提示ハイブリドーマを作製した。
【0058】
(実施例4)抗体提示ハイブリドーマの確認
実施例3で培養したハイブリドーマ2mlを1000回転/分で5分間遠心分離し、上清を除去した後1mlのPBSで2回洗浄した。洗浄後、上清を除去した後、500μlのPBSに細胞を懸濁し、1mg/mlの抗マウスIgG(H+L)−FITC(Vector社製)を2μl添加し、遮光して1時間反応させた。その後1000回転/分で5分間遠心分離し、上清を除去した後1mlのPBSで2回洗浄した。洗浄後、上清を除去した後、500μlのPBSに細胞を懸濁し、フローサイトメトリー(BD FACS Aria:ベクトンアンドデッキンソン社製)で解析した。なお、遠心分離機はトミー社製、型式EX−126を用いた。
【0059】
陰性コントロール1として、実施例1から3により作製した抗体非提示ハイブリドーマを、上記実施例4に従って抗マウスIgG(H+L)−FITCで染色し、同様にフローサイトメトリーで解析した。
【0060】
結果を図2および図3に示した。図2および図3に示すクロマトグラムは、本技術により実施例1から3により作製したハイブリドーマの細胞膜上に提示された抗体を見たものである。図2のクロマトグラムが実施例4に従って抗マウスIgG(H+L)−FITCで染色した抗体提示ハイブリドーマであり、図3のクロマトグラム)が、実施例4に従って抗マウスIgG(H+L)−FITCで染色した細胞膜上に抗体が提示されていないハイブリドーマ(陰性コントロール1)である。
【0061】
その結果、細胞膜上に抗体が提示されていない陰性コントロール1図3と比較して、細胞膜上に抗体を提示した抗体提示ハイブリドーマ細胞図2は抗マウスIgG(H+L)−FITCが結合し緑色の蛍光を発するため、ピークが右にシフトした(図2−1)。
【0062】
また、陰性コントロール2として、上記抗マウスIgG(H+L)−FITCを反応させていない実施例3で培養したハイブリドーマを同様にフローサイトメトリーで解析した。
【0063】
結果を図4および図5に示した。図4および図5に示すクロマトグラムは、本技術により実施例1から3により作製したハイブリドーマの細胞膜上に提示された抗体を見たものである。図4のクロマトグラムが、実施例4に従って抗マウスIgG(H+L)−FITCで染色したハイブリドーマであり、図5のクロマトグラムが、抗マウスIgG(H+L)−FITCで染色していないハイブリドーマ(陰性コントロール2)である。
【0064】
その結果、細胞膜上に抗体を提示した細胞は抗マウスIgG(H+L)−FITCが結合し緑色の蛍光を発するため、陰性コントロールと比較して、ピークが右にシフトした。
【0065】
これらのことは、本法により、ハイブリドーマの分泌する抗体が、ハイブリドーマ細胞膜に結合した状態で細胞外に発現したFcγRIに結合することにより、抗体を提示したハイブリドーマが作製されたことを示す。
【図面の簡単な説明】
【0066】
【図1】本発明の全体の流れを示すフローチャートである。
【図2】本発明の抗体提示ハイブリドーマを用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【図3】抗体非提示ハイブリドーマを用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【図4】本発明の抗マウスIgG(H+L)−FITCで染色された細胞を用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【図5】本発明の抗マウスIgG(H+L)−FITCで染色されなかった細胞を用いたフローサイトメトリー解析によるヒストグラムであり、X軸(横軸)は細胞数(細胞個数)を、Y軸(縦軸)は染色された細胞の蛍光強度(単位は任意)を示す。
【特許請求の範囲】
【請求項1】
抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる、ミエローマ細胞。
【請求項2】
ミエローマ細胞が、マウスあるいはウサギあるいはラット由来の細胞である、請求項1に記載のミエローマ細胞。
【請求項3】
請求項1に記載のミエローマ細胞と脾臓細胞とを細胞融合する方法。
【請求項4】
脾臓細胞が、マウスあるいはウサギあるいはラット由来の細胞である、請求項3に記載の方法。
【請求項5】
請求項3に記載の細胞融合により得られる抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる交雑細胞。
【請求項6】
抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる、抗体提示交雑細胞。
【請求項7】
請求項6に記載の抗体提示交雑細胞を、提示された抗体の抗原に対する親和性または特異性の差により選別する、交雑細胞の選別方法。
【請求項8】
抗体に結合可能な蛋白質がFcレセプターである、請求項1から7のいずれかに記載の方法。
【請求項9】
抗体に結合可能な蛋白質がプロテインGまたはその改変体である、請求項1から7のいずれかに記載の方法。
【請求項1】
抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる、ミエローマ細胞。
【請求項2】
ミエローマ細胞が、マウスあるいはウサギあるいはラット由来の細胞である、請求項1に記載のミエローマ細胞。
【請求項3】
請求項1に記載のミエローマ細胞と脾臓細胞とを細胞融合する方法。
【請求項4】
脾臓細胞が、マウスあるいはウサギあるいはラット由来の細胞である、請求項3に記載の方法。
【請求項5】
請求項3に記載の細胞融合により得られる抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させてなる交雑細胞。
【請求項6】
抗体に結合可能な蛋白質を、細胞膜に結合した状態で細胞外に発現させた交雑細胞を培養することにより得られる、抗体提示交雑細胞。
【請求項7】
請求項6に記載の抗体提示交雑細胞を、提示された抗体の抗原に対する親和性または特異性の差により選別する、交雑細胞の選別方法。
【請求項8】
抗体に結合可能な蛋白質がFcレセプターである、請求項1から7のいずれかに記載の方法。
【請求項9】
抗体に結合可能な蛋白質がプロテインGまたはその改変体である、請求項1から7のいずれかに記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2009−268399(P2009−268399A)
【公開日】平成21年11月19日(2009.11.19)
【国際特許分類】
【出願番号】特願2008−121080(P2008−121080)
【出願日】平成20年5月7日(2008.5.7)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成21年11月19日(2009.11.19)
【国際特許分類】
【出願日】平成20年5月7日(2008.5.7)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

