抗体標識が可能な無担体177Luの分離精製法
【解決課題】Ca、Fe、Znを含まない無担体177Luを分離・精製して、標識率の高い177Lu−抗体を提供する。
【解決手段】176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る工程と、照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLCに通して177LuとターゲットであるYbとを分離する工程と、分離したLuフラクションを陽イオン交換カラムに通して177Luを分離する工程と、を含む177Luの分離・精製方法。HPLCを用いる分離工程において、あらかじめ陽イオン交換及びキレート交換により精製した溶離液を使用すること、及び陽イオン交換を用いる177Luの分離工程の後にさらに177Luを含む溶液を陰イオン交換カラムに通してFeを除去する工程を含む。
【解決手段】176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る工程と、照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLCに通して177LuとターゲットであるYbとを分離する工程と、分離したLuフラクションを陽イオン交換カラムに通して177Luを分離する工程と、を含む177Luの分離・精製方法。HPLCを用いる分離工程において、あらかじめ陽イオン交換及びキレート交換により精製した溶離液を使用すること、及び陽イオン交換を用いる177Luの分離工程の後にさらに177Luを含む溶液を陰イオン交換カラムに通してFeを除去する工程を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗体標識が可能な無担体177Luの分離精製法に関する。
【背景技術】
【0002】
RI(放射性同位元素)を用いた癌治療は、RI標識薬剤を体内に投与して癌細胞に特異的に集積させ、当該RIから放射される飛程の短い放射線を病巣の組織や細胞に照射することによって、目的とする病巣の組織や細胞を破壊して疾患を治療する方法であり、正常な身体組織や細胞への放射線の影響を低く抑えることができ、副作用が少ないことから、患者のQOL(生活の質)の向上が期待できる方法である。しかしながら、RI標識薬剤の癌集積性の向上及び非ターゲット臓器への集積の低減など、解決すべき課題が多く実用化は未だ限られている。
【0003】
現在国内で使用されている癌治療用RIは、131I、89Sr及び90Yの3種であり、すべてβ線放出RIである。これらβ線の組織中の飛程は、数〜数十ミリメートル程度であり、小〜中サイズの腫瘍の照射に適当な長さである。また、癌治療に有用なβ線を放出するRIは、数時間〜数日の範囲の適当な半減期を持つものが多く、さらに、多様な化学的性質を有する。加えて、体外からの画像化に適したガンマ線を放出する場合には、治療レベルの高線量での投与に先立ち、低い線量で生体内分布を確認することができるので、最適な放射性薬剤の投与量の決定に寄与できる。さらに、モニタリングすることにより癌の治療状況を的確に把握することができると共に、各組織の吸収線量の評価を治療と同時に行うことができる。
【0004】
RIを癌治療に利用するには、その物理的性質(半減期、β線エネルギー)に加え、RIの比放射能(安定同位体に対する放射性同位体の割合)も重要な要素の一つである。すなわち、治療効果を高めるためには、より多くのβ線エネルギーをターゲットの癌組織に照射することが必要であるため、比放射能が高いRIが有利である。177Luは、半減期が6.73日、β線の最大エネルギーが498keV、組織中のβ線の飛程が1.8mmと短く、画像化に適した113keVと208keVのγ線を放出する。さらに、ルテチウムは、臨床応用が認められたイットリウム(90Y)と同族元素であり、化学的特性が類似しているため、90Y標識薬剤の開発で蓄積された知見を有効に活用することができる。
【0005】
癌治療用の放射性同位元素として有望視されている177Luの製造方法には、原子炉を用いた直接法と間接法の2種類がある。
【0006】
直接法は、176Lu(n,γ)177Lu反応により177Luを製造する方法であり、ターゲットとしてLuを用いる。直接法により製造される177Luには安定同位元素であるLu担体が含まれる。
【0007】
間接法は、176Yb(n,γ)177Yb(半減期1.91時間)→177Lu反応により製造する方法であり、ターゲットとしてYbを用いる。間接法により製造される177Luには安定同位元素であるLu担体が含まれない。すなわち、無担体177Luを得ることができる。
【0008】
177Luを癌治療に用いる方法として、癌細胞に発現する抗原に特異的に結合可能な抗体に177Luを標識した177Lu−抗体を作製し、体内に投与して癌治療を行なう方法がある。この治療法の場合、安定同位元素であるLu担体を含んでいると、177Lu−抗体の標識率が低くなるとともに、体内においては、抗原に177Lu−抗体以外に安定Lu−抗体が結合して、177Luの治療効果を低下させる。そこで、このような癌治療法には間接法で製造した無担体177Luを用いる必要がある。
【0009】
癌治療に用いる177Lu−抗体は、無担体177Luと、1,4,7,10-tetraazacyclododecan-N,N’,N’’,N’’’-tetraacetic acid(DOTA)を抗体に結合させたDOTA−抗体とを反応させることによって得ることができる。
【0010】
間接法で製造した無担体177Luの製造、分離・精製法は橋本らの"Production of No-carrier-added 177Lu via the 176Lu(n, γ)177Yb→177Lu process", K. Hashimoto, H. Matsuoka, S. Uchida, Journal of Radioanalytical and Nuclear Chemistry, Vol. 255, No. 3 (2003)575-579に報告されている。
【0011】
橋本らの論文に記載されている分離・精製方法は逆相シリカゲルカラムを用いた方法であり、その手順は以下の通りである。
【0012】
176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る。次いで、照射済み176Yb2O3を塩酸と過酸化水素水で溶解して蒸発乾固の後0.01M HCl溶液とする。この溶液をHPLC(逆相シリカゲルカラム:Waters Resolve C18 Radial-Pack 8mmφ×300mm)にチャージし、溶離液として0.25M 2−ヒドロキシイソ酪酸(2−HIBA)/0.1M 1−オクタンスルホン酸ナトリウム(1−OS)を用い、流速2ml/minで、177LuとターゲットであるYbとを分離する。分離したLuフラクションを陽イオン交換カラム(Bio Rad社製AG50WX,8mmφ×20mm)に通してLuを樹脂に吸着させておき、0.1M HClを流して2−HIBA/1−OSを完全に除去した後、6M HClで177Luを溶離し、蒸発乾固を行なって標識実験用とする。
【0013】
しかし、橋本らの従来方法では、分離精製後の177LuにCa、Fe、Znが大量に含まれており、DOTA−抗体とCa、Fe、Znが優先的に結合してCa−抗体、Fe−抗体、Zn−抗体を作り、もはや177LuはDOTA−抗体と結合できなくなってしまい、177Lu−DOTA−抗体の標識ができない、という問題があった。
【先行技術文献】
【非特許文献】
【0014】
【非特許文献1】"Production of No-carrier-added 177Lu via the 176Lu(n, γ)177Yb→177Lu process", K. Hashimoto, H. Matsuoka, S. Uchida, Journal of Radioanalytical and Nuclear Chemistry, Vol. 255, No. 3 (2003)575-579
【発明の概要】
【発明が解決しようとする課題】
【0015】
本発明の目的は、Ca、Fe、Znを含まない無担体177Luを分離・精製して、標識率の高い177Lu抗体を提供することにある。
【課題を解決するための手段】
【0016】
本発明者らは鋭意研究の結果、177Luと抗体との結合を阻害するCa、Fe、Znの混入の原因が主に溶離液中に含まれる不純物であることを突き止め、溶離液をあらかじめ精製すること及び分離工程の最後に不純物を除去する工程を加えることで、上記課題を解決できることを知見した。
【0017】
すなわち、本発明によれば、176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る工程と、照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLCに通して177LuとターゲットであるYbとを分離する工程と、分離したLuフラクションを陽イオン交換カラムに通して177Luを分離する工程と、を含む177Luの分離・精製方法であって、HPLCを用いる分離工程において、あらかじめ陽イオン交換及びキレート交換により精製した溶離液を使用すること、及び陽イオン交換を用いる177Luの分離工程の後にさらに177Luを含む溶液を陰イオン交換カラムに通してFeを除去する工程を含むこと、を特徴とする分離・精製方法が提供される。
【0018】
HPLCとしては、充填剤としてシリカゲルを用いた逆相シリカゲルカラムを用いることができる。
【0019】
HPLCで用いる溶離液としては、従来法と同様に0.25M 2−ヒドロキシイソ酪酸(2−HIBA)/0.1M 1−オクタンスルホン酸ナトリウム(1−OS)を用いることができる。ただし、本発明においては、溶離液をHPLCカラムに通す前に、あらかじめ陽イオン交換及びキレート交換によって精製しておくことが必要である。溶離液の精製に使用することができる陽イオン交換樹脂としてはスルホン酸型イオン交換樹脂が好ましく、具体的にはAG560Wx8(Bio Rad社製)を挙げることができる。キレート樹脂としてはイミノ二酢酸型キレート樹脂が好ましく、具体的にはChelex−100(Bio Rad社製)を挙げることができる。
【0020】
Luフラクションから177Luを分離する工程において使用することができる陽イオン交換カラムに充填する陽イオン交換樹脂としては、スルホン酸型イオン交換樹脂が好ましく、具体的にはAG560Wx8(Bio Rad社製)を挙げることができる。
【0021】
分離後の177Luを含む溶液からFeを除去する工程において使用することができる陰イオン交換カラムに充填することができる陰イオン交換樹脂としては、トリメチルアンモニウム型、具体的にはAG1x8(Bio Rad社製)、を挙げることができる。また、この樹脂ではFeだけでなく、Zn、Ga、Mo等、いろいろな元素を除去することができる。
【0022】
また、本発明によれば、上述の方法で分離・精製された177Lu最終溶液を蒸発乾固し、酢酸溶液とした後、抗体溶液を添加して反応させ、177Lu−抗体を合成する工程を含む、177Lu−抗体の製造方法が提供される。
【0023】
177Luに抗体を結合させるためには、まずキレート剤を抗体に結合させ、次いで、キレート剤−抗体を177Luに結合させる。このとき使用することができるキレート剤としては、ポリアザポリカルボン酸誘導体及びポリアミノポリカルボン酸誘導体を好ましく用いることができる。ポリアザポリカルボン酸誘導体としては、特に1,4,7,10−テトラアザシクロドデカン−N,N’,N’’,N’’’−四酢酸(1,4,7,10-tetraazacyclododecan-N,N’,N’’,N’’’-tetraacetic acid(DOTA))、1,4,8,11−テトラアザシクロテトラデカン−N,N,N”,N”’−四酢酸(TETA)を挙げることができ、ポリアミノポリカルボン酸誘導体としては、特にジエチレントリアミン−N,N,N’,N”,N”−五酢酸(Diethylenetriamine-N,N,N',N",N"-pentaacetic acid(DTPA))、エチレンジアミン−N,N,N',N'−四酢酸(EDTA)を挙げることができる。
【0024】
キレート剤と結合させる抗体としては、悪性リンパ腫に多く発現するCD20抗原を認識するNuB2、乳癌、肺癌の治療を目的とする抗Erb−B2抗体(trastuzumab)、悪性リンパ腫の治療を目的とする抗CD22抗体(epratuzumab)、転移性大腸癌の治療を目的とする抗CEA抗体(cT84.66)、前立腺癌の治療を目的とする抗PMSA抗体(J591)、転移性腎細胞癌の治療を目的とする抗CA−IXG250/MN抗体(cG250)などを挙げることができる。
【発明の効果】
【0025】
本発明によれば、無担体177Luの精製純度を向上させることができるので、177Lu−キレート剤−抗体の標識率を大幅に向上させることができる。177Luは半減期が6.73日と癌治療に適しており、また最大エネルギー498keVのβ線を放出するため、癌治療に有望な核種である。本発明で分離・精製した177Luを用いて、癌細胞に発現する抗原に特異的に結合する177Lu−抗体を用いた癌治療の研究の進展が期待できる。
【図面の簡単な説明】
【0026】
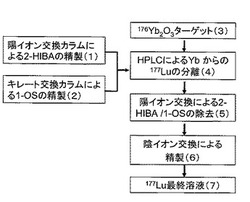
【図1】図1は、本発明による177Luの分離精製フローである。
【発明を実施するための形態】
【0027】
以下、実施例を参照しながら本発明を具体的に説明する。
【0028】
図1に本発明の177Luの分離精製フローを示す。177Luを得るためにターゲットである176Yb2O3を原子炉で照射して、照射済み176Yb2O3を得る(3)。照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLC逆相シリカゲルカラムに通して177LuとターゲットであるYbとを分離する(4)。このとき、2−HIBAを陽イオン交換カラムに通して不純物を除去し(1)、1−OSをキレート交換カラムに通して不純物を除去し(2)、両者を当量混合して溶離液を調製し、HPLCカラムに導入する。分離したLuフラクションを陽イオン交換カラムに通して177Luを吸着させ、HPLCの溶離液を除去して、177Luを分離する(5)。分離した177Luを含む溶液を陰イオン交換カラムに通して、Feを除去する(6)。精製された177Luを含む溶液を得る(7)。
【実施例】
【0029】
(1)溶離液の調製
陽イオン交換樹脂AG50Wx8(Bio Rad製)を15mmφ×113mmのカラムに詰めて陽イオン交換カラムを調製した。この陽イオン交換カラムに、0.5M 2−HIBA(2−ヒドロキシイソ酪酸)溶液を流し、2−HIBAの精製を行なった。
【0030】
キレート樹脂Chelex−100を15mmφ×113mmのカラムに詰めてキレート交換カラムを調製した。このキレート交換カラムに、0.2M 1−OS(1−オクタンスルホン酸ナトリウム)溶液を流し、1−OSの精製を行なった。
【0031】
0.5M 2−HIBA溶液と0.2M 1−OS溶液を当量混合して0.25M 2−HIBA/0.1M 1−OS溶液を調製した。
(2)無担体177Luの製造
176Yb2O3を原子炉(日本原子力研究開発機構のJRR3HR−2孔(1×1014n.cm-2.s-1.))を用いて6時間照射した。
【0032】
照射済み176Yb2O3を6M塩酸3mLと30%過酸化水素水2mLで溶解し、蒸発乾固させて0.01M HCl溶液としてHPLC(カラム:Waters Resolve C18 Radial-Pack 8mmφ×300mm)に仕込んだ。あらかじめ精製した溶離液(0.25M 2−HIBA/0.1M 1−OS溶液)をHPLCカラムに通して、ターゲットであるYbから177Luを分離した。
【0033】
分離した177Luフラクションを陽イオン交換カラム(Bio Rad製 AG50WX8、8mmφ×20mm)に通してLuを樹脂に吸着させておき、0.1M HClを流して2−HIBA/1−OSを完全に除去した。次いで、陽イオン交換カラムに6M HClを流して177Luを溶離した。
【0034】
最後に、溶離した177Luを含む溶出液を陰イオン交換カラム(Bio Rad製の陰イオン交換樹脂AG1x8を8mmφ×20mmのカラムに詰めた)に通して、177Lu最終溶液を得た。
(3)177Lu最終溶液中の不純物含有量
比較のため、対照1(HPLC溶離液の精製を行わず、HPLC溶出液の陰イオン交換による精製も行わなかった。従来方法と同じ)及び対照2(HPLC溶離液の精製は行ったが、HPLC溶出液の陰イオン交換による精製は行わなかった)を調製した。
(4)抗体標識
177Lu最終溶液を蒸発乾固し、0.1M酢酸35μlを加えて溶解させた。これに3M酢酸緩衝液(pH=6)を7μl及び5mg/ml DOTA−NuB2抗体溶液を26μl加えて、40℃で1.5時間反応させて、177Lu−DOTA−NuB2を合成した。なお、DOTA−NuB2抗体溶液の調製は以下のように行った。
【0035】
500μLのホウ酸緩衝液(0.1M,pH=8)中のNuB2に、5μL ジメチルスルホキシド(DMSO)中の1,4,7,10−テトラアザシクロドデカン−N,N’,N”,N’”−四酢酸モノ(N−ヒドロキシサクシンイミジルエステル)(1,4,7,10-tetraazacyclodocecane-N,N’,N’’,N’’’-tetracetic acid mono (N-hydroxysuccinimidyl ester))(mDOTA)を加え、15時間室温で反応させた後、0.5M酢酸緩衝液(pH=6)を通したゲルろ過カラムで精製した。
【0036】
次に、合成された177Lu−DOTA−NuB2を含む溶液に100mMのEDTA(ethylenediaminetetraacetic acid)を添加して、未反応の177Luを177Lu−EDTAとした。
【0037】
標識率は薄層クロマトグラフィ(TLC)で求めた。具体的には、合成した177Lu−DOTA−NuB2を含む溶液をTLCペーパー(Gelman Science Inc.のITLC SG)にスポットして生理食塩水で展開し177Lu−DOTA−NuB2と177Lu−EDTAを分離して、それぞれの放射能を測定した。Ge検出器で177Luの208keVのγ線を測定することにより放射能量を求めた。なお、本実験は抗体標識のため、20MBq程度の放射能を使用しているが、動物の治療には100〜200MBqが必要となる。
【0038】
標識率は下記式で求めた。
【0039】
標識率(%)=177Lu -DOTA-NuB2の放射能量/標識に使用した177Luの放射能量×100
なお、「標識に使用した177Luの放射能量」は177Lu−DOTA−NuB2と177Lu−EDTAに別れ、生成した177Lu−DOTA−NuB2の割合が標識率となる。
【0040】
本発明による実施例並びに対照1及び対照2について、Ca、Fe、Znの残留量測定結果及び標識率を表1に示す。
【0041】
【表1】

【0042】
表1より、本発明の分離・精製方法を行った実施例では従来法と比較してCa、Fe、Znの残留量が大幅に減少し、標識率が大幅に向上したことがわかる。
【技術分野】
【0001】
本発明は、抗体標識が可能な無担体177Luの分離精製法に関する。
【背景技術】
【0002】
RI(放射性同位元素)を用いた癌治療は、RI標識薬剤を体内に投与して癌細胞に特異的に集積させ、当該RIから放射される飛程の短い放射線を病巣の組織や細胞に照射することによって、目的とする病巣の組織や細胞を破壊して疾患を治療する方法であり、正常な身体組織や細胞への放射線の影響を低く抑えることができ、副作用が少ないことから、患者のQOL(生活の質)の向上が期待できる方法である。しかしながら、RI標識薬剤の癌集積性の向上及び非ターゲット臓器への集積の低減など、解決すべき課題が多く実用化は未だ限られている。
【0003】
現在国内で使用されている癌治療用RIは、131I、89Sr及び90Yの3種であり、すべてβ線放出RIである。これらβ線の組織中の飛程は、数〜数十ミリメートル程度であり、小〜中サイズの腫瘍の照射に適当な長さである。また、癌治療に有用なβ線を放出するRIは、数時間〜数日の範囲の適当な半減期を持つものが多く、さらに、多様な化学的性質を有する。加えて、体外からの画像化に適したガンマ線を放出する場合には、治療レベルの高線量での投与に先立ち、低い線量で生体内分布を確認することができるので、最適な放射性薬剤の投与量の決定に寄与できる。さらに、モニタリングすることにより癌の治療状況を的確に把握することができると共に、各組織の吸収線量の評価を治療と同時に行うことができる。
【0004】
RIを癌治療に利用するには、その物理的性質(半減期、β線エネルギー)に加え、RIの比放射能(安定同位体に対する放射性同位体の割合)も重要な要素の一つである。すなわち、治療効果を高めるためには、より多くのβ線エネルギーをターゲットの癌組織に照射することが必要であるため、比放射能が高いRIが有利である。177Luは、半減期が6.73日、β線の最大エネルギーが498keV、組織中のβ線の飛程が1.8mmと短く、画像化に適した113keVと208keVのγ線を放出する。さらに、ルテチウムは、臨床応用が認められたイットリウム(90Y)と同族元素であり、化学的特性が類似しているため、90Y標識薬剤の開発で蓄積された知見を有効に活用することができる。
【0005】
癌治療用の放射性同位元素として有望視されている177Luの製造方法には、原子炉を用いた直接法と間接法の2種類がある。
【0006】
直接法は、176Lu(n,γ)177Lu反応により177Luを製造する方法であり、ターゲットとしてLuを用いる。直接法により製造される177Luには安定同位元素であるLu担体が含まれる。
【0007】
間接法は、176Yb(n,γ)177Yb(半減期1.91時間)→177Lu反応により製造する方法であり、ターゲットとしてYbを用いる。間接法により製造される177Luには安定同位元素であるLu担体が含まれない。すなわち、無担体177Luを得ることができる。
【0008】
177Luを癌治療に用いる方法として、癌細胞に発現する抗原に特異的に結合可能な抗体に177Luを標識した177Lu−抗体を作製し、体内に投与して癌治療を行なう方法がある。この治療法の場合、安定同位元素であるLu担体を含んでいると、177Lu−抗体の標識率が低くなるとともに、体内においては、抗原に177Lu−抗体以外に安定Lu−抗体が結合して、177Luの治療効果を低下させる。そこで、このような癌治療法には間接法で製造した無担体177Luを用いる必要がある。
【0009】
癌治療に用いる177Lu−抗体は、無担体177Luと、1,4,7,10-tetraazacyclododecan-N,N’,N’’,N’’’-tetraacetic acid(DOTA)を抗体に結合させたDOTA−抗体とを反応させることによって得ることができる。
【0010】
間接法で製造した無担体177Luの製造、分離・精製法は橋本らの"Production of No-carrier-added 177Lu via the 176Lu(n, γ)177Yb→177Lu process", K. Hashimoto, H. Matsuoka, S. Uchida, Journal of Radioanalytical and Nuclear Chemistry, Vol. 255, No. 3 (2003)575-579に報告されている。
【0011】
橋本らの論文に記載されている分離・精製方法は逆相シリカゲルカラムを用いた方法であり、その手順は以下の通りである。
【0012】
176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る。次いで、照射済み176Yb2O3を塩酸と過酸化水素水で溶解して蒸発乾固の後0.01M HCl溶液とする。この溶液をHPLC(逆相シリカゲルカラム:Waters Resolve C18 Radial-Pack 8mmφ×300mm)にチャージし、溶離液として0.25M 2−ヒドロキシイソ酪酸(2−HIBA)/0.1M 1−オクタンスルホン酸ナトリウム(1−OS)を用い、流速2ml/minで、177LuとターゲットであるYbとを分離する。分離したLuフラクションを陽イオン交換カラム(Bio Rad社製AG50WX,8mmφ×20mm)に通してLuを樹脂に吸着させておき、0.1M HClを流して2−HIBA/1−OSを完全に除去した後、6M HClで177Luを溶離し、蒸発乾固を行なって標識実験用とする。
【0013】
しかし、橋本らの従来方法では、分離精製後の177LuにCa、Fe、Znが大量に含まれており、DOTA−抗体とCa、Fe、Znが優先的に結合してCa−抗体、Fe−抗体、Zn−抗体を作り、もはや177LuはDOTA−抗体と結合できなくなってしまい、177Lu−DOTA−抗体の標識ができない、という問題があった。
【先行技術文献】
【非特許文献】
【0014】
【非特許文献1】"Production of No-carrier-added 177Lu via the 176Lu(n, γ)177Yb→177Lu process", K. Hashimoto, H. Matsuoka, S. Uchida, Journal of Radioanalytical and Nuclear Chemistry, Vol. 255, No. 3 (2003)575-579
【発明の概要】
【発明が解決しようとする課題】
【0015】
本発明の目的は、Ca、Fe、Znを含まない無担体177Luを分離・精製して、標識率の高い177Lu抗体を提供することにある。
【課題を解決するための手段】
【0016】
本発明者らは鋭意研究の結果、177Luと抗体との結合を阻害するCa、Fe、Znの混入の原因が主に溶離液中に含まれる不純物であることを突き止め、溶離液をあらかじめ精製すること及び分離工程の最後に不純物を除去する工程を加えることで、上記課題を解決できることを知見した。
【0017】
すなわち、本発明によれば、176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る工程と、照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLCに通して177LuとターゲットであるYbとを分離する工程と、分離したLuフラクションを陽イオン交換カラムに通して177Luを分離する工程と、を含む177Luの分離・精製方法であって、HPLCを用いる分離工程において、あらかじめ陽イオン交換及びキレート交換により精製した溶離液を使用すること、及び陽イオン交換を用いる177Luの分離工程の後にさらに177Luを含む溶液を陰イオン交換カラムに通してFeを除去する工程を含むこと、を特徴とする分離・精製方法が提供される。
【0018】
HPLCとしては、充填剤としてシリカゲルを用いた逆相シリカゲルカラムを用いることができる。
【0019】
HPLCで用いる溶離液としては、従来法と同様に0.25M 2−ヒドロキシイソ酪酸(2−HIBA)/0.1M 1−オクタンスルホン酸ナトリウム(1−OS)を用いることができる。ただし、本発明においては、溶離液をHPLCカラムに通す前に、あらかじめ陽イオン交換及びキレート交換によって精製しておくことが必要である。溶離液の精製に使用することができる陽イオン交換樹脂としてはスルホン酸型イオン交換樹脂が好ましく、具体的にはAG560Wx8(Bio Rad社製)を挙げることができる。キレート樹脂としてはイミノ二酢酸型キレート樹脂が好ましく、具体的にはChelex−100(Bio Rad社製)を挙げることができる。
【0020】
Luフラクションから177Luを分離する工程において使用することができる陽イオン交換カラムに充填する陽イオン交換樹脂としては、スルホン酸型イオン交換樹脂が好ましく、具体的にはAG560Wx8(Bio Rad社製)を挙げることができる。
【0021】
分離後の177Luを含む溶液からFeを除去する工程において使用することができる陰イオン交換カラムに充填することができる陰イオン交換樹脂としては、トリメチルアンモニウム型、具体的にはAG1x8(Bio Rad社製)、を挙げることができる。また、この樹脂ではFeだけでなく、Zn、Ga、Mo等、いろいろな元素を除去することができる。
【0022】
また、本発明によれば、上述の方法で分離・精製された177Lu最終溶液を蒸発乾固し、酢酸溶液とした後、抗体溶液を添加して反応させ、177Lu−抗体を合成する工程を含む、177Lu−抗体の製造方法が提供される。
【0023】
177Luに抗体を結合させるためには、まずキレート剤を抗体に結合させ、次いで、キレート剤−抗体を177Luに結合させる。このとき使用することができるキレート剤としては、ポリアザポリカルボン酸誘導体及びポリアミノポリカルボン酸誘導体を好ましく用いることができる。ポリアザポリカルボン酸誘導体としては、特に1,4,7,10−テトラアザシクロドデカン−N,N’,N’’,N’’’−四酢酸(1,4,7,10-tetraazacyclododecan-N,N’,N’’,N’’’-tetraacetic acid(DOTA))、1,4,8,11−テトラアザシクロテトラデカン−N,N,N”,N”’−四酢酸(TETA)を挙げることができ、ポリアミノポリカルボン酸誘導体としては、特にジエチレントリアミン−N,N,N’,N”,N”−五酢酸(Diethylenetriamine-N,N,N',N",N"-pentaacetic acid(DTPA))、エチレンジアミン−N,N,N',N'−四酢酸(EDTA)を挙げることができる。
【0024】
キレート剤と結合させる抗体としては、悪性リンパ腫に多く発現するCD20抗原を認識するNuB2、乳癌、肺癌の治療を目的とする抗Erb−B2抗体(trastuzumab)、悪性リンパ腫の治療を目的とする抗CD22抗体(epratuzumab)、転移性大腸癌の治療を目的とする抗CEA抗体(cT84.66)、前立腺癌の治療を目的とする抗PMSA抗体(J591)、転移性腎細胞癌の治療を目的とする抗CA−IXG250/MN抗体(cG250)などを挙げることができる。
【発明の効果】
【0025】
本発明によれば、無担体177Luの精製純度を向上させることができるので、177Lu−キレート剤−抗体の標識率を大幅に向上させることができる。177Luは半減期が6.73日と癌治療に適しており、また最大エネルギー498keVのβ線を放出するため、癌治療に有望な核種である。本発明で分離・精製した177Luを用いて、癌細胞に発現する抗原に特異的に結合する177Lu−抗体を用いた癌治療の研究の進展が期待できる。
【図面の簡単な説明】
【0026】
【図1】図1は、本発明による177Luの分離精製フローである。
【発明を実施するための形態】
【0027】
以下、実施例を参照しながら本発明を具体的に説明する。
【0028】
図1に本発明の177Luの分離精製フローを示す。177Luを得るためにターゲットである176Yb2O3を原子炉で照射して、照射済み176Yb2O3を得る(3)。照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLC逆相シリカゲルカラムに通して177LuとターゲットであるYbとを分離する(4)。このとき、2−HIBAを陽イオン交換カラムに通して不純物を除去し(1)、1−OSをキレート交換カラムに通して不純物を除去し(2)、両者を当量混合して溶離液を調製し、HPLCカラムに導入する。分離したLuフラクションを陽イオン交換カラムに通して177Luを吸着させ、HPLCの溶離液を除去して、177Luを分離する(5)。分離した177Luを含む溶液を陰イオン交換カラムに通して、Feを除去する(6)。精製された177Luを含む溶液を得る(7)。
【実施例】
【0029】
(1)溶離液の調製
陽イオン交換樹脂AG50Wx8(Bio Rad製)を15mmφ×113mmのカラムに詰めて陽イオン交換カラムを調製した。この陽イオン交換カラムに、0.5M 2−HIBA(2−ヒドロキシイソ酪酸)溶液を流し、2−HIBAの精製を行なった。
【0030】
キレート樹脂Chelex−100を15mmφ×113mmのカラムに詰めてキレート交換カラムを調製した。このキレート交換カラムに、0.2M 1−OS(1−オクタンスルホン酸ナトリウム)溶液を流し、1−OSの精製を行なった。
【0031】
0.5M 2−HIBA溶液と0.2M 1−OS溶液を当量混合して0.25M 2−HIBA/0.1M 1−OS溶液を調製した。
(2)無担体177Luの製造
176Yb2O3を原子炉(日本原子力研究開発機構のJRR3HR−2孔(1×1014n.cm-2.s-1.))を用いて6時間照射した。
【0032】
照射済み176Yb2O3を6M塩酸3mLと30%過酸化水素水2mLで溶解し、蒸発乾固させて0.01M HCl溶液としてHPLC(カラム:Waters Resolve C18 Radial-Pack 8mmφ×300mm)に仕込んだ。あらかじめ精製した溶離液(0.25M 2−HIBA/0.1M 1−OS溶液)をHPLCカラムに通して、ターゲットであるYbから177Luを分離した。
【0033】
分離した177Luフラクションを陽イオン交換カラム(Bio Rad製 AG50WX8、8mmφ×20mm)に通してLuを樹脂に吸着させておき、0.1M HClを流して2−HIBA/1−OSを完全に除去した。次いで、陽イオン交換カラムに6M HClを流して177Luを溶離した。
【0034】
最後に、溶離した177Luを含む溶出液を陰イオン交換カラム(Bio Rad製の陰イオン交換樹脂AG1x8を8mmφ×20mmのカラムに詰めた)に通して、177Lu最終溶液を得た。
(3)177Lu最終溶液中の不純物含有量
比較のため、対照1(HPLC溶離液の精製を行わず、HPLC溶出液の陰イオン交換による精製も行わなかった。従来方法と同じ)及び対照2(HPLC溶離液の精製は行ったが、HPLC溶出液の陰イオン交換による精製は行わなかった)を調製した。
(4)抗体標識
177Lu最終溶液を蒸発乾固し、0.1M酢酸35μlを加えて溶解させた。これに3M酢酸緩衝液(pH=6)を7μl及び5mg/ml DOTA−NuB2抗体溶液を26μl加えて、40℃で1.5時間反応させて、177Lu−DOTA−NuB2を合成した。なお、DOTA−NuB2抗体溶液の調製は以下のように行った。
【0035】
500μLのホウ酸緩衝液(0.1M,pH=8)中のNuB2に、5μL ジメチルスルホキシド(DMSO)中の1,4,7,10−テトラアザシクロドデカン−N,N’,N”,N’”−四酢酸モノ(N−ヒドロキシサクシンイミジルエステル)(1,4,7,10-tetraazacyclodocecane-N,N’,N’’,N’’’-tetracetic acid mono (N-hydroxysuccinimidyl ester))(mDOTA)を加え、15時間室温で反応させた後、0.5M酢酸緩衝液(pH=6)を通したゲルろ過カラムで精製した。
【0036】
次に、合成された177Lu−DOTA−NuB2を含む溶液に100mMのEDTA(ethylenediaminetetraacetic acid)を添加して、未反応の177Luを177Lu−EDTAとした。
【0037】
標識率は薄層クロマトグラフィ(TLC)で求めた。具体的には、合成した177Lu−DOTA−NuB2を含む溶液をTLCペーパー(Gelman Science Inc.のITLC SG)にスポットして生理食塩水で展開し177Lu−DOTA−NuB2と177Lu−EDTAを分離して、それぞれの放射能を測定した。Ge検出器で177Luの208keVのγ線を測定することにより放射能量を求めた。なお、本実験は抗体標識のため、20MBq程度の放射能を使用しているが、動物の治療には100〜200MBqが必要となる。
【0038】
標識率は下記式で求めた。
【0039】
標識率(%)=177Lu -DOTA-NuB2の放射能量/標識に使用した177Luの放射能量×100
なお、「標識に使用した177Luの放射能量」は177Lu−DOTA−NuB2と177Lu−EDTAに別れ、生成した177Lu−DOTA−NuB2の割合が標識率となる。
【0040】
本発明による実施例並びに対照1及び対照2について、Ca、Fe、Znの残留量測定結果及び標識率を表1に示す。
【0041】
【表1】

【0042】
表1より、本発明の分離・精製方法を行った実施例では従来法と比較してCa、Fe、Znの残留量が大幅に減少し、標識率が大幅に向上したことがわかる。
【特許請求の範囲】
【請求項1】
176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る工程と、
照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLCに通して177LuとターゲットであるYbとを分離する工程と、
分離したLuフラクションを陽イオン交換カラムに通して177Luを分離する工程と、を含む177Luの分離・精製方法であって、
HPLCを用いる分離工程において、あらかじめ陽イオン交換及びキレート交換により精製した溶離液を使用すること、及び
陽イオン交換を用いる177Luの分離工程の後にさらに177Luを含む溶液を陰イオン交換カラムに通してFeを除去する工程を含むこと、
を特徴とする177Luの分離・精製方法。
【請求項2】
請求項1に記載の方法によって分離・精製された177Lu最終溶液を蒸発乾固し、酸溶液に溶解させた後、キレート剤−抗体溶液を添加して反応させ、177Lu−キレート剤−抗体を合成する工程を含む、177Lu−キレート剤−抗体の製造方法。
【請求項3】
前記キレート剤−抗体溶液は、ホウ酸緩衝液中でキレート剤と抗体とを反応させ、次いで酢酸緩衝液を通したゲル濾過カラムで精製することによって得られ、
前記177Lu−キレート剤−抗体は、得られた当該キレート剤−抗体溶液を177Lu酸溶液に加えて反応させることによって得られる
ことを特徴とする請求項1に記載の177Lu−キレート剤−抗体の製造方法。
【請求項4】
前記キレート剤は、ポリアザポリカルボン酸誘導体及びポリアミノポリカルボン酸誘導体から選択される、請求項2又は3に記載の製造方法。
【請求項5】
ポリアザポリカルボン酸誘導体は1,4,7,10−テトラアザシクロドデカン−N,N’,N’’,N’’’−四酢酸(DOTA)及び1,4,8,11−テトラアザシクロテトラデカン−N,N,N'',N''−四酢酸(TETA)から選択され、
ポリアミノポリカルボン酸誘導体は、ジエチレントリアミン−N,N,N',N'',N''−五酢酸((DTPA)及びエチレンジアミン−N,N,N',N'−四酢酸(EDTA)から選択される、請求項4に記載の製造方法。
【請求項6】
前記抗体は、NuB2、Erb−B2、CD22、CEA、PMSA、CA−IXG250/MNから選択される、
請求項2〜5のいずれか1項に記載の177Lu−キレート剤−抗体の製造方法。
【請求項1】
176Yb2O3を原子炉で照射し、照射済み176Yb2O3を得る工程と、
照射済み176Yb2O3を塩酸に溶解したHCl溶液をHPLCに通して177LuとターゲットであるYbとを分離する工程と、
分離したLuフラクションを陽イオン交換カラムに通して177Luを分離する工程と、を含む177Luの分離・精製方法であって、
HPLCを用いる分離工程において、あらかじめ陽イオン交換及びキレート交換により精製した溶離液を使用すること、及び
陽イオン交換を用いる177Luの分離工程の後にさらに177Luを含む溶液を陰イオン交換カラムに通してFeを除去する工程を含むこと、
を特徴とする177Luの分離・精製方法。
【請求項2】
請求項1に記載の方法によって分離・精製された177Lu最終溶液を蒸発乾固し、酸溶液に溶解させた後、キレート剤−抗体溶液を添加して反応させ、177Lu−キレート剤−抗体を合成する工程を含む、177Lu−キレート剤−抗体の製造方法。
【請求項3】
前記キレート剤−抗体溶液は、ホウ酸緩衝液中でキレート剤と抗体とを反応させ、次いで酢酸緩衝液を通したゲル濾過カラムで精製することによって得られ、
前記177Lu−キレート剤−抗体は、得られた当該キレート剤−抗体溶液を177Lu酸溶液に加えて反応させることによって得られる
ことを特徴とする請求項1に記載の177Lu−キレート剤−抗体の製造方法。
【請求項4】
前記キレート剤は、ポリアザポリカルボン酸誘導体及びポリアミノポリカルボン酸誘導体から選択される、請求項2又は3に記載の製造方法。
【請求項5】
ポリアザポリカルボン酸誘導体は1,4,7,10−テトラアザシクロドデカン−N,N’,N’’,N’’’−四酢酸(DOTA)及び1,4,8,11−テトラアザシクロテトラデカン−N,N,N'',N''−四酢酸(TETA)から選択され、
ポリアミノポリカルボン酸誘導体は、ジエチレントリアミン−N,N,N',N'',N''−五酢酸((DTPA)及びエチレンジアミン−N,N,N',N'−四酢酸(EDTA)から選択される、請求項4に記載の製造方法。
【請求項6】
前記抗体は、NuB2、Erb−B2、CD22、CEA、PMSA、CA−IXG250/MNから選択される、
請求項2〜5のいずれか1項に記載の177Lu−キレート剤−抗体の製造方法。
【図1】




【公開番号】特開2010−223827(P2010−223827A)
【公開日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願番号】特願2009−72558(P2009−72558)
【出願日】平成21年3月24日(2009.3.24)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託事業の成果に記載事項 平成20年度文部科学省原子力基礎基盤研究委託事業「先進的ながん診断・治療を実現するRI−DDS開発研究」(委託事業)、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(505374783)独立行政法人 日本原子力研究開発機構 (727)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
【公開日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願日】平成21年3月24日(2009.3.24)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託事業の成果に記載事項 平成20年度文部科学省原子力基礎基盤研究委託事業「先進的ながん診断・治療を実現するRI−DDS開発研究」(委託事業)、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(505374783)独立行政法人 日本原子力研究開発機構 (727)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
[ Back to top ]

