抗体療法
【課題】癌の治療に対して有効な、免疫学的試薬および少なくとも1種類の治療薬を未接合形態にて含んでなる医薬組成物の提供。
【解決手段】少なくとも1種類のクラスIII抗CEAモノクローナル抗体(MAb)またはその断片、好ましくはクラスIII抗CEAMAbまたは断片と、少なくとも1種類の治療薬を含んでなる組成物。好ましくは、抗体断片は、F(ab')2、Fab'、Fab、Fv、およびscFvからなる群から選択される。また、クラスIII抗CEAMAbまたはその断片はヒト化したものであり、ヒト化MAbが実質的にネズミのクラスIII抗CEAMAbのクラスIII抗CEA結合特異性を保持しているものも好ましい。
【解決手段】少なくとも1種類のクラスIII抗CEAモノクローナル抗体(MAb)またはその断片、好ましくはクラスIII抗CEAMAbまたは断片と、少なくとも1種類の治療薬を含んでなる組成物。好ましくは、抗体断片は、F(ab')2、Fab'、Fab、Fv、およびscFvからなる群から選択される。また、クラスIII抗CEAMAbまたはその断片はヒト化したものであり、ヒト化MAbが実質的にネズミのクラスIII抗CEAMAbのクラスIII抗CEA結合特異性を保持しているものも好ましい。
【発明の詳細な説明】
【関連出願】
【0001】
本出願は、2003年5月2日出願の米国仮特許出願第60/467,161号の一部継続出願である。本出願は、2002年10月11日出願の国際出願第PCT/US/02/32307号に対する優先権を主張しており、この国際出願はまた2002年10月8日出願の米国仮特許出願第60/416,531号に対する優先権を主張している。
【発明の背景】
【0002】
A.発明の分野
本発明は、癌胎児性抗原(「CEA」)を発現する癌、特に甲状腺髄様癌(MTC)、甲状腺非髄様癌(非-MTC)、結腸直腸癌、肝細胞癌、胃癌、肺癌、乳癌および他の癌の治療方法であって、別の抗体、化学療法薬、放射性薬剤、イムノモジュレーター、免疫接合体またはそれらの組合せなどの少なくとも1種類の他の治療薬と組み合わせた抗体を含んでなる免疫学的試薬を投与することによってCEAを発現することを特徴とする方法に関する。本発明はまた、免疫学的試薬および少なくとも1種類の治療薬を未接合形態にて含んでなる医薬組成物にも関する。詳細には、本発明は、治療薬の投与前、中または後に、クラスIII抗-癌胎児性抗原(「抗CEA」)モノクローナル抗体(「MAb」)、特に相当するネズミのクラスIII抗CEA MAbの結合親和性特性および特異性を有するMAb、さらに詳細にはヒト抗体の抗原およびエフェクター特性を一層多く有するヒト化、キメラまたはヒトMAbを投与することによるCEAを発現する癌の治療方法に関する。治療方法において特に有用なMAbは、抗CEAネズミMAbの相補性決定領域(「CDR」)がヒト抗体の枠組構造領域に移植されているヒト化MAbである。
【0003】
B.背景技術
CEAは多数の上皮癌で通常に発現され、最も一般的には結腸で生じるが、胸部、肺、膵臓、甲状腺(髄様型)および卵巣でも生じるる癌胎児性抗原である(Goldenberg et al., J. Natl. Cancer Inst. 57: 11-22 (1976), Shively, et al., Crit. Rev. Oncol. Hematol. 2: 355-399 (1985))。CEAは、当初は結腸直腸癌の腫瘍特異性抗原であると考えられた(Gold et al., J. Exper. Med., 122: 467 (1965))。しかしながら、これは、後年に多種多様な癌、良性腫瘍および疾病組織、並びに通常のヒト結腸に存在することが見出された(Shively et al., Crit. Rev. Oncol. Hematol., 2: 355 (1985); von Kleist et al., Proc. Natl. Acad. Sci. U.S.A., 69: 2492 (1972))。CEAは同型および異型相互作用によって細胞-細胞接着をし、これらの相互作用は腫瘍形成の様々な態様におけるCEAの役割にも関与していることが示された。
【0004】
甲状腺に限定される甲状腺髄様癌(MTC)は、甲状腺全摘出および中心リンパ節切除によって治癒する可能性がある。しかしながら、これらの患者の約50%において、疾患が再発する。その上、切除できない疾患または離れた部位の転移を有する患者の予後は不十分であり、10年生存率は30%未満である(Rossi et al., Amer. J. Surgery, 139: 554 (1980); Samaan et al., J. Clin. Ezzdocrinol. Metab., 67:801 (1988); Schroder et al., Cancer, 61:806 (1988))。これらの患者は、治療法の選択の余地がほとんどない(「腫瘍学の原理と実践(Principles and Practice of Oncology)」, DeVita, Hellman and Rosenberg監修, New York: JB Lippincott Co. 1333-1435 (1989); Cance et al., Current Problems Surgery, 22:1 (1985) )。化学療法はは余り役に立たず、放射線療法は局所疾患の抑制にしか用いられない(Cance et al.; Tubiana et al., Cancer, 55:2062 (1985))。従って、この疾患を治療するには、新たな抑制モダリティーが必要である。
【0005】
癌の治療および診断に有用な方法では、抗体のターゲッティングを用いて治療および診断薬を悪性腫瘍の部位に直接送達する方法が用いられる。過去10年間に、多種多様な腫瘍特異性抗体および抗体断片が開発されてきたが、その理由は、それが薬剤、毒素、放射性核種、サイトカインまたは他の薬剤のようなイムノモジュレーターなどの治療薬に抗体を接合し、腫瘍をターゲッティングする接合体を患者に投与する方法を有しているためである。しかしながら、ネズミモノクローナル抗体(大抵の場合にはヒトに対する抗体のターゲッティングに用いられてきた)と複合体形成した薬剤または放射性核種を投与した患者は、循環するヒト抗マウス抗体(HAMA)を生じ時には複合体の抗体部分に対する全身性の即時型III型過敏症反応を発現する。しかしながら、これらの問題点は、ヒト化、キメラまたはヒト抗体の作製を包含む多数の様々な手法によりこれらネズミ抗体の免疫原性を少なくすることによって、ポリエチレングリコールをターゲッティング抗体に接合すること(PEG化)によるなどのターゲッティング抗体の化学修飾によって、または抗体における抗原性の部位を特定した後にそれを除くことによって、例えば、Fab'、F(ab)2および他の抗体断片を全IgGの代わりに用いることによって、上記問題点は少なくなった。その上、HAMAを血液から血漿分離法により(plasmaphoretically)除去することによって、HAMAの有害な作用を減少させる様々な試みがなされてきた。免疫抑制法も用いられ、外来抗体の有害な作用がターゲッティング薬を用いて複数の治療を行うのに十分なほどまで改善された。
【0006】
これらの治療の進歩とは関係なく、CEAを発現する癌の一層有効な治療方法を提供することが未だに求められている。本発明は、例えば、米国特許第5,874,540号明細書およびHansen et al., Cancer, 71:3478 (1993)に定義されているネズミMN-14MAbであるクラスIII抗CEA MAb、および米国特許第5,874,540号明細書に定義されているキメラおよびヒト化MN-14MAbであるクラスIII抗CEA MAb、およびPrimus et al.による米国特許第4,818,709号明細書に定義されているNP-4のような抗CEA抗体を用いる効果的な治療法を提供し、上記文献の総ての内容は、その開示の一部として本明細書に引用されている。好ましくは、クラスIII抗CEA MAbはヒト化したものであり、治療薬、特に化学療法薬と併用して、毒性をできるだけ少なくしてCEA発現癌の効果的な治療を行う。また、クラスII MAb、例えば、MN-6(Hansen et al., 上記引用を参照されたい)およびNP-3(米国特許第4,818,709号明細書を参照されたい)、およびクラスI MAb、例えば、MN-3およびMN-15(また、Hansen et al., 上記引用を参照されたい)のような他の抗CEA抗体は、CEA発現癌の有効な治療方法を提供する。さらに、これらの二成分を別個に投与すると、効果が増大し、個々の治療方法を調整する多用性および適応性が得られる。
【発明の概要】
【0007】
本発明は、甲状腺髄様癌および甲状腺非髄様癌の治療組成物および治療方法を意図するものである。
【0008】
本発明の第一の態様は、少なくとも1種類のクラスIII抗CEAモノクローナル抗体(MAb)またはその断片、好ましくはクラスIII抗CEA MAbまたは断片と、少なくとも1種類の治療薬を含んでなる組成物である。好ましくは、抗体断片は、F(ab')2、Fab'、Fab、Fv、およびscFvからなる群から選択される。また、クラスIII抗CEA MAbまたはその断片はヒト化したものであり、ヒト化MAbが実質的にネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を保持しているものも好ましい。クラスIII抗CEA MAbまたはその断片がキメラMAbであり、キメラMAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものも好ましい。さらに、クラスIII抗CEA MAbまたはその断片が完全ヒトMAbであって、上記の完全にヒトのMAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものも好ましい。この目的のための他の好ましい抗CEA MAbとしては、CD66a-dと交差反応性ではないクラスII MAbまたはその断片であって、さらに詳細に本明細書で説明されるものが挙げられる。他の態様としては、CD66a、bおよびdとは反応することができるが、CD66cとは反応しないクラスII抗CEA Mabまたはその断片、またはCD66a、bまたはd並びにCD66cと反応するクラスI Mabまたはその断片が挙げられる(クラスI MabがCD66cと結合するという定義による)。
【0009】
本発明の一態様において、クラスIII抗CEAモノクローナル抗体またはその断片は、好ましくはMN-14抗体またはその断片である。さらに好ましくは、MN-14モノクローナル抗体またはその断片は、ネズミのMN-14モノクローナル抗体の相補性決定領域(CDR)であって、MN-14抗体の軽鎖可変領域のCDRが、アミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、クラスIII抗CEA抗体の重鎖可変領域のCDRが、TYWMS を含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。また好ましくは、MN-14モノクローナル抗体はCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない。最も好ましくは、MN-14モノクローナル抗体またはその断片は、ヒト化、キメラまたは完全ヒトMN-14抗体またはその断片である。
【0010】
好ましい態様によれば、ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)は、ネズミMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。とりわけ、ヒト化MN-14抗体またはその断片は、好ましくは図14A-Cのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24(A)、28(D)、30(T)、48(1)、49(G)、74(A)および94(S)からなる群から選択されるネズミMN-14抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。同様に、ヒト化MN-14抗体またはその断片は、ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなることもできる。さらに好ましくは、ヒト化MN-14抗体またはその断片は、図13Aに示される軽鎖可変領域と、KLHuVhAIGAと呼ばれる図14A-Cに示される重鎖可変領域を含んでなる。
【0011】
本発明の第一の態様において、治療薬は、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、免疫接合体、ホルモン、またはそれらの組合せであって、所望により、薬学上許容可能なビヒクル中に処方されたものからなる群から選択される。本明細書では、治療薬がダカルバジン(DTIC)でないことも意図される。
【0012】
本発明の第二の態様は、クラスIII抗CEAモノクローナル抗体またはその断片の治療上有効量および少なくとも1種類の治療薬であって、場合により薬学上許容可能なビヒクル中に処方したものを同時または逐次的に投与することを含んでなる甲状腺髄様並びに甲状腺非髄様癌の治療方法を説明する。好ましくは、抗体断片はF(ab')2、Fab'、Fab、Fv、およびscFvからなる群から選択される。クラスIII抗CEA MAbまたはその断片がヒト化したものであり、上記ヒト化MAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものであることも好ましい。クラスIII抗CEA MAbまたはその断片がキメラMAbであって、上記キメラMAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものであるものも意図される。
【0013】
好ましい態様によれば、クラスIII抗CEAモノクローナル抗体またはその断片はMN-14抗体またはその断片である。好ましくは、MN-14モノクローナル抗体またはその断片はネズミのMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRはアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記クラスIIIのMN-14抗体の重鎖可変領域のCDRはTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。MN-14モノクローナル抗体がヒト化、キメラまたは完全にヒトのものであり、CEAと反応しかつ通常の交差反応性抗原(NCA)および胎便抗原とは反応しないものも好ましい。MN-14抗体またはその断片を、注入用量当たり100-600mgタンパク質の投薬量で投与するのも好ましい。最も好ましくは、MN-14抗体またはその断片は、注入用量当たり(per dose per injection)300-400mgタンパク質の投薬量で投与される。
【0014】
本発明の方法において、上記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)は、好ましくはネズミMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。さらに好ましくは、上記ネズミMN-14抗体の上記の相当するFR由来の少なくとも1種類のアミノ酸を含んでなるヒト化MN-14抗体またはその断片は、上記したように図14A-Cのネズミの重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94 からなる群から選択される。上記ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなるヒト化MN-14抗体またはその断片も好ましい。最も好ましくは、ヒト化MN-14抗体またはその断片は、図13A (中央配列)または図22A (hMN-14)または図23Aに記載の軽鎖可変領域と KLHuVhAIGAと称される図14A-Cまたは図22B (hMn-14)または図23Bに記載の重鎖可変領域を含んでなる。
【0015】
本発明の方法はまた、EGP-1、EGP-2(例えば、17-1A)、IL-6、インスリン様増殖因子-1、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、胎盤増殖因子(PlGF)または他の腫瘍血管新生抗原、Ga733、テネイシン、フィブロネクチンまたはそれらの組合せと反応するモノクローナル抗体またはその断片からなる群から選択される第二のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片の治療上有効量を患者に同時または逐次的に投与することを特徴とすることができる。同様に、この方法は、上記のクラスIまたはクラスIIまたはクラスIII抗CEAモノクローナル抗体またはその断片からなる群から選択される第二のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片の治療上有効量を患者に同時にまたは逐次的に投与することを含んでなることもある。好ましくは、第二の抗体またはその断片は、裸のものであるかまたは治療薬に接合している。
【0016】
本明細書に記載の方法の好ましい態様によれば、治療薬は裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、CEAまたは非CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクルで処方されたものからなる群から選択される。治療薬がダカルバジン(DTIC)でないことも意図される。
【0017】
好ましくは、治療薬は、薬剤または毒素からなる群から選択される細胞傷害性物質である。例えば、薬剤が有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2、および抗生物質、およびそれらの組合せからなる群から選択される薬学特性を有することが意図される。好ましくは、薬剤は、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される。
【0018】
治療薬が微生物、植物または動物毒素であるときには、この薬剤はリシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択することができる。
【0019】
本発明による方法では、治療薬が、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチンおよびそれらの組合せからなる群から選択されるイムノモジュレーターであることも意図される。好ましくは、リンホトキシンは腫瘍壊死因子(TNF)であり、上記造血因子はインターロイキン(IL)であり、上記コロニー刺激因子は顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、上記インターフェロンがインターフェロン-α、-βまたは-γであり、上記幹細胞増殖因子は「S1因子」と称されるものである。イムノモジュレーターがIL-1、IL-2、IL-3、IL-6, IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-α、またはそれらの組合せであるのも好ましい。骨髄または造血毒性を生じる細胞傷害性薬剤への暴露の前、同時、または後のサイトカインの投与は、米国特許第5,120,525号明細書に記載されており、この特許明細書の内容は、その開示の一部として本明細書に引用されている。
【0020】
治療薬が、色素原(chromogen)または色素である光活性治療薬であるか、またはダカルバジンであるアルキル化剤であるのも好ましい。
【0021】
治療薬は、エネルギーが20-10,000keVの放射性核種であることも好ましい。好ましくは、放射性核種は、125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される。
【0022】
他の態様によれば、本明細書に記載されているように、イムノモジュレーターは抗CEAモノクローナル抗体またはその断片の単独の治療上有効量を投与する前に投与され、またはイムノモジュレーターは抗CEAモノクローナル抗体と少なくとも1種類の治療薬の治療上有効量を投与する前に投与され、本明細書に記載のこれらの成分のいずれかは所望により学上許容可能なビヒクル中に処方される。
【発明の具体的説明】
【0023】
1.概観
本発明は、裸の抗CEA抗体またはその断片と少なくとも1種類の治療薬を治療期間にわたって逐次的または同時に投与する治療方法を提供する。この方法は、特に甲状腺髄様癌の治療に有用であるが、意外なことには、甲状腺非髄様癌、結腸直腸癌、肝細胞癌、膵臓癌、乳癌、肺癌、頭部と首部癌、膀胱癌、子宮癌および卵巣癌、およびCEAを余り高水準で発現しない癌の治療に有用である。例えば、少なくとも100ng/g組織の水準でCEAを発現する癌における治療が意図される。本発明の方法は、さらに抗CEA抗体、好ましくはクラスIII抗CEA抗体または抗体断片を含んでなる組成物であって、抗体および治療薬が互いに接合または結合しないものを提供する。本発明で用いられる「クラスIII抗CEA」抗体または抗体断片という用語は、CEA抗原(またはCD66e)に結合しかつ通常の交差反応性抗原(NCA)、胎便抗原(MA)、顆粒球およびCD66a-dとは反応しない抗体または断片を意味する(Primus et al.,米国特許第4,818,709号明細書を参照されたい。上記特許明細書の内容は、その開示の一部として本明細書に引用されている)。裸のクラスIII抗CEA抗体またはその断片は、ヒト化、キメラ、ヒトまたはネズミ抗体であってもよい。好ましい態様によれば、裸のクラスIII抗CEA抗体またはその断片はヒト化MN-14抗体またはその断片である。
【0024】
また、CD66a-dとは交差反応性でないクラスII Mabが本発明で用いるために意図される。これらは、胎便抗原と反応するが、NCAと反応せずかつ顆粒球と反応しないCEAドメインN-A1B1、A2B2と反応するMabである。例えば、NP-3およびMN-6は、本発明で有用なクラスII抗CEA抗体である。また、CD66a、bおよびdと反応することができるがCD66cとは反応することができないクラスII抗CEA Mabまたはその断片、またはCD66a、bまたはd並びにCD66cと反応するクラスI Mabまたはその断片も、本発明で用いるために意図される。(クラスI MabがCD66cと結合するという定義による)。
【0025】
意外なことには、本明細書に記載の組成物および方法は、結直腸癌、膵臓癌、乳癌、肺癌、肝細胞癌、膀胱癌、頭部と首部癌、および卵巣癌などの甲状腺非髄様癌の治療にも有用である。これらの形態の癌は甲状腺髄様癌よりCEAの発現が少ないので、治療薬と併用した裸のクラスIII抗CEA抗体は甲状腺非髄様癌の治療に有用であることが期待されなかった。
【0026】
裸のクラスIII抗CEA抗体による腫瘍細胞を殺す機構は確実には知られていないが、幾つかの機構を伴うと思われる。裸の抗体は単独でまたは治療薬と併用することにより、それらのそれぞれの抗原の生物学的活性をブロックすることによってまたは抗体依存性細胞傷害(ADCC)または補体依存性リーシスのような天然の免疫学的機能を刺激することによって腫瘍増殖に影響を与えることができると仮定されている。さらに、裸の抗体は単独でまたは治療薬と併用することにより、細胞増殖および細胞サイクル進行を阻害し、アポトーシスを誘導し、血管新生を阻害し、転移活性を阻害し、および/または腫瘍細胞接着に影響を与えることによって癌を治療し、制御することができる。実際に、本発明の抗CEA抗体またはその断片は、転移が腫瘍細胞接着の拮抗薬に一層感受性である可能性があるので、原発性癌より転移癌の治療に一層効果的であることがある。本発明の治療方法は、最適化を行い、抗体と一種類以上の治療薬を滴加して効果的な治療方法を提供することによって個々の患者にとって最大の抗腫瘍活性を提供することができる治療計画を提供する。
【0027】
本発明の一態様によれば、裸のクラスIII抗CEA抗体またはその断片と治療薬には、裸のまたは接合したヒト化、ネズミ、キメラまたはヒト抗体、融合タンパク質、またはその断片のような少なくとも1種類の補助治療薬を追加することができる。例えば、非ブロック性であり且つ顆粒球またはCD66a-dに結合しない別のクラスIII CEA抗体または抗体断片、非ブロック性であり且つ顆粒球またはCD66a-dに結合しないクラスII抗CEA抗体または抗体断片、CD66a、bおよびdとは反応するが、CD66cとは反応しないクラスII抗CEA Mabまたはその断片、CD66a、またはd並びにCD66cと反応するクラスI Mab(クラスI MabがCD66cと結合するという定義による)、または様々な癌関連エピトープまたは抗原に対する抗体を、好ましいヒト化MN-14抗体との併用治療の治療薬として用いることができる。このような補助抗体、融合タンパク質またはその断片は、以下において一層詳細に記載されるように、CEAまたは別の癌または腫瘍関連抗原に結合することができる。
【0028】
2.定義
以下の説明において、多数の用語を用いており、本発明の理解を容易にするために以下の定義を提供する。
【0029】
本明細書に記載の抗体は、完全長(すなわち、天然に存在するものまたは通常の免疫グロブリン遺伝子断片組換え法によって形成されたもの)の免疫グロブリン分子(例えば、IgG抗体)、または抗体断片のような免疫グロブリン分子の免疫学的に活性な(すなわち、特異結合性)部分を表す。
【0030】
抗体断片は、F(ab')2、F(ab)2、Fab'、Fab、Fv、scFv (一本鎖Fv)などの抗体の部分である。構造とは無関係に、抗体断片は完全な抗体によって認識される同じ抗原と結合する。
【0031】
「抗体断片」という用語は、特異抗原に結合して複合体を形成することによって抗体のような作用をする任意の合成または遺伝子工学処理を行ったタンパク質も包含する。例えば、抗体断片としては、例えば、重鎖および軽鎖の可変領域からなる「Fv」断片、組換え一本鎖ポリペプチド分子であって軽鎖および重鎖可変領域がペプチドリンカーによって連結されているもの(「scFvタンパク質」)、および超可変領域に類似のアミノ酸残基からなる最小認識単位のような可変領域からなる単離断片が挙げられる。Fv断片は、多価および/または多重特異性結合形態を生じるのと異なる方法で構築することができる。多価の前者の場合には、それらはCEAエピトープに対する2個以上の結合部位と反応し、多重特異性形態では、(CEAのまたはCEAおよび異なる抗原に対する)2個以上のエピトープが結合する。
【0032】
本明細書で用いられる抗体成分という用語は、完全な抗体、融合タンパク質、およびそれらの断片を包含する。
【0033】
裸の抗体は、一般に治療薬に接合しない完全な抗体である。これは、抗体分子のFc部分が、補体固定およびADCC (抗体依存性細胞傷害)のような機構を実行して細胞リーシスを生じることができるエフェクターまたは免疫学的機能を提供するので、その通りである。しかしながら、Fc部分は抗体の治療機能を必要としないことがあるが、アポトーシス、抗血管新生、抗転移活性、抗接着活性、例えば異型または同型接着の阻害、およびシグナル形成経路の干渉のようなむしろ他の機構が効果を示し、疾患の進行を干渉することがある。裸の抗体としては、ポリクローナルおよびモノクローナル抗体の両方、およびそれらの断片であって、ネズミ抗体、並びにある種の組換え抗体、例えばキメラ、ヒト化 またはヒト抗体およびそれらの断片などが挙げられる。本発明で定義されるように、「裸の」とは「未接合」と同義であり、一緒に投与される治療薬に連結または接合されていないことを意味する。
【0034】
キメラ抗体は、1つの種、好ましくは齧歯類抗体由来の抗体の相補性決定領域(CDR)などの重および軽抗体鎖の可変ドメインを含む組換えタンパク質であり、一方抗体分子の定常ドメインはヒト抗体の定常ドメインから誘導される。動物での応用については、キメラ抗体の定常ドメインは、ネコまたはイヌのような他の種の定常ドメインから誘導することができる。
【0035】
ヒト化抗体は、1つの種、例えば齧歯類抗体由来の抗体からのCDRが齧歯類抗体の重および軽可変鎖からヒトの重および軽可変ドメインへ導入される組換えタンパク質である。この抗体分子の定常ドメインは、ヒト抗体の定常ドメインから誘導される。
【0036】
ヒト抗体は、抗原投与に応答して特異的ヒト抗体を産生するように「工学処理された」トランスジェニックマウスから得られた抗体である。この手法では、ヒト重および軽鎖座の要素を、内在性重鎖および軽鎖座のターゲッティングした崩壊物を含む胚幹細胞系から誘導されたマウスの株に導入する。トランスジェニックマウスはヒト抗原に特異的なヒト抗体を合成することができ、このマウスを用いてヒト抗体分泌ハイブリドーマを産生することができる。トランスジェニックマウスからヒト抗体を得る方法は、Green et al., Nature Genet. 7:13 (1994)、Lonberg et al., Nature 368:856 (1994)、およびTaylor et al., Int. Immun. 6:579 (1994)に記載されている。完全にヒトの抗体は、遺伝子または染色体トランスフェクション法、並びにファージディスプレー法によって構築することもでき、これらの方法はいずれも当該技術分野で知られている。例えば、免役されていないドナーの免疫グロブリン可変ドメイン遺伝子レパートリーからヒト抗体およびその断片のイン・ビトロでの産生については、McCafferty et al., Nature 348:552-553 (1990)を参照されたい。この手法では、抗体可変ドメイン遺伝子を糸状バクテリオファージの主要または微量コートタンパク質遺伝子にインフレームでクローニングし、ファージ粒子の表面で機能的抗体断片として示される。糸状粒子はファージゲノムの一本鎖DNAコピーを含むので、抗体の機能特性に基づく選択ではそれらの特性を示す抗体をコードする遺伝子も選択される。この方法では、ファージはB細胞の特性の幾つかに類似している。ファージディスプレーは様々なフォーマットで行うことができ、それらの概説については、例えば、Johnson and Chiswell, Current Opinion in Structural Biology 3:5564-571 (1993)を参照されたい。
【0037】
ヒト抗体は、イン・ビトロで活性化したB細胞によって産生することもできる。米国特許第5,567,610号明細書および第5,229,275号明細書を参照されたい。上記特許明細書の内容は、その開示の一部として本明細書に引用されている。
【0038】
治療薬は、抗体成分、すなわち、抗体または抗体断片、またはその副次断片とは別個に、同時にまたは逐次的に投与され、疾患の治療に有用な分子または原子である。治療薬の例としては、抗体、抗体断片、免疫接合体、薬剤、細胞傷害性物質、毒素、ヌクレアーゼ、ホルモン、イムノモジュレーター、キレート化剤、ホウ素化合物、光活性剤または色素、放射性同位体または放射性核種、アンチセンスオリゴヌクレオチド、免疫接合体、またはそれらの組合せが挙げられる。
【0039】
免疫接合体は、治療薬に接合した抗体成分である。適当な治療薬は、上記されている。
【0040】
本明細書で用いられる抗体融合タンパク質という用語は、組換えによって産生した抗原結合分子であって、同じまたは異なる特異性を有する同じまたは異なる天然抗体、一本鎖抗体または抗体断片セグメントの2種類以上が連結しているものである。クラスIII抗CEA融合タンパク質は、少なくとも1種類のCEA結合部位を含んでなる。好ましくは、クラスIII抗CEA融合タンパク質は、MN-14融合タンパク質である。
【0041】
融合タンパク質の結合価は、融合タンパク質が有する(複数の)抗原または(複数の)エピトープに対する結合アームまたは部位の総数、すなわち、一価、二価、三価または多価を示している。抗体融合タンパク質が多価であることは、抗原との結合において複数の相互作用を利用することができ、従って、この抗原または異なる抗原に対する結合の親和力を増加することを意味している。特異性は、いくつの異なる種類の抗原またはエピトープに抗体融合タンパク質が結合し得るか、すなわち、単一特異性、二重特異性、三重特異性、多重特異性を示している。これらの定義を用いれば、天然抗体、例えば、IgGは2本の結合アームを有するので二価であるが、1種類の抗原またはエピトープに結合するので単一特異性である。単一特異性の多価融合タンパク質は、同一抗原またはエピトープに2個以上の結合部位を有する。例えば、単一特異性ジアボディーは、同一抗原と反応する2個の結合部位を有する融合タンパク質である。融合タンパク質は、異なる抗体成分または同一抗体成分の複数のコピーの多価または多重特異性の組合せを含んでなることができる。例えば、本発明の多重特異性であって、融合タンパク質の一方のアーム(例えば、scFvまたはFab)がCD66eをターゲッティングするクラスIIIの抗CEA mAbであって、融合タンパク質のもう一方のアームがCD66a-dをターゲッティングする別のCEA交差反応性抗体由来であることができる。
【0042】
本発明による好ましい二重特異性融合タンパク質はクラスIII CEAエピトープに対するアームと、顆粒球で発現したCD66a-dエピトープ(クラスII)に対する第二のアームを有する。これらの態様では、CD66a-d結合部分は、補体に固定しまたはFc-受容体に結合してADCCを行う(顆粒球からサイトカインを放出する)ことができないものであるべきである。補体固定およびADCCを行うことは本発明の裸の療法態様の好ましい特性ではあるが、二重特異性融合タンパク質に関する本発明の態様に関しては回避すべきである。正常な結腸細胞では、NCA-50/90およびCEAがいずれも発現するが、それらは正常な上皮細胞の先端面に限定されており、かつこの面は結腸管腔にのみ向けられており、投与された抗体には接近できない。CEAのようなこれらの正常細胞から放出されるまたは死んだ正常細胞に結合したCEAは、糞便中に排出される。この分極化(polarization)は結腸癌が発現すると失われ、次にNCA-50/90とCEAがいずれも正常な上皮細胞を固定している下にある正常な基底膜を冒している癌細胞膜上で発現する。hMN3/hMN14のような二重特異性抗体は、これらの侵襲細胞上でCEAおよびNCA-50/90のいずれとも反応することが予想される。さらに、NCA50/90は顆粒球上にあるので、この二重特異性は顆粒球に侵襲性結腸癌細胞を殺す指令を行うことが期待される。本発明による更に一層好ましい構築物は、NCA50/90と反応する1本のアームとCEAのみと反応する2本のアームを有する二重特異性の三価タンパク質である。他の態様は、NCA50/90に結合する2本のアームを有する二重特異性タンパク質であろう。
【0043】
顆粒球とも反応する好ましい融合タンパク質は、NCA-50/90 (例えば、hMN-3)に対する1本のアームとCEA(hMN14)上のクラスIIIエピトープに対する1本のアームを有するジアボディーであろう。これらの融合タンパク質はFc-ドメインを持たないので、顆粒球からのサイトカイン放出を活性化しない。さらに一層好ましい融合タンパク質は1本のhMN-3アームと2本のhMN14アームを有するトリアボディーであろう。このようなジアボディーとトリアボディーの構築は、米国特許出願連続番号第60/404,919号明細書(2002年8月22日出願)、第60/345,641号明細書(2002年1月8日出願)、第60/328,835号明細書(2001年10月15日出願)、および第60/341,881号明細書(2001年12月21日出願)に開示されている。
【0044】
hMN14/NP-3特異性のmabで作製した任意の種類の多重特異性抗体も好ましく、補体を固定/ADCCを活性化することができるFc-ドメインを有することができる。例えば、hMN14-IgGl/[NP-3-scFv]2融合タンパク質を用いることができ、その作製は米国特許出願連続番号第09/337,756号明細書に教示されている。
【0045】
本発明によるさらに他の好ましい種類の多重特異性抗体は、補体を固定/ADCCを行う能力を欠いているFc-ドメインを有するhMN-3MAbである。
【0046】
融合タンパク質は、さらに治療薬を含んでなることができる。例えば、少なくとも1種類の抗体またはその断片、例えば、CD66eまたはそのscFvまたはFabをターゲッティングするクラスIIIの抗CEA mAbをインターフェロンのようなサイトカインまたはGM-CSFまたはG-CSFまたはインターロイキンのようなコロニー刺激因子に接合することができる場合であり、これらはいずれも本明細書に記載されている。
【0047】
イムノモジュレーターは、これを含むときに、身体の免疫系を変化、抑制または刺激する本発明で定義されている治療薬である。典型的には、本発明で用いられるイムノモジュレーターは、免疫細胞を刺激してマクロファージ、B細胞、および/またはT細胞のような免疫応答カスケードにおいて増殖しまたは活性化される。本明細書に記載のイムノモジュレーターの一例はサイトカインであり、これは特異性抗原と接触したときに1個の細胞個体群(例えば、感作Tリンパ球)によって放出される約5-20kDの可溶性の小タンパク質であり、細胞間で細胞間メディエーターとして作用する。熟練技術者であれば理解されるように、サイトカインの例としては、リンホカイン、モノカイン、インターロイキン、および幾つかの関連したシグナル形成分子、例えば腫瘍壊死因子(TNF)およびインターフェロンが挙げられる。ケモカインは、サイトカインに包含される。ある種のインターロイキンおよびインターフェロンは、T細胞または他の免疫細胞増殖を刺激するサイトカインの例である。
【0048】
キメラ、ヒト化およびヒト抗体などのモノクローナル抗体の調製
モノクローナル抗体(MAb)は特定抗原に対する抗体の均質個体群であり、抗体は1種類だけの抗原結合部位を含んでなり、抗原決定基上の1個のエピトープのみに結合する。特異性抗原に対する齧歯類のモノクローナル抗体は、当業者に知られている方法によって得ることができる。例えば、Kohler and Milstein, Nature 256:495 (1975)、およびColigan et al. (監修), 「免疫学の最新の方法(CURRENT PROTOCOLS IN IMMUNOLOGY)」, 第1巻, 2.5.1-2.6.7頁 (John Wiley & Sons 1991)[以後「Coligan」と表す]を参照されたい。簡単に説明すれば、モノクローナル抗体は、マウスに抗原を含んでなる組成物を投与し、血清試料を採取することによって抗体産生の存在を確認し、脾臓を取り出してBリンパ球を得て、Bリンパ球を骨髄腫細胞と融合させてハイブリドーマを産生させ、ハイブリドーマをクローニングし、抗原に対する抗体を産生する陽性クローンを選択し、抗原に対する抗体を産生するクローンを培養し、ハイブリドーマ培養物から抗体を単離することによって得ることができる。
【0049】
MAbは、ハイブリドーマ培養物から様々な周知の手法によって単離し、精製することができる。このような単離法としては、プロテインAセファロースを用いるアフィニティークロマトグラフィー、サイズ排除クロマトグラフィー、およびイオン交換クロマトグラフィーが挙げられる。例えば、Coliganの2.7.1-2.7.12頁および2.9.1-2.9.3頁を参照されたい。また、Baines et al.,分子生物学の方法(METHODS IN MOLECULAR BIOLOGY)、「免疫グロブリンG(IgG)の精製」第10巻, pages 79-104 (The Humana Press, Inc. 1992)も参照されたい。
【0050】
ペプチド主鎖に対するAbは、Ab産生の周知の方法によって生成される。例えば、(ペプチド)n-KLH(但し、KLHは鍵穴のリムペットヘモシアニンであり、n=1-30)のような免疫原を完全Freundアジュバントに懸濁したものを免疫担当動物に投与した後、同一免疫原を不完全Freundアジュバントに懸濁したものを2回投与するのである。動物に、最後に抗原を静脈内に追加投与した後、3日後に脾臓細胞を集める。次に、集めた脾臓細胞をSp2/0-Ag14骨髄腫細胞と融合させ、生成するクローンの培養上清を直接結合ELISAを用いて抗ペプチド反応性について分析する。生成したAbの微細な特異性は、元の免疫原のペプチド断片を用いることによって分析することができる。これらの断片は、自動ペプチド合成装置を用いて容易に調製することができる。Ab産生のため、酵素欠損ハイブリドーマを単離して、融合細胞系を選択できるようにする。この手法を用いて、リンカーを含んでなるキレート、例えばIn(III)-DTPAキレートの1種類以上に対する抗体を生じさせることもできる。In(III)-ジ-DTPAに対するモノクローナルマウス抗体は知られている(Barbetに対する米国特許第5,256,395号明細書)。
【0051】
抗体を産生するもう一つの方法は、トランスジェニック家畜の乳における産生によるものである。例えば、Colman, A., Biochem. Soc. Symp., 63:141-147, 1998; 米国特許第5,827,690号明細書を参照されたい。上記文献の内容は、その開示の一部として本明細書に引用されている。それぞれ対になった免疫グロブリン重および軽鎖をコードするDNAセグメントを含む2種類のDNA構築物を調製する。DNAセグメントを、哺乳類上皮細胞で優先的に発現するプロモーター配列を含む発現ベクターにクローニングする。例えば、ウサギ、ウシおよびヒツジカゼイン遺伝子、ウシα-ラクトグロブリン遺伝子、ヒツジβ-ラクトグロブリン遺伝子、およびマウスホエー酸性タンパク質遺伝子由来のプロモーターが挙げられるが、これらに限定されない。好ましくは、挿入した断片を、哺乳類特異性遺伝子からの同種ゲノム配列によりその3'側に配置する。これにより、ポリアデニル化部位と転写体安定化配列が提供される。発現カセットを受精した哺乳類卵の前核に同時投与した後、雌被験動物の子宮に移植し、懐妊させる。誕生後、子孫を、サザン分析法によって両トランスジーンの存在についてスクリーニングする。抗体が存在するには、重および軽鎖遺伝子が両方とも同一細胞で同時に発現しなければならない。トランスジェニック雌動物の乳を、抗体または抗体断片の存在および機能について当該技術分野で知られている標準的免疫学的方法を用いて分析する。抗体は、当該技術分野で知られている標準的方法を用いて乳から精製することができる。
【0052】
免疫原に対する抗体を最初に生じさせた後、モノクローナル抗体の可変遺伝子をハイブリドーマ細胞からクローニングし、シークエンシングした後、組換法によって調製することができる。ネズミ免疫グロブリン可変ドメインをクローニングする一般的手法は、例えばOrlandi et al., Proc. Nat'l Acad. Sci. USA 86:3833 (1989)の公表物によって説明されており、上記文献の内容は、その開示の一部として本明細書に引用されている。ネズミ抗体および抗体断片のヒト化およびキメラ化は、当業者には周知である。キメラ抗体は、齧歯類抗体のような一種の動物由来のCDRを包含する可変ドメインを含む組換えタンパク質であり、この抗体分子の残り、すなわち定常ドメインはヒト抗体から誘導される。ヒト化およびキメラ化モノクローナル抗体は、ネズミ定常領域の免疫原性に関する問題点を緩和する。キメラ抗体を構築する方法は、当業者に周知である。例えば、Leung et al., Hybridome 13:469 (1994)には、抗CD22抗体であるLL2モノクローナル抗体のVKおよびVHドメインをコードするDNA配列をそれぞれのヒトKおよびIgG1定常領域ドメインと組み合わせることによってLL2キメラを産生する方法が記載されている。
【0053】
キメラモノクローナル抗体(MAb)は、キメラMAbの可変ドメインにおけるネズミFRの配列を1種類以上のヒトFRで置き換えることによってヒト化することもできる。具体的には、ヒト化モノクローナル抗体は、マウス免疫グロブリンの重および軽可変鎖由来のマウス相補性決定領域をヒト可変ドメインに導入した後、ネズミの対応部の枠組構造領域におけるヒト残基を置換することによって産生される。ヒトFRへのマウスCDRを簡単に導入することによって抗体親和性が減少または喪失することが多いので、更に修飾を行ってネズミ抗体の元の親和性を回復させる必要があることがある。これは、FR領域における1種類以上のヒト残基をそれらのネズミ対応物で置き換えて、そのエピトープに良好な結合親和性を有する抗体を得ることによって行うことができる。例えば、Tempest et al., Biotechnology 9:266 (1991)およびVerhoeyen et al., Science 239:1534 (1988)を参照されたい。
【0054】
好ましい態様によれば、ヒト化抗CEA抗体またはその断片の枠組構造領域における幾つかのヒト残基は、それらのネズミ対応物によって置き換えられている。さらに、キメラ抗CEAがネズミ対応物に匹敵する結合親和性を示すことを知れば、ヒト化抗CEA MAbの元の形態における欠陥デザインがもしあれば、キメラ抗CEAの軽および重鎖をヒト化形態のものに混合してマッチさせることによって同定することができる。好ましくは、ヒト化抗CEA抗体はヒト化MN-14抗体であり、その調製および配列は米国特許第5,874,540号明細書に開示されており、その内容は、その開示の一部として本明細書に引用されている。2種類のヒト抗体REIおよびNEWMはヒト化およびキメラMN-14抗体の調製に好ましい抗体であるが、2種類以上のヒト抗体由来の枠組構造配列の組合せをVHおよびVKに用いることができる。ヒト化MAbの産生は、例えば、Jones et al., Nature 321:522 (1986)、Riechmann et al., Nature 332:323 (1988)、Verhoeyen et al., Science 239:1534 (1988)、Carter et al., Proc. Nat'l Acad. Sci. USA 89:4285 (1992)、Sandhu, Crit. Rev. Biotech. 12:437 (1992)、およびSinger et al., J. Immun. 150:2844 (1993)に記載されており、それら内容は、その開示の一部として本明細書に引用されている。更に、ヒト化、キメラおよびヒトMAbの特異性エピトープに対する親和性はCDRの突然変異誘発によって増加することができるので、少なめの用量の抗体は突然変異誘発前の低めの親和性のMAbの高めの用量と同様な効果を得ることができる。例えば、WO0029584A1号明細書を参照されたい。
【0055】
他の態様によれば、本発明の抗体はヒトクラスIII抗CEAモノクローナル抗体である。抗CEA MAbまたは別のヒト抗体は、トランスジェニックなヒト以外の動物から得ることができる。例えば、Mendez et al., Nature Genetics, 15:146-156 (1997)および米国特許第5,633,425号明細書を参照されたい。これらの文献の内容は、その開示の一部として本明細書に引用されている。例えば、ヒト抗体は、ヒト免疫グロブリン座を有するトランスジェニックマウスから回収することができる。好ましくは、抗CEA抗体はMN-14抗体である。マウス体液性免疫系は、内在性免疫グロブリン遺伝子を不活性化し、ヒト免疫グロブリン座を導入することによってヒト化される。ヒト免疫グロブリン座は極端に複雑であり、ヒトゲノムのほぼ0.2%を占める多数の別個のセグメントを含んでなる。トランスジェニックマウスが抗体の適当なレパートリーを確実に産生できるようにするには、ヒト重および軽鎖座の大部分をマウスゲノムに導入しなければならない。これは、生殖細胞系におけるヒト重および軽鎖免疫グロブリン座を含む酵母の人工染色体(YAC)を形成することから初めて段階的に行われる。それぞれのインサートは大きさが約1Mbであるので、YAC構築には免疫グロブリン座の重複断片の相同組換えが必要である。重鎖座を含むものと軽鎖座を含むものの2個のYACを、YACを含む酵母スフェロブラスト(spheroblasts)とマウス胚幹細胞との融合を介してマウスに個別に導入する。次に、胚幹細胞クローンをマウス胚盤胞に微量投与する。生成するキメラ雄動物をYACをそれらの生殖細胞系中を透過する能力についてスクリーニングし、ネズミ抗体産生を欠いたマウスと共に飼育する。一方がヒト重鎖座を含み、他方がヒト軽鎖座を含む2種類のトランスジェニック株を飼育することによって、感作に応答してヒト抗体を産生する子孫が生じる。
【0056】
再配置されないヒト免疫グロブリン遺伝子を、ミセル依存性染色体導入(MMCT)を介してマウス胚幹細胞に導入することもできる。例えば、Tomizuka et al., Nature Genetics, 16:133 (1997)を参照されたい。この方法では、ヒト染色体を含むミセルをマウス胚幹細胞と融合させる。導入された染色体は安定に保持され、成熟キメラが適当な組織特異性発現を示す。
【0057】
あるいは、本発明の抗体または抗体断片は、組合せ免疫グロブリンライブラリーから単離されたヒト抗体断片から誘導することができる。例えば、Barbas et al., METHODS : A Companion to Methods in Enzymology 2:119 (1991)、およびWinter et al., Ann. Rev. Immunol. 12:433 (1994)を参照されたい。これらの文献の内容は、その開示の一部として本明細書に引用されている。B細胞の不朽化によるモノクローナル抗体の生成に関連した問題点の多くは、E. coliでの抗体断片をファージディスプレーを用いて工学処理を行い、発現させることによって解決することができる。高親和性のモノクローナル抗体を確実に回収するには、組合せ免疫グロブリンライブラリーは大きなレパートリーサイズを含むものでなければならない。典型的な方法では、免役マウスのリンパ球または脾臓細胞から得られたmRNAを用い、逆転写酵素を用いてcDNAを合成する。重および軽鎖遺伝子をPCRによって個別に増幅し、ファージクローニングベクターに連結する。2種類の異なるライブラリーである重鎖遺伝子を含むものと軽鎖遺伝子を含むものが産生される。ファージDNAをそれぞれのライブラリーから単離し、重および軽鎖配列を一緒に連結し、まとめて、組合せライブラリーを形成する。それぞれのファージは重および軽鎖cDNAのランダム対を含み、E. coliの感染時には、感染細胞中の抗体鎖の発現を指示する。目的とする抗原を認識する抗体を同定するため、ファージライブラリーを培養し、プラークに含まれる抗体分子をフィルターに移す。フィルターを放射性標識した抗原とインキュベーションした後、洗浄して過剰の未結合リガンドを除く。オートラジオグラム上の放射性スポットにより、抗原に結合する抗体を含むプラークが同定される。ヒト免疫グロブリンファージライブラリーの産生に有用なクローニングおよび発現ベクターは、例えば、STRATAGENE Cloning Systems (La Jolla, CA)から得ることができる。
【0058】
一つの態様によれば、本発明の抗体は、Hansen et al.,米国特許第5,874,540号明細書、Hansen et al., Cancer, 71:3478 (1993)、Primus et al.,米国特許第4,818,709号明細書、およびShively et al.,米国特許第5,081,235号明細書に記載の方法で産生され、上記文献の内容は、その開示の一部として本明細書に引用されている。
【0059】
抗体断片の産生
本発明は、クラスIII抗CEA抗体、好ましくはMN-14抗体の断片の使用を意図する。本発明のクラスIII抗CEA抗体またはその断片は、顆粒球またはCD66a-dと結合しない。特異性エピトープを認識する抗体断片は、既知の方法によって生成させることができる。例えば、抗体断片は、抗体のタンパク質分解性加水分解によって、または断片をコードするDNAのE. coliでの発現によって調製することができる。抗体断片はF(ab')2、Fab'、Fab、Fv、scFvなどのような抗体の抗原結合部分であり、通常の方法によって全抗体をペプシンまたはパパイン消化によって得ることができる。
【0060】
例えば、抗体断片は、ペプシンを用いる抗体の酵素開裂によって産生させ、F(ab')2で表される100Kd断片を得ることができる。この断片をチオール還元剤およびジスルフィド結合の開裂によって生じるスルフヒドリル基のブロッキング基を用いて更に開裂させ、50Kd Fab'の一価断片を産生させることができる。あるいは、パパインを用いる酵素開裂により、一価のFab断片およびFc断片直接生成する。これらの方法は、例えば、Goldenberg, 米国特許第4,036,945号明細書および第4,331,647号明細書、およびそこに記載されている参考文献に記載されており、上記特許明細書の内容は、その開示の一部として本明細書に引用されている。また、Nisonoff et al., Arch Biochem. Biophys. 89:230 (1960)、Porter, Biochenz. J 73:119 (1959)、Edelman et al., 「酵素学の方法(METHODS IN ENZYMOLOGY)」,第1巻, 422頁(Academic Press, 1967)、およびColigan, 2.8.1-2.8.10および2.10-2.10.4も参照されたい。
【0061】
重鎖を分離して一価の軽-重鎖断片の形成、断片の更なる開裂、または他の酵素的、化学的または遺伝学的手法のような抗体を開裂する他の方法も、断片が完全な抗体によって認識される抗原に結合する限り用いることができる。
【0062】
例えば、Fv断片はVHおよびVL鎖の会合を含んでなる。この会合は、Inbar et al., Proc. Nat'l. Acad. Sci. U.S.A. 69:2659 (1972)に記載されているように非共有結合性であることができる。あるいは、可変鎖同士を分子間ジスルフィド結合によって結合させまたはグルチルアルデヒドのような薬剤によって架橋させることができる。例えば、Sandhu, Crit. Rev. Biotech. 12:437 (1992)を参照されたい。
【0063】
好ましくは、Fv断片はペプチドリンカーによって結ばれているVHおよびVL鎖を含んでなる。これらの一本鎖抗原結合タンパク質(sFv)は、オリゴヌクレオチドによって結ばれているVHおよびVLドメインをコードするDNA配列を含んでなる構造遺伝子を構築することによって調製される。構造遺伝子を発現ベクターに挿入した後、これをE. coliのような宿主細胞中に導入する。組換え宿主細胞は、2個のVドメインを架橋するリンカーペプチドを有する一本鎖ポリペプチドを合成する。sFvを産生する方法は、例えば、Whitlow et al., Methods: A Companion to Methods in Enzymology, 2:97 (1991)に記載されている。Bird et al., Science 242:423 (1988)、Ladner et al., 米国特許第4,946,778号明細書、Pack et al., Bio Technology 11:1271 (1993)、およびSandhu, 上記引用も参照されたい。
【0064】
抗体断片の他の形態は、単一相補性決定領域(CDR)をコードするペプチドである。CDRは、抗体が結合し且つ可変領域の残りよりも一層可変であるエピトープに構造が相補性である抗体の可変領域のセグメントである。従って、CDRは時には超可変領域と表されることがある。可変領域は3種類のCDRを含んでなる。CDRペプチドは、目的の抗体のCDRをコードする遺伝子を構築することによって得ることができる。このような遺伝子は、例えば、ポリメラーゼ連鎖反応を用いて抗体産生細胞のRNAから可変領域を合成することによって調製される。例えば、Larrick et al., Methods: A Companion to Methods in Enzymology 2:106 (1991)、Courtenay-Luck, 「モノクローナル抗体の遺伝子操作(Genetic Manipulation of Monoclonal Antibodies)」, モノクローナル抗体: 産生、工学処理および臨床応用(MONOCLONAL ANTIBODIES: PRODUCTION, ENGINEERING AND CLINICAL APPLICATION), Ritter et al. (監修), 166-179頁(Cambridge University Press 1995)、およびWard et al.,「抗体の遺伝子操作および発現(Genetic Manipulation and Expression of Antibodies)」, モノクローナル抗体: 原理と応用(MONOCLONAL ANTIBODIES: PRINCIPLES AND APPLICATIONS), Birch et al., (監修), 137-185頁 (Wiley-Liss, Inc. 1995)を参照されたい。
【0065】
重鎖を分離して一価の軽-重鎖断片の形成、断片のさらなる開裂、または他の酵素的、化学的または遺伝学的手法のような抗体を開裂する他の方法も、断片が完全な抗体によって認識される抗原に結合する限り用いることができる。
【0066】
治療用のヒト化、キメラおよびヒト抗CEA抗体
本発明では、治療用のネズミ、キメラ、ヒト化およびヒトクラスIII抗CEA抗体およびそれらの断片を用いる組成物および方法が記載されている。好ましくは、クラスIII抗CEA抗体またはその断片はMN-14抗体またはその断片である。本発明の抗体を用いて、甲状腺髄様癌(MTC)、並びに非MTC CEAを発現する癌を治療することができる。典型的な非MTC CEA発現癌としては、結直腸癌、膵臓癌、肝細胞癌、胃癌、肺癌、頭部と首部癌、膀胱癌、子宮癌、乳癌および卵巣癌が挙げられる。
【0067】
組成物
本明細書では、少なくとも1種類のクラスIII抗CEAモノクローナル抗体(MAb)またはその断片と少なくとも1種類の治療薬であって、それらが互いに接合しておらず、従って、成分のそれぞれの未接合形態として組成物中に存在しているものを含んでなる組成物を意図する。第二のクラスIII抗CEA抗体のような2種類以上の抗体または抗体断片を含んでなる組成物では、第二の抗体は非ブロッキング性である(すなわち、第一のクラスIII抗CEA抗体または抗体断片の結合をブロックしない)。
【0068】
一つの態様によれば、クラスIII抗CEAモノクローナル抗体またはその断片は、ヒト化、キメラ、または完全にヒトのものであり、ヒト化、キメラ、または完全にヒトのMAbは実質的にネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を保持している。
【0069】
好ましい態様によれば、クラスIII抗CEAモノクローナル抗体またはその断片は、MN-14抗体またはその断片である。好ましくは、MN-14モノクローナル抗体またはその断片はネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRはアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記クラスIIIの抗CEA抗体の重鎖可変領域のCDRはTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。MN-14モノクローナル抗体はCEAと反応し且つ通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しないことも好ましい。しかしながら、これらの交差反応性決定基に対する抗体は、MN-14モノクローナル抗体と組み合わされるようなCEA特異性抗体との併用療法に用いることができる。
【0070】
本発明の他の態様によれば、MN-14モノクローナル抗体またはその断片はヒト化または完全にヒトのMN-14抗体またはその断片である。ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)は、好ましくはネズミMN-14モノクローナル抗体の相当するFRで置換された少なくとも1種類のアミノ酸を含んでなる。さらに好ましくは、ヒト化MN-14抗体またはその断片は、上記した図14A-Cのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24、28、30、48、49、74および94からなる群から選択されるネズミMN-14抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。好ましいヒト化重鎖可変領域のアミノ酸配列は、Hansen et al.,米国特許第5,874,540号明細書にも記載されており、上記特許明細書の内容は、その開示の一部として本明細書に引用されている。また、好ましくは、ヒト化重鎖可変領域は、KLHuVhAIGおよびKLHuVhAIGAYと呼ばれる図14A-Cに記載のアミノ酸配列を含んでなる。他の態様によれば、ヒト化MN-14抗体またはその断片は、ネズミMN-14軽鎖可変領域の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。最も好ましくは、ヒト化MN-14抗体またはその断片は、図13Aまたは図22Aまたは図23Aの軽鎖可変領域を含んでなる。本発明の他の態様によれば、キメラMN-14モノクローナル抗体またはその断片と少なくとも1種類の治療薬を含んでなる組成物であって、これらは互いに接合しておらず、従って、成分のそれぞれの未接合形態として組成物中に存在しているものを含んでなる組成物である。好ましくは、キメラMN-14抗体またはその断片は、図13Aまたは図22Aまたは図23Aに記載のネズミMN14軽鎖可変領域のCDRと、図14A-Cまたは図22Bまたは図23Bに記載のネズミMN14重鎖可変領域のCDRを含んでなる。
【0071】
本明細書では、裸のネズミ、ヒト化、キメラまたはヒトクラスIII抗CEA抗体またはその断片と治療薬、および第二の裸のまたは接合したクラスIII抗CEA抗体またはその抗体断片であって、非ブロッキング性、すなわち、第一のクラスIII抗CEA抗体またはその断片の結合をブロックせず、薬学上許容可能なビヒクル中に処方されるものを含んでなる組成物も記載される。換言すれば、クラスIII抗CEA抗体またはその断片はいずれも互いに非ブロッキング性であり、従って、抗体またはその断片のいずれをもCEA(CD66e)に結合させる。さらに、本発明のクラスIII CEA抗体または抗体断片、並びに併用療法に用いるものは、顆粒球またはCD66a-dを結合しない。裸の抗体としてまたは免疫接合体の一成分として本発明の抗体断片の裸のクラスIII抗CEA抗体との併用療法に適する他のクラスIII抗体としては、Kuroki et al., JP J Can. Res., 78 (4):386 (1987)およびHammarstrom (Cancer Res. 52 (8):2329 (1992))に記載の非ブロッキング抗体またはその断片であって、顆粒球またはCD66a-dとも結合しないものが挙げられる。
【0072】
さらに、クラスIIまたはクラスI抗CEA抗体のような他の抗CEA抗体は、裸のまたは接合した形態のクラスIII抗CEA本発明の抗体と組み合わせて用いることができる。併用療法に用いることができるこのようなクラスII抗体または抗体断片は非ブロッキング性であり、顆粒球またはCD66a-dと結合しないが、胎便抗原(MA)およびCEAと反応する。例えば、MN-6またはNP-3のような1種類以上のキメラまたはヒト化クラスII抗CEA抗体またはその断片は、本発明のクラスIII抗CEA抗体またはその断片と組み合わせることができる。これら2種類の抗体は、CD66a-dまたは顆粒球と反応しない。多数の公表物、例えば、Thompson et al. ,J. Clin. Lab. Anal. 5:344 (1991)、Kuroki et al., J. Biol. Chem. 266:11810 (1991)、Nagel et al., Eur. J. Biochem. 214:27 (1993)、Skubitz et al., J. Immunol. 155:5382 (1995)、Skubitz et al., J. Leukoc. Biol. 60:106 (1996)、およびChen et al., Proc. Natl. Acad. Sci. 93:14851 (1996)には、CEAおよびCEA遺伝子ファミリーの様々な要素を認識するMAbが開示されている。
【0073】
さらに、第二の抗体または抗体断片は、未接合(裸)であるかまたは少なくとも1種類の治療薬接合している(免疫接合体)。免疫接合体は、治療薬を抗体成分に間接的に接合させることによって調製することができる。一般的手法は、Shih et al., Int. J. Cancer, 41:832 (1988)、Shih et al., Int. J. Cancer, 46:1101 (1990)、およびShih et al., 米国特許第5,057,313号明細書に記載されている。 一般的方法は、参加された炭水化物部分を有する抗体成分を少なくとも1種類の遊離アミン官能基を有し且つ複数の薬剤、毒素、キレート化剤、ホウ素アデンド(boron addend)、または他の治療薬を含んだキャリヤーポリマーと反応させることを必要とする。この反応によって最初のシッフ塩基(イミン)結合が生じ、これは還元して第二アミンとし、最終的接合体を形成することによって安定化することができる。好ましくは、治療用組成物の抗CEA抗体またはその断片は、MN-14抗体またはその断片である。さらに好ましくは、MN-14抗体またはその断片はヒト化している。
【0074】
本発明では、裸のヒト化、キメラ、ネズミまたはヒトクラスIII抗CEA抗体またはその断片と、治療薬、および第二の治療薬、例えば、クラスIIまたはクラスIII抗CEA抗体ではない接合または未接合抗体またはその抗体断片を含んでなる組成物も意図される。一つの態様によれば、第二の治療薬(または第二の抗体またはその断片)は、未接合(裸)であるかまたは少なくとも1種類の治療薬に接合している。併用療法に適するクラスI、クラスIIまたはクラスIII以外の抗CEA抗体およびその断片としては、癌関連抗体およびそれらの断片が挙げられるが、これらに限定されない。癌関連抗体および抗体断片の例は、EGP-1、EGP-2(例えば、17-1A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGFまたは他の腫瘍血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、テネイシン、フィブロネクチン、またはそれらの組合せに結合する。上記のように、CD66a-dまたは顆粒球と結合しない非ブロッキング性のクラスIIクラスIII抗CEA MAb、あるいはCD66a、bおよびdと結合するクラスII抗CEA MAb、またはCD66a、bおよびd、並びにCD66cと結合するクラスI抗CEA MAbは、クラスIII CEA抗体と組み合わせて用いることもできる。併用療法に適する他の抗体および抗体断片としては、癌遺伝子マーカーまたは産物に対してターゲッティングしたもの、または血管新生因子、胎盤増殖因子(P1GF)のような腫瘍-血管系マーカーに対する抗体、およびCD40に対する抗体のようなある種の免疫応答モジュレーターに対する抗体も挙げられる。
【0075】
方法
本発明には、甲状腺髄様癌および甲状腺非髄様癌の治療方法も記載される。甲状腺非髄様癌としては、結直腸癌および任意の他のCEA発現腫瘍、例えば、膵臓癌、乳癌、肝細胞癌、卵巣癌、ある種の肺、頭部と首部、子宮内膜、膀胱、および肝臓癌であって、様々な量のCEAを発現するものが挙げられる。これらの種類の癌におけるCEAレベルは甲状腺髄様癌に含まれるものよりずっと低いが、必要とされる総ては、CEAレベルが十分に高く、クラスIII抗CEA療法により効果的治療が行われることである。通常の結腸粘膜では約100-500μg/gであるが、約5μg/g組織のレベルの癌発現CEAが本発明に記載の方法を用いる治療に適している。
【0076】
例えば、本発明では、患者に同時にまたは逐次的に治療上有効量のクラスIII抗CEAモノクローナル抗体またはその断片と少なくとも1種類の治療薬であって、所望により薬学上許容可能なビヒクル中に処方したものを投与することを特徴とする甲状腺髄様癌または甲状腺非髄様癌が意図される。好ましくは、クラスIII抗CEAモノクローナル抗体またはその断片は、キメラ、ネズミ、ヒト化 またはヒトであって、キメラ、ヒト化、ネズミ、またはヒトクラスIII抗CEA MAbがネズミMAbのクラスIII抗CEA結合特異性を実質的に保持しているものである。さらに好ましくは、クラスIII抗CEA抗体はヒト化したものであって、最も好ましくは、本明細書および米国特許第5,874,540号明細書に記載されているヒト化MN-14モノクローナル抗体である。好ましくは、治療薬は細胞傷害性物質であり、さらに好ましくはアルキル化剤であり、最も好ましくは、ダカルバジン(DTIC)である。しかし、他の態様によれば、治療薬がDTICでないこともある。他のクラスの抗癌細胞増殖抑制剤および細胞傷害性物質、例えば、5-フルオロウラシル、CPT-11(イリノテカンおよびカンプトサルとしても知られる)およびオクサリプラチンを、特に結直腸癌の治療ではこれらの抗体と組み合わせて用いることもできる。他の癌の種類では、有効であることが知られている癌薬剤も、本発明で提案される抗体療法と併用するための良好な候補である。
【0077】
本発明では、患者に同時にまたは逐次的に治療上有効量の第一のクラスIII抗CEAモノクローナル抗体またはその断片と少なくとも1種類の治療薬、および裸のまたは接合した第二のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片であって、所望により薬学上許容可能なビヒクル中に処方したものを投与することを特徴とする甲状腺髄様癌および甲状腺非髄様癌の治療方法も意図される。好ましくは、第一のクラスIII抗CEA MAbはヒト化MN-14抗体またはその断片である。一つの態様によれば、第二の抗体またはその断片は、TAG-72、EGFR、HER2/neu、MUC1、MUC2、MUC3、MUC4、EGP-1、EGP-2、AFP、Tn、IL-6、インスリン増殖因子-1、または上記した別の腫瘍関連抗原と反応するモノクローナル抗体またはその断片からなる群から選択される癌関連抗体またはその断片である。他の態様によれば、第二の抗体またはその断片は、非ブロック性でありかつ顆粒球またはCD66a-dに結合しないクラスIII抗CEA抗体またはその断片であることができる。
【0078】
他の態様によれば、第二の抗CEA抗体はクラスII抗体またはその断片、例えば、Hammarstrom and Kurokiに記載のものであり、但し、それらは顆粒球またはCD66a-dと結合しないものである。他の態様によれば、この抗体としては、CD66a、b、またはd、並びにCD66cと反応するクラスI Mabまたはその断片が挙げられる。抗体およびその断片は、互いにまたは治療薬と同時にまたは逐次的に投与することができる。一つの態様によれば、第二の抗体またはその断片は、裸であるか、または治療薬に接合している。
【0079】
従って、本発明は、裸のネズミ、ヒト化、キメラおよびヒトクラスIII抗CEA抗体およびその断片を1種類以上の治療薬と逐次的または同時に、または多様療法として投与することを意図する。クラスIIIの抗CEA抗体が好ましいが、腫瘍細胞をターゲットする任意の抗CEA抗体が本発明で用いられる。本明細書に記載の裸のクラスIII抗CEA抗体は、1種類以上の治療薬に対する癌細胞の化学感受性を有意に増加させることができる。例えば、結腸癌細胞を本明細書に記載の裸のクラスIII抗CEA抗体MN-14で、CPT-11、5'-フルオロウラシル(5-FU)またはオキサリプラチンのような治療薬の前にまたは同時に治療すると、細胞傷害性薬剤のような治療薬に対する細胞の応答が向上する。さらに、裸のクラスIII抗CEA抗体単独でまたは治療薬と組み合わせる処置を用いるこれらの治療方法は、本明細書に記載のイムノモジュレーターを投与した後、裸の抗体を投与しまたは裸の抗体と少なくとも1種類の治療薬を投与することによってさらに高めることができる。
【0080】
本発明の多様療法は、クラスIII抗CEA抗体またはその断片および治療薬を用いる免疫療法であって、未接合または接合抗体、未接合または接合融合タンパク質、またはその断片の投与で補足したものを包含する。例えば、未接合のヒト化、キメラ、ネズミまたはヒトMN-14MAbまたはその断片は、別の裸のヒト化、ネズミ、キメラまたはヒトクラスIII抗CEA抗体(例えば、CEA上の異なるエピトープに対する抗体であって、顆粒球またはCD66a-dと結合しない)、または放射性同位体、化学療法薬、サイトカイン、酵素、酵素阻害剤、ホルモンまたはホルモン拮抗薬、金属、毒素、アンチセンスオリゴヌクレオチド(例えば、抗bc1-2)またはそれらの組合せに接合したヒト化、キメラ、ネズミまたはヒトクラスIII抗CEA抗体免疫接合体と組み合わせることができる。裸のクラスIII抗CEA抗体またはその断片は、ネズミの、ヒト化、キメラまたはヒトクラスIII抗CEA抗体の接合または未接合融合タンパク質と組み合わせることもできる。しかしながら、併用療法のクラスIII抗CEA抗体は互いに非ブロッキング性であり、顆粒球またはCD66a-dを結合することができない。好ましくは、裸のクラスIII抗CEA抗体は、第二の裸のまたは接合した抗体、融合タンパク質、またはその断片と逐次的または同時に投与する。また、併用療法に用いられる抗体または抗体断片の一つは、裸のヒト化MN-14抗体またはその断片であることが好ましい。さらに、裸のまたは接合した抗体、融合タンパク質、またはその断片として用いられる第二の抗体は、非ブロッキング性でありかつ顆粒球またはCD66a-dを結合しないヒト、ヒト化、キメラまたはネズミクラスII CEA抗体またはその断片であることができる。この態様による抗体の好ましい組合せは、エフェクター機能を欠き、補体を活性化せずかつサイトカイン放出を誘発しない裸の交差反応性の抗CD66a-d抗体を包含する。さらに、交差反応性の抗CD66a-d Fab'またはF(ab')2でも、顆粒球を損傷しないと思われ、NP-3タイプのクラスIII抗CEA MAbまたはクラスII抗CEA MAbと共に用いることができる。
【0081】
本明細書に記載の方法では、患者は、治療薬の前、後または同時に投与された少なくとも1種類の裸のクラスIII抗CEA抗体またはその断片を受け取る。一つの態様によれば、クラスIII抗CEA抗体は、細胞の前処理に用いられ、すなわち、治療薬の前に投与される。好ましくは、クラスIII抗CEA抗体はヒト化MN-14(hMN-14)のようなMN-14抗体であり、5-FUまたはCPT-11のような治療薬の少なくとも1時間前に投与される。
【0082】
好ましくは、治療薬は標準的な癌化学療法で用いられる薬剤であり、例えば、卵巣癌ではタキサンまたは白金薬、結直腸癌ではフルオロウラシル、CPT-11、およびオキサロプラチン、膵臓および他の癌ではジェムシタビン(gemcitabine)、または乳癌ではタキサン誘導体である。COX-2阻害薬は、癌化学療法において典型的な細胞傷害性物質と組み合わせて活性を示すさらにもう一つのクラスの薬剤であり、本発明で同様に、しかしさらにCEA抗体単独とおよび他の癌関連抗体と組み合わせたものと組み合わせて用いることができる。所望により、これらの薬剤を、上記の種類の放射能標識した抗体である他の癌関連抗体とのCEA抗体接合体または放射性接合体と組み合わせて用いることができる。また、クラスIII抗CEA抗体またはその断片がMN-14抗体またはその断片であることも好ましい。さらに好ましくは、MN-14抗体またはその断片はヒト化したものである。
【0083】
好ましい態様によれば、裸のクラスIII抗CEA抗体またはその断片は、ダカルバジン(DTIC)、ドキソルビン(doxorubin)、シクロホスファミドまたはビンクリスチン、またはこれらの任意の組合せと逐次的に(前または後に)または同時に投与される。例えば、DTICおよびシクロホスファミドを、裸のクラスIII抗CEA抗体またはその断片と逐次的にまたは同時に投与することができる。好ましくは、抗CEA抗体またはその断片は、ヒト化MN-14抗体またはその断片である。同様に、ホリニン酸と組み合わせた5-フルオロウラシルを単独で、またはイリノテカン(irinotecan)(CPT-11)と組み合わせたもの、またはオキサリプラチンとくみあわせたものは、結直腸癌の治療に用いられる養生法である。例えば、オクサリプラチンの単独これらの他の薬剤と組み合わせたものとの他の適当な併用化学療法は、当業者には周知である。従って、これらの化学療法薬のいずれかと裸のクラスIII抗CEA抗体またはその断片を用いる併用療法を用い、その用いた方法によってMTCまたは非-MTCを治療することができる。甲状腺髄様癌では、さらに他の化学療法薬、例えば、アルキル化剤の一つ(例えば、DTIC)、並びにジェムシタビン(gemcitabine)および他のさらに新しいクラスの細胞傷害性薬剤が好ましいことがある。化学療法剤と裸のクラスIII抗CEA抗体またはその断片は、任意の順序でまたは一緒に投与することができる。換言すれば、抗体と治療薬は、同時にまたは逐次的に投与することができる。好ましい多様療法では、化学療法剤と裸のクラスIII抗CEA抗体またはその断片は、本発明による接合または未接合の抗CEA抗体、融合タンパク質、またはその断片の前、後または同時に投与される。好ましくは、クラスIII抗CEA抗体またはその断片は、ヒト化MN-14抗体またはその断片である。
【0084】
多様治療の好ましい治療計画では、hMN-14とDTICを3日間投与し、hMN-14のみを7、14、21日目、およびその後12ヶ月の治療期間中21日毎に投与する。hMN-14の用量は輸液当たり0.5-15mg/kg体重であり、さらに好ましくは2-8であり、さらに一層好ましくは輸液当たり3-5mg/kgであり、DTICの用量は臨床上好ましい用量で現在適用されている通りであるが、使用されている好ましい最大用量の2/3以下で投与することによって薬剤に関連した副作用を減少させることもできる。1-6ヶ月毎などの反復薬剤サイクルを、裸の抗体療法の継続、または放射能標識した抗体、薬剤接合抗体、およびある種のサイトカイン、例えば、G-CSFおよび/またはGM-CSFの封入と共に行い、それぞれの用量を調整して、患者に対する毒性が治療の組合せによって増大しないようにすることができる。G-CSFのようなサイトカイン増殖因子の応用により、更に高用量の骨髄抑制薬、例えば、放射性標識した抗体または細胞傷害性薬剤を投与することができ、これらの計画および用量は、患者に個別的に、患者の疾患状態および以前の療法によって調整され、これら総ては骨髄の状態および追加の細胞傷害性療法に対する耐性に影響する。好ましい態様によれば、MN-14抗体またはその断片は、注入用量当たり100-600mgタンパク質で投与される。さらに好ましくは、MN-14抗体またはその断片は、注入用量当たり300-400mgタンパク質の投薬量で、好ましくは反復用量で投与される。好ましい抗体計画は毎週1回またはそれ以下の頻度、例えば、疾患の程度および患者の血液中を循環するCEAの量などの因子の数によって2週間に1回または3週間に1回の輸液である。
【0085】
治療薬
本発明で挙げられる治療薬は、本明細書に記載されているように、裸の抗体と共に別々の投与にも用いられる薬剤である。適当な治療薬細胞傷害性物質、放射性核種、イムノモジュレーター、光活性治療薬(例えば、色素原(chromagen)または色素)、アンチセンスオリゴヌクレオチド、免疫接合体、別の裸の抗体、ホルモン、またはそれらの組合せからなる群から選択することができる。治療薬としては、化学療法薬、例えば、ビンカアルカロイドおよび他のアルカロイド、アントラサイクリン、エピドフィロトキシン、タキサン、代謝拮抗物質、アルキル化剤、抗生物質、COX-2阻害薬、抗有糸分裂薬、抗血管新生およびアポトーシス薬、特にドキソルビシン、メトトレキセート、タキソール、CPT-11、カンプトテカン、およびこれらや他のクラスの抗癌薬由来の他のものなどが挙げられる。免疫接合体および抗体融合タンパク質の調製用の他の有用な癌化学療法薬としては、ナイトロジェンマスタード、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、COX-2阻害薬、ピリミジン類似体、プリン類似体、白金配位錯体、ホルモン、毒素(例えば、RNアーゼ、シュードモナス外毒素)などが挙げられる。好ましい治療薬としては、治療を行う悪性腫瘍によって、DTIC、CPT-11、5-フルオロウラシル、タキソール、オクサリプラチン、ドキソルビシン、シクロホスファミドおよびビンクリスチン、またはそれらの組合せが挙げられる。適当な化学療法薬は、「REMINGTONの薬科学, 第19版(REMINGTON'S PHARMACEUTICAL SCIENCES,19th Ed.)」 (Mack Publishing Co. 1995)、および「GOODMAN AND GILMANの治療薬の薬理学的基礎, 第7版(GOODMAN AND GILMAN'S THE PHARMACOLOGICAL BASIS OF THERAPEUTICS, 7th Ed.)」(MacMillan Publishing Co. 1985)、並びにこれらの出版物の改訂版に記載されている。他の適当な化学療法薬、例えば、実験薬は、当業者に知られている。
【0086】
シュードモナス外毒素のような毒素は、裸のクラスIII抗CEA抗体またはその断片と共に投与することもできる。好ましくは、クラスIII抗CEA抗体またはその断片は、ヒト化MN-14抗体またはその断片である。裸のクラスIII抗CEA抗体またはその断片に接合していないがそれらの前、後または同時に投与される他の適当な微生物、植物または動物毒素としては、リシン、アブリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素が挙げられる。例えば、Pastanet al., Cell 47:641 (1986)、およびGoldenberg, CA - A Cancer Journal for Clinicians 44:43 (1994)を参照されたい。本発明で用いるのに適している他の毒素は、当業者に知られており、米国特許第6,077,499号明細書に開示されており、上記特許明細書の内容は、その開示の一部として本明細書に引用されている。これらは、例えば、動物、植物および微生物供給源から誘導し、または化学的にまたは組換え工学処理を行うことができる。毒素は植物、微生物、または動物性毒素であるか、またはそれらの合成変異体であることができる。
【0087】
サイトカインのようなイムノモジュレーターは、本発明のキメラ、ネズミ、ヒト化 またはヒトクラスIII抗CEA抗体またはその断片に接合せずに投与することもできる。本発明で用いられる「イムノモジュレーター」という用語は、サイトカイン、幹細胞増殖因子、リンホトキシン、例えば、腫瘍壊死因子(TNF)、および造血因子、例えば、インターロイキン(例えば、インターロイキン-1 (IL-1)、IL-2、IL-3、IL-6、IL-10、IL-12、IL-18およびIL-21)、コロニー刺激因子(例えば、顆粒球-コロニー刺激因子(G-CSF)および顆粒球マクロファージ-コロニー刺激因子(GM-CSF))、インターフェロン(例えば、インターフェロン-α、-βおよび-γ)、「S1因子」と呼ばれる幹細胞増殖因子、エリトロポエチンおよびトロンボポエチンを包含する。適当なイムノモジュレーター残基の例としては、IL-2、IL-6、IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-αなどが挙げられる。従って、患者は、裸のクラスIII抗CEA抗体またはその断片と、裸のクラスIII抗CEA抗体またはその断片の投与の前、と同時またはの後に投与することができる別個に投与されるサイトカインを受け取ることができる。幾つかの抗原はイムノモジュレーターであることもできるので、例えば、CD40抗原は、裸のクラスIII抗CEA抗体またはその断片と組み合わせて、裸の抗体または抗体の組合せの投与と一緒に、前または後に投与することもできる。更に、疾患組織の治療に適する放射性核種としては、32P、33P、47Sc、59Fe、64Cu、67Cu、75Se、77As、89Sr、90Y、99Mo、105Rh、109Pd、111Ag、125I、131I、142Pr、143Pr、149Pm、153Sm、161Tb、166Ho、169Er、177Lu、186Re、188Re、189Re、194Ir、198Au、199Au、211Pb、212Pb、および213Bi、58Co、67Ga、80mBr、99mTc、103mRh、109Pt、111In、119Sb、161Ho、189mOs、192Ir、152Dy、211At、212Bi、223Ra、219Rn、215Po、211Bi、225Ac、221Fr、217At、213Bi、88Yおよび255Fmが挙げられるが、これらに限定されない。好ましい放射性核種は、125I、131I、90Y、177Lu、および225Acである。また、好ましくは、放射性核種のエネルギーは20-10,000keVである。
【0088】
薬学上許容可能なビヒクル
患者に送達される裸のネズミ、ヒト化、キメラおよびヒトクラスIII抗CEA MAbは、1種類以上の薬学上許容可能なビヒクル、1種類以上の補助成分、またはこれらの幾つかの組合せを含んでなることができる。
【0089】
本発明の未接合のクラスIII抗CEA抗体およびその断片は、薬学上有用な組成物を調製するための既知の方法に従って処方することができる。好ましくは、クラスIII抗CEA抗体またはその断片はMN-14抗体またはその断片である。滅菌したリン酸緩衝食塩水は、薬学上許容可能なビヒクルの一例である。他の許容可能なビヒクルは、当業者には周知である。例えば、Ansel et al.,「医薬の投薬形態および薬物送達系(PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS)」, 第5版(Lea & Febiger 1990)、およびGennaro (監修),「REMINGTONの薬科学(REMINGTON'S PHARMACEUTICAL SCIENCES)」, 第18版(Mack Publishing Company 1990)、およびそれらの改訂版を参照されたい。
【0090】
本発明の未接合のクラスIII抗CEA抗体またはその断片を、例えば、ボーラス投与または継続的輸液による静脈内投与用に処方することができる。好ましくは、クラスIII抗CEA抗体または断片は、MN-14抗体またはその断片である。注射用処方物は、例えば、アンプルまたは複数回投与用容器で、防腐剤を添加した単位投薬形態で提供することができる。組成物は、油性または水性ビヒクルの懸濁液、溶液またはエマルションのような形態を採ることができ、懸濁剤、安定剤および/または分散剤のような処方剤を含むことができる。あるいは、活性成分は、粉末状であって、使用前に滅菌した発熱物質不含水などの適当なビヒクルで構成することもできる。
【0091】
他の薬学的方法を用いて、薬剤および裸の抗体またはその断片の作用の期間を制御することができる。徐放性製剤は、裸の抗体と錯形成するまたは吸着するポリマーを用いて調製することができる。例えば、生体適合性ポリマーとしては、ポリ(エチレン-コ-酢酸ビニル)のマトリックス、およびステアリン酸二量体とセバシン酸のポリ無水物コポリマーのマトリックスが挙げられる。Sherwood et al., Bio/Technology 10:1446 (1992)。このようなマトリックスからの抗体またはその断片の放出速度は、免疫接合体または抗体の分子量、マトリックス中の抗体の量、および分散粒子の粒度によって変化する。Saltzman et al., Biophys. J. 55:163 (1989)、Sherwood et al., 上記引用。他の固形投薬形態は、Ansel et al., 「医薬の投薬形態および薬物送達系(PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS)」, 第5版(Lea & Febiger 1990)、およびGennaro (監修),「REMINGTONの薬科学(REMINGTON'S PHARMACEUTICAL SCIENCES)」, 第18版(Mack Publishing Company 1990)、およびそれらの改訂版に記載されている。
【0092】
未接合のクラスIII抗CEA抗体またはその断片を、哺乳類に皮下または他の非経口経路によって投与することもできる。さらに、連続輸液によりまたは単回または複数回ボーラス投与によって投与することができる。一般に、投与した裸の抗体またはその断片のヒトに対する投薬量は、患者の年齢、体重、身長、性別、全般的医学的条件および以前の医学的履歴によって変化する。典型的には、受容者に、単回静脈内輸液として約0.5mg/kg-20mg/kgの範囲の投薬量で裸の抗体またはその断片を投与するのが望ましいが、状況によっては一層低または高投薬量を投与することもできる。この投薬量は、必要に応じて例えば、月1回4-10ヶ月間、好ましくは2週間毎に16週間、さらに好ましくは毎週1回で8週間繰り返すことができる。これは2週間毎に数ヶ月間のように低頻度で投与し、または一層高頻度および/または一層長期間にわたって投与することもできる。この投薬量は、用量および計画を適当に調整することによって様々な非経口経路で投与することができる。
【0093】
治療の目的で、クラスIII抗CEA抗体またはその断片は、未治療コントロールと比較して腫瘍の大きさを減少させるのに治療上有効量で哺乳類に投与される。好ましくはクラスIII抗CEA抗体またはその断片はヒト化MN-14抗体またはその断片である。本発明に適する患者は、通常はヒトであるが、ヒト以外の哺乳類または動物の患者も考慮される。抗体製剤は、投与量が生理学的に有意であるときには、「治療上有効量」で投与されるといわれる。ある薬剤が存在することによって受容者の哺乳類の生理に検出可能な変化を生じるときには、これは生理学的に有意である。詳細には、本発明の抗体製剤は、その存在によって抗腫瘍応答を生じるときには、生理学的に有意である。生理学的に有意な効果は、受容者である哺乳類に体液性および/または細胞性免疫応答を引き起こすことでもある。
【0094】
本発明は、下記の番号を付けた態様も包含する。
1. 少なくとも1種類の抗CEAモノクローナル抗体(MAb)またはその断片と少なくとも1種類の治療薬とを含んでなる、組成物。態様1の組成物であって、上記の抗CEA MAbがクラスI、クラスIIまたはクラスIII抗CEA mAbであり、上記MAbがクラスIまたはクラスIIのMAbでありかつ顆粒球と反応するときに、上記MAbがMAbの一価形態であるもの。
【0095】
2. 上記抗CEA MAbまたはその断片がヒト化してあり、上記ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、態様1に記載の組成物。
【0096】
3. 上記抗CEA MAbまたはその断片がキメラMAbであり、このキメラMAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、態様1に記載の組成物。
【0097】
4. 上記抗CEA MAbまたはその断片が完全ヒトMAbであり、この完全ヒトMAbネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、態様1に記載の組成物。
【0098】
5. 上記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、態様1に記載の組成物。
【0099】
6. 上記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、このMN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなる、態様5に記載の組成物。抗CEA抗体またはその断片は、上記抗CEA抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。さらに、抗CEAモノクローナル抗体またはその断片は、軽および重鎖可変領域のCDRを含んでなる。
【0100】
7. 上記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、態様1に記載の組成物。
【0101】
8. 上記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、態様7に記載の組成物。
【0102】
9. 上記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、態様7に記載の組成物。
【0103】
10. 上記MN-14モノクローナル抗体またはその断片が完全にヒトMN-14抗体またはその断片である、態様7に記載の組成物。
【0104】
11. 上記ヒト化MN-14抗体またはその断片の軽鎖および重鎖可変領域の枠組構造領域(FR)が、ネズミMN-14モノクローナル抗体の相当するFRから置換された少なくとも1種類のアミノ酸を含んでなる、態様10に記載の組成物。
【0105】
12. 上記ヒト化MN-14抗体またはその断片が、図14A-Cまたは図22B(hMn-14)または図23Bのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される上記ネズミMN-14抗体の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様11に記載の組成物。
【0106】
13. 上記ヒト化MN-14抗体またはその断片が上記ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様11に記載の組成物。
【0107】
14. 上記ヒト化MN-14抗体またはその断片が図13Aまたは図22Aまたは図23Aに示される軽鎖可変領域と、KLHuVhAIGAとして表される図14A-Cまたは図22B (hMN-14)または図23Bに示される重鎖可変領域を含んでなる、態様8に記載の組成物。
【0108】
15. 上記キメラMN-14抗体またはその断片が、ネズミMN-14 VKと呼ばれる図13Aに示される軽鎖可変領域とネズミMN-14 VHと称される図14A-Cに示される重鎖可変領域を含んでなる、態様9に記載の組成物。
【0109】
16. 上記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、態様1-15のいずれか一項に記載の組成物。
【0110】
17. 上記治療薬が裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、免疫接合体、ホルモン、毒素、アンチセンスオリゴヌクレオチド、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、態様1-15のいずれか一項に記載の組成物。
【0111】
18. 上記それらの組合せがビンクリスチン、ドキソルビシン、オキサリプラチン、CPT-11、フルオロウラシル、DTIC、およびシクロホスファミドを含んでなる、態様17に記載の組成物。
【0112】
19. 上記治療薬が裸の抗体または免疫接合体である、態様17に記載の組成物。
【0113】
20. 上記裸の抗体または上記免疫接合体の抗体部分が、EGP-1、EGP-2(例えば、17-1 A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGF、または他の血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、テネイシン、フィブロネクチン、またはそれらの組合せと反応性であるモノクローナル抗体またはその断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片を含んでなる、態様19に記載の組成物。
【0114】
21. 上記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、態様20に記載の組成物。
【0115】
22. 上記治療薬がDTICではない、態様1-15のいずれか一項に記載の組成物。
【0116】
23. 患者に抗CEAモノクローナル抗体またはその断片の治療上有効量、および少なくとも1種類の治療薬であって、所望により薬学上許容可能なビヒクル中に処方したものを同時にまたは逐次的に投与することを含んでなる、甲状腺非髄様癌の治療方法。
【0117】
24. 上記抗CEA MAbまたはその断片がヒト化したものであり、上記ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、態様23に記載の方法。
【0118】
25. 上記抗CEA MAbまたはその断片がキメラMAbであり、上記キメラMAbが実質的にネズミ抗CEA MAbの抗CEA結合特異性を保持する、態様23に記載の方法。
【0119】
26. 上記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、態様23に記載の方法。
【0120】
27. 上記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記抗CEA抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、態様23に記載の方法。
【0121】
28. 上記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、態様27に記載の方法。
【0122】
29. 上記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、態様28に記載の方法。
【0123】
30. 上記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、請求項49に記載の方法。
【0124】
31. 上記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、態様28に記載の方法。
【0125】
32. 上記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)が、ネズミのMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様29に記載の方法。
【0126】
33. 上記ネズミMN-14モノクローナル抗体の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる上記ヒト化MN-14抗体またはその断片が、KLHuVhAIGAと称される図14A-Cまたは22B (hMN-14)または23Bのネズミの重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、態様32に記載の方法。
【0127】
34. 上記ヒト化MN-14抗体またはその断片が上記ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様32に記載の方法。
【0128】
35. 上記ヒト化MN-14抗体またはその断片が、図13Aまたは22A(hMN-14)または23Aに示される軽鎖可変領域とKLHuVhAIGAと称される図14A-Cまたは22B(hMN-14)または23Bに示される重鎖可変領域を含んでなる、態様32に記載の方法。
【0129】
36. 上記断片がF(ab')2、Fab'、Fab、 FvおよびsFvからなる群から選択される、態様23-25のいずれか一項に記載の方法。
【0130】
37. 上記治療薬がクラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に投与される、態様23-36のいずれか一項に記載の方法。
【0131】
38. 上記治療薬が裸の抗体または別の治療薬に接合した抗体である、態様37に記載の方法。
【0132】
39. 上記治療薬が裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、アンチセンスオリゴヌクレオチド、CEAまたは非-CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、態様23-36のいずれか一項に記載の方法。
【0133】
40. 上記治療薬がEGP-1、EGP-2(例えば、17-1A)、IL-6、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGFまたは他の腫瘍血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、およびそれらの組合せと反応性のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に上記患者に投与される、態様39に記載の方法。
【0134】
41. 上記抗体またはその断片が裸であるかまたは別の治療薬に接合している、態様40に記載の方法。
【0135】
42. 上記治療薬がDTICではない、態様23-36のいずれか一項に記載の方法。
【0136】
43. 上記細胞傷害性物質が薬剤または毒素である、態様39に記載の方法。
【0137】
44. 上記薬剤が、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、態様43に記載の方法。
【0138】
45. 上記薬剤が、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、 代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、態様43に記載の方法。
【0139】
46. 上記毒素がリシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される微生物、植物または動物性毒素である、態様43に記載の方法。
【0140】
47. 上記イムノモジュレーターがサイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチン、およびそれらの組合せからなる群から選択される、態様39に記載の方法。
【0141】
48. 上記リンホトキシンが腫瘍壊死因子(TNF)であり、上記造血因子がインターロイキン(IL)であり、上記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、上記インターフェロンがインターフェロン-α、-βまたは-γであり、上記幹細胞増殖因子が「S1因子」と称されるものである、態様47に記載の方法。
【0142】
49. 上記イムノモジュレーターがIL-1、IL-2、IL-3、IL-6、IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、態様40に記載の方法。
【0143】
50. 上記放射性核種のエネルギーが20-10,000keVである、態様39に記載の方法。
【0144】
51. 上記放射性核種が125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、態様50に記載の方法。
【0145】
52. 上記光活性治療薬が色素原または色素である、態様39に記載の方法。
【0146】
53. 上記アルキル化剤がダカルバジンである、態様44に記載の方法。
【0147】
54. 上記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量で投与する、態様53に記載の方法。
【0148】
55. 上記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量で投与する、態様54に記載の方法。
【0149】
56. 抗CEAモノクローナル抗体またはその断片、および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を同時または逐次的に患者に投与することを含んでなる、甲状腺髄様癌の治療方法。
【0150】
57. 上記抗CEA MAbがまたはその断片がヒト化しており、上記ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、態様56に記載の方法。
【0151】
58. 上記抗CEA MAbまたはその断片がキメラMAbであり、上記キメラMAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、態様56に記載の方法。
【0152】
59. 上記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、態様56に記載の方法。
【0153】
60. 上記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記クラスIIIのMN-14抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、態様59に記載の方法。
【0154】
61. 上記抗-CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、態様60に記載の方法。
【0155】
62. 上記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、態様61に記載の方法。
【0156】
63. 上記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、態様61に記載の方法。
【0157】
64. 上記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、態様61に記載の方法。
【0158】
65. 上記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)がネズミMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様62に記載の方法。
【0159】
66. 上記ネズミMN-14抗体の上記の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる上記ヒト化MN-14抗体またはその断片が、図14A-Cまたは22Bのネズミ重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、態様65に記載の方法。
【0160】
67. 上記ヒト化MN-14抗体またはその断片が上記ネズミMN-14軽鎖可変領域の上記の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様65に記載の方法。
【0161】
68. 上記ヒト化MN-14抗体またはその断片が、図13Aまたは22A(hMN-14)または23Aに記載の軽鎖可変領域と図14A-Cまたは22B(hMN-14)または23Bに記載の重鎖可変領域とを含んでなる、態様65に記載の方法。
【0162】
69. 上記断片がF(ab')2、Fab'、Fab、FvおよびsFvからなる群から選択される、態様56-68のいずれか一項に記載の方法。
【0163】
70. 上記治療薬が、クラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、 およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に投与される、態様56-68のいずれか一項に記載の方法。
【0164】
71. 上記抗体またはその断片が裸のまたは別の治療薬に接合したものである、態様70に記載の方法。
【0165】
72. 上記治療薬が、裸の抗体、細胞傷害性物質、薬剤、毒素、放射性核種、イムノモジュレーター、アンチセンスオリゴヌクレオチド、光活性治療薬、CEAまたは非-CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、場合によっては、薬学上許容可能なビヒクルで処方されたものからなる群から選択される、態様56-68のいずれか一項に記載の方法。
【0166】
73. 上記治療薬が、EGP-1、EGP-2(例えば、17-1A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGFまたは他の腫瘍血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、およびそれらの組合せと反応性のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に上記患者に投与される、態様72に記載の方法。
【0167】
74. 上記抗体またはその断片が裸のまたは別の治療薬に接合している、態様73に記載の方法。
【0168】
75. 上記治療薬がDTICではない、態様56-68のいずれか一項に記載の方法。
【0169】
76. 上記細胞傷害性物質が薬剤または毒素である、態様72に記載の方法。
【0170】
77. 上記薬剤が、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、態様72に記載の方法。
【0171】
78. 上記薬剤がナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、態様76に記載の方法。
【0172】
79. 上記微生物、植物または動物性毒素が、リシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される、態様76に記載の方法。
【0173】
80. 上記イムノモジュレーターが、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチンおよびそれらの組合せからなる群から選択される、態様72に記載の方法。
【0174】
81. 上記リンホトキシンが、腫瘍壊死因子(TNF)であり、上記造血因子がインターロイキン(IL)であり、上記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、上記インターフェロンがインターフェロン-α、-βまたは-γであり、上記幹細胞増殖因子が「S 1因子」と称されるものである、態様80に記載の方法。
【0175】
82. 上記イムノモジュレーターが、IL-1、IL-2、IL-3、IL-6, IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、態様72に記載の方法。
【0176】
83. 上記放射性核種のエネルギーが、20-10,000keVである、態様72に記載の方法。
【0177】
84. 上記放射性核種125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、態様72に記載の方法。
【0178】
85. 上記光活性治療薬が色素原または色素である、態様72に記載の方法。
【0179】
86. 上記アルキル化剤がダカルバジンである、態様77に記載の方法。
【0180】
87. 上記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量で投与する、態様86に記載の方法。
【0181】
88. 上記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量で投与する、態様87に記載の方法。
【0182】
89. 抗CEAモノクローナル抗体またはその断片、および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を同時または逐次的に患者に投与することを含んでなる、癌の治療方法。
【0183】
90. 治療薬がCPT-11である、態様89に記載の方法。
【0184】
91. 抗CEA抗体または断片を投与した後、CPT-11を投与する、態様90に記載の方法。
【0185】
92. 抗CEA抗体または断片を投与した約3日後にCPT-11を投与する、態様91に記載の方法。
【0186】
93. 治療薬がDTICである、態様89に記載の方法。
【0187】
94. 治療薬がオクサリプラチンである、態様89に記載の方法。
【0188】
95. 治療薬が5-フルオロウラシル/ロイコボリンである、態様89に記載の方法。
【0189】
96. 非抗体治療薬を用いる癌の治療方法において、癌患者に抗CEA抗体またはその断片を前投与した後、非抗体治療薬を投与することを含んでなる、改良法。
【0190】
97. 抗CEA抗体がhMN-14である、態様96に記載の方法。
【0191】
98. 治療薬がCPT-11である、態様96に記載の方法。
【0192】
99. 抗体を用いる癌の治療方法であって、抗体を投与する前に、顆粒球および/またはNK細胞を活性化する薬剤を癌患者に投与して抗体のエフェクター機能を増加させることを含んでなる、方法。
【0193】
100. 薬剤がGM-CSFである、態様99に記載の方法。
【0194】
101. 抗体が抗CEA抗体である、態様99に記載の方法。
【0195】
102. 抗体がhMN-14である、態様101に記載の方法。
【0196】
103. 抗CEA抗体または断片を用いる癌の治療方法であって、抗CEA抗体またはその断片を投与する前に、腫瘍細胞中のCEA発現をアップレギュレーションするのに有効な量のインターフェロンを癌患者に投与することを含んでなる、方法。
【0197】
104. 抗CEA抗体がhMN-14である、態様103に記載の方法。
【0198】
105. 同一または異なる抗原に対して少なくとも1種類のCEA結合部位および少なくとも1種類の他の結合部位を含んでなる、抗体融合タンパク質。
【0199】
106. CEA結合部位がMN-14抗体と同じ部位に結合する、態様105に記載の抗体融合タンパク質。
【0200】
107. 二価または三価である、態様105に記載の抗体融合タンパク質。
【0201】
108. 融合タンパク質の一方のアームがCD66eをターゲッティングするクラスIIIの抗CEA mAbであり、融合タンパク質もう一つのアームがCD66a-dをターゲッティングする別の抗CEA交差反応性抗体由来である、態様105に記載の抗体融合タンパク質。
【0202】
109. 結合アームがscFvまたはFab領域である、態様105に記載の抗体融合タンパク質。
【0203】
110. CD66a-dと反応する一本のアームとCEAのみと反応する2本のアームを含んでなる二重特異性の三価のタンパク質である、請求項25に記載の抗体融合タンパク質。
【0204】
111. NCA50/90に結合する2本のアームを含んでなる二重特異性タンパク質である、態様105に記載の抗体融合タンパク質。
【0205】
112. NCA50/90に結合する一本のアームとCEAのクラスIIIエピトープに結合する第二のアームを含んでなるジアボディーである、態様105に記載の抗体融合タンパク質。
【0206】
113. NCA-50/90アームがhMN-3抗体から得られ、CEAのクラスIIIエピトープに結合する第二のアームがhMN-14から得られる、態様112に記載の抗体融合タンパク質。
【0207】
114. 融合タンパク質が顆粒球からのサイトカイン放出の活性化を防止するためのFc-ドメインを欠き、または補体固定とADCCを防止する目的で変更されているFc-ドメインを有する、態様113に記載の抗体融合タンパク質。
【0208】
115. 1本のhMN-3アームと2本のhMN14アームを含んでなるトリアボディーである、態様104に記載の抗体融合タンパク質。115a. 1本のhMN-15アームと2本のhMN14アームを含んでなるトリアボディーである、態様104に記載の抗体融合タンパク質。
【0209】
116. 少なくとも1本のhMN-14アームと少なくとも1本のNP-3アームを含んでなる、態様104に記載の抗体融合タンパク質。
【0210】
117. 補体固定とADCCの活性化を可能にするFc-ドメインを含んでなる、態様116に記載の抗体融合タンパク質。
【0211】
118. 治療薬をも含んでなる、態様104に記載の抗体融合タンパク質。
【0212】
119. 治療薬がサイトカインである、態様118に記載の抗体融合タンパク質。
【0213】
120. サイトカインがインターフェロン、コロニー刺激因子、またはインターロイキンである、態様120に記載の抗体融合タンパク質。
【0214】
121. コロニー刺激因子がGM-CSFまたはG-CSFである、態様120に記載の抗体融合タンパク質。
【実施例】
【0215】
本発明を、下記の実施例によってさらに説明するが、これらに限定されるものではない。
【0216】
実施例1:材料および方法
モノクローナル抗体および細胞系
ヒト甲状腺髄様細胞系TTは、the American Type Culture Collectionから購入した。細胞は、10%ウシ胎仔血清、ペニシリン(100U/ml)、ストレプトマイシン(100μg/ml)、およびL-グルタミン(2mM)を補足したDMEM (Life Technologies, Gaithersburg, MD)中で単層として成長させた。細胞は、トリプシン、0.2% EDTAを用いて分離した後は常法によって継代した。
【0217】
MN-14は、CEAと反応し且つ通常の交差反応性抗原、NCA、および胎便抗原とは反応しないクラスIII抗CEA MAbである(Hansen et al., Cancer, 71:3478 (1993))。本発明でネガティブコントロールとして用いられるMN-14および抗-CD22 MAbであるLL2のヒト化形態の構築および特性決定については、以前に報告した。(Sharkey et al., Cancer Res., 55:5935s (1995); Leung et al., Mol. Immunol., 32: 1416 (1995))。P3x63Ag8 (MOPC-21)は、the American Type Culture collection (Rockville, MD)から入手した不適切なマウス骨髄腫IgG1である。抗体は、プロテインAクロマトグラフィーによって精製した。
【0218】
イン・ビボ研究
腫瘍は、組織培養によって増殖させた2x108個の洗浄したTT細胞を皮下投与することによって6-8週齢の雌nu/nuマウス(Taconic Farms, Germantown, NY)で増殖させた。抗体を、外側尾静脈を介して腫瘍担持動物に静脈内投与した。投与した抗体の量および投与の時間についての詳細は、それぞれの研究についての結果の節に示している。結果は、個々の動物の腫瘍容積並びに平均値±SEとして示す。腫瘍の大きさを、カリパスを用いて腫瘍の長さ、幅および深さを毎週測定することによって観察した。腫瘍容積は、3個の測定値の積として計算した。統計学的比較をStudentのT検定を用いて行い、腫瘍容積と増殖曲線の下の面積を比較した。
【0219】
実施例2.TT(ヒト甲状腺髄様)腫瘍細胞の2日後に送達した裸のhMN-14およびDTICの併用療法
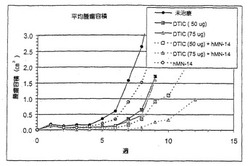
前の研究では、裸のhMN-14とダカルバジン(DTIC)を、腫瘍の移植の2日後に100μgおよび25μg用量のDTIC (2、3および4日)、および2日目、次いで毎週投与した250μg用量のhMN-14を用いてTTに組み合わせて投与した。hMN-14と組み合わせた100μgのDTIC用量は、単独での治療より効果的であった(図1A)。しかしながら、100μgDTIC用量は応答が強すぎ、一方25μg用量は有効でなかった。意外なことには、MN-14単独およびDTIC単独での効果は相加的ではなかった。換言すれば、250μg hMN-14単独および100μgDTIC単独を用いる治療の結果を考慮すれば、250μg hMN-14および100μgDTICの併用がこのような顕著な効果を有するとは予測する者はなかったであろう。図1Aを参照されたい。
【0220】
この研究では、以前の研究と同様に、TT細胞投与の2日後に治療を開始した。hMN-14は、100μgの用量で2、3、4、5、7、8、9、10、11、15および22日後、次いで動物が死亡するまで、腫瘍容積が2.0cm3になるまで、または人道的理由から研究を終了するまで投与した。DTICの用量は用量当たり50および75μgであり、これは以前の研究で投与した用量の間にある。TT細胞を60ヌードマウスに皮下投与した。投与日は月曜日であった。0日。図1Bを参照されたい。
【0221】
結果は、MAb療法単独、または化学療法単独のいずれによっても、腫瘍増殖が有意に遅れることを示している(図1B)。hMN-14抗体のこの計画と組み合わせた75μg用量のDTICは、いずれの単独での治療より有意に効果的であった(p<0.02)。意外にも、DTICとMAbの併用療法は相加的ではなかった。7週目では、75μgのDTICおよびMAb群の8/10で触診可能な腫瘍はなかったが、75μgのDTIC単独群では1/10、および未治療およびMAb群では0/10であった。
【0222】
7週間目の平均腫瘍容積は、0.018±0.039cm3 (75μgDTIC+MN-14)、0.284+0.197cm3 (75μgDTIC単独)、0.899±0.545cm3 (hMN-14単独)、および1.578±0.959cm3 (未処理)であった。裸の抗CEA抗体とDTICとの組合せ療法は抗体または化学療法のみの抗腫瘍効果を増加させるが、毒性は増加しない。組合せモダリティー治療が優れていることは、意外なものであった。
【0223】
投薬の要約: (1) hMN-14を、100μg/用量/マウスで日曜日を除き2-11日に毎日投与した(腹腔内)。抗体投与は、DTIC投与と同じ日に開始した。(2)DTICは2、3および4日目にMTDの5%および7.5%に相当する50および75μg/用量で投与した。1コースのみのDTICを投与した。
【0224】
群: 6群のマウスであり、各群は10匹のマウスからなる。
群1: 未処理。
群2. 50μg/用量のDTIC、2、3および4日目 (水曜日、木曜日および金曜日)。
群3. 75μg/用量のDTIC、2、3および4日目。
群4. 50μg/用量のDTIC、2、3および4日目と、hMN-14 (100μg/用量)を2、3、4、5、7、8、9、10、11、15および22日目、次いで動物が死亡するか、腫瘍容積が2.0cm3になるか、または研究を終了するまで7日毎に投与。
群5. 25μg/用量のDTIC、2、3および4日目と、hMN-14 (100μg/用量)を2、3、4、5、7、8、9、10、11、15および22日目、次いで動物が死亡するか、腫瘍容積が2.0cm3になるか、または研究を終了するまで7日毎に投与。
群6. hMN-14(100μg/用量を確認)、2、3、4、5、7、8、9、10、11、15および22日目、次いで動物が死亡するか、腫瘍容積が2.0cm3になるか、または研究を終了するまで7日毎に投与。
動物を生存について観察した。腫瘍および体重を毎週測定した。
【0225】
プロトコール: 2日目に、200mg/バイアルのDTICを、19.7mlの注射用滅菌水で再構成した。生成する溶液は、10 mg/mlのダカルバジンを含み、pHは3.0- 4.0であった。溶液を必要に応じて下記の希釈液のために用い、残りは後で使用するため1ml分量で凍結した。
群2および4: 0.5mg/ml溶液5mlを調製した。0.5mg/ml/マウスの100μlを、静脈内投与した。
群3および5: 0.75 mg/ml溶液5mlを調製した。0.75mg/ml/マウスの100μlを、静脈内投与した。
hMN-14の量を推定した。1mg/ml hMN-14 100μlを群4、5および6で腹腔内投与した。
【0226】
実施例3.ヒトMTC異種移植片モデルでの放射線免疫療法研究
出願人は、TTと呼ばれるヒトMTC細胞系を産生するCEA-およびカルシトニンのヒトMTC異種移植片を用いてMTCと放射能標識した抗CEA MAbの実験的放射線免疫療法のモデルを開発した([Stein, 1999 #82], 付表参照)。MTC腫瘍は、ヌードマウスで2x108個の細胞を皮下接種することによって定着させ、2-5週間成長させた後、MAbを投与した。次に、MN-14を用いて生体分布およびRAIT研究を行い、フローサイトメトリーによってTT細胞と反応することを示した。Ag8およびMu-9を両方とも、これらの研究におけるネガティブコントロールMAbとして用いた。約0.08gの小さめの腫瘍を用いる予備研究では、131I-MN-14の投与の7日後には、腫瘍1g当たりの投与量の百分率(%ID/g)は、同時に投与した125I-Ag8コントロールについて12.6%ID/gに過ぎないのに比較して、68.9%であった。大きめの腫瘍(ヌードマウスで5週間増殖; 平均腫瘍重量=0.404g)を用いたときには、125I-MN-14の投与から7日後に観察した腫瘍の% ID/gは12.4%であった。しかしながら、同時投与した88Y-MN-14の% ID/gは50. 5%であるか、または125I-MN-14より4.1倍高かった。腫瘍対血液、肺、肝臓、脾臓、および腎臓も125I-MN-14より88Y-MN-14での方が高かったが、腫瘍対骨比は両薬剤で同等であった。125I-MN-14と88Y-MN-14の生体分布データーを用いてそれぞれ131I-MN-14と90Y-MN-14の腫瘍線量測定を予測したときには、90Y-MN-14(115μCi)のMTDで送達された放射線吸収線量は、131I-MN-14のMTDで送達されたものより1.75倍高かった(275μCi) (4900 cGy対2800 cGy)。
【0227】
このモデルでの療法研究により、90Y-MN-14は131I-MN-14より良好な治療薬であることが確認された。5週齢腫瘍では、131I-MN-14では腫瘍成長が遅延しただけであったのと比較して、90Y-MN-14のMTDでは5週間の腫瘍成長の完全な阻害が見られた(図2)。さらに、小さめの2週齢腫瘍を治療したときには、幾つかの完全な腫瘍の退縮を伴う平均して60%の腫瘍容積の減少が90Y-MN-14のMTDで見られた。これらの抗腫瘍効果は、未治療動物またはコントロールMAbのMTDで治療したものでの腫瘍成長が割合速やかであるのと比較して、極めて有意であった。従って、本発明者らの前臨床研究は、この動物モデルが抗CEA MAbを用いる実験的RAITに極めて適することを示した。
【0228】
90Yの方がターゲット細胞によってより長時間保持されるという事実に加えて、131Iと比較して90Yの方がパス長さが長くかつエネルギーが高いことにより、増加した放射線線量を腫瘍に送達し、従って、等毒性線量で一層効果的な治療が得られた。残留(residualizing)131I (refs)を用いる本発明者らの結果をMTCにおけるMN-14に一般化することができれば、残留(residualizing)131Iは本発明で検討した大きさの腫瘍での90Yと少なくとも等しく有効となり、恐らくは微小転移疾患のセッティング(setting)または手術後の補助療法として優れていると予想する。
【0229】
実施例4:化学療法
ドキソルビシン、DTIC(ダカルバジン)、シクロホスファミド、およびビンクリスチンの4種類の薬剤をヌードマウスでのTT MTC異種移植片の成長に対するそれらの効果について、単独および組合せで評価した。用量は、mg/m2基剤でヒトに臨床投与されるそれぞれの薬剤の用量に基づいて選択した。動物を生存について観察し、腫瘍容積および体重を毎週測定した。図3は、この研究における動物についての腫瘍成長曲線を示す。個別に投与したところ、ドキソルビシン、DTIC、およびシクロホスホルアミドは有意な成長阻害を示すが、ビンクリスチンでは示さず、DTICによって引き起こされた成長遅延は他の薬剤のものより著しく長期間であった。それぞれの群についての倍化の近似的平均時間は、未処理では1週間、ドキソルビシンでは2.5週間、DTICでは7.5週間、シクロホスファミドでは3週間、ビンクリスチンでは1.5週間であった。ドキソルビシンとDTICを併用することにより、いずれかの薬剤単独と比較して効力が向上し、倍化の平均時間が10週間に増加した。しかしながら、ドキソルビシンとDTICの併用による効力の増加は、DTIC単独と比較して95% 信頼水準には達しなかった。AUC比較についてのP値は、下記の通りであり、ドキソルビシン+DTIC対ドキソルビシンについてはP<0.01であり、ドキソルビシン+DTIC対DTICについてはP<0.1であった。4薬剤法は倍化の平均時間を12週間まで伸長し、ドキソルビシンとDTICのいずれに対する比較でもP<0.01であった。
【0230】
個々の薬剤対未処理群についての生存データーの対数ランク分析は、DTICおよびシクロホスホルアミドについてのみ有意差を示した。未処理群についての平均生存時間は、DTICおよびシクロホスホルアミド処理群についてそれぞれ11週および8週間であったのに比較して4週間であり、薬剤併用についての12週間より大きかった。体重損失によって測定した毒性は、総ての検討群について許容範囲内であった。最大重量損失は、総ての4薬剤を投与したマウスにおいて投与後1週間で観察され、体重損失は3-12%であった。
【0231】
実施例5.MTCの治療のための放射線免疫療法と化学療法の併用
RAITと4薬剤併用
90Y-抗CEA MAb MN-14を用いるRAITと4剤併用を組み合わせる効果は、未処理マウスでのTTの成長を上記4剤法(ドキソルビシン、DTIC、シクロホスファミドおよびビンクリスチン)、RAITの最大許容線量(MTD)の100%(105μCi)、RAITのMTDの50%、およびRAITのMTDの50%と4薬剤の併用で処理したものと比較することによって評価した。図4は、様々な処理法で養生したマウスのTT腫瘍の成長曲線を示す。4処理群は総て、未処理動物と比較して効力が有意に向上した。未処理動物での倍化の近似的平均時間は1.5週間であったのに対して、4薬剤を用いる化学療法では平均倍化時間が10週間に伸び、RAIT単独ではそれぞれMTDの50%および100%で倍化時間が4週間および8週間となった。予想されたように、100% RAIT群および4薬剤療法による養生法はいずれも50% RAIT群より有意に良好であった。最も重要なことは、50% RAITと4薬剤による養生法の併用によって、いずれかの療法単独と比較して結果が改良され、平均倍化時間が約12.5週間に伸びた。併用治療と4薬剤による養生法の比較については、P<0.02であり、100% RAITとの比較については、P<0.01であった。
【0232】
治療から1週間後の平均重量損失(最下点)は100% RAITおよび4薬剤による養生法については9%であったが、50% RAITと4薬剤治療の併用については15%であった。その上、併用療法群では、1匹の動物が治療から3週間後に死亡し、第二の動物の重量損失は20%を上回った。従って、この治療は最大許容線量を超過していた。
【0233】
RAITと2薬剤法を用いる化学療法の併用
90Y-抗CEA MAb MN-14を用いるRAITとドキソルビシンおよびDTICからなる2剤併用の組合せ効果を、このMTC異種移植片モデルでも評価した。群についての近似的平均倍化時間は、未処理では1.5週間、ドキソルビシンとDTICの併用では8週間、RAITのMTDでは10週間、および2薬剤法の25-75%と組み合わせたRAITのMTDでは12週間を上回った。従って、RAIT単独は2薬剤法より効果的であり、最も重要なことは、RAITと2薬剤法の併用によりいずれかの療法単独と比較して改良された結果が得られたことである。併用治療と2薬剤法の比較については、P<0.005であり、RAIT単独との比較については、P<0.02であった。
【0234】
治療の1-2週間後の平均重量損失(最下点)は、100% RAITと75% 2薬剤化学療法群で2週間後に13%の損失が観察されたのを除けば、総ての群について2-8%であった。その上、この組合せ療法群では、2匹の動物が治療後3-4週間で死亡し、1匹の重量損失が20%を上回った。従って、75%用量レベルのドキソルビシンとDTICを100% RAIT治療に加えたところMTDを超過したのに対して、この2剤併用の50%は100% RAITとの併用で許容することができる。
【0235】
RAITとドキソルビシンの併用
以前の公表文献では、このモデルでのRAITとドキソルビシンの併用が報告されていたので(Stein et al., Clin Cancer Res., 5:3199s (1999)、Behr et al., Cancer Res. 57:5309 (1997))、RAITとドキソルビシンの併用法について直接比較を行った。直接比較は、RAITと4薬剤法の併用に対しても行った。いずれの治療法も、未治療動物と比較して有意な効力を生じた。RAITとドキソルビシンの併用群についての平均倍化時間は12週間であった。この研究では、RAITの完全なMTDを50%のドキソルビシンおよびDTICまたは4薬剤法と併用することにより、平均倍化時間は15週間を上回るまで伸び、これらの2群の間には統計学的有意差はなかった。これらの研究では、かなりの数の具体的応答が見られた。RAITとドキソルビシンの併用での治療後には、総数が10匹のマウスの中3匹では完全な応答、2匹では部分応答があり、5匹の動物は少なくとも4週間安定な疾患を有した。RAITと2薬剤の併用法では、具体的応答を増加し、12匹の動物の中10匹が完全応答および2匹が部分応答を示し、RAITと4薬剤併用治療法では、9匹のマウスの中7匹が完全応答を、2匹が部分応答を示した。
【0236】
RAITとDTICとの併用
DTICは、単独で投与するときには最も効果的な化学療法薬であるので、RAITとDTICの併用の効力をRAITとドキソルビシンおよびDTICの併用と比較して評価した。治療法からドキソルビシンを省くことは、この薬剤によって毒性、特に既知の心臓毒性が加えられるのを防止するのに臨床応用上重要となる。図5に示されるように、ドキソルビシンとDTICまたはDTIC単独の化学療法をRAITと組み合わせて受けた2検討群は互いにほぼ同等であり、いずれも単一様相治療より有効である。AUC比較のためのP値は下記の通りであり、RAIT+DTIC対DTICについてP<0.01、RAIT+DTIC対RAITについてP<0.05であった。RAITとDTICの併用、およびRAITとドキソルビシンおよびDTICの併用群の平均倍化時間は、DTICおよびRAIT単独では、それぞれ7.5週間および9週間であったのと比較して、それぞれ15.5週間および14週間であった。従って、RAITとDTICの併用様相治療では、平均倍化時間がDTIC化学療法と比較して100%だけ伸びた。RAITとDTICの併用、およびRAITとドキソルビシンおよびDTICの併用群の間のAUCまたは対数ランク分析のいずれによっても、有意差は見られなかった。
【0237】
実施例6:裸の抗CEA単独を用いる検討
裸のhMN-14を用いる療法
ヌードマウスでのTT腫瘍の成長に対する未標識hMN-14の効果を検討するため、腫瘍細胞投与から1日後または7日後にhMN-14を単回投与で静脈内投与した。図6は、未処理コントロールと比較した0.5mg hMN-14/マウスを投与した動物の腫瘍成長曲線を示す。未治療群は16匹の動物を含み、2つの治療群はそれぞれ10匹の動物を含んだ。未治療群と腫瘍投与から1日後に治療した群では、有意な成長遅延が観察された。平均腫瘍サイズの有意差(p<0.05)は、32日-93日に見られた。32日と60日の間では、未治療動物と比較してMN-14を投与した群で腫瘍のサイズが64-70%抑制された。11日目の群と未治療動物での平均腫瘍サイズには、有意差はなかった。成長曲線の下の面積のt検定分析により、腫瘍成長の有意な遅延も見られた。腫瘍投与から1日後に治療した群と比較して未治療群についてはP<0.05であったが、腫瘍投与から7日後に治療した群についてはP<0.05とはならなかった。
【0238】
治療の特異性
図7は、抗腫瘍応答の特異性についての検討結果をまとめている。未標識hMN-14のヌードマウスにおけるTT腫瘍の成長に対する効果を、ネガティブコントロールヒト化MAb、hLL2 (抗-CD22)、およびネズミMN-14の効果と比較した。MAb (0.5mg/マウス)をTT細胞の1日後に(静脈内)投与した後、更に1週間毎に3週間0.5mg/マウスの用量を投与した。15匹の動物群を検討した。0.5mg hMN-14の投与からの最初の検討で観察された成長阻害は、この検討で確認された。hMN-14および未治療群の間の平均腫瘍サイズの有意差(p<0.05)は、23日目に初めて観察された。37日目には、hMN-14で治療した群の平均腫瘍容積は、未治療コントロール動物の42.7%であった。ネズミMN-14での治療では、hMN-14と同様な結果が得られた。hLL2を用いる治療では腫瘍成長を遅らせず、代わりに小さな(有意でない)成長速度の増加が見られた。例えば、37日目には、hMN-14で治療した腫瘍の87%は、未治療の40%およびhLL2治療群の29%と比較して、0.5cm3未満であった。 成長曲線の下の面積のt検定分析は、未治療群とhMN-14またはネズミMN-14で治療した群との間に有意差(p<0.05)を示したが、hLL2を投与した群ではなかった。その上、hMN-14群はhLL2群と有意差があったが、ネズミMN-14を投与した動物とは有意差はなかった。
【0239】
用量の効果
未標識のhMN-14の用量のヌードマウスでのTT腫瘍の成長に対する効果を検討するため、増加用量のhMN-14を評価した。抗体用量をTT細胞の1日後に投与した後、検討を終了するまで毎週投与した。毎週用量は、6匹のマウスの群で0.125mg-2.0mg hMN-14/マウスであった。未治療群と総ての治療群の間で、平均腫瘍サイズと成長曲線の下の面積の有意差が観察された(図8)。例えば、21日目と49日目では、2つの最低hMN-14処理群における平均腫瘍容積は、未治療動物での腫瘍サイズの27-40%であった。0.125mgおよび0.25mgの低用量で治療すると、高用量で治療したときより効果的であると思われたが、その差は統計学的に有意とはならなかった。
【0240】
時期
ヌードマウスでのTT腫瘍の成長に対するTT投与およびhMN-14の初期用量の時期の効果を、MAbの投与の日を変更することによって評価した。hMN-14 (0.25 mg)をTT細胞の投与から1、3または7日後に投与した後、検討を終了するまで毎週投与した。7-8匹の動物群を検討した。結果を、図9にまとめている。未治療群と総ての3つの治療群では、平均腫瘍サイズ(p<0.05)に有意差が見られた。しかしながら、未治療マウスと7日後治療群との平均腫瘍サイズの差は、28日後の1時点だけでしか有意でなかった。1日後に治療したマウスは21-77日後とは有意差を生じ、3日後に治療したマウス21-70日毎は有意差を生じた。成長曲線の下の面積のt検定分析は、未治療群と比較してTT細胞の投与から1または3日後にhMN-14で治療した群について有意な成長阻害を示した。この分析は、未治療群と7日後に治療した群との間の差について95%信頼限界に達しなかった(p=0.057、5週間)。
【0241】
実施例7:MTCの裸の抗CEAとDTICの併用療法
裸のhMN-14がDTICの効果を増すことができるかどうかを検討するため、TT担持ヌードマウスに未標識MAbの投与の経路と組み合わせてDTIC(75μg/用量)を投与した。DTICは、TT細胞を皮下投与してから2日後に初めて1経路として75μg/用量で3日連続して投与した。hMN-14 MAb治療は、DTICの最初の投与と同じ日に100μg/用量/日で開始し、最初の2週間は5日間、次いで毎週2回行った。腫瘍成長の有意な遅延は、これらのMAb療法または化学療法単独のいずれかの計画によって生じた(図10)。hMN-14のこの計画と組み合わせたDTICの75μg用量、いずれか単独での治療より有意に効果的であった(P<0.02)。7週間後では、75μgDTIC単独群での1/10、および未治療およびMAb単独群での0/10と比較して、75μgDTIC+MAb群の8/10のマウスでは触診可能な腫瘍がなかった。7週間後の平均腫瘍容積は、0.018+0.039cm3 (75μgDTIC+hMN-14)、0.284+0.197cm3 (75μgDTIC)、0.899+0.545cm3 (hMN-14)、および1.578+0.959cm3 (未処理)であった。
【0242】
抗CEA MAb MN-14は、細胞傷害性物質に接合することなくMTCで予想外の抗腫瘍効力を示した。hMN-14投与および未治療群の間では平均腫瘍サイズの差が、3週間後に観察され始め、少なくとも2ヶ月間継続した。イソタイプにマッチしたネガティブコントロールMAbを用いる治療では、腫瘍成長を遅らせなかった。これは、「裸の」抗CEA MAbを用いる腫瘍抑制の最初の証拠である。しかしながら、裸の抗CEA MAbとDTICの併用療法は、毒性を増加することなく抗体または化学療法単独の抗腫瘍効果を増加させる。併用様相治療が優れていることは、MTC処理の化学療法へのCEA-MAb療法の組込みを立証している。
【0243】
図15は、甲状腺髄様癌モデルでの裸のhMN-14 CEA MabとDTICの治療の効果を示す。治療は、腫瘍移植の2日後に開始した。DTICを75μgでMTDの7.5%で2、3および4日目にマウスに投与した。hMN-14を、100μg/日で2-5、7-10、11、15、22日目、次いで週1回ずつ投与した。結果は、総ての群についての曲線の下の面積に統計学的有意差(P<0.05)を示している。裸のhMN-14 CEA Mab治療は、腫瘍成長阻害に対して有意な効果を示した。DTICと併用したときには、いずれか単独での治療と比較して腫瘍成長の阻害が意外なほど高くなった。
【0244】
実施例9:結腸癌細胞における裸の抗CEA抗体治療とCPT-11または 5-FUの併用
この実験では、ヒト化、裸の抗CEA、hMN-14抗体(hMN-14)単独と、化学療法との併用の結腸癌成長に対するイン・ビトロおよびイン・ビボ効果を開示する。
【0245】
方法および材料
抗体産生 The CDR移植した(ヒト化)MN-14 (hMN-14) 抗-癌胎児性抗原(CEA) (Sharkey, R.M., et al., Cancer Res, 55:5935-5945, 1995)、並びにネズミMN-14および異なるCEAエピトープをターゲッティングする他の抗体(NP1、NP3、MN3、MN15 (Sharkey, R. M., et al., Cancer Res, 50:2823-2831, 1990)は、プロテインAおよびイオン交換クロマトグラフィー(Q-Sepharose; Pharmacia, Piscataway, NJ)によって精製した。純度は、免疫電気泳動、還元および非還元条件を用いるポリアクリルアミドゲル電気泳動、およびサイズ排除高圧液体クロマトグラフィーによって試験した。
【0246】
イン・ビボ療法研究
CEA陽性GW-39肺内微小転移モデルを用いて生存療法研究を行った(Sharkey, R.M., et al., J Natl Cancer Inst., 83:627-632, 1991 ; Blumenthal, R. D., et al., Cancer Res, 52:6036-6044, 1992)。保存しておいた皮下GW-39ヒト結直腸腫瘍を用いて、10%または5%細胞懸濁液を調製した。細胞(30μl)を尾静脈に静脈内投与した。HuMN-14 IgGを、細胞移植の0日または3日後に開始し、毎日14日間、その後は週2回ずつ研究期間中100μg/日で投与した。CPT-11を、細胞移植の0日または3日後に開始して160μg/日の用量で5日間腹腔内に投与した(MTDの20%)。幾つかの研究については、保存GW-39腫瘍は、100,000UのIFN-γを一日2回ずつ4日間投与してCEA発現をアップレギュレーションしたマウスから得て(Greiner, J.W., et al., 16:2129-2133, 1996)、これは上記のように免疫組織学によって確認した(Blumenthal, R.D., et al., Int. J Cancer, 51:935-941, 1992)。体重を毎週観察し、動物の生存を記録した。結果をKaplan-Meir試験を用いて解析し、中央生存時間を決定した。
【0247】
癌細胞の抗体誘導化学感作のイン・ビボ効果
hMN14誘導化学感作の効果は、イン・ビボ並びにイン・ビトロで明らかであった。GW-39肺内微小転移を有するマウスの生存曲線は上記と同様であり、未処理またはhMN14単独(100μg/日 x 14日、および検討期間中週2回)、10% MTDのCPT-11 (80μg/日 x 5日)単独または両モダリティーを一緒に投与した。治療は、細胞移植の日に開始した(30μlの10% GW-39細胞懸濁液)。それぞれの治療群は10匹のマウスで始め、検討を2回繰り返した。結果は、hMN-14とCPT-11をGW-39肺微小転移を有するヌードマウスに同時投与したところ、生存はいずれの単独モダリティーの効果をも上回って増加した。CPT-11を10% MTDで投与したところ、56日から63日まで中央生存時間が1週間増加した(p<0.05)。0日目にhMN-14とCPT-11を両方とも投与した動物の中央生存時間は、さらに2週間77日まで増加した(p<0.005、未処理マウスと比較)。最大抗体付着が投与後3日目に起こるので、hMN-14治療をCPT-11の3日前に開始して、このような投与が組合せモダリティー治療法の治療効果がイン・ビボでの高抗体摂取および化学感作を行うことによってさらに高まるかどうかを決定した。結果は、hMN-14で3日間前処理を行った後CPT-11を投与したものでは、3日目にCPT-11単独投与では中央生存時間が70日であったのと比較して、中央生存時間が105日まで増加した(p < 0.001)。この研究では、hMN-14とCPT-11の同時投与が、中央生存時間が70日であったのに対して0日目にCPT-11単独の場合が中央生存時間が63日でありまたは未処理マウスでは中央生存時間が35日であったことから明らかなように、優れていた。結果は、10% GW-39細胞懸濁液の代わりに5%GW-39細胞懸濁液を用いた実験についても同様であった。
【0248】
実施例10:腫瘍細胞化学感作に対するhMN-14およびCPT-11を投与する前のイムノモジュレーターの予備投与のイン・ビボ効果
更なる実験では、GW-39保存腫瘍(10% GW-39細胞懸濁液)のインターフェロン-γ(IFNγ)による予備治療の結果として、CEAを高レベルで発現するGW-39腫瘍を有するマウスで一緒に開始したhMN-14とCPT-11の組合せ治療を評価した。裸の CEA抗体(hMN-14)の抗癌効果を高めるインターフェロン-γを含む実験は、下記のようにして行った。
【0249】
最初に、GW-39ヒト結腸癌を、IFN-γ100,000単位を1日2回ずつ4日間投与されたマウスで皮下で成長させた。GW-39腫瘍を有するコントロールマウスには、IFNを投与しなかった。実験マウスに、2匹のマウス(IFN投与ありまたはなし)のいずれかからのGW-39(w/v)の5%懸濁液を8匹の2群に静脈内投与した。それぞれの群の4匹にはIFNを投与したマウスからの腫瘍を投与し、4匹に未治療マウスからのものを投与した。次に、8匹の1群にhMN-14 (100μg/日x14日、次いで、実験が終了するまで週2回)を投与し、別の群にはCPT-11を160μg/日x5日(=最大許容用量の20%)で、第三の群には同用量の抗体+薬剤の組合せを投与し、第四の群は全く治療を行わなかった。動物の体重を測定し、生存数を毎週測定した。また、後で移植したマウスにおけるIFNを投与した保存腫瘍の試料も免疫組織学の目的で加工し、IFNを投与したマウス由来の腫瘍におけるCEA発現の増加を評価し、これを、CEA染色を示さないAg8のような関連のないIgGを用いる免疫組織学によって懸濁液を処理することによっても制御した。
【0250】
実施例11
動物モデルにおける低および高(上記のように、インターフェロン-γによって誘導される)CEA発現腫瘍細胞に対する裸のhMN-14 CEA Mabの効果を比較した。結果は、腫瘍細胞でのCEA抗原の発現増加は抗CEA抗体の効力向上と相関することを示している。比較研究の結果を、図21に示す。従って、インターフェロン-γの予備治療は、癌の治療における抗CEA抗体療法の効力を高めるのに有用である。
【0251】
実施例12:CEA抗体およびGM-CSFを用いるS状結腸癌療法
JRは、S状結腸癌の発見および除去の時点で見出された肝臓への転移を減少させる目的で5-フルオロウラシルとロイコボリンによる化学療法を受けている62歳の男性である。発表時の癌胎児性抗原(CEA)の血漿価は34ng/mlであり、肝臓のコンピューター断層撮影法は、右葉に直径2-4cmの数個の小さな病巣を示しているが、他の放射線医学的所見は正常である。ヒト化抗CEAIgG1、hMN-14モノクローナル抗体による免疫療法を、週単位で4週間、300 mg/m2の静脈内用量で2時間かけて輸液した。hMN-14療法の1週間前、患者に200 μg/m2のGM-CSF(sargamostim, Leukine(登録商標))を3日間間隔を置いて2回皮下投与し、週2回ずつhMN-14療法の4週間継続した。これらの4週間後、hMN-14とGM-CSFを両方とも同用量で2週間毎にさらに3ヶ月間投与するがGM-CSFの用量は250μg/m2まで増加させる。ヒト化CEA抗体のそれぞれの投与前に、患者にジフェンヒドラミン(Benadryl(登録商標)) 50mg経口およびアセトアミノフェン(Tylenol(登録商標)) 500mg経口を投与した。この時点で、患者を再登場させ、肝臓転移についてCT測定を行い、身体の残りの部分を様々な放射線走査を行う。血液を採取して化学分析と血中CEA価の測定も行う。肝臓以外に疾患の部分は見られないが、肝臓における測定可能な腫瘍の直径の和は40%減少していると思われ、患者の血中CEA価は18ng/mlまで減少し、治療応答を示している。hMN-14については200 mg/m2およびGM-CSFについては250μg/m2で2週間毎に投与したhMN-14およびGM-CSFによる免疫療法では、更に2ヶ月間投与し、再検査では、肝臓腫瘍の直径の和が更に減少しCEA価は10ng/mlまで低下している。腫瘍減少は予備治療ベースラインに対して>65%と測定されるので、この療法は部分的応答を行うものと考えられる。この後、投与頻度を減少させ、次の6ヶ月間は月1回ずつとしたが、総ての検討は疾患に変化がないことを示している。次に、患者を更に10ヶ月間追跡し、部分的緩解のままであり、この療法に対する副作用は見られず、一般的には疾患の症状は何もない。
【0252】
実施例13:転移結腸癌の免疫療法と化学療法の併用
STは、原発性腫瘍の切除後に結腸癌が肝臓と肺へ転移した52歳の女性である。患者に、ヒト化抗CEAモノクローナル抗体IgG1を添加すること以外はGramont計画(A. de Gramont et al, J Clin Oncol. 2000; 18:2938-1947)に基づく化学療法および免疫療法の併用法を行う。抗体を点滴する前に、患者にジフェンヒドラミン(Benadryl(登録商標)) 50mg経口およびアセトアミノフェン(Tylenol(登録商標)) 500mg経口を投与する。ロイコボリン(200mg/m2/日)を2時間輸液した後、5-フルオロウラシル(400mg/m2/日)のボーラス投与と5-フルオロウラシル(600mg/m2/日)の22時間連続輸液を2連続日2週間毎に行い、一緒にオクサリプラチン85mg/m2を5%デキストロース250mlでの2時間輸液としてロイココリンと同時に1日目に投与する(FOLFOX4計画)。患者には、5-ヒドロキシルトリプタミン-3-受容体拮抗薬と共に嘔吐防止薬も投与する。この2週間の化学療法サイクルの1週間前に、hMN-14モノクローナル抗CEA抗体を200 mg/m2の用量で2時間かけて点滴し、2週間の化学療法サイクルのそれぞれの週に反復し、その後、次の月については毎週別の化学療法サイクルを毎週行う。また、G-CSF (フィルグラスチム(filgrastim), Neupogen(登録商標)) 5 μg/kg/日を、第二の化学療法サイクルと共に開始して毎週1回皮下投与し、この用量でhMN-14抗体による免疫療法の期間、次の3ヶ月間継続した。総数が5サイクルの化学療法は、hMN-14抗体およびフィルグラスチムの連続投与である。その後、hMN-14とフィルグラスチムの投与を同用量で2週間毎に次の3ヶ月間行い、化学療法は行わない。患者を2ヶ月後に検査したところ、肝臓と肺の転移はコンピューター断層撮影法によれば、治療前に行った測定と比較して、肝臓と肺で測定した疾患の>80%が縮小していることを示している。血中CEA価も、治療前のレベルの63ng/mlから9ng/mlへ低下している。さらに6ヶ月間追跡を行ったが、疾患は安定していると思われ、新たな病巣は見られずまた肝臓と肺に残っている疾患の増加も見られない。患者の主な毒性は末梢感覚神経
障害であり、咽頭知覚不全(laryngeopharyngeal dysesthesia)である。患者は、化学療法サイクル中に下痢、粘液症(mucositis)、悪心および嘔吐を示したが、これらは極端なものではない。患者は免疫療法のみを行うときには副作用を全く示さず、有意なレトリクション(retriction)はなかった。
【0253】
実施例14
図16は、進行結腸癌モデルでの裸のhMN-14 CEA MabおよびCPT-11治療の効果を示す。hMN-14を、マウスに腫瘍移植の0日後から開始して、100μg/日の用量で14日間、次に2回/週ずつ投与した。CPT-11を60μg/日で5日間投与した。これらの条件下では、hMN-14自体の効果は明らかではなく、CPT-11の僅かな効果のみが見られた(p<0.05)。しかしながら、CPT-11の中央生存時間が63日間であり、併用療法中央生存時間が77日間であるのを比較することによって明らかなように、hMN-14はCPT-11の効果を増加させる(p<0.005)。hMN-14 CEA MabとCPT-11の併用療法は、進行ヒト結腸腫瘍転移を有する動物の生存を有意に引き延ばす。
【0254】
実施例15
図17は、低腫瘍負荷癌モデル(low tumor burden cancer model)における裸のhMN-14 CEA MabとCPT-11治療の効果を示す。5%腫瘍細胞懸濁液を用いる減少した腫瘍負荷モデルで、CPT-11、hMN-14単独、およびhMN-14とCPT-11の併用療法を比較した。投薬量は、実施例14に示した通りである。これらの条件下では、hMN-14単独の明らかな効果はなかった。CPT 11単独では、中央生存時間は70日となった。対照的に、併用療法では、中央生存時間が91日となった(p<0.025)。hMN-14とCPT-11の併用では、ヒト結腸癌の転移モデルでの低腫瘍負荷を有する動物の生存は有意に伸長する。
【0255】
実施例16
図18は、癌モデルでのCPT-11治療の3日前に行った裸のhMN-14 CEA Mabによる予備治療の効果を示す。5%腫瘍細胞懸濁液を用いる減少した腫瘍負荷モデルで、CPT-11、hMN-14単独、およびhMN-14とCPT-11との併用療法であって、hMN-14をCPT-11の3日前に投与したものを比較した。投薬量は、実施例14に示した通りである。hMN-14単独は、これらの条件下で中央生存時間を21%増加した(p<0.05)。CPT 11単独は、生存を76%増加した(p<0.001)。対照的に、併用療法であって、hMN-14をCPT-11の3日前に投与するものは、中央生存時間をCPT-11単独より更に58%増加した(p<0.001、CPT-11単独と比較)。hMN-14による予備治療は、ヒト結腸癌の転移モデルでの低腫瘍負荷を有する動物の生存を有意に引き延ばす。
【0256】
実施例17
図19は、ヒト結腸癌モデルでの裸のhMN-14 CEA MabとCPT-11の様々な投与計画の比較を示す。hMN-14をCPT-11の3日前に投与するのが、最も効果的である。投薬量は、実施例14に示した通りである。順序を逆にすると(CPT-11をhMN-14の3日前に投与)、または両者を同時に一緒にして投与すると、中央生存時間70日は未治療コントロール群(35日)より増加しているが、CPT-11の3日前にhMN-14で予備治療を行った場合の中央生存時間105日より有意に小さい。
【0257】
実施例18
図20は、ヒト結腸癌モデルでの裸のhMN-14 CEA Mab療法に対するGM-CSF予備治療の効果を示す。GM-CSFを、1μg/マウス/日の用量で-4、-3、-2および-1日に投与した。腫瘍細胞を、hMN-14投与と共に0日目に移植した。他の投薬量は、実施例14に示した通りである。GM-CSF予備治療は、GM-CSF単独またはhMN-14単独と比較して中央生存時間を統計学的に有意に増加した(p<0.002)。
【0258】
上記に特定の好ましい態様を示しているが、本発明はそれだけに限定されないことを理解されるであろう。当業者であれば、開示された態様に様々な修飾を行うことができ、かつこれらの修飾は本発明の範囲内にあることを意図するものであることを理解されるであろう。
【0259】
本明細書に引用された総ての公表文献、および特許出願明細書および特許明細書の内容は、その開示の一部として本明細書に引用されている。
【図面の簡単な説明】
【0260】
【図1A】hMN-14単独、DTIC単独、またはhMN-14とDTICの組合せを投与した後の腫瘍容積を比較するグラフ。図1Aは、25および100μg/用量で単独でまたは250μghMN-14抗体と共に投与したDTICを示す。
【図1B】hMN-14単独、DTIC単独、またはhMN-14とDTICの組合せを投与した後の腫瘍容積を比較するグラフ。図1BはDTICを50および75μg/用量で単独でまたは100μghMN-14抗体と共に投与したDTICを示す。
【図2】131Iおよび90Y-MN-14を用いる放射線免疫療法(RAIT)後の腫瘍容積を比較するグラフ。
【図3】TT担持マウスでの腫瘍容積に対する数種類の化学療法薬の治療効力を比較するグラフ。
【図4】マウスでの腫瘍容積に対する90Y標識抗 CEA MAbMN-14を用いたRAITとRAITの24時間後に開始した4剤併用の治療効力を比較するグラフ。
【図5】TT担持マウスにおけるRAITとDTICとの併用およびRAITとドキソルビシンとDTICの併用の効力を比較するグラフ。
【図6】TT異種移植片担持マウスでの裸のhMN-14の投与療法の効果を比較するグラフ。動物にTT細胞を皮下投与し、未処理のままにし(A)、または1日後(B)または11日後に0.5mg hMN-14を静脈内投与した。
【図7】甲状腺髄様癌の治療におけるヒト化およびネズミMN-14抗体の効果を比較するグラフ。動物にTT細胞を皮下投与し、未処理のままにし(A)、または1日後にhMN-14(0.5mg) を静脈内投与した。
【図8】甲状腺髄様癌の治療における様々なhMN-14用量の効果を比較するグラフ。動物に、TT細胞の皮下投与の1日後に増加用量のhMN-14を静脈内投与した。
【図9】TT担持ヌードマウスでの様々な投与時間を比較するグラフ。
【図10】TT担持ヌードマウスへのhMN-14とDTICの併用、DTIC単独、hMN-14単独の投与、および未処理マウスを比較するグラフ。
【図11A】ネズミMN-14可変領域重鎖(VH)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図11B】ネズミMN-14可変領域重鎖(VH)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図12A】ネズミMN-14可変領域軽鎖(VK)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図12B】ネズミMN-14可変領域軽鎖(VK)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図13A】ネズミMN-14可変領域とヒト可変領域NEWM VHおよびREI VKとの整列。CDRはボックスに囲われており、ヒト化VHに組込まれているネズミVH FRは、Kabat et al. 「免疫学的に興味深いタンパク質の配列(SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST)」, U.S. Government Printing Office, Washington, D.C., 1987のナンバリングシステムに従ってそれらの位置に印が付けられている。KLHuVHに包含されるCDR外のネズミ残基は黒丸が付けられている。
【図13B】ネズミMN-14可変領域とヒトKOL VH領域との整列。CDRはボックスに囲われており、ヒト化VHに組込まれているネズミVH FRは、Kabat et al. 「免疫学的に興味深いタンパク質の配列(SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST)」, U.S. Government Printing Office, Washington, D.C., 1987のナンバリングシステムに従ってそれらの位置に印が付けられている。KLHuVHに包含されるCDR外のネズミ残基は黒丸が付けられている。
【図14A】図14A-14Cは、ネズミおよびヒト化MN-14 VH枠組残基(FR)の間のアミノ酸配列の比較を示す。マウスと異なるヒトFR残基のみが、示されている。NEWMおよびKOLについてのCDRも、示されていない。それぞれのFRにおけるアミノ酸置換の範囲を太文字で表し、置換の位置はKabat et al.のナンバリングシステムに従って表した。3個のCDRがボックスで囲まれている。
【図14B】図14A-14Cは、ネズミおよびヒト化MN-14 VH枠組残基(FR)の間のアミノ酸配列の比較を示す。マウスと異なるヒトFR残基のみが、示されている。NEWMおよびKOLについてのCDRも、示されていない。それぞれのFRにおけるアミノ酸置換の範囲を太文字で表し、置換の位置はKabat et al.のナンバリングシステムに従って表した。3個のCDRがボックスで囲まれている。
【図14C】図14A-14Cは、ネズミおよびヒト化MN-14 VH枠組残基(FR)の間のアミノ酸配列の比較を示す。マウスと異なるヒトFR残基のみが、示されている。NEWMおよびKOLについてのCDRも、示されていない。それぞれのFRにおけるアミノ酸置換の範囲を太文字で表し、置換の位置はKabat et al.のナンバリングシステムに従って表した。3個のCDRがボックスで囲まれている。
【図15】ヒト甲状腺髄様癌モデルでの裸のhMN-14 CEA MabおよびDTIC治療の効果。
【図16】進行したヒト結腸癌モデルでの裸のhMN-14 CEA MabおよびCPT-11治療の効果。
【図17】低腫瘍負荷のヒト結腸癌モデルでの裸のhMN-14 CEA MabおよびCPT-11治療の効果。
【図18】ヒト結腸癌モデルでのCPT-11治療の3日前に投与した裸のhMN-14 CEA Mabの前投与の効果。
【図19】ヒト結腸癌モデルでの裸のhMN-14 CEA MabとCPT-11の様々な投与順序の比較。
【図20】ヒト結腸癌モデルでの裸のhMN-14 CEA Mab療法に対するGM-CSFの前投与の効果。
【図21】ヒト結腸癌モデルでの低CEA発現および高(インターフェロンにより誘導される)CEA発現腫瘍細胞に対する裸のhMN-14 CEA Mab療法の効果の比較。
【図22A】図22Aおよび22Bは、それぞれ show ヒトREIおよびKOL抗体のVkおよびVH領域のヒト、ネズミおよびヒト化配列と、ネズミおよびヒト化MN-14との比較を示す。図22AにおけるREIVkのヒト配列を、ネズミおよびヒト化MN-14Vk配列と比較する。黒丸は、ヒトREI Vk配列から保持された配列を示す。CDRはボックスで囲われている。
【図22B】図22Aおよび22Bは、それぞれ show ヒトREIおよびKOL抗体のVkおよびVH領域のヒト、ネズミおよびヒト化配列と、ネズミおよびヒト化MN-14との比較を示す。図22BにおけるKOL VHのヒト配列を、ネズミおよびヒト化MN-14 VH配列と比較する。黒丸は、ヒトKOL VH配列から保持された配列を示す。CDRはボックスで囲われている。
【図23A】図23Aおよび23Bは、hMN-14ヒト化クラスIII抗CEA抗体のVk,可変軽鎖およびVH,可変重鎖配列を示す。CDR領域配列は太文字でしめし、下線を付けている。アミノ酸残基およびヌクレアーゼは、順次番号を付けている。軽鎖可変領域は図23Aに示す。
【図23B】図23Aおよび23Bは、hMN-14ヒト化クラスIII抗CEA抗体のVk,可変軽鎖およびVH,可変重鎖配列を示す。CDR領域配列は太文字でしめし、下線を付けている。アミノ酸残基およびヌクレアーゼは、順次番号を付けている。重鎖可変領域は図23Bに示す。
【関連出願】
【0001】
本出願は、2003年5月2日出願の米国仮特許出願第60/467,161号の一部継続出願である。本出願は、2002年10月11日出願の国際出願第PCT/US/02/32307号に対する優先権を主張しており、この国際出願はまた2002年10月8日出願の米国仮特許出願第60/416,531号に対する優先権を主張している。
【発明の背景】
【0002】
A.発明の分野
本発明は、癌胎児性抗原(「CEA」)を発現する癌、特に甲状腺髄様癌(MTC)、甲状腺非髄様癌(非-MTC)、結腸直腸癌、肝細胞癌、胃癌、肺癌、乳癌および他の癌の治療方法であって、別の抗体、化学療法薬、放射性薬剤、イムノモジュレーター、免疫接合体またはそれらの組合せなどの少なくとも1種類の他の治療薬と組み合わせた抗体を含んでなる免疫学的試薬を投与することによってCEAを発現することを特徴とする方法に関する。本発明はまた、免疫学的試薬および少なくとも1種類の治療薬を未接合形態にて含んでなる医薬組成物にも関する。詳細には、本発明は、治療薬の投与前、中または後に、クラスIII抗-癌胎児性抗原(「抗CEA」)モノクローナル抗体(「MAb」)、特に相当するネズミのクラスIII抗CEA MAbの結合親和性特性および特異性を有するMAb、さらに詳細にはヒト抗体の抗原およびエフェクター特性を一層多く有するヒト化、キメラまたはヒトMAbを投与することによるCEAを発現する癌の治療方法に関する。治療方法において特に有用なMAbは、抗CEAネズミMAbの相補性決定領域(「CDR」)がヒト抗体の枠組構造領域に移植されているヒト化MAbである。
【0003】
B.背景技術
CEAは多数の上皮癌で通常に発現され、最も一般的には結腸で生じるが、胸部、肺、膵臓、甲状腺(髄様型)および卵巣でも生じるる癌胎児性抗原である(Goldenberg et al., J. Natl. Cancer Inst. 57: 11-22 (1976), Shively, et al., Crit. Rev. Oncol. Hematol. 2: 355-399 (1985))。CEAは、当初は結腸直腸癌の腫瘍特異性抗原であると考えられた(Gold et al., J. Exper. Med., 122: 467 (1965))。しかしながら、これは、後年に多種多様な癌、良性腫瘍および疾病組織、並びに通常のヒト結腸に存在することが見出された(Shively et al., Crit. Rev. Oncol. Hematol., 2: 355 (1985); von Kleist et al., Proc. Natl. Acad. Sci. U.S.A., 69: 2492 (1972))。CEAは同型および異型相互作用によって細胞-細胞接着をし、これらの相互作用は腫瘍形成の様々な態様におけるCEAの役割にも関与していることが示された。
【0004】
甲状腺に限定される甲状腺髄様癌(MTC)は、甲状腺全摘出および中心リンパ節切除によって治癒する可能性がある。しかしながら、これらの患者の約50%において、疾患が再発する。その上、切除できない疾患または離れた部位の転移を有する患者の予後は不十分であり、10年生存率は30%未満である(Rossi et al., Amer. J. Surgery, 139: 554 (1980); Samaan et al., J. Clin. Ezzdocrinol. Metab., 67:801 (1988); Schroder et al., Cancer, 61:806 (1988))。これらの患者は、治療法の選択の余地がほとんどない(「腫瘍学の原理と実践(Principles and Practice of Oncology)」, DeVita, Hellman and Rosenberg監修, New York: JB Lippincott Co. 1333-1435 (1989); Cance et al., Current Problems Surgery, 22:1 (1985) )。化学療法はは余り役に立たず、放射線療法は局所疾患の抑制にしか用いられない(Cance et al.; Tubiana et al., Cancer, 55:2062 (1985))。従って、この疾患を治療するには、新たな抑制モダリティーが必要である。
【0005】
癌の治療および診断に有用な方法では、抗体のターゲッティングを用いて治療および診断薬を悪性腫瘍の部位に直接送達する方法が用いられる。過去10年間に、多種多様な腫瘍特異性抗体および抗体断片が開発されてきたが、その理由は、それが薬剤、毒素、放射性核種、サイトカインまたは他の薬剤のようなイムノモジュレーターなどの治療薬に抗体を接合し、腫瘍をターゲッティングする接合体を患者に投与する方法を有しているためである。しかしながら、ネズミモノクローナル抗体(大抵の場合にはヒトに対する抗体のターゲッティングに用いられてきた)と複合体形成した薬剤または放射性核種を投与した患者は、循環するヒト抗マウス抗体(HAMA)を生じ時には複合体の抗体部分に対する全身性の即時型III型過敏症反応を発現する。しかしながら、これらの問題点は、ヒト化、キメラまたはヒト抗体の作製を包含む多数の様々な手法によりこれらネズミ抗体の免疫原性を少なくすることによって、ポリエチレングリコールをターゲッティング抗体に接合すること(PEG化)によるなどのターゲッティング抗体の化学修飾によって、または抗体における抗原性の部位を特定した後にそれを除くことによって、例えば、Fab'、F(ab)2および他の抗体断片を全IgGの代わりに用いることによって、上記問題点は少なくなった。その上、HAMAを血液から血漿分離法により(plasmaphoretically)除去することによって、HAMAの有害な作用を減少させる様々な試みがなされてきた。免疫抑制法も用いられ、外来抗体の有害な作用がターゲッティング薬を用いて複数の治療を行うのに十分なほどまで改善された。
【0006】
これらの治療の進歩とは関係なく、CEAを発現する癌の一層有効な治療方法を提供することが未だに求められている。本発明は、例えば、米国特許第5,874,540号明細書およびHansen et al., Cancer, 71:3478 (1993)に定義されているネズミMN-14MAbであるクラスIII抗CEA MAb、および米国特許第5,874,540号明細書に定義されているキメラおよびヒト化MN-14MAbであるクラスIII抗CEA MAb、およびPrimus et al.による米国特許第4,818,709号明細書に定義されているNP-4のような抗CEA抗体を用いる効果的な治療法を提供し、上記文献の総ての内容は、その開示の一部として本明細書に引用されている。好ましくは、クラスIII抗CEA MAbはヒト化したものであり、治療薬、特に化学療法薬と併用して、毒性をできるだけ少なくしてCEA発現癌の効果的な治療を行う。また、クラスII MAb、例えば、MN-6(Hansen et al., 上記引用を参照されたい)およびNP-3(米国特許第4,818,709号明細書を参照されたい)、およびクラスI MAb、例えば、MN-3およびMN-15(また、Hansen et al., 上記引用を参照されたい)のような他の抗CEA抗体は、CEA発現癌の有効な治療方法を提供する。さらに、これらの二成分を別個に投与すると、効果が増大し、個々の治療方法を調整する多用性および適応性が得られる。
【発明の概要】
【0007】
本発明は、甲状腺髄様癌および甲状腺非髄様癌の治療組成物および治療方法を意図するものである。
【0008】
本発明の第一の態様は、少なくとも1種類のクラスIII抗CEAモノクローナル抗体(MAb)またはその断片、好ましくはクラスIII抗CEA MAbまたは断片と、少なくとも1種類の治療薬を含んでなる組成物である。好ましくは、抗体断片は、F(ab')2、Fab'、Fab、Fv、およびscFvからなる群から選択される。また、クラスIII抗CEA MAbまたはその断片はヒト化したものであり、ヒト化MAbが実質的にネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を保持しているものも好ましい。クラスIII抗CEA MAbまたはその断片がキメラMAbであり、キメラMAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものも好ましい。さらに、クラスIII抗CEA MAbまたはその断片が完全ヒトMAbであって、上記の完全にヒトのMAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものも好ましい。この目的のための他の好ましい抗CEA MAbとしては、CD66a-dと交差反応性ではないクラスII MAbまたはその断片であって、さらに詳細に本明細書で説明されるものが挙げられる。他の態様としては、CD66a、bおよびdとは反応することができるが、CD66cとは反応しないクラスII抗CEA Mabまたはその断片、またはCD66a、bまたはd並びにCD66cと反応するクラスI Mabまたはその断片が挙げられる(クラスI MabがCD66cと結合するという定義による)。
【0009】
本発明の一態様において、クラスIII抗CEAモノクローナル抗体またはその断片は、好ましくはMN-14抗体またはその断片である。さらに好ましくは、MN-14モノクローナル抗体またはその断片は、ネズミのMN-14モノクローナル抗体の相補性決定領域(CDR)であって、MN-14抗体の軽鎖可変領域のCDRが、アミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、クラスIII抗CEA抗体の重鎖可変領域のCDRが、TYWMS を含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。また好ましくは、MN-14モノクローナル抗体はCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない。最も好ましくは、MN-14モノクローナル抗体またはその断片は、ヒト化、キメラまたは完全ヒトMN-14抗体またはその断片である。
【0010】
好ましい態様によれば、ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)は、ネズミMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。とりわけ、ヒト化MN-14抗体またはその断片は、好ましくは図14A-Cのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24(A)、28(D)、30(T)、48(1)、49(G)、74(A)および94(S)からなる群から選択されるネズミMN-14抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。同様に、ヒト化MN-14抗体またはその断片は、ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなることもできる。さらに好ましくは、ヒト化MN-14抗体またはその断片は、図13Aに示される軽鎖可変領域と、KLHuVhAIGAと呼ばれる図14A-Cに示される重鎖可変領域を含んでなる。
【0011】
本発明の第一の態様において、治療薬は、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、免疫接合体、ホルモン、またはそれらの組合せであって、所望により、薬学上許容可能なビヒクル中に処方されたものからなる群から選択される。本明細書では、治療薬がダカルバジン(DTIC)でないことも意図される。
【0012】
本発明の第二の態様は、クラスIII抗CEAモノクローナル抗体またはその断片の治療上有効量および少なくとも1種類の治療薬であって、場合により薬学上許容可能なビヒクル中に処方したものを同時または逐次的に投与することを含んでなる甲状腺髄様並びに甲状腺非髄様癌の治療方法を説明する。好ましくは、抗体断片はF(ab')2、Fab'、Fab、Fv、およびscFvからなる群から選択される。クラスIII抗CEA MAbまたはその断片がヒト化したものであり、上記ヒト化MAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものであることも好ましい。クラスIII抗CEA MAbまたはその断片がキメラMAbであって、上記キメラMAbがネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持しているものであるものも意図される。
【0013】
好ましい態様によれば、クラスIII抗CEAモノクローナル抗体またはその断片はMN-14抗体またはその断片である。好ましくは、MN-14モノクローナル抗体またはその断片はネズミのMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRはアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記クラスIIIのMN-14抗体の重鎖可変領域のCDRはTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。MN-14モノクローナル抗体がヒト化、キメラまたは完全にヒトのものであり、CEAと反応しかつ通常の交差反応性抗原(NCA)および胎便抗原とは反応しないものも好ましい。MN-14抗体またはその断片を、注入用量当たり100-600mgタンパク質の投薬量で投与するのも好ましい。最も好ましくは、MN-14抗体またはその断片は、注入用量当たり(per dose per injection)300-400mgタンパク質の投薬量で投与される。
【0014】
本発明の方法において、上記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)は、好ましくはネズミMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。さらに好ましくは、上記ネズミMN-14抗体の上記の相当するFR由来の少なくとも1種類のアミノ酸を含んでなるヒト化MN-14抗体またはその断片は、上記したように図14A-Cのネズミの重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94 からなる群から選択される。上記ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなるヒト化MN-14抗体またはその断片も好ましい。最も好ましくは、ヒト化MN-14抗体またはその断片は、図13A (中央配列)または図22A (hMN-14)または図23Aに記載の軽鎖可変領域と KLHuVhAIGAと称される図14A-Cまたは図22B (hMn-14)または図23Bに記載の重鎖可変領域を含んでなる。
【0015】
本発明の方法はまた、EGP-1、EGP-2(例えば、17-1A)、IL-6、インスリン様増殖因子-1、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、胎盤増殖因子(PlGF)または他の腫瘍血管新生抗原、Ga733、テネイシン、フィブロネクチンまたはそれらの組合せと反応するモノクローナル抗体またはその断片からなる群から選択される第二のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片の治療上有効量を患者に同時または逐次的に投与することを特徴とすることができる。同様に、この方法は、上記のクラスIまたはクラスIIまたはクラスIII抗CEAモノクローナル抗体またはその断片からなる群から選択される第二のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片の治療上有効量を患者に同時にまたは逐次的に投与することを含んでなることもある。好ましくは、第二の抗体またはその断片は、裸のものであるかまたは治療薬に接合している。
【0016】
本明細書に記載の方法の好ましい態様によれば、治療薬は裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、CEAまたは非CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクルで処方されたものからなる群から選択される。治療薬がダカルバジン(DTIC)でないことも意図される。
【0017】
好ましくは、治療薬は、薬剤または毒素からなる群から選択される細胞傷害性物質である。例えば、薬剤が有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2、および抗生物質、およびそれらの組合せからなる群から選択される薬学特性を有することが意図される。好ましくは、薬剤は、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される。
【0018】
治療薬が微生物、植物または動物毒素であるときには、この薬剤はリシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択することができる。
【0019】
本発明による方法では、治療薬が、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチンおよびそれらの組合せからなる群から選択されるイムノモジュレーターであることも意図される。好ましくは、リンホトキシンは腫瘍壊死因子(TNF)であり、上記造血因子はインターロイキン(IL)であり、上記コロニー刺激因子は顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、上記インターフェロンがインターフェロン-α、-βまたは-γであり、上記幹細胞増殖因子は「S1因子」と称されるものである。イムノモジュレーターがIL-1、IL-2、IL-3、IL-6, IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-α、またはそれらの組合せであるのも好ましい。骨髄または造血毒性を生じる細胞傷害性薬剤への暴露の前、同時、または後のサイトカインの投与は、米国特許第5,120,525号明細書に記載されており、この特許明細書の内容は、その開示の一部として本明細書に引用されている。
【0020】
治療薬が、色素原(chromogen)または色素である光活性治療薬であるか、またはダカルバジンであるアルキル化剤であるのも好ましい。
【0021】
治療薬は、エネルギーが20-10,000keVの放射性核種であることも好ましい。好ましくは、放射性核種は、125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される。
【0022】
他の態様によれば、本明細書に記載されているように、イムノモジュレーターは抗CEAモノクローナル抗体またはその断片の単独の治療上有効量を投与する前に投与され、またはイムノモジュレーターは抗CEAモノクローナル抗体と少なくとも1種類の治療薬の治療上有効量を投与する前に投与され、本明細書に記載のこれらの成分のいずれかは所望により学上許容可能なビヒクル中に処方される。
【発明の具体的説明】
【0023】
1.概観
本発明は、裸の抗CEA抗体またはその断片と少なくとも1種類の治療薬を治療期間にわたって逐次的または同時に投与する治療方法を提供する。この方法は、特に甲状腺髄様癌の治療に有用であるが、意外なことには、甲状腺非髄様癌、結腸直腸癌、肝細胞癌、膵臓癌、乳癌、肺癌、頭部と首部癌、膀胱癌、子宮癌および卵巣癌、およびCEAを余り高水準で発現しない癌の治療に有用である。例えば、少なくとも100ng/g組織の水準でCEAを発現する癌における治療が意図される。本発明の方法は、さらに抗CEA抗体、好ましくはクラスIII抗CEA抗体または抗体断片を含んでなる組成物であって、抗体および治療薬が互いに接合または結合しないものを提供する。本発明で用いられる「クラスIII抗CEA」抗体または抗体断片という用語は、CEA抗原(またはCD66e)に結合しかつ通常の交差反応性抗原(NCA)、胎便抗原(MA)、顆粒球およびCD66a-dとは反応しない抗体または断片を意味する(Primus et al.,米国特許第4,818,709号明細書を参照されたい。上記特許明細書の内容は、その開示の一部として本明細書に引用されている)。裸のクラスIII抗CEA抗体またはその断片は、ヒト化、キメラ、ヒトまたはネズミ抗体であってもよい。好ましい態様によれば、裸のクラスIII抗CEA抗体またはその断片はヒト化MN-14抗体またはその断片である。
【0024】
また、CD66a-dとは交差反応性でないクラスII Mabが本発明で用いるために意図される。これらは、胎便抗原と反応するが、NCAと反応せずかつ顆粒球と反応しないCEAドメインN-A1B1、A2B2と反応するMabである。例えば、NP-3およびMN-6は、本発明で有用なクラスII抗CEA抗体である。また、CD66a、bおよびdと反応することができるがCD66cとは反応することができないクラスII抗CEA Mabまたはその断片、またはCD66a、bまたはd並びにCD66cと反応するクラスI Mabまたはその断片も、本発明で用いるために意図される。(クラスI MabがCD66cと結合するという定義による)。
【0025】
意外なことには、本明細書に記載の組成物および方法は、結直腸癌、膵臓癌、乳癌、肺癌、肝細胞癌、膀胱癌、頭部と首部癌、および卵巣癌などの甲状腺非髄様癌の治療にも有用である。これらの形態の癌は甲状腺髄様癌よりCEAの発現が少ないので、治療薬と併用した裸のクラスIII抗CEA抗体は甲状腺非髄様癌の治療に有用であることが期待されなかった。
【0026】
裸のクラスIII抗CEA抗体による腫瘍細胞を殺す機構は確実には知られていないが、幾つかの機構を伴うと思われる。裸の抗体は単独でまたは治療薬と併用することにより、それらのそれぞれの抗原の生物学的活性をブロックすることによってまたは抗体依存性細胞傷害(ADCC)または補体依存性リーシスのような天然の免疫学的機能を刺激することによって腫瘍増殖に影響を与えることができると仮定されている。さらに、裸の抗体は単独でまたは治療薬と併用することにより、細胞増殖および細胞サイクル進行を阻害し、アポトーシスを誘導し、血管新生を阻害し、転移活性を阻害し、および/または腫瘍細胞接着に影響を与えることによって癌を治療し、制御することができる。実際に、本発明の抗CEA抗体またはその断片は、転移が腫瘍細胞接着の拮抗薬に一層感受性である可能性があるので、原発性癌より転移癌の治療に一層効果的であることがある。本発明の治療方法は、最適化を行い、抗体と一種類以上の治療薬を滴加して効果的な治療方法を提供することによって個々の患者にとって最大の抗腫瘍活性を提供することができる治療計画を提供する。
【0027】
本発明の一態様によれば、裸のクラスIII抗CEA抗体またはその断片と治療薬には、裸のまたは接合したヒト化、ネズミ、キメラまたはヒト抗体、融合タンパク質、またはその断片のような少なくとも1種類の補助治療薬を追加することができる。例えば、非ブロック性であり且つ顆粒球またはCD66a-dに結合しない別のクラスIII CEA抗体または抗体断片、非ブロック性であり且つ顆粒球またはCD66a-dに結合しないクラスII抗CEA抗体または抗体断片、CD66a、bおよびdとは反応するが、CD66cとは反応しないクラスII抗CEA Mabまたはその断片、CD66a、またはd並びにCD66cと反応するクラスI Mab(クラスI MabがCD66cと結合するという定義による)、または様々な癌関連エピトープまたは抗原に対する抗体を、好ましいヒト化MN-14抗体との併用治療の治療薬として用いることができる。このような補助抗体、融合タンパク質またはその断片は、以下において一層詳細に記載されるように、CEAまたは別の癌または腫瘍関連抗原に結合することができる。
【0028】
2.定義
以下の説明において、多数の用語を用いており、本発明の理解を容易にするために以下の定義を提供する。
【0029】
本明細書に記載の抗体は、完全長(すなわち、天然に存在するものまたは通常の免疫グロブリン遺伝子断片組換え法によって形成されたもの)の免疫グロブリン分子(例えば、IgG抗体)、または抗体断片のような免疫グロブリン分子の免疫学的に活性な(すなわち、特異結合性)部分を表す。
【0030】
抗体断片は、F(ab')2、F(ab)2、Fab'、Fab、Fv、scFv (一本鎖Fv)などの抗体の部分である。構造とは無関係に、抗体断片は完全な抗体によって認識される同じ抗原と結合する。
【0031】
「抗体断片」という用語は、特異抗原に結合して複合体を形成することによって抗体のような作用をする任意の合成または遺伝子工学処理を行ったタンパク質も包含する。例えば、抗体断片としては、例えば、重鎖および軽鎖の可変領域からなる「Fv」断片、組換え一本鎖ポリペプチド分子であって軽鎖および重鎖可変領域がペプチドリンカーによって連結されているもの(「scFvタンパク質」)、および超可変領域に類似のアミノ酸残基からなる最小認識単位のような可変領域からなる単離断片が挙げられる。Fv断片は、多価および/または多重特異性結合形態を生じるのと異なる方法で構築することができる。多価の前者の場合には、それらはCEAエピトープに対する2個以上の結合部位と反応し、多重特異性形態では、(CEAのまたはCEAおよび異なる抗原に対する)2個以上のエピトープが結合する。
【0032】
本明細書で用いられる抗体成分という用語は、完全な抗体、融合タンパク質、およびそれらの断片を包含する。
【0033】
裸の抗体は、一般に治療薬に接合しない完全な抗体である。これは、抗体分子のFc部分が、補体固定およびADCC (抗体依存性細胞傷害)のような機構を実行して細胞リーシスを生じることができるエフェクターまたは免疫学的機能を提供するので、その通りである。しかしながら、Fc部分は抗体の治療機能を必要としないことがあるが、アポトーシス、抗血管新生、抗転移活性、抗接着活性、例えば異型または同型接着の阻害、およびシグナル形成経路の干渉のようなむしろ他の機構が効果を示し、疾患の進行を干渉することがある。裸の抗体としては、ポリクローナルおよびモノクローナル抗体の両方、およびそれらの断片であって、ネズミ抗体、並びにある種の組換え抗体、例えばキメラ、ヒト化 またはヒト抗体およびそれらの断片などが挙げられる。本発明で定義されるように、「裸の」とは「未接合」と同義であり、一緒に投与される治療薬に連結または接合されていないことを意味する。
【0034】
キメラ抗体は、1つの種、好ましくは齧歯類抗体由来の抗体の相補性決定領域(CDR)などの重および軽抗体鎖の可変ドメインを含む組換えタンパク質であり、一方抗体分子の定常ドメインはヒト抗体の定常ドメインから誘導される。動物での応用については、キメラ抗体の定常ドメインは、ネコまたはイヌのような他の種の定常ドメインから誘導することができる。
【0035】
ヒト化抗体は、1つの種、例えば齧歯類抗体由来の抗体からのCDRが齧歯類抗体の重および軽可変鎖からヒトの重および軽可変ドメインへ導入される組換えタンパク質である。この抗体分子の定常ドメインは、ヒト抗体の定常ドメインから誘導される。
【0036】
ヒト抗体は、抗原投与に応答して特異的ヒト抗体を産生するように「工学処理された」トランスジェニックマウスから得られた抗体である。この手法では、ヒト重および軽鎖座の要素を、内在性重鎖および軽鎖座のターゲッティングした崩壊物を含む胚幹細胞系から誘導されたマウスの株に導入する。トランスジェニックマウスはヒト抗原に特異的なヒト抗体を合成することができ、このマウスを用いてヒト抗体分泌ハイブリドーマを産生することができる。トランスジェニックマウスからヒト抗体を得る方法は、Green et al., Nature Genet. 7:13 (1994)、Lonberg et al., Nature 368:856 (1994)、およびTaylor et al., Int. Immun. 6:579 (1994)に記載されている。完全にヒトの抗体は、遺伝子または染色体トランスフェクション法、並びにファージディスプレー法によって構築することもでき、これらの方法はいずれも当該技術分野で知られている。例えば、免役されていないドナーの免疫グロブリン可変ドメイン遺伝子レパートリーからヒト抗体およびその断片のイン・ビトロでの産生については、McCafferty et al., Nature 348:552-553 (1990)を参照されたい。この手法では、抗体可変ドメイン遺伝子を糸状バクテリオファージの主要または微量コートタンパク質遺伝子にインフレームでクローニングし、ファージ粒子の表面で機能的抗体断片として示される。糸状粒子はファージゲノムの一本鎖DNAコピーを含むので、抗体の機能特性に基づく選択ではそれらの特性を示す抗体をコードする遺伝子も選択される。この方法では、ファージはB細胞の特性の幾つかに類似している。ファージディスプレーは様々なフォーマットで行うことができ、それらの概説については、例えば、Johnson and Chiswell, Current Opinion in Structural Biology 3:5564-571 (1993)を参照されたい。
【0037】
ヒト抗体は、イン・ビトロで活性化したB細胞によって産生することもできる。米国特許第5,567,610号明細書および第5,229,275号明細書を参照されたい。上記特許明細書の内容は、その開示の一部として本明細書に引用されている。
【0038】
治療薬は、抗体成分、すなわち、抗体または抗体断片、またはその副次断片とは別個に、同時にまたは逐次的に投与され、疾患の治療に有用な分子または原子である。治療薬の例としては、抗体、抗体断片、免疫接合体、薬剤、細胞傷害性物質、毒素、ヌクレアーゼ、ホルモン、イムノモジュレーター、キレート化剤、ホウ素化合物、光活性剤または色素、放射性同位体または放射性核種、アンチセンスオリゴヌクレオチド、免疫接合体、またはそれらの組合せが挙げられる。
【0039】
免疫接合体は、治療薬に接合した抗体成分である。適当な治療薬は、上記されている。
【0040】
本明細書で用いられる抗体融合タンパク質という用語は、組換えによって産生した抗原結合分子であって、同じまたは異なる特異性を有する同じまたは異なる天然抗体、一本鎖抗体または抗体断片セグメントの2種類以上が連結しているものである。クラスIII抗CEA融合タンパク質は、少なくとも1種類のCEA結合部位を含んでなる。好ましくは、クラスIII抗CEA融合タンパク質は、MN-14融合タンパク質である。
【0041】
融合タンパク質の結合価は、融合タンパク質が有する(複数の)抗原または(複数の)エピトープに対する結合アームまたは部位の総数、すなわち、一価、二価、三価または多価を示している。抗体融合タンパク質が多価であることは、抗原との結合において複数の相互作用を利用することができ、従って、この抗原または異なる抗原に対する結合の親和力を増加することを意味している。特異性は、いくつの異なる種類の抗原またはエピトープに抗体融合タンパク質が結合し得るか、すなわち、単一特異性、二重特異性、三重特異性、多重特異性を示している。これらの定義を用いれば、天然抗体、例えば、IgGは2本の結合アームを有するので二価であるが、1種類の抗原またはエピトープに結合するので単一特異性である。単一特異性の多価融合タンパク質は、同一抗原またはエピトープに2個以上の結合部位を有する。例えば、単一特異性ジアボディーは、同一抗原と反応する2個の結合部位を有する融合タンパク質である。融合タンパク質は、異なる抗体成分または同一抗体成分の複数のコピーの多価または多重特異性の組合せを含んでなることができる。例えば、本発明の多重特異性であって、融合タンパク質の一方のアーム(例えば、scFvまたはFab)がCD66eをターゲッティングするクラスIIIの抗CEA mAbであって、融合タンパク質のもう一方のアームがCD66a-dをターゲッティングする別のCEA交差反応性抗体由来であることができる。
【0042】
本発明による好ましい二重特異性融合タンパク質はクラスIII CEAエピトープに対するアームと、顆粒球で発現したCD66a-dエピトープ(クラスII)に対する第二のアームを有する。これらの態様では、CD66a-d結合部分は、補体に固定しまたはFc-受容体に結合してADCCを行う(顆粒球からサイトカインを放出する)ことができないものであるべきである。補体固定およびADCCを行うことは本発明の裸の療法態様の好ましい特性ではあるが、二重特異性融合タンパク質に関する本発明の態様に関しては回避すべきである。正常な結腸細胞では、NCA-50/90およびCEAがいずれも発現するが、それらは正常な上皮細胞の先端面に限定されており、かつこの面は結腸管腔にのみ向けられており、投与された抗体には接近できない。CEAのようなこれらの正常細胞から放出されるまたは死んだ正常細胞に結合したCEAは、糞便中に排出される。この分極化(polarization)は結腸癌が発現すると失われ、次にNCA-50/90とCEAがいずれも正常な上皮細胞を固定している下にある正常な基底膜を冒している癌細胞膜上で発現する。hMN3/hMN14のような二重特異性抗体は、これらの侵襲細胞上でCEAおよびNCA-50/90のいずれとも反応することが予想される。さらに、NCA50/90は顆粒球上にあるので、この二重特異性は顆粒球に侵襲性結腸癌細胞を殺す指令を行うことが期待される。本発明による更に一層好ましい構築物は、NCA50/90と反応する1本のアームとCEAのみと反応する2本のアームを有する二重特異性の三価タンパク質である。他の態様は、NCA50/90に結合する2本のアームを有する二重特異性タンパク質であろう。
【0043】
顆粒球とも反応する好ましい融合タンパク質は、NCA-50/90 (例えば、hMN-3)に対する1本のアームとCEA(hMN14)上のクラスIIIエピトープに対する1本のアームを有するジアボディーであろう。これらの融合タンパク質はFc-ドメインを持たないので、顆粒球からのサイトカイン放出を活性化しない。さらに一層好ましい融合タンパク質は1本のhMN-3アームと2本のhMN14アームを有するトリアボディーであろう。このようなジアボディーとトリアボディーの構築は、米国特許出願連続番号第60/404,919号明細書(2002年8月22日出願)、第60/345,641号明細書(2002年1月8日出願)、第60/328,835号明細書(2001年10月15日出願)、および第60/341,881号明細書(2001年12月21日出願)に開示されている。
【0044】
hMN14/NP-3特異性のmabで作製した任意の種類の多重特異性抗体も好ましく、補体を固定/ADCCを活性化することができるFc-ドメインを有することができる。例えば、hMN14-IgGl/[NP-3-scFv]2融合タンパク質を用いることができ、その作製は米国特許出願連続番号第09/337,756号明細書に教示されている。
【0045】
本発明によるさらに他の好ましい種類の多重特異性抗体は、補体を固定/ADCCを行う能力を欠いているFc-ドメインを有するhMN-3MAbである。
【0046】
融合タンパク質は、さらに治療薬を含んでなることができる。例えば、少なくとも1種類の抗体またはその断片、例えば、CD66eまたはそのscFvまたはFabをターゲッティングするクラスIIIの抗CEA mAbをインターフェロンのようなサイトカインまたはGM-CSFまたはG-CSFまたはインターロイキンのようなコロニー刺激因子に接合することができる場合であり、これらはいずれも本明細書に記載されている。
【0047】
イムノモジュレーターは、これを含むときに、身体の免疫系を変化、抑制または刺激する本発明で定義されている治療薬である。典型的には、本発明で用いられるイムノモジュレーターは、免疫細胞を刺激してマクロファージ、B細胞、および/またはT細胞のような免疫応答カスケードにおいて増殖しまたは活性化される。本明細書に記載のイムノモジュレーターの一例はサイトカインであり、これは特異性抗原と接触したときに1個の細胞個体群(例えば、感作Tリンパ球)によって放出される約5-20kDの可溶性の小タンパク質であり、細胞間で細胞間メディエーターとして作用する。熟練技術者であれば理解されるように、サイトカインの例としては、リンホカイン、モノカイン、インターロイキン、および幾つかの関連したシグナル形成分子、例えば腫瘍壊死因子(TNF)およびインターフェロンが挙げられる。ケモカインは、サイトカインに包含される。ある種のインターロイキンおよびインターフェロンは、T細胞または他の免疫細胞増殖を刺激するサイトカインの例である。
【0048】
キメラ、ヒト化およびヒト抗体などのモノクローナル抗体の調製
モノクローナル抗体(MAb)は特定抗原に対する抗体の均質個体群であり、抗体は1種類だけの抗原結合部位を含んでなり、抗原決定基上の1個のエピトープのみに結合する。特異性抗原に対する齧歯類のモノクローナル抗体は、当業者に知られている方法によって得ることができる。例えば、Kohler and Milstein, Nature 256:495 (1975)、およびColigan et al. (監修), 「免疫学の最新の方法(CURRENT PROTOCOLS IN IMMUNOLOGY)」, 第1巻, 2.5.1-2.6.7頁 (John Wiley & Sons 1991)[以後「Coligan」と表す]を参照されたい。簡単に説明すれば、モノクローナル抗体は、マウスに抗原を含んでなる組成物を投与し、血清試料を採取することによって抗体産生の存在を確認し、脾臓を取り出してBリンパ球を得て、Bリンパ球を骨髄腫細胞と融合させてハイブリドーマを産生させ、ハイブリドーマをクローニングし、抗原に対する抗体を産生する陽性クローンを選択し、抗原に対する抗体を産生するクローンを培養し、ハイブリドーマ培養物から抗体を単離することによって得ることができる。
【0049】
MAbは、ハイブリドーマ培養物から様々な周知の手法によって単離し、精製することができる。このような単離法としては、プロテインAセファロースを用いるアフィニティークロマトグラフィー、サイズ排除クロマトグラフィー、およびイオン交換クロマトグラフィーが挙げられる。例えば、Coliganの2.7.1-2.7.12頁および2.9.1-2.9.3頁を参照されたい。また、Baines et al.,分子生物学の方法(METHODS IN MOLECULAR BIOLOGY)、「免疫グロブリンG(IgG)の精製」第10巻, pages 79-104 (The Humana Press, Inc. 1992)も参照されたい。
【0050】
ペプチド主鎖に対するAbは、Ab産生の周知の方法によって生成される。例えば、(ペプチド)n-KLH(但し、KLHは鍵穴のリムペットヘモシアニンであり、n=1-30)のような免疫原を完全Freundアジュバントに懸濁したものを免疫担当動物に投与した後、同一免疫原を不完全Freundアジュバントに懸濁したものを2回投与するのである。動物に、最後に抗原を静脈内に追加投与した後、3日後に脾臓細胞を集める。次に、集めた脾臓細胞をSp2/0-Ag14骨髄腫細胞と融合させ、生成するクローンの培養上清を直接結合ELISAを用いて抗ペプチド反応性について分析する。生成したAbの微細な特異性は、元の免疫原のペプチド断片を用いることによって分析することができる。これらの断片は、自動ペプチド合成装置を用いて容易に調製することができる。Ab産生のため、酵素欠損ハイブリドーマを単離して、融合細胞系を選択できるようにする。この手法を用いて、リンカーを含んでなるキレート、例えばIn(III)-DTPAキレートの1種類以上に対する抗体を生じさせることもできる。In(III)-ジ-DTPAに対するモノクローナルマウス抗体は知られている(Barbetに対する米国特許第5,256,395号明細書)。
【0051】
抗体を産生するもう一つの方法は、トランスジェニック家畜の乳における産生によるものである。例えば、Colman, A., Biochem. Soc. Symp., 63:141-147, 1998; 米国特許第5,827,690号明細書を参照されたい。上記文献の内容は、その開示の一部として本明細書に引用されている。それぞれ対になった免疫グロブリン重および軽鎖をコードするDNAセグメントを含む2種類のDNA構築物を調製する。DNAセグメントを、哺乳類上皮細胞で優先的に発現するプロモーター配列を含む発現ベクターにクローニングする。例えば、ウサギ、ウシおよびヒツジカゼイン遺伝子、ウシα-ラクトグロブリン遺伝子、ヒツジβ-ラクトグロブリン遺伝子、およびマウスホエー酸性タンパク質遺伝子由来のプロモーターが挙げられるが、これらに限定されない。好ましくは、挿入した断片を、哺乳類特異性遺伝子からの同種ゲノム配列によりその3'側に配置する。これにより、ポリアデニル化部位と転写体安定化配列が提供される。発現カセットを受精した哺乳類卵の前核に同時投与した後、雌被験動物の子宮に移植し、懐妊させる。誕生後、子孫を、サザン分析法によって両トランスジーンの存在についてスクリーニングする。抗体が存在するには、重および軽鎖遺伝子が両方とも同一細胞で同時に発現しなければならない。トランスジェニック雌動物の乳を、抗体または抗体断片の存在および機能について当該技術分野で知られている標準的免疫学的方法を用いて分析する。抗体は、当該技術分野で知られている標準的方法を用いて乳から精製することができる。
【0052】
免疫原に対する抗体を最初に生じさせた後、モノクローナル抗体の可変遺伝子をハイブリドーマ細胞からクローニングし、シークエンシングした後、組換法によって調製することができる。ネズミ免疫グロブリン可変ドメインをクローニングする一般的手法は、例えばOrlandi et al., Proc. Nat'l Acad. Sci. USA 86:3833 (1989)の公表物によって説明されており、上記文献の内容は、その開示の一部として本明細書に引用されている。ネズミ抗体および抗体断片のヒト化およびキメラ化は、当業者には周知である。キメラ抗体は、齧歯類抗体のような一種の動物由来のCDRを包含する可変ドメインを含む組換えタンパク質であり、この抗体分子の残り、すなわち定常ドメインはヒト抗体から誘導される。ヒト化およびキメラ化モノクローナル抗体は、ネズミ定常領域の免疫原性に関する問題点を緩和する。キメラ抗体を構築する方法は、当業者に周知である。例えば、Leung et al., Hybridome 13:469 (1994)には、抗CD22抗体であるLL2モノクローナル抗体のVKおよびVHドメインをコードするDNA配列をそれぞれのヒトKおよびIgG1定常領域ドメインと組み合わせることによってLL2キメラを産生する方法が記載されている。
【0053】
キメラモノクローナル抗体(MAb)は、キメラMAbの可変ドメインにおけるネズミFRの配列を1種類以上のヒトFRで置き換えることによってヒト化することもできる。具体的には、ヒト化モノクローナル抗体は、マウス免疫グロブリンの重および軽可変鎖由来のマウス相補性決定領域をヒト可変ドメインに導入した後、ネズミの対応部の枠組構造領域におけるヒト残基を置換することによって産生される。ヒトFRへのマウスCDRを簡単に導入することによって抗体親和性が減少または喪失することが多いので、更に修飾を行ってネズミ抗体の元の親和性を回復させる必要があることがある。これは、FR領域における1種類以上のヒト残基をそれらのネズミ対応物で置き換えて、そのエピトープに良好な結合親和性を有する抗体を得ることによって行うことができる。例えば、Tempest et al., Biotechnology 9:266 (1991)およびVerhoeyen et al., Science 239:1534 (1988)を参照されたい。
【0054】
好ましい態様によれば、ヒト化抗CEA抗体またはその断片の枠組構造領域における幾つかのヒト残基は、それらのネズミ対応物によって置き換えられている。さらに、キメラ抗CEAがネズミ対応物に匹敵する結合親和性を示すことを知れば、ヒト化抗CEA MAbの元の形態における欠陥デザインがもしあれば、キメラ抗CEAの軽および重鎖をヒト化形態のものに混合してマッチさせることによって同定することができる。好ましくは、ヒト化抗CEA抗体はヒト化MN-14抗体であり、その調製および配列は米国特許第5,874,540号明細書に開示されており、その内容は、その開示の一部として本明細書に引用されている。2種類のヒト抗体REIおよびNEWMはヒト化およびキメラMN-14抗体の調製に好ましい抗体であるが、2種類以上のヒト抗体由来の枠組構造配列の組合せをVHおよびVKに用いることができる。ヒト化MAbの産生は、例えば、Jones et al., Nature 321:522 (1986)、Riechmann et al., Nature 332:323 (1988)、Verhoeyen et al., Science 239:1534 (1988)、Carter et al., Proc. Nat'l Acad. Sci. USA 89:4285 (1992)、Sandhu, Crit. Rev. Biotech. 12:437 (1992)、およびSinger et al., J. Immun. 150:2844 (1993)に記載されており、それら内容は、その開示の一部として本明細書に引用されている。更に、ヒト化、キメラおよびヒトMAbの特異性エピトープに対する親和性はCDRの突然変異誘発によって増加することができるので、少なめの用量の抗体は突然変異誘発前の低めの親和性のMAbの高めの用量と同様な効果を得ることができる。例えば、WO0029584A1号明細書を参照されたい。
【0055】
他の態様によれば、本発明の抗体はヒトクラスIII抗CEAモノクローナル抗体である。抗CEA MAbまたは別のヒト抗体は、トランスジェニックなヒト以外の動物から得ることができる。例えば、Mendez et al., Nature Genetics, 15:146-156 (1997)および米国特許第5,633,425号明細書を参照されたい。これらの文献の内容は、その開示の一部として本明細書に引用されている。例えば、ヒト抗体は、ヒト免疫グロブリン座を有するトランスジェニックマウスから回収することができる。好ましくは、抗CEA抗体はMN-14抗体である。マウス体液性免疫系は、内在性免疫グロブリン遺伝子を不活性化し、ヒト免疫グロブリン座を導入することによってヒト化される。ヒト免疫グロブリン座は極端に複雑であり、ヒトゲノムのほぼ0.2%を占める多数の別個のセグメントを含んでなる。トランスジェニックマウスが抗体の適当なレパートリーを確実に産生できるようにするには、ヒト重および軽鎖座の大部分をマウスゲノムに導入しなければならない。これは、生殖細胞系におけるヒト重および軽鎖免疫グロブリン座を含む酵母の人工染色体(YAC)を形成することから初めて段階的に行われる。それぞれのインサートは大きさが約1Mbであるので、YAC構築には免疫グロブリン座の重複断片の相同組換えが必要である。重鎖座を含むものと軽鎖座を含むものの2個のYACを、YACを含む酵母スフェロブラスト(spheroblasts)とマウス胚幹細胞との融合を介してマウスに個別に導入する。次に、胚幹細胞クローンをマウス胚盤胞に微量投与する。生成するキメラ雄動物をYACをそれらの生殖細胞系中を透過する能力についてスクリーニングし、ネズミ抗体産生を欠いたマウスと共に飼育する。一方がヒト重鎖座を含み、他方がヒト軽鎖座を含む2種類のトランスジェニック株を飼育することによって、感作に応答してヒト抗体を産生する子孫が生じる。
【0056】
再配置されないヒト免疫グロブリン遺伝子を、ミセル依存性染色体導入(MMCT)を介してマウス胚幹細胞に導入することもできる。例えば、Tomizuka et al., Nature Genetics, 16:133 (1997)を参照されたい。この方法では、ヒト染色体を含むミセルをマウス胚幹細胞と融合させる。導入された染色体は安定に保持され、成熟キメラが適当な組織特異性発現を示す。
【0057】
あるいは、本発明の抗体または抗体断片は、組合せ免疫グロブリンライブラリーから単離されたヒト抗体断片から誘導することができる。例えば、Barbas et al., METHODS : A Companion to Methods in Enzymology 2:119 (1991)、およびWinter et al., Ann. Rev. Immunol. 12:433 (1994)を参照されたい。これらの文献の内容は、その開示の一部として本明細書に引用されている。B細胞の不朽化によるモノクローナル抗体の生成に関連した問題点の多くは、E. coliでの抗体断片をファージディスプレーを用いて工学処理を行い、発現させることによって解決することができる。高親和性のモノクローナル抗体を確実に回収するには、組合せ免疫グロブリンライブラリーは大きなレパートリーサイズを含むものでなければならない。典型的な方法では、免役マウスのリンパ球または脾臓細胞から得られたmRNAを用い、逆転写酵素を用いてcDNAを合成する。重および軽鎖遺伝子をPCRによって個別に増幅し、ファージクローニングベクターに連結する。2種類の異なるライブラリーである重鎖遺伝子を含むものと軽鎖遺伝子を含むものが産生される。ファージDNAをそれぞれのライブラリーから単離し、重および軽鎖配列を一緒に連結し、まとめて、組合せライブラリーを形成する。それぞれのファージは重および軽鎖cDNAのランダム対を含み、E. coliの感染時には、感染細胞中の抗体鎖の発現を指示する。目的とする抗原を認識する抗体を同定するため、ファージライブラリーを培養し、プラークに含まれる抗体分子をフィルターに移す。フィルターを放射性標識した抗原とインキュベーションした後、洗浄して過剰の未結合リガンドを除く。オートラジオグラム上の放射性スポットにより、抗原に結合する抗体を含むプラークが同定される。ヒト免疫グロブリンファージライブラリーの産生に有用なクローニングおよび発現ベクターは、例えば、STRATAGENE Cloning Systems (La Jolla, CA)から得ることができる。
【0058】
一つの態様によれば、本発明の抗体は、Hansen et al.,米国特許第5,874,540号明細書、Hansen et al., Cancer, 71:3478 (1993)、Primus et al.,米国特許第4,818,709号明細書、およびShively et al.,米国特許第5,081,235号明細書に記載の方法で産生され、上記文献の内容は、その開示の一部として本明細書に引用されている。
【0059】
抗体断片の産生
本発明は、クラスIII抗CEA抗体、好ましくはMN-14抗体の断片の使用を意図する。本発明のクラスIII抗CEA抗体またはその断片は、顆粒球またはCD66a-dと結合しない。特異性エピトープを認識する抗体断片は、既知の方法によって生成させることができる。例えば、抗体断片は、抗体のタンパク質分解性加水分解によって、または断片をコードするDNAのE. coliでの発現によって調製することができる。抗体断片はF(ab')2、Fab'、Fab、Fv、scFvなどのような抗体の抗原結合部分であり、通常の方法によって全抗体をペプシンまたはパパイン消化によって得ることができる。
【0060】
例えば、抗体断片は、ペプシンを用いる抗体の酵素開裂によって産生させ、F(ab')2で表される100Kd断片を得ることができる。この断片をチオール還元剤およびジスルフィド結合の開裂によって生じるスルフヒドリル基のブロッキング基を用いて更に開裂させ、50Kd Fab'の一価断片を産生させることができる。あるいは、パパインを用いる酵素開裂により、一価のFab断片およびFc断片直接生成する。これらの方法は、例えば、Goldenberg, 米国特許第4,036,945号明細書および第4,331,647号明細書、およびそこに記載されている参考文献に記載されており、上記特許明細書の内容は、その開示の一部として本明細書に引用されている。また、Nisonoff et al., Arch Biochem. Biophys. 89:230 (1960)、Porter, Biochenz. J 73:119 (1959)、Edelman et al., 「酵素学の方法(METHODS IN ENZYMOLOGY)」,第1巻, 422頁(Academic Press, 1967)、およびColigan, 2.8.1-2.8.10および2.10-2.10.4も参照されたい。
【0061】
重鎖を分離して一価の軽-重鎖断片の形成、断片の更なる開裂、または他の酵素的、化学的または遺伝学的手法のような抗体を開裂する他の方法も、断片が完全な抗体によって認識される抗原に結合する限り用いることができる。
【0062】
例えば、Fv断片はVHおよびVL鎖の会合を含んでなる。この会合は、Inbar et al., Proc. Nat'l. Acad. Sci. U.S.A. 69:2659 (1972)に記載されているように非共有結合性であることができる。あるいは、可変鎖同士を分子間ジスルフィド結合によって結合させまたはグルチルアルデヒドのような薬剤によって架橋させることができる。例えば、Sandhu, Crit. Rev. Biotech. 12:437 (1992)を参照されたい。
【0063】
好ましくは、Fv断片はペプチドリンカーによって結ばれているVHおよびVL鎖を含んでなる。これらの一本鎖抗原結合タンパク質(sFv)は、オリゴヌクレオチドによって結ばれているVHおよびVLドメインをコードするDNA配列を含んでなる構造遺伝子を構築することによって調製される。構造遺伝子を発現ベクターに挿入した後、これをE. coliのような宿主細胞中に導入する。組換え宿主細胞は、2個のVドメインを架橋するリンカーペプチドを有する一本鎖ポリペプチドを合成する。sFvを産生する方法は、例えば、Whitlow et al., Methods: A Companion to Methods in Enzymology, 2:97 (1991)に記載されている。Bird et al., Science 242:423 (1988)、Ladner et al., 米国特許第4,946,778号明細書、Pack et al., Bio Technology 11:1271 (1993)、およびSandhu, 上記引用も参照されたい。
【0064】
抗体断片の他の形態は、単一相補性決定領域(CDR)をコードするペプチドである。CDRは、抗体が結合し且つ可変領域の残りよりも一層可変であるエピトープに構造が相補性である抗体の可変領域のセグメントである。従って、CDRは時には超可変領域と表されることがある。可変領域は3種類のCDRを含んでなる。CDRペプチドは、目的の抗体のCDRをコードする遺伝子を構築することによって得ることができる。このような遺伝子は、例えば、ポリメラーゼ連鎖反応を用いて抗体産生細胞のRNAから可変領域を合成することによって調製される。例えば、Larrick et al., Methods: A Companion to Methods in Enzymology 2:106 (1991)、Courtenay-Luck, 「モノクローナル抗体の遺伝子操作(Genetic Manipulation of Monoclonal Antibodies)」, モノクローナル抗体: 産生、工学処理および臨床応用(MONOCLONAL ANTIBODIES: PRODUCTION, ENGINEERING AND CLINICAL APPLICATION), Ritter et al. (監修), 166-179頁(Cambridge University Press 1995)、およびWard et al.,「抗体の遺伝子操作および発現(Genetic Manipulation and Expression of Antibodies)」, モノクローナル抗体: 原理と応用(MONOCLONAL ANTIBODIES: PRINCIPLES AND APPLICATIONS), Birch et al., (監修), 137-185頁 (Wiley-Liss, Inc. 1995)を参照されたい。
【0065】
重鎖を分離して一価の軽-重鎖断片の形成、断片のさらなる開裂、または他の酵素的、化学的または遺伝学的手法のような抗体を開裂する他の方法も、断片が完全な抗体によって認識される抗原に結合する限り用いることができる。
【0066】
治療用のヒト化、キメラおよびヒト抗CEA抗体
本発明では、治療用のネズミ、キメラ、ヒト化およびヒトクラスIII抗CEA抗体およびそれらの断片を用いる組成物および方法が記載されている。好ましくは、クラスIII抗CEA抗体またはその断片はMN-14抗体またはその断片である。本発明の抗体を用いて、甲状腺髄様癌(MTC)、並びに非MTC CEAを発現する癌を治療することができる。典型的な非MTC CEA発現癌としては、結直腸癌、膵臓癌、肝細胞癌、胃癌、肺癌、頭部と首部癌、膀胱癌、子宮癌、乳癌および卵巣癌が挙げられる。
【0067】
組成物
本明細書では、少なくとも1種類のクラスIII抗CEAモノクローナル抗体(MAb)またはその断片と少なくとも1種類の治療薬であって、それらが互いに接合しておらず、従って、成分のそれぞれの未接合形態として組成物中に存在しているものを含んでなる組成物を意図する。第二のクラスIII抗CEA抗体のような2種類以上の抗体または抗体断片を含んでなる組成物では、第二の抗体は非ブロッキング性である(すなわち、第一のクラスIII抗CEA抗体または抗体断片の結合をブロックしない)。
【0068】
一つの態様によれば、クラスIII抗CEAモノクローナル抗体またはその断片は、ヒト化、キメラ、または完全にヒトのものであり、ヒト化、キメラ、または完全にヒトのMAbは実質的にネズミのクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を保持している。
【0069】
好ましい態様によれば、クラスIII抗CEAモノクローナル抗体またはその断片は、MN-14抗体またはその断片である。好ましくは、MN-14モノクローナル抗体またはその断片はネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRはアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記クラスIIIの抗CEA抗体の重鎖可変領域のCDRはTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。MN-14モノクローナル抗体はCEAと反応し且つ通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しないことも好ましい。しかしながら、これらの交差反応性決定基に対する抗体は、MN-14モノクローナル抗体と組み合わされるようなCEA特異性抗体との併用療法に用いることができる。
【0070】
本発明の他の態様によれば、MN-14モノクローナル抗体またはその断片はヒト化または完全にヒトのMN-14抗体またはその断片である。ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)は、好ましくはネズミMN-14モノクローナル抗体の相当するFRで置換された少なくとも1種類のアミノ酸を含んでなる。さらに好ましくは、ヒト化MN-14抗体またはその断片は、上記した図14A-Cのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24、28、30、48、49、74および94からなる群から選択されるネズミMN-14抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。好ましいヒト化重鎖可変領域のアミノ酸配列は、Hansen et al.,米国特許第5,874,540号明細書にも記載されており、上記特許明細書の内容は、その開示の一部として本明細書に引用されている。また、好ましくは、ヒト化重鎖可変領域は、KLHuVhAIGおよびKLHuVhAIGAYと呼ばれる図14A-Cに記載のアミノ酸配列を含んでなる。他の態様によれば、ヒト化MN-14抗体またはその断片は、ネズミMN-14軽鎖可変領域の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる。最も好ましくは、ヒト化MN-14抗体またはその断片は、図13Aまたは図22Aまたは図23Aの軽鎖可変領域を含んでなる。本発明の他の態様によれば、キメラMN-14モノクローナル抗体またはその断片と少なくとも1種類の治療薬を含んでなる組成物であって、これらは互いに接合しておらず、従って、成分のそれぞれの未接合形態として組成物中に存在しているものを含んでなる組成物である。好ましくは、キメラMN-14抗体またはその断片は、図13Aまたは図22Aまたは図23Aに記載のネズミMN14軽鎖可変領域のCDRと、図14A-Cまたは図22Bまたは図23Bに記載のネズミMN14重鎖可変領域のCDRを含んでなる。
【0071】
本明細書では、裸のネズミ、ヒト化、キメラまたはヒトクラスIII抗CEA抗体またはその断片と治療薬、および第二の裸のまたは接合したクラスIII抗CEA抗体またはその抗体断片であって、非ブロッキング性、すなわち、第一のクラスIII抗CEA抗体またはその断片の結合をブロックせず、薬学上許容可能なビヒクル中に処方されるものを含んでなる組成物も記載される。換言すれば、クラスIII抗CEA抗体またはその断片はいずれも互いに非ブロッキング性であり、従って、抗体またはその断片のいずれをもCEA(CD66e)に結合させる。さらに、本発明のクラスIII CEA抗体または抗体断片、並びに併用療法に用いるものは、顆粒球またはCD66a-dを結合しない。裸の抗体としてまたは免疫接合体の一成分として本発明の抗体断片の裸のクラスIII抗CEA抗体との併用療法に適する他のクラスIII抗体としては、Kuroki et al., JP J Can. Res., 78 (4):386 (1987)およびHammarstrom (Cancer Res. 52 (8):2329 (1992))に記載の非ブロッキング抗体またはその断片であって、顆粒球またはCD66a-dとも結合しないものが挙げられる。
【0072】
さらに、クラスIIまたはクラスI抗CEA抗体のような他の抗CEA抗体は、裸のまたは接合した形態のクラスIII抗CEA本発明の抗体と組み合わせて用いることができる。併用療法に用いることができるこのようなクラスII抗体または抗体断片は非ブロッキング性であり、顆粒球またはCD66a-dと結合しないが、胎便抗原(MA)およびCEAと反応する。例えば、MN-6またはNP-3のような1種類以上のキメラまたはヒト化クラスII抗CEA抗体またはその断片は、本発明のクラスIII抗CEA抗体またはその断片と組み合わせることができる。これら2種類の抗体は、CD66a-dまたは顆粒球と反応しない。多数の公表物、例えば、Thompson et al. ,J. Clin. Lab. Anal. 5:344 (1991)、Kuroki et al., J. Biol. Chem. 266:11810 (1991)、Nagel et al., Eur. J. Biochem. 214:27 (1993)、Skubitz et al., J. Immunol. 155:5382 (1995)、Skubitz et al., J. Leukoc. Biol. 60:106 (1996)、およびChen et al., Proc. Natl. Acad. Sci. 93:14851 (1996)には、CEAおよびCEA遺伝子ファミリーの様々な要素を認識するMAbが開示されている。
【0073】
さらに、第二の抗体または抗体断片は、未接合(裸)であるかまたは少なくとも1種類の治療薬接合している(免疫接合体)。免疫接合体は、治療薬を抗体成分に間接的に接合させることによって調製することができる。一般的手法は、Shih et al., Int. J. Cancer, 41:832 (1988)、Shih et al., Int. J. Cancer, 46:1101 (1990)、およびShih et al., 米国特許第5,057,313号明細書に記載されている。 一般的方法は、参加された炭水化物部分を有する抗体成分を少なくとも1種類の遊離アミン官能基を有し且つ複数の薬剤、毒素、キレート化剤、ホウ素アデンド(boron addend)、または他の治療薬を含んだキャリヤーポリマーと反応させることを必要とする。この反応によって最初のシッフ塩基(イミン)結合が生じ、これは還元して第二アミンとし、最終的接合体を形成することによって安定化することができる。好ましくは、治療用組成物の抗CEA抗体またはその断片は、MN-14抗体またはその断片である。さらに好ましくは、MN-14抗体またはその断片はヒト化している。
【0074】
本発明では、裸のヒト化、キメラ、ネズミまたはヒトクラスIII抗CEA抗体またはその断片と、治療薬、および第二の治療薬、例えば、クラスIIまたはクラスIII抗CEA抗体ではない接合または未接合抗体またはその抗体断片を含んでなる組成物も意図される。一つの態様によれば、第二の治療薬(または第二の抗体またはその断片)は、未接合(裸)であるかまたは少なくとも1種類の治療薬に接合している。併用療法に適するクラスI、クラスIIまたはクラスIII以外の抗CEA抗体およびその断片としては、癌関連抗体およびそれらの断片が挙げられるが、これらに限定されない。癌関連抗体および抗体断片の例は、EGP-1、EGP-2(例えば、17-1A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGFまたは他の腫瘍血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、テネイシン、フィブロネクチン、またはそれらの組合せに結合する。上記のように、CD66a-dまたは顆粒球と結合しない非ブロッキング性のクラスIIクラスIII抗CEA MAb、あるいはCD66a、bおよびdと結合するクラスII抗CEA MAb、またはCD66a、bおよびd、並びにCD66cと結合するクラスI抗CEA MAbは、クラスIII CEA抗体と組み合わせて用いることもできる。併用療法に適する他の抗体および抗体断片としては、癌遺伝子マーカーまたは産物に対してターゲッティングしたもの、または血管新生因子、胎盤増殖因子(P1GF)のような腫瘍-血管系マーカーに対する抗体、およびCD40に対する抗体のようなある種の免疫応答モジュレーターに対する抗体も挙げられる。
【0075】
方法
本発明には、甲状腺髄様癌および甲状腺非髄様癌の治療方法も記載される。甲状腺非髄様癌としては、結直腸癌および任意の他のCEA発現腫瘍、例えば、膵臓癌、乳癌、肝細胞癌、卵巣癌、ある種の肺、頭部と首部、子宮内膜、膀胱、および肝臓癌であって、様々な量のCEAを発現するものが挙げられる。これらの種類の癌におけるCEAレベルは甲状腺髄様癌に含まれるものよりずっと低いが、必要とされる総ては、CEAレベルが十分に高く、クラスIII抗CEA療法により効果的治療が行われることである。通常の結腸粘膜では約100-500μg/gであるが、約5μg/g組織のレベルの癌発現CEAが本発明に記載の方法を用いる治療に適している。
【0076】
例えば、本発明では、患者に同時にまたは逐次的に治療上有効量のクラスIII抗CEAモノクローナル抗体またはその断片と少なくとも1種類の治療薬であって、所望により薬学上許容可能なビヒクル中に処方したものを投与することを特徴とする甲状腺髄様癌または甲状腺非髄様癌が意図される。好ましくは、クラスIII抗CEAモノクローナル抗体またはその断片は、キメラ、ネズミ、ヒト化 またはヒトであって、キメラ、ヒト化、ネズミ、またはヒトクラスIII抗CEA MAbがネズミMAbのクラスIII抗CEA結合特異性を実質的に保持しているものである。さらに好ましくは、クラスIII抗CEA抗体はヒト化したものであって、最も好ましくは、本明細書および米国特許第5,874,540号明細書に記載されているヒト化MN-14モノクローナル抗体である。好ましくは、治療薬は細胞傷害性物質であり、さらに好ましくはアルキル化剤であり、最も好ましくは、ダカルバジン(DTIC)である。しかし、他の態様によれば、治療薬がDTICでないこともある。他のクラスの抗癌細胞増殖抑制剤および細胞傷害性物質、例えば、5-フルオロウラシル、CPT-11(イリノテカンおよびカンプトサルとしても知られる)およびオクサリプラチンを、特に結直腸癌の治療ではこれらの抗体と組み合わせて用いることもできる。他の癌の種類では、有効であることが知られている癌薬剤も、本発明で提案される抗体療法と併用するための良好な候補である。
【0077】
本発明では、患者に同時にまたは逐次的に治療上有効量の第一のクラスIII抗CEAモノクローナル抗体またはその断片と少なくとも1種類の治療薬、および裸のまたは接合した第二のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片であって、所望により薬学上許容可能なビヒクル中に処方したものを投与することを特徴とする甲状腺髄様癌および甲状腺非髄様癌の治療方法も意図される。好ましくは、第一のクラスIII抗CEA MAbはヒト化MN-14抗体またはその断片である。一つの態様によれば、第二の抗体またはその断片は、TAG-72、EGFR、HER2/neu、MUC1、MUC2、MUC3、MUC4、EGP-1、EGP-2、AFP、Tn、IL-6、インスリン増殖因子-1、または上記した別の腫瘍関連抗原と反応するモノクローナル抗体またはその断片からなる群から選択される癌関連抗体またはその断片である。他の態様によれば、第二の抗体またはその断片は、非ブロック性でありかつ顆粒球またはCD66a-dに結合しないクラスIII抗CEA抗体またはその断片であることができる。
【0078】
他の態様によれば、第二の抗CEA抗体はクラスII抗体またはその断片、例えば、Hammarstrom and Kurokiに記載のものであり、但し、それらは顆粒球またはCD66a-dと結合しないものである。他の態様によれば、この抗体としては、CD66a、b、またはd、並びにCD66cと反応するクラスI Mabまたはその断片が挙げられる。抗体およびその断片は、互いにまたは治療薬と同時にまたは逐次的に投与することができる。一つの態様によれば、第二の抗体またはその断片は、裸であるか、または治療薬に接合している。
【0079】
従って、本発明は、裸のネズミ、ヒト化、キメラおよびヒトクラスIII抗CEA抗体およびその断片を1種類以上の治療薬と逐次的または同時に、または多様療法として投与することを意図する。クラスIIIの抗CEA抗体が好ましいが、腫瘍細胞をターゲットする任意の抗CEA抗体が本発明で用いられる。本明細書に記載の裸のクラスIII抗CEA抗体は、1種類以上の治療薬に対する癌細胞の化学感受性を有意に増加させることができる。例えば、結腸癌細胞を本明細書に記載の裸のクラスIII抗CEA抗体MN-14で、CPT-11、5'-フルオロウラシル(5-FU)またはオキサリプラチンのような治療薬の前にまたは同時に治療すると、細胞傷害性薬剤のような治療薬に対する細胞の応答が向上する。さらに、裸のクラスIII抗CEA抗体単独でまたは治療薬と組み合わせる処置を用いるこれらの治療方法は、本明細書に記載のイムノモジュレーターを投与した後、裸の抗体を投与しまたは裸の抗体と少なくとも1種類の治療薬を投与することによってさらに高めることができる。
【0080】
本発明の多様療法は、クラスIII抗CEA抗体またはその断片および治療薬を用いる免疫療法であって、未接合または接合抗体、未接合または接合融合タンパク質、またはその断片の投与で補足したものを包含する。例えば、未接合のヒト化、キメラ、ネズミまたはヒトMN-14MAbまたはその断片は、別の裸のヒト化、ネズミ、キメラまたはヒトクラスIII抗CEA抗体(例えば、CEA上の異なるエピトープに対する抗体であって、顆粒球またはCD66a-dと結合しない)、または放射性同位体、化学療法薬、サイトカイン、酵素、酵素阻害剤、ホルモンまたはホルモン拮抗薬、金属、毒素、アンチセンスオリゴヌクレオチド(例えば、抗bc1-2)またはそれらの組合せに接合したヒト化、キメラ、ネズミまたはヒトクラスIII抗CEA抗体免疫接合体と組み合わせることができる。裸のクラスIII抗CEA抗体またはその断片は、ネズミの、ヒト化、キメラまたはヒトクラスIII抗CEA抗体の接合または未接合融合タンパク質と組み合わせることもできる。しかしながら、併用療法のクラスIII抗CEA抗体は互いに非ブロッキング性であり、顆粒球またはCD66a-dを結合することができない。好ましくは、裸のクラスIII抗CEA抗体は、第二の裸のまたは接合した抗体、融合タンパク質、またはその断片と逐次的または同時に投与する。また、併用療法に用いられる抗体または抗体断片の一つは、裸のヒト化MN-14抗体またはその断片であることが好ましい。さらに、裸のまたは接合した抗体、融合タンパク質、またはその断片として用いられる第二の抗体は、非ブロッキング性でありかつ顆粒球またはCD66a-dを結合しないヒト、ヒト化、キメラまたはネズミクラスII CEA抗体またはその断片であることができる。この態様による抗体の好ましい組合せは、エフェクター機能を欠き、補体を活性化せずかつサイトカイン放出を誘発しない裸の交差反応性の抗CD66a-d抗体を包含する。さらに、交差反応性の抗CD66a-d Fab'またはF(ab')2でも、顆粒球を損傷しないと思われ、NP-3タイプのクラスIII抗CEA MAbまたはクラスII抗CEA MAbと共に用いることができる。
【0081】
本明細書に記載の方法では、患者は、治療薬の前、後または同時に投与された少なくとも1種類の裸のクラスIII抗CEA抗体またはその断片を受け取る。一つの態様によれば、クラスIII抗CEA抗体は、細胞の前処理に用いられ、すなわち、治療薬の前に投与される。好ましくは、クラスIII抗CEA抗体はヒト化MN-14(hMN-14)のようなMN-14抗体であり、5-FUまたはCPT-11のような治療薬の少なくとも1時間前に投与される。
【0082】
好ましくは、治療薬は標準的な癌化学療法で用いられる薬剤であり、例えば、卵巣癌ではタキサンまたは白金薬、結直腸癌ではフルオロウラシル、CPT-11、およびオキサロプラチン、膵臓および他の癌ではジェムシタビン(gemcitabine)、または乳癌ではタキサン誘導体である。COX-2阻害薬は、癌化学療法において典型的な細胞傷害性物質と組み合わせて活性を示すさらにもう一つのクラスの薬剤であり、本発明で同様に、しかしさらにCEA抗体単独とおよび他の癌関連抗体と組み合わせたものと組み合わせて用いることができる。所望により、これらの薬剤を、上記の種類の放射能標識した抗体である他の癌関連抗体とのCEA抗体接合体または放射性接合体と組み合わせて用いることができる。また、クラスIII抗CEA抗体またはその断片がMN-14抗体またはその断片であることも好ましい。さらに好ましくは、MN-14抗体またはその断片はヒト化したものである。
【0083】
好ましい態様によれば、裸のクラスIII抗CEA抗体またはその断片は、ダカルバジン(DTIC)、ドキソルビン(doxorubin)、シクロホスファミドまたはビンクリスチン、またはこれらの任意の組合せと逐次的に(前または後に)または同時に投与される。例えば、DTICおよびシクロホスファミドを、裸のクラスIII抗CEA抗体またはその断片と逐次的にまたは同時に投与することができる。好ましくは、抗CEA抗体またはその断片は、ヒト化MN-14抗体またはその断片である。同様に、ホリニン酸と組み合わせた5-フルオロウラシルを単独で、またはイリノテカン(irinotecan)(CPT-11)と組み合わせたもの、またはオキサリプラチンとくみあわせたものは、結直腸癌の治療に用いられる養生法である。例えば、オクサリプラチンの単独これらの他の薬剤と組み合わせたものとの他の適当な併用化学療法は、当業者には周知である。従って、これらの化学療法薬のいずれかと裸のクラスIII抗CEA抗体またはその断片を用いる併用療法を用い、その用いた方法によってMTCまたは非-MTCを治療することができる。甲状腺髄様癌では、さらに他の化学療法薬、例えば、アルキル化剤の一つ(例えば、DTIC)、並びにジェムシタビン(gemcitabine)および他のさらに新しいクラスの細胞傷害性薬剤が好ましいことがある。化学療法剤と裸のクラスIII抗CEA抗体またはその断片は、任意の順序でまたは一緒に投与することができる。換言すれば、抗体と治療薬は、同時にまたは逐次的に投与することができる。好ましい多様療法では、化学療法剤と裸のクラスIII抗CEA抗体またはその断片は、本発明による接合または未接合の抗CEA抗体、融合タンパク質、またはその断片の前、後または同時に投与される。好ましくは、クラスIII抗CEA抗体またはその断片は、ヒト化MN-14抗体またはその断片である。
【0084】
多様治療の好ましい治療計画では、hMN-14とDTICを3日間投与し、hMN-14のみを7、14、21日目、およびその後12ヶ月の治療期間中21日毎に投与する。hMN-14の用量は輸液当たり0.5-15mg/kg体重であり、さらに好ましくは2-8であり、さらに一層好ましくは輸液当たり3-5mg/kgであり、DTICの用量は臨床上好ましい用量で現在適用されている通りであるが、使用されている好ましい最大用量の2/3以下で投与することによって薬剤に関連した副作用を減少させることもできる。1-6ヶ月毎などの反復薬剤サイクルを、裸の抗体療法の継続、または放射能標識した抗体、薬剤接合抗体、およびある種のサイトカイン、例えば、G-CSFおよび/またはGM-CSFの封入と共に行い、それぞれの用量を調整して、患者に対する毒性が治療の組合せによって増大しないようにすることができる。G-CSFのようなサイトカイン増殖因子の応用により、更に高用量の骨髄抑制薬、例えば、放射性標識した抗体または細胞傷害性薬剤を投与することができ、これらの計画および用量は、患者に個別的に、患者の疾患状態および以前の療法によって調整され、これら総ては骨髄の状態および追加の細胞傷害性療法に対する耐性に影響する。好ましい態様によれば、MN-14抗体またはその断片は、注入用量当たり100-600mgタンパク質で投与される。さらに好ましくは、MN-14抗体またはその断片は、注入用量当たり300-400mgタンパク質の投薬量で、好ましくは反復用量で投与される。好ましい抗体計画は毎週1回またはそれ以下の頻度、例えば、疾患の程度および患者の血液中を循環するCEAの量などの因子の数によって2週間に1回または3週間に1回の輸液である。
【0085】
治療薬
本発明で挙げられる治療薬は、本明細書に記載されているように、裸の抗体と共に別々の投与にも用いられる薬剤である。適当な治療薬細胞傷害性物質、放射性核種、イムノモジュレーター、光活性治療薬(例えば、色素原(chromagen)または色素)、アンチセンスオリゴヌクレオチド、免疫接合体、別の裸の抗体、ホルモン、またはそれらの組合せからなる群から選択することができる。治療薬としては、化学療法薬、例えば、ビンカアルカロイドおよび他のアルカロイド、アントラサイクリン、エピドフィロトキシン、タキサン、代謝拮抗物質、アルキル化剤、抗生物質、COX-2阻害薬、抗有糸分裂薬、抗血管新生およびアポトーシス薬、特にドキソルビシン、メトトレキセート、タキソール、CPT-11、カンプトテカン、およびこれらや他のクラスの抗癌薬由来の他のものなどが挙げられる。免疫接合体および抗体融合タンパク質の調製用の他の有用な癌化学療法薬としては、ナイトロジェンマスタード、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、COX-2阻害薬、ピリミジン類似体、プリン類似体、白金配位錯体、ホルモン、毒素(例えば、RNアーゼ、シュードモナス外毒素)などが挙げられる。好ましい治療薬としては、治療を行う悪性腫瘍によって、DTIC、CPT-11、5-フルオロウラシル、タキソール、オクサリプラチン、ドキソルビシン、シクロホスファミドおよびビンクリスチン、またはそれらの組合せが挙げられる。適当な化学療法薬は、「REMINGTONの薬科学, 第19版(REMINGTON'S PHARMACEUTICAL SCIENCES,19th Ed.)」 (Mack Publishing Co. 1995)、および「GOODMAN AND GILMANの治療薬の薬理学的基礎, 第7版(GOODMAN AND GILMAN'S THE PHARMACOLOGICAL BASIS OF THERAPEUTICS, 7th Ed.)」(MacMillan Publishing Co. 1985)、並びにこれらの出版物の改訂版に記載されている。他の適当な化学療法薬、例えば、実験薬は、当業者に知られている。
【0086】
シュードモナス外毒素のような毒素は、裸のクラスIII抗CEA抗体またはその断片と共に投与することもできる。好ましくは、クラスIII抗CEA抗体またはその断片は、ヒト化MN-14抗体またはその断片である。裸のクラスIII抗CEA抗体またはその断片に接合していないがそれらの前、後または同時に投与される他の適当な微生物、植物または動物毒素としては、リシン、アブリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素が挙げられる。例えば、Pastanet al., Cell 47:641 (1986)、およびGoldenberg, CA - A Cancer Journal for Clinicians 44:43 (1994)を参照されたい。本発明で用いるのに適している他の毒素は、当業者に知られており、米国特許第6,077,499号明細書に開示されており、上記特許明細書の内容は、その開示の一部として本明細書に引用されている。これらは、例えば、動物、植物および微生物供給源から誘導し、または化学的にまたは組換え工学処理を行うことができる。毒素は植物、微生物、または動物性毒素であるか、またはそれらの合成変異体であることができる。
【0087】
サイトカインのようなイムノモジュレーターは、本発明のキメラ、ネズミ、ヒト化 またはヒトクラスIII抗CEA抗体またはその断片に接合せずに投与することもできる。本発明で用いられる「イムノモジュレーター」という用語は、サイトカイン、幹細胞増殖因子、リンホトキシン、例えば、腫瘍壊死因子(TNF)、および造血因子、例えば、インターロイキン(例えば、インターロイキン-1 (IL-1)、IL-2、IL-3、IL-6、IL-10、IL-12、IL-18およびIL-21)、コロニー刺激因子(例えば、顆粒球-コロニー刺激因子(G-CSF)および顆粒球マクロファージ-コロニー刺激因子(GM-CSF))、インターフェロン(例えば、インターフェロン-α、-βおよび-γ)、「S1因子」と呼ばれる幹細胞増殖因子、エリトロポエチンおよびトロンボポエチンを包含する。適当なイムノモジュレーター残基の例としては、IL-2、IL-6、IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-αなどが挙げられる。従って、患者は、裸のクラスIII抗CEA抗体またはその断片と、裸のクラスIII抗CEA抗体またはその断片の投与の前、と同時またはの後に投与することができる別個に投与されるサイトカインを受け取ることができる。幾つかの抗原はイムノモジュレーターであることもできるので、例えば、CD40抗原は、裸のクラスIII抗CEA抗体またはその断片と組み合わせて、裸の抗体または抗体の組合せの投与と一緒に、前または後に投与することもできる。更に、疾患組織の治療に適する放射性核種としては、32P、33P、47Sc、59Fe、64Cu、67Cu、75Se、77As、89Sr、90Y、99Mo、105Rh、109Pd、111Ag、125I、131I、142Pr、143Pr、149Pm、153Sm、161Tb、166Ho、169Er、177Lu、186Re、188Re、189Re、194Ir、198Au、199Au、211Pb、212Pb、および213Bi、58Co、67Ga、80mBr、99mTc、103mRh、109Pt、111In、119Sb、161Ho、189mOs、192Ir、152Dy、211At、212Bi、223Ra、219Rn、215Po、211Bi、225Ac、221Fr、217At、213Bi、88Yおよび255Fmが挙げられるが、これらに限定されない。好ましい放射性核種は、125I、131I、90Y、177Lu、および225Acである。また、好ましくは、放射性核種のエネルギーは20-10,000keVである。
【0088】
薬学上許容可能なビヒクル
患者に送達される裸のネズミ、ヒト化、キメラおよびヒトクラスIII抗CEA MAbは、1種類以上の薬学上許容可能なビヒクル、1種類以上の補助成分、またはこれらの幾つかの組合せを含んでなることができる。
【0089】
本発明の未接合のクラスIII抗CEA抗体およびその断片は、薬学上有用な組成物を調製するための既知の方法に従って処方することができる。好ましくは、クラスIII抗CEA抗体またはその断片はMN-14抗体またはその断片である。滅菌したリン酸緩衝食塩水は、薬学上許容可能なビヒクルの一例である。他の許容可能なビヒクルは、当業者には周知である。例えば、Ansel et al.,「医薬の投薬形態および薬物送達系(PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS)」, 第5版(Lea & Febiger 1990)、およびGennaro (監修),「REMINGTONの薬科学(REMINGTON'S PHARMACEUTICAL SCIENCES)」, 第18版(Mack Publishing Company 1990)、およびそれらの改訂版を参照されたい。
【0090】
本発明の未接合のクラスIII抗CEA抗体またはその断片を、例えば、ボーラス投与または継続的輸液による静脈内投与用に処方することができる。好ましくは、クラスIII抗CEA抗体または断片は、MN-14抗体またはその断片である。注射用処方物は、例えば、アンプルまたは複数回投与用容器で、防腐剤を添加した単位投薬形態で提供することができる。組成物は、油性または水性ビヒクルの懸濁液、溶液またはエマルションのような形態を採ることができ、懸濁剤、安定剤および/または分散剤のような処方剤を含むことができる。あるいは、活性成分は、粉末状であって、使用前に滅菌した発熱物質不含水などの適当なビヒクルで構成することもできる。
【0091】
他の薬学的方法を用いて、薬剤および裸の抗体またはその断片の作用の期間を制御することができる。徐放性製剤は、裸の抗体と錯形成するまたは吸着するポリマーを用いて調製することができる。例えば、生体適合性ポリマーとしては、ポリ(エチレン-コ-酢酸ビニル)のマトリックス、およびステアリン酸二量体とセバシン酸のポリ無水物コポリマーのマトリックスが挙げられる。Sherwood et al., Bio/Technology 10:1446 (1992)。このようなマトリックスからの抗体またはその断片の放出速度は、免疫接合体または抗体の分子量、マトリックス中の抗体の量、および分散粒子の粒度によって変化する。Saltzman et al., Biophys. J. 55:163 (1989)、Sherwood et al., 上記引用。他の固形投薬形態は、Ansel et al., 「医薬の投薬形態および薬物送達系(PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS)」, 第5版(Lea & Febiger 1990)、およびGennaro (監修),「REMINGTONの薬科学(REMINGTON'S PHARMACEUTICAL SCIENCES)」, 第18版(Mack Publishing Company 1990)、およびそれらの改訂版に記載されている。
【0092】
未接合のクラスIII抗CEA抗体またはその断片を、哺乳類に皮下または他の非経口経路によって投与することもできる。さらに、連続輸液によりまたは単回または複数回ボーラス投与によって投与することができる。一般に、投与した裸の抗体またはその断片のヒトに対する投薬量は、患者の年齢、体重、身長、性別、全般的医学的条件および以前の医学的履歴によって変化する。典型的には、受容者に、単回静脈内輸液として約0.5mg/kg-20mg/kgの範囲の投薬量で裸の抗体またはその断片を投与するのが望ましいが、状況によっては一層低または高投薬量を投与することもできる。この投薬量は、必要に応じて例えば、月1回4-10ヶ月間、好ましくは2週間毎に16週間、さらに好ましくは毎週1回で8週間繰り返すことができる。これは2週間毎に数ヶ月間のように低頻度で投与し、または一層高頻度および/または一層長期間にわたって投与することもできる。この投薬量は、用量および計画を適当に調整することによって様々な非経口経路で投与することができる。
【0093】
治療の目的で、クラスIII抗CEA抗体またはその断片は、未治療コントロールと比較して腫瘍の大きさを減少させるのに治療上有効量で哺乳類に投与される。好ましくはクラスIII抗CEA抗体またはその断片はヒト化MN-14抗体またはその断片である。本発明に適する患者は、通常はヒトであるが、ヒト以外の哺乳類または動物の患者も考慮される。抗体製剤は、投与量が生理学的に有意であるときには、「治療上有効量」で投与されるといわれる。ある薬剤が存在することによって受容者の哺乳類の生理に検出可能な変化を生じるときには、これは生理学的に有意である。詳細には、本発明の抗体製剤は、その存在によって抗腫瘍応答を生じるときには、生理学的に有意である。生理学的に有意な効果は、受容者である哺乳類に体液性および/または細胞性免疫応答を引き起こすことでもある。
【0094】
本発明は、下記の番号を付けた態様も包含する。
1. 少なくとも1種類の抗CEAモノクローナル抗体(MAb)またはその断片と少なくとも1種類の治療薬とを含んでなる、組成物。態様1の組成物であって、上記の抗CEA MAbがクラスI、クラスIIまたはクラスIII抗CEA mAbであり、上記MAbがクラスIまたはクラスIIのMAbでありかつ顆粒球と反応するときに、上記MAbがMAbの一価形態であるもの。
【0095】
2. 上記抗CEA MAbまたはその断片がヒト化してあり、上記ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、態様1に記載の組成物。
【0096】
3. 上記抗CEA MAbまたはその断片がキメラMAbであり、このキメラMAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、態様1に記載の組成物。
【0097】
4. 上記抗CEA MAbまたはその断片が完全ヒトMAbであり、この完全ヒトMAbネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、態様1に記載の組成物。
【0098】
5. 上記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、態様1に記載の組成物。
【0099】
6. 上記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、このMN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなる、態様5に記載の組成物。抗CEA抗体またはその断片は、上記抗CEA抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる。さらに、抗CEAモノクローナル抗体またはその断片は、軽および重鎖可変領域のCDRを含んでなる。
【0100】
7. 上記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、態様1に記載の組成物。
【0101】
8. 上記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、態様7に記載の組成物。
【0102】
9. 上記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、態様7に記載の組成物。
【0103】
10. 上記MN-14モノクローナル抗体またはその断片が完全にヒトMN-14抗体またはその断片である、態様7に記載の組成物。
【0104】
11. 上記ヒト化MN-14抗体またはその断片の軽鎖および重鎖可変領域の枠組構造領域(FR)が、ネズミMN-14モノクローナル抗体の相当するFRから置換された少なくとも1種類のアミノ酸を含んでなる、態様10に記載の組成物。
【0105】
12. 上記ヒト化MN-14抗体またはその断片が、図14A-Cまたは図22B(hMn-14)または図23Bのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される上記ネズミMN-14抗体の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様11に記載の組成物。
【0106】
13. 上記ヒト化MN-14抗体またはその断片が上記ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様11に記載の組成物。
【0107】
14. 上記ヒト化MN-14抗体またはその断片が図13Aまたは図22Aまたは図23Aに示される軽鎖可変領域と、KLHuVhAIGAとして表される図14A-Cまたは図22B (hMN-14)または図23Bに示される重鎖可変領域を含んでなる、態様8に記載の組成物。
【0108】
15. 上記キメラMN-14抗体またはその断片が、ネズミMN-14 VKと呼ばれる図13Aに示される軽鎖可変領域とネズミMN-14 VHと称される図14A-Cに示される重鎖可変領域を含んでなる、態様9に記載の組成物。
【0109】
16. 上記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、態様1-15のいずれか一項に記載の組成物。
【0110】
17. 上記治療薬が裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、免疫接合体、ホルモン、毒素、アンチセンスオリゴヌクレオチド、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、態様1-15のいずれか一項に記載の組成物。
【0111】
18. 上記それらの組合せがビンクリスチン、ドキソルビシン、オキサリプラチン、CPT-11、フルオロウラシル、DTIC、およびシクロホスファミドを含んでなる、態様17に記載の組成物。
【0112】
19. 上記治療薬が裸の抗体または免疫接合体である、態様17に記載の組成物。
【0113】
20. 上記裸の抗体または上記免疫接合体の抗体部分が、EGP-1、EGP-2(例えば、17-1 A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGF、または他の血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、テネイシン、フィブロネクチン、またはそれらの組合せと反応性であるモノクローナル抗体またはその断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片を含んでなる、態様19に記載の組成物。
【0114】
21. 上記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、態様20に記載の組成物。
【0115】
22. 上記治療薬がDTICではない、態様1-15のいずれか一項に記載の組成物。
【0116】
23. 患者に抗CEAモノクローナル抗体またはその断片の治療上有効量、および少なくとも1種類の治療薬であって、所望により薬学上許容可能なビヒクル中に処方したものを同時にまたは逐次的に投与することを含んでなる、甲状腺非髄様癌の治療方法。
【0117】
24. 上記抗CEA MAbまたはその断片がヒト化したものであり、上記ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、態様23に記載の方法。
【0118】
25. 上記抗CEA MAbまたはその断片がキメラMAbであり、上記キメラMAbが実質的にネズミ抗CEA MAbの抗CEA結合特異性を保持する、態様23に記載の方法。
【0119】
26. 上記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、態様23に記載の方法。
【0120】
27. 上記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記抗CEA抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、態様23に記載の方法。
【0121】
28. 上記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、態様27に記載の方法。
【0122】
29. 上記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、態様28に記載の方法。
【0123】
30. 上記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、請求項49に記載の方法。
【0124】
31. 上記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、態様28に記載の方法。
【0125】
32. 上記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)が、ネズミのMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様29に記載の方法。
【0126】
33. 上記ネズミMN-14モノクローナル抗体の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる上記ヒト化MN-14抗体またはその断片が、KLHuVhAIGAと称される図14A-Cまたは22B (hMN-14)または23Bのネズミの重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、態様32に記載の方法。
【0127】
34. 上記ヒト化MN-14抗体またはその断片が上記ネズミMN-14軽鎖可変領域の上記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様32に記載の方法。
【0128】
35. 上記ヒト化MN-14抗体またはその断片が、図13Aまたは22A(hMN-14)または23Aに示される軽鎖可変領域とKLHuVhAIGAと称される図14A-Cまたは22B(hMN-14)または23Bに示される重鎖可変領域を含んでなる、態様32に記載の方法。
【0129】
36. 上記断片がF(ab')2、Fab'、Fab、 FvおよびsFvからなる群から選択される、態様23-25のいずれか一項に記載の方法。
【0130】
37. 上記治療薬がクラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に投与される、態様23-36のいずれか一項に記載の方法。
【0131】
38. 上記治療薬が裸の抗体または別の治療薬に接合した抗体である、態様37に記載の方法。
【0132】
39. 上記治療薬が裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、アンチセンスオリゴヌクレオチド、CEAまたは非-CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、態様23-36のいずれか一項に記載の方法。
【0133】
40. 上記治療薬がEGP-1、EGP-2(例えば、17-1A)、IL-6、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGFまたは他の腫瘍血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、およびそれらの組合せと反応性のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に上記患者に投与される、態様39に記載の方法。
【0134】
41. 上記抗体またはその断片が裸であるかまたは別の治療薬に接合している、態様40に記載の方法。
【0135】
42. 上記治療薬がDTICではない、態様23-36のいずれか一項に記載の方法。
【0136】
43. 上記細胞傷害性物質が薬剤または毒素である、態様39に記載の方法。
【0137】
44. 上記薬剤が、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、態様43に記載の方法。
【0138】
45. 上記薬剤が、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、 代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、態様43に記載の方法。
【0139】
46. 上記毒素がリシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される微生物、植物または動物性毒素である、態様43に記載の方法。
【0140】
47. 上記イムノモジュレーターがサイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチン、およびそれらの組合せからなる群から選択される、態様39に記載の方法。
【0141】
48. 上記リンホトキシンが腫瘍壊死因子(TNF)であり、上記造血因子がインターロイキン(IL)であり、上記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、上記インターフェロンがインターフェロン-α、-βまたは-γであり、上記幹細胞増殖因子が「S1因子」と称されるものである、態様47に記載の方法。
【0142】
49. 上記イムノモジュレーターがIL-1、IL-2、IL-3、IL-6、IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、態様40に記載の方法。
【0143】
50. 上記放射性核種のエネルギーが20-10,000keVである、態様39に記載の方法。
【0144】
51. 上記放射性核種が125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、態様50に記載の方法。
【0145】
52. 上記光活性治療薬が色素原または色素である、態様39に記載の方法。
【0146】
53. 上記アルキル化剤がダカルバジンである、態様44に記載の方法。
【0147】
54. 上記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量で投与する、態様53に記載の方法。
【0148】
55. 上記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量で投与する、態様54に記載の方法。
【0149】
56. 抗CEAモノクローナル抗体またはその断片、および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を同時または逐次的に患者に投与することを含んでなる、甲状腺髄様癌の治療方法。
【0150】
57. 上記抗CEA MAbがまたはその断片がヒト化しており、上記ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、態様56に記載の方法。
【0151】
58. 上記抗CEA MAbまたはその断片がキメラMAbであり、上記キメラMAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、態様56に記載の方法。
【0152】
59. 上記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、態様56に記載の方法。
【0153】
60. 上記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、上記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、上記クラスIIIのMN-14抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、態様59に記載の方法。
【0154】
61. 上記抗-CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、態様60に記載の方法。
【0155】
62. 上記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、態様61に記載の方法。
【0156】
63. 上記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、態様61に記載の方法。
【0157】
64. 上記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、態様61に記載の方法。
【0158】
65. 上記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)がネズミMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様62に記載の方法。
【0159】
66. 上記ネズミMN-14抗体の上記の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる上記ヒト化MN-14抗体またはその断片が、図14A-Cまたは22Bのネズミ重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、態様65に記載の方法。
【0160】
67. 上記ヒト化MN-14抗体またはその断片が上記ネズミMN-14軽鎖可変領域の上記の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、態様65に記載の方法。
【0161】
68. 上記ヒト化MN-14抗体またはその断片が、図13Aまたは22A(hMN-14)または23Aに記載の軽鎖可変領域と図14A-Cまたは22B(hMN-14)または23Bに記載の重鎖可変領域とを含んでなる、態様65に記載の方法。
【0162】
69. 上記断片がF(ab')2、Fab'、Fab、FvおよびsFvからなる群から選択される、態様56-68のいずれか一項に記載の方法。
【0163】
70. 上記治療薬が、クラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、 およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に投与される、態様56-68のいずれか一項に記載の方法。
【0164】
71. 上記抗体またはその断片が裸のまたは別の治療薬に接合したものである、態様70に記載の方法。
【0165】
72. 上記治療薬が、裸の抗体、細胞傷害性物質、薬剤、毒素、放射性核種、イムノモジュレーター、アンチセンスオリゴヌクレオチド、光活性治療薬、CEAまたは非-CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、場合によっては、薬学上許容可能なビヒクルで処方されたものからなる群から選択される、態様56-68のいずれか一項に記載の方法。
【0166】
73. 上記治療薬が、EGP-1、EGP-2(例えば、17-1A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、PlGFまたは他の腫瘍血管新生抗原、Ga733、IL-6、インスリン様増殖因子-1、およびそれらの組合せと反応性のヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量で同時にまたは逐次的に上記患者に投与される、態様72に記載の方法。
【0167】
74. 上記抗体またはその断片が裸のまたは別の治療薬に接合している、態様73に記載の方法。
【0168】
75. 上記治療薬がDTICではない、態様56-68のいずれか一項に記載の方法。
【0169】
76. 上記細胞傷害性物質が薬剤または毒素である、態様72に記載の方法。
【0170】
77. 上記薬剤が、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、態様72に記載の方法。
【0171】
78. 上記薬剤がナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、態様76に記載の方法。
【0172】
79. 上記微生物、植物または動物性毒素が、リシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される、態様76に記載の方法。
【0173】
80. 上記イムノモジュレーターが、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチンおよびそれらの組合せからなる群から選択される、態様72に記載の方法。
【0174】
81. 上記リンホトキシンが、腫瘍壊死因子(TNF)であり、上記造血因子がインターロイキン(IL)であり、上記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、上記インターフェロンがインターフェロン-α、-βまたは-γであり、上記幹細胞増殖因子が「S 1因子」と称されるものである、態様80に記載の方法。
【0175】
82. 上記イムノモジュレーターが、IL-1、IL-2、IL-3、IL-6, IL-10、IL-12、IL-18、IL-21、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、態様72に記載の方法。
【0176】
83. 上記放射性核種のエネルギーが、20-10,000keVである、態様72に記載の方法。
【0177】
84. 上記放射性核種125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、態様72に記載の方法。
【0178】
85. 上記光活性治療薬が色素原または色素である、態様72に記載の方法。
【0179】
86. 上記アルキル化剤がダカルバジンである、態様77に記載の方法。
【0180】
87. 上記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量で投与する、態様86に記載の方法。
【0181】
88. 上記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量で投与する、態様87に記載の方法。
【0182】
89. 抗CEAモノクローナル抗体またはその断片、および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を同時または逐次的に患者に投与することを含んでなる、癌の治療方法。
【0183】
90. 治療薬がCPT-11である、態様89に記載の方法。
【0184】
91. 抗CEA抗体または断片を投与した後、CPT-11を投与する、態様90に記載の方法。
【0185】
92. 抗CEA抗体または断片を投与した約3日後にCPT-11を投与する、態様91に記載の方法。
【0186】
93. 治療薬がDTICである、態様89に記載の方法。
【0187】
94. 治療薬がオクサリプラチンである、態様89に記載の方法。
【0188】
95. 治療薬が5-フルオロウラシル/ロイコボリンである、態様89に記載の方法。
【0189】
96. 非抗体治療薬を用いる癌の治療方法において、癌患者に抗CEA抗体またはその断片を前投与した後、非抗体治療薬を投与することを含んでなる、改良法。
【0190】
97. 抗CEA抗体がhMN-14である、態様96に記載の方法。
【0191】
98. 治療薬がCPT-11である、態様96に記載の方法。
【0192】
99. 抗体を用いる癌の治療方法であって、抗体を投与する前に、顆粒球および/またはNK細胞を活性化する薬剤を癌患者に投与して抗体のエフェクター機能を増加させることを含んでなる、方法。
【0193】
100. 薬剤がGM-CSFである、態様99に記載の方法。
【0194】
101. 抗体が抗CEA抗体である、態様99に記載の方法。
【0195】
102. 抗体がhMN-14である、態様101に記載の方法。
【0196】
103. 抗CEA抗体または断片を用いる癌の治療方法であって、抗CEA抗体またはその断片を投与する前に、腫瘍細胞中のCEA発現をアップレギュレーションするのに有効な量のインターフェロンを癌患者に投与することを含んでなる、方法。
【0197】
104. 抗CEA抗体がhMN-14である、態様103に記載の方法。
【0198】
105. 同一または異なる抗原に対して少なくとも1種類のCEA結合部位および少なくとも1種類の他の結合部位を含んでなる、抗体融合タンパク質。
【0199】
106. CEA結合部位がMN-14抗体と同じ部位に結合する、態様105に記載の抗体融合タンパク質。
【0200】
107. 二価または三価である、態様105に記載の抗体融合タンパク質。
【0201】
108. 融合タンパク質の一方のアームがCD66eをターゲッティングするクラスIIIの抗CEA mAbであり、融合タンパク質もう一つのアームがCD66a-dをターゲッティングする別の抗CEA交差反応性抗体由来である、態様105に記載の抗体融合タンパク質。
【0202】
109. 結合アームがscFvまたはFab領域である、態様105に記載の抗体融合タンパク質。
【0203】
110. CD66a-dと反応する一本のアームとCEAのみと反応する2本のアームを含んでなる二重特異性の三価のタンパク質である、請求項25に記載の抗体融合タンパク質。
【0204】
111. NCA50/90に結合する2本のアームを含んでなる二重特異性タンパク質である、態様105に記載の抗体融合タンパク質。
【0205】
112. NCA50/90に結合する一本のアームとCEAのクラスIIIエピトープに結合する第二のアームを含んでなるジアボディーである、態様105に記載の抗体融合タンパク質。
【0206】
113. NCA-50/90アームがhMN-3抗体から得られ、CEAのクラスIIIエピトープに結合する第二のアームがhMN-14から得られる、態様112に記載の抗体融合タンパク質。
【0207】
114. 融合タンパク質が顆粒球からのサイトカイン放出の活性化を防止するためのFc-ドメインを欠き、または補体固定とADCCを防止する目的で変更されているFc-ドメインを有する、態様113に記載の抗体融合タンパク質。
【0208】
115. 1本のhMN-3アームと2本のhMN14アームを含んでなるトリアボディーである、態様104に記載の抗体融合タンパク質。115a. 1本のhMN-15アームと2本のhMN14アームを含んでなるトリアボディーである、態様104に記載の抗体融合タンパク質。
【0209】
116. 少なくとも1本のhMN-14アームと少なくとも1本のNP-3アームを含んでなる、態様104に記載の抗体融合タンパク質。
【0210】
117. 補体固定とADCCの活性化を可能にするFc-ドメインを含んでなる、態様116に記載の抗体融合タンパク質。
【0211】
118. 治療薬をも含んでなる、態様104に記載の抗体融合タンパク質。
【0212】
119. 治療薬がサイトカインである、態様118に記載の抗体融合タンパク質。
【0213】
120. サイトカインがインターフェロン、コロニー刺激因子、またはインターロイキンである、態様120に記載の抗体融合タンパク質。
【0214】
121. コロニー刺激因子がGM-CSFまたはG-CSFである、態様120に記載の抗体融合タンパク質。
【実施例】
【0215】
本発明を、下記の実施例によってさらに説明するが、これらに限定されるものではない。
【0216】
実施例1:材料および方法
モノクローナル抗体および細胞系
ヒト甲状腺髄様細胞系TTは、the American Type Culture Collectionから購入した。細胞は、10%ウシ胎仔血清、ペニシリン(100U/ml)、ストレプトマイシン(100μg/ml)、およびL-グルタミン(2mM)を補足したDMEM (Life Technologies, Gaithersburg, MD)中で単層として成長させた。細胞は、トリプシン、0.2% EDTAを用いて分離した後は常法によって継代した。
【0217】
MN-14は、CEAと反応し且つ通常の交差反応性抗原、NCA、および胎便抗原とは反応しないクラスIII抗CEA MAbである(Hansen et al., Cancer, 71:3478 (1993))。本発明でネガティブコントロールとして用いられるMN-14および抗-CD22 MAbであるLL2のヒト化形態の構築および特性決定については、以前に報告した。(Sharkey et al., Cancer Res., 55:5935s (1995); Leung et al., Mol. Immunol., 32: 1416 (1995))。P3x63Ag8 (MOPC-21)は、the American Type Culture collection (Rockville, MD)から入手した不適切なマウス骨髄腫IgG1である。抗体は、プロテインAクロマトグラフィーによって精製した。
【0218】
イン・ビボ研究
腫瘍は、組織培養によって増殖させた2x108個の洗浄したTT細胞を皮下投与することによって6-8週齢の雌nu/nuマウス(Taconic Farms, Germantown, NY)で増殖させた。抗体を、外側尾静脈を介して腫瘍担持動物に静脈内投与した。投与した抗体の量および投与の時間についての詳細は、それぞれの研究についての結果の節に示している。結果は、個々の動物の腫瘍容積並びに平均値±SEとして示す。腫瘍の大きさを、カリパスを用いて腫瘍の長さ、幅および深さを毎週測定することによって観察した。腫瘍容積は、3個の測定値の積として計算した。統計学的比較をStudentのT検定を用いて行い、腫瘍容積と増殖曲線の下の面積を比較した。
【0219】
実施例2.TT(ヒト甲状腺髄様)腫瘍細胞の2日後に送達した裸のhMN-14およびDTICの併用療法
前の研究では、裸のhMN-14とダカルバジン(DTIC)を、腫瘍の移植の2日後に100μgおよび25μg用量のDTIC (2、3および4日)、および2日目、次いで毎週投与した250μg用量のhMN-14を用いてTTに組み合わせて投与した。hMN-14と組み合わせた100μgのDTIC用量は、単独での治療より効果的であった(図1A)。しかしながら、100μgDTIC用量は応答が強すぎ、一方25μg用量は有効でなかった。意外なことには、MN-14単独およびDTIC単独での効果は相加的ではなかった。換言すれば、250μg hMN-14単独および100μgDTIC単独を用いる治療の結果を考慮すれば、250μg hMN-14および100μgDTICの併用がこのような顕著な効果を有するとは予測する者はなかったであろう。図1Aを参照されたい。
【0220】
この研究では、以前の研究と同様に、TT細胞投与の2日後に治療を開始した。hMN-14は、100μgの用量で2、3、4、5、7、8、9、10、11、15および22日後、次いで動物が死亡するまで、腫瘍容積が2.0cm3になるまで、または人道的理由から研究を終了するまで投与した。DTICの用量は用量当たり50および75μgであり、これは以前の研究で投与した用量の間にある。TT細胞を60ヌードマウスに皮下投与した。投与日は月曜日であった。0日。図1Bを参照されたい。
【0221】
結果は、MAb療法単独、または化学療法単独のいずれによっても、腫瘍増殖が有意に遅れることを示している(図1B)。hMN-14抗体のこの計画と組み合わせた75μg用量のDTICは、いずれの単独での治療より有意に効果的であった(p<0.02)。意外にも、DTICとMAbの併用療法は相加的ではなかった。7週目では、75μgのDTICおよびMAb群の8/10で触診可能な腫瘍はなかったが、75μgのDTIC単独群では1/10、および未治療およびMAb群では0/10であった。
【0222】
7週間目の平均腫瘍容積は、0.018±0.039cm3 (75μgDTIC+MN-14)、0.284+0.197cm3 (75μgDTIC単独)、0.899±0.545cm3 (hMN-14単独)、および1.578±0.959cm3 (未処理)であった。裸の抗CEA抗体とDTICとの組合せ療法は抗体または化学療法のみの抗腫瘍効果を増加させるが、毒性は増加しない。組合せモダリティー治療が優れていることは、意外なものであった。
【0223】
投薬の要約: (1) hMN-14を、100μg/用量/マウスで日曜日を除き2-11日に毎日投与した(腹腔内)。抗体投与は、DTIC投与と同じ日に開始した。(2)DTICは2、3および4日目にMTDの5%および7.5%に相当する50および75μg/用量で投与した。1コースのみのDTICを投与した。
【0224】
群: 6群のマウスであり、各群は10匹のマウスからなる。
群1: 未処理。
群2. 50μg/用量のDTIC、2、3および4日目 (水曜日、木曜日および金曜日)。
群3. 75μg/用量のDTIC、2、3および4日目。
群4. 50μg/用量のDTIC、2、3および4日目と、hMN-14 (100μg/用量)を2、3、4、5、7、8、9、10、11、15および22日目、次いで動物が死亡するか、腫瘍容積が2.0cm3になるか、または研究を終了するまで7日毎に投与。
群5. 25μg/用量のDTIC、2、3および4日目と、hMN-14 (100μg/用量)を2、3、4、5、7、8、9、10、11、15および22日目、次いで動物が死亡するか、腫瘍容積が2.0cm3になるか、または研究を終了するまで7日毎に投与。
群6. hMN-14(100μg/用量を確認)、2、3、4、5、7、8、9、10、11、15および22日目、次いで動物が死亡するか、腫瘍容積が2.0cm3になるか、または研究を終了するまで7日毎に投与。
動物を生存について観察した。腫瘍および体重を毎週測定した。
【0225】
プロトコール: 2日目に、200mg/バイアルのDTICを、19.7mlの注射用滅菌水で再構成した。生成する溶液は、10 mg/mlのダカルバジンを含み、pHは3.0- 4.0であった。溶液を必要に応じて下記の希釈液のために用い、残りは後で使用するため1ml分量で凍結した。
群2および4: 0.5mg/ml溶液5mlを調製した。0.5mg/ml/マウスの100μlを、静脈内投与した。
群3および5: 0.75 mg/ml溶液5mlを調製した。0.75mg/ml/マウスの100μlを、静脈内投与した。
hMN-14の量を推定した。1mg/ml hMN-14 100μlを群4、5および6で腹腔内投与した。
【0226】
実施例3.ヒトMTC異種移植片モデルでの放射線免疫療法研究
出願人は、TTと呼ばれるヒトMTC細胞系を産生するCEA-およびカルシトニンのヒトMTC異種移植片を用いてMTCと放射能標識した抗CEA MAbの実験的放射線免疫療法のモデルを開発した([Stein, 1999 #82], 付表参照)。MTC腫瘍は、ヌードマウスで2x108個の細胞を皮下接種することによって定着させ、2-5週間成長させた後、MAbを投与した。次に、MN-14を用いて生体分布およびRAIT研究を行い、フローサイトメトリーによってTT細胞と反応することを示した。Ag8およびMu-9を両方とも、これらの研究におけるネガティブコントロールMAbとして用いた。約0.08gの小さめの腫瘍を用いる予備研究では、131I-MN-14の投与の7日後には、腫瘍1g当たりの投与量の百分率(%ID/g)は、同時に投与した125I-Ag8コントロールについて12.6%ID/gに過ぎないのに比較して、68.9%であった。大きめの腫瘍(ヌードマウスで5週間増殖; 平均腫瘍重量=0.404g)を用いたときには、125I-MN-14の投与から7日後に観察した腫瘍の% ID/gは12.4%であった。しかしながら、同時投与した88Y-MN-14の% ID/gは50. 5%であるか、または125I-MN-14より4.1倍高かった。腫瘍対血液、肺、肝臓、脾臓、および腎臓も125I-MN-14より88Y-MN-14での方が高かったが、腫瘍対骨比は両薬剤で同等であった。125I-MN-14と88Y-MN-14の生体分布データーを用いてそれぞれ131I-MN-14と90Y-MN-14の腫瘍線量測定を予測したときには、90Y-MN-14(115μCi)のMTDで送達された放射線吸収線量は、131I-MN-14のMTDで送達されたものより1.75倍高かった(275μCi) (4900 cGy対2800 cGy)。
【0227】
このモデルでの療法研究により、90Y-MN-14は131I-MN-14より良好な治療薬であることが確認された。5週齢腫瘍では、131I-MN-14では腫瘍成長が遅延しただけであったのと比較して、90Y-MN-14のMTDでは5週間の腫瘍成長の完全な阻害が見られた(図2)。さらに、小さめの2週齢腫瘍を治療したときには、幾つかの完全な腫瘍の退縮を伴う平均して60%の腫瘍容積の減少が90Y-MN-14のMTDで見られた。これらの抗腫瘍効果は、未治療動物またはコントロールMAbのMTDで治療したものでの腫瘍成長が割合速やかであるのと比較して、極めて有意であった。従って、本発明者らの前臨床研究は、この動物モデルが抗CEA MAbを用いる実験的RAITに極めて適することを示した。
【0228】
90Yの方がターゲット細胞によってより長時間保持されるという事実に加えて、131Iと比較して90Yの方がパス長さが長くかつエネルギーが高いことにより、増加した放射線線量を腫瘍に送達し、従って、等毒性線量で一層効果的な治療が得られた。残留(residualizing)131I (refs)を用いる本発明者らの結果をMTCにおけるMN-14に一般化することができれば、残留(residualizing)131Iは本発明で検討した大きさの腫瘍での90Yと少なくとも等しく有効となり、恐らくは微小転移疾患のセッティング(setting)または手術後の補助療法として優れていると予想する。
【0229】
実施例4:化学療法
ドキソルビシン、DTIC(ダカルバジン)、シクロホスファミド、およびビンクリスチンの4種類の薬剤をヌードマウスでのTT MTC異種移植片の成長に対するそれらの効果について、単独および組合せで評価した。用量は、mg/m2基剤でヒトに臨床投与されるそれぞれの薬剤の用量に基づいて選択した。動物を生存について観察し、腫瘍容積および体重を毎週測定した。図3は、この研究における動物についての腫瘍成長曲線を示す。個別に投与したところ、ドキソルビシン、DTIC、およびシクロホスホルアミドは有意な成長阻害を示すが、ビンクリスチンでは示さず、DTICによって引き起こされた成長遅延は他の薬剤のものより著しく長期間であった。それぞれの群についての倍化の近似的平均時間は、未処理では1週間、ドキソルビシンでは2.5週間、DTICでは7.5週間、シクロホスファミドでは3週間、ビンクリスチンでは1.5週間であった。ドキソルビシンとDTICを併用することにより、いずれかの薬剤単独と比較して効力が向上し、倍化の平均時間が10週間に増加した。しかしながら、ドキソルビシンとDTICの併用による効力の増加は、DTIC単独と比較して95% 信頼水準には達しなかった。AUC比較についてのP値は、下記の通りであり、ドキソルビシン+DTIC対ドキソルビシンについてはP<0.01であり、ドキソルビシン+DTIC対DTICについてはP<0.1であった。4薬剤法は倍化の平均時間を12週間まで伸長し、ドキソルビシンとDTICのいずれに対する比較でもP<0.01であった。
【0230】
個々の薬剤対未処理群についての生存データーの対数ランク分析は、DTICおよびシクロホスホルアミドについてのみ有意差を示した。未処理群についての平均生存時間は、DTICおよびシクロホスホルアミド処理群についてそれぞれ11週および8週間であったのに比較して4週間であり、薬剤併用についての12週間より大きかった。体重損失によって測定した毒性は、総ての検討群について許容範囲内であった。最大重量損失は、総ての4薬剤を投与したマウスにおいて投与後1週間で観察され、体重損失は3-12%であった。
【0231】
実施例5.MTCの治療のための放射線免疫療法と化学療法の併用
RAITと4薬剤併用
90Y-抗CEA MAb MN-14を用いるRAITと4剤併用を組み合わせる効果は、未処理マウスでのTTの成長を上記4剤法(ドキソルビシン、DTIC、シクロホスファミドおよびビンクリスチン)、RAITの最大許容線量(MTD)の100%(105μCi)、RAITのMTDの50%、およびRAITのMTDの50%と4薬剤の併用で処理したものと比較することによって評価した。図4は、様々な処理法で養生したマウスのTT腫瘍の成長曲線を示す。4処理群は総て、未処理動物と比較して効力が有意に向上した。未処理動物での倍化の近似的平均時間は1.5週間であったのに対して、4薬剤を用いる化学療法では平均倍化時間が10週間に伸び、RAIT単独ではそれぞれMTDの50%および100%で倍化時間が4週間および8週間となった。予想されたように、100% RAIT群および4薬剤療法による養生法はいずれも50% RAIT群より有意に良好であった。最も重要なことは、50% RAITと4薬剤による養生法の併用によって、いずれかの療法単独と比較して結果が改良され、平均倍化時間が約12.5週間に伸びた。併用治療と4薬剤による養生法の比較については、P<0.02であり、100% RAITとの比較については、P<0.01であった。
【0232】
治療から1週間後の平均重量損失(最下点)は100% RAITおよび4薬剤による養生法については9%であったが、50% RAITと4薬剤治療の併用については15%であった。その上、併用療法群では、1匹の動物が治療から3週間後に死亡し、第二の動物の重量損失は20%を上回った。従って、この治療は最大許容線量を超過していた。
【0233】
RAITと2薬剤法を用いる化学療法の併用
90Y-抗CEA MAb MN-14を用いるRAITとドキソルビシンおよびDTICからなる2剤併用の組合せ効果を、このMTC異種移植片モデルでも評価した。群についての近似的平均倍化時間は、未処理では1.5週間、ドキソルビシンとDTICの併用では8週間、RAITのMTDでは10週間、および2薬剤法の25-75%と組み合わせたRAITのMTDでは12週間を上回った。従って、RAIT単独は2薬剤法より効果的であり、最も重要なことは、RAITと2薬剤法の併用によりいずれかの療法単独と比較して改良された結果が得られたことである。併用治療と2薬剤法の比較については、P<0.005であり、RAIT単独との比較については、P<0.02であった。
【0234】
治療の1-2週間後の平均重量損失(最下点)は、100% RAITと75% 2薬剤化学療法群で2週間後に13%の損失が観察されたのを除けば、総ての群について2-8%であった。その上、この組合せ療法群では、2匹の動物が治療後3-4週間で死亡し、1匹の重量損失が20%を上回った。従って、75%用量レベルのドキソルビシンとDTICを100% RAIT治療に加えたところMTDを超過したのに対して、この2剤併用の50%は100% RAITとの併用で許容することができる。
【0235】
RAITとドキソルビシンの併用
以前の公表文献では、このモデルでのRAITとドキソルビシンの併用が報告されていたので(Stein et al., Clin Cancer Res., 5:3199s (1999)、Behr et al., Cancer Res. 57:5309 (1997))、RAITとドキソルビシンの併用法について直接比較を行った。直接比較は、RAITと4薬剤法の併用に対しても行った。いずれの治療法も、未治療動物と比較して有意な効力を生じた。RAITとドキソルビシンの併用群についての平均倍化時間は12週間であった。この研究では、RAITの完全なMTDを50%のドキソルビシンおよびDTICまたは4薬剤法と併用することにより、平均倍化時間は15週間を上回るまで伸び、これらの2群の間には統計学的有意差はなかった。これらの研究では、かなりの数の具体的応答が見られた。RAITとドキソルビシンの併用での治療後には、総数が10匹のマウスの中3匹では完全な応答、2匹では部分応答があり、5匹の動物は少なくとも4週間安定な疾患を有した。RAITと2薬剤の併用法では、具体的応答を増加し、12匹の動物の中10匹が完全応答および2匹が部分応答を示し、RAITと4薬剤併用治療法では、9匹のマウスの中7匹が完全応答を、2匹が部分応答を示した。
【0236】
RAITとDTICとの併用
DTICは、単独で投与するときには最も効果的な化学療法薬であるので、RAITとDTICの併用の効力をRAITとドキソルビシンおよびDTICの併用と比較して評価した。治療法からドキソルビシンを省くことは、この薬剤によって毒性、特に既知の心臓毒性が加えられるのを防止するのに臨床応用上重要となる。図5に示されるように、ドキソルビシンとDTICまたはDTIC単独の化学療法をRAITと組み合わせて受けた2検討群は互いにほぼ同等であり、いずれも単一様相治療より有効である。AUC比較のためのP値は下記の通りであり、RAIT+DTIC対DTICについてP<0.01、RAIT+DTIC対RAITについてP<0.05であった。RAITとDTICの併用、およびRAITとドキソルビシンおよびDTICの併用群の平均倍化時間は、DTICおよびRAIT単独では、それぞれ7.5週間および9週間であったのと比較して、それぞれ15.5週間および14週間であった。従って、RAITとDTICの併用様相治療では、平均倍化時間がDTIC化学療法と比較して100%だけ伸びた。RAITとDTICの併用、およびRAITとドキソルビシンおよびDTICの併用群の間のAUCまたは対数ランク分析のいずれによっても、有意差は見られなかった。
【0237】
実施例6:裸の抗CEA単独を用いる検討
裸のhMN-14を用いる療法
ヌードマウスでのTT腫瘍の成長に対する未標識hMN-14の効果を検討するため、腫瘍細胞投与から1日後または7日後にhMN-14を単回投与で静脈内投与した。図6は、未処理コントロールと比較した0.5mg hMN-14/マウスを投与した動物の腫瘍成長曲線を示す。未治療群は16匹の動物を含み、2つの治療群はそれぞれ10匹の動物を含んだ。未治療群と腫瘍投与から1日後に治療した群では、有意な成長遅延が観察された。平均腫瘍サイズの有意差(p<0.05)は、32日-93日に見られた。32日と60日の間では、未治療動物と比較してMN-14を投与した群で腫瘍のサイズが64-70%抑制された。11日目の群と未治療動物での平均腫瘍サイズには、有意差はなかった。成長曲線の下の面積のt検定分析により、腫瘍成長の有意な遅延も見られた。腫瘍投与から1日後に治療した群と比較して未治療群についてはP<0.05であったが、腫瘍投与から7日後に治療した群についてはP<0.05とはならなかった。
【0238】
治療の特異性
図7は、抗腫瘍応答の特異性についての検討結果をまとめている。未標識hMN-14のヌードマウスにおけるTT腫瘍の成長に対する効果を、ネガティブコントロールヒト化MAb、hLL2 (抗-CD22)、およびネズミMN-14の効果と比較した。MAb (0.5mg/マウス)をTT細胞の1日後に(静脈内)投与した後、更に1週間毎に3週間0.5mg/マウスの用量を投与した。15匹の動物群を検討した。0.5mg hMN-14の投与からの最初の検討で観察された成長阻害は、この検討で確認された。hMN-14および未治療群の間の平均腫瘍サイズの有意差(p<0.05)は、23日目に初めて観察された。37日目には、hMN-14で治療した群の平均腫瘍容積は、未治療コントロール動物の42.7%であった。ネズミMN-14での治療では、hMN-14と同様な結果が得られた。hLL2を用いる治療では腫瘍成長を遅らせず、代わりに小さな(有意でない)成長速度の増加が見られた。例えば、37日目には、hMN-14で治療した腫瘍の87%は、未治療の40%およびhLL2治療群の29%と比較して、0.5cm3未満であった。 成長曲線の下の面積のt検定分析は、未治療群とhMN-14またはネズミMN-14で治療した群との間に有意差(p<0.05)を示したが、hLL2を投与した群ではなかった。その上、hMN-14群はhLL2群と有意差があったが、ネズミMN-14を投与した動物とは有意差はなかった。
【0239】
用量の効果
未標識のhMN-14の用量のヌードマウスでのTT腫瘍の成長に対する効果を検討するため、増加用量のhMN-14を評価した。抗体用量をTT細胞の1日後に投与した後、検討を終了するまで毎週投与した。毎週用量は、6匹のマウスの群で0.125mg-2.0mg hMN-14/マウスであった。未治療群と総ての治療群の間で、平均腫瘍サイズと成長曲線の下の面積の有意差が観察された(図8)。例えば、21日目と49日目では、2つの最低hMN-14処理群における平均腫瘍容積は、未治療動物での腫瘍サイズの27-40%であった。0.125mgおよび0.25mgの低用量で治療すると、高用量で治療したときより効果的であると思われたが、その差は統計学的に有意とはならなかった。
【0240】
時期
ヌードマウスでのTT腫瘍の成長に対するTT投与およびhMN-14の初期用量の時期の効果を、MAbの投与の日を変更することによって評価した。hMN-14 (0.25 mg)をTT細胞の投与から1、3または7日後に投与した後、検討を終了するまで毎週投与した。7-8匹の動物群を検討した。結果を、図9にまとめている。未治療群と総ての3つの治療群では、平均腫瘍サイズ(p<0.05)に有意差が見られた。しかしながら、未治療マウスと7日後治療群との平均腫瘍サイズの差は、28日後の1時点だけでしか有意でなかった。1日後に治療したマウスは21-77日後とは有意差を生じ、3日後に治療したマウス21-70日毎は有意差を生じた。成長曲線の下の面積のt検定分析は、未治療群と比較してTT細胞の投与から1または3日後にhMN-14で治療した群について有意な成長阻害を示した。この分析は、未治療群と7日後に治療した群との間の差について95%信頼限界に達しなかった(p=0.057、5週間)。
【0241】
実施例7:MTCの裸の抗CEAとDTICの併用療法
裸のhMN-14がDTICの効果を増すことができるかどうかを検討するため、TT担持ヌードマウスに未標識MAbの投与の経路と組み合わせてDTIC(75μg/用量)を投与した。DTICは、TT細胞を皮下投与してから2日後に初めて1経路として75μg/用量で3日連続して投与した。hMN-14 MAb治療は、DTICの最初の投与と同じ日に100μg/用量/日で開始し、最初の2週間は5日間、次いで毎週2回行った。腫瘍成長の有意な遅延は、これらのMAb療法または化学療法単独のいずれかの計画によって生じた(図10)。hMN-14のこの計画と組み合わせたDTICの75μg用量、いずれか単独での治療より有意に効果的であった(P<0.02)。7週間後では、75μgDTIC単独群での1/10、および未治療およびMAb単独群での0/10と比較して、75μgDTIC+MAb群の8/10のマウスでは触診可能な腫瘍がなかった。7週間後の平均腫瘍容積は、0.018+0.039cm3 (75μgDTIC+hMN-14)、0.284+0.197cm3 (75μgDTIC)、0.899+0.545cm3 (hMN-14)、および1.578+0.959cm3 (未処理)であった。
【0242】
抗CEA MAb MN-14は、細胞傷害性物質に接合することなくMTCで予想外の抗腫瘍効力を示した。hMN-14投与および未治療群の間では平均腫瘍サイズの差が、3週間後に観察され始め、少なくとも2ヶ月間継続した。イソタイプにマッチしたネガティブコントロールMAbを用いる治療では、腫瘍成長を遅らせなかった。これは、「裸の」抗CEA MAbを用いる腫瘍抑制の最初の証拠である。しかしながら、裸の抗CEA MAbとDTICの併用療法は、毒性を増加することなく抗体または化学療法単独の抗腫瘍効果を増加させる。併用様相治療が優れていることは、MTC処理の化学療法へのCEA-MAb療法の組込みを立証している。
【0243】
図15は、甲状腺髄様癌モデルでの裸のhMN-14 CEA MabとDTICの治療の効果を示す。治療は、腫瘍移植の2日後に開始した。DTICを75μgでMTDの7.5%で2、3および4日目にマウスに投与した。hMN-14を、100μg/日で2-5、7-10、11、15、22日目、次いで週1回ずつ投与した。結果は、総ての群についての曲線の下の面積に統計学的有意差(P<0.05)を示している。裸のhMN-14 CEA Mab治療は、腫瘍成長阻害に対して有意な効果を示した。DTICと併用したときには、いずれか単独での治療と比較して腫瘍成長の阻害が意外なほど高くなった。
【0244】
実施例9:結腸癌細胞における裸の抗CEA抗体治療とCPT-11または 5-FUの併用
この実験では、ヒト化、裸の抗CEA、hMN-14抗体(hMN-14)単独と、化学療法との併用の結腸癌成長に対するイン・ビトロおよびイン・ビボ効果を開示する。
【0245】
方法および材料
抗体産生 The CDR移植した(ヒト化)MN-14 (hMN-14) 抗-癌胎児性抗原(CEA) (Sharkey, R.M., et al., Cancer Res, 55:5935-5945, 1995)、並びにネズミMN-14および異なるCEAエピトープをターゲッティングする他の抗体(NP1、NP3、MN3、MN15 (Sharkey, R. M., et al., Cancer Res, 50:2823-2831, 1990)は、プロテインAおよびイオン交換クロマトグラフィー(Q-Sepharose; Pharmacia, Piscataway, NJ)によって精製した。純度は、免疫電気泳動、還元および非還元条件を用いるポリアクリルアミドゲル電気泳動、およびサイズ排除高圧液体クロマトグラフィーによって試験した。
【0246】
イン・ビボ療法研究
CEA陽性GW-39肺内微小転移モデルを用いて生存療法研究を行った(Sharkey, R.M., et al., J Natl Cancer Inst., 83:627-632, 1991 ; Blumenthal, R. D., et al., Cancer Res, 52:6036-6044, 1992)。保存しておいた皮下GW-39ヒト結直腸腫瘍を用いて、10%または5%細胞懸濁液を調製した。細胞(30μl)を尾静脈に静脈内投与した。HuMN-14 IgGを、細胞移植の0日または3日後に開始し、毎日14日間、その後は週2回ずつ研究期間中100μg/日で投与した。CPT-11を、細胞移植の0日または3日後に開始して160μg/日の用量で5日間腹腔内に投与した(MTDの20%)。幾つかの研究については、保存GW-39腫瘍は、100,000UのIFN-γを一日2回ずつ4日間投与してCEA発現をアップレギュレーションしたマウスから得て(Greiner, J.W., et al., 16:2129-2133, 1996)、これは上記のように免疫組織学によって確認した(Blumenthal, R.D., et al., Int. J Cancer, 51:935-941, 1992)。体重を毎週観察し、動物の生存を記録した。結果をKaplan-Meir試験を用いて解析し、中央生存時間を決定した。
【0247】
癌細胞の抗体誘導化学感作のイン・ビボ効果
hMN14誘導化学感作の効果は、イン・ビボ並びにイン・ビトロで明らかであった。GW-39肺内微小転移を有するマウスの生存曲線は上記と同様であり、未処理またはhMN14単独(100μg/日 x 14日、および検討期間中週2回)、10% MTDのCPT-11 (80μg/日 x 5日)単独または両モダリティーを一緒に投与した。治療は、細胞移植の日に開始した(30μlの10% GW-39細胞懸濁液)。それぞれの治療群は10匹のマウスで始め、検討を2回繰り返した。結果は、hMN-14とCPT-11をGW-39肺微小転移を有するヌードマウスに同時投与したところ、生存はいずれの単独モダリティーの効果をも上回って増加した。CPT-11を10% MTDで投与したところ、56日から63日まで中央生存時間が1週間増加した(p<0.05)。0日目にhMN-14とCPT-11を両方とも投与した動物の中央生存時間は、さらに2週間77日まで増加した(p<0.005、未処理マウスと比較)。最大抗体付着が投与後3日目に起こるので、hMN-14治療をCPT-11の3日前に開始して、このような投与が組合せモダリティー治療法の治療効果がイン・ビボでの高抗体摂取および化学感作を行うことによってさらに高まるかどうかを決定した。結果は、hMN-14で3日間前処理を行った後CPT-11を投与したものでは、3日目にCPT-11単独投与では中央生存時間が70日であったのと比較して、中央生存時間が105日まで増加した(p < 0.001)。この研究では、hMN-14とCPT-11の同時投与が、中央生存時間が70日であったのに対して0日目にCPT-11単独の場合が中央生存時間が63日でありまたは未処理マウスでは中央生存時間が35日であったことから明らかなように、優れていた。結果は、10% GW-39細胞懸濁液の代わりに5%GW-39細胞懸濁液を用いた実験についても同様であった。
【0248】
実施例10:腫瘍細胞化学感作に対するhMN-14およびCPT-11を投与する前のイムノモジュレーターの予備投与のイン・ビボ効果
更なる実験では、GW-39保存腫瘍(10% GW-39細胞懸濁液)のインターフェロン-γ(IFNγ)による予備治療の結果として、CEAを高レベルで発現するGW-39腫瘍を有するマウスで一緒に開始したhMN-14とCPT-11の組合せ治療を評価した。裸の CEA抗体(hMN-14)の抗癌効果を高めるインターフェロン-γを含む実験は、下記のようにして行った。
【0249】
最初に、GW-39ヒト結腸癌を、IFN-γ100,000単位を1日2回ずつ4日間投与されたマウスで皮下で成長させた。GW-39腫瘍を有するコントロールマウスには、IFNを投与しなかった。実験マウスに、2匹のマウス(IFN投与ありまたはなし)のいずれかからのGW-39(w/v)の5%懸濁液を8匹の2群に静脈内投与した。それぞれの群の4匹にはIFNを投与したマウスからの腫瘍を投与し、4匹に未治療マウスからのものを投与した。次に、8匹の1群にhMN-14 (100μg/日x14日、次いで、実験が終了するまで週2回)を投与し、別の群にはCPT-11を160μg/日x5日(=最大許容用量の20%)で、第三の群には同用量の抗体+薬剤の組合せを投与し、第四の群は全く治療を行わなかった。動物の体重を測定し、生存数を毎週測定した。また、後で移植したマウスにおけるIFNを投与した保存腫瘍の試料も免疫組織学の目的で加工し、IFNを投与したマウス由来の腫瘍におけるCEA発現の増加を評価し、これを、CEA染色を示さないAg8のような関連のないIgGを用いる免疫組織学によって懸濁液を処理することによっても制御した。
【0250】
実施例11
動物モデルにおける低および高(上記のように、インターフェロン-γによって誘導される)CEA発現腫瘍細胞に対する裸のhMN-14 CEA Mabの効果を比較した。結果は、腫瘍細胞でのCEA抗原の発現増加は抗CEA抗体の効力向上と相関することを示している。比較研究の結果を、図21に示す。従って、インターフェロン-γの予備治療は、癌の治療における抗CEA抗体療法の効力を高めるのに有用である。
【0251】
実施例12:CEA抗体およびGM-CSFを用いるS状結腸癌療法
JRは、S状結腸癌の発見および除去の時点で見出された肝臓への転移を減少させる目的で5-フルオロウラシルとロイコボリンによる化学療法を受けている62歳の男性である。発表時の癌胎児性抗原(CEA)の血漿価は34ng/mlであり、肝臓のコンピューター断層撮影法は、右葉に直径2-4cmの数個の小さな病巣を示しているが、他の放射線医学的所見は正常である。ヒト化抗CEAIgG1、hMN-14モノクローナル抗体による免疫療法を、週単位で4週間、300 mg/m2の静脈内用量で2時間かけて輸液した。hMN-14療法の1週間前、患者に200 μg/m2のGM-CSF(sargamostim, Leukine(登録商標))を3日間間隔を置いて2回皮下投与し、週2回ずつhMN-14療法の4週間継続した。これらの4週間後、hMN-14とGM-CSFを両方とも同用量で2週間毎にさらに3ヶ月間投与するがGM-CSFの用量は250μg/m2まで増加させる。ヒト化CEA抗体のそれぞれの投与前に、患者にジフェンヒドラミン(Benadryl(登録商標)) 50mg経口およびアセトアミノフェン(Tylenol(登録商標)) 500mg経口を投与した。この時点で、患者を再登場させ、肝臓転移についてCT測定を行い、身体の残りの部分を様々な放射線走査を行う。血液を採取して化学分析と血中CEA価の測定も行う。肝臓以外に疾患の部分は見られないが、肝臓における測定可能な腫瘍の直径の和は40%減少していると思われ、患者の血中CEA価は18ng/mlまで減少し、治療応答を示している。hMN-14については200 mg/m2およびGM-CSFについては250μg/m2で2週間毎に投与したhMN-14およびGM-CSFによる免疫療法では、更に2ヶ月間投与し、再検査では、肝臓腫瘍の直径の和が更に減少しCEA価は10ng/mlまで低下している。腫瘍減少は予備治療ベースラインに対して>65%と測定されるので、この療法は部分的応答を行うものと考えられる。この後、投与頻度を減少させ、次の6ヶ月間は月1回ずつとしたが、総ての検討は疾患に変化がないことを示している。次に、患者を更に10ヶ月間追跡し、部分的緩解のままであり、この療法に対する副作用は見られず、一般的には疾患の症状は何もない。
【0252】
実施例13:転移結腸癌の免疫療法と化学療法の併用
STは、原発性腫瘍の切除後に結腸癌が肝臓と肺へ転移した52歳の女性である。患者に、ヒト化抗CEAモノクローナル抗体IgG1を添加すること以外はGramont計画(A. de Gramont et al, J Clin Oncol. 2000; 18:2938-1947)に基づく化学療法および免疫療法の併用法を行う。抗体を点滴する前に、患者にジフェンヒドラミン(Benadryl(登録商標)) 50mg経口およびアセトアミノフェン(Tylenol(登録商標)) 500mg経口を投与する。ロイコボリン(200mg/m2/日)を2時間輸液した後、5-フルオロウラシル(400mg/m2/日)のボーラス投与と5-フルオロウラシル(600mg/m2/日)の22時間連続輸液を2連続日2週間毎に行い、一緒にオクサリプラチン85mg/m2を5%デキストロース250mlでの2時間輸液としてロイココリンと同時に1日目に投与する(FOLFOX4計画)。患者には、5-ヒドロキシルトリプタミン-3-受容体拮抗薬と共に嘔吐防止薬も投与する。この2週間の化学療法サイクルの1週間前に、hMN-14モノクローナル抗CEA抗体を200 mg/m2の用量で2時間かけて点滴し、2週間の化学療法サイクルのそれぞれの週に反復し、その後、次の月については毎週別の化学療法サイクルを毎週行う。また、G-CSF (フィルグラスチム(filgrastim), Neupogen(登録商標)) 5 μg/kg/日を、第二の化学療法サイクルと共に開始して毎週1回皮下投与し、この用量でhMN-14抗体による免疫療法の期間、次の3ヶ月間継続した。総数が5サイクルの化学療法は、hMN-14抗体およびフィルグラスチムの連続投与である。その後、hMN-14とフィルグラスチムの投与を同用量で2週間毎に次の3ヶ月間行い、化学療法は行わない。患者を2ヶ月後に検査したところ、肝臓と肺の転移はコンピューター断層撮影法によれば、治療前に行った測定と比較して、肝臓と肺で測定した疾患の>80%が縮小していることを示している。血中CEA価も、治療前のレベルの63ng/mlから9ng/mlへ低下している。さらに6ヶ月間追跡を行ったが、疾患は安定していると思われ、新たな病巣は見られずまた肝臓と肺に残っている疾患の増加も見られない。患者の主な毒性は末梢感覚神経
障害であり、咽頭知覚不全(laryngeopharyngeal dysesthesia)である。患者は、化学療法サイクル中に下痢、粘液症(mucositis)、悪心および嘔吐を示したが、これらは極端なものではない。患者は免疫療法のみを行うときには副作用を全く示さず、有意なレトリクション(retriction)はなかった。
【0253】
実施例14
図16は、進行結腸癌モデルでの裸のhMN-14 CEA MabおよびCPT-11治療の効果を示す。hMN-14を、マウスに腫瘍移植の0日後から開始して、100μg/日の用量で14日間、次に2回/週ずつ投与した。CPT-11を60μg/日で5日間投与した。これらの条件下では、hMN-14自体の効果は明らかではなく、CPT-11の僅かな効果のみが見られた(p<0.05)。しかしながら、CPT-11の中央生存時間が63日間であり、併用療法中央生存時間が77日間であるのを比較することによって明らかなように、hMN-14はCPT-11の効果を増加させる(p<0.005)。hMN-14 CEA MabとCPT-11の併用療法は、進行ヒト結腸腫瘍転移を有する動物の生存を有意に引き延ばす。
【0254】
実施例15
図17は、低腫瘍負荷癌モデル(low tumor burden cancer model)における裸のhMN-14 CEA MabとCPT-11治療の効果を示す。5%腫瘍細胞懸濁液を用いる減少した腫瘍負荷モデルで、CPT-11、hMN-14単独、およびhMN-14とCPT-11の併用療法を比較した。投薬量は、実施例14に示した通りである。これらの条件下では、hMN-14単独の明らかな効果はなかった。CPT 11単独では、中央生存時間は70日となった。対照的に、併用療法では、中央生存時間が91日となった(p<0.025)。hMN-14とCPT-11の併用では、ヒト結腸癌の転移モデルでの低腫瘍負荷を有する動物の生存は有意に伸長する。
【0255】
実施例16
図18は、癌モデルでのCPT-11治療の3日前に行った裸のhMN-14 CEA Mabによる予備治療の効果を示す。5%腫瘍細胞懸濁液を用いる減少した腫瘍負荷モデルで、CPT-11、hMN-14単独、およびhMN-14とCPT-11との併用療法であって、hMN-14をCPT-11の3日前に投与したものを比較した。投薬量は、実施例14に示した通りである。hMN-14単独は、これらの条件下で中央生存時間を21%増加した(p<0.05)。CPT 11単独は、生存を76%増加した(p<0.001)。対照的に、併用療法であって、hMN-14をCPT-11の3日前に投与するものは、中央生存時間をCPT-11単独より更に58%増加した(p<0.001、CPT-11単独と比較)。hMN-14による予備治療は、ヒト結腸癌の転移モデルでの低腫瘍負荷を有する動物の生存を有意に引き延ばす。
【0256】
実施例17
図19は、ヒト結腸癌モデルでの裸のhMN-14 CEA MabとCPT-11の様々な投与計画の比較を示す。hMN-14をCPT-11の3日前に投与するのが、最も効果的である。投薬量は、実施例14に示した通りである。順序を逆にすると(CPT-11をhMN-14の3日前に投与)、または両者を同時に一緒にして投与すると、中央生存時間70日は未治療コントロール群(35日)より増加しているが、CPT-11の3日前にhMN-14で予備治療を行った場合の中央生存時間105日より有意に小さい。
【0257】
実施例18
図20は、ヒト結腸癌モデルでの裸のhMN-14 CEA Mab療法に対するGM-CSF予備治療の効果を示す。GM-CSFを、1μg/マウス/日の用量で-4、-3、-2および-1日に投与した。腫瘍細胞を、hMN-14投与と共に0日目に移植した。他の投薬量は、実施例14に示した通りである。GM-CSF予備治療は、GM-CSF単独またはhMN-14単独と比較して中央生存時間を統計学的に有意に増加した(p<0.002)。
【0258】
上記に特定の好ましい態様を示しているが、本発明はそれだけに限定されないことを理解されるであろう。当業者であれば、開示された態様に様々な修飾を行うことができ、かつこれらの修飾は本発明の範囲内にあることを意図するものであることを理解されるであろう。
【0259】
本明細書に引用された総ての公表文献、および特許出願明細書および特許明細書の内容は、その開示の一部として本明細書に引用されている。
【図面の簡単な説明】
【0260】
【図1A】hMN-14単独、DTIC単独、またはhMN-14とDTICの組合せを投与した後の腫瘍容積を比較するグラフ。図1Aは、25および100μg/用量で単独でまたは250μghMN-14抗体と共に投与したDTICを示す。
【図1B】hMN-14単独、DTIC単独、またはhMN-14とDTICの組合せを投与した後の腫瘍容積を比較するグラフ。図1BはDTICを50および75μg/用量で単独でまたは100μghMN-14抗体と共に投与したDTICを示す。
【図2】131Iおよび90Y-MN-14を用いる放射線免疫療法(RAIT)後の腫瘍容積を比較するグラフ。
【図3】TT担持マウスでの腫瘍容積に対する数種類の化学療法薬の治療効力を比較するグラフ。
【図4】マウスでの腫瘍容積に対する90Y標識抗 CEA MAbMN-14を用いたRAITとRAITの24時間後に開始した4剤併用の治療効力を比較するグラフ。
【図5】TT担持マウスにおけるRAITとDTICとの併用およびRAITとドキソルビシンとDTICの併用の効力を比較するグラフ。
【図6】TT異種移植片担持マウスでの裸のhMN-14の投与療法の効果を比較するグラフ。動物にTT細胞を皮下投与し、未処理のままにし(A)、または1日後(B)または11日後に0.5mg hMN-14を静脈内投与した。
【図7】甲状腺髄様癌の治療におけるヒト化およびネズミMN-14抗体の効果を比較するグラフ。動物にTT細胞を皮下投与し、未処理のままにし(A)、または1日後にhMN-14(0.5mg) を静脈内投与した。
【図8】甲状腺髄様癌の治療における様々なhMN-14用量の効果を比較するグラフ。動物に、TT細胞の皮下投与の1日後に増加用量のhMN-14を静脈内投与した。
【図9】TT担持ヌードマウスでの様々な投与時間を比較するグラフ。
【図10】TT担持ヌードマウスへのhMN-14とDTICの併用、DTIC単独、hMN-14単独の投与、および未処理マウスを比較するグラフ。
【図11A】ネズミMN-14可変領域重鎖(VH)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図11B】ネズミMN-14可変領域重鎖(VH)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図12A】ネズミMN-14可変領域軽鎖(VK)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図12B】ネズミMN-14可変領域軽鎖(VK)のコンセンサスDNA配列、およびDNA配列によってコードされたアミノ酸配列。CDRはボックスで囲われている。
【図13A】ネズミMN-14可変領域とヒト可変領域NEWM VHおよびREI VKとの整列。CDRはボックスに囲われており、ヒト化VHに組込まれているネズミVH FRは、Kabat et al. 「免疫学的に興味深いタンパク質の配列(SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST)」, U.S. Government Printing Office, Washington, D.C., 1987のナンバリングシステムに従ってそれらの位置に印が付けられている。KLHuVHに包含されるCDR外のネズミ残基は黒丸が付けられている。
【図13B】ネズミMN-14可変領域とヒトKOL VH領域との整列。CDRはボックスに囲われており、ヒト化VHに組込まれているネズミVH FRは、Kabat et al. 「免疫学的に興味深いタンパク質の配列(SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST)」, U.S. Government Printing Office, Washington, D.C., 1987のナンバリングシステムに従ってそれらの位置に印が付けられている。KLHuVHに包含されるCDR外のネズミ残基は黒丸が付けられている。
【図14A】図14A-14Cは、ネズミおよびヒト化MN-14 VH枠組残基(FR)の間のアミノ酸配列の比較を示す。マウスと異なるヒトFR残基のみが、示されている。NEWMおよびKOLについてのCDRも、示されていない。それぞれのFRにおけるアミノ酸置換の範囲を太文字で表し、置換の位置はKabat et al.のナンバリングシステムに従って表した。3個のCDRがボックスで囲まれている。
【図14B】図14A-14Cは、ネズミおよびヒト化MN-14 VH枠組残基(FR)の間のアミノ酸配列の比較を示す。マウスと異なるヒトFR残基のみが、示されている。NEWMおよびKOLについてのCDRも、示されていない。それぞれのFRにおけるアミノ酸置換の範囲を太文字で表し、置換の位置はKabat et al.のナンバリングシステムに従って表した。3個のCDRがボックスで囲まれている。
【図14C】図14A-14Cは、ネズミおよびヒト化MN-14 VH枠組残基(FR)の間のアミノ酸配列の比較を示す。マウスと異なるヒトFR残基のみが、示されている。NEWMおよびKOLについてのCDRも、示されていない。それぞれのFRにおけるアミノ酸置換の範囲を太文字で表し、置換の位置はKabat et al.のナンバリングシステムに従って表した。3個のCDRがボックスで囲まれている。
【図15】ヒト甲状腺髄様癌モデルでの裸のhMN-14 CEA MabおよびDTIC治療の効果。
【図16】進行したヒト結腸癌モデルでの裸のhMN-14 CEA MabおよびCPT-11治療の効果。
【図17】低腫瘍負荷のヒト結腸癌モデルでの裸のhMN-14 CEA MabおよびCPT-11治療の効果。
【図18】ヒト結腸癌モデルでのCPT-11治療の3日前に投与した裸のhMN-14 CEA Mabの前投与の効果。
【図19】ヒト結腸癌モデルでの裸のhMN-14 CEA MabとCPT-11の様々な投与順序の比較。
【図20】ヒト結腸癌モデルでの裸のhMN-14 CEA Mab療法に対するGM-CSFの前投与の効果。
【図21】ヒト結腸癌モデルでの低CEA発現および高(インターフェロンにより誘導される)CEA発現腫瘍細胞に対する裸のhMN-14 CEA Mab療法の効果の比較。
【図22A】図22Aおよび22Bは、それぞれ show ヒトREIおよびKOL抗体のVkおよびVH領域のヒト、ネズミおよびヒト化配列と、ネズミおよびヒト化MN-14との比較を示す。図22AにおけるREIVkのヒト配列を、ネズミおよびヒト化MN-14Vk配列と比較する。黒丸は、ヒトREI Vk配列から保持された配列を示す。CDRはボックスで囲われている。
【図22B】図22Aおよび22Bは、それぞれ show ヒトREIおよびKOL抗体のVkおよびVH領域のヒト、ネズミおよびヒト化配列と、ネズミおよびヒト化MN-14との比較を示す。図22BにおけるKOL VHのヒト配列を、ネズミおよびヒト化MN-14 VH配列と比較する。黒丸は、ヒトKOL VH配列から保持された配列を示す。CDRはボックスで囲われている。
【図23A】図23Aおよび23Bは、hMN-14ヒト化クラスIII抗CEA抗体のVk,可変軽鎖およびVH,可変重鎖配列を示す。CDR領域配列は太文字でしめし、下線を付けている。アミノ酸残基およびヌクレアーゼは、順次番号を付けている。軽鎖可変領域は図23Aに示す。
【図23B】図23Aおよび23Bは、hMN-14ヒト化クラスIII抗CEA抗体のVk,可変軽鎖およびVH,可変重鎖配列を示す。CDR領域配列は太文字でしめし、下線を付けている。アミノ酸残基およびヌクレアーゼは、順次番号を付けている。重鎖可変領域は図23Bに示す。
【特許請求の範囲】
【請求項1】
少なくとも1種類の抗CEAモノクローナル抗体(MAb)またはその断片と少なくとも1種類の治療薬とを含んでなる、組成物。
【請求項2】
前記抗CEA MAbがクラスI、クラスIIまたはクラスIIの抗CEA MAbである、請求項1に記載の組成物。
【請求項3】
前記抗CEA MAbが、顆粒球と反応性でありかつMAbの一価形態であるクラスIまたはクラスIIの抗CEA Mabである、請求項1に記載の組成物。
【請求項4】
前記抗CEA MAbまたはその断片がヒト化してあり、該ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、請求項1に記載の組成物。
【請求項5】
前記抗CEA MAbまたはその断片がキメラMAbであり、該キメラMAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、請求項1に記載の組成物。
【請求項6】
前記抗CEA MAbまたはその断片が完全ヒトMAbであり、該完全ヒトMAbが、ネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、請求項1に記載の組成物。
【請求項7】
前記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、請求項1に記載の組成物。
【請求項8】
前記MN-14モノクローナル抗体またはその断片が、ネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、(1) 該MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、(2) 前記クラスIIIの抗CEA抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3、または(1)および(2)の両方のCDRを含んでなる、請求項7に記載の組成物。
【請求項9】
前記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、請求項1に記載の組成物。
【請求項10】
前記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、請求項7に記載の組成物。
【請求項11】
前記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、請求項7に記載の組成物。
【請求項12】
前記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、請求項7に記載の組成物。
【請求項13】
前記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)が、ネズミMN-14モノクローナル抗体の相当するFRから置換された少なくとも1種類のアミノ酸を含んでなる、請求項10に記載の組成物。
【請求項14】
前記ヒト化MN-14抗体またはその断片が、図14A-Cまたは図15B(hMn-14)または図16Bのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される前記ネズミMN-14抗体の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項13に記載の組成物。
【請求項15】
前記ヒト化MN-14抗体またはその断片が、前記ネズミMN-14軽鎖可変領域の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項13に記載の組成物。
【請求項16】
前記ヒト化MN-14抗体またはその断片が図13Aまたは図15Aまたは図16Aに示される軽鎖可変領域と、KLHuVhAIGAと称される図14A-Cまたは図15B (hMN-14)または図16Bに示される重鎖可変領域とを含んでなる、請求項10に記載の組成物。
【請求項17】
前記キメラMN-14抗体またはその断片が、ネズミMN-14 VKと称される図13Aに示される軽鎖可変領域とネズミMN-14 VHと称される図14A-Cに示される重鎖可変領域を含んでなる、請求項11に記載の組成物。
【請求項18】
前記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、請求項1に記載の組成物。
【請求項19】
前記治療薬が、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、請求項1に記載の組成物。
【請求項20】
前記それらの組合せが、ビンクリスチン、ドキソルビシン、DTIC、およびシクロホスファミドを含んでなる、請求項19に記載の組成物。
【請求項21】
前記治療薬が裸の抗体または免疫接合体である、請求項19に記載の組成物。
【請求項22】
前記裸の抗体または上記免疫接合体の抗体部分が、EGP-1、EGP-2(例えば、17-1 A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、テネイシン、フィブロネクチンまたは他の血管新生抗原、Ga733、またはそれらの組合せと反応性であるモノクローナル抗体またはその断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片を含んでなる、請求項21に記載の組成物。
【請求項23】
前記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、請求項22に記載の組成物。
【請求項24】
前記治療薬がDTICではない、請求項1に記載の組成物。
【請求項25】
同一または異なる抗原に対して少なくとも1種類のCEA結合部位および少なくとも1種類の他の結合部位を含んでなる、抗体融合タンパク質。
【請求項26】
前記CEA結合部位がクラスI、IIまたはIIIの抗CEA抗体と同じ部位に結合する、請求項25に記載の抗体融合タンパク質。
【請求項27】
前記CEA結合部位がクラスIII抗CEA抗体と同じ部位に結合する、請求項25に記載の抗体融合タンパク質。
【請求項28】
二価または三価である、請求項25に記載の抗体融合タンパク質。
【請求項29】
前記融合タンパク質の一方のアームがCD66eをターゲッティングするクラスIIIの抗CEA mAbであり、融合タンパク質もう一つのアームがCD66a-dをターゲッティングする別の抗CEA交差反応性抗体由来である、請求項25に記載の抗体融合タンパク質。
【請求項30】
前記結合部位がscFvまたはFab領域である、請求項25に記載の抗体融合タンパク質。
【請求項31】
NCA50/90と反応する一本のアームと、CEAのみと反応する2本のアームとを含んでなる二重特異性の三価のタンパク質である、請求項25に記載の抗体融合タンパク質。
【請求項32】
NCA50/90に結合する2本のアームを含んでなる二重特異性タンパク質である、請求項25に記載の抗体融合タンパク質。
【請求項33】
NCA50/90に結合する一つのアームと、CEAのクラスIIIエピトープに結合する第二のアームとを含んでなるジアボディーである、請求項25に記載の抗体融合タンパク質。
【請求項34】
NCA-50/90アームがhMN-3抗体から得られ、CEAのクラスIIIエピトープに結合する第二のアームがhMN-14から得られる、請求項33に記載の抗体融合タンパク質。
【請求項35】
前記融合タンパク質が顆粒球からのサイトカイン放出の活性化を防止するためのFc-ドメインを欠き、または補体固定およびADCCを防止する目的で変更されているFc-ドメインを有する、請求項34に記載の抗体融合タンパク質。
【請求項36】
1種類のhMN-3アームと2種類のhMN14アームとを含んでなるトリアボディーである、請求項35に記載の抗体融合タンパク質。
【請求項37】
1種類のhMN-15アームと2種類ののhMN14アームとを含んでなるトリアボディーである、請求項25に記載の抗体融合タンパク質。
【請求項38】
少なくとも1種類のhMN-14アームと少なくとも1種類のMN-6アームとを含んでなる、請求項25に記載の抗体融合タンパク質。
【請求項39】
補体固定およびADCCの活性化を可能にするFc-ドメインを含んでなる、請求項38に記載の抗体融合タンパク質。
【請求項40】
治療薬をさらに含んでなる、請求項35に記載の抗体融合タンパク質。
【請求項41】
前記治療薬がサイトカインである、請求項40に記載の抗体融合タンパク質。
【請求項42】
前記サイトカインがインターフェロン、コロニー刺激因子、またはインターロイキンである、請求項41に記載の抗体融合タンパク質。
【請求項43】
前記コロニー刺激因子がGM-CSFまたはG-CSFである、請求項42に記載の抗体融合タンパク質。
【請求項44】
患者に抗CEAモノクローナル抗体またはその断片の治療上有効量、および少なくとも1種類の治療薬であって、所望により薬学上許容可能なビヒクル中に処方したものを同時にまたは逐次的に投与することを含んでなる、甲状腺非髄様癌の治療方法。
【請求項45】
前記抗CEA MAbがクラスI、クラスIIまたはクラスIII抗CEA MAbである、請求項44に記載の方法。
【請求項46】
前記抗CEA MAbがクラスIまたはクラスII 抗CEA Mabであり、顆粒球と反応しかつMAbの一価形態である、請求項45に記載の方法。
【請求項47】
前記抗CEA MAbまたはその断片がヒト化したものであり、該ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、請求項45に記載の方法。
【請求項48】
前記抗CEA MAbまたはその断片がキメラMAbであり、該キメラMAbが実質的にネズミ抗CEA MAbの抗CEA結合特異性を保持する、請求項45に記載の方法。
【請求項49】
前記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、請求項45に記載の方法。
【請求項50】
前記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、前記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、前記MN-14抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、請求項49に記載の方法。
【請求項51】
前記MN-14モノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、請求項44に記載の方法。
【請求項52】
前記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、請求項49に記載の方法。
【請求項53】
前記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、請求項49に記載の方法。
【請求項54】
前記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、請求項49に記載の方法。
【請求項55】
前記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)が、ネズミのMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項49に記載の方法。
【請求項56】
前記ネズミMN-14モノクローナル抗体の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる前記ヒト化MN-14抗体またはその断片が、KLHuVhAIGAと称される図14A-Cまたは15B (hMN-14)または16Bのネズミの重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、請求項55に記載の方法。
【請求項57】
前記ヒト化MN-14抗体またはその断片が前記ネズミMN-14軽鎖可変領域の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項52に記載の方法。
【請求項58】
前記ヒト化MN-14抗体またはその断片が、図13Aまたは15A(hMN-14)または16Aに示される軽鎖可変領域と、KLHuVhAIGAと称される図14A-Cまたは15B(hMN-14)または16Bに示される重鎖可変領域とを含んでなる、請求項57に記載の方法。
【請求項59】
前記断片がF(ab')2、Fab'、Fab、 FvおよびsFvからなる群から選択される、請求項44に記載の方法。
【請求項60】
前記治療薬が、クラスI抗CEAモノクローナル抗体、クラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に投与される、請求項44に記載の方法。
【請求項61】
前記治療薬が裸の抗体または別の治療薬に接合した抗体である、請求項57に記載の方法。
【請求項62】
前記治療薬が、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、CEAまたは非CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、請求項44に記載の方法。
【請求項63】
前記治療薬が、EGP-1、EGP-2(例えば、17-1A)、IL-6、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGFまたは他の腫瘍血管新生抗原、Ga733、およびそれらの組合せと反応性であるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に上記患者に投与される、請求項62に記載の方法。
【請求項64】
前記抗体またはその断片が裸であるかまたは別の治療薬に接合している、請求項63に記載の方法。
【請求項65】
前記治療薬がDTICではない、請求項44に記載の方法。
【請求項66】
前記細胞傷害性物質が薬剤または毒素である、請求項62に記載の方法。
【請求項67】
前記薬剤が、有糸分裂阻害剤、アルキル化、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、請求項66に記載の方法。
【請求項68】
前記薬剤が、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、 代謝拮抗物質、 抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、請求項66に記載の方法。
【請求項69】
前記毒素が、リシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される微生物、植物または動物性毒素である、請求項66に記載の方法。
【請求項70】
前記イムノモジュレーターが、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチン、およびそれらの組合せからなる群から選択される、請求項62に記載の方法。
【請求項71】
前記リンホトキシンが腫瘍壊死因子(TNF)であり、前記造血因子がインターロイキン(IL)であり、前記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、前記インターフェロンがインターフェロン-α、-βまたは-γであり、前記幹細胞増殖因子が「S1因子」と称されるものである、請求項70に記載の方法。
【請求項72】
前記イムノモジュレーターがIL-1、IL-2、IL-3、 IL-6, IL-10、IL-12、IL-18、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、請求項70に記載の方法。
【請求項73】
前記放射性核種のエネルギーが20-10,000keVである、請求項62に記載の方法。
【請求項74】
前記放射性核種が125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、請求項73に記載の方法。
【請求項75】
前記光活性治療薬が色素原または色素である、請求項62に記載の方法。
【請求項76】
前記アルキル化剤がダカルバジンである、請求項67に記載の方法。
【請求項77】
前記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量で投与する、請求項49に記載の方法。
【請求項78】
前記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量で投与する、請求項49に記載の方法。
【請求項79】
クラスIII抗CEAモノクローナル抗体またはその断片、および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を、同時または逐次的に患者に投与することを含んでなる、甲状腺髄様癌の治療方法。
【請求項80】
前記抗CEA MAbがクラスI、クラスIIまたはクラスIII抗CEA MAbである、請求項79に記載の方法。
【請求項81】
前記抗CEA MAbが顆粒球と反応しかつMAbの一価形態であるクラスIまたはクラスII 抗CEA Mabである、請求項80に記載の方法。
【請求項82】
前記クラスIII抗CEA MAbまたはその断片がヒト化しており、該ヒト化MAbがネズミクラスIII抗CEA MAbのクラスIII 抗CEA結合特異性を実質的に保持する、請求項80に記載の方法。
【請求項83】
前記クラスIII抗CEA MAbまたはその断片がキメラMAbであり、該キメラMAbがネズミクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持する、請求項80に記載の方法。
【請求項84】
前記クラスIII抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、請求項80に記載の方法。
【請求項85】
前記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、前記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、前記クラスIIIのMN-14抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、請求項84に記載の方法。
【請求項86】
前記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、請求項79に記載の方法。
【請求項87】
前記ヒト化クラスIII抗CEA抗体またはその断片がヒト化MN-14抗体またはその断片である、請求項82に記載の方法。
【請求項88】
前記キメラクラスIII抗CEA抗体またはその断片がキメラMN-14抗体またはその断片である、請求項82に記載の方法。
【請求項89】
前記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、請求項84に記載の方法。
【請求項90】
前記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR) がネズミMN-14モノクローナル抗体の相当するFRから置換された少なくとも1種類のアミノ酸を含んでなる、請求項87に記載の方法。
【請求項91】
前記ネズミMN-14抗体の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる前記ヒト化MN-14抗体またはその断片が、図14A-Cまたは15Bのネズミ重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、請求項90に記載の方法。
【請求項92】
前記ヒト化MN-14抗体またはその断片が、前記ネズミMN-14軽鎖可変領域の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項87に記載の方法。
【請求項93】
前記ヒト化MN-14抗体またはその断片が、図13Aまたは15A(hMN-14)または16Aに記載の軽鎖可変領域と、図14A-Cまたは15B(hMN-14)または16Bに記載の重鎖可変領域とを含んでなる、請求項87に記載の方法。
【請求項94】
前記断片がF(ab')2、Fab'、Fab、FvおよびsFvからなる群から選択される、請求項79に記載の方法。
【請求項95】
前記治療薬が、クラスI抗CEAモノクローナル抗体、クラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に投与される、請求項79に記載の方法。
【請求項96】
前記抗体またはその断片が裸の抗体または別の治療薬に接合したものである、請求項95に記載の方法。
【請求項97】
前記治療薬が、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、CEAまたは非-CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、請求項79に記載の方法。
【請求項98】
前記治療薬が、EGP-1、EGP-2(例えば、17-1A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、テネイシン、フィブロネクチン、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGFまたは他の腫瘍血管新生抗原、Ga733、およびそれらの組合せと反応性であるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に上記患者に投与される、請求項98に記載の方法。
【請求項99】
前記抗体またはその断片が裸のものであるかまたは別の治療薬に接合している、請求項98に記載の方法。
【請求項100】
前記治療薬がDTICではない、請求項79に記載の方法。
【請求項101】
前記細胞傷害性物質が薬剤または毒素である、請求項97に記載の方法。
【請求項102】
前記薬剤が、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、請求項101に記載の方法。
【請求項103】
前記薬剤が、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、請求項101に記載の方法。
【請求項104】
前記微生物、植物または動物性毒素が、リシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される、請求項101に記載の方法。
【請求項105】
前記イムノモジュレーターが、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチンおよびそれらの組合せからなる群から選択される、請求項97に記載の方法。
【請求項106】
前記リンホトキシンが腫瘍壊死因子(TNF)であり、前記造血因子がインターロイキン(IL)であり、前記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、前記インターフェロンがインターフェロン-α、-βまたは-γであり、前記幹細胞増殖因子が「S 1因子」と称されるものである、請求項105に記載の方法。
【請求項107】
前記イムノモジュレーターがIL-1、IL-2、IL-3、IL-6, IL-10、IL-12、IL-18、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、請求項105に記載の方法。
【請求項108】
前記放射性核種のエネルギーが20-10,000keVである、請求項97に記載の方法。
【請求項109】
前記放射性核種125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、請求項108に記載の方法。
【請求項110】
前記光活性治療薬が色素原または色素である、請求項97に記載の方法。
【請求項111】
前記アルキル化剤がダカルバジンである、請求項102に記載の方法。
【請求項112】
前記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量にて投与する、請求項87に記載の方法。
【請求項113】
前記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量にて投与する、請求項87に記載の方法。
【請求項114】
抗CEAモノクローナル抗体またはその断片および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を、同時または逐次的に患者に投与することを含んでなる、癌の治療方法。
【請求項115】
前記治療薬がCPT-11である、請求項114に記載の方法。
【請求項116】
前記抗CEA抗体または断片を投与した後、CPT-11を投与する、請求項114に記載の方法。
【請求項117】
前記抗CEA抗体または断片を投与した約3日後にCPT-11を投与する、請求項114に記載の方法。
【請求項118】
前記治療薬がDTICである、請求項114に記載の方法。
【請求項119】
前記治療薬がオクサリプラチンである、請求項114に記載の方法。
【請求項120】
前記治療薬が5-フルオロウラシル/ロイコボリンである、請求項114に記載の方法。
【請求項121】
非抗体治療薬を用いる癌の治療方法において、癌患者に抗CEA抗体またはその断片を前投与した後、非抗体治療薬を投与することを含んでなる、改良された方法。
【請求項122】
前記抗CEA抗体がhMN-14である、請求項121に記載の方法。
【請求項123】
前記治療薬がCPT-11である、請求項121に記載の方法。
【請求項124】
抗体を用いる癌の治療方法であって、抗体を投与する前に、顆粒球および/またはNK細胞を活性化する薬剤を癌患者に投与して抗体のエフェクター機能を増加させることを含んでなる、方法。
【請求項125】
前記薬剤がGM-CSFである、請求項125に記載の方法。
【請求項126】
前記抗体が抗CEA抗体である、請求項125に記載の方法。
【請求項127】
前記抗体がhMN-14である、請求項125に記載の方法。
【請求項128】
抗CEA抗体または断片を用いる癌の治療方法であって、抗CEA抗体またはその断片を投与する前に、腫瘍細胞中のCEA発現をアップレギュレーションするのに有効な量のインターフェロンを癌患者に投与することを含んでなる、方法。
【請求項129】
前記抗CEA抗体がhMN-14である、請求項128に記載の方法。
【請求項1】
少なくとも1種類の抗CEAモノクローナル抗体(MAb)またはその断片と少なくとも1種類の治療薬とを含んでなる、組成物。
【請求項2】
前記抗CEA MAbがクラスI、クラスIIまたはクラスIIの抗CEA MAbである、請求項1に記載の組成物。
【請求項3】
前記抗CEA MAbが、顆粒球と反応性でありかつMAbの一価形態であるクラスIまたはクラスIIの抗CEA Mabである、請求項1に記載の組成物。
【請求項4】
前記抗CEA MAbまたはその断片がヒト化してあり、該ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、請求項1に記載の組成物。
【請求項5】
前記抗CEA MAbまたはその断片がキメラMAbであり、該キメラMAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、請求項1に記載の組成物。
【請求項6】
前記抗CEA MAbまたはその断片が完全ヒトMAbであり、該完全ヒトMAbが、ネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持している、請求項1に記載の組成物。
【請求項7】
前記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、請求項1に記載の組成物。
【請求項8】
前記MN-14モノクローナル抗体またはその断片が、ネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、(1) 該MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、(2) 前記クラスIIIの抗CEA抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3、または(1)および(2)の両方のCDRを含んでなる、請求項7に記載の組成物。
【請求項9】
前記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、請求項1に記載の組成物。
【請求項10】
前記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、請求項7に記載の組成物。
【請求項11】
前記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、請求項7に記載の組成物。
【請求項12】
前記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、請求項7に記載の組成物。
【請求項13】
前記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)が、ネズミMN-14モノクローナル抗体の相当するFRから置換された少なくとも1種類のアミノ酸を含んでなる、請求項10に記載の組成物。
【請求項14】
前記ヒト化MN-14抗体またはその断片が、図14A-Cまたは図15B(hMn-14)または図16Bのネズミの重鎖可変領域(KLHuVhAIGA)のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される前記ネズミMN-14抗体の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項13に記載の組成物。
【請求項15】
前記ヒト化MN-14抗体またはその断片が、前記ネズミMN-14軽鎖可変領域の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項13に記載の組成物。
【請求項16】
前記ヒト化MN-14抗体またはその断片が図13Aまたは図15Aまたは図16Aに示される軽鎖可変領域と、KLHuVhAIGAと称される図14A-Cまたは図15B (hMN-14)または図16Bに示される重鎖可変領域とを含んでなる、請求項10に記載の組成物。
【請求項17】
前記キメラMN-14抗体またはその断片が、ネズミMN-14 VKと称される図13Aに示される軽鎖可変領域とネズミMN-14 VHと称される図14A-Cに示される重鎖可変領域を含んでなる、請求項11に記載の組成物。
【請求項18】
前記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、請求項1に記載の組成物。
【請求項19】
前記治療薬が、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、請求項1に記載の組成物。
【請求項20】
前記それらの組合せが、ビンクリスチン、ドキソルビシン、DTIC、およびシクロホスファミドを含んでなる、請求項19に記載の組成物。
【請求項21】
前記治療薬が裸の抗体または免疫接合体である、請求項19に記載の組成物。
【請求項22】
前記裸の抗体または上記免疫接合体の抗体部分が、EGP-1、EGP-2(例えば、17-1 A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGF、テネイシン、フィブロネクチンまたは他の血管新生抗原、Ga733、またはそれらの組合せと反応性であるモノクローナル抗体またはその断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片を含んでなる、請求項21に記載の組成物。
【請求項23】
前記断片がF(ab')2、Fab'、Fab、FvおよびscFvからなる群から選択される、請求項22に記載の組成物。
【請求項24】
前記治療薬がDTICではない、請求項1に記載の組成物。
【請求項25】
同一または異なる抗原に対して少なくとも1種類のCEA結合部位および少なくとも1種類の他の結合部位を含んでなる、抗体融合タンパク質。
【請求項26】
前記CEA結合部位がクラスI、IIまたはIIIの抗CEA抗体と同じ部位に結合する、請求項25に記載の抗体融合タンパク質。
【請求項27】
前記CEA結合部位がクラスIII抗CEA抗体と同じ部位に結合する、請求項25に記載の抗体融合タンパク質。
【請求項28】
二価または三価である、請求項25に記載の抗体融合タンパク質。
【請求項29】
前記融合タンパク質の一方のアームがCD66eをターゲッティングするクラスIIIの抗CEA mAbであり、融合タンパク質もう一つのアームがCD66a-dをターゲッティングする別の抗CEA交差反応性抗体由来である、請求項25に記載の抗体融合タンパク質。
【請求項30】
前記結合部位がscFvまたはFab領域である、請求項25に記載の抗体融合タンパク質。
【請求項31】
NCA50/90と反応する一本のアームと、CEAのみと反応する2本のアームとを含んでなる二重特異性の三価のタンパク質である、請求項25に記載の抗体融合タンパク質。
【請求項32】
NCA50/90に結合する2本のアームを含んでなる二重特異性タンパク質である、請求項25に記載の抗体融合タンパク質。
【請求項33】
NCA50/90に結合する一つのアームと、CEAのクラスIIIエピトープに結合する第二のアームとを含んでなるジアボディーである、請求項25に記載の抗体融合タンパク質。
【請求項34】
NCA-50/90アームがhMN-3抗体から得られ、CEAのクラスIIIエピトープに結合する第二のアームがhMN-14から得られる、請求項33に記載の抗体融合タンパク質。
【請求項35】
前記融合タンパク質が顆粒球からのサイトカイン放出の活性化を防止するためのFc-ドメインを欠き、または補体固定およびADCCを防止する目的で変更されているFc-ドメインを有する、請求項34に記載の抗体融合タンパク質。
【請求項36】
1種類のhMN-3アームと2種類のhMN14アームとを含んでなるトリアボディーである、請求項35に記載の抗体融合タンパク質。
【請求項37】
1種類のhMN-15アームと2種類ののhMN14アームとを含んでなるトリアボディーである、請求項25に記載の抗体融合タンパク質。
【請求項38】
少なくとも1種類のhMN-14アームと少なくとも1種類のMN-6アームとを含んでなる、請求項25に記載の抗体融合タンパク質。
【請求項39】
補体固定およびADCCの活性化を可能にするFc-ドメインを含んでなる、請求項38に記載の抗体融合タンパク質。
【請求項40】
治療薬をさらに含んでなる、請求項35に記載の抗体融合タンパク質。
【請求項41】
前記治療薬がサイトカインである、請求項40に記載の抗体融合タンパク質。
【請求項42】
前記サイトカインがインターフェロン、コロニー刺激因子、またはインターロイキンである、請求項41に記載の抗体融合タンパク質。
【請求項43】
前記コロニー刺激因子がGM-CSFまたはG-CSFである、請求項42に記載の抗体融合タンパク質。
【請求項44】
患者に抗CEAモノクローナル抗体またはその断片の治療上有効量、および少なくとも1種類の治療薬であって、所望により薬学上許容可能なビヒクル中に処方したものを同時にまたは逐次的に投与することを含んでなる、甲状腺非髄様癌の治療方法。
【請求項45】
前記抗CEA MAbがクラスI、クラスIIまたはクラスIII抗CEA MAbである、請求項44に記載の方法。
【請求項46】
前記抗CEA MAbがクラスIまたはクラスII 抗CEA Mabであり、顆粒球と反応しかつMAbの一価形態である、請求項45に記載の方法。
【請求項47】
前記抗CEA MAbまたはその断片がヒト化したものであり、該ヒト化MAbがネズミ抗CEA MAbの抗CEA結合特異性を実質的に保持する、請求項45に記載の方法。
【請求項48】
前記抗CEA MAbまたはその断片がキメラMAbであり、該キメラMAbが実質的にネズミ抗CEA MAbの抗CEA結合特異性を保持する、請求項45に記載の方法。
【請求項49】
前記抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、請求項45に記載の方法。
【請求項50】
前記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、前記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、前記MN-14抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、請求項49に記載の方法。
【請求項51】
前記MN-14モノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、請求項44に記載の方法。
【請求項52】
前記MN-14モノクローナル抗体またはその断片がヒト化MN-14抗体またはその断片である、請求項49に記載の方法。
【請求項53】
前記MN-14モノクローナル抗体またはその断片がキメラMN-14抗体またはその断片である、請求項49に記載の方法。
【請求項54】
前記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、請求項49に記載の方法。
【請求項55】
前記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR)が、ネズミのMN-14モノクローナル抗体の相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項49に記載の方法。
【請求項56】
前記ネズミMN-14モノクローナル抗体の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる前記ヒト化MN-14抗体またはその断片が、KLHuVhAIGAと称される図14A-Cまたは15B (hMN-14)または16Bのネズミの重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、請求項55に記載の方法。
【請求項57】
前記ヒト化MN-14抗体またはその断片が前記ネズミMN-14軽鎖可変領域の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項52に記載の方法。
【請求項58】
前記ヒト化MN-14抗体またはその断片が、図13Aまたは15A(hMN-14)または16Aに示される軽鎖可変領域と、KLHuVhAIGAと称される図14A-Cまたは15B(hMN-14)または16Bに示される重鎖可変領域とを含んでなる、請求項57に記載の方法。
【請求項59】
前記断片がF(ab')2、Fab'、Fab、 FvおよびsFvからなる群から選択される、請求項44に記載の方法。
【請求項60】
前記治療薬が、クラスI抗CEAモノクローナル抗体、クラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒト、またはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に投与される、請求項44に記載の方法。
【請求項61】
前記治療薬が裸の抗体または別の治療薬に接合した抗体である、請求項57に記載の方法。
【請求項62】
前記治療薬が、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、CEAまたは非CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、請求項44に記載の方法。
【請求項63】
前記治療薬が、EGP-1、EGP-2(例えば、17-1A)、IL-6、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGFまたは他の腫瘍血管新生抗原、Ga733、およびそれらの組合せと反応性であるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に上記患者に投与される、請求項62に記載の方法。
【請求項64】
前記抗体またはその断片が裸であるかまたは別の治療薬に接合している、請求項63に記載の方法。
【請求項65】
前記治療薬がDTICではない、請求項44に記載の方法。
【請求項66】
前記細胞傷害性物質が薬剤または毒素である、請求項62に記載の方法。
【請求項67】
前記薬剤が、有糸分裂阻害剤、アルキル化、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、請求項66に記載の方法。
【請求項68】
前記薬剤が、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、 代謝拮抗物質、 抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、請求項66に記載の方法。
【請求項69】
前記毒素が、リシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される微生物、植物または動物性毒素である、請求項66に記載の方法。
【請求項70】
前記イムノモジュレーターが、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチン、およびそれらの組合せからなる群から選択される、請求項62に記載の方法。
【請求項71】
前記リンホトキシンが腫瘍壊死因子(TNF)であり、前記造血因子がインターロイキン(IL)であり、前記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、前記インターフェロンがインターフェロン-α、-βまたは-γであり、前記幹細胞増殖因子が「S1因子」と称されるものである、請求項70に記載の方法。
【請求項72】
前記イムノモジュレーターがIL-1、IL-2、IL-3、 IL-6, IL-10、IL-12、IL-18、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、請求項70に記載の方法。
【請求項73】
前記放射性核種のエネルギーが20-10,000keVである、請求項62に記載の方法。
【請求項74】
前記放射性核種が125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、請求項73に記載の方法。
【請求項75】
前記光活性治療薬が色素原または色素である、請求項62に記載の方法。
【請求項76】
前記アルキル化剤がダカルバジンである、請求項67に記載の方法。
【請求項77】
前記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量で投与する、請求項49に記載の方法。
【請求項78】
前記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量で投与する、請求項49に記載の方法。
【請求項79】
クラスIII抗CEAモノクローナル抗体またはその断片、および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を、同時または逐次的に患者に投与することを含んでなる、甲状腺髄様癌の治療方法。
【請求項80】
前記抗CEA MAbがクラスI、クラスIIまたはクラスIII抗CEA MAbである、請求項79に記載の方法。
【請求項81】
前記抗CEA MAbが顆粒球と反応しかつMAbの一価形態であるクラスIまたはクラスII 抗CEA Mabである、請求項80に記載の方法。
【請求項82】
前記クラスIII抗CEA MAbまたはその断片がヒト化しており、該ヒト化MAbがネズミクラスIII抗CEA MAbのクラスIII 抗CEA結合特異性を実質的に保持する、請求項80に記載の方法。
【請求項83】
前記クラスIII抗CEA MAbまたはその断片がキメラMAbであり、該キメラMAbがネズミクラスIII抗CEA MAbのクラスIII抗CEA結合特異性を実質的に保持する、請求項80に記載の方法。
【請求項84】
前記クラスIII抗CEAモノクローナル抗体またはその断片がMN-14抗体またはその断片である、請求項80に記載の方法。
【請求項85】
前記MN-14モノクローナル抗体またはその断片がネズミMN-14モノクローナル抗体の相補性決定領域(CDR)を含んでなり、前記MN-14抗体の軽鎖可変領域のCDRがアミノ酸配列KASQDVGTSVAを含んでなるCDR1、アミノ酸配列WTSTRHTを含んでなるCDR2、およびアミノ酸配列QQYSLYRSを含んでなるCDR3を含んでなり、前記クラスIIIのMN-14抗体の重鎖可変領域のCDRがTYWMSを含んでなるCDR1、EIHPDSSTINYAPSLKDを含んでなるCDR2、およびLYFGFPWFAYを含んでなるCDR3を含んでなる、請求項84に記載の方法。
【請求項86】
前記抗CEAモノクローナル抗体がCEAと反応し、通常の交差反応性抗原(NCA)および胎便抗原(MA)とは反応しない、請求項79に記載の方法。
【請求項87】
前記ヒト化クラスIII抗CEA抗体またはその断片がヒト化MN-14抗体またはその断片である、請求項82に記載の方法。
【請求項88】
前記キメラクラスIII抗CEA抗体またはその断片がキメラMN-14抗体またはその断片である、請求項82に記載の方法。
【請求項89】
前記MN-14モノクローナル抗体またはその断片が完全ヒトMN-14抗体またはその断片である、請求項84に記載の方法。
【請求項90】
前記ヒト化MN-14抗体またはその断片の軽および重鎖可変領域の枠組構造領域(FR) がネズミMN-14モノクローナル抗体の相当するFRから置換された少なくとも1種類のアミノ酸を含んでなる、請求項87に記載の方法。
【請求項91】
前記ネズミMN-14抗体の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる前記ヒト化MN-14抗体またはその断片が、図14A-Cまたは15Bのネズミ重鎖可変領域のアミノ酸残基24、28、30、48、49、74および94からなる群から選択される、請求項90に記載の方法。
【請求項92】
前記ヒト化MN-14抗体またはその断片が、前記ネズミMN-14軽鎖可変領域の前記相当するFR由来の少なくとも1種類のアミノ酸を含んでなる、請求項87に記載の方法。
【請求項93】
前記ヒト化MN-14抗体またはその断片が、図13Aまたは15A(hMN-14)または16Aに記載の軽鎖可変領域と、図14A-Cまたは15B(hMN-14)または16Bに記載の重鎖可変領域とを含んでなる、請求項87に記載の方法。
【請求項94】
前記断片がF(ab')2、Fab'、Fab、FvおよびsFvからなる群から選択される、請求項79に記載の方法。
【請求項95】
前記治療薬が、クラスI抗CEAモノクローナル抗体、クラスII抗CEAモノクローナル抗体、クラスIII抗CEAモノクローナル抗体、およびそれらの断片からなる群から選択されるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に投与される、請求項79に記載の方法。
【請求項96】
前記抗体またはその断片が裸の抗体または別の治療薬に接合したものである、請求項95に記載の方法。
【請求項97】
前記治療薬が、裸の抗体、細胞傷害性物質、薬剤、放射性核種、イムノモジュレーター、光活性治療薬、CEAまたは非-CEA抗体の免疫接合体、ホルモン、またはそれらの組合せであって、所望により薬学上許容可能なビヒクル中に処方されたものからなる群から選択される、請求項79に記載の方法。
【請求項98】
前記治療薬が、EGP-1、EGP-2(例えば、17-1A)、MUC-1、MUC-2、MUC-3、MUC-4、PAM-4、KC4、TAG-72、EGFR、EGP-2、HER2/neu、BrE3、Le-Y、A3、A33、Ep-CAM、AFP、Tn、テネイシン、フィブロネクチン、Thomson-Friedenreich抗原、腫瘍壊死抗原、VEGFまたは他の腫瘍血管新生抗原、Ga733、およびそれらの組合せと反応性であるヒト化、キメラ、ヒトまたはネズミモノクローナル抗体またはその断片からなる群から選択され、治療上有効量にて同時にまたは逐次的に上記患者に投与される、請求項98に記載の方法。
【請求項99】
前記抗体またはその断片が裸のものであるかまたは別の治療薬に接合している、請求項98に記載の方法。
【請求項100】
前記治療薬がDTICではない、請求項79に記載の方法。
【請求項101】
前記細胞傷害性物質が薬剤または毒素である、請求項97に記載の方法。
【請求項102】
前記薬剤が、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、血管新生阻害因子、アポトーシス因子、アルカロイド、COX-2および抗生物質、およびそれらの組合せからなる群から選択される医薬特性を有する、請求項101に記載の方法。
【請求項103】
前記薬剤が、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホン酸塩、ニトロソウレア、トリアゼン、葉酸類似体、アントラサイクリン、タキサン、COX-2阻害薬、ピリミジン類似体、プリン類似体、代謝拮抗物質、抗生物質、酵素、エピポドフィロトキシン、白金配位錯体、ビンカアルカロイド、置換尿素、メチルヒドラジン誘導体、副腎皮質ホルモン抑制因子、拮抗因子、エンドスタチン、タキソール、カンプトテシン、ドキソルビシンおよびそれらの類似体、およびそれらの組合せからなる群から選択される、請求項101に記載の方法。
【請求項104】
前記微生物、植物または動物性毒素が、リシン、アブリン、α毒素、サポリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼI、ブドウ球菌エンテロトキシン-A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒素、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される、請求項101に記載の方法。
【請求項105】
前記イムノモジュレーターが、サイトカイン、幹細胞増殖因子、リンホトキシン、造血因子、コロニー刺激因子(CSF)、インターフェロン(IFN)、幹細胞増殖因子、エリトロポエチン、トロンボポエチンおよびそれらの組合せからなる群から選択される、請求項97に記載の方法。
【請求項106】
前記リンホトキシンが腫瘍壊死因子(TNF)であり、前記造血因子がインターロイキン(IL)であり、前記コロニー刺激因子が顆粒球-コロニー刺激因子(G-CSF)または顆粒球マクロファージ-コロニー刺激因子(GM-CSF)であり、前記インターフェロンがインターフェロン-α、-βまたは-γであり、前記幹細胞増殖因子が「S 1因子」と称されるものである、請求項105に記載の方法。
【請求項107】
前記イムノモジュレーターがIL-1、IL-2、IL-3、IL-6, IL-10、IL-12、IL-18、インターフェロン-γ、TNF-αまたはそれらの組合せを含んでなる、請求項105に記載の方法。
【請求項108】
前記放射性核種のエネルギーが20-10,000keVである、請求項97に記載の方法。
【請求項109】
前記放射性核種125I、131I、90Y、88Y、225Ac、177Lu、188Re、186Re、およびそれらの組合せからなる群から選択される、請求項108に記載の方法。
【請求項110】
前記光活性治療薬が色素原または色素である、請求項97に記載の方法。
【請求項111】
前記アルキル化剤がダカルバジンである、請求項102に記載の方法。
【請求項112】
前記MN-14抗体またはその断片を注入用量当たり100-600mgタンパク質の投薬量にて投与する、請求項87に記載の方法。
【請求項113】
前記MN-14抗体またはその断片を注入用量当たり300-400mgタンパク質の投薬量にて投与する、請求項87に記載の方法。
【請求項114】
抗CEAモノクローナル抗体またはその断片および少なくとも1種類の治療薬、所望により薬学上許容可能なビヒクル中に処方したものの治療上有効量を、同時または逐次的に患者に投与することを含んでなる、癌の治療方法。
【請求項115】
前記治療薬がCPT-11である、請求項114に記載の方法。
【請求項116】
前記抗CEA抗体または断片を投与した後、CPT-11を投与する、請求項114に記載の方法。
【請求項117】
前記抗CEA抗体または断片を投与した約3日後にCPT-11を投与する、請求項114に記載の方法。
【請求項118】
前記治療薬がDTICである、請求項114に記載の方法。
【請求項119】
前記治療薬がオクサリプラチンである、請求項114に記載の方法。
【請求項120】
前記治療薬が5-フルオロウラシル/ロイコボリンである、請求項114に記載の方法。
【請求項121】
非抗体治療薬を用いる癌の治療方法において、癌患者に抗CEA抗体またはその断片を前投与した後、非抗体治療薬を投与することを含んでなる、改良された方法。
【請求項122】
前記抗CEA抗体がhMN-14である、請求項121に記載の方法。
【請求項123】
前記治療薬がCPT-11である、請求項121に記載の方法。
【請求項124】
抗体を用いる癌の治療方法であって、抗体を投与する前に、顆粒球および/またはNK細胞を活性化する薬剤を癌患者に投与して抗体のエフェクター機能を増加させることを含んでなる、方法。
【請求項125】
前記薬剤がGM-CSFである、請求項125に記載の方法。
【請求項126】
前記抗体が抗CEA抗体である、請求項125に記載の方法。
【請求項127】
前記抗体がhMN-14である、請求項125に記載の方法。
【請求項128】
抗CEA抗体または断片を用いる癌の治療方法であって、抗CEA抗体またはその断片を投与する前に、腫瘍細胞中のCEA発現をアップレギュレーションするのに有効な量のインターフェロンを癌患者に投与することを含んでなる、方法。
【請求項129】
前記抗CEA抗体がhMN-14である、請求項128に記載の方法。
【図1A】


【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11A】


【図11B】


【図12A】


【図12B】


【図13A】


【図13B】


【図14A】


【図14B】


【図14C】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22A】


【図22B】


【図23A】


【図23B】




【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11A】


【図11B】


【図12A】


【図12B】


【図13A】


【図13B】


【図14A】


【図14B】


【図14C】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22A】


【図22B】


【図23A】


【図23B】


【公開番号】特開2011−173903(P2011−173903A)
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【出願番号】特願2011−93352(P2011−93352)
【出願日】平成23年4月19日(2011.4.19)
【分割の表示】特願2005−501118(P2005−501118)の分割
【原出願日】平成15年10月8日(2003.10.8)
【出願人】(504149971)イミューノメディクス、インコーポレイテッド (48)
【氏名又は名称原語表記】IMMUNOMEDICS, INC.
【Fターム(参考)】
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【出願日】平成23年4月19日(2011.4.19)
【分割の表示】特願2005−501118(P2005−501118)の分割
【原出願日】平成15年10月8日(2003.10.8)
【出願人】(504149971)イミューノメディクス、インコーポレイテッド (48)
【氏名又は名称原語表記】IMMUNOMEDICS, INC.
【Fターム(参考)】
[ Back to top ]

