抗体結合タンパク質およびその製造方法
【課題】 Fc結合性タンパク質(ヒトFcγRIの細胞外領域)が有する抗体への親和性を保持したまま、安定製造が可能なタンパク質、および遺伝子工学的手法を用いた前記タンパク質の製造方法を提供すること。
【解決手段】 Fc結合性タンパク質を構成する3つのドメインのうち、N末端側の第1ドメインおよび第2ドメインを含み、かつC末端側の第3ドメインを欠失させた、小型化Fc結合性タンパク質、前記タンパク質をコードするポリヌクレオチド、前記ポリヌクレオチドを含むベクター、および前記ベクターを用いて宿主を形質転換して得られる形質転換体により前記課題を解決する。
【解決手段】 Fc結合性タンパク質を構成する3つのドメインのうち、N末端側の第1ドメインおよび第2ドメインを含み、かつC末端側の第3ドメインを欠失させた、小型化Fc結合性タンパク質、前記タンパク質をコードするポリヌクレオチド、前記ポリヌクレオチドを含むベクター、および前記ベクターを用いて宿主を形質転換して得られる形質転換体により前記課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒト抗体に対する結合親和性の高いタンパク質、および遺伝子工学的手法を用いた前記タンパク質の製造方法に関する。
【背景技術】
【0002】
抗体は、医薬品、研究試薬等に幅広く利用され、特に医療分野においては必須な物質として認識されている。抗体利用の拡大から、抗体を認識し結合する物質の需要も増加している。中でも、ヒトFc受容体(以下、単に「FcR」と略記する)は、ヒト抗体IgGに対する結合親和性が高いため、産業上の応用が試みられている(特許文献1)。
【0003】
FcRには、抗体との複合体形成後の機能および構造上の分類からFcγRI、FcγRIIa、FcγRIIb、FcγRIIIのサブクラスが存在する。これらのFcRは免疫細胞の表面に存在し、抗体と結合し複合体を形成することにより、免疫細胞内にシグナルが伝達されるなど、免疫機構の中核を担うタンパク質である。FcRサブクラス間のアミノ酸配列の相同性は非常に高く、抗体との複合体形成において、実際に抗体と相互作用するアミノ酸位置の推測も可能であるとされている。一方で、FcRサブクラスの一つであるFcγRIの細胞外領域(以下、「Fc結合性タンパク質」とする)には、他のFcRには存在しない3つ目のドメインがC末端側に存在しており(非特許文献1および2)、この3つ目のドメインが存在することで、FcγRIが高度な親和性、抗体選択性を備えていると考えられている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2002−531086号公報
【特許文献2】特開2008−245580号公報
【非特許文献】
【0005】
【非特許文献1】J.M.Allen等,Science,243,378,1989
【非特許文献2】A.Paetz等,Biochem.Biophys.Res.Commun.,338,1811,2005
【発明の概要】
【発明が解決しようとする課題】
【0006】
抗体検出試薬等に使用する目的でFc結合性タンパク質を製造・使用する際、従来はFc結合性タンパク質が有する3つのドメインすべて含むタンパク質として発現(製造)し、使用してきた(特許文献2)。しかしながら、Fc結合性タンパク質の発現量は低く、また安定性等についても課題を有していた。
【0007】
そこで本発明は、Fc結合性タンパク質が有する抗体への親和性を保持したまま、安定製造が可能なタンパク質、および遺伝子工学的手法を用いた前記タンパク質の製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは上記の課題を解決すべく鋭意検討した結果、FcγRIの細胞外領域(Fc結合性タンパク質)を構成する3つのドメインのうち、これまでFcγRIが高度な親和性、抗体選択性を備えている原因として考えられた、C末端側の第3ドメインを削除しても(すなわちN末端側の第1ドメインと第2ドメインのみであっても)、抗体への高い親和性を有していることを見出し、本発明の完成に至った。
【0009】
すなわち、本発明は、以下の態様を包含する:
(1)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含む、Fc結合性タンパク質。
【0010】
(2)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含み、かつ前記アミノ酸のうちの一つ以上が他のアミノ酸に置換された、Fc結合性タンパク質。
【0011】
(3)(1)または(2)に記載のアミノ酸配列をコードするポリヌクレオチド。
【0012】
(4)配列番号7に記載のヌクレオチド配列のうち、1番目から522番目までのヌクレオチドからなるポリヌクレオチド。
【0013】
(5)(3)または(4)に記載のポリヌクレオチドを含む、Fc結合性タンパク質を発現させるためのベクター。
【0014】
(6)(5)に記載のベクターを用いて宿主を形質転換して得られる、形質転換体。
【0015】
(7)宿主が大腸菌である、(6)に記載の形質転換体。
【0016】
(8)(6)または(7)に記載の形質転換体を用いた、Fc結合性タンパク質の製造方法。
【0017】
以下、本発明について詳細に説明する。
【0018】
ヒトFcγRIは、図1に示すように、N末端側から、15アミノ酸からなるシグナルペプチド領域(SS、配列番号6に記載のアミノ酸配列のうち1番目から15番目までの領域)、277アミノ酸からなる細胞外領域(EC、配列番号6に記載のアミノ酸配列のうち16番目から292番目までの領域)、21アミノ酸からなる細胞膜貫通領域(TM、配列番号6に記載のアミノ酸配列のうち293番目から313番目までの領域)、61アミノ酸からなる細胞内領域(C、配列番号6に記載のアミノ酸配列のうち314番目から374番目までの領域)、から構成される。またヒトFcγRIの細胞外領域(Fc結合性タンパク質)は、公的データベース(UniProtKB/Swiss−Prot No.P12314)より、さらにN末端側から第1ドメイン(配列番号6に記載のアミノ酸配列のうち22番目から101番目までの領域)、第2ドメイン(配列番号6に記載のアミノ酸配列のうち95番目から184番目までの領域)、第3ドメイン(配列番号6に記載のアミノ酸配列のうち190番目から277番目までの領域)を有していることが知られている。
【0019】
本発明のFc結合性タンパク質は、Fc結合性タンパク質(ヒトFcγRIの細胞外領域)(配列番号6に記載のアミノ酸配列のうち16番目から292番目までの領域)の一部領域である、配列番号52(配列番号6に記載のアミノ酸配列のうち16番目から189番目までの領域)に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸(すなわち第1ドメインおよび第2ドメインの領域)を含むタンパク質である。なお、本発明のFc結合性タンパク質を構成するアミノ酸のうちの一つ以上が他のアミノ酸に置換されたタンパク質も、本発明のFc結合性タンパク質に含まれる。前記タンパク質の一態様として、配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含むタンパク質であって、
(ア)配列番号52の10番目のスレオニンがリジンに置換
(イ)配列番号52の23番目のスレオニンがアラニンまたはセリンに置換
(ウ)配列番号52の31番目のロイシンがアルギニンまたはプロリンに置換
(エ)配列番号52の47番目のアラニンがバリンに置換
(オ)配列番号52の48番目のスレオニンがイソロイシンに置換
(カ)配列番号52の54番目のセリンがフェニルアラニンまたはスレオニンに置換
(キ)配列番号52の56番目のアルギニンがヒスチジンに置換
(ク)配列番号52の62番目のバリンがアラニンまたはグルタミン酸に置換
(ケ)配列番号52の63番目のアスパラギンがアスパラギン酸に置換
(コ)配列番号52の79番目のアスパラギン酸がグルタミン酸に置換
(サ)配列番号52の85番目のイソロイシンがバリンに置換
(シ)配列番号52の95番目のセリンがアスパラギンに置換
(ス)配列番号52の99番目のフェニルアラニンがロイシンに置換
(セ)配列番号52の110番目のヒスチジンがアルギニンに置換
(ソ)配列番号52の116番目のロイシンがアルギニンまたはプロリンに置換
(タ)配列番号52の134番目のトリプトファンがロイシンに置換
(チ)配列番号52の141番目のロイシンがプロリンに置換
(ツ)配列番号52の145番目のイソロイシンがメチオニンに置換
(テ)配列番号52の148番目のアスパラギンがセリンに置換
のいずれかのアミノ酸置換を一つ以上含む、タンパク質があげられる(特願2010−052789号)。また、ポリヒスチジンタグといった精製などを行なうためのタグペプチドを本発明のFc結合性タンパク質のN末端側またはC末端側に付加しても、本発明のFc結合性タンパク質に含まれる。
【0020】
本発明のFc結合性タンパク質をコードするポリヌクレオチド(以下、単に「本発明のポリヌクレオチド」とする)の作製方法として、
(I)本発明のFc結合性タンパク質のアミノ酸配列からヌクレオチド配列に変換し、前記ヌクレオチド配列を含むポリヌクレオチドを人工的に合成して作製する方法や、
(II)ヒトFcγRIの全体または部分配列を含むポリヌクレオチドを直接人工的に、またはヒトFcγRIのcDNAなどからPCR法といったDNA増幅法を用いて調製し、調製した前記ポリヌクレオチドを適当な方法で連結し作製する方法、
を例示することができる。なお、アミノ酸配列からヌクレオチド配列に変換する際は、形質転換させる宿主におけるコドンの使用頻度を考慮して変換するのが好ましい。一例として、宿主が大腸菌(Escherichia coli)の場合は、アルギニン(Arg)ではAGA/AGG/CGG/CGAが、イソロイシン(Ile)ではATAが、ロイシン(Leu)ではCTAが、グリシン(Gly)ではGGAが、プロリン(Pro)ではCCCが、それぞれ使用頻度が少ないため(いわゆるレアコドンであるため)、それらのコドンを避けるように変換すればよい。コドンの使用頻度の解析は公的データベース(例えば、かずさDNA研究所のホームページにあるCodon Usage Databaseなど)を利用することによっても可能である。大腸菌のコドン使用頻度を基に、本発明のFc結合性タンパク質のアミノ酸配列からヌクレオチド配列に変換した例として、配列番号52に記載のアミノ酸配列から変換した、配列番号7に記載のヌクレオチド配列のうち1番目から522番目までのヌクレオチドからなるポリヌクレオチドがあげられる。
【0021】
なお、前記(I)または(II)の方法で作製した本発明のポリヌクレオチドの5’末端側にシグナルペプチドをコードするポリヌクレオチドを付加してもよく、宿主が大腸菌の場合は、前記シグナルペプチドとしてpelB(UniProt No.P0C1C1の1番目から22番目までの領域)、DsbA(UniProt No.P0AEG4の1から19番目までの領域)、MalE(UniProt No.P0AEX9の1番目から26番目までの領域、配列番号1)、TorT(UniProt No.P38683の1番目から18番目の領域)といったペリプラズムにタンパク質を分泌させるシグナルペプチドをあげることができる(特願2009−256180号)。
【0022】
本発明のポリヌクレオチドを用いて宿主を形質転換する際は、本発明のポリヌクレオチドそのものを用いてもよいが、発現ベクター(例えば、原核細胞や真核細胞の形質転換に通常用いるバクテリオファージ、コスミドやプラスミドなど)の適切な位置に本発明のポリヌクレオチドを挿入したものを用いると、より好ましい。なお、前記発現ベクターは、形質転換する宿主内で安定に存在し複製できるものであれば特に制限はなく、大腸菌を宿主とする場合は、pETプラスミド、pUCプラスミド、pTrc99aプラスミド、pCDFプラスミド、pBBRプラスミドなどを例示することができる。なお、前記発現ベクターに本発明のポリヌクレオチドを挿入する際、本発明のポリヌクレオチドを複数連結した状態(連結部分にリンカーペプチドをコードするポリヌクレオチドを含んでもよい)で挿入してもよく、複数連結した状態で挿入することにより、形質転換体による本発明のFc結合性タンパク質生産性の向上が期待できる(特願2009−274352号、特願2009−274353号)。
【0023】
本発明のポリヌクレオチドを挿入した発現ベクターを用いて宿主を形質転換するには当業者が通常用いる方法で行なえばよい。例えば、宿主として大腸菌などEscherichia属に属する微生物を選択した場合には、ヒートショック法やエレクトロポレーション法などの方法により形質転換すればよい。前記方法で得られた形質転換体から適切な方法でスクリーニングすることにより、本発明のFc結合性タンパク質を発現する形質転換体を取得することができる。前記形質転換体のスクリーニングは、例えば、Fc結合性タンパク質の抗体に対する結合活性を評価することで可能である。結合活性の評価は、例えばIgGに対する結合活性をELISA法や表面プラズモン共鳴法などを用いて測定することにより可能である。前記測定に使用するIgGは、ヒトIgGが好ましく、ヒトIgG1がより好ましい。
【0024】
本発明のFc結合性タンパク質は、前記タンパク質をコードしたポリヌクレオチド(本発明のポリヌクレオチド)を含む発現ベクターで形質転換された宿主(形質転換体)を培養することで製造することができる。本発明のFc結合性タンパク質の製造方法で用いる形質転換体は、対象宿主の培養に適した培地で培養すればよく、宿主が大腸菌の場合は、必要な栄養源を補ったLB(Luria−Bertani)培地が好ましい培地の一例としてあげることができる。なお、発現ベクターを保持する形質転換体を安定に培養するためには、発現ベクターに挿入されている薬剤耐性遺伝子に対応した薬剤を培地中に添加して培養すると好ましい。培養温度は宿主が大腸菌の場合、10℃から40℃、好ましくは25℃から37℃、より好ましくは30℃前後であるが、発現させるFc結合性タンパク質の特性により選択すればよい。培地のpHは宿主が大腸菌の場合、pH6.8からpH7.4、好ましくはpH7.0前後である。
【0025】
本発明のポリヌクレオチドを含む発現ベクターに誘導性のプロモータを含んでいる場合は、本発明のFc結合性タンパク質を含むポリペプチドが良好に発現できるような条件下で誘導すればよい。誘導剤としてはIPTG(isopropyl−β−D−thiogalactopyranoside)が例示できる。宿主が大腸菌の場合、培養液の濁度(600nmにおける吸光度)を測定後、その値が約0.5となったときに適当量のIPTGを添加し、引き続き培養することで、本発明のFc結合性タンパク質の発現を誘導することができる。IPTGの添加濃度は終濃度0.005から1.0mMが好ましく、より好ましくは終濃度0.01から0.5mMである。IPTG誘導に関する種々の条件は当該技術分野において周知の条件で行なえばよい。
【0026】
本発明の形質転換体の培養液から本発明のFc結合性タンパク質を抽出するには、発現の形態によって適宜抽出方法を選択すればよく、培養上清に発現する場合は菌体を遠心分離操作によって分離し、得られる培養上清からFc結合性タンパク質を抽出すればよい。一方、細胞内(原核生物においてはペリプラズムも含む)に発現する場合には、遠心分離操作により集菌した後、超音波または酵素処理剤もしくは界面活性剤などを添加することにより菌体を破砕して、Fc結合性タンパク質を抽出すればよい。
【0027】
本発明のFc結合性タンパク質を含む抽出物から本発明のFc結合性タンパク質を分離・精製するには、当該技術分野において公知の方法を用いればよい。一例として、液体クロマトグラフィーを用いた分離・精製があげられる。液体クロマトグラフィーとしては、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、アフィニティークロマトグラフィーなどがあげられる。これらのクロマトグラフィーを組み合わせて精製操作を行なうことによって、本発明のFc結合性タンパク質を高純度に調製することができる。
【発明の効果】
【0028】
本発明のFc結合性タンパク質は、ヒトFcγRIの細胞外領域(Fc結合性タンパク質)が有する3つのドメインのうち、少なくともN末端側の第1のドメインと第2のドメインを含むタンパク質であり、具体的には、
(1)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含む、Fc結合性タンパク質、または
(2)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含み、かつ前記アミノ酸のうちの一つ以上が他のアミノ酸に置換された、Fc結合性タンパク質、
である。本発明のFc結合性タンパク質は、これまでFcγRIが高度な親和性、抗体選択性を備えている原因として考えられた、Fc結合性タンパク質のC末端側にある第3ドメインが欠失しているが、Fc結合性タンパク質が有する抗体に対する高い結合親和性は保持しており、タンパク質分子の小型化にも成功している。そのため、遺伝子工学的手法を用いてFc結合性タンパク質を製造する際、安定したタンパク質製造が可能となり、製造したFc結合性タンパク質の抗体検出試薬等への利用性を高めることができる。
【図面の簡単な説明】
【0029】
【図1】ヒトFcγRIの構造を示す図である。
【図2】プラスミドpETMalEの作製方法および構造を示す図である。
【図3】プラスミドpETFcRの作製方法および構造を示す図である。
【図4】プラスミドpETsFcRの作製方法および構造を示す図である。
【図5】野生型Fc結合性タンパク質および小型化Fc結合性タンパク質(本発明のFc結合性タンパク質)のヒトIgG各サブクラスへの結合選択性を示した図である。
【図6】野生型Fc結合性タンパク質および小型化Fc結合性タンパク質(本発明のFc結合性タンパク質)の分子量を確認した図である。
【図7】小型化Fc結合性タンパク質(本発明のFc結合性タンパク質)のヒトIgGへの親和性を評価した図である。
【実施例】
【0030】
以下、実施例をあげて本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0031】
実施例1
シグナルペプチドをコードするポリヌクレオチドを挿入したプラスミドを以下の方法で調製した。
(1)配列番号1(MKIKTGARILALSALTTMMFSASALA)に記載のアミノ酸配列からなる、MalEシグナルペプチドをコードするポリヌクレオチドを作製するために、配列番号2(5’−TATA[CATATG]AAAATAAAAACAGGTGCACGCATCC−3’;角かっこ内の塩基は制限酵素NdeIサイト)に記載の配列からなるオリゴヌクレオチド、配列番号3(5’−GCATTAACGACGATGATGTTTTCCGCCTCGGCTCTCGCC−3’)に記載の配列からなるオリゴヌクレオチド、配列番号4(5’−ATCGTCGTTAATGCGGATAATGCGAGGATGCGTGCACCTG−3’)に記載の配列からなるオリゴヌクレオチド、および配列番号5(5’−TTGTC[CCATGG]CTTCTTCGATTTTGGCGAGAGCCG−3’;角かっこ内の塩基は制限酵素NcoIサイト)に記載の配列からなるオリゴヌクレオチドを、それぞれPCR法により連結した。PCR反応は表1に示す反応液を用い、98℃で10秒間の第1ステップ、55℃で5秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を5サイクル行なった。
【0032】
【表1】

なお、表1に記載のオリゴヌクレオチドミックスは、50pmoL/μLの前記4種類(配列番号2から5に記載の配列からなるオリゴヌクレオチド)の合成オリゴヌクレオチド溶液を、同量ずつ採取し混合した溶液を指す。
(2)(1)のPCR産物を鋳型とし、PCRプライマーとして配列番号2および配列番号5に記載の配列からなる各オリゴヌクレオチドを用いた他は、表1に記載の反応液と同じ組成を用い、98℃で10秒間の第1ステップ、55℃で5秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を30サイクル行なうPCR反応により、MalEシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)で作製したMalEシグナルペプチドをコードするポリヌクレオチドを、制限酵素NdeIとNcoIで消化した。前記消化物を、あらかじめ制限酵素NdeIとNcoIで消化したpET26b(+)プラスミドベクター(Novagen社製)にライゲーションし、ヒートショック法により大腸菌(E.coli) JM109株(タカラバイオ社製)を形質転換した。
(4)得られた形質転換体を50μg/mLのカナマイシンを含むLB培地で培養し、形質転換体よりプラスミドDNAを抽出することで、プラスミドpETMalEを調製した。pETMalE作製方法の概略およびpETMalEの構造を図2に示す。
【0033】
実施例2
実施例1で調製したプラスミドに挿入するFc結合性タンパク質をコードするポリヌクレオチドを調製した。
(1)野生型Fc結合性タンパク質として、配列番号6に記載のヒトFc受容体FcγRIのアミノ酸配列のうち、16番目のグルタミンから289番目のバリンまでのアミノ酸からなるタンパク質を選択し、前記タンパク質をコードするポリヌクレオチドを大腸菌のコドンを用いて変換し設計した。前記設計したポリヌクレオチド配列を配列番号7に示す。
(2)配列番号7に記載の配列からなるポリヌクレオチドを作製するための、合成オリゴヌクレオチドを作製した。作製したオリゴヌクレオチドの配列を配列番号8から45に示す。
(3)(2)で作製した合成オリゴヌクレオチドから、下記に示す2段階のPCRを行なうことで、野生型Fc結合性タンパク質をコードするポリヌクレオチドを作製した。
(3−1)1段階目のPCR反応は、表2に示す反応液を用い、94℃で5分間熱処理後、94℃で30秒間の第1ステップ、62℃で30秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を25サイクル行ない、最後に72℃で7分間熱処理することで行なった。
【0034】
【表2】

なお、表2に記載のオリゴヌクレオチドミックスは、50pmoL/μLの38種類(配列番号8から45に記載の配列からなるオリゴヌクレオチド)の合成オリゴヌクレオチド溶液を同量ずつ採取し混合した溶液を指す。
(3−2)2段階目のPCR反応は、表3に示す反応液を用い、94℃で5分間熱処理後、94℃で30秒間の第1ステップ、65℃で30秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を25サイクル行ない、最後に72℃で7分間熱処理することで行なった。
【0035】
【表3】

なお、表3に示す組成のうち、鋳型は1段階目のPCR産物を用い、PCRプライマーは配列番号46(5’−TCAG[CCATGG]GACAAGTAGATACCACCAAAGCTGTGATTA−3’;角かっこ内は制限酵素NcoIサイト)に記載の配列からなるオリゴヌクレオチドおよび配列番号47(5’−CC[AAGCTT]AATGATGATGATGATGATGGACCGGGGTCGGCAGTTGAAGACCCAG−3’;角かっこ内は制限酵素HindIIIサイト)に記載の配列からなるオリゴヌクレオチドを用いた。なお、配列番号47に記載の配列からなるPCRプライマーは、野生型Fc結合性タンパク質のC末端側に検出用のタグである6個のヒスチジン(His)が付加するよう設計している。
(4)(3−2)でのPCR産物をアガロースゲルを用いて抽出精製(QIAquick Gel extraction kit:キアゲン社製)し、野生型Fc結合性タンパク質をコードするポリヌクレオチドを調製した。
【0036】
実施例3
実施例1で調製したプラスミドと、実施例2で調製したFc結合性タンパク質をコードするポリヌクレオチドから、Fc結合性タンパク質発現プラスミドを調製した。
(1)実施例1で調製したpETMalEベクターと、実施例2で調製した野生型Fc結合性タンパク質をコードするポリヌクレオチドを、それぞれ制限酵素NcoIとHindIIIで消化後、ライゲーションし、ヒートショック法により大腸菌(E.coli) JM109株(タカラバイオ社製)を形質転換した。
(2)得られた形質転換体を50μg/mLのカナマイシンを含むLB培地にて培養後、定法に従いプラスミドを抽出し(Qiaprep Spin Miniprep Kit:キアゲン社製)、これをpETFcR(挿入されたポリヌクレオチドによりコードされるタンパク質を以下「野生型Fc結合性タンパク質」とする)と命名した。pETFcR作製の概略およびpETFcRの構造を図3に示す。
(3)pETFcRを用いてヒートショック法により大腸菌(E.coli) BL21(DE3)株を形質転換した。
【0037】
実施例4
pETFcR(図3)に挿入されたFc結合性タンパク質をコードするポリヌクレオチドの配列をチェーンターミネータ法に基づくBig Dye Terminator Cycle Sequencing FS read Reaction kit(PEアプライドバイオシステム社製)を用いてサイクルシークエンス反応に供し、全自動DNAシークエンサーABI Prism 3700 DNA analyzer(PEアプライドバイオシステム社製)にて解析した。なお、シークエンス用プライマーとして、配列番号48(5’−TAATACGACTCACTATAGGG−3’)に記載の配列からなるオリゴヌクレオチドおよび配列番号49(5’−TATGCTAGTTATTGCTCAG−3’)に記載の配列からなるオリゴヌクレオチドを用いた。解析の結果、pETFcRに挿入されたFc結合性タンパク質をコードするポリヌクレオチドの配列は設計通りであることを確認した。
【0038】
実施例5
実施例1で調製したプラスミドと、本発明のFc結合性タンパク質をコードするポリヌクレオチドから、Fc結合性タンパク質発現プラスミドを調製した。
(1)実施例3で調製したプラスミドpETFcRを鋳型として、表4に示す反応液を用い、PCR反応を、98℃で5分間熱処理後、98℃で10秒間の第1ステップ、55℃で5秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を30サイクル行ない、最後に72℃で5分間熱処理することで行なった。
【0039】
【表4】

なお、表4に示す組成のうち、PCRプライマーは配列番号46に記載の配列からなるオリゴヌクレオチドおよび配列番号50(5’−CCG[CTCGAG]GCTGCCGCCAAACAGTTCTTTGACGG−3’;角かっこ内は制限酵素XhoIサイト)に記載の配列からなるオリゴヌクレオチドを用いた。
(2)(1)のPCR産物をアガロースゲルを用いて抽出精製(QIAquick Gel extraction kit:キアゲン社製)し、ポリヌクレオチドを調製した。
(3)精製したポリヌクレオチドと、実施例1に調製したプラスミドpETMalEとを制限酵素NcoIおよびXhoIで消化し、ライゲーション後、ヒートショック法により大腸菌(E.coli) JM109株(タカラバイオ社製)を形質転換した。
(4)得られた形質転換体を50μg/mLのカナマイシンを含むLB培地にて培養後、定法に従いプラスミドを抽出し(Qiaprep Spin Miniprep Kit:キアゲン社製)、これをpETsFcRと命名した。プラスミドpETsFcR作製の概略とpETsFcRの構造を図4に示す。
【0040】
pETsFcRを実施例4に記載の方法で配列確認を行なったところ、挿入したFc結合性タンパク質をコードするポリヌクレオチドの配列は設計通りであることを確認した。pETsFcRのうち、配列番号1に記載のアミノ酸配列からなるMalEシグナルペプチドおよび配列番号52に記載のアミノ酸配列からなる本発明のFc結合性タンパク質を含むタンパク質(以下「小型化Fc結合性タンパク質」とする)をコードするポリヌクレオチドの配列を配列番号51に示す。配列番号51の詳細は、1番目から78番目の塩基が配列番号1に記載のアミノ酸配列からなるMalEシグナルペプチドをコードする配列、79番目から99番目までの塩基がリンカー配列、100番目から621番目までの塩基が配列番号52に記載のアミノ酸配列からなる本発明のFc結合性タンパク質をコードする配列、622番目から630番目までの塩基がリンカー配列、である。なお、検出用のタグとしてpETMalE由来の6個のヒスチジン(His)タグを使用している。配列確認を行なったpETsFcRを用いて、ヒートショック法により大腸菌(E.coli) BL21(DE3)株を形質転換した。
【0041】
実施例6
実施例3で調製したプラスミドpETFcR形質転換体、および実施例5で調製したプラスミドpETsFcR形質転換体を用いてFc結合性タンパク質を発現させた。
(1)pETFcR(図3)またはpETsFcR(図4)により、それぞれ形質転換された大腸菌(E.coli) BL21(DE3)株を、50μg/mLのカナマイシンを含むLB培地で培養(37℃で18時間)後、再調製した50μg/mLのカナマイシンを添加したLB培地(800mL)に前記培養液8mLを植菌した。
(2)培養液の濁度(600nmにおける吸光度)の値が1.0から2.0になった時点で培養温度を15℃に切り替え、IPTGを終濃度0.1mMとなるように培養液に添加後、さらに20時間培養した。
(3)培養液から遠心分離操作により菌体を集菌し、150mMのNaClを含む20mMのTris−HCl緩衝液(pH8.0)に懸濁した後、超音波破砕にて菌体からタンパク質を抽出し、遠心操作にて上清を回収した。
(4)回収した上清に終濃度で20から50mMとなるようイミダゾールを加え、あらかじめ150mMのNaClを含む20mMのTris−HCl緩衝液(pH8.0)で平衡化したニッケルキレートカラム(His・Bind Resin:Novagen社製)にアプライ後、150mMのNaClを含む20mMのTris−HCl緩衝液(pH8.0)で洗浄し、500mMのイミダゾールと10%のグリセリンを含む20mMのTris−HCl緩衝液(pH8.0)を用いてタンパク質を溶出させた。
【0042】
実施例7
実施例6に記載の方法で精製した、野生型Fc結合性タンパク質または小型化Fc結合性タンパク質の、ヒトIgG各サブクラス(IgG1、IgG2、IgG3、IgG4)への結合活性を、以下に記載するELISA法により評価した。
(1)ヒトIgGのサブクラスであるIgG1、IgG2、IgG3、IgG4(シグマアルドリッチ社製)を、96穴マイクロプレートのウェルに1μg/wellの濃度で固定した(4℃、18時間)。
(2)固定化終了後、2%のスキムミルクを含んだ50mMのTris−HCl緩衝液(pH8.0)によりブロッキングした。
(3)洗浄緩衝液(0.2%(w/v)のTween 20と150mMのNaClを含む10mMのTris−HCl緩衝液(pH8.0))で洗浄後、調製したタンパク質溶液を50mMのTris−HCl緩衝液(pH8.0)で適宜希釈し、固定化ガンマグロブリンと反応させた(30℃で1時間)。
(4)反応終了後、前記洗浄緩衝液で再度洗浄し、Horse radish Peroxidase(HRP)標識の抗His−Tag抗体試薬(BETHYL社製)を10000倍希釈し100μL/wellで添加した。
(5)30℃で1時間反応後、前記洗浄緩衝液で洗浄し、TMB Peroxidase Substrate(KPL社製)を添加し発色後、1Mのリン酸溶液で反応を停止させ450nmの吸光度を測定した。
【0043】
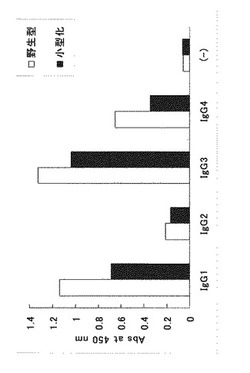
測定結果を図5に示す。図中、X軸(横軸)はIgGサブクラスを示し、Y軸(縦軸)は、450nmの吸光度(単位は任意)であり抗体結合活性を示す。図5に示すように、各IgGサブクラスへの反応性は、野生型Fc結合性タンパク質、小型化Fc結合性タンパク質、ともにIgG3>IgG1>IgG4>>IgG2という反応性を示した。したがって、本発明のFc結合性タンパク質である小型化Fc結合性タンパク質は、IgGへの結合に関して野生型Fc結合性タンパク質と同等の性能を有しているといえる。
【0044】
実施例8
小型化Fc結合性タンパク質の分子量を確認するため、下記に示すWestern Blottingを行なった。
(1)実施例6に記載の方法で精製した、野生型Fc結合性タンパク質または小型化Fc結合性タンパク質を還元処理し、SDS−PAGEにて分離した。
(2)SDS−PAGE後、PVDF膜(GEヘルスケア社製)に転写し、転写されたPVDF膜を5%のスキムミルクを含んだ50mMのTris−HCl緩衝液(pH8.0)によりブロッキングした。
(3)洗浄緩衝液(0.2%(w/v)のTween 20と150mMのNaClを含む10mMのTris−HCl緩衝液(pH8.0))で洗浄後、Horse radish Peroxidase(HRP)標識の抗His−Tag抗体試薬(BETHYL社製)を反応させた(室温で1時間)。
(4)反応終了後、前記洗浄緩衝液で再度洗浄し、検出用試薬(ECL Plus:GEヘルスケア社製)を使用し検出を行なった。
【0045】
測定結果を図6に示す。図中のMはマーカー、APは実施例6においてカラムにアプライした試料、FTはカラム通過画分、Fr1からFr4はカラム溶出画分を示す。アミノ酸組成から計算される分子量は野生型Fc結合性タンパク質が約32kDa、小型化Fc結合性タンパク質が約21kDaであるが、図6の結果より、野生型Fc結合性タンパク質が約30kDaの位置、小型化Fc結合性タンパク質が約20kDaの位置に、それぞれバンドを確認できた。よって、本発明のFc結合性タンパク質である小型化Fc結合性タンパク質が、確かに野生型Fc結合性タンパク質よりも分子量が小さいことが判明した。
【0046】
実施例9
小型化Fc結合性タンパク質のヒトIgG1に対する結合親和性を、BIAcoreT100(GEヘルスケア社製)による表面プラズモン共鳴法を用いて測定した。
(1)実施例6に記載の方法で精製した小型化Fc結合性タンパク質を、150mMのNaClと3mMのEDTAを含む10mMのHEPES緩衝液(pH7.4)で透析した。
(2)透析後の小型化Fc結合タンパク質をHBS−EP+緩衝液(150mMのNaCl、3mMのEDTA、0.05%(v/v)のSurfactant P20を含む10mMのHEPES緩衝液(pH7.4))にて、4.2nMから希釈系列を作製した。
(3)(2)で作製した希釈系列を、2730.5RUのヒトIgG1(シグマアルドリッチ社製)を固定化したセンサーチップ(CM5)を用いて、Fc結合性タンパク質とヒトIgG1の相互作用を解析した。
【0047】
解析した結果を図7に示す。小型化Fc結合性タンパク質の結合速度定数(ka)は7.4×106(1/Ms)、解離速度定数(kd)は8.2×10−4(1/s)、平衡解離定数(KD)は1.1×10−10(M)であり、野生型Fc結合性タンパク質の平衡解離定数(KD):10−10(M)(非特許文献2)と同等の高い結合親和性を有することが判明した。
【技術分野】
【0001】
本発明は、ヒト抗体に対する結合親和性の高いタンパク質、および遺伝子工学的手法を用いた前記タンパク質の製造方法に関する。
【背景技術】
【0002】
抗体は、医薬品、研究試薬等に幅広く利用され、特に医療分野においては必須な物質として認識されている。抗体利用の拡大から、抗体を認識し結合する物質の需要も増加している。中でも、ヒトFc受容体(以下、単に「FcR」と略記する)は、ヒト抗体IgGに対する結合親和性が高いため、産業上の応用が試みられている(特許文献1)。
【0003】
FcRには、抗体との複合体形成後の機能および構造上の分類からFcγRI、FcγRIIa、FcγRIIb、FcγRIIIのサブクラスが存在する。これらのFcRは免疫細胞の表面に存在し、抗体と結合し複合体を形成することにより、免疫細胞内にシグナルが伝達されるなど、免疫機構の中核を担うタンパク質である。FcRサブクラス間のアミノ酸配列の相同性は非常に高く、抗体との複合体形成において、実際に抗体と相互作用するアミノ酸位置の推測も可能であるとされている。一方で、FcRサブクラスの一つであるFcγRIの細胞外領域(以下、「Fc結合性タンパク質」とする)には、他のFcRには存在しない3つ目のドメインがC末端側に存在しており(非特許文献1および2)、この3つ目のドメインが存在することで、FcγRIが高度な親和性、抗体選択性を備えていると考えられている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2002−531086号公報
【特許文献2】特開2008−245580号公報
【非特許文献】
【0005】
【非特許文献1】J.M.Allen等,Science,243,378,1989
【非特許文献2】A.Paetz等,Biochem.Biophys.Res.Commun.,338,1811,2005
【発明の概要】
【発明が解決しようとする課題】
【0006】
抗体検出試薬等に使用する目的でFc結合性タンパク質を製造・使用する際、従来はFc結合性タンパク質が有する3つのドメインすべて含むタンパク質として発現(製造)し、使用してきた(特許文献2)。しかしながら、Fc結合性タンパク質の発現量は低く、また安定性等についても課題を有していた。
【0007】
そこで本発明は、Fc結合性タンパク質が有する抗体への親和性を保持したまま、安定製造が可能なタンパク質、および遺伝子工学的手法を用いた前記タンパク質の製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは上記の課題を解決すべく鋭意検討した結果、FcγRIの細胞外領域(Fc結合性タンパク質)を構成する3つのドメインのうち、これまでFcγRIが高度な親和性、抗体選択性を備えている原因として考えられた、C末端側の第3ドメインを削除しても(すなわちN末端側の第1ドメインと第2ドメインのみであっても)、抗体への高い親和性を有していることを見出し、本発明の完成に至った。
【0009】
すなわち、本発明は、以下の態様を包含する:
(1)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含む、Fc結合性タンパク質。
【0010】
(2)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含み、かつ前記アミノ酸のうちの一つ以上が他のアミノ酸に置換された、Fc結合性タンパク質。
【0011】
(3)(1)または(2)に記載のアミノ酸配列をコードするポリヌクレオチド。
【0012】
(4)配列番号7に記載のヌクレオチド配列のうち、1番目から522番目までのヌクレオチドからなるポリヌクレオチド。
【0013】
(5)(3)または(4)に記載のポリヌクレオチドを含む、Fc結合性タンパク質を発現させるためのベクター。
【0014】
(6)(5)に記載のベクターを用いて宿主を形質転換して得られる、形質転換体。
【0015】
(7)宿主が大腸菌である、(6)に記載の形質転換体。
【0016】
(8)(6)または(7)に記載の形質転換体を用いた、Fc結合性タンパク質の製造方法。
【0017】
以下、本発明について詳細に説明する。
【0018】
ヒトFcγRIは、図1に示すように、N末端側から、15アミノ酸からなるシグナルペプチド領域(SS、配列番号6に記載のアミノ酸配列のうち1番目から15番目までの領域)、277アミノ酸からなる細胞外領域(EC、配列番号6に記載のアミノ酸配列のうち16番目から292番目までの領域)、21アミノ酸からなる細胞膜貫通領域(TM、配列番号6に記載のアミノ酸配列のうち293番目から313番目までの領域)、61アミノ酸からなる細胞内領域(C、配列番号6に記載のアミノ酸配列のうち314番目から374番目までの領域)、から構成される。またヒトFcγRIの細胞外領域(Fc結合性タンパク質)は、公的データベース(UniProtKB/Swiss−Prot No.P12314)より、さらにN末端側から第1ドメイン(配列番号6に記載のアミノ酸配列のうち22番目から101番目までの領域)、第2ドメイン(配列番号6に記載のアミノ酸配列のうち95番目から184番目までの領域)、第3ドメイン(配列番号6に記載のアミノ酸配列のうち190番目から277番目までの領域)を有していることが知られている。
【0019】
本発明のFc結合性タンパク質は、Fc結合性タンパク質(ヒトFcγRIの細胞外領域)(配列番号6に記載のアミノ酸配列のうち16番目から292番目までの領域)の一部領域である、配列番号52(配列番号6に記載のアミノ酸配列のうち16番目から189番目までの領域)に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸(すなわち第1ドメインおよび第2ドメインの領域)を含むタンパク質である。なお、本発明のFc結合性タンパク質を構成するアミノ酸のうちの一つ以上が他のアミノ酸に置換されたタンパク質も、本発明のFc結合性タンパク質に含まれる。前記タンパク質の一態様として、配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含むタンパク質であって、
(ア)配列番号52の10番目のスレオニンがリジンに置換
(イ)配列番号52の23番目のスレオニンがアラニンまたはセリンに置換
(ウ)配列番号52の31番目のロイシンがアルギニンまたはプロリンに置換
(エ)配列番号52の47番目のアラニンがバリンに置換
(オ)配列番号52の48番目のスレオニンがイソロイシンに置換
(カ)配列番号52の54番目のセリンがフェニルアラニンまたはスレオニンに置換
(キ)配列番号52の56番目のアルギニンがヒスチジンに置換
(ク)配列番号52の62番目のバリンがアラニンまたはグルタミン酸に置換
(ケ)配列番号52の63番目のアスパラギンがアスパラギン酸に置換
(コ)配列番号52の79番目のアスパラギン酸がグルタミン酸に置換
(サ)配列番号52の85番目のイソロイシンがバリンに置換
(シ)配列番号52の95番目のセリンがアスパラギンに置換
(ス)配列番号52の99番目のフェニルアラニンがロイシンに置換
(セ)配列番号52の110番目のヒスチジンがアルギニンに置換
(ソ)配列番号52の116番目のロイシンがアルギニンまたはプロリンに置換
(タ)配列番号52の134番目のトリプトファンがロイシンに置換
(チ)配列番号52の141番目のロイシンがプロリンに置換
(ツ)配列番号52の145番目のイソロイシンがメチオニンに置換
(テ)配列番号52の148番目のアスパラギンがセリンに置換
のいずれかのアミノ酸置換を一つ以上含む、タンパク質があげられる(特願2010−052789号)。また、ポリヒスチジンタグといった精製などを行なうためのタグペプチドを本発明のFc結合性タンパク質のN末端側またはC末端側に付加しても、本発明のFc結合性タンパク質に含まれる。
【0020】
本発明のFc結合性タンパク質をコードするポリヌクレオチド(以下、単に「本発明のポリヌクレオチド」とする)の作製方法として、
(I)本発明のFc結合性タンパク質のアミノ酸配列からヌクレオチド配列に変換し、前記ヌクレオチド配列を含むポリヌクレオチドを人工的に合成して作製する方法や、
(II)ヒトFcγRIの全体または部分配列を含むポリヌクレオチドを直接人工的に、またはヒトFcγRIのcDNAなどからPCR法といったDNA増幅法を用いて調製し、調製した前記ポリヌクレオチドを適当な方法で連結し作製する方法、
を例示することができる。なお、アミノ酸配列からヌクレオチド配列に変換する際は、形質転換させる宿主におけるコドンの使用頻度を考慮して変換するのが好ましい。一例として、宿主が大腸菌(Escherichia coli)の場合は、アルギニン(Arg)ではAGA/AGG/CGG/CGAが、イソロイシン(Ile)ではATAが、ロイシン(Leu)ではCTAが、グリシン(Gly)ではGGAが、プロリン(Pro)ではCCCが、それぞれ使用頻度が少ないため(いわゆるレアコドンであるため)、それらのコドンを避けるように変換すればよい。コドンの使用頻度の解析は公的データベース(例えば、かずさDNA研究所のホームページにあるCodon Usage Databaseなど)を利用することによっても可能である。大腸菌のコドン使用頻度を基に、本発明のFc結合性タンパク質のアミノ酸配列からヌクレオチド配列に変換した例として、配列番号52に記載のアミノ酸配列から変換した、配列番号7に記載のヌクレオチド配列のうち1番目から522番目までのヌクレオチドからなるポリヌクレオチドがあげられる。
【0021】
なお、前記(I)または(II)の方法で作製した本発明のポリヌクレオチドの5’末端側にシグナルペプチドをコードするポリヌクレオチドを付加してもよく、宿主が大腸菌の場合は、前記シグナルペプチドとしてpelB(UniProt No.P0C1C1の1番目から22番目までの領域)、DsbA(UniProt No.P0AEG4の1から19番目までの領域)、MalE(UniProt No.P0AEX9の1番目から26番目までの領域、配列番号1)、TorT(UniProt No.P38683の1番目から18番目の領域)といったペリプラズムにタンパク質を分泌させるシグナルペプチドをあげることができる(特願2009−256180号)。
【0022】
本発明のポリヌクレオチドを用いて宿主を形質転換する際は、本発明のポリヌクレオチドそのものを用いてもよいが、発現ベクター(例えば、原核細胞や真核細胞の形質転換に通常用いるバクテリオファージ、コスミドやプラスミドなど)の適切な位置に本発明のポリヌクレオチドを挿入したものを用いると、より好ましい。なお、前記発現ベクターは、形質転換する宿主内で安定に存在し複製できるものであれば特に制限はなく、大腸菌を宿主とする場合は、pETプラスミド、pUCプラスミド、pTrc99aプラスミド、pCDFプラスミド、pBBRプラスミドなどを例示することができる。なお、前記発現ベクターに本発明のポリヌクレオチドを挿入する際、本発明のポリヌクレオチドを複数連結した状態(連結部分にリンカーペプチドをコードするポリヌクレオチドを含んでもよい)で挿入してもよく、複数連結した状態で挿入することにより、形質転換体による本発明のFc結合性タンパク質生産性の向上が期待できる(特願2009−274352号、特願2009−274353号)。
【0023】
本発明のポリヌクレオチドを挿入した発現ベクターを用いて宿主を形質転換するには当業者が通常用いる方法で行なえばよい。例えば、宿主として大腸菌などEscherichia属に属する微生物を選択した場合には、ヒートショック法やエレクトロポレーション法などの方法により形質転換すればよい。前記方法で得られた形質転換体から適切な方法でスクリーニングすることにより、本発明のFc結合性タンパク質を発現する形質転換体を取得することができる。前記形質転換体のスクリーニングは、例えば、Fc結合性タンパク質の抗体に対する結合活性を評価することで可能である。結合活性の評価は、例えばIgGに対する結合活性をELISA法や表面プラズモン共鳴法などを用いて測定することにより可能である。前記測定に使用するIgGは、ヒトIgGが好ましく、ヒトIgG1がより好ましい。
【0024】
本発明のFc結合性タンパク質は、前記タンパク質をコードしたポリヌクレオチド(本発明のポリヌクレオチド)を含む発現ベクターで形質転換された宿主(形質転換体)を培養することで製造することができる。本発明のFc結合性タンパク質の製造方法で用いる形質転換体は、対象宿主の培養に適した培地で培養すればよく、宿主が大腸菌の場合は、必要な栄養源を補ったLB(Luria−Bertani)培地が好ましい培地の一例としてあげることができる。なお、発現ベクターを保持する形質転換体を安定に培養するためには、発現ベクターに挿入されている薬剤耐性遺伝子に対応した薬剤を培地中に添加して培養すると好ましい。培養温度は宿主が大腸菌の場合、10℃から40℃、好ましくは25℃から37℃、より好ましくは30℃前後であるが、発現させるFc結合性タンパク質の特性により選択すればよい。培地のpHは宿主が大腸菌の場合、pH6.8からpH7.4、好ましくはpH7.0前後である。
【0025】
本発明のポリヌクレオチドを含む発現ベクターに誘導性のプロモータを含んでいる場合は、本発明のFc結合性タンパク質を含むポリペプチドが良好に発現できるような条件下で誘導すればよい。誘導剤としてはIPTG(isopropyl−β−D−thiogalactopyranoside)が例示できる。宿主が大腸菌の場合、培養液の濁度(600nmにおける吸光度)を測定後、その値が約0.5となったときに適当量のIPTGを添加し、引き続き培養することで、本発明のFc結合性タンパク質の発現を誘導することができる。IPTGの添加濃度は終濃度0.005から1.0mMが好ましく、より好ましくは終濃度0.01から0.5mMである。IPTG誘導に関する種々の条件は当該技術分野において周知の条件で行なえばよい。
【0026】
本発明の形質転換体の培養液から本発明のFc結合性タンパク質を抽出するには、発現の形態によって適宜抽出方法を選択すればよく、培養上清に発現する場合は菌体を遠心分離操作によって分離し、得られる培養上清からFc結合性タンパク質を抽出すればよい。一方、細胞内(原核生物においてはペリプラズムも含む)に発現する場合には、遠心分離操作により集菌した後、超音波または酵素処理剤もしくは界面活性剤などを添加することにより菌体を破砕して、Fc結合性タンパク質を抽出すればよい。
【0027】
本発明のFc結合性タンパク質を含む抽出物から本発明のFc結合性タンパク質を分離・精製するには、当該技術分野において公知の方法を用いればよい。一例として、液体クロマトグラフィーを用いた分離・精製があげられる。液体クロマトグラフィーとしては、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、アフィニティークロマトグラフィーなどがあげられる。これらのクロマトグラフィーを組み合わせて精製操作を行なうことによって、本発明のFc結合性タンパク質を高純度に調製することができる。
【発明の効果】
【0028】
本発明のFc結合性タンパク質は、ヒトFcγRIの細胞外領域(Fc結合性タンパク質)が有する3つのドメインのうち、少なくともN末端側の第1のドメインと第2のドメインを含むタンパク質であり、具体的には、
(1)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含む、Fc結合性タンパク質、または
(2)配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含み、かつ前記アミノ酸のうちの一つ以上が他のアミノ酸に置換された、Fc結合性タンパク質、
である。本発明のFc結合性タンパク質は、これまでFcγRIが高度な親和性、抗体選択性を備えている原因として考えられた、Fc結合性タンパク質のC末端側にある第3ドメインが欠失しているが、Fc結合性タンパク質が有する抗体に対する高い結合親和性は保持しており、タンパク質分子の小型化にも成功している。そのため、遺伝子工学的手法を用いてFc結合性タンパク質を製造する際、安定したタンパク質製造が可能となり、製造したFc結合性タンパク質の抗体検出試薬等への利用性を高めることができる。
【図面の簡単な説明】
【0029】
【図1】ヒトFcγRIの構造を示す図である。
【図2】プラスミドpETMalEの作製方法および構造を示す図である。
【図3】プラスミドpETFcRの作製方法および構造を示す図である。
【図4】プラスミドpETsFcRの作製方法および構造を示す図である。
【図5】野生型Fc結合性タンパク質および小型化Fc結合性タンパク質(本発明のFc結合性タンパク質)のヒトIgG各サブクラスへの結合選択性を示した図である。
【図6】野生型Fc結合性タンパク質および小型化Fc結合性タンパク質(本発明のFc結合性タンパク質)の分子量を確認した図である。
【図7】小型化Fc結合性タンパク質(本発明のFc結合性タンパク質)のヒトIgGへの親和性を評価した図である。
【実施例】
【0030】
以下、実施例をあげて本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0031】
実施例1
シグナルペプチドをコードするポリヌクレオチドを挿入したプラスミドを以下の方法で調製した。
(1)配列番号1(MKIKTGARILALSALTTMMFSASALA)に記載のアミノ酸配列からなる、MalEシグナルペプチドをコードするポリヌクレオチドを作製するために、配列番号2(5’−TATA[CATATG]AAAATAAAAACAGGTGCACGCATCC−3’;角かっこ内の塩基は制限酵素NdeIサイト)に記載の配列からなるオリゴヌクレオチド、配列番号3(5’−GCATTAACGACGATGATGTTTTCCGCCTCGGCTCTCGCC−3’)に記載の配列からなるオリゴヌクレオチド、配列番号4(5’−ATCGTCGTTAATGCGGATAATGCGAGGATGCGTGCACCTG−3’)に記載の配列からなるオリゴヌクレオチド、および配列番号5(5’−TTGTC[CCATGG]CTTCTTCGATTTTGGCGAGAGCCG−3’;角かっこ内の塩基は制限酵素NcoIサイト)に記載の配列からなるオリゴヌクレオチドを、それぞれPCR法により連結した。PCR反応は表1に示す反応液を用い、98℃で10秒間の第1ステップ、55℃で5秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を5サイクル行なった。
【0032】
【表1】

なお、表1に記載のオリゴヌクレオチドミックスは、50pmoL/μLの前記4種類(配列番号2から5に記載の配列からなるオリゴヌクレオチド)の合成オリゴヌクレオチド溶液を、同量ずつ採取し混合した溶液を指す。
(2)(1)のPCR産物を鋳型とし、PCRプライマーとして配列番号2および配列番号5に記載の配列からなる各オリゴヌクレオチドを用いた他は、表1に記載の反応液と同じ組成を用い、98℃で10秒間の第1ステップ、55℃で5秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を30サイクル行なうPCR反応により、MalEシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)で作製したMalEシグナルペプチドをコードするポリヌクレオチドを、制限酵素NdeIとNcoIで消化した。前記消化物を、あらかじめ制限酵素NdeIとNcoIで消化したpET26b(+)プラスミドベクター(Novagen社製)にライゲーションし、ヒートショック法により大腸菌(E.coli) JM109株(タカラバイオ社製)を形質転換した。
(4)得られた形質転換体を50μg/mLのカナマイシンを含むLB培地で培養し、形質転換体よりプラスミドDNAを抽出することで、プラスミドpETMalEを調製した。pETMalE作製方法の概略およびpETMalEの構造を図2に示す。
【0033】
実施例2
実施例1で調製したプラスミドに挿入するFc結合性タンパク質をコードするポリヌクレオチドを調製した。
(1)野生型Fc結合性タンパク質として、配列番号6に記載のヒトFc受容体FcγRIのアミノ酸配列のうち、16番目のグルタミンから289番目のバリンまでのアミノ酸からなるタンパク質を選択し、前記タンパク質をコードするポリヌクレオチドを大腸菌のコドンを用いて変換し設計した。前記設計したポリヌクレオチド配列を配列番号7に示す。
(2)配列番号7に記載の配列からなるポリヌクレオチドを作製するための、合成オリゴヌクレオチドを作製した。作製したオリゴヌクレオチドの配列を配列番号8から45に示す。
(3)(2)で作製した合成オリゴヌクレオチドから、下記に示す2段階のPCRを行なうことで、野生型Fc結合性タンパク質をコードするポリヌクレオチドを作製した。
(3−1)1段階目のPCR反応は、表2に示す反応液を用い、94℃で5分間熱処理後、94℃で30秒間の第1ステップ、62℃で30秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を25サイクル行ない、最後に72℃で7分間熱処理することで行なった。
【0034】
【表2】

なお、表2に記載のオリゴヌクレオチドミックスは、50pmoL/μLの38種類(配列番号8から45に記載の配列からなるオリゴヌクレオチド)の合成オリゴヌクレオチド溶液を同量ずつ採取し混合した溶液を指す。
(3−2)2段階目のPCR反応は、表3に示す反応液を用い、94℃で5分間熱処理後、94℃で30秒間の第1ステップ、65℃で30秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を25サイクル行ない、最後に72℃で7分間熱処理することで行なった。
【0035】
【表3】

なお、表3に示す組成のうち、鋳型は1段階目のPCR産物を用い、PCRプライマーは配列番号46(5’−TCAG[CCATGG]GACAAGTAGATACCACCAAAGCTGTGATTA−3’;角かっこ内は制限酵素NcoIサイト)に記載の配列からなるオリゴヌクレオチドおよび配列番号47(5’−CC[AAGCTT]AATGATGATGATGATGATGGACCGGGGTCGGCAGTTGAAGACCCAG−3’;角かっこ内は制限酵素HindIIIサイト)に記載の配列からなるオリゴヌクレオチドを用いた。なお、配列番号47に記載の配列からなるPCRプライマーは、野生型Fc結合性タンパク質のC末端側に検出用のタグである6個のヒスチジン(His)が付加するよう設計している。
(4)(3−2)でのPCR産物をアガロースゲルを用いて抽出精製(QIAquick Gel extraction kit:キアゲン社製)し、野生型Fc結合性タンパク質をコードするポリヌクレオチドを調製した。
【0036】
実施例3
実施例1で調製したプラスミドと、実施例2で調製したFc結合性タンパク質をコードするポリヌクレオチドから、Fc結合性タンパク質発現プラスミドを調製した。
(1)実施例1で調製したpETMalEベクターと、実施例2で調製した野生型Fc結合性タンパク質をコードするポリヌクレオチドを、それぞれ制限酵素NcoIとHindIIIで消化後、ライゲーションし、ヒートショック法により大腸菌(E.coli) JM109株(タカラバイオ社製)を形質転換した。
(2)得られた形質転換体を50μg/mLのカナマイシンを含むLB培地にて培養後、定法に従いプラスミドを抽出し(Qiaprep Spin Miniprep Kit:キアゲン社製)、これをpETFcR(挿入されたポリヌクレオチドによりコードされるタンパク質を以下「野生型Fc結合性タンパク質」とする)と命名した。pETFcR作製の概略およびpETFcRの構造を図3に示す。
(3)pETFcRを用いてヒートショック法により大腸菌(E.coli) BL21(DE3)株を形質転換した。
【0037】
実施例4
pETFcR(図3)に挿入されたFc結合性タンパク質をコードするポリヌクレオチドの配列をチェーンターミネータ法に基づくBig Dye Terminator Cycle Sequencing FS read Reaction kit(PEアプライドバイオシステム社製)を用いてサイクルシークエンス反応に供し、全自動DNAシークエンサーABI Prism 3700 DNA analyzer(PEアプライドバイオシステム社製)にて解析した。なお、シークエンス用プライマーとして、配列番号48(5’−TAATACGACTCACTATAGGG−3’)に記載の配列からなるオリゴヌクレオチドおよび配列番号49(5’−TATGCTAGTTATTGCTCAG−3’)に記載の配列からなるオリゴヌクレオチドを用いた。解析の結果、pETFcRに挿入されたFc結合性タンパク質をコードするポリヌクレオチドの配列は設計通りであることを確認した。
【0038】
実施例5
実施例1で調製したプラスミドと、本発明のFc結合性タンパク質をコードするポリヌクレオチドから、Fc結合性タンパク質発現プラスミドを調製した。
(1)実施例3で調製したプラスミドpETFcRを鋳型として、表4に示す反応液を用い、PCR反応を、98℃で5分間熱処理後、98℃で10秒間の第1ステップ、55℃で5秒間の第2ステップ、72℃で1分間の第3ステップを1サイクルとする反応を30サイクル行ない、最後に72℃で5分間熱処理することで行なった。
【0039】
【表4】

なお、表4に示す組成のうち、PCRプライマーは配列番号46に記載の配列からなるオリゴヌクレオチドおよび配列番号50(5’−CCG[CTCGAG]GCTGCCGCCAAACAGTTCTTTGACGG−3’;角かっこ内は制限酵素XhoIサイト)に記載の配列からなるオリゴヌクレオチドを用いた。
(2)(1)のPCR産物をアガロースゲルを用いて抽出精製(QIAquick Gel extraction kit:キアゲン社製)し、ポリヌクレオチドを調製した。
(3)精製したポリヌクレオチドと、実施例1に調製したプラスミドpETMalEとを制限酵素NcoIおよびXhoIで消化し、ライゲーション後、ヒートショック法により大腸菌(E.coli) JM109株(タカラバイオ社製)を形質転換した。
(4)得られた形質転換体を50μg/mLのカナマイシンを含むLB培地にて培養後、定法に従いプラスミドを抽出し(Qiaprep Spin Miniprep Kit:キアゲン社製)、これをpETsFcRと命名した。プラスミドpETsFcR作製の概略とpETsFcRの構造を図4に示す。
【0040】
pETsFcRを実施例4に記載の方法で配列確認を行なったところ、挿入したFc結合性タンパク質をコードするポリヌクレオチドの配列は設計通りであることを確認した。pETsFcRのうち、配列番号1に記載のアミノ酸配列からなるMalEシグナルペプチドおよび配列番号52に記載のアミノ酸配列からなる本発明のFc結合性タンパク質を含むタンパク質(以下「小型化Fc結合性タンパク質」とする)をコードするポリヌクレオチドの配列を配列番号51に示す。配列番号51の詳細は、1番目から78番目の塩基が配列番号1に記載のアミノ酸配列からなるMalEシグナルペプチドをコードする配列、79番目から99番目までの塩基がリンカー配列、100番目から621番目までの塩基が配列番号52に記載のアミノ酸配列からなる本発明のFc結合性タンパク質をコードする配列、622番目から630番目までの塩基がリンカー配列、である。なお、検出用のタグとしてpETMalE由来の6個のヒスチジン(His)タグを使用している。配列確認を行なったpETsFcRを用いて、ヒートショック法により大腸菌(E.coli) BL21(DE3)株を形質転換した。
【0041】
実施例6
実施例3で調製したプラスミドpETFcR形質転換体、および実施例5で調製したプラスミドpETsFcR形質転換体を用いてFc結合性タンパク質を発現させた。
(1)pETFcR(図3)またはpETsFcR(図4)により、それぞれ形質転換された大腸菌(E.coli) BL21(DE3)株を、50μg/mLのカナマイシンを含むLB培地で培養(37℃で18時間)後、再調製した50μg/mLのカナマイシンを添加したLB培地(800mL)に前記培養液8mLを植菌した。
(2)培養液の濁度(600nmにおける吸光度)の値が1.0から2.0になった時点で培養温度を15℃に切り替え、IPTGを終濃度0.1mMとなるように培養液に添加後、さらに20時間培養した。
(3)培養液から遠心分離操作により菌体を集菌し、150mMのNaClを含む20mMのTris−HCl緩衝液(pH8.0)に懸濁した後、超音波破砕にて菌体からタンパク質を抽出し、遠心操作にて上清を回収した。
(4)回収した上清に終濃度で20から50mMとなるようイミダゾールを加え、あらかじめ150mMのNaClを含む20mMのTris−HCl緩衝液(pH8.0)で平衡化したニッケルキレートカラム(His・Bind Resin:Novagen社製)にアプライ後、150mMのNaClを含む20mMのTris−HCl緩衝液(pH8.0)で洗浄し、500mMのイミダゾールと10%のグリセリンを含む20mMのTris−HCl緩衝液(pH8.0)を用いてタンパク質を溶出させた。
【0042】
実施例7
実施例6に記載の方法で精製した、野生型Fc結合性タンパク質または小型化Fc結合性タンパク質の、ヒトIgG各サブクラス(IgG1、IgG2、IgG3、IgG4)への結合活性を、以下に記載するELISA法により評価した。
(1)ヒトIgGのサブクラスであるIgG1、IgG2、IgG3、IgG4(シグマアルドリッチ社製)を、96穴マイクロプレートのウェルに1μg/wellの濃度で固定した(4℃、18時間)。
(2)固定化終了後、2%のスキムミルクを含んだ50mMのTris−HCl緩衝液(pH8.0)によりブロッキングした。
(3)洗浄緩衝液(0.2%(w/v)のTween 20と150mMのNaClを含む10mMのTris−HCl緩衝液(pH8.0))で洗浄後、調製したタンパク質溶液を50mMのTris−HCl緩衝液(pH8.0)で適宜希釈し、固定化ガンマグロブリンと反応させた(30℃で1時間)。
(4)反応終了後、前記洗浄緩衝液で再度洗浄し、Horse radish Peroxidase(HRP)標識の抗His−Tag抗体試薬(BETHYL社製)を10000倍希釈し100μL/wellで添加した。
(5)30℃で1時間反応後、前記洗浄緩衝液で洗浄し、TMB Peroxidase Substrate(KPL社製)を添加し発色後、1Mのリン酸溶液で反応を停止させ450nmの吸光度を測定した。
【0043】
測定結果を図5に示す。図中、X軸(横軸)はIgGサブクラスを示し、Y軸(縦軸)は、450nmの吸光度(単位は任意)であり抗体結合活性を示す。図5に示すように、各IgGサブクラスへの反応性は、野生型Fc結合性タンパク質、小型化Fc結合性タンパク質、ともにIgG3>IgG1>IgG4>>IgG2という反応性を示した。したがって、本発明のFc結合性タンパク質である小型化Fc結合性タンパク質は、IgGへの結合に関して野生型Fc結合性タンパク質と同等の性能を有しているといえる。
【0044】
実施例8
小型化Fc結合性タンパク質の分子量を確認するため、下記に示すWestern Blottingを行なった。
(1)実施例6に記載の方法で精製した、野生型Fc結合性タンパク質または小型化Fc結合性タンパク質を還元処理し、SDS−PAGEにて分離した。
(2)SDS−PAGE後、PVDF膜(GEヘルスケア社製)に転写し、転写されたPVDF膜を5%のスキムミルクを含んだ50mMのTris−HCl緩衝液(pH8.0)によりブロッキングした。
(3)洗浄緩衝液(0.2%(w/v)のTween 20と150mMのNaClを含む10mMのTris−HCl緩衝液(pH8.0))で洗浄後、Horse radish Peroxidase(HRP)標識の抗His−Tag抗体試薬(BETHYL社製)を反応させた(室温で1時間)。
(4)反応終了後、前記洗浄緩衝液で再度洗浄し、検出用試薬(ECL Plus:GEヘルスケア社製)を使用し検出を行なった。
【0045】
測定結果を図6に示す。図中のMはマーカー、APは実施例6においてカラムにアプライした試料、FTはカラム通過画分、Fr1からFr4はカラム溶出画分を示す。アミノ酸組成から計算される分子量は野生型Fc結合性タンパク質が約32kDa、小型化Fc結合性タンパク質が約21kDaであるが、図6の結果より、野生型Fc結合性タンパク質が約30kDaの位置、小型化Fc結合性タンパク質が約20kDaの位置に、それぞれバンドを確認できた。よって、本発明のFc結合性タンパク質である小型化Fc結合性タンパク質が、確かに野生型Fc結合性タンパク質よりも分子量が小さいことが判明した。
【0046】
実施例9
小型化Fc結合性タンパク質のヒトIgG1に対する結合親和性を、BIAcoreT100(GEヘルスケア社製)による表面プラズモン共鳴法を用いて測定した。
(1)実施例6に記載の方法で精製した小型化Fc結合性タンパク質を、150mMのNaClと3mMのEDTAを含む10mMのHEPES緩衝液(pH7.4)で透析した。
(2)透析後の小型化Fc結合タンパク質をHBS−EP+緩衝液(150mMのNaCl、3mMのEDTA、0.05%(v/v)のSurfactant P20を含む10mMのHEPES緩衝液(pH7.4))にて、4.2nMから希釈系列を作製した。
(3)(2)で作製した希釈系列を、2730.5RUのヒトIgG1(シグマアルドリッチ社製)を固定化したセンサーチップ(CM5)を用いて、Fc結合性タンパク質とヒトIgG1の相互作用を解析した。
【0047】
解析した結果を図7に示す。小型化Fc結合性タンパク質の結合速度定数(ka)は7.4×106(1/Ms)、解離速度定数(kd)は8.2×10−4(1/s)、平衡解離定数(KD)は1.1×10−10(M)であり、野生型Fc結合性タンパク質の平衡解離定数(KD):10−10(M)(非特許文献2)と同等の高い結合親和性を有することが判明した。
【特許請求の範囲】
【請求項1】
配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含む、Fc結合性タンパク質。
【請求項2】
配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含み、かつ前記アミノ酸のうちの一つ以上が他のアミノ酸に置換された、Fc結合性タンパク質。
【請求項3】
請求項1または2に記載のアミノ酸配列をコードするポリヌクレオチド。
【請求項4】
配列番号7に記載のヌクレオチド配列のうち、1番目から522番目までのヌクレオチドからなるポリヌクレオチド。
【請求項5】
請求項3または4に記載のポリヌクレオチドを含む、Fc結合性タンパク質を発現させるためのベクター。
【請求項6】
請求項5に記載のベクターを用いて宿主を形質転換して得られる、形質転換体。
【請求項7】
宿主が大腸菌である、請求項6に記載の形質転換体。
【請求項8】
請求項6または7に記載の形質転換体を用いた、Fc結合性タンパク質の製造方法。
【請求項1】
配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含む、Fc結合性タンパク質。
【請求項2】
配列番号52に記載のアミノ酸配列のうち、少なくとも7番目のアラニンから169番目のスレオニンまでのアミノ酸を含み、かつ前記アミノ酸のうちの一つ以上が他のアミノ酸に置換された、Fc結合性タンパク質。
【請求項3】
請求項1または2に記載のアミノ酸配列をコードするポリヌクレオチド。
【請求項4】
配列番号7に記載のヌクレオチド配列のうち、1番目から522番目までのヌクレオチドからなるポリヌクレオチド。
【請求項5】
請求項3または4に記載のポリヌクレオチドを含む、Fc結合性タンパク質を発現させるためのベクター。
【請求項6】
請求項5に記載のベクターを用いて宿主を形質転換して得られる、形質転換体。
【請求項7】
宿主が大腸菌である、請求項6に記載の形質転換体。
【請求項8】
請求項6または7に記載の形質転換体を用いた、Fc結合性タンパク質の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−130294(P2012−130294A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2010−285741(P2010−285741)
【出願日】平成22年12月22日(2010.12.22)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成22年12月22日(2010.12.22)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

