抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物及び同組成物の医薬品の製造における使用
【課題】抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物を提供すること。
【解決手段】製薬組成物は、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーである。また、同製薬組成物は、動物に投与する前に、マンノース受容体保有抗原提示細胞がインビトロ又はイクスビボにて前記複合体をパルス適用される。
【解決手段】製薬組成物は、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーである。また、同製薬組成物は、動物に投与する前に、マンノース受容体保有抗原提示細胞がインビトロ又はイクスビボにて前記複合体をパルス適用される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、炭水化物化合物を用いてT細胞活性を調節するための生産物および方法に関する。本発明の生産物は、特に、マンノース受容体保有細胞および抗原に結合された酸化マンノースに関し、該生産物はクラスIMHC抗原提示を高めることができる。
【背景技術】
【0002】
癌は現代社会において、死亡や重大障害の主要な原因となっている。癌は若者、老人、男性、女性を苦しめ、あらゆる人種の人々が癌にかかる可能性があるが、子供の癌には、おそらく小児白血病などの例外はあるものの比較的希である。西洋社会において、結腸および肺の癌は主要な病気となっている。女性では、乳癌が最も一般的な癌の形態である。
【0003】
多くの癌にはヒトムチンの過剰産生が伴う。ムチンは、多くの上皮細胞および腫瘍によって産生される、約100キロダルトン(kD)を越える高度にグリコシル化されたタンパク質である(非特許文献1)。癌細胞上に見られるムチンは、いくつかのムチンが炭水化物被覆に欠損を有し、その結果タンパク質コアが露出しているというように、正常な上皮細胞上で見られるムチンとはいくつかの点で異なっている(非特許文献2)。ヒトのムチンには、MUC1、MUC2、MUC3、MUC4、MUC5、MUC6およびMUC7と呼ばれる7つの型が知られている(非特許文献3乃至6)。MUC1は、最も至るところで見られる。様々なムチンのどれもが非常に類似した性質、すなわちそれらは貫膜糖タンパク質であり、いずれもセリン、スレオニンおよびプロリン含量の高い不定数の反復アミノ酸配列を有するという性質を有している。変異的にグリコシル化されたムチン(非グリコシル化またはグリコシル化欠失のいずれか)の過剰産生が、乳房、卵巣、膵臓、結腸、肺、前立腺の腫瘍、および他の分泌組織の腫瘍に特徴的にみられる。ヒトムチンMUC1〜MUC7のそれぞれのタンパク質コアのコピーDNA(cDNA)配列が、クローン化および特徴付けされ、不定数の特殊なアミノ酸モチーフ(VNTRモチーフとして知られている)の反復からなる、反復性の高い中央部分を含むことが発見されている。例示として、MUC1は、40〜80の縦一列に配列した20アミノ酸モチーフの複製物または反復物を含む反復性の高い中央部分によって分離された、固有のアミノおよびカルボキシル末端配列から構成される。MUC1〜MUC7のVNTRモチーフは、以下に列挙する通りである。
MUC1 VNTR−SAPDTRPAPGSTAPPAHGVT(配列番号1)
MUC2 VNTR−PTTTPISTTTMVTPTPTGTQT(配列番号2)
MUC3 VNTR−HSTPSFTSSITTTETTS(配列番号3)
MUC4 VNTR−TSSASTGHATPLPVTD(配列番号4)
MUC5 VNTR−PTTSTTSA(494塩基対挿入配列−8アミノ酸縦列反復)
MUC6 VNTR−169アミノ酸反復単位(配列番号5)
MUC7 VNTR−TTAAPPTPPATTPAPPSSSAPPE(配列番号6)
MUC6の反復サブユニットは169個のアミノ酸から構成されるが、現時点においては、この反復単位のアミノ酸配列は完全には特徴付けされていない。MUC7の配列は、最近になって発表された(上記非特許文献6)。
【0004】
フィン(Finn)とその同僚達は、乳癌(非特許文献7及び8)、膵臓癌、卵巣および他の腫瘍に罹患した患者のリンパ節の中に、ヒトムチンと反応する細胞障害性リンパ球が存在することを実証した。MUC1ペプチドに対する抗体は、MUC1および標的細胞に対するこれらの細胞障害性Tリンパ球の活性を阻害することができる(上記非特許文献7および上記非特許文献8)。最近では、ネズミの肺癌に対する細胞障害性リンパ球についての報告もなされている(非特許文献9)。
【0005】
腫瘍除去に関連する外科手術は患者に外傷を与え、たいていは外観を傷つけ、費用もかかる。外科的処置に代えて、もしくは外科的処置と組み合わせて行うことのできる、腫瘍治療のために確立された化学的治療および照射方法は、大抵の場合、衰弱をもたらすとともに重大な副作用を随伴する。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Gendler et al.,J.Biol.Chem.,263:12820−12823,1988
【非特許文献2】Harisch et al.,J.Biol.Chem.,264:872−883,1989
【非特許文献3】Marjolijn et al.,J.Biol.Chem,265:5573−5578,1990
【非特許文献4】Crocker et al.,Br.J.Cancer,55:651−652,1987
【非特許文献5】Apostolopoulos et al.,Crit.Rev.Immunol.,14:293−309,1994
【非特許文献6】Bobek et al.,J.Biol.Chem.,268:20563−2056 9,1993
【非特許文献7】Barnd et al.,Proc.Natl.Acad.Sci USA,86:7159−7163,1989
【非特許文献8】Jerome et al.,in Cell.Immunity and Immunotherapy of Cancer,pp.321−328,1990
【非特許文献9】Mandelboimo et al.,Nature,369:67−71,1994
【発明の概要】
【発明が解決しようとする課題】
【0007】
したがって、腫瘍の予防/治療のための免疫調節組成物および方法が緊急に必要とされている。
癌を治療するための新しい組成物および方法が緊急に必要とされている。同様に、他の病状、たとえばI型アレルギー、マラリア、HIV、虫歯、インフルエンザ、コレラ、口蹄疫、髄膜炎、リーシュマニア感染、百日咳、狂犬病、連鎖球菌感染、呼吸感染、麻疹、ライム病、結核、細菌性髄膜炎、帯状ヘルペス、風疹、肝炎、疱疹、A型肝炎、ポリオ、性病/トラコーマ、B型肝炎、一般的な感冒、頸部癌、髄膜炎/肺炎、水痘、痘瘡、および肺炎/PUO(原因不明熱)などの治療のための代替の組成物および方法が緊急に必要とされている。
【課題を解決するための手段】
【0008】
上記した課題を解決するために、請求項1に記載の発明は、動物において、抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物であって、同組成物は、マンノースを含む炭水化物ポリマーと、抗原と、を有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、同炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、動物に投与する前に、マンノース受容体保有抗原提示細胞は、インビトロ又はイクスビボにて同複合体をパルス適用される、製薬組成物、を提供する。
【0009】
請求項2に記載の発明は、請求項1に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、末梢血白血球、骨髄、幹細胞、腹腔細胞、脾臓、肺およびリンパ節からなる群から選択される細胞集団に由来する、ことをその要旨とする。
【0010】
請求項3に記載の発明は、請求項1又は2に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、マクロファージ細胞及び樹状細胞からなる群から選択される、ことをその要旨とする。
【0011】
請求項4に記載の発明は、請求項1乃至3のいずれか一項に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、CD11b、CD14、CD68、CD80およびCD86からなる群から選択される分子を発現する、ことをその要旨とする。
【0012】
請求項5に記載の発明は、請求項1乃至4のいずれか一項に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、サイトカイン及びビタミンからなる群から選択される1以上の生体応答調節剤と接触された細胞を含み、同細胞は、当該細胞による炭水化物受容体の発現を誘導するのに効果的な条件にて接触される、ことをその要旨とする。
【0013】
請求項6に記載の発明は、請求項5に記載の製薬組成物において、生体応答調節剤は、抗原提示細胞においてマンノース受容体の発現を誘導する、ことをその要旨とする。
請求項7に記載の発明は、請求項5又は6に記載の製薬組成物において、生体応答調節剤は、顆粒球マクロファージ刺激因子(GM−CSF)、インターロイキン−3、インターロイキン−4、ビタミンD、マクロファージコロニー刺激因子(M−CSF)、Flt−3リガンドおよび腫瘍壊死因子(TNF)αからなる群から選択される、ことをその要旨とする。
【0014】
請求項8に記載の発明は、請求項1乃至7のいずれか一項に記載の製薬組成物において、抗原は、ムチンポリペプチド、ムチンポリペプチドの1以上の反復サブユニット、または抗原フラグメントであり、前記フラグメントは、少なくとも5個のアミノ酸の反復サブユニットを含む、ことをその要旨とする。
【0015】
請求項9に記載の発明は、請求項8に記載の製薬組成物において、ムチンはヒトムチンである、ことをその要旨とする。
請求項10に記載の発明は、請求項9に記載の製薬組成物において、抗原は、ヒトムチンの反復サブユニットの2乃至80のコピーを含む、ことをその要旨とする。
【0016】
請求項11に記載の発明は、請求項8乃至10のいずれか一項に記載の製薬組成物において、抗原の1以上の反復サブユニットは融合ポリペプチドの部分を含む、ことをその要旨とする。
【0017】
請求項12に記載の発明は、動物の抗原に対する細胞障害性T細胞応答を誘導するための医薬品の製造において有効量の組成物を使用する方法であって、同組成物は、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、かつ動物に投与する前に、マンノース受容体保有抗原提示細胞がインビトロ又はイクスビボにて複合体をパルス適用される、組成物、を使用する方法を提供する。
【0018】
本発明は、動物におけるTリンパ球(T細胞)応答を調節することができ、これにより、病気の発生を治療または緩和することのできる免疫調節組成物を提供する。本発明は、抗原を、クラスI分子による提示のためにクラスIMHC経路に送達し、これにより細胞障害性Tリンパ球およびT1(すなわちTH1)サイトカイン、たとえば、IL−2、IL−12、およびγ−インターフェロンなどの産生を誘導することによってT細胞応答を調節するので、有益である。本発明は、本発明の抗原:炭水化物ポリマー複合体の取り込みを、該複合体の抗原と反応するT細胞を活性化することのできる、細胞上のマンノース受容体を誘導することにより高めて、T細胞応答を調節するという点で特に有益である。さらに、本発明は、たとえばムチンなどの抗原が、動物内の抗原に対抗するか交差反応する天然に存在する抗体によって捕捉されるのを防止するように、本発明の抗原、たとえばムチン:炭水化物ポリマー複合体を動物に投与することができるので、特に有益である。さらに本発明の免疫調節組成物は、動物への投与に対して実質的に無毒であるという利点を有しているので、動物への許容性が大きい。
【0019】
本発明の1実施形態は、単離されたマンノース受容体保有細胞と、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体とを含む免疫調節組成物を含む。好ましい抗原としては、腫瘍、ウイルス、真菌、原生動物または細菌の抗原が含まれる。好ましい酸化マンノースは、アルデヒドを有する炭水化物ポリマーを含む。
【0020】
本発明の他の実施形態は、免疫調節マンノース受容体保有細胞集団を含む組成物を含み、該集団は、免疫調節マンノース受容体保有細胞集団を生産するのに効果的な条件下でマンノース受容体保有細胞を培養することによって得ることができ、該条件は抗原送達培地(antigen delivery medium)を含む。好ましい抗原送達培地は、抗原と、完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースとから成る複合体を含む。
【0021】
本発明のさらに別の実施形態は、免疫調節マンノース受容体保有細胞集団を含み、免疫調節マンノース受容体保有細胞集団は、以下の工程(a)および(b)を含む方法によって得ることができる。(a)インビトロにおいて、マンノース受容体保有細胞を1つ以上の生体応答調節剤とともに培養し、強化マンノース受容体保有細胞集団を生産させる。(b)強化マンノース受容体保有細胞集団を、抗原と、完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースとから成る複合体とともにインキュベートし、免疫調節マンノース受容体保有細胞集団を得る。好ましい生体応答調節剤としては、サイトカインおよびビタミンが含まれる。
【0022】
本発明は、単離されたマンノース受容体保有細胞と、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体とを含む抗原送達ベヒクルをも含む。好ましい抗原としては、ムチンが含まれる。
【0023】
本発明は、免疫調節マンノース受容体保有細胞を含む集団を得るための方法であって、マンノース受容体保有細胞に対して強化された細胞集団を、免疫調節マンノース受容体保有細胞を得るのに効果的な条件下で培養することを含み、該条件は抗原送達培地を含むことを特徴とする方法をも含む。好ましくは、上記方法は、マンノース受容体保有細胞に対して強化された細胞集団を、培養工程に先だって1つ以上の生体応答調節剤の存在下でインキュベートすることを含む。
【0024】
本発明の他の実施形態は、免疫応答を誘導する方法であって、レシピエント動物に対して、マンノース受容体保有細胞と、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体とを含む免疫調節組成物を有効量投与することを含む方法を含む。
【0025】
本発明は、抗原に対する免疫応答を誘導する方法であって、単離されたマンノース受容体保有細胞を、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体と接触させることと、該接触後の細胞を動物に投与することとを含む方法をも含む。
【0026】
さらに本発明には、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体に接触させたマンノース受容体保有細胞を動物に投与することによって、動物に抗原を送達するための方法が含まれ、該方法において、マンノース受容体保有細胞は、T細胞からの応答が誘引されるように、T細胞に対する抗原を提示することができる。
【0027】
本発明のさらなる実施形態は、アルデヒド基を有する部分的に還元された炭水化物を含む炭水化物ポリマーに結合された抗原を含む化合物である。
【発明の効果】
【0028】
本発明によれば、動物において抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物であって、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、かつ動物に投与する前に、マンノース受容体保有抗原提示細胞がインビトロ又はイクスビボにて複合体をパルス適用される、製薬組成物、が得られた。
【図面の簡単な説明】
【0029】
【図1】異なる形のマンノースポリマーをパルス適用した腹膜滲出細胞を用いて、1回のインビトロ免疫化を行った場合と、3回のインビボ免疫化を行った場合とで得られたCTLp度数の比較図。
【図2】T細胞応答を誘導するのに必要とされる抗原提示マンノース受容体保有細胞の最小数を示した図。
【図3】酸化MUC1、酸化マンナン融合タンパク質、あるいは緩衝液のみをパルス適用した、腹膜滲出抗原提示マンノース受容体保有細胞によって免疫化されたマウスにおける腫瘍成長を示した図。
【図4】GM−CSFまたはγ−インターフェロンで処理され、酸化マンナン融合タンパク質をパルス適用した、抗原提示マンノース受容体保有細胞を含む、腹膜滲出細胞を用いた場合のCTLp度数を示した図。
【図5】酸化マンナン融合タンパク質で免疫化した、GM−CSFまたはG−CSF遺伝子をノックアウトしたマウスのCTLp度数を示した図。
【図6】酸化マンナン融合タンパク質の注射前にGM−CSFを注射したマウスにおけるCTLp度数を示した図。
【図7】酸化マンナン融合タンパク質をパルス適用したマクロファージの半同種異系および同種異系レシピエントにおけるCTLp度数を示した図。
【図8】Gala(1,3)Gal−細胞系およびGala(1,3)Gal+細胞系における、MUC1とガラクトースとの間の交差反応のFACS分析結果を示した図。
【図9】酸化マンナン融合タンパク質で免疫化したGal o/oマウスおよびC57BL/6マウスから分離した血清中の抗MUC1ペプチド抗体の検出結果を示した図。
【図10】酸化マンナン融合タンパク質、もしくは酸化マンナン融合タンパク質をパルス適用したマクロファージで免疫化したGal o/oマウスから分離した血清中の抗MUC1ペプチド抗体の検出結果を示した図。
【図11】ox−M−FPを注射した正常なマウスと、gal o/o血清と混合したox−M−FPを注射した正常なマウスとの間のCTLp度数の差を示した図。
【図12】ox−M−SIINFEKLを与えたマクロファージ細胞で免疫化したマウスと、gal o/o血清と混合したox−M−SIINFEKLを与えたマクロファージ細胞で免疫化したマウスとの間のCTLp度数の差を示した図。
【図13】正常なマウスの血清またはGal o/oマウスから分離した血清のいずれかの存在下における、マクロファージおよび酸化マンナン融合タンパク質で免疫化した、正常なマウスとGal o/oマウスとの間のCTLp度数の差を示した図。
【図14】マンナンへのMUC1融合タンパク質の結合を示した図。
【発明を実施するための形態】
【0030】
本発明は、免疫調節の影響を受けやすい動物において、病気の発生を治療または緩和するための生産物および方法を提供する。特に、本発明の生産物は、炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体とを含む免疫調節組成物を含む。
【0031】
本発明の1実施形態は、単離された炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体とを含む免疫調節組成物である。本明細書中で用いる「酸化炭水化物」という用語は、完全に(すなわち全体的に)酸化された炭水化物、あるいはアルデヒドを有する部分的に還元された炭水化物(以下で詳細に説明する)を示しうる。本発明の他の実施形態は、抗原および酸化炭水化物から成る複合体に接触させた受容体保有細胞である。本発明によれば、「炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体」または「抗原および酸化炭水化物から成る複合体に接触させた炭水化物受容体保有細胞」を含む組成物という場合、以下の(1)〜(5)の1つ以上を含意し得る。(1)複合体が細胞に結合していない状態の複合体と受容体保有細胞との混合物、(2)複合体が細胞に結合しているが内在化されていない状態の複合体と受容体保有細胞との混合物、(3)複合体が内在化された状態の受容体保有細胞、(4)複合体が内在化され、プロセシングを受けた状態の受容体保有細胞、および/または、(5)複合体が内在化され、プロセシングを受け、提示された状態の受容体保有細胞。不定冠詞「a」または「an」で示される実体は、1つ以上の実体のことをいい、たとえば「化合物(a compound)」という場合には、1つ以上の化合物のことを指すことを注記しておく。そのようなものとして、「a」(または「an」)、「1つ以上」および「少なくとも1つの」という用語も、本明細書中で互換的に使用されることがある。「単離された」という用語は、それ自身の自然の環境から移転された、細胞、ポリペプチドまたはペプチドなどの実体のことをいう。これに関して、「単離された」という用語は、その実体が精製された程度を反映するものではない。本明細書中で用いる「炭水化物受容体保有細胞」とは、細胞表面上の炭水化物に特異的に結合する受容体(すなわち、タンパク質)を含むか、あるいは炭水化物受容体を発現することの可能なあらゆる種類の細胞のことをいう。本明細書中で用いる炭水化物受容体とは、当業者周知の炭水化物受容体のことをいう。炭水化物受容体保有細胞は、様々な濃度の炭水化物受容体保有細胞を含む細胞集団の一部でもあり得ることを注記しておく。したがって、炭水化物受容体保有細胞の集団には、少なくとも1つの炭水化物受容体保有細胞を含む細胞集団が含まれる。あるいは、炭水化物受容体保有細胞の集団は、炭水化物受容体保有細胞の純粋集団から成るものであってもよい(すなわち、100%炭水化物受容体保有細胞)。好ましくは、炭水化物受容体保有細胞の集団は、少なくとも約25%、より好ましくは少なくとも約50%、さらに好ましくは少なくとも約75%、さらに好ましくは少なくとも約80%、さらに好ましくは少なくとも約85%、さらに好ましくは約90%、さらに好ましくは約95%の炭水化物受容体保有細胞を含む。炭水化物受容体保有細胞の集団の相対純度は、炭水化物受容体保有細胞の起源に左右されうることに注目することは当業者の知識の範囲である。本明細書中で用いる「炭水化物受容体保有細胞の強化集団」とは、炭水化物受容体保有細胞(すなわち、炭水化物受容体を有するか、あるいはこれを発現可能な細胞)ではない細胞が集団から除去されるように処理された細胞集団のことをいう。本明細書中で用いる「増加炭水化物受容体保有細胞集団」とは、炭水化物受容体を保有する細胞の数、および/または細胞上の炭水化物受容体の数が、処理前の集団内の細胞に比べて増加するように処理された細胞の集団のことをいう。炭水化物受容体保有細胞は、たとえば、血液、骨髄、リンパ節、または気管支洗浄からの細胞集団内において、当該技術分野における標準的な方法を用いて強化することができる。そのような方法としては、パニング、白血球伝達(leukophoresis)または増殖強化法が含まれるが、それらに限定されるわけではない。炭水化物受容体保有細胞の集団を増加する方法について、ここで詳細に説明する。
【0032】
本発明で使用される適切な炭水化物受容体保有細胞には、動物から単離された細胞、または、組織培養に適合させ、インビトロにおいて増殖させた細胞が含まれる。本明細書中で用いる「インビトロ」という用語は、動物外部で行われる方法のことをいう。「イクス ビボ(ex vivo)」という用語は、動物外部において、動物(すなわちドナー動物)の一部分(たとえば、組織、細胞および体液)に対して行われ、該部分を動物(すなわちレシピエント動物)の同じ一部分に戻すことが意図された方法のことをいう。レシピエント動物は、ドナー動物と同一の動物である必要はない。本発明の好ましい炭水化物受容体保有細胞は、骨髄、末梢血液白血球、肺胞マクロファージ、幹細胞、腫瘍細胞、および/または、間質細胞から得られる。細胞は、細胞の起源に応じた当該技術分野において知られる標準的な方法を用いて、動物から単離することができる。より好ましい炭水化物受容体保有細胞には、抗原提示細胞(APC)に対して強化した細胞が含まれる。適切な抗原提示細胞には、T細胞に対する抗原を提示することによって、T細胞応答を誘引することのできる細胞が含まれる。免疫応答の部分は、主要組織適合性遺伝子複合体(MHC)による抗原提示によって調節される。MHCは、抗原に由来するペプチド断片と結合して、T細胞表面上のT細胞レセプターによって認識される複合体を形成し、その結果、MHC拘束性T細胞認識の現象を引き起こす。「T細胞応答」とは、MHCによって提示された抗原およびペプチド複合体に対する、T細胞の応答のことをいう。T細胞による応答は、天然のT細胞などを用いてのT細胞の活性化、あるいはすでに活性化されているT細胞を用いてのT細胞刺激を含んでいてもよい。「細胞媒介性免疫応答」とは、T細胞の活性化および/または刺激を含む免疫応答のことをいう。本発明によれば、本発明の複合体または組成物は、T細胞、特に抗原特異的T細胞を活性化および/または刺激することによってT細胞応答を誘引することができる。好ましい抗原提示細胞には、樹状細胞、単球、マクロファージ、およびBリンパ球(B細胞)が含まれるが、マクロファージおよび単球細胞がより好ましい。さらに好ましい炭水化物受容体保有細胞には、マンノース受容体保有細胞、すなわち、マンノース受容体を有する細胞が含まれる。本明細書中で用いられる「受容体担持」細胞および受容体陽性細胞は、互換的に使用されるものとする。本発明のさらに好ましい炭水化物受容体保有細胞には、F4/80,抗MAC−1抗体、抗マンノース受容体抗体、NLDC−145、抗CD14抗体、抗CD11b抗体、抗CD11c抗体、抗CD68抗体、抗CD80抗体または抗CD86抗体を含む抗体に特異的に結合する細胞を強化した細胞が含まれる。
【0033】
好ましくは、本発明の炭水化物受容体保有細胞は、免疫調節組成物の目的とするレシピエントである動物、あるいは目的とするレシピエントにMHC適合された動物、たとえば、血縁関係のないドナーまたは当該動物の親戚、好ましくは当該動物の兄弟姉妹を起源とするものである。好ましい炭水化物受容体保有細胞は、本発明の免疫調節組成物の目的とするレシピエントである動物から得られたものである。
【0034】
1実施形態において、本発明の炭水化物受容体保有細胞には、炭水化物受容体を発現することのできる細胞上の炭水化物に対する、受容体の発現を誘導できる化合物に接触させた炭水化物受容体保有細胞が含まれる。炭水化物受容体の発現を誘導するために用いられる適切な化合物には、サイトカインなどの生体応答調節剤が含まれる。本発明の好ましい生体応答調節剤には、単球、マクロファージおよび/または樹状細胞上の炭水化物受容体の発現を誘導することができるあらゆる化合物が含まれる。より好ましい生体応答調節剤には、サイトカインおよびビタミンが含まれるが、これらに限定されるわけではない。細胞表面上の炭水化物受容体の数を増加させるために有用な好ましいサイトカインには、顆粒球マクロファージコロニー刺激因子(GM−CSF)、インターロイキン−3(IL−3)、インターロイキン−4(IL−4)、γ−インターフェロン、Flt−3リガンド、顆粒球コロニー刺激因子(G−CSF)、インターロイキン−12(IL−12)、腫瘍壊死因子α(TNF−α)、マクロファージコロニー刺激因子(M−CSF)、インターロイキン−3(IL−3)、インターロイキン−4(IL−4)、および/または、インターロイキン−6(IL−6)が含まれ、これらに限定されるわけではないが、GM−CSFおよびIL−3がより好ましい。本発明で使用される好ましいビタミンには、ビタミンDが含まれるが、これに限定されるわけではない。
【0035】
本発明によれば、炭水化物受容体保有細胞は、該炭水化物受容体保有細胞を動物から取り除く前若しくは後に、生体応答調節剤と接触させることができる。これに関して、生体応答調節剤は、インビボにおいて細胞上の炭水化物受容体を誘導するのに適した条件下で動物に投与することができる。
【0036】
好ましい実施形態において、本発明の炭水化物受容体保有細胞は、GM−CSF、IL−3、IL−4、TNFγおよび/またはビタミンDを含む調剤に接触させた、単球、マクロファージおよび/または樹状細胞の細胞集団を含む。
【0037】
本発明の1実施形態は、免疫調節炭水化物受容体保有細胞を含む細胞集団を得るための方法であって、該方法は、炭水化物受容体保有細胞を強化した細胞集団を、免疫調節炭水化物受容体保有細胞を得るのに効果的な条件下で培養する工程を含み、前記条件は抗原送達培地を含む。抗原送達培地は、本発明の複合体、好ましくは抗原および酸化炭水化物から成る複合体を含む。抗原送達培地の追加成分としては、本明細書の実施例の中で開示する適当な細胞培養培地および当業者周知のものが含まれる。炭水化物受容体保有細胞に対して強化した細胞集団の培養方法は、本明細書の実施例の中に開示されている。好ましくは、培養工程は約1日間〜約12日間、より好ましくは約3日間〜約10日間、さらに好ましくは約5日間〜約7日間かけて行われるが、約5日間がさらに好ましい。
【0038】
本発明はまた、以下の工程(a)および(b)を含む方法によって得られる免疫調節炭水化物受容体保有細胞集団を含む。(a)インビトロにおいて、1つ以上の生体応答調節剤とともに炭水化物受容体保有細胞を培養し、増加炭水化物受容体保有細胞集団を生産させる。(b)前記増加炭水化物受容体保有細胞集団を、抗原および酸化炭水化物から成る複合体とともにインキュベートし、免疫調節炭水化物受容体保有細胞集団を得る。好ましくは、培養の工程は、約1時間〜約6時間、より好ましくは約2時間〜約4時間、さらに好ましくは3時間かけて行われる。本方法によって得られる好ましい炭水化物受容体保有細胞には、マンノース受容体保有細胞が含まれる。
【0039】
本発明によれば、抗原としてはポリペプチドまたはペプチドが含まれる。本発明の抗原は、細胞性または体液性の免疫応答に至る一連の事象を開始させる。特に、本発明の抗原には、MHCに関連してT細胞に対して提示されるものが含まれる。本発明で使用される適切な抗原には、ポリペプチドおよびペプチドが含まれる。抗原を含むポリペプチドは、ペプチド合成、タンパク質精製、あるいは宿主細胞中でのポリペプチドの発現などの、周知の方法によって製造することができる。ペプチド合成は約100個までのアミノ酸(たとえばMUC1の5つの反復サブユニット)を含むポリペプチドに対して使用することができる。一般に、約20個以上のアミノ酸を含むポリペプチドに対しての好ましい製造手段は、宿主細胞、好ましくは原核宿主細胞、より好ましくは細菌宿主細胞内での組み換え発現である。しかしながら、前述のように真核系も使用することができる。宿主細胞中における組換え型タンパク質の発現方法は、十分に確立されており、たとえば、サンブルック(Sambrook)らによる、「分子クローニング:実験室マニュアル(Molecular Cloning:A Laboratory Manual)」(コールドスプリンハーバー出版、コールドスプリングハーバー、1989年)を参照されたい。
【0040】
本発明によれば、本発明のペプチドは単離されたペプチドである。単離されたペプチドとは、自身の天然の環境におかれていないペプチドのことをいう。本発明の単離ペプチドは、その天然の起源から得るか、完全な長さのタンパク質またはより大きなタンパク質断片からタンパク質分解によって製造するか、組み換えDNA技術を用いて製造するか、あるいは標準的な化学的ペプチド合成法を用いて合成するかのいずれかによって得ることができる。
【0041】
本発明に関する限り、抗原は、ウイルス、微生物もしくは植物に由来する自己抗原または抗原性ペプチド、あるいは、ウイルス、微生物または植物に由来する自己抗原または抗原性ペプチドの全長内の少なくとも5個のアミノ酸から成るアミノ酸サブユニットであってもよい。本発明の抗原は、(上述のように)互いに結合された1つより多くの、5個以上のアミノ酸で構成されるサブユニットから成るものであってもよい。これらの結合されたサブユニットは、上述した範囲内の同一起源または異なる起源に由来するものであり得る。本発明の抗原性ペプチドは、MHC分子に結合することができる。
【0042】
本発明の組成物に使用するのに適した抗原の例としては、以下のものが含まれる。腫瘍抗原:これにはCEA、p53、Her2/neu、ErB2、メランA、MAGE抗原、nm23、BRACA1、BRACA2などが含まれるが、それらに限定されるわけではない;花粉、C型肝炎ウイルス(HIV)コア、E1、E2およびNS2タンパク質;熱帯熱マラリア原虫(Plasmodium faliciparum)周辺スポロゾイトタンパク質;HIV−gp120/160エンベロープ糖タンパク質;連鎖球菌表面タンパク質抗原;インフルエンザ核タンパク質;血球凝集素ノイラミニダーゼ表面感染;TcpAピリンサブユニット;VP1タンパク質;LMCV核タンパク質;レーシュマニア主要表面糖タンパク質(gp63);百日咳菌(Bordetella partussis)表面タンパク質;狂犬病ウイルスGタンパク質;連鎖球菌Mタンパク質;呼吸合胞体ウイルス(RSV)FまたはGタンパク質;エプスタイン−バーウイルス(EBV)gp340または核抗原3A、血球凝集素、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)外表タンパク質(Osp)A、ヒト結核菌(Mycobacterium tuberculosis)38kDaリポタンパク質またはAg85、髄膜炎菌(Neisseria meningitides)クラスI外部タンパク質;水痘ウイルスIE62およびgpI、風疹ウイルスキャプシドタンパク質;B型肝炎ウイルスプレS1抗原、I型単純疱疹ウイルス糖タンパク質GまたはgpDまたはCP27、マリーバレー脳炎ウイルスE糖タンパク質、A型肝炎ウイルスVP1、ポリオウイルスキャプシドタンパク質VP1,VP2およびVP3、トラコーマクラミジア表面タンパク質、B型肝炎ウイルスエンベロープ抗原プレS2、ヒトライノウイルス(HRV)キャプシド、腫瘍遺伝子E6およびE7からの乳頭腫ウイルスペプチド、リステリア属表面タンパク質、水痘ウイルスエンベロープタンパク質、ワクシニアウイルスエンベロープタンパク質、ブルセラ属表面タンパク質、1つ以上の上記抗原の組み合わせ、5個以上のアミノ酸長からなる前記抗原のアミノ酸サブユニット、または1つ以上のそのようなアミノ酸サブユニットの組み合せである。
【0043】
本発明の抗原は、全細胞またはその細胞下画分から構成されてもよい。そのような細胞または細胞下画分は、あらゆる腫瘍のタイプまたは他の起源に由来するものであってもよい。全細胞または細胞下画分を得ることのできる癌の種類の例としては、乳癌、肺癌、膵臓癌および結腸癌、ならびに黒色腫が挙げられる。腫瘍から得られる特異的抗原のいくつかの他の例としては、黒色腫特異的抗原(たとえば、MAGE系抗原)、結腸および他の癌に由来する癌胎児性抗原(CEA)、あるいは実際にはあらゆる腫瘍から抽出された抗原が挙げられる。
【0044】
本発明は、上で列挙したいずれか1つ以上の抗原を含み、特に、ヒトムチンMUC1〜MUC7のうちのいずれか1つ以上を含み、これらのヒトムチンはすべて、上述のように、セリン、スレオニンおよびプロリン含量の高い反復アミノ酸配列から成る反復性の高い中央部分を含んでいる。特に、本発明の組成物は、ヒトムチンポリペプチド(正常な対立遺伝子変形に伴う不定数の反復を含む)を含んでいてもよいし、あるいは、1つ以上のヒトムチン反復配列、好ましくは2〜80回、より好ましくは2〜20回、さらに好ましくは2〜10回のヒトムチンの反復サブユニットを含んでいてもよい。ヒトムチンおよびそのサブユニットは、好ましくはグリコシル化されていないか、あるいは、癌細胞上に見られる、炭水化物被覆が欠失してタンパク質コアが露出したムチンに対する免疫応答を誘発させるように変異的にグリコシル化されている。ヒトムチンMUC1を使用するのが特に好ましいが、本発明はあらゆる抗原の使用、特にヒトムチンMUC1〜MUC7の使用にも拡張されることが明確に理解される。便宜上、これから先はMUCという語を、ヒトムチンMUC1〜MUC7およびそれらのサブユニットのいずれかを指すために用いる。これから先、ヒトムチンのみを取り扱うが、本発明は上述したような他の抗原のいずれにも同等に関連することに留意すべきである。
【0045】
MUCの断片は炭水化物ポリマーに結合されていてもよい。これらの断片は炭水化物に結合可能な分子MUCのいずれの部分を含んでもよい。MUC分子の断片には、MUC分子の天然に存在する配列、および/または、MUC分子に由来する配列の断片であって、クラスIMHC分子へのMUC分子の結合性を高めるように修飾された断片が含まれる。MHC分子を模擬する方法には、ペプチド合成や組み換えDNA技術などの、当該技術分野において周知の方法が含まれる。好ましいMUC分子の断片は、MUC分子のペプチドを含む。好ましいMUC分子のペプチドは、約5〜約20個のアミノ酸から成る。好ましいMUC分子の断片は、非VNTRまたはVNTR領域を含む。より好ましいMUC分子の断片には、APDTR(配列番号7)、APDTRPAPG(配列番号8)、DTRPAPGSTAPP(配列番号9)などを含むアミノ酸配列を有するペプチドが含まれる。説明の便宜上、これらの断片もまたMUCの定義の中に含める。同様に、少なくとも5個のアミノ酸から成る他の抗原断片もまた、炭水化物ポリマーに結合させることができる。
【0046】
本発明の特定の抗原は、組み換え宿主細胞中での融合タンパク質の産生における発現と精製を容易化するために、融合タンパク質の一部を構成してもよい。融合タンパク質の非抗原部分は、一般に融合ポリペプチドのアミノ末端領域に出現し、カルボキシ末端配列が抗原配列を含んでいる。融合タンパク質は、グルタチオン−S−トランスフェラーゼ、β−ガラクトシダーゼ、または他のタンパク質あるいはその一部であって、特に産生される融合タンパク質を精製するための、タンパク質の結合能または他の親和性を利用したアフィニティー精製を可能にするタンパク質から選択することができる。タンパク質は、担体タンパク質のC末端またはN末端のいずれに融合されていてもよい。融合タンパク質の性質は、該融合タンパク質が産生されるベクター系に依存すると考えられる。細菌の発現ベクターの一例としてはpGEXがあり、このpGEXは、目的の遺伝子を該ベクターに挿入してサブクローニングすることにより、グルタチオン−S−トランスフェラーゼと目的のタンパク質とから成る融合タンパク質を産生する。目的のタンパク質を備えた融合タンパク質をもたらす他のベクター系の例は、上記サンブロックらの文献の中に記載されており、該文献全体を引用として本明細書に含める。これらは包含または分離されることができるが、包含される場合には「担体」機能を有すると考えられる。
【0047】
タンパク質または融合タンパク質は、多くの原核性(大腸菌(E.coli)または枯草菌(B.subtilis))または真核性(バキュロウイルス、CHO細胞、コス細胞または酵母)の発現系において発現させることができる。これらの系のいくつか、たとえばバキュロウイルスまたは酵母においては、グリコシル化モチーフをタンパク質または融合タンパク質に導入することにより、マンノースに富むグリコシル化が十分に達成され、マンノースに富む炭水化物ポリマーと化学的に結合させる必要性を無くすことができる。これらの新規な融合タンパク質は、穏やかな過ヨウ素酸酸化を行って使用してもよいし、行わずに使用してもよい。
【0048】
1実施形態において、本発明の抗原は炭水化物ポリマーに結合されている。炭水化物ポリマー内の反復モノマー単位の数は重要ではないが、一般に炭水化物ポリマーは、少なくとも20個のモノマー単位、好ましくは100個以上のモノマー単位、より好ましくは1000個以上のモノマー単位、さらに好ましくは10000個以上のモノマー単位を含む。炭水化物ポリマーは、様々な分子量の多糖鎖の混合物であり得る。本発明の組成物の炭水化物部分は、たとえば、グルコース、ガラクトース、マンノース、キシロース、アラビノース、フコース、グルコサミン、ガラクトサミン、ラムノース、6−O−メチル−D−ガラクトース、2−O−アセチル−β−D−キシロース、N−アセチル−グルコサミン、イズロネート、グルロネート、マンヌロネート、メチルガラクツロネート、α−D−ガラクトピラノース−6−スルフェート、フルクトース、およびα−アベクオース、それらの配座異性体および立体異性体を含むポリマー、あるいは、2個以上の異なるモノマー単位で構成される炭水化物などの、あらゆる炭水化物ポリマーを含むことができる。本発明のより好ましい炭水化物ポリマーは、マンノースを含む。より好ましい炭水化物ポリマーはマンノースポリマーである。さらに好ましい炭水化物ポリマーは、完全に酸化されたマンノース、および/または、アルデヒドを有する部分的に還元されたマンノースのポリマーである。
【0049】
好ましい炭水化物は、炭水化物が部分的に還元されるように処理された酸化炭水化物から成る。より好ましい炭水化物は、炭水化物のアルデヒド基が実質的に還元されずに、シッフ塩基が優先的に還元されるように処理された酸化炭水化物から成る。本発明による炭水化物を部分的に還元するための適切な試薬には、水素化シアノホウ素ナトリウムが含まれるが、これに限定されるわけではない。本発明による炭水化物を部分的に還元するのに適した他の試薬は当業者にとって明らかであり、本願に包含されることが理解される。酸化炭水化物をシアノホウ化水素ナトリウムで処理することにより、たとえば、アルデヒド基を保持したまま、シッフ塩基などの他の基を還元することができる。理論と結び付けられてはいないが、本発明の発明者は、本発明の酸化炭水化物の露出および/または遊離したアルデヒド基が、おそらくはエンドソームやリソソームから細胞質への抗原の取り込み、放出、あるいは漏出を変化させることにより、本発明の炭水化物および抗原複合体の送達に重要な役割を果たしていると確信している。好ましい実施形態において、酸化炭水化物は、遊離のアルデヒドを実質的に含む炭水化物ポリマーの酸化されたマンノース単位を含む。本発明の炭水化物ポリマーには、完全に酸化されたマンノース、あるいはアルデヒドを有する部分的に還元されたマンナンが含まれ得ることを注記しておく。炭水化物は、天然の起源から精製してもよいし、あるいは従来の方法に従って合成してもよい。炭水化物は多くの供給業者から市販されている。
【0050】
抗原は、多糖および単糖の誘導体化および反応に関する炭水化物化学の分野において周知の標準的な方法に従って、炭水化物ポリマーに結合させてもよい。炭水化物は、過ヨウ素酸塩、たとえば過ヨウ素酸ナトリウムなどの従来の酸化剤を用いて酸化してポリアルデヒドとし、これを直接抗原(MUC1の反復サブユニットなど)と反応させるようにしてもよく、この反応においては、タンパク質鎖上のアミノ官能基(リシンのε−アミノ基など)が、シッフ塩基を形成するアルデヒド基と反応する(図14参照)。多糖鎖はまず最初に臭化シアンで活性化し、この活性化された多糖をジアミンと反応させ、次に抗原と結合させて複合体を形成させるようにしてもよい。この複合体はその後、任意に酸化してもよい。炭水化物およびポリペプチドは、炭水化物とポリペプチドとを架橋するために、二機能試薬を用いて誘導体化してもよい。一般に用いられる架橋試薬には、1,1−ビス(ジアゾアセチル)−2−フェニルエタン、グルタルアルデヒド、N−ヒドロキシスクシニミドエステル、たとえば、4−アジドサリチル酸とのエステル、3,3−ジチオビス(スクシンイミジル−プロピオン酸塩)などのジスクシニミジルエステルを含むホモ二価性イミドエステル、および、ビス−N−マレイミド−1,8−オクタンなどの二価性マレイミドが含まれる。メチル−3[(p−アジド−フェニル)ジチオ]プロピオイミデートなどの誘導化試薬は、光の存在により架橋を形成することのできる光活性化中間体を生み出すことができる。酸化炭水化物は、抗原のヒドラジン誘導体と反応させて複合体を形成するようにしてもよい。あるいは、炭水化物は、酸化後に所望の複合体を与えるカルボニルジイミダゾールなどの試薬と反応させてもよい。そのような複合体形成と酸化の方法については、たとえば、1994年12月23日に出願されたPCT出願番号PCT/AU94/00789(WO95/18145)の中で以前に検討されており、この文献はその全体を参照により本明細書中に包含する。本発明による炭水化物の複合体化と酸化の他の方法は、当業者にとって明らかであるだろうし、これらも本願に包含されるものであることを注記しておく。
【0051】
炭水化物への抗体の結合は、炭水化物上のいずれか若しくはすべての官能基を反応基に変換し、その後、該炭水化物上の反応基をポリペプチド上の反応基と反応させることを含む。炭水化物ポリマーは、ヒドロキシル基を豊富に有し、いくつかの例においては、カルボキシル基(イズロネートなどにおいて)、エステル基(メチルガラクツロネートなどにおいて)などで満たされる。これらの基は、標準的な化学的手順に従って活性化することができる。たとえば、ヒドロキシル基は、ヨウ化水素、臭化水素、および塩化水素などのハロゲン化水素と反応させて反応性ハロゲン化多糖を与えることができる。ヒドロキシル基は、トリハロゲン化リン、活性金属(ナトリウムエトキシド、アルミニウムイソプロポキシド、およびカリウム第三ブトキシドなど)によって活性化するか、あるいは(塩化トシルまたは酢酸などの基によって)エステル化することにより、続いてポリペプチド上の反応基と反応して1つ以上の結合を形成することのできる反応基を形成することもできる。ヒドロキシル基以外の炭水化物上の他の官能基は、当該技術分野において周知の手順に従って活性化し、反応基を与えることができる。
【0052】
本発明の1実施形態において、マンノース受容体担持マクロファージおよび/または単球細胞に対して強化された細胞集団と、ヒトムチンポリペプチド、該ポリペプチドの1つ以上の反復もしくは非反復サブユニット、あるいは反復もしくは非反復サブユニットの断片と、酸化マンノースから成る炭水化物ポリマーとの間で形成される複合体と含む免疫調節組成物が提供される。特に、上記免疫調節組成物は、複合体に結合される前にGM−CSF、IL−3、IL−4、TNFγおよび/またはビタミンDと接触させた、マンノース受容体担持マクロファージおよび/または単球細胞に対して強化された細胞集団を含んでいる。
【0053】
本発明の免疫調節組成物は、薬剤学的に許容可能な担体中で調製することができる。そのような担体の例には、水、生理食塩水、リンゲル溶液、デキストロース溶液、ハンク溶液、および他の水性の生理的に平衡な塩溶液が含まれる。不揮発油、ゴマ油、オレイン酸エチル、あるいはトリグリセリドなどの非水性賦形剤も使用することができる。他の有用な製剤としては、カルボキシメチルセルロースナトリウム、ソルビトール、あるいはデキストランなどの増粘剤を含む懸濁剤が含まれる。補形剤は、少量の添加剤、たとえば等張性および化学的安定性を高める物質などを含んでいてもよい。緩衝液の例としては、リン酸緩衝液、重炭酸緩衝液、およびトリス緩衝液が含まれ、保存剤の例としては、チメロサール、m−またはo−クレゾール、ホルマリンおよびベンジルアルコールが含まれる。標準的な製剤は、液体の注射可能な医薬品、あるいは注射用に適当な液体に懸濁液または溶液として溶解可能な固体のいずれかであり得る。したがって非液体製剤においては、担体はデキストロース、ヒト血清アルブミン、保存剤などを含み、これに無菌の水または生理食塩水を投与前に添加することが可能である。
【0054】
本発明の薬剤学的に許容可能な担体は、さらにアジュバントや伝達賦形剤などの免疫増強剤をさらに含んでいてもよい。アジュバントは典型的には、特異的抗原に対する動物の免疫応答を全体的に増強する物質である。適切なアジュバントとしては、動物、特にヒトに投与することのできるアジュバントが含まれる。本発明の免疫調節組成物と併用される好ましいアジュバントには、アルミニウムをベースとした塩、カルシウムをベースとした塩、シリカ、γ−インターフェロン、IL−12、および他の市販のアジュバントが含まれるが、それらに限定されるわけではない。
【0055】
他の態様において、本発明の免疫調節組成物は、患者に対して、様々な病状に対する予防または治療を施すために投与される。特に、本発明の免疫調節組成物は、異常細胞の増殖を治療または予防するのに有用である。本明細書中で用いる異常細胞とは、異常増殖、発生、死といった異常な生物学的機能を呈した細胞のことをいう。本発明の異常細胞には、好ましくは癌細胞、感染物質(すなわち病原体)および異常増殖性成長をみせる非癌細胞(たとえば、類肉腫症、肉芽腫症または乳頭腫)に感染した細胞、ならびに癌細胞および感染細胞に感染した非癌細胞が含まれる。癌細胞の増殖には、乳房、結腸、肺、膵臓、前立腺などの分泌組織の腫瘍の増殖が含まれるが、これらに限定されるわけではない。
【0056】
上記のようにして予防することのできる他のいくつかの病状としては、I型アレルギー、マラリア、HIV、虫歯、インフルエンザ、コレラ、口蹄疫、髄膜炎、リーシュマニア感染、百日咳、狂犬病、連鎖球菌感染、呼吸感染、麻疹、ライム病、結核、細菌性髄膜炎、帯状ヘルペス、風疹、肝炎、疱疹、A型肝炎、ポリオ、性病/トラコーマ、B型肝炎、一般的な感冒、頸部癌、髄膜炎/肺炎、水痘、痘瘡、および肺炎/PUO(原因不明熱)が含まれるが、これらに限定されるわけではない。
【0057】
分泌組織の腫瘍形成を予防するために、動物を本発明の免疫調節組成物で免疫化してもよい。あるいは、腫瘍に罹った動物を、腫瘍治療のための治療計画の一部として、本発明の免疫調節組成物で免疫化してもよい。例示として、女性の乳癌予防のために、女性に対して思春期前または後に、本発明の免疫調節組成物で免疫してもよいし、1回以上の注射を、好ましくは最初の免疫化後、数ヶ月から数年の間隔を空けて、1回以上のブースター注射を受けさせるようにしてもよい。1つの免疫化計画として、女性に対して本発明の組成物で免疫化を行った後、適当な間隔を空けてブースター免疫化を受けさせるようにしてもよい。その後のブースター免疫化は一定の間隔で行う。免疫化の経路は、従来のヒトワクチン投与の場合と何ら違いはない。したがって、本発明の免疫調節組成物は、皮下、筋肉内、経口、静脈内などの様式で投与することができる。
【0058】
動物に送達される本発明の組成物の量は、臨界量あるいは限界量ではない。本発明の組成物の有効量は、抗原成分に対する免疫応答を刺激するような量である。送達される組成物の量は、動物の免疫状態(患者が免疫抑制されているか、あるいは免疫刺激されているかに依存)、担当医または獣医師の判断、あるいは、化合物が病状を予防または治療のいずれを行う治療薬として用いられるのかに従って変わる。適切な一回投与量は、適切な期間にわたって1回または数回投与した場合に、動物に対して特定の病気の予防または治療を行うことができる投与量である。たとえば、動物が、本発明の組成物中、約105個〜約1013個の細胞、より好ましくは本発明の組成物中、約106個〜約1012個、さらに好ましくは約107個〜約1011個の細胞を受け取るようにすることができる。
【0059】
上述のように、本発明の組成物は、免疫応答を増強するサイトカインや他の化合物などのアジュバントと共に動物に投与してもよい。例示として、本発明の組成物と共に投与してもよいそのような増強化合物には、GM−CSF、G−CSF、M−CSF、TNFαまたはβ、γまたはα−インターフェロン、IL−1〜IL−18のいずれか、あるいは他のサイトカインのうちの1つ以上が含まれる。これらの増強化合物は、本発明の組成物と同時に動物に投与されてもよいし、任意に多成分投与剤形の一部として投与されてもよい。あるいは、本発明の増強化合物と組成物とは、本発明の免疫調節組成物の投与後、異なる期間をおいて投与するようにしてもよい。
【0060】
本発明の他の態様において、動物に本発明の免疫調節組成物を投与することを含む、抗原に対する免疫応答を誘導するための方法が提供される。動物に本発明の免疫調節組成物を投与することにより、特に抗原成分と反応する細胞に対して細胞障害性を呈する、活性化されたT細胞の高い細胞性応答が誘起される。例示として、動物をムチンまたは他の腫瘍抗原決定基を発現する腫瘍に対して免疫化することができる。本発明の潜在的利益は、本発明の組成物が、ムチンまたは他の抗原決定基を発現している腫瘍細胞を殺す細胞障害性T細胞の細胞性免疫応答を誘起することができるため、動物に対して腫瘍の成長前に癌予防を行うことができるという事実から生じるものである。本発明は、腺癌などの分泌組織の腫瘍、より詳細には、乳房、卵巣、結腸、肺、前立腺などの腫瘍に対する免疫化に特に適用できる。
【0061】
本発明の1実施形態は、動物における免疫応答を誘導するための方法を含み、該方法は、動物に、マンノース受容体保有細胞と、抗原および酸化マンノースから成る複合体とを含む免疫調節組成物を有効量投与することを含む。本発明の免疫調節組成物の有効量は、本明細書中に記載の病気を予防または治療することのできる量を含む。
【0062】
本発明で使用される動物には、ヒト、家畜動物および食用動物が含まれるが、これらに限定されることはなく、ヒトまたはサルがより好ましく、ヒトが最も好ましい。
本発明の他の実施形態は、動物において癌に対する免疫応答を誘導する方法に関し、該方法は、動物に、炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体とを含む免疫調節組成物を有効量投与することを含む。本方法で用いられる好ましい炭水化物はマンノースである。本明細書中で開示されるあらゆる抗原が本方法での使用に適している。好ましい抗原は、ムチンポリペプチドを含む。
【0063】
本発明の組成物は、癌根絶のための総合的治療の一部として、あるいは単独で投与することができる。総合的治療の一部として投与される場合には、本発明の組成物は、他の治療形態の前、最中もしくは後に投与することができる。たとえば、本発明の組成物は、癌に罹っている動物に対して、癌化した細胞を切除する外科手術の前または後のいずれに投与してもよい。同様に、本発明の組成物は、腫瘍刺激を伴う化学的治療または照射計画の前または後に投与することができる。好ましくは、本発明の組成物は、動物の免疫系が完全である時に、細胞媒介性免疫応答を動物内で誘導することができるように投与される。このように、本発明の組成物は、動物の免疫除去治療の後に投与するのには適していない。本発明の免疫調節組成物を、腫瘍を有する動物に投与する場合、好ましくは組成物は腫瘍の主要部位かまたはその周囲に投与される。
【0064】
好ましい実施形態において、免疫応答を誘導する方法は、以下の工程(a)〜(d)を含む。(a)マンノース受容体保有細胞集団を動物から単離する。(b)細胞を1つ以上の生体応答調節剤と接触させて、増加マンノース受容体保有細胞集団を得る。(c)増加マンノース受容体保有細胞集団を、抗原および酸化マンノースから成る複合体に結合させ、免疫調節マンノース受容体保有細胞集団を得る。(d)免疫調節マンノース受容体保有細胞集団を動物に投与して、免疫応答を誘導する。本実施形態で使用される好ましいサイトカインおよびビタミンは、本明細書中に開示されている。
【0065】
さらに他の態様において、本発明は、ヒトムチンポリペプチド、該ポリペプチドの1つ以上の反復サブユニット、もしくは前記反復サブユニットの断片と、炭水化物ポリマーとの間の複合体を含む化合物を、腺癌、特に乳癌の治療において使用することに関する。
【0066】
本明細書中に記載した発明は、ヒトムチンMUC1に限定されるものではない。本発明は明らかに、癌細胞によって発現される他のムチンの使用、ならびに、多糖に結合されると、主要細胞に対して細胞障害性T細胞応答を誘起するために用いることのできる他の抗原の使用にも適用され、該化合物は、腫瘍形成を予防するワクチンにおいて使用してもよいし、癌の治療、および/または前述のような他の病状の治療または予防のために使用してもよい。様々な病気および病状に対応する抗原であって、それに対する免疫応答の誘引が望まれる抗原は技術上周知であり、そのような抗原も本発明の範囲に同等に含まれる。
【0067】
本発明はまた、抗原に結合する先在抗体(すなわち自然抗体)を有する動物に、本発明の抗原を送達する方法も含み、該方法によって、抗原に対する細胞性免疫応答が誘引される。本発明の方法の利点の1つは、目的の抗原に結合することができ、細胞性免疫応答よりも抗体応答を優先的に誘導するであろう天然に存在する抗体(すなわち自然抗体)が、複合体に結合するのを阻止できることである。たとえば抗原がムチンの場合、ヒトはムチンペプチドに結合する大量の循環性の天然に存在する抗体を有している。これらの天然に存在する抗体の特異性の殆どは、ガラクトースエピトープに抗して誘導されるものであるが、これらの抗体はムチンペプチドと交差反応する。したがって、患者がマンナン:ムチン複合体によって免疫化される場合、おそらくは抗体が複合体に結合し、該複合体が適切な抗原提示経路に到達して細胞性免疫応答(たとえばCTL応答)を誘導するのを阻止すると考えられる。したがって、本発明の方法は、炭水化物受容体保有細胞をイクスビボにおいて抗原:炭水化物複合体と結合させることにより、本発明の治療用組成物を動物に投与する際の循環性の交差反応する抗体を排除して、体液性(抗体)応答の優先的誘導を克服するものである。患者に導入される場合には、細胞性免疫応答、および特にCTLおよび/またはT1(TH1)応答が、目的の抗原の抗原性ペプチドを提示する細胞によって優先的に誘導される。本方法は、抗原および酸化炭水化物から成る複合体に接触させた炭水化物受容体保有細胞を、動物に投与する工程を含み、この工程において、炭水化物受容体保有細胞は、T細胞からの応答が誘引されるようにT細胞に対する抗原を提示することができる。本方法で用いられる好ましい抗原はムチンである。本方法で用いられる好ましい炭水化物はマンノースである。
【0068】
以下の実施例は説明を目的としたものであり、本発明の範囲を限定することを意図したものではない。
【実施例1】
【0069】
この実施例では、インビボでマンノース受容体を標的にすると、T1細胞免疫応答が起こることを述べる。
A.腹腔滲出細胞のマンナン−MUC1へのインビトロ曝露
腹腔滲出細胞(PEC)を以下のように調製した。マウスを屠殺し、10mlのリン酸緩衝液(PBS)を腹腔内に注射し、穏やかにマッサージし、腹腔滲出細胞を収集した。付着PECは、組織培養プレート中に約2×106/mlのPECを取り、約37℃で約16乃至約24時間培養することにより調製した。非付着PEC細胞をピペットで取り除き、付着PEC細胞を以下に説明する研究に用いた。
【0070】
DBA/2(H−2d)マウスから得た約4×106のPEC細胞は、約16乃至約24時間の付着後、20μg/mlの酸化−マンナン−MUC1融合タンパク質(ox−M−FP;Apostolopoulos et al.,Proc.Natl.Acad.Sci.USA,92,10128−10132,1995a、Apostolopoulos et al.,J.Immunol.,155:5089−5094,1995bに詳述)、還元−マンナン−MUC1融合タンパク質(red−M−FP)、または無処理MUC1融合タンパク質(FP;グルチオン−S−トランスフェラーゼに融合させた5つのVNTR反復配列を含む105アミノ酸ペプチドを含む。詳細は、Apostolopoulos et al.,Br.J.Cancer,67:713−720,1993)もしくはマンナン−ox−グルタチオン−S−トランスフェラーゼ(M−GST;詳細は、Apostolopoulos et al.、前掲の文献、1993に述べられている)により感作させた。感作させた細胞の各群を、腹腔内注射によりDBA/2マウスへ移入した。
【0071】
その後、マウスの細胞障害性T細胞(CTL)応答試験を、CTL前駆体(CTLp)度数を以下のように測定することにより行った。CTLp度数は、10%ウシ胎児血清と、5mMの合成MUC1ペプチド(2つのVNTR反復配列から成る;Apostolopoulos et al.、前掲の文献1995aに述べられている)と、約10U/mlの組換えヒトIL−2とを含むダルベッコ変法イーグル培地において、約25μg/mlの投与量のマイトマイシンCで約1乃至約1.5時間処理した約2乃至約5×105のDBA/2刺激脾細胞と共に、U底マイクロタイタートレイ中で細胞を培養することにより、少なくとも6通りのエフェクター細胞投与の最小で32の複製を用いて決定した。7日後、各ミクロ培養の細胞毒性について、100μlの培地を約104 51Cr−標識MUC1+P815腫瘍標的細胞(ヒトMUC1をコードするcDNAをトランスフェクトしたB815細胞;フランス、ストラスブールのトランスジーン、B.アクレス(Acres)博士から提供)を含む100mlの標的細胞懸濁液と置換することにより、分析した。培養物が細胞障害活性を有する細胞を備えていることは、単独で培養されるか、あるいはMUC1合成ペプチドは含まず刺激細胞および組換えIL−2と共に培養されるかした応答細胞に添加される、約104の標的細胞から得られた平均同位体放出より51Cr放出が約3標準偏差高いことにより同定した。直線スケールで表される応答細胞の投与量と、対数スケールで表される陰性ウェルの度数との間には直線関係が存在した。CTLp度数は、37%の陰性ウェルを生成するのに必要とされる応答細胞投与量の逆数として決定した。
【0072】
図1について参照する。この結果から、Ox−M−FPをインビトロでパルス適用(pulse)したPECによる1回の免疫後に得られたCTLp度数は、Ox−M−FPの無細胞タンパク質型の3回のインビボ免疫後に得られたCTLpとほぼ同じ(1/7,000)であることが示された。インビトロでred−M−FPまたはFPを適用したPECの1回の注入では、それぞれ、1/28,000および1/29,600のCTLp度数が発生した。red−M−FPまたはFPのいずれかの3回の腹腔内注射では、それぞれ、1/89,000および1/87,500のCTLp度数が得られた。M−GSTで感作された細胞では1/800,000の度数が得られた。全ての場合において、応答はMUC1特異であった。というのは、トランスフェクトされていないP815標的細胞は溶解されなかったからである。まとめて考えると、これらの結果は、融合タンパク質の複数回注入によるか、あるいはインビトロでox−M−FPを適用したPECの1回の注入により加えられたox−M−FPによりCTL応答が刺激され、この応答は、いずれかの経路により加えられたred−M−FPまたはFPによる応答よりも高いことを示す。red−M−FP上にマンノースが存在しても、インビボで融合タンパク質として運搬される場合には、(無処理FPに比べ)選択的な利点はない。しかしながら、これらのタンパク質をインビトロでPECに適用し、その後、これらの細胞を免疫化に使用することにより、red−M−FPあるいはFPをマンノース受容体への標的とすることは、それらの融合タンパク質を注入するよりも(両方に対する度数は約1/80,000)、CTLpの誘導に効果的であった(両方に対する度数は約1/28,000)。このように、インビトロで、Ox−M−FPをPECに適用する(およびこれによりマンノース受容体に対する標的とする)と、インビトロでred−M−FPまたはFPをPECに適用するよりも良好なCTL応答が得られる。さらに、red−M−FPまたはFPではなく、融合タンパク質Ox−M−FPの注入により、CTLp度数が向上する。最後に、PECにred−M−FPまたはFPをインビトロで適用すると、これらのタンパク質のインビボ注入に比べ、CTLpの生成が向上する。
【0073】
図2について参照する。この図は、インビトロ感作PECの注入数に関する投与量応答を示したものであり、これにより、CTLp度数を向上させるのに必要なPECの最小数は104細胞であることが示された。104細胞では、CTLp度数1/10,200が得られたが、これは400倍の細胞を用いて得られたもの(4×106細胞;CTLp度数は1/4,000)と実質的に差異がない。このように、移入したPECの数が104を超えると、CTLp度数は移入した細胞の数に対して投与量依存性を示さず、CTLp度数は104〜4×106細胞の範囲で同様であった。103細胞を移入した場合、CTLp度数は1/44,000まで落ちた。
【0074】
B.インビトロで適用させたPECで免疫したマウスは腫瘍の攻撃から防御された
腫瘍の攻撃に対して感作PECが防御応答を誘発する可能性を調べるために、5匹のDBA/2マウスの群に、ox−M−FP、またはox−M−FPを適用したPEC、もしくはパルス処理していないPECを1回注入し、その後、5×106 MUC1+P815細胞で攻撃した。図3を参照する。これらの結果から、ox−M−FPで感作されたPECを用いて免疫した5匹のマウスのいずれにおいても検出可能な腫瘍の成長はないことが示唆された。逆に、ox−M−FPで1回免疫した5匹のマウスのうち3匹で腫瘍が発現し、未処理PECで1回免疫した5匹のマウスのうち5匹で腫瘍が発現した。
【0075】
このように、マウスの腹腔由来のPECであって、インビトロでox−M−FPと共に培養させたPECは、養子免疫伝達後、効率よくMUC1抗原を処理すると共に提示し、高い度数のCTLを生成させ、その後の腫瘍の攻撃に対し防御する。
【0076】
C.還元および酸化M−FPの結合研究
異なるマンナン型の、様々な種類の組織、細胞系、細胞および受容体への結合について分析するために実験を行った。この結合試験の結果を表1にまとめて示す。
【0077】
【表1】

1.細胞系
フルオレセインイソチオシアネート(FITC、シグマ社、ミズーリ州セントルイス(Sigma,St.Louis)から入手可能;Apostolopoulos et al.、前掲の文献、1995aに詳述)と共役した還元マンナンまたは酸化マンナンのいずれかを、Apostolopoulos et al.、前掲の文献、1995aに一般的に述べられている方法を用いて様々な種類の細胞と共に混合した。FITC−共役還元マンナンおよびFITC−共役酸化マンナンのいずれも、以下の細胞系には結合しなかった:3T3(線維芽細胞)細胞、P815(肥満細胞腫)細胞、NS1およびスルタン(B細胞系)細胞、EL−4細胞、RMA細胞、E3細胞およびCEM(T細胞系)細胞、MM200(メラノーマ)細胞、COS細胞およびBHK(腎細胞系)細胞。FITC−共役還元およびFITC−共役酸化マンナンのいずれも、J774細胞(マクロファージ細胞系、P.リシアルジ−キャスタグノーリ(Ricciardi−Castagnoli)博士(ミラノ、イタリア)から供与)には結合した。樹状細胞系であるD2SC/1への結合は、酸化−マンナン−FITCでは陰性であり、還元−マンナン−FITCでは非常に弱かった(表1)。
【0078】
FITCと共役させた酸化あるいは還元マンノースのJ774細胞への結合を阻害する炭水化物を用いて、阻害試験を行った。酸化マンナン−FITCのJ774細胞への結合はマンナン、D−マンノース、L−フコースおよびN−アセチルグルコサミンにより阻害された。一方、還元マンナン−FITCの結合は、マンナン、D−マンノース、L−フコースおよびN−アセチルガラクトサミンにより阻害された。他の糖(グルコース、D−フコースおよびガラクトース)は阻害しなかった(表1)。上記の糖がFITC共役マンナン型の結合を阻害することができるということは、それらがマンノース受容体へ結合することを暗示する。
【0079】
2.組織
還元および酸化マンナン−FITCをマウスの腹腔内に注入し、1時間後、器官を4%パラホルムアルデヒドで固定し、標準方法を用いて共焦顕微鏡により分析した。酸化および還元材料はいずれも、肝臓内、脾臓内、赤色脾髄内で観察された。肝臓では、クッパー細胞に富む洞様血管の周りが染色された。脾臓では、白髄の周りが染色された。赤色脾髄では、周辺帯マクロファージと共に染色された。結果はまとめて表1に示す。
【0080】
3.受容体
マンノース受容体をコードする核酸分子をトランスフェクトしたCOS細胞を、red−M−FPまたはox−M−FPと共に、M−FPがマンノース受容体に結合することができるような条件下で混合した。マンノース受容体へのM−FPの結合は、SDS−PAGEゲルにより受容体へ結合したM−FPを分離し、ゲル上に分離したタンパク質をブロッティングし、マンノース受容体に特異的に結合する抗体を用いてウエスターンブロットによりバンドを分解することにより、確認した。この結果、red−M−FPおよびox−M−FPのいずれもが、マンノース受容体に結合することが示唆された。
【0081】
4.PECの特徴付け
マクロファージおよび樹状細胞を規定するために使用される細胞表面マーカーはF4/80、33D1およびNLDC−145とした。マクロファージはF4/80+33D1−と分類し、樹状細胞はF4/80−33D1+と分類した。付着PECは以下のようにフローサイトメトリにより分析した。付着PECは標準的な技術を用いて、F4/80抗体(ラット抗マウスモノクローナル抗体、これはマクロファージを検出するが樹状細胞は検出しない;Austyn et al.,Eur.J.Immunol.,11:805−812,1981およびNussenzweig et al.,J.Exp.Med.,154:168−179,1981に記載);33D1抗体(ラット抗マウスモノクローナル抗体、これはマウス樹状細胞と反応するがマクロファージとは反応しない;Steinman,et al.,J.Exp.Med.,157:613−627,1983に記載);およびNLDC−145抗体(ラット抗マウスモノクローナル抗体、これは樹状細胞上のDEC−205分子を検出する、DEC−205分子はマクロファージには存在しない;Swiggard,et al.,Cell.Immunol.,165:302−11,1995に記載。クリストチャーチ病院、ニュージーランド、クライストチャーチのデレク ハート博士から供与)のいずれかにより染色した。染色した細胞は標準方法を用いてフローサイトメトリにより識別した。血清学的研究のために、約100μlの各抗体を約2×105のPEC細胞に添加し、約1時間、約4℃でインキュベートした。細胞を3回、約.5mlのPBSで洗浄した。FITC−共役ヒツジ(Fab’)2抗マウス免疫グロブリン(シレナス社、オーストラリア(Silenus,Australia)から入手可能)の1:50希釈液を約100μl、各サンプルに添加し、約45分間、約4℃でインキュベートした。細胞を再び洗浄し、その後、FACScanフローサイトメーターを用いて、フローサイトメトリにより分析した。
【0082】
結果をまとめて表2に示す。これらの結果から、付着PECの約75%がF4/80+であり、約30%がNLDC−145+であり、約33%が33D1+であることが示唆された。付着PECの約5%が二重に陽性であった(F4/80+33D1+)。
【0083】
【表2】

付着PECの1つの集団をDynabeads(登録商標)を用いて2つの集団に分離した。1つの集団(マクロファージに富む)は約80%のF4/80+と、約13%の33D1+と、約14%のF4/80−33D1−とより構成された。第2の集団(樹状細胞に富む)は、約3%のF4/80+と、約85%の33D1+と、約3%のF4/80−33D1−とを含んだ(表2を参照のこと)。これらの2つの集団を誘導するために使用した方法は以下の通りである。Dynabeads(M−450)をヒツジ抗ラットIgGに対する抗体で被覆し、2つのラットモノクローナル抗体であるF4/80または33D1のいずれかと、3時間、4℃で混合した。これらの処理Dynabeadsを別々に107PEC細胞に添加し、30分間、4℃で混合した。抗体により被覆されたDynabeadsに結合した細胞は、磁石を用いて除去し、Dynabeadsに結合しなかった細胞は、更なる試験のために収集した。Dynabeadsに結合しなかったこれらの細胞のサンプルについて、F4/80または33D1抗体と結合することができるか、フローサイトメトリにより試験した。Dynabeadsに結合しなかった細胞の残りはその後、ox−M−FPと共に、16時間乃至24時間インキュベートし、セクションA(次の実施例を参照のこと)において上述の方法を用いて、同系マウスの腹腔内への養子免疫伝達を行った。
【0084】
すぐ上に述べたマクロファージ(33D1−)および樹状細胞(F4/80−)に富んだ集団についてさらに、マンナン−FITC、酸化マンナン−FITCまたは還元マンナン−FITCを用いたフローサイトメトリによりマンノース受容体の発現に関する特徴付けを行った。各FITC複合体を約100μl、約2×105のマクロファージまたは樹状細胞強化集団に添加し、約1時間、約4℃でインキュベートした。細胞を3回、約.5mlのPBSで洗浄した。細胞について、FACScanフローサイトメーターを用いて、フローサイトメトリにより分析した。表2を参照すると、F4/80+33D1−集団内の約46%の細胞がマンナン−FITCで染色され、この集団内の細胞の58%がマンナン−FITCおよびF4/80抗体の両方に結合した。F4/80+33D1−集団はマンナン−FITCと結合しなかった(5%以下、これはPBSを受け取ったサンプル中の陽性細胞の数であった)。F4/80+集団の約52%が還元−M−FITCで染色された(この集団内の65%の細胞が還元−マンナン−FITCおよびF4/80抗体の両方と結合した)。また、33D1+細胞集団は還元−マンナン−FITCとは結合しなかった。F4/80+集団の約70%が酸化−M−FITCで染色され、この集団内の58%の細胞が、酸化−マンナン−FITCおよびF4/80抗体の両方と結合した。また、33D1+細胞集団は酸化−マンナン−FITCとは結合しなかった。このように、マンナンの両方の型(還元および酸化)がマクロファージには結合するが、樹状細胞には結合せず、酸化材料の結合が最も良好であった。
【0085】
5.PEC集団におけるマクロファージおよび樹状細胞の好ましい役割の決定
PECはセクションDにおいて説明したように、F4/80または33D1抗体と、ダイナビードとを用いて、80%のF4/80+33D1−マクロファージ強化細胞および85%のF4/80−33D1+樹状細胞のいずれかを含む2つの集団に分離した。分離したマクロファージ(Mac)と樹状細胞(DC)の集団は、約20μgのM−FPと共にインビトロで、約16乃至24時間、別々に培養した。未分割PEC集団を同様に培養した。その後、細胞集団を別々のマウスに腹腔内注射し、MUC1特異CTLp度数を、セクションAで一般的に説明した方法を用いて決定した。
【0086】
【表3】

表3を参照する。この結果から、106のインビトロにおいてパルス適用したPECの注射により、1/11,000のCTLp度数が生じることが示唆された。同様に、6×105適用マクロファージは1/15,000のCTLp度数を生じ、2×105樹状細胞は1/64,000のCTLp度数を生じた。このように、マンノース受容体陽性のF4/80+マクロファージが、CTLp度数の増加に対する主な原因となった。マンノース受容体陰性である樹状細胞のCTLp度数の増加への有効性はより低かった。
【0087】
上記実験において、注射したマクロファージ(6×105)の数は注射した樹状細胞(2×105)の数とは異なった。続いて、同じ投与量(2×105)の各細胞型を用いて比較を行った。マクロファージ集団と樹状細胞集団とは、すぐ上で説明したように調製し、マウスに注射した。約2×105のマクロファージおよび約2×105の樹状細胞を別々のマウスに注射し、MUC1特異CTLp度数を決定した。マクロファージの注射により1/13,000のCTLp度数が得られ、一方、樹状細胞の注射により1/65,000のCTLp度数が得られた(表3を参照のこと)。このように、マクロファージは、マウスがインビトロでox−M−FPを適用した細胞を受け取ると、高いCTLp度数を発生させる主なエフェクター細胞である。
【0088】
MUC1抗原提示における樹状細胞の役割もまた、16乃至24時間、インビトロでox−M−FPを適用した約106のJ774細胞を用いて1回BALB/cマウスを免疫することにより決定した。J774細胞により1/33,000のCTLp度数が得られた(表3を参照)。BALB/cマウスはまた、16乃至24時間、ox−M−FPを適用したD2SC/1細胞(樹状細胞系)を用いて1回免疫した。D2SC/1細胞の注射により、130,000/1のCTLp度数が得られた(表3を参照)。これらのことから、ox−M−FPを適用したマクロファージの方が、ox−M−FPを適用した樹状細胞よりも、CTLp度数の増加について有効であることが示される。
【0089】
6.ox−M−FPを適用したPECを用いて生じた免疫応答に関するGM−CSFの効果
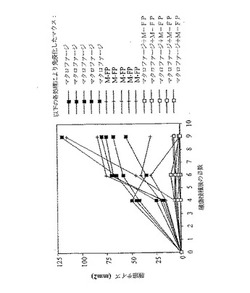
PECをマウスから単離し、プラスチックに付着させ、酸化−M−FP(ox−M−FP)を適用し、GM−CSF(約10ng/ml)またはγインターフェロンと共に、約3時間インビトロでインキュベートした。いくつかの細胞はサイトカインの不在下で、ox−M−FPと共に約3時間インキュベートした。図4を参照する。その後、細胞は特定の実験を受けていない別々のマウスに移入された。GM−CSF処理細胞の移入により、1/2,500のCTLp度数が得られた。無処理細胞の移入により、1/7,000のCTLp度数が得られた。逆に、γインターフェロンで処理した細胞の移入により、1/9,000のCTLp度数が得られた。
【0090】
別の試験では、PECをマウスから単離し、プラスチックに付着させ、ox−M−FPを適用した。パルス適用細胞をその後、GM−CSF o/o マウス(同族組換えにより生成したGM−CSF欠失マウス;アシュレイ ダン博士から入手)、G−CSF o/o マウス(同族組換えにより生成したG−CSF欠失マウス;アシュレイ ダン博士から入手)または野生型マウスのいずれかに注射した。このプロセスを繰り返し、各マウスに対し合計3回の注射を行った。図5を参照する。この結果から、野生型マウスから単離したPECの移入により、野生型マウスでは1/8,000、G−CSF o/o マウスでは1/16,000、GS−CSF o/o マウスでは1/32,000のCTLp度数が得られた。GM−CSF o/o マウスをさらにM−FPで免疫し、また、GM−CSFを与えた。このマウスにおけるCTLp度数は1/16,000まで増加した。このように、インビトロでox−M−FPを適用したPECに対するCTLp応答は、部分的にGM−CSFに依存し、GM−CSFにより増大させることができる。
【0091】
別の試験において、組換えGM−CSFを1日に当たり1μg、2,3,4,5または6日間、野生型マウスの腹腔内に注射した。マウスからPECを単離し、F4/80または33D抗体および標準方法を用いて計数および染色した。染色した細胞はその後、標準方法を用いてフローサイトメトリにより検出した。マウス1匹当たり、約106の存在するPEC細胞を1日(1回の注射)後に単離した。約9.6×106のマクロファージ(F4/80+細胞)が2日(2回の注射)後に得られ、約1.2×107のマクロファージが3日(3回の注射)後に得られ、約2×107のマクロファージが4から6日(4回から6回の注射)後に得られた。4日後のGM−CSF注射が、最も多くの数のマクロファージを単離するには最適である。1つのグループのマウスにはその後、1日につき1μgの組換えGM−CSFを4日間注射した。5日目に、ox−M−FPを1回だけ、これらのマウスおよびGM−SCFで処理していないマウスのグループに注射した。図6を参照する。GM−CSFで処理し、その後1回のox−M−FP注射を受けたマウスは1/9,900のCTLp度数を有した。GM−CSFを受けなかったが、1回のox−M−FPの注射を受けたマウスでは、1/45,000のCTLp度数が得られた。このように、Ox−M−FPタンパク質の注射に対するCTLp応答はGM−CSFの投与により向上させることができる。
【0092】
7.マウスにおける半同種異系マクロファージの伝達
DBA/2マウスから単離したマクロファージに、上述したようにox−M−FPを適用するか、あるいは適用しなかった。2つの細胞集団はその後、別々にDBA/2、C57BL/6あるいは(DBA/2×C57BL/6)F1マウスのいずれかに注射した。図7を参照する。パルス適用マクロファージをDBA/2マウスに注射すると、1/8,000のCTLp度数が得られ、適用マクロファージをC57BL/6マウスに注射すると、1/220,000のCTLp度数が得られ、適用したマクロファージを(DBA/2×C57BL/6)F1マウスに注射すると、1/10,000のCTLp度数が得られた。非パルス適用マクロファージを注射したマウスでは、CTLp度数は<1/106であった。PECを(DBA/2×C57BL/6)F1マウスから単離し、ox−M−FPを適用した後、それをC57BL/6またはDBA/2マウスのいずれかに注射することを除き、直前に述べたのと同じ方法を繰り返した。(DBA/2×C57BL/6)F1マウスからのox−M−Pパルス適用PECを、C57BL/6またはDBA/2マウスのいずれかに移入させると、高いCTLp度数が得られた。このように免疫応答は半同種異系的に伝達され得る(すなわち、1つのハプロタイプが共有される場合)。
【0093】
ひとまとめにして考えると、セクションAからセクションGまでにおいて説明した結果から、ox−M−FPと共にマクロファージ細胞を培養し、その細胞を同系マウスに養子免疫伝達させると、MUC1に対する特異的CTL応答が誘発されることが示唆された。さらに、酸化−M−FPを適用したマクロファージによる1回の免疫化が、MUC1+腫瘍からの保護につながった。インビトロでox−M−FPを適用したマクロファージを用いた1回の免疫により、CTLpが増加し、ox−M−FP融合タンパク質を用いた3回の免疫で与えられるCTLpと等価になる。このように、インビトロでox−M−FPを適用することによりマンノース受容体を標的とすると、T1細胞免疫応答が起こる。
【実施例2】
【0094】
この実施例では、還元剤であるホウ化水素ナトリウムとシアノホウ化水素ナトリウムとの比較について述べる。
Ox−M−FPは実施例1で説明したように調製した。3つの異なるサンプルを以下のように調製した。ox−M−FPの一部を0.5mg/mlのホウ化水素ナトリウムと結合させて、シッフ塩基およびアルデヒドを還元した。ox−M−FPの別の一部分を0.5mg/mlのシアノホウ化水素ナトリウムと結合させ、優先的にシッフ塩基だけを還元させた。第3の部分は未処理のままとした。3つのサンプルをそれぞれ5μg、別々のマウスに注射した。細胞障害性T細胞度数(CTLp)を、実施例1において一般的に説明した方法を用いて決定した。
【0095】
結果から、シアノホウ化水素ナトリウムで処理したox−M−FPにより誘導されたCTLp度数は1/10,300であることが示唆された。ホウ化水素ナトリウムで処理したox−M−FPにより誘導されたCTLp度数は1/79,500であった。未処理ox−M−FPにより誘導されたCTLp度数は1/14,575であった。まとめて考えると、これらの結果により、ox−M−FP上のアルデヒド基がCTLp誘導には重要であることが示唆された。
【実施例3】
【0096】
この実施例では、GM−CSF、IL−3およびビタミンDと共に末梢血液の単核細胞を培養する効果について述べる。
末梢血単核細胞(PBMC)は、標準方法を用いて、正常なヒトドナーから単離した。新しく単離したPBMCは、無血清のAIM−V培地中の標準6−ウェル組織培養プレートのウェルで、ウェル毎に、2mlの培地当たり10×106の濃度で、2時間培養した。インキュベーション工程後、非付着細胞をウェルから除去した。1ng/mlのGM−CSF、10ng/mlのIL−3、10ng/mlのIL−4、50ng/mlのTNF−αおよび50nMのビタミンDを含む約2mlの新しい無血清AIM−V培地を各ウェルに添加した。細胞は2、4および7日間インキュベートした。
【0097】
それぞれ予め決めた時点で、細胞を収集し、マンノース受容体の発現、および単球、マクロファージならびに樹状細胞を識別する細胞表面標識について分析した。発現は実施例1で一般的に説明した方法を用いてFACS分析により決定した。FACS分析では以下の試薬を用いた:フルオレセイン共役(FITC)酸化マンナン(ox−M−FITC;実施例1で述べた);フィコエリトリン(PE)共役CD11b、PE共役CD11c、PE共役CD14、FITC共役CD68、FITC共役CD80、PE共役CD86およびPE共役CD54。
【0098】
FACS分析の結果を以下の表4に示す。
【0099】
【表4】

最大数のマンノース受容体陽性細胞は、インキュベーション4日の2日の培養の後に生成された。これは、細胞活性化標識を表すCD54、CD80およびCD86保持細胞における増加とよく相関する。
【実施例4】
【0100】
この実施例では、MUC1に対する抗体およびGala(1,3)Gal抗体の結合がそれぞれ、Gala(1,3)GalおよびMUC1との交差反応することについて述べる。
【0101】
いくつかのマウスにおいて、Gala(1,3)GalまたはMUC1に特異的に結合する抗体の存在について分析した。正常なマウス、同系組換えによりGal遺伝子を欠失させたマウス(gal o/oマウス)、および約5μgのMUC1ペプチドにより3回腹腔内に投与して免疫したマウスのいずれかから血清を得た。これらの血清中のMUC1に結合する抗体の存在を、それらの抗体がMUC1を発現する(BT−20細胞またはRMA−MUC1細胞)かまたは発現しない(ME272またはRMA細胞)細胞系に結合する能力を調べることにより決定した。抗体のこれらの細胞への結合は実施例1で一般的に説明した方法を用いてFACS分析により決定した。
【0102】
図8を参照する。正常マウスからの血清はどの細胞系にも結合しなかった。MUC1に対して作製された抗血清は、BT−20細胞(図8のパネルA)およびRMA−MUC1細胞(図8のパネルC)に結合するが、ME272(図8のパネルB)およびRMA細胞(図8のパネルD)には結合しない抗体を含有した。
【0103】
BT−20細胞およびME272細胞はGala(1,3)Galを発現しないが、RMA−MUC1およびRMA細胞はGala(1,3)Galを発現する。gal o/oマウスの血清はガラクトースに対する自然抗体を含み、これは、BT−20細胞(MUC−gal+細胞;図8のパネルA)およびRMA−MUC1細胞(MUC+gal+細胞;図8のパネルC)との反応性により示された。RMA細胞(MUC−gal+;図8のパネルD)では弱く、ME272細胞(MUC−gal−)は陰性であった。gal o/oマウスの血清は、RMA−MUC1細胞により強く結合する抗体を含んでいた。RMA−MUC1細胞はMUC1の発現によってのみ、RMA細胞と異なる。
【0104】
まとめて考えると、これらの結果から、RMA細胞によるMUC1の発現、およびBT−20細胞上でのMUC1の発現が、gal o/oマウス中に存在する抗−gal抗体との反応性を与えることが示唆された。このように、gal o/oマウスで自然に生じる抗体はMUC1と反応し、MUC1に対して作製された抗体はGala(1,3)Galと反応した。
【実施例5】
【0105】
この実施例では、Gala(1,3)Galを発現する動物はGala(1,3)Galに対する自然に生じる抗体を有していないこと、酸化マンナン−MUC1で免疫するとMUC1に結合する抗体を産出しないことを述べる。
【0106】
約5μgのox−M−FP(実施例1に記載)を用いた動物の多重免疫を週1回の間隔で、以下の部位に行った:マウスの腹腔内;ウサギおよびニワトリの筋内;ヒトおよびサル。免疫した動物から得た血清について、以下の方法を用いて酵素結合免疫収着検定法(ELISA)によりMUC1に対する抗体の存在を調べた。標準マイクロタイタープレートをリン酸緩衝液(PBS)の10μg/mlMUC1ペプチド(実施例1に記載)溶液で、約16時間、4℃でコートした。非結合ペプチドをプレートから除去した。プレートを標準方法を用いて洗浄した。その後、プレートをウシ血清アルブミン(BSA)の2%w/v溶液で、約2時間、約4℃でコートした。非結合分をプレートから除去し、標準方法を用いてプレートの洗浄を行った。マウス、ウサギ、ニワトリ、ヒト、サル血清の約50μlの様々な希釈液をコートプレート上の別々のウェルに添加し、約2時間室温でインキュベートした。その後、プレートを洗浄し、非結合抗体を除去した。各種の動物由来の、プレートに結合した抗体の存在は、2次抗体を用いて検出した。2次抗体としては、マウス抗体を検出するためのヒツジ抗マウス抗体、ウサギ抗体を検出するための抗ウサギ抗体、ニワトリ抗体を検出するための抗ニワトリ抗体、ヒト抗体を検出するための抗ヒト抗体、サル抗体を検出するための抗サル抗体が挙げられる。これらの抗体をプレートに添加し、プレートを約1時間、室温でインキュベートした。プレートに結合した2次抗体の存在は、約pH4で、0.03%2,2’−アジノ−ジ(3)−エチルベンズチアゾリンスルホン酸(アマーシャム、イギリス所在(Amersham,U.K.)から入手可能)および0.02%過酸化水素の約0.1Mのクエン酸緩衝液50μlを用いて検出した。反応は約10乃至約15分間、室温で行い、その後、ELISA読み取り装置を用いて、405nmでの吸光度の読み取りを行った。
【0107】
図9を参照する。正常C57BL/6マウスのox−M−FPによる免疫では、マイクロタイタープレート上に固定したMUC1に結合する抗体の検出可能な産出は誘導されなかった。逆に、gal o/oマウスのox−M−FPによる免疫では、MUC1に結合する抗体が高い滴定濃度、約10−4希釈で産出された。gal o/oマウス中に存在するgalに対する自然に生じる抗体は、溶液中の完全なMUC1またはMUC1融合タンパク質と反応するが、マイクロタイタープレート上に固定されたMUC1の合成ペプチドとは反応しない。これから、gal o/oマウスからの免疫前の血清と固定MUC1ペプチドとの反応性が欠如していることが示唆された(図9)。さらに、Gala(1,3)Galに対して陰性のいくつかの他の動物において、ox−M−FPに結合する抗体の高滴定量が示された(表5を参照)。Gala(1,3)Galに対し陰性であるウサギは、MUC1に結合する抗体を産出しなかった。このように、Gala(1,3)Galに対し陽性ではあるがガラクトースに結合する予め存在する抗体を有さない動物(すなわち、マウスおよびウサギ)は、ox−M−FPによる免疫に伴う抗MUC1抗体を産出しなかった。対照的に、ガラクトースに対し陰性である動物(すなわち、ヒト、サル、ニワトリおよびgal o/oマウス)は、ox−M−FPによる免疫に応答して、抗−MUC1抗体を産出した。
【0108】
【表5】

【実施例6】
【0109】
この実施例では、Gala(1,3)Galに対し陽性である動物は、マンナン−MUC1による免疫に応答して、抗体ではなくCTLpを産出することについて述べる。
正常マウスおよびgal o/oマウスにox−M−FPを注射し、得られたCTLp度数を実施例1で一般的に説明した方法を用いて測定した。図11を参照する。正常マウスにox−M−FPを1回または3回注射すると、それぞれ、1/70,000または1/10,000のCTLp度数が得られた。同様にgal o/oマウスに注射すると、1回の注射で1/20,000の、3回の注射で1/60,000のCTLp度数が得られた。正常マウスおよびgal o/oマウスにはまた、同様に、卵白アルブミンから導いた対照標準ペプチドを注射した。ox−M−FPを用いた時に観察された正常マウスとgal o/oマウスにおけるCTLp度数の違いは、卵白アルブミンエピトープを用いた時には観察されなかった。図12を参照する。マンナン結合卵白アルブミンペプチドを用いた正常マウスあるいはgal o/oマウスを3回免疫し、それぞれ、1/10,000および1/12,000のCTLp度数を得た。ゆえに、gal o/oマウスにおけるCTlp度数応答の減小はMUC1に独特のものであり、gal o/oマウスは他の抗原に対するCTLp応答を開始することができた。これらの結果から、ox−M−FP免疫に対するCTLp度数応答はgal o/oマウスに比べ正常マウスにおいて大きいことが示唆された。これらの結果は実施例5において説明した抗体産出結果に反するものである。
【0110】
別の試験において、マウスについてすぐ上で説明したのと同様の方法により、サルをox−M−FPで免疫した。表5を参照する。ox−M−FPで免疫したサルは抗体応答を示したが、CTLp応答は示さなかった。この結果は、gal o/oマウスを用いて得られた結果と同様である。
【0111】
このように、CTLpが測定できる種においては、ガラクトースに対する予め存在する抗体がないこととox−M−FPを用いた免疫によるCTLp応答の向上との間には相関がある。
【実施例7】
【0112】
この実施例では、ガラクトースに対する抗体が、動物の免疫前にox−M−FPと混合されるとCTLpの出現を減小させることについて述べる。
正常マウスに、ox−M−FPまたは抗ガラクトース抗体を含むgal o/o血清と共に混合したox−M−FPのいずれかを1回あるいは3回注射した。実施例1で一般的に説明した方法を用いて、免疫したマウスに対し、CTLp度数を求めた。図11について説明する。1回の注射を受けたマウスでは、ox−M−FPで免疫すると1/62,000のCTLp度数が、gal o/o血清と混合したox−M−FPで免疫すると1/275,000のCTLp度数が得られた。同様に、3回注射したマウスに対しては、CTLp度数は、ox−M−FPで1/8,000、gal o/o血清と混合したox−M−FPで1/59,000であった。このように、ox−M−FPに抗−ガラクトース抗体を添加すると、正常マウスにおけるCTLp度数の生成はgal o/oマウスにおいて観察されるレベルまで制限された。さらに、正常マウスに、gal o/o血清と共に混合したox−M−FPを注射すると、かなりの抗体が産出された(表5を参照)。
【実施例8】
【0113】
この実施例では、インビトロでox−M−FPを適用したマクロファージ細胞による正常マウスおよびgal o/oマウスの免疫と、そのようなマウスにおける抗体ではなくCTLpの産出とについて述べる。
【0114】
マクロファージ細胞は実施例1で一般的に説明した方法を用いてC57BL/6マウスから得た。マクロファージ細胞には、実施例1で一般的に説明した方法を用いて、ox−M−FPまたはgal o/o血清と混合したox−M−FPのいずれかを一晩中、パルス適用した。正常マウスおよびgal o/oマウスは実施例1で一般的に説明した適用マクロファージ細胞で免疫した。
【0115】
図13を参照する。パルス適用したマクロファージによるgal o/oマウスの免疫では、CTLpは正常マウスと本質的に等価なレベルまで誘導された(それぞれ、1/11,500および1/8,000)が、検出可能な抗体応答は誘導されなかった(図10を参照のこと)。gal o/o血清と混合したox−M−FPをパルス適用したマクロファージを用いたマウスの免疫では、強いCTLp応答は誘導されなかった。
【0116】
本発明の様々な実施の形態において詳細に説明してきたが、これらの実施の形態の変更および改良は当業者であれば可能であることは明らかであろう。しかしながら、このような変更および改良は特許請求の範囲に記載されるように本発明の範囲内にあることを明白に理解すべきである。
【技術分野】
【0001】
本発明は、炭水化物化合物を用いてT細胞活性を調節するための生産物および方法に関する。本発明の生産物は、特に、マンノース受容体保有細胞および抗原に結合された酸化マンノースに関し、該生産物はクラスIMHC抗原提示を高めることができる。
【背景技術】
【0002】
癌は現代社会において、死亡や重大障害の主要な原因となっている。癌は若者、老人、男性、女性を苦しめ、あらゆる人種の人々が癌にかかる可能性があるが、子供の癌には、おそらく小児白血病などの例外はあるものの比較的希である。西洋社会において、結腸および肺の癌は主要な病気となっている。女性では、乳癌が最も一般的な癌の形態である。
【0003】
多くの癌にはヒトムチンの過剰産生が伴う。ムチンは、多くの上皮細胞および腫瘍によって産生される、約100キロダルトン(kD)を越える高度にグリコシル化されたタンパク質である(非特許文献1)。癌細胞上に見られるムチンは、いくつかのムチンが炭水化物被覆に欠損を有し、その結果タンパク質コアが露出しているというように、正常な上皮細胞上で見られるムチンとはいくつかの点で異なっている(非特許文献2)。ヒトのムチンには、MUC1、MUC2、MUC3、MUC4、MUC5、MUC6およびMUC7と呼ばれる7つの型が知られている(非特許文献3乃至6)。MUC1は、最も至るところで見られる。様々なムチンのどれもが非常に類似した性質、すなわちそれらは貫膜糖タンパク質であり、いずれもセリン、スレオニンおよびプロリン含量の高い不定数の反復アミノ酸配列を有するという性質を有している。変異的にグリコシル化されたムチン(非グリコシル化またはグリコシル化欠失のいずれか)の過剰産生が、乳房、卵巣、膵臓、結腸、肺、前立腺の腫瘍、および他の分泌組織の腫瘍に特徴的にみられる。ヒトムチンMUC1〜MUC7のそれぞれのタンパク質コアのコピーDNA(cDNA)配列が、クローン化および特徴付けされ、不定数の特殊なアミノ酸モチーフ(VNTRモチーフとして知られている)の反復からなる、反復性の高い中央部分を含むことが発見されている。例示として、MUC1は、40〜80の縦一列に配列した20アミノ酸モチーフの複製物または反復物を含む反復性の高い中央部分によって分離された、固有のアミノおよびカルボキシル末端配列から構成される。MUC1〜MUC7のVNTRモチーフは、以下に列挙する通りである。
MUC1 VNTR−SAPDTRPAPGSTAPPAHGVT(配列番号1)
MUC2 VNTR−PTTTPISTTTMVTPTPTGTQT(配列番号2)
MUC3 VNTR−HSTPSFTSSITTTETTS(配列番号3)
MUC4 VNTR−TSSASTGHATPLPVTD(配列番号4)
MUC5 VNTR−PTTSTTSA(494塩基対挿入配列−8アミノ酸縦列反復)
MUC6 VNTR−169アミノ酸反復単位(配列番号5)
MUC7 VNTR−TTAAPPTPPATTPAPPSSSAPPE(配列番号6)
MUC6の反復サブユニットは169個のアミノ酸から構成されるが、現時点においては、この反復単位のアミノ酸配列は完全には特徴付けされていない。MUC7の配列は、最近になって発表された(上記非特許文献6)。
【0004】
フィン(Finn)とその同僚達は、乳癌(非特許文献7及び8)、膵臓癌、卵巣および他の腫瘍に罹患した患者のリンパ節の中に、ヒトムチンと反応する細胞障害性リンパ球が存在することを実証した。MUC1ペプチドに対する抗体は、MUC1および標的細胞に対するこれらの細胞障害性Tリンパ球の活性を阻害することができる(上記非特許文献7および上記非特許文献8)。最近では、ネズミの肺癌に対する細胞障害性リンパ球についての報告もなされている(非特許文献9)。
【0005】
腫瘍除去に関連する外科手術は患者に外傷を与え、たいていは外観を傷つけ、費用もかかる。外科的処置に代えて、もしくは外科的処置と組み合わせて行うことのできる、腫瘍治療のために確立された化学的治療および照射方法は、大抵の場合、衰弱をもたらすとともに重大な副作用を随伴する。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Gendler et al.,J.Biol.Chem.,263:12820−12823,1988
【非特許文献2】Harisch et al.,J.Biol.Chem.,264:872−883,1989
【非特許文献3】Marjolijn et al.,J.Biol.Chem,265:5573−5578,1990
【非特許文献4】Crocker et al.,Br.J.Cancer,55:651−652,1987
【非特許文献5】Apostolopoulos et al.,Crit.Rev.Immunol.,14:293−309,1994
【非特許文献6】Bobek et al.,J.Biol.Chem.,268:20563−2056 9,1993
【非特許文献7】Barnd et al.,Proc.Natl.Acad.Sci USA,86:7159−7163,1989
【非特許文献8】Jerome et al.,in Cell.Immunity and Immunotherapy of Cancer,pp.321−328,1990
【非特許文献9】Mandelboimo et al.,Nature,369:67−71,1994
【発明の概要】
【発明が解決しようとする課題】
【0007】
したがって、腫瘍の予防/治療のための免疫調節組成物および方法が緊急に必要とされている。
癌を治療するための新しい組成物および方法が緊急に必要とされている。同様に、他の病状、たとえばI型アレルギー、マラリア、HIV、虫歯、インフルエンザ、コレラ、口蹄疫、髄膜炎、リーシュマニア感染、百日咳、狂犬病、連鎖球菌感染、呼吸感染、麻疹、ライム病、結核、細菌性髄膜炎、帯状ヘルペス、風疹、肝炎、疱疹、A型肝炎、ポリオ、性病/トラコーマ、B型肝炎、一般的な感冒、頸部癌、髄膜炎/肺炎、水痘、痘瘡、および肺炎/PUO(原因不明熱)などの治療のための代替の組成物および方法が緊急に必要とされている。
【課題を解決するための手段】
【0008】
上記した課題を解決するために、請求項1に記載の発明は、動物において、抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物であって、同組成物は、マンノースを含む炭水化物ポリマーと、抗原と、を有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、同炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、動物に投与する前に、マンノース受容体保有抗原提示細胞は、インビトロ又はイクスビボにて同複合体をパルス適用される、製薬組成物、を提供する。
【0009】
請求項2に記載の発明は、請求項1に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、末梢血白血球、骨髄、幹細胞、腹腔細胞、脾臓、肺およびリンパ節からなる群から選択される細胞集団に由来する、ことをその要旨とする。
【0010】
請求項3に記載の発明は、請求項1又は2に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、マクロファージ細胞及び樹状細胞からなる群から選択される、ことをその要旨とする。
【0011】
請求項4に記載の発明は、請求項1乃至3のいずれか一項に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、CD11b、CD14、CD68、CD80およびCD86からなる群から選択される分子を発現する、ことをその要旨とする。
【0012】
請求項5に記載の発明は、請求項1乃至4のいずれか一項に記載の製薬組成物において、マンノース受容体保有抗原提示細胞は、サイトカイン及びビタミンからなる群から選択される1以上の生体応答調節剤と接触された細胞を含み、同細胞は、当該細胞による炭水化物受容体の発現を誘導するのに効果的な条件にて接触される、ことをその要旨とする。
【0013】
請求項6に記載の発明は、請求項5に記載の製薬組成物において、生体応答調節剤は、抗原提示細胞においてマンノース受容体の発現を誘導する、ことをその要旨とする。
請求項7に記載の発明は、請求項5又は6に記載の製薬組成物において、生体応答調節剤は、顆粒球マクロファージ刺激因子(GM−CSF)、インターロイキン−3、インターロイキン−4、ビタミンD、マクロファージコロニー刺激因子(M−CSF)、Flt−3リガンドおよび腫瘍壊死因子(TNF)αからなる群から選択される、ことをその要旨とする。
【0014】
請求項8に記載の発明は、請求項1乃至7のいずれか一項に記載の製薬組成物において、抗原は、ムチンポリペプチド、ムチンポリペプチドの1以上の反復サブユニット、または抗原フラグメントであり、前記フラグメントは、少なくとも5個のアミノ酸の反復サブユニットを含む、ことをその要旨とする。
【0015】
請求項9に記載の発明は、請求項8に記載の製薬組成物において、ムチンはヒトムチンである、ことをその要旨とする。
請求項10に記載の発明は、請求項9に記載の製薬組成物において、抗原は、ヒトムチンの反復サブユニットの2乃至80のコピーを含む、ことをその要旨とする。
【0016】
請求項11に記載の発明は、請求項8乃至10のいずれか一項に記載の製薬組成物において、抗原の1以上の反復サブユニットは融合ポリペプチドの部分を含む、ことをその要旨とする。
【0017】
請求項12に記載の発明は、動物の抗原に対する細胞障害性T細胞応答を誘導するための医薬品の製造において有効量の組成物を使用する方法であって、同組成物は、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、かつ動物に投与する前に、マンノース受容体保有抗原提示細胞がインビトロ又はイクスビボにて複合体をパルス適用される、組成物、を使用する方法を提供する。
【0018】
本発明は、動物におけるTリンパ球(T細胞)応答を調節することができ、これにより、病気の発生を治療または緩和することのできる免疫調節組成物を提供する。本発明は、抗原を、クラスI分子による提示のためにクラスIMHC経路に送達し、これにより細胞障害性Tリンパ球およびT1(すなわちTH1)サイトカイン、たとえば、IL−2、IL−12、およびγ−インターフェロンなどの産生を誘導することによってT細胞応答を調節するので、有益である。本発明は、本発明の抗原:炭水化物ポリマー複合体の取り込みを、該複合体の抗原と反応するT細胞を活性化することのできる、細胞上のマンノース受容体を誘導することにより高めて、T細胞応答を調節するという点で特に有益である。さらに、本発明は、たとえばムチンなどの抗原が、動物内の抗原に対抗するか交差反応する天然に存在する抗体によって捕捉されるのを防止するように、本発明の抗原、たとえばムチン:炭水化物ポリマー複合体を動物に投与することができるので、特に有益である。さらに本発明の免疫調節組成物は、動物への投与に対して実質的に無毒であるという利点を有しているので、動物への許容性が大きい。
【0019】
本発明の1実施形態は、単離されたマンノース受容体保有細胞と、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体とを含む免疫調節組成物を含む。好ましい抗原としては、腫瘍、ウイルス、真菌、原生動物または細菌の抗原が含まれる。好ましい酸化マンノースは、アルデヒドを有する炭水化物ポリマーを含む。
【0020】
本発明の他の実施形態は、免疫調節マンノース受容体保有細胞集団を含む組成物を含み、該集団は、免疫調節マンノース受容体保有細胞集団を生産するのに効果的な条件下でマンノース受容体保有細胞を培養することによって得ることができ、該条件は抗原送達培地(antigen delivery medium)を含む。好ましい抗原送達培地は、抗原と、完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースとから成る複合体を含む。
【0021】
本発明のさらに別の実施形態は、免疫調節マンノース受容体保有細胞集団を含み、免疫調節マンノース受容体保有細胞集団は、以下の工程(a)および(b)を含む方法によって得ることができる。(a)インビトロにおいて、マンノース受容体保有細胞を1つ以上の生体応答調節剤とともに培養し、強化マンノース受容体保有細胞集団を生産させる。(b)強化マンノース受容体保有細胞集団を、抗原と、完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースとから成る複合体とともにインキュベートし、免疫調節マンノース受容体保有細胞集団を得る。好ましい生体応答調節剤としては、サイトカインおよびビタミンが含まれる。
【0022】
本発明は、単離されたマンノース受容体保有細胞と、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体とを含む抗原送達ベヒクルをも含む。好ましい抗原としては、ムチンが含まれる。
【0023】
本発明は、免疫調節マンノース受容体保有細胞を含む集団を得るための方法であって、マンノース受容体保有細胞に対して強化された細胞集団を、免疫調節マンノース受容体保有細胞を得るのに効果的な条件下で培養することを含み、該条件は抗原送達培地を含むことを特徴とする方法をも含む。好ましくは、上記方法は、マンノース受容体保有細胞に対して強化された細胞集団を、培養工程に先だって1つ以上の生体応答調節剤の存在下でインキュベートすることを含む。
【0024】
本発明の他の実施形態は、免疫応答を誘導する方法であって、レシピエント動物に対して、マンノース受容体保有細胞と、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体とを含む免疫調節組成物を有効量投与することを含む方法を含む。
【0025】
本発明は、抗原に対する免疫応答を誘導する方法であって、単離されたマンノース受容体保有細胞を、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体と接触させることと、該接触後の細胞を動物に投与することとを含む方法をも含む。
【0026】
さらに本発明には、抗原、および完全に酸化されたマンノースおよび/またはアルデヒドを有する部分的に還元されたマンノースを含むマンノースから成る複合体に接触させたマンノース受容体保有細胞を動物に投与することによって、動物に抗原を送達するための方法が含まれ、該方法において、マンノース受容体保有細胞は、T細胞からの応答が誘引されるように、T細胞に対する抗原を提示することができる。
【0027】
本発明のさらなる実施形態は、アルデヒド基を有する部分的に還元された炭水化物を含む炭水化物ポリマーに結合された抗原を含む化合物である。
【発明の効果】
【0028】
本発明によれば、動物において抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物であって、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、かつ動物に投与する前に、マンノース受容体保有抗原提示細胞がインビトロ又はイクスビボにて複合体をパルス適用される、製薬組成物、が得られた。
【図面の簡単な説明】
【0029】
【図1】異なる形のマンノースポリマーをパルス適用した腹膜滲出細胞を用いて、1回のインビトロ免疫化を行った場合と、3回のインビボ免疫化を行った場合とで得られたCTLp度数の比較図。
【図2】T細胞応答を誘導するのに必要とされる抗原提示マンノース受容体保有細胞の最小数を示した図。
【図3】酸化MUC1、酸化マンナン融合タンパク質、あるいは緩衝液のみをパルス適用した、腹膜滲出抗原提示マンノース受容体保有細胞によって免疫化されたマウスにおける腫瘍成長を示した図。
【図4】GM−CSFまたはγ−インターフェロンで処理され、酸化マンナン融合タンパク質をパルス適用した、抗原提示マンノース受容体保有細胞を含む、腹膜滲出細胞を用いた場合のCTLp度数を示した図。
【図5】酸化マンナン融合タンパク質で免疫化した、GM−CSFまたはG−CSF遺伝子をノックアウトしたマウスのCTLp度数を示した図。
【図6】酸化マンナン融合タンパク質の注射前にGM−CSFを注射したマウスにおけるCTLp度数を示した図。
【図7】酸化マンナン融合タンパク質をパルス適用したマクロファージの半同種異系および同種異系レシピエントにおけるCTLp度数を示した図。
【図8】Gala(1,3)Gal−細胞系およびGala(1,3)Gal+細胞系における、MUC1とガラクトースとの間の交差反応のFACS分析結果を示した図。
【図9】酸化マンナン融合タンパク質で免疫化したGal o/oマウスおよびC57BL/6マウスから分離した血清中の抗MUC1ペプチド抗体の検出結果を示した図。
【図10】酸化マンナン融合タンパク質、もしくは酸化マンナン融合タンパク質をパルス適用したマクロファージで免疫化したGal o/oマウスから分離した血清中の抗MUC1ペプチド抗体の検出結果を示した図。
【図11】ox−M−FPを注射した正常なマウスと、gal o/o血清と混合したox−M−FPを注射した正常なマウスとの間のCTLp度数の差を示した図。
【図12】ox−M−SIINFEKLを与えたマクロファージ細胞で免疫化したマウスと、gal o/o血清と混合したox−M−SIINFEKLを与えたマクロファージ細胞で免疫化したマウスとの間のCTLp度数の差を示した図。
【図13】正常なマウスの血清またはGal o/oマウスから分離した血清のいずれかの存在下における、マクロファージおよび酸化マンナン融合タンパク質で免疫化した、正常なマウスとGal o/oマウスとの間のCTLp度数の差を示した図。
【図14】マンナンへのMUC1融合タンパク質の結合を示した図。
【発明を実施するための形態】
【0030】
本発明は、免疫調節の影響を受けやすい動物において、病気の発生を治療または緩和するための生産物および方法を提供する。特に、本発明の生産物は、炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体とを含む免疫調節組成物を含む。
【0031】
本発明の1実施形態は、単離された炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体とを含む免疫調節組成物である。本明細書中で用いる「酸化炭水化物」という用語は、完全に(すなわち全体的に)酸化された炭水化物、あるいはアルデヒドを有する部分的に還元された炭水化物(以下で詳細に説明する)を示しうる。本発明の他の実施形態は、抗原および酸化炭水化物から成る複合体に接触させた受容体保有細胞である。本発明によれば、「炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体」または「抗原および酸化炭水化物から成る複合体に接触させた炭水化物受容体保有細胞」を含む組成物という場合、以下の(1)〜(5)の1つ以上を含意し得る。(1)複合体が細胞に結合していない状態の複合体と受容体保有細胞との混合物、(2)複合体が細胞に結合しているが内在化されていない状態の複合体と受容体保有細胞との混合物、(3)複合体が内在化された状態の受容体保有細胞、(4)複合体が内在化され、プロセシングを受けた状態の受容体保有細胞、および/または、(5)複合体が内在化され、プロセシングを受け、提示された状態の受容体保有細胞。不定冠詞「a」または「an」で示される実体は、1つ以上の実体のことをいい、たとえば「化合物(a compound)」という場合には、1つ以上の化合物のことを指すことを注記しておく。そのようなものとして、「a」(または「an」)、「1つ以上」および「少なくとも1つの」という用語も、本明細書中で互換的に使用されることがある。「単離された」という用語は、それ自身の自然の環境から移転された、細胞、ポリペプチドまたはペプチドなどの実体のことをいう。これに関して、「単離された」という用語は、その実体が精製された程度を反映するものではない。本明細書中で用いる「炭水化物受容体保有細胞」とは、細胞表面上の炭水化物に特異的に結合する受容体(すなわち、タンパク質)を含むか、あるいは炭水化物受容体を発現することの可能なあらゆる種類の細胞のことをいう。本明細書中で用いる炭水化物受容体とは、当業者周知の炭水化物受容体のことをいう。炭水化物受容体保有細胞は、様々な濃度の炭水化物受容体保有細胞を含む細胞集団の一部でもあり得ることを注記しておく。したがって、炭水化物受容体保有細胞の集団には、少なくとも1つの炭水化物受容体保有細胞を含む細胞集団が含まれる。あるいは、炭水化物受容体保有細胞の集団は、炭水化物受容体保有細胞の純粋集団から成るものであってもよい(すなわち、100%炭水化物受容体保有細胞)。好ましくは、炭水化物受容体保有細胞の集団は、少なくとも約25%、より好ましくは少なくとも約50%、さらに好ましくは少なくとも約75%、さらに好ましくは少なくとも約80%、さらに好ましくは少なくとも約85%、さらに好ましくは約90%、さらに好ましくは約95%の炭水化物受容体保有細胞を含む。炭水化物受容体保有細胞の集団の相対純度は、炭水化物受容体保有細胞の起源に左右されうることに注目することは当業者の知識の範囲である。本明細書中で用いる「炭水化物受容体保有細胞の強化集団」とは、炭水化物受容体保有細胞(すなわち、炭水化物受容体を有するか、あるいはこれを発現可能な細胞)ではない細胞が集団から除去されるように処理された細胞集団のことをいう。本明細書中で用いる「増加炭水化物受容体保有細胞集団」とは、炭水化物受容体を保有する細胞の数、および/または細胞上の炭水化物受容体の数が、処理前の集団内の細胞に比べて増加するように処理された細胞の集団のことをいう。炭水化物受容体保有細胞は、たとえば、血液、骨髄、リンパ節、または気管支洗浄からの細胞集団内において、当該技術分野における標準的な方法を用いて強化することができる。そのような方法としては、パニング、白血球伝達(leukophoresis)または増殖強化法が含まれるが、それらに限定されるわけではない。炭水化物受容体保有細胞の集団を増加する方法について、ここで詳細に説明する。
【0032】
本発明で使用される適切な炭水化物受容体保有細胞には、動物から単離された細胞、または、組織培養に適合させ、インビトロにおいて増殖させた細胞が含まれる。本明細書中で用いる「インビトロ」という用語は、動物外部で行われる方法のことをいう。「イクス ビボ(ex vivo)」という用語は、動物外部において、動物(すなわちドナー動物)の一部分(たとえば、組織、細胞および体液)に対して行われ、該部分を動物(すなわちレシピエント動物)の同じ一部分に戻すことが意図された方法のことをいう。レシピエント動物は、ドナー動物と同一の動物である必要はない。本発明の好ましい炭水化物受容体保有細胞は、骨髄、末梢血液白血球、肺胞マクロファージ、幹細胞、腫瘍細胞、および/または、間質細胞から得られる。細胞は、細胞の起源に応じた当該技術分野において知られる標準的な方法を用いて、動物から単離することができる。より好ましい炭水化物受容体保有細胞には、抗原提示細胞(APC)に対して強化した細胞が含まれる。適切な抗原提示細胞には、T細胞に対する抗原を提示することによって、T細胞応答を誘引することのできる細胞が含まれる。免疫応答の部分は、主要組織適合性遺伝子複合体(MHC)による抗原提示によって調節される。MHCは、抗原に由来するペプチド断片と結合して、T細胞表面上のT細胞レセプターによって認識される複合体を形成し、その結果、MHC拘束性T細胞認識の現象を引き起こす。「T細胞応答」とは、MHCによって提示された抗原およびペプチド複合体に対する、T細胞の応答のことをいう。T細胞による応答は、天然のT細胞などを用いてのT細胞の活性化、あるいはすでに活性化されているT細胞を用いてのT細胞刺激を含んでいてもよい。「細胞媒介性免疫応答」とは、T細胞の活性化および/または刺激を含む免疫応答のことをいう。本発明によれば、本発明の複合体または組成物は、T細胞、特に抗原特異的T細胞を活性化および/または刺激することによってT細胞応答を誘引することができる。好ましい抗原提示細胞には、樹状細胞、単球、マクロファージ、およびBリンパ球(B細胞)が含まれるが、マクロファージおよび単球細胞がより好ましい。さらに好ましい炭水化物受容体保有細胞には、マンノース受容体保有細胞、すなわち、マンノース受容体を有する細胞が含まれる。本明細書中で用いられる「受容体担持」細胞および受容体陽性細胞は、互換的に使用されるものとする。本発明のさらに好ましい炭水化物受容体保有細胞には、F4/80,抗MAC−1抗体、抗マンノース受容体抗体、NLDC−145、抗CD14抗体、抗CD11b抗体、抗CD11c抗体、抗CD68抗体、抗CD80抗体または抗CD86抗体を含む抗体に特異的に結合する細胞を強化した細胞が含まれる。
【0033】
好ましくは、本発明の炭水化物受容体保有細胞は、免疫調節組成物の目的とするレシピエントである動物、あるいは目的とするレシピエントにMHC適合された動物、たとえば、血縁関係のないドナーまたは当該動物の親戚、好ましくは当該動物の兄弟姉妹を起源とするものである。好ましい炭水化物受容体保有細胞は、本発明の免疫調節組成物の目的とするレシピエントである動物から得られたものである。
【0034】
1実施形態において、本発明の炭水化物受容体保有細胞には、炭水化物受容体を発現することのできる細胞上の炭水化物に対する、受容体の発現を誘導できる化合物に接触させた炭水化物受容体保有細胞が含まれる。炭水化物受容体の発現を誘導するために用いられる適切な化合物には、サイトカインなどの生体応答調節剤が含まれる。本発明の好ましい生体応答調節剤には、単球、マクロファージおよび/または樹状細胞上の炭水化物受容体の発現を誘導することができるあらゆる化合物が含まれる。より好ましい生体応答調節剤には、サイトカインおよびビタミンが含まれるが、これらに限定されるわけではない。細胞表面上の炭水化物受容体の数を増加させるために有用な好ましいサイトカインには、顆粒球マクロファージコロニー刺激因子(GM−CSF)、インターロイキン−3(IL−3)、インターロイキン−4(IL−4)、γ−インターフェロン、Flt−3リガンド、顆粒球コロニー刺激因子(G−CSF)、インターロイキン−12(IL−12)、腫瘍壊死因子α(TNF−α)、マクロファージコロニー刺激因子(M−CSF)、インターロイキン−3(IL−3)、インターロイキン−4(IL−4)、および/または、インターロイキン−6(IL−6)が含まれ、これらに限定されるわけではないが、GM−CSFおよびIL−3がより好ましい。本発明で使用される好ましいビタミンには、ビタミンDが含まれるが、これに限定されるわけではない。
【0035】
本発明によれば、炭水化物受容体保有細胞は、該炭水化物受容体保有細胞を動物から取り除く前若しくは後に、生体応答調節剤と接触させることができる。これに関して、生体応答調節剤は、インビボにおいて細胞上の炭水化物受容体を誘導するのに適した条件下で動物に投与することができる。
【0036】
好ましい実施形態において、本発明の炭水化物受容体保有細胞は、GM−CSF、IL−3、IL−4、TNFγおよび/またはビタミンDを含む調剤に接触させた、単球、マクロファージおよび/または樹状細胞の細胞集団を含む。
【0037】
本発明の1実施形態は、免疫調節炭水化物受容体保有細胞を含む細胞集団を得るための方法であって、該方法は、炭水化物受容体保有細胞を強化した細胞集団を、免疫調節炭水化物受容体保有細胞を得るのに効果的な条件下で培養する工程を含み、前記条件は抗原送達培地を含む。抗原送達培地は、本発明の複合体、好ましくは抗原および酸化炭水化物から成る複合体を含む。抗原送達培地の追加成分としては、本明細書の実施例の中で開示する適当な細胞培養培地および当業者周知のものが含まれる。炭水化物受容体保有細胞に対して強化した細胞集団の培養方法は、本明細書の実施例の中に開示されている。好ましくは、培養工程は約1日間〜約12日間、より好ましくは約3日間〜約10日間、さらに好ましくは約5日間〜約7日間かけて行われるが、約5日間がさらに好ましい。
【0038】
本発明はまた、以下の工程(a)および(b)を含む方法によって得られる免疫調節炭水化物受容体保有細胞集団を含む。(a)インビトロにおいて、1つ以上の生体応答調節剤とともに炭水化物受容体保有細胞を培養し、増加炭水化物受容体保有細胞集団を生産させる。(b)前記増加炭水化物受容体保有細胞集団を、抗原および酸化炭水化物から成る複合体とともにインキュベートし、免疫調節炭水化物受容体保有細胞集団を得る。好ましくは、培養の工程は、約1時間〜約6時間、より好ましくは約2時間〜約4時間、さらに好ましくは3時間かけて行われる。本方法によって得られる好ましい炭水化物受容体保有細胞には、マンノース受容体保有細胞が含まれる。
【0039】
本発明によれば、抗原としてはポリペプチドまたはペプチドが含まれる。本発明の抗原は、細胞性または体液性の免疫応答に至る一連の事象を開始させる。特に、本発明の抗原には、MHCに関連してT細胞に対して提示されるものが含まれる。本発明で使用される適切な抗原には、ポリペプチドおよびペプチドが含まれる。抗原を含むポリペプチドは、ペプチド合成、タンパク質精製、あるいは宿主細胞中でのポリペプチドの発現などの、周知の方法によって製造することができる。ペプチド合成は約100個までのアミノ酸(たとえばMUC1の5つの反復サブユニット)を含むポリペプチドに対して使用することができる。一般に、約20個以上のアミノ酸を含むポリペプチドに対しての好ましい製造手段は、宿主細胞、好ましくは原核宿主細胞、より好ましくは細菌宿主細胞内での組み換え発現である。しかしながら、前述のように真核系も使用することができる。宿主細胞中における組換え型タンパク質の発現方法は、十分に確立されており、たとえば、サンブルック(Sambrook)らによる、「分子クローニング:実験室マニュアル(Molecular Cloning:A Laboratory Manual)」(コールドスプリンハーバー出版、コールドスプリングハーバー、1989年)を参照されたい。
【0040】
本発明によれば、本発明のペプチドは単離されたペプチドである。単離されたペプチドとは、自身の天然の環境におかれていないペプチドのことをいう。本発明の単離ペプチドは、その天然の起源から得るか、完全な長さのタンパク質またはより大きなタンパク質断片からタンパク質分解によって製造するか、組み換えDNA技術を用いて製造するか、あるいは標準的な化学的ペプチド合成法を用いて合成するかのいずれかによって得ることができる。
【0041】
本発明に関する限り、抗原は、ウイルス、微生物もしくは植物に由来する自己抗原または抗原性ペプチド、あるいは、ウイルス、微生物または植物に由来する自己抗原または抗原性ペプチドの全長内の少なくとも5個のアミノ酸から成るアミノ酸サブユニットであってもよい。本発明の抗原は、(上述のように)互いに結合された1つより多くの、5個以上のアミノ酸で構成されるサブユニットから成るものであってもよい。これらの結合されたサブユニットは、上述した範囲内の同一起源または異なる起源に由来するものであり得る。本発明の抗原性ペプチドは、MHC分子に結合することができる。
【0042】
本発明の組成物に使用するのに適した抗原の例としては、以下のものが含まれる。腫瘍抗原:これにはCEA、p53、Her2/neu、ErB2、メランA、MAGE抗原、nm23、BRACA1、BRACA2などが含まれるが、それらに限定されるわけではない;花粉、C型肝炎ウイルス(HIV)コア、E1、E2およびNS2タンパク質;熱帯熱マラリア原虫(Plasmodium faliciparum)周辺スポロゾイトタンパク質;HIV−gp120/160エンベロープ糖タンパク質;連鎖球菌表面タンパク質抗原;インフルエンザ核タンパク質;血球凝集素ノイラミニダーゼ表面感染;TcpAピリンサブユニット;VP1タンパク質;LMCV核タンパク質;レーシュマニア主要表面糖タンパク質(gp63);百日咳菌(Bordetella partussis)表面タンパク質;狂犬病ウイルスGタンパク質;連鎖球菌Mタンパク質;呼吸合胞体ウイルス(RSV)FまたはGタンパク質;エプスタイン−バーウイルス(EBV)gp340または核抗原3A、血球凝集素、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)外表タンパク質(Osp)A、ヒト結核菌(Mycobacterium tuberculosis)38kDaリポタンパク質またはAg85、髄膜炎菌(Neisseria meningitides)クラスI外部タンパク質;水痘ウイルスIE62およびgpI、風疹ウイルスキャプシドタンパク質;B型肝炎ウイルスプレS1抗原、I型単純疱疹ウイルス糖タンパク質GまたはgpDまたはCP27、マリーバレー脳炎ウイルスE糖タンパク質、A型肝炎ウイルスVP1、ポリオウイルスキャプシドタンパク質VP1,VP2およびVP3、トラコーマクラミジア表面タンパク質、B型肝炎ウイルスエンベロープ抗原プレS2、ヒトライノウイルス(HRV)キャプシド、腫瘍遺伝子E6およびE7からの乳頭腫ウイルスペプチド、リステリア属表面タンパク質、水痘ウイルスエンベロープタンパク質、ワクシニアウイルスエンベロープタンパク質、ブルセラ属表面タンパク質、1つ以上の上記抗原の組み合わせ、5個以上のアミノ酸長からなる前記抗原のアミノ酸サブユニット、または1つ以上のそのようなアミノ酸サブユニットの組み合せである。
【0043】
本発明の抗原は、全細胞またはその細胞下画分から構成されてもよい。そのような細胞または細胞下画分は、あらゆる腫瘍のタイプまたは他の起源に由来するものであってもよい。全細胞または細胞下画分を得ることのできる癌の種類の例としては、乳癌、肺癌、膵臓癌および結腸癌、ならびに黒色腫が挙げられる。腫瘍から得られる特異的抗原のいくつかの他の例としては、黒色腫特異的抗原(たとえば、MAGE系抗原)、結腸および他の癌に由来する癌胎児性抗原(CEA)、あるいは実際にはあらゆる腫瘍から抽出された抗原が挙げられる。
【0044】
本発明は、上で列挙したいずれか1つ以上の抗原を含み、特に、ヒトムチンMUC1〜MUC7のうちのいずれか1つ以上を含み、これらのヒトムチンはすべて、上述のように、セリン、スレオニンおよびプロリン含量の高い反復アミノ酸配列から成る反復性の高い中央部分を含んでいる。特に、本発明の組成物は、ヒトムチンポリペプチド(正常な対立遺伝子変形に伴う不定数の反復を含む)を含んでいてもよいし、あるいは、1つ以上のヒトムチン反復配列、好ましくは2〜80回、より好ましくは2〜20回、さらに好ましくは2〜10回のヒトムチンの反復サブユニットを含んでいてもよい。ヒトムチンおよびそのサブユニットは、好ましくはグリコシル化されていないか、あるいは、癌細胞上に見られる、炭水化物被覆が欠失してタンパク質コアが露出したムチンに対する免疫応答を誘発させるように変異的にグリコシル化されている。ヒトムチンMUC1を使用するのが特に好ましいが、本発明はあらゆる抗原の使用、特にヒトムチンMUC1〜MUC7の使用にも拡張されることが明確に理解される。便宜上、これから先はMUCという語を、ヒトムチンMUC1〜MUC7およびそれらのサブユニットのいずれかを指すために用いる。これから先、ヒトムチンのみを取り扱うが、本発明は上述したような他の抗原のいずれにも同等に関連することに留意すべきである。
【0045】
MUCの断片は炭水化物ポリマーに結合されていてもよい。これらの断片は炭水化物に結合可能な分子MUCのいずれの部分を含んでもよい。MUC分子の断片には、MUC分子の天然に存在する配列、および/または、MUC分子に由来する配列の断片であって、クラスIMHC分子へのMUC分子の結合性を高めるように修飾された断片が含まれる。MHC分子を模擬する方法には、ペプチド合成や組み換えDNA技術などの、当該技術分野において周知の方法が含まれる。好ましいMUC分子の断片は、MUC分子のペプチドを含む。好ましいMUC分子のペプチドは、約5〜約20個のアミノ酸から成る。好ましいMUC分子の断片は、非VNTRまたはVNTR領域を含む。より好ましいMUC分子の断片には、APDTR(配列番号7)、APDTRPAPG(配列番号8)、DTRPAPGSTAPP(配列番号9)などを含むアミノ酸配列を有するペプチドが含まれる。説明の便宜上、これらの断片もまたMUCの定義の中に含める。同様に、少なくとも5個のアミノ酸から成る他の抗原断片もまた、炭水化物ポリマーに結合させることができる。
【0046】
本発明の特定の抗原は、組み換え宿主細胞中での融合タンパク質の産生における発現と精製を容易化するために、融合タンパク質の一部を構成してもよい。融合タンパク質の非抗原部分は、一般に融合ポリペプチドのアミノ末端領域に出現し、カルボキシ末端配列が抗原配列を含んでいる。融合タンパク質は、グルタチオン−S−トランスフェラーゼ、β−ガラクトシダーゼ、または他のタンパク質あるいはその一部であって、特に産生される融合タンパク質を精製するための、タンパク質の結合能または他の親和性を利用したアフィニティー精製を可能にするタンパク質から選択することができる。タンパク質は、担体タンパク質のC末端またはN末端のいずれに融合されていてもよい。融合タンパク質の性質は、該融合タンパク質が産生されるベクター系に依存すると考えられる。細菌の発現ベクターの一例としてはpGEXがあり、このpGEXは、目的の遺伝子を該ベクターに挿入してサブクローニングすることにより、グルタチオン−S−トランスフェラーゼと目的のタンパク質とから成る融合タンパク質を産生する。目的のタンパク質を備えた融合タンパク質をもたらす他のベクター系の例は、上記サンブロックらの文献の中に記載されており、該文献全体を引用として本明細書に含める。これらは包含または分離されることができるが、包含される場合には「担体」機能を有すると考えられる。
【0047】
タンパク質または融合タンパク質は、多くの原核性(大腸菌(E.coli)または枯草菌(B.subtilis))または真核性(バキュロウイルス、CHO細胞、コス細胞または酵母)の発現系において発現させることができる。これらの系のいくつか、たとえばバキュロウイルスまたは酵母においては、グリコシル化モチーフをタンパク質または融合タンパク質に導入することにより、マンノースに富むグリコシル化が十分に達成され、マンノースに富む炭水化物ポリマーと化学的に結合させる必要性を無くすことができる。これらの新規な融合タンパク質は、穏やかな過ヨウ素酸酸化を行って使用してもよいし、行わずに使用してもよい。
【0048】
1実施形態において、本発明の抗原は炭水化物ポリマーに結合されている。炭水化物ポリマー内の反復モノマー単位の数は重要ではないが、一般に炭水化物ポリマーは、少なくとも20個のモノマー単位、好ましくは100個以上のモノマー単位、より好ましくは1000個以上のモノマー単位、さらに好ましくは10000個以上のモノマー単位を含む。炭水化物ポリマーは、様々な分子量の多糖鎖の混合物であり得る。本発明の組成物の炭水化物部分は、たとえば、グルコース、ガラクトース、マンノース、キシロース、アラビノース、フコース、グルコサミン、ガラクトサミン、ラムノース、6−O−メチル−D−ガラクトース、2−O−アセチル−β−D−キシロース、N−アセチル−グルコサミン、イズロネート、グルロネート、マンヌロネート、メチルガラクツロネート、α−D−ガラクトピラノース−6−スルフェート、フルクトース、およびα−アベクオース、それらの配座異性体および立体異性体を含むポリマー、あるいは、2個以上の異なるモノマー単位で構成される炭水化物などの、あらゆる炭水化物ポリマーを含むことができる。本発明のより好ましい炭水化物ポリマーは、マンノースを含む。より好ましい炭水化物ポリマーはマンノースポリマーである。さらに好ましい炭水化物ポリマーは、完全に酸化されたマンノース、および/または、アルデヒドを有する部分的に還元されたマンノースのポリマーである。
【0049】
好ましい炭水化物は、炭水化物が部分的に還元されるように処理された酸化炭水化物から成る。より好ましい炭水化物は、炭水化物のアルデヒド基が実質的に還元されずに、シッフ塩基が優先的に還元されるように処理された酸化炭水化物から成る。本発明による炭水化物を部分的に還元するための適切な試薬には、水素化シアノホウ素ナトリウムが含まれるが、これに限定されるわけではない。本発明による炭水化物を部分的に還元するのに適した他の試薬は当業者にとって明らかであり、本願に包含されることが理解される。酸化炭水化物をシアノホウ化水素ナトリウムで処理することにより、たとえば、アルデヒド基を保持したまま、シッフ塩基などの他の基を還元することができる。理論と結び付けられてはいないが、本発明の発明者は、本発明の酸化炭水化物の露出および/または遊離したアルデヒド基が、おそらくはエンドソームやリソソームから細胞質への抗原の取り込み、放出、あるいは漏出を変化させることにより、本発明の炭水化物および抗原複合体の送達に重要な役割を果たしていると確信している。好ましい実施形態において、酸化炭水化物は、遊離のアルデヒドを実質的に含む炭水化物ポリマーの酸化されたマンノース単位を含む。本発明の炭水化物ポリマーには、完全に酸化されたマンノース、あるいはアルデヒドを有する部分的に還元されたマンナンが含まれ得ることを注記しておく。炭水化物は、天然の起源から精製してもよいし、あるいは従来の方法に従って合成してもよい。炭水化物は多くの供給業者から市販されている。
【0050】
抗原は、多糖および単糖の誘導体化および反応に関する炭水化物化学の分野において周知の標準的な方法に従って、炭水化物ポリマーに結合させてもよい。炭水化物は、過ヨウ素酸塩、たとえば過ヨウ素酸ナトリウムなどの従来の酸化剤を用いて酸化してポリアルデヒドとし、これを直接抗原(MUC1の反復サブユニットなど)と反応させるようにしてもよく、この反応においては、タンパク質鎖上のアミノ官能基(リシンのε−アミノ基など)が、シッフ塩基を形成するアルデヒド基と反応する(図14参照)。多糖鎖はまず最初に臭化シアンで活性化し、この活性化された多糖をジアミンと反応させ、次に抗原と結合させて複合体を形成させるようにしてもよい。この複合体はその後、任意に酸化してもよい。炭水化物およびポリペプチドは、炭水化物とポリペプチドとを架橋するために、二機能試薬を用いて誘導体化してもよい。一般に用いられる架橋試薬には、1,1−ビス(ジアゾアセチル)−2−フェニルエタン、グルタルアルデヒド、N−ヒドロキシスクシニミドエステル、たとえば、4−アジドサリチル酸とのエステル、3,3−ジチオビス(スクシンイミジル−プロピオン酸塩)などのジスクシニミジルエステルを含むホモ二価性イミドエステル、および、ビス−N−マレイミド−1,8−オクタンなどの二価性マレイミドが含まれる。メチル−3[(p−アジド−フェニル)ジチオ]プロピオイミデートなどの誘導化試薬は、光の存在により架橋を形成することのできる光活性化中間体を生み出すことができる。酸化炭水化物は、抗原のヒドラジン誘導体と反応させて複合体を形成するようにしてもよい。あるいは、炭水化物は、酸化後に所望の複合体を与えるカルボニルジイミダゾールなどの試薬と反応させてもよい。そのような複合体形成と酸化の方法については、たとえば、1994年12月23日に出願されたPCT出願番号PCT/AU94/00789(WO95/18145)の中で以前に検討されており、この文献はその全体を参照により本明細書中に包含する。本発明による炭水化物の複合体化と酸化の他の方法は、当業者にとって明らかであるだろうし、これらも本願に包含されるものであることを注記しておく。
【0051】
炭水化物への抗体の結合は、炭水化物上のいずれか若しくはすべての官能基を反応基に変換し、その後、該炭水化物上の反応基をポリペプチド上の反応基と反応させることを含む。炭水化物ポリマーは、ヒドロキシル基を豊富に有し、いくつかの例においては、カルボキシル基(イズロネートなどにおいて)、エステル基(メチルガラクツロネートなどにおいて)などで満たされる。これらの基は、標準的な化学的手順に従って活性化することができる。たとえば、ヒドロキシル基は、ヨウ化水素、臭化水素、および塩化水素などのハロゲン化水素と反応させて反応性ハロゲン化多糖を与えることができる。ヒドロキシル基は、トリハロゲン化リン、活性金属(ナトリウムエトキシド、アルミニウムイソプロポキシド、およびカリウム第三ブトキシドなど)によって活性化するか、あるいは(塩化トシルまたは酢酸などの基によって)エステル化することにより、続いてポリペプチド上の反応基と反応して1つ以上の結合を形成することのできる反応基を形成することもできる。ヒドロキシル基以外の炭水化物上の他の官能基は、当該技術分野において周知の手順に従って活性化し、反応基を与えることができる。
【0052】
本発明の1実施形態において、マンノース受容体担持マクロファージおよび/または単球細胞に対して強化された細胞集団と、ヒトムチンポリペプチド、該ポリペプチドの1つ以上の反復もしくは非反復サブユニット、あるいは反復もしくは非反復サブユニットの断片と、酸化マンノースから成る炭水化物ポリマーとの間で形成される複合体と含む免疫調節組成物が提供される。特に、上記免疫調節組成物は、複合体に結合される前にGM−CSF、IL−3、IL−4、TNFγおよび/またはビタミンDと接触させた、マンノース受容体担持マクロファージおよび/または単球細胞に対して強化された細胞集団を含んでいる。
【0053】
本発明の免疫調節組成物は、薬剤学的に許容可能な担体中で調製することができる。そのような担体の例には、水、生理食塩水、リンゲル溶液、デキストロース溶液、ハンク溶液、および他の水性の生理的に平衡な塩溶液が含まれる。不揮発油、ゴマ油、オレイン酸エチル、あるいはトリグリセリドなどの非水性賦形剤も使用することができる。他の有用な製剤としては、カルボキシメチルセルロースナトリウム、ソルビトール、あるいはデキストランなどの増粘剤を含む懸濁剤が含まれる。補形剤は、少量の添加剤、たとえば等張性および化学的安定性を高める物質などを含んでいてもよい。緩衝液の例としては、リン酸緩衝液、重炭酸緩衝液、およびトリス緩衝液が含まれ、保存剤の例としては、チメロサール、m−またはo−クレゾール、ホルマリンおよびベンジルアルコールが含まれる。標準的な製剤は、液体の注射可能な医薬品、あるいは注射用に適当な液体に懸濁液または溶液として溶解可能な固体のいずれかであり得る。したがって非液体製剤においては、担体はデキストロース、ヒト血清アルブミン、保存剤などを含み、これに無菌の水または生理食塩水を投与前に添加することが可能である。
【0054】
本発明の薬剤学的に許容可能な担体は、さらにアジュバントや伝達賦形剤などの免疫増強剤をさらに含んでいてもよい。アジュバントは典型的には、特異的抗原に対する動物の免疫応答を全体的に増強する物質である。適切なアジュバントとしては、動物、特にヒトに投与することのできるアジュバントが含まれる。本発明の免疫調節組成物と併用される好ましいアジュバントには、アルミニウムをベースとした塩、カルシウムをベースとした塩、シリカ、γ−インターフェロン、IL−12、および他の市販のアジュバントが含まれるが、それらに限定されるわけではない。
【0055】
他の態様において、本発明の免疫調節組成物は、患者に対して、様々な病状に対する予防または治療を施すために投与される。特に、本発明の免疫調節組成物は、異常細胞の増殖を治療または予防するのに有用である。本明細書中で用いる異常細胞とは、異常増殖、発生、死といった異常な生物学的機能を呈した細胞のことをいう。本発明の異常細胞には、好ましくは癌細胞、感染物質(すなわち病原体)および異常増殖性成長をみせる非癌細胞(たとえば、類肉腫症、肉芽腫症または乳頭腫)に感染した細胞、ならびに癌細胞および感染細胞に感染した非癌細胞が含まれる。癌細胞の増殖には、乳房、結腸、肺、膵臓、前立腺などの分泌組織の腫瘍の増殖が含まれるが、これらに限定されるわけではない。
【0056】
上記のようにして予防することのできる他のいくつかの病状としては、I型アレルギー、マラリア、HIV、虫歯、インフルエンザ、コレラ、口蹄疫、髄膜炎、リーシュマニア感染、百日咳、狂犬病、連鎖球菌感染、呼吸感染、麻疹、ライム病、結核、細菌性髄膜炎、帯状ヘルペス、風疹、肝炎、疱疹、A型肝炎、ポリオ、性病/トラコーマ、B型肝炎、一般的な感冒、頸部癌、髄膜炎/肺炎、水痘、痘瘡、および肺炎/PUO(原因不明熱)が含まれるが、これらに限定されるわけではない。
【0057】
分泌組織の腫瘍形成を予防するために、動物を本発明の免疫調節組成物で免疫化してもよい。あるいは、腫瘍に罹った動物を、腫瘍治療のための治療計画の一部として、本発明の免疫調節組成物で免疫化してもよい。例示として、女性の乳癌予防のために、女性に対して思春期前または後に、本発明の免疫調節組成物で免疫してもよいし、1回以上の注射を、好ましくは最初の免疫化後、数ヶ月から数年の間隔を空けて、1回以上のブースター注射を受けさせるようにしてもよい。1つの免疫化計画として、女性に対して本発明の組成物で免疫化を行った後、適当な間隔を空けてブースター免疫化を受けさせるようにしてもよい。その後のブースター免疫化は一定の間隔で行う。免疫化の経路は、従来のヒトワクチン投与の場合と何ら違いはない。したがって、本発明の免疫調節組成物は、皮下、筋肉内、経口、静脈内などの様式で投与することができる。
【0058】
動物に送達される本発明の組成物の量は、臨界量あるいは限界量ではない。本発明の組成物の有効量は、抗原成分に対する免疫応答を刺激するような量である。送達される組成物の量は、動物の免疫状態(患者が免疫抑制されているか、あるいは免疫刺激されているかに依存)、担当医または獣医師の判断、あるいは、化合物が病状を予防または治療のいずれを行う治療薬として用いられるのかに従って変わる。適切な一回投与量は、適切な期間にわたって1回または数回投与した場合に、動物に対して特定の病気の予防または治療を行うことができる投与量である。たとえば、動物が、本発明の組成物中、約105個〜約1013個の細胞、より好ましくは本発明の組成物中、約106個〜約1012個、さらに好ましくは約107個〜約1011個の細胞を受け取るようにすることができる。
【0059】
上述のように、本発明の組成物は、免疫応答を増強するサイトカインや他の化合物などのアジュバントと共に動物に投与してもよい。例示として、本発明の組成物と共に投与してもよいそのような増強化合物には、GM−CSF、G−CSF、M−CSF、TNFαまたはβ、γまたはα−インターフェロン、IL−1〜IL−18のいずれか、あるいは他のサイトカインのうちの1つ以上が含まれる。これらの増強化合物は、本発明の組成物と同時に動物に投与されてもよいし、任意に多成分投与剤形の一部として投与されてもよい。あるいは、本発明の増強化合物と組成物とは、本発明の免疫調節組成物の投与後、異なる期間をおいて投与するようにしてもよい。
【0060】
本発明の他の態様において、動物に本発明の免疫調節組成物を投与することを含む、抗原に対する免疫応答を誘導するための方法が提供される。動物に本発明の免疫調節組成物を投与することにより、特に抗原成分と反応する細胞に対して細胞障害性を呈する、活性化されたT細胞の高い細胞性応答が誘起される。例示として、動物をムチンまたは他の腫瘍抗原決定基を発現する腫瘍に対して免疫化することができる。本発明の潜在的利益は、本発明の組成物が、ムチンまたは他の抗原決定基を発現している腫瘍細胞を殺す細胞障害性T細胞の細胞性免疫応答を誘起することができるため、動物に対して腫瘍の成長前に癌予防を行うことができるという事実から生じるものである。本発明は、腺癌などの分泌組織の腫瘍、より詳細には、乳房、卵巣、結腸、肺、前立腺などの腫瘍に対する免疫化に特に適用できる。
【0061】
本発明の1実施形態は、動物における免疫応答を誘導するための方法を含み、該方法は、動物に、マンノース受容体保有細胞と、抗原および酸化マンノースから成る複合体とを含む免疫調節組成物を有効量投与することを含む。本発明の免疫調節組成物の有効量は、本明細書中に記載の病気を予防または治療することのできる量を含む。
【0062】
本発明で使用される動物には、ヒト、家畜動物および食用動物が含まれるが、これらに限定されることはなく、ヒトまたはサルがより好ましく、ヒトが最も好ましい。
本発明の他の実施形態は、動物において癌に対する免疫応答を誘導する方法に関し、該方法は、動物に、炭水化物受容体保有細胞と、抗原および酸化炭水化物から成る複合体とを含む免疫調節組成物を有効量投与することを含む。本方法で用いられる好ましい炭水化物はマンノースである。本明細書中で開示されるあらゆる抗原が本方法での使用に適している。好ましい抗原は、ムチンポリペプチドを含む。
【0063】
本発明の組成物は、癌根絶のための総合的治療の一部として、あるいは単独で投与することができる。総合的治療の一部として投与される場合には、本発明の組成物は、他の治療形態の前、最中もしくは後に投与することができる。たとえば、本発明の組成物は、癌に罹っている動物に対して、癌化した細胞を切除する外科手術の前または後のいずれに投与してもよい。同様に、本発明の組成物は、腫瘍刺激を伴う化学的治療または照射計画の前または後に投与することができる。好ましくは、本発明の組成物は、動物の免疫系が完全である時に、細胞媒介性免疫応答を動物内で誘導することができるように投与される。このように、本発明の組成物は、動物の免疫除去治療の後に投与するのには適していない。本発明の免疫調節組成物を、腫瘍を有する動物に投与する場合、好ましくは組成物は腫瘍の主要部位かまたはその周囲に投与される。
【0064】
好ましい実施形態において、免疫応答を誘導する方法は、以下の工程(a)〜(d)を含む。(a)マンノース受容体保有細胞集団を動物から単離する。(b)細胞を1つ以上の生体応答調節剤と接触させて、増加マンノース受容体保有細胞集団を得る。(c)増加マンノース受容体保有細胞集団を、抗原および酸化マンノースから成る複合体に結合させ、免疫調節マンノース受容体保有細胞集団を得る。(d)免疫調節マンノース受容体保有細胞集団を動物に投与して、免疫応答を誘導する。本実施形態で使用される好ましいサイトカインおよびビタミンは、本明細書中に開示されている。
【0065】
さらに他の態様において、本発明は、ヒトムチンポリペプチド、該ポリペプチドの1つ以上の反復サブユニット、もしくは前記反復サブユニットの断片と、炭水化物ポリマーとの間の複合体を含む化合物を、腺癌、特に乳癌の治療において使用することに関する。
【0066】
本明細書中に記載した発明は、ヒトムチンMUC1に限定されるものではない。本発明は明らかに、癌細胞によって発現される他のムチンの使用、ならびに、多糖に結合されると、主要細胞に対して細胞障害性T細胞応答を誘起するために用いることのできる他の抗原の使用にも適用され、該化合物は、腫瘍形成を予防するワクチンにおいて使用してもよいし、癌の治療、および/または前述のような他の病状の治療または予防のために使用してもよい。様々な病気および病状に対応する抗原であって、それに対する免疫応答の誘引が望まれる抗原は技術上周知であり、そのような抗原も本発明の範囲に同等に含まれる。
【0067】
本発明はまた、抗原に結合する先在抗体(すなわち自然抗体)を有する動物に、本発明の抗原を送達する方法も含み、該方法によって、抗原に対する細胞性免疫応答が誘引される。本発明の方法の利点の1つは、目的の抗原に結合することができ、細胞性免疫応答よりも抗体応答を優先的に誘導するであろう天然に存在する抗体(すなわち自然抗体)が、複合体に結合するのを阻止できることである。たとえば抗原がムチンの場合、ヒトはムチンペプチドに結合する大量の循環性の天然に存在する抗体を有している。これらの天然に存在する抗体の特異性の殆どは、ガラクトースエピトープに抗して誘導されるものであるが、これらの抗体はムチンペプチドと交差反応する。したがって、患者がマンナン:ムチン複合体によって免疫化される場合、おそらくは抗体が複合体に結合し、該複合体が適切な抗原提示経路に到達して細胞性免疫応答(たとえばCTL応答)を誘導するのを阻止すると考えられる。したがって、本発明の方法は、炭水化物受容体保有細胞をイクスビボにおいて抗原:炭水化物複合体と結合させることにより、本発明の治療用組成物を動物に投与する際の循環性の交差反応する抗体を排除して、体液性(抗体)応答の優先的誘導を克服するものである。患者に導入される場合には、細胞性免疫応答、および特にCTLおよび/またはT1(TH1)応答が、目的の抗原の抗原性ペプチドを提示する細胞によって優先的に誘導される。本方法は、抗原および酸化炭水化物から成る複合体に接触させた炭水化物受容体保有細胞を、動物に投与する工程を含み、この工程において、炭水化物受容体保有細胞は、T細胞からの応答が誘引されるようにT細胞に対する抗原を提示することができる。本方法で用いられる好ましい抗原はムチンである。本方法で用いられる好ましい炭水化物はマンノースである。
【0068】
以下の実施例は説明を目的としたものであり、本発明の範囲を限定することを意図したものではない。
【実施例1】
【0069】
この実施例では、インビボでマンノース受容体を標的にすると、T1細胞免疫応答が起こることを述べる。
A.腹腔滲出細胞のマンナン−MUC1へのインビトロ曝露
腹腔滲出細胞(PEC)を以下のように調製した。マウスを屠殺し、10mlのリン酸緩衝液(PBS)を腹腔内に注射し、穏やかにマッサージし、腹腔滲出細胞を収集した。付着PECは、組織培養プレート中に約2×106/mlのPECを取り、約37℃で約16乃至約24時間培養することにより調製した。非付着PEC細胞をピペットで取り除き、付着PEC細胞を以下に説明する研究に用いた。
【0070】
DBA/2(H−2d)マウスから得た約4×106のPEC細胞は、約16乃至約24時間の付着後、20μg/mlの酸化−マンナン−MUC1融合タンパク質(ox−M−FP;Apostolopoulos et al.,Proc.Natl.Acad.Sci.USA,92,10128−10132,1995a、Apostolopoulos et al.,J.Immunol.,155:5089−5094,1995bに詳述)、還元−マンナン−MUC1融合タンパク質(red−M−FP)、または無処理MUC1融合タンパク質(FP;グルチオン−S−トランスフェラーゼに融合させた5つのVNTR反復配列を含む105アミノ酸ペプチドを含む。詳細は、Apostolopoulos et al.,Br.J.Cancer,67:713−720,1993)もしくはマンナン−ox−グルタチオン−S−トランスフェラーゼ(M−GST;詳細は、Apostolopoulos et al.、前掲の文献、1993に述べられている)により感作させた。感作させた細胞の各群を、腹腔内注射によりDBA/2マウスへ移入した。
【0071】
その後、マウスの細胞障害性T細胞(CTL)応答試験を、CTL前駆体(CTLp)度数を以下のように測定することにより行った。CTLp度数は、10%ウシ胎児血清と、5mMの合成MUC1ペプチド(2つのVNTR反復配列から成る;Apostolopoulos et al.、前掲の文献1995aに述べられている)と、約10U/mlの組換えヒトIL−2とを含むダルベッコ変法イーグル培地において、約25μg/mlの投与量のマイトマイシンCで約1乃至約1.5時間処理した約2乃至約5×105のDBA/2刺激脾細胞と共に、U底マイクロタイタートレイ中で細胞を培養することにより、少なくとも6通りのエフェクター細胞投与の最小で32の複製を用いて決定した。7日後、各ミクロ培養の細胞毒性について、100μlの培地を約104 51Cr−標識MUC1+P815腫瘍標的細胞(ヒトMUC1をコードするcDNAをトランスフェクトしたB815細胞;フランス、ストラスブールのトランスジーン、B.アクレス(Acres)博士から提供)を含む100mlの標的細胞懸濁液と置換することにより、分析した。培養物が細胞障害活性を有する細胞を備えていることは、単独で培養されるか、あるいはMUC1合成ペプチドは含まず刺激細胞および組換えIL−2と共に培養されるかした応答細胞に添加される、約104の標的細胞から得られた平均同位体放出より51Cr放出が約3標準偏差高いことにより同定した。直線スケールで表される応答細胞の投与量と、対数スケールで表される陰性ウェルの度数との間には直線関係が存在した。CTLp度数は、37%の陰性ウェルを生成するのに必要とされる応答細胞投与量の逆数として決定した。
【0072】
図1について参照する。この結果から、Ox−M−FPをインビトロでパルス適用(pulse)したPECによる1回の免疫後に得られたCTLp度数は、Ox−M−FPの無細胞タンパク質型の3回のインビボ免疫後に得られたCTLpとほぼ同じ(1/7,000)であることが示された。インビトロでred−M−FPまたはFPを適用したPECの1回の注入では、それぞれ、1/28,000および1/29,600のCTLp度数が発生した。red−M−FPまたはFPのいずれかの3回の腹腔内注射では、それぞれ、1/89,000および1/87,500のCTLp度数が得られた。M−GSTで感作された細胞では1/800,000の度数が得られた。全ての場合において、応答はMUC1特異であった。というのは、トランスフェクトされていないP815標的細胞は溶解されなかったからである。まとめて考えると、これらの結果は、融合タンパク質の複数回注入によるか、あるいはインビトロでox−M−FPを適用したPECの1回の注入により加えられたox−M−FPによりCTL応答が刺激され、この応答は、いずれかの経路により加えられたred−M−FPまたはFPによる応答よりも高いことを示す。red−M−FP上にマンノースが存在しても、インビボで融合タンパク質として運搬される場合には、(無処理FPに比べ)選択的な利点はない。しかしながら、これらのタンパク質をインビトロでPECに適用し、その後、これらの細胞を免疫化に使用することにより、red−M−FPあるいはFPをマンノース受容体への標的とすることは、それらの融合タンパク質を注入するよりも(両方に対する度数は約1/80,000)、CTLpの誘導に効果的であった(両方に対する度数は約1/28,000)。このように、インビトロで、Ox−M−FPをPECに適用する(およびこれによりマンノース受容体に対する標的とする)と、インビトロでred−M−FPまたはFPをPECに適用するよりも良好なCTL応答が得られる。さらに、red−M−FPまたはFPではなく、融合タンパク質Ox−M−FPの注入により、CTLp度数が向上する。最後に、PECにred−M−FPまたはFPをインビトロで適用すると、これらのタンパク質のインビボ注入に比べ、CTLpの生成が向上する。
【0073】
図2について参照する。この図は、インビトロ感作PECの注入数に関する投与量応答を示したものであり、これにより、CTLp度数を向上させるのに必要なPECの最小数は104細胞であることが示された。104細胞では、CTLp度数1/10,200が得られたが、これは400倍の細胞を用いて得られたもの(4×106細胞;CTLp度数は1/4,000)と実質的に差異がない。このように、移入したPECの数が104を超えると、CTLp度数は移入した細胞の数に対して投与量依存性を示さず、CTLp度数は104〜4×106細胞の範囲で同様であった。103細胞を移入した場合、CTLp度数は1/44,000まで落ちた。
【0074】
B.インビトロで適用させたPECで免疫したマウスは腫瘍の攻撃から防御された
腫瘍の攻撃に対して感作PECが防御応答を誘発する可能性を調べるために、5匹のDBA/2マウスの群に、ox−M−FP、またはox−M−FPを適用したPEC、もしくはパルス処理していないPECを1回注入し、その後、5×106 MUC1+P815細胞で攻撃した。図3を参照する。これらの結果から、ox−M−FPで感作されたPECを用いて免疫した5匹のマウスのいずれにおいても検出可能な腫瘍の成長はないことが示唆された。逆に、ox−M−FPで1回免疫した5匹のマウスのうち3匹で腫瘍が発現し、未処理PECで1回免疫した5匹のマウスのうち5匹で腫瘍が発現した。
【0075】
このように、マウスの腹腔由来のPECであって、インビトロでox−M−FPと共に培養させたPECは、養子免疫伝達後、効率よくMUC1抗原を処理すると共に提示し、高い度数のCTLを生成させ、その後の腫瘍の攻撃に対し防御する。
【0076】
C.還元および酸化M−FPの結合研究
異なるマンナン型の、様々な種類の組織、細胞系、細胞および受容体への結合について分析するために実験を行った。この結合試験の結果を表1にまとめて示す。
【0077】
【表1】

1.細胞系
フルオレセインイソチオシアネート(FITC、シグマ社、ミズーリ州セントルイス(Sigma,St.Louis)から入手可能;Apostolopoulos et al.、前掲の文献、1995aに詳述)と共役した還元マンナンまたは酸化マンナンのいずれかを、Apostolopoulos et al.、前掲の文献、1995aに一般的に述べられている方法を用いて様々な種類の細胞と共に混合した。FITC−共役還元マンナンおよびFITC−共役酸化マンナンのいずれも、以下の細胞系には結合しなかった:3T3(線維芽細胞)細胞、P815(肥満細胞腫)細胞、NS1およびスルタン(B細胞系)細胞、EL−4細胞、RMA細胞、E3細胞およびCEM(T細胞系)細胞、MM200(メラノーマ)細胞、COS細胞およびBHK(腎細胞系)細胞。FITC−共役還元およびFITC−共役酸化マンナンのいずれも、J774細胞(マクロファージ細胞系、P.リシアルジ−キャスタグノーリ(Ricciardi−Castagnoli)博士(ミラノ、イタリア)から供与)には結合した。樹状細胞系であるD2SC/1への結合は、酸化−マンナン−FITCでは陰性であり、還元−マンナン−FITCでは非常に弱かった(表1)。
【0078】
FITCと共役させた酸化あるいは還元マンノースのJ774細胞への結合を阻害する炭水化物を用いて、阻害試験を行った。酸化マンナン−FITCのJ774細胞への結合はマンナン、D−マンノース、L−フコースおよびN−アセチルグルコサミンにより阻害された。一方、還元マンナン−FITCの結合は、マンナン、D−マンノース、L−フコースおよびN−アセチルガラクトサミンにより阻害された。他の糖(グルコース、D−フコースおよびガラクトース)は阻害しなかった(表1)。上記の糖がFITC共役マンナン型の結合を阻害することができるということは、それらがマンノース受容体へ結合することを暗示する。
【0079】
2.組織
還元および酸化マンナン−FITCをマウスの腹腔内に注入し、1時間後、器官を4%パラホルムアルデヒドで固定し、標準方法を用いて共焦顕微鏡により分析した。酸化および還元材料はいずれも、肝臓内、脾臓内、赤色脾髄内で観察された。肝臓では、クッパー細胞に富む洞様血管の周りが染色された。脾臓では、白髄の周りが染色された。赤色脾髄では、周辺帯マクロファージと共に染色された。結果はまとめて表1に示す。
【0080】
3.受容体
マンノース受容体をコードする核酸分子をトランスフェクトしたCOS細胞を、red−M−FPまたはox−M−FPと共に、M−FPがマンノース受容体に結合することができるような条件下で混合した。マンノース受容体へのM−FPの結合は、SDS−PAGEゲルにより受容体へ結合したM−FPを分離し、ゲル上に分離したタンパク質をブロッティングし、マンノース受容体に特異的に結合する抗体を用いてウエスターンブロットによりバンドを分解することにより、確認した。この結果、red−M−FPおよびox−M−FPのいずれもが、マンノース受容体に結合することが示唆された。
【0081】
4.PECの特徴付け
マクロファージおよび樹状細胞を規定するために使用される細胞表面マーカーはF4/80、33D1およびNLDC−145とした。マクロファージはF4/80+33D1−と分類し、樹状細胞はF4/80−33D1+と分類した。付着PECは以下のようにフローサイトメトリにより分析した。付着PECは標準的な技術を用いて、F4/80抗体(ラット抗マウスモノクローナル抗体、これはマクロファージを検出するが樹状細胞は検出しない;Austyn et al.,Eur.J.Immunol.,11:805−812,1981およびNussenzweig et al.,J.Exp.Med.,154:168−179,1981に記載);33D1抗体(ラット抗マウスモノクローナル抗体、これはマウス樹状細胞と反応するがマクロファージとは反応しない;Steinman,et al.,J.Exp.Med.,157:613−627,1983に記載);およびNLDC−145抗体(ラット抗マウスモノクローナル抗体、これは樹状細胞上のDEC−205分子を検出する、DEC−205分子はマクロファージには存在しない;Swiggard,et al.,Cell.Immunol.,165:302−11,1995に記載。クリストチャーチ病院、ニュージーランド、クライストチャーチのデレク ハート博士から供与)のいずれかにより染色した。染色した細胞は標準方法を用いてフローサイトメトリにより識別した。血清学的研究のために、約100μlの各抗体を約2×105のPEC細胞に添加し、約1時間、約4℃でインキュベートした。細胞を3回、約.5mlのPBSで洗浄した。FITC−共役ヒツジ(Fab’)2抗マウス免疫グロブリン(シレナス社、オーストラリア(Silenus,Australia)から入手可能)の1:50希釈液を約100μl、各サンプルに添加し、約45分間、約4℃でインキュベートした。細胞を再び洗浄し、その後、FACScanフローサイトメーターを用いて、フローサイトメトリにより分析した。
【0082】
結果をまとめて表2に示す。これらの結果から、付着PECの約75%がF4/80+であり、約30%がNLDC−145+であり、約33%が33D1+であることが示唆された。付着PECの約5%が二重に陽性であった(F4/80+33D1+)。
【0083】
【表2】

付着PECの1つの集団をDynabeads(登録商標)を用いて2つの集団に分離した。1つの集団(マクロファージに富む)は約80%のF4/80+と、約13%の33D1+と、約14%のF4/80−33D1−とより構成された。第2の集団(樹状細胞に富む)は、約3%のF4/80+と、約85%の33D1+と、約3%のF4/80−33D1−とを含んだ(表2を参照のこと)。これらの2つの集団を誘導するために使用した方法は以下の通りである。Dynabeads(M−450)をヒツジ抗ラットIgGに対する抗体で被覆し、2つのラットモノクローナル抗体であるF4/80または33D1のいずれかと、3時間、4℃で混合した。これらの処理Dynabeadsを別々に107PEC細胞に添加し、30分間、4℃で混合した。抗体により被覆されたDynabeadsに結合した細胞は、磁石を用いて除去し、Dynabeadsに結合しなかった細胞は、更なる試験のために収集した。Dynabeadsに結合しなかったこれらの細胞のサンプルについて、F4/80または33D1抗体と結合することができるか、フローサイトメトリにより試験した。Dynabeadsに結合しなかった細胞の残りはその後、ox−M−FPと共に、16時間乃至24時間インキュベートし、セクションA(次の実施例を参照のこと)において上述の方法を用いて、同系マウスの腹腔内への養子免疫伝達を行った。
【0084】
すぐ上に述べたマクロファージ(33D1−)および樹状細胞(F4/80−)に富んだ集団についてさらに、マンナン−FITC、酸化マンナン−FITCまたは還元マンナン−FITCを用いたフローサイトメトリによりマンノース受容体の発現に関する特徴付けを行った。各FITC複合体を約100μl、約2×105のマクロファージまたは樹状細胞強化集団に添加し、約1時間、約4℃でインキュベートした。細胞を3回、約.5mlのPBSで洗浄した。細胞について、FACScanフローサイトメーターを用いて、フローサイトメトリにより分析した。表2を参照すると、F4/80+33D1−集団内の約46%の細胞がマンナン−FITCで染色され、この集団内の細胞の58%がマンナン−FITCおよびF4/80抗体の両方に結合した。F4/80+33D1−集団はマンナン−FITCと結合しなかった(5%以下、これはPBSを受け取ったサンプル中の陽性細胞の数であった)。F4/80+集団の約52%が還元−M−FITCで染色された(この集団内の65%の細胞が還元−マンナン−FITCおよびF4/80抗体の両方と結合した)。また、33D1+細胞集団は還元−マンナン−FITCとは結合しなかった。F4/80+集団の約70%が酸化−M−FITCで染色され、この集団内の58%の細胞が、酸化−マンナン−FITCおよびF4/80抗体の両方と結合した。また、33D1+細胞集団は酸化−マンナン−FITCとは結合しなかった。このように、マンナンの両方の型(還元および酸化)がマクロファージには結合するが、樹状細胞には結合せず、酸化材料の結合が最も良好であった。
【0085】
5.PEC集団におけるマクロファージおよび樹状細胞の好ましい役割の決定
PECはセクションDにおいて説明したように、F4/80または33D1抗体と、ダイナビードとを用いて、80%のF4/80+33D1−マクロファージ強化細胞および85%のF4/80−33D1+樹状細胞のいずれかを含む2つの集団に分離した。分離したマクロファージ(Mac)と樹状細胞(DC)の集団は、約20μgのM−FPと共にインビトロで、約16乃至24時間、別々に培養した。未分割PEC集団を同様に培養した。その後、細胞集団を別々のマウスに腹腔内注射し、MUC1特異CTLp度数を、セクションAで一般的に説明した方法を用いて決定した。
【0086】
【表3】

表3を参照する。この結果から、106のインビトロにおいてパルス適用したPECの注射により、1/11,000のCTLp度数が生じることが示唆された。同様に、6×105適用マクロファージは1/15,000のCTLp度数を生じ、2×105樹状細胞は1/64,000のCTLp度数を生じた。このように、マンノース受容体陽性のF4/80+マクロファージが、CTLp度数の増加に対する主な原因となった。マンノース受容体陰性である樹状細胞のCTLp度数の増加への有効性はより低かった。
【0087】
上記実験において、注射したマクロファージ(6×105)の数は注射した樹状細胞(2×105)の数とは異なった。続いて、同じ投与量(2×105)の各細胞型を用いて比較を行った。マクロファージ集団と樹状細胞集団とは、すぐ上で説明したように調製し、マウスに注射した。約2×105のマクロファージおよび約2×105の樹状細胞を別々のマウスに注射し、MUC1特異CTLp度数を決定した。マクロファージの注射により1/13,000のCTLp度数が得られ、一方、樹状細胞の注射により1/65,000のCTLp度数が得られた(表3を参照のこと)。このように、マクロファージは、マウスがインビトロでox−M−FPを適用した細胞を受け取ると、高いCTLp度数を発生させる主なエフェクター細胞である。
【0088】
MUC1抗原提示における樹状細胞の役割もまた、16乃至24時間、インビトロでox−M−FPを適用した約106のJ774細胞を用いて1回BALB/cマウスを免疫することにより決定した。J774細胞により1/33,000のCTLp度数が得られた(表3を参照)。BALB/cマウスはまた、16乃至24時間、ox−M−FPを適用したD2SC/1細胞(樹状細胞系)を用いて1回免疫した。D2SC/1細胞の注射により、130,000/1のCTLp度数が得られた(表3を参照)。これらのことから、ox−M−FPを適用したマクロファージの方が、ox−M−FPを適用した樹状細胞よりも、CTLp度数の増加について有効であることが示される。
【0089】
6.ox−M−FPを適用したPECを用いて生じた免疫応答に関するGM−CSFの効果
PECをマウスから単離し、プラスチックに付着させ、酸化−M−FP(ox−M−FP)を適用し、GM−CSF(約10ng/ml)またはγインターフェロンと共に、約3時間インビトロでインキュベートした。いくつかの細胞はサイトカインの不在下で、ox−M−FPと共に約3時間インキュベートした。図4を参照する。その後、細胞は特定の実験を受けていない別々のマウスに移入された。GM−CSF処理細胞の移入により、1/2,500のCTLp度数が得られた。無処理細胞の移入により、1/7,000のCTLp度数が得られた。逆に、γインターフェロンで処理した細胞の移入により、1/9,000のCTLp度数が得られた。
【0090】
別の試験では、PECをマウスから単離し、プラスチックに付着させ、ox−M−FPを適用した。パルス適用細胞をその後、GM−CSF o/o マウス(同族組換えにより生成したGM−CSF欠失マウス;アシュレイ ダン博士から入手)、G−CSF o/o マウス(同族組換えにより生成したG−CSF欠失マウス;アシュレイ ダン博士から入手)または野生型マウスのいずれかに注射した。このプロセスを繰り返し、各マウスに対し合計3回の注射を行った。図5を参照する。この結果から、野生型マウスから単離したPECの移入により、野生型マウスでは1/8,000、G−CSF o/o マウスでは1/16,000、GS−CSF o/o マウスでは1/32,000のCTLp度数が得られた。GM−CSF o/o マウスをさらにM−FPで免疫し、また、GM−CSFを与えた。このマウスにおけるCTLp度数は1/16,000まで増加した。このように、インビトロでox−M−FPを適用したPECに対するCTLp応答は、部分的にGM−CSFに依存し、GM−CSFにより増大させることができる。
【0091】
別の試験において、組換えGM−CSFを1日に当たり1μg、2,3,4,5または6日間、野生型マウスの腹腔内に注射した。マウスからPECを単離し、F4/80または33D抗体および標準方法を用いて計数および染色した。染色した細胞はその後、標準方法を用いてフローサイトメトリにより検出した。マウス1匹当たり、約106の存在するPEC細胞を1日(1回の注射)後に単離した。約9.6×106のマクロファージ(F4/80+細胞)が2日(2回の注射)後に得られ、約1.2×107のマクロファージが3日(3回の注射)後に得られ、約2×107のマクロファージが4から6日(4回から6回の注射)後に得られた。4日後のGM−CSF注射が、最も多くの数のマクロファージを単離するには最適である。1つのグループのマウスにはその後、1日につき1μgの組換えGM−CSFを4日間注射した。5日目に、ox−M−FPを1回だけ、これらのマウスおよびGM−SCFで処理していないマウスのグループに注射した。図6を参照する。GM−CSFで処理し、その後1回のox−M−FP注射を受けたマウスは1/9,900のCTLp度数を有した。GM−CSFを受けなかったが、1回のox−M−FPの注射を受けたマウスでは、1/45,000のCTLp度数が得られた。このように、Ox−M−FPタンパク質の注射に対するCTLp応答はGM−CSFの投与により向上させることができる。
【0092】
7.マウスにおける半同種異系マクロファージの伝達
DBA/2マウスから単離したマクロファージに、上述したようにox−M−FPを適用するか、あるいは適用しなかった。2つの細胞集団はその後、別々にDBA/2、C57BL/6あるいは(DBA/2×C57BL/6)F1マウスのいずれかに注射した。図7を参照する。パルス適用マクロファージをDBA/2マウスに注射すると、1/8,000のCTLp度数が得られ、適用マクロファージをC57BL/6マウスに注射すると、1/220,000のCTLp度数が得られ、適用したマクロファージを(DBA/2×C57BL/6)F1マウスに注射すると、1/10,000のCTLp度数が得られた。非パルス適用マクロファージを注射したマウスでは、CTLp度数は<1/106であった。PECを(DBA/2×C57BL/6)F1マウスから単離し、ox−M−FPを適用した後、それをC57BL/6またはDBA/2マウスのいずれかに注射することを除き、直前に述べたのと同じ方法を繰り返した。(DBA/2×C57BL/6)F1マウスからのox−M−Pパルス適用PECを、C57BL/6またはDBA/2マウスのいずれかに移入させると、高いCTLp度数が得られた。このように免疫応答は半同種異系的に伝達され得る(すなわち、1つのハプロタイプが共有される場合)。
【0093】
ひとまとめにして考えると、セクションAからセクションGまでにおいて説明した結果から、ox−M−FPと共にマクロファージ細胞を培養し、その細胞を同系マウスに養子免疫伝達させると、MUC1に対する特異的CTL応答が誘発されることが示唆された。さらに、酸化−M−FPを適用したマクロファージによる1回の免疫化が、MUC1+腫瘍からの保護につながった。インビトロでox−M−FPを適用したマクロファージを用いた1回の免疫により、CTLpが増加し、ox−M−FP融合タンパク質を用いた3回の免疫で与えられるCTLpと等価になる。このように、インビトロでox−M−FPを適用することによりマンノース受容体を標的とすると、T1細胞免疫応答が起こる。
【実施例2】
【0094】
この実施例では、還元剤であるホウ化水素ナトリウムとシアノホウ化水素ナトリウムとの比較について述べる。
Ox−M−FPは実施例1で説明したように調製した。3つの異なるサンプルを以下のように調製した。ox−M−FPの一部を0.5mg/mlのホウ化水素ナトリウムと結合させて、シッフ塩基およびアルデヒドを還元した。ox−M−FPの別の一部分を0.5mg/mlのシアノホウ化水素ナトリウムと結合させ、優先的にシッフ塩基だけを還元させた。第3の部分は未処理のままとした。3つのサンプルをそれぞれ5μg、別々のマウスに注射した。細胞障害性T細胞度数(CTLp)を、実施例1において一般的に説明した方法を用いて決定した。
【0095】
結果から、シアノホウ化水素ナトリウムで処理したox−M−FPにより誘導されたCTLp度数は1/10,300であることが示唆された。ホウ化水素ナトリウムで処理したox−M−FPにより誘導されたCTLp度数は1/79,500であった。未処理ox−M−FPにより誘導されたCTLp度数は1/14,575であった。まとめて考えると、これらの結果により、ox−M−FP上のアルデヒド基がCTLp誘導には重要であることが示唆された。
【実施例3】
【0096】
この実施例では、GM−CSF、IL−3およびビタミンDと共に末梢血液の単核細胞を培養する効果について述べる。
末梢血単核細胞(PBMC)は、標準方法を用いて、正常なヒトドナーから単離した。新しく単離したPBMCは、無血清のAIM−V培地中の標準6−ウェル組織培養プレートのウェルで、ウェル毎に、2mlの培地当たり10×106の濃度で、2時間培養した。インキュベーション工程後、非付着細胞をウェルから除去した。1ng/mlのGM−CSF、10ng/mlのIL−3、10ng/mlのIL−4、50ng/mlのTNF−αおよび50nMのビタミンDを含む約2mlの新しい無血清AIM−V培地を各ウェルに添加した。細胞は2、4および7日間インキュベートした。
【0097】
それぞれ予め決めた時点で、細胞を収集し、マンノース受容体の発現、および単球、マクロファージならびに樹状細胞を識別する細胞表面標識について分析した。発現は実施例1で一般的に説明した方法を用いてFACS分析により決定した。FACS分析では以下の試薬を用いた:フルオレセイン共役(FITC)酸化マンナン(ox−M−FITC;実施例1で述べた);フィコエリトリン(PE)共役CD11b、PE共役CD11c、PE共役CD14、FITC共役CD68、FITC共役CD80、PE共役CD86およびPE共役CD54。
【0098】
FACS分析の結果を以下の表4に示す。
【0099】
【表4】

最大数のマンノース受容体陽性細胞は、インキュベーション4日の2日の培養の後に生成された。これは、細胞活性化標識を表すCD54、CD80およびCD86保持細胞における増加とよく相関する。
【実施例4】
【0100】
この実施例では、MUC1に対する抗体およびGala(1,3)Gal抗体の結合がそれぞれ、Gala(1,3)GalおよびMUC1との交差反応することについて述べる。
【0101】
いくつかのマウスにおいて、Gala(1,3)GalまたはMUC1に特異的に結合する抗体の存在について分析した。正常なマウス、同系組換えによりGal遺伝子を欠失させたマウス(gal o/oマウス)、および約5μgのMUC1ペプチドにより3回腹腔内に投与して免疫したマウスのいずれかから血清を得た。これらの血清中のMUC1に結合する抗体の存在を、それらの抗体がMUC1を発現する(BT−20細胞またはRMA−MUC1細胞)かまたは発現しない(ME272またはRMA細胞)細胞系に結合する能力を調べることにより決定した。抗体のこれらの細胞への結合は実施例1で一般的に説明した方法を用いてFACS分析により決定した。
【0102】
図8を参照する。正常マウスからの血清はどの細胞系にも結合しなかった。MUC1に対して作製された抗血清は、BT−20細胞(図8のパネルA)およびRMA−MUC1細胞(図8のパネルC)に結合するが、ME272(図8のパネルB)およびRMA細胞(図8のパネルD)には結合しない抗体を含有した。
【0103】
BT−20細胞およびME272細胞はGala(1,3)Galを発現しないが、RMA−MUC1およびRMA細胞はGala(1,3)Galを発現する。gal o/oマウスの血清はガラクトースに対する自然抗体を含み、これは、BT−20細胞(MUC−gal+細胞;図8のパネルA)およびRMA−MUC1細胞(MUC+gal+細胞;図8のパネルC)との反応性により示された。RMA細胞(MUC−gal+;図8のパネルD)では弱く、ME272細胞(MUC−gal−)は陰性であった。gal o/oマウスの血清は、RMA−MUC1細胞により強く結合する抗体を含んでいた。RMA−MUC1細胞はMUC1の発現によってのみ、RMA細胞と異なる。
【0104】
まとめて考えると、これらの結果から、RMA細胞によるMUC1の発現、およびBT−20細胞上でのMUC1の発現が、gal o/oマウス中に存在する抗−gal抗体との反応性を与えることが示唆された。このように、gal o/oマウスで自然に生じる抗体はMUC1と反応し、MUC1に対して作製された抗体はGala(1,3)Galと反応した。
【実施例5】
【0105】
この実施例では、Gala(1,3)Galを発現する動物はGala(1,3)Galに対する自然に生じる抗体を有していないこと、酸化マンナン−MUC1で免疫するとMUC1に結合する抗体を産出しないことを述べる。
【0106】
約5μgのox−M−FP(実施例1に記載)を用いた動物の多重免疫を週1回の間隔で、以下の部位に行った:マウスの腹腔内;ウサギおよびニワトリの筋内;ヒトおよびサル。免疫した動物から得た血清について、以下の方法を用いて酵素結合免疫収着検定法(ELISA)によりMUC1に対する抗体の存在を調べた。標準マイクロタイタープレートをリン酸緩衝液(PBS)の10μg/mlMUC1ペプチド(実施例1に記載)溶液で、約16時間、4℃でコートした。非結合ペプチドをプレートから除去した。プレートを標準方法を用いて洗浄した。その後、プレートをウシ血清アルブミン(BSA)の2%w/v溶液で、約2時間、約4℃でコートした。非結合分をプレートから除去し、標準方法を用いてプレートの洗浄を行った。マウス、ウサギ、ニワトリ、ヒト、サル血清の約50μlの様々な希釈液をコートプレート上の別々のウェルに添加し、約2時間室温でインキュベートした。その後、プレートを洗浄し、非結合抗体を除去した。各種の動物由来の、プレートに結合した抗体の存在は、2次抗体を用いて検出した。2次抗体としては、マウス抗体を検出するためのヒツジ抗マウス抗体、ウサギ抗体を検出するための抗ウサギ抗体、ニワトリ抗体を検出するための抗ニワトリ抗体、ヒト抗体を検出するための抗ヒト抗体、サル抗体を検出するための抗サル抗体が挙げられる。これらの抗体をプレートに添加し、プレートを約1時間、室温でインキュベートした。プレートに結合した2次抗体の存在は、約pH4で、0.03%2,2’−アジノ−ジ(3)−エチルベンズチアゾリンスルホン酸(アマーシャム、イギリス所在(Amersham,U.K.)から入手可能)および0.02%過酸化水素の約0.1Mのクエン酸緩衝液50μlを用いて検出した。反応は約10乃至約15分間、室温で行い、その後、ELISA読み取り装置を用いて、405nmでの吸光度の読み取りを行った。
【0107】
図9を参照する。正常C57BL/6マウスのox−M−FPによる免疫では、マイクロタイタープレート上に固定したMUC1に結合する抗体の検出可能な産出は誘導されなかった。逆に、gal o/oマウスのox−M−FPによる免疫では、MUC1に結合する抗体が高い滴定濃度、約10−4希釈で産出された。gal o/oマウス中に存在するgalに対する自然に生じる抗体は、溶液中の完全なMUC1またはMUC1融合タンパク質と反応するが、マイクロタイタープレート上に固定されたMUC1の合成ペプチドとは反応しない。これから、gal o/oマウスからの免疫前の血清と固定MUC1ペプチドとの反応性が欠如していることが示唆された(図9)。さらに、Gala(1,3)Galに対して陰性のいくつかの他の動物において、ox−M−FPに結合する抗体の高滴定量が示された(表5を参照)。Gala(1,3)Galに対し陰性であるウサギは、MUC1に結合する抗体を産出しなかった。このように、Gala(1,3)Galに対し陽性ではあるがガラクトースに結合する予め存在する抗体を有さない動物(すなわち、マウスおよびウサギ)は、ox−M−FPによる免疫に伴う抗MUC1抗体を産出しなかった。対照的に、ガラクトースに対し陰性である動物(すなわち、ヒト、サル、ニワトリおよびgal o/oマウス)は、ox−M−FPによる免疫に応答して、抗−MUC1抗体を産出した。
【0108】
【表5】

【実施例6】
【0109】
この実施例では、Gala(1,3)Galに対し陽性である動物は、マンナン−MUC1による免疫に応答して、抗体ではなくCTLpを産出することについて述べる。
正常マウスおよびgal o/oマウスにox−M−FPを注射し、得られたCTLp度数を実施例1で一般的に説明した方法を用いて測定した。図11を参照する。正常マウスにox−M−FPを1回または3回注射すると、それぞれ、1/70,000または1/10,000のCTLp度数が得られた。同様にgal o/oマウスに注射すると、1回の注射で1/20,000の、3回の注射で1/60,000のCTLp度数が得られた。正常マウスおよびgal o/oマウスにはまた、同様に、卵白アルブミンから導いた対照標準ペプチドを注射した。ox−M−FPを用いた時に観察された正常マウスとgal o/oマウスにおけるCTLp度数の違いは、卵白アルブミンエピトープを用いた時には観察されなかった。図12を参照する。マンナン結合卵白アルブミンペプチドを用いた正常マウスあるいはgal o/oマウスを3回免疫し、それぞれ、1/10,000および1/12,000のCTLp度数を得た。ゆえに、gal o/oマウスにおけるCTlp度数応答の減小はMUC1に独特のものであり、gal o/oマウスは他の抗原に対するCTLp応答を開始することができた。これらの結果から、ox−M−FP免疫に対するCTLp度数応答はgal o/oマウスに比べ正常マウスにおいて大きいことが示唆された。これらの結果は実施例5において説明した抗体産出結果に反するものである。
【0110】
別の試験において、マウスについてすぐ上で説明したのと同様の方法により、サルをox−M−FPで免疫した。表5を参照する。ox−M−FPで免疫したサルは抗体応答を示したが、CTLp応答は示さなかった。この結果は、gal o/oマウスを用いて得られた結果と同様である。
【0111】
このように、CTLpが測定できる種においては、ガラクトースに対する予め存在する抗体がないこととox−M−FPを用いた免疫によるCTLp応答の向上との間には相関がある。
【実施例7】
【0112】
この実施例では、ガラクトースに対する抗体が、動物の免疫前にox−M−FPと混合されるとCTLpの出現を減小させることについて述べる。
正常マウスに、ox−M−FPまたは抗ガラクトース抗体を含むgal o/o血清と共に混合したox−M−FPのいずれかを1回あるいは3回注射した。実施例1で一般的に説明した方法を用いて、免疫したマウスに対し、CTLp度数を求めた。図11について説明する。1回の注射を受けたマウスでは、ox−M−FPで免疫すると1/62,000のCTLp度数が、gal o/o血清と混合したox−M−FPで免疫すると1/275,000のCTLp度数が得られた。同様に、3回注射したマウスに対しては、CTLp度数は、ox−M−FPで1/8,000、gal o/o血清と混合したox−M−FPで1/59,000であった。このように、ox−M−FPに抗−ガラクトース抗体を添加すると、正常マウスにおけるCTLp度数の生成はgal o/oマウスにおいて観察されるレベルまで制限された。さらに、正常マウスに、gal o/o血清と共に混合したox−M−FPを注射すると、かなりの抗体が産出された(表5を参照)。
【実施例8】
【0113】
この実施例では、インビトロでox−M−FPを適用したマクロファージ細胞による正常マウスおよびgal o/oマウスの免疫と、そのようなマウスにおける抗体ではなくCTLpの産出とについて述べる。
【0114】
マクロファージ細胞は実施例1で一般的に説明した方法を用いてC57BL/6マウスから得た。マクロファージ細胞には、実施例1で一般的に説明した方法を用いて、ox−M−FPまたはgal o/o血清と混合したox−M−FPのいずれかを一晩中、パルス適用した。正常マウスおよびgal o/oマウスは実施例1で一般的に説明した適用マクロファージ細胞で免疫した。
【0115】
図13を参照する。パルス適用したマクロファージによるgal o/oマウスの免疫では、CTLpは正常マウスと本質的に等価なレベルまで誘導された(それぞれ、1/11,500および1/8,000)が、検出可能な抗体応答は誘導されなかった(図10を参照のこと)。gal o/o血清と混合したox−M−FPをパルス適用したマクロファージを用いたマウスの免疫では、強いCTLp応答は誘導されなかった。
【0116】
本発明の様々な実施の形態において詳細に説明してきたが、これらの実施の形態の変更および改良は当業者であれば可能であることは明らかであろう。しかしながら、このような変更および改良は特許請求の範囲に記載されるように本発明の範囲内にあることを明白に理解すべきである。
【特許請求の範囲】
【請求項1】
動物において、抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物であって、
前記組成物は、マンノースを含む炭水化物ポリマーと、抗原と、を有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、
前記炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、
前記動物に投与する前に、前記マンノース受容体保有抗原提示細胞は、インビトロ又はイクスビボにて前記複合体をパルス適用される、製薬組成物。
【請求項2】
前記マンノース受容体保有抗原提示細胞は、末梢血白血球、骨髄、幹細胞、腹腔細胞、脾臓、肺およびリンパ節からなる群から選択される細胞集団に由来する請求項1に記載の製薬組成物。
【請求項3】
前記マンノース受容体保有抗原提示細胞は、マクロファージ細胞及び樹状細胞からなる群から選択される、請求項1又は2に記載の製薬組成物。
【請求項4】
前記マンノース受容体保有抗原提示細胞は、CD11b、CD14、CD68、CD80およびCD86からなる群から選択される分子を発現する請求項1乃至3のいずれか一項に記載の製薬組成物。
【請求項5】
前記マンノース受容体保有抗原提示細胞は、サイトカイン及びビタミンからなる群から選択される1以上の生体応答調節剤と接触された細胞を含み、前記細胞は、同細胞による炭水化物受容体の発現を誘導するのに効果的な条件にて接触される、請求項1乃至4のいずれか一項に記載の製薬組成物。
【請求項6】
前記生体応答調節剤は、抗原提示細胞においてマンノース受容体の発現を誘導する、請求項5に記載の製薬組成物。
【請求項7】
前記生体応答調節剤は、顆粒球マクロファージ刺激因子(GM−CSF)、インターロイキン−3、インターロイキン−4、ビタミンD、マクロファージコロニー刺激因子(M−CSF)、Flt−3リガンドおよび腫瘍壊死因子(TNF)αからなる群から選択される請求項5又は6に記載の製薬組成物。
【請求項8】
前記抗原は、ムチンポリペプチド、ムチンポリペプチドの1以上の反復サブユニット、または抗原フラグメントであり、前記フラグメントは、少なくとも5個のアミノ酸の反復サブユニットを含む、請求項1乃至7のいずれか一項に記載の製薬組成物。
【請求項9】
前記ムチンはヒトムチンである、請求項8に記載の製薬組成物。
【請求項10】
前記抗原は、ヒトムチンの反復サブユニットの2乃至80のコピーを含む請求項9に記載の製薬組成物。
【請求項11】
前記抗原の前記1以上の反復サブユニットは融合ポリペプチドの部分を含む請求項8乃至10のいずれか一項に記載の製薬組成物。
【請求項12】
動物の抗原に対する細胞障害性T細胞応答を誘導するための医薬品の製造において有効量の組成物を使用する方法であって、
前記組成物は、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、前記炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、かつ前記動物に投与する前に、前記マンノース受容体保有抗原提示細胞は、インビトロ又はイクスビボにて前記複合体をパルス適用される、組成物、を使用する方法。
【請求項1】
動物において、抗原に対する細胞障害性T細胞応答を誘導するための製薬組成物であって、
前記組成物は、マンノースを含む炭水化物ポリマーと、抗原と、を有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、
前記炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、
前記動物に投与する前に、前記マンノース受容体保有抗原提示細胞は、インビトロ又はイクスビボにて前記複合体をパルス適用される、製薬組成物。
【請求項2】
前記マンノース受容体保有抗原提示細胞は、末梢血白血球、骨髄、幹細胞、腹腔細胞、脾臓、肺およびリンパ節からなる群から選択される細胞集団に由来する請求項1に記載の製薬組成物。
【請求項3】
前記マンノース受容体保有抗原提示細胞は、マクロファージ細胞及び樹状細胞からなる群から選択される、請求項1又は2に記載の製薬組成物。
【請求項4】
前記マンノース受容体保有抗原提示細胞は、CD11b、CD14、CD68、CD80およびCD86からなる群から選択される分子を発現する請求項1乃至3のいずれか一項に記載の製薬組成物。
【請求項5】
前記マンノース受容体保有抗原提示細胞は、サイトカイン及びビタミンからなる群から選択される1以上の生体応答調節剤と接触された細胞を含み、前記細胞は、同細胞による炭水化物受容体の発現を誘導するのに効果的な条件にて接触される、請求項1乃至4のいずれか一項に記載の製薬組成物。
【請求項6】
前記生体応答調節剤は、抗原提示細胞においてマンノース受容体の発現を誘導する、請求項5に記載の製薬組成物。
【請求項7】
前記生体応答調節剤は、顆粒球マクロファージ刺激因子(GM−CSF)、インターロイキン−3、インターロイキン−4、ビタミンD、マクロファージコロニー刺激因子(M−CSF)、Flt−3リガンドおよび腫瘍壊死因子(TNF)αからなる群から選択される請求項5又は6に記載の製薬組成物。
【請求項8】
前記抗原は、ムチンポリペプチド、ムチンポリペプチドの1以上の反復サブユニット、または抗原フラグメントであり、前記フラグメントは、少なくとも5個のアミノ酸の反復サブユニットを含む、請求項1乃至7のいずれか一項に記載の製薬組成物。
【請求項9】
前記ムチンはヒトムチンである、請求項8に記載の製薬組成物。
【請求項10】
前記抗原は、ヒトムチンの反復サブユニットの2乃至80のコピーを含む請求項9に記載の製薬組成物。
【請求項11】
前記抗原の前記1以上の反復サブユニットは融合ポリペプチドの部分を含む請求項8乃至10のいずれか一項に記載の製薬組成物。
【請求項12】
動物の抗原に対する細胞障害性T細胞応答を誘導するための医薬品の製造において有効量の組成物を使用する方法であって、
前記組成物は、マンノースを含む炭水化物ポリマーと抗原とを有する複合体と、マンノース受容体保有抗原提示細胞と、を含み、前記炭水化物ポリマーは遊離のアルデヒド基を含む完全に酸化された炭水化物ポリマーであり、かつ前記動物に投与する前に、前記マンノース受容体保有抗原提示細胞は、インビトロ又はイクスビボにて前記複合体をパルス適用される、組成物、を使用する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2011−46723(P2011−46723A)
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2010−226648(P2010−226648)
【出願日】平成22年10月6日(2010.10.6)
【分割の表示】特願2000−513589(P2000−513589)の分割
【原出願日】平成10年9月29日(1998.9.29)
【出願人】(301033226)ジ オースティン リサーチ インスティテュート (1)
【Fターム(参考)】
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成22年10月6日(2010.10.6)
【分割の表示】特願2000−513589(P2000−513589)の分割
【原出願日】平成10年9月29日(1998.9.29)
【出願人】(301033226)ジ オースティン リサーチ インスティテュート (1)
【Fターム(参考)】
[ Back to top ]

