抗原抗体複合体を分離する方法
【課題】抗原抗体複合体に結合する抗原抗体複合体結合蛋白質を含み、B/F分離を省略することで測定時間を短縮することができる抗原抗体複合体を分離する方法を提供する。
【解決手段】以下の配列番号:5の一次構造を有する抗原抗体複合体認識蛋白質を用いて抗原抗体複合体を分離する。配列番号5:AQHEVTQQNAFYQVLNMPNLNADQRNAFIQSLKDDPSQSANVLGEAQKLNDSQAPK
【解決手段】以下の配列番号:5の一次構造を有する抗原抗体複合体認識蛋白質を用いて抗原抗体複合体を分離する。配列番号5:AQHEVTQQNAFYQVLNMPNLNADQRNAFIQSLKDDPSQSANVLGEAQKLNDSQAPK
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、黄色ブドウ球菌由来のプロテインAのEドメイン遺伝子の変異体であって、抗原抗体複合体に選択的に結合する抗原抗体複合体結合蛋白質を含む、抗原抗体複合体を分離する方法に関するものである。
【背景技術】
【0002】
目的とする抗原を定量する方法として、例えば免疫反応を利用した、ELISAによるサンドイッチ法や競合法などがあげられる。(特許文献1)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第3998245号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかし、背景技術に記載の免疫反応を利用したELISA測定法では、一次抗体の固定化、抗原抗体反応、2次抗体の固定化といったステップの合間に洗浄工程(B/F(バインディング/フリー)分離)が必須であることで測定時間がかかる、操作が煩雑になるといった問題があった。
【0005】
そこで、本発明は、上記従来の問題点に鑑み、抗原抗体複合体に結合する抗原抗体複合体結合蛋白質を含み、B/F分離を省略することで測定時間を短縮することができる抗原抗体複合体を分離する方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
上記従来の課題を解決するために、本発明の抗原抗体複合体を分離する方法は、複数のエピトープを有する抗原と、前記抗原を認識するマウス由来の抗体と、前記抗原と前記抗体が反応することにより形成される抗原抗体複合体と結合する抗原抗体複合体認識蛋白質と、前記抗体が液体により溶出するよう塗布された基板部位aと前記抗原抗体複合体認識蛋白質が固定化された基板部位bを含む基板と、前記基板部位aおよび前記基板部位bを繋ぐように覆う流路を有し、前記抗原を含む溶液を前記基板部位aへ流し込む工程Xと、
前記溶液により前記抗体を溶出させ前記抗原と反応させる工程Yと、前記溶液が流れる下流に位置する前記基板部位bにおいて前記抗原抗体複合体と前記抗原抗体複合体認識蛋白質を反応させる工程Zから構成され、抗体単体と抗原抗体複合体を分離する。
【0007】
本構成によって、B/F分離を必要とせず、短時間で抗体単体と抗原抗体複合体を分離することができる。
【発明の効果】
【0008】
本発明によれば、抗原抗体複合体結合蛋白質は抗原抗体複合体に対して結合し、抗原抗体複合体を分離する方法を提供することができる。
【図面の簡単な説明】
【0009】
【図1】本発明の免疫測定方法における実施の形態を示す図
【図2】本発明の免疫測定方法における実施の形態を示す図
【図3】本発明の免疫測定方法における実施の形態を示す図
【図4】本発明の免疫測定方法における実施の形態を示す図
【図5】本発明の一実験例の結果を示す図
【図6】本発明の一実験例の結果を示す図
【図7】本発明の一実験例の結果を示す図
【図8】本発明の一実験例の結果を示す図
【図9】本発明の一実験例の結果を示す図
【発明を実施するための形態】
【0010】
以下において、本発明の実施の形態について説明する。
【0011】
ランダム変異導入遺伝子ライブラリーの作製
テンプレート遺伝子としてプロテインAのEドメインを使用した。
【0012】
ランダム変異を導入するために、プロテインAのEドメイン5’側および3’側に結合する2つのプライマーと変異導入酵素(GeneMorpho II Random Mutagenesis Kit; Stratagene)を用い、エラープローンPCRを3回行った。
【0013】
上記プロテインAのEドメイン変異遺伝子群203をpBluescript II SK (+)ベクター101(アジレント・テクノジー社)のMCS102に存在する制限酵素サイトEcoRV201へ導入するため、メガプライマーとしてプロテインAのEドメイン変異遺伝子群、テンプレートとしてプロテインAのEドメイン遺伝子が導入されたpBluescript II SK (+)ベクター101、酵素としてPrimeSTAR HS(タカラバイオ株式会社)を用いたPCRによって行った。
【0014】
図1にpBluescript II SK (+)ベクター101のマップを示す。
【0015】
図2にMCS102におけるプロテインAのEドメイン変異遺伝子群202の導入箇所である制限酵素サイトEcoRV201を示す。
【0016】
PCR後、テンプレートのプラスミドベクターがプロテインAのEドメイン変異遺伝子群202に混入することが無いよう、酵素DpnIにて処理を行い、テンプレートを消化した。
蛋白質発現を行う遺伝子の選択
上記PCRにより獲得したプロテインAのEドメイン変異遺伝子群が導入されたpBluescript II SK (+)ベクター群から、蛋白質発現する遺伝子を選択するために、遺伝子配列を解読した。
【0017】
遺伝子配列を解読するために、以下の操作を実施した。
【0018】
まず、プロテインAのEドメイン変異遺伝子ライブラリーが導入されたpBluescript II SK (+)ベクター群を、エレクトロポレーション法を用いて、45uLの大腸菌株DH10bへ形質導入した。
【0019】
導入後、SOC培地を500uL加えて、30分間37度でインキュベートした。
【0020】
インキュベート後、100ug/mlアンピシリンを含むLBアガー培地へSOC培地を含む形質導入後の大腸菌株DH10bを塗布した。
【0021】
塗布した量は、
SOC培地を含む形質導入後の大腸菌株DH10bを塗布したLBアガー培地を、37度下にて一晩インキュベートした。
【0022】
インキュベート後、形成した大腸菌コロニーから、ブルーホワイトセレクションにより目視選別した中から24個のコロニーをランダムに選択した。
【0023】
選択した24個のコロニーに含まれるプロテインAのEドメイン変異遺伝子が導入されたpBluescript II SK (+)ベクターを増幅するため、各コロニーをそれぞれ100ug/mlアンピシリンを含むLB培地にて一晩揺動培養した。
【0024】
揺動条件は、37度230rpmを用いた。
【0025】
揺動培養後、ミニプレップキット(キアゲン社)を用いて、各コロニーに含まれるプロテインAのEドメイン変異遺伝子が導入されたpBluescript II SK (+)ベクターを抽出した。
【0026】
pBluescript II SK (+)ベクターに導入されたプロテインAのEドメイン変異遺伝子をシークエンスし、遺伝子配列を特定した。
【0027】
シークエンスには、GenomeLab DTCS−Quick start kit およびBECKMAN製COULTER ACE−2000シークエンサー(BECMAN COULTER)を用いた。
【0028】
シークエンスの際、PCRにより遺伝子を増幅するために、プライマーには、フォワードプライマおよびリバースプライマーとして、
T7 original:5’−taatacgactcactataggg−3’(配列番号:1)
および、
T3:5’−aattaaccctcactaaaggg−3’(配列番号:2)
を用いた。
【0029】
PCRの条件は、94℃1minを1サイクルした後, 95℃30sec、55℃30sec 60℃1minを30サイクルとした。
【0030】
以上の操作により、遺伝子配列を解読した。
【0031】
解読した24種類の遺伝子配列の中から、配列が重複して存在したプロテインAのEドメイン変異遺伝子について蛋白質発現し、評価することとした。
【0032】
本プロテインAのEドメイン変異遺伝子をクローン#24とした。
【0033】
図3にプロテインAのEドメイン変異遺伝子クローン#24の遺伝子配列を示す。
抗原抗体複合体結合蛋白質の作製
上記シークエンスにより選択したプロテインAのEドメイン変異遺伝子クローン#24を大腸菌蛋白質発現に用いられるpET15bベクター(ノヴァジェン社)へ導入した。
【0034】
本ベクターは、6つヒスチジン遺伝子配列を有するため、目的遺伝子を蛋白質として発現したときに、N末端側にヒスチジンタグが融合される。
【0035】
本タグを目的蛋白質が有することにより、ニッケルビーズを用いて目的蛋白質を精製することができる。
【0036】
以下に、pBluescript II SK (+)ベクターからプロテインAのEドメイン変異遺伝子クローン#24のみを増幅し、増幅した遺伝子をpET15bベクターに導入する操作を示す。 pBluescript II SK (+)ベクターからプロテインAのEドメイン変異遺伝子クローン#24のみを増幅するために、PCRを用いた。
【0037】
プライマーには、フォワードプライマーおよびリバースプライマーとして、
5’−tatGGCCCAGCCGGCCtttttttttGCGGCCGCaagcttcaaccgtaacgaatgctaag−3’
および、
5’−gatccttagcattcgttacggttgaagcttGCGGCCGCaaaaaaaaaGGCCGGCTGGGCCa−3’
を用いた。
【0038】
PCRの条件は、94℃1minを1サイクルした後, 98℃10sec、55℃5sec 72℃30secを30サイクルとした。
【0039】
PCR反応液から核酸電気泳動により増幅したプロテインAのEドメイン変異遺伝子クローン#24を抽出、精製した。
【0040】
得られたプロテインAのEドメイン変異遺伝子クローン#24、およびpET15bベクターを2つの制限酵素、すなわちNdeI、XhoIを用いて消化した。
【0041】
消化後、プロテインAのEドメイン変異遺伝子クローン#24とpET15bベクターのライゲーションを行った。
【0042】
以上により、pBluescript II SK (+)ベクターからプロテインAのEドメイン変異遺伝子クローン#24のみを増幅し、増幅した遺伝子をpET15bベクターに導入した。
【0043】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質発現を行うために、プロテインAのEドメイン変異遺伝子クローン#24を導入したpET15bベクターをエレクトロポレーションを用いて、たんぱく質発現用大腸菌BL21(DE3)pLysS株(インビトロジェン社)へ形質導入した。
【0044】
以下にプロテインAのEドメイン変異遺伝子クローン#24の蛋白質の精製方法を記す。
【0045】
形質導入された大腸菌BL21(DE3)pLysS株をLBアガー培地上へ塗布し、37度にて一晩培養した。
【0046】
培養後、得られた大腸菌BL21(DE3)pLysS株コロニーを1つピックアップし、各々50mlの2YT培地 (アンピシリン100μg/ml、クロランフェニコール25μg/ml)で一晩、37℃で振とう培養した(pre culture)。
【0047】
500mlの2YT培地 (アンピシリン100μg/ml)に1/100量 (5ml)のpre cultureした大腸菌液を加え、37℃で2.5時間振とう培養後、最終濃度が500μMになるようにIPTGを加え、さらに6時間培養した。
【0048】
遠心により、培養した大腸菌を回収し、50mlの最終濃度5mMイミダゾールを含む1xPBS (pH7.4)(ソニケーションバッファー)に再懸濁し、ソニケーションにより菌体を超音波破砕した。
【0049】
遠心により破砕大腸菌を含む不溶分画を除き、上清を回収した後0.22μmのフィルターに通した。
【0050】
フィルター後の上清を、0.5mlのベットボリュームのNi Sepharose 6 Fast Flow (GE Healthcare)を充填したカラムに2回通した後、カラムを1xPBS (pH7.4)で5回洗浄した。
【0051】
カラム内に結合したプロテインAのEドメイン変異遺伝子クローン#24の蛋白質を溶出するために、最終濃度300mMイミダゾールを含む1xPBS (pH7.4)を用いて、溶出液を1mlずつ4フラクション分回収した。
【0052】
O.D.280の吸光度測定により、各フラクションに含まれる溶出蛋白質量を同定した。
SPR測定法による測定感度の評価
得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質と抗原抗体複合体との相互作用を評価するために、SPR測定を行った。
【0053】
SPR装置はBIAcore2000 (GE Healthcare社)を用いた。
【0054】
BIAcoreは、一つのセンサーチップに対して4つの測定部位を有する。
【0055】
得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質をセンサーチップCM5 (GE Healthcare社)に固定化した。
【0056】
センサーチップは、金基板、デキストラン、カルボキシル基から構成され、金基板上にカルボキシル基を有するデキストランが固定化された構造を有する。
【0057】
相互作用測定時のバッファーとしてPBS 0.005%Tween20を用いた。
【0058】
測定後、固定化したプロテインAのEドメイン変異遺伝子クローン#24の蛋白質から抗原抗体複合体を洗浄するための再生液として3M Guanidine−HCl, 1M Acetic acid pH1.8を使用した。
【0059】
抗原抗体複合体の抗原として(4−hydroxy−3−nitrophenyl) acetyl(NP)が平均19.8個アミノカップリングされた牛血清アルブミン(NP−BSA)を用いた。
【0060】
抗体として抗NPマウスIgG1(東京理科大作製)を用いた。
【0061】
以下に得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質をセンサーチップへ固定化する方法を記す。
【0062】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質のセンサーチップへの固定化には、Amine coupling kit(GE Healthcare社)を用いて行った。
【0063】
蛋白質を固定化する際、流速は5μl/minで行い、BIAcoreの第2番目の測定部位を用いた。
【0064】
新しいセンサーチップ上へ0.1M NHSと0.4M EDCとの混合液(NHS/EDC)(GE Healthcare社) 35μlを流した後、1M ethanolamine−HCl pH8.5 (GE Healthcare社) を35μl流し、チップ上の電荷を中和した。
【0065】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質を含むpH4.0の10mM sodium acetateを流し、センサーチップ上へ約4000RU分固定化した。
【0066】
固定化後、ethanolamineを35μl流すことで蛋白質が固定化されていない活性基をブロッキングした。
【0067】
蛋白質を固定化していない時のチップへの抗原抗体複合体の非特異結合を測定するため、BIAcoreの第1番目の測定部位にNHS/EDC 35μlを流した後、ethanolamineを35μl流し活性基をブロッキングした。
【0068】
以上により、センサーチップ上へ蛋白質を固定化した。
【0069】
次に、得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質と抗原抗体複合体との相互作用のSPR測定について以下に記す。
【0070】
測定時の流速は20μl/minで行った。
【0071】
抗体である抗NPマウスIgG1濃度を100nMに揃え、抗原であるNP−BSAの濃度を0nM、および10倍希釈にて0.0001−100nMの間で調整し、各抗原濃度と抗体を反応させ、抗原抗体複合体を作製した。
【0072】
各濃度の抗原抗体複合体をBIAcoreの第1および2番目の測定部位へ流速50μlで流し、非特異結合およびプロテインAのEドメイン変異遺伝子クローン#24の蛋白質との相互作用を測定した。
【0073】
図4に抗体濃度100nMとプロテインAのEドメイン変異遺伝子クローン#24の蛋白質との相互作用401、および抗体濃度100nMと抗原濃度20nMからなる抗原抗体複合体とプロテインAのEドメイン変異遺伝子クローン#24の蛋白質との相互作用402を示す。
【0074】
この結果から、プロテインAのEドメイン変異遺伝子クローン#24の蛋白質は、抗体単体に対する結合は無く、抗原抗体複合体に対して結合することが分かった。
【0075】
次に、抗原抗体複合体を180秒間センサーチップに流し、抗原抗体複合体を流し始めてから240秒後の結合量を2度測定した。
【0076】
抗原抗体複合体の各濃度における測定値を±2S.D.法により検出限界値を求めた。
【0077】
比較対象として、ネイティブのプロテインAのEドメインの蛋白質を上記と同様にセンサーチップに固定化し、同様の測定を実施した。
【0078】
図5に測定結果を示す。
【0079】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質502は、抗原抗体複合体の濃度0.001nMと0.0001nMにおいて、結合量に差を有した。
【0080】
一方、ネイティブのプロテインAのEドメイン501は、抗原抗体複合体の濃度0.001nMと0.0001nMにおいて、結合量に差を有しなかった。
【0081】
このことから、NP19.8−BSAが検出できることが確認され、ネイティブのプロテインAのEドメインの蛋白質に比べて約10倍結合力が強いことが確認された。
【0082】
上記の結果から、プロテインAのEドメイン変異遺伝子クローン#24の蛋白質は、抗体単体とは結合せず抗原抗体複合体と結合する、ネイティブのプロテインA のEドメインに比べて約10倍結合力が強いという性質を持ち、本蛋白質が抗原抗体複合体認識蛋白質であることが確認された。
抗原抗体複合体を分離する方法
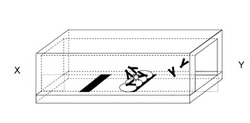
抗原抗体複合体を分離する方法について、図6から図9を用いて説明する。
【0083】
図6に示すように、構成は基板601と抗原602を認識する抗体603と抗原抗体複合体認識蛋白質604と前記抗体603を塗布する部位605と前記抗原抗体複合体認識蛋白質604を固定化する部位606基板上を覆う流路607からなる。
【0084】
図7に示すように、抗原602を含む溶液を、XからYの方向へ流す。
【0085】
基板上流の部位605に抗原602を認識する抗体603を風乾または凍結乾燥により塗布する。これにより、塗布された抗体603は、抗原602を含む溶液により容易に溶解する。
【0086】
図8に示すように、溶液中の抗原602と溶解した抗体603が反応し抗原抗体複合体801が形成され、溶液と共に下流へ流れる。
【0087】
図9に示すように、基板上の抗体603が塗布された部位605の下流の部位606に抗原抗体複合体認識蛋白質604を固定化する。固定化方法として、例えば、基板を金とし蛋白質中のアミノ酸システインによるAu−S結合を用いる、基板をポリスチレンとし蛋白質の吸着を用いる、ということが挙げられる。
【0088】
図9に示すように、溶液中の抗原抗体複合体801は、抗原抗体複合体認識蛋白質604と結合し、抗原抗体複合体認識蛋白質604が固定化された部位606に蓄積する。
【0089】
一方、抗原602と未反応の抗体603は、抗原抗体複合体認識蛋白質606と結合せず、溶液と共にさらに下流へ流れる。
【0090】
上記により、B/F分離なしで抗原抗体複合体801と抗原602と未反応の抗体603を分離することが可能である。
【産業上の利用可能性】
【0091】
本発明の抗原抗体複合体を分離する方法を用いれば、図9に記載のようにB/F分離をすることなく、目的の抗原に対して特異的に結合した抗体からなる抗原抗体複合体と抗原非結合の抗体と分離することができ、抗原濃度測定時間の短縮にとって有用である。
【符号の説明】
【0092】
102 MCS、マルチクローニングサイト
103 lacZ
104 f1(+) origin
105 Amp
106 pUC ori
201 制限酵素サイトEcoRV
202 プロテインAのEドメイン変異遺伝子群
401 抗体と抗原抗体複合体認識蛋白質の相互作用を示すセンサーグラム
402 抗原抗体複合体と抗原抗体複合体認識蛋白質の相互作用を示すセンサーグラム
501 ネイティブのプロテインAのEドメインと抗原抗体複合体の結合量を示すグラフ
502 プロテインAのEドメイン変異体遺伝子クローン#24の蛋白質と抗原抗体複合体の結合量を示すグラフ
601 基板
602 抗原
603 抗体
604 抗原抗体複合体認識蛋白質
607 流路
801 抗原抗体複合体
【技術分野】
【0001】
本発明は、黄色ブドウ球菌由来のプロテインAのEドメイン遺伝子の変異体であって、抗原抗体複合体に選択的に結合する抗原抗体複合体結合蛋白質を含む、抗原抗体複合体を分離する方法に関するものである。
【背景技術】
【0002】
目的とする抗原を定量する方法として、例えば免疫反応を利用した、ELISAによるサンドイッチ法や競合法などがあげられる。(特許文献1)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第3998245号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかし、背景技術に記載の免疫反応を利用したELISA測定法では、一次抗体の固定化、抗原抗体反応、2次抗体の固定化といったステップの合間に洗浄工程(B/F(バインディング/フリー)分離)が必須であることで測定時間がかかる、操作が煩雑になるといった問題があった。
【0005】
そこで、本発明は、上記従来の問題点に鑑み、抗原抗体複合体に結合する抗原抗体複合体結合蛋白質を含み、B/F分離を省略することで測定時間を短縮することができる抗原抗体複合体を分離する方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
上記従来の課題を解決するために、本発明の抗原抗体複合体を分離する方法は、複数のエピトープを有する抗原と、前記抗原を認識するマウス由来の抗体と、前記抗原と前記抗体が反応することにより形成される抗原抗体複合体と結合する抗原抗体複合体認識蛋白質と、前記抗体が液体により溶出するよう塗布された基板部位aと前記抗原抗体複合体認識蛋白質が固定化された基板部位bを含む基板と、前記基板部位aおよび前記基板部位bを繋ぐように覆う流路を有し、前記抗原を含む溶液を前記基板部位aへ流し込む工程Xと、
前記溶液により前記抗体を溶出させ前記抗原と反応させる工程Yと、前記溶液が流れる下流に位置する前記基板部位bにおいて前記抗原抗体複合体と前記抗原抗体複合体認識蛋白質を反応させる工程Zから構成され、抗体単体と抗原抗体複合体を分離する。
【0007】
本構成によって、B/F分離を必要とせず、短時間で抗体単体と抗原抗体複合体を分離することができる。
【発明の効果】
【0008】
本発明によれば、抗原抗体複合体結合蛋白質は抗原抗体複合体に対して結合し、抗原抗体複合体を分離する方法を提供することができる。
【図面の簡単な説明】
【0009】
【図1】本発明の免疫測定方法における実施の形態を示す図
【図2】本発明の免疫測定方法における実施の形態を示す図
【図3】本発明の免疫測定方法における実施の形態を示す図
【図4】本発明の免疫測定方法における実施の形態を示す図
【図5】本発明の一実験例の結果を示す図
【図6】本発明の一実験例の結果を示す図
【図7】本発明の一実験例の結果を示す図
【図8】本発明の一実験例の結果を示す図
【図9】本発明の一実験例の結果を示す図
【発明を実施するための形態】
【0010】
以下において、本発明の実施の形態について説明する。
【0011】
ランダム変異導入遺伝子ライブラリーの作製
テンプレート遺伝子としてプロテインAのEドメインを使用した。
【0012】
ランダム変異を導入するために、プロテインAのEドメイン5’側および3’側に結合する2つのプライマーと変異導入酵素(GeneMorpho II Random Mutagenesis Kit; Stratagene)を用い、エラープローンPCRを3回行った。
【0013】
上記プロテインAのEドメイン変異遺伝子群203をpBluescript II SK (+)ベクター101(アジレント・テクノジー社)のMCS102に存在する制限酵素サイトEcoRV201へ導入するため、メガプライマーとしてプロテインAのEドメイン変異遺伝子群、テンプレートとしてプロテインAのEドメイン遺伝子が導入されたpBluescript II SK (+)ベクター101、酵素としてPrimeSTAR HS(タカラバイオ株式会社)を用いたPCRによって行った。
【0014】
図1にpBluescript II SK (+)ベクター101のマップを示す。
【0015】
図2にMCS102におけるプロテインAのEドメイン変異遺伝子群202の導入箇所である制限酵素サイトEcoRV201を示す。
【0016】
PCR後、テンプレートのプラスミドベクターがプロテインAのEドメイン変異遺伝子群202に混入することが無いよう、酵素DpnIにて処理を行い、テンプレートを消化した。
蛋白質発現を行う遺伝子の選択
上記PCRにより獲得したプロテインAのEドメイン変異遺伝子群が導入されたpBluescript II SK (+)ベクター群から、蛋白質発現する遺伝子を選択するために、遺伝子配列を解読した。
【0017】
遺伝子配列を解読するために、以下の操作を実施した。
【0018】
まず、プロテインAのEドメイン変異遺伝子ライブラリーが導入されたpBluescript II SK (+)ベクター群を、エレクトロポレーション法を用いて、45uLの大腸菌株DH10bへ形質導入した。
【0019】
導入後、SOC培地を500uL加えて、30分間37度でインキュベートした。
【0020】
インキュベート後、100ug/mlアンピシリンを含むLBアガー培地へSOC培地を含む形質導入後の大腸菌株DH10bを塗布した。
【0021】
塗布した量は、
SOC培地を含む形質導入後の大腸菌株DH10bを塗布したLBアガー培地を、37度下にて一晩インキュベートした。
【0022】
インキュベート後、形成した大腸菌コロニーから、ブルーホワイトセレクションにより目視選別した中から24個のコロニーをランダムに選択した。
【0023】
選択した24個のコロニーに含まれるプロテインAのEドメイン変異遺伝子が導入されたpBluescript II SK (+)ベクターを増幅するため、各コロニーをそれぞれ100ug/mlアンピシリンを含むLB培地にて一晩揺動培養した。
【0024】
揺動条件は、37度230rpmを用いた。
【0025】
揺動培養後、ミニプレップキット(キアゲン社)を用いて、各コロニーに含まれるプロテインAのEドメイン変異遺伝子が導入されたpBluescript II SK (+)ベクターを抽出した。
【0026】
pBluescript II SK (+)ベクターに導入されたプロテインAのEドメイン変異遺伝子をシークエンスし、遺伝子配列を特定した。
【0027】
シークエンスには、GenomeLab DTCS−Quick start kit およびBECKMAN製COULTER ACE−2000シークエンサー(BECMAN COULTER)を用いた。
【0028】
シークエンスの際、PCRにより遺伝子を増幅するために、プライマーには、フォワードプライマおよびリバースプライマーとして、
T7 original:5’−taatacgactcactataggg−3’(配列番号:1)
および、
T3:5’−aattaaccctcactaaaggg−3’(配列番号:2)
を用いた。
【0029】
PCRの条件は、94℃1minを1サイクルした後, 95℃30sec、55℃30sec 60℃1minを30サイクルとした。
【0030】
以上の操作により、遺伝子配列を解読した。
【0031】
解読した24種類の遺伝子配列の中から、配列が重複して存在したプロテインAのEドメイン変異遺伝子について蛋白質発現し、評価することとした。
【0032】
本プロテインAのEドメイン変異遺伝子をクローン#24とした。
【0033】
図3にプロテインAのEドメイン変異遺伝子クローン#24の遺伝子配列を示す。
抗原抗体複合体結合蛋白質の作製
上記シークエンスにより選択したプロテインAのEドメイン変異遺伝子クローン#24を大腸菌蛋白質発現に用いられるpET15bベクター(ノヴァジェン社)へ導入した。
【0034】
本ベクターは、6つヒスチジン遺伝子配列を有するため、目的遺伝子を蛋白質として発現したときに、N末端側にヒスチジンタグが融合される。
【0035】
本タグを目的蛋白質が有することにより、ニッケルビーズを用いて目的蛋白質を精製することができる。
【0036】
以下に、pBluescript II SK (+)ベクターからプロテインAのEドメイン変異遺伝子クローン#24のみを増幅し、増幅した遺伝子をpET15bベクターに導入する操作を示す。 pBluescript II SK (+)ベクターからプロテインAのEドメイン変異遺伝子クローン#24のみを増幅するために、PCRを用いた。
【0037】
プライマーには、フォワードプライマーおよびリバースプライマーとして、
5’−tatGGCCCAGCCGGCCtttttttttGCGGCCGCaagcttcaaccgtaacgaatgctaag−3’
および、
5’−gatccttagcattcgttacggttgaagcttGCGGCCGCaaaaaaaaaGGCCGGCTGGGCCa−3’
を用いた。
【0038】
PCRの条件は、94℃1minを1サイクルした後, 98℃10sec、55℃5sec 72℃30secを30サイクルとした。
【0039】
PCR反応液から核酸電気泳動により増幅したプロテインAのEドメイン変異遺伝子クローン#24を抽出、精製した。
【0040】
得られたプロテインAのEドメイン変異遺伝子クローン#24、およびpET15bベクターを2つの制限酵素、すなわちNdeI、XhoIを用いて消化した。
【0041】
消化後、プロテインAのEドメイン変異遺伝子クローン#24とpET15bベクターのライゲーションを行った。
【0042】
以上により、pBluescript II SK (+)ベクターからプロテインAのEドメイン変異遺伝子クローン#24のみを増幅し、増幅した遺伝子をpET15bベクターに導入した。
【0043】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質発現を行うために、プロテインAのEドメイン変異遺伝子クローン#24を導入したpET15bベクターをエレクトロポレーションを用いて、たんぱく質発現用大腸菌BL21(DE3)pLysS株(インビトロジェン社)へ形質導入した。
【0044】
以下にプロテインAのEドメイン変異遺伝子クローン#24の蛋白質の精製方法を記す。
【0045】
形質導入された大腸菌BL21(DE3)pLysS株をLBアガー培地上へ塗布し、37度にて一晩培養した。
【0046】
培養後、得られた大腸菌BL21(DE3)pLysS株コロニーを1つピックアップし、各々50mlの2YT培地 (アンピシリン100μg/ml、クロランフェニコール25μg/ml)で一晩、37℃で振とう培養した(pre culture)。
【0047】
500mlの2YT培地 (アンピシリン100μg/ml)に1/100量 (5ml)のpre cultureした大腸菌液を加え、37℃で2.5時間振とう培養後、最終濃度が500μMになるようにIPTGを加え、さらに6時間培養した。
【0048】
遠心により、培養した大腸菌を回収し、50mlの最終濃度5mMイミダゾールを含む1xPBS (pH7.4)(ソニケーションバッファー)に再懸濁し、ソニケーションにより菌体を超音波破砕した。
【0049】
遠心により破砕大腸菌を含む不溶分画を除き、上清を回収した後0.22μmのフィルターに通した。
【0050】
フィルター後の上清を、0.5mlのベットボリュームのNi Sepharose 6 Fast Flow (GE Healthcare)を充填したカラムに2回通した後、カラムを1xPBS (pH7.4)で5回洗浄した。
【0051】
カラム内に結合したプロテインAのEドメイン変異遺伝子クローン#24の蛋白質を溶出するために、最終濃度300mMイミダゾールを含む1xPBS (pH7.4)を用いて、溶出液を1mlずつ4フラクション分回収した。
【0052】
O.D.280の吸光度測定により、各フラクションに含まれる溶出蛋白質量を同定した。
SPR測定法による測定感度の評価
得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質と抗原抗体複合体との相互作用を評価するために、SPR測定を行った。
【0053】
SPR装置はBIAcore2000 (GE Healthcare社)を用いた。
【0054】
BIAcoreは、一つのセンサーチップに対して4つの測定部位を有する。
【0055】
得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質をセンサーチップCM5 (GE Healthcare社)に固定化した。
【0056】
センサーチップは、金基板、デキストラン、カルボキシル基から構成され、金基板上にカルボキシル基を有するデキストランが固定化された構造を有する。
【0057】
相互作用測定時のバッファーとしてPBS 0.005%Tween20を用いた。
【0058】
測定後、固定化したプロテインAのEドメイン変異遺伝子クローン#24の蛋白質から抗原抗体複合体を洗浄するための再生液として3M Guanidine−HCl, 1M Acetic acid pH1.8を使用した。
【0059】
抗原抗体複合体の抗原として(4−hydroxy−3−nitrophenyl) acetyl(NP)が平均19.8個アミノカップリングされた牛血清アルブミン(NP−BSA)を用いた。
【0060】
抗体として抗NPマウスIgG1(東京理科大作製)を用いた。
【0061】
以下に得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質をセンサーチップへ固定化する方法を記す。
【0062】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質のセンサーチップへの固定化には、Amine coupling kit(GE Healthcare社)を用いて行った。
【0063】
蛋白質を固定化する際、流速は5μl/minで行い、BIAcoreの第2番目の測定部位を用いた。
【0064】
新しいセンサーチップ上へ0.1M NHSと0.4M EDCとの混合液(NHS/EDC)(GE Healthcare社) 35μlを流した後、1M ethanolamine−HCl pH8.5 (GE Healthcare社) を35μl流し、チップ上の電荷を中和した。
【0065】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質を含むpH4.0の10mM sodium acetateを流し、センサーチップ上へ約4000RU分固定化した。
【0066】
固定化後、ethanolamineを35μl流すことで蛋白質が固定化されていない活性基をブロッキングした。
【0067】
蛋白質を固定化していない時のチップへの抗原抗体複合体の非特異結合を測定するため、BIAcoreの第1番目の測定部位にNHS/EDC 35μlを流した後、ethanolamineを35μl流し活性基をブロッキングした。
【0068】
以上により、センサーチップ上へ蛋白質を固定化した。
【0069】
次に、得られたプロテインAのEドメイン変異遺伝子クローン#24の蛋白質と抗原抗体複合体との相互作用のSPR測定について以下に記す。
【0070】
測定時の流速は20μl/minで行った。
【0071】
抗体である抗NPマウスIgG1濃度を100nMに揃え、抗原であるNP−BSAの濃度を0nM、および10倍希釈にて0.0001−100nMの間で調整し、各抗原濃度と抗体を反応させ、抗原抗体複合体を作製した。
【0072】
各濃度の抗原抗体複合体をBIAcoreの第1および2番目の測定部位へ流速50μlで流し、非特異結合およびプロテインAのEドメイン変異遺伝子クローン#24の蛋白質との相互作用を測定した。
【0073】
図4に抗体濃度100nMとプロテインAのEドメイン変異遺伝子クローン#24の蛋白質との相互作用401、および抗体濃度100nMと抗原濃度20nMからなる抗原抗体複合体とプロテインAのEドメイン変異遺伝子クローン#24の蛋白質との相互作用402を示す。
【0074】
この結果から、プロテインAのEドメイン変異遺伝子クローン#24の蛋白質は、抗体単体に対する結合は無く、抗原抗体複合体に対して結合することが分かった。
【0075】
次に、抗原抗体複合体を180秒間センサーチップに流し、抗原抗体複合体を流し始めてから240秒後の結合量を2度測定した。
【0076】
抗原抗体複合体の各濃度における測定値を±2S.D.法により検出限界値を求めた。
【0077】
比較対象として、ネイティブのプロテインAのEドメインの蛋白質を上記と同様にセンサーチップに固定化し、同様の測定を実施した。
【0078】
図5に測定結果を示す。
【0079】
プロテインAのEドメイン変異遺伝子クローン#24の蛋白質502は、抗原抗体複合体の濃度0.001nMと0.0001nMにおいて、結合量に差を有した。
【0080】
一方、ネイティブのプロテインAのEドメイン501は、抗原抗体複合体の濃度0.001nMと0.0001nMにおいて、結合量に差を有しなかった。
【0081】
このことから、NP19.8−BSAが検出できることが確認され、ネイティブのプロテインAのEドメインの蛋白質に比べて約10倍結合力が強いことが確認された。
【0082】
上記の結果から、プロテインAのEドメイン変異遺伝子クローン#24の蛋白質は、抗体単体とは結合せず抗原抗体複合体と結合する、ネイティブのプロテインA のEドメインに比べて約10倍結合力が強いという性質を持ち、本蛋白質が抗原抗体複合体認識蛋白質であることが確認された。
抗原抗体複合体を分離する方法
抗原抗体複合体を分離する方法について、図6から図9を用いて説明する。
【0083】
図6に示すように、構成は基板601と抗原602を認識する抗体603と抗原抗体複合体認識蛋白質604と前記抗体603を塗布する部位605と前記抗原抗体複合体認識蛋白質604を固定化する部位606基板上を覆う流路607からなる。
【0084】
図7に示すように、抗原602を含む溶液を、XからYの方向へ流す。
【0085】
基板上流の部位605に抗原602を認識する抗体603を風乾または凍結乾燥により塗布する。これにより、塗布された抗体603は、抗原602を含む溶液により容易に溶解する。
【0086】
図8に示すように、溶液中の抗原602と溶解した抗体603が反応し抗原抗体複合体801が形成され、溶液と共に下流へ流れる。
【0087】
図9に示すように、基板上の抗体603が塗布された部位605の下流の部位606に抗原抗体複合体認識蛋白質604を固定化する。固定化方法として、例えば、基板を金とし蛋白質中のアミノ酸システインによるAu−S結合を用いる、基板をポリスチレンとし蛋白質の吸着を用いる、ということが挙げられる。
【0088】
図9に示すように、溶液中の抗原抗体複合体801は、抗原抗体複合体認識蛋白質604と結合し、抗原抗体複合体認識蛋白質604が固定化された部位606に蓄積する。
【0089】
一方、抗原602と未反応の抗体603は、抗原抗体複合体認識蛋白質606と結合せず、溶液と共にさらに下流へ流れる。
【0090】
上記により、B/F分離なしで抗原抗体複合体801と抗原602と未反応の抗体603を分離することが可能である。
【産業上の利用可能性】
【0091】
本発明の抗原抗体複合体を分離する方法を用いれば、図9に記載のようにB/F分離をすることなく、目的の抗原に対して特異的に結合した抗体からなる抗原抗体複合体と抗原非結合の抗体と分離することができ、抗原濃度測定時間の短縮にとって有用である。
【符号の説明】
【0092】
102 MCS、マルチクローニングサイト
103 lacZ
104 f1(+) origin
105 Amp
106 pUC ori
201 制限酵素サイトEcoRV
202 プロテインAのEドメイン変異遺伝子群
401 抗体と抗原抗体複合体認識蛋白質の相互作用を示すセンサーグラム
402 抗原抗体複合体と抗原抗体複合体認識蛋白質の相互作用を示すセンサーグラム
501 ネイティブのプロテインAのEドメインと抗原抗体複合体の結合量を示すグラフ
502 プロテインAのEドメイン変異体遺伝子クローン#24の蛋白質と抗原抗体複合体の結合量を示すグラフ
601 基板
602 抗原
603 抗体
604 抗原抗体複合体認識蛋白質
607 流路
801 抗原抗体複合体
【特許請求の範囲】
【請求項1】
複数のエピトープを有する抗原と、
前記抗原を認識するマウス由来の抗体と、
前記抗原と前記抗体が反応することにより形成される抗原抗体複合体と結合する抗原抗体複合体認識蛋白質と、
前記抗体が液体により溶出するよう塗布された基板部位aと前記抗原抗体複合体認識蛋白質が固定化された基板部位bを含む基板と、
前記基板部位aおよび前記基板部位bを繋ぐように覆う流路を有し、
前記抗原を含む溶液を前記基板部位aへ流し込む工程Xと、
前記溶液により前記抗体を溶出させ前記抗原と反応させる工程Yと、
前記溶液が流れる下流に位置する前記基板部位bにおいて前記抗原抗体複合体と前記抗原抗体複合体認識蛋白質を反応させる工程Zから構成され、
前記抗原抗体複合体認識蛋白質の配列が以下の配列番号:5の一次構造を有する蛋白質であることを特徴とする抗原抗体複合体を分離する方法。
配列番号5:AQHEVTQQNAFYQVLNMPNLNADQRNAFIQSLKDDPSQSANVLGEAQKLNDSQAPK
【請求項1】
複数のエピトープを有する抗原と、
前記抗原を認識するマウス由来の抗体と、
前記抗原と前記抗体が反応することにより形成される抗原抗体複合体と結合する抗原抗体複合体認識蛋白質と、
前記抗体が液体により溶出するよう塗布された基板部位aと前記抗原抗体複合体認識蛋白質が固定化された基板部位bを含む基板と、
前記基板部位aおよび前記基板部位bを繋ぐように覆う流路を有し、
前記抗原を含む溶液を前記基板部位aへ流し込む工程Xと、
前記溶液により前記抗体を溶出させ前記抗原と反応させる工程Yと、
前記溶液が流れる下流に位置する前記基板部位bにおいて前記抗原抗体複合体と前記抗原抗体複合体認識蛋白質を反応させる工程Zから構成され、
前記抗原抗体複合体認識蛋白質の配列が以下の配列番号:5の一次構造を有する蛋白質であることを特徴とする抗原抗体複合体を分離する方法。
配列番号5:AQHEVTQQNAFYQVLNMPNLNADQRNAFIQSLKDDPSQSANVLGEAQKLNDSQAPK
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−122868(P2012−122868A)
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願番号】特願2010−274292(P2010−274292)
【出願日】平成22年12月9日(2010.12.9)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願日】平成22年12月9日(2010.12.9)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

