抗微生物物質産生・分泌促進剤
【課題】 茸の抽出物やエルゴチオネインを有効成分とする、パネト細胞において抗微生物物質の産生や分泌を促進する剤を提供する。
【解決手段】 パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする。本発明に係る抗微生物物質の産生や分泌を促進する剤は、食用茸の抽出物やエルゴチオネインを有効成分としており、高い安全性を有している。また、本発明に係る抗微生物物質の産生や分泌を促進する剤によれば、生体内のパネト細胞において抗微生物物質の産生や分泌を促進することができることから、生体の免疫を賦活する他、疾病の予防や治療をすることができる。
【解決手段】 パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする。本発明に係る抗微生物物質の産生や分泌を促進する剤は、食用茸の抽出物やエルゴチオネインを有効成分としており、高い安全性を有している。また、本発明に係る抗微生物物質の産生や分泌を促進する剤によれば、生体内のパネト細胞において抗微生物物質の産生や分泌を促進することができることから、生体の免疫を賦活する他、疾病の予防や治療をすることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗微生物物質の産生および/または分泌を促進する剤に関し、より詳細には、パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって、茸の抽出物および/またはエルゴチオネインを有効成分とする前記剤に関する。
【背景技術】
【0002】
パネト細胞は腸上皮細胞の一種であり、主として、小腸内腔を覆う腸柔毛の間にあるクリプト(腸腺、リーベルキューン腺、腸陰窩、腸小窩、intestinal crypt)と呼ばれる窪みの基底部に存在している。パネト細胞は細胞質内に大型の分泌顆粒を多数有しており、他の細胞種と容易に見分けることができる。
【0003】
小腸の内腔は体内に取り込んだ食物を消化・吸収する場であると同時に、外界と接する場であり、常時、細菌やウイルスなどの感染の危険に晒されているが、この小腸内腔において、パネト細胞は感染防御に中心的な役割を果たしている。具体的には、パネト細胞は、抗菌ペプチドなどの抗微生物物質を産生して分泌顆粒内に貯蔵し、細菌に曝されるなどの刺激を受けると、貯蔵していた抗微生物物質を小腸内腔へ分泌する。パネト細胞が分泌する抗微生物物質には多種類の物質が含まれており、幅広い微生物に対して殺傷効果や抑制効果を発揮することが知られている。
【0004】
したがって、パネト細胞やパネト細胞が分泌する抗微生物物質を医療や医薬品産業などに利用するための研究開発がなされおり、特許文献1には、イソロイシン、ロイシンまたはバリンから選択される少なくとも1種の分岐鎖必須アミノ酸を有効成分として含有する、パネト細胞の抗菌ペプチド分泌誘発剤が開示されている。
【0005】
一方、茸は、食品産業、健康産業、化粧品産業、医薬品産業などにおいて有用な種々の成分を有することが知られており、例えば、特許文献2には食用担子菌類の有機酸含有親水性溶媒抽出物を有効成分とする腸内菌叢改善剤が、特許文献3にはハナビラタケ科に属する茸類の抽出物を有効成分とする筋肉増加剤が、特許文献4にはシイタケ菌糸体の抽出物を有効成分とする皮膚美白作用剤が、特許文献5には本発明者らによりタモギタケの熱水抽出物を有効成分とする抗腫瘍性免疫賦活剤が、特許文献6にはタモギタケから抽出されるエルゴチオネインを有効成分とする抗酸化剤、チロシナーゼ活性阻害剤、リパーゼ活性阻害剤、5α−レダクターゼ活性阻害剤、抗老化剤および抗メタボリックシンドローム剤が、それぞれ開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2003−95938号公報
【特許文献2】特開2009−161502号公報
【特許文献3】特開2009−62346号公報
【特許文献4】特開2003−48821号公報
【特許文献5】国際公開WO2006/038527号パンフレット
【特許文献6】特開2009−126863号
【発明の概要】
【発明が解決しようとする課題】
【0007】
このように、パネト細胞において抗微生物物質の産生や分泌を促進する物質の探索や開発がなされ、また、茸の抽出物が種々の効果を有することは知られていたが、茸の抽出物やエルゴチオネインがパネト細胞において抗微生物物質の産生や分泌を促進することは、これまでに知られていなかった。
【0008】
実際に、特許文献1に開示されている抗菌ペプチド分泌誘発剤は単体のアミノ酸を有効成分とするものであり、茸の抽出物やエルゴチオネインを有効成分とするものではない。また、特許文献2〜特許文献6に記載の食用担子菌類の有機酸含有親水性溶媒抽出物、ハナビラタケ科に属する茸類の抽出物、シイタケ菌糸体の抽出物、タモギタケの熱水抽出物およびタモギタケから抽出されるエルゴチオネインはいずれも、パネト細胞において抗微生物物質の産生および/または分泌を促進する剤として用いられているものではない。
【0009】
本発明は、茸の抽出物やエルゴチオネインを有効成分とする、パネト細胞において抗微生物物質の産生や分泌を促進する剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは、鋭意研究の結果、茸の抽出物やエルゴチオネインを添加してインキュベートしたパネト細胞の分泌物が、抗微生物物質を多量に含有することを見出し、下記の各発明を完成した。
【0011】
(1)パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする前記剤。
【0012】
(2)茸の抽出物が茸の水系溶媒抽出物である、(1)に記載の剤。
【0013】
(3)茸の水系溶媒抽出物が茸の熱水抽出物である、(2)に記載の剤。
【0014】
(4)茸がタモギタケ、シイタケおよびマイタケからなる群から選択される1または2以上の茸である、(1)から(3)のいずれかに記載の剤。
【0015】
(5)茸がタモギタケである、(1)から(3)のいずれかに記載の剤。
【発明の効果】
【0016】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、食用茸の抽出物やエルゴチオネインを有効成分としており、高い安全性を有している。また、本発明に係る抗微生物物質の産生や分泌を促進する剤によれば、生体内のパネト細胞において抗微生物物質の産生や分泌を促進することができることから、生体の免疫を賦活する他、疾病の予防や治療をすることができる。また、本発明に係る抗微生物物質の産生や分泌を促進する剤によれば、生体外の(生体から分離採取した)パネト細胞において抗微生物物質の産生や分泌を促進することができることから、多量の抗微生物物質を容易に得ることができ、得られた抗微生物物質は、抗菌剤や疾病の予防剤、治療剤、農薬などとして用いることができる。
【図面の簡単な説明】
【0017】
【図1】タモギタケの熱水抽出物を1000μg/mL、100μg/mLおよび10μg/mLとなるようそれぞれ添加して(A、BおよびC)インキュベートしたパネト細胞の分泌物ならびにタモギタケの熱水抽出物を添加せずに(D)インキュベートしたパネト細胞の分泌物をサルモネラ菌に添加して培養し、抗菌率を測定した結果を示す図(左図)、ならびに、タモギタケの熱水抽出物を1000μg/mL、100μg/mLおよび10μg/mLとなるようそれぞれ添加して(F、GおよびH)インキュベートしたパネト細胞の分泌物ならびにタモギタケの熱水抽出物を添加せずに(I)インキュベートしたパネト細胞の分泌物を黄色ブドウ球菌に添加して培養し、抗菌率を測定した結果を示す図(右図)である。
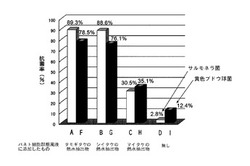
【図2】タモギタケの熱水抽出物(A、F)、シイタケの熱水抽出物(B、G)およびマイタケの熱水抽出物(C、H)をそれぞれ添加してインキュベートしたパネト細胞の分泌物、ならびにタモギタケの熱水抽出物を添加せずに(D、I)インキュベートしたパネト細胞の分泌物を、サルモネラ菌および黄色ブドウ球菌にそれぞれ添加して培養し、抗菌率を測定した結果を示す図である。図中、白抜きの棒グラフはサルモネラ菌に対する抗菌率を、黒塗りの棒グラフは黄色ブドウ球菌に対する抗菌率をそれぞれ示す。
【図3】タモギタケから抽出されるエルゴチオネイン(A、E)およびタモギタケの熱水抽出物(B、F)をそれぞれ添加してインキュベートしたパネト細胞の分泌物、ならびにタモギタケの熱水抽出物を添加せずに(C、G)インキュベートしたパネト細胞の分泌物を、サルモネラ菌および黄色ブドウ球菌にそれぞれ添加して培養し、抗菌率を測定した結果を示す図である。図中、白抜きの棒グラフはサルモネラ菌に対する抗菌率を、黒塗りの棒グラフは黄色ブドウ球菌に対する抗菌率をそれぞれ示す。
【発明を実施するための形態】
【0018】
以下、本発明に係る抗微生物物質の産生および/または分泌を促進する剤について詳細に説明する。本発明に係る抗微生物物質の産生および/または分泌を促進する剤は、パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって、茸の抽出物および/またはエルゴチオネインを有効成分とする。
【0019】
本発明において、「パネト細胞」は、「Paneth cell」あるいは「パネート細胞」と表記される場合がある。本発明において、パネト細胞は、生体の小腸内に元来存在するものや移植などにより生体内に有することとなったものなど、生体内に存在するパネト細胞でもよく、生体から分離採取した、生体外のパネト細胞でもよい。生体外のパネト細胞を用いる場合は、パネト細胞のみを用いてもよく、小腸組織やクリプト、腸上皮細胞群など、パネト細胞以外の細胞とパネト細胞とを含む状態で用いてもよい。
【0020】
パネト細胞を有する動物としては、例えば、ヒト、サル(ヒトを除く霊長目)、ウシ、ウマ、ブタ、ミニブタ、フェレット、マウス、ラット、モルモット、ハムスター、スナネズミなどの哺乳類を挙げることができる。
【0021】
パネト細胞を生体から分離採取する場合において、パネト細胞や小腸組織、クリプト、腸上皮細胞はそれぞれ定法に従って得ることができ、例えば、クリプトは、既報(Ayabe Tら、Nature Immunol.第1巻、第113〜118頁、2000年)に従って得ることができ、細胞総数に対するパネト細胞数の割合が大きい細胞群(パネト細胞群)は、本発明者らによる日本国特許出願第2009−230904号に記載の方法により得ることができる。日本国特許出願第2009−230904号の内容は、本願明細書に包含される。
【0022】
本発明において、「抗微生物物質」は、微生物を殺傷する作用を有する物質のみならず、微生物の増殖や成長、付着、結合、移動などを妨げる他、微生物からの毒素の放出を抑えるなど、微生物の何らかの機能や活動に対して阻害的あるいは阻止的に働く作用を有する物質であればよく、その作用機序はいかなるものでもよい。そのような抗微生物物質としては、例えば、キレート化合物やシグナル伝達物質、アミノ酸、ヌクレオチド、単糖などの低分子化合物、抗体、酵素などのタンパク質、ペプチド、脂質、多糖類、核酸などの高分子化合物を挙げることができ、具体的には、例えば、αディフェンシン、βディフェンシン、θディフェンシン、Cathelicidin、ダームシジン、Hepcidin/LEAP−1、ヒスタチンなどの抗菌ペプチドや、リゾチーム、分泌型ホスホリパーゼA2などを挙げることができる。
【0023】
また、本発明における「微生物」としては、例えば、大腸菌、サルモネラ菌、酢酸菌、レジオネラ菌、緑色硫黄細菌、緑色非硫黄細菌、淋菌、髄膜炎菌、カタラリス菌、インフルエンザ菌、肺炎桿菌、緑膿菌などミラビリス変形菌、マイコプラズマ、ヘリコバクター・ピロリ、ゲルトネル菌、チフス菌などのグラム陰性菌や、黄色ブドウ球菌、コアグラーゼ陰性ブドウ球菌、レンサ球菌、腸球菌、破傷風菌、ジフテリア菌などのグラム陽性菌などの細菌の他、カビや酵母などの菌類、蠕虫、原虫、リケッチア、クラミジア、スピロヘータ、ウイルス、プラスミド、ウイロイド、プリオンなどを挙げることができる。
【0024】
なお、本発明において、「産生を促進する」あるいは「分泌を促進する」というときの「促進する」は、「増大させる」、「増強する」、「増進する」、「亢進する」、「刺激する」、「賦活する」と交換可能に用いられる。
【0025】
本発明における「茸」とは、菌類であって比較的大型の子実体を有するものをいい、そのような菌類としては、例えば、担子菌や子嚢菌、変形菌などを挙げることができる。具体的には、例えば、アミガサタケ、イモタケ、セイヨウショウロ、セミタケ、キクラゲ、シロキクラゲ、アラゲキクラゲ、アンズタケ、ホウキタケ、キホウキタケ、コノミタケ、クロラッパタケ、ハナビラタケ、カンゾウタケ、ヤマブシタケ、ブナハリタケ、コウタケ、カワラタケ、ヒトクチタケ、マイタケ、マンネンタケ、ミヤマトンビマイタケ、スエヒロタケ、ヒラタケ、エリンギ、アワビタケ、サクラシメジ、フユヤマタケ、エノキタケ、タモギタケ、キシメジ、シイタケ、ホンシメジ、マツタケ、ナラタケ、タマゴタケ、フクロタケ、マッシュルーム、ハラタケ、クリタケ、ナメコ、ヌメリササタケ、ウラベニホテイシメジ、オウギタケ、ヤマドリタケ、チチタケ、シバフタケ、キヌガサタケ、ブナシメジ、シロマイタケなどを挙げることができる。なお、本実施例においては、タモギタケ、シイタケおよびマイタケを好適な茸として用いており、タモギタケを最も好適な茸としている。
【0026】
本発明において、茸は、天然に自生しているものでもよく、人工栽培されたものでもよい。また、生の茸でもよく、乾燥させたものや、乾燥させた上で粉末にしたものなど、採取した後に加工を施されたものでもよい。
【0027】
本発明における「茸の抽出物」とは、茸から抽出された成分を含有する液体状、半固体状または固体状の物質、もしくはこれらの物質から選択される1または2以上の物質の混合物をいい、その抽出方法はいかなるものでもよい。そのような茸の抽出物としては、例えば、茸の水系溶媒抽出物や有機溶媒抽出物の他、茸から抽出されるグルコシルセラミド、茸から抽出されるエルゴチステロールパーオキサイドなどを挙げることができるが、茸の水系溶媒抽出物が好ましい。
【0028】
本発明における「茸の水系溶媒抽出物」とは、茸の抽出物のうち、水系溶媒により茸から抽出された成分を含有するものをいい、茸の有機溶媒抽出物は、茸の抽出物のうち、有機溶媒により茸から抽出された成分を含有するものをいう。
【0029】
本発明において、茸の水系溶媒抽出物は、当業者が適宜選択することができる公知あるいは新たな方法に従い製造することができ、例えば、水系溶媒に茸を投入し、加熱または粉砕・攪拌した後、濾過などにより固液分離し、液体成分を回収するなどの常法を用いて製造することができる。そうして製造された茸の水系溶媒抽出物について、さらに、精製、濃縮、凍結乾燥、限外濾過、超音波処理などの処理をしてもよく、そのような処理をしたものもまた、茸の水系溶媒抽出物であり、本発明に包含される。
【0030】
なお、本発明において、水系溶媒は、極性溶媒を主体とした溶媒であれば特に限定されず、1種類の溶媒からなるものでもよく、2種類以上の溶媒を混合したものでもよい。そのような極性溶媒としては、例えば、水、メタノール、エタノール、酢酸、ギ酸、1−ブタノール、1−プロパノール、2−プロパノールなどを挙げることができるが、水が好ましい。
【0031】
また、本発明において、水系溶媒は、予め適当な溶質を混合または溶解させて水系溶媒としてもよく、そのような水系溶媒としては、例えば、水にクエン酸を混合または溶解させたもの、水に重曹を混合または溶解させたもの、酢酸に食塩を混合または溶解させたものなどを挙げることができるが、クエン酸水溶液、重曹水溶液および食塩酢酸溶液が好ましい。
【0032】
また、本発明において、水系溶媒は、酸性、中性および塩基性のいずれでもよく、水系溶媒の温度もまた、その機能が損なわれない限りにおいて特に限定されず、低温の他、常温、高温でもよい。なお、本発明においては、熱水を好適な水系溶媒として用いることができる。
【0033】
茸の有機溶媒抽出物もまた、当業者が適宜選択することができる公知あるいは新たな方法に従い製造することができ、そのような方法としては、例えば、上述の茸の水系溶媒抽出物の製造方法において、水系溶媒を有機溶媒に代えて行う方法などの常法を挙げることができる。有機溶媒としては、例えば、ペンタン、ヘキサン、ヘプタン、シクロヘキサンなどの炭化水素類、塩化メチレン、クロロホルムなどのハロゲン化炭化水素類、ベンゼン、トルエンなどの芳香族炭化水素類、メタノール、エタノールなどの低級アルコール類、酢酸メチル、酢酸エチルなどのエステル類、アセトンなどのケトン類などを挙げることができ、これらの1種または2種以上を用いることができる。
【0034】
本発明において、茸から抽出されるグルコシルセラミドは、当業者が適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、茹でた茸を乾燥させ、粉砕して粉末としたものをエタノールに入れて加熱・抽出し、得られた抽出液をNaOH水溶液によりケン化した後、希塩酸によりpHを調整し、遠心分離を行って上清を除去したものにエタノールを添加して沈殿物を回収し、この沈殿物について、シリカゲルカラムとクロロホルム/メタノール溶液とを用いてカラムクロマトグラフィーによる精製を繰り返すという方法を挙げることができる。
【0035】
本発明において、茸から抽出されるエルゴチステロールパーオキサイドもまた、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、上述のグルコシルセラミドを製造する方法と同様の方法を行い、カラムクロマトグラフィーによる精製の際に、グルコシルセラミドに代えてエルゴステロールパーオキサイドを含む溶出液を選択するという方法を挙げることができる。
【0036】
また、エルゴチオネインは1909年にM.C.Tanretによって、麦角菌が麦に寄生してなる麦角から初めて単離された化合物であり、本発明における「エルゴチオネイン」は、茸から抽出したものの他、化学合成して得られるものなどでもよい。
【0037】
本発明において、「茸から抽出されるエルゴチオネイン」は、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、茸を煮出して得た煮汁をイオン交換樹脂に供した後、その樹脂から陽イオン性化合物を溶出し、溶出液を濃縮し、これを高速液体クロマトグラフィーにより分離・精製し、凍結乾燥するという方法を挙げることができる。
【0038】
本発明において、茸の抽出物や茸から抽出されるエルゴチオネインの製造の際には、必要とする純度や態様などに応じて、粉砕、精製、濃縮、乾燥、滅菌などの処理を1または2回以上行ってもよく、あるいはこれらの処理を省略してもよい。
【0039】
粉砕方法としては、例えば、ロール式粉砕機などにより押しつぶす方法、フードプロセッサーなどにより切断する方法、ボールミル粉砕機などにより磨り潰す方法、ハンマー式粉砕機などにより打撃を与えて粉砕する方法などを、精製方法としては、例えば、濾過法、蒸留法、再結晶法、再沈殿法、各種のクロマトグラフィーを用いた方法などを、濃縮方法としては、例えば、煮沸濃縮法、エバポレーターなどによる真空濃縮(減圧濃縮)法、凍結乾燥濃縮法、逆浸透膜などを用いた膜濃縮法などを、滅菌方法としては、例えば、オートクレーブを用いた方法、高周波法、フィルター濾過法などを、それぞれ挙げることができる。
【0040】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、生体に投与することにより、生体内のパネト細胞において抗微生物物質の産生や分泌を促進することができることから、ひいては生体の免疫を賦活する他、疾病の予防や治療をすることができる。予防や治療をすることができる疾病としては、上述の微生物の感染による感染症の他、微生物の生産する毒素による中毒症やアレルギー症などを挙げることができ、具体的には、例えば、食中毒、カンジダ症、クリプトコッカス感染症、アスペルギルス症、ニューモシスチス肺炎、う蝕、HIV感染症、白癬(水虫、たむし、しらくもなど)、とびひ、水痘、ヘルペスウィルス感染症、サイトメガロウイルス感染症、MRSA感染症、緑膿菌感染症、レジオネラ肺炎、セラチア感染症、トキソプラズマ症、クリプトスポリジウム症、アトピー性皮膚炎などを挙げることができる。
【0041】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、生体から分離採取したパネト細胞に投与することにより、パネト細胞が分泌する抗微生物物質を得ることができる。得られた抗微生物物質は、抗菌剤や疾病の予防剤、治療剤、あるいは農作物などの植物の疫病を防ぐ農薬として用いることができ、抗菌剤としては、例えば、食品や化粧料に添加して、その保存性を高めるために用いるものの他、物品に添加、配合して、腐食を防ぐため、衛生的状態を保持するため、あるいは悪臭を防ぐために用いるものを挙げることができる。また、疾病としては、上述と同様のものを挙げることができ、植物の疾病としては、例えば褐斑病、黒星病、黒斑病、黒紋病、すすかび病、輪紋病、黒点病、いもち病、さび病、斑点細菌病、斑点病、葉枯病 腐敗病、青枯病、萎黄(いおう)病、萎凋(いちょう)病、半身萎凋、ウイルス・モザイク病、温州萎縮病、灰星病、ぺスタロチア病、べと病、うどんこ病、すす病、菌核病、灰色カビ病、つる割病、炭疽病、そうか・とうそう病、茎枯病、黒腐病、ハマキムシ類、枝枯病、こぶ病・がんしゅ病、胴枯病、てんぐ巣病、根こぶ病などを挙げることができる。
【0042】
なお、パネト細胞の外液や培養液、あるいは分泌物中における抗微生物物質の有無や含有量は、当業者が適宜選択することができる公知あるいは新たな方法に従い確認することができ、そのような方法としては、例えば、パネト細胞の外液、培養液あるいは分泌物を回収して、精製、濃縮した後、それを細菌に添加して培養し、生存細菌数の変化を計測する方法の他、パネト細胞の外液、培養液あるいは分泌物を回収して、ELISAやウエスタンブロットなどの免疫染色を行い、反応の強弱を確認する方法などの常法を挙げることができる。
【0043】
本発明に係る抗微生物物質の産生および/または分泌を促進する剤の製剤化には、当業者が適宜選択することができる公知あるいは新たな方法を用いることができる。投与形態もまた、当業者によって適宜選択することができる投与形態でよく、そのような投与形態としては、例えば、液剤、顆粒剤、散剤、錠剤、カプセル剤、コーティング剤、懸濁剤、ジェル剤、吸入剤、注射剤、点滴剤、座薬、塗布剤、噴霧剤、貼付剤、軟膏、クリームなどの公知の形態を挙げることができる。また、その投与量は、製剤形態、投与方法、使用目的および生体に投与する場合は投与対象の年齢、体重、症状によって適宜設定することができる。
【0044】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、医薬品の他、サプリメントなどの医薬部外品や食品添加物などの態様で利用することができる。医薬部外品や食品添加剤などの態様で利用する場合、その形態は適宜選択することができ、例えば、カプセル、顆粒剤、錠剤などの通常用いられる任意の形態を挙げることができる。また、食品中に配合して利用する場合には、適宜、賦形剤、増量剤、結合剤、増粘剤、乳化剤、着色料、香料、食品添加物、調味料などと混合し、用途に応じて、粉末、顆粒剤、錠剤などの形に成形して利用することができる。さらには、食品原料中に混合して食品を調製し、機能性食品として利用することができる。
【0045】
以下、本発明に係るパネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする前記剤について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0046】
<実施例1>タモギタケの熱水抽出物のパネト細胞における抗微生物物質分泌促進能の検討
(1)パネト細胞群の調製
[1−1]クリプト懸濁液の調製
ICRマウス(日本チャールズ・リバー社)から、従来法に従って小腸の組織を採取した。続いて、既報(Ayabe Tら、Nature Immunol.第1巻、第113〜118頁、2000年)に従い、クリプトを含む懸濁液(クリプト懸濁液)を調製した。血球計算盤(Burker−Turk;サンリード硝子社)を用いてこのクリプト懸濁液に含まれるクリプト数を数えたところ、1〜3×104個/mLであった。
【0047】
[1−2]パネト細胞群懸濁液の調製
本実施例(1)[1−1]のクリプト懸濁液から、本発明者らによる日本国特許出願第2009−230904号に記載の方法により、蛍光物質などで標識されていない、生きたパネト細胞をPBS(−)中に含むパネト細胞群懸濁液を調製した。なお、細胞を分取する際のパラメーターは、前方散乱光の強度(Forward scatter−height;FSC−H)を390≦FSC−H≦930、かつ側方散乱光の強度(Side scatter−height;SSC−H)を510≦SSC−H≦660とした。調製したパネト細胞群懸濁液における細胞の濃度は2〜4×104個/mLであり、細胞総数に対するパネト細胞数の割合は60〜80%であった。
【0048】
(2)タモギタケの熱水抽出物の調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得た。続いて、凍結乾燥機(RLE;共和真空技術社)を用いて濾液150Lを凍結乾燥し、2kgの凍結乾燥物を得て、これをタモギタケの熱水抽出物とした。
【0049】
(3)パネト細胞群懸濁液へのタモギタケの熱水抽出物の添加
本実施例(1)[1−2]のパネト細胞群懸濁液(クリプト10,000〜12,000個、パネト細胞0.5〜1×105個に相当)を1サンプルとして計4サンプル用意し、a、b、cおよびdとした。各サンプルに、本実施例(2)のタモギタケの熱水抽出物を下記の終濃度となるよう添加した後、37℃にて30分間インキュベートした。
【0050】
パネト細胞群懸濁液に添加したタモギタケの熱水抽出物の終濃度
a:終濃度 1000μg/mL
b:終濃度 100μg/mL
c:終濃度 10μg/mL
d:添加しない(コントロール)
【0051】
(4)パネト細胞分泌物水溶液の調製
本実施例(3)のa、b、cおよびdについて、400×g、4℃の条件下で5分間遠心分離を行い、上清を約1mLずつ回収した。続いて、回収した上清に30%(v/v)となるように酢酸を添加した後、室温で30分間撹拌を行うことによって酢酸抽出を行い、それぞれ約1.5mLの酢酸抽出液を得た。次に、外液として0.1%(v/v)酢酸水溶液を用いて、メンブレンフィルター(Spectra/Por Membrane 1000cut;Spectrum Laboratories社)により透析し、それぞれ約1.5mLの内液を回収した。その後、凍結乾燥機(FreeZone;Labconco社)により凍結乾燥し、各サンプルの凍結乾燥物を得た。凍結乾燥物はそれぞれ滅菌蒸留水1mLで溶解して、パネト細胞分泌物水溶液とした。
【0052】
(5)抗菌率の測定
サルモネラ菌(ATCC)を1×103CFU含むTryptic Soy Broth(TSB)培地40μLを5つ用意し、A、B、C、DおよびEとした。また、黄色ブドウ球菌(ATCC)を1×103CFU含むTSB培地40μLを5つ用意し、F、G、H、IおよびJとした。続いて、A、B、C、D、E、F、G、H、IおよびJに本実施例(3)のa、b、cおよびdのパネト細胞分泌物水溶液ならびに滅菌蒸留水を下記のとおり、10μLずつ添加して、37℃にて1時間培養した。
【0053】
A、F:aのパネト細胞分泌物水溶液
B、G:bのパネト細胞分泌物水溶液
C、H:cのパネト細胞分泌物水溶液
D、I:dのパネト細胞分泌物水溶液(コントロール)
E、J:滅菌蒸留水
【0054】
続いて、A、B、C、D、E、F、G、H、IおよびJの培地を50μLずつ回収し、Triptic soy agar(Difco社)を用いて作成した栄養アガープレート上にそれぞれ塗布して、37℃にて一晩培養した。その後、既報(Ayabe Tら、Nature Immunol.第1巻、第113−118頁、2000年)に従って、それぞれの栄養アガープレート上の生存コロニー数を計測し、A、B、CおよびDについてはEの生存コロニー数を、F、G、HおよびIについてはJの生存コロニー数をそれぞれ基準として、下記式を用いて抗菌率を算出した。
【0055】
式:抗菌率(%)={(EまたはJの生存コロニー数−A、B、C、D、F、G、HまたはIの生存コロニー数)/EまたはJの生存コロニー数}×100
【0056】
すなわち、抗菌率は、滅菌蒸留水を添加した場合(パネト細胞分泌物水溶液を添加していない場合)の生存コロニー数を基準として、各種のパネト細胞分泌物水溶液を添加した場合の生存コロニー数の多少を示すことから、パネト細胞の分泌物中に含まれる抗微生物物質の多少を示す指標である。
【0057】
本実施例(1)〜(5)の実験を3回繰り返し、各サンプルについて得られた抗菌率の平均値を算出した。A、B、CおよびDにおける抗菌率(サルモネラ菌に対する抗菌率)の算出結果を図1左図に、F、G、HおよびIにおける抗菌率(黄色ブドウ球菌に対する抗菌率)の算出結果を図1左図に、それぞれ示す。
【0058】
図1左図に示すように、サルモネラ菌に対する抗菌率はA>B>D>Cであり、図1右図に示すように、黄色ブドウ球菌に対する抗菌率はF>G>H>Iであった。
【0059】
これらの結果から、タモギタケの熱水抽出物を添加してインキュベートしたパネト細胞の分泌物は、タモギタケの熱水抽出物を添加せずにインキュベートしたパネト細胞の分泌物と比較して、抗微生物物質を多く含むこと、および、添加したタモギタケの熱水抽出物の濃度が大きいほど、パネト細胞の分泌物に含まれる抗微生物物質が多くなることが明らかになった。
【0060】
すなわち、タモギタケの抽出物が、パネト細胞において抗微生物物質の産生や分泌を促進することが明らかになった。
【0061】
<実施例2>茸の抽出物のパネト細胞における抗微生物物質分泌促進能の検討
(1)シイタケの熱水抽出物およびマイタケの熱水抽出物の調製
包丁を用いて生のシイタケ300gを約1cm角にカットした。一方、生のマイタケ300gを小房となるよう手で割いてほぐした。続いて、シイタケおよびマイタケをそれぞれ水800Lに入れて加熱し、沸騰させた状態で3分間煮出した。その後、濾布を敷いたザルに注いで濾過し、シイタケの濾液709gおよびマイタケの濾液740gを回収した。続いて、凍結乾燥機(RLE;共和真空技術社)を用いて濾液を凍結乾燥し、シイタケ濾液の凍結乾燥物6gおよびマイタケ濾液の凍結乾燥物6gを得て、それぞれシイタケの熱水抽出物およびマイタケの熱水抽出物とした。
【0062】
(2)パネト細胞群懸濁液への茸の熱水抽出物の添加
実施例1(1)[1−2]のパネト細胞群懸濁液(クリプト10,000〜12,000個、パネト細胞0.5〜1×105個に相当)を1サンプルとして計4サンプル用意し、a、b、cおよびdとした。各サンプルに、実施例1(2)のタモギタケの熱水抽出物、本実施例(1)のシイタケの熱水抽出物およびマイタケの熱水抽出物を下記のとおり添加した後、37℃にて30分間培養した。
【0063】
パネト細胞群懸濁液に添加したものおよびその終濃度
a:タモギタケの熱水抽出物 終濃度 100μg/mL
b:シイタケの熱水抽出物 終濃度 100μg/mL
c:マイタケの熱水抽出物 終濃度 100μg/mL
d:添加しない(コントロール)
【0064】
(3)パネト細胞分泌物水溶液の調製および抗菌率の測定
本実施例(2)のa、b、cおよびdについて、実施例1(4)に記載の方法により、パネト細胞分泌物水溶液を調製した。続いて、a、b、cおよびdのパネト細胞分泌物水溶液について、実施例1(5)に記載の方法により、抗菌率の測定を行った。
【0065】
本実施例(2)および(3)の実験を3回繰り返し、各サンプルについて得られた結果の平均値を算出した。その結果を図2に示す。
【0066】
図2に示すように、サルモネラ菌に対する抗菌率は、A、BおよびCがそれぞれ89.3%、88.6%および30.5%と高い値であったのに対し、Dは2.8%と低い値であった。また、黄色ブドウ球菌に対する抗菌率も、F、GおよびHがそれぞれ78.5%、76.1%および35.1%と高い値であったのに対し、Iは12.4%と低い値であった。
【0067】
これらの結果から、タモギタケの熱水抽出物、シイタケの熱水抽出物およびマイタケの熱水抽出物を添加してインキュベートしたパネト細胞の分泌物は、それらを添加せずにインキュベートしたパネト細胞の分泌物と比較して、抗微生物物質を多く含むことが明らかになった。
【0068】
すなわち、茸の抽出物が、パネト細胞において抗微生物物質の産生や分泌を促進することが明らかになった。
【0069】
<実施例3>タモギタケから抽出されるエルゴチオネインのパネト細胞における抗微生物物質分泌促進能の検討
(1)エルゴチオネインの調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得た。この濾液について、5000rpm、10℃の条件下で30分間遠心分離を行って135Lの上清を回収した。5×30cmのカラムに充填したイオン交換樹脂(アンバーライトIR120B H型;オルガノ社)に、回収した上清のうちの7.5Lを入れ、一晩自然落下させた。続いて、イオン交換樹脂を回収し、蒸留水2.5Lを用いて洗浄して糖質成分を除去した後、0.28%(w/w)アンモニア水10Lを用いてイオン交換樹脂に吸着していた陽イオン性化合物を溶出した。ロータリーエバポレーターを用いてこの溶出液を濃縮して濃縮液10mLを得た後、下記の条件により定法に従って高速液体クロマトグラフィー(HPLC)を行い、流出開始3〜4分に検出されるピークの画分を分取した。
【0070】
HPLCの条件
HPLCシステム;日立高速液体クロマトグラフLaChrom Elite
溶離溶媒;0〜1%(v/v)アセトニトリル水溶液
カラム;Inertsil ODS−SP(ジーエルサイエンス社)
検出器;UV検出器
検出条件;250nm
【0071】
分取した画分を合わせた後、溶媒をとばして結晶化させ、粉末状のエルゴチオネイン1.7g(7.4mmol)を得た。
【0072】
(2)パネト細胞群懸濁液へのタモギタケの熱水抽出物およびエルゴチオネインの添加
実施例1(1)[1−2]のパネト細胞群懸濁液(クリプト10,000〜12,000個、パネト細胞0.5〜1×105個に相当)を1サンプルとして計3サンプル用意し、a、bおよびcとした。各サンプルに、本実施例(1)のエルゴチオネインおよび実施例1(2)のタモギタケの熱水抽出物を下記のとおり添加した後、37℃にて30分間培養した。
【0073】
パネト細胞群懸濁液に添加したものおよびその終濃度
a:エルゴチオネイン 終濃度 1000μg/mL
b:タモギタケの熱水抽出物 終濃度 1000μg/mL
c:添加しない(コントロール)
【0074】
(3)パネト細胞分泌物水溶液の調製および抗菌率の測定
本実施例(2)のa、bおよびcについて、実施例1(4)に記載の方法により、パネト細胞分泌物水溶液を調製した。続いて、a、bおよびcのパネト細胞分泌物水溶液について、実施例1(5)に記載の方法により、抗菌率の測定を行った。ただし、サルモネラ菌(ATCC)を含むTSB培地は4つ用意してA、B、CおよびDとし、黄色ブドウ球菌(ATCC)を含むTSB培地は4つ用意してE、F、GおよびHとした。また、A、B、C、D、E、F、GおよびHに添加したパネト細胞分泌物水溶液および滅菌蒸留水は下記のとおりとし、抗菌率はA、BおよびCについてはDの、E、FおよびGについてはHの生存コロニー数を基準として算出した。
【0075】
A、E:aのパネト細胞分泌物水溶液
B、F:bのパネト細胞分泌物水溶液
C、G:cのパネト細胞分泌物水溶液(コントロール)
D、H:滅菌蒸留水
【0076】
本実施例(2)および(3)の実験を3回繰り返し、各サンプルについて得られた結果の平均値を算出した。その結果を図3に示す。
【0077】
図3に示すように、サルモネラ菌に対する抗菌率は、AおよびBがそれぞれ32%および95.3%と高い値であったのに対し、Cは2.7%と低い値であった。また、黄色ブドウ球菌に対する抗菌率も、EおよびFがそれぞれ48.6%および82.4%と高い値であったのに対し、Gは4.8%と低い値であった。
【0078】
これらの結果から、タモギタケから抽出されるエルゴチオネインおよびタモギタケの熱水抽出物を添加してインキュベートしたパネト細胞の分泌物は、それらを添加せずにインキュベートしたパネト細胞の分泌物と比較して、抗微生物物質を多く含むことが明らかになった。
【0079】
すなわち、茸の抽出物および茸から抽出されるエルゴチオネインが、パネト細胞において抗微生物物質の産生や分泌を促進することが明らかになった。
【0080】
<実施例4>タモギタケの各種水系溶媒についての検討
(1)タモギタケ水抽出物の調製
フードプロセッサーに生のタモギタケ100gと水100gとを投入し、粉砕した後、濾布を用いて濾過し、70mLの濾液を得た。得られた濾液のpHを測定したところ、pH6.08であった。続いて、オートクレーブ装置を用いて、濾液を120℃で15分間滅菌処理し、これをタモギタケ水抽出物とした。
【0081】
(2)タモギタケ酸性溶媒抽出物の調製
水を0.4%(w/w)クエン酸水溶液に代えて、本実施例(1)に記載の方法によりタモギタケの抽出物を調製し、これをタモギタケ酸性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH4.61であった。
【0082】
(3)タモギタケ塩基性溶媒抽出物の調製
水を1%(w/w)重曹水溶液に代えて、本実施例(1)に記載の方法により、タモギタケの抽出物を調製し、これをタモギタケ塩基性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH7.6であった。
【0083】
(4)効果の検討
本実施例(1)〜(3)で調製したタモギタケの水性溶媒抽出物、酸性溶媒抽出物および塩基性溶媒抽出物は、いずれも同様の作用効果を示すことが明らかとなった。
【技術分野】
【0001】
本発明は、抗微生物物質の産生および/または分泌を促進する剤に関し、より詳細には、パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって、茸の抽出物および/またはエルゴチオネインを有効成分とする前記剤に関する。
【背景技術】
【0002】
パネト細胞は腸上皮細胞の一種であり、主として、小腸内腔を覆う腸柔毛の間にあるクリプト(腸腺、リーベルキューン腺、腸陰窩、腸小窩、intestinal crypt)と呼ばれる窪みの基底部に存在している。パネト細胞は細胞質内に大型の分泌顆粒を多数有しており、他の細胞種と容易に見分けることができる。
【0003】
小腸の内腔は体内に取り込んだ食物を消化・吸収する場であると同時に、外界と接する場であり、常時、細菌やウイルスなどの感染の危険に晒されているが、この小腸内腔において、パネト細胞は感染防御に中心的な役割を果たしている。具体的には、パネト細胞は、抗菌ペプチドなどの抗微生物物質を産生して分泌顆粒内に貯蔵し、細菌に曝されるなどの刺激を受けると、貯蔵していた抗微生物物質を小腸内腔へ分泌する。パネト細胞が分泌する抗微生物物質には多種類の物質が含まれており、幅広い微生物に対して殺傷効果や抑制効果を発揮することが知られている。
【0004】
したがって、パネト細胞やパネト細胞が分泌する抗微生物物質を医療や医薬品産業などに利用するための研究開発がなされおり、特許文献1には、イソロイシン、ロイシンまたはバリンから選択される少なくとも1種の分岐鎖必須アミノ酸を有効成分として含有する、パネト細胞の抗菌ペプチド分泌誘発剤が開示されている。
【0005】
一方、茸は、食品産業、健康産業、化粧品産業、医薬品産業などにおいて有用な種々の成分を有することが知られており、例えば、特許文献2には食用担子菌類の有機酸含有親水性溶媒抽出物を有効成分とする腸内菌叢改善剤が、特許文献3にはハナビラタケ科に属する茸類の抽出物を有効成分とする筋肉増加剤が、特許文献4にはシイタケ菌糸体の抽出物を有効成分とする皮膚美白作用剤が、特許文献5には本発明者らによりタモギタケの熱水抽出物を有効成分とする抗腫瘍性免疫賦活剤が、特許文献6にはタモギタケから抽出されるエルゴチオネインを有効成分とする抗酸化剤、チロシナーゼ活性阻害剤、リパーゼ活性阻害剤、5α−レダクターゼ活性阻害剤、抗老化剤および抗メタボリックシンドローム剤が、それぞれ開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2003−95938号公報
【特許文献2】特開2009−161502号公報
【特許文献3】特開2009−62346号公報
【特許文献4】特開2003−48821号公報
【特許文献5】国際公開WO2006/038527号パンフレット
【特許文献6】特開2009−126863号
【発明の概要】
【発明が解決しようとする課題】
【0007】
このように、パネト細胞において抗微生物物質の産生や分泌を促進する物質の探索や開発がなされ、また、茸の抽出物が種々の効果を有することは知られていたが、茸の抽出物やエルゴチオネインがパネト細胞において抗微生物物質の産生や分泌を促進することは、これまでに知られていなかった。
【0008】
実際に、特許文献1に開示されている抗菌ペプチド分泌誘発剤は単体のアミノ酸を有効成分とするものであり、茸の抽出物やエルゴチオネインを有効成分とするものではない。また、特許文献2〜特許文献6に記載の食用担子菌類の有機酸含有親水性溶媒抽出物、ハナビラタケ科に属する茸類の抽出物、シイタケ菌糸体の抽出物、タモギタケの熱水抽出物およびタモギタケから抽出されるエルゴチオネインはいずれも、パネト細胞において抗微生物物質の産生および/または分泌を促進する剤として用いられているものではない。
【0009】
本発明は、茸の抽出物やエルゴチオネインを有効成分とする、パネト細胞において抗微生物物質の産生や分泌を促進する剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは、鋭意研究の結果、茸の抽出物やエルゴチオネインを添加してインキュベートしたパネト細胞の分泌物が、抗微生物物質を多量に含有することを見出し、下記の各発明を完成した。
【0011】
(1)パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする前記剤。
【0012】
(2)茸の抽出物が茸の水系溶媒抽出物である、(1)に記載の剤。
【0013】
(3)茸の水系溶媒抽出物が茸の熱水抽出物である、(2)に記載の剤。
【0014】
(4)茸がタモギタケ、シイタケおよびマイタケからなる群から選択される1または2以上の茸である、(1)から(3)のいずれかに記載の剤。
【0015】
(5)茸がタモギタケである、(1)から(3)のいずれかに記載の剤。
【発明の効果】
【0016】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、食用茸の抽出物やエルゴチオネインを有効成分としており、高い安全性を有している。また、本発明に係る抗微生物物質の産生や分泌を促進する剤によれば、生体内のパネト細胞において抗微生物物質の産生や分泌を促進することができることから、生体の免疫を賦活する他、疾病の予防や治療をすることができる。また、本発明に係る抗微生物物質の産生や分泌を促進する剤によれば、生体外の(生体から分離採取した)パネト細胞において抗微生物物質の産生や分泌を促進することができることから、多量の抗微生物物質を容易に得ることができ、得られた抗微生物物質は、抗菌剤や疾病の予防剤、治療剤、農薬などとして用いることができる。
【図面の簡単な説明】
【0017】
【図1】タモギタケの熱水抽出物を1000μg/mL、100μg/mLおよび10μg/mLとなるようそれぞれ添加して(A、BおよびC)インキュベートしたパネト細胞の分泌物ならびにタモギタケの熱水抽出物を添加せずに(D)インキュベートしたパネト細胞の分泌物をサルモネラ菌に添加して培養し、抗菌率を測定した結果を示す図(左図)、ならびに、タモギタケの熱水抽出物を1000μg/mL、100μg/mLおよび10μg/mLとなるようそれぞれ添加して(F、GおよびH)インキュベートしたパネト細胞の分泌物ならびにタモギタケの熱水抽出物を添加せずに(I)インキュベートしたパネト細胞の分泌物を黄色ブドウ球菌に添加して培養し、抗菌率を測定した結果を示す図(右図)である。
【図2】タモギタケの熱水抽出物(A、F)、シイタケの熱水抽出物(B、G)およびマイタケの熱水抽出物(C、H)をそれぞれ添加してインキュベートしたパネト細胞の分泌物、ならびにタモギタケの熱水抽出物を添加せずに(D、I)インキュベートしたパネト細胞の分泌物を、サルモネラ菌および黄色ブドウ球菌にそれぞれ添加して培養し、抗菌率を測定した結果を示す図である。図中、白抜きの棒グラフはサルモネラ菌に対する抗菌率を、黒塗りの棒グラフは黄色ブドウ球菌に対する抗菌率をそれぞれ示す。
【図3】タモギタケから抽出されるエルゴチオネイン(A、E)およびタモギタケの熱水抽出物(B、F)をそれぞれ添加してインキュベートしたパネト細胞の分泌物、ならびにタモギタケの熱水抽出物を添加せずに(C、G)インキュベートしたパネト細胞の分泌物を、サルモネラ菌および黄色ブドウ球菌にそれぞれ添加して培養し、抗菌率を測定した結果を示す図である。図中、白抜きの棒グラフはサルモネラ菌に対する抗菌率を、黒塗りの棒グラフは黄色ブドウ球菌に対する抗菌率をそれぞれ示す。
【発明を実施するための形態】
【0018】
以下、本発明に係る抗微生物物質の産生および/または分泌を促進する剤について詳細に説明する。本発明に係る抗微生物物質の産生および/または分泌を促進する剤は、パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって、茸の抽出物および/またはエルゴチオネインを有効成分とする。
【0019】
本発明において、「パネト細胞」は、「Paneth cell」あるいは「パネート細胞」と表記される場合がある。本発明において、パネト細胞は、生体の小腸内に元来存在するものや移植などにより生体内に有することとなったものなど、生体内に存在するパネト細胞でもよく、生体から分離採取した、生体外のパネト細胞でもよい。生体外のパネト細胞を用いる場合は、パネト細胞のみを用いてもよく、小腸組織やクリプト、腸上皮細胞群など、パネト細胞以外の細胞とパネト細胞とを含む状態で用いてもよい。
【0020】
パネト細胞を有する動物としては、例えば、ヒト、サル(ヒトを除く霊長目)、ウシ、ウマ、ブタ、ミニブタ、フェレット、マウス、ラット、モルモット、ハムスター、スナネズミなどの哺乳類を挙げることができる。
【0021】
パネト細胞を生体から分離採取する場合において、パネト細胞や小腸組織、クリプト、腸上皮細胞はそれぞれ定法に従って得ることができ、例えば、クリプトは、既報(Ayabe Tら、Nature Immunol.第1巻、第113〜118頁、2000年)に従って得ることができ、細胞総数に対するパネト細胞数の割合が大きい細胞群(パネト細胞群)は、本発明者らによる日本国特許出願第2009−230904号に記載の方法により得ることができる。日本国特許出願第2009−230904号の内容は、本願明細書に包含される。
【0022】
本発明において、「抗微生物物質」は、微生物を殺傷する作用を有する物質のみならず、微生物の増殖や成長、付着、結合、移動などを妨げる他、微生物からの毒素の放出を抑えるなど、微生物の何らかの機能や活動に対して阻害的あるいは阻止的に働く作用を有する物質であればよく、その作用機序はいかなるものでもよい。そのような抗微生物物質としては、例えば、キレート化合物やシグナル伝達物質、アミノ酸、ヌクレオチド、単糖などの低分子化合物、抗体、酵素などのタンパク質、ペプチド、脂質、多糖類、核酸などの高分子化合物を挙げることができ、具体的には、例えば、αディフェンシン、βディフェンシン、θディフェンシン、Cathelicidin、ダームシジン、Hepcidin/LEAP−1、ヒスタチンなどの抗菌ペプチドや、リゾチーム、分泌型ホスホリパーゼA2などを挙げることができる。
【0023】
また、本発明における「微生物」としては、例えば、大腸菌、サルモネラ菌、酢酸菌、レジオネラ菌、緑色硫黄細菌、緑色非硫黄細菌、淋菌、髄膜炎菌、カタラリス菌、インフルエンザ菌、肺炎桿菌、緑膿菌などミラビリス変形菌、マイコプラズマ、ヘリコバクター・ピロリ、ゲルトネル菌、チフス菌などのグラム陰性菌や、黄色ブドウ球菌、コアグラーゼ陰性ブドウ球菌、レンサ球菌、腸球菌、破傷風菌、ジフテリア菌などのグラム陽性菌などの細菌の他、カビや酵母などの菌類、蠕虫、原虫、リケッチア、クラミジア、スピロヘータ、ウイルス、プラスミド、ウイロイド、プリオンなどを挙げることができる。
【0024】
なお、本発明において、「産生を促進する」あるいは「分泌を促進する」というときの「促進する」は、「増大させる」、「増強する」、「増進する」、「亢進する」、「刺激する」、「賦活する」と交換可能に用いられる。
【0025】
本発明における「茸」とは、菌類であって比較的大型の子実体を有するものをいい、そのような菌類としては、例えば、担子菌や子嚢菌、変形菌などを挙げることができる。具体的には、例えば、アミガサタケ、イモタケ、セイヨウショウロ、セミタケ、キクラゲ、シロキクラゲ、アラゲキクラゲ、アンズタケ、ホウキタケ、キホウキタケ、コノミタケ、クロラッパタケ、ハナビラタケ、カンゾウタケ、ヤマブシタケ、ブナハリタケ、コウタケ、カワラタケ、ヒトクチタケ、マイタケ、マンネンタケ、ミヤマトンビマイタケ、スエヒロタケ、ヒラタケ、エリンギ、アワビタケ、サクラシメジ、フユヤマタケ、エノキタケ、タモギタケ、キシメジ、シイタケ、ホンシメジ、マツタケ、ナラタケ、タマゴタケ、フクロタケ、マッシュルーム、ハラタケ、クリタケ、ナメコ、ヌメリササタケ、ウラベニホテイシメジ、オウギタケ、ヤマドリタケ、チチタケ、シバフタケ、キヌガサタケ、ブナシメジ、シロマイタケなどを挙げることができる。なお、本実施例においては、タモギタケ、シイタケおよびマイタケを好適な茸として用いており、タモギタケを最も好適な茸としている。
【0026】
本発明において、茸は、天然に自生しているものでもよく、人工栽培されたものでもよい。また、生の茸でもよく、乾燥させたものや、乾燥させた上で粉末にしたものなど、採取した後に加工を施されたものでもよい。
【0027】
本発明における「茸の抽出物」とは、茸から抽出された成分を含有する液体状、半固体状または固体状の物質、もしくはこれらの物質から選択される1または2以上の物質の混合物をいい、その抽出方法はいかなるものでもよい。そのような茸の抽出物としては、例えば、茸の水系溶媒抽出物や有機溶媒抽出物の他、茸から抽出されるグルコシルセラミド、茸から抽出されるエルゴチステロールパーオキサイドなどを挙げることができるが、茸の水系溶媒抽出物が好ましい。
【0028】
本発明における「茸の水系溶媒抽出物」とは、茸の抽出物のうち、水系溶媒により茸から抽出された成分を含有するものをいい、茸の有機溶媒抽出物は、茸の抽出物のうち、有機溶媒により茸から抽出された成分を含有するものをいう。
【0029】
本発明において、茸の水系溶媒抽出物は、当業者が適宜選択することができる公知あるいは新たな方法に従い製造することができ、例えば、水系溶媒に茸を投入し、加熱または粉砕・攪拌した後、濾過などにより固液分離し、液体成分を回収するなどの常法を用いて製造することができる。そうして製造された茸の水系溶媒抽出物について、さらに、精製、濃縮、凍結乾燥、限外濾過、超音波処理などの処理をしてもよく、そのような処理をしたものもまた、茸の水系溶媒抽出物であり、本発明に包含される。
【0030】
なお、本発明において、水系溶媒は、極性溶媒を主体とした溶媒であれば特に限定されず、1種類の溶媒からなるものでもよく、2種類以上の溶媒を混合したものでもよい。そのような極性溶媒としては、例えば、水、メタノール、エタノール、酢酸、ギ酸、1−ブタノール、1−プロパノール、2−プロパノールなどを挙げることができるが、水が好ましい。
【0031】
また、本発明において、水系溶媒は、予め適当な溶質を混合または溶解させて水系溶媒としてもよく、そのような水系溶媒としては、例えば、水にクエン酸を混合または溶解させたもの、水に重曹を混合または溶解させたもの、酢酸に食塩を混合または溶解させたものなどを挙げることができるが、クエン酸水溶液、重曹水溶液および食塩酢酸溶液が好ましい。
【0032】
また、本発明において、水系溶媒は、酸性、中性および塩基性のいずれでもよく、水系溶媒の温度もまた、その機能が損なわれない限りにおいて特に限定されず、低温の他、常温、高温でもよい。なお、本発明においては、熱水を好適な水系溶媒として用いることができる。
【0033】
茸の有機溶媒抽出物もまた、当業者が適宜選択することができる公知あるいは新たな方法に従い製造することができ、そのような方法としては、例えば、上述の茸の水系溶媒抽出物の製造方法において、水系溶媒を有機溶媒に代えて行う方法などの常法を挙げることができる。有機溶媒としては、例えば、ペンタン、ヘキサン、ヘプタン、シクロヘキサンなどの炭化水素類、塩化メチレン、クロロホルムなどのハロゲン化炭化水素類、ベンゼン、トルエンなどの芳香族炭化水素類、メタノール、エタノールなどの低級アルコール類、酢酸メチル、酢酸エチルなどのエステル類、アセトンなどのケトン類などを挙げることができ、これらの1種または2種以上を用いることができる。
【0034】
本発明において、茸から抽出されるグルコシルセラミドは、当業者が適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、茹でた茸を乾燥させ、粉砕して粉末としたものをエタノールに入れて加熱・抽出し、得られた抽出液をNaOH水溶液によりケン化した後、希塩酸によりpHを調整し、遠心分離を行って上清を除去したものにエタノールを添加して沈殿物を回収し、この沈殿物について、シリカゲルカラムとクロロホルム/メタノール溶液とを用いてカラムクロマトグラフィーによる精製を繰り返すという方法を挙げることができる。
【0035】
本発明において、茸から抽出されるエルゴチステロールパーオキサイドもまた、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、上述のグルコシルセラミドを製造する方法と同様の方法を行い、カラムクロマトグラフィーによる精製の際に、グルコシルセラミドに代えてエルゴステロールパーオキサイドを含む溶出液を選択するという方法を挙げることができる。
【0036】
また、エルゴチオネインは1909年にM.C.Tanretによって、麦角菌が麦に寄生してなる麦角から初めて単離された化合物であり、本発明における「エルゴチオネイン」は、茸から抽出したものの他、化学合成して得られるものなどでもよい。
【0037】
本発明において、「茸から抽出されるエルゴチオネイン」は、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、茸を煮出して得た煮汁をイオン交換樹脂に供した後、その樹脂から陽イオン性化合物を溶出し、溶出液を濃縮し、これを高速液体クロマトグラフィーにより分離・精製し、凍結乾燥するという方法を挙げることができる。
【0038】
本発明において、茸の抽出物や茸から抽出されるエルゴチオネインの製造の際には、必要とする純度や態様などに応じて、粉砕、精製、濃縮、乾燥、滅菌などの処理を1または2回以上行ってもよく、あるいはこれらの処理を省略してもよい。
【0039】
粉砕方法としては、例えば、ロール式粉砕機などにより押しつぶす方法、フードプロセッサーなどにより切断する方法、ボールミル粉砕機などにより磨り潰す方法、ハンマー式粉砕機などにより打撃を与えて粉砕する方法などを、精製方法としては、例えば、濾過法、蒸留法、再結晶法、再沈殿法、各種のクロマトグラフィーを用いた方法などを、濃縮方法としては、例えば、煮沸濃縮法、エバポレーターなどによる真空濃縮(減圧濃縮)法、凍結乾燥濃縮法、逆浸透膜などを用いた膜濃縮法などを、滅菌方法としては、例えば、オートクレーブを用いた方法、高周波法、フィルター濾過法などを、それぞれ挙げることができる。
【0040】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、生体に投与することにより、生体内のパネト細胞において抗微生物物質の産生や分泌を促進することができることから、ひいては生体の免疫を賦活する他、疾病の予防や治療をすることができる。予防や治療をすることができる疾病としては、上述の微生物の感染による感染症の他、微生物の生産する毒素による中毒症やアレルギー症などを挙げることができ、具体的には、例えば、食中毒、カンジダ症、クリプトコッカス感染症、アスペルギルス症、ニューモシスチス肺炎、う蝕、HIV感染症、白癬(水虫、たむし、しらくもなど)、とびひ、水痘、ヘルペスウィルス感染症、サイトメガロウイルス感染症、MRSA感染症、緑膿菌感染症、レジオネラ肺炎、セラチア感染症、トキソプラズマ症、クリプトスポリジウム症、アトピー性皮膚炎などを挙げることができる。
【0041】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、生体から分離採取したパネト細胞に投与することにより、パネト細胞が分泌する抗微生物物質を得ることができる。得られた抗微生物物質は、抗菌剤や疾病の予防剤、治療剤、あるいは農作物などの植物の疫病を防ぐ農薬として用いることができ、抗菌剤としては、例えば、食品や化粧料に添加して、その保存性を高めるために用いるものの他、物品に添加、配合して、腐食を防ぐため、衛生的状態を保持するため、あるいは悪臭を防ぐために用いるものを挙げることができる。また、疾病としては、上述と同様のものを挙げることができ、植物の疾病としては、例えば褐斑病、黒星病、黒斑病、黒紋病、すすかび病、輪紋病、黒点病、いもち病、さび病、斑点細菌病、斑点病、葉枯病 腐敗病、青枯病、萎黄(いおう)病、萎凋(いちょう)病、半身萎凋、ウイルス・モザイク病、温州萎縮病、灰星病、ぺスタロチア病、べと病、うどんこ病、すす病、菌核病、灰色カビ病、つる割病、炭疽病、そうか・とうそう病、茎枯病、黒腐病、ハマキムシ類、枝枯病、こぶ病・がんしゅ病、胴枯病、てんぐ巣病、根こぶ病などを挙げることができる。
【0042】
なお、パネト細胞の外液や培養液、あるいは分泌物中における抗微生物物質の有無や含有量は、当業者が適宜選択することができる公知あるいは新たな方法に従い確認することができ、そのような方法としては、例えば、パネト細胞の外液、培養液あるいは分泌物を回収して、精製、濃縮した後、それを細菌に添加して培養し、生存細菌数の変化を計測する方法の他、パネト細胞の外液、培養液あるいは分泌物を回収して、ELISAやウエスタンブロットなどの免疫染色を行い、反応の強弱を確認する方法などの常法を挙げることができる。
【0043】
本発明に係る抗微生物物質の産生および/または分泌を促進する剤の製剤化には、当業者が適宜選択することができる公知あるいは新たな方法を用いることができる。投与形態もまた、当業者によって適宜選択することができる投与形態でよく、そのような投与形態としては、例えば、液剤、顆粒剤、散剤、錠剤、カプセル剤、コーティング剤、懸濁剤、ジェル剤、吸入剤、注射剤、点滴剤、座薬、塗布剤、噴霧剤、貼付剤、軟膏、クリームなどの公知の形態を挙げることができる。また、その投与量は、製剤形態、投与方法、使用目的および生体に投与する場合は投与対象の年齢、体重、症状によって適宜設定することができる。
【0044】
本発明に係る抗微生物物質の産生や分泌を促進する剤は、医薬品の他、サプリメントなどの医薬部外品や食品添加物などの態様で利用することができる。医薬部外品や食品添加剤などの態様で利用する場合、その形態は適宜選択することができ、例えば、カプセル、顆粒剤、錠剤などの通常用いられる任意の形態を挙げることができる。また、食品中に配合して利用する場合には、適宜、賦形剤、増量剤、結合剤、増粘剤、乳化剤、着色料、香料、食品添加物、調味料などと混合し、用途に応じて、粉末、顆粒剤、錠剤などの形に成形して利用することができる。さらには、食品原料中に混合して食品を調製し、機能性食品として利用することができる。
【0045】
以下、本発明に係るパネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする前記剤について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0046】
<実施例1>タモギタケの熱水抽出物のパネト細胞における抗微生物物質分泌促進能の検討
(1)パネト細胞群の調製
[1−1]クリプト懸濁液の調製
ICRマウス(日本チャールズ・リバー社)から、従来法に従って小腸の組織を採取した。続いて、既報(Ayabe Tら、Nature Immunol.第1巻、第113〜118頁、2000年)に従い、クリプトを含む懸濁液(クリプト懸濁液)を調製した。血球計算盤(Burker−Turk;サンリード硝子社)を用いてこのクリプト懸濁液に含まれるクリプト数を数えたところ、1〜3×104個/mLであった。
【0047】
[1−2]パネト細胞群懸濁液の調製
本実施例(1)[1−1]のクリプト懸濁液から、本発明者らによる日本国特許出願第2009−230904号に記載の方法により、蛍光物質などで標識されていない、生きたパネト細胞をPBS(−)中に含むパネト細胞群懸濁液を調製した。なお、細胞を分取する際のパラメーターは、前方散乱光の強度(Forward scatter−height;FSC−H)を390≦FSC−H≦930、かつ側方散乱光の強度(Side scatter−height;SSC−H)を510≦SSC−H≦660とした。調製したパネト細胞群懸濁液における細胞の濃度は2〜4×104個/mLであり、細胞総数に対するパネト細胞数の割合は60〜80%であった。
【0048】
(2)タモギタケの熱水抽出物の調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得た。続いて、凍結乾燥機(RLE;共和真空技術社)を用いて濾液150Lを凍結乾燥し、2kgの凍結乾燥物を得て、これをタモギタケの熱水抽出物とした。
【0049】
(3)パネト細胞群懸濁液へのタモギタケの熱水抽出物の添加
本実施例(1)[1−2]のパネト細胞群懸濁液(クリプト10,000〜12,000個、パネト細胞0.5〜1×105個に相当)を1サンプルとして計4サンプル用意し、a、b、cおよびdとした。各サンプルに、本実施例(2)のタモギタケの熱水抽出物を下記の終濃度となるよう添加した後、37℃にて30分間インキュベートした。
【0050】
パネト細胞群懸濁液に添加したタモギタケの熱水抽出物の終濃度
a:終濃度 1000μg/mL
b:終濃度 100μg/mL
c:終濃度 10μg/mL
d:添加しない(コントロール)
【0051】
(4)パネト細胞分泌物水溶液の調製
本実施例(3)のa、b、cおよびdについて、400×g、4℃の条件下で5分間遠心分離を行い、上清を約1mLずつ回収した。続いて、回収した上清に30%(v/v)となるように酢酸を添加した後、室温で30分間撹拌を行うことによって酢酸抽出を行い、それぞれ約1.5mLの酢酸抽出液を得た。次に、外液として0.1%(v/v)酢酸水溶液を用いて、メンブレンフィルター(Spectra/Por Membrane 1000cut;Spectrum Laboratories社)により透析し、それぞれ約1.5mLの内液を回収した。その後、凍結乾燥機(FreeZone;Labconco社)により凍結乾燥し、各サンプルの凍結乾燥物を得た。凍結乾燥物はそれぞれ滅菌蒸留水1mLで溶解して、パネト細胞分泌物水溶液とした。
【0052】
(5)抗菌率の測定
サルモネラ菌(ATCC)を1×103CFU含むTryptic Soy Broth(TSB)培地40μLを5つ用意し、A、B、C、DおよびEとした。また、黄色ブドウ球菌(ATCC)を1×103CFU含むTSB培地40μLを5つ用意し、F、G、H、IおよびJとした。続いて、A、B、C、D、E、F、G、H、IおよびJに本実施例(3)のa、b、cおよびdのパネト細胞分泌物水溶液ならびに滅菌蒸留水を下記のとおり、10μLずつ添加して、37℃にて1時間培養した。
【0053】
A、F:aのパネト細胞分泌物水溶液
B、G:bのパネト細胞分泌物水溶液
C、H:cのパネト細胞分泌物水溶液
D、I:dのパネト細胞分泌物水溶液(コントロール)
E、J:滅菌蒸留水
【0054】
続いて、A、B、C、D、E、F、G、H、IおよびJの培地を50μLずつ回収し、Triptic soy agar(Difco社)を用いて作成した栄養アガープレート上にそれぞれ塗布して、37℃にて一晩培養した。その後、既報(Ayabe Tら、Nature Immunol.第1巻、第113−118頁、2000年)に従って、それぞれの栄養アガープレート上の生存コロニー数を計測し、A、B、CおよびDについてはEの生存コロニー数を、F、G、HおよびIについてはJの生存コロニー数をそれぞれ基準として、下記式を用いて抗菌率を算出した。
【0055】
式:抗菌率(%)={(EまたはJの生存コロニー数−A、B、C、D、F、G、HまたはIの生存コロニー数)/EまたはJの生存コロニー数}×100
【0056】
すなわち、抗菌率は、滅菌蒸留水を添加した場合(パネト細胞分泌物水溶液を添加していない場合)の生存コロニー数を基準として、各種のパネト細胞分泌物水溶液を添加した場合の生存コロニー数の多少を示すことから、パネト細胞の分泌物中に含まれる抗微生物物質の多少を示す指標である。
【0057】
本実施例(1)〜(5)の実験を3回繰り返し、各サンプルについて得られた抗菌率の平均値を算出した。A、B、CおよびDにおける抗菌率(サルモネラ菌に対する抗菌率)の算出結果を図1左図に、F、G、HおよびIにおける抗菌率(黄色ブドウ球菌に対する抗菌率)の算出結果を図1左図に、それぞれ示す。
【0058】
図1左図に示すように、サルモネラ菌に対する抗菌率はA>B>D>Cであり、図1右図に示すように、黄色ブドウ球菌に対する抗菌率はF>G>H>Iであった。
【0059】
これらの結果から、タモギタケの熱水抽出物を添加してインキュベートしたパネト細胞の分泌物は、タモギタケの熱水抽出物を添加せずにインキュベートしたパネト細胞の分泌物と比較して、抗微生物物質を多く含むこと、および、添加したタモギタケの熱水抽出物の濃度が大きいほど、パネト細胞の分泌物に含まれる抗微生物物質が多くなることが明らかになった。
【0060】
すなわち、タモギタケの抽出物が、パネト細胞において抗微生物物質の産生や分泌を促進することが明らかになった。
【0061】
<実施例2>茸の抽出物のパネト細胞における抗微生物物質分泌促進能の検討
(1)シイタケの熱水抽出物およびマイタケの熱水抽出物の調製
包丁を用いて生のシイタケ300gを約1cm角にカットした。一方、生のマイタケ300gを小房となるよう手で割いてほぐした。続いて、シイタケおよびマイタケをそれぞれ水800Lに入れて加熱し、沸騰させた状態で3分間煮出した。その後、濾布を敷いたザルに注いで濾過し、シイタケの濾液709gおよびマイタケの濾液740gを回収した。続いて、凍結乾燥機(RLE;共和真空技術社)を用いて濾液を凍結乾燥し、シイタケ濾液の凍結乾燥物6gおよびマイタケ濾液の凍結乾燥物6gを得て、それぞれシイタケの熱水抽出物およびマイタケの熱水抽出物とした。
【0062】
(2)パネト細胞群懸濁液への茸の熱水抽出物の添加
実施例1(1)[1−2]のパネト細胞群懸濁液(クリプト10,000〜12,000個、パネト細胞0.5〜1×105個に相当)を1サンプルとして計4サンプル用意し、a、b、cおよびdとした。各サンプルに、実施例1(2)のタモギタケの熱水抽出物、本実施例(1)のシイタケの熱水抽出物およびマイタケの熱水抽出物を下記のとおり添加した後、37℃にて30分間培養した。
【0063】
パネト細胞群懸濁液に添加したものおよびその終濃度
a:タモギタケの熱水抽出物 終濃度 100μg/mL
b:シイタケの熱水抽出物 終濃度 100μg/mL
c:マイタケの熱水抽出物 終濃度 100μg/mL
d:添加しない(コントロール)
【0064】
(3)パネト細胞分泌物水溶液の調製および抗菌率の測定
本実施例(2)のa、b、cおよびdについて、実施例1(4)に記載の方法により、パネト細胞分泌物水溶液を調製した。続いて、a、b、cおよびdのパネト細胞分泌物水溶液について、実施例1(5)に記載の方法により、抗菌率の測定を行った。
【0065】
本実施例(2)および(3)の実験を3回繰り返し、各サンプルについて得られた結果の平均値を算出した。その結果を図2に示す。
【0066】
図2に示すように、サルモネラ菌に対する抗菌率は、A、BおよびCがそれぞれ89.3%、88.6%および30.5%と高い値であったのに対し、Dは2.8%と低い値であった。また、黄色ブドウ球菌に対する抗菌率も、F、GおよびHがそれぞれ78.5%、76.1%および35.1%と高い値であったのに対し、Iは12.4%と低い値であった。
【0067】
これらの結果から、タモギタケの熱水抽出物、シイタケの熱水抽出物およびマイタケの熱水抽出物を添加してインキュベートしたパネト細胞の分泌物は、それらを添加せずにインキュベートしたパネト細胞の分泌物と比較して、抗微生物物質を多く含むことが明らかになった。
【0068】
すなわち、茸の抽出物が、パネト細胞において抗微生物物質の産生や分泌を促進することが明らかになった。
【0069】
<実施例3>タモギタケから抽出されるエルゴチオネインのパネト細胞における抗微生物物質分泌促進能の検討
(1)エルゴチオネインの調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得た。この濾液について、5000rpm、10℃の条件下で30分間遠心分離を行って135Lの上清を回収した。5×30cmのカラムに充填したイオン交換樹脂(アンバーライトIR120B H型;オルガノ社)に、回収した上清のうちの7.5Lを入れ、一晩自然落下させた。続いて、イオン交換樹脂を回収し、蒸留水2.5Lを用いて洗浄して糖質成分を除去した後、0.28%(w/w)アンモニア水10Lを用いてイオン交換樹脂に吸着していた陽イオン性化合物を溶出した。ロータリーエバポレーターを用いてこの溶出液を濃縮して濃縮液10mLを得た後、下記の条件により定法に従って高速液体クロマトグラフィー(HPLC)を行い、流出開始3〜4分に検出されるピークの画分を分取した。
【0070】
HPLCの条件
HPLCシステム;日立高速液体クロマトグラフLaChrom Elite
溶離溶媒;0〜1%(v/v)アセトニトリル水溶液
カラム;Inertsil ODS−SP(ジーエルサイエンス社)
検出器;UV検出器
検出条件;250nm
【0071】
分取した画分を合わせた後、溶媒をとばして結晶化させ、粉末状のエルゴチオネイン1.7g(7.4mmol)を得た。
【0072】
(2)パネト細胞群懸濁液へのタモギタケの熱水抽出物およびエルゴチオネインの添加
実施例1(1)[1−2]のパネト細胞群懸濁液(クリプト10,000〜12,000個、パネト細胞0.5〜1×105個に相当)を1サンプルとして計3サンプル用意し、a、bおよびcとした。各サンプルに、本実施例(1)のエルゴチオネインおよび実施例1(2)のタモギタケの熱水抽出物を下記のとおり添加した後、37℃にて30分間培養した。
【0073】
パネト細胞群懸濁液に添加したものおよびその終濃度
a:エルゴチオネイン 終濃度 1000μg/mL
b:タモギタケの熱水抽出物 終濃度 1000μg/mL
c:添加しない(コントロール)
【0074】
(3)パネト細胞分泌物水溶液の調製および抗菌率の測定
本実施例(2)のa、bおよびcについて、実施例1(4)に記載の方法により、パネト細胞分泌物水溶液を調製した。続いて、a、bおよびcのパネト細胞分泌物水溶液について、実施例1(5)に記載の方法により、抗菌率の測定を行った。ただし、サルモネラ菌(ATCC)を含むTSB培地は4つ用意してA、B、CおよびDとし、黄色ブドウ球菌(ATCC)を含むTSB培地は4つ用意してE、F、GおよびHとした。また、A、B、C、D、E、F、GおよびHに添加したパネト細胞分泌物水溶液および滅菌蒸留水は下記のとおりとし、抗菌率はA、BおよびCについてはDの、E、FおよびGについてはHの生存コロニー数を基準として算出した。
【0075】
A、E:aのパネト細胞分泌物水溶液
B、F:bのパネト細胞分泌物水溶液
C、G:cのパネト細胞分泌物水溶液(コントロール)
D、H:滅菌蒸留水
【0076】
本実施例(2)および(3)の実験を3回繰り返し、各サンプルについて得られた結果の平均値を算出した。その結果を図3に示す。
【0077】
図3に示すように、サルモネラ菌に対する抗菌率は、AおよびBがそれぞれ32%および95.3%と高い値であったのに対し、Cは2.7%と低い値であった。また、黄色ブドウ球菌に対する抗菌率も、EおよびFがそれぞれ48.6%および82.4%と高い値であったのに対し、Gは4.8%と低い値であった。
【0078】
これらの結果から、タモギタケから抽出されるエルゴチオネインおよびタモギタケの熱水抽出物を添加してインキュベートしたパネト細胞の分泌物は、それらを添加せずにインキュベートしたパネト細胞の分泌物と比較して、抗微生物物質を多く含むことが明らかになった。
【0079】
すなわち、茸の抽出物および茸から抽出されるエルゴチオネインが、パネト細胞において抗微生物物質の産生や分泌を促進することが明らかになった。
【0080】
<実施例4>タモギタケの各種水系溶媒についての検討
(1)タモギタケ水抽出物の調製
フードプロセッサーに生のタモギタケ100gと水100gとを投入し、粉砕した後、濾布を用いて濾過し、70mLの濾液を得た。得られた濾液のpHを測定したところ、pH6.08であった。続いて、オートクレーブ装置を用いて、濾液を120℃で15分間滅菌処理し、これをタモギタケ水抽出物とした。
【0081】
(2)タモギタケ酸性溶媒抽出物の調製
水を0.4%(w/w)クエン酸水溶液に代えて、本実施例(1)に記載の方法によりタモギタケの抽出物を調製し、これをタモギタケ酸性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH4.61であった。
【0082】
(3)タモギタケ塩基性溶媒抽出物の調製
水を1%(w/w)重曹水溶液に代えて、本実施例(1)に記載の方法により、タモギタケの抽出物を調製し、これをタモギタケ塩基性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH7.6であった。
【0083】
(4)効果の検討
本実施例(1)〜(3)で調製したタモギタケの水性溶媒抽出物、酸性溶媒抽出物および塩基性溶媒抽出物は、いずれも同様の作用効果を示すことが明らかとなった。
【特許請求の範囲】
【請求項1】
パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする前記剤。
【請求項2】
茸の抽出物が茸の水系溶媒抽出物である、請求項1に記載の剤。
【請求項3】
茸の水系溶媒抽出物が茸の熱水抽出物である、請求項2に記載の剤。
【請求項4】
茸がタモギタケ、シイタケおよびマイタケからなる群から選択される1または2以上の茸である、請求項1から請求項3のいずれかに記載の剤。
【請求項5】
茸がタモギタケである、請求項1から請求項3のいずれかに記載の剤。
【請求項1】
パネト細胞において抗微生物物質の産生および/または分泌を促進する剤であって茸の抽出物および/または茸から抽出されるエルゴチオネインを有効成分とする前記剤。
【請求項2】
茸の抽出物が茸の水系溶媒抽出物である、請求項1に記載の剤。
【請求項3】
茸の水系溶媒抽出物が茸の熱水抽出物である、請求項2に記載の剤。
【請求項4】
茸がタモギタケ、シイタケおよびマイタケからなる群から選択される1または2以上の茸である、請求項1から請求項3のいずれかに記載の剤。
【請求項5】
茸がタモギタケである、請求項1から請求項3のいずれかに記載の剤。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−180329(P2012−180329A)
【公開日】平成24年9月20日(2012.9.20)
【国際特許分類】
【出願番号】特願2011−45604(P2011−45604)
【出願日】平成23年3月2日(2011.3.2)
【出願人】(504173471)国立大学法人北海道大学 (971)
【出願人】(500451632)株式会社スリービー (4)
【Fターム(参考)】
【公開日】平成24年9月20日(2012.9.20)
【国際特許分類】
【出願日】平成23年3月2日(2011.3.2)
【出願人】(504173471)国立大学法人北海道大学 (971)
【出願人】(500451632)株式会社スリービー (4)
【Fターム(参考)】
[ Back to top ]

