抗炎症剤または抗炎症作用を有する飲食品
【課題】茶化合物を用いた、COX−2阻害及び/又はPGE2生合成阻害の作用を有す
る飲食品又は医薬品を提供することを目的とする。
【解決手段】緑茶、烏龍茶、紅茶から分離された40種類の茶化合物を供試し、慢性炎症
に引き起こす酵素COX−2およびその産物であるPGE2を標的として鋭意研究を行っ
た結果、18種類の茶化合物がCOX−2の発現及び/又はPGE2の産生を抑制するこ
とを見出した。
る飲食品又は医薬品を提供することを目的とする。
【解決手段】緑茶、烏龍茶、紅茶から分離された40種類の茶化合物を供試し、慢性炎症
に引き起こす酵素COX−2およびその産物であるPGE2を標的として鋭意研究を行っ
た結果、18種類の茶化合物がCOX−2の発現及び/又はPGE2の産生を抑制するこ
とを見出した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗炎症作用、特に、シクロオキシゲナーゼ−2(cyclooxygena
se−2;以下、COX−2)阻害作用及び/又はプロスタグランジンE2(以下、PG
E2)生合成阻害作用を有するポリフェノール誘導体に関する。
【背景技術】
【0002】
プロスタグランジン(prostaglandin)は、ヒト生体部位の器官、組織に
炎症を起こす生理活性物質である。中でも特に、PGE2は、肺癌、乳癌、大腸癌、前立
腺癌などを誘発する物質であることが知られている。プロスタグランジン類は、アラキド
ン酸(arachidonic acid)を前駆物質として、シクロオキシゲナーゼ(
cyclooxygenase;COX)の酵素によって生合成される。
【0003】
COXには3種類あることが知られている。これらの内、ひとつは各種臓器に存在し、
消化液の分泌や利尿、血小板を凝集させるなど、恒常的に働くシクロオキシゲナーゼ−1
(cyclooxygenase−1;COX−1)である。一つは、炎症性のサイトカ
インや活性酸素に刺激を受けて誘導される、COX−2である。
【0004】
COX−2はプロスタグランジンH2合成酵素であり、アラキドン酸カスケード中最終
的にPGE2の生合成に関与する酵素として知られている。例えば、炎症性のサイトカイ
ンである腫瘍壊死因子α(tumor necrosis factor α;TNFα
)の刺激を受け、転写因子であるNF−κB(necrosis factor κB;
NFκB)が活性化され、この活性化によってCOX−2が発現する。COX−2の発現
によってPGE2の生合成が亢進し、癌細胞は増殖する上に、抗癌剤などに対しても抵抗
性を有するようになる。ヒト生体内のこの生合成カスケード中のどの部分を抑えることが
できるか、癌の治療や予防薬を開発する上で目標となることが示されている。
【0005】
COX−2の発現を抑える効果のあるものは、COX−2阻害剤と呼ばれている。CO
X−2阻害剤の一例として、セレブレックス(Celebrex)の記載がある。「血液
腫瘍や上皮性腫瘍の増殖抑制において、COX阻害剤の中で最も強力な活性を示す」とい
う記載がある(非特許文献1、Waskewich,C.et.al.:Cancer
Res.、62:2029−2033)。
【0006】
ポリフェノールは、タンパク質やアルカロイド等と結合し、難溶化の傾向を示す多価フ
ェノール類の総称である(非特許文献2、川崎敏男、他:天然薬物化学、廣川書店、19
86年4月:124)。中でも茶葉に含まれるポリフェノール(通称茶ポリフェノール)
には、多くの生物活性のあることが報告された。例えば、抗酸化作用(非特許文献3、H
ashimoto、F.et al.:Biosci.Biotechnol.Bioc
hem.、67:396−401、2003)、抗HIV作用(非特許文献4、Hash
imoto、F.et al.:Bioorg.Med.Chem.Lett.、6:6
95−700、1996)、抗アレルギー作用(非特許文献5、Yamada、K.et
al.:Food Sci.Technol.Res.、5:1−8、1999)、抗
トポイソメラーゼI及びII作用(非特許文献6、Suzuki、K.et al.:B
iol.Pharm.Bull.、24:1088−1090、2001)、抗癌作用(
非特許文献7、中村好志:茶の抗突然変異・抗癌作用、朝倉書店、1997年9月:13
1−143)、リパーゼ活性阻害作用(非特許文献8、Nakai、M.et al.:
J.Agri.Food Chem.、53:4593−4598、2005)、の報告
がある。
【0007】
茶ポリフェノールは、緑茶、紅茶、烏龍茶、黒(プーアル)茶から単離され、70種以
上ものポリフェノール類が含有されていることが知られている(非特許文献9、橋本文雄
:各種茶のポリフェノールに関する化学的研究、1988年2月:68−72、147−
151、162−164;非特許文献10、Hashimoto、F.et al.:C
hem.Pharm.Bull.、35:611−616、1987;非特許文献11、
Hashimoto、F.et al.:Chem.Pharm.Bull.、36:1
676−1684、1988;非特許文献12、Hashimoto、F.et al.
:Chem.Pharm.Bull.、37:77−85、1989;非特許文献13、
Hashimoto、F.et al.:Chem.Pharm.Bull.、37:3
255−3263、1989;非特許文献14、Hashimoto、F.et al.
:Chem.Pharm.Bull.、40:1383−1389、1992)。
【0008】
茶ポリフェノールは、その生合成機構の違いにより、二つに分類されている。即ち、生
葉中に元来含まれる一次ポリフェノールと、紅茶、烏龍茶等の製造工程(萎凋、発酵)で
、フラバン3−オール(flavan−3−ol)類から変換した二次ポリフェノールと
に大別される。一次ポリフェノールには、フラバン3−オール(flavan−3−ol
)類、プロアントシアニジン(proanthocyanidin)類、加水分解型タン
ニン(hydrolyzable tannin)類、チャルカン−フラバン二量体(c
halcan−flavan dimer)類、ウーロンホモビスフラバン(oolon
ghomobisflavan)類が含まれる。一方、二次ポリフェノールとして、テア
シネンシン(theasinensin)類、テアフラガリン(theaflagall
in)類、テアフラビン(theaflavin)類が含まれる(非特許文献9)。
【0009】
いわゆる茶カテキン類と称する主ポリフェノールの、エピガロカテキン3−ガレート(
(−)−epigallocatechin 3−O−gallte、EGCG)、エピ
ガロカテキン((−)−epigallocatechin、EGC)、エピカテキン3
−ガレート((−)−epicatechin 3−O−gallate、ECG)、エ
ピカテキン((−)−epicatechin、EC)、ガロカテキン((+)−gal
locatechin、GC)、カテキン((+)−catechin、CA)を除く、
種々のポリフェノール類は、茶葉からの単離が容易ではなかったこともあって、種々の生
物活性試験を行うことが困難であった問題点がある。
【0010】
近年、発酵茶より分離される5種のテアシネンシン類(theasinensin)の
COX−2遺伝子の発現抑制について報告した。COX−2の発現により産生されるタン
パク質を分析したところ、テアシネンシンA及びDはその産生を強く抑制し、結果として
COX−2の発現を抑制することを報告した(非特許文献15、益崎智子、他4名:平成
15年度日本農芸化学会西日本支部、中国・四国支部、日本栄養・食糧学会西日本支部、
日本食品科学工学会西日本支部鹿児島合同大会およびシンポジウム、2003年9月:3
7)。
【0011】
特開2002−220340号(以下、特許文献1という)に、茶に由来する薬理組成
物(特許文献1の第0033〜0056段落)の記載がある。「茶から抽出される温水抽
出物、ポリフェノール、カテキン類、EGCgなど、抽出後各生成段階で得られる成分に
ついて様々な薬理作用を検討し、その結果得られた知見に基づいて本発明を完成した物で
ある」、「この際、増強されるカテキンの薬理作用としては、少なくとも、シクロオキシ
ゲナーゼ−2活性阻害作用、インターフェロン−γ−産生抑制作用、腫瘍壊死因子−α−
産生抑制作用、フィブロネクチン介在細胞接着抑制作用、血管内皮細胞増殖因子(VGE
F)による欠陥内皮細胞増殖抑制作用、及び乳癌細胞増殖抑制作用を挙げることができる
」、「本発明はまた、上記の「温水抽出非カテキン成分」とカテキン類とを含む「混合物
X」を有効成分として含有し、好ましくは当該「混合物X」中に、(−)−エピガロカテ
キンガレート(EGCg)、(−)−エピカテキンガレート(ECg)、(−)−エピガ
ロカテキン(EGC)、(−)−エピカテキン(EC)、(−)−ガロカテキンガレート
(GCg)、(−)−カテキンガレート(Cg)、(±)−ガロカテキン(GC)及び(
±)−カテキン(C)の総量(以下、この総量を「カテキン総量」と呼び、これら8種類
のカテキンを「総カテキン」と呼ぶ。)としてカテキン類を約30%以上、例えば約30
〜40重量%含有してなる薬理組成物を提案する」という記載がある(特許文献の第00
33、0038、0039段落)。
【0012】
WO2004052873号(以下、特許文献2という)に、緑茶のポリフェノール並
びに関連誘導体の化学療法剤または化学予防剤の記載がある。「化学療法剤または化学予
防剤として有用な新規化合物の調整法であり、緑茶に含まれる例えばエピガロカテキン3
−Oーガレート(EGCG)の関連化合物であって、化学式(I)[C6−C3−C6骨
格]のR1からR11までの官能基がここに示すものを含む。」、「R4の官能基は好ま
しくは、O,S,NH2,CH2の官能基であって、」、「化合物の提供と共に、化学療
法または化学予防法として、薬理学的方法論もまた提供する。」という記載がある(特許
文献の要旨)。
【0013】
その他、特開2000−226329号(以下、特許文献3という)に、MMP阻害剤
(特許文献3の第0001〜0014段落)の記載がある。「カテキン化合物の抗酸化活
性や抗ウィルス活性、など多様な生物活性に着目し、カテキン化合物がMMPsに対して
阻害作用を有するかもしれないと推測し、カテキンのMMPs阻害活性を調べた結果、カ
テキンが、その多様な生物活性と併せて、MMP阻害作用を示し、結果として、MMPs
活性の調節不能に起因する難治性疾患の治療及び予防に対する有用性が期待できることを
見出した」という記載がある(特許文献3の第0013段落)。
【0014】
特開2000−344672号(以下、特許文献4という)には、マトリックスメタロ
プロテアーゼ阻害剤(特許文献4の第0001〜0014段落)の記載がある。「ポリフ
ェノール類であるタンニン化合物についても、MMPs阻害活性を調べた結果、該化合物
が、優れたMMP阻害作用を示し、結果として、MMPs活性の調節不能に起因する難治
性疾患の治療および予防に対して有用性が期待できることを見出し、本発明を完成した」
という記載がある(特許文献4の第0013段落)。
【0015】
特開2004−359576号(以下、特許文献5という)には、アポトーシス誘導剤
(特許文献5の第0015、0016段落)と記載がある。「紅茶から抽出されたプルプ
ロガリン誘導体並びにその合成したプルプロガリン誘導体のヒト急性前骨髄性白血病疾患
細胞(HL−60細胞)に対するアポトーシス誘導を調べた結果、プルプロガリン(pu
rpurogallin)が濃度依存的および経時的にアポトーシスを誘導することと併
せて、テアフラビン(theaflavin)類も同様にHL−60細胞に対してアポト
ーシスを誘導することを見出し、結果として、正常細胞に対してアポトーシス誘導を起こ
させなくて、癌細胞に対してのみアポトーシスを誘導できることを見出した。」、「プル
プロガリン(Purpurogallin)がHL−60細胞に対してカスパーゼ8を活
性化し、カスパーゼ8の直接作用によりカスパーゼ3を活性化し、引き続いてDNAが断
片化され、アポトーシスが誘導されることを見出した。また、カスパーゼ8からはビッド
(Bid)は切断されず、ミトコンドリアからも細胞質へチトクロームcは放出されず、
カスパーゼ9は結果として活性化されないことを見出した。この細胞死機構は、HL−6
0細胞内の活性酸素の増加を伴わないでアポトーシスを誘導することを見出し、本発明を
完成した。」と記載がある。
【0016】
特開2005−075790号(以下、特許文献6という)には、Apoptosis
誘導剤(特許文献6の第0019、0020段落)と記載がある。「紅茶から抽出された
ポリフェノール誘導体並びにその合成したポリフェノール誘導体のヒト急性前骨髄性白血
病疾患細胞(HL−60細胞)、ヒト大腸癌細胞(LoVo細胞)に対するアポトーシス
誘導を調べた結果、プロデルフィニジンB−2(prodelphinidin B−2
)が濃度依存的および経時的にアポトーシスを誘導することと併せて、ポリフェノール(
polyphenol)類も同様にHL−60細胞、LoVo細胞に対してアポトーシス
を誘導すること、癌細胞に対してアポトーシスを誘導できることを見出した。」、「プロ
デルフィニジンB−2(prodelphinidin B−2)がHL−60細胞に対
してカスパーゼ8を活性化し、カスパーゼ8の直接作用によりカスパーゼ3を活性化し、
引き続いてDNAが断片化され、アポトーシスが誘導されることを見出した。また、カス
パーゼ9も活性化されることを見出した。この細胞死機序は、HL−60細胞内の活性酸
素の増加を伴いアポトーシスを誘導することを見出し、本発明を完成した。」と記載があ
る。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特開2002−220340号公報
【特許文献2】国際公開WO2004052873号パンフレット
【特許文献3】特開2000−226329号公報
【特許文献4】特開2000−344672号公報
【特許文献5】特開2004−359576号公報
【特許文献6】特開2005−075790号公報
【非特許文献】
【0018】
【非特許文献1】Waskewich、C.、他5名、「Celecoxib Exhibits the Greatest Potency amongst Cyclooxygenase (COX) Inhibitors for Growth Inhibition of COX−2−negative Hematopoietic and Epithelial Cell Lines」、Cancer Res.、2002年、第62巻、P.2029−2033
【非特許文献2】川崎敏男、他10名、「タンニン」、天然薬物化学、廣川書店、1986年4月、P.124
【非特許文献3】Hashimoto、F.、他9名、「Evaluation of the Anti−oxidative Effect (in vitro) of Tea Polyphenols」、Biosci.Biotechnol.Biochem.、2003年、第67巻、P.396−401
【非特許文献4】Hashimoto、F.、他6名、「Evaluation of Tea Polyphenols as Anti−HIV Agents」、Bioorg.Med.Chem.Lett.、1996年、第6巻、P.695−700
【非特許文献5】Yamada、K.、他4名、「Structure−activity Relationship of Immunoregulatory Factors in Foodstuffs」、Food Sci.Technol.Res.、1999年、第5巻、P.1−8
【非特許文献6】Suzuki、K.、他3名、「Inhibitory Activities of (−)−Epigallocatechin−3−O−gallate against Topoisomerase I and II」、Biol.Pharm.Bull.、2001年、第24巻、P.1088−1090
【非特許文献7】西岡五夫、「茶のポリフェノール」、茶の科学、朝倉書店、1997年9月、P.115−123
【非特許文献8】Nakai、M.、他8名、「Inhibitory Effects of Tea Polyphenols on Pancreatic Lipase in vitro」、J.Agric.Food Chem.、2005年、第53巻、P.4593−4598
【非特許文献9】橋本文雄、「各種茶のポリフェノールに関する化学的研究」、博士論文、1988年2月、P.68−72、147−151、162−164
【非特許文献10】Hashimoto、F.、他2名、「Tannins and Related Compounds.LVI.Isolation of four New Acylated Flavan−3−ols from Oolong Tea.(I)」、Chem.Pharm.Bull.、1987年、第35巻、P.611−616
【非特許文献11】Hashimoto、F.、他2名、「Tannins and Related Compounds.LXIX.Isolation and Structure Elucidation of B,B’−linked Bisflavanoids, Theasinensins D−G and Oolongthanin from Oolong Tea (2)」、Chem.Pharm.Bull.、1988年、第36巻、P.1676−1684
【非特許文献12】Hashimoto、F.、他2名、「Tannins and Related Compounds.LXXVII.Novel Chalcan−flavan Dimers, Assamicains A, B andC, and a New Flavan−3−ol and Proanthocyanidins from the Fresh Leaves of Camellia sinensis L. var. assamica Kitamura」、Chem.Pharm.Bull.、1989年、第37巻、P.77−85
【非特許文献13】Hashimoto、F.、他2名、「Tannins and Related Compounds.XC.8−C−Ascorbyl (−)−Epigallocatechin 3−O−gallate and Novel Dimeric Flavan−3−ols, Oolonghomobisflavans A and B, from Oolong Tea(3)」、Chem.Pharm.Bull.、1989年、第37巻、P.3255−3263
【非特許文献14】Hashimoto、F.、他2名、「Tannins and Related Compounds.CXIV.Structures of Novel Fermentation Products, Theogallinin, Theaflavonin and Desgalloyl Theaflavonin from Black Tea, and Changes of Tea Polyphenols during Fermentation」、Chem.Pharm.Bull.、1992年、第40巻、P.1383−1389
【非特許文献15】益▲崎▼智子、他4名、「TheasinensinによるCOX−2遺伝子発現の制御について」、平成15年度日本農芸化学会西日本支部、中国・四国支部、日本栄養・食糧学会西日本支部、日本食品科学工学会西日本支部鹿児島合同大会およびシンポジウム、2003年9月、P.37
【発明の概要】
【発明が解決しようとする課題】
【0019】
上記の特許文献の中で、8種類の茶カテキン類にCOX−2阻害活性があることが明ら
かにされたにも拘わらず、茶葉に含まれるテアシネンシン類を除く他の化合物がCOX−
2阻害活性を有することは知られていなかった。もしこれらの茶化合物にCOX−2阻害
活性の効果が確認できれば、8種類の茶カテキン類以外の茶化合物をCOX−2阻害剤及
び/又はPGE2生合成阻害剤の、いわゆる抗炎症剤として、種々の癌疾患の予防又は治
療に使用できるものと考えられる。
【0020】
また上記の非特許文献の中で、テアシネンシン類にCOX−2阻害活性があることが明
らかにされたが、PGE2生合成を阻害するかどうかは知られていなかった。もしテアシ
ネンシン類のPGE2生合成阻害活性の効果が確認できれば、テアシネンシン類をPGE
2生合成阻害剤の、いわゆる抗炎症剤として、種々の癌疾患の予防又は治療に使用できる
ものと考えられる。
【0021】
本発明は茶由来の化合物のなかから抗炎症作用、より具体的にはCOX−2阻害作用及
び/又はPGE2生合成阻害作用、を有する化合物を見出すことを目的とする。そして本
発明はかかる化合物を有効成分として含有する抗炎症剤および抗炎症作用を有する飲食品
を提供することを目的とする。
【課題を解決するための手段】
【0022】
本発明者らは、上記の課題を解決するため、緑茶、烏龍茶、紅茶から分離された茶化合
物を供試し、慢性炎症に引き起こす酵素COX−2およびその産物であるPGE2を標的
として鋭意研究を行った結果、18種類の茶化合物がCOX−2の発現及び/又はPGE
2の産生を抑制することを見出し、本発明を完成した。
【0023】
本発明は以下の発明を包含する。
【0024】
(1)式(I):
【化1】

[式中、
R11およびR12は独立に−Hまたは−OHであり、
R13は−Hまたはガロイル基であり、
R14は
【化2】

で表される基(R15は−Hまたは−OHであり、R16は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(I)の2位及び3位は独立にR配置またはS配置であり、
式(I)の3位がR配置の場合には基R14は4位にβ結合により結合し、式(I)の
3位がS配置の場合には基R14は4位にα結合により結合する。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0025】
(2)前記化合物が表1及び表2に示すプロデルフィニジンB−2 3,3’−ジ−O−
ガレート(化合物1)、プロデルフィニジンB−2 3’−O−ガレート(化合物2)、
エピガロカテキン−3−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート
(化合物3)、エピガロカテキン−(4β−8)−エピカテキン−3−O−ガレート(化
合物4)、プロデルフィニジンB−4−3’−O−ガレート(化合物5)、プロデルフィ
ニジンB−4(化合物6)、ガロカテキン−(4α−8)−エピカテキン(化合物7)、
またはカテキン−(4α−8)−エピガロカテキン(化合物8)である(1)記載の抗炎
症剤。
【0026】
【表1】

【0027】
【表2】

【0028】
(3)式(II):
【化3】

[式中、
R21およびR22は独立に−Hまたは−OHであり、
R23は−Hまたはガロイル基であり、
R24およびR25は独立に−Hまたは
【化4】

で表される基(R26は−Hまたは−OH、好ましくは−OH、であり、R27は−Hま
たはガロイル基であり、*は結合位置を示す)であり、
式(II)の2位及び3位は独立にR配置またはS配置である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0029】
(4)前記化合物が表3に示すウーロンホモビスフラバンA(化合物9)、またはモノデ
スガロイルウーロンホモビスフラバンA(化合物10)である(3)記載の抗炎症剤。
【0030】
【表3】

【0031】
(5)式(III):
【化5】

[式中、
R31は−Hまたは−OHであり、
R32およびR33は独立に−Hまたは
【化6】

で表される基(R34は−Hまたはガロイル基であり、*は結合位置を示す)である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0032】
(6)前記化合物が表4に示すテアフラビン3’−O−ガレート(化合物11)、テアフ
ラビン3,3’−ジ−O−ガレート(化合物12)、エピテアフラガリン3−O−ガレー
ト(化合物13)、またはプルプロガリン(化合物14)である(5)記載の抗炎症剤。
【0033】
【表4】

【0034】
(7)式(IV):
【化7】

[式中、
R41およびR42は独立に−Hまたは−OHであり、
R43は−Hまたはガロイル基であり、
R44は
【化8】

で表される基(R45は−Hまたは−OH、好ましくは−OH、であり、R46は−Hま
たはガロイル基であり、*は結合位置を示す)であり、
式(IV)の2位及び3位は独立にR配置またはS配置であり、
式(IV)のフラバン骨格と基R44との間で生じる立体配置はR配置であってもS配
置であってもよい。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0035】
(8)前記化合物が表5に示すテアシネンシンA(化合物15)、テアシネンシンB(化
合物16)、テアシネンシンD(化合物17)、またはテアシネンシンE(化合物18)
である(7)記載の抗炎症剤。
【0036】
【表5】

【0037】
(9)プロスタグランジン生合成阻害剤である(1)〜(8)のいずれか記載の抗炎症剤
。
(10)シクロオキシゲナーゼ−2(COX−2)阻害剤である(1)〜(6)のいずれ
か記載の抗炎症剤。
(11)前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(I
II)で表される化合物、および前記式(IV)で表される化合物からなる群から選択さ
れる少なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物が人
為的に添加された、抗炎症作用を有する飲食品。
(12)前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(I
II)で表される化合物、および前記式(IV)で表される化合物からなる群から選択さ
れる少なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物を含
有し、抗炎症作用を有する旨の表示が付された、抗炎症作用を有する飲食品。
(13)不発酵茶、半発酵茶、強発酵茶または後発酵茶である(11)または(12)記
載の飲食品。
【0038】
表1〜4に挙げる化合物はいずれも、緑茶(不発酵茶)、烏龍茶(半発酵茶)、紅茶(
強発酵茶)、黒(プーアル)茶(後発酵茶)などのいわゆる茶葉から抽出された化合物で
ある。本発明者らの鋭意研究の結果、シクロオキシゲナーゼ(COX−2)阻害作用、及
びプロスタグランジン生合成阻害作用を有することが見出された。一方、表5に挙げる化
合物は、烏龍茶(半発酵茶)、紅茶(強発酵茶)、黒(プーアル)茶(後発酵茶)などの
いわゆる発酵茶葉から抽出された化合物である。本発明者らの鋭意研究の結果、プロスタ
グランジン生合成阻害作用を有することが見出された。
【0039】
本発明に用いられる化合物は薬理学的に許容される塩として存在することができる。そ
のような塩としては、薬理学的に許容される非毒性塩が挙げられ、例えばナトリウム塩、
カリウム塩又はカルシウム塩等のアルカリ金属塩、又はアルカリ土類金属塩、塩酸塩等の
ハロゲン化水素塩、硝酸塩、硫酸塩又はリン酸塩等の無機酸塩、メタンスルホン酸、ベン
ゼンスルホン酸等のスルホン酸塩、フマル酸、コハク酸、クエン酸、シュウ酸又はマレイ
ン酸等の有機酸塩及びグルタミン酸、アスパラギン酸等のアミノ酸塩等を挙げることがで
きる。
【0040】
本発明に用いられる化合物はまた、溶媒和物として存在することができる。好ましい溶
媒和物としては、水和物、エタノール和物等を挙げることができる。
【発明の効果】
【0041】
本発明により、茶由来の化合物を有効成分として含有する抗炎症剤および抗炎症作用を
有する飲食品が提供される。本発明の抗炎症剤は、COX−2阻害作用及び/又はPGE
2生合成阻害作用を有することを特徴とする。
【図面の簡単な説明】
【0042】
【図1】実験4の電気泳動の図である。
【図2】実験4の電気泳動の図である。
【図3】実験4の電気泳動の図である。
【図4】実験4の電気泳動の図である。
【図5】実験4の電気泳動の図である。
【図6】実験5の電気泳動の図である。
【図7】実験5のプロスタグランジンE2産生量を比較した図である。
【図8】実験5のプロスタグランジンE2産生量のポリフェノール濃度的変化を示した図である。
【図9】実験6の電気泳動の図である。COX−2の発現について、ポリフェノールの濃度的変化を示した図である。
【図10】実験6のプロスタグランジンE2産生量のポリフェノール濃度的変化を示した図である。
【図11】実験7の電気泳動の図である。
【図12】実験8の電気泳動の図である。
【図13】実験8の電気泳動の図である。COX−2の発現について、ポリフェノールの濃度的変化を示した図である。
【図14】実験8のプロスタグランジンE2産生量を比較した図である。
【図15】実験8のプロスタグランジンE2産生量のポリフェノール濃度的変化を示した図である。
【発明を実施するための形態】
【0043】
以下、本発明を詳細に説明する。
【0044】
本発明において有効成分として用いられる化合物はいずれも新鮮チャ葉、或いは不発酵
茶(例えば緑茶)、半発酵茶(例えば烏龍茶)、強発酵茶(例えば紅茶)、後発酵茶(例
えば黒(プーアル)茶)などのいわゆる茶葉から常法を用いて抽出により単離することが
できる。抽出方法は特に限定されないが、新鮮チャ葉または上記の茶葉から水や、低級ア
ルコール、アセトンなどの水溶性有機溶媒、水性有機溶媒と水との混合溶媒を用いて常法
に従い抽出することができる。本発明において有効成分として用いられる化合物はまた、
化学的な合成法により合成されたものであってもよい。
【0045】
本発明において有効成分として用いられる化合物は、例えば本出願人による特開200
4−359576号(特許文献4)および特開2005−075790号(特許文献5)
に記載される方法によって調製することができる。
【0046】
下記の実施例では、文献記載の方法を用いて単離した化合物を使用した(非特許文献9
)。また、プルプロガリン、テアシネンシン類、ウーロンホモビスフラバン類は特許文献
記載の方法で合成した化合物を使用した(特許文献5)。また、文献記載の方法を用いて
エピテアフラガリン3−O−ガレートを合成し使用した(Nonaka,G.、et.a
l.:Chem.Pharm.Bull.、34、61−65:1986)。
【0047】
本発明の抗炎症剤は、例えば経口投与または非経口投与(静脈内、動脈内、腹腔内、経
直腸内、皮下、筋肉内、舌下、経鼻腔内、経膣内など)用に製剤化され得る。かかる製剤
は例えば抗炎症剤としてヒトや哺乳動物などの動物に投与することができる。本発明の抗
炎症剤は、COX−2阻害作用及び/又はPGE2生合成阻害作用を有することを特徴と
する。本発明の抗炎症剤は癌の予防または治療に有用であると期待される。製剤の形態は
、特に制限されないが、溶液剤、錠剤、粉末剤、顆粒剤、カプセル剤、座剤、噴霧剤、制
御放出剤、懸濁剤、ドリンク剤などが挙げられる。
【0048】
本発明の抗炎症剤の製剤化に際しては、製薬上許容可能な担体(賦形剤もしくは希釈剤
)、ならびに、結合剤、増量剤、滑沢剤、崩壊剤、湿潤剤、乳化剤、緩衝剤、懸濁化剤、
保存剤、着色剤、風味剤、甘味剤などから適宜選択される添加剤を含有させることができ
る。担体および添加剤は、製剤化のために一般的に使用されるものを、本発明の抗炎症剤
の製造に使用することができる。結合剤の例としては、デンプン、ポリビニルピロリドン
、ヒドロキシプロピルメチルセルロースなどが挙げられる。増量剤の例としては、ラクト
ース、微結晶セルロースなどが挙げられる。滑沢剤の例としては、タルク、シリカ、ステ
アリン酸マグネシウムなどが挙げられる。崩壊剤の例としては、デンプン、デンプングリ
コール酸ナトリウムなどが挙げられる。湿潤剤の例はとしては、ラウリウ硫酸ナトリウム
などが挙げられる。乳化剤の例としては、セルロース誘導体、ソルビトールなどが挙げら
れる。保存剤の例としては、メチル−p−ヒドロキシベンゾエート、ソルビン酸などが挙
げられる。しかしながら、上記の特定例に制限されない。
【0049】
本発明の茶化合物の用量は、患者の年齢、体重、性別、状態、重篤度などによって変化
しうる。患者に投与される一日用量は、例えば患者の体重1kgあたり0.1〜200m
g、好ましくは1〜100mgの範囲であるが、この範囲に制限されない。必要に応じて
、用量を数回、例えば2〜3回に分けて分割投与してもよい。また、本発明の抗炎症剤は
治療用途の同じまたは異なる他のシクロオキシゲナーゼ−2(COX−2)阻害剤、プロ
スタグランジン生合成阻害剤と併用して患者に投与することもできる。
【0050】
本発明の化合物はまた、常法に従って、固形食品、半固形食品、飲料等の飲食品に添加
することができる。具体的には菓子類、レトルト食品、ジュース類、茶類、乳製品、清涼
飲料、アルコール飲料などを挙げることができるがこれらには限定されない。これらの飲
食品は、いわゆる特定保健用食品や健康補助食品とするのが好ましい。かかる食品は抗炎
症作用(具体的にはCOX−2阻害作用及び/又はPGE2生合成阻害作用)を有する。
【0051】
本発明の飲食品は、茶化合物の有効量を、錠剤、カプセル、顆粒、ドリンク、ペットボ
トルなどの任意の形態に添加または封入するか、あるいは任意の食品に添加して得られる
。
【0052】
本発明の飲食品には必要に応じて甘味剤、調味料、乳化剤、懸濁化剤、防腐剤などを添
加してもよいし、あるいはビタミン類、栄養剤、免疫増強剤(例えば、プロポリス、きの
こ抽出物など)などを添加してもよい。
【0053】
飲食品中への茶化合物の添加量は、成人体重1kgあたり0.1〜200mgに相当す
る範囲内の量、1製品あたり例えば50mg〜1gであるが、この範囲に制限されないも
のとする。
【0054】
本発明の飲食品は、所定の茶化合物を人為的に添加した上記飲食品だけでなく、従来か
ら存在する不発酵茶、半発酵茶、強発酵茶または後発酵茶であって抗炎症作用を奏するの
に有効な量の茶化合物が含有されているものをも包含する。
【0055】
本発明の飲食品はその本体、包装、説明書、宣伝物または宣伝用電子的情報にその効能
の表示、例えば抗炎症作用を有する旨の表示、より具体的には、シクロオキシゲナーゼ−
2(COX−2)阻害作用を有する旨の表示やプロスタグランジン生合成阻害作用を有す
る旨の表示が付されたものであることが好ましい。
【実施例】
【0056】
以下、本発明を実施例により具体的に説明するが、本発明の技術的範囲はこれらの実施
例に限定されないものとする。
【0057】
本実施例に使用する茶化合物(化合物1〜18)は、非特許文献9記載の方法で調整し
た(非特許文献9のP.166−218)。材料の茶葉として、市販の烏龍茶「白折」、
紅茶の製造原料である新鮮アッサム茶葉(大葉種、Camellia sinensis
var. assamica)、市販の紅茶「日東:インド・セイロン茶のブレンド茶
」を用いた。これらの茶葉を80%水性のアセトン溶液に冷浸し、抽出した(操作は3回
繰り返した)。抽出液は、減圧下アセトンを留去し、析出するクロロフィルなどを濾去、
または、エーテルなどの溶媒で分配し、除去した。濾液または分配液(いずれも水溶液の
状態)を直接、エムシーアイゲルCHP−20P(MCI gel CHP−20P、三
菱化学株式会社、Mitsubishi Chemical Corporation)
、セファデックスLH−20(Sephadex LH−20、ファルマシアファインケ
ミカル株式会社)のオープンカラムクロマトグラフィーに付した。移動層にA液として水
(H2O)、B液としてメタノール(MeOH)を用い、A液からB液の含量を増やすこ
とによってクロマトグラフィーを行った。この方法には、移動層にA液(H2O)を用い
、C液としてアセトン(Me2CO)を用い、C液からA液の含量を増やすことによって
クロマトグラフィーを行うこともできる。また、固定相にボンダパックC18(Bond
apakC18 ODS、Waters株式会社)を用い、移動層にA液(H2O)及び
B液(MeOH)を用い、A液からB液の含量を増やすことによってクロマトグラフィー
を行った。これらのクロマトグラフィーを繰り返すことによって、本実施例に使用する茶
化合物(化合物1〜18)を抽出、単離することができる。
【0058】
また、ウーロンホモビスフラバン類は、非特許文献13に記載の方法で合成できる。(
−)−エピガロカテキン3−O−ガレートを塩酸などの酸性溶媒下、室温でホルマリンと
処理すると主成物として、ウーロンホモビスフラバン類が合成される。
【0059】
テアシネンシン類は、非特許文献11に記載の方法で合成できる。(−)−エピガロカ
テキン3−O−ガレートを炭酸水素ナトリウムNaHCO3などの弱アルカリ性の条件下
、室温でフェリシアン化カリウムK3Fe(CN)6で酸化すると、テアシネンシン類を
合成することができる。
【0060】
[実験1]細胞の培養法
(1)細胞の種類
RIKEN CELL BANKから入手したマウスのマクロファージ様細胞(Cel
l No.RCB0535、以下、RAW264と称す)を用いた。
【0061】
(2)培地の準備
D−MEM(Dulbecco‘s Modified Eagle Medium
“Nissui”)9.5gを水(H2O)1Lに溶解し、オートクレーブにて高温加圧
滅菌した。冷却後、10%NaHCO3溶液を15ml加え、抗生物質混合試薬(PSG
[penicillin、streptomycin、glutamin]:Gibco
100mL Lot No.1185891)を10mL加えた。FBS(Fetal
Bovine Serum:Equitech−Bio 500mL Lot No.
SFB30−1463)溶液を前記調整した溶液に10%の割合で添加し、培地を準備し
た。
【0062】
(3)細胞の継代
予め冷凍庫(−80℃)にて保管しておいたRAW264細胞を解凍し、前記調整した
培地(以下、培地と称す)を10mL添加し、細胞と混合した。軽く混ぜ、遠心分離(1
000rpm、5min)し、上澄みを捨て、この操作を2回繰り返した。上澄みを除去
し、トリプシン(Trypsin−EDTA:Gibco 100mL)を1mL加え、
培地9mLを加え攪拌した後、遠心分離(1000rpm、5min)し、上澄み培地を
除去、培地10mLを加えた。細胞の入った培地を10cmのシャーレに置床した。各シ
ャーレのRAW264細胞の濃度が1〜3x105セル数程度になるよう調整した。細胞
は、37℃、5%の二酸化炭素(CO2)を気流に混入させたインキュベーター(以下、
CO2インキュベーターと称す)中で培養した。
【0063】
[実験2]細胞中のCOX−2の誘導法
(1)コントロール細胞の培養
シャーレ(6mLサイズ)中、RAW264細胞の濃度が1x106セル数になるよう
調整した。これを予め37℃、21時間、CO2インキュベーターで培養した。培養後、
細胞をシャーレ(3mLサイズ)へ置床した。このときは、培地にFBS溶液を加えなか
った。引き続き、37℃、3時間、CO2インキュベーターで培養した。培養後、リポ多
糖を5ng/μLに調整したもの(以下、LPSと称す)を、24μL培地へ添加し、3
7℃、12時間、CO2インキュベーターで培養した。この方法により、COX−2に加
えて、COX−1、iNOSの誘導も調査した。
【0064】
(2)試験化合物の調整
所定の茶化合物を各40〜100μMの濃度で溶解した。溶媒に水(H2O)とジメチ
ルスルフォキシド(以下、DMSOと称す)を用いた。以下、この濃度に調整したサンプ
ルを試験化合物と称す。
【0065】
(3)試験細胞の培養
シャーレ(6mLサイズ)中、RAW264細胞の濃度が1x106セル数になるよう
調整した。これを予め37℃、21時間、CO2インキュベーターで培養した。培養後、
細胞をシャーレ(3mLサイズ)へ置床した。このときは、培地にFBS溶液を加えなか
った。引き続き、37℃、2時間半、CO2インキュベーターで培養した。培養後、調整
した試験化合物を添加し、37℃、30分間、CO2インキュベーターで培養した。これ
に、リポ多糖を5ng/μLに調整したもの(以下、LPSと称す)を、24μL培地へ
添加し、37℃、12時間、CO2インキュベーターで培養した。この方法により、CO
X−2に加えて、COX−1、iNOSの誘導も調査した。
【0066】
[実験3]細胞中のCOX−2発現蛋白の回収と検出法
(1)COX−2発現蛋白の回収
前記実験2(1)及び(3)で培養した細胞を回収した。回収した細胞を37℃、PB
S(KCl:0.02%、KH2PO4:0.02%、NaHPO4・12H2O:0.29%
、NaCl:0.8%の水溶液)で洗浄後、SDS試薬(1M Tris−HCl、pH
6.8を1.25mL;SDS(2%w/v)0.4g;Glycerol(10%)2
mL;1M DTT(50mM)1mL;bromophenol blue(0.1%
)0.02gを混合したもの)を20mL添加し、100℃、5分間煮沸加熱し、細胞中
のタンパク質を回収した。
【0067】
(2)COX−2発現蛋白の検出
前記(1)にて回収したタンパク質溶液を、COX−2の発現タンパク質を調べるため
には10μL、COX−1の発現タンパク質を調べるためには30μL、iNOSの発現
タンパク質を調べるためには37μLを電気泳動用ウェルにそれぞれ吸着させた。定電流
で電気泳動を行った。メンブランを活性化し、よく洗浄した後、トランスファー緩衝液に
浸積し、ゲル版と濾紙とを共に装着し、定電流でトランスファーした。回収したメンブラ
ンについてウェスタンブロットを行い、抗体反応を繰り返し行い、化学発光検出器によっ
てタンパク質を検出した。検出されたタンパク質について、Lumi Vision A
nalyzer 140を用いて、泳動画像を保存した。
【0068】
[実験4]茶化合物の抗炎症機能のスクリーニング
(1)4β−8結合を有するプロアントシアニジン類のCOX−2抑制効果
プロデルフィニジンB−2、プロデルフィニジンB−2 3,3’−ジ−O−ガレート
(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガロカテキン−3
−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)、エピガロカテ
キン−(4β−8)−エピカテキン−3−O−ガレート(4)(表1)について、COX
−2発現の抑制効果のスクリーニングを行った。その結果を図1に示す。図中、番号は化
合物番号を示す。また、LPSが「−」と標記されているものは、LPSを添加していな
いものであり、COX−2の発現が認められない。LPSが「+」と標記されているもの
は、LPSを添加したもので、COX−2が発現していることが分かる。「PDB2」は
、茶葉より単離したプロデルフィニジンB−2である。プロデルフィニジンB−2はLP
S誘導によるCOX−2発現を抑制しないことが分かる。プロデルフィニジンB−2 3
,3’−ジ−O−ガレート(1)が最も強く、次にエピガロカテキン−3−O−ガレート
−(4β−8)−エピカテキン−3−O−ガレート(3)の順で、COX−2の発現を抑
制していることが分かる。なお、5つのプロアントシアニジン類は、いずれもCOX−1
の発現を抑制しないことが分かる(図1)。
【0069】
(2)4α−8結合を有するプロアントシアニジン類のCOX−2抑制効果
プロシアニジンB−4、プロデルフィニジンB−4−3’−O−ガレート(5)、プロ
デルフィニジンB−4(6)、ガロカテキン−(4α−8)−エピカテキン(7)、カテ
キン−(4α−8)−エピガロカテキン(8)(表2)について、COX−2発現の抑制
効果のスクリーニングを行った。その結果を図2に示す。図中、番号は化合物番号を示す
。また、LPSが「−」と標記されているものは、LPSを添加していないものであり、
COX−2の発現が認められない。LPSが「+」と標記されているものは、LPSを添
加したもので、COX−2が発現していることが分かる。「PCB4」は、茶葉より単離
したプロシアニジンB−4である。プロシアニジンB−4はLPS誘導によるCOX−2
発現を抑制しないことが分かる。プロデルフィニジンB−4−3’−O−ガレート(5)
並びにプロデルフィニジンB−4(6)が最も強く、ガロカテキン−(4α−8)−エピ
カテキン(7)、カテキン−(4α−8)−エピガロカテキン(8)も同様に、COX−
2の発現を抑制していることが分かる(図2)。
【0070】
(3)ウーロンホモビスフラバン類のCOX−2抑制効果
ウーロンホモビスフラバンA(9)、モノデスガロイルウーロンホモビスフラバンA(
10)(表3)について、COX−2発現の抑制効果のスクリーニングを行った。その結
果を図3及び図4に示す。図中、番号は化合物番号を示す。また、LPSが「−」と標記
されているものは、LPSを添加していないものであり、COX−2の発現が認められな
い。LPSが「+」と標記されているものは、LPSを添加したもので、COX−2が発
現していることが分かる。図4中、「ST」は、茶葉より単離したストリクティニンであ
る。「TriG」は、茶葉より単離した1,4,6−トリ−O−ガロイル−β−D−グル
コースである。「pCQA」は、茶葉より単離したp−クマロイル−キナ酸である。「T
G」は、茶葉より単離したテオガリンである。[ST]、[TriG]、「pCQA」、
「TG」はLPS誘導によるCOX−2発現を抑制しないことが分かる。ウーロンホモビ
スフラバンA(9)、モノデスガロイルウーロンホモビスフラバンA(10)、共にCO
X−2の発現を抑制していることが分かる(図3及び図4)。
【0071】
(4)プルプロガリンのCOX−2抑制効果
プルプロガリン(14)(表4)について、COX−2発現の抑制効果のスクリーニン
グを行った。その結果を図5に示す。図中、番号は化合物番号を示す。また、LPSが「
−」と標記されているものは、LPSを添加していないものであり、COX−2の発現が
認められない。LPSが「+」と標記されているものは、LPSを添加したもので、CO
X−2が発現していることが分かる。図4中、「AsEC」は、茶葉より単離したアスコ
ルビン酸(−)−エピガロカテキンである。「Caf」は、茶葉より単離したカフェイン
である。「GA」は、茶葉より単離した没食子酸である。[AsEC]、[Caf]、「
GA」はLPS誘導によるCOX−2発現を抑制しないことが分かる。プルプロガリン(
14)はCOX−2の発現を抑制することが分かる(図5)。
【0072】
(5)その他茶ポリフェノール単量体のCOX−2抑制効果
(−)−エピガロカテキン3−O−ガレート、(−)−エピガロカテキン、(−)−エ
ピカテキン3−O−ガレート、(−)−エピカテキン、(+)−カテキン、(±)−ガロ
カテキン、(−)−エピカテキン3−O−(3‘−O−メチル)−ガレート、(−)−エ
ピガロカテキン3,5−ジ−O−ガレートについて、COX−2発現の抑制効果のスクリ
ーニングを行った。その結果、いずれのポリフェノールもCOX−2の発現を抑制しない
か、または、その効果はかなり弱いことが分かった。
【0073】
[実験5]4β−8結合を有するプロアントシアニジン類の抗炎症機能
(1)LPS誘発による細胞内iNOS産生の抑制効果
プロデルフィニジンB−2、プロデルフィニジンB−2 3,3’−ジ−O−ガレート
(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガロカテキン−3
−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)、エピガロカテ
キン−(4β−8)−エピカテキン−3−O−ガレート(4)(表1)の化合物について
、iNOS産生の抑制効果試験を行った。その結果を図6に示す。図中、番号は化合物番
号を示す。また、LPSが「−」と標記されているものは、LPSを添加していないもの
であり、iNOSの産生が認められない。LPSが「+」と標記されているものは、LP
Sを添加したもので、iNOSが産生されていることが分かる。「PDB2」は、茶葉よ
り単離したプロデルフィニジンB−2である。プロデルフィニジンB−2はLPS誘導に
よるiNOS産生を抑制しないことが分かる。プロデルフィニジンB−2 3,3’−ジ
−O−ガレート(1)及びエピガロカテキン−3−O−ガレート−(4β−8)−エピカ
テキン−3−O−ガレート(3)が、iNOS産生を抑制していることが分かる(図6)
。
【0074】
(2)LPS誘発による細胞内プロスタグランジンE2(PGE2)産生の抑制効果
プロデルフィニジンB−2、プロデルフィニジンB−2 3,3’−ジ−O−ガレート
(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガロカテキン−3
−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)、エピガロカテ
キン−(4β−8)−エピカテキン−3−O−ガレート(4)(表1)の化合物について
、PGE2産生の抑制効果試験を行った。その結果を図7に示す。図中、番号は化合物番
号を示す。また、LPSが「−」と標記されているものは、LPSを添加していないもの
であり、PGE2の産生が認められない。LPSが「+」と標記されているものは、LP
Sを添加したもので、PGE2が産生されていることが分かる。「PDB2」は、茶葉よ
り単離したプロデルフィニジンB−2である。プロデルフィニジンB−2はLPS誘導に
よるPGE2産生を抑制しないことが分かる。プロデルフィニジンB−2 3,3’−ジ
−O−ガレート(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガ
ロカテキン−3−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)
、エピガロカテキン−(4β−8)−エピカテキン−3−O−ガレート(4)は全て、P
GE2産生を抑制することが分かる(図7)。
【0075】
(3)プロデルフィニジンB−2 3,3’−ジ−O−ガレート(1)のPGE2産生
抑制効果の濃度的変化
プロデルフィニジンB−2 3,3’−ジ−O−ガレート(1)のPGE2産生抑制効
果について、濃度的変化を調査した。その結果を図8に示す。図中、LPSが「−」と標
記されているものは、LPSを添加していないものであり、PGE2の産生が認められな
い。LPSが「+」と標記されているものは、LPSを添加したもので、PGE2が産生
されていることが分かる。これにプロデルフィニジンB−2 3,3’−ジ−O−ガレー
ト(1)の12.5,25,50μMの各濃度で処理すると、PGE2の産生を強く抑制
することが分かる(図8)。
【0076】
[実験6]4α−8結合を有するプロアントシアニジン類の抗炎症機能
(1)プロデルフィニジンB−4 3’−O−ガレート(5)のLPS誘発によるCO
X−2の発現抑制並びに細胞内iNOS産生抑制効果の濃度的変化
プロデルフィニジンB−4 3’−O−ガレート(5)のCOX−2の発現抑制及びi
NOS産生抑制効果について、濃度的変化を調査した。その結果を図9に示す。図中、L
PSが「−」と標記されているものは、LPSを添加していないものであり、COX−2
の発現及びiNOSの産生が認められない。LPSが「+」と標記されているものは、L
PSを添加したもので、COX−2が発現し、また、iNOSが産生されていることが分
かる。これにプロデルフィニジンB−4 3’−O−ガレート(5)の25,50,75
,100μMの各濃度で処理すると、濃度依存的にCOX−2の発現及びiNOSの産生
を抑制することが分かる。なお、プロデルフィニジンB−4 3’−O−ガレート(5)
はCOX−1の発現を抑制しないことも分かる(図9)。
【0077】
(2)プロデルフィニジンB−4 3’−O−ガレート(5)のLPS誘発によるPG
E2産生抑制効果の濃度的変化
プロデルフィニジンB−4 3’−O−ガレート(5)のPGE2産生抑制効果につい
て、濃度的変化を調査した。その結果を図10に示す。図中、LPSは、LPS添加した
もので、PGE2が産生されていることが分かる。このLPS添加培地に、プロデルフィ
ニジンB−4 3’−O−ガレート(5)を25,50,75,100μMの各濃度で処
理すると、濃度依存的にPGE2の産生を抑制することが分かる(図10)。
【0078】
[実験7]プルプロガリン誘導体の抗炎症機能
テアフラビン3’−O−ガレート(11)、テアフラビン3,3’−ジ−O−ガレート
(12)、エピテアフラガリン3−O−ガレート(13)、プルプロガリン(14)(表
4)の化合物について、COX−2発現及びiNOS産生の抑制効果試験を行った。その
結果を図11に示す。図中、番号は化合物番号を示す。また、LPSが「−」と標記され
ているものは、LPSを添加していないものであり、COX−2の発現及びiNOSの産
生が認められない。LPSが「+」と標記されているものは、LPSを添加したもので、
COX−2が発現及びiNOSが産生していることが分かる。「PGC」は、プルプロガ
リンガルボン酸である。プロデルフィニジンB−2はLPS誘導によるCOX−2発現を
抑制しないことが分かる。テアフラビン3’−O−ガレート(11)、テアフラビン3,
3’−ジ−O−ガレート(12)、エピテアフラガリン3−O−ガレート(13)、プル
プロガリン(14)はCOX−2の発現及びiNOSの産生を抑制することが分かる(図
11)。
【0079】
[実験8]テアシネンシン類の抗炎症機能
(1)テアシネンシン類のCOX−2、COX−1発現抑制及びiNOS産生抑制
テアシネンシンA(15)、テアシネンシンB(16)、テアシネンシンD(17)、
テアシネンシンE(18)(表5)のCOX−2の発現抑制及びiNOS産生抑制効果に
ついて調査した。その結果を図12に示す。図中、LPSが「−」と標記されているもの
は、LPSを添加していないものであり、COX−2の発現及びiNOSの産生が認めら
れない。LPSが「+」と標記されているものは、LPSを添加したもので、COX−2
が発現し、また、iNOSが産生されていることが分かる。また図中、「TSS」とはテ
アシネンシン類であり、A〜Eの記号は、それぞれテアシネンシンA(15)、テアシネ
ンシンB(16)、テシネンシンC、テアシネンシンD(17)、テアシネンシンE(1
8)である。この結果、テアシネンシンA(15)及びテアシネンシンD(17)は強く
COX−2の発現及びiNOSの産生を抑制することが分かる。全ての化合物はCOX−
1を抑制しない(図12)。
【0080】
(2)テアシネンシンA(15)のLPS誘発によるCOX−2の発現抑制並びに細胞
内iNOS産生抑制効果の濃度的変化
テアシネンシンA(15)のCOX−2の発現抑制及びiNOS産生抑制効果について
、濃度的変化を調査した。その結果を図13に示す。図中、LPSが「−」と標記されて
いるものは、LPSを添加していないものであり、COX−2の発現及びiNOSの産生
が認められない。LPSが「+」と標記されているものは、LPSを添加したもので、C
OX−2が発現し、また、iNOSが産生されていることが分かる。これにテアシネンシ
ンA(15)の25,50,75,100μMの各濃度で処理すると、濃度依存的にCO
X−2の発現及びiNOSの産生を抑制することが分かる。なお、テアシネンシンA(1
5)はCOX−1の発現を抑制しないことも分かる(図13)。
【0081】
(3)LPS誘発によるPGE2産生抑制
テアシネンシンA(15)、テアシネンシンB(16)、テアシネンシンD(17)、
テアシネンシンE(18)(表5)について、PGE2産生の抑制効果試験を行った。そ
の結果を図14に示す。図中、番号は化合物番号を示す。また図中、LPSは、LPS添
加したもので、PGE2が産生されていることが分かる。このLPS添加培地に、各テア
シネンシン類を添加した結果、テアシネンシンA(15)、テアシネンシンB(16)、
テアシネンシンD(17)、テアシネンシンE(18)は、PGE2の産生を抑制するこ
とが分かる。「TSC」は、茶葉より単離したテアシネンシンCである。テアシネンシン
CはLPS誘導によるPGE2産生を抑制しないことが分かる(図14)。
【0082】
(4)テアシネンシンA(15)のLPS誘発によるPGE2産生抑制効果の濃度的変
化
テアシネンシンA(15)のPGE2産生抑制効果について、濃度的変化を調査した。
その結果を図15に示す。図中、LPSは、LPSを添加したもので、PGE2が産生さ
れていることが分かる。このLPS添加培地に、テアシネンシンA(15)の25,50
,75,100μMの各濃度で処理すると、濃度依存的にPGE2の産生を抑制すること
が分かる(図13)。
【産業上の利用可能性】
【0083】
本発明により、緑茶、烏龍茶、紅茶から分離された18種類の茶化合物がCOX−2の
発現及び/又はPGE2の産生抑制の作用を有することから、COX−2阻害剤、PGE
2阻害剤として利用可能である。
【技術分野】
【0001】
本発明は、抗炎症作用、特に、シクロオキシゲナーゼ−2(cyclooxygena
se−2;以下、COX−2)阻害作用及び/又はプロスタグランジンE2(以下、PG
E2)生合成阻害作用を有するポリフェノール誘導体に関する。
【背景技術】
【0002】
プロスタグランジン(prostaglandin)は、ヒト生体部位の器官、組織に
炎症を起こす生理活性物質である。中でも特に、PGE2は、肺癌、乳癌、大腸癌、前立
腺癌などを誘発する物質であることが知られている。プロスタグランジン類は、アラキド
ン酸(arachidonic acid)を前駆物質として、シクロオキシゲナーゼ(
cyclooxygenase;COX)の酵素によって生合成される。
【0003】
COXには3種類あることが知られている。これらの内、ひとつは各種臓器に存在し、
消化液の分泌や利尿、血小板を凝集させるなど、恒常的に働くシクロオキシゲナーゼ−1
(cyclooxygenase−1;COX−1)である。一つは、炎症性のサイトカ
インや活性酸素に刺激を受けて誘導される、COX−2である。
【0004】
COX−2はプロスタグランジンH2合成酵素であり、アラキドン酸カスケード中最終
的にPGE2の生合成に関与する酵素として知られている。例えば、炎症性のサイトカイ
ンである腫瘍壊死因子α(tumor necrosis factor α;TNFα
)の刺激を受け、転写因子であるNF−κB(necrosis factor κB;
NFκB)が活性化され、この活性化によってCOX−2が発現する。COX−2の発現
によってPGE2の生合成が亢進し、癌細胞は増殖する上に、抗癌剤などに対しても抵抗
性を有するようになる。ヒト生体内のこの生合成カスケード中のどの部分を抑えることが
できるか、癌の治療や予防薬を開発する上で目標となることが示されている。
【0005】
COX−2の発現を抑える効果のあるものは、COX−2阻害剤と呼ばれている。CO
X−2阻害剤の一例として、セレブレックス(Celebrex)の記載がある。「血液
腫瘍や上皮性腫瘍の増殖抑制において、COX阻害剤の中で最も強力な活性を示す」とい
う記載がある(非特許文献1、Waskewich,C.et.al.:Cancer
Res.、62:2029−2033)。
【0006】
ポリフェノールは、タンパク質やアルカロイド等と結合し、難溶化の傾向を示す多価フ
ェノール類の総称である(非特許文献2、川崎敏男、他:天然薬物化学、廣川書店、19
86年4月:124)。中でも茶葉に含まれるポリフェノール(通称茶ポリフェノール)
には、多くの生物活性のあることが報告された。例えば、抗酸化作用(非特許文献3、H
ashimoto、F.et al.:Biosci.Biotechnol.Bioc
hem.、67:396−401、2003)、抗HIV作用(非特許文献4、Hash
imoto、F.et al.:Bioorg.Med.Chem.Lett.、6:6
95−700、1996)、抗アレルギー作用(非特許文献5、Yamada、K.et
al.:Food Sci.Technol.Res.、5:1−8、1999)、抗
トポイソメラーゼI及びII作用(非特許文献6、Suzuki、K.et al.:B
iol.Pharm.Bull.、24:1088−1090、2001)、抗癌作用(
非特許文献7、中村好志:茶の抗突然変異・抗癌作用、朝倉書店、1997年9月:13
1−143)、リパーゼ活性阻害作用(非特許文献8、Nakai、M.et al.:
J.Agri.Food Chem.、53:4593−4598、2005)、の報告
がある。
【0007】
茶ポリフェノールは、緑茶、紅茶、烏龍茶、黒(プーアル)茶から単離され、70種以
上ものポリフェノール類が含有されていることが知られている(非特許文献9、橋本文雄
:各種茶のポリフェノールに関する化学的研究、1988年2月:68−72、147−
151、162−164;非特許文献10、Hashimoto、F.et al.:C
hem.Pharm.Bull.、35:611−616、1987;非特許文献11、
Hashimoto、F.et al.:Chem.Pharm.Bull.、36:1
676−1684、1988;非特許文献12、Hashimoto、F.et al.
:Chem.Pharm.Bull.、37:77−85、1989;非特許文献13、
Hashimoto、F.et al.:Chem.Pharm.Bull.、37:3
255−3263、1989;非特許文献14、Hashimoto、F.et al.
:Chem.Pharm.Bull.、40:1383−1389、1992)。
【0008】
茶ポリフェノールは、その生合成機構の違いにより、二つに分類されている。即ち、生
葉中に元来含まれる一次ポリフェノールと、紅茶、烏龍茶等の製造工程(萎凋、発酵)で
、フラバン3−オール(flavan−3−ol)類から変換した二次ポリフェノールと
に大別される。一次ポリフェノールには、フラバン3−オール(flavan−3−ol
)類、プロアントシアニジン(proanthocyanidin)類、加水分解型タン
ニン(hydrolyzable tannin)類、チャルカン−フラバン二量体(c
halcan−flavan dimer)類、ウーロンホモビスフラバン(oolon
ghomobisflavan)類が含まれる。一方、二次ポリフェノールとして、テア
シネンシン(theasinensin)類、テアフラガリン(theaflagall
in)類、テアフラビン(theaflavin)類が含まれる(非特許文献9)。
【0009】
いわゆる茶カテキン類と称する主ポリフェノールの、エピガロカテキン3−ガレート(
(−)−epigallocatechin 3−O−gallte、EGCG)、エピ
ガロカテキン((−)−epigallocatechin、EGC)、エピカテキン3
−ガレート((−)−epicatechin 3−O−gallate、ECG)、エ
ピカテキン((−)−epicatechin、EC)、ガロカテキン((+)−gal
locatechin、GC)、カテキン((+)−catechin、CA)を除く、
種々のポリフェノール類は、茶葉からの単離が容易ではなかったこともあって、種々の生
物活性試験を行うことが困難であった問題点がある。
【0010】
近年、発酵茶より分離される5種のテアシネンシン類(theasinensin)の
COX−2遺伝子の発現抑制について報告した。COX−2の発現により産生されるタン
パク質を分析したところ、テアシネンシンA及びDはその産生を強く抑制し、結果として
COX−2の発現を抑制することを報告した(非特許文献15、益崎智子、他4名:平成
15年度日本農芸化学会西日本支部、中国・四国支部、日本栄養・食糧学会西日本支部、
日本食品科学工学会西日本支部鹿児島合同大会およびシンポジウム、2003年9月:3
7)。
【0011】
特開2002−220340号(以下、特許文献1という)に、茶に由来する薬理組成
物(特許文献1の第0033〜0056段落)の記載がある。「茶から抽出される温水抽
出物、ポリフェノール、カテキン類、EGCgなど、抽出後各生成段階で得られる成分に
ついて様々な薬理作用を検討し、その結果得られた知見に基づいて本発明を完成した物で
ある」、「この際、増強されるカテキンの薬理作用としては、少なくとも、シクロオキシ
ゲナーゼ−2活性阻害作用、インターフェロン−γ−産生抑制作用、腫瘍壊死因子−α−
産生抑制作用、フィブロネクチン介在細胞接着抑制作用、血管内皮細胞増殖因子(VGE
F)による欠陥内皮細胞増殖抑制作用、及び乳癌細胞増殖抑制作用を挙げることができる
」、「本発明はまた、上記の「温水抽出非カテキン成分」とカテキン類とを含む「混合物
X」を有効成分として含有し、好ましくは当該「混合物X」中に、(−)−エピガロカテ
キンガレート(EGCg)、(−)−エピカテキンガレート(ECg)、(−)−エピガ
ロカテキン(EGC)、(−)−エピカテキン(EC)、(−)−ガロカテキンガレート
(GCg)、(−)−カテキンガレート(Cg)、(±)−ガロカテキン(GC)及び(
±)−カテキン(C)の総量(以下、この総量を「カテキン総量」と呼び、これら8種類
のカテキンを「総カテキン」と呼ぶ。)としてカテキン類を約30%以上、例えば約30
〜40重量%含有してなる薬理組成物を提案する」という記載がある(特許文献の第00
33、0038、0039段落)。
【0012】
WO2004052873号(以下、特許文献2という)に、緑茶のポリフェノール並
びに関連誘導体の化学療法剤または化学予防剤の記載がある。「化学療法剤または化学予
防剤として有用な新規化合物の調整法であり、緑茶に含まれる例えばエピガロカテキン3
−Oーガレート(EGCG)の関連化合物であって、化学式(I)[C6−C3−C6骨
格]のR1からR11までの官能基がここに示すものを含む。」、「R4の官能基は好ま
しくは、O,S,NH2,CH2の官能基であって、」、「化合物の提供と共に、化学療
法または化学予防法として、薬理学的方法論もまた提供する。」という記載がある(特許
文献の要旨)。
【0013】
その他、特開2000−226329号(以下、特許文献3という)に、MMP阻害剤
(特許文献3の第0001〜0014段落)の記載がある。「カテキン化合物の抗酸化活
性や抗ウィルス活性、など多様な生物活性に着目し、カテキン化合物がMMPsに対して
阻害作用を有するかもしれないと推測し、カテキンのMMPs阻害活性を調べた結果、カ
テキンが、その多様な生物活性と併せて、MMP阻害作用を示し、結果として、MMPs
活性の調節不能に起因する難治性疾患の治療及び予防に対する有用性が期待できることを
見出した」という記載がある(特許文献3の第0013段落)。
【0014】
特開2000−344672号(以下、特許文献4という)には、マトリックスメタロ
プロテアーゼ阻害剤(特許文献4の第0001〜0014段落)の記載がある。「ポリフ
ェノール類であるタンニン化合物についても、MMPs阻害活性を調べた結果、該化合物
が、優れたMMP阻害作用を示し、結果として、MMPs活性の調節不能に起因する難治
性疾患の治療および予防に対して有用性が期待できることを見出し、本発明を完成した」
という記載がある(特許文献4の第0013段落)。
【0015】
特開2004−359576号(以下、特許文献5という)には、アポトーシス誘導剤
(特許文献5の第0015、0016段落)と記載がある。「紅茶から抽出されたプルプ
ロガリン誘導体並びにその合成したプルプロガリン誘導体のヒト急性前骨髄性白血病疾患
細胞(HL−60細胞)に対するアポトーシス誘導を調べた結果、プルプロガリン(pu
rpurogallin)が濃度依存的および経時的にアポトーシスを誘導することと併
せて、テアフラビン(theaflavin)類も同様にHL−60細胞に対してアポト
ーシスを誘導することを見出し、結果として、正常細胞に対してアポトーシス誘導を起こ
させなくて、癌細胞に対してのみアポトーシスを誘導できることを見出した。」、「プル
プロガリン(Purpurogallin)がHL−60細胞に対してカスパーゼ8を活
性化し、カスパーゼ8の直接作用によりカスパーゼ3を活性化し、引き続いてDNAが断
片化され、アポトーシスが誘導されることを見出した。また、カスパーゼ8からはビッド
(Bid)は切断されず、ミトコンドリアからも細胞質へチトクロームcは放出されず、
カスパーゼ9は結果として活性化されないことを見出した。この細胞死機構は、HL−6
0細胞内の活性酸素の増加を伴わないでアポトーシスを誘導することを見出し、本発明を
完成した。」と記載がある。
【0016】
特開2005−075790号(以下、特許文献6という)には、Apoptosis
誘導剤(特許文献6の第0019、0020段落)と記載がある。「紅茶から抽出された
ポリフェノール誘導体並びにその合成したポリフェノール誘導体のヒト急性前骨髄性白血
病疾患細胞(HL−60細胞)、ヒト大腸癌細胞(LoVo細胞)に対するアポトーシス
誘導を調べた結果、プロデルフィニジンB−2(prodelphinidin B−2
)が濃度依存的および経時的にアポトーシスを誘導することと併せて、ポリフェノール(
polyphenol)類も同様にHL−60細胞、LoVo細胞に対してアポトーシス
を誘導すること、癌細胞に対してアポトーシスを誘導できることを見出した。」、「プロ
デルフィニジンB−2(prodelphinidin B−2)がHL−60細胞に対
してカスパーゼ8を活性化し、カスパーゼ8の直接作用によりカスパーゼ3を活性化し、
引き続いてDNAが断片化され、アポトーシスが誘導されることを見出した。また、カス
パーゼ9も活性化されることを見出した。この細胞死機序は、HL−60細胞内の活性酸
素の増加を伴いアポトーシスを誘導することを見出し、本発明を完成した。」と記載があ
る。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特開2002−220340号公報
【特許文献2】国際公開WO2004052873号パンフレット
【特許文献3】特開2000−226329号公報
【特許文献4】特開2000−344672号公報
【特許文献5】特開2004−359576号公報
【特許文献6】特開2005−075790号公報
【非特許文献】
【0018】
【非特許文献1】Waskewich、C.、他5名、「Celecoxib Exhibits the Greatest Potency amongst Cyclooxygenase (COX) Inhibitors for Growth Inhibition of COX−2−negative Hematopoietic and Epithelial Cell Lines」、Cancer Res.、2002年、第62巻、P.2029−2033
【非特許文献2】川崎敏男、他10名、「タンニン」、天然薬物化学、廣川書店、1986年4月、P.124
【非特許文献3】Hashimoto、F.、他9名、「Evaluation of the Anti−oxidative Effect (in vitro) of Tea Polyphenols」、Biosci.Biotechnol.Biochem.、2003年、第67巻、P.396−401
【非特許文献4】Hashimoto、F.、他6名、「Evaluation of Tea Polyphenols as Anti−HIV Agents」、Bioorg.Med.Chem.Lett.、1996年、第6巻、P.695−700
【非特許文献5】Yamada、K.、他4名、「Structure−activity Relationship of Immunoregulatory Factors in Foodstuffs」、Food Sci.Technol.Res.、1999年、第5巻、P.1−8
【非特許文献6】Suzuki、K.、他3名、「Inhibitory Activities of (−)−Epigallocatechin−3−O−gallate against Topoisomerase I and II」、Biol.Pharm.Bull.、2001年、第24巻、P.1088−1090
【非特許文献7】西岡五夫、「茶のポリフェノール」、茶の科学、朝倉書店、1997年9月、P.115−123
【非特許文献8】Nakai、M.、他8名、「Inhibitory Effects of Tea Polyphenols on Pancreatic Lipase in vitro」、J.Agric.Food Chem.、2005年、第53巻、P.4593−4598
【非特許文献9】橋本文雄、「各種茶のポリフェノールに関する化学的研究」、博士論文、1988年2月、P.68−72、147−151、162−164
【非特許文献10】Hashimoto、F.、他2名、「Tannins and Related Compounds.LVI.Isolation of four New Acylated Flavan−3−ols from Oolong Tea.(I)」、Chem.Pharm.Bull.、1987年、第35巻、P.611−616
【非特許文献11】Hashimoto、F.、他2名、「Tannins and Related Compounds.LXIX.Isolation and Structure Elucidation of B,B’−linked Bisflavanoids, Theasinensins D−G and Oolongthanin from Oolong Tea (2)」、Chem.Pharm.Bull.、1988年、第36巻、P.1676−1684
【非特許文献12】Hashimoto、F.、他2名、「Tannins and Related Compounds.LXXVII.Novel Chalcan−flavan Dimers, Assamicains A, B andC, and a New Flavan−3−ol and Proanthocyanidins from the Fresh Leaves of Camellia sinensis L. var. assamica Kitamura」、Chem.Pharm.Bull.、1989年、第37巻、P.77−85
【非特許文献13】Hashimoto、F.、他2名、「Tannins and Related Compounds.XC.8−C−Ascorbyl (−)−Epigallocatechin 3−O−gallate and Novel Dimeric Flavan−3−ols, Oolonghomobisflavans A and B, from Oolong Tea(3)」、Chem.Pharm.Bull.、1989年、第37巻、P.3255−3263
【非特許文献14】Hashimoto、F.、他2名、「Tannins and Related Compounds.CXIV.Structures of Novel Fermentation Products, Theogallinin, Theaflavonin and Desgalloyl Theaflavonin from Black Tea, and Changes of Tea Polyphenols during Fermentation」、Chem.Pharm.Bull.、1992年、第40巻、P.1383−1389
【非特許文献15】益▲崎▼智子、他4名、「TheasinensinによるCOX−2遺伝子発現の制御について」、平成15年度日本農芸化学会西日本支部、中国・四国支部、日本栄養・食糧学会西日本支部、日本食品科学工学会西日本支部鹿児島合同大会およびシンポジウム、2003年9月、P.37
【発明の概要】
【発明が解決しようとする課題】
【0019】
上記の特許文献の中で、8種類の茶カテキン類にCOX−2阻害活性があることが明ら
かにされたにも拘わらず、茶葉に含まれるテアシネンシン類を除く他の化合物がCOX−
2阻害活性を有することは知られていなかった。もしこれらの茶化合物にCOX−2阻害
活性の効果が確認できれば、8種類の茶カテキン類以外の茶化合物をCOX−2阻害剤及
び/又はPGE2生合成阻害剤の、いわゆる抗炎症剤として、種々の癌疾患の予防又は治
療に使用できるものと考えられる。
【0020】
また上記の非特許文献の中で、テアシネンシン類にCOX−2阻害活性があることが明
らかにされたが、PGE2生合成を阻害するかどうかは知られていなかった。もしテアシ
ネンシン類のPGE2生合成阻害活性の効果が確認できれば、テアシネンシン類をPGE
2生合成阻害剤の、いわゆる抗炎症剤として、種々の癌疾患の予防又は治療に使用できる
ものと考えられる。
【0021】
本発明は茶由来の化合物のなかから抗炎症作用、より具体的にはCOX−2阻害作用及
び/又はPGE2生合成阻害作用、を有する化合物を見出すことを目的とする。そして本
発明はかかる化合物を有効成分として含有する抗炎症剤および抗炎症作用を有する飲食品
を提供することを目的とする。
【課題を解決するための手段】
【0022】
本発明者らは、上記の課題を解決するため、緑茶、烏龍茶、紅茶から分離された茶化合
物を供試し、慢性炎症に引き起こす酵素COX−2およびその産物であるPGE2を標的
として鋭意研究を行った結果、18種類の茶化合物がCOX−2の発現及び/又はPGE
2の産生を抑制することを見出し、本発明を完成した。
【0023】
本発明は以下の発明を包含する。
【0024】
(1)式(I):
【化1】

[式中、
R11およびR12は独立に−Hまたは−OHであり、
R13は−Hまたはガロイル基であり、
R14は
【化2】

で表される基(R15は−Hまたは−OHであり、R16は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(I)の2位及び3位は独立にR配置またはS配置であり、
式(I)の3位がR配置の場合には基R14は4位にβ結合により結合し、式(I)の
3位がS配置の場合には基R14は4位にα結合により結合する。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0025】
(2)前記化合物が表1及び表2に示すプロデルフィニジンB−2 3,3’−ジ−O−
ガレート(化合物1)、プロデルフィニジンB−2 3’−O−ガレート(化合物2)、
エピガロカテキン−3−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート
(化合物3)、エピガロカテキン−(4β−8)−エピカテキン−3−O−ガレート(化
合物4)、プロデルフィニジンB−4−3’−O−ガレート(化合物5)、プロデルフィ
ニジンB−4(化合物6)、ガロカテキン−(4α−8)−エピカテキン(化合物7)、
またはカテキン−(4α−8)−エピガロカテキン(化合物8)である(1)記載の抗炎
症剤。
【0026】
【表1】

【0027】
【表2】

【0028】
(3)式(II):
【化3】

[式中、
R21およびR22は独立に−Hまたは−OHであり、
R23は−Hまたはガロイル基であり、
R24およびR25は独立に−Hまたは
【化4】

で表される基(R26は−Hまたは−OH、好ましくは−OH、であり、R27は−Hま
たはガロイル基であり、*は結合位置を示す)であり、
式(II)の2位及び3位は独立にR配置またはS配置である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0029】
(4)前記化合物が表3に示すウーロンホモビスフラバンA(化合物9)、またはモノデ
スガロイルウーロンホモビスフラバンA(化合物10)である(3)記載の抗炎症剤。
【0030】
【表3】

【0031】
(5)式(III):
【化5】

[式中、
R31は−Hまたは−OHであり、
R32およびR33は独立に−Hまたは
【化6】

で表される基(R34は−Hまたはガロイル基であり、*は結合位置を示す)である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0032】
(6)前記化合物が表4に示すテアフラビン3’−O−ガレート(化合物11)、テアフ
ラビン3,3’−ジ−O−ガレート(化合物12)、エピテアフラガリン3−O−ガレー
ト(化合物13)、またはプルプロガリン(化合物14)である(5)記載の抗炎症剤。
【0033】
【表4】

【0034】
(7)式(IV):
【化7】

[式中、
R41およびR42は独立に−Hまたは−OHであり、
R43は−Hまたはガロイル基であり、
R44は
【化8】

で表される基(R45は−Hまたは−OH、好ましくは−OH、であり、R46は−Hま
たはガロイル基であり、*は結合位置を示す)であり、
式(IV)の2位及び3位は独立にR配置またはS配置であり、
式(IV)のフラバン骨格と基R44との間で生じる立体配置はR配置であってもS配
置であってもよい。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【0035】
(8)前記化合物が表5に示すテアシネンシンA(化合物15)、テアシネンシンB(化
合物16)、テアシネンシンD(化合物17)、またはテアシネンシンE(化合物18)
である(7)記載の抗炎症剤。
【0036】
【表5】

【0037】
(9)プロスタグランジン生合成阻害剤である(1)〜(8)のいずれか記載の抗炎症剤
。
(10)シクロオキシゲナーゼ−2(COX−2)阻害剤である(1)〜(6)のいずれ
か記載の抗炎症剤。
(11)前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(I
II)で表される化合物、および前記式(IV)で表される化合物からなる群から選択さ
れる少なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物が人
為的に添加された、抗炎症作用を有する飲食品。
(12)前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(I
II)で表される化合物、および前記式(IV)で表される化合物からなる群から選択さ
れる少なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物を含
有し、抗炎症作用を有する旨の表示が付された、抗炎症作用を有する飲食品。
(13)不発酵茶、半発酵茶、強発酵茶または後発酵茶である(11)または(12)記
載の飲食品。
【0038】
表1〜4に挙げる化合物はいずれも、緑茶(不発酵茶)、烏龍茶(半発酵茶)、紅茶(
強発酵茶)、黒(プーアル)茶(後発酵茶)などのいわゆる茶葉から抽出された化合物で
ある。本発明者らの鋭意研究の結果、シクロオキシゲナーゼ(COX−2)阻害作用、及
びプロスタグランジン生合成阻害作用を有することが見出された。一方、表5に挙げる化
合物は、烏龍茶(半発酵茶)、紅茶(強発酵茶)、黒(プーアル)茶(後発酵茶)などの
いわゆる発酵茶葉から抽出された化合物である。本発明者らの鋭意研究の結果、プロスタ
グランジン生合成阻害作用を有することが見出された。
【0039】
本発明に用いられる化合物は薬理学的に許容される塩として存在することができる。そ
のような塩としては、薬理学的に許容される非毒性塩が挙げられ、例えばナトリウム塩、
カリウム塩又はカルシウム塩等のアルカリ金属塩、又はアルカリ土類金属塩、塩酸塩等の
ハロゲン化水素塩、硝酸塩、硫酸塩又はリン酸塩等の無機酸塩、メタンスルホン酸、ベン
ゼンスルホン酸等のスルホン酸塩、フマル酸、コハク酸、クエン酸、シュウ酸又はマレイ
ン酸等の有機酸塩及びグルタミン酸、アスパラギン酸等のアミノ酸塩等を挙げることがで
きる。
【0040】
本発明に用いられる化合物はまた、溶媒和物として存在することができる。好ましい溶
媒和物としては、水和物、エタノール和物等を挙げることができる。
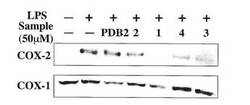
【発明の効果】
【0041】
本発明により、茶由来の化合物を有効成分として含有する抗炎症剤および抗炎症作用を
有する飲食品が提供される。本発明の抗炎症剤は、COX−2阻害作用及び/又はPGE
2生合成阻害作用を有することを特徴とする。
【図面の簡単な説明】
【0042】
【図1】実験4の電気泳動の図である。
【図2】実験4の電気泳動の図である。
【図3】実験4の電気泳動の図である。
【図4】実験4の電気泳動の図である。
【図5】実験4の電気泳動の図である。
【図6】実験5の電気泳動の図である。
【図7】実験5のプロスタグランジンE2産生量を比較した図である。
【図8】実験5のプロスタグランジンE2産生量のポリフェノール濃度的変化を示した図である。
【図9】実験6の電気泳動の図である。COX−2の発現について、ポリフェノールの濃度的変化を示した図である。
【図10】実験6のプロスタグランジンE2産生量のポリフェノール濃度的変化を示した図である。
【図11】実験7の電気泳動の図である。
【図12】実験8の電気泳動の図である。
【図13】実験8の電気泳動の図である。COX−2の発現について、ポリフェノールの濃度的変化を示した図である。
【図14】実験8のプロスタグランジンE2産生量を比較した図である。
【図15】実験8のプロスタグランジンE2産生量のポリフェノール濃度的変化を示した図である。
【発明を実施するための形態】
【0043】
以下、本発明を詳細に説明する。
【0044】
本発明において有効成分として用いられる化合物はいずれも新鮮チャ葉、或いは不発酵
茶(例えば緑茶)、半発酵茶(例えば烏龍茶)、強発酵茶(例えば紅茶)、後発酵茶(例
えば黒(プーアル)茶)などのいわゆる茶葉から常法を用いて抽出により単離することが
できる。抽出方法は特に限定されないが、新鮮チャ葉または上記の茶葉から水や、低級ア
ルコール、アセトンなどの水溶性有機溶媒、水性有機溶媒と水との混合溶媒を用いて常法
に従い抽出することができる。本発明において有効成分として用いられる化合物はまた、
化学的な合成法により合成されたものであってもよい。
【0045】
本発明において有効成分として用いられる化合物は、例えば本出願人による特開200
4−359576号(特許文献4)および特開2005−075790号(特許文献5)
に記載される方法によって調製することができる。
【0046】
下記の実施例では、文献記載の方法を用いて単離した化合物を使用した(非特許文献9
)。また、プルプロガリン、テアシネンシン類、ウーロンホモビスフラバン類は特許文献
記載の方法で合成した化合物を使用した(特許文献5)。また、文献記載の方法を用いて
エピテアフラガリン3−O−ガレートを合成し使用した(Nonaka,G.、et.a
l.:Chem.Pharm.Bull.、34、61−65:1986)。
【0047】
本発明の抗炎症剤は、例えば経口投与または非経口投与(静脈内、動脈内、腹腔内、経
直腸内、皮下、筋肉内、舌下、経鼻腔内、経膣内など)用に製剤化され得る。かかる製剤
は例えば抗炎症剤としてヒトや哺乳動物などの動物に投与することができる。本発明の抗
炎症剤は、COX−2阻害作用及び/又はPGE2生合成阻害作用を有することを特徴と
する。本発明の抗炎症剤は癌の予防または治療に有用であると期待される。製剤の形態は
、特に制限されないが、溶液剤、錠剤、粉末剤、顆粒剤、カプセル剤、座剤、噴霧剤、制
御放出剤、懸濁剤、ドリンク剤などが挙げられる。
【0048】
本発明の抗炎症剤の製剤化に際しては、製薬上許容可能な担体(賦形剤もしくは希釈剤
)、ならびに、結合剤、増量剤、滑沢剤、崩壊剤、湿潤剤、乳化剤、緩衝剤、懸濁化剤、
保存剤、着色剤、風味剤、甘味剤などから適宜選択される添加剤を含有させることができ
る。担体および添加剤は、製剤化のために一般的に使用されるものを、本発明の抗炎症剤
の製造に使用することができる。結合剤の例としては、デンプン、ポリビニルピロリドン
、ヒドロキシプロピルメチルセルロースなどが挙げられる。増量剤の例としては、ラクト
ース、微結晶セルロースなどが挙げられる。滑沢剤の例としては、タルク、シリカ、ステ
アリン酸マグネシウムなどが挙げられる。崩壊剤の例としては、デンプン、デンプングリ
コール酸ナトリウムなどが挙げられる。湿潤剤の例はとしては、ラウリウ硫酸ナトリウム
などが挙げられる。乳化剤の例としては、セルロース誘導体、ソルビトールなどが挙げら
れる。保存剤の例としては、メチル−p−ヒドロキシベンゾエート、ソルビン酸などが挙
げられる。しかしながら、上記の特定例に制限されない。
【0049】
本発明の茶化合物の用量は、患者の年齢、体重、性別、状態、重篤度などによって変化
しうる。患者に投与される一日用量は、例えば患者の体重1kgあたり0.1〜200m
g、好ましくは1〜100mgの範囲であるが、この範囲に制限されない。必要に応じて
、用量を数回、例えば2〜3回に分けて分割投与してもよい。また、本発明の抗炎症剤は
治療用途の同じまたは異なる他のシクロオキシゲナーゼ−2(COX−2)阻害剤、プロ
スタグランジン生合成阻害剤と併用して患者に投与することもできる。
【0050】
本発明の化合物はまた、常法に従って、固形食品、半固形食品、飲料等の飲食品に添加
することができる。具体的には菓子類、レトルト食品、ジュース類、茶類、乳製品、清涼
飲料、アルコール飲料などを挙げることができるがこれらには限定されない。これらの飲
食品は、いわゆる特定保健用食品や健康補助食品とするのが好ましい。かかる食品は抗炎
症作用(具体的にはCOX−2阻害作用及び/又はPGE2生合成阻害作用)を有する。
【0051】
本発明の飲食品は、茶化合物の有効量を、錠剤、カプセル、顆粒、ドリンク、ペットボ
トルなどの任意の形態に添加または封入するか、あるいは任意の食品に添加して得られる
。
【0052】
本発明の飲食品には必要に応じて甘味剤、調味料、乳化剤、懸濁化剤、防腐剤などを添
加してもよいし、あるいはビタミン類、栄養剤、免疫増強剤(例えば、プロポリス、きの
こ抽出物など)などを添加してもよい。
【0053】
飲食品中への茶化合物の添加量は、成人体重1kgあたり0.1〜200mgに相当す
る範囲内の量、1製品あたり例えば50mg〜1gであるが、この範囲に制限されないも
のとする。
【0054】
本発明の飲食品は、所定の茶化合物を人為的に添加した上記飲食品だけでなく、従来か
ら存在する不発酵茶、半発酵茶、強発酵茶または後発酵茶であって抗炎症作用を奏するの
に有効な量の茶化合物が含有されているものをも包含する。
【0055】
本発明の飲食品はその本体、包装、説明書、宣伝物または宣伝用電子的情報にその効能
の表示、例えば抗炎症作用を有する旨の表示、より具体的には、シクロオキシゲナーゼ−
2(COX−2)阻害作用を有する旨の表示やプロスタグランジン生合成阻害作用を有す
る旨の表示が付されたものであることが好ましい。
【実施例】
【0056】
以下、本発明を実施例により具体的に説明するが、本発明の技術的範囲はこれらの実施
例に限定されないものとする。
【0057】
本実施例に使用する茶化合物(化合物1〜18)は、非特許文献9記載の方法で調整し
た(非特許文献9のP.166−218)。材料の茶葉として、市販の烏龍茶「白折」、
紅茶の製造原料である新鮮アッサム茶葉(大葉種、Camellia sinensis
var. assamica)、市販の紅茶「日東:インド・セイロン茶のブレンド茶
」を用いた。これらの茶葉を80%水性のアセトン溶液に冷浸し、抽出した(操作は3回
繰り返した)。抽出液は、減圧下アセトンを留去し、析出するクロロフィルなどを濾去、
または、エーテルなどの溶媒で分配し、除去した。濾液または分配液(いずれも水溶液の
状態)を直接、エムシーアイゲルCHP−20P(MCI gel CHP−20P、三
菱化学株式会社、Mitsubishi Chemical Corporation)
、セファデックスLH−20(Sephadex LH−20、ファルマシアファインケ
ミカル株式会社)のオープンカラムクロマトグラフィーに付した。移動層にA液として水
(H2O)、B液としてメタノール(MeOH)を用い、A液からB液の含量を増やすこ
とによってクロマトグラフィーを行った。この方法には、移動層にA液(H2O)を用い
、C液としてアセトン(Me2CO)を用い、C液からA液の含量を増やすことによって
クロマトグラフィーを行うこともできる。また、固定相にボンダパックC18(Bond
apakC18 ODS、Waters株式会社)を用い、移動層にA液(H2O)及び
B液(MeOH)を用い、A液からB液の含量を増やすことによってクロマトグラフィー
を行った。これらのクロマトグラフィーを繰り返すことによって、本実施例に使用する茶
化合物(化合物1〜18)を抽出、単離することができる。
【0058】
また、ウーロンホモビスフラバン類は、非特許文献13に記載の方法で合成できる。(
−)−エピガロカテキン3−O−ガレートを塩酸などの酸性溶媒下、室温でホルマリンと
処理すると主成物として、ウーロンホモビスフラバン類が合成される。
【0059】
テアシネンシン類は、非特許文献11に記載の方法で合成できる。(−)−エピガロカ
テキン3−O−ガレートを炭酸水素ナトリウムNaHCO3などの弱アルカリ性の条件下
、室温でフェリシアン化カリウムK3Fe(CN)6で酸化すると、テアシネンシン類を
合成することができる。
【0060】
[実験1]細胞の培養法
(1)細胞の種類
RIKEN CELL BANKから入手したマウスのマクロファージ様細胞(Cel
l No.RCB0535、以下、RAW264と称す)を用いた。
【0061】
(2)培地の準備
D−MEM(Dulbecco‘s Modified Eagle Medium
“Nissui”)9.5gを水(H2O)1Lに溶解し、オートクレーブにて高温加圧
滅菌した。冷却後、10%NaHCO3溶液を15ml加え、抗生物質混合試薬(PSG
[penicillin、streptomycin、glutamin]:Gibco
100mL Lot No.1185891)を10mL加えた。FBS(Fetal
Bovine Serum:Equitech−Bio 500mL Lot No.
SFB30−1463)溶液を前記調整した溶液に10%の割合で添加し、培地を準備し
た。
【0062】
(3)細胞の継代
予め冷凍庫(−80℃)にて保管しておいたRAW264細胞を解凍し、前記調整した
培地(以下、培地と称す)を10mL添加し、細胞と混合した。軽く混ぜ、遠心分離(1
000rpm、5min)し、上澄みを捨て、この操作を2回繰り返した。上澄みを除去
し、トリプシン(Trypsin−EDTA:Gibco 100mL)を1mL加え、
培地9mLを加え攪拌した後、遠心分離(1000rpm、5min)し、上澄み培地を
除去、培地10mLを加えた。細胞の入った培地を10cmのシャーレに置床した。各シ
ャーレのRAW264細胞の濃度が1〜3x105セル数程度になるよう調整した。細胞
は、37℃、5%の二酸化炭素(CO2)を気流に混入させたインキュベーター(以下、
CO2インキュベーターと称す)中で培養した。
【0063】
[実験2]細胞中のCOX−2の誘導法
(1)コントロール細胞の培養
シャーレ(6mLサイズ)中、RAW264細胞の濃度が1x106セル数になるよう
調整した。これを予め37℃、21時間、CO2インキュベーターで培養した。培養後、
細胞をシャーレ(3mLサイズ)へ置床した。このときは、培地にFBS溶液を加えなか
った。引き続き、37℃、3時間、CO2インキュベーターで培養した。培養後、リポ多
糖を5ng/μLに調整したもの(以下、LPSと称す)を、24μL培地へ添加し、3
7℃、12時間、CO2インキュベーターで培養した。この方法により、COX−2に加
えて、COX−1、iNOSの誘導も調査した。
【0064】
(2)試験化合物の調整
所定の茶化合物を各40〜100μMの濃度で溶解した。溶媒に水(H2O)とジメチ
ルスルフォキシド(以下、DMSOと称す)を用いた。以下、この濃度に調整したサンプ
ルを試験化合物と称す。
【0065】
(3)試験細胞の培養
シャーレ(6mLサイズ)中、RAW264細胞の濃度が1x106セル数になるよう
調整した。これを予め37℃、21時間、CO2インキュベーターで培養した。培養後、
細胞をシャーレ(3mLサイズ)へ置床した。このときは、培地にFBS溶液を加えなか
った。引き続き、37℃、2時間半、CO2インキュベーターで培養した。培養後、調整
した試験化合物を添加し、37℃、30分間、CO2インキュベーターで培養した。これ
に、リポ多糖を5ng/μLに調整したもの(以下、LPSと称す)を、24μL培地へ
添加し、37℃、12時間、CO2インキュベーターで培養した。この方法により、CO
X−2に加えて、COX−1、iNOSの誘導も調査した。
【0066】
[実験3]細胞中のCOX−2発現蛋白の回収と検出法
(1)COX−2発現蛋白の回収
前記実験2(1)及び(3)で培養した細胞を回収した。回収した細胞を37℃、PB
S(KCl:0.02%、KH2PO4:0.02%、NaHPO4・12H2O:0.29%
、NaCl:0.8%の水溶液)で洗浄後、SDS試薬(1M Tris−HCl、pH
6.8を1.25mL;SDS(2%w/v)0.4g;Glycerol(10%)2
mL;1M DTT(50mM)1mL;bromophenol blue(0.1%
)0.02gを混合したもの)を20mL添加し、100℃、5分間煮沸加熱し、細胞中
のタンパク質を回収した。
【0067】
(2)COX−2発現蛋白の検出
前記(1)にて回収したタンパク質溶液を、COX−2の発現タンパク質を調べるため
には10μL、COX−1の発現タンパク質を調べるためには30μL、iNOSの発現
タンパク質を調べるためには37μLを電気泳動用ウェルにそれぞれ吸着させた。定電流
で電気泳動を行った。メンブランを活性化し、よく洗浄した後、トランスファー緩衝液に
浸積し、ゲル版と濾紙とを共に装着し、定電流でトランスファーした。回収したメンブラ
ンについてウェスタンブロットを行い、抗体反応を繰り返し行い、化学発光検出器によっ
てタンパク質を検出した。検出されたタンパク質について、Lumi Vision A
nalyzer 140を用いて、泳動画像を保存した。
【0068】
[実験4]茶化合物の抗炎症機能のスクリーニング
(1)4β−8結合を有するプロアントシアニジン類のCOX−2抑制効果
プロデルフィニジンB−2、プロデルフィニジンB−2 3,3’−ジ−O−ガレート
(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガロカテキン−3
−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)、エピガロカテ
キン−(4β−8)−エピカテキン−3−O−ガレート(4)(表1)について、COX
−2発現の抑制効果のスクリーニングを行った。その結果を図1に示す。図中、番号は化
合物番号を示す。また、LPSが「−」と標記されているものは、LPSを添加していな
いものであり、COX−2の発現が認められない。LPSが「+」と標記されているもの
は、LPSを添加したもので、COX−2が発現していることが分かる。「PDB2」は
、茶葉より単離したプロデルフィニジンB−2である。プロデルフィニジンB−2はLP
S誘導によるCOX−2発現を抑制しないことが分かる。プロデルフィニジンB−2 3
,3’−ジ−O−ガレート(1)が最も強く、次にエピガロカテキン−3−O−ガレート
−(4β−8)−エピカテキン−3−O−ガレート(3)の順で、COX−2の発現を抑
制していることが分かる。なお、5つのプロアントシアニジン類は、いずれもCOX−1
の発現を抑制しないことが分かる(図1)。
【0069】
(2)4α−8結合を有するプロアントシアニジン類のCOX−2抑制効果
プロシアニジンB−4、プロデルフィニジンB−4−3’−O−ガレート(5)、プロ
デルフィニジンB−4(6)、ガロカテキン−(4α−8)−エピカテキン(7)、カテ
キン−(4α−8)−エピガロカテキン(8)(表2)について、COX−2発現の抑制
効果のスクリーニングを行った。その結果を図2に示す。図中、番号は化合物番号を示す
。また、LPSが「−」と標記されているものは、LPSを添加していないものであり、
COX−2の発現が認められない。LPSが「+」と標記されているものは、LPSを添
加したもので、COX−2が発現していることが分かる。「PCB4」は、茶葉より単離
したプロシアニジンB−4である。プロシアニジンB−4はLPS誘導によるCOX−2
発現を抑制しないことが分かる。プロデルフィニジンB−4−3’−O−ガレート(5)
並びにプロデルフィニジンB−4(6)が最も強く、ガロカテキン−(4α−8)−エピ
カテキン(7)、カテキン−(4α−8)−エピガロカテキン(8)も同様に、COX−
2の発現を抑制していることが分かる(図2)。
【0070】
(3)ウーロンホモビスフラバン類のCOX−2抑制効果
ウーロンホモビスフラバンA(9)、モノデスガロイルウーロンホモビスフラバンA(
10)(表3)について、COX−2発現の抑制効果のスクリーニングを行った。その結
果を図3及び図4に示す。図中、番号は化合物番号を示す。また、LPSが「−」と標記
されているものは、LPSを添加していないものであり、COX−2の発現が認められな
い。LPSが「+」と標記されているものは、LPSを添加したもので、COX−2が発
現していることが分かる。図4中、「ST」は、茶葉より単離したストリクティニンであ
る。「TriG」は、茶葉より単離した1,4,6−トリ−O−ガロイル−β−D−グル
コースである。「pCQA」は、茶葉より単離したp−クマロイル−キナ酸である。「T
G」は、茶葉より単離したテオガリンである。[ST]、[TriG]、「pCQA」、
「TG」はLPS誘導によるCOX−2発現を抑制しないことが分かる。ウーロンホモビ
スフラバンA(9)、モノデスガロイルウーロンホモビスフラバンA(10)、共にCO
X−2の発現を抑制していることが分かる(図3及び図4)。
【0071】
(4)プルプロガリンのCOX−2抑制効果
プルプロガリン(14)(表4)について、COX−2発現の抑制効果のスクリーニン
グを行った。その結果を図5に示す。図中、番号は化合物番号を示す。また、LPSが「
−」と標記されているものは、LPSを添加していないものであり、COX−2の発現が
認められない。LPSが「+」と標記されているものは、LPSを添加したもので、CO
X−2が発現していることが分かる。図4中、「AsEC」は、茶葉より単離したアスコ
ルビン酸(−)−エピガロカテキンである。「Caf」は、茶葉より単離したカフェイン
である。「GA」は、茶葉より単離した没食子酸である。[AsEC]、[Caf]、「
GA」はLPS誘導によるCOX−2発現を抑制しないことが分かる。プルプロガリン(
14)はCOX−2の発現を抑制することが分かる(図5)。
【0072】
(5)その他茶ポリフェノール単量体のCOX−2抑制効果
(−)−エピガロカテキン3−O−ガレート、(−)−エピガロカテキン、(−)−エ
ピカテキン3−O−ガレート、(−)−エピカテキン、(+)−カテキン、(±)−ガロ
カテキン、(−)−エピカテキン3−O−(3‘−O−メチル)−ガレート、(−)−エ
ピガロカテキン3,5−ジ−O−ガレートについて、COX−2発現の抑制効果のスクリ
ーニングを行った。その結果、いずれのポリフェノールもCOX−2の発現を抑制しない
か、または、その効果はかなり弱いことが分かった。
【0073】
[実験5]4β−8結合を有するプロアントシアニジン類の抗炎症機能
(1)LPS誘発による細胞内iNOS産生の抑制効果
プロデルフィニジンB−2、プロデルフィニジンB−2 3,3’−ジ−O−ガレート
(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガロカテキン−3
−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)、エピガロカテ
キン−(4β−8)−エピカテキン−3−O−ガレート(4)(表1)の化合物について
、iNOS産生の抑制効果試験を行った。その結果を図6に示す。図中、番号は化合物番
号を示す。また、LPSが「−」と標記されているものは、LPSを添加していないもの
であり、iNOSの産生が認められない。LPSが「+」と標記されているものは、LP
Sを添加したもので、iNOSが産生されていることが分かる。「PDB2」は、茶葉よ
り単離したプロデルフィニジンB−2である。プロデルフィニジンB−2はLPS誘導に
よるiNOS産生を抑制しないことが分かる。プロデルフィニジンB−2 3,3’−ジ
−O−ガレート(1)及びエピガロカテキン−3−O−ガレート−(4β−8)−エピカ
テキン−3−O−ガレート(3)が、iNOS産生を抑制していることが分かる(図6)
。
【0074】
(2)LPS誘発による細胞内プロスタグランジンE2(PGE2)産生の抑制効果
プロデルフィニジンB−2、プロデルフィニジンB−2 3,3’−ジ−O−ガレート
(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガロカテキン−3
−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)、エピガロカテ
キン−(4β−8)−エピカテキン−3−O−ガレート(4)(表1)の化合物について
、PGE2産生の抑制効果試験を行った。その結果を図7に示す。図中、番号は化合物番
号を示す。また、LPSが「−」と標記されているものは、LPSを添加していないもの
であり、PGE2の産生が認められない。LPSが「+」と標記されているものは、LP
Sを添加したもので、PGE2が産生されていることが分かる。「PDB2」は、茶葉よ
り単離したプロデルフィニジンB−2である。プロデルフィニジンB−2はLPS誘導に
よるPGE2産生を抑制しないことが分かる。プロデルフィニジンB−2 3,3’−ジ
−O−ガレート(1)、プロデルフィニジンB−2 3’−O−ガレート(2)、エピガ
ロカテキン−3−O−ガレート−(4β−8)−エピカテキン−3−O−ガレート(3)
、エピガロカテキン−(4β−8)−エピカテキン−3−O−ガレート(4)は全て、P
GE2産生を抑制することが分かる(図7)。
【0075】
(3)プロデルフィニジンB−2 3,3’−ジ−O−ガレート(1)のPGE2産生
抑制効果の濃度的変化
プロデルフィニジンB−2 3,3’−ジ−O−ガレート(1)のPGE2産生抑制効
果について、濃度的変化を調査した。その結果を図8に示す。図中、LPSが「−」と標
記されているものは、LPSを添加していないものであり、PGE2の産生が認められな
い。LPSが「+」と標記されているものは、LPSを添加したもので、PGE2が産生
されていることが分かる。これにプロデルフィニジンB−2 3,3’−ジ−O−ガレー
ト(1)の12.5,25,50μMの各濃度で処理すると、PGE2の産生を強く抑制
することが分かる(図8)。
【0076】
[実験6]4α−8結合を有するプロアントシアニジン類の抗炎症機能
(1)プロデルフィニジンB−4 3’−O−ガレート(5)のLPS誘発によるCO
X−2の発現抑制並びに細胞内iNOS産生抑制効果の濃度的変化
プロデルフィニジンB−4 3’−O−ガレート(5)のCOX−2の発現抑制及びi
NOS産生抑制効果について、濃度的変化を調査した。その結果を図9に示す。図中、L
PSが「−」と標記されているものは、LPSを添加していないものであり、COX−2
の発現及びiNOSの産生が認められない。LPSが「+」と標記されているものは、L
PSを添加したもので、COX−2が発現し、また、iNOSが産生されていることが分
かる。これにプロデルフィニジンB−4 3’−O−ガレート(5)の25,50,75
,100μMの各濃度で処理すると、濃度依存的にCOX−2の発現及びiNOSの産生
を抑制することが分かる。なお、プロデルフィニジンB−4 3’−O−ガレート(5)
はCOX−1の発現を抑制しないことも分かる(図9)。
【0077】
(2)プロデルフィニジンB−4 3’−O−ガレート(5)のLPS誘発によるPG
E2産生抑制効果の濃度的変化
プロデルフィニジンB−4 3’−O−ガレート(5)のPGE2産生抑制効果につい
て、濃度的変化を調査した。その結果を図10に示す。図中、LPSは、LPS添加した
もので、PGE2が産生されていることが分かる。このLPS添加培地に、プロデルフィ
ニジンB−4 3’−O−ガレート(5)を25,50,75,100μMの各濃度で処
理すると、濃度依存的にPGE2の産生を抑制することが分かる(図10)。
【0078】
[実験7]プルプロガリン誘導体の抗炎症機能
テアフラビン3’−O−ガレート(11)、テアフラビン3,3’−ジ−O−ガレート
(12)、エピテアフラガリン3−O−ガレート(13)、プルプロガリン(14)(表
4)の化合物について、COX−2発現及びiNOS産生の抑制効果試験を行った。その
結果を図11に示す。図中、番号は化合物番号を示す。また、LPSが「−」と標記され
ているものは、LPSを添加していないものであり、COX−2の発現及びiNOSの産
生が認められない。LPSが「+」と標記されているものは、LPSを添加したもので、
COX−2が発現及びiNOSが産生していることが分かる。「PGC」は、プルプロガ
リンガルボン酸である。プロデルフィニジンB−2はLPS誘導によるCOX−2発現を
抑制しないことが分かる。テアフラビン3’−O−ガレート(11)、テアフラビン3,
3’−ジ−O−ガレート(12)、エピテアフラガリン3−O−ガレート(13)、プル
プロガリン(14)はCOX−2の発現及びiNOSの産生を抑制することが分かる(図
11)。
【0079】
[実験8]テアシネンシン類の抗炎症機能
(1)テアシネンシン類のCOX−2、COX−1発現抑制及びiNOS産生抑制
テアシネンシンA(15)、テアシネンシンB(16)、テアシネンシンD(17)、
テアシネンシンE(18)(表5)のCOX−2の発現抑制及びiNOS産生抑制効果に
ついて調査した。その結果を図12に示す。図中、LPSが「−」と標記されているもの
は、LPSを添加していないものであり、COX−2の発現及びiNOSの産生が認めら
れない。LPSが「+」と標記されているものは、LPSを添加したもので、COX−2
が発現し、また、iNOSが産生されていることが分かる。また図中、「TSS」とはテ
アシネンシン類であり、A〜Eの記号は、それぞれテアシネンシンA(15)、テアシネ
ンシンB(16)、テシネンシンC、テアシネンシンD(17)、テアシネンシンE(1
8)である。この結果、テアシネンシンA(15)及びテアシネンシンD(17)は強く
COX−2の発現及びiNOSの産生を抑制することが分かる。全ての化合物はCOX−
1を抑制しない(図12)。
【0080】
(2)テアシネンシンA(15)のLPS誘発によるCOX−2の発現抑制並びに細胞
内iNOS産生抑制効果の濃度的変化
テアシネンシンA(15)のCOX−2の発現抑制及びiNOS産生抑制効果について
、濃度的変化を調査した。その結果を図13に示す。図中、LPSが「−」と標記されて
いるものは、LPSを添加していないものであり、COX−2の発現及びiNOSの産生
が認められない。LPSが「+」と標記されているものは、LPSを添加したもので、C
OX−2が発現し、また、iNOSが産生されていることが分かる。これにテアシネンシ
ンA(15)の25,50,75,100μMの各濃度で処理すると、濃度依存的にCO
X−2の発現及びiNOSの産生を抑制することが分かる。なお、テアシネンシンA(1
5)はCOX−1の発現を抑制しないことも分かる(図13)。
【0081】
(3)LPS誘発によるPGE2産生抑制
テアシネンシンA(15)、テアシネンシンB(16)、テアシネンシンD(17)、
テアシネンシンE(18)(表5)について、PGE2産生の抑制効果試験を行った。そ
の結果を図14に示す。図中、番号は化合物番号を示す。また図中、LPSは、LPS添
加したもので、PGE2が産生されていることが分かる。このLPS添加培地に、各テア
シネンシン類を添加した結果、テアシネンシンA(15)、テアシネンシンB(16)、
テアシネンシンD(17)、テアシネンシンE(18)は、PGE2の産生を抑制するこ
とが分かる。「TSC」は、茶葉より単離したテアシネンシンCである。テアシネンシン
CはLPS誘導によるPGE2産生を抑制しないことが分かる(図14)。
【0082】
(4)テアシネンシンA(15)のLPS誘発によるPGE2産生抑制効果の濃度的変
化
テアシネンシンA(15)のPGE2産生抑制効果について、濃度的変化を調査した。
その結果を図15に示す。図中、LPSは、LPSを添加したもので、PGE2が産生さ
れていることが分かる。このLPS添加培地に、テアシネンシンA(15)の25,50
,75,100μMの各濃度で処理すると、濃度依存的にPGE2の産生を抑制すること
が分かる(図13)。
【産業上の利用可能性】
【0083】
本発明により、緑茶、烏龍茶、紅茶から分離された18種類の茶化合物がCOX−2の
発現及び/又はPGE2の産生抑制の作用を有することから、COX−2阻害剤、PGE
2阻害剤として利用可能である。
【特許請求の範囲】
【請求項1】
式(I):
【化1】

[式中、
R11およびR12は独立に−Hまたは−OHであり、
R13は−Hまたはガロイル基であり、
R14は
【化2】

で表される基(R15は−Hまたは−OHであり、R16は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(I)の2位及び3位は独立にR配置またはS配置であり、
式(I)の3位がR配置の場合には基R14は4位にβ結合により結合し、式(I)の
3位がS配置の場合には基R14は4位にα結合により結合する。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項2】
前記化合物がプロデルフィニジンB−2 3,3’−ジ−O−ガレート、プロデルフィ
ニジンB−2 3’−O−ガレート、エピガロカテキン−3−O−ガレート−(4β−8
)−エピカテキン−3−O−ガレート、エピガロカテキン−(4β−8)−エピカテキン
−3−O−ガレート、プロデルフィニジンB−4−3’−O−ガレート、プロデルフィニ
ジンB−4、ガロカテキン−(4α−8)−エピカテキン、またはカテキン−(4α−8
)−エピガロカテキンである請求項1記載の抗炎症剤。
【請求項3】
式(II):
【化3】

[式中、
R21およびR22は独立に−Hまたは−OHであり、
R23は−Hまたはガロイル基であり、
R24およびR25は独立に−Hまたは
【化4】

で表される基(R26は−Hまたは−OHであり、R27は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(II)の2位及び3位は独立にR配置またはS配置である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項4】
前記化合物がウーロンホモビスフラバンA、またはモノデスガロイルウーロンホモビス
フラバンAである請求項3記載の抗炎症剤。
【請求項5】
式(III):
【化5】

[式中、
R31は−Hまたは−OHであり、
R32およびR33は独立に−Hまたは
【化6】

で表される基(R34は−Hまたはガロイル基であり、*は結合位置を示す)である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項6】
前記化合物がテアフラビン3’−O−ガレート、テアフラビン3,3’−ジ−O−ガレ
ート、エピテアフラガリン3−O−ガレート、またはプルプロガリンである請求項5記載
の抗炎症剤。
【請求項7】
式(IV):
【化7】

[式中、
R41およびR42は独立に−Hまたは−OHであり、
R43は−Hまたはガロイル基であり、
R44は
【化8】

で表される基(R45は−Hまたは−OHであり、R46は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(IV)の2位及び3位は独立にR配置またはS配置であり、
式(IV)のフラバン骨格と基R44との間で生じる立体配置はR配置であってもS配
置であってもよい。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項8】
前記化合物がテアシネンシンA、テアシネンシンB、テアシネンシンD、またはテアシ
ネンシンEである請求項7記載の抗炎症剤。
【請求項9】
プロスタグランジン生合成阻害剤である請求項1〜8のいずれか1項記載の抗炎症剤。
【請求項10】
シクロオキシゲナーゼ−2(COX−2)阻害剤である請求項1〜6のいずれか1項記
載の抗炎症剤。
【請求項11】
前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(III)
で表される化合物、および前記式(IV)で表される化合物からなる群から選択される少
なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物が人為的に
添加された、抗炎症作用を有する飲食品。
【請求項12】
前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(III)
で表される化合物、および前記式(IV)で表される化合物からなる群から選択される少
なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物を含有し、
抗炎症作用を有する旨の表示が付された、抗炎症作用を有する飲食品。
【請求項13】
不発酵茶、半発酵茶、強発酵茶または後発酵茶である請求項11または12記載の飲食
品。
【請求項1】
式(I):
【化1】

[式中、
R11およびR12は独立に−Hまたは−OHであり、
R13は−Hまたはガロイル基であり、
R14は
【化2】

で表される基(R15は−Hまたは−OHであり、R16は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(I)の2位及び3位は独立にR配置またはS配置であり、
式(I)の3位がR配置の場合には基R14は4位にβ結合により結合し、式(I)の
3位がS配置の場合には基R14は4位にα結合により結合する。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項2】
前記化合物がプロデルフィニジンB−2 3,3’−ジ−O−ガレート、プロデルフィ
ニジンB−2 3’−O−ガレート、エピガロカテキン−3−O−ガレート−(4β−8
)−エピカテキン−3−O−ガレート、エピガロカテキン−(4β−8)−エピカテキン
−3−O−ガレート、プロデルフィニジンB−4−3’−O−ガレート、プロデルフィニ
ジンB−4、ガロカテキン−(4α−8)−エピカテキン、またはカテキン−(4α−8
)−エピガロカテキンである請求項1記載の抗炎症剤。
【請求項3】
式(II):
【化3】

[式中、
R21およびR22は独立に−Hまたは−OHであり、
R23は−Hまたはガロイル基であり、
R24およびR25は独立に−Hまたは
【化4】

で表される基(R26は−Hまたは−OHであり、R27は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(II)の2位及び3位は独立にR配置またはS配置である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項4】
前記化合物がウーロンホモビスフラバンA、またはモノデスガロイルウーロンホモビス
フラバンAである請求項3記載の抗炎症剤。
【請求項5】
式(III):
【化5】

[式中、
R31は−Hまたは−OHであり、
R32およびR33は独立に−Hまたは
【化6】

で表される基(R34は−Hまたはガロイル基であり、*は結合位置を示す)である。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項6】
前記化合物がテアフラビン3’−O−ガレート、テアフラビン3,3’−ジ−O−ガレ
ート、エピテアフラガリン3−O−ガレート、またはプルプロガリンである請求項5記載
の抗炎症剤。
【請求項7】
式(IV):
【化7】

[式中、
R41およびR42は独立に−Hまたは−OHであり、
R43は−Hまたはガロイル基であり、
R44は
【化8】

で表される基(R45は−Hまたは−OHであり、R46は−Hまたはガロイル基であり
、*は結合位置を示す)であり、
式(IV)の2位及び3位は独立にR配置またはS配置であり、
式(IV)のフラバン骨格と基R44との間で生じる立体配置はR配置であってもS配
置であってもよい。]
で表される化合物または薬学的に許容されるその塩もしくは溶媒和物を有効成分として含
有する抗炎症剤。
【請求項8】
前記化合物がテアシネンシンA、テアシネンシンB、テアシネンシンD、またはテアシ
ネンシンEである請求項7記載の抗炎症剤。
【請求項9】
プロスタグランジン生合成阻害剤である請求項1〜8のいずれか1項記載の抗炎症剤。
【請求項10】
シクロオキシゲナーゼ−2(COX−2)阻害剤である請求項1〜6のいずれか1項記
載の抗炎症剤。
【請求項11】
前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(III)
で表される化合物、および前記式(IV)で表される化合物からなる群から選択される少
なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物が人為的に
添加された、抗炎症作用を有する飲食品。
【請求項12】
前記式(I)で表される化合物、前記式(II)で表される化合物、前記式(III)
で表される化合物、および前記式(IV)で表される化合物からなる群から選択される少
なくとも1種の化合物または飲食品として許容されるその塩もしくは溶媒和物を含有し、
抗炎症作用を有する旨の表示が付された、抗炎症作用を有する飲食品。
【請求項13】
不発酵茶、半発酵茶、強発酵茶または後発酵茶である請求項11または12記載の飲食
品。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2012−21020(P2012−21020A)
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願番号】特願2011−218833(P2011−218833)
【出願日】平成23年10月3日(2011.10.3)
【分割の表示】特願2005−315406(P2005−315406)の分割
【原出願日】平成17年10月28日(2005.10.28)
【出願人】(504258527)国立大学法人 鹿児島大学 (284)
【Fターム(参考)】
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願日】平成23年10月3日(2011.10.3)
【分割の表示】特願2005−315406(P2005−315406)の分割
【原出願日】平成17年10月28日(2005.10.28)
【出願人】(504258527)国立大学法人 鹿児島大学 (284)
【Fターム(参考)】
[ Back to top ]

