抗炎症剤
【課題】 より安全で抗炎症効果に優れた抗炎症剤を提供する。
【解決手段】 アシタバ黄汁から分離されるイソババカルコン、キサントアンゲロール、4‐ハイドロキシデリシン、キサントアンゲロールF又は2´´‐ハイドロキシキサントアンゲロールIであり、ラセルピチン、イソラセルピチン、セリニジン、プテリキシン、3´‐セネシオイルケーラクトン又は4´‐セネシオイルケーラクトン、プロストラトールF又はマンデレアフラバノンBの各化合物を抗炎症剤として用いる。特に、4‐ハイドロキシデリシンは抗炎症効果に極めて優れる。
【解決手段】 アシタバ黄汁から分離されるイソババカルコン、キサントアンゲロール、4‐ハイドロキシデリシン、キサントアンゲロールF又は2´´‐ハイドロキシキサントアンゲロールIであり、ラセルピチン、イソラセルピチン、セリニジン、プテリキシン、3´‐セネシオイルケーラクトン又は4´‐セネシオイルケーラクトン、プロストラトールF又はマンデレアフラバノンBの各化合物を抗炎症剤として用いる。特に、4‐ハイドロキシデリシンは抗炎症効果に極めて優れる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はカルコン類化合物、クマリン類化合物、フラバノン類化合物を有効成分として含有する抗炎症剤に関する。
【背景技術】
【0002】
炎症は、主に外界の刺激によって誘起される生体防御反応であり、血管拡張、血管透過性亢進、白血球遊走、結合組織増殖などの組織反応が、キニン、アミン、ペプチド、エイコサノイドなどの化学的メディエーターによって誘起され、発赤、発熱、腫脹、疼痛などの炎症症状が発現する。抗炎症剤は、このような疾病を軽減又は治癒する薬物であり、ステロイド系抗炎症剤や非ステロイド系抗炎症剤など作用の異なる薬剤が知られている。
【0003】
ところで、アシタバ(Angelica keiskei)は、セリ料の植物であり、房総半島、伊豆半島、三浦半島、伊豆諸島、大島、八丈島などに自生している。茎、葉、根に多量の黄色物質を含んでおり、その破切面から黄汁が滲出する。アシタバは、黄汁の主成分であるカルコン類のほか、クマリン類やフラバノン類を含み、これらの化合物には抗菌作用、抗潰瘍、胃酸分泌抑制作用などの種々の健康効果が報告されている(非特許文献1参照)。
【非特許文献1】馬場きみ江、谷口雅彦著、「アシタバの健康効果と利用法」、Food Style、2003年、21巻、68−76頁
【発明の開示】
【発明が解決しようとする課題】
【0004】
上記のように種々の抗炎症剤が提供されるものの、ステロイド系抗炎症剤は効果に優れる一方で、副作用が強い。また、一方非ステロイド系抗炎症剤は緩和な抗炎症作用を示す場合が多く全ての炎症に有効であるとはいえない。このため、より副作用が少なく、かつ、抗炎症効果に優れた抗炎症剤の開発が求められる。
また、アシタバ成分について抗炎症効果は報告されていない。
本発明は上述の課題に鑑みてなされたものであり、安全で抗炎症効果に優れた抗炎症剤を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記課題を解決するために、本発明の請求項1による抗炎症剤は、下記一般式(A)又は下記一般式(B)で示されるカルコン類化合物、下記一般式(C)又は下記構造式(D)で示されるクマリン類化合物、及び、下記一般式(E)で示されるフラバノン類化合物のうちの少なくとも1種を有効成分として含有することを特徴とする。
一般式(A):
【0006】
【化1】

【0007】
(但し、式中RはOH又はOCH3であり、R1は下記構造式(1)〜下記構造式(4)に示すもののうちのいずれかである。)
【0008】
【化2】

【0009】
【化3】

【0010】
一般式(B):
【0011】
【化4】

【0012】
(但し、式中R2はOH又はOCH3であり、R3はH又はOHであり、R4はCH3又はCH2CH2CHC(CH3)2である。)
一般式(C):
【0013】
【化5】

【0014】
(但し、式中R5及びR6は、H、OH、下記構造式(5)及び下記構造式(6)に示されるもののうちのいずれかであり、R5及びR6が同一であってもよいし、異なっていてもよい。)
【0015】
【化6】

【0016】
構造式(D):
【0017】
【化7】

【0018】
一般式(E):
【0019】
【化8】

【0020】
(式中、R7はH、OH及びOCH3のうちのいずれかであり、R8はOH又はOCH3であり、R9は前記構造式(1)又は前記構造式(2)に示すものであり、R10はH又は前記構造式(2)に示すものである。)
なお、上述した本発明の化合物は、上記構造式に限定されず、例えば、医学的に使用され薬理学的に許容される各化合物の塩も含むものである。このような塩として、例えば、ナトリウム塩、カリウム塩、リチウム塩、のようなアルカリ金属塩、カルシウム塩、マグネシウム塩、のようなアルカリ土類金属塩、アルミニウム塩、鉄塩、亜鉛塩、銅塩、ニッケル塩、コバルト塩等の金属塩や、アンモニウム塩のような無機塩が挙げられる。また、例えば、本発明の化合物が、大気中に放置されたり、または再結晶することにより、水分を吸収し、吸着水が付着したり、水和物を形成する場合がある。本発明にはこのような水和物も含まれる。
【0021】
また、上記化合物は全て、アシタバから公知の方法により分離及び精製が可能である(後述の非特許文献2〜7参照)。
本発明の請求項2による抗炎症剤は、請求項1において、
前記カルコン類化合物が、イソババカルコン、キサントアンゲロール、4−ハイドロキシデリシン、キサントアンゲロールF又は2´´−ハイドロキシキサントアンゲロールIであり、
【0022】
前記クマリン類化合物が、ラセルピチン、イソラセルピチン、セリニジン、プテリキシン、3´−セネシオイルケーラクトン又は4´−セネシオイルケーラクトンであり、
前記フラバノン類化合物が、プロストラトールF又はマンデレアフラバノンBであることを特徴とする。
本発明の請求項3による抗炎症剤は、請求項1又は2において、前記カルコン類化合物、前記クマリン類化合物及び前記フラバノン類化合物がアシタバから抽出されたものであることを特徴とする。
【発明の効果】
【0023】
本発明の抗炎症剤は、抗炎症効果に優れる。
【発明を実施するための最良の形態】
【0024】
次に、図面を参照して本発明の実施の形態について説明する。
本発明に係るカルコン類化合物、クマリン類化合物及びフラバノン類化合物は、アシタバの茎部を切断したときに切断面から滲出する黄汁、アシタバの茎部や根茎部からの抽出溶媒に含まれる。
黄汁は、切断面からの回収後、必要に応じてろ過、加熱殺菌などの処理を行う。加熱殺菌処理としては、例えば、黄汁が入った容器を熱湯中に入れ、容器内の黄汁の温度が熱湯の温度と同じになってから数時間放置してもよいし、オートクレープで処理してもよい。
【0025】
抽出溶媒としては、低級アルコール、例えば、メタノール、エタノール、n‐プロパノール、イソプロパノール及びこれらの水性媒体やエーテルを挙げることができる。これらは単独で用いてもよいし、混合してもよい。好ましくは、メタノール、エタノール又はエーテルである。また、酢酸エチルやアセトンなども好ましい抽出溶媒である。
本発明に係る化合物は、上記黄汁又は抽出溶媒から分離精製することで得られる。
【0026】
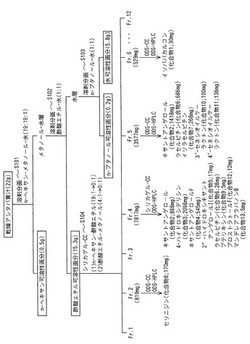
以下、アシタバ黄汁から5種のカルコン類化合物、6種のクマリン類化合物及び2種のフラバノン類化合物を分離精製する方法の一例を、図1を用いて説明する。
乾燥アシタバ黄汁(22g)は、先ずステップS101において、n‐ヘキサン−メタノール−水(19:19:1)で溶剤分画を行い、n‐ヘキサン可溶性画分(回収量:0.5g)とメタノール−水層を得た。
【0027】
次に、ステップS102において、ステップS101で得たメタノール−水層について、酢酸エチル−水(1:1)で溶剤分画を行い、酢酸エチル可溶性画分(回収量:15.3g;黄色を示している)と水層を得た。この水層は、ステップS103において、n‐ブタノール−水で溶剤分画を行い、n‐ブタノール可溶性画分(回収量:0.2g)と水可溶性画分(回収量:5.8g)に分画した。ステップS104においては、ステップS102において得た酢酸エチル可溶性画分を、シリカゲル−カラムクロマトグラフィー(以下、カラムクロマトグラフィーを「CC」と略す。)[シリカゲル使用量:500g、溶出液:n‐ヘキサン−酢酸エチル(19:1→0:1)、酢酸エチル−メタノール(4:1→0:1)]により12の画分(フラクション1〜12)に分画した。
【0028】
上記画分のうちフラクション(以下、「Fr.」と略す。)2(回収量:819mg)はオクタデシルシリカ(以下、「ODS」と略す。)−CC[ODS使用量:38g、溶出液:メタノール−水(7:3→1:0)]、続く分取ODS−高速液体クロマトグラフィー(以下、「HPLC」と略す。)により、セリニジン(化合物8;回収量:170mg)(非特許文献2)を得た。
【0029】
一方、Fr.4(回収量:7817mg)からはシリカゲル−CC、続く分取ODS−HPLCにより、キサントアンゲロール(化合物2;回収量:868mg)(非特許文献3)、4‐ハイドロキシデリシン(化合物3;回収量:2096mg)(非特許文献3)、キサントアンゲロールF(化合物4;回収量:3545mg)(非特許文献4)、2´´‐ハイドロキシキサントアンゲロールI(化合物5;回収量:17mg)(非特許文献4)、ラセルピチン(化合物6;回収量:28mg)(非特許文献2)、プテリキシン(化合物9;回収量:5mg)(非特許文献5)、プロストラトールF(化合物12;回収量:12mg)(非特許文献6)、及び、マンデレアフラバノンB(化合物13;回収量:5mg)(非特許文献7)を得た。Fr.5(回収量:3577mg)からは、ODS−CCによりキサントアンゲロール(化合物2;回収量:1418mg)を、さらにODS−CC及びODS−HPLCにより、ラセルピチン(化合物6;回収量:686mg)、イソラセルピチン(化合物7;回収量:268mg)(非特許文献2)、3´‐セネシオイルケーラクトン(化合物10;回収量:100mg)(非特許文献2)及び4´‐セネシオイルケーラクトン(化合物11;回収量:136mg)(非特許文献2)を得た。また、Fr.6(回収量:529mg)からは、ODS−CC及びODS−HPLCにより、イソババカルコン(化合物1;回収量:30mg)(非特許文献6)を単離した。化合物1〜化合物13の構造を以下に示す。
[カルコン類化合物:化合物1〜化合物5]
一般式(A)
【0030】
【化9】

【0031】
式中のR及びR1と、各化合物と、の対応は以下の通りである。
化合物1:R=OH、R1=Pn(Pnは前記構造式(1)に示すプレニル基、以下同じ)
化合物2:R=OH、R1=Gn(Gnは前記構造式(2)に示すゲラニル基、以下同じ)
化合物3:R=OCH3、R1=Pn
化合物4:R=OCH3、R1=Gn
一般式(B)
【0032】
【化10】

【0033】
式中のR2、R3及びR4と化合物5との対応は以下の通りである。
化合物5:R2=OCH3、R3=H、R4=CH3
[クマリン類化合物:化合物6〜化合物11]
一般式(7)
【0034】
【化11】

【0035】
式中のR5及びR6と各化合物との対応は以下の通りである。
化合物6:R5=OH、R6=O‐Ag(Agは下記構造式(8)に示すアンゲロイル基、以下同じ)
化合物7:R5=O‐Ag、R6=OH
化合物8:R5=O‐Ag、R6=H
化合物9:R5=O‐COCH3、R6=O‐Ag
化合物10:R5=O‐Sn(Snは下記構造式(9)に示すセネシオイル基、以下同じ)、R6=OH
化合物11:R5=OH、R6=O‐Sn
アンゲロイル基及びセネシオイル基を以下に示す。
【0036】
【化12】

【0037】
[フラバノン類化合物:化合物12及び化合物13]
一般式(10)
【0038】
【化13】

【0039】
式中のR7、R8、R9及びR10と各化合物との対応は以下の通りである。
化合物12:R7=OH、R8=OH、R9=Gn、R10=H
化合物13:R7=OH、R8=OCH3、R9=Pn、R10=H
ここで、化合物1〜化合物13は、全て既出文献記載の化合物であり、それらの同定は1H−NMRスペクトル及びMSスペクトルの文献値との比較により行った。なお、当該文献は上記のそれぞれの化合物の名称の後に記載した。
【0040】
[非特許文献2] T.M.Swager、J.H.CadellinaII著、Phytochemistry、24巻、805−813頁(1985)
[非特許文献3] K.Baba、K.Nakata、M.Taniguchi、T.Kido、M.Kozawa著、Phytochemistry、29巻、3907−3910頁(1990)
[非特許文献4] 小澤貢、森田伸子、馬場きみ江、秦清之著、薬学雑誌、98巻、210−214頁(1978)
[非特許文献5] I.S.Chen、C.T.Chang、W.S.Sheen、C.M.Teng、I.L.Tsai、C.Y.Duh、F.N.Ko著、Phytochemistry、41巻、525−530頁(1996)
[非特許文献6] M.Iinuma、M.Ohyama、T.Tanaka著、Phytochemistry、38巻、539−543頁(1995)
[非特許文献7] E.Venkata Rao、P.Sridhar、Y.Rajendra Prasad著、Phytochemistry、46巻、1271−1274頁(1997)
【0041】
上記本発明に係る化合物は、抗炎症剤として、医薬品、食品などに添加し、あるいは、主成分として配合することができる。医薬品として用いる場合には、適当な医薬用の担体又は希釈剤と組み合わせて医薬とすることができ、通常の如何なる方法によっても製剤化でき、経口又は非経口投与するための固体、半固体又は液体の剤形に処方することができる。処方にあたっては、他の医薬活性成分との配合剤としてもよい。例えば、日本薬局方に記載されている各種製剤、即ち、錠剤、丸剤、カプセル剤、顆粒剤、散剤、乾燥エキス剤、トローチ剤等の内用固形製剤、流エキス剤、エリキシル剤、酒精剤、シロップ剤、リモナーデ剤等の内用液剤、チンキ剤、リニメント剤等の外用液剤、硬膏剤、軟膏剤、バップ剤等の外用剤などに製剤化できる。また、投与可能であるならば、吸入剤、エアゾール剤、注射剤、点眼剤、座剤等にも用途に応じて製剤化してもよい。
【0042】
医薬品に配合した本発明に係る化合物の投与量は、その目的、投与対象者により異なるが、成人の体重1kgに対し、経口投与の場合は、10〜100mg/日、非経口投与の場合は、1〜20mg/日であることが好ましい。
また、抗炎症剤を含む食品の形態は特に限定されず、上記医薬品と同様の形態であってもよく、さらに本発明に係る化合物、あるいは、本発明に係る化合物を含む材料(アシタバ黄汁、アシタバ成分含有粉末など)を食品原料に加えて、種々の食品の形態にされる。
【0043】
例えば、上記本発明に係る化合物、あるいは、本発明に係る化合物を含む材料を飲料に配合するか、あるいはビスケットのような固形の食品に配合して健康食品あるいは機能性食品などとして提供することができる。本発明に係る化合物、あるいは、本発明に係る化合物を含む材料を用いて各種食品を製造するには、必要に応じて、油脂、エタノール、プロピレングリコール、グリセリンなどの希釈剤、アラビアガム、デキストリンなどのバインダー、安定剤、保存料などが適宜用いられる。
上記食品には、通常、成人の体重1kgに対し、本発明に係る化合物が、0.1〜10mg/日の割合で摂取されるように配合することが好ましい。
【実施例】
【0044】
次に、本発明の効果を確認すべく試験を行ったので説明する。
本試験では、TPA(12‐O‐tetradecanoylphorbol‐13‐acetate)が誘発する炎症に対する抑制効果を確認した。
(1)使用動物:7週齢のICR系雌性マウス(日本エスエルシー(株))をSPF(Specific Pathogen Free)室で室温22〜23度、湿度50±5%、照明8時〜20時の条件で飼育した。
【0045】
(2)被験物質:乾燥アシタバ黄汁、及び、図1に示す黄汁のn‐ヘキサン可溶性画分、酢酸エチル可溶性画分、n‐ブタノール可溶性画分及び水可溶性画分の各画分を被験エキスとした。また、本発明に係る上記化合物1〜化合物13についても、酢酸エチル可溶性画分から上記のようにして単離して被験化合物とした。
(3)被験溶液の調製:被験エキス及び被験化合物はクロロホルム−メタノール(体積比1:1)混液に溶解し、被験溶液を調製した。なお、n‐ブタノール可溶性画分及び水可溶性画分は、メタノール−水(体積比1:1)混液に溶解し、被験溶液を調製した。また、TPAはアセトンに溶解してTPA溶液とした。
【0046】
(4)試験方法:まずマウスの右耳の内外耳殻に被験物質を塗布し、その30分後に同様に1μgのTPAを塗布した。そして、最高腫脹時であるTPA塗布の6時間後に耳殻腫脹サイズをシックネスゲージで測定した。各被験物質につき4〜6耳殻に実施した。
(5)試験1:被験エキスを1mg投与し、TPA塗布後の耳殻腫脹サイズの平均値を測定した。そして、その平均値を、被験エキスを投与せずにTPAを塗布した場合における耳殻腫脹サイズを100(%)、TPAを投与しない場合を0(%)とした場合の相対値に変換し、マウス耳殻炎症抑制率を算出した。結果を表1に示す。
【0047】
【表1】

【0048】
表1に示すように、乾燥黄汁に炎症抑制効果があること(抑制率66%)が確認された。また、溶剤分画物では、酢酸エチル可溶性画分に抑制率74%と、強い炎症抑制効果が確認された。図1にも示したように、酢酸エチル可溶性画分は黄汁成分全体の約70質量%を占めており、黄汁の活性成分の大部分は酢酸エチル画分に含まれると見なされた。従って、酢酸エチル画分成分について続いて下記のように炎症抑制効果を検討した。
(7)試験2:各被験化合物を種々の量で投与し、TPA塗布後の耳殻腫脹サイズの平均値を測定した。そして、上記平均値が、被験化合物を投与せずにTPA塗布した場合における耳殻腫脹サイズの50%となる場合の被験化合物の投与量、すなわち50%抑制投与量(ID50)を算出した。この算出はプロビット法に従った。結果を表2に示す。
【0049】
【表2】

【0050】
表2に示すように、13種の化合物の全てが抗炎症効果を持つことが確認された。13種の化合物のうち、2´´‐ハイドロキシキサントアンゲロール(化合物5;ID50=463μg/耳殻)を除く12種の化合物の抑制率はID50=68〜317μg/耳殻であり、合成消炎剤であるインドメタシン(ID50=300μg/耳殻)に匹敵するか、あるいはそれよりも高い抑制効果を示した。
【0051】
特に、2種の化合物、4‐ハイドロキシデリシン(化合物3;ID50=68μg/耳殻)及びプロストラトールF(化合物12;ID50=92μg/耳殻)は、TPA誘発炎症に対して極めて高い抑制効果を示した。なお、本試験において最も優れた効果が確認された4‐ハイドロキシデリシンは、従来、炎症反応を媒介する起炎物質の1つであるヒスタミンの遊離抑制作用確認試験においてヒスタミンの遊離抑制作用が確認されず、抗炎症効果がないと考えられていた化合物である(中田功二、馬場きみ江著、Natural Medicines、55巻、32−34頁参照)。さらに、4‐ハイドロキシデリシンは、図1にも示すようにキサントアンゲロールとならび、酢酸エチル画分から大量に回収される化合物であり、アシタバを原料とすることで低コストで実用的な量の製造が可能であり、製造的な観点から見ても優れていることが確認された。
【図面の簡単な説明】
【0052】
【図1】抗炎症作用を有する本発明に係る化合物のアシタバ黄汁からの分離を説明する図である。
【技術分野】
【0001】
本発明はカルコン類化合物、クマリン類化合物、フラバノン類化合物を有効成分として含有する抗炎症剤に関する。
【背景技術】
【0002】
炎症は、主に外界の刺激によって誘起される生体防御反応であり、血管拡張、血管透過性亢進、白血球遊走、結合組織増殖などの組織反応が、キニン、アミン、ペプチド、エイコサノイドなどの化学的メディエーターによって誘起され、発赤、発熱、腫脹、疼痛などの炎症症状が発現する。抗炎症剤は、このような疾病を軽減又は治癒する薬物であり、ステロイド系抗炎症剤や非ステロイド系抗炎症剤など作用の異なる薬剤が知られている。
【0003】
ところで、アシタバ(Angelica keiskei)は、セリ料の植物であり、房総半島、伊豆半島、三浦半島、伊豆諸島、大島、八丈島などに自生している。茎、葉、根に多量の黄色物質を含んでおり、その破切面から黄汁が滲出する。アシタバは、黄汁の主成分であるカルコン類のほか、クマリン類やフラバノン類を含み、これらの化合物には抗菌作用、抗潰瘍、胃酸分泌抑制作用などの種々の健康効果が報告されている(非特許文献1参照)。
【非特許文献1】馬場きみ江、谷口雅彦著、「アシタバの健康効果と利用法」、Food Style、2003年、21巻、68−76頁
【発明の開示】
【発明が解決しようとする課題】
【0004】
上記のように種々の抗炎症剤が提供されるものの、ステロイド系抗炎症剤は効果に優れる一方で、副作用が強い。また、一方非ステロイド系抗炎症剤は緩和な抗炎症作用を示す場合が多く全ての炎症に有効であるとはいえない。このため、より副作用が少なく、かつ、抗炎症効果に優れた抗炎症剤の開発が求められる。
また、アシタバ成分について抗炎症効果は報告されていない。
本発明は上述の課題に鑑みてなされたものであり、安全で抗炎症効果に優れた抗炎症剤を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記課題を解決するために、本発明の請求項1による抗炎症剤は、下記一般式(A)又は下記一般式(B)で示されるカルコン類化合物、下記一般式(C)又は下記構造式(D)で示されるクマリン類化合物、及び、下記一般式(E)で示されるフラバノン類化合物のうちの少なくとも1種を有効成分として含有することを特徴とする。
一般式(A):
【0006】
【化1】

【0007】
(但し、式中RはOH又はOCH3であり、R1は下記構造式(1)〜下記構造式(4)に示すもののうちのいずれかである。)
【0008】
【化2】

【0009】
【化3】

【0010】
一般式(B):
【0011】
【化4】

【0012】
(但し、式中R2はOH又はOCH3であり、R3はH又はOHであり、R4はCH3又はCH2CH2CHC(CH3)2である。)
一般式(C):
【0013】
【化5】

【0014】
(但し、式中R5及びR6は、H、OH、下記構造式(5)及び下記構造式(6)に示されるもののうちのいずれかであり、R5及びR6が同一であってもよいし、異なっていてもよい。)
【0015】
【化6】

【0016】
構造式(D):
【0017】
【化7】

【0018】
一般式(E):
【0019】
【化8】

【0020】
(式中、R7はH、OH及びOCH3のうちのいずれかであり、R8はOH又はOCH3であり、R9は前記構造式(1)又は前記構造式(2)に示すものであり、R10はH又は前記構造式(2)に示すものである。)
なお、上述した本発明の化合物は、上記構造式に限定されず、例えば、医学的に使用され薬理学的に許容される各化合物の塩も含むものである。このような塩として、例えば、ナトリウム塩、カリウム塩、リチウム塩、のようなアルカリ金属塩、カルシウム塩、マグネシウム塩、のようなアルカリ土類金属塩、アルミニウム塩、鉄塩、亜鉛塩、銅塩、ニッケル塩、コバルト塩等の金属塩や、アンモニウム塩のような無機塩が挙げられる。また、例えば、本発明の化合物が、大気中に放置されたり、または再結晶することにより、水分を吸収し、吸着水が付着したり、水和物を形成する場合がある。本発明にはこのような水和物も含まれる。
【0021】
また、上記化合物は全て、アシタバから公知の方法により分離及び精製が可能である(後述の非特許文献2〜7参照)。
本発明の請求項2による抗炎症剤は、請求項1において、
前記カルコン類化合物が、イソババカルコン、キサントアンゲロール、4−ハイドロキシデリシン、キサントアンゲロールF又は2´´−ハイドロキシキサントアンゲロールIであり、
【0022】
前記クマリン類化合物が、ラセルピチン、イソラセルピチン、セリニジン、プテリキシン、3´−セネシオイルケーラクトン又は4´−セネシオイルケーラクトンであり、
前記フラバノン類化合物が、プロストラトールF又はマンデレアフラバノンBであることを特徴とする。
本発明の請求項3による抗炎症剤は、請求項1又は2において、前記カルコン類化合物、前記クマリン類化合物及び前記フラバノン類化合物がアシタバから抽出されたものであることを特徴とする。
【発明の効果】
【0023】
本発明の抗炎症剤は、抗炎症効果に優れる。
【発明を実施するための最良の形態】
【0024】
次に、図面を参照して本発明の実施の形態について説明する。
本発明に係るカルコン類化合物、クマリン類化合物及びフラバノン類化合物は、アシタバの茎部を切断したときに切断面から滲出する黄汁、アシタバの茎部や根茎部からの抽出溶媒に含まれる。
黄汁は、切断面からの回収後、必要に応じてろ過、加熱殺菌などの処理を行う。加熱殺菌処理としては、例えば、黄汁が入った容器を熱湯中に入れ、容器内の黄汁の温度が熱湯の温度と同じになってから数時間放置してもよいし、オートクレープで処理してもよい。
【0025】
抽出溶媒としては、低級アルコール、例えば、メタノール、エタノール、n‐プロパノール、イソプロパノール及びこれらの水性媒体やエーテルを挙げることができる。これらは単独で用いてもよいし、混合してもよい。好ましくは、メタノール、エタノール又はエーテルである。また、酢酸エチルやアセトンなども好ましい抽出溶媒である。
本発明に係る化合物は、上記黄汁又は抽出溶媒から分離精製することで得られる。
【0026】
以下、アシタバ黄汁から5種のカルコン類化合物、6種のクマリン類化合物及び2種のフラバノン類化合物を分離精製する方法の一例を、図1を用いて説明する。
乾燥アシタバ黄汁(22g)は、先ずステップS101において、n‐ヘキサン−メタノール−水(19:19:1)で溶剤分画を行い、n‐ヘキサン可溶性画分(回収量:0.5g)とメタノール−水層を得た。
【0027】
次に、ステップS102において、ステップS101で得たメタノール−水層について、酢酸エチル−水(1:1)で溶剤分画を行い、酢酸エチル可溶性画分(回収量:15.3g;黄色を示している)と水層を得た。この水層は、ステップS103において、n‐ブタノール−水で溶剤分画を行い、n‐ブタノール可溶性画分(回収量:0.2g)と水可溶性画分(回収量:5.8g)に分画した。ステップS104においては、ステップS102において得た酢酸エチル可溶性画分を、シリカゲル−カラムクロマトグラフィー(以下、カラムクロマトグラフィーを「CC」と略す。)[シリカゲル使用量:500g、溶出液:n‐ヘキサン−酢酸エチル(19:1→0:1)、酢酸エチル−メタノール(4:1→0:1)]により12の画分(フラクション1〜12)に分画した。
【0028】
上記画分のうちフラクション(以下、「Fr.」と略す。)2(回収量:819mg)はオクタデシルシリカ(以下、「ODS」と略す。)−CC[ODS使用量:38g、溶出液:メタノール−水(7:3→1:0)]、続く分取ODS−高速液体クロマトグラフィー(以下、「HPLC」と略す。)により、セリニジン(化合物8;回収量:170mg)(非特許文献2)を得た。
【0029】
一方、Fr.4(回収量:7817mg)からはシリカゲル−CC、続く分取ODS−HPLCにより、キサントアンゲロール(化合物2;回収量:868mg)(非特許文献3)、4‐ハイドロキシデリシン(化合物3;回収量:2096mg)(非特許文献3)、キサントアンゲロールF(化合物4;回収量:3545mg)(非特許文献4)、2´´‐ハイドロキシキサントアンゲロールI(化合物5;回収量:17mg)(非特許文献4)、ラセルピチン(化合物6;回収量:28mg)(非特許文献2)、プテリキシン(化合物9;回収量:5mg)(非特許文献5)、プロストラトールF(化合物12;回収量:12mg)(非特許文献6)、及び、マンデレアフラバノンB(化合物13;回収量:5mg)(非特許文献7)を得た。Fr.5(回収量:3577mg)からは、ODS−CCによりキサントアンゲロール(化合物2;回収量:1418mg)を、さらにODS−CC及びODS−HPLCにより、ラセルピチン(化合物6;回収量:686mg)、イソラセルピチン(化合物7;回収量:268mg)(非特許文献2)、3´‐セネシオイルケーラクトン(化合物10;回収量:100mg)(非特許文献2)及び4´‐セネシオイルケーラクトン(化合物11;回収量:136mg)(非特許文献2)を得た。また、Fr.6(回収量:529mg)からは、ODS−CC及びODS−HPLCにより、イソババカルコン(化合物1;回収量:30mg)(非特許文献6)を単離した。化合物1〜化合物13の構造を以下に示す。
[カルコン類化合物:化合物1〜化合物5]
一般式(A)
【0030】
【化9】

【0031】
式中のR及びR1と、各化合物と、の対応は以下の通りである。
化合物1:R=OH、R1=Pn(Pnは前記構造式(1)に示すプレニル基、以下同じ)
化合物2:R=OH、R1=Gn(Gnは前記構造式(2)に示すゲラニル基、以下同じ)
化合物3:R=OCH3、R1=Pn
化合物4:R=OCH3、R1=Gn
一般式(B)
【0032】
【化10】

【0033】
式中のR2、R3及びR4と化合物5との対応は以下の通りである。
化合物5:R2=OCH3、R3=H、R4=CH3
[クマリン類化合物:化合物6〜化合物11]
一般式(7)
【0034】
【化11】

【0035】
式中のR5及びR6と各化合物との対応は以下の通りである。
化合物6:R5=OH、R6=O‐Ag(Agは下記構造式(8)に示すアンゲロイル基、以下同じ)
化合物7:R5=O‐Ag、R6=OH
化合物8:R5=O‐Ag、R6=H
化合物9:R5=O‐COCH3、R6=O‐Ag
化合物10:R5=O‐Sn(Snは下記構造式(9)に示すセネシオイル基、以下同じ)、R6=OH
化合物11:R5=OH、R6=O‐Sn
アンゲロイル基及びセネシオイル基を以下に示す。
【0036】
【化12】

【0037】
[フラバノン類化合物:化合物12及び化合物13]
一般式(10)
【0038】
【化13】

【0039】
式中のR7、R8、R9及びR10と各化合物との対応は以下の通りである。
化合物12:R7=OH、R8=OH、R9=Gn、R10=H
化合物13:R7=OH、R8=OCH3、R9=Pn、R10=H
ここで、化合物1〜化合物13は、全て既出文献記載の化合物であり、それらの同定は1H−NMRスペクトル及びMSスペクトルの文献値との比較により行った。なお、当該文献は上記のそれぞれの化合物の名称の後に記載した。
【0040】
[非特許文献2] T.M.Swager、J.H.CadellinaII著、Phytochemistry、24巻、805−813頁(1985)
[非特許文献3] K.Baba、K.Nakata、M.Taniguchi、T.Kido、M.Kozawa著、Phytochemistry、29巻、3907−3910頁(1990)
[非特許文献4] 小澤貢、森田伸子、馬場きみ江、秦清之著、薬学雑誌、98巻、210−214頁(1978)
[非特許文献5] I.S.Chen、C.T.Chang、W.S.Sheen、C.M.Teng、I.L.Tsai、C.Y.Duh、F.N.Ko著、Phytochemistry、41巻、525−530頁(1996)
[非特許文献6] M.Iinuma、M.Ohyama、T.Tanaka著、Phytochemistry、38巻、539−543頁(1995)
[非特許文献7] E.Venkata Rao、P.Sridhar、Y.Rajendra Prasad著、Phytochemistry、46巻、1271−1274頁(1997)
【0041】
上記本発明に係る化合物は、抗炎症剤として、医薬品、食品などに添加し、あるいは、主成分として配合することができる。医薬品として用いる場合には、適当な医薬用の担体又は希釈剤と組み合わせて医薬とすることができ、通常の如何なる方法によっても製剤化でき、経口又は非経口投与するための固体、半固体又は液体の剤形に処方することができる。処方にあたっては、他の医薬活性成分との配合剤としてもよい。例えば、日本薬局方に記載されている各種製剤、即ち、錠剤、丸剤、カプセル剤、顆粒剤、散剤、乾燥エキス剤、トローチ剤等の内用固形製剤、流エキス剤、エリキシル剤、酒精剤、シロップ剤、リモナーデ剤等の内用液剤、チンキ剤、リニメント剤等の外用液剤、硬膏剤、軟膏剤、バップ剤等の外用剤などに製剤化できる。また、投与可能であるならば、吸入剤、エアゾール剤、注射剤、点眼剤、座剤等にも用途に応じて製剤化してもよい。
【0042】
医薬品に配合した本発明に係る化合物の投与量は、その目的、投与対象者により異なるが、成人の体重1kgに対し、経口投与の場合は、10〜100mg/日、非経口投与の場合は、1〜20mg/日であることが好ましい。
また、抗炎症剤を含む食品の形態は特に限定されず、上記医薬品と同様の形態であってもよく、さらに本発明に係る化合物、あるいは、本発明に係る化合物を含む材料(アシタバ黄汁、アシタバ成分含有粉末など)を食品原料に加えて、種々の食品の形態にされる。
【0043】
例えば、上記本発明に係る化合物、あるいは、本発明に係る化合物を含む材料を飲料に配合するか、あるいはビスケットのような固形の食品に配合して健康食品あるいは機能性食品などとして提供することができる。本発明に係る化合物、あるいは、本発明に係る化合物を含む材料を用いて各種食品を製造するには、必要に応じて、油脂、エタノール、プロピレングリコール、グリセリンなどの希釈剤、アラビアガム、デキストリンなどのバインダー、安定剤、保存料などが適宜用いられる。
上記食品には、通常、成人の体重1kgに対し、本発明に係る化合物が、0.1〜10mg/日の割合で摂取されるように配合することが好ましい。
【実施例】
【0044】
次に、本発明の効果を確認すべく試験を行ったので説明する。
本試験では、TPA(12‐O‐tetradecanoylphorbol‐13‐acetate)が誘発する炎症に対する抑制効果を確認した。
(1)使用動物:7週齢のICR系雌性マウス(日本エスエルシー(株))をSPF(Specific Pathogen Free)室で室温22〜23度、湿度50±5%、照明8時〜20時の条件で飼育した。
【0045】
(2)被験物質:乾燥アシタバ黄汁、及び、図1に示す黄汁のn‐ヘキサン可溶性画分、酢酸エチル可溶性画分、n‐ブタノール可溶性画分及び水可溶性画分の各画分を被験エキスとした。また、本発明に係る上記化合物1〜化合物13についても、酢酸エチル可溶性画分から上記のようにして単離して被験化合物とした。
(3)被験溶液の調製:被験エキス及び被験化合物はクロロホルム−メタノール(体積比1:1)混液に溶解し、被験溶液を調製した。なお、n‐ブタノール可溶性画分及び水可溶性画分は、メタノール−水(体積比1:1)混液に溶解し、被験溶液を調製した。また、TPAはアセトンに溶解してTPA溶液とした。
【0046】
(4)試験方法:まずマウスの右耳の内外耳殻に被験物質を塗布し、その30分後に同様に1μgのTPAを塗布した。そして、最高腫脹時であるTPA塗布の6時間後に耳殻腫脹サイズをシックネスゲージで測定した。各被験物質につき4〜6耳殻に実施した。
(5)試験1:被験エキスを1mg投与し、TPA塗布後の耳殻腫脹サイズの平均値を測定した。そして、その平均値を、被験エキスを投与せずにTPAを塗布した場合における耳殻腫脹サイズを100(%)、TPAを投与しない場合を0(%)とした場合の相対値に変換し、マウス耳殻炎症抑制率を算出した。結果を表1に示す。
【0047】
【表1】

【0048】
表1に示すように、乾燥黄汁に炎症抑制効果があること(抑制率66%)が確認された。また、溶剤分画物では、酢酸エチル可溶性画分に抑制率74%と、強い炎症抑制効果が確認された。図1にも示したように、酢酸エチル可溶性画分は黄汁成分全体の約70質量%を占めており、黄汁の活性成分の大部分は酢酸エチル画分に含まれると見なされた。従って、酢酸エチル画分成分について続いて下記のように炎症抑制効果を検討した。
(7)試験2:各被験化合物を種々の量で投与し、TPA塗布後の耳殻腫脹サイズの平均値を測定した。そして、上記平均値が、被験化合物を投与せずにTPA塗布した場合における耳殻腫脹サイズの50%となる場合の被験化合物の投与量、すなわち50%抑制投与量(ID50)を算出した。この算出はプロビット法に従った。結果を表2に示す。
【0049】
【表2】

【0050】
表2に示すように、13種の化合物の全てが抗炎症効果を持つことが確認された。13種の化合物のうち、2´´‐ハイドロキシキサントアンゲロール(化合物5;ID50=463μg/耳殻)を除く12種の化合物の抑制率はID50=68〜317μg/耳殻であり、合成消炎剤であるインドメタシン(ID50=300μg/耳殻)に匹敵するか、あるいはそれよりも高い抑制効果を示した。
【0051】
特に、2種の化合物、4‐ハイドロキシデリシン(化合物3;ID50=68μg/耳殻)及びプロストラトールF(化合物12;ID50=92μg/耳殻)は、TPA誘発炎症に対して極めて高い抑制効果を示した。なお、本試験において最も優れた効果が確認された4‐ハイドロキシデリシンは、従来、炎症反応を媒介する起炎物質の1つであるヒスタミンの遊離抑制作用確認試験においてヒスタミンの遊離抑制作用が確認されず、抗炎症効果がないと考えられていた化合物である(中田功二、馬場きみ江著、Natural Medicines、55巻、32−34頁参照)。さらに、4‐ハイドロキシデリシンは、図1にも示すようにキサントアンゲロールとならび、酢酸エチル画分から大量に回収される化合物であり、アシタバを原料とすることで低コストで実用的な量の製造が可能であり、製造的な観点から見ても優れていることが確認された。
【図面の簡単な説明】
【0052】
【図1】抗炎症作用を有する本発明に係る化合物のアシタバ黄汁からの分離を説明する図である。
【特許請求の範囲】
【請求項1】
下記一般式(A)又は下記一般式(B)で示されるカルコン類化合物、下記一般式(C)又は下記構造式(D)で示されるクマリン類化合物、及び、下記一般式(E)で示されるフラバノン類化合物のうちの少なくとも1種を有効成分として含有することを特徴とする抗炎症剤。
一般式(A):
【化1】

(但し、式中RはOH又はOCH3であり、R1は下記構造式(1)〜下記構造式(4)に示すもののうちのいずれかである。)
【化2】

【化3】

一般式(B):
【化4】

(但し、式中R2はOH又はOCH3であり、R3はH又はOHであり、R4はCH3又はCH2CH2CHC(CH3)2である。)
一般式(C):
【化5】

(但し、式中R5及びR6は、H、OH、下記構造式(5)及び下記構造式(6)に示されるもののうちのいずれかであり、R5及びR6が同一であってもよいし、異なっていてもよい。)
【化6】

構造式(D):
【化7】

一般式(E):
【化8】

(式中、R7はH、OH及びOCH3のうちのいずれかであり、R8はOH又はOCH3であり、R9は前記構造式(1)又は前記構造式(2)に示すものであり、R10はH又は前記構造式(2)に示すものである。)
【請求項2】
前記カルコン類化合物が、イソババカルコン、キサントアンゲロール、4−ハイドロキシデリシン、キサントアンゲロールF又は2´´−ハイドロキシキサントアンゲロールIであり、
前記クマリン類化合物が、ラセルピチン、イソラセルピチン、セリニジン、プテリキシン、3´−セネシオイルケーラクトン又は4´−セネシオイルケーラクトンであり、
前記フラバノン類化合物が、プロストラトールF又はマンデレアフラバノンBであることを特徴とする請求項1に記載の抗炎症剤。
【請求項3】
前記カルコン類化合物、前記クマリン類化合物及び前記フラバノン類化合物がアシタバから抽出されたものであることを特徴とする請求項1又は2に記載の抗炎症剤。
【請求項1】
下記一般式(A)又は下記一般式(B)で示されるカルコン類化合物、下記一般式(C)又は下記構造式(D)で示されるクマリン類化合物、及び、下記一般式(E)で示されるフラバノン類化合物のうちの少なくとも1種を有効成分として含有することを特徴とする抗炎症剤。
一般式(A):
【化1】

(但し、式中RはOH又はOCH3であり、R1は下記構造式(1)〜下記構造式(4)に示すもののうちのいずれかである。)
【化2】

【化3】

一般式(B):
【化4】

(但し、式中R2はOH又はOCH3であり、R3はH又はOHであり、R4はCH3又はCH2CH2CHC(CH3)2である。)
一般式(C):
【化5】

(但し、式中R5及びR6は、H、OH、下記構造式(5)及び下記構造式(6)に示されるもののうちのいずれかであり、R5及びR6が同一であってもよいし、異なっていてもよい。)
【化6】

構造式(D):
【化7】

一般式(E):
【化8】

(式中、R7はH、OH及びOCH3のうちのいずれかであり、R8はOH又はOCH3であり、R9は前記構造式(1)又は前記構造式(2)に示すものであり、R10はH又は前記構造式(2)に示すものである。)
【請求項2】
前記カルコン類化合物が、イソババカルコン、キサントアンゲロール、4−ハイドロキシデリシン、キサントアンゲロールF又は2´´−ハイドロキシキサントアンゲロールIであり、
前記クマリン類化合物が、ラセルピチン、イソラセルピチン、セリニジン、プテリキシン、3´−セネシオイルケーラクトン又は4´−セネシオイルケーラクトンであり、
前記フラバノン類化合物が、プロストラトールF又はマンデレアフラバノンBであることを特徴とする請求項1に記載の抗炎症剤。
【請求項3】
前記カルコン類化合物、前記クマリン類化合物及び前記フラバノン類化合物がアシタバから抽出されたものであることを特徴とする請求項1又は2に記載の抗炎症剤。
【図1】




【公開番号】特開2007−1898(P2007−1898A)
【公開日】平成19年1月11日(2007.1.11)
【国際特許分類】
【出願番号】特願2005−182196(P2005−182196)
【出願日】平成17年6月22日(2005.6.22)
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
【公開日】平成19年1月11日(2007.1.11)
【国際特許分類】
【出願日】平成17年6月22日(2005.6.22)
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
[ Back to top ]

