抗老化剤のスクリーニング方法及び老化状態の評価方法
【課題】新規な指標を用いた抗老化剤のスクリーニング方法及び老化状態の評価方法の提供。
【解決手段】本発明は、抗老化剤のスクリーニング方法であって、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る方法、を提供する。
【解決手段】本発明は、抗老化剤のスクリーニング方法であって、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る方法、を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規な指標を用いた抗老化剤のスクリーニング方法及び老化状態の評価方法に関する。
【背景技術】
【0002】
血液は、心臓から送り込まれて毛細血管・静脈を経て心臓へもどる。この血管系とは別個に組織液の排水路を形成するものがリンパ管である。リンパ管は、末梢組織で血管から漏出した間質液、タンパク質、脂肪、細胞などを血管系へと環流することにより血液量を一定に保ち、閉鎖循環系を維持する。血管は肌に栄養や酸素を供給し、リンパ管は肌の老廃物を回収する非常に重要な器官である。これらの変化は、皮膚の老化と密接に関係している。
【0003】
皮膚に存在する毛細血管では、内皮細胞の外側を基底膜が取り囲み、さらに周皮細胞が付着している。毛細血管の構造が正常な場合には、その周囲からしみ出すようにして必要な量の栄養分が皮膚の隅々まで届けられる。しかしながら、加齢に伴い周皮細胞が血管内皮細胞から剥がれると、栄養分が皮膚の隅々にまで届けられる前に漏れてしまう。このような栄養分の不足も皮膚老化の原因の1つと考えられる。一方、毛細リンパ管では、内皮細胞の外には基底膜がほとんどなく、周皮細胞の付着もない。この構造が、効率よく間質から体液や細胞を取り込むために役立っている(非特許文献1)。
【0004】
老化においては、慢性炎症が生じやすくなっていることも知られている。発症要因としては、炎症性サイトカインの持続的な発現や細胞老化などが挙げられているが、収束機構の障害もその一つであることが示唆されている(非特許文献2)。さらに、慢性炎症はがんや動脈硬化、神経変性疾患の発症や進展に関与する。慢性炎症の収束機構の解明、関与する因子の同定は、抗老化、延いては老化に伴う疾患の治療、予防においても重要である。
【0005】
加齢に伴う様々な老化現象は不可避的な問題であるが、抗老化は多くの人にとっての重大な関心事であり、新規の抗老化剤が切望されている。また、老化の進行度は一般的に人の外見、例えば皮膚等を目視評価することで行われるが、抗老化剤を用いて老化に関連する症状を適切に処置するためには、客観的な指標に基づき老化状態を事前に評価することが望ましい。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】実験医学 Vol. 24, No. 18 (2006), pp. 133-138
【非特許文献2】Nathan, C., and Ding, A., (2010) Nonresolving Inflammation. Cell 140: 871-882
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、新規な指標を用いた抗老化剤のスクリーニング方法及び老化状態の評価方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
炎症においてはマクロファージなどの炎症性細胞の組織間への侵入が認められる。炎症反応は、血管透過性の亢進、それに続く好中球の浸潤によって誘発される。炎症の収束過程では、炎症部位でアポトーシス細胞や組織屑がマクロファージによって取り込まれてクリアランスされる。さらに、異物を貪食した細胞および浮腫は、リンパ管を介したドレナージによって炎症組織から除去される。従って、炎症を終焉させるためには、炎症性細胞がリンパ管の誘引作用によりリンパ管へと遊走され、回収される必要がある。この炎症性細胞のリンパ管への遊走を、本明細書ではリンパ管の「誘引」作用と定義する。
【0009】
細胞を繰り返し継代して培養すると、細胞は老化が進み、最終的には分裂機能を失う。本発明者は、継代培養されたリンパ管内皮細胞に対して誘引される炎症性細胞の数が継代回数の増大につれて減少することを見出し、炎症性細胞の遊走能と老化との関連に着目して本発明を完成させるに至った。
【0010】
即ち、本願は下記の発明を包含する:
[1]抗老化剤のスクリーニング方法であって、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る方法。
[2]前記候補薬剤が、前記リンパ管を構成するリンパ管内皮細胞におけるCCケモカインの発現を亢進するか、又は前記炎症性細胞が発現するCCケモカイン受容体を活性化する場合に、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させると評価される、[1]に記載の方法。
[3]前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、[2]に記載の方法。
[4]前記リガンドがCCL21である、[3]に記載の方法。
[5]前記抗老化剤が皮膚老化を防止又は抑制するためのものである、[1]〜[4]のいずれかに記載の方法。
[6]リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を指標とする、老化状態を評価するための方法。
[7]リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能が、リンパ管内皮細胞におけるCCケモカインの発現量又は炎症性細胞が発現するCCケモカイン受容体の活性化状態により評価される、[6]に記載の方法。
[8]前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、[7]に記載の方法。
[9]前記リガンドがCCL21である、[8]に記載の方法。
[10]前記老化が皮膚老化である、[6]〜[9]のいずれかに記載の方法。
【発明の効果】
【0011】
炎症性細胞がリンパ管内に誘引されずに炎症部位に留まると炎症は終結せず、浮腫が生じることもある。理論に拘束されることを意図するものではないが、本発明のスクリーニング方法により得られる抗老化剤は、リンパ管内皮細胞の誘引作用又は炎症性細胞のリンパ管内皮細胞への遊走能を亢進させて炎症の終結を促進し、延いては炎症に起因する老化を緩和するものと考えられる。また、リンパ管内皮細胞の誘引作用又は炎症性細胞のリンパ管内皮細胞への遊走能を指標とすることで客観的に老化状態を評価することが可能になる。
【図面の簡単な説明】
【0012】
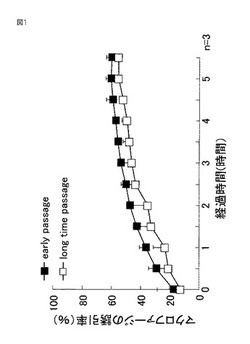
【図1】図1は、継代数の異なるリンパ管内皮細胞とマクロファージとの共培養開始から6時間までのマクロファージの誘引率(%)を示す。
【図2】図2は、継代数の異なるリンパ管内皮細胞とマクロファージとの共培養開始から6時間までのマクロファージの遊走量(変位量)を示す。
【図3】図3は、継代数の異なるリンパ管内皮細胞におけるCCL21の定量解析結果を示す。
【発明を実施するための形態】
【0013】
抗老化剤のスクリーニング方法
本発明のスクリーニング方法は、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る。上記誘引作用及び/又は遊走能の評価は、例えば、リンパ管内皮細胞、炎症性細胞、及び支持体、を含んで成る三次元モデル、具体的には、支持体上に、下から順にリンパ管内皮細胞、炎症性細胞が積層されて成り、リンパ管内皮細胞が当該支持体上で管腔網を形成している、三次元モデルを用いて実施することができる。三次元モデルを用いるスクリーニング方法は生体をより反映した系を利用している点で好ましいが、本発明のスクリーニング方法は三次元モデルを用いるものに限定されない。より具体的な態様において、本発明のスクリーニング方法は、上記選定工程の前に候補薬剤を三次元モデルに添加する工程を含んでいてもよい。三次元モデルに添加される候補薬剤の量は当業者により適宜決定される。
【0014】
上記三次元モデルに含まれるリンパ管内皮細胞は、リンパ管腔を形成し、そのネットワーク、すなわち管腔網に炎症性細胞を誘引できるものであれば特に制限はない。また、当該リンパ管内皮細胞は、当該細胞上に積層される炎症性細胞と同種系でも異種系であってもよく、また、任意の哺乳動物由来のものを使用することができる。更に、リンパ管内皮細胞は、紫外線照射や薬剤投与、あるいは遺伝子改変を受けているものでもよい。しかしながら、本発明で使用するリンパ管内皮細胞は、当該三次元モデルを用いて得られる薬剤がヒトに適用されることが意図されている場合、ヒト由来のものを使用して三次元モデルの性状をヒトリンパ管周辺のものに近づけることが好ましい。リンパ管内皮細胞は、血管内皮細胞と区別するためにマーカー遺伝子として知られているProx1,podoplaninが強く発現することが確認されているものを用いることが特に好ましい。
【0015】
上文で定義したとおり、炎症性細胞は、リンパ管の誘引作用によりリンパ管へと遊走し、リンパ管腔内へ浸潤して回収される。本明細書で使用する場合、「炎症性細胞」とは、炎症の際にリンパ管腔内に誘引される細胞、例えばマクロファージ、樹状細胞、T細胞、B細胞等を意味している。更に、炎症性細胞は、紫外線照射や薬剤投与、あるいは遺伝子改変を受けているものでもよい。しかしながら、本発明で使用する炎症性細胞は、本発明の三次元モデルを用いて得られる薬剤がヒトに適用されることが意図されている場合、ヒト由来のものを使用して三次元モデルの性状をヒトリンパ管周辺のものに近づけることが好ましい。本発明の三次元モデルの用途に応じて、例えば、炎症細胞の動態解析を実施するために、炎症性細胞は標識されることがある。
【0016】
リンパ管の誘引作用を評価する観点からは、本発明で使用する炎症細胞は、リンパ管内皮細胞によって産生されるCCケモカインの受容体、例えばCCL21又はCCL19の受容体であるCCR7を発現するものが好ましい。しかしながら、本発明で使用する炎症性細胞が発現すべきCCケモカイン受容体はCCR7に限定されない。
【0017】
上記リンパ管内皮細胞及び炎症細胞は、支持体上に積層されることで上記三次元モデルを形成する。本発明で使用する「支持体」は、基底膜成分を含むゲルであって、リンパ管内皮細胞がネットワークを形成することができるゲルを意味する。当該支持体は、基底膜成分に加え、炎症性細胞の遊走能を抑制しない限り任意の成分を含んでもよい。かかる支持体は市販されており、例えばBD Bioscienc社から販売されているBD Matrigel(登録商標)基底膜マトリックス・グロースファクターリデューストを本発明の支持体として使用することもできる。具体的な態様において、当該支持体上にリンパ管内皮細胞が、そして炎症性細胞がリンパ管内皮細胞により形成された管腔網上に配置される。
【0018】
支持体上にリンパ管内皮細胞を播種した後、所定の期間、所定の条件下で培養することで、リンパ管内皮細胞は徐々にネットワークを形成する。例えば、37℃、5%CO2の保湿インキュベーター内で培養した場合、15時間後には安定した管腔網が形成される。培養条件やリンパ管腔のネットワーク形成の程度は本発明の三次元モデルの使用目的に応じて当業者により適宜決定される。管腔網の形成状態は炎症性細胞の遊走能に影響を及ぼすため、本発明の三次元モデルにおいては、安定な管腔網が形成されていることが好ましい。しかしながら、三次元モデルのうち実際に使用される範囲の管腔網、例えば、顕微鏡を使用する場合には一視野中の管腔網が安定して形成されていれば使用することができる。所望のリンパ管内皮細胞層が構成された後、当該層に炎症性細胞が播種される。リンパ管内皮細胞と同様に、炎症性細胞の培養条件も適宜決定されるものであるが、リンパ管内皮細胞と同じ培養条件で培養することが好ましい。
【0019】
本明細書で使用する場合、用語「誘引作用」とは、上文で定義したとおり、リンパ管、すなわちリンパ管内皮細胞により形成された管腔網が炎症性細胞を誘引する作用を意味する。限定することを意図するものではないが、リンパ管内皮細胞により形成された管腔網に誘引される炎症性細胞の数の増大は、炎症性細胞の誘引作用を「活性化」するものとして評価される。
【0020】
リンパ管の炎症性細胞誘引作用の評価は、後述するとおり、リンパ管内皮細胞と炎症性細胞をそれぞれ異なる蛍光色素で標識し、蛍光顕微鏡、好ましくは蛍光タイムプラス顕微鏡にかけ、リンパ管内皮細胞が形成した管腔上に誘引された炎症細胞数を計数することで実施することができる。
【0021】
リンパ管の炎症性細胞誘引作用は、本明細書において「誘引率」として表すこともあり、当該誘引率は、全体の炎症細胞数に対する管腔上の炎症性細胞の割合(%)(管腔上の炎症性細胞数/全体の炎症性細胞数)によって算出される。
【0022】
候補薬剤は、例えば、コントロールと比較して有意に誘引率を増大させる場合、管腔網に誘引される炎症性細胞の数が増大していると評価され、抗老化剤として選定され得る。
【0023】
上記選定工程において、リンパ管の誘引作用の代わりに又は誘引作用とともに、炎症性細胞の遊走能を評価してもよい。スクリーニングの精度を向上させる観点からは、リンパ管の誘引作用と炎症性細胞の遊走能の両方を評価することが好ましい。炎症性細胞の「遊走能」は、既定の時間間隔で炎症細胞の遊走距離を測定し、単位時間当たりのその変位量(換言すると「遊走量」)を指標として評価することができる。遊走量を測定するにあたり、統計学的に信頼できる数の炎症細胞が無作為に選択される。遊走量の測定については、動態解析ソフトを用いることで、簡便に測定することができる。
【0024】
候補薬剤は、例えば、コントロールと比較して有意に遊走量を増大させる場合、炎症性細胞の遊走能が活性化されていると評価され、抗老化剤として選定され得る。
【0025】
本発明のスクリーニング方法により得られる「抗老化剤」は、老化、特に皮膚老化を防止又は抑制することができる。当該抗老化剤は、皮膚老化の中でも、リンパ管内皮細胞に関連する老化、例えば、慢性微弱炎症に起因する皮膚老化、より具体的にはしわの治療等に使用することが考えられる。
【0026】
炎症の収束における細胞のリンパ管を介したドレナージでは、マクロファージなどの炎症性細胞が、リンパ管の誘引作用によってリンパ管に遊走することが必要である。リンパ管などの脈管系へのマクロファージなどの遊走に関わる因子としてケモカインが知られている。ケモカインはGタンパク質共役受容体を介して作用し、構造上の違いからCCケモカイン、CXCケモカイン、CケモカインおよびCX3Cケモカインに分類される。これまでに44種類以上のケモカインが同定されている(生化学 Vol. 82, No. 4 (2010), pp. 271-289)。
【0027】
CCケモカインについては現在までに27種類が同定されており、その一つにCCケモカインリガンド21(CCL21)がある。CCL21は主に高内皮細静脈やリンパ管内皮細胞に発現しており、CCケモカイン受容体7(CCR7)を介して細胞遊走に関与する。これまでに、CCL21を発現する高内皮細静脈では、血液中を循環するT細胞やB細胞を接着させ、血管壁を通過して二次リンパ組織へと移動させることが知られている(脈管学 Vol. 48 (2008), pp. 151-157)。さらに、末梢組織では、CCR7を発現するT細胞や、抗原を捕捉して成熟するとともにCCR7の発現を増強した樹状細胞が、CCL21依存的にリンパ管へ移動することが報告されている(Debes GF., et al., (2005) Chemokine receptor CCR7 required for T lymphocyte exit from peripheral tissue. Nat Immunol 6: 889-894; Randolph GJ., et al., (2005) Dendritic-cell trafficking to lymph nodes through lymphatic vessel. Nat Rev Immunol 5:617-628)。
【0028】
また、CCLファミリーの中ではリンパ球などの細胞遊走に関わる因子として、受容体CCL7のもう一つのリガンドであるCCL19も知られている(Haessler U., Pisano M., Wu M., and Swartz MA., (2011) Dendritic cell chemotaxis in 3D under defined chemokine gradients reveals differential response to ligands CCL21 and CCL19. Proc NatlAcadSci USA 108:5614-5619)。限定することを意図するものではないが、本発明で使用するリンパ管内皮細胞から産生されるサイトカインは、好ましくはCCR7のリガンド、例えばCCL21又はCCL19、特に好ましくはCCL21である。
【0029】
リンパ管内皮細胞により産生されるCCケモカイン、特にCCL21の発現を阻害するとリンパ管の誘引作用や炎症性細胞の遊走能が低下する。事実、後述するとおりsiRNAによりリンパ管内皮細胞におけるCCL21発現を抑制した結果、マクロファージの誘引率や遊走量が低下した。従って、CCケモカインの発現を亢進させる薬剤は抗老化剤となり得る。同様に、当該CCケモカインの受容体、例えばCCL21の受容体であるCCR7を活性化する薬剤も抗老化剤の候補となる。
【0030】
老化状態の評価方法
本発明の老化状態を評価する方法は、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を指標とする。例えば、対象者のリンパ管の炎症性細胞誘引作用が同世代のものと比較して有意に低い場合、その対象者の老化は進行している、と評価することができる。同様に、対象者の炎症性細胞の遊走能が同世代のものと比較して有意に低い場合、その対象者の老化は進行している、と評価することができる。
【0031】
リンパ管の炎症性細胞誘引作用は、上記三次元モデルを使用する場合、誘引率、すなわち、全体の炎症細胞数に対する管腔上の炎症性細胞の割合(%)(管腔上の炎症性細胞数/全体の炎症性細胞数)によって評価することもできる。別の態様において、リンパ管の炎症性細胞誘引作用は、リンパ管内皮細胞におけるCCケモカインの発現量によって評価することができる。例えば、対象者のCCケモカインの発現量が同世代のものと比較して有意に低い場合、リンパ管の炎症性細胞誘引作用は低下しているとみなされる。
【0032】
本発明の評価方法において、リンパ管の誘引作用の代わりに又は誘引作用とともに、炎症性細胞の遊走能を評価してもよい。評価精度を向上させる観点からは、リンパ管の誘引作用と炎症性細胞の遊走能の両方を評価することが好ましい。炎症性細胞の遊走能は、上記三次元モデルを使用する場合、遊走量、すなわち、既定の時間間隔で炎症細胞の遊走距離を測定し、単位時間当たりのその変位量を指標として評価することができる。別の態様において、炎症性細胞の遊走能は、炎症性細胞におけるCCケモカイン受容体の活性化状態によって評価することができる。例えば、対象者の炎症性細胞が発現するCCケモカイン受容体の活性化状態が同世代のものと比較して有意に低い場合、炎症性細胞の遊走能は低下しているとみなされる。
【0033】
前記CCケモカインは、好ましくはCCケモカイン受容体CCR7のリガンドであり、より好ましくはCCL21又はCCL19である。CCL21が特に好ましい。
【0034】
本発明は、in vitroの細胞の老化状態を評価するのにも使用することができ、例えば、培養リンパ管内皮細胞の誘引作用を評価することで、当該リンパ管内皮細胞がどの程度継代されたものかを判断することができる。
【0035】
次に、本願発明を以下の実施例により更に具体的に説明する。
【実施例】
【0036】
1.三次元共培養モデルの作成
BD Matrigel(登録商標)基底膜マトリックスグロースファクターリデュースト(BD Biosciences)と10倍濃度ダルベッコリン酸緩衝生理食塩水(Sigma-Aldrich Co. LLC)を10:1の割合で混合した後、カバーグラスチャンバー 8ウェル(nunc; Thermo Fisher Scientific K.K.)に150 μlを入れ、37℃ 5%CO2の保湿インキュベーターで50分間維持してゲル化した。その後、ゲル上にヒト新生児包皮よりCD31陽性CD34陰性CD45陰性細胞として単離したリンパ管内皮細胞(Kajiya K., et al., (2005) Hepatocyte growth factor promotes lymphatic vessel formation and function. EMBO J 24:2885-95)を2x104細胞数/ウェルで播種し、37℃ 5%CO2の保湿インキュベーターで15時間培養し、ネットワークを形成させた。リンパ管内皮細胞を標識する場合にはPKH26赤色蛍光細胞リンカーキット(Sigma-Aldrich Co. LLC)を用いて細胞膜標識をし、同細胞数をゲル上に播種した。
【0037】
リンパ管内皮細胞と共培養される炎症性細胞として、100 ng/ml PMA(Sigma-Aldrich Co. LLC)刺激を48時間行ってマクロファージへ分化させたTHP1(American Type Culture Collection)細胞を用いた。炎症性細胞をPKH67緑色蛍光細胞リンカーキット(Sigma-Aldrich Co. LLC)で細胞膜標識した後、ネットワークを形成したリンパ管内皮細胞上に2x103細胞数/ウェルで添加した。
【0038】
2.継代数の異なるリンパ管内皮細胞の誘引作用及び炎症性細胞の遊走能の評価
上記三次元モデルの製法に従い、継代培養を繰り返したリンパ管内皮細胞が導入された三次元モデル(long time passage)を作成した(リンパ管内皮細胞の継代数:13又は16)。作成後、HSオールインワン蛍光顕微鏡 BZ-9000(KEYENCE CORPORATION. Japan)を用いて、三次元モデルについてタイムラプス撮影を行った。各撮影時間において、視野中のリンパ管内皮細胞ネットワーク上に存在する炎症性細胞を数え、視野中に存在する炎症性細胞の総数に対する割合(誘引率(%))を求めた。結果を図1に示す。図1より、コントロール(early passage)として使用した、継代数7回のリンパ管内皮細胞を含んで成る三次元モデルと比較して、継代数の多いリンパ管内皮細胞を含んで成る三次元モデル(long time passage)は、マクロファージの誘引率が有意に低下したことが分かる。
【0039】
また、動画編集解析ソフトウェア(KEYENCE CORPORATION. Japan)を用いて、炎症性細胞の動きを追尾し、追尾開始時点の細胞の位置から追尾終了時点の細胞の位置までの直線距離を算出し、これを炎症性細胞の遊走量として評価した。単位時間当たりに測定された遊走量を図2に示す。
【0040】
図2に示すとおり、継代数の多いリンパ管内皮細胞を含んで成る三次元モデルにおいて、マクロファージの誘引率だけでなく遊走量も有意に低下した。これらの結果から、繰り返し継代して培養し、細胞老化が進んだリンパ管内皮細胞では誘引作用が低下していることがわかる。
【0041】
3.継代数の異なるリンパ管内皮細胞におけるCCL21の定量解析
上記リンパ管細胞を二次元培養し、それぞれ継代数の異なるリンパ管細胞を準備した。リンパ管内皮細胞のTotal RNAをTRIZOL Reagent(Invitrogen, Carlsbad, CA)を用いて抽出した。Total RNA 2μgをOne step qRT-PCR MasterMix(Eurogentec S.A.)と混合し、ABI Prism 7000 Sequence Detection System (Applied Biosystems, Foster City, CA)を用いてリアルタイム定量PCRを行った。
【0042】
CCL21については、TaqMan gene expression assays(Applied Biosystems Inc., Hs00171076)を、内部標準のβ-アクチンについては、以下のプライマー(フォワードプライマー:5’-TCACCGAGCGCGGCT-3’(配列番号1);リバースプライマー:5’-TAATGTCACGCACGATTTCCC-3’(配列番号2))及びプローブ(5’-FAM-CAGCTTCACCACCACGGCCGAG -TAMRA-3’(配列番号3))を用いた。β-アクチン補正後のCCL21の定量結果を図3に示す。
【0043】
図3の結果から、継代数の増加と共にCCL21の発現量が低下したことが分かる。すなわち、老化が進行するにつれ、CCL21の発現量は低下する。上記結果は、上記三次元モデルにおいて継代数の異なるリンパ管内皮細胞を用いた場合、継代数の多いリンパ管内皮細胞を用いた三次元モデルにおいてマクロファージの遊走量が低下した結果とも符号する。
【技術分野】
【0001】
本発明は、新規な指標を用いた抗老化剤のスクリーニング方法及び老化状態の評価方法に関する。
【背景技術】
【0002】
血液は、心臓から送り込まれて毛細血管・静脈を経て心臓へもどる。この血管系とは別個に組織液の排水路を形成するものがリンパ管である。リンパ管は、末梢組織で血管から漏出した間質液、タンパク質、脂肪、細胞などを血管系へと環流することにより血液量を一定に保ち、閉鎖循環系を維持する。血管は肌に栄養や酸素を供給し、リンパ管は肌の老廃物を回収する非常に重要な器官である。これらの変化は、皮膚の老化と密接に関係している。
【0003】
皮膚に存在する毛細血管では、内皮細胞の外側を基底膜が取り囲み、さらに周皮細胞が付着している。毛細血管の構造が正常な場合には、その周囲からしみ出すようにして必要な量の栄養分が皮膚の隅々まで届けられる。しかしながら、加齢に伴い周皮細胞が血管内皮細胞から剥がれると、栄養分が皮膚の隅々にまで届けられる前に漏れてしまう。このような栄養分の不足も皮膚老化の原因の1つと考えられる。一方、毛細リンパ管では、内皮細胞の外には基底膜がほとんどなく、周皮細胞の付着もない。この構造が、効率よく間質から体液や細胞を取り込むために役立っている(非特許文献1)。
【0004】
老化においては、慢性炎症が生じやすくなっていることも知られている。発症要因としては、炎症性サイトカインの持続的な発現や細胞老化などが挙げられているが、収束機構の障害もその一つであることが示唆されている(非特許文献2)。さらに、慢性炎症はがんや動脈硬化、神経変性疾患の発症や進展に関与する。慢性炎症の収束機構の解明、関与する因子の同定は、抗老化、延いては老化に伴う疾患の治療、予防においても重要である。
【0005】
加齢に伴う様々な老化現象は不可避的な問題であるが、抗老化は多くの人にとっての重大な関心事であり、新規の抗老化剤が切望されている。また、老化の進行度は一般的に人の外見、例えば皮膚等を目視評価することで行われるが、抗老化剤を用いて老化に関連する症状を適切に処置するためには、客観的な指標に基づき老化状態を事前に評価することが望ましい。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】実験医学 Vol. 24, No. 18 (2006), pp. 133-138
【非特許文献2】Nathan, C., and Ding, A., (2010) Nonresolving Inflammation. Cell 140: 871-882
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、新規な指標を用いた抗老化剤のスクリーニング方法及び老化状態の評価方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
炎症においてはマクロファージなどの炎症性細胞の組織間への侵入が認められる。炎症反応は、血管透過性の亢進、それに続く好中球の浸潤によって誘発される。炎症の収束過程では、炎症部位でアポトーシス細胞や組織屑がマクロファージによって取り込まれてクリアランスされる。さらに、異物を貪食した細胞および浮腫は、リンパ管を介したドレナージによって炎症組織から除去される。従って、炎症を終焉させるためには、炎症性細胞がリンパ管の誘引作用によりリンパ管へと遊走され、回収される必要がある。この炎症性細胞のリンパ管への遊走を、本明細書ではリンパ管の「誘引」作用と定義する。
【0009】
細胞を繰り返し継代して培養すると、細胞は老化が進み、最終的には分裂機能を失う。本発明者は、継代培養されたリンパ管内皮細胞に対して誘引される炎症性細胞の数が継代回数の増大につれて減少することを見出し、炎症性細胞の遊走能と老化との関連に着目して本発明を完成させるに至った。
【0010】
即ち、本願は下記の発明を包含する:
[1]抗老化剤のスクリーニング方法であって、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る方法。
[2]前記候補薬剤が、前記リンパ管を構成するリンパ管内皮細胞におけるCCケモカインの発現を亢進するか、又は前記炎症性細胞が発現するCCケモカイン受容体を活性化する場合に、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させると評価される、[1]に記載の方法。
[3]前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、[2]に記載の方法。
[4]前記リガンドがCCL21である、[3]に記載の方法。
[5]前記抗老化剤が皮膚老化を防止又は抑制するためのものである、[1]〜[4]のいずれかに記載の方法。
[6]リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を指標とする、老化状態を評価するための方法。
[7]リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能が、リンパ管内皮細胞におけるCCケモカインの発現量又は炎症性細胞が発現するCCケモカイン受容体の活性化状態により評価される、[6]に記載の方法。
[8]前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、[7]に記載の方法。
[9]前記リガンドがCCL21である、[8]に記載の方法。
[10]前記老化が皮膚老化である、[6]〜[9]のいずれかに記載の方法。
【発明の効果】
【0011】
炎症性細胞がリンパ管内に誘引されずに炎症部位に留まると炎症は終結せず、浮腫が生じることもある。理論に拘束されることを意図するものではないが、本発明のスクリーニング方法により得られる抗老化剤は、リンパ管内皮細胞の誘引作用又は炎症性細胞のリンパ管内皮細胞への遊走能を亢進させて炎症の終結を促進し、延いては炎症に起因する老化を緩和するものと考えられる。また、リンパ管内皮細胞の誘引作用又は炎症性細胞のリンパ管内皮細胞への遊走能を指標とすることで客観的に老化状態を評価することが可能になる。
【図面の簡単な説明】
【0012】
【図1】図1は、継代数の異なるリンパ管内皮細胞とマクロファージとの共培養開始から6時間までのマクロファージの誘引率(%)を示す。
【図2】図2は、継代数の異なるリンパ管内皮細胞とマクロファージとの共培養開始から6時間までのマクロファージの遊走量(変位量)を示す。
【図3】図3は、継代数の異なるリンパ管内皮細胞におけるCCL21の定量解析結果を示す。
【発明を実施するための形態】
【0013】
抗老化剤のスクリーニング方法
本発明のスクリーニング方法は、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る。上記誘引作用及び/又は遊走能の評価は、例えば、リンパ管内皮細胞、炎症性細胞、及び支持体、を含んで成る三次元モデル、具体的には、支持体上に、下から順にリンパ管内皮細胞、炎症性細胞が積層されて成り、リンパ管内皮細胞が当該支持体上で管腔網を形成している、三次元モデルを用いて実施することができる。三次元モデルを用いるスクリーニング方法は生体をより反映した系を利用している点で好ましいが、本発明のスクリーニング方法は三次元モデルを用いるものに限定されない。より具体的な態様において、本発明のスクリーニング方法は、上記選定工程の前に候補薬剤を三次元モデルに添加する工程を含んでいてもよい。三次元モデルに添加される候補薬剤の量は当業者により適宜決定される。
【0014】
上記三次元モデルに含まれるリンパ管内皮細胞は、リンパ管腔を形成し、そのネットワーク、すなわち管腔網に炎症性細胞を誘引できるものであれば特に制限はない。また、当該リンパ管内皮細胞は、当該細胞上に積層される炎症性細胞と同種系でも異種系であってもよく、また、任意の哺乳動物由来のものを使用することができる。更に、リンパ管内皮細胞は、紫外線照射や薬剤投与、あるいは遺伝子改変を受けているものでもよい。しかしながら、本発明で使用するリンパ管内皮細胞は、当該三次元モデルを用いて得られる薬剤がヒトに適用されることが意図されている場合、ヒト由来のものを使用して三次元モデルの性状をヒトリンパ管周辺のものに近づけることが好ましい。リンパ管内皮細胞は、血管内皮細胞と区別するためにマーカー遺伝子として知られているProx1,podoplaninが強く発現することが確認されているものを用いることが特に好ましい。
【0015】
上文で定義したとおり、炎症性細胞は、リンパ管の誘引作用によりリンパ管へと遊走し、リンパ管腔内へ浸潤して回収される。本明細書で使用する場合、「炎症性細胞」とは、炎症の際にリンパ管腔内に誘引される細胞、例えばマクロファージ、樹状細胞、T細胞、B細胞等を意味している。更に、炎症性細胞は、紫外線照射や薬剤投与、あるいは遺伝子改変を受けているものでもよい。しかしながら、本発明で使用する炎症性細胞は、本発明の三次元モデルを用いて得られる薬剤がヒトに適用されることが意図されている場合、ヒト由来のものを使用して三次元モデルの性状をヒトリンパ管周辺のものに近づけることが好ましい。本発明の三次元モデルの用途に応じて、例えば、炎症細胞の動態解析を実施するために、炎症性細胞は標識されることがある。
【0016】
リンパ管の誘引作用を評価する観点からは、本発明で使用する炎症細胞は、リンパ管内皮細胞によって産生されるCCケモカインの受容体、例えばCCL21又はCCL19の受容体であるCCR7を発現するものが好ましい。しかしながら、本発明で使用する炎症性細胞が発現すべきCCケモカイン受容体はCCR7に限定されない。
【0017】
上記リンパ管内皮細胞及び炎症細胞は、支持体上に積層されることで上記三次元モデルを形成する。本発明で使用する「支持体」は、基底膜成分を含むゲルであって、リンパ管内皮細胞がネットワークを形成することができるゲルを意味する。当該支持体は、基底膜成分に加え、炎症性細胞の遊走能を抑制しない限り任意の成分を含んでもよい。かかる支持体は市販されており、例えばBD Bioscienc社から販売されているBD Matrigel(登録商標)基底膜マトリックス・グロースファクターリデューストを本発明の支持体として使用することもできる。具体的な態様において、当該支持体上にリンパ管内皮細胞が、そして炎症性細胞がリンパ管内皮細胞により形成された管腔網上に配置される。
【0018】
支持体上にリンパ管内皮細胞を播種した後、所定の期間、所定の条件下で培養することで、リンパ管内皮細胞は徐々にネットワークを形成する。例えば、37℃、5%CO2の保湿インキュベーター内で培養した場合、15時間後には安定した管腔網が形成される。培養条件やリンパ管腔のネットワーク形成の程度は本発明の三次元モデルの使用目的に応じて当業者により適宜決定される。管腔網の形成状態は炎症性細胞の遊走能に影響を及ぼすため、本発明の三次元モデルにおいては、安定な管腔網が形成されていることが好ましい。しかしながら、三次元モデルのうち実際に使用される範囲の管腔網、例えば、顕微鏡を使用する場合には一視野中の管腔網が安定して形成されていれば使用することができる。所望のリンパ管内皮細胞層が構成された後、当該層に炎症性細胞が播種される。リンパ管内皮細胞と同様に、炎症性細胞の培養条件も適宜決定されるものであるが、リンパ管内皮細胞と同じ培養条件で培養することが好ましい。
【0019】
本明細書で使用する場合、用語「誘引作用」とは、上文で定義したとおり、リンパ管、すなわちリンパ管内皮細胞により形成された管腔網が炎症性細胞を誘引する作用を意味する。限定することを意図するものではないが、リンパ管内皮細胞により形成された管腔網に誘引される炎症性細胞の数の増大は、炎症性細胞の誘引作用を「活性化」するものとして評価される。
【0020】
リンパ管の炎症性細胞誘引作用の評価は、後述するとおり、リンパ管内皮細胞と炎症性細胞をそれぞれ異なる蛍光色素で標識し、蛍光顕微鏡、好ましくは蛍光タイムプラス顕微鏡にかけ、リンパ管内皮細胞が形成した管腔上に誘引された炎症細胞数を計数することで実施することができる。
【0021】
リンパ管の炎症性細胞誘引作用は、本明細書において「誘引率」として表すこともあり、当該誘引率は、全体の炎症細胞数に対する管腔上の炎症性細胞の割合(%)(管腔上の炎症性細胞数/全体の炎症性細胞数)によって算出される。
【0022】
候補薬剤は、例えば、コントロールと比較して有意に誘引率を増大させる場合、管腔網に誘引される炎症性細胞の数が増大していると評価され、抗老化剤として選定され得る。
【0023】
上記選定工程において、リンパ管の誘引作用の代わりに又は誘引作用とともに、炎症性細胞の遊走能を評価してもよい。スクリーニングの精度を向上させる観点からは、リンパ管の誘引作用と炎症性細胞の遊走能の両方を評価することが好ましい。炎症性細胞の「遊走能」は、既定の時間間隔で炎症細胞の遊走距離を測定し、単位時間当たりのその変位量(換言すると「遊走量」)を指標として評価することができる。遊走量を測定するにあたり、統計学的に信頼できる数の炎症細胞が無作為に選択される。遊走量の測定については、動態解析ソフトを用いることで、簡便に測定することができる。
【0024】
候補薬剤は、例えば、コントロールと比較して有意に遊走量を増大させる場合、炎症性細胞の遊走能が活性化されていると評価され、抗老化剤として選定され得る。
【0025】
本発明のスクリーニング方法により得られる「抗老化剤」は、老化、特に皮膚老化を防止又は抑制することができる。当該抗老化剤は、皮膚老化の中でも、リンパ管内皮細胞に関連する老化、例えば、慢性微弱炎症に起因する皮膚老化、より具体的にはしわの治療等に使用することが考えられる。
【0026】
炎症の収束における細胞のリンパ管を介したドレナージでは、マクロファージなどの炎症性細胞が、リンパ管の誘引作用によってリンパ管に遊走することが必要である。リンパ管などの脈管系へのマクロファージなどの遊走に関わる因子としてケモカインが知られている。ケモカインはGタンパク質共役受容体を介して作用し、構造上の違いからCCケモカイン、CXCケモカイン、CケモカインおよびCX3Cケモカインに分類される。これまでに44種類以上のケモカインが同定されている(生化学 Vol. 82, No. 4 (2010), pp. 271-289)。
【0027】
CCケモカインについては現在までに27種類が同定されており、その一つにCCケモカインリガンド21(CCL21)がある。CCL21は主に高内皮細静脈やリンパ管内皮細胞に発現しており、CCケモカイン受容体7(CCR7)を介して細胞遊走に関与する。これまでに、CCL21を発現する高内皮細静脈では、血液中を循環するT細胞やB細胞を接着させ、血管壁を通過して二次リンパ組織へと移動させることが知られている(脈管学 Vol. 48 (2008), pp. 151-157)。さらに、末梢組織では、CCR7を発現するT細胞や、抗原を捕捉して成熟するとともにCCR7の発現を増強した樹状細胞が、CCL21依存的にリンパ管へ移動することが報告されている(Debes GF., et al., (2005) Chemokine receptor CCR7 required for T lymphocyte exit from peripheral tissue. Nat Immunol 6: 889-894; Randolph GJ., et al., (2005) Dendritic-cell trafficking to lymph nodes through lymphatic vessel. Nat Rev Immunol 5:617-628)。
【0028】
また、CCLファミリーの中ではリンパ球などの細胞遊走に関わる因子として、受容体CCL7のもう一つのリガンドであるCCL19も知られている(Haessler U., Pisano M., Wu M., and Swartz MA., (2011) Dendritic cell chemotaxis in 3D under defined chemokine gradients reveals differential response to ligands CCL21 and CCL19. Proc NatlAcadSci USA 108:5614-5619)。限定することを意図するものではないが、本発明で使用するリンパ管内皮細胞から産生されるサイトカインは、好ましくはCCR7のリガンド、例えばCCL21又はCCL19、特に好ましくはCCL21である。
【0029】
リンパ管内皮細胞により産生されるCCケモカイン、特にCCL21の発現を阻害するとリンパ管の誘引作用や炎症性細胞の遊走能が低下する。事実、後述するとおりsiRNAによりリンパ管内皮細胞におけるCCL21発現を抑制した結果、マクロファージの誘引率や遊走量が低下した。従って、CCケモカインの発現を亢進させる薬剤は抗老化剤となり得る。同様に、当該CCケモカインの受容体、例えばCCL21の受容体であるCCR7を活性化する薬剤も抗老化剤の候補となる。
【0030】
老化状態の評価方法
本発明の老化状態を評価する方法は、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を指標とする。例えば、対象者のリンパ管の炎症性細胞誘引作用が同世代のものと比較して有意に低い場合、その対象者の老化は進行している、と評価することができる。同様に、対象者の炎症性細胞の遊走能が同世代のものと比較して有意に低い場合、その対象者の老化は進行している、と評価することができる。
【0031】
リンパ管の炎症性細胞誘引作用は、上記三次元モデルを使用する場合、誘引率、すなわち、全体の炎症細胞数に対する管腔上の炎症性細胞の割合(%)(管腔上の炎症性細胞数/全体の炎症性細胞数)によって評価することもできる。別の態様において、リンパ管の炎症性細胞誘引作用は、リンパ管内皮細胞におけるCCケモカインの発現量によって評価することができる。例えば、対象者のCCケモカインの発現量が同世代のものと比較して有意に低い場合、リンパ管の炎症性細胞誘引作用は低下しているとみなされる。
【0032】
本発明の評価方法において、リンパ管の誘引作用の代わりに又は誘引作用とともに、炎症性細胞の遊走能を評価してもよい。評価精度を向上させる観点からは、リンパ管の誘引作用と炎症性細胞の遊走能の両方を評価することが好ましい。炎症性細胞の遊走能は、上記三次元モデルを使用する場合、遊走量、すなわち、既定の時間間隔で炎症細胞の遊走距離を測定し、単位時間当たりのその変位量を指標として評価することができる。別の態様において、炎症性細胞の遊走能は、炎症性細胞におけるCCケモカイン受容体の活性化状態によって評価することができる。例えば、対象者の炎症性細胞が発現するCCケモカイン受容体の活性化状態が同世代のものと比較して有意に低い場合、炎症性細胞の遊走能は低下しているとみなされる。
【0033】
前記CCケモカインは、好ましくはCCケモカイン受容体CCR7のリガンドであり、より好ましくはCCL21又はCCL19である。CCL21が特に好ましい。
【0034】
本発明は、in vitroの細胞の老化状態を評価するのにも使用することができ、例えば、培養リンパ管内皮細胞の誘引作用を評価することで、当該リンパ管内皮細胞がどの程度継代されたものかを判断することができる。
【0035】
次に、本願発明を以下の実施例により更に具体的に説明する。
【実施例】
【0036】
1.三次元共培養モデルの作成
BD Matrigel(登録商標)基底膜マトリックスグロースファクターリデュースト(BD Biosciences)と10倍濃度ダルベッコリン酸緩衝生理食塩水(Sigma-Aldrich Co. LLC)を10:1の割合で混合した後、カバーグラスチャンバー 8ウェル(nunc; Thermo Fisher Scientific K.K.)に150 μlを入れ、37℃ 5%CO2の保湿インキュベーターで50分間維持してゲル化した。その後、ゲル上にヒト新生児包皮よりCD31陽性CD34陰性CD45陰性細胞として単離したリンパ管内皮細胞(Kajiya K., et al., (2005) Hepatocyte growth factor promotes lymphatic vessel formation and function. EMBO J 24:2885-95)を2x104細胞数/ウェルで播種し、37℃ 5%CO2の保湿インキュベーターで15時間培養し、ネットワークを形成させた。リンパ管内皮細胞を標識する場合にはPKH26赤色蛍光細胞リンカーキット(Sigma-Aldrich Co. LLC)を用いて細胞膜標識をし、同細胞数をゲル上に播種した。
【0037】
リンパ管内皮細胞と共培養される炎症性細胞として、100 ng/ml PMA(Sigma-Aldrich Co. LLC)刺激を48時間行ってマクロファージへ分化させたTHP1(American Type Culture Collection)細胞を用いた。炎症性細胞をPKH67緑色蛍光細胞リンカーキット(Sigma-Aldrich Co. LLC)で細胞膜標識した後、ネットワークを形成したリンパ管内皮細胞上に2x103細胞数/ウェルで添加した。
【0038】
2.継代数の異なるリンパ管内皮細胞の誘引作用及び炎症性細胞の遊走能の評価
上記三次元モデルの製法に従い、継代培養を繰り返したリンパ管内皮細胞が導入された三次元モデル(long time passage)を作成した(リンパ管内皮細胞の継代数:13又は16)。作成後、HSオールインワン蛍光顕微鏡 BZ-9000(KEYENCE CORPORATION. Japan)を用いて、三次元モデルについてタイムラプス撮影を行った。各撮影時間において、視野中のリンパ管内皮細胞ネットワーク上に存在する炎症性細胞を数え、視野中に存在する炎症性細胞の総数に対する割合(誘引率(%))を求めた。結果を図1に示す。図1より、コントロール(early passage)として使用した、継代数7回のリンパ管内皮細胞を含んで成る三次元モデルと比較して、継代数の多いリンパ管内皮細胞を含んで成る三次元モデル(long time passage)は、マクロファージの誘引率が有意に低下したことが分かる。
【0039】
また、動画編集解析ソフトウェア(KEYENCE CORPORATION. Japan)を用いて、炎症性細胞の動きを追尾し、追尾開始時点の細胞の位置から追尾終了時点の細胞の位置までの直線距離を算出し、これを炎症性細胞の遊走量として評価した。単位時間当たりに測定された遊走量を図2に示す。
【0040】
図2に示すとおり、継代数の多いリンパ管内皮細胞を含んで成る三次元モデルにおいて、マクロファージの誘引率だけでなく遊走量も有意に低下した。これらの結果から、繰り返し継代して培養し、細胞老化が進んだリンパ管内皮細胞では誘引作用が低下していることがわかる。
【0041】
3.継代数の異なるリンパ管内皮細胞におけるCCL21の定量解析
上記リンパ管細胞を二次元培養し、それぞれ継代数の異なるリンパ管細胞を準備した。リンパ管内皮細胞のTotal RNAをTRIZOL Reagent(Invitrogen, Carlsbad, CA)を用いて抽出した。Total RNA 2μgをOne step qRT-PCR MasterMix(Eurogentec S.A.)と混合し、ABI Prism 7000 Sequence Detection System (Applied Biosystems, Foster City, CA)を用いてリアルタイム定量PCRを行った。
【0042】
CCL21については、TaqMan gene expression assays(Applied Biosystems Inc., Hs00171076)を、内部標準のβ-アクチンについては、以下のプライマー(フォワードプライマー:5’-TCACCGAGCGCGGCT-3’(配列番号1);リバースプライマー:5’-TAATGTCACGCACGATTTCCC-3’(配列番号2))及びプローブ(5’-FAM-CAGCTTCACCACCACGGCCGAG -TAMRA-3’(配列番号3))を用いた。β-アクチン補正後のCCL21の定量結果を図3に示す。
【0043】
図3の結果から、継代数の増加と共にCCL21の発現量が低下したことが分かる。すなわち、老化が進行するにつれ、CCL21の発現量は低下する。上記結果は、上記三次元モデルにおいて継代数の異なるリンパ管内皮細胞を用いた場合、継代数の多いリンパ管内皮細胞を用いた三次元モデルにおいてマクロファージの遊走量が低下した結果とも符号する。
【特許請求の範囲】
【請求項1】
抗老化剤のスクリーニング方法であって、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る方法。
【請求項2】
前記候補薬剤が、前記リンパ管を構成するリンパ管内皮細胞におけるCCケモカインの発現を亢進するか、又は前記炎症性細胞が発現するCCケモカイン受容体を活性化する場合に、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させると評価される、請求項1に記載の方法。
【請求項3】
前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、請求項2に記載の方法。
【請求項4】
前記リガンドがCCL21である、請求項3に記載の方法。
【請求項5】
前記抗老化剤が皮膚老化を防止又は抑制するためのものである、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を指標とする、老化状態を評価するための方法。
【請求項7】
リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能が、リンパ管内皮細胞におけるCCケモカインの発現量又は炎症性細胞が発現するCCケモカイン受容体の活性化状態により評価される、請求項6に記載の方法。
【請求項8】
前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、請求項7に記載の方法。
【請求項9】
前記リガンドがCCL21である、請求項8に記載の方法。
【請求項10】
前記老化が皮膚老化である、請求項6〜9のいずれか1項に記載の方法。
【請求項1】
抗老化剤のスクリーニング方法であって、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させる候補薬剤を抗老化剤として選定する工程を含んで成る方法。
【請求項2】
前記候補薬剤が、前記リンパ管を構成するリンパ管内皮細胞におけるCCケモカインの発現を亢進するか、又は前記炎症性細胞が発現するCCケモカイン受容体を活性化する場合に、リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を活性化させると評価される、請求項1に記載の方法。
【請求項3】
前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、請求項2に記載の方法。
【請求項4】
前記リガンドがCCL21である、請求項3に記載の方法。
【請求項5】
前記抗老化剤が皮膚老化を防止又は抑制するためのものである、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能を指標とする、老化状態を評価するための方法。
【請求項7】
リンパ管の炎症性細胞誘引作用及び/又は炎症性細胞の遊走能が、リンパ管内皮細胞におけるCCケモカインの発現量又は炎症性細胞が発現するCCケモカイン受容体の活性化状態により評価される、請求項6に記載の方法。
【請求項8】
前記CCケモカインがCCケモカイン受容体CCR7のリガンドである、請求項7に記載の方法。
【請求項9】
前記リガンドがCCL21である、請求項8に記載の方法。
【請求項10】
前記老化が皮膚老化である、請求項6〜9のいずれか1項に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−48582(P2013−48582A)
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願番号】特願2011−188395(P2011−188395)
【出願日】平成23年8月31日(2011.8.31)
【出願人】(000001959)株式会社 資生堂 (1,748)
【Fターム(参考)】
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願日】平成23年8月31日(2011.8.31)
【出願人】(000001959)株式会社 資生堂 (1,748)
【Fターム(参考)】
[ Back to top ]

