抗肥満剤及び糖尿病改善剤
【課題】クワ科の植物に着目して、天然成分からなる新規な抗肥満剤を提供する。
【解決手段】クワ科植物の根の皮の抽出物を含有する抗肥満剤である。
【解決手段】クワ科植物の根の皮の抽出物を含有する抗肥満剤である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は抗肥満剤及び糖尿病改善剤に係わり、特に、クワ科植物の根の皮の抽出物を含有することを特徴とするものに関するものである。
【背景技術】
【0002】
近年、日本および欧米先進国のみならず、中国においても、肥満が急増している。特に、内臓肥満を中心として、糖尿病、高血圧、高脂血症などが集積した病態であるメタボリックシンドロームが注目されている。
【0003】
中国の衛生部の調査によると、2002年には2億人が標準体重を超え、6000万人が肥満症だということが分かった。また、18歳以上のうち、高血圧人は1億6000万人(罹患率約18.8%)、糖尿病人は2000万(罹患率約2.6%)である。
【0004】
日本の厚生労働省の「2007年国民健康・栄養調査」によると、糖尿病が強く疑われる人は約890万人。糖尿病の可能性が否定できない人は約1320万人、合わせて約2210万人と推定された。40〜74歳でみると、男性の2人に1人、女性の5人に1人が、メタボリックシンドロームが強く疑われる者又は予備群と考えられている。高脂肪食や運動不足による肥満の増加とそれに伴うインスリン抵抗性はメタボリックシンドロームのリスクを上げることが知られている。
【0005】
また、インスリン抵抗性の状態では、軽度の慢性炎症状態にあることが明らかになってきた。肥満者では脂肪細胞の肥大化が認められ、肥大した脂肪細胞では、TNF-α、IL-6に代表される炎症性アディポサイトカインの分泌の増加とアディポネクチンのような抗炎症性アディポサイトカインの産生が減少している事が認められ、インスリン抵抗性が惹起されると言われている。
【0006】
一方、正常な小型脂肪細胞ではインスリン感受性サイトカインであるアディポネクチンを分泌してインスリン感受性を改善することが知られている。そこで、メタボリックシンドロームを抑制するためには、脂肪細胞の分化を抑えること、また、小型脂肪細胞からのアディポネクチンを上昇させると共にTNF-αを下降させる必要がある。
【0007】
肥満や糖尿病、高血圧を抑制するための対策としては、脂肪細胞の分化を抑えること、また、小型脂肪細胞からのアディポネクチンを上昇させると共にTNF-αなどの炎症性サイトカインを下降させる必要がある。最近、マクロファージは脂肪組織に浸潤し、肥大化した脂肪細胞が相互作用することによって炎症が惹起され、インスリン抵抗性が発症や増悪するといわれている。
【0008】
天然物由来のresveratrol、quercetin、vitisin A、xanthohumol、isoxanthohumol、capsaicinなどの化合物は脂肪細胞の分化と中性脂肪の蓄積を抑制することが報告されている。また、phloretin、retrofractaminde A、narigenin、hesperetin、catechin、6-gingerol、curcumin、capsaicinなどの化合物は脂肪細胞からのアディポネクチンの分泌を増加することが報告されている。curcumin、resveratrolなどの化合物は脂肪細胞からのTNF-αの分泌を下降することが知られている。
【0009】
特開2002−138044号公報には、アカネ、アスナロ、アマチャ、オオバナサルスベリ、ガイヨウ、ハクカユマトウ、ハスナゲ、ヒキオコシ、ホウキギから選ばれる1種以上の植物抽出物を含有して、前駆脂肪細胞の分化誘導を阻害する薬剤、化粧料組成物又は飲食品が開示されている。
【0010】
さらに、特開2007−269757号公報には、副作用がなく優れた前駆脂肪細胞分化誘導阻害作用を有する脂肪細胞分化阻害剤が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2002−138044号公報
【特許文献2】特開2007−269757号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
マグワMorus alba L.は、クワ科植物で、東アジアに広く分布、または栽培される落葉高木であり、樹皮は灰色を帯び、葉は互生、卵形〜広卵形で、縁にはあらい鋸歯があり、時に、片側に湾入があり、雌雄異株、まれに同株であり、淡黄色の無花弁を多数付けて穗状に垂れ下がり、果実は初夏に熟すと紫黒色の集合果となり、その果実は甘酸っぱく、食用にされている。
【0013】
桑白皮は《神農本草経》の中品に「桑根白皮」として収録され、その薬能は「傷中、五労、六極の羸痩、崩中、脈絶を主どる、云々」と記載され、また、薬性論には「肺気喘満、虚労客熱、頭痛を治し、不足を内補する」と述べられている。
【0014】
《本草綱目》には「消渇多尿(糖尿病に相当)で(桑白皮を)水で濃汁に煮て随意に飲む」と記載されている。中国で、秋末または春発芽前に桑根を掘り起こし、コルク皮を除去し、皮を剥ぎ取って乾燥する。生薬として皮の色は白色また淡黄色である。桑白皮は中国薬典と日本薬局方に収載され、鎮咳去痰、消炎薬として杏蘇散,五虎湯,清肺湯などに配合されており、喘を鎮め、肺の腫れを消す効能があり、肺熱喘咳、水腫、排尿障害を治すことが知られている。
【0015】
また、桑白皮の成分として、プレニールフラボノイド、トリテルペン、2-アリルベンゾフラン誘導体、Diels-Alder型付加化合物)などの報告がある。さらに、その薬理作用として、抗菌作用、血圧下降作用、血糖下降作用、抗炎症作用、抗酸化作用などの報告がある。
【0016】
本発明は、クワ科の植物に着目して、天然成分からなる新規な抗肥満剤及び糖尿病改善を提供することを目的とするものである。
【課題を解決するための手段】
【0017】
前記目的を達成するために、本発明は、クワ科植物の根の皮の抽出物を含有する抗肥満剤及び糖尿病改善であることを特徴とするものである。
【発明の効果】
【0018】
本発明によれば、クワ科の植物の天然成分からなる新規な抗肥満剤及び糖尿病改善を提供することができる。
【図面の簡単な説明】
【0019】
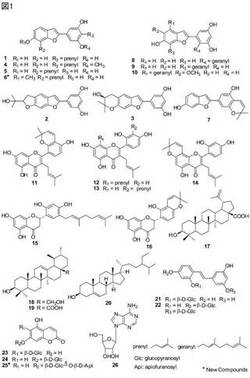
【図1】クワ科植物の根の皮の抽出物に属する複数の有効成分の各化合物(複数)の構造式を示した一覧図である。
【図2】化合物6の1H-1H COSY、HMQCを測定した結果の部分構造を示すブロック図である。
【図3】化合物25の1H-1H COSY、HMQCを測定した結果の部分構造を示すブロック図である。
【図4】桑根皮の抽出液、各画分についてのTG蓄積抑制試験とGPDH活性試験との結果を示す表である。
【図5】桑根皮より得られた各化合物についてのTG蓄積抑制試験とGPDH活性試験の結果を示す表である。
【図6】桑根皮より得られた各化合物についてのNO産生抑制試験の結果を示す表である。
【発明を実施するための形態】
【0020】
本発明者は、マグワ(M. alba var. multicaulis Perro.)の根の皮を剥ぎ取って、桑根皮(桑白皮と異なりコルクを除去していない皮部)を抽出し、成分の単離と構造決定を行い、次のとおり、10種のベンゾフラン誘導体、6種のフラボノイド誘導体、3種のトリテルベン誘導体、1種のステロイド誘導体、2種のスチルベン誘導体、3種のクマリン誘導体及びアデノシンなど、26種の化合物の単離・構造決定を行った。このうち、化合物6はベンゾフラン誘導体、化合物25はクマリン誘導体で、いずれも新規化合物である。
【0021】
また、これらの化合物について、3T3-L1前駆脂肪細胞の分化および中性脂肪蓄積を抑制作用、マクロファージの一酸化窒素産生抑制作用を有する活性成分について検討した。図1に化合物1〜26の構造式を示す。
【実施例】
【0022】
以下、実施例を挙げて、本発明を更に詳細に説明する。本発明はこれらの実施例に限定されるものではない。日本国千葉県産の魯桑(Morus alba var. multicaulis Perro.)の根皮を80%メタノール45Lで3回抽出を行い、減圧濃縮して1311.9 gのエキスを得た。このエキスを水(6.0 L)に懸濁し、クロロホルム、酢酸エチル、ブタノール(各6.0 L×3)で順次分配抽出した。これらを減圧濃縮し、クロロホルム可溶性画分(8.72 g)、酢酸エチル可溶性画分(356.93 g)、ブタノール可溶性画分(225.06 g)、水可溶性画分(758.32 g)を得た。
【0023】
それぞれの画分について、3T3-L1前駆脂肪細胞の分化及び中性脂肪蓄積抑制試験を行い、また、RAW264.7のNO産生抑制試験を行い、サンプル濃度 30 μg/mLにおいて、クロロホルム画分(TG抑制率:46.1 %、NO抑制率:96.0 %)、酢酸エチル画分(TG:52.0 %、NO:98.2 %)、ブタノール画分(TG :44.5 %、NO:27.9 %)、水画分(TG:22.3 %、NO:11.2 %)の活性が認められた。
【0024】
上記の各画分のうち、抑制効果が高い酢酸エチル可溶性画分(331.39 g)をシリカゲルカラムクロマトグラフィー(Silica gel 60N、12.5×31 cm)に付し、クロロホルム:メタノール=100:0~0:100で溶出し、Fr.1~Fr.14に分画した。Fr.9(31.477g)をODS C.C.(Chromatorex、12.5×31 cm)に付し、水:メタノール=80:20~0:100で溶出し、12個の画分を得た。
【0025】
Fr.9-6(0.791g)をSilica gel C.C.(2.5×18 cm)に付し、n-ヘキサン:酢酸エチル=80:20~0:100、メタノールで溶出し、4個の画分を得た。このうちFr.9-6a(83mg)を高速液体クロマトグラフィー(HPLC、Fulofix 120E、10×250 mm、UV254 nm、CH3CN:H2O=43:57、3 ml/min)により精製を行い、化合物1(保時時間15分14秒、40.0 mg)を得た。Fr.9-6b(148mg)を高速液体クロマトグラフィー(HPLC、Fulofix 120E、10×250 mm、UV254 nm、CH3CN:H2O=42:58、3 ml/min)により精製を行い、化合物5(保時時間13分42秒、25.0 mg)を得た。Fr.9-6c(338mg)を高速液体クロマトグラフィー(HPLC、Senshu Pak Aquasil SS、10×250 mm、UV254 nm、CHCl3:MeOH=100:1.5、3 ml/min)により精製を行い、化合物2(保時時間20分31秒、62.0 mg)と化合物3(保時時間21分20秒、20.0 mg)を得た。
【0026】
Fr.9-8(5.773 g)をSephadex LH-20 C.C.(Pharmacia、3.5×40 cm)水:メタノール=50:50~0:100で溶出し、9個の画分を得た。Fr.9-8-4(1.800 g)をSilica gel C.C.(2.5×18 cm)に付し、n-ヘキサン:酢酸エチル=90:10~0:100、メタノールで溶出し、6個の画分を得た。このうちFr.9-8-4-4(835mg)を高速液体クロマトグラフィー(HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV254 nm、CH3OH:H2O=80:20、3 ml/min)により精製を行い、化合物4(保時時間12分17秒、4.0 mg)、化合物6(保時時間13分35秒、5.0 mg)、及び11(保時時間14分15秒、30.0 mg)を得た。Fr.9-8-4-5(56 mg)を高速液体クロマトグラフィー(HPLC、Fulofix 120E、10×250 mm、UV 254 nm、CH3OH:H2O=75:25、4 ml/min)により精製を行い、化合物16(保時時間11分15秒、4.0 mg)及び化合物12(保時時間16分40秒、35.0 mg)を得た。
【0027】
Fr.9-8-6(1.987 g)をODS C.C.(Chromatorex、3.5×25 cm)に付し、水:メタノール=50:50~0:100で溶出し、7個の画分を得た。このうちFr.9-8-6-d(51 mg)を高速液体クロマトグラフィー(HPLC、Siseido SG80、10×250 mm、UV254 nm、n-hexane:EtOAc=70:30、4 ml/min)により精製を行い、化合物7(保時時間12分50秒、31.0 mg)を得た。
【0028】
Fr.9-8-6-f(500 mg)を高速液体クロマトグラフィー(HPLC、Siseido SG80、10×250 mm、UV 254 nm、n-hexane:EtOAc=70:30、4 ml/min)により精製を行い、化合物13(保時時間11分18秒、26.0 mg)、化合物9(保時時間18分32秒、45.0 mg)及び化合物8(保時時間22分53秒、38.0 mg)を得た。Fr.9-8-6-g(1267 mg)を高速液体クロマトグラフィー(HPLC、Siseido SG80、10×250 mm、UV254 nm、n-hexane:EtOAc=70:30、4 ml/min)により精製を行い、化合物10(保時時間18分10秒、15.0 mg)及び化合物15(保時時間23分00秒、438.0 mg)を得た。
【0029】
Fr.5と6を合わせて(12.346 g)Silica gel C.C.(6×15 cm)に付し、n-ヘキサン:酢酸エチル=100:0~0:100、メタノールで溶出し、6個の画分を得た。このうち、Fr.56-b(370 mg)から結晶が析出したため、これをろ取しクロロホルム-メタノールにより再結晶を行い、化合物20(210.2 mg)を得た。Fr.56-c(395 mg)から結晶が析出したため、これをろ取しクロロホルム-メタノールにより再結晶を行い、化合物17(183.9 mg)を得た。
【0030】
ろ液をまとめ、高速液体クロマトグラフィー(HPLC、YMC Pak SIL 60-5、4.6×250 mm、RI示差屈折計、n-hexane:EtOAc=75:25、1ml/min)により精製を行い、化合物18(6.0 mg)を得た。Fr.56-d(1268 mg)から結晶が析出したため、これをろ取しクロロホルム-メタノールにより再結晶を行い、化合物17(136.0 mg)を得た。ろ液をまとめ、高速液体クロマトグラフィー(HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV210 nm、CH3OH:H2O=80:20、4ml/min)により精製を行い、化合物14(保時時間14分31秒、28.0 mg)及び化合物19(保時時間18分45秒、7.0 mg)を得た。
【0031】
Fr.10(200 g)をHP-20 C.C.(Diaion、13×25 cm)水:メタノール=100:0~0:100、70%アセトンで溶出し、6個の画分を得た。このうち、Fr.10-2(1237 mg)をODS C.C.(Chromatorex、3.5×15 cm)に付し、水:メタノール=100:0~0:100で溶出し、6個の画分を得た。Fr.10-2-4(1010 mg)をSephadex LH-20 C.C.(Pharmacia、3.5×40 cm)に付し、水:メタノール=90:10~0:100で溶出し、30%メタノール部分を高速液体クロマトグラフィー(HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV254 nm、CH3OH:H2O=28:72、4 ml/min)により精製を行い、化合物21(保時時間12分47秒、56.0 mg)を得た。
ブタノール可溶性画分(225 g)をHP-20 C.C.(Diaion、13×25 cm)水:メタノール=100:0~0:100、70%アセトンで溶出し、4個の画分を得た。このうち、Fr.2(180 g)から結晶が析出したため、これをろ取し水-メタノールにより再結晶を行い、化合物22(2100 mg)を得た。
【0032】
ろ液をまとめ、Silica gel C.C.(Silica gel 60N、6×24 cm)に付し、クロロホルム:メタノール=100:0~0:100で溶出し、3の画分を得た。
【0033】
Fr.2-2(10.2 mg)ODS C.C.(Chromatorex、6×20 cm)に付し、水:メタノール=100:0~0:100で溶出し、4個の画分を得た。このうちFr.2-2-2(4086mg)を高速液体クロマトグラフィー((HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV254 nm、CH3OH:H2O=10:90、3 ml/min)により精製を行い、化合物26(保時時間7分02秒、10.0 mg)、化合物23(保時時間10分13秒5.0 mg)、化合物24(保時時間12分13秒4.0 mg)、及び化合物25(保時時間15分23秒、51.2 mg)を得た。
【0034】
Moracin C ( 1 )の構造
化合物1は、黄色粉末、EI-MSスペクトルにm/z 310を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 310.1204 (calcd. 310.1204)を示すことから、分子式C19H18O4が推定された。
【0035】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル [
δH 7.38 ( 1H, d, J = 8.5 Hz )、6.96 (1H, d, J = 2.0 Hz ) 及び6.80 ( 1H, dd, J = 8.5、2.0 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.92 ( 2H, s )]より1,3,4,5−四置換ベンゼンの存在が推定された。また、[5.30 ( 1H, m )、3.39 ( 2H, d, J = 7.0 Hz )、δH 1.78 ( 3H, s )及び1.65 ( 3H, s )]よりプレニル基の存在が推定された。
【0036】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 17.9, 25.9 )、1個のメチレン(δC 23.1 )、7個のメチン(δC 98.3, 101.4, 103.8×2, 113.1, 121.8, 124.8 )、9個の四級炭素シグナル(δC116.3, 122.6, 129.8, 131.0, 155.8, 156.5, 156.6, 157.2×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Takasugi M., Nagao S., Ueno S., Masamune T., Shirata A., Takahashi K., Chemistry Letters, (11), 1239 - 1240 (1978))を比較することにより、Moracin Cと同定した。
【0037】
Moracin O ( 2 )の構造
化合物2は、褐色粉末、EI-MSスペクトルにm/z 326を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 326.1154 (calcd. 326.1154)を示すことから、分子式C19H18O5が推定された。
【0038】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 6.85 ( 2H, d, J = 2.2 Hz ) 及び6.36 ( 1H, t, J = 2.2 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。[δH 7.33 ( 1H, s )及び6.86 (1H, s )] より1,2,4,5−四置換ベンゼンの存在が推定された。また、[δH 4.68 ( 1H, dt, J = 9.1, 8.4 Hz )、3.31 ( 1H, dd, J = 16.1, 8.4 Hz )、3.21 ( 1H, dd, J =16.1, 9.1 Hz )、1.23 ( 3H, s )]及び[δH 1.27 ( 3H, s )]のシグナルが認められた。
【0039】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 25.5, 26.0 )、1個のメチレン(δC 30.6 )、7個のメチン(δC 91.2, 92.9, 102.4, 103.0, 103.6×2, 116.9 )、9個の四級炭素シグナル(δC 71.5, 123.3, 125.2, 133.4, 155.5, 155.8, 159.6, 159.8×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ferrari. F., Delle monache F., Fitoterapia, (6), 554-555 (1998))を比較することにより、Moracin Oと同定した。
【0040】
Moracin P ( 3 )の構造
化合物3は、褐色粉末、EI-MSスペクトルにm/z 326を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 326.1154 (calcd. 326.1154)を示すことから、分子式C19H18O5が推定された。
【0041】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.26 ( 1H, s )及び6.88 (1H, s )] より1,2,4,5−四置換ベンゼンの存在が推定された。[δH 6.87 ( 2H, d, J = 2.2 Hz ) 及び 6.37 ( 1H, t, J = 2.2 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。また、[δH 3.83 ( 1H, dt, J = 8.2, 5.4 Hz )、3.11 ( 1H, dq, J =16.1, 5.4 Hz )、2.83 ( 1H, dq, J = 16.1, 8.2 Hz )、1.38 ( 3H, s )及びδH 1.26 ( 3H, s )]のシグナルが認められた。
【0042】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 20.5, 26.2 )、1個のメチレン(δC 32.4 )、7個のメチン(δC 69.9, 99.3, 101.9, 103.5, 103.8×2, 121.7 )、9個の四級炭素シグナル(δC 78.0, 117.9, 123.4, 133.3, 152.4, 155.3, 155.8, 159.8×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ferrari. F., Delle monache F., Fitoterapia, (6), 554-555 (1998))を比較することにより、Moracin Pと同定した。
【0043】
Artoindonesianin O ( 4 )の構造
化合物4は、黄色粉末、EI-MSスペクトルにm/z 324を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 324.1357 (calcd. 324.1361)を示すことから、分子式C20H20O4が推定された。
【0044】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.42 ( 1H, d, J = 8.4 Hz )、6.96 (1H, dd, J = 2.1 Hz )及び 6.80 ( 1H, dd, J = 8.4、2.1 Hz )] より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.81 ( 1H, d, J = 2.1 Hz) 及び 6.52 ( 1H, d, J = 2.1 Hz )]より1,3,4,5−四置換ベンゼンの存在が推定された。また、[δH 5.12 ( 1H, m )、3.46 ( 2H, d, J = 6.3 Hz )、1.64 ( 3H, d, J = 1.5 Hz )及びδH 1.67 ( 3H, d, J = 0.9 Hz)]よりプレニル基の存在が推定された。
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 17.7, 25.2 )、1個のメトキシ(δC 55.6 )、1個のメチレン(δC 26.0 )、7個のメチン(δC 97.7, 99.6, 105.2, 107.1, 112.4, 119.4, 124.4 )、9個の四級炭素シグナル(δC 121.3, 121.8, 130.4, 131.6, 154.4, 155.7×2, 156.4, 159.2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(E.H.Hakim., U.Z.Ulinnuha., Y. M. Syah., E.L.Ghisalberti., Fitoterapia 73 (3) 597-603(2002))を比較することにより、Artoindonesianin Oと同定した。
【0045】
Moracin R ( 5 )の構造
化合物5は、黄色粉末、EI-MSスペクトルにm/z 310を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 310.1205 (calcd. 310.1204)を示すことから、分子式C19H18O4が推定された。
【0046】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.23 ( 1H, d, J = 8.5 Hz ) 及び6.84 (1H, d, J = 8.5 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.90 ( 2H, d, J = 2.3 Hz ) 及び6.38 ( 1H, t, J = 2.3 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。また、[δH 5.45 ( 1H, m )、3.65 ( 2H, d, J = 7.5 Hz )、δH 1.89 ( 3H, s )及び1.67 ( 3H, s )]よりプレニル基の存在が推定された。
【0047】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 17.3, 25.1 )、1個のメチレン(δC 22.6 )、7個のメチン(δC 101.8, 102.7, 103.0×2, 112.3, 111.8, 122.3 )、9個の四級炭素シグナル(δC113.0, 121.8, 131.2, 132.8, 152.7, 154.5, 154.6, 159.0×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Shirata A., Takahashi K., Takasugi M., Nagao S., Ichikawa., Ueno S., Munoz L., Bull. Seric. Exp.Sta, 28 (6) 793 - 806 (1983))を比較することにより、Moracin Rと同定した。
【0048】
6- methylmoracin R ( 6 )の構造
化合物6は、黄色粉末、EI-MSスペクトルにm/z 324を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 324.1360 (calcd. 324.1361)を示すことから、分子式C20H20O4が推定された。UVスペクトルでは、216、318、330 nmに極大吸収が観測され、2-アリルベンゾフラン誘導体が推定された。
【0049】
1H-NMRでは、化合物5と比較すると新たにメトキシプロトンのシグナル[δH 3.90 ( 3H, s )]の存在が認められた。また、プロトン[δH 6.84 (1H, d, J = 8.5 Hz )]は低磁場にシフトして[δH 6.97 (1H, d, J = 8.5 Hz )]になった。他のプロトンシグナルの化学シフト値及び分裂タイプと化合物5比較する類似していることが明らかとなった。芳香族領域においてオルトカプリングするプロトンシグナル[δH 7.38 ( 1H, d, J = 8.5 Hz ) 及び6.97 (1H, d, J = 8.5 Hz )] より1,2,3,4−四置換ベンゼンの存在が推定された。メタカプリングするプロトンシグナル[δH 6.91 ( 2H, d, J = 2.4 Hz ) 及び6.39 ( 1H, t, J = 2.4 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。また、1個のオレフィンプロトンシグナル[δH 5.38 ( 1H, m )]、1個のメチレンシグナル[δH 3.63 ( 2H, d, J = 7.3 Hz )]、2個のメチルシグナル[δH 1.88 ( 3H, s )及び1.67 ( 3H, s ) ]よりプレニル基の存在が推定された。
【0050】
13C-NMR及びDEPTスペクトルでは、1個のメトキシ(δC 56.9 )、2個のメチル(δC 18.0, 25.9 )、1個のメチレン(δC 23.4 )、7個のメチン(δC 102.4, 103.7, 103.9×2, 109.0, 119.0, 123.0 )、9個の四級炭素シグナル(δC113.9, 123.8, 132.1, 133.4, 154.9, 156.0, 156.1, 159.8×2 )の存在が明らかになった。1H-1H COSY、HMQCを測定した結果、図2に示すような部分構造A-Cが推定された。
【0051】
さらに、プロトン及びカーボンシングナルの帰属及び置換基の結合位置を決定するため、HMBCスペクトルを測定した。1,2,3,4−四置換ベンゼン上のδH 7.38 ( H-4 )はδC 101.8 ( C-3 )、113.9 ( C-7 )及び154.9 ( C-7a )と、δH 6.97 ( H-5 )はδC 113.9 ( C-7 )、123.8 ( C-3a )及び156.0 ( C-6 )とロングレンジ相関が認められた。1,3,5−三置換ベンゼンのδH 6.91 ( H-2', 6' )はδC 103.7 ( C-4' )、156.1 ( C-1 )及び159.8 ( C-3', 5' )と、δH 6.39 ( H-4' )はδC 103.9 ( C-2',6')及び159.8 ( C-3', 5' )とロングレンジ相関が認められた。プレニル基のδH 3.63 ( H-1'' )はδC 113.9 ( C-7 )、123.0 ( C-2'' )、132.1 ( C-3'' )及び154.9 ( C-7a )と、δH 5.38 ( H-2'' )はδC 18.7 ( C-5'' )、23.4 ( C-1'' )及び25.9 ( C-3'' )ロングレンジ相関が認められた。また、δH 7.06 ( H-3 )はδC 119.0 ( C-4 )、123.8 ( C-3a )及び154.9 ( C-7a )とロングレンジ相関が認められた。さらに、3.90のメトキシ基はδC 156.0 ( C-6 )と相関が認められた。以上の結果より化合物6の構造は6-methylmoracin Rと決定した。
【0052】
Moracin D ( 7 )の構造
化合物7は、褐色粉末、EI-MSスペクトルにm/z 308を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 308.104 (calcd. 308.104)を示すことから、分子式C19H16O4が推定された。
【0053】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル
[δH 7.39 ( 1H, d, J = 8.1 Hz )、6.96 ( 1H, dd, J = 2.1 Hz ) 及び6.79 (1H, dd, J = 8.1, 2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.92 ( 1H, d, J = 1.5 Hz )、6.77 ( 1H, dd, J = 1.5, 0.9 Hz )、δH 6.69 ( 1H, d, J = 9.9, 0.9 Hz ) 及び5.67 ( 1H, dd, J = 9.9 Hz )]よりchromeneの存在が推定された20)。また、[δH 1.42 (6H, s )]より2個のメチルの存在が推定された。
【0054】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 27.7×2 )、8個のメチン(δC 97.8, 101.8, 103.8, 104.2, 112.6, 116.9, 121.3, 129.0 )、9個の四級炭素シグナル(δC76.0, 109.8, 121.9, 129.0, 131.3, 153.4, 154.4×2, 156.0 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Takasugi M., Nagao S., Ueno S., Masamune T., Shirata A., Takahashi K., Chemistry Letters, (11), 1239 - 1240 (1978))を比較することにより、Moracin Dと同定した。
【0055】
Albafuran A ( 8 )の構造
化合物8は、黄色粉末、EI-MSスペクトルにm/z 378を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 378.1831 (calcd. 378.1830)を示すことから、分子式C24H26O4が推定された。
【0056】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.40 ( 1H, d, J = 8.7 Hz )、6.81 ( 1H, dd, J = 8.7, 2.1 Hz )及び6.97 (1H, d, J = 2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.74 ( 1H, d, J = 2.7 Hz )及び6.49 (1H, d, J = 2.7 Hz )]より1,2,3,5−四置換ベンゼンの存在が推定された。また、[δH 5.20 ( 1H, m )、5.07 ( 1H, m )、3.52 ( 2H, d, J = 6.6 Hz )、2.01 ( 4H, m )、1.69 ( 3H, s )、1.60 ( 3H, s )及び1.55 ( 3H, s )]よりゲラニル基の存在が推定された。
【0057】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 16.1, 17.4, 25.5 )、3個のメチレン(δC 25.9, 27.0, 40.0 )、8個のメチン(δC 97.8, 103.2, 104.9, 107.1, 112.3, 121.2, 124.5, 124.7 )、10個の四級炭素シグナル(δC 117.9, 121.9, 130.8, 132.0, 134.1, 154.7, 155.7×2, 156.0, 156.7 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Takasugi M., Ishikawa S., Masamune T., Chemistry Letters, (8), 1221 - 1222 (1982))を比較することにより、Albafuran Aと同定した。
【0058】
Mulberrofuran L ( 9 )の構造
化合物9は、黄色粉末、EI-MSスペクトルにm/z 378を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 378.1832 (calcd. 378.1830)を示すことから、分子式C24H26O4が推定された。
【0059】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.21 ( 1H, d, J = 8.4 Hz )及び6.82 (1H, d, J = 8.4 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.88 ( 2H, d, J = 2.4 Hz )及び6.36 (1H, t, J = 2.4 Hz )]より1,3,4−三置換ベンゼンの存在が推定された。また、[δH 5.45 ( 1H, m )、5.03 ( 1H, m )、3.65 ( 2H, d, J = 7.2 Hz )、2.01 ( 4H, m )、1.90 ( 3H, s )、1.55( 3H, s )及び1.51 ( 3H, s )]よりゲラニル基の存在が推定された。
【0060】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 16.2, 17.3, 25.4 )、3個のメチレン(δC 23.0, 27.0, 40.1 )、8個のメチン(δC 102.0, 102.8, 103.2×2, 112.4, 118.2, 122.4, 124.3 )、10個の四級炭素シグナル(δC 111.5, 121.9, 130.9, 132.9, 134.9, 152.7, 154.6×2, 159.0×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Fujimoto T., Hano Y., Nomura T., Uzawa J., Heterocycles, 22 (12) 2805 - 2811 (1984))を比較することにより、Mulberrofuran Lと同定した。
【0061】
Mulberrofuran Y ( 10 )の構造
化合物10は、黄色粉末、EI-MSスペクトルにm/z 408を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 408.1933 (calcd. 408.1936)を示すことから、分子式C25H28O5が推定された。
【0062】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 6.83 ( 2H, d, J = 2.4 Hz )及び6.34 (1H, t, J = 2.4 Hz )]より1,3,4−三置換ベンゼンの存在が推定された。[δH 7.01 ( 1H, d, J = 0.9 Hz )及び6.91 ( 1H, d, J = 0.9 Hz )]のプロトンシグナルが認められた。また、[δH 5.32 ( 1H, m )、5.05 ( 1H, m )、3.59 ( 2H, d, J = 6.9 Hz )、2.01 ( 4H, m )、1.87 ( 3H, s )、1.57( 3H, s )及び1.54 ( 3H, s )]よりゲラニル基の存在が推定された。
【0063】
13C-NMR及びDEPTスペクトルでは、1個のオキシメチル(δC 61.1 )、3個のメチル(δC 16.1, 17.4, 25.4 )、3個のメチレン(δC 26.6, 26.9, 40.0 )、7個のメチン(δC 96.5, 101.1, 102.8, 103.1×2, 123.2, 124.3 )、11個の四級炭素シグナル(δC 121.3, 126.6, 131.0, 132.7, 135.2, 143.0, 148.9, 151.4, 154.5, 159.0×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Shi Y. Q., Fukai T., Sakagami H., Chang W. J., Yang P. Q., Wang F. P., Nomura T., J. Nat. Prod., 64 (2) 181 - 188 (2001))を比較することにより、Mulberrofuran Yと同定した。
【0064】
Kuwanon A ( 11 )の構造
化合物11は、黄色粉末、EI-MSスペクトルにm/z 420を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 420.1575 ( calcd. 420.1572 )を示すことから、分子式C25H24O6が推定された。
【0065】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.08 ( 1H, d, J = 8.1 Hz )及び6.56 (1H, d, J = 8.1 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.31( 1H, d, J = 2.0 Hz )及び6.24 (1H, d, J = 2.0 Hz )]より1,2,3,5−四置換ベンゼンの存在が推定された。[δH 6.73 ( 1H, d, J = 9.9 Hz )及び5.71 ( 1H, d, J = 9.9 Hz )]よりシスカプリングするオレフィンの存在が推定された。また、[δH 5.10 ( 1H, m )、3.10 ( 2H, d, J = 7.2 Hz )、1.44 ( 3H, s )及び1.57 (3H, s )]よりプレニル基の存在が推定された。[δH 13.11 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0066】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 17.4, 25.5, 27.8 )、1個のメチレン(δC 24.3 )、7個のメチン(δC 93.5, 98.7, 107.8, 116.7, 122.2, 129.2, 130.2 )、12個の四級炭素シグナル(δC 76.9, 104.5, 109.8, 113.2, 120.7, 131.4, 152.1, 154.9, 158.3, 161.3, 162.5, 163.9 ) 及び1個のカルボニル基(δC 182.0 )の存在が明らかになった。
【0067】
1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Hano Y., Hirakura K., Nomura T., Uzawa J., Chem. Pharm. Bull., 26 (5) 1453-1458 (1978))を比較することにより、Kuwanon Aと同定した。
【0068】
Kuwanon C ( 12 )の構造
化合物12は、黄色粉末、EI-MSスペクトルにm/z 422を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 422.1737 (calcd. 422.1729)を示すことから、分子式C25H26O6が推定された。
【0069】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.21 ( 1H, d, J =8.1 Hz )、6.56 ( 1H, d, J =2.1 Hz )及び6.51 ( 1H, dd, J = 8.1, 2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.30 ( 1H, s )]より1,2,3,4,5−五置換ベンゼンの存在が推定された。また、[δH 5.19 ( 1H, m )、5.12 ( 1H, m )、3.56 ( 2H, d, J = 7.5 Hz )、3.12 ( 2H, d, J = 6.9 Hz )、1.44 ( 3H, s )、1.57 ( 3H, s )及び1.58 ( 6H, s )]より2個のプレニル基の存在が推定された。[δH 13.05 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0070】
13C-NMR及びDEPTスペクトルでは、4個のメチル(δC 17.3, 17.4, 25.5×2 )、2個のメチレン(δC 21.8, 24.3 )、6個のメチン(δC 98.2, 103.2, 107.4, 122.1, 122.4, 131.6 )、12個の四級炭素シグナル(δC 104.6, 106.1, 112.5, 120.5, 130.9, 131.3, 155.7, 156.5, 160.1, 160.5, 160.9, 161.4 ) 及び1個のカルボニル基(δC 182.4 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Hano Y., Hirakura K., Nomura T., Uzawa J., Chem. Pharm. Bull., 26 (5) 1453-1458 (1978))を比較することにより、Kuwanon Cと同定した。
【0071】
Kuwanon T ( 13 )の構造
化合物13は、黄色粉末、EI-MSスペクトルにm/z 422を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 422.1724 (calcd. 422.1729)を示すことから、分子式C25H26O6が推定された。
【0072】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.00 ( 1H, d, J = 8.4 Hz )及び6.56 ( 1H, d, J = 8.4 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.29 ( 1H, d, J = 2.1 Hz )及び6.22 ( 1H, d, J = 2.1 Hz )]より1,2,3,5−四置換ベンゼンの存在が推定された。また、[δH 5.09 ( 1H, m )、5.30 ( 1H, m )、3.08 ( 2H, d, J = 6.9 Hz )、3.44 ( 2H, d, J = 7.2 Hz )、1.38 ( 3H, s )、1.56 ( 3H, s )、1.65 ( 3H, s )及び1.77 ( 3H, s )]より2個のプレニル基の存在が推定された。[δH 13.08 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0073】
13C-NMR及びDEPTスペクトルでは、4個のメチル(δC 17.3, 17.6, 25.5, 25.6 )、2個のメチレン(δC 22.8, 24.2 )、6個のメチン(δC 93.6, 98.6, 107.5, 121.6, 123.0, 128.0 )、12個の四級炭素シグナル(δC 104.7, 112.5, 116.2, 121.5, 130.7, 131.5, 153.6, 157.9, 158.6, 161.2, 162.5, 164.0 ) 及び1個のカルボニル基(δC 182.2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Hano Y., Hirakura K., Nomura T., Uzawa J., Chem. Pharm. Bull., 33 (10) 4288-4295 (1985))を比較することにより、Kuwanon Tと同定した。
【0074】
Morusin ( 14 )の構造
化合物14は、黄色粉末、EI-MSスペクトルにm/z 420を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 420.1572 ( calcd. 420.1572 )を示すことから、分子式C25H24O6が推定された。
【0075】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.26 ( 1H, d, J = 8.2 Hz )、6.58 ( 1H, d, J =2.0 Hz )及び6.53 ( 1H, dd, J = 8.2, 2.0 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。 [δH 6.16 ( 1H, s )]より1,2,3,4,5−五置換ベンゼンの存在が推定された。[δH 6.60 (1H, d, J = 10.0 Hz )及び5.65 ( 1H, d, J = 10.0 Hz )]よりシスカプリングするオレフィンの存在が推定された。また、[δH 5.13 ( 1H, m )、3.14 ( 2H, d, J = 7.2 Hz )、1.44 ( 3H, s )、及び1.57 ( 6H, s )]より1個のプレニル基の存在が推定された。[δH 13.10 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0076】
13C-NMR及びDEPTスペクトルでは、4個のメチル(δC 17.6, 25.8, 28.2×2 )、1個のメチレン(δC 24.6 )、7個のメチン(δC 99.7, 103.9, 108.2, 115.4, 122.5, 128.0, 132.4 )、12個の四級炭素シグナル(δC 78.7, 101.6, 105.6, 112.7, 121.7, 132.4, 153.2, 157.3, 159.9, 161.6, 162.4, 162.7 ) 及び1個のカルボニル基(δC 183.2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Nomura T., Fukai T., Yamada S., Katayanagi M., Chem. Pharm. Bull., 26 (5)1394-1402 (1978))を比較することにより、Morusinと同定した。
【0077】
Kuwanon E ( 15 )の構造
化合物15は、黄色粉末、EI-MSスペクトルにm/z 424を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 424.1885 (calcd. 424.1885)を示すことから、分子式C25H28O6が推定された。
【0078】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 5.95 ( 1H, d, J =2.0 Hz ) 及び5.96 ( 1H, d, J = 2.0 Hz )]よりより1,2,3,5−四置換ベンゼンの存在が推定された。[δH 7.21 ( 1H, s )及び6.50 ( 1H, s )]より1,2,4,5−四置換ベンゼンの存在が推定された。また、[δH 5.36 ( 1H, m )、5.12 ( 1H, m )、3.28 ( 2H, d, J = 7.3 Hz )、2.05 ( 2H, m )、2.10( 2H, m )、1.71 ( 3H, s )、1.62( 3H, s )及び1.57 ( 3H, s )]よりゲラニル基の存在が推定された。[δH 13.05 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0079】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 16.2, 17.7, 25.8 )、4個のメチレン(δC 27.4, 28.3, 40.5, 42.6 )、7個のメチン(δC 75.5, 95.8, 96.7, 103.5, 124.0, 125.1, 129.0 )、10個の四級炭素シグナル(δC 103.2, 117.0, 120.2, 131.6, 135.9, 154.2, 156.6, 164.8, 165.3, 167.3) 及び1個のカルボニル基(δC 197.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Nomura T., Fukai T., Planta Medica., 42, 79- 88 (1981))を比較することにより、Kuwanon Eと同定した。
【0080】
Sanggenon F ( 16 )の構造
化合物16は、黄色粉末、EI-MSスペクトルにm/z 354を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 354.1102 (calcd. 354.1103)を示すことから、分子式C20H18O6が推定された。
【0081】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 5.97 ( 1H, d, J =2.0 Hz ) 及び5.96 (1H, d, J = 2.0 Hz )]よりより1,2,3,5−四置換ベンゼンの存在が推定された。[δH 7.22 ( 1H, d, J = 8.6 Hz )及び6.50 ( 1H, d, J = 8.6 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.71 ( 1H, d, J = 10.0 Hz )及び5.70 ( 1H, d, J = 10.0 Hz )]よりシスカプリングするオレフィンの存在が推定された。また、[δH 13.05 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0082】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 27.8, 27.9 )、1個のメチレン(δC 42.7 )、7個のメチン(δC 74.9, 95.8, 96.8, 108.5, 117.7, 127.7, 129.6 )、9個の四級炭素シグナル(δC 77.0, 103.2, 110.3, 118.7, 151.7, 154.2, 164.8, 165.4, 167.4 ) 及び1個のカルボニル基(δC 197.5 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Nomura T., Fukai T., Hano Y., Tsukamoto K., Heterocycles, 20 (4) 661-666 (1983))を比較することにより、Sanggenon Fと同定した。
【0083】
Betulinic acid ( 17 )の構造
化合物17は、無色針状結晶、mp300℃、EI-MSスペクトルにm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3600 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0084】
1H-NMRでは、4級炭素に結合する6個のメチルプロトン(δH 0.83, 1.02, 1.07, 1.08, 1.23, 1.80 )、1個のオキシメチンプロトン(δH 3.46 )、1個の末端メチレンプロトン(δH 4.78, 4.95)の存在が認められた。
【0085】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0086】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0087】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0088】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0089】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0090】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0091】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0092】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0093】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0094】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0095】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0096】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0097】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0098】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0099】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0100】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0101】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0102】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0103】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0104】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0105】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0106】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0107】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0108】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0109】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0110】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0111】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0112】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0113】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0114】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0115】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0116】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0117】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0118】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0119】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0120】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0121】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0122】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0123】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0124】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0125】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0126】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0127】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0128】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0129】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0130】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0131】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0132】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0133】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0134】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0135】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0136】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0137】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0138】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0139】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0140】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0141】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0142】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0143】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0144】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0145】
【化1】

【0146】
Mulberroside A ( 22 )の構造
化合物22は、無色粉末、Negative-FAB-MSスペクトルよりm/z 567 [M-H]-を与え、疑似分子イオンピークが認められ、HR-FAB-MSでは、m/z 567.1716 (calcd. 567.1712)を示すことから、分子式C26H32O14が推定された。
【0147】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.42 ( 1H, d, J = 9.0 Hz )、6.59 ( 1H, d, J = 2.0 Hz )及び6.58 ( 1H, dd, J = 9.0、2.0 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.76 ( 1H, t, J = 2.0 Hz )、6.63 ( 1H, t, J = 2.0 Hz )及び6.44 ( 1H, t, J = 2.0 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。[δH 7.31 (1H, d, J = 16.6 Hz )及び6.93 ( 1H, d, J = 16.6 Hz )]よりトランス−オレフィンの存在が推定された。また、[δH 4.90 ( 1H, d, J = 7.0 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0148】
13C-NMR及びDEPTスペクトルでは、2個のメチレン(δC 62.4, 62.5 )、17個のメチン(δC 71.3×2, 74.8, 74.9, 78.0×2, 78.07, 78.12, , 102.0, 102.3, 104.0, 104.9, 107.2, 108.2, 109.3, 124.9, 127.6, 128.4 )、6個の四級炭素シグナル(δC 120.2, 141.9, 157.1, 159.5×2, 160.4×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Hirakura K., Fujimoto Y., Fukai T., Nomura T., J. Nat. Prod., 49 (2) 218-224 (1986))を比較することにより、下記化2に示すMulberroside Aと同定した。
【0149】
【化2】

【0150】
Mulberroside B ( 23 )の構造
化合物23は、無色粉末、Positive-FAB-MSスペクトルよりm/z 341を与え、疑似分子イオンピーク[M+H]+が認められ、HR-FAB-MSでは、m/z 341.0868 (calcd. 341.0872)を示すことから、分子式C15H16O9が推定された。
【0151】
1H-NMRでは、芳香族領域においてシスカプリングするオレフィンプロトンシグナル[δH 6.08 ( 1H, d, J = 9.5 Hz )及び8.02 ( 1H, d, J = 9.5 Hz )]、1個のシングルプロトンのシグナル[δH 6.30 ( 1H, s Hz )]が観測された。また、[δH 4.73 ( 1H, d, J = 9.8 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0152】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 60.1 )、8個のメチン(δC 69.3, 72.1, 74.7, 77.9, 81.0, 94.6, 108.8, 139.6 ) 、6個の四級炭素シグナル(δC 102.3, 109.2, 154.0, 155.0, 160.2, 160.6 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値Hirakura K., Saida I., Fukai T., Nomura T., Heterocycles, 23 (9) 2239-2242 (1985)を比較することにより、下記化3に示す、Mulberroside Bと同定した。
【0153】
【化3】

【0154】
5,7-dihydroxycoumarin 7-O-β-D-glucopyranoside ( 24 )の構造
化合物24は、無色粉末、Positive-FAB-MSスペクトルよりm/z 341を与え、疑似分子イオンピーク[M+H]+が認められ、HR-FAB-MSでは、m/z 341.0866 (calcd. 341.0872)を示すことから、分子式C15H16O9が推定された。
【0155】
1H-NMRでは、芳香族領域においてシスカプリングするオレフィンプロトンシグナル[δH 6.13 ( 1H, d, J = 9.4 Hz )及び8.10 ( 1H, d, J = 9.4 Hz )]、メタカプリングするプロトンのシグナル[δH 6.48 ( 1H, d, J = 2.0 Hz )及び6.53 ( 1H, d, J = 2.0 Hz )]が観測された。また、[δH 4.96 ( 1H, d, J = 7.4 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0156】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 62.4 )、9個のメチン(δC 71.2, 74.7, 77.9, 78.3, 96.2, 100.3, 101.8, 111.2, 141.2 )、4個の四級炭素シグナル(δC 105.6, 157.6, 163.0, 163.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値を比較することにより、下記化4に示す、5,7-dihydroxycoumarin 7-O-β-D-glucopyranosideと同定した。
【0157】
【化4】

【0158】
5,7-dihydroxycoumarin 7-O-β-D-apiofuranosyl -(1→6)-O-β-D-glucopyranoside( 25 )の構造
化合物25は、黄色粉末、Negative-FAB-MSスペクトルよりm/z 471 [M-H]- に疑似分子イオンピークが認められ、HR-FAB-MSでは、m/z 471.1137 (calcd. 471.1137)を示すことから、分子式C20H24O13が推定された。UVスペクトルでは、237、254、319 nmに極大吸収が観測された。IRでは、3400 cm-1に水酸基、1712 cm-1にケトン及び1619 cm-1にベンゼン環に基づく吸収が観測された。また、TLC上365 nmのUV照射下で、青色蛍光を発することからクマリン誘導体が推定された。
【0159】
1H-NMRでは、芳香族領域においてメタカプリングするプロトンのシグナル[δH 6.40 ( 1H, d, J = 2.0 Hz )及び6.51 ( 1H, d, J = 2.0 Hz )]が認められ、1,2,3,5−四置換ベンゼンの存在が推定された。シスカプリングするオレフィンプロトンシグナル[δH 6.15 ( 1H, d, J = 9.4 Hz )及び8.00 ( 1H, d, J = 9.4 Hz )] よりクマリン誘導体が支持された。また、δH 4.96 ( 1H, d, J = 7.4 Hz )及びδH 4.80 ( 1H, d, J = 2.9 Hz )にアノマープロトンのシグナルが観測され、2モルの糖の存在が示された。
【0160】
13C-NMR及びDEPTスペクトルでは、20個の炭素シグナルが認められ、このうち3個のメチレン(δC 63.3, 67.4, 73.4 )、11個のメチン(δC 69.7, 73.1, 73.4, 75.5, 76.4, 94.5, 99.2, 100.0, 109.3, 110.6, 139,4 )、6個の四級炭素シグナル(δC 78.8, 103.6, 155.7, 156.1, 160.6, 161.0 )の存在が明らかになった。
【0161】
1H-1H COSY及びHMQCを測定した結果、図3に示すようにアグリコン部分のAとBのユニット、部分構造のCユニット及びグルコシル基が推定された。糖部では、アノマープロトンからのクロスピークをたどると、δH 4.96 ( 1H, d, J = 7.4 Hz, Glc-1' )はδH 3.21 ( 1H, t, J = 9.2 Hz, Glc-2')、更に、δH 3.27 ( 1H, t, J = 9.2 Hz, Glc-3')、δH 3.15 ( 1H, t, J = 9.2 Hz, Glc-4')、δH 3.53 ( 1H, ddd, J = 9.2, 6.3, 1.4 Hz, Glc-5')と2個のジェミカレメチレンシグナルδH 3.45 ( 1H, dd, J = 10.9, 6.3 Hz, Glc-6' )と 3.85 ( 1H, dd, J = 10.9, 1.4 Hz, Glc-6' )との連接性が認められた。このユニットはグルコースと判明した。また、Glc-6位の炭素シグナルδC 67.4は通常のGlucose(δC 62付近)と比較すると、低磁場に現われている。そこで、Glc-6位に他の糖が結合していると考えられた。
【0162】
次に、HMBCスペクトルを測定し、アグリコンの構造と未解決の糖について解析を行った。1H-NMR で推定されたオレフィンプロトンシグナルのδH 6.15 ( H-3 )はδC 103.6 ( C-4a )の四級炭素及び160.6 ( C-2 )と、δH 8.00 ( H-4 )はδC 156.1 ( C-8a )及び160.6 ( C-2 )とロングレンジ相関が認められた。1,2,3,5−四置換ベンゼン上のδH 6.40 ( H-6 )はδC 94.5 ( C-8 )、103.6 ( C-4a )、155.7 ( C-5 ) 、156.1 ( C-8a )及び161.0 ( C-7 )と、δH 6.51 ( H-8 )はδC 99.2 ( C-6)、103.6 ( C-4a )、156.1 ( C-8a )及び161.0 ( C-7 )とロングレンジ相関が認められた。これらの相関性について考えると、C-4aはH-6と8は両方と相関が認められることから、H-6とH-8はC-4aのメタ位に位置している事が判明した。すなわち、アグリコンは5,7-dihydroxycoumarinである。
【0163】
また、Glc-1'はC-7とロングレンジ相関が認められた。クマリン環の7位にグルコースが結合している事が明らかになった。
【0164】
さらに、残り糖のプロトン及び5個の炭素について検討した。δH 4.80 ( 1H, d, J = 2.9 Hz, Api-1'' )はオのδC 73.4 ( Api-4'' )、76.0 ( Api-2'' )及び 78.8 ( Api-3'' )とロングレンジ相関が認められた。δH 3.73 ( 1H, d, J = 2.9 Hz, Api-2'' )はδC 63.3 ( Api-5'' )と109.3 ( Api-1'' )とロングレンジ相関が認められた。メチレンの[δH 3.87( 1H, d, J = 9.5 Hz, Api-4'' )と3.58 (1H, d, J = 9.5 Hz, Api-4'' )]はδC 63.3 ( Api-5'' )、78.8 ( Api-3'' )及び109.3 ( Api-1'' )とロングレンジ相関が認められた。一方、残りの比等価なメチレンの[δH 3.36 ( 1H, d, J = 11.5 Hz, Api-5'' )と3.35 (1H, d, J = 11.5 Hz, Api-5'' )]はδC 73.4 ( Api-4'' )、76.0 ( Api-2'' )及び78.8 ( Api-3'' ) とロングレンジ相関が認められた。すなわち、この糖部はフラノース環を形成しており、3位にヒドロキシメチレン基を有する。
【0165】
そこで、β-D-apioseが結合していると考えられるので、apiinの加水分解により得られたD-apioseと旋光度検出器を備えたHPLCでD-apioseと同定した。また、アノマープロトンのJ値、炭素のシフト値よりβ結合していることが明かとなった。
【0166】
また、アノマープロトンδH 4.80 ( A-1'' )はδC 67.4 ( G-6' ) と、グルコースのプロトンδH 3.15 ( G-6' )はδC 109.3 ( A-1'' )とロングレンジ相関が認められた。このことにより、アピオースはグルコースの6位に結合している事が明らかになった。
【0167】
以上の結果より、化合物25の構造は、下記化5に示す、5,7-dihydroxycoumarin 7-O-β-D-apiofuranosyl -(1→6)-O-β-D-glucopyranosideと決定した。
【0168】
【化5】

【0169】
Adenosine ( 26 )の構造
化合物26は、無色粉末、Positive-FAB-MSスペクトルよりm/z 268を与え、疑似分子イオンピーク[M+H]+が認められ、HR-FAB-MSでは、m/z 268.1045 (calcd. 268.1045)を示すことから、分子式C10H13N5O4が推定された。
【0170】
1H-NMRでは、低磁場領域において2個のプロトンシグナル[δH 8.13 ( 1H, s )、8.34 ( 1H, s )]、1個のブロドなシングルプロトンのシグナル[δH 7.34 ( brs, -NH2 )]が観測された。また、[δH 5.87 (1H, d, J = 6.0 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0171】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 62.2 )、6個のメチン(δC 71.2, 74.0, 86.4, 88.4, 140.5, 152.9 )、3個の四級炭素シグナル(δC 119.9, 149.6, 156.7 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値Otsuka H., Takeuchi M., Inoshiri S., Sato T., Yamasaki K., Phytochemistry, 28 (3) 883-886 (1989)を比較することにより、下記化6に示す、Adenosineと同定した。
【0172】
【化6】

【0173】
TG蓄積抑制試験とGPDH活性試験
1)3T3-L1前駆脂肪細胞から脂肪細胞への分化誘導及び促進試験
3T3-L1前駆脂肪細胞は、5% CO2下37℃で培養した。脂肪細胞分化抑制試験には対数増殖期の細胞を1.0×105 cells/ mLに調製し使用した。基本培地(10% FCSを含むDMEM培地)で2日間培養後(Day 0)、3-イソブチル-1-メチルキサンチン(IBMX, 500 μM)、デキサメタゾン(DEX, 1 μM)及びインスリン(10 μg/mL)を含有する分化誘導培地(10% FBSを含むDMEM培地)に試験薬物を添加し、3日間培養した(Day 3)。さらに、インスリン(10 μg/mL)を含有する分化維持培地に試験薬物を添加し、2日おきに同じ培地で交換し8日間培養した(Day 8)。
【0174】
2)細胞ホモジネートの調製
分化した細胞の上清はチュープに回収し、脂肪細胞はリン酸緩衝生理食塩水(PBS(−))で2回洗浄する。500μl 1 mM EDTAを含むトリス−塩酸緩衝液25 mM Tri buffer ( pH 7.5)を加え、ビペット用いて細胞を剥離し、1.5mlプラスチックチューブに回収する。氷水で冷やしながら、超音波処理(1本/2分程度)により細胞膜を破壊後、4℃、15,000rpm、2分間遠心分離を行った。
【0175】
3)トリグリセライド(TG)含量の測定
細胞ホモジネートの一部分を取って、細胞内に蓄積されたトリグリセライド(TG)はラボアッセイTMトリグリセライド(和光純薬)を用いて定量した。
各サンプルの細胞ホモジネートにトリグリセライド発色試薬を添加してよく混合し、37℃で5分間加温した。ブランクを対照として、波長595 nmにおける検体及び基準液の吸光度を測定した。標準曲線を作るために、基準液を終濃度が100, 200, 300, 596, 882 mg/dLになるように調整して添加した。
【0176】
抑制率 (%) = {(Y - X) / Y}× 100
X:試料を添加した際の1wellあたりのTG量を1wellあたりのDNA量で除したもの。
Y:DMSOを添加した際の1wellあたりのTG量を1wellあたりのDNA量で除したもの。
【0177】
4)GPDH活性の測定
細胞ホモジネートの一部分を取って、細胞内のGPDHはGPDH活性測定キット(Primary Cell Co., Ltd.)を用いた。
反応基質溶液を分光光度計用セル(石英ミクロセル)に入れ、セル内に検体を加え、良く攪拌した後、波長340nmにおける吸光度の減少を経時測定し、1分間当りの吸光度の変化量(ΔO.D.)を求める。ストップウオッチで時間を計りながら30秒1回測定する。4分間測定を行った。
【0178】
活性値の計算:
検体1ml当りのGPDHが1分間に1μmoleのNADHを消費する活性を1Uとすると、GPDH活性は次式で求められる(光路長が1cmの場合)。
GPDH活性(U/ml)=ΔO.D.×0.482
ΔO.D.:1分間当たりの波長340nmにおける吸光度の変化量
抑制率 (%) = {(Y - X) / Y}× 100
X:試料を添加した際の1wellあたりのGPDH活性を1wellあたりのDNA量で除したもの。
Y:DMSOを添加した際の1wellあたりのGPDH活性を1wellあたりのDNA量で除したもの。
【0179】
5)DNAの定量
細胞ホモジネートの一部分を取って、細胞内のDNAの量はDNA活性測定キット(Primary Cell Co., Ltd.)を用いて定量した。細胞ホモジネートと緩衝液及び発色剤を加えてよく混合する。
【0180】
混合した溶液を励起フィルター356 nm、蛍光フィルター458 nmで蛍光を測定した。標準曲線を作るために、基準液 (DNA 100 μg/ml) を精製水で希釈し、100, 50, 25, 12.5, 0 μg/mlになるように調整した。混合した溶液を励起フィルター(Excitation filter):356nm, 蛍光フィルター(Emission filter):458nmで蛍光を測定した。
【0181】
魯桑(Morus alba var. multicaulis Perro.)の根皮の抽出液、さらに、各画分について、TG蓄積抑制試験とGPDH活性試験を行ったところ、図4に示す通り、酢酸エチル画分に最も強い効果が認められた。結果は、±SD(n−3)法で示されている。サンプルの濃度は、a (100 μg/ml), b (30 μg/ml)である。
【0182】
さらに、桑根皮より得られた化合物についてTG蓄積抑制試験とGPDH活性試験を行った。その結果を図5に示す。サンプルの濃度は、20μM (Pioglitazone: 3μM)である。フラボノイド( 11-16 )、トリテルベン(17,18)、ステロイド(20)、クマリン(24, 25)に脂肪細胞へのTGの蓄積を抑制したともに、GPDH活性を抑制したことが認められた。これらの化合物は、ポジティブコントロールとして使用したクエルセチンより強い抑制活性が認められた。また、11-14と15,16を比較するとフラボンはフラバノンより強い活性が認められた。
ベンゾフラン(1-10)、スチルベン配糖体(21-22)、クマリン配糖体(23)には弱い活性が認められた。
【0183】
一酸化窒素(NO)産生抑制効果の検討
RAW264.7細胞は、5 %CO2下37℃、10 %FBS含有Ham’s F12培地で培養した。NO産生抑制試験には対数増殖期の細胞を1.0×105 cells/ mLに調製し使用した。細胞を2時間培養し、種々の濃度の抽出エキス、又は試験化合物を添加した。同時にIFN-γ( 10U/mL )及びLPS (100 ng/mL)を添加し、16時間培養後、上清を採取し、NOの酸化体であるNO2−をGriess法で測定した。
【0184】
抽出エキス、又は試験化合物を溶解したDMSO濃度は培地中0.2 %以下となるようにした。RAW264.7細胞の培養上清を平底96穴マイクロプレートに100 μL入れ、1 %スルファニルアミド5 %リン酸溶液、0.1 %N-1-ナフチルエチレンジアミン二塩酸塩溶液を各50 μL添加し、10分間放置後、655 nmの吸収を対照に、570 nmの吸光度を測定した。
【0185】
細胞毒性の確認はMTT法、鏡検により確認した。MTT法は常法に従った。すなわち、96穴マイクロプレートに1.0×105 cell/mLに調製した細胞を200 μLずつ入れ、抽出エキスを種々の濃度で添加し、16時間培養後、MTT試薬を加え、さらに4時間培養した。上清を除去し、DMSOを150μL添加し、生成したホルマザンを完全に溶解し、570 nmの吸光度を測定した。また、ポジティブコントロールとしてQuercetin、Resveratrolを使用した。
【0186】
抑制率(%)={1−(X−Y)/(Z−Y)}×100
X:試験化合物の存在下でIFN-γとLPSにより誘導される吸光度。
Y:試験化合物、IFN-γ及びLPSがない状態で誘導される吸光度。
Z:IFN-γとLPSにより誘導される吸光度。
【0187】
桑根皮より得られた化合物についてNO産生抑制試験を行った。その結果を図6に示す。ベンゾフラン( 1-10 )、フラボノイド( 11-16 )、トリテルベン(19)にNO産生抑制活性が認められた。これらの化合物は、ポジティブコントロールとして使用した塩酸アミノグアニジンと同程度、またはそれ以上の活性が認められた。ポジティブコントロールとして使用したクエルセチンより強い活性が認められた。ステロイド、スチルベン配糖体、クマリン配糖体には活性は認められた。
【0188】
既述の実施例によれば、本発明に係る既述の有効成分に、一酸化窒素(NO)産生抑制効果が認められた。これにより、マクロファージの活性化が抑制され、インシュリン抵抗性が改善されるために、糖尿病の症状の改善効果が達成される。
【0189】
本発明に係る有効成分は、人間及び動物に対して抗肥満作用を発揮する。本発明の有効成分を人間又は動物に対して適用するには、内服、注射、外用など公知の全ての剤型を用いることができる。本発明の有効成分は、薬剤、健康食品、外用剤として利用することができる。
【技術分野】
【0001】
本発明は抗肥満剤及び糖尿病改善剤に係わり、特に、クワ科植物の根の皮の抽出物を含有することを特徴とするものに関するものである。
【背景技術】
【0002】
近年、日本および欧米先進国のみならず、中国においても、肥満が急増している。特に、内臓肥満を中心として、糖尿病、高血圧、高脂血症などが集積した病態であるメタボリックシンドロームが注目されている。
【0003】
中国の衛生部の調査によると、2002年には2億人が標準体重を超え、6000万人が肥満症だということが分かった。また、18歳以上のうち、高血圧人は1億6000万人(罹患率約18.8%)、糖尿病人は2000万(罹患率約2.6%)である。
【0004】
日本の厚生労働省の「2007年国民健康・栄養調査」によると、糖尿病が強く疑われる人は約890万人。糖尿病の可能性が否定できない人は約1320万人、合わせて約2210万人と推定された。40〜74歳でみると、男性の2人に1人、女性の5人に1人が、メタボリックシンドロームが強く疑われる者又は予備群と考えられている。高脂肪食や運動不足による肥満の増加とそれに伴うインスリン抵抗性はメタボリックシンドロームのリスクを上げることが知られている。
【0005】
また、インスリン抵抗性の状態では、軽度の慢性炎症状態にあることが明らかになってきた。肥満者では脂肪細胞の肥大化が認められ、肥大した脂肪細胞では、TNF-α、IL-6に代表される炎症性アディポサイトカインの分泌の増加とアディポネクチンのような抗炎症性アディポサイトカインの産生が減少している事が認められ、インスリン抵抗性が惹起されると言われている。
【0006】
一方、正常な小型脂肪細胞ではインスリン感受性サイトカインであるアディポネクチンを分泌してインスリン感受性を改善することが知られている。そこで、メタボリックシンドロームを抑制するためには、脂肪細胞の分化を抑えること、また、小型脂肪細胞からのアディポネクチンを上昇させると共にTNF-αを下降させる必要がある。
【0007】
肥満や糖尿病、高血圧を抑制するための対策としては、脂肪細胞の分化を抑えること、また、小型脂肪細胞からのアディポネクチンを上昇させると共にTNF-αなどの炎症性サイトカインを下降させる必要がある。最近、マクロファージは脂肪組織に浸潤し、肥大化した脂肪細胞が相互作用することによって炎症が惹起され、インスリン抵抗性が発症や増悪するといわれている。
【0008】
天然物由来のresveratrol、quercetin、vitisin A、xanthohumol、isoxanthohumol、capsaicinなどの化合物は脂肪細胞の分化と中性脂肪の蓄積を抑制することが報告されている。また、phloretin、retrofractaminde A、narigenin、hesperetin、catechin、6-gingerol、curcumin、capsaicinなどの化合物は脂肪細胞からのアディポネクチンの分泌を増加することが報告されている。curcumin、resveratrolなどの化合物は脂肪細胞からのTNF-αの分泌を下降することが知られている。
【0009】
特開2002−138044号公報には、アカネ、アスナロ、アマチャ、オオバナサルスベリ、ガイヨウ、ハクカユマトウ、ハスナゲ、ヒキオコシ、ホウキギから選ばれる1種以上の植物抽出物を含有して、前駆脂肪細胞の分化誘導を阻害する薬剤、化粧料組成物又は飲食品が開示されている。
【0010】
さらに、特開2007−269757号公報には、副作用がなく優れた前駆脂肪細胞分化誘導阻害作用を有する脂肪細胞分化阻害剤が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2002−138044号公報
【特許文献2】特開2007−269757号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
マグワMorus alba L.は、クワ科植物で、東アジアに広く分布、または栽培される落葉高木であり、樹皮は灰色を帯び、葉は互生、卵形〜広卵形で、縁にはあらい鋸歯があり、時に、片側に湾入があり、雌雄異株、まれに同株であり、淡黄色の無花弁を多数付けて穗状に垂れ下がり、果実は初夏に熟すと紫黒色の集合果となり、その果実は甘酸っぱく、食用にされている。
【0013】
桑白皮は《神農本草経》の中品に「桑根白皮」として収録され、その薬能は「傷中、五労、六極の羸痩、崩中、脈絶を主どる、云々」と記載され、また、薬性論には「肺気喘満、虚労客熱、頭痛を治し、不足を内補する」と述べられている。
【0014】
《本草綱目》には「消渇多尿(糖尿病に相当)で(桑白皮を)水で濃汁に煮て随意に飲む」と記載されている。中国で、秋末または春発芽前に桑根を掘り起こし、コルク皮を除去し、皮を剥ぎ取って乾燥する。生薬として皮の色は白色また淡黄色である。桑白皮は中国薬典と日本薬局方に収載され、鎮咳去痰、消炎薬として杏蘇散,五虎湯,清肺湯などに配合されており、喘を鎮め、肺の腫れを消す効能があり、肺熱喘咳、水腫、排尿障害を治すことが知られている。
【0015】
また、桑白皮の成分として、プレニールフラボノイド、トリテルペン、2-アリルベンゾフラン誘導体、Diels-Alder型付加化合物)などの報告がある。さらに、その薬理作用として、抗菌作用、血圧下降作用、血糖下降作用、抗炎症作用、抗酸化作用などの報告がある。
【0016】
本発明は、クワ科の植物に着目して、天然成分からなる新規な抗肥満剤及び糖尿病改善を提供することを目的とするものである。
【課題を解決するための手段】
【0017】
前記目的を達成するために、本発明は、クワ科植物の根の皮の抽出物を含有する抗肥満剤及び糖尿病改善であることを特徴とするものである。
【発明の効果】
【0018】
本発明によれば、クワ科の植物の天然成分からなる新規な抗肥満剤及び糖尿病改善を提供することができる。
【図面の簡単な説明】
【0019】
【図1】クワ科植物の根の皮の抽出物に属する複数の有効成分の各化合物(複数)の構造式を示した一覧図である。
【図2】化合物6の1H-1H COSY、HMQCを測定した結果の部分構造を示すブロック図である。
【図3】化合物25の1H-1H COSY、HMQCを測定した結果の部分構造を示すブロック図である。
【図4】桑根皮の抽出液、各画分についてのTG蓄積抑制試験とGPDH活性試験との結果を示す表である。
【図5】桑根皮より得られた各化合物についてのTG蓄積抑制試験とGPDH活性試験の結果を示す表である。
【図6】桑根皮より得られた各化合物についてのNO産生抑制試験の結果を示す表である。
【発明を実施するための形態】
【0020】
本発明者は、マグワ(M. alba var. multicaulis Perro.)の根の皮を剥ぎ取って、桑根皮(桑白皮と異なりコルクを除去していない皮部)を抽出し、成分の単離と構造決定を行い、次のとおり、10種のベンゾフラン誘導体、6種のフラボノイド誘導体、3種のトリテルベン誘導体、1種のステロイド誘導体、2種のスチルベン誘導体、3種のクマリン誘導体及びアデノシンなど、26種の化合物の単離・構造決定を行った。このうち、化合物6はベンゾフラン誘導体、化合物25はクマリン誘導体で、いずれも新規化合物である。
【0021】
また、これらの化合物について、3T3-L1前駆脂肪細胞の分化および中性脂肪蓄積を抑制作用、マクロファージの一酸化窒素産生抑制作用を有する活性成分について検討した。図1に化合物1〜26の構造式を示す。
【実施例】
【0022】
以下、実施例を挙げて、本発明を更に詳細に説明する。本発明はこれらの実施例に限定されるものではない。日本国千葉県産の魯桑(Morus alba var. multicaulis Perro.)の根皮を80%メタノール45Lで3回抽出を行い、減圧濃縮して1311.9 gのエキスを得た。このエキスを水(6.0 L)に懸濁し、クロロホルム、酢酸エチル、ブタノール(各6.0 L×3)で順次分配抽出した。これらを減圧濃縮し、クロロホルム可溶性画分(8.72 g)、酢酸エチル可溶性画分(356.93 g)、ブタノール可溶性画分(225.06 g)、水可溶性画分(758.32 g)を得た。
【0023】
それぞれの画分について、3T3-L1前駆脂肪細胞の分化及び中性脂肪蓄積抑制試験を行い、また、RAW264.7のNO産生抑制試験を行い、サンプル濃度 30 μg/mLにおいて、クロロホルム画分(TG抑制率:46.1 %、NO抑制率:96.0 %)、酢酸エチル画分(TG:52.0 %、NO:98.2 %)、ブタノール画分(TG :44.5 %、NO:27.9 %)、水画分(TG:22.3 %、NO:11.2 %)の活性が認められた。
【0024】
上記の各画分のうち、抑制効果が高い酢酸エチル可溶性画分(331.39 g)をシリカゲルカラムクロマトグラフィー(Silica gel 60N、12.5×31 cm)に付し、クロロホルム:メタノール=100:0~0:100で溶出し、Fr.1~Fr.14に分画した。Fr.9(31.477g)をODS C.C.(Chromatorex、12.5×31 cm)に付し、水:メタノール=80:20~0:100で溶出し、12個の画分を得た。
【0025】
Fr.9-6(0.791g)をSilica gel C.C.(2.5×18 cm)に付し、n-ヘキサン:酢酸エチル=80:20~0:100、メタノールで溶出し、4個の画分を得た。このうちFr.9-6a(83mg)を高速液体クロマトグラフィー(HPLC、Fulofix 120E、10×250 mm、UV254 nm、CH3CN:H2O=43:57、3 ml/min)により精製を行い、化合物1(保時時間15分14秒、40.0 mg)を得た。Fr.9-6b(148mg)を高速液体クロマトグラフィー(HPLC、Fulofix 120E、10×250 mm、UV254 nm、CH3CN:H2O=42:58、3 ml/min)により精製を行い、化合物5(保時時間13分42秒、25.0 mg)を得た。Fr.9-6c(338mg)を高速液体クロマトグラフィー(HPLC、Senshu Pak Aquasil SS、10×250 mm、UV254 nm、CHCl3:MeOH=100:1.5、3 ml/min)により精製を行い、化合物2(保時時間20分31秒、62.0 mg)と化合物3(保時時間21分20秒、20.0 mg)を得た。
【0026】
Fr.9-8(5.773 g)をSephadex LH-20 C.C.(Pharmacia、3.5×40 cm)水:メタノール=50:50~0:100で溶出し、9個の画分を得た。Fr.9-8-4(1.800 g)をSilica gel C.C.(2.5×18 cm)に付し、n-ヘキサン:酢酸エチル=90:10~0:100、メタノールで溶出し、6個の画分を得た。このうちFr.9-8-4-4(835mg)を高速液体クロマトグラフィー(HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV254 nm、CH3OH:H2O=80:20、3 ml/min)により精製を行い、化合物4(保時時間12分17秒、4.0 mg)、化合物6(保時時間13分35秒、5.0 mg)、及び11(保時時間14分15秒、30.0 mg)を得た。Fr.9-8-4-5(56 mg)を高速液体クロマトグラフィー(HPLC、Fulofix 120E、10×250 mm、UV 254 nm、CH3OH:H2O=75:25、4 ml/min)により精製を行い、化合物16(保時時間11分15秒、4.0 mg)及び化合物12(保時時間16分40秒、35.0 mg)を得た。
【0027】
Fr.9-8-6(1.987 g)をODS C.C.(Chromatorex、3.5×25 cm)に付し、水:メタノール=50:50~0:100で溶出し、7個の画分を得た。このうちFr.9-8-6-d(51 mg)を高速液体クロマトグラフィー(HPLC、Siseido SG80、10×250 mm、UV254 nm、n-hexane:EtOAc=70:30、4 ml/min)により精製を行い、化合物7(保時時間12分50秒、31.0 mg)を得た。
【0028】
Fr.9-8-6-f(500 mg)を高速液体クロマトグラフィー(HPLC、Siseido SG80、10×250 mm、UV 254 nm、n-hexane:EtOAc=70:30、4 ml/min)により精製を行い、化合物13(保時時間11分18秒、26.0 mg)、化合物9(保時時間18分32秒、45.0 mg)及び化合物8(保時時間22分53秒、38.0 mg)を得た。Fr.9-8-6-g(1267 mg)を高速液体クロマトグラフィー(HPLC、Siseido SG80、10×250 mm、UV254 nm、n-hexane:EtOAc=70:30、4 ml/min)により精製を行い、化合物10(保時時間18分10秒、15.0 mg)及び化合物15(保時時間23分00秒、438.0 mg)を得た。
【0029】
Fr.5と6を合わせて(12.346 g)Silica gel C.C.(6×15 cm)に付し、n-ヘキサン:酢酸エチル=100:0~0:100、メタノールで溶出し、6個の画分を得た。このうち、Fr.56-b(370 mg)から結晶が析出したため、これをろ取しクロロホルム-メタノールにより再結晶を行い、化合物20(210.2 mg)を得た。Fr.56-c(395 mg)から結晶が析出したため、これをろ取しクロロホルム-メタノールにより再結晶を行い、化合物17(183.9 mg)を得た。
【0030】
ろ液をまとめ、高速液体クロマトグラフィー(HPLC、YMC Pak SIL 60-5、4.6×250 mm、RI示差屈折計、n-hexane:EtOAc=75:25、1ml/min)により精製を行い、化合物18(6.0 mg)を得た。Fr.56-d(1268 mg)から結晶が析出したため、これをろ取しクロロホルム-メタノールにより再結晶を行い、化合物17(136.0 mg)を得た。ろ液をまとめ、高速液体クロマトグラフィー(HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV210 nm、CH3OH:H2O=80:20、4ml/min)により精製を行い、化合物14(保時時間14分31秒、28.0 mg)及び化合物19(保時時間18分45秒、7.0 mg)を得た。
【0031】
Fr.10(200 g)をHP-20 C.C.(Diaion、13×25 cm)水:メタノール=100:0~0:100、70%アセトンで溶出し、6個の画分を得た。このうち、Fr.10-2(1237 mg)をODS C.C.(Chromatorex、3.5×15 cm)に付し、水:メタノール=100:0~0:100で溶出し、6個の画分を得た。Fr.10-2-4(1010 mg)をSephadex LH-20 C.C.(Pharmacia、3.5×40 cm)に付し、水:メタノール=90:10~0:100で溶出し、30%メタノール部分を高速液体クロマトグラフィー(HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV254 nm、CH3OH:H2O=28:72、4 ml/min)により精製を行い、化合物21(保時時間12分47秒、56.0 mg)を得た。
ブタノール可溶性画分(225 g)をHP-20 C.C.(Diaion、13×25 cm)水:メタノール=100:0~0:100、70%アセトンで溶出し、4個の画分を得た。このうち、Fr.2(180 g)から結晶が析出したため、これをろ取し水-メタノールにより再結晶を行い、化合物22(2100 mg)を得た。
【0032】
ろ液をまとめ、Silica gel C.C.(Silica gel 60N、6×24 cm)に付し、クロロホルム:メタノール=100:0~0:100で溶出し、3の画分を得た。
【0033】
Fr.2-2(10.2 mg)ODS C.C.(Chromatorex、6×20 cm)に付し、水:メタノール=100:0~0:100で溶出し、4個の画分を得た。このうちFr.2-2-2(4086mg)を高速液体クロマトグラフィー((HPLC、Cosmosil 5C18 PAQ、10×250 mm、UV254 nm、CH3OH:H2O=10:90、3 ml/min)により精製を行い、化合物26(保時時間7分02秒、10.0 mg)、化合物23(保時時間10分13秒5.0 mg)、化合物24(保時時間12分13秒4.0 mg)、及び化合物25(保時時間15分23秒、51.2 mg)を得た。
【0034】
Moracin C ( 1 )の構造
化合物1は、黄色粉末、EI-MSスペクトルにm/z 310を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 310.1204 (calcd. 310.1204)を示すことから、分子式C19H18O4が推定された。
【0035】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル [
δH 7.38 ( 1H, d, J = 8.5 Hz )、6.96 (1H, d, J = 2.0 Hz ) 及び6.80 ( 1H, dd, J = 8.5、2.0 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.92 ( 2H, s )]より1,3,4,5−四置換ベンゼンの存在が推定された。また、[5.30 ( 1H, m )、3.39 ( 2H, d, J = 7.0 Hz )、δH 1.78 ( 3H, s )及び1.65 ( 3H, s )]よりプレニル基の存在が推定された。
【0036】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 17.9, 25.9 )、1個のメチレン(δC 23.1 )、7個のメチン(δC 98.3, 101.4, 103.8×2, 113.1, 121.8, 124.8 )、9個の四級炭素シグナル(δC116.3, 122.6, 129.8, 131.0, 155.8, 156.5, 156.6, 157.2×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Takasugi M., Nagao S., Ueno S., Masamune T., Shirata A., Takahashi K., Chemistry Letters, (11), 1239 - 1240 (1978))を比較することにより、Moracin Cと同定した。
【0037】
Moracin O ( 2 )の構造
化合物2は、褐色粉末、EI-MSスペクトルにm/z 326を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 326.1154 (calcd. 326.1154)を示すことから、分子式C19H18O5が推定された。
【0038】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 6.85 ( 2H, d, J = 2.2 Hz ) 及び6.36 ( 1H, t, J = 2.2 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。[δH 7.33 ( 1H, s )及び6.86 (1H, s )] より1,2,4,5−四置換ベンゼンの存在が推定された。また、[δH 4.68 ( 1H, dt, J = 9.1, 8.4 Hz )、3.31 ( 1H, dd, J = 16.1, 8.4 Hz )、3.21 ( 1H, dd, J =16.1, 9.1 Hz )、1.23 ( 3H, s )]及び[δH 1.27 ( 3H, s )]のシグナルが認められた。
【0039】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 25.5, 26.0 )、1個のメチレン(δC 30.6 )、7個のメチン(δC 91.2, 92.9, 102.4, 103.0, 103.6×2, 116.9 )、9個の四級炭素シグナル(δC 71.5, 123.3, 125.2, 133.4, 155.5, 155.8, 159.6, 159.8×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ferrari. F., Delle monache F., Fitoterapia, (6), 554-555 (1998))を比較することにより、Moracin Oと同定した。
【0040】
Moracin P ( 3 )の構造
化合物3は、褐色粉末、EI-MSスペクトルにm/z 326を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 326.1154 (calcd. 326.1154)を示すことから、分子式C19H18O5が推定された。
【0041】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.26 ( 1H, s )及び6.88 (1H, s )] より1,2,4,5−四置換ベンゼンの存在が推定された。[δH 6.87 ( 2H, d, J = 2.2 Hz ) 及び 6.37 ( 1H, t, J = 2.2 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。また、[δH 3.83 ( 1H, dt, J = 8.2, 5.4 Hz )、3.11 ( 1H, dq, J =16.1, 5.4 Hz )、2.83 ( 1H, dq, J = 16.1, 8.2 Hz )、1.38 ( 3H, s )及びδH 1.26 ( 3H, s )]のシグナルが認められた。
【0042】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 20.5, 26.2 )、1個のメチレン(δC 32.4 )、7個のメチン(δC 69.9, 99.3, 101.9, 103.5, 103.8×2, 121.7 )、9個の四級炭素シグナル(δC 78.0, 117.9, 123.4, 133.3, 152.4, 155.3, 155.8, 159.8×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ferrari. F., Delle monache F., Fitoterapia, (6), 554-555 (1998))を比較することにより、Moracin Pと同定した。
【0043】
Artoindonesianin O ( 4 )の構造
化合物4は、黄色粉末、EI-MSスペクトルにm/z 324を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 324.1357 (calcd. 324.1361)を示すことから、分子式C20H20O4が推定された。
【0044】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.42 ( 1H, d, J = 8.4 Hz )、6.96 (1H, dd, J = 2.1 Hz )及び 6.80 ( 1H, dd, J = 8.4、2.1 Hz )] より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.81 ( 1H, d, J = 2.1 Hz) 及び 6.52 ( 1H, d, J = 2.1 Hz )]より1,3,4,5−四置換ベンゼンの存在が推定された。また、[δH 5.12 ( 1H, m )、3.46 ( 2H, d, J = 6.3 Hz )、1.64 ( 3H, d, J = 1.5 Hz )及びδH 1.67 ( 3H, d, J = 0.9 Hz)]よりプレニル基の存在が推定された。
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 17.7, 25.2 )、1個のメトキシ(δC 55.6 )、1個のメチレン(δC 26.0 )、7個のメチン(δC 97.7, 99.6, 105.2, 107.1, 112.4, 119.4, 124.4 )、9個の四級炭素シグナル(δC 121.3, 121.8, 130.4, 131.6, 154.4, 155.7×2, 156.4, 159.2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(E.H.Hakim., U.Z.Ulinnuha., Y. M. Syah., E.L.Ghisalberti., Fitoterapia 73 (3) 597-603(2002))を比較することにより、Artoindonesianin Oと同定した。
【0045】
Moracin R ( 5 )の構造
化合物5は、黄色粉末、EI-MSスペクトルにm/z 310を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 310.1205 (calcd. 310.1204)を示すことから、分子式C19H18O4が推定された。
【0046】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.23 ( 1H, d, J = 8.5 Hz ) 及び6.84 (1H, d, J = 8.5 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.90 ( 2H, d, J = 2.3 Hz ) 及び6.38 ( 1H, t, J = 2.3 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。また、[δH 5.45 ( 1H, m )、3.65 ( 2H, d, J = 7.5 Hz )、δH 1.89 ( 3H, s )及び1.67 ( 3H, s )]よりプレニル基の存在が推定された。
【0047】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 17.3, 25.1 )、1個のメチレン(δC 22.6 )、7個のメチン(δC 101.8, 102.7, 103.0×2, 112.3, 111.8, 122.3 )、9個の四級炭素シグナル(δC113.0, 121.8, 131.2, 132.8, 152.7, 154.5, 154.6, 159.0×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Shirata A., Takahashi K., Takasugi M., Nagao S., Ichikawa., Ueno S., Munoz L., Bull. Seric. Exp.Sta, 28 (6) 793 - 806 (1983))を比較することにより、Moracin Rと同定した。
【0048】
6- methylmoracin R ( 6 )の構造
化合物6は、黄色粉末、EI-MSスペクトルにm/z 324を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 324.1360 (calcd. 324.1361)を示すことから、分子式C20H20O4が推定された。UVスペクトルでは、216、318、330 nmに極大吸収が観測され、2-アリルベンゾフラン誘導体が推定された。
【0049】
1H-NMRでは、化合物5と比較すると新たにメトキシプロトンのシグナル[δH 3.90 ( 3H, s )]の存在が認められた。また、プロトン[δH 6.84 (1H, d, J = 8.5 Hz )]は低磁場にシフトして[δH 6.97 (1H, d, J = 8.5 Hz )]になった。他のプロトンシグナルの化学シフト値及び分裂タイプと化合物5比較する類似していることが明らかとなった。芳香族領域においてオルトカプリングするプロトンシグナル[δH 7.38 ( 1H, d, J = 8.5 Hz ) 及び6.97 (1H, d, J = 8.5 Hz )] より1,2,3,4−四置換ベンゼンの存在が推定された。メタカプリングするプロトンシグナル[δH 6.91 ( 2H, d, J = 2.4 Hz ) 及び6.39 ( 1H, t, J = 2.4 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。また、1個のオレフィンプロトンシグナル[δH 5.38 ( 1H, m )]、1個のメチレンシグナル[δH 3.63 ( 2H, d, J = 7.3 Hz )]、2個のメチルシグナル[δH 1.88 ( 3H, s )及び1.67 ( 3H, s ) ]よりプレニル基の存在が推定された。
【0050】
13C-NMR及びDEPTスペクトルでは、1個のメトキシ(δC 56.9 )、2個のメチル(δC 18.0, 25.9 )、1個のメチレン(δC 23.4 )、7個のメチン(δC 102.4, 103.7, 103.9×2, 109.0, 119.0, 123.0 )、9個の四級炭素シグナル(δC113.9, 123.8, 132.1, 133.4, 154.9, 156.0, 156.1, 159.8×2 )の存在が明らかになった。1H-1H COSY、HMQCを測定した結果、図2に示すような部分構造A-Cが推定された。
【0051】
さらに、プロトン及びカーボンシングナルの帰属及び置換基の結合位置を決定するため、HMBCスペクトルを測定した。1,2,3,4−四置換ベンゼン上のδH 7.38 ( H-4 )はδC 101.8 ( C-3 )、113.9 ( C-7 )及び154.9 ( C-7a )と、δH 6.97 ( H-5 )はδC 113.9 ( C-7 )、123.8 ( C-3a )及び156.0 ( C-6 )とロングレンジ相関が認められた。1,3,5−三置換ベンゼンのδH 6.91 ( H-2', 6' )はδC 103.7 ( C-4' )、156.1 ( C-1 )及び159.8 ( C-3', 5' )と、δH 6.39 ( H-4' )はδC 103.9 ( C-2',6')及び159.8 ( C-3', 5' )とロングレンジ相関が認められた。プレニル基のδH 3.63 ( H-1'' )はδC 113.9 ( C-7 )、123.0 ( C-2'' )、132.1 ( C-3'' )及び154.9 ( C-7a )と、δH 5.38 ( H-2'' )はδC 18.7 ( C-5'' )、23.4 ( C-1'' )及び25.9 ( C-3'' )ロングレンジ相関が認められた。また、δH 7.06 ( H-3 )はδC 119.0 ( C-4 )、123.8 ( C-3a )及び154.9 ( C-7a )とロングレンジ相関が認められた。さらに、3.90のメトキシ基はδC 156.0 ( C-6 )と相関が認められた。以上の結果より化合物6の構造は6-methylmoracin Rと決定した。
【0052】
Moracin D ( 7 )の構造
化合物7は、褐色粉末、EI-MSスペクトルにm/z 308を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 308.104 (calcd. 308.104)を示すことから、分子式C19H16O4が推定された。
【0053】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル
[δH 7.39 ( 1H, d, J = 8.1 Hz )、6.96 ( 1H, dd, J = 2.1 Hz ) 及び6.79 (1H, dd, J = 8.1, 2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.92 ( 1H, d, J = 1.5 Hz )、6.77 ( 1H, dd, J = 1.5, 0.9 Hz )、δH 6.69 ( 1H, d, J = 9.9, 0.9 Hz ) 及び5.67 ( 1H, dd, J = 9.9 Hz )]よりchromeneの存在が推定された20)。また、[δH 1.42 (6H, s )]より2個のメチルの存在が推定された。
【0054】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 27.7×2 )、8個のメチン(δC 97.8, 101.8, 103.8, 104.2, 112.6, 116.9, 121.3, 129.0 )、9個の四級炭素シグナル(δC76.0, 109.8, 121.9, 129.0, 131.3, 153.4, 154.4×2, 156.0 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Takasugi M., Nagao S., Ueno S., Masamune T., Shirata A., Takahashi K., Chemistry Letters, (11), 1239 - 1240 (1978))を比較することにより、Moracin Dと同定した。
【0055】
Albafuran A ( 8 )の構造
化合物8は、黄色粉末、EI-MSスペクトルにm/z 378を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 378.1831 (calcd. 378.1830)を示すことから、分子式C24H26O4が推定された。
【0056】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.40 ( 1H, d, J = 8.7 Hz )、6.81 ( 1H, dd, J = 8.7, 2.1 Hz )及び6.97 (1H, d, J = 2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.74 ( 1H, d, J = 2.7 Hz )及び6.49 (1H, d, J = 2.7 Hz )]より1,2,3,5−四置換ベンゼンの存在が推定された。また、[δH 5.20 ( 1H, m )、5.07 ( 1H, m )、3.52 ( 2H, d, J = 6.6 Hz )、2.01 ( 4H, m )、1.69 ( 3H, s )、1.60 ( 3H, s )及び1.55 ( 3H, s )]よりゲラニル基の存在が推定された。
【0057】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 16.1, 17.4, 25.5 )、3個のメチレン(δC 25.9, 27.0, 40.0 )、8個のメチン(δC 97.8, 103.2, 104.9, 107.1, 112.3, 121.2, 124.5, 124.7 )、10個の四級炭素シグナル(δC 117.9, 121.9, 130.8, 132.0, 134.1, 154.7, 155.7×2, 156.0, 156.7 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Takasugi M., Ishikawa S., Masamune T., Chemistry Letters, (8), 1221 - 1222 (1982))を比較することにより、Albafuran Aと同定した。
【0058】
Mulberrofuran L ( 9 )の構造
化合物9は、黄色粉末、EI-MSスペクトルにm/z 378を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 378.1832 (calcd. 378.1830)を示すことから、分子式C24H26O4が推定された。
【0059】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.21 ( 1H, d, J = 8.4 Hz )及び6.82 (1H, d, J = 8.4 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.88 ( 2H, d, J = 2.4 Hz )及び6.36 (1H, t, J = 2.4 Hz )]より1,3,4−三置換ベンゼンの存在が推定された。また、[δH 5.45 ( 1H, m )、5.03 ( 1H, m )、3.65 ( 2H, d, J = 7.2 Hz )、2.01 ( 4H, m )、1.90 ( 3H, s )、1.55( 3H, s )及び1.51 ( 3H, s )]よりゲラニル基の存在が推定された。
【0060】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 16.2, 17.3, 25.4 )、3個のメチレン(δC 23.0, 27.0, 40.1 )、8個のメチン(δC 102.0, 102.8, 103.2×2, 112.4, 118.2, 122.4, 124.3 )、10個の四級炭素シグナル(δC 111.5, 121.9, 130.9, 132.9, 134.9, 152.7, 154.6×2, 159.0×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Fujimoto T., Hano Y., Nomura T., Uzawa J., Heterocycles, 22 (12) 2805 - 2811 (1984))を比較することにより、Mulberrofuran Lと同定した。
【0061】
Mulberrofuran Y ( 10 )の構造
化合物10は、黄色粉末、EI-MSスペクトルにm/z 408を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 408.1933 (calcd. 408.1936)を示すことから、分子式C25H28O5が推定された。
【0062】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 6.83 ( 2H, d, J = 2.4 Hz )及び6.34 (1H, t, J = 2.4 Hz )]より1,3,4−三置換ベンゼンの存在が推定された。[δH 7.01 ( 1H, d, J = 0.9 Hz )及び6.91 ( 1H, d, J = 0.9 Hz )]のプロトンシグナルが認められた。また、[δH 5.32 ( 1H, m )、5.05 ( 1H, m )、3.59 ( 2H, d, J = 6.9 Hz )、2.01 ( 4H, m )、1.87 ( 3H, s )、1.57( 3H, s )及び1.54 ( 3H, s )]よりゲラニル基の存在が推定された。
【0063】
13C-NMR及びDEPTスペクトルでは、1個のオキシメチル(δC 61.1 )、3個のメチル(δC 16.1, 17.4, 25.4 )、3個のメチレン(δC 26.6, 26.9, 40.0 )、7個のメチン(δC 96.5, 101.1, 102.8, 103.1×2, 123.2, 124.3 )、11個の四級炭素シグナル(δC 121.3, 126.6, 131.0, 132.7, 135.2, 143.0, 148.9, 151.4, 154.5, 159.0×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Shi Y. Q., Fukai T., Sakagami H., Chang W. J., Yang P. Q., Wang F. P., Nomura T., J. Nat. Prod., 64 (2) 181 - 188 (2001))を比較することにより、Mulberrofuran Yと同定した。
【0064】
Kuwanon A ( 11 )の構造
化合物11は、黄色粉末、EI-MSスペクトルにm/z 420を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 420.1575 ( calcd. 420.1572 )を示すことから、分子式C25H24O6が推定された。
【0065】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.08 ( 1H, d, J = 8.1 Hz )及び6.56 (1H, d, J = 8.1 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.31( 1H, d, J = 2.0 Hz )及び6.24 (1H, d, J = 2.0 Hz )]より1,2,3,5−四置換ベンゼンの存在が推定された。[δH 6.73 ( 1H, d, J = 9.9 Hz )及び5.71 ( 1H, d, J = 9.9 Hz )]よりシスカプリングするオレフィンの存在が推定された。また、[δH 5.10 ( 1H, m )、3.10 ( 2H, d, J = 7.2 Hz )、1.44 ( 3H, s )及び1.57 (3H, s )]よりプレニル基の存在が推定された。[δH 13.11 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0066】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 17.4, 25.5, 27.8 )、1個のメチレン(δC 24.3 )、7個のメチン(δC 93.5, 98.7, 107.8, 116.7, 122.2, 129.2, 130.2 )、12個の四級炭素シグナル(δC 76.9, 104.5, 109.8, 113.2, 120.7, 131.4, 152.1, 154.9, 158.3, 161.3, 162.5, 163.9 ) 及び1個のカルボニル基(δC 182.0 )の存在が明らかになった。
【0067】
1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Hano Y., Hirakura K., Nomura T., Uzawa J., Chem. Pharm. Bull., 26 (5) 1453-1458 (1978))を比較することにより、Kuwanon Aと同定した。
【0068】
Kuwanon C ( 12 )の構造
化合物12は、黄色粉末、EI-MSスペクトルにm/z 422を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 422.1737 (calcd. 422.1729)を示すことから、分子式C25H26O6が推定された。
【0069】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.21 ( 1H, d, J =8.1 Hz )、6.56 ( 1H, d, J =2.1 Hz )及び6.51 ( 1H, dd, J = 8.1, 2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.30 ( 1H, s )]より1,2,3,4,5−五置換ベンゼンの存在が推定された。また、[δH 5.19 ( 1H, m )、5.12 ( 1H, m )、3.56 ( 2H, d, J = 7.5 Hz )、3.12 ( 2H, d, J = 6.9 Hz )、1.44 ( 3H, s )、1.57 ( 3H, s )及び1.58 ( 6H, s )]より2個のプレニル基の存在が推定された。[δH 13.05 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0070】
13C-NMR及びDEPTスペクトルでは、4個のメチル(δC 17.3, 17.4, 25.5×2 )、2個のメチレン(δC 21.8, 24.3 )、6個のメチン(δC 98.2, 103.2, 107.4, 122.1, 122.4, 131.6 )、12個の四級炭素シグナル(δC 104.6, 106.1, 112.5, 120.5, 130.9, 131.3, 155.7, 156.5, 160.1, 160.5, 160.9, 161.4 ) 及び1個のカルボニル基(δC 182.4 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Hano Y., Hirakura K., Nomura T., Uzawa J., Chem. Pharm. Bull., 26 (5) 1453-1458 (1978))を比較することにより、Kuwanon Cと同定した。
【0071】
Kuwanon T ( 13 )の構造
化合物13は、黄色粉末、EI-MSスペクトルにm/z 422を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 422.1724 (calcd. 422.1729)を示すことから、分子式C25H26O6が推定された。
【0072】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 7.00 ( 1H, d, J = 8.4 Hz )及び6.56 ( 1H, d, J = 8.4 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.29 ( 1H, d, J = 2.1 Hz )及び6.22 ( 1H, d, J = 2.1 Hz )]より1,2,3,5−四置換ベンゼンの存在が推定された。また、[δH 5.09 ( 1H, m )、5.30 ( 1H, m )、3.08 ( 2H, d, J = 6.9 Hz )、3.44 ( 2H, d, J = 7.2 Hz )、1.38 ( 3H, s )、1.56 ( 3H, s )、1.65 ( 3H, s )及び1.77 ( 3H, s )]より2個のプレニル基の存在が推定された。[δH 13.08 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0073】
13C-NMR及びDEPTスペクトルでは、4個のメチル(δC 17.3, 17.6, 25.5, 25.6 )、2個のメチレン(δC 22.8, 24.2 )、6個のメチン(δC 93.6, 98.6, 107.5, 121.6, 123.0, 128.0 )、12個の四級炭素シグナル(δC 104.7, 112.5, 116.2, 121.5, 130.7, 131.5, 153.6, 157.9, 158.6, 161.2, 162.5, 164.0 ) 及び1個のカルボニル基(δC 182.2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Fukai T., Hano Y., Hirakura K., Nomura T., Uzawa J., Chem. Pharm. Bull., 33 (10) 4288-4295 (1985))を比較することにより、Kuwanon Tと同定した。
【0074】
Morusin ( 14 )の構造
化合物14は、黄色粉末、EI-MSスペクトルにm/z 420を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 420.1572 ( calcd. 420.1572 )を示すことから、分子式C25H24O6が推定された。
【0075】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.26 ( 1H, d, J = 8.2 Hz )、6.58 ( 1H, d, J =2.0 Hz )及び6.53 ( 1H, dd, J = 8.2, 2.0 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。 [δH 6.16 ( 1H, s )]より1,2,3,4,5−五置換ベンゼンの存在が推定された。[δH 6.60 (1H, d, J = 10.0 Hz )及び5.65 ( 1H, d, J = 10.0 Hz )]よりシスカプリングするオレフィンの存在が推定された。また、[δH 5.13 ( 1H, m )、3.14 ( 2H, d, J = 7.2 Hz )、1.44 ( 3H, s )、及び1.57 ( 6H, s )]より1個のプレニル基の存在が推定された。[δH 13.10 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0076】
13C-NMR及びDEPTスペクトルでは、4個のメチル(δC 17.6, 25.8, 28.2×2 )、1個のメチレン(δC 24.6 )、7個のメチン(δC 99.7, 103.9, 108.2, 115.4, 122.5, 128.0, 132.4 )、12個の四級炭素シグナル(δC 78.7, 101.6, 105.6, 112.7, 121.7, 132.4, 153.2, 157.3, 159.9, 161.6, 162.4, 162.7 ) 及び1個のカルボニル基(δC 183.2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Nomura T., Fukai T., Yamada S., Katayanagi M., Chem. Pharm. Bull., 26 (5)1394-1402 (1978))を比較することにより、Morusinと同定した。
【0077】
Kuwanon E ( 15 )の構造
化合物15は、黄色粉末、EI-MSスペクトルにm/z 424を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 424.1885 (calcd. 424.1885)を示すことから、分子式C25H28O6が推定された。
【0078】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 5.95 ( 1H, d, J =2.0 Hz ) 及び5.96 ( 1H, d, J = 2.0 Hz )]よりより1,2,3,5−四置換ベンゼンの存在が推定された。[δH 7.21 ( 1H, s )及び6.50 ( 1H, s )]より1,2,4,5−四置換ベンゼンの存在が推定された。また、[δH 5.36 ( 1H, m )、5.12 ( 1H, m )、3.28 ( 2H, d, J = 7.3 Hz )、2.05 ( 2H, m )、2.10( 2H, m )、1.71 ( 3H, s )、1.62( 3H, s )及び1.57 ( 3H, s )]よりゲラニル基の存在が推定された。[δH 13.05 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0079】
13C-NMR及びDEPTスペクトルでは、3個のメチル(δC 16.2, 17.7, 25.8 )、4個のメチレン(δC 27.4, 28.3, 40.5, 42.6 )、7個のメチン(δC 75.5, 95.8, 96.7, 103.5, 124.0, 125.1, 129.0 )、10個の四級炭素シグナル(δC 103.2, 117.0, 120.2, 131.6, 135.9, 154.2, 156.6, 164.8, 165.3, 167.3) 及び1個のカルボニル基(δC 197.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Nomura T., Fukai T., Planta Medica., 42, 79- 88 (1981))を比較することにより、Kuwanon Eと同定した。
【0080】
Sanggenon F ( 16 )の構造
化合物16は、黄色粉末、EI-MSスペクトルにm/z 354を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 354.1102 (calcd. 354.1103)を示すことから、分子式C20H18O6が推定された。
【0081】
1H-NMRでは、芳香族領域においてプロトンシグナル[δH 5.97 ( 1H, d, J =2.0 Hz ) 及び5.96 (1H, d, J = 2.0 Hz )]よりより1,2,3,5−四置換ベンゼンの存在が推定された。[δH 7.22 ( 1H, d, J = 8.6 Hz )及び6.50 ( 1H, d, J = 8.6 Hz )]より1,2,3,4−四置換ベンゼンの存在が推定された。[δH 6.71 ( 1H, d, J = 10.0 Hz )及び5.70 ( 1H, d, J = 10.0 Hz )]よりシスカプリングするオレフィンの存在が推定された。また、[δH 13.05 ( 1H, s )]のプロトンシグナルより、キレート水酸基の存在が推定された。
【0082】
13C-NMR及びDEPTスペクトルでは、2個のメチル(δC 27.8, 27.9 )、1個のメチレン(δC 42.7 )、7個のメチン(δC 74.9, 95.8, 96.8, 108.5, 117.7, 127.7, 129.6 )、9個の四級炭素シグナル(δC 77.0, 103.2, 110.3, 118.7, 151.7, 154.2, 164.8, 165.4, 167.4 ) 及び1個のカルボニル基(δC 197.5 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Nomura T., Fukai T., Hano Y., Tsukamoto K., Heterocycles, 20 (4) 661-666 (1983))を比較することにより、Sanggenon Fと同定した。
【0083】
Betulinic acid ( 17 )の構造
化合物17は、無色針状結晶、mp300℃、EI-MSスペクトルにm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3600 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0084】
1H-NMRでは、4級炭素に結合する6個のメチルプロトン(δH 0.83, 1.02, 1.07, 1.08, 1.23, 1.80 )、1個のオキシメチンプロトン(δH 3.46 )、1個の末端メチレンプロトン(δH 4.78, 4.95)の存在が認められた。
【0085】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0086】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0087】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0088】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0089】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0090】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0091】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0092】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0093】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0094】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0095】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0096】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0097】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0098】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0099】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0100】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0101】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0102】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0103】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0104】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0105】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0106】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0107】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0108】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0109】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0110】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0111】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0112】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0113】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0114】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0115】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0116】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0117】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0118】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0119】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0120】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0121】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0122】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0123】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0124】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0125】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0126】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0127】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0128】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0129】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0130】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0131】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0132】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0133】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 14.9, 16.3, 16.4, 16.5, 19.5, 28.7 )、11個のメチレン(δC18.8, 21.2, 26.2, 28.3, 30.3, 31.3, 32.9, 34.9, 37.6, 39.3, 109.9 )及び6個の四級炭素シグナル(δC 37.5, 39.5, 41.2, 42.9, 56.7, 151.3 )及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Ikura A., Itokawa H., Phytochemistry, 27 (9) 2813- 2815 (1988))を比較することにより、Betulinic acidと同定した。
【0134】
Uvaol ( 18 )の構造
化合物18は無色粉末、EI-MSスペクトルよりm/z 442を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 442.3813 (calcd. 442.3810)を示すことから、分子式C30H50O2が推定された。
【0135】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.79, 0.95, 0.99, 1.00, 1.10 )、メチンに結合する2個のメチルプロトン(δH 0.81, 0.94 )、2個のオキシメチレンプロトン(δH 3.20, 3.52 )、1個のオキシメチンプロトン(δH 3.22, dd, J = 11.3, 4.8 Hz )、1個のオレフィンメチンプロトン(δH 5.14, t, J = 3.5 Hz )の存在が認められた。
【0136】
13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 15.6, 15.7, 16.8, 17.4, 21.3, 23.3, 28.1 )、10個のメチレン(δC18.3, 23.3, 23.4, 26.0, 27.2, 30.6, 32.8, 35.2, 38.8, 69.9 )及び5個の四級炭素シグナル(δC 36.9, 38.0, 40.0, 42.0, 138.7)の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Salimuzzaman S., FarrukhH., Sabira B., Bina S.S., J. Nat. Prod., 49 (6) 1086-1090 (1986))を比較することにより、Uvaolと同定した。
【0137】
Ursolic acid ( 19 )の構造
化合物19は無色粉末、EI-MSスペクトルよりm/z 456を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 456.3599 (calcd. 456.3603)を示すことから、分子式C30H48O3が推定された。
【0138】
1H-NMRでは、4級炭素に結合する5個のメチルプロトン(δH 0.90, 1.04, 1.07, 1.25, 1.26 )、メチンに結合する2個のメチルプロトン(δH 0.98, 1.02 )、1個のオキシメチンプロトン(δH 3.48, m )、1個のオレフィンメチンプロトン(δH 5.51, t, J = 3.7 Hz )の存在が認められた。
【0139】
13C-NMR及びDEPTスペクトルでは、7個のメチル(δC 15.7, 16.6, 17.4, 17.5, 21.4, 23.9, 28.8 ) 、9個のメチレン(δC18.8, 23.6, 24.9, 28.1, 28.7, 31.0, 33.6, 37.4, 39.0)、5個の四級炭素シグナル(δC 37.3, 39.9, 42.5, 48.0, 139.2) 及び1個のカルボニル基(δC 178.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、Ursolic acidと同定した。
【0140】
β-sitosterol ( 20 )の構造
化合物20は、無色針状結晶、mp140℃、EI-MSスペクトルよりm/z 414を与え、分子イオンピークが認められ、HR-EI-MSでは、m/z 414.3854 (calcd. 414.3861)を示すことから、分子式C29H50Oが推定された。
【0141】
1H-NMRでは、1個のオキシメチンプロトン(δH 3.52, m )、1個のオレフィンメチンプロトン(δH 5.35, d, J = 4.5 Hz )の存在が認められた。13C-NMR及びDEPTスペクトルでは、6個のメチル(δC 11.9, 12.0, 18.9, 19.0, 19.4, 19.8 ) 、11個のメチレン(δC 21.2, 23.1, 24.3, 26.1, 28.3, 31.7, 31.9, 34.0, 37.3, 39.8, 42.3 )、1つオキシメチン(δC 71.8 )及び1つ二重結合炭素シグナル(δC 121.7, 140.8 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Basnet P., Kadota S., Terashima S., Shimazu M., Namba T., Chem. Pharm. Bull., 41(7), 1238 - 1243 (1993))を比較することにより、β-sitosterolと同定した。
【0142】
Oxyresveratrol 2-O-β-D- glucopyranoside ( 21 )の構造
化合物21は、無色粉末、Negative-FAB-MSスペクトルよりm/z 405[M-H]-を与え、分子イオンピークが認められ、HR-FAB-MSでは、m/z 405.1183 (calcd. 405.1185)を示すことから、分子式C20H22O9が推定された。
【0143】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.45 ( 1H, d, J = 8.6 Hz )、6.54 ( 1H, d, J = 2.1 Hz )及び6.52 ( 1H, dd, J = 8.6、2.1 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.37 ( 2H, d, J = 2.1 Hz )及び6.10 ( 1H, t, J = 2.1 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。δH 7.17 ( 1H, d, J = 16.5 Hz )及び6.87 ( 1H, d, J = 16.5 Hz )よりトランス−オレフィンの存在が推定された。また、[δH 4.79 ( 1H, d, J = 7.6 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0144】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 61.0 )、13個のメチン(δC 70.0, 73.6, 77.0, 77.4, 100.8, 102.1, 104.3, 104.6×2, 107.9, 123.1, 126.6, 127.4 )、6個の四級炭素シグナル(δC 118.4, 140.1, 156.1, 158.3, 168.9×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Piao S.J., Qu G.X., Qiu F., Chinese Journal of Medicinal Chemistry, 16 (1) 40-45 (2006))を比較することにより、下記化1に示すOxyresveratrol 2-O-β-D- glucopyranosideと同定した。
【0145】
【化1】

【0146】
Mulberroside A ( 22 )の構造
化合物22は、無色粉末、Negative-FAB-MSスペクトルよりm/z 567 [M-H]-を与え、疑似分子イオンピークが認められ、HR-FAB-MSでは、m/z 567.1716 (calcd. 567.1712)を示すことから、分子式C26H32O14が推定された。
【0147】
1H-NMRでは、芳香族領域においてABXタイプに分裂する3個のプロトンシグナル[δH 7.42 ( 1H, d, J = 9.0 Hz )、6.59 ( 1H, d, J = 2.0 Hz )及び6.58 ( 1H, dd, J = 9.0、2.0 Hz )]より1,2,4−三置換ベンゼンの存在が推定された。[δH 6.76 ( 1H, t, J = 2.0 Hz )、6.63 ( 1H, t, J = 2.0 Hz )及び6.44 ( 1H, t, J = 2.0 Hz )]より1,3,5−三置換ベンゼンの存在が推定された。[δH 7.31 (1H, d, J = 16.6 Hz )及び6.93 ( 1H, d, J = 16.6 Hz )]よりトランス−オレフィンの存在が推定された。また、[δH 4.90 ( 1H, d, J = 7.0 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0148】
13C-NMR及びDEPTスペクトルでは、2個のメチレン(δC 62.4, 62.5 )、17個のメチン(δC 71.3×2, 74.8, 74.9, 78.0×2, 78.07, 78.12, , 102.0, 102.3, 104.0, 104.9, 107.2, 108.2, 109.3, 124.9, 127.6, 128.4 )、6個の四級炭素シグナル(δC 120.2, 141.9, 157.1, 159.5×2, 160.4×2 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値(Hirakura K., Fujimoto Y., Fukai T., Nomura T., J. Nat. Prod., 49 (2) 218-224 (1986))を比較することにより、下記化2に示すMulberroside Aと同定した。
【0149】
【化2】

【0150】
Mulberroside B ( 23 )の構造
化合物23は、無色粉末、Positive-FAB-MSスペクトルよりm/z 341を与え、疑似分子イオンピーク[M+H]+が認められ、HR-FAB-MSでは、m/z 341.0868 (calcd. 341.0872)を示すことから、分子式C15H16O9が推定された。
【0151】
1H-NMRでは、芳香族領域においてシスカプリングするオレフィンプロトンシグナル[δH 6.08 ( 1H, d, J = 9.5 Hz )及び8.02 ( 1H, d, J = 9.5 Hz )]、1個のシングルプロトンのシグナル[δH 6.30 ( 1H, s Hz )]が観測された。また、[δH 4.73 ( 1H, d, J = 9.8 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0152】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 60.1 )、8個のメチン(δC 69.3, 72.1, 74.7, 77.9, 81.0, 94.6, 108.8, 139.6 ) 、6個の四級炭素シグナル(δC 102.3, 109.2, 154.0, 155.0, 160.2, 160.6 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値Hirakura K., Saida I., Fukai T., Nomura T., Heterocycles, 23 (9) 2239-2242 (1985)を比較することにより、下記化3に示す、Mulberroside Bと同定した。
【0153】
【化3】

【0154】
5,7-dihydroxycoumarin 7-O-β-D-glucopyranoside ( 24 )の構造
化合物24は、無色粉末、Positive-FAB-MSスペクトルよりm/z 341を与え、疑似分子イオンピーク[M+H]+が認められ、HR-FAB-MSでは、m/z 341.0866 (calcd. 341.0872)を示すことから、分子式C15H16O9が推定された。
【0155】
1H-NMRでは、芳香族領域においてシスカプリングするオレフィンプロトンシグナル[δH 6.13 ( 1H, d, J = 9.4 Hz )及び8.10 ( 1H, d, J = 9.4 Hz )]、メタカプリングするプロトンのシグナル[δH 6.48 ( 1H, d, J = 2.0 Hz )及び6.53 ( 1H, d, J = 2.0 Hz )]が観測された。また、[δH 4.96 ( 1H, d, J = 7.4 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0156】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 62.4 )、9個のメチン(δC 71.2, 74.7, 77.9, 78.3, 96.2, 100.3, 101.8, 111.2, 141.2 )、4個の四級炭素シグナル(δC 105.6, 157.6, 163.0, 163.9 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値を比較することにより、下記化4に示す、5,7-dihydroxycoumarin 7-O-β-D-glucopyranosideと同定した。
【0157】
【化4】

【0158】
5,7-dihydroxycoumarin 7-O-β-D-apiofuranosyl -(1→6)-O-β-D-glucopyranoside( 25 )の構造
化合物25は、黄色粉末、Negative-FAB-MSスペクトルよりm/z 471 [M-H]- に疑似分子イオンピークが認められ、HR-FAB-MSでは、m/z 471.1137 (calcd. 471.1137)を示すことから、分子式C20H24O13が推定された。UVスペクトルでは、237、254、319 nmに極大吸収が観測された。IRでは、3400 cm-1に水酸基、1712 cm-1にケトン及び1619 cm-1にベンゼン環に基づく吸収が観測された。また、TLC上365 nmのUV照射下で、青色蛍光を発することからクマリン誘導体が推定された。
【0159】
1H-NMRでは、芳香族領域においてメタカプリングするプロトンのシグナル[δH 6.40 ( 1H, d, J = 2.0 Hz )及び6.51 ( 1H, d, J = 2.0 Hz )]が認められ、1,2,3,5−四置換ベンゼンの存在が推定された。シスカプリングするオレフィンプロトンシグナル[δH 6.15 ( 1H, d, J = 9.4 Hz )及び8.00 ( 1H, d, J = 9.4 Hz )] よりクマリン誘導体が支持された。また、δH 4.96 ( 1H, d, J = 7.4 Hz )及びδH 4.80 ( 1H, d, J = 2.9 Hz )にアノマープロトンのシグナルが観測され、2モルの糖の存在が示された。
【0160】
13C-NMR及びDEPTスペクトルでは、20個の炭素シグナルが認められ、このうち3個のメチレン(δC 63.3, 67.4, 73.4 )、11個のメチン(δC 69.7, 73.1, 73.4, 75.5, 76.4, 94.5, 99.2, 100.0, 109.3, 110.6, 139,4 )、6個の四級炭素シグナル(δC 78.8, 103.6, 155.7, 156.1, 160.6, 161.0 )の存在が明らかになった。
【0161】
1H-1H COSY及びHMQCを測定した結果、図3に示すようにアグリコン部分のAとBのユニット、部分構造のCユニット及びグルコシル基が推定された。糖部では、アノマープロトンからのクロスピークをたどると、δH 4.96 ( 1H, d, J = 7.4 Hz, Glc-1' )はδH 3.21 ( 1H, t, J = 9.2 Hz, Glc-2')、更に、δH 3.27 ( 1H, t, J = 9.2 Hz, Glc-3')、δH 3.15 ( 1H, t, J = 9.2 Hz, Glc-4')、δH 3.53 ( 1H, ddd, J = 9.2, 6.3, 1.4 Hz, Glc-5')と2個のジェミカレメチレンシグナルδH 3.45 ( 1H, dd, J = 10.9, 6.3 Hz, Glc-6' )と 3.85 ( 1H, dd, J = 10.9, 1.4 Hz, Glc-6' )との連接性が認められた。このユニットはグルコースと判明した。また、Glc-6位の炭素シグナルδC 67.4は通常のGlucose(δC 62付近)と比較すると、低磁場に現われている。そこで、Glc-6位に他の糖が結合していると考えられた。
【0162】
次に、HMBCスペクトルを測定し、アグリコンの構造と未解決の糖について解析を行った。1H-NMR で推定されたオレフィンプロトンシグナルのδH 6.15 ( H-3 )はδC 103.6 ( C-4a )の四級炭素及び160.6 ( C-2 )と、δH 8.00 ( H-4 )はδC 156.1 ( C-8a )及び160.6 ( C-2 )とロングレンジ相関が認められた。1,2,3,5−四置換ベンゼン上のδH 6.40 ( H-6 )はδC 94.5 ( C-8 )、103.6 ( C-4a )、155.7 ( C-5 ) 、156.1 ( C-8a )及び161.0 ( C-7 )と、δH 6.51 ( H-8 )はδC 99.2 ( C-6)、103.6 ( C-4a )、156.1 ( C-8a )及び161.0 ( C-7 )とロングレンジ相関が認められた。これらの相関性について考えると、C-4aはH-6と8は両方と相関が認められることから、H-6とH-8はC-4aのメタ位に位置している事が判明した。すなわち、アグリコンは5,7-dihydroxycoumarinである。
【0163】
また、Glc-1'はC-7とロングレンジ相関が認められた。クマリン環の7位にグルコースが結合している事が明らかになった。
【0164】
さらに、残り糖のプロトン及び5個の炭素について検討した。δH 4.80 ( 1H, d, J = 2.9 Hz, Api-1'' )はオのδC 73.4 ( Api-4'' )、76.0 ( Api-2'' )及び 78.8 ( Api-3'' )とロングレンジ相関が認められた。δH 3.73 ( 1H, d, J = 2.9 Hz, Api-2'' )はδC 63.3 ( Api-5'' )と109.3 ( Api-1'' )とロングレンジ相関が認められた。メチレンの[δH 3.87( 1H, d, J = 9.5 Hz, Api-4'' )と3.58 (1H, d, J = 9.5 Hz, Api-4'' )]はδC 63.3 ( Api-5'' )、78.8 ( Api-3'' )及び109.3 ( Api-1'' )とロングレンジ相関が認められた。一方、残りの比等価なメチレンの[δH 3.36 ( 1H, d, J = 11.5 Hz, Api-5'' )と3.35 (1H, d, J = 11.5 Hz, Api-5'' )]はδC 73.4 ( Api-4'' )、76.0 ( Api-2'' )及び78.8 ( Api-3'' ) とロングレンジ相関が認められた。すなわち、この糖部はフラノース環を形成しており、3位にヒドロキシメチレン基を有する。
【0165】
そこで、β-D-apioseが結合していると考えられるので、apiinの加水分解により得られたD-apioseと旋光度検出器を備えたHPLCでD-apioseと同定した。また、アノマープロトンのJ値、炭素のシフト値よりβ結合していることが明かとなった。
【0166】
また、アノマープロトンδH 4.80 ( A-1'' )はδC 67.4 ( G-6' ) と、グルコースのプロトンδH 3.15 ( G-6' )はδC 109.3 ( A-1'' )とロングレンジ相関が認められた。このことにより、アピオースはグルコースの6位に結合している事が明らかになった。
【0167】
以上の結果より、化合物25の構造は、下記化5に示す、5,7-dihydroxycoumarin 7-O-β-D-apiofuranosyl -(1→6)-O-β-D-glucopyranosideと決定した。
【0168】
【化5】

【0169】
Adenosine ( 26 )の構造
化合物26は、無色粉末、Positive-FAB-MSスペクトルよりm/z 268を与え、疑似分子イオンピーク[M+H]+が認められ、HR-FAB-MSでは、m/z 268.1045 (calcd. 268.1045)を示すことから、分子式C10H13N5O4が推定された。
【0170】
1H-NMRでは、低磁場領域において2個のプロトンシグナル[δH 8.13 ( 1H, s )、8.34 ( 1H, s )]、1個のブロドなシングルプロトンのシグナル[δH 7.34 ( brs, -NH2 )]が観測された。また、[δH 5.87 (1H, d, J = 6.0 Hz )]にアノマープロトンのシグナルが観測され、1モルの糖の存在が明らかとなった。
【0171】
13C-NMR及びDEPTスペクトルでは、1個のメチレン(δC 62.2 )、6個のメチン(δC 71.2, 74.0, 86.4, 88.4, 140.5, 152.9 )、3個の四級炭素シグナル(δC 119.9, 149.6, 156.7 )の存在が明らかになった。1H-NMR、13C-NMRスペクトルデータを文献値Otsuka H., Takeuchi M., Inoshiri S., Sato T., Yamasaki K., Phytochemistry, 28 (3) 883-886 (1989)を比較することにより、下記化6に示す、Adenosineと同定した。
【0172】
【化6】

【0173】
TG蓄積抑制試験とGPDH活性試験
1)3T3-L1前駆脂肪細胞から脂肪細胞への分化誘導及び促進試験
3T3-L1前駆脂肪細胞は、5% CO2下37℃で培養した。脂肪細胞分化抑制試験には対数増殖期の細胞を1.0×105 cells/ mLに調製し使用した。基本培地(10% FCSを含むDMEM培地)で2日間培養後(Day 0)、3-イソブチル-1-メチルキサンチン(IBMX, 500 μM)、デキサメタゾン(DEX, 1 μM)及びインスリン(10 μg/mL)を含有する分化誘導培地(10% FBSを含むDMEM培地)に試験薬物を添加し、3日間培養した(Day 3)。さらに、インスリン(10 μg/mL)を含有する分化維持培地に試験薬物を添加し、2日おきに同じ培地で交換し8日間培養した(Day 8)。
【0174】
2)細胞ホモジネートの調製
分化した細胞の上清はチュープに回収し、脂肪細胞はリン酸緩衝生理食塩水(PBS(−))で2回洗浄する。500μl 1 mM EDTAを含むトリス−塩酸緩衝液25 mM Tri buffer ( pH 7.5)を加え、ビペット用いて細胞を剥離し、1.5mlプラスチックチューブに回収する。氷水で冷やしながら、超音波処理(1本/2分程度)により細胞膜を破壊後、4℃、15,000rpm、2分間遠心分離を行った。
【0175】
3)トリグリセライド(TG)含量の測定
細胞ホモジネートの一部分を取って、細胞内に蓄積されたトリグリセライド(TG)はラボアッセイTMトリグリセライド(和光純薬)を用いて定量した。
各サンプルの細胞ホモジネートにトリグリセライド発色試薬を添加してよく混合し、37℃で5分間加温した。ブランクを対照として、波長595 nmにおける検体及び基準液の吸光度を測定した。標準曲線を作るために、基準液を終濃度が100, 200, 300, 596, 882 mg/dLになるように調整して添加した。
【0176】
抑制率 (%) = {(Y - X) / Y}× 100
X:試料を添加した際の1wellあたりのTG量を1wellあたりのDNA量で除したもの。
Y:DMSOを添加した際の1wellあたりのTG量を1wellあたりのDNA量で除したもの。
【0177】
4)GPDH活性の測定
細胞ホモジネートの一部分を取って、細胞内のGPDHはGPDH活性測定キット(Primary Cell Co., Ltd.)を用いた。
反応基質溶液を分光光度計用セル(石英ミクロセル)に入れ、セル内に検体を加え、良く攪拌した後、波長340nmにおける吸光度の減少を経時測定し、1分間当りの吸光度の変化量(ΔO.D.)を求める。ストップウオッチで時間を計りながら30秒1回測定する。4分間測定を行った。
【0178】
活性値の計算:
検体1ml当りのGPDHが1分間に1μmoleのNADHを消費する活性を1Uとすると、GPDH活性は次式で求められる(光路長が1cmの場合)。
GPDH活性(U/ml)=ΔO.D.×0.482
ΔO.D.:1分間当たりの波長340nmにおける吸光度の変化量
抑制率 (%) = {(Y - X) / Y}× 100
X:試料を添加した際の1wellあたりのGPDH活性を1wellあたりのDNA量で除したもの。
Y:DMSOを添加した際の1wellあたりのGPDH活性を1wellあたりのDNA量で除したもの。
【0179】
5)DNAの定量
細胞ホモジネートの一部分を取って、細胞内のDNAの量はDNA活性測定キット(Primary Cell Co., Ltd.)を用いて定量した。細胞ホモジネートと緩衝液及び発色剤を加えてよく混合する。
【0180】
混合した溶液を励起フィルター356 nm、蛍光フィルター458 nmで蛍光を測定した。標準曲線を作るために、基準液 (DNA 100 μg/ml) を精製水で希釈し、100, 50, 25, 12.5, 0 μg/mlになるように調整した。混合した溶液を励起フィルター(Excitation filter):356nm, 蛍光フィルター(Emission filter):458nmで蛍光を測定した。
【0181】
魯桑(Morus alba var. multicaulis Perro.)の根皮の抽出液、さらに、各画分について、TG蓄積抑制試験とGPDH活性試験を行ったところ、図4に示す通り、酢酸エチル画分に最も強い効果が認められた。結果は、±SD(n−3)法で示されている。サンプルの濃度は、a (100 μg/ml), b (30 μg/ml)である。
【0182】
さらに、桑根皮より得られた化合物についてTG蓄積抑制試験とGPDH活性試験を行った。その結果を図5に示す。サンプルの濃度は、20μM (Pioglitazone: 3μM)である。フラボノイド( 11-16 )、トリテルベン(17,18)、ステロイド(20)、クマリン(24, 25)に脂肪細胞へのTGの蓄積を抑制したともに、GPDH活性を抑制したことが認められた。これらの化合物は、ポジティブコントロールとして使用したクエルセチンより強い抑制活性が認められた。また、11-14と15,16を比較するとフラボンはフラバノンより強い活性が認められた。
ベンゾフラン(1-10)、スチルベン配糖体(21-22)、クマリン配糖体(23)には弱い活性が認められた。
【0183】
一酸化窒素(NO)産生抑制効果の検討
RAW264.7細胞は、5 %CO2下37℃、10 %FBS含有Ham’s F12培地で培養した。NO産生抑制試験には対数増殖期の細胞を1.0×105 cells/ mLに調製し使用した。細胞を2時間培養し、種々の濃度の抽出エキス、又は試験化合物を添加した。同時にIFN-γ( 10U/mL )及びLPS (100 ng/mL)を添加し、16時間培養後、上清を採取し、NOの酸化体であるNO2−をGriess法で測定した。
【0184】
抽出エキス、又は試験化合物を溶解したDMSO濃度は培地中0.2 %以下となるようにした。RAW264.7細胞の培養上清を平底96穴マイクロプレートに100 μL入れ、1 %スルファニルアミド5 %リン酸溶液、0.1 %N-1-ナフチルエチレンジアミン二塩酸塩溶液を各50 μL添加し、10分間放置後、655 nmの吸収を対照に、570 nmの吸光度を測定した。
【0185】
細胞毒性の確認はMTT法、鏡検により確認した。MTT法は常法に従った。すなわち、96穴マイクロプレートに1.0×105 cell/mLに調製した細胞を200 μLずつ入れ、抽出エキスを種々の濃度で添加し、16時間培養後、MTT試薬を加え、さらに4時間培養した。上清を除去し、DMSOを150μL添加し、生成したホルマザンを完全に溶解し、570 nmの吸光度を測定した。また、ポジティブコントロールとしてQuercetin、Resveratrolを使用した。
【0186】
抑制率(%)={1−(X−Y)/(Z−Y)}×100
X:試験化合物の存在下でIFN-γとLPSにより誘導される吸光度。
Y:試験化合物、IFN-γ及びLPSがない状態で誘導される吸光度。
Z:IFN-γとLPSにより誘導される吸光度。
【0187】
桑根皮より得られた化合物についてNO産生抑制試験を行った。その結果を図6に示す。ベンゾフラン( 1-10 )、フラボノイド( 11-16 )、トリテルベン(19)にNO産生抑制活性が認められた。これらの化合物は、ポジティブコントロールとして使用した塩酸アミノグアニジンと同程度、またはそれ以上の活性が認められた。ポジティブコントロールとして使用したクエルセチンより強い活性が認められた。ステロイド、スチルベン配糖体、クマリン配糖体には活性は認められた。
【0188】
既述の実施例によれば、本発明に係る既述の有効成分に、一酸化窒素(NO)産生抑制効果が認められた。これにより、マクロファージの活性化が抑制され、インシュリン抵抗性が改善されるために、糖尿病の症状の改善効果が達成される。
【0189】
本発明に係る有効成分は、人間及び動物に対して抗肥満作用を発揮する。本発明の有効成分を人間又は動物に対して適用するには、内服、注射、外用など公知の全ての剤型を用いることができる。本発明の有効成分は、薬剤、健康食品、外用剤として利用することができる。
【特許請求の範囲】
【請求項1】
クワ科植物の根の皮の抽出物を含有する抗肥満剤。
【請求項2】
前記クワ科植物が、マグワ(M. alba var. multicaulis Perro.)である、請求項1記載の抗肥満剤。
【請求項3】
前記抽出物が、酢酸エチルの画分に存在する請求項1又は2記載の抗肥満剤。
【請求項4】
クワ科植物の根の皮の抽出物を含有する糖尿病改善剤。
【請求項5】
前記クワ科植物が、マグワ(M. alba var. multicaulis Perro.)である、請求項4記載の糖尿病改善剤。
【請求項6】
前記抽出物が、酢酸エチルの画分に存在する請求項4又は5記載の糖尿病改善剤。
【請求項1】
クワ科植物の根の皮の抽出物を含有する抗肥満剤。
【請求項2】
前記クワ科植物が、マグワ(M. alba var. multicaulis Perro.)である、請求項1記載の抗肥満剤。
【請求項3】
前記抽出物が、酢酸エチルの画分に存在する請求項1又は2記載の抗肥満剤。
【請求項4】
クワ科植物の根の皮の抽出物を含有する糖尿病改善剤。
【請求項5】
前記クワ科植物が、マグワ(M. alba var. multicaulis Perro.)である、請求項4記載の糖尿病改善剤。
【請求項6】
前記抽出物が、酢酸エチルの画分に存在する請求項4又は5記載の糖尿病改善剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−202558(P2010−202558A)
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願番号】特願2009−48626(P2009−48626)
【出願日】平成21年3月2日(2009.3.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月1日 日本生薬学会発行の「日本生薬学会第55回年会(2008年)年会講演要旨集」に発表
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願日】平成21年3月2日(2009.3.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月1日 日本生薬学会発行の「日本生薬学会第55回年会(2008年)年会講演要旨集」に発表
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
[ Back to top ]

