抗肥満剤及び脂肪蓄積抑制作用を有する医薬品、食品又は化粧料
【課題】副作用の恐れがなく、安全で、かつ、優れた脂肪蓄積抑制作用を有する抗肥満剤の提供。
【解決手段】下記の式(1)で表されるリナカンチンDを含有する抗肥満剤。

下記の式(2)で表される新規化合物Aを含有する抗肥満剤。

【解決手段】下記の式(1)で表されるリナカンチンDを含有する抗肥満剤。

下記の式(2)で表される新規化合物Aを含有する抗肥満剤。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗肥満剤及び脂脂肪蓄積抑制作用を有する医薬品、食品又は化粧料に関する。
【背景技術】
【0002】
近年、食生活の欧米化やライフスタイルの変化に伴い、肥満の割合が増加している。飲食物により摂取されるエネルギー量が、運動などにより消費されるエネルギー量を上回ることで発生する過剰なエネルギーが脂肪として体内に蓄積し、この状態が持続することにより肥満となる。肥満は、高血圧、糖尿病、動脈硬化などの生活習慣病の発症との関連性が高く、これら疾患の発症の予防と治療の観点からも肥満の予防又は解消が極めて重要となってきている。また、医学的な観点だけではなく美容的な観点からも肥満の予防又は解消が極めて重要となってきている。このような社会的背景において、様々な作用様式の抗肥満剤や抗肥満作用を有する医薬品、食品又は化粧料が知られている。
【0003】
脂肪の分解促進のメカニズムに関連するものとして、リパーゼ活性化作用を呈するアントラキノン誘導体(例えば、特許文献1参照。)及び脂肪分解作用を有するイソキノリンアルカロイド誘導体(例えば、特許文献2参照。)が知られている。また、リパーゼ阻害作用を有し遊離脂肪酸産生抑制効果に基づくものとして、マテチャ含有サポニン化合物を有効成分とする抗肥満剤(例えば、特許文献3参照。)が知られている。中性脂肪低下及びコレステロール低下作用に起因するものとして、シクロアルタン型トリテルペン又はその配糖体を含有することを特徴とする血中中性脂肪低下剤(例えば、特許文献4参照。)が知られている。脂肪細胞特異的作用メカニズムに基づくものとしては、内分泌因子アディポネクチンへの作用を介するものとして、シアニジン化合物を有効成分とするアディポネクチン発現促進剤(例えば、特許文献5参照。)及びシアニジン3−グルコシドを有効成分とする抗肥満剤(例えば、特許文献6参照。)が知られている。脂肪細胞数の増加を抑制し抗肥満効果を有するものとして、カミツレに含まれるビサボロールオキサイド-A-β-グルコシド(Bisabolol oxide-A-β-glucoside)を含有する脂肪蓄積抑制剤(例えば、特許文献7参照。)が知られている。脂肪蓄積抑制及び脂肪細胞への分化抑制作用に基づくものとして、アルクチイン及び/又はアルクチゲニンを含有する脂肪代謝改善組成物(例えば、特許文献8参照。)が知られている。また、脂肪細胞への分化抑制作用に基づく脂肪蓄積抑制作用を有する外用剤として、ω-3系高度不飽和脂肪酸を有効成分として含有する脂肪蓄積抑制剤(例えば、特許文献9参照。)が知られている。
【0004】
一方、本発明の「リナカンチンD」を含有するとともに、本発明により「後述する新規化合物A」を含有することが明らかとなった白鶴霊芝(以下、白鶴霊芝草というこよもある。Rhinacanthus nasutus (L.) Kurz)は、インド南部デカン高原の原産とされるリナカンサス属キツネノマゴ科に属する常緑小低木であり、その全草は駆虫、消炎、皮膚真菌に対する抗菌作用のあることが知られ(例えば、非特許文献1参照。)、主に中国、台湾等において、また、最近では日本国において漢方薬として用いられている。その他、本出願人による以前の出願で、白鶴霊芝に活性酸素消去能があること(例えば、特許文献10参照。)、排泄促進作用があること(例えば、特許文献11参照。)、抗アレルギー作用があること(例えば、特許文献12参照。)及び抗腫瘍作用があること(例えば、特許文献13参照。)が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−347952号公報
【特許文献2】特開2008−308446号公報
【特許文献3】特開2009−196902号公報
【特許文献4】特開2006−290882号公報
【特許文献5】国際公開第WO2004/078741号パンフレット
【特許文献6】特開2003−252766号公報
【特許文献7】特開2006−213648号公報
【特許文献8】特開2008−297209号公報
【特許文献9】特許第3607062号公報
【特許文献10】特開平9−143091号公報
【特許文献11】特開平9−169662号公報
【特許文献12】特開2001−10964号公報
【特許文献13】特開2002−53481号公報
【非特許文献】
【0006】
【非特許文献1】原色牧野和漢薬草大図鑑、492頁、北隆館、1988年
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、白鶴霊芝草植物本体、白鶴霊芝草抽出物又は白鶴霊芝草植物本体若しくは白鶴霊芝草抽出物に含まれる「リナカンチンD」若しくは「後述する新規化合物A」が脂肪蓄積抑制作用(脂肪細胞分化抑制作用、抗メタボリックシンドローム作用)を有することは知られていない。
【0008】
そこで、本発明は、副作用の恐れがなく、安全で、かつ、優れた脂肪蓄積抑制作用を有する「抗肥満剤」及び「当該抗肥満剤を含有し、優れた脂脂肪蓄積抑制作用を有する医薬品、食品又は化粧料」を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、脂肪蓄積抑制作用を有する化合物の検索を行った結果、白鶴霊芝草から得られたリナカンチンD及び後述する新規化合物Aに優れた脂肪蓄積抑制作用(前駆白色脂肪細胞の分化抑制作用)があることを見出し、本発明を完成するに至った。上記課題を解決するために、本発明は、下記の事項より構成される。
【0010】
[1]下記の式(1)で表されるリナカンチンDを含有する抗肥満剤。
【化1】

【0011】
[2]下記の式(2)で表される新規化合物(以下、当該新規化合物のことを新規化合物Aという。)を含有する抗肥満剤。
【化2】

【0012】
[3]脂肪蓄積抑制作用を有する上記[1]に記載の抗肥満剤。
【0013】
[4]脂肪蓄積抑制作用を有する上記[2]に記載の抗肥満剤。
【0014】
[5]上記[1]又は[3]に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【0015】
[6]上記[2]又は[4]に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【0016】
なお、上記[3]又は[4]に記載の抗肥満剤は、脂肪蓄積抑制剤と言うこともできる。
【発明の効果】
【0017】
本発明によれば、後述する試験例からも分かるように、「副作用の恐れがなく、安全で、かつ、優れた脂肪蓄積抑制作用を有する抗肥満剤」及び「当該抗肥満剤を含み、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料」を提供することができる。
【図面の簡単な説明】
【0018】
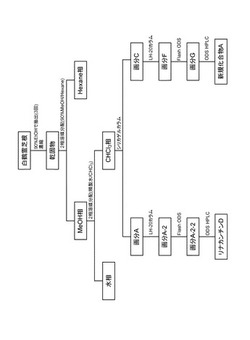
【図1】白鶴霊芝根からリナカンチンD及び新規化合物を分画・単離する際のフローチャートである。
【発明を実施するための形態】
【0019】
本発明で用いるリナカンチンD及び/又は新規化合物Aは、白鶴霊芝草を原料に抽出・精製工程により得ても良いし、その他の植物体から得ても良い。また、本発明においては、合成によって得たリナカンチンD及び/又は新規化合物Aを用いることもできる。また、白鶴霊芝草や、リナカンチンD及び/又は新規化合物Aを含有する植物体からの抽出物、粗精製物又は植物体の乾燥物や植物体のペーストを用いることもできる。
【0020】
白鶴霊芝草などの植物体から本発明に用いるリナカンチンD及び/又は新規化合物Aを抽出・精製する場合、通常工業的に用いるいずれの抽出・精製工程をも用いることができる。原料である植物の葉、茎、根、花等を、適当な時期に採取した後、そのまま、若しくは通常通風乾燥等の乾燥工程に付し、抽出原料とする。上記の乾燥した植物体からリナカンチンD及び新規化合物Aの抽出を行う場合は、公知の方法(例えば、「ファイトメディシン、第16巻、929〜934ページ、2009年」参照。)を参考にして行うことができる。
【0021】
すなわち、原料を粉砕若しくは細切した後、溶媒を用いて抽出を行う。抽出溶媒としては、水、エタノール、メタノール、イソプロピルアルコール等のアルコール類、アセトン、メチルエチルケトン等のケトン類、酢酸メチル、酢酸エチル等のエステル類、ヘキサン、クロロホルム等の親油性の溶媒を、単独若しくは混合溶媒として用いることができる。抽出温度は、通常0〜100℃、好ましくは5〜50℃である。抽出時間は、1時間〜10日間程度であり、溶媒量は、乾燥原料あたり通常1〜30倍重量、好ましくは5〜10倍重量である。抽出操作は、攪拌によっても浸漬放置によっても良い。抽出操作は、必要に応じて2〜3回繰り返しても良い。上記の操作で得られた粗抽出液から不溶性残渣を濾過若しくは遠心分離により取り除いた抽出液、あるいは植物の搾汁液からのリナカンチンD及び新規化合物Aの精製方法は、公知の生薬の分離精製方法であればどのようなものでも良いが、二相溶媒分配法、向流分配法、カラムクロマトグラフィー法、分取高速液体クロマトグラフィー法等を単独又は組み合わせて用いることが好ましい。例えば二相溶媒分配法としては、前記の抽出液からn−ヘキサン、クロロホルム、メチルエチルケトン、酢酸エチル、酢酸メチル等の溶媒と水との分配により、溶媒相へ目的化合物を回収する方法等があげられる。カラムクロマトグラフィー法としては、イオン交換カラムクロマトグラフィー法、担体として順相系、又は逆相系シリカゲルを用いる方法、ダイヤイオンHP−20等を用いる吸着カラムクロマトグラフィー法、担体としてセファデックスLH−20等の修飾デキストランゲルを用いるゲルろ過法等があげられ、これらを単独で若しくは組み合わせて、また、反復して使用することができる。分取高速液体クロマトグラフィー法としては、オクタデシルシリカ等を用いる逆相系のカラムを用いる方法、シリカゲル等を用いる順相系のカラムを用いる方法等があげられる。
【0022】
本発明の抗肥満剤の投与経路としては、特に限定されないが、例えば、経口投与・直腸内投与等の経腸投与、経鼻投与などの粘膜投与、静脈内投与・皮下投与などの注射投与等をあげることができる。本発明の抗肥満剤の剤型としては、いずれも投与方法に適した製剤の形態をとることができ、例えば錠剤、散剤、細粒剤、顆粒剤、カプセル剤、粉末、丸剤、トローチ剤等の固形剤、溶液、懸濁剤、乳剤、シロップ剤、注射剤などの液剤、ゲル状の製剤などが挙げられる。リナカンチンD及び/又は新規化合物Aの純品、精製物、粗精製物等をそのまま投与しても良いが、薬理的に許容される賦形剤とともに投与しても良い。賦形剤としては、単糖類、二糖類、多糖類、無機塩類、油脂、蒸留水など、製剤として一般に使用可能なものであればいずれも用いることができる。製剤化する際には、結合剤、滑沢剤、分散剤、懸濁剤、乳化剤、希釈剤、緩衝剤、抗酸化剤、細菌抑制剤等の添加剤を用いることもできる。
【0023】
リナカンチンD及び/又は新規化合物Aの有効投与量は、投与経路、剤形、疾患の症状、対象者の年齢等により異なるが、通常成人一日あたり0.1〜1000 mg、好ましくは0.5〜300 mg、さらに好ましくは1〜100 mgである。本発明の経口の抗肥満剤中のリナカンチンD及び/又は新規化合物Aの含有量は、製剤の形態・有効投与量・製剤としての投与量のデータに基づき、各投与形態に最適な製剤中の有効成分含有量を設定することができる。
【0024】
食品の形態としては、白鶴霊芝草や、リナカンチンD及び/又は新規化合物Aを含有する植物体の乾燥物のお茶としての形態や、リナカンチンD及び/又は新規化合物Aの純品、これら化合物の部分精製品、当該化合物を含有する植物からの当該化合物の粗抽出物、当該化合物を含有する植物体ペースト、当該化合物を含有する植物体乾燥物を配合した食品などがあげられる。
【0025】
お茶としては、単独又は他の茶原料と混合して用いても良い。他の茶原料としては、緑茶、ウーロン茶、プーアル茶、紅茶、ほうじ茶、玄米茶、杜仲茶、柿の葉茶、桑の葉茶など、通常お茶として食されるものであれば、どのようなものも用いることができる。
【0026】
植物抽出物を得る場合は、熱水による抽出、エタノールや含水エタノールによる抽出等、通常食品の抽出に用いられる方法であれば、いずれの方法も用いることができる。リナカンチンD及び/又は新規化合物Aの植物体からの粗抽出物や部分精製品は常法により得ることができる。
【0027】
本発明の脂肪蓄積抑制作用を有する食品の形態としては、お茶のほか、ドリンク剤、ゼリー、ビスケット、錠剤、丸剤、ソフトカプセル剤、ハードカプセル剤、散剤、細粒剤、顆粒剤等、通常食品として提供可能な形態であれば、いずれの形態も用いることができる。副原料として、賦形剤、結合剤、滑沢剤、分散剤、懸濁剤、乳化剤、希釈剤、緩衝剤、抗酸化剤、細菌抑制剤等の添加剤を用いることもできる。
【0028】
本発明の脂肪蓄積抑制作用を有する食品によるリナカンチンD及び/又は新規化合物Aの有効摂取量は、摂取形態、対象者の健康状態、対象者の年齢等により異なるが、通常成人1日あたり通常0.001〜100 mg、好ましくは0.01〜10 mg、さらに好ましくは0.1〜1 mgである。
【0029】
本発明の脂肪蓄積抑制作用を有する食品中のリナカンチンD及び/又は新規化合物Aの含有量は、食品の形態によって異なるが、通常0.0001〜1wt%、好ましくは0.001〜0.5wt%、より好ましくは、0.01〜0.1wt%である。
【0030】
本発明の外用医薬品又は化粧料の形態の例としては、特に限定されない。
【0031】
外用医薬品の形態としては、例えば、軟膏剤、クリーム剤、発布剤、テープ剤、外用剤等があげられる。本発明の医薬品は、リナカンチンD及び/又は新規化合物Aに、必要に応じてその他の医薬成分を含有することができ、また、結合剤、分散剤、懸濁剤、乳化剤、希釈剤、緩衝剤、抗酸化剤、細菌抑制剤等の添加剤を用いても良い。
【0032】
化粧料の形態としては、化粧水、美容液、乳液、クリーム、ジェル、パック、美容パウダー、洗顔フォーム、浴用剤等、外用剤・化粧料製剤として使用可能ないずれの形態も用いることができる。上記化粧料製剤には、リナカンチンD及び/又は新規化合物A純品、該化合物の部分精製品、植物からの該化合物の粗抽出物、又は該化合物を含有する植物体等の必須成分に加え、必要に応じて化粧料製剤に配合される成分を含有しても良い。配合成分としては、例えば、固形油、半固形油、液体油、低分子保湿剤、高分子保湿剤、脂溶性保湿剤、エモリエント剤、界面活性剤、防腐剤、酸化防止剤、pH調整剤、エタノール、水等をあげることができる。
【0033】
リナカンチンD及び/又は新規化合物Aの外用での有効投与量は、対象者の症状、対象者の年齢等により異なるが、通常成人一日あたり0.001〜100 mg、好ましくは0.01〜10 mg、さらに好ましくは0.1〜1 mgである。
【0034】
本発明の脂肪蓄積抑制作用を有する医薬品又は化粧料中のリナカンチンD及び/又は新規化合物Aの含有量は、単独又は混合物として通常0.0001〜1wt%、好ましくは0.001〜0.5wt%、より好ましくは、0.01〜0.1wt%である。
【0035】
以下、リナカンチンD及び新規化合物A並びに比較例としてのリナカンチンCの分画・単離例、脂肪蓄積抑制作用の試験例、毒性の試験例及び実施例を挙げ、本発明をさらに詳しく説明するが、本発明はこれらになんら制約されるものではない。
【0036】
1.リナカンチンD及び新規化合物A並びにリナカンチンCの分画・単離例
1−1.リナカンチンD
(1)リナカンチンDの分画・単離
リナカンチンDの分画・単離は、図1に示すフローに従って行った。すなわち、白鶴霊芝(Rhinacanthus nasutus (L.) Kurz)乾燥根(5 Kg)を25 Lの90%(v/v) エタノールを用いて室温にて計3回各24時間抽出を行い、これらを合わせて濃縮し乾固物(407 g)を得た。
次に、これを7 Lの90%(v/v) メタノールへ懸濁溶解後、等量のヘキサンで3回分配後、90%(v/v) メタノール相をとり減圧濃縮した。この減圧濃縮物に精製水を加え5Lへフィルアップ、分液漏斗に移し、5 Lのクロロホルムにて3回2相溶媒分配を行った。次に、この操作により得たクロロホルム相を合わせ乾固物69.3 gを得た。
【0037】
このうち69.0gをヘキサン/酢酸エチルを溶出溶媒とするシリカゲルカラムクロマトグラフィー(80mmφ × 150 mm、関東化学株式会社製)に付した。すなわち、3ベッドボリューム(BV)の溶出溶媒ヘキサン/酢酸エチル(9:1)によりシリカゲルカラムを洗浄後、1 BVの溶出溶媒ヘキサン/酢酸エチル(8:2)により溶出し画分A(乾固物 4.71 g)を得た。
【0038】
次に、画分Aについてメタノールを溶出溶媒とするセファデックスLH-20カラムクロマトグラフィー(20 mmφ × 200 mm、ファルマシア社製)に付した。すなわち、1.5 BVのメタノールにてセファデックスLH-20カラムを洗浄後、0.5 BVのメタノールにて溶出し画分A−2(1.34g)を得た。
さらに、画分A−2を水/メタノールを溶出溶媒とするフラッシュODSカラムクロマトグラフィー(20mm φ × 150 mm、和光純薬社製)により分画した。すなわち、180 mlの50%(v/v) メタノールにてフラッシュODSカラムを洗浄後、ステップワイズにて順次60%(v/v) メタノール、70%(v/v) メタノールにて溶出、80%(v/v) メタノールにて溶出し、目的化合物を含有する画分 A−2−2(乾固物 407 mg)を得た。
さらに、画分 A−2−2(乾固物 407 mg)を分取高速液体クロマトグラフィー(ODSカラム、20 mmφ × 250 mm、野村化学社製、移動相: 72%(v/v) アセトニトリル/水/0.1%(v/v) 蟻酸、検出: 254 nm UVモニター)にて精製し、リナカンチンD(rhinacanthin D)(乾固物18.8 mg)を得た。
【0039】
上記方法により分画・単離されたリナカンチンDについて、核磁気共鳴スペクトル法により1H NMRスペクトルデータを取得したところ、以下のピークが観測され、文献(ジャーナル オブ ナチュラル プロダクト (Journal of Natural Products) 第59巻、808〜811ページ,1996年)の値と略一致した。
【0040】
δ 1.06 (H-,6H,s)、2.74 (H-,2H, s)、4.03 (H-,2H,s)、5.97 (H-,2H,s)、6.70 (H-,1H,d)、7.38 (H-,1H,s)、7.56 (H-,1H,d)、7.63 (H-,1H,t)、7.67 (H-,1H,t)、8.02 (H-,2H,d).
【0041】
なお、上記において、高速液体クロマトグラフィーは、Waters 515システム及びWaters600システム(ともに日本ウォーターズ株式会社製)を用いた。また、シリカゲルカラムクロマトグラフィー、セファデックスLH-20カラムクロマトグラフィー及びフラッシュODSクロマトグラフィーは、汎用の実験器具及び実験装置を用いた。
【0042】
1−2.新規化合物A
(1)新規化合物Aの分画・単離
新規化合物Aの分画・単離は、図1に示すフローに従って行った。すなわち、白鶴霊芝(Rhinacanthus nasutus (L.) Kurz)乾燥根(5 Kg)を25 Lの90%(v/v) エタノールを用いて室温にて計3回各24時間抽出を行い、これらを合わせて濃縮し乾固物(407 g)を得た。
次に、これを7 Lの90%(v/v) メタノールへ懸濁溶解後、等量のヘキサンで3回分配後、90%(v/v) メタノール相をとり減圧濃縮した。この減圧濃縮物に精製水を加え5 Lへフィルアップ、分液漏斗に移しクロロホルムにて3回2相溶媒分配を行った。次に、この操作により得たクロロホルム相を合わせ乾固物69.3 gを得た。
【0043】
このうち69.0 gをヘキサン/酢酸エチルを溶出溶媒とするシリカゲルカラムクロマトグラフィー(80 mmφ × 150 mm、関東化学株式会社製)に付した。すなわち、3 BVの溶出溶媒ヘキサン/酢酸エチル(9:1)、2 BVの溶出溶媒ヘキサン/酢酸エチル(8:2)、及び2 BVの溶出溶媒ヘキサン/酢酸エチル(7:3)によりシリカゲルカラムを順次洗浄後、2 BVの溶出溶媒ヘキサン/酢酸エチル(6:4)により溶出し画分C(乾固物3.73 g)を得た。
【0044】
次に、画分Cについてメタノールを溶出溶媒とするセファデックスLH-20カラムクロマトグラフィー(20 mmφ × 200 mm、ファルマシア社製)を行った。すなわち、2 BVのメタノールでカラムを洗浄後、1 BVのメタノールにて溶出し画分 F (乾固物 369 mg)を得た。
さらに、画分 F(乾固物 369 mg)を水/メタノールを溶出溶媒とするフラッシュODSカラムクロマトグラフィー(20 mmφ × 150 mm、野村化学社製)に付した。すなわち、180 mlの50%(v/v) メタノールにてフラッシュODSカラムを洗浄後、ステップワイズにて順次60%(v/v) メタノール、70%(v/v) メタノールにて洗浄後、80%(v/v) メタノールにて溶出し、目的化合物を含有する画分G(乾固物 75.6 mg)を得た。
さらに画分G(乾固物 75.6 mg)を分取高速液体クロマトグラフィー(ODSカラム、20 mmφ × 250 mm、野村化学社製、移動相:45%(v/v) アセトニトリル、検出: 254 nm UVモニター)にて精製し、新規化合物Aの乾固物(9.8 mg)を得た。
【0045】
(2)新規化合物Aの構造解析
新規化合物Aの構造解析は、高分解能質量分析法(HRFABMS)及び核磁気共鳴スペクトル法(1H NMR、13C NMR)を用いて行った。以下にその結果を示す。
【0046】
(2−1)高分解能質量分析法(HRFABMS)による結果
高分解能質量分析法(HRFABMS)においては、「m/z 272.1039 [M]+ (calcd. 272.1049 Δ 0.9 mmu).」が観測され、分子式が「C16H16O4」であることが分かった。なお、低分解能質量分析法(LRFABMS)においては、「m/z 272.」が観測された。
【0047】
(2−2)核磁気共鳴スペクトル法(1H NMR)による結果
核磁気共鳴スペクトル法(1H NMR)においては、以下のピークが観測された。
「1H NMR (CDCl3, 500 MHz):δ 3.69 (H-14, J = 11.2 Hz, 1H, d)、3.75 (H-14, J = 11.2 Hz, 1H, d)、3.95 (8-OMe, 3H, s)、4.22 (H-2, J = 11.7 Hz, 1H, d)、4.31 (H-2, J = 11.7 Hz, 1H, d)、5.93 (H-4, J = 11.7 Hz, 1H, d)、6.43 (H-5, J = 11.7 Hz, 1H,d)、6.51(H-7, 1H, s)、7.47 (H-10, J = 1.5, 6.7, 7.5 Hz, 1H, m)、7.50 (H-11, J =1.5, 6.7, 7.5 Hz, 1H, m)、8.14 (H-9, J = 1.5, 7.5 Hz, 1H, d)、8.24 (H-12, J = 1.5, 7.5 Hz, 1H, d).」
【0048】
(2−3)核磁気共鳴スペクトル法(13C NMR)による結果
核磁気共鳴スペクトル法(13C NMR)においては、以下のピークが観測された。
「13C NMR (CDCl3, 125 MHz):δ 55.7 (8-OMe)、65.9 (C-14)、74.4 (C-2)、74.9 (C-3)、106.8 (C-7)、119.1 (C-6)、121.6 (C-9)、122.7 (C-12)、126.0 (C-12a)、126.3 (C-10)、126.7 (C-11)、127.6 (C-8a)、130.1 (C-5)、132.1 (C-4)、148.9 (C-13)、150.6 (C-8).」
【0049】
なお、上記において、高分解能質量分析装置としては、JEOL JMS SX-102型質量分析装置(日本電子株式会社製)を用いた。また、核磁気共鳴スペクトル装置(1H NMR及び13C NMR)としては、JEOL JNM-GSX500型核磁気共鳴スペクトル装置(日本電子株式会社製)を用いた。
【0050】
以上の結果並びにHMQCスペクトル及びHMBCスペクトルから、新規化合物Aが、上記の式(2)で表される新規化合物であることが分かった。
【0051】
2.脂肪蓄積抑制作用の試験例
脂肪蓄積抑制作用の試験は、SDラット由来前駆白色脂肪細胞に対する脂肪蓄積抑制活性の測定をすることにより行った。
【0052】
(1)試験方法
SDラット由来前駆白色脂肪細胞(タカラバイオ社より購入)を、1回継代培養後、液体窒素容器で凍結保存し、以降の実験に供した。この凍結細胞を37℃の温水で常法に従い融解し、1×105 cells/mlの細胞濃度で基本培地[高グルコースDMEM培地(Lonza社製)にアスコルビン酸、ビオチン、パントテン酸、トリヨードチロニン、オクタン酸、牛胎児血清、ペニシリン(50 U/ml)、ストレプトマイシン(50 μg/ml)を添加]に懸濁、24穴培養プレート(1 cm2/ウェル、NUNC)に1 mlずつ播種、37℃、5%炭酸ガス存在下培養した。90%〜95%コンフルエントまで細胞が増殖した時点で基本培地を吸引除去し、分化培地[基本培地にインシュリン(10 μg/ml)、デキサメタゾン(2.5 μM)、3-イソブチル-1-メチルキサンチン(0.5 mM)を添加]を加え、さらに48時間、37℃、5%炭酸ガス存在下培養を続けた。分化培地での培養48時間後に分化培地を吸引除去し、カルシウム・マグネシウムフリーPBS(Dulbecco’s Phosphate-Buffered Saline)溶液(以下PBS)で2回洗浄後、リナカンチンD又は新規化合物A(いずれもDMSOへ溶解、培地中の最終DMSO濃度 = 0.2%(v/v); なお、DMSOのみを1/500体積量加えた培地で培養したものを対照群とした。)を含有する維持培地[基本培地に10 μg/mlインシュリンを添加]を加え、さらに6日間、37℃、5%炭酸ガス存在下培養した。
【0053】
培養6日後に培地を吸引除去し、PBSで2回洗浄、マイルドホルム(和光純薬工業社製)を1ウェルあたり200 μl添加し、4℃で2時間静置により細胞を固定した。次に、マイルドホルムを吸引除去し、60%(v/v) イソプロピルアルコールで1回洗浄した。この後、調製したオイルレッド O試薬[オイルレッド Oをイソプロピルアルコールへ0.5%(w/v)濃度で溶解したストック溶液に、2/3量の超純水を用事添加し15分間室温で放置後、メンブランフィルター(0.45 μm)でろ過して調製]を1ウェルあたり100 μlずつ添加し、室温下で15分間静置した。15分間静置後、60%(v/v) イソプロピルアルコールで2回洗浄を行い、培養基を乾燥させてから、1ウェルあたり100 μlのイソプロピルアルコールを加えて振盪、オイルレッド O色素を溶出させた。80 μlの色素溶出液を96穴マイクロプレートに回収し、イムノリーダー(大日本製薬株式会社製)を用いて540 nmにおける吸光度を測定した。吸光度から、中性脂肪の相対蓄積値を算出した。
【0054】
(2)試験結果
リナカンチンD及び新規化合物Aの「前駆白色脂肪細胞の中性脂肪蓄積値」の相対値を表1に示す。
【0055】
[表1]
前駆白色脂肪細胞の中性脂肪蓄積値
試験区 濃度 中性脂肪蓄積値(相対値)
無添加コントロール 100%
リナカンチンD 10μg/ml 20%
新規化合物A 10μg/ml 32%
【0056】
表1に示すように、リナカンチンD及新規化合物Aが、10μg/mlという比較的低濃度で優れた脂肪蓄積抑制作用(前駆白色脂肪細胞に対する優れた中性脂肪蓄積抑制活性)を示すことが確認できた。
【0057】
3.毒性試験例
毒性試験は、SDラット由来前駆白色脂肪細胞に対する増殖抑制活性の測定をすることにより行った。
【0058】
(1)試験方法
SDラット由来前駆白色脂肪細胞(タカラバイオ社より購入)を、1回継代培養後、液体窒素容器で凍結保存し、以降の実験に供した。この凍結細胞を37℃の温水で常法に従い融解し、基本培地[高グルコースDMEM培地(Lonza社製)にアスコルビン酸、ビオチン、パントテン酸、トリヨードチロニン、オクタン酸、牛胎児血清、ペニシリン(50 U/ml)、ストレプトマイシン(50 μg/ml)を添加]を用い、1×104 cells/100 μlの細胞濃度で96穴培養プレート(NUNC)に播種し、37℃、5%炭酸ガス存在下、48時間培養を行った。培養48時間後に、リナカンチンD又は新規化合物A(いずれもDMSOへ溶解、培地中の最終DMSO濃度 = 0.1%(v/v); なお、DMSOのみを1/1000体積量加えた培地で培養したものを対照群とした)を加え、さらに、37℃、5%炭酸ガス存在下、48時間培養した。
【0059】
細胞増殖度の測定は、MTT[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide、ナカライテスク]を用いた方法で行った[株式会社東京化学同人発行、新生化学実験講座12 分子免疫学I 免疫細胞・サイトカイン 358-359ページ]。すなわち、毒性試験対象の各化合物を加え48時間培養後、培地交換を行い96穴培養プレート(0.33 cm2/ウェル)の各ウェルの培養液90 μlに対し10 μlのMTT溶液[5 mg/ml; カルシウム・マグネシウムフリーPBS(Dulbecco’s Phosphate-Buffered Saline)溶液へ溶解後、メンブランフィルター(0.22 μm)でろ過]を加え、振盪して均一にし、37℃、5%炭酸ガス存在下で4時間培養した。培養4時間後に各々のウェルに10%(w/v) SDS−50%(v/v) N , N-Dimethylformamide−0.005N 塩酸溶液100 μl を加え、18時間、37℃、5%炭酸ガス存在下静置した後、イムノリーダー(大日本製薬株式会社製)を用いて、750 nmを対照とし、590 nmにおける吸光度を測定、生存率の指標とした。
【0060】
(2)試験結果
リナカンチンD及び新規化合物Aの「前駆白色脂肪細胞の生存率」を表2に示す。
【0061】
[表2]
前駆白色脂肪細胞の増殖抑制活性
試験区 濃度 生存率
無添加コントロール 100%
リナカンチンD 10μg/ml 88%
新規化合物A 10μg/ml 100%
【0062】
表2に示すように、リナカンチンD及新規化合物Aが、低い毒性(前駆白色脂肪細胞に対する低い増殖抑制活性)を示すことが確認できた。
【実施例】
【0063】
実施例1.錠剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で錠剤(1錠あたり500mg)を作製する。
リナカンチンD 1mg
乳糖 479mg
乾燥コーンスターチ 10mg
タルク 9mg
ステアリン酸カルシウム 1mg
【0064】
(調製法)
乳糖(95.8g)に、リナカンチンD(0.2g)、乾燥コーンスターチ(2g)、タルク(1.8g)、ステアリン酸カルシウム(0.2g)を添加して混合する。次いで、単発式打錠機を用いて常法により錠剤を作製する。
【0065】
実施例2.ハードカプセル剤の作製
上記の「1−2.新規化合物A (1)新規化合物Aの分画・単離」に記載した方法に従って分画・単離された新規化合物Aを用いて、次の処方でハードカプセル剤(1カプセルあたり360mg)を作製する。
新規化合物A 5mg
乳糖 220mg
コーンスターチ 110mg
ヒドロキシプロピルセルロース 25mg
【0066】
(調製法)
新規化合物A(5g)に、乳糖(220g)及びコーンスターチ(110g)を添加して混合し、これにヒドロキシプロピルセルロース(25g)の水溶液を添加して練合する。次いで、押し出し造粒機を用いて、常法により顆粒を製造する。この顆粒をゼラチンハードカプセルに充填することにより、ハードカプセル剤を作製する。
【0067】
実施例3.ソフトカプセル剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方でソフトカプセル剤(1カプセルあたり170mg)を作製する。
リナカンチンD 0.5mg
大豆油 169.5mg
【0068】
(調製法)
大豆油(169.5g)に、リナカンチンD(0.5g)を添加して混合する。次いで、ロータリー・ダイズ式自動成型機を用いて、常法に従い、ソフトカプセルに充填することにより、ソフトカプセル剤を作製する。
【0069】
実施例4.丸剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で丸剤(1粒あたり100mg)を作製する。
リナカンチンD 0.5mg
モロヘイヤ末 20.0mg
デンプン 30.0mg
糖蜜 20.0mg
茶抽出物 15.0mg
大豆ファイバー 14.0mg
セラック 0.5mg
【0070】
(調製法)
上記配合で原料を混合し、適量加水後、練合機で均質な練合物を製造し、得られた練合物を圧延し製丸機を用いて製丸後乾燥して丸剤を作製する。
【0071】
実施例5.散剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で常法により散剤(1包あたり1000mg)を作製する。
リナカンチンD 1mg
乳糖 799mg
コーンスターチ 200mg
【0072】
実施例6.ゼリーの作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で、常法によりゼリー(100g)を作製する。
リナカンチンD 0.002g
ゼラチン 2.0g
オレンジ果汁 20.0g
水 77.998g
【0073】
(調製法)
上記成分を混合し、90℃へ加熱する。ゼラチンの溶解を確認してから容器に充填し、冷却する。ゼラチンを固化することでゼリーを作製する。
【0074】
実施例7.軟膏の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で、常法により軟膏(100g)を作製する。
(油相成分)
リナカンチンD 0.1g
白色ワセリン 20.0g
ミネラルオイル 20.0g
ステアリルアルコール 5.0g
ステアレス−2 3.0g
プロピルパラベン 0.1g
天然ビタミンE 0.1g
(水相成分)
1,3−ブチレングリコール 5.0g
フェノキシエタノール 0.4g
ポリソルベート 60 4.5g
精製水 適量
全量 100g
【0075】
(調製法)
油相成分及び水相成分をそれぞれ80℃に熱して均一にし、水相を油相に攪拌しながら加え、乳化後冷却し軟膏を作製した。
【0076】
実施例8.テープ剤の作製
上記の「1−2.新規化合物A (1)新規化合物Aの分画・単離」に記載した方法に従って分画・単離された新規化合物Aを用いて、次の処方で、常法によりテープ剤(100g)を作製する。
(粘着剤溶剤)
スチレン−イソプロピレン−スチレンブロック共重合体 7.0g
ピコライト 25.0g
イソプロピレンゴム 5.0g
トルエン 15.0g
酢酸エチル 14.2g
ヘキサン 25.0g
(薬効成分)
新規化合物A 0.1g
エタノール 5.0g
(経皮吸収促進剤)
オレイルアルコール 0.8g
全量 100g
【0077】
(調製法)
粘着剤溶剤及び薬効成分をそれぞれ均一にし、薬効成分及び経皮吸収促進剤を粘着剤溶剤に加え、室温で攪拌し組成物を作製した。この組成物をシリコーン処理したポリエステルフィルム上に延展し、120℃で乾燥させ冷却後、ポリエチレンフィルムへ粘着剤層を転写させ、テープ剤を作製する。
【0078】
実施例9.痩身用ローションの調製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で、常法により痩身用ローション(100g)を作製する。
(油相成分)
リナカンチンD 0.1g
ポリオキシエチレン(60モル)硬化ヒマシ油 2.0g
1,3−ブチレングリコール 5.0g
(水相成分)
グリセリン 5.0g
フェノキシエタノール 0.3g
クエン酸 0.1g
クエン酸ナトリウム 0.2g
エタノール 8.0g
精製水 適量
全量 100g
【0079】
(調製法)
油相成分及び水相成分をそれぞれ均一に溶解し、油相を水相に攪拌しながら加え、痩身用ローションを作製する。
【0080】
実施例10.痩身用マッサージジェルの作製
上記の「1−2.新規化合物A (1)新規化合物Aの分画・単離」に記載した方法に従って分画・単離された新規化合物Aを用いて、次の処方で、常法により痩身用マッサージジェル(100g)を作製する。
(油相成分)
新規化合物A 0.1g
マイクロクリスタリンワックス 11.0g
白色ワセリン 8.0g
ホホバ油 5.0g
イソステアリンポリグリセリル−2 1.0g
天然ビタミンE 0.05g
プロピルパラベン 0.1g
(水相成分)
ジプロピレングリコール 5.0g
グリセリン 7.0g
ポリオキシエチレン(60モル)硬化ヒマシ油 3.0g
フェノキシエタノール 0.3g
精製水 適量
全量 100g
【0081】
(調製法)
油相成分及び水相成分をそれぞれ80℃に熱して均一にし、水相を油相に攪拌しながら加え、乳化後冷却し痩身用マッサージジェルを作製する。
【技術分野】
【0001】
本発明は、抗肥満剤及び脂脂肪蓄積抑制作用を有する医薬品、食品又は化粧料に関する。
【背景技術】
【0002】
近年、食生活の欧米化やライフスタイルの変化に伴い、肥満の割合が増加している。飲食物により摂取されるエネルギー量が、運動などにより消費されるエネルギー量を上回ることで発生する過剰なエネルギーが脂肪として体内に蓄積し、この状態が持続することにより肥満となる。肥満は、高血圧、糖尿病、動脈硬化などの生活習慣病の発症との関連性が高く、これら疾患の発症の予防と治療の観点からも肥満の予防又は解消が極めて重要となってきている。また、医学的な観点だけではなく美容的な観点からも肥満の予防又は解消が極めて重要となってきている。このような社会的背景において、様々な作用様式の抗肥満剤や抗肥満作用を有する医薬品、食品又は化粧料が知られている。
【0003】
脂肪の分解促進のメカニズムに関連するものとして、リパーゼ活性化作用を呈するアントラキノン誘導体(例えば、特許文献1参照。)及び脂肪分解作用を有するイソキノリンアルカロイド誘導体(例えば、特許文献2参照。)が知られている。また、リパーゼ阻害作用を有し遊離脂肪酸産生抑制効果に基づくものとして、マテチャ含有サポニン化合物を有効成分とする抗肥満剤(例えば、特許文献3参照。)が知られている。中性脂肪低下及びコレステロール低下作用に起因するものとして、シクロアルタン型トリテルペン又はその配糖体を含有することを特徴とする血中中性脂肪低下剤(例えば、特許文献4参照。)が知られている。脂肪細胞特異的作用メカニズムに基づくものとしては、内分泌因子アディポネクチンへの作用を介するものとして、シアニジン化合物を有効成分とするアディポネクチン発現促進剤(例えば、特許文献5参照。)及びシアニジン3−グルコシドを有効成分とする抗肥満剤(例えば、特許文献6参照。)が知られている。脂肪細胞数の増加を抑制し抗肥満効果を有するものとして、カミツレに含まれるビサボロールオキサイド-A-β-グルコシド(Bisabolol oxide-A-β-glucoside)を含有する脂肪蓄積抑制剤(例えば、特許文献7参照。)が知られている。脂肪蓄積抑制及び脂肪細胞への分化抑制作用に基づくものとして、アルクチイン及び/又はアルクチゲニンを含有する脂肪代謝改善組成物(例えば、特許文献8参照。)が知られている。また、脂肪細胞への分化抑制作用に基づく脂肪蓄積抑制作用を有する外用剤として、ω-3系高度不飽和脂肪酸を有効成分として含有する脂肪蓄積抑制剤(例えば、特許文献9参照。)が知られている。
【0004】
一方、本発明の「リナカンチンD」を含有するとともに、本発明により「後述する新規化合物A」を含有することが明らかとなった白鶴霊芝(以下、白鶴霊芝草というこよもある。Rhinacanthus nasutus (L.) Kurz)は、インド南部デカン高原の原産とされるリナカンサス属キツネノマゴ科に属する常緑小低木であり、その全草は駆虫、消炎、皮膚真菌に対する抗菌作用のあることが知られ(例えば、非特許文献1参照。)、主に中国、台湾等において、また、最近では日本国において漢方薬として用いられている。その他、本出願人による以前の出願で、白鶴霊芝に活性酸素消去能があること(例えば、特許文献10参照。)、排泄促進作用があること(例えば、特許文献11参照。)、抗アレルギー作用があること(例えば、特許文献12参照。)及び抗腫瘍作用があること(例えば、特許文献13参照。)が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−347952号公報
【特許文献2】特開2008−308446号公報
【特許文献3】特開2009−196902号公報
【特許文献4】特開2006−290882号公報
【特許文献5】国際公開第WO2004/078741号パンフレット
【特許文献6】特開2003−252766号公報
【特許文献7】特開2006−213648号公報
【特許文献8】特開2008−297209号公報
【特許文献9】特許第3607062号公報
【特許文献10】特開平9−143091号公報
【特許文献11】特開平9−169662号公報
【特許文献12】特開2001−10964号公報
【特許文献13】特開2002−53481号公報
【非特許文献】
【0006】
【非特許文献1】原色牧野和漢薬草大図鑑、492頁、北隆館、1988年
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、白鶴霊芝草植物本体、白鶴霊芝草抽出物又は白鶴霊芝草植物本体若しくは白鶴霊芝草抽出物に含まれる「リナカンチンD」若しくは「後述する新規化合物A」が脂肪蓄積抑制作用(脂肪細胞分化抑制作用、抗メタボリックシンドローム作用)を有することは知られていない。
【0008】
そこで、本発明は、副作用の恐れがなく、安全で、かつ、優れた脂肪蓄積抑制作用を有する「抗肥満剤」及び「当該抗肥満剤を含有し、優れた脂脂肪蓄積抑制作用を有する医薬品、食品又は化粧料」を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、脂肪蓄積抑制作用を有する化合物の検索を行った結果、白鶴霊芝草から得られたリナカンチンD及び後述する新規化合物Aに優れた脂肪蓄積抑制作用(前駆白色脂肪細胞の分化抑制作用)があることを見出し、本発明を完成するに至った。上記課題を解決するために、本発明は、下記の事項より構成される。
【0010】
[1]下記の式(1)で表されるリナカンチンDを含有する抗肥満剤。
【化1】

【0011】
[2]下記の式(2)で表される新規化合物(以下、当該新規化合物のことを新規化合物Aという。)を含有する抗肥満剤。
【化2】

【0012】
[3]脂肪蓄積抑制作用を有する上記[1]に記載の抗肥満剤。
【0013】
[4]脂肪蓄積抑制作用を有する上記[2]に記載の抗肥満剤。
【0014】
[5]上記[1]又は[3]に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【0015】
[6]上記[2]又は[4]に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【0016】
なお、上記[3]又は[4]に記載の抗肥満剤は、脂肪蓄積抑制剤と言うこともできる。
【発明の効果】
【0017】
本発明によれば、後述する試験例からも分かるように、「副作用の恐れがなく、安全で、かつ、優れた脂肪蓄積抑制作用を有する抗肥満剤」及び「当該抗肥満剤を含み、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料」を提供することができる。
【図面の簡単な説明】
【0018】
【図1】白鶴霊芝根からリナカンチンD及び新規化合物を分画・単離する際のフローチャートである。
【発明を実施するための形態】
【0019】
本発明で用いるリナカンチンD及び/又は新規化合物Aは、白鶴霊芝草を原料に抽出・精製工程により得ても良いし、その他の植物体から得ても良い。また、本発明においては、合成によって得たリナカンチンD及び/又は新規化合物Aを用いることもできる。また、白鶴霊芝草や、リナカンチンD及び/又は新規化合物Aを含有する植物体からの抽出物、粗精製物又は植物体の乾燥物や植物体のペーストを用いることもできる。
【0020】
白鶴霊芝草などの植物体から本発明に用いるリナカンチンD及び/又は新規化合物Aを抽出・精製する場合、通常工業的に用いるいずれの抽出・精製工程をも用いることができる。原料である植物の葉、茎、根、花等を、適当な時期に採取した後、そのまま、若しくは通常通風乾燥等の乾燥工程に付し、抽出原料とする。上記の乾燥した植物体からリナカンチンD及び新規化合物Aの抽出を行う場合は、公知の方法(例えば、「ファイトメディシン、第16巻、929〜934ページ、2009年」参照。)を参考にして行うことができる。
【0021】
すなわち、原料を粉砕若しくは細切した後、溶媒を用いて抽出を行う。抽出溶媒としては、水、エタノール、メタノール、イソプロピルアルコール等のアルコール類、アセトン、メチルエチルケトン等のケトン類、酢酸メチル、酢酸エチル等のエステル類、ヘキサン、クロロホルム等の親油性の溶媒を、単独若しくは混合溶媒として用いることができる。抽出温度は、通常0〜100℃、好ましくは5〜50℃である。抽出時間は、1時間〜10日間程度であり、溶媒量は、乾燥原料あたり通常1〜30倍重量、好ましくは5〜10倍重量である。抽出操作は、攪拌によっても浸漬放置によっても良い。抽出操作は、必要に応じて2〜3回繰り返しても良い。上記の操作で得られた粗抽出液から不溶性残渣を濾過若しくは遠心分離により取り除いた抽出液、あるいは植物の搾汁液からのリナカンチンD及び新規化合物Aの精製方法は、公知の生薬の分離精製方法であればどのようなものでも良いが、二相溶媒分配法、向流分配法、カラムクロマトグラフィー法、分取高速液体クロマトグラフィー法等を単独又は組み合わせて用いることが好ましい。例えば二相溶媒分配法としては、前記の抽出液からn−ヘキサン、クロロホルム、メチルエチルケトン、酢酸エチル、酢酸メチル等の溶媒と水との分配により、溶媒相へ目的化合物を回収する方法等があげられる。カラムクロマトグラフィー法としては、イオン交換カラムクロマトグラフィー法、担体として順相系、又は逆相系シリカゲルを用いる方法、ダイヤイオンHP−20等を用いる吸着カラムクロマトグラフィー法、担体としてセファデックスLH−20等の修飾デキストランゲルを用いるゲルろ過法等があげられ、これらを単独で若しくは組み合わせて、また、反復して使用することができる。分取高速液体クロマトグラフィー法としては、オクタデシルシリカ等を用いる逆相系のカラムを用いる方法、シリカゲル等を用いる順相系のカラムを用いる方法等があげられる。
【0022】
本発明の抗肥満剤の投与経路としては、特に限定されないが、例えば、経口投与・直腸内投与等の経腸投与、経鼻投与などの粘膜投与、静脈内投与・皮下投与などの注射投与等をあげることができる。本発明の抗肥満剤の剤型としては、いずれも投与方法に適した製剤の形態をとることができ、例えば錠剤、散剤、細粒剤、顆粒剤、カプセル剤、粉末、丸剤、トローチ剤等の固形剤、溶液、懸濁剤、乳剤、シロップ剤、注射剤などの液剤、ゲル状の製剤などが挙げられる。リナカンチンD及び/又は新規化合物Aの純品、精製物、粗精製物等をそのまま投与しても良いが、薬理的に許容される賦形剤とともに投与しても良い。賦形剤としては、単糖類、二糖類、多糖類、無機塩類、油脂、蒸留水など、製剤として一般に使用可能なものであればいずれも用いることができる。製剤化する際には、結合剤、滑沢剤、分散剤、懸濁剤、乳化剤、希釈剤、緩衝剤、抗酸化剤、細菌抑制剤等の添加剤を用いることもできる。
【0023】
リナカンチンD及び/又は新規化合物Aの有効投与量は、投与経路、剤形、疾患の症状、対象者の年齢等により異なるが、通常成人一日あたり0.1〜1000 mg、好ましくは0.5〜300 mg、さらに好ましくは1〜100 mgである。本発明の経口の抗肥満剤中のリナカンチンD及び/又は新規化合物Aの含有量は、製剤の形態・有効投与量・製剤としての投与量のデータに基づき、各投与形態に最適な製剤中の有効成分含有量を設定することができる。
【0024】
食品の形態としては、白鶴霊芝草や、リナカンチンD及び/又は新規化合物Aを含有する植物体の乾燥物のお茶としての形態や、リナカンチンD及び/又は新規化合物Aの純品、これら化合物の部分精製品、当該化合物を含有する植物からの当該化合物の粗抽出物、当該化合物を含有する植物体ペースト、当該化合物を含有する植物体乾燥物を配合した食品などがあげられる。
【0025】
お茶としては、単独又は他の茶原料と混合して用いても良い。他の茶原料としては、緑茶、ウーロン茶、プーアル茶、紅茶、ほうじ茶、玄米茶、杜仲茶、柿の葉茶、桑の葉茶など、通常お茶として食されるものであれば、どのようなものも用いることができる。
【0026】
植物抽出物を得る場合は、熱水による抽出、エタノールや含水エタノールによる抽出等、通常食品の抽出に用いられる方法であれば、いずれの方法も用いることができる。リナカンチンD及び/又は新規化合物Aの植物体からの粗抽出物や部分精製品は常法により得ることができる。
【0027】
本発明の脂肪蓄積抑制作用を有する食品の形態としては、お茶のほか、ドリンク剤、ゼリー、ビスケット、錠剤、丸剤、ソフトカプセル剤、ハードカプセル剤、散剤、細粒剤、顆粒剤等、通常食品として提供可能な形態であれば、いずれの形態も用いることができる。副原料として、賦形剤、結合剤、滑沢剤、分散剤、懸濁剤、乳化剤、希釈剤、緩衝剤、抗酸化剤、細菌抑制剤等の添加剤を用いることもできる。
【0028】
本発明の脂肪蓄積抑制作用を有する食品によるリナカンチンD及び/又は新規化合物Aの有効摂取量は、摂取形態、対象者の健康状態、対象者の年齢等により異なるが、通常成人1日あたり通常0.001〜100 mg、好ましくは0.01〜10 mg、さらに好ましくは0.1〜1 mgである。
【0029】
本発明の脂肪蓄積抑制作用を有する食品中のリナカンチンD及び/又は新規化合物Aの含有量は、食品の形態によって異なるが、通常0.0001〜1wt%、好ましくは0.001〜0.5wt%、より好ましくは、0.01〜0.1wt%である。
【0030】
本発明の外用医薬品又は化粧料の形態の例としては、特に限定されない。
【0031】
外用医薬品の形態としては、例えば、軟膏剤、クリーム剤、発布剤、テープ剤、外用剤等があげられる。本発明の医薬品は、リナカンチンD及び/又は新規化合物Aに、必要に応じてその他の医薬成分を含有することができ、また、結合剤、分散剤、懸濁剤、乳化剤、希釈剤、緩衝剤、抗酸化剤、細菌抑制剤等の添加剤を用いても良い。
【0032】
化粧料の形態としては、化粧水、美容液、乳液、クリーム、ジェル、パック、美容パウダー、洗顔フォーム、浴用剤等、外用剤・化粧料製剤として使用可能ないずれの形態も用いることができる。上記化粧料製剤には、リナカンチンD及び/又は新規化合物A純品、該化合物の部分精製品、植物からの該化合物の粗抽出物、又は該化合物を含有する植物体等の必須成分に加え、必要に応じて化粧料製剤に配合される成分を含有しても良い。配合成分としては、例えば、固形油、半固形油、液体油、低分子保湿剤、高分子保湿剤、脂溶性保湿剤、エモリエント剤、界面活性剤、防腐剤、酸化防止剤、pH調整剤、エタノール、水等をあげることができる。
【0033】
リナカンチンD及び/又は新規化合物Aの外用での有効投与量は、対象者の症状、対象者の年齢等により異なるが、通常成人一日あたり0.001〜100 mg、好ましくは0.01〜10 mg、さらに好ましくは0.1〜1 mgである。
【0034】
本発明の脂肪蓄積抑制作用を有する医薬品又は化粧料中のリナカンチンD及び/又は新規化合物Aの含有量は、単独又は混合物として通常0.0001〜1wt%、好ましくは0.001〜0.5wt%、より好ましくは、0.01〜0.1wt%である。
【0035】
以下、リナカンチンD及び新規化合物A並びに比較例としてのリナカンチンCの分画・単離例、脂肪蓄積抑制作用の試験例、毒性の試験例及び実施例を挙げ、本発明をさらに詳しく説明するが、本発明はこれらになんら制約されるものではない。
【0036】
1.リナカンチンD及び新規化合物A並びにリナカンチンCの分画・単離例
1−1.リナカンチンD
(1)リナカンチンDの分画・単離
リナカンチンDの分画・単離は、図1に示すフローに従って行った。すなわち、白鶴霊芝(Rhinacanthus nasutus (L.) Kurz)乾燥根(5 Kg)を25 Lの90%(v/v) エタノールを用いて室温にて計3回各24時間抽出を行い、これらを合わせて濃縮し乾固物(407 g)を得た。
次に、これを7 Lの90%(v/v) メタノールへ懸濁溶解後、等量のヘキサンで3回分配後、90%(v/v) メタノール相をとり減圧濃縮した。この減圧濃縮物に精製水を加え5Lへフィルアップ、分液漏斗に移し、5 Lのクロロホルムにて3回2相溶媒分配を行った。次に、この操作により得たクロロホルム相を合わせ乾固物69.3 gを得た。
【0037】
このうち69.0gをヘキサン/酢酸エチルを溶出溶媒とするシリカゲルカラムクロマトグラフィー(80mmφ × 150 mm、関東化学株式会社製)に付した。すなわち、3ベッドボリューム(BV)の溶出溶媒ヘキサン/酢酸エチル(9:1)によりシリカゲルカラムを洗浄後、1 BVの溶出溶媒ヘキサン/酢酸エチル(8:2)により溶出し画分A(乾固物 4.71 g)を得た。
【0038】
次に、画分Aについてメタノールを溶出溶媒とするセファデックスLH-20カラムクロマトグラフィー(20 mmφ × 200 mm、ファルマシア社製)に付した。すなわち、1.5 BVのメタノールにてセファデックスLH-20カラムを洗浄後、0.5 BVのメタノールにて溶出し画分A−2(1.34g)を得た。
さらに、画分A−2を水/メタノールを溶出溶媒とするフラッシュODSカラムクロマトグラフィー(20mm φ × 150 mm、和光純薬社製)により分画した。すなわち、180 mlの50%(v/v) メタノールにてフラッシュODSカラムを洗浄後、ステップワイズにて順次60%(v/v) メタノール、70%(v/v) メタノールにて溶出、80%(v/v) メタノールにて溶出し、目的化合物を含有する画分 A−2−2(乾固物 407 mg)を得た。
さらに、画分 A−2−2(乾固物 407 mg)を分取高速液体クロマトグラフィー(ODSカラム、20 mmφ × 250 mm、野村化学社製、移動相: 72%(v/v) アセトニトリル/水/0.1%(v/v) 蟻酸、検出: 254 nm UVモニター)にて精製し、リナカンチンD(rhinacanthin D)(乾固物18.8 mg)を得た。
【0039】
上記方法により分画・単離されたリナカンチンDについて、核磁気共鳴スペクトル法により1H NMRスペクトルデータを取得したところ、以下のピークが観測され、文献(ジャーナル オブ ナチュラル プロダクト (Journal of Natural Products) 第59巻、808〜811ページ,1996年)の値と略一致した。
【0040】
δ 1.06 (H-,6H,s)、2.74 (H-,2H, s)、4.03 (H-,2H,s)、5.97 (H-,2H,s)、6.70 (H-,1H,d)、7.38 (H-,1H,s)、7.56 (H-,1H,d)、7.63 (H-,1H,t)、7.67 (H-,1H,t)、8.02 (H-,2H,d).
【0041】
なお、上記において、高速液体クロマトグラフィーは、Waters 515システム及びWaters600システム(ともに日本ウォーターズ株式会社製)を用いた。また、シリカゲルカラムクロマトグラフィー、セファデックスLH-20カラムクロマトグラフィー及びフラッシュODSクロマトグラフィーは、汎用の実験器具及び実験装置を用いた。
【0042】
1−2.新規化合物A
(1)新規化合物Aの分画・単離
新規化合物Aの分画・単離は、図1に示すフローに従って行った。すなわち、白鶴霊芝(Rhinacanthus nasutus (L.) Kurz)乾燥根(5 Kg)を25 Lの90%(v/v) エタノールを用いて室温にて計3回各24時間抽出を行い、これらを合わせて濃縮し乾固物(407 g)を得た。
次に、これを7 Lの90%(v/v) メタノールへ懸濁溶解後、等量のヘキサンで3回分配後、90%(v/v) メタノール相をとり減圧濃縮した。この減圧濃縮物に精製水を加え5 Lへフィルアップ、分液漏斗に移しクロロホルムにて3回2相溶媒分配を行った。次に、この操作により得たクロロホルム相を合わせ乾固物69.3 gを得た。
【0043】
このうち69.0 gをヘキサン/酢酸エチルを溶出溶媒とするシリカゲルカラムクロマトグラフィー(80 mmφ × 150 mm、関東化学株式会社製)に付した。すなわち、3 BVの溶出溶媒ヘキサン/酢酸エチル(9:1)、2 BVの溶出溶媒ヘキサン/酢酸エチル(8:2)、及び2 BVの溶出溶媒ヘキサン/酢酸エチル(7:3)によりシリカゲルカラムを順次洗浄後、2 BVの溶出溶媒ヘキサン/酢酸エチル(6:4)により溶出し画分C(乾固物3.73 g)を得た。
【0044】
次に、画分Cについてメタノールを溶出溶媒とするセファデックスLH-20カラムクロマトグラフィー(20 mmφ × 200 mm、ファルマシア社製)を行った。すなわち、2 BVのメタノールでカラムを洗浄後、1 BVのメタノールにて溶出し画分 F (乾固物 369 mg)を得た。
さらに、画分 F(乾固物 369 mg)を水/メタノールを溶出溶媒とするフラッシュODSカラムクロマトグラフィー(20 mmφ × 150 mm、野村化学社製)に付した。すなわち、180 mlの50%(v/v) メタノールにてフラッシュODSカラムを洗浄後、ステップワイズにて順次60%(v/v) メタノール、70%(v/v) メタノールにて洗浄後、80%(v/v) メタノールにて溶出し、目的化合物を含有する画分G(乾固物 75.6 mg)を得た。
さらに画分G(乾固物 75.6 mg)を分取高速液体クロマトグラフィー(ODSカラム、20 mmφ × 250 mm、野村化学社製、移動相:45%(v/v) アセトニトリル、検出: 254 nm UVモニター)にて精製し、新規化合物Aの乾固物(9.8 mg)を得た。
【0045】
(2)新規化合物Aの構造解析
新規化合物Aの構造解析は、高分解能質量分析法(HRFABMS)及び核磁気共鳴スペクトル法(1H NMR、13C NMR)を用いて行った。以下にその結果を示す。
【0046】
(2−1)高分解能質量分析法(HRFABMS)による結果
高分解能質量分析法(HRFABMS)においては、「m/z 272.1039 [M]+ (calcd. 272.1049 Δ 0.9 mmu).」が観測され、分子式が「C16H16O4」であることが分かった。なお、低分解能質量分析法(LRFABMS)においては、「m/z 272.」が観測された。
【0047】
(2−2)核磁気共鳴スペクトル法(1H NMR)による結果
核磁気共鳴スペクトル法(1H NMR)においては、以下のピークが観測された。
「1H NMR (CDCl3, 500 MHz):δ 3.69 (H-14, J = 11.2 Hz, 1H, d)、3.75 (H-14, J = 11.2 Hz, 1H, d)、3.95 (8-OMe, 3H, s)、4.22 (H-2, J = 11.7 Hz, 1H, d)、4.31 (H-2, J = 11.7 Hz, 1H, d)、5.93 (H-4, J = 11.7 Hz, 1H, d)、6.43 (H-5, J = 11.7 Hz, 1H,d)、6.51(H-7, 1H, s)、7.47 (H-10, J = 1.5, 6.7, 7.5 Hz, 1H, m)、7.50 (H-11, J =1.5, 6.7, 7.5 Hz, 1H, m)、8.14 (H-9, J = 1.5, 7.5 Hz, 1H, d)、8.24 (H-12, J = 1.5, 7.5 Hz, 1H, d).」
【0048】
(2−3)核磁気共鳴スペクトル法(13C NMR)による結果
核磁気共鳴スペクトル法(13C NMR)においては、以下のピークが観測された。
「13C NMR (CDCl3, 125 MHz):δ 55.7 (8-OMe)、65.9 (C-14)、74.4 (C-2)、74.9 (C-3)、106.8 (C-7)、119.1 (C-6)、121.6 (C-9)、122.7 (C-12)、126.0 (C-12a)、126.3 (C-10)、126.7 (C-11)、127.6 (C-8a)、130.1 (C-5)、132.1 (C-4)、148.9 (C-13)、150.6 (C-8).」
【0049】
なお、上記において、高分解能質量分析装置としては、JEOL JMS SX-102型質量分析装置(日本電子株式会社製)を用いた。また、核磁気共鳴スペクトル装置(1H NMR及び13C NMR)としては、JEOL JNM-GSX500型核磁気共鳴スペクトル装置(日本電子株式会社製)を用いた。
【0050】
以上の結果並びにHMQCスペクトル及びHMBCスペクトルから、新規化合物Aが、上記の式(2)で表される新規化合物であることが分かった。
【0051】
2.脂肪蓄積抑制作用の試験例
脂肪蓄積抑制作用の試験は、SDラット由来前駆白色脂肪細胞に対する脂肪蓄積抑制活性の測定をすることにより行った。
【0052】
(1)試験方法
SDラット由来前駆白色脂肪細胞(タカラバイオ社より購入)を、1回継代培養後、液体窒素容器で凍結保存し、以降の実験に供した。この凍結細胞を37℃の温水で常法に従い融解し、1×105 cells/mlの細胞濃度で基本培地[高グルコースDMEM培地(Lonza社製)にアスコルビン酸、ビオチン、パントテン酸、トリヨードチロニン、オクタン酸、牛胎児血清、ペニシリン(50 U/ml)、ストレプトマイシン(50 μg/ml)を添加]に懸濁、24穴培養プレート(1 cm2/ウェル、NUNC)に1 mlずつ播種、37℃、5%炭酸ガス存在下培養した。90%〜95%コンフルエントまで細胞が増殖した時点で基本培地を吸引除去し、分化培地[基本培地にインシュリン(10 μg/ml)、デキサメタゾン(2.5 μM)、3-イソブチル-1-メチルキサンチン(0.5 mM)を添加]を加え、さらに48時間、37℃、5%炭酸ガス存在下培養を続けた。分化培地での培養48時間後に分化培地を吸引除去し、カルシウム・マグネシウムフリーPBS(Dulbecco’s Phosphate-Buffered Saline)溶液(以下PBS)で2回洗浄後、リナカンチンD又は新規化合物A(いずれもDMSOへ溶解、培地中の最終DMSO濃度 = 0.2%(v/v); なお、DMSOのみを1/500体積量加えた培地で培養したものを対照群とした。)を含有する維持培地[基本培地に10 μg/mlインシュリンを添加]を加え、さらに6日間、37℃、5%炭酸ガス存在下培養した。
【0053】
培養6日後に培地を吸引除去し、PBSで2回洗浄、マイルドホルム(和光純薬工業社製)を1ウェルあたり200 μl添加し、4℃で2時間静置により細胞を固定した。次に、マイルドホルムを吸引除去し、60%(v/v) イソプロピルアルコールで1回洗浄した。この後、調製したオイルレッド O試薬[オイルレッド Oをイソプロピルアルコールへ0.5%(w/v)濃度で溶解したストック溶液に、2/3量の超純水を用事添加し15分間室温で放置後、メンブランフィルター(0.45 μm)でろ過して調製]を1ウェルあたり100 μlずつ添加し、室温下で15分間静置した。15分間静置後、60%(v/v) イソプロピルアルコールで2回洗浄を行い、培養基を乾燥させてから、1ウェルあたり100 μlのイソプロピルアルコールを加えて振盪、オイルレッド O色素を溶出させた。80 μlの色素溶出液を96穴マイクロプレートに回収し、イムノリーダー(大日本製薬株式会社製)を用いて540 nmにおける吸光度を測定した。吸光度から、中性脂肪の相対蓄積値を算出した。
【0054】
(2)試験結果
リナカンチンD及び新規化合物Aの「前駆白色脂肪細胞の中性脂肪蓄積値」の相対値を表1に示す。
【0055】
[表1]
前駆白色脂肪細胞の中性脂肪蓄積値
試験区 濃度 中性脂肪蓄積値(相対値)
無添加コントロール 100%
リナカンチンD 10μg/ml 20%
新規化合物A 10μg/ml 32%
【0056】
表1に示すように、リナカンチンD及新規化合物Aが、10μg/mlという比較的低濃度で優れた脂肪蓄積抑制作用(前駆白色脂肪細胞に対する優れた中性脂肪蓄積抑制活性)を示すことが確認できた。
【0057】
3.毒性試験例
毒性試験は、SDラット由来前駆白色脂肪細胞に対する増殖抑制活性の測定をすることにより行った。
【0058】
(1)試験方法
SDラット由来前駆白色脂肪細胞(タカラバイオ社より購入)を、1回継代培養後、液体窒素容器で凍結保存し、以降の実験に供した。この凍結細胞を37℃の温水で常法に従い融解し、基本培地[高グルコースDMEM培地(Lonza社製)にアスコルビン酸、ビオチン、パントテン酸、トリヨードチロニン、オクタン酸、牛胎児血清、ペニシリン(50 U/ml)、ストレプトマイシン(50 μg/ml)を添加]を用い、1×104 cells/100 μlの細胞濃度で96穴培養プレート(NUNC)に播種し、37℃、5%炭酸ガス存在下、48時間培養を行った。培養48時間後に、リナカンチンD又は新規化合物A(いずれもDMSOへ溶解、培地中の最終DMSO濃度 = 0.1%(v/v); なお、DMSOのみを1/1000体積量加えた培地で培養したものを対照群とした)を加え、さらに、37℃、5%炭酸ガス存在下、48時間培養した。
【0059】
細胞増殖度の測定は、MTT[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide、ナカライテスク]を用いた方法で行った[株式会社東京化学同人発行、新生化学実験講座12 分子免疫学I 免疫細胞・サイトカイン 358-359ページ]。すなわち、毒性試験対象の各化合物を加え48時間培養後、培地交換を行い96穴培養プレート(0.33 cm2/ウェル)の各ウェルの培養液90 μlに対し10 μlのMTT溶液[5 mg/ml; カルシウム・マグネシウムフリーPBS(Dulbecco’s Phosphate-Buffered Saline)溶液へ溶解後、メンブランフィルター(0.22 μm)でろ過]を加え、振盪して均一にし、37℃、5%炭酸ガス存在下で4時間培養した。培養4時間後に各々のウェルに10%(w/v) SDS−50%(v/v) N , N-Dimethylformamide−0.005N 塩酸溶液100 μl を加え、18時間、37℃、5%炭酸ガス存在下静置した後、イムノリーダー(大日本製薬株式会社製)を用いて、750 nmを対照とし、590 nmにおける吸光度を測定、生存率の指標とした。
【0060】
(2)試験結果
リナカンチンD及び新規化合物Aの「前駆白色脂肪細胞の生存率」を表2に示す。
【0061】
[表2]
前駆白色脂肪細胞の増殖抑制活性
試験区 濃度 生存率
無添加コントロール 100%
リナカンチンD 10μg/ml 88%
新規化合物A 10μg/ml 100%
【0062】
表2に示すように、リナカンチンD及新規化合物Aが、低い毒性(前駆白色脂肪細胞に対する低い増殖抑制活性)を示すことが確認できた。
【実施例】
【0063】
実施例1.錠剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で錠剤(1錠あたり500mg)を作製する。
リナカンチンD 1mg
乳糖 479mg
乾燥コーンスターチ 10mg
タルク 9mg
ステアリン酸カルシウム 1mg
【0064】
(調製法)
乳糖(95.8g)に、リナカンチンD(0.2g)、乾燥コーンスターチ(2g)、タルク(1.8g)、ステアリン酸カルシウム(0.2g)を添加して混合する。次いで、単発式打錠機を用いて常法により錠剤を作製する。
【0065】
実施例2.ハードカプセル剤の作製
上記の「1−2.新規化合物A (1)新規化合物Aの分画・単離」に記載した方法に従って分画・単離された新規化合物Aを用いて、次の処方でハードカプセル剤(1カプセルあたり360mg)を作製する。
新規化合物A 5mg
乳糖 220mg
コーンスターチ 110mg
ヒドロキシプロピルセルロース 25mg
【0066】
(調製法)
新規化合物A(5g)に、乳糖(220g)及びコーンスターチ(110g)を添加して混合し、これにヒドロキシプロピルセルロース(25g)の水溶液を添加して練合する。次いで、押し出し造粒機を用いて、常法により顆粒を製造する。この顆粒をゼラチンハードカプセルに充填することにより、ハードカプセル剤を作製する。
【0067】
実施例3.ソフトカプセル剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方でソフトカプセル剤(1カプセルあたり170mg)を作製する。
リナカンチンD 0.5mg
大豆油 169.5mg
【0068】
(調製法)
大豆油(169.5g)に、リナカンチンD(0.5g)を添加して混合する。次いで、ロータリー・ダイズ式自動成型機を用いて、常法に従い、ソフトカプセルに充填することにより、ソフトカプセル剤を作製する。
【0069】
実施例4.丸剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で丸剤(1粒あたり100mg)を作製する。
リナカンチンD 0.5mg
モロヘイヤ末 20.0mg
デンプン 30.0mg
糖蜜 20.0mg
茶抽出物 15.0mg
大豆ファイバー 14.0mg
セラック 0.5mg
【0070】
(調製法)
上記配合で原料を混合し、適量加水後、練合機で均質な練合物を製造し、得られた練合物を圧延し製丸機を用いて製丸後乾燥して丸剤を作製する。
【0071】
実施例5.散剤の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で常法により散剤(1包あたり1000mg)を作製する。
リナカンチンD 1mg
乳糖 799mg
コーンスターチ 200mg
【0072】
実施例6.ゼリーの作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で、常法によりゼリー(100g)を作製する。
リナカンチンD 0.002g
ゼラチン 2.0g
オレンジ果汁 20.0g
水 77.998g
【0073】
(調製法)
上記成分を混合し、90℃へ加熱する。ゼラチンの溶解を確認してから容器に充填し、冷却する。ゼラチンを固化することでゼリーを作製する。
【0074】
実施例7.軟膏の作製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で、常法により軟膏(100g)を作製する。
(油相成分)
リナカンチンD 0.1g
白色ワセリン 20.0g
ミネラルオイル 20.0g
ステアリルアルコール 5.0g
ステアレス−2 3.0g
プロピルパラベン 0.1g
天然ビタミンE 0.1g
(水相成分)
1,3−ブチレングリコール 5.0g
フェノキシエタノール 0.4g
ポリソルベート 60 4.5g
精製水 適量
全量 100g
【0075】
(調製法)
油相成分及び水相成分をそれぞれ80℃に熱して均一にし、水相を油相に攪拌しながら加え、乳化後冷却し軟膏を作製した。
【0076】
実施例8.テープ剤の作製
上記の「1−2.新規化合物A (1)新規化合物Aの分画・単離」に記載した方法に従って分画・単離された新規化合物Aを用いて、次の処方で、常法によりテープ剤(100g)を作製する。
(粘着剤溶剤)
スチレン−イソプロピレン−スチレンブロック共重合体 7.0g
ピコライト 25.0g
イソプロピレンゴム 5.0g
トルエン 15.0g
酢酸エチル 14.2g
ヘキサン 25.0g
(薬効成分)
新規化合物A 0.1g
エタノール 5.0g
(経皮吸収促進剤)
オレイルアルコール 0.8g
全量 100g
【0077】
(調製法)
粘着剤溶剤及び薬効成分をそれぞれ均一にし、薬効成分及び経皮吸収促進剤を粘着剤溶剤に加え、室温で攪拌し組成物を作製した。この組成物をシリコーン処理したポリエステルフィルム上に延展し、120℃で乾燥させ冷却後、ポリエチレンフィルムへ粘着剤層を転写させ、テープ剤を作製する。
【0078】
実施例9.痩身用ローションの調製
上記の「1−1.リナカンチンD (1)リナカンチンDの分画・単離」に記載した方法に従って分画・単離されたリナカンチンDを用いて、次の処方で、常法により痩身用ローション(100g)を作製する。
(油相成分)
リナカンチンD 0.1g
ポリオキシエチレン(60モル)硬化ヒマシ油 2.0g
1,3−ブチレングリコール 5.0g
(水相成分)
グリセリン 5.0g
フェノキシエタノール 0.3g
クエン酸 0.1g
クエン酸ナトリウム 0.2g
エタノール 8.0g
精製水 適量
全量 100g
【0079】
(調製法)
油相成分及び水相成分をそれぞれ均一に溶解し、油相を水相に攪拌しながら加え、痩身用ローションを作製する。
【0080】
実施例10.痩身用マッサージジェルの作製
上記の「1−2.新規化合物A (1)新規化合物Aの分画・単離」に記載した方法に従って分画・単離された新規化合物Aを用いて、次の処方で、常法により痩身用マッサージジェル(100g)を作製する。
(油相成分)
新規化合物A 0.1g
マイクロクリスタリンワックス 11.0g
白色ワセリン 8.0g
ホホバ油 5.0g
イソステアリンポリグリセリル−2 1.0g
天然ビタミンE 0.05g
プロピルパラベン 0.1g
(水相成分)
ジプロピレングリコール 5.0g
グリセリン 7.0g
ポリオキシエチレン(60モル)硬化ヒマシ油 3.0g
フェノキシエタノール 0.3g
精製水 適量
全量 100g
【0081】
(調製法)
油相成分及び水相成分をそれぞれ80℃に熱して均一にし、水相を油相に攪拌しながら加え、乳化後冷却し痩身用マッサージジェルを作製する。
【特許請求の範囲】
【請求項1】
下記の式(1)で表されるリナカンチンDを含有する抗肥満剤。
【化1】

【請求項2】
下記の式(2)で表される新規化合物を含有する抗肥満剤。
【化2】

【請求項3】
脂肪蓄積抑制作用を有する請求項1に記載の抗肥満剤。
【請求項4】
脂肪蓄積抑制作用を有する請求項2に記載の抗肥満剤。
【請求項5】
請求項1又は3に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【請求項6】
請求項2又は4に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【請求項1】
下記の式(1)で表されるリナカンチンDを含有する抗肥満剤。
【化1】

【請求項2】
下記の式(2)で表される新規化合物を含有する抗肥満剤。
【化2】

【請求項3】
脂肪蓄積抑制作用を有する請求項1に記載の抗肥満剤。
【請求項4】
脂肪蓄積抑制作用を有する請求項2に記載の抗肥満剤。
【請求項5】
請求項1又は3に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【請求項6】
請求項2又は4に記載の抗肥満剤を含有し、脂肪蓄積抑制作用を有する医薬品、食品又は化粧料。
【図1】




【公開番号】特開2011−190251(P2011−190251A)
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願番号】特願2011−32673(P2011−32673)
【出願日】平成23年2月17日(2011.2.17)
【出願人】(398050777)株式会社アルソア本社 (10)
【出願人】(509114631)株式会社慧央メディカ (2)
【Fターム(参考)】
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願日】平成23年2月17日(2011.2.17)
【出願人】(398050777)株式会社アルソア本社 (10)
【出願人】(509114631)株式会社慧央メディカ (2)
【Fターム(参考)】
[ Back to top ]

