抗腫瘍剤
【課題】 医薬として有用な抗腫瘍剤を提供する。
【解決手段】 次の一般式

(式中、----- は単結合の存在または非存在を意味し、XはNまたはC−Rxを意味し、ここにおいてRxは水素原子またはハロゲン原子を意味し、R1 およびR2は同一または異なり水素原子やハロゲン原子などを意味し、R3 は水素原子やカルボキシル基などを意味し、R4 はオキソ基または水酸基を意味し、R5 は水素原子やアミノ基などを意味し、R6 は環状アミノの如き置換基を意味する。)で表される化合物を有効成分とする抗腫瘍剤。
【解決手段】 次の一般式

(式中、----- は単結合の存在または非存在を意味し、XはNまたはC−Rxを意味し、ここにおいてRxは水素原子またはハロゲン原子を意味し、R1 およびR2は同一または異なり水素原子やハロゲン原子などを意味し、R3 は水素原子やカルボキシル基などを意味し、R4 はオキソ基または水酸基を意味し、R5 は水素原子やアミノ基などを意味し、R6 は環状アミノの如き置換基を意味する。)で表される化合物を有効成分とする抗腫瘍剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は医薬として有用な抗腫瘍剤に関する。
【背景技術】
【0002】
2−チアゾリル基を有するピリドンカルボン酸誘導体が抗菌活性を有することは知られている。例えば、特開昭61−152682号公報(以下、Ref.1という:特許文献1)の実施例24には次の化合物が記載されている。
【0003】
【化1】

【0004】
また、このRef.1の実施例5には次の化合物が記載されている。
【0005】
【化2】

【0006】
更に、このRef.1の実施例12には、次の化合物が記載されている。
【化3】

【0007】
前記〔化2〕や〔化3〕で表される化合物は特開昭62−33176号公報(以下、Ref.2という:特許文献2)の表1にも記載されている。特開昭60−56959号公報(以下、Ref.3という:特許文献3)の実施例24-4および特開昭61−251667号公報(以下、Ref.4という:特許文献4)の実施例15には次の化合物が記載されている。
【0008】
【化4】

【0009】
特開昭60−163866号公報(以下Ref.5という:特許文献5)の実施例28-16 には次の化合物が記載されている。
【0010】
【化5】

【0011】
更に、特開平2−85255号公報(以下Ref.6という:特許文献6)の実施例8には次の化合物が記載されている。
【0012】
【化6】

【0013】
しかし、以上のRef.1〜6は、これらの化合物が抗菌作用を有することについて言及するだけであって、抗腫瘍活性や抗癌活性については全く教示していない。なお、これらの化合物はその6位にフッ素原子が置換されている点において共通している。
【0014】
また、ある種のピリドンカルボン酸誘導体が抗腫瘍活性や抗癌活性を有することも知られている。例えば、Cancer Research 52, 2818 (1992):非特許文献1は、90種類のピリドンカルボン酸誘導体の抗腫瘍作用を検討した結果、ほとんどのピリドンカルボン酸誘導体に抗腫瘍活性は認められず、認められた化合物は数種にすぎなかった、と報告している。そして、この論文には、1位に置換されているシクロプロピル基および6位と8位に置換されている2個のハロゲン原子が抗腫瘍作用の発現に重要な役割を果たしており、このような置換基をもたないピリドンカルボン酸誘導体は抗腫瘍作用を示さないことが教示されている。
【0015】
【特許文献1】特開昭61−152682号公報
【特許文献2】特開昭62−33176号公報
【特許文献3】特開昭60−56959号公報
【特許文献4】特開昭61−251667号公報
【特許文献5】特開昭60−163866号公報
【特許文献6】特開平2−85255号公報
【非特許文献1】Cancer Research 52, 2818 (1992)
【発明の開示】
【発明が解決しようとする課題】
【0016】
本発明者らは抗腫瘍作用を有する化合物を鋭意探索し、その結果として、1位にシクロプロピル基を持たないピリドンカルボン酸およびその関連化合物が顕著な抗腫瘍作用を有することを見出し、本発明を完成した。
【課題を解決するための手段】
【0017】
本発明によれば2−チアゾリル基を含む下記一般式(I)を有する化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする抗腫瘍剤が提供される。
【0018】
【化7】

【0019】
なお、前記、一般式(I)における基本骨格の各位置を示す番号は、原則として、2−チアゾリル基が結合する位置から反時計回りに順次付すこととする。従って、2−チアゾリル基が結合している位置は1位であり、R6 が結合する位置は7位となる(この番号づけは、通常の場合と異なっていることもあるが、本明細書では、説明の便宜上、このように扱うこともある)。
【0020】
以下に前記一般式(I)における各記号(置換基)について定義し、説明する。
【0021】
一般式(I)における--------- は単結合の存在または非存在を意味する。すなわち、2位の炭素原子と3位の炭素原子の間の結合および4位の炭素原子と置換基R4 の間の結合は単結合であったり、二重結合であったりする。
【0022】
XはNまたはC−Rx を意味し、ここにおいてRx は水素原子またはハロゲン原子を意味する。本明細書において、「ハロゲン」または「ハロゲン原子」なる用語は、フッ素、塩素、臭素またはヨウ素を意味し、フッ素または塩素が好適である。
【0023】
R1 およびR2 は同一または異なり、水素原子、ハロゲン原子、ニトロ基、低級アルコキシ基、低級アルキル基(該低級アルキル基は低級アルコキシカルボニルまたはカルボキシルで置換されていてもよい)、ハロゲンで置換されていてもよいフェニル基もしくはチエニル基、またはフェニルスルホニル基(該フェニル部分はハロゲンもしくはニトロで置換されていてもよい)を意味するか、あるいはR1およびR2 が一緒になってベンゼン環またはナフタレン環を形成し、該ベンゼン環またはナフタレン環はハロゲン、ニトロもしくは低級アルキルで置換されていてもよい。
【0024】
本明細書において、「低級」なる用語は、特に断らないかぎり、この用語が付された基が1〜5個の炭素原子を含むことを意味する。従って、例えばR1 の定義に含まれる低級アルキル基としては、直鎖状または分岐状のものであり、例えば、メチル基,エチル基,n−プロピル基,イソプロピル基,n−ブチル基,tert −ブチル基,ペンチル基が挙げられ、メチル基やエチル基が好適である。また、「低級アルコキシ基」は前記低級アルキル基と酸素原子とが結合したものであり、例えば、メトキシ基やエトキシ基が挙げられる。
【0025】
R3 は水素原子、ベンジル基、水酸基、カルボキシル基またはカルボキシル基に変換しうる基を意味する。
【0026】
置換基R3 の定義に含まれる「カルボキシル基に変換しうる基」としては、化学的手段または酵素学的手段により脱離してカルボキシル基に変換しうる基であればいずれでもよく、必ずしも生体内でカルボキシル基に変換される必要はない。
【0027】
このようなカルボキシル基に変換しうる基としては、ヒドロキシメチル基やホルミル基、エステル体、カルバモイル基またはアミド体が好適である。
【0028】
前記エステル体としては、メチルエステルやエチルエステルの如き低級アルキルエステル、アセトキシメチルエステルや1−アセトキシエチルエステル、ピバロイルオキシメチルエステルの如き低級アルカノイルオキシ低級アルキルエステル、1−エトキシカルボニルオキシエチルエステルの如き低級アルコキシカルボニルオキシ低級アルキルエステル、2−ジメチルアミノエチルエステルのようなジ低級アルキルアミノ低級アルキルエステル、2−(1−ピペリジニル)エチルエステル、3−ブチロラクトニルエステル、コリンエステル、フタリジルエステル、(5−メチル−2−オキソ−1,3−ジオキソール−4−イル)メチルエステルなどが挙げられる。
【0029】
R4 はオキソ基または水酸基を意味する。R4 がオキソ基であり、R3 がカルボキシル基である場合には、一般式(I)で表される化合物はピリドンカルボン酸誘導体となる。
【0030】
5位の置換基たるR5 は水素原子、アミノ基、ハロゲン原子または低級アルキル基を意味し、該低級アルキル基はハロゲンで置換されていてもよい。ここにおけるハロゲンで置換されている低級アルキル基の例としては、トリフルオロメチル基が挙げられる。
【0031】
R6 はN−C結合、C−C結合、S−C結合またはO−C結合により母核と結合している置換基を意味し、より具体的には、以下の(a)〜(e)から選ばれるいずれかの基がその例として挙げられる。
【0032】
(a):R6 は次の式(a)で表される4〜7員の単環性アミノ基である。
【0033】
【化8】

【0034】
(式中、--------- は単結合の存在または非存在を意味し、R6a1、Ra2、R6a3およびR6a4は同一または異なり、C、CH、CH2 、CH2CH2 、CH=CH、S(O)0-2 、O、NまたはN−R6a を意味し、ここでR6a は水素原子、低級アルキル基またはフェニル基を意味し、該フェニル基は低級アルコキシ、低級アルキル、ハロゲンまたはニトロで置換されていてもよい。kおよびmは同一または異なり、0または1の整数を意味する。R6a5、R6a6およびR6a7については、後述する。)
【0035】
式(a)には、例えば、次の〔化9〕で表される基が包含され、これらの基は、N−C結合(mが0の場合)またはC−C結合(mが1の場合)により母核の7位と結合している。
【0036】
【化9】

【0037】
(式中、R6a 、R6a5、R6a6、R6a7およびmは前掲と同じものを意味する。)
【0038】
式(a)における置換基R6a5は、水素原子、メチレン基または次の式(R6a −5)で表される基を意味する:
【0039】
【化10】

【0040】
〔式中、R6a51 は水素原子またはフェニル基(該フェニル基はハロゲンで置換されていてもよい)を意味するか、またはフェニルもしくはハロゲノフェニルで置換されていてもよい低級アルキル基を意味し、R6a52 は水素原子、低級アルキル基または水素原子に変換しうる基であり、nは0〜4の整数である。〕
【0041】
置換基R6a52 の定義に含まれる「水素原子に変換しうる基」としては、加水分解の如き化学的手段または酵素学的手段により水素原子に変換できるものならばいずれでもよく、必ずしも生体内で水素原子に変換される必要はない。
【0042】
このような「水素原子に変換しうる基」としては、ホルミルやアセチルの如きアシル基、エトキシカルボニルの如きオキシカルボニル基を有する基、アミノ酸残基やペプチド残基の他、例えばo−ニトロフェニルスルフェニル、トリメチルシリル、テトラヒドロピラニル、ジフェニルホスフィニルなどが挙げられ、殊にアミノ酸残基やペプチド残基が好適である。
【0043】
アミノ酸は、一般に3文字からなる英文字でもって表され、本明細書でもこれに従う。また、L−体、D−体またはこれらの混合体は、3文字の頭に「L−」、「D−」または「DL−」なる記号を付すことにより区別することにする。これらの異性体を区別することなく総称するときは、これらの記号は付さないことにする。
【0044】
アミノ酸残基としては、例えば、Gly(グリシン) 、Ala(アラニン)、Arg(アルギニン)、Asn(アスパラギン)、Asp(アスパラギン酸) 、Cys(システイン)、Glu(グルタミン酸) 、His(ヒスチジン) 、Ile(イソロイシン)、Leu(ロイシン) 、Lys(リジン)、Met(メチオニン)、Phe(フェニルアラニン) 、Pro(プロリン) 、Ser(セリン)、Thr(トレオニン) 、Trp(トリプトファン)、Tyr(チロシン)、Val(バリン)、Nva(ノルバリン) 、Hse(ホモセリン)、4-Hyp(4−ヒドロキシプロリン)、5-Hyl(5−ヒドロキシリジン) 、Orn(オルニチン) などのアミノ酸の残基が挙げられる。
【0045】
ペプチド残基としては、前述のアミノ酸が2〜5個、好ましくは2〜3個連結されたペプチド残基であり、例えば、Ala-Ala 、Gly-Phe 、Nva-Nva 、Ala-Phe、Gly-Gly 、Gly-Gly-Gly 、Ala-Met 、Met-Met 、Leu-Met 、Ala-Leu などのペプチドの残基が挙げられる。
【0046】
これらのアミノ酸やペプチドの残基における立体化学的配置は、D−体、L−体またはこれらの混合体であってもよいが、L−体が好ましい。更に、「水素原子に変換しうる基」がアミノ酸やペプチドの残基であるときは、これらの残基中にも不斉炭素原子を有することもある。不斉炭素原子を有するアミノ酸残基の例としては、Ala, Leu, Phe, Trp, Nva, Val, Met, Ser, Lys, Thr, Tyr などのアミノ酸の残基が挙げられ、不斉炭素原子を有するペプチド残基の例としては、不斉炭素原子を有するこれらのアミノ酸残基を構成成分とするものが挙げられる。
【0047】
式(a)に含まれる置換基R6a6は、水素原子、ハロゲン原子、水酸基、アジド基、ホルミル基、オキソ基、低級アルコキシ基、低級アルキルチオ基または低級アルキル基(該低級アルキル基はハロゲンもしくはヒドロキシで置換されていてもよい)を意味する。
【0048】
また、式(a)に含まれる置換基R6a7は、R6a6と同じものを意味するか、あるいは次の式(R6a −7)で表されるスピロ環状アミノ基を意味する:
【0049】
【化11】

【0050】
〔式中、pは3または4の整数を意味する。〕
なお、R6a6とR6a7とは、同一または異なるものを選択してもよい。
【0051】
(b):7位の置換基R6 は次の式(b) で表される二環性アミノ基である。
【0052】
【化12】

【0053】
(式中、--------- は単結合の存在または非存在を意味し、q,sおよびtは同一または異なり、0〜2の整数であり、qとtの和は2または3である。R6b1はC、CH、CH2またはN−R6b を意味し、ここにおいてR6b は水素原子または低級アルキル基を意味し、R6b2はC、CH、CH2 、CH2CH2 またはCH=CHを意味し、R6b3はC、CH、CH2 またはOを意味し、u、vおよびwは同一または異なり、0または1の整数であって、これらの和が1〜3であることを意味し、R6b4およびR6b5は同一または異なり、水素原子、水酸基、低級アルキル基、アミノ基、モノもしくはジ−低級アルキルアミノ基またはモノもしくはジ−低級アルキルアミノ低級アルキル基を意味する。)
【0054】
式(b)には、例えば、次の〔化13〕で表される基が包含され、これらの基はN−C結合により母核の7位と結合している。
【0055】
【化13】

【0056】
(式中、------、R6b 、R6b4およびR6b5は前掲と同じものを意味する。)
【0057】
(c):R6 は、次の式(c)で表される3〜7員の環状基である。
【0058】
【化14】

【0059】
(式中、--------- は単結合の存在または非存在を意味し、R6c1、R6c2、R6c3およびR6c4は同一または異なり、C、CH、CH2 、CH2CH2 、CH=CH、S(O)0-2 、 O、NまたはN−R6c を意味し、ここでR6c は水素原子または低級アルキル基を意味する。R6c5はO、SまたはCH2を意味し、R6c6およびR6c7は同一または異なり、水素原子、アミノ基または低級アルキル基を意味する。f、gおよびhは同一または異なり、0または1の整数を意味する。)
【0060】
式(c)には、例えば、次の〔化15〕で表される基が包含され、これらの基はC−C結合(R6c5がCH2 であるか、hが0の場合)、O−C結合(R6c5がOでありhが1の場合)またはS−C結合(R6c5がSでありhが1の場合)により母核の7位と結合している。
【0061】
【化15】

【0062】
(式中、R6c、R6c5 、R6c6 、R6c7 およびhは前掲と同じものを意味する。)
【0063】
(d):R6 は次の式(d)で表されるアミノ基である。
【0064】
【化16】

【0065】
(式中、R6d1はSまたはNHを意味し、R6d2およびRd3は同一または異なり、水素原子または低級アルキル基を意味し、iは0または1の整数を意味し、jは1〜5の整数を意味する。)
【0066】
式(d)には、低級アルキルで置換されていてもよいアミノ基(iが0の場合)、低級アルキルで置換されていてもよいアミノアルキルアミノ(iが1でR6d1 がNHの場合)および低級アルキルで置換されていてもよいアミノアルキルチオ(iが1でR6d1がSの場合)が含まれる。
【0067】
(e):R6 は、水酸基、低級アルキル基、低級アルケニル基または低級アルキニル基のいずれかである。低級アルケニル基の例としては、ビニル基が、低級アルキニル基の例としてはエチニル基が、それぞれ挙げられる。
【0068】
一般式(I)で表される本発明にかかわる化合物には、その立体異性体もしくはその光学異性体またはこれらの生理的に許容される塩あるいは場合によって存在することもあるこれらの水和物や溶媒和物が包含される。
【0069】
塩としては、その構造中に存在することもあるカルボキシル基部分の塩とアミノ基や環状アミノ基の如き塩基性置換基部分の酸付加塩とがある。
【0070】
該カルボキシル基での塩としては、例えば、ナトリウム,カリウム,マグネシウム,亜鉛,銀,アルミニウム,白金などの金属との塩、またはジメチルアミノエタノール,メチルアミノエタノール,トリエタノールアミン,グアニジン等の有機塩基との塩が挙げられる。
【0071】
また、塩基性置換基での酸付加塩としては、例えば、塩酸,臭化水素酸,ヨウ化水素酸,硫酸,リン酸などの無機酸との塩、またはメタンスルホン酸,シュウ酸,マレイン酸,フマル酸,マロン酸,乳酸,リンゴ酸,クエン酸,酒石酸,安息香酸,p−トルエンスルホン酸,アスコルビン酸,グルクロン酸,2−ヒドロキシエタンスルホン酸,ラクトビオン酸,グルコヘプトン酸, グルコン酸などの有機酸との塩が挙げられる。
【0072】
以上、詳述した本発明にかかわる化合物は、冒頭に述べた6位がフッ素原子である極一部の化合物を除き、新規である。
【0073】
本発明にかかわる化合物は、いずれも抗腫瘍剤ないし抗癌剤として優れているが、その内でも下記一般式(I−a)に包含される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物が抗腫瘍剤として好ましい。
【0074】
【化17】

【0075】
(式中、------、R1、R2 、R3 、R4 、R5 、X、R6a1 、R6a2、R6a3、R6a4、R6a5、R6a6、R6a7およびkは前掲と同じものを意味する。)
【0076】
さらに抗腫瘍剤として好適な本発明に係わる化合物は、下記一般式(I−b)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物である。
【0077】
【化18】

【0078】
(式中、Wは水素原子またはフッ素原子であり、------、R1 、R2 、R3 、R4 、R5、R6a5、R6a6およびR6a7は前掲と同じものを意味する。)
【0079】
抗腫瘍剤として特に好適な本発明にかかわる化合物は、下記一般式(I−c)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物である。
【0080】
【化19】

【0081】
(式中、R6a511は低級アルキル基であり、R6a61 およびR6a71 は、同一または異なり、水素原子、低級アルコキシ基または低級アルキル基を意味する。)
【0082】
一般式(I−c)で表される化合物の構造上の特徴は、(1)1,8−ナフチリジン骨格を基本とし、(2)1位に2−チアゾリル基が結合されており、(3)3位がカルボキシル基であり、(4)4位がオキソ基であり、(5)5位および6位にフッ素原子の如き置換基が存在せず、(6)7位に特定の置換基を有する1−ピロリジニル基が結合されている、ことにあり、特に1位と7位の置換基の組み合わせと6位にフッ素原子を含まない点にある。
【0083】
一般式(I−c)に包含される具体的化合物としては、例えば、1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩が挙げられる。
【0084】
本発明にかかわる化合物は、具体的には後記実施例に記載されているが、この他に以下の化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物が挙げられる。
【0085】
7−(3−アミノ−4−フルオロ−1−ピロリジニル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0086】
7−(3−アミノ−4−メトキシ−3−メチル−1−ピロリジニル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0087】
5,8−ジヒドロ−2−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸
【0088】
8−(4−フルオロ−2−チアゾリル)−5,8−ジヒドロ−2−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−5−オキソピリド〔2,3−d〕ピリミジン−6−カルボン酸
【0089】
5−アミノ−1−(4−フルオロ−2−チアゾリル)−1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1,8−ナフチリジン−3−カルボン酸
【0090】
5−アミノ−7−(1−アミノ−3−アザビシクロ〔3.1.0〕ヘキサ−3−イル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0091】
以下において示されることもある立体構造は、特に断らないかぎり、絶対的なものではなく相対的なものである。そして、以下の表中の「立体」の欄は7位の相対的な立体構造を示し、光学活性な化合物については(+)(−)もしくは(R)(S)で表すことにする。
【発明の効果】
【0092】
本発明にかかわる化合物は、リンパ性白血病腫瘍の如き非固形腫瘍のみならず、例えば、肺、乳、胃、子宮、皮膚、腸、膀胱、鼻喉などの各組織に発生する各種の固形腫瘍に対してても顕著な抗腫瘍作用を示す。また、本発明にかかわる化合物は生体に対する安全性が高い。従って、本発明にかかわる化合物は、ヒト腫瘍の治療剤または予防剤として有用である。
【0093】
以下において用いられることもある記号は次の意味を有する。
Me:メチル基、
Et:エチル基、
Ac:アセチル基、
Bz:ベンジル基、
Ph:フェニル基、
Bu:ブチル基、
t−:tert−。
[試験例]
【0094】
つぎに本発明にかかわる化合物の抗腫瘍活性について、試験例を挙げて説明する。市販抗癌剤たるエトポシド(EP)および市販抗菌剤たるシプロフロキサシン(CPFX)およびエノキサシン(ENX)を対照として用いた。
【0095】
試験例 1:P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0096】
P388リンパ性マウス白血病細胞を用い、MTT〔3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] 法により、試験化合物の抗腫瘍活性を試験した。
【0097】
1000〜2000個のP388リンパ性マウス白血病細胞と所定濃度の試験化合物を含む培養液の0.1 mlずつを96穴プレ−トの各穴に加え、37℃、5%炭酸ガス条件下で72時間培養した。培養後、MTT(5mg/ml)溶液の0.02mlずつを各穴に添加し、更に4時間培養した。培養液を遠心分離(4℃、2000rpm×20分)し、上清を吸引除去した。ついで0.1 mlのジメチルスルホキシドを各穴に加えて形成されているフォルマザン(formazan)を溶解し、更に0.1 mlのジメチルスルホキシドを加えた。この溶液の吸光度(OD)をマルチスキャンバイクロマティック(主波長570 nm,副波長690 nm)で測定した。未処理細胞(コントロール)の吸光度を100 %とし、最小二乗法により50%増殖抑制濃度(IC50:μg/ml)を算出した。
【0098】
結果を以下の第1表〜第9表に示す。なお、対照化合物のデータは第9表に示されている。
【0099】
第1表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【化20】

【0100】
【表1】

*:1=HCl
【0101】
【表2】

*:1=HCl、 2=1/2 HCl、 3=1/5 HCl
【0102】
【表3】

*:1=HCl
【0103】
【表4】

*:「−」=遊離体、 1=HCl
【0104】
第2表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0105】
【化21】

【0106】
【表5】

*:1=HCl
【0107】
【表6】

*:「−」=遊離体、 1=HCl
【0108】
【表7】

*:「−」=遊離体、 1=HCl
【0109】
【表8】

*:「−」=遊離体、 1=HCl
【0110】
【表9】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0111】
【化22】

【0112】
第3表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0113】
【化23】

【0114】
【表10】

*:「−」=遊離体、 1=HCl
【0115】
第4表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0116】
【化24】

【0117】
【表11】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0118】
第5表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0119】
【表12】

【0120】
第6表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0121】
【表13】

【0122】
第6表のつづき
【0123】
【表14】

【0124】
第7表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0125】
【化25】

【0126】
【表15】

*:「−」=遊離体、 1=HCl、 5=4/3 CF3COOH 、 6=3/2 HCl
【0127】
【化26】

【0128】
第8表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0129】
【化27】

【0130】
【表16】

*:1=HCl、 7=CF3COOH
【0131】
第9表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0132】
【表17】

【0133】
第1表〜第9表に示すように、P388リンパ性マウス白血病細胞に対する本発明にかかわる化合物のin vitroにおける抗腫瘍活性(IC50)は、優れている。一方、第9表に示すように、市販抗菌剤たるシプロフロキサシンならびにエノキサシンは、実質的に抗腫瘍活性をもたない。
【0134】
試験例 2:ヒト癌細胞に対するin vitroにおける抗腫瘍活性
【0135】
500 〜2000個のヒト癌細胞を含む培養液の0.1 mlずつを96穴プレ−トの各穴に加え、37℃、5%炭酸ガス条件下で約20時間培養した。培養後、所定濃度の試験化合物の溶液を添加し、更に72時間培養した。培養後、MTT(5mg/ml)溶液の0.01mlずつを各穴に添加し、更に4時間培養した。培養液の上清を吸引除去し、ついで0.1 mlのジメチルスルホキシドを各穴に加えて形成されているフォルマザンを溶解し、更に0.1 mlのジメチルスルホキシドを加えた。この溶液について、試験例1と同様にして50%増殖抑制濃度(IC50:μg/ml)を算出し、つぎの第10表に示す結果を得た。
【0136】
【表18】

表中の数字はIC50(μg/ml)を示す。
【0137】
【表19】

表中の数字はIC50(μg/ml)を示す。
【0138】
第10表に示すように本発明にかかわる化合物のヒト癌細胞に対するin vitroにおける抗腫瘍活性(IC50)は優れている。特に、本発明にかかわるH系化合物、すなわち6位が非置換体の化合物は、市販抗癌剤たるエトポシド(EP)と同等以上の抗腫瘍活性を示した。
【0139】
試験例 3:P388リンパ性マウス白血病細胞移植マウスにおける延命効果
【0140】
1×106個のP388リンパ性マウス白血病細胞をSLC :BDF1マウス(8〜10週齢,雌,1群7匹)の腹腔内に移植した。試験化合物(薬剤)を0.1 N−NaOHに溶解するか、または0.4 %カルボキシメチルセルロース溶液に懸濁し、これを各投与濃度になるように蒸留水または0.4 %カルボキシメチルセルロース溶液で希釈した。各溶液の0.2 mlを移植の翌日(1日目)と5日目の2回、腹腔内(ip)に投与した。30日間にわたってマウスの生死を観察し、各群の生存日数中央値を求め、下記式により延命率(ILS:%)を算出した。
【0141】
【数1】

【0142】
薬効の判定は米国の国立癌研究所の基準に従って行った。すなわち、延命率が≧75%,++(著効);20〜74%,+(有効);≦19%,−(無効)と判定した。 結果を第11表に示す。
【0143】
【表20】

【0144】
【表21】

【0145】
【表22】

【0146】
【表23】

【0147】
第11表に示すように、P388リンパ性マウス白血病細胞を移植したマウスに対する本発明にかかわる化合物による延命効果は優れている。
【0148】
試験例 4:コロン26マウス腫瘍細胞移植マウスにおける腫瘍増殖抑制効果
【0149】
SLC :CDF1雌性マウス(7〜9週齢,1群7匹)の腹部皮内にコロン26マウス腫瘍細胞の2%ブライ(brei) を0.1 ml移植した。試験化合物(薬剤)を0.1 N−NaOHで溶解し、これを各投与濃度になるように蒸留水で希釈した。各溶液の0.2 mlを移植の翌日(1日目)より9日目まで1日1回、腹腔内(ip)に投与した。移植後、21〜22日目の腫瘍径より推定腫瘍重量を求め、下記式より、対照群に対する薬剤投与群の腫瘍増殖抑制率(IR:%)を算出し、第12表の結果を得た。
【0150】
【数2】

【0151】
【表24】

【0152】
【表25】

【0153】
第12表に示すように、コロン26マウス腫瘍細胞を移植したマウスに対する本発明にかかわる化合物の腫瘍増殖抑制効果(IR)は優れている。
【0154】
以下の試験例5〜9は、ヒト癌細胞をヌードマウスに移植し、これにNaOHを含む水溶液で溶解した試験化合物を投与し、癌細胞増殖抑制の程度の強さを観察したものである。
【0155】
以下の試験例5〜9の結果は第1図〜第5図に示されており、そこには試験例4で説明した腫瘍増殖抑制率(IR)の経日変化が示されている。また、各図には各化合物の投与量(mg/kg/day)および観察最終日での腫瘍増殖抑制率も示されている。
【0156】
ここで説明の便宜上、試験化合物のヌードマウスへの投与スケジュールについて述べる。ヌードマウスにヒト癌細胞を移植した日からx日後に試験化合物をy日間投与〔腹腔内投与(ip)〕し、その後、z日間投薬を中止(休薬) し、その後、再び試験化合物をy日間投薬したとき、投薬(y日間)および休薬(z日間)のサイクルを「クール(course)」と名付けた。この場合の投薬スケジュールは次の記号により表されるものとする。
【0157】
〔(x)(y)(z)(クール)(ip)〕
【0158】
つぎに例を挙げてこの記号について説明する。但し、矢印は投薬日を示す。
【0159】
〔例〕 移植後25日目に1回投薬(ip)し、その後6日間の休薬期間をもうけた後、再度1回投薬する。これを5回繰り返す。
【0160】
【表26】

【0161】
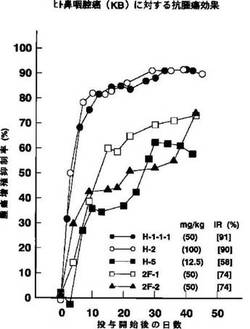
試験例 5:ヒト鼻咽腔癌細胞移植ヌードマウスに対する抗腫瘍効果
【0162】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(9〜14週齢、1群5〜7匹)。
使用癌細胞 :ヒト鼻咽腔癌KB。
癌細胞の移植:2 〜2.5 ×106 個の癌細胞をマウスの腹部皮内に移植。
投薬スケシ゛ュール :〔(5)(1)(6)(6 クール)(ip)]。
結 果:第1図。
【0163】
試験例 6:ヒト乳癌細胞移植ヌードマウスに対する抗腫瘍効果
【0164】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(7〜9週齢、1群5〜7匹)。
使用癌細胞 :ヒト乳癌MX−1。
癌細胞の移植:2mm3 の癌組織片をマウスの背部皮下に移植。
投薬スケシ゛ュール :〔(15 〜23)(1)(6)(6 クール)(ip)]。
結 果:第2図。
【0165】
試験例 7:ヒト結腸癌細胞移植ヌードマウスに対する抗腫瘍効果
【0166】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(9週齢、1群6匹)。
使用癌細胞 :ヒト結腸癌WiDr。
癌細胞の移植:2.5 ×106 個の癌細胞をマウスの腹部皮内に移植。
投薬スケシ゛ュール :[(7)(1)(6)(6クール)(ip)]。
結 果:第3図。
【0167】
試験例 8:ヒト黒色腫移植ヌードマウスに対する抗腫瘍効果
【0168】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(8〜15週齢、1群6〜7匹)。
使用癌細胞 :黒色腫HMV−2。
癌細胞の移植:2.5 〜4.4 ×106 個の癌細胞をマウスの腹部皮内に移植。
投薬スケシ゛ュール :[(8〜10)(1)(6)(9 クール)(ip)]。
結 果:第4図。
【0169】
試験例 9:ヒト肺癌移植ヌードマウスに対する抗腫瘍効果
【0170】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(13週齢、1群6匹)。
使用癌細胞 :ヒト肺癌LX−1。
癌細胞の移植:2mm3 の癌組織片をマウスの背部皮下に移植。
投薬スケシ゛ュール :[(19〜26)(1)(6)(5 〜6 クール)(ip)]。
結 果:第5図。
【0171】
以上の第1図〜第5図に示すように本発明にかかわる化合物は、ヌードマウスに移植したヒト癌細胞の増殖を顕著に抑制した。
【0172】
試験例 10:急性毒性
【0173】
マウスに所定濃度の試験液を投与(0.1ml/体重10g) し、投与後14日目におけるマウスの死亡率からLD50値を算出し、次表の結果を得た。なお、次表において、H系化合物については雌性BALB/c CrSlcマウス( 1群5〜10匹、10週齢)に対する毒性を、またF系化合物については雌性JCL:ICRマウス(1群5〜10匹)に対する毒性をみた。
【0174】
【表27】

【0175】
第13表に示すように、本発明にかかわる化合物の急性毒性は、市販抗癌剤たるエトポシド(EP)と同程度である。
【0176】
以上の試験結果に示すとおり、本発明にかかわる化合物は、リンパ性白血病腫瘍の如き非固形腫瘍のみならず、例えば肺、乳、胃、子宮、皮膚、腸、膀胱、鼻咽などの各組織に発生する各種の固形腫瘍に対して顕著な抗腫瘍活性を示す。また、本発明にかかわる化合物の安全性も高い。従って、本発明にかかわる化合物はヒト腫瘍の治療剤または予防剤として有用である。
【0177】
本発明にかかわる化合物の投与量は、化合物の腫瘍抑制作用量であり、その薬力学的特性,投与方法,症状・年齢,処置形式(予防又は治療)などにより異なる。通常、1日につき、体重1kg当り約0.4 mg〜約20mg、好ましくは約1mg〜約10mg、特に好ましくは3〜6mgである。例えば、体重約50kgの患者には、1日当り合計約20mg〜約1g,好ましくは50mg〜500mg、特に好ましくは150mg〜300mgの活性成分が投与される。1日に2〜4回に分割投与してもよい。投与経路は経口、非経口のいずれでもよいが、非経口投与が推奨される。
【0178】
本発明にかかわる化合物は、製剤の形で投与されるのが一般的である。これらの製剤は、本発明にかかわる化合物と製剤担体とを配合することにより調製できる。例えば、非経口投与製剤たる液剤における製剤担体としては溶剤が必須の成分であり、このほか等張化剤、可溶化剤、無痛化剤、pH調節剤、緩衝剤、保存剤などの補助成分が、適宜、配合される。
【0179】
溶剤としては、水が一般的に用いられ、プロピレングリコールの如き有機溶媒または水と有機溶媒との混合物も用いられる。
【0180】
等張化剤としてはソルビットやマンニットの如き糖類、塩化ナトリウムなどが挙げられ、糖類が好適である。
【0181】
pH調節剤としては水酸化ナトリウムの如き塩基または塩酸やリン酸の如き酸が挙げられる。
【0182】
可溶化剤としてはポリソルベート80やプルロニックF68の如き界面活性剤、または、乳酸,メタンスルホン酸などの本発明にかかわる化合物と酸付加塩を形成しうる有機酸などが挙げられる。
【0183】
無痛化剤としては塩酸リドカインや塩酸プロカインなどが、保存剤としてはベンジルアルコールなどが、安定化剤としてはアスコルビン酸の如き抗酸化剤が、緩衝剤としてはリン酸、クエン酸、乳酸などの酸の塩などがそれぞれ挙げられる。
【0184】
注射剤や輸液剤の如き液剤は本発明にかかわる化合物を溶剤に溶解または懸濁、好ましくは溶解し、所望により溶解もしくは懸濁の前もしくは後にその他の補助成分を配合することにより調製できる。凍結乾燥製剤は、これらの液剤を凍結乾燥することにより調製でき、投与するとき溶剤で再溶解または再懸濁される。
【0185】
また、錠剤やカプセル剤、顆粒剤、細粒剤、散剤の如き固形製剤における担体としては、本発明化合物と反応せず、当分野で使用されているものならばいずれでもよいが、例えば、デンプン,マンニット,結晶セルロース,カルボキシメチルセルロースなどが使用される。
【0186】
なお、これらの製剤には、本発明にかかわる化合物とは別に、治療上有効な他の医薬成分を更に含有していてもよい。
[製造方法]
【0187】
つぎに本発明にかかわる化合物の製造方法について説明する。本発明にかかわる化合物は、基本的には、抗菌性ピリドンカルボン酸の製造方法とほぼ同様な方法により製造できる。以下には、代表的な製造方法である7位置換法による製造方法を説明する。その他の製造方法については、後記製造例において詳細に説明する。
【0188】
7位がN−C結合、S−C結合またはO−C結合により母核と結合している本発明にかかわる化合物は、次の一般式(II)
【0189】
【化28】

【0190】
(式中、Lは脱離しうる基であり、----、R1 、R2 、R3 、R4 、R5 およびXは前掲と同じものを意味する。)で表される化合物またはこれらの塩と、置換基R6 に対応するアミン類、チオール類またはアルコール類とを反応させることにより製造することができる。
【0191】
式(II)の脱離しうる基(L)は、前記アミン類などと置換して脱離し得るものならばいずれでもよく、例えば、ハロゲン原子、低級アルコキシ基、低級アルキルチオ基、低級アルキルスルフィニル基、低級アルキルスルホニル基、アリルスルホニル基、低級アルキルスルホニルオキシ基、アリルスルホニルオキシ基などが挙げられ、特にフッ素原子や塩素原子の如きハロゲン原子が好適である。
【0192】
また、一方の原料たるアミン類は、先に説明した置換基R6 に含まれるmが0である(a) 群の単環性アミノ基、(b) 群の二環性アミノ基、iが0である(d) 群のアミノ基などに対応するものがその例として挙げられる。チオール類やアルコール類としては、置換基R6 に含まれるR6c5 がSやOでありhが1である(c) 群やR6d1 がSでありiが1である(d) 群に含まれる基に対応するものが例示される。
【0193】
化合物(II)とアミン類などとの反応は、無溶媒下または適当な溶媒中、好ましくは塩基の存在下、10〜150 ℃の温度範囲で実施することができる。溶媒としては、アセトニトリルや水, エタノール, ピリジン, ジメチルスルホキシド, 1−メチル−2−ピロリドンなどが使用される。塩基は酸受容体として機能するものであり、例えば、トリエチルアミン, 1,8−ジアザビシクロ〔5.4.0 〕−7−ウンデセンまたは炭酸ナトリウムや炭酸水素ナトリウムなどの炭酸塩、水素化ナトリウム等が使用される。アミン類を使用する時は、これを過剰に用いて酸受容体としての役割を兼ねそなえさせることもできる。
【0194】
なお、原料として使用される化合物(II)も新規であり、例えば、後記製造例により製造することができる。
【0195】
本法により得られる本発明にかかわる化合物がエステル体である場合、そのエステル部分を常法により加水分解することによりカルボン酸体に変換することができる。また、逆にカルボン酸部分を常法によりエステル化したり、またはカルボキシル基に変換しうる基に導くこともできる。更に、保護されたアミノ基が存在するときは、常法により、該保護基を脱離することもできる。
【0196】
このようにして製造される本発明にかかわる化合物は、常法に従って、単離、精製される。単離・精製条件によって、塩の形、遊離カルボン酸や遊離アミンの形で得られるが、これらは、目的に応じて相互に変換され、所望の化合物が製造できる。
【0197】
化合物がラセミ体であるときは、必要なら、公知の方法を適用することにより、それぞれの光学異性体に分離することができる。化合物の立体異性体(シス型−トランス型、R体−S体)や光学活性体(+体や−体)は、必要なら、通常の方法、例えば、分別結晶法やクロマトグラフィー法などにより、互いに分離することができる。
【実施例】
【0198】
つぎに実施例を挙げて本発明にかかわる化合物の製造方法について詳細に説明する。なお、以下において、シリーズAの実施例には中間体(II)の製造方法を、シリーズBの実施例には原料アミン類の製造方法を、シリーズCの実施例には目的物(I) の製造方法を、シリーズDの実施例には製剤の製造方法を、それぞれ具体的に説明する。
【0199】
シリーズA:中間体(II)の製造法
【0200】
実施例A−1:−−中間体(II)の製造−−:
7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0201】
(1) 2,6−ジクロロピリジン(20g)をテトラヒドロフラン(200ml)に溶解し、アルゴン気流下、−78℃でn−ブチルリチウム(1.6M)のn−ヘキサン溶液(84.5ml)を30分で滴下した。同温度で1時間攪拌後、大過剰の二酸化炭素(固体)を加えた。1時間攪拌後、−10℃まで昇温させ、水、塩酸を順次加え、pH1〜2となし、酢酸エチルで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し乾固させた。得られた固体に塩化チオニル(40ml)を加え、3時間加熱還流した。過剰の塩化チオニルを減圧留去し、粗生成物を減圧蒸留して、2,6−ジクロロニコチン酸クロリド(19.8g)を得た。
【0202】
沸点:97−99℃/1mmHg;
IR(neat)cm-1:1784
【0203】
(2) 金属マグネシウム(5.36g)、マロン酸ジエチルエステル(35.4g)およびエタノール(27ml)から誘導されたエトキシマグネシウムマロン酸ジエチルエステルをテトラヒドロフラン(35ml)およびトルエン(140 ml)からなる混合溶液に溶解する。この溶液を氷冷し、攪拌下、これに前項で得た酸クロリド(44.9g)を含むテトラヒドロフラン(19ml)およびトルエン(32ml)からなる混液を滴下した。滴下終了後、室温で一夜攪拌した。減圧濃縮し、残渣に塩酸水を加え、酢酸エチルで抽出した。これを無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して油状物を得た。これに水(190 ml)およびp−トルエンスルホン酸(0.1 g)を加えて2時間還流した。冷却後、クロロホルムで抽出し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して油状物を得た。粗生成物を減圧蒸留して2,6−ジクロロニコチノイル酢酸エチルエステル(45.2g)を得た。沸点:135−140℃/2mmHg
【0204】
(3) 前項(2)で得た化合物(44.9g)、無水酢酸(43.8g)およびオルトギ酸エチル(37.7g)からなる混合物を1時間還流した。減圧乾固し、氷冷下、ジイソプロピルエーテル(500 ml)および2−アミノチアゾール(20g)を加え、室温で5時間攪拌した。析出結晶を濾取して2−(2,6−ジクロロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(52.8g)を得た。
【0205】
融点:119 −122 ℃(ジイソプロピルエーテルから再結晶);
IR(KBr)cm-1:1700
【0206】
(4) 前項(3)で得た化合物(51.7g)をジオキサン(310 ml)に溶解し、炭酸カリウム(21.4g)を加えて、60℃で1時間攪拌した。氷水を加えたのち10%塩酸水で中和し、析出する結晶を濾取した。クロロホルムおよびジイソプロピルエーテルの混液から再結晶して7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(44.6g)を得た。
【0207】
融点:176−177℃;
IR(KBr)cm-1:1724;
NMR(CDCl3 )δ:1.43(t,3H,J=6.5 Hz), 4.45(q,2H, J=6.5 Hz), 7.38(d,1H,J=3.5 Hz),7.52(d,1H,J=8.5 Hz), 7.75(d,1H,J=3.5 Hz), 8.78(d,1H,J=8.5 Hz), 10.00 (s,1H)
【0208】
実施例A−2:−−中間体(II)の製造−−:
7−クロロ−1−(4−フルオロ−2−チアゾリル)−1,4−ジヒドロ−4−オキソ−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0209】
実施例1(4)で得たエステル(250 mg)、N−フルオロ−2,6−ジクロロピリジニウムテトラフルオロボレート(240 mg)および1,2−ジクロロエタン(10ml)からなる混合物を2日間加熱還流した。反応液に水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、酢酸エチルから再結晶して標記化合物(40mg)を得た。
【0210】
融点:174−175℃;
IR(KBr)cm-1:1700;
NMR(CDCl3 )δ:1.42(t,3H,J=6.5 Hz), 4.45(q,2H, J=6.5 Hz), 7.33(d,1H,J=3.5 Hz),7.51(d,1H,J=8.5 Hz), 8.78(d,1H,J=8.5 Hz), 9.85(s,1H)
【0211】
実施例A−3:−−中間体(II)の製造−−:
5,7−ジクロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0212】
(1) 4−アミノ−2,6−ジクロロピリジン(5.5 g)、塩化第一銅(4.4g)および濃塩酸(50ml)の混合物に、氷−塩冷却下、亜硝酸ナトリウム(3.5 g)を少しずつ加えた。同温度で1時間、室温で1.5 時間攪拌後、水を加えてクロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して2,4,6−トリクロロピリジン(5.5 g)を得た。
【0213】
IR(neat)cm-1:1563, 1357, 1155, 851, 823;
NMR(CDCl3 )δ:7.31(s,2H)
【0214】
(2) 前項(1)で得た化合物(5.5 g)とテトラヒドロフラン(55ml)からなる混合物に−78℃でn−ブチルリチウム(1.6 M)のn−ヘキサン溶液(20ml)を滴下した。同温度で1時間攪拌後、大過剰の二酸化炭素(固体)を加えた。1時間攪拌後、0℃まで昇温させ、塩酸水を加えて酸性となし、酢酸エチルで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して残渣にジイソプロピルエーテルを加え、結晶を濾取して2,4,6−トリクロロニコチン酸(6.5 g)を得た。
【0215】
融点:138−141℃;
IR(KBr)cm-1:1715
【0216】
(3) 前項(2)で得た化合物(6.5 g)と塩化チオニル(25ml)からなる混合物を3時間還流した。過剰の塩化チオニルを減圧留去し、粗生成物を減圧蒸留して2,4,6−トリクロロニコチン酸クロリド(6.6 g)を得た。
【0217】
沸点:93−95℃/1mmHg;
IR(neat)cm-1:1791
【0218】
(4) マロン酸モノエチルエステル(3.6 g)とテトラヒドロフラン(30ml)からなる混合物に0℃で臭化メチルマグネシウム(3M)のエーテル溶液(19ml)を滴下した。室温で1時間攪拌後、前項(3)で得た化合物(6.6 g)とテトラヒドロフラン(30ml)の混合物を滴下し、60℃で1.5 時間加熱した。溶媒を減圧留去して残渣に塩酸水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、粗生成物を減圧蒸留して2,4,6−トリクロロニコチノイル酢酸エチルエステル(4.8 g)を得た。
【0219】
沸点:160−162℃/2mmHg;
IR(neat)cm-1:1746
【0220】
(5) 前項(4)で得た化合物(4.8 g)、無水酢酸(4.2 g)およびオルトギ酸エチル(3.6 g)からなる混合物を1.5 時間還流した。減圧乾固し、氷冷下、ジイソプロピルエーテル(100 ml)および2−アミノチアゾール(1.6 g)を加え、室温で3時間攪拌した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、酢酸エチルから再結晶して2−(2,4,6−トリクロロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(4.0 g)を得た。
【0221】
融点:126−127℃;
IR(KBr)cm-1:1691
【0222】
(6) 前項(5)で得た化合物(4.0 g)、炭酸カリウム(1.5 g)および酢酸エチル(40ml)からなる混合物を60℃で1時間加熱した。溶媒を減圧留去して残渣に水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、クロロホルムから再結晶して5,7−ジクロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(2.5 g)を得た。
【0223】
融点:226−227℃;
IR(KBr)cm-1:1737,1692
【0224】
(7) 前項(6)で得たエステル体(1.8 g)と20%塩酸水60mlの混合物を5時間加熱還流し、冷後、水を加えて析出結晶を濾取し、水洗して標記の5,7−ジクロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(1.4 g)を得た。
【0225】
融点:264−266℃;
IR(KBr)cm-1:1729
【0226】
実施例A−4:−−中間体(II)の製造−−:
5−アミノ−7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0227】
(1) 実施例A−3(6)で得た化合物(500 mg)、ベンジルアミン(140mg)、トリエチルアミン(280 mg)およびトルエン(15ml)からなる混合物を30分間還流した。溶媒を減圧留去して残渣に水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣を酢酸エチルから再結晶して5−ベンジルアミノ−7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(510 mg)を得た。
【0228】
融点:141−143℃;
IR(KBr)cm-1:1733;
NMR(CDCl3 )δ:1.42(t,3H,J=7Hz), 4.41(q,2H,J=7Hz), 4.49(d,2H,J=6.5 Hz),6.47(s,1H), 7.31(d,1H,J=3.5 Hz), 7.32−7.40(m,5H), 7.70(d,1H,J=3.5 Hz), 9.87(s,1H), 11.2−11.7(m,1H)
【0229】
(2) 前項(1)で得たエステル(1.0 g)、濃硫酸(2ml)および酢酸(8ml)からなる混合物を110 ℃で5 時間攪拌し、冷後、水8mlを加え、110℃で1 時間攪拌した。析出結晶を濾取・水洗して740 mgの標記化合物を得た。
【0230】
融点:264−265℃;
IR(KBr)cm-1:1727
【0231】
実施例A−5:−−中間体(II)の製造−−:
7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−5−トリフルオロメチル−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0232】
(1) 2,6−ジクロロ−4−トリフルオロメチルピリジン(5g)とテトラヒドロフラン(50ml)からなる混合物を−78℃に冷却し、n−ブチルリチウム(1.6 M)のn−ヘキサン溶液(16ml)を滴下し、30分間攪拌した。これに大過剰の二酸化炭素(固体)を加え、1時間攪拌した。0℃まで昇温し、酢酸エチルと希塩酸を加えて抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣に塩化チオニル(20ml)を加え、6時間加熱還流した。過剰の塩化チオニルを減圧留去し、残渣を減圧蒸留して2,6−ジクロロ−4−トリフルオロメチルニコチン酸クロリド(3.8 g)を得た。
【0233】
沸点:77−78℃/2mmHg;
IR(neat)cm-1:1797
【0234】
(2) マグネシウム(0.36g)とエタノール(1.5 ml)からなる混合物に1滴の四塩化炭素を加え、マロン酸ジエチル(2.4 g)、エタノール(1.5 ml)およびトルエン(10ml)からなる混合物を滴下し、2時間攪拌した。さらに氷冷下、前項(1)で得た化合物(3.8 g)とテトラヒドロフラン(10ml)の混合物を滴下し、室温で3時間攪拌した。これに酢酸エチルと希塩酸水を加えて抽出し、有機層を水洗し、硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣に水(20ml)とp−トルエンスルホン酸(50mg)を加え、3時間加熱還流した。これにクロロホルムと水を加えて抽出し、有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去して2,6−ジクロロ−4−トリフルオロメチルニコチノイル酢酸エチルエステル(0.9 g)を得た。
【0235】
IR(neat)cm-1:1744,1721;
MS(m/z):330(MH+ )
【0236】
(3) 前項(2)で得た化合物(0.9 g)、オルトギ酸エチル(0.6 g)および無水酢酸(0.7 g)からなる混合物を140 ℃で1.5 時間加熱還流し、減圧乾固した。残渣にジイソプロピルエーテル(20ml)を加え、氷冷下、2−アミノチアゾール(0.3 g)を加え、室温で3時間攪拌後、溶媒を留去した。これにクロロホルムと水を加えて抽出し、有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して2−(2,6−ジクロロ−4−トリフルオロメチルニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(0.37g)を得た。
【0237】
IR(neat)cm-1:1713;
MS(m/z):440(MH+ )
【0238】
(4) 前項(3)で得た化合物(0.37g)、炭酸カリウム(0.13g)および酢酸エチル(10ml)からなる混合物を15分間加熱還流し、酢酸エチルと水を加えて抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣を酢酸エチルから再結晶して標記の7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−5−トリフルオロメチル−1,8−ナフチリジン−3−カルボン酸エチルエステル(0.27g)を得た。
【0239】
融点:184−185℃;
IR(KBr)cm-1:1736,1703
【0240】
実施例A−6:−−中間体(II)の製造−−:
7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0241】
(1) 特開昭61−152682号公報 (Ref.1) に記載の方法に準じて、2,6−ジクロロ−5−フルオロニコチノイル酢酸エチルエステル9.8 gをオルトギ酸エチルと無水酢酸で処理して、2−(2,6−ジクロロ−5−フルオロニコチノイル)−3−エトキシアクリル酸エチルエステルとし、次いで、この化合物に、エタノ−ル中、室温下で2−アミノチアゾ−ルとトリエチルアミンを反応させて、2−(2,6−ジクロロ−5−フルオロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル12.3gを得た。融点:125−126℃
【0242】
(2)上記化合物12.3gを無水ジオキサン中でカリウムt−ブトキシドと反応させて、7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル7.1gを得た。
融点:182−184℃
【0243】
実施例A−7:−−中間体(II)の製造−−:
5,8−ジヒドロ−2−メタンスルホニル−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステル
【0244】
(1) マロン酸モノエチルエステル(12.3g)のテトラヒドロフラン溶液(80ml)を氷冷し、臭化メチルマグネシウム(3M)のエーテル溶液(64ml)を滴下し、20分間攪拌後、4−クロロ−2−メチルチオピリミジン−5−カルボニルクロリド(8.6 g)のテトラヒドロフラン溶液(100 ml)を滴下し、室温で2時間攪拌した。反応液を氷水に注ぎ、濃塩酸でpH5〜6にして、酢酸エチルで抽出した。硫酸ナトリウで乾燥後、溶媒を減圧留去し、シリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して3−(4−クロロ−2−メチルチオピリミジン−5−イル)−3−オキソプロピオン酸エチルエステル(8.0 g)を得た。
【0245】
IR(neat)cm-1:1743;
MS(m/z):275(MH+ )
【0246】
(2) 前項(1)で得た化合物(7.95g)、オルトギ酸エチル(6.80g)および無水酢酸(7.76g)からなる混合物を130 ℃で1時間加熱還流し、減圧濃縮した。氷冷下、ジイソプロピルエーテル(100 ml)および2−アミノチアゾール(3.28g)を加え、室温で一夜攪拌して析出結晶を濾取し、ジイソプロピルエーテルで洗浄した。これを1,4−ジオキサン(70ml)に溶解し、氷冷下、炭酸カリウム(2.72g)を加え、室温で5時間攪拌した。これを氷冷し、氷水(200 ml)を加え、10%塩酸水で中和した。析出結晶を濾取し、水、1,4−ジオキサンおよびジイソプロピルエーテルで順次、洗浄して5,8−ジヒドロ−2−メチルチオ−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステル(6.0 g)を得た。
【0247】
融点:183−184℃;
IR(KBr)cm-1:1736
【0248】
(3) 前項(2)で得た化合物(5.99g)の塩化メチレン溶液(450 ml)を氷冷し、80%のm−クロロ過安息香酸(9.30g)を少量ずつ加え、室温で一夜攪拌した。チオ硫酸ナトリウム水溶液、炭酸水素ナトリウム水溶液および飽和食塩水で順次洗浄し、硫酸ナトリウムで乾燥後、溶媒を減圧留去し、酢酸エチルとジイソプロピルエーテルの混液から再結晶して標記の5,8−ジヒドロ−2−メタンスルホニル−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステル(4.48g)を得た。
【0249】
融点:185−187℃;
IR(KBr)cm-1:1741
【0250】
実施例A−8:−−中間体(II) の製造−−:
実施例A−1からA−6までに記載の方法またはこれに準じる方法により第14表に示す中間体(II)を得た。
【0251】
第14表 中間体(II)
【化29】

【0252】
【表28】

【0253】
【表29】

【0254】
【化30】

【0255】
シリーズB:原料アミン類の製造方法
【0256】
実施例B−1:−−アミン類の製造−−:
トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メチルピロリジン
【0257】
(1) トランス−3−アミノ−1−ベンジル−4−メチルピロリジン(19g)を塩化メチレン(200 ml)に溶解し、二炭酸ジ−t−ブチル(22.9g)の塩化メチレン(20ml)溶液を水冷下加えた。室温で1時間攪拌後、反応液を減圧濃縮して、トランス−1−ベンジル−3−(t−ブトキシカルボニルアミノ)−4−メチルピロリジン(28.2g)を得た。
【0258】
融点:138 −140 ℃(酢酸エチル−n−ヘキサンから再結晶);
IR(KBr)cm-1:3198,1706;
MS(m/z):291(MH+ )
【0259】
(2) 水素化ビス(2−メトキシエトキシ)アルミニウムナトリウムの70%トルエン溶液(40ml)をトルエン(150 ml)で希釈し、前項(1)で得た化合物(10g)を氷冷下、少しずつ加えた。反応液を1時間加熱還流し、氷冷後、過剰の試薬を水で分解した。不溶物を濾別し、濾液を無水硫酸マグネシウムで乾燥後、溶媒を減圧留去した。得られた残渣を塩化メチレン(100 ml)に溶解し、これに二炭酸ジ−t−ブチル(7.5 g)の塩化メチレン(10ml)溶液を氷冷下、加えた。室温で3.5 時間攪拌後、反応液を減圧濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 n−ヘキサン:酢酸エチル=5:1)で精製してトランス−1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メチルピロリジン(9.9 g)を得た。
【0260】
IR(neat)cm-1:1694;
MS(m/z):305(MH+ )
【0261】
(3) 前項(2)で得た化合物(1.52g)をエタノール(50ml)に溶解し、10%パラジウム炭素(200 mg)を加えて、50℃で理論量の水素を吸収させた。触媒を濾去後、溶媒を減圧留去して目的のトランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メチルピロリジン(950 mg)を得た。
【0262】
IR(neat)cm-1:3337,1685;
MS(m/z):215(MH+ )
【0263】
実施例B−2:−−アミン類の製造−−:
(+)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン
【0264】
(1) 特開平2−69474 号公報に記載のトランス−3−アミノ−1−ベンジル−4−メトキシピロリジン(ラセミ体、22.4g)と19.6gのL−酒石酸をメタノール(350 ml)に溶解し、室温で7時間放置した。析出したL−酒石酸塩を濾取し、メタノールと水にて再結晶して下記物性のトランス−3−アミノ−1−ベンジル−4−メトキシピロリジンL−酒石酸塩(14.1g)を得た。
【0265】
次いで、総ての母液を合わせ、溶媒を減圧下留去し、飽和食塩水を加え、炭酸カリウムにて塩基性となし、酢酸エチルで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣とD−酒石酸(6.73g)をメタノール(180 ml)に溶解し、室温で7時間放置した。析出したD−酒石酸塩を濾取し、メタノールと水にて再結晶して下記物性のトランス−3−アミノ−1−ベンジル−4−メトキシピロリジンD−酒石酸塩(9.9 g)を得た。
【0266】
L−酒石酸塩;
融点:206−208℃(分解);
〔α〕D 29 +33.0°(c=1.003 ,水);
元素分析値(%):C12H18N2O ・3/2 C4H6O6として;
計算値 C,50.11 ;H,6.31;N,6.49;
実測値 C,49.85 ;H,6.26;N,6.27;
【0267】
D−酒石酸塩;
融点:207−209℃(分解);
〔α〕D 29 −33.4°(c=1.020 ,水);
元素分析値(%):C12H18N2O ・3/2 C4H6O6として;
計算値 C,50.11 ;H,6.31;N,6.49;
実測値 C,50.35 ;H,6.32;N,6.47;
【0268】
(2) 前項(1)で得たL−酒石酸塩(3.65g)に飽和食塩水を加え、炭酸カリウムにて中和し、酢酸エチルで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して(+)−トランス−3−アミノ−1−ベンジル−4−メトキシピロリジン(1.23g)を得た。
〔α〕D 27 +32.2°(c=1.053 ,メタノール)
【0269】
(3) 前項(2)で得た化合物(5.74g)をメタノール(65ml)に溶解し、氷冷下、二炭酸ジ−t−ブチル(7.29g)を加えた。同温度で30分間、室温で4時間攪拌した。溶媒を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製して、(+)−トランス−1−ベンジル−3−(t−ブトキシカルボニルアミノ)−4−メトキシピロリジン(8.55g)を得た。
【0270】
融点:44−45℃;
〔α〕D 29 +9.5 °(c=1.044 ,メタノール)
【0271】
(4) 水素化リチウムアルミニウム(3.43g)を無水テトラヒドロフラン(150 ml)に懸濁させ、前項(3)で得た化合物(8.4 g)の無水テトラヒドロフラン(50ml)溶液を滴下し、室温で1時間攪拌した。さらに5時間加熱還流した後、氷冷下、過剰の試薬を水で分解し、不溶物を濾去した。濾液を酢酸エチルで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣を塩化メチレン(180 ml)に溶解し、氷冷下、二炭酸ジ−t−ブチル(6.3 g)を加えた。同温度で30分間、室温で2時間攪拌後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製して(+)−トランス−1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(8.26g)を得た。
〔α〕D 29 +9.9 °(c=1.002 ,メタノール)
【0272】
(5) 実施例B−1(3)項と同様にして、前項(4)で得た化合物(8.15g)から目的とする(+)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(5.59g)を得た。
【0273】
〔α〕D 29 +12.5°(c=1.051 ,メタノール);
IR(neat)cm-1:3318,1693;
MS(m/z):231(MH+ )
【0274】
実施例B−3:−−アミン類の製造−−:
(−)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン
【0275】
(1) 実施例B−2(2)項と同様にして、実施例B−2(1)で得たD−酒石酸塩(2.57g)から(−)−トランス−3−アミノ−1−ベンジル−4−メトキシピロリジン(1.01g)を得た。
〔α〕D 27 −32.7°(c=1.016 ,メタノール)
【0276】
(2) 実施例B−2(3)項と同様にして、前項で得た化合物(3.03g)から(−)−トランス−1−ベンジル−3−(t−ブトキシカルボニルアミノ)−4−メトキシピロリジン(4.5 g)を得た。
【0277】
融点:44−45℃;
〔α〕D 29 −9.5 °(c=1.080 ,メタノール)
【0278】
(3) 実施例B−2(4)項と同様にして、前項で得た化合物(4.25g)から(−)−トランス−1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(4.25g)を得た。
〔α〕D 29 −10.1°(c=1.054 ,メタノール)
【0279】
(4) 実施例B−2(5)項と同様にして、前項で得た化合物(4.25g)から目的とする(−)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(2.81g)を得た。
【0280】
〔α〕D 29 −12.2°(c=1.003 ,メタノール);
IR(neat)cm-1:3318,1693;
MS(m/z):231(MH+ )
【0281】
実施例B−4:−−アミン類の製造−−:
3−(N−t−ブトキシカルボニルメチルアミノ)−3−メチルピロリジン
【0282】
(1) 実施例B−1(1)と同様にして、3−アミノ−1−ベンジル−3−メチルピロリジン(20g)から1−ベンジル−3−(N−t−ブトキシカルボニルアミノ)−3−メチルピロリジン(28.3g)を得た。
【0283】
IR(neat)cm-1:3356、1716、1697;
MS(m/z):291(MH+ )
【0284】
(2) 実施例B−1(2)と同様にして、前項(1)で得た化合物(11.4g)から1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−3−メチルピロリジン(7.5 g)を得た。
【0285】
IR(neat)cm-1:1697 ;
MS(m/z):305(MH+ )
【0286】
(3) 実施例B−1(3)と同様にして、前項(2)で得た化合物(7.5 g)から目的の3−(N−t−ブトキシカルボニルメチルアミノ)−3−メチルピロリジン(5.5 g)を得た。
【0287】
IR(neat)cm-1:3337、 1682;
MS(m/z):215(MH+ )
【0288】
実施例 B−5:−−アミン類の製造−−:
(1R* ,4R* ,5S* )−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン
【0289】
(1) 2−エトキシカルボニルシクロペンタノン97g,ベンジルアミン71.2mlおよびp−トルエンスルホン酸 5.9gにトルエン 500mlを加え、Dean−Stark 装置で脱水しながら2時間加熱還流した。反応液を減圧乾固し、残渣をシリカゲルカラムクロマトグラフィー(溶離液:n−ヘキサン)で精製して、2−ベンジルアミノ−1−シクロペンテン−1−カルボン酸エチル 119.6gを得た。
【0290】
融点:31−32℃;
IR(neat)cm-1:3328,2951,1656,1606;
MS(m/z): 246(MH+ );
NMR(CDCl3)δ:1.25(t,3H,J=7.5 Hz),1.80(m,2H),2.55(t,4H,J=7.5 Hz),4.15(q,2H,J=7.5 Hz),4.40(d,2H,J=6.5Hz ),7.20−7.40(m,5H),7.75(br s,1H)
【0291】
(2) 前項で得られた化合物60gをエタノール 500mlに溶解し、二酸化白金1gを加えて中圧で接触還元した。触媒を濾去した後、濾液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液:クロロホルム)で精製して、シス−2−ベンジルアミノ−1−シクロペンタンカルボン酸エチル34.0gを得た。
【0292】
IR(neat)cm-1:2955,2871,1727;
MS(m/z): 248(MH+ );
NMR(CDCl3)δ:1.25(t,3H,J=7.5 Hz),1.40−2.10(m,7H),2.95(m,1H),3.30(m,1H),3.80(s,2H),4.15(q,2H,J=7.5 Hz),7.15−7.35(m,5H)
【0293】
(3) 前項で得られた化合物85.6g,ブロモ酢酸エチル46ml,炭酸カリウム57.4gおよびヨウ化カリウム 2.9gに1000mlのジオキサンを加え、18時間加熱還流した。反応液を濾別し、濾液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液:n−ヘキサン)で精製して、シス−2−〔(N−ベンジル)エトキシカルボニルメチルアミノ〕−1−シクロペンタンカルボン酸エチル92.5gを得た。
【0294】
IR(neat)cm-1:2976,2871,1732;
MS(m/z): 334(MH+ );
NMR(CDCl3)δ:1.10−1.30(m,6H),1.50−2.10(m,6H),3.10(m,1H),3.35(s,2H),3.50−3.70(m,1H),3.85−4.30(m,6H),7.15−7.35(m,5H)
【0295】
(4)1000mlのテトラヒドロフランに60%水素化ナトリウム12.2gを懸濁させて、前項で得られた化合物92.5gのテトラヒドロフラン溶液 400mlを加えた。1時間加熱還流した後、反応液を減圧下濃縮し、残渣に1000mlの20%塩酸水を加え、6時間加熱還流した。反応液を中和し、トルエンで抽出した。有機層を無水硫酸ナトリウムで乾燥後、減圧下溶媒を留去し、シス−2−ベンジル−2−アザビシクロ〔3.3.0〕オクタン−4−オン53.7gを得た。
【0296】
IR(neat)cm-1:2952,2866,1751;
MS(m/z): 216(MH+ );
NMR(CDCl3)δ:1.50−2.05(m,6H),2.75(m,1H),2.80(m,1H),3.15(d,1H,J=16Hz),3.42(d,1H,J=13Hz),3.45−3.55(m,1H),4.03(d,1H,J=13Hz),7.20−7.40(m,5H)
【0297】
(5) ヒドロキシルアミン塩酸塩26gを水 500mlに溶解し、前項で得られた化合物53.7gのエタノール溶液 200mlを加えた。更に、20%水酸化ナトリウム水溶液80mlを加え、室温で17時間攪拌した。反応液に酢酸水を加えて、酢酸酸性とし、トルエンで洗浄した。水層をアルカリ性とし、トルエンで抽出した。有機層を無水硫酸ナトリウムで乾燥後、減圧下溶媒を留去し、シス−2−ベンジル−2−アザビシクロ〔3.3.0〕オクタン−4−オンオキシム30.6gを得た。
【0298】
融点:90−91℃IR(KBr)cm-1:3279,2958,1699;
MS(m/z): 231(MH+ );
NMR(CDCl3)δ:1.40−2.10(m,6H),2.90−4.00(m,6H),7.15−7.35(m,5H),7.80(br s,1H)
【0299】
(6) 前項で得られた化合物12gをジオキサン 120mlに溶解し、ラネーニッケル6gを加え、70℃で理論量の水素を添加した。触媒を濾去した後、濾液を減圧下濃縮し、得られた残渣を塩化メチレン 100mlに溶解し、二炭酸ジ−t−ブチル13.6gを加えた。室温で11時間攪拌後、反応液を減圧下濃縮し、得られた残渣に酢酸エチルおよびジイソプロピルエーテルを加え、析出結晶を濾取して(1R*,4R* ,5R* )−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン10.6gを得た。
【0300】
融点: 161−162 ℃;
IR(KBr)cm-1:3353,2950,1678;
MS(m/z): 317(MH+ );
NMR(CDCl3)δ:1.20−1.80(m,6H),1.40(s,9H),2.20(m,1H),3.00−3.20(m,2H),3.35(d,1H,J=13Hz),3.85(d,1H,J=13Hz),3.60−3.80(m,1H),4.55(br s,1H),7.15−7.35(m,5H)
【0301】
上記で得られた母液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液:クロロホルム)で精製して、(1R* ,4S* ,5R*)−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン 3.0gを得た。
【0302】
IR(neat)cm-1:3447,2952,1713;
MS(m/z): 317(MH+ );
NMR(CDCl3)δ:1.20−1.80(m,6H),1.45(s,9H),2.20−2.40(m,1H),2.55−3.00(m,3H),3.10−3.95(m,2H),4.10(m,1H),4.80(br s,1H),7.15−7.35(m,5H)
【0303】
(7) 前項で得られた(1R* ,4R* ,5R* )−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン10.5gをエタノール 150mlに溶解し、5%パラジウム炭素 1.0gを加え、理論量の水素を添加した。触媒を濾去した後、濾液を減圧下濃縮して、目的物 7.1gを得た。
【0304】
融点: 102−103 ℃;
IR(KBr)cm-1:3305,3184,2926,1709;
MS(m/z): 227(MH+ );
NMR(CDCl3)δ:1.40−1.90(m,6H),1.45(s,9H),2.20(m,1H),2.60−3.20(m,2H),3.65(br s,1H),3.75(m,1H),4.70(br s,1H)
【0305】
実施例B−6:−−アミン類の製造−−:
(1R* ,4S* ,5S* )−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン
【0306】
実施例B−5の(6)項で得られた(1R* ,4S* ,5R* )−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン1.58g,5%パラジウム炭素 200mgおよびエタノール20mlを用いて、実施例B−5(7)項と同様に処理して目的物 940mgを得た。
【0307】
融点:85−87℃;
IR(KBr)cm-1:3372,3210,2940,1682;
MS(m/z): 227(MH+ );
NMR(CDCl3)δ:1.40−1.90(m,6H),1.45(s,9H),2.05(br s,1H),2.60−3.10(m,3H),3.70(br s,1H),4.05(m,1H),4.75(br s,1H)
【0308】
実施例B−7:−−アミン類の製造−−:
1−アミノ−3−アザビシクロ〔3.1.1〕ヘプタン
【0309】
(1) 60%水素化ナトリウム1.29gをn−ヘキサンで2回洗浄後、エーテル60mlに懸濁させた。氷冷下エーテル5mlに溶解したマロン酸ジエチル 5.0gを10分間で滴下した。この混合物を室温下30分攪拌したのち氷冷し、エーテル10mlに溶解したベンジルクロロメチルエーテル5.38gを10分間で加えて室温で一夜攪拌し、更に5時間還流した。反応液を氷水に注ぎ酢酸エチルで抽出し、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、ベンジルオキシメチルマロン酸ジエチルの粗生成物 9.0gを得た。
【0310】
これをエーテル50mlに溶解し、氷冷下水素化アルミニウムリチウム2.85gとエーテル 300mlの混合物に滴下した。同温で 1.5時間、更に室温で2時間攪拌した。氷冷下飽和酒石酸ナトリウム水を加え、一夜攪拌した。不溶物を濾別し濾液を硫酸ナトリウムで乾燥させた後、減圧下濃縮した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:エタノール=40:1〜20:1)により精製し、2−ベンジルオキシメチル−1,3−プロパンジオール1.96gを得た。
【0311】
IR(neat)cm-1:3380;
1H−NMR(CDCl3) δ:2.05(m,1H),2.35(br s,2H),3.63(d,2H,J=5.5Hz ),3.81(dd,4H,J=5.5, 5.5Hz),4.52(s,2H),7.25−7.40(m,5H)
【0312】
(2) 前項で得た化合物84.8gとピリジン 360mlからなる混合物を氷−食塩で冷却しながら、塩化p−トルエンスルホニル 206.3gを3回に分けて加え、同温で2時間、室温で一夜攪拌した。反応液を氷水に注ぎ、酢酸エチルで抽出した。希塩酸,水で洗浄したのち硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をシリカゲルクロマトグラフィー(溶離液 クロロホルム:エタノール=30:1)で精製し、2−ベンジルオキシメチル−1,3−ビス(p−トルエンスルホニルオキシ)プロパン 162.3gを得た。
【0313】
IR(neat)cm-1:1598,1361;
1H−NMR(CDCl3) δ:2.33(m,1H),2.44(s,6H),3.41(d,2H,J=6Hz),4.04(m,4H),4.34(s,2H),7.10−7.40(m,9H),7.74(d,4H,J=8Hz)
【0314】
(3) 60%水素化ナトリウム22.8gをn−ヘキサンで2回洗浄後、トルエン 350mlに懸濁させた。氷冷下トルエン 150mlに溶解したマロン酸ジエチル91.1gを25分間で滴下した。この混合物を室温下で40分攪拌した後、トルエン 300mlに溶解した前項で得た化合物 119.6gを加え、 4.5日間還流した。反応液を氷水に注ぎ酢酸エチルで抽出し、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。減圧下溶媒および未反応のマロン酸ジエチルを留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:エタノール=50:1)で精製し、3−ベンジルオキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル66.8gを得た。
【0315】
IR(neat)cm-1:1726,1263;
1H−NMR(CDCl3) δ:1.23(t,3H,J=7Hz),1.25(t,3H,J=7Hz),2.25−2.50(m,2H),2.55−2.80(m,3H),3.44(d,2H,J=6Hz),4.17(q,2H,J=7Hz),4.21(q,2H,J=7Hz),4.50(s,2H),7.20−7.40(m,5H)
【0316】
(4) 前項で得られた化合物66.8gを酢酸エチル 500mlに溶解し、5%パラジウム炭素6.68gを加え、30〜40℃で理論量の水素を添加した。触媒を濾別後、溶媒を留去し、残渣をシリカゲルクロマトグラフィー(溶離液 クロロホルム:エタノール=20:1)で精製し、3−ヒドロキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル45.0gを得た。
【0317】
IR(neat)cm-1:3452,1728,1266;
1H−NMR(CDCl3) δ:1.25(t,3H,J=7Hz),1.27(t,3H,J=7Hz),1.70(br s,1H),2.30−2.50(m,2H),2.50−2.70(m,3H),3.62(d,2H,J=5.5 Hz),4.20(q,2H,J=7Hz),4.23(q,2H,J=7Hz)
【0318】
前項で得られた3−ヒドロキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル45.0gとピリジン 350mlの混合物に氷冷下、塩化p−トルエンスルホニル48.5gを4回に分けて加えた。同温で 5.5時間、室温で13.5時間、30〜40℃で8時間攪拌後、氷水を加え、酢酸エチルで抽出した。飽和重曹水,水,希塩酸および飽和食塩水で順次洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、3−p−トルエンスルホニルオキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステルの粗生成物を得た。
【0319】
上記粗生成物,ベンジルアミン42.2g,炭酸カリウム32.4gおよびジオキサン600 mlの混合物を 4.5日間還流した。反応液に氷水を加えてクロロホルムで抽出し、飽和重曹水、次いで飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液クロロホルム:エタノール=20:1)で精製し、3−ベンジルアミノメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル32.3gを得た。
【0320】
IR(neat)cm-1:3324,2813,1727,1263;
1H−NMR(CDCl3) δ:1.23(t,3H,J=7Hz),1.25(t,3H,J=7Hz),2.15−2.30(m,2H),2.40−2.70(m,3H),2.67(d,2H,J=6Hz),3.76(s,2H),4.17(q,2H,J=7Hz),4.21(q,2H,J=7Hz),7.20−7.40(m,5H)
【0321】
(5) 前項で得られた3−ベンジルアミノメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル32.3g,10%水酸化ナトリウム水溶液 120mlおよびテトラヒドロフラン 120mlからなる混合物を、室温で13.5時間、次いで50〜60℃で6時間攪拌した。減圧下濃縮し、水 100mlと活性炭を加えて濾過した。濾液に室温下、20%塩酸水54.5mlを攪拌しながら加えた。氷冷後結晶を濾取し、水およびエタノールで洗浄して、3−ベンジルアミノメチルシクロブタン−1,1−ジカルボン酸20gを得た。
【0322】
融点 : 224−226 ℃(分解);
IR(KBr)cm-1:3444,1632;
1H−NMR(DMSO−d6 ) δ:2.10−2.26(m,2H),2.30−2.45(m,2H),2.65−2.95(m,1H),3.02(d,2H,J=7Hz),4.11(s,2H),7.35−7.55(m,5H),9.00(br s,2H)
【0323】
(6) 前項で得られた化合物20gとN,N−ジメチルホルムアミド 200mlからなる混合物にカルボニルジイミダゾール37gを加え、室温で13時間、30〜40℃で5.5時間、60〜70℃で4時間攪拌した。溶媒を減圧留去し、残渣に希塩酸を加えてpH2とした。酢酸エチルで抽出し、飽和食塩水で洗浄したのち硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣にジイソプロピルエーテル−n−ヘキサン(2:1)を加えて析出結晶を濾取し、3−ベンジル−2−オキソ−3−アザビシクロ〔3.1.1〕ヘプタン−1−カルボン酸15.5gを得た。
【0324】
融点 : 127−128 ℃(酢酸エチルから再結晶);
IR(KBr)cm-1:2531,1750,1732;
1H−NMR(CDCl3) δ:1.85−2.00(m,2H),2.70−2.84(m,1H),2.84−2.97(m,2H),3.44(d,2H,J=2Hz),4.65(s,2H),7.20−7.45(m,5H)
【0325】
(7) 前項で得られた化合物15.5g,トリエチルアミン 9.6gおよびt−ブタノール 150mlからなる混合物を70℃に加熱し、ジフェニルホスホリルアジド26gを滴下した。この反応液を15時間還流した。減圧下濃縮し、残渣に氷水を加え、酢酸エチルで抽出した。希水酸化ナトリウム水溶液、次いで飽和食塩水で洗浄したのち、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:エタノール=50:1)で精製し、3−ベンジル−1−t−ブトキシカルボニルアミノ−3−アザビシクロ〔3.1.1〕ヘプタン−2−オン14.6gを得た。
【0326】
融点 : 106−107 ℃(塩化メチレン−ジイソプロピルエーテルから再結晶);
IR(KBr)cm-1:3402,1723,1646;
1H−NMR(CDCl3) δ:1.45(s,9H),1.70−1.83(m,2H),2.56(tt,1H,J=2.5 ,7Hz),3.10−3.35(m,2H),3.25(d,2H,J=2.5Hz ),4.60(s,2H),6.22(br s,1H),7.20−7.40(m,5H)
【0327】
(8) 前項で得られた化合物6.07g,10%塩酸水12mlおよびテトラヒドロフラン6mlからなる混合物を50〜60℃で3時間加温した。減圧下濃縮し、残渣に水を少量加え、n−ヘキサンで洗浄した。水層を水酸化ナトリウム水溶液でアルカリ性とし、クロロホルムで抽出した。飽和食塩水で洗浄したのち、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、1−アミノ−3−ベンジル−3−アザビシクロ〔3.1.1〕ヘプタン−2−オン4.09gを得た。
【0328】
IR(neat)cm-1:3381,1659,1495,1250;
1H−NMR(CDCl3) δ:1.85−2.00(m,2H),1.90(s,2H),2.10−2.25(m,2H),2.54(tt,1H,J=2.5 ,7Hz),3.26(d,2H,J=2.5Hz ),4.60(s,2H),7.20−7.40(m,5H)
【0329】
(9) 前項で得られた化合物 2.1gとテトラヒドロフラン25mlからなる混合物に、ボラン−テトラヒドロフラン錯体の 1.0M−テトラヒドロフラン溶液30mlを加えた。7時間還流した後、減圧下濃縮した。残渣にエタノール40mlを加え、9時間還流した。減圧下濃縮し、残渣に氷水を加え、酢酸エチルで抽出した。飽和重曹水、次いで飽和食塩水で洗浄した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をクーゲルロールミクロ蒸留装置で蒸留して、1−アミノ−3−ベンジル−3−アザビシクロ〔3.1.1〕ヘプタン1.86gを得た。
【0330】
沸点:約100 ℃(3mmHg);
IR(neat)cm-1:3360,2791,1603;
1H−NMR(CDCl3) δ:1.51(br s,2H),1.60−1.90(m,4H),2.18(tt,1H,J=3,6Hz),2.65(s,2H),2.69(d,2H,J=3Hz),3.67(s,2H),7.15−7.40(m,5H)
【0331】
(10) 前項で得られた化合物1.86gをエタノール20mlに溶解し、5%パラジウム炭素 190mgを加え、理論量の水素を添加した。触媒を濾去し、減圧下溶媒を留去して、目的物 1.0gを得た。
【0332】
実施例B−8:−−アミン類の製造−−:
9−メチレン−1,7−ジアザスピロ〔4.4〕ノナン二塩酸塩
【0333】
(1) 2,3−ジブロモプロペン300g、3,4-ジメトキシベンジルアミン245.3g、トリエチルアミン503.7 gおよび3000mlのトルエンからなる混合物を45分間加熱還流し、冷後、水、酢酸水を加え、酢酸エチルで抽出し、水洗した。無水硫酸ナトリウムで乾燥後、溶媒を留去して残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して、2−ブロモ−3−(3,4−ジメトキシベンジルアミノ)プロペン120gを得た。
IR(neat)cm-1:2934,2833,1516
【0334】
(2) N−(t−ブトキシカルボニル)−L−プロリン 73.8 g、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(WSC)72.4gおよび1000mlのジクロロメタンからなる混合物に、氷冷下、前項で得た化合物108gとジクロロメタン100mlとの混合物を20分間かけて滴下後、室温で20時間攪拌し、これに水を加え、ついでジクロロメタンにより抽出した。無水硫酸ナトリウムで乾燥後、溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製してN−(2−ブロモプロペニル)−N−(3,4−ジメトキシベンジル)−1−(t−ブトキシカルボニル)プロリンアミド149gを得た。
IR(neat)cm-1:2974,1697
【0335】
(3) 前項で得た化合物67.7gおよびトルエン800mlからなる混合物に、氷冷下、0.5 N−カリウムヘキサメチルジシラザンのトルエン溶液800mlを20分間かけて滴下し、同温度で90分間攪拌した。これに水、酢酸水を加え、酢酸エチルで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して1−(t−ブトキシカルボニル)−7−(3.4−ジメトキシベンジル)−9−メチレン−6−オキソ−1,7−ジアザスピロ〔4.4〕ノナン29.3gを得た。
【0336】
IR(neat)cm-1:2971,1692;
MS(m/z):=403(MH+ )
【0337】
(4) 前項で得た化合物20gおよびジクロロメタン500mlからなる混合物に、氷冷下、トリフルオロ酢酸100mlを10分間かけて滴下し、室温で16時間攪拌した。これに水および水酸化ナトリウム水溶液を加え、ジクロロメタンにより抽出した。無水硫酸ナトリウムで乾燥後、溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して7−(3,4−ジメトキシベンジル)−9−メチレン−6−オキソ−1,7−ジアザスピロ〔4.4〕ノナン10.6gを得た。
【0338】
IR(neat)cm-1:2959,1699;
MS(m/z):303(MH+ )
【0339】
(5) 前項で得た化合物10.6gおよびトルエン200mlからなる混合物に、氷冷下、水素化ビス(2−メトキシエトキシ)アルミニウムナトリウムの70%トルエン溶液20.5 mlを5分間かけて滴下し、室温で5時間攪拌した。これに食塩水および水酸化ナトリウム水溶液を加え、酢酸エチルで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して7−(3,4−ジメトキシベンジル)−9−メチレン−1,7−ジアザスピロ〔4.4〕ノナン7.8 gを得た。
【0340】
IR(neat)cm-1:2953,1516;
MS(m/z):289(MH+ )
【0341】
(6) 前項で得た化合物0.23g、クロロ蟻酸1−クロロエチル0.57gおよび1,2−ジクロロエタン10mlからなる混合物を2時間加熱還流し、溶媒を留去した。残渣にメタノ−ル10mlを加え、1時間加熱還流し、溶媒を留去して目的とする9−メチレン−1,7−ジアザスピロ〔4.4〕ノナン二塩酸塩0.12gを得た。本化合物は、後記化合物6F−6の製造原料として使用した。
【0342】
IR(neat)cm-1:3400,2917,1631;
MS(m/z):139(MH+ );
1H−NMR(DMSO−d6 ) δ:1.8 −2.1 (m,4H), 3.0 −3.3(m,4H), 3.6.−3.9 (m,2H) 5.26(t,1H,J=2Hz),5.43(t,1H,J=2Hz)
【0343】
実施例B−9:−−アミン類の製造−−:
3−ヒドロキシ−3−トリフルオロメチルピロリジン
【0344】
(1) 1−ベンジル−3−ピロリドン14.5gにテトラヒドロフラン150ml、テトラ−n−ブチルアンモニウムフルオリドの1M−テトラヒドロフラン溶液0.92mlを加えた。混合物に氷冷下、トリメチルシリルトリフルオロメタン16.5gを加え、30分間攪拌した。反応液を室温にし、更に、3時間攪拌した。そこにテトラ−n−ブチルアンモニウムフルオリドの1M−テトラヒドロフラン溶液30mlを加えて、室温で4時間攪拌した。反応終了後、水と酢酸エチルを加えて抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、1−ベンジル−3−ヒドロキシ−3−トリフルオロメチルピロリジン13.3gを得た。
融点60−61℃
【0345】
(2) 前項で得られた化合物1.0 gにエタノール15ml、10%パラジウム炭素100mgを加え60℃で理論量の水素を吸収させた。触媒を濾去し、溶媒を減圧乾固し、目的のアミン630mgを得た。
【0346】
実施例 B−10:−−アミン類の製造−−:
(1R,5S,8R)−8−(tert−ブトキシカルボニルアミノ)−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン
【0347】
(1) D−酒石酸を原料にしてJ. Org. Chem. 60, 103-108 (1995)の記載に従って製造した(3S,4R,5S)−1−ベンジル−3,4−ビス(tert−ブチルジメチルシリルオキシ)−5−(2−ヒドロキシエチル)−2−ピロリジノン125.5gに60% 酢酸水1200mlを加え、一夜還流した。減圧濃縮後、残渣に濃アンモニア水300ml およびメタノール500ml を加え、室温で一夜攪拌した。反応液を減圧濃縮し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=10:1)で精製して、(3S,4R,5S)−1−ベンジル−3,4−ジヒドロキシ−5−(2−ヒドロキシエチル)−2−ピロリジノン35g を得た。
【0348】
IR (neat) 3370, 1682 cm-1;
MS (m/z) : 252 (MH+ )
【0349】
1H-NMR (CDCl3)δ:7.10-7.32(m, 5H), 5.52(br s, 2H), 4.90(d, 1H, J=15.0Hz), 4.50(d, 1H, J=7.5Hz), 4.21(br t, 1H, J=7.5Hz), 3.94(d, 1H, J=15.0Hz),3.55(br s, 3H), 2.20-2.00(br s, 1H), 1.86(br s, 2H)
【0350】
(2) 前項で得た化合物35g をピリジン400ml に加え、氷冷したところにp−トルエンスルホニルクロリド26.6g を加え、一晩攪拌した。反応溶液に水、クロロホルムを加え生成物を有機層に抽出した後、10%塩酸水で洗浄し、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、油状の(1R,5S,8S)−6−ベンジル−8−ヒドロキシ−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン24g を得た。
【0351】
IR (neat):3390, 1692 cm -1;
MS m/z:234 (MH+ )
【0352】
1H-NMR (CDCl3)δ:7.40-7.18(m, 5H), 4.84(d, 1H, J=15.0Hz), 4.49(br, 1H),4.42(dd, 1H, J=6.5, 1.7Hz), 4.32(br, 1H), 4.16-4.06(m, 2H), 3.92-3.66(m, 2H), 1.92-1.82(m, 2H)
【0353】
(3) 前項で得た化合物14g を塩化メチレン250ml に加え、氷冷したところにピリジン14.6mlを加え、次にゆっくりトリフルオロメタンスルホン酸無水物13.1mlを加えた。2時間後、反応液にジメチルホルムアミド550ml および酢酸カリウム58.9g を加え、一晩攪拌した。不溶物を濾過し、減圧濃縮して得た残渣に水およびクロロホルムを加え、生成物を有機層に抽出した後、溶媒を減圧留去して、粗製の(1R,5S,8S)−8−アセトキシ−6−ベンジル−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタンを得た。
【0354】
この化合物にエタール500ml と濃アンモニア水200ml を加え、室温で一晩攪拌し、減圧濃縮した。残渣に水およびクロロホルムを加え、生成物を有機層に抽出後、溶媒を減圧留去し、シリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=30:1)で精製して(1R,5S,8R)−6−ベンジル−8−ヒドロキシ−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン9.2gを得た。
【0355】
IR (neat):3381, 1694 cm -1;
MS m/z:234 (MH+ )
【0356】
1H-NMR (CDCl3)δ:7.40-7.20(m, 5H), 4.93(d, 1H, J=15.0Hz), 4.50(dd, 1H,J=6.0, 5.0Hz), 4.28(d, 1H, J=6.0Hz), 4.09(d, 1H, J=15.0Hz), 4.08-3.93(m,2H), 3.80-3.66(m, 1H), 3.22(br s, 1H), 2.24-2.11(m, 1H), 2.01-1.81(m, 1H)
【0357】
(4) 前項で得た化合物9.2gを塩化メチレン100ml に加え、氷冷したところにピリジン9.5ml を加え、次にゆっくりトリフルオロメタンスルホン酸無水物9.1mlを加えた。2時間後、反応液にジメチルホルムアミド300ml およびアジ化ナトリウム24.4g を加え、一晩攪拌した。減圧濃縮して得た残渣に水およびクロロホルムを加え、生成物を有機層に抽出した。希塩酸水で洗浄し、無水硫酸マグネシウムで乾燥した後、溶媒を減圧留去して(1R,5S,8S)−8−アジド−6−ベンジル−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン7.4gを得た。
【0358】
IR (neat) : 2109, 1694 cm -1;
1H-NMR (CDCl3)δ:7.40-7.20(m, 5H), 4.93(d, 1H, J=15.0Hz), 4.23(dd, 1H,J=6.0, 1.5Hz), 4.16-4.02(m, 3H), 3.94-3.82(m, 1H), 3.81-3.67(m, 1H), 2.00-1.80(m, 2H)
【0359】
(5) 前項で得た化合物7.4gをテトラヒドロフラン300ml に加え、氷冷したところにボラン−テトラヒドロフラン錯体の1.0 モル−テトラヒドロフラン溶液116ml を加えた。30分後加熱し、一晩還流した。反応液を室温に冷却し、過剰のボランをエタノールで処理した。減圧濃縮後、残渣にエタノール600ml を加え、一晩還流した。減圧濃縮後、残渣に10% 塩酸水を加え、生成物を水層に抽出し、クロロホルムで洗浄した。20% NaOH水でアルカリ性にした後、クロロホルムで抽出した。無水硫酸マグネシウムで乾燥し、溶媒を減圧留去して(1S,5S,8R)−8−アミノ−6−ベンジル−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン5.5gを得た。
【0360】
続いてこの化合物をメタノール100ml に加えて氷冷し、これに二炭酸−ジ−tert−ブチル7.2gを加え、一晩攪拌した。減圧濃縮して得た残渣をシリカゲルカラムクロマトグラフィー(溶離液 n−ヘキサン:酢酸エチル=6:1)に付し、(1S,5S,8R)−6−ベンジル−8−(tert−ブトキシカルボニルアミノ)−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン7.0gを得た。
【0361】
融点115−116℃(酢酸エチルから再結晶);
〔α〕D 27 +2.3 °(c=1.023,メタノール)
【0362】
(6) 前項で得た化合物5.4gをエタノール100ml に溶解し、5%パラジウム炭素350mg を加え、40℃で理論量の水素を吸収させた。触媒を濾去し、溶媒を減圧留去した後、得られた粗結晶をエチルエーテル−ジイソプロピルエーテルから再結晶して、最終目的物たる(1R,5S,8R)−8−(tert−ブトキシカルボニルアミノ)−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン3.5gを得た。
【0363】
融点110−111℃;
IR (KBr) : 3377, 3228, 1680 cm-1;
〔α〕D 29 −44.4°(c=1.026, メタノール)
【0364】
シリーズC:目的物の製造方法
【0365】
実施例C−1:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(ラセミ体)およびその関連化合物
【0366】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(7.1 g)とトランス−3−メトキシ−4−メチルアミノピロリジン二塩酸塩(6.0 g)およびアセトニトリル(150 ml)からなる懸濁液にトリエチルアミン(18ml)を加えた。室温で5時間攪拌し、減圧下、反応液を濃縮し、炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出した。抽出液を無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=6:1)で精製して1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(6.1 g)を得た。
融点:73−76℃
【0367】
(2) 上記エステル(6.0 g)および18%塩酸水(100 ml)からなる溶液を100 ℃で28時間攪拌した。析出結晶を濾取し、エタノールおよびジイソプロピルエーテルからなる混液で洗浄して4.45gの1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物H−1−1−1)(4.45g)を得た。
融点:270−273℃
【0368】
(3) 前記(2)で得た塩酸塩(51.5g)、水(500 ml)およびアンモニア水(40ml)からなる溶液を50℃で一夜攪拌した。これにアセトニトリルを加え、減圧濃縮し、析出結晶を濾取した。得られた結晶を水およびアセトニトリルで洗浄して32.6gの1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物H-1-1-0)を得た。
融点:290−292℃(分解)
【0369】
(4) 前項(3)で得た化合物(2.0 g)、乳酸(3.1 g)および蒸留水(4ml)からなる混合物を60℃で加熱溶解した。室温に冷却後、エタノール(70ml)を加え、析出結晶を濾取し、エタノールで洗浄して2gの乳酸塩(化合物H-1-1-2 )を得た。
融点:288−291℃(分解)
【0370】
(5) 前項(1)で得たエステル(1.89g)、N−t−ブトキシカルボニル−L−アラニン(1.26g)および塩化メチレン(80ml)からなる混合物に1.27gのWSCを加え、室温で3時間攪拌した。水洗後、無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)により精製して7−{トランス−3−〔N−(N−t−ブトキシカルボニル−L−アラニル)〕メチルアミノ−4−メトキシ−1−ピロリジニル}−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(2.15g)を得た。
【0371】
融点:120−123℃;
〔α〕D 28 +10.2°(c=1.0 ,クロロホルム)
【0372】
このエチルエステル(1.71g)、0.5 N塩酸水(42ml)、エタノール(22ml)からなる混合物を80℃で17.5時間加熱攪拌した。この溶液を減圧濃縮し、析出結晶を濾取し、10%塩酸水およびエタノールで洗浄して7−〔トランス−3−(N−L−アラニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩1.16gを得た。
【0373】
融点:230−233℃;
〔α〕D 29 +8.4 °(c=1.0 ,水)
【0374】
実施例C−2:−−目的物(I)の製造−−:
(+)−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(光学活性体)およびその関連化合物
【0375】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルと実施例B−2で得た(+)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジンを用い、実施例C−1(1)と同様にして(−)−7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(非結晶体)を得た。
〔α〕D 29 −9.1 °(c=1.006 ,クロロホルム)
【0376】
(2) 実施例C−1(2)に記載の方法に準じて、前項(1)で得たエチルエステル体から標記塩酸塩(化合物H−1−2)を得た。
【0377】
融点:278−282℃(分解);
〔α〕D 29 +24.8°(c=0.500 ,水)
【0378】
(3) 前記(2)で得た塩酸塩(28.1g)、水(300 ml)およびアンモニア水(25ml)からなる溶液を50℃で一夜攪拌し、ついで減圧濃縮した。析出結晶を濾取し、水およびエタノールで洗浄して目的のカルボン酸体(化合物H−1−2−1)(19.5g)を得た。
【0379】
融点:268−271℃;
〔α〕D 30 +53.1°(c=1.005 ,1N NaOH)
【0380】
(4) 前記(3)項で得たカルボン酸体6.22gを蒸留水150mlに溶解し、氷冷下にて、1.002 N−水酸化ナトリウム水溶液14.8mlを加え、直ちに10分間攪拌した。溶媒を減圧留去し、残渣にアセトニトリルおよびジイソプロピルエーテルを加えて析出する結晶を濾取し、目的とするナトリウム塩(化合物H−1−2−2)6.28gを得た。
融点:189−190℃(分解)
【0381】
(5) 前記(3)で得た化合物(300mg)と水(1.2 ml)からなる懸濁液にメタンスルホン酸(140mg)を加え、60℃で加熱溶解した。熱時濾過し、濾液を室温で冷却した。これにアセトン(10ml)を加え、析出結晶を濾取し、アセトンで洗浄して標記化合物のメタンスルホン酸塩(化合物H−1−2−3)を得た。
【0382】
融点:283−285℃(分解);
〔α〕D 28 +46.9°(c=1.00,1N NaOH)
【0383】
(6) 実施例C−1(4)に記載の方法に準じて、前記(3)で得た化合物から標記化合物の乳酸塩(化合物H−1−2−4)を得た。
【0384】
融点:273−275℃(分解);
〔α〕D 27 +44.7°(c=1.00,1N NaOH)
【0385】
(7) 前記(3)で得た化合物(350mg)およびグルコン酸(約50%、1.1 g)を水(1ml)に加熱(60℃)溶解した。放冷後、アセトン(100ml)を加え、析出する固体を水−メタノールから再結晶し、析出結晶を濾取し、メタノールで洗浄して標記化合物のグルコン酸塩(化合物H−1−2−5)を得た。
【0386】
融点:129−132℃;
〔α〕D 28 +36.7°(c=0.36,1N NaOH)
【0387】
(8) 前記(1)で得た化合物を塩酸−エタノール(30%)で処理して、(−)−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(化合物H−1−2−6)を得た。
【0388】
融点:184−185℃;
〔α〕D 28 −16.9°(c=0.503, クロロホルム)
【0389】
実施例C−3:−−目的物(I)の製造−−:
(−)−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(光学活性体)およびその塩
【0390】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルと実施例B−3で得た(−)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジンを用い、実施例C−1(1)と同様にして(+)−7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(非結晶体)を得た。
〔α〕D 29 +9.0 °(c=1.002 ,クロロホルム)
【0391】
(2) 実施例C−1(2)に記載の方法に準じて、前項(1)で得たエチルエステル体から標記化合物の塩酸塩(化合物H−1−3)を得た。
【0392】
融点:278−282℃(分解);
〔α〕D 29 −25.2°(c=0.504 ,水)
【0393】
(3) 実施例C−2(3)に記載の方法に準じて、前記(2)で得た化合物から目的のカルボン酸体(化合物H−1−3−1)を得た。
【0394】
融点:277−279℃(分解);
〔α〕D 29 −59.9°(c=1.00,1N NaOH)
【0395】
(4) 実施例C−2(5)に記載の方法に準じて、前記(3)で得た化合物から標記化合物のメタンスルホン酸塩(化合物H−1−3−2)を得た。
【0396】
融点:287−289℃(分解);
〔α〕D 30 −47.2°(c=1.00,1N NaOH)
【0397】
実施例C−4:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(シス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸およびその関連化合物
【0398】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルとシス−3−メトキシ−4−メチルアミノピロリジンを用い、実施例C−1(1)と同様にして1,4−ジヒドロ−7−(シス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルを得た。
融点253−259℃(分解)
【0399】
(2) 実施例C−1(2)に記載の方法に準じて、前項(1)で得たエチルエステル体から標記化合物の塩酸塩(化合物H−1−4)を得た。
融点:263−269℃(分解)
【0400】
実施例 C−5:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチチリジン−3−カルボン酸塩酸塩(化合物2F−1)
【0401】
(1) 実施例A(6)で得た7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチル6.5 g,3−アミノピロリジン1.7 g,トリエチルアミン5.6 gおよびアセトニトリル65mlの混合物を30分間加熱還流した。冷後、結晶を濾取し、エタノ−ルから再結晶して、7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(化合物2F−1のエステル体)7.1gを得た。
融点:218−220℃。
【0402】
(2) 上記エステル7.1gと10%塩酸水200mlの混合物を1時間加熱還流した。冷後、結晶を濾取し、水−エタノ−ルから再結晶して、6.9gの7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1)を得た。
融点:294−296℃(分解)
【0403】
(3) 上記塩酸塩を常法に従って処理し、7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物2F−1の遊離体)を得た。
融点:253−254℃(分解)
【0404】
(4) (R)−3−アミノピロリジンを用い、前記と同様に反応・処理して下記化合物を得た。
【0405】
7−〔(R)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル;
融点:254−257℃
【0406】
7−〔(R)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1−1)
【0407】
融点:297−300℃(分解);
[α]D 28=−21.0O (1N NaOH ,c=0.1 )
【0408】
(5) (S)−3−アミノピロリジンを用い、前記と同様に反応・処理して下記化合物を得た。
【0409】
7−〔(S)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル;
融点:256−259℃
【0410】
7−〔(S)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1−2)
【0411】
融点:>300℃;
[α]D 28=+20.0O (1N NaOH ,c=0.1 )
【0412】
(6) 実施例C−1(5)の記載に準じて、7−〔3−(N−L−アラニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1−3)を得た。;
融点:236−239℃
【0413】
実施例C−6;−−目的物(I)の製造−−:
上記実施例C−1からC−5までに記載の方法またはこれに準じる方法により、以下の第15表〜第21表に示す化合物およびそのエチルエステルを得た。
【0414】
第15表 目的化合物(I)
【0415】
【化31】

【0416】
【表30】

*:1=HCl、 2=1/2 HCl、 3=1/5 HCl
**:(分)は分解点を示す。以下、同様。
【0417】
【表31】

*:1=HCl
【0418】
【表32】

*:「−」=遊離体、 1=HCl
【0419】
第16表 目的化合物(I)
【化32】

【0420】
【表33】

*:1=HCl
【0421】
【表34】

*:「−」=遊離体、 1=HCl
【0422】
【表35】

*:「−」=遊離体、 1=HCl
【0423】
【表36】

*:「−」=遊離体、 1=HCl
【0424】
【表37】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0425】
【表38】

*:「−」=遊離体、 1=HCl
【0426】
【化33】

【0427】
第17表 目的化合物(I)
【0428】
【化34】

【0429】
【表39】

*:「−」=遊離体、 1=HCl
【0430】
第18表 目的化合物(I)
【0431】
【化35】

【0432】
【表40】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0433】
【表41】

*:「−」=遊離体、 1=HCl、
**:3位エチルエステル体
【0434】
第19表 目的化合物(I)
【0435】
【表42】

【0436】
第19表のつづき
【0437】
【表43】

【0438】
第20表 目的化合物(I)
【0439】
【表44】

【0440】
第20表のつづき
【0441】
【表45】

【0442】
第20表のつづき
【0443】
【表46】

【0444】
第21表 目的化合物(I)
【0445】
【化36】

【0446】
【表47】

*:水中(c=0.1)で測定。
**:DMSO中(c=0.1 )で測定。
【0447】
【表48】

*:水中(c=0.1)で測定。
**:2塩酸塩。
【0448】
【表49】

*:水中(c=0.1)で測定。
**:水中(c=0.5)で測定。
【0449】
実施例C−7:−−目的物(I)の製造−−:
2−(3−アミノ−1−ピロリジニル)−5,8−ジヒドロ−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸
【0450】
実施例A−7で得た5,8−ジヒドロ−2−メタンスルホニル−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステルと3−アミノピロリジンとを実施例C−1とほぼ同様な方法により反応させ、標記化合物(9N−1)を得た。
融点:288−291℃(分解)
【0451】
実施例C−8:−−目的物(I)の製造−−:
3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物7H−1)
【0452】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(8.49g)、トランス−3−メトキシ−4−メチルアミノピロリジン二塩酸塩(6.5 g)およびアセトニトリル(400 ml)からなる懸濁液にトリエチルアミン(13.4ml)を加えた。室温で一夜攪拌後、反応液を減圧濃縮し、炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣に塩化メチレン(500 ml)を加え、氷冷下、二炭酸ジ−t−ブチル(6.4 g)を加えた。室温で一夜攪拌後、反応液を減圧濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100 :1)で精製して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(9.1 g)を得た。
【0453】
IR(KBr)cm-1:1735,1695;
MS(m/z):530(MH+ )
【0454】
(2) 前項(1)で得た化合物(8.95g)とエタノール(150 ml)の混合物に氷冷下、1N水酸化ナトリウム水溶液(150 ml)を加え、同温度で30分間、室温で一夜攪拌した。酢酸水で酸性となし、クロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(7.19g)を得た。
【0455】
融点 185−188℃;
IR(KBr)cm-1:1715,1690;
MS(m/z):502(MH+ )
【0456】
(3) 前項(2)で得た化合物(7.15g)とメタノール(400 ml)からなる混合物に、氷冷下、水素化ホウ素ナトリウム(2.16g)を加え、同温度で15分間、室温で一夜攪拌した。溶媒を減圧留去し、ついでクロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100 :1)で精製して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(3.9 g)を得た。
【0457】
IR(neat)cm-1:1690;
MS(m/z):460(MH+ )
【0458】
(4) 前項(3)で得た化合物(3.8 g)をテトラヒドロフラン(500 ml)に溶解し、−78℃でn−ブチルリチウム(1.6 M)のn−ヘキサン溶液(6.1ml)を滴下した。同温度で30分間攪拌後、ギ酸エチル(1.34ml)を加え、ゆっくり昇温させ、一夜攪拌した。溶媒を減圧留去し、残渣に酢酸水を加えクロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−3−ホルミル−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(3.87g)を得た。
【0459】
IR(neat)cm-1:1690,1615;
MS(m/z):488(MH+ )
【0460】
(5) 前項(4)で得た化合物(3.6 g)を1,4−ジオキサン(160 ml)に溶解し、2,3−ジクロロ−5,6−ジシアノ−1,4−ベンゾキノン(2.51g)をゆっくり加えた。2時間攪拌後、溶媒を減圧留去し、残渣に水酸化ナトリウム水溶液を加え、クロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100 :1)で精製して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−3−ホルミル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(1.73g)を得た。
【0461】
融点 130−132℃;
IR(KBr)cm-1:1695,1645,1615;
MS(m/z):486(MH+ )
【0462】
(6) 前項(5)で得た化合物(1.65g)、10%塩酸水(10ml)およびエタノール(40ml)からなる混液を50−60℃で7時間加熱した。析出結晶を濾取し、エタノールおよびジイソプロピルエーテルで洗浄して3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物7H−1)(1.05g)を得た。
【0463】
融点 255−263℃(分解);
IR(KBr)cm-1:3460,1695,1645;
MS(m/z):386(MH+ )
【0464】
実施例C−9:−−目的物(I)の製造−−:
1,2,3,4−テトラヒドロ−4−ヒドロキシ−3−ヒドロキシメチル−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−1−(2−チアゾリル)−1,8−ナフチリジン(化合物7H−2)
【0465】
氷冷下にて、4.90gの1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルを無水テトラヒドロフラン150mlに溶解し、水素化リチウムアルミニウム3.00gを加え、30分間攪拌し、更に、室温で一晩攪拌した。反応液を水にゆっくり加え、塩化アンモニウム水溶液、炭酸水素ナトリウム水溶液を、順次加えた。これをクロロホルムにて抽出し、飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製し目的とする化合物7H−2(1.60g)を得た。融点:69−70℃
【0466】
実施例C−10:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸 2−ヒドロキシエチルエステル 4/3トリフルオロ酢酸塩(化合物7H−3)
【0467】
(1) 氷冷下にて、1.00gの7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸を塩化メチレン90mlに溶解し、エチレングリコール1.24g、WSC420mg、4−ジメチルアミノピリジン50mgを加えて30分間攪拌し、更に、室温で一晩攪拌した。水を加え、これをクロロホルムにて抽出し、飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製し、1,4−ジヒドロ−7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸2−ヒドロキシエチルエステル(590mg)を得た。
融点:101−105℃
【0468】
(2) 前項の化合物250mgを塩化メチレン3mlに溶解し、氷冷下にて、トリフルオロ酢酸1.0 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。ジイソプロピルエーテルを加え析出結晶を濾取し、目的とする化合物7H−3(150mg)を得た。
融点:125−127℃
【0469】
実施例C−11:−−目的物(I)の製造−−:
1−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕−3−ヒドロキシピロリジン 3/2塩酸塩(化合物7H−4)
【0470】
(1) 氷冷下にて、250mgの7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸を塩化メチレン20mlに溶解し、これに3−ピロリジノール52mg、ベンゾトリアゾール−1−イロキシトリス(ジメチルアミノ)ホスホニウムヘキサフルオロホスフェート(BOP試薬)265mgおよびトリエチルアミン0.17mlを加えて30分間攪拌し、更に、室温で一晩攪拌した。水を加え、これをクロロホルムにて抽出し、飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=20:1)で精製し、1−{7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル}−3−ヒドロキシピロリジン(280mg)を得た。
融点:127−129℃
【0471】
(2) 前項の化合物275mgをエタノール5mlに溶解し、氷冷下にて、10%エタノール−塩酸3.0 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。ジイソプロピルエーテルを加え析出結晶を濾取し、目的とする化合物7H−4(163mg)を得た。
融点:189−193℃(分解)
【0472】
実施例C−12:−−目的物(I)の製造−−:
3−ヒドロキシメチル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物7H−5)
【0473】
氷冷下にて、実施例C−8で得た110mgの3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジンの塩酸塩をメタノール30mlに溶解し、これに塩化セリウム七水和物108mg、水素化ホウ素ナトリウム30mgを加えて30分間攪拌し、クロロホルムおよび酢酸水溶液を加えた。炭酸水素ナトリウム水溶液でアルカリ性となし、クロロホルムにて抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去し、エタノール−塩酸溶液を加えて析出結晶を濾取し、69mgの目的化合物7H−5を得た。
融点:263−268℃(分解)
【0474】
実施例C−13:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボキサミド トリフルオロ酢酸塩(化合物8F−1)
【0475】
(1) 氷冷下にて、メタノール150mlに9.00gの7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル、1N−水酸化ナトリウム水溶液150mlを加え、30分間攪拌し、更に、室温で一晩攪拌した。酢酸水溶液を加え、クロロホルムにて抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸8.50gを得た。
融点:220−224℃
【0476】
(2) 前項の化合物2.20gをクロロホルム20mlに溶解し、氷冷下にて、トリエチルアミン0.97ml、クロロ蟻酸エチル604mgを加え、1時間攪拌し、更に、室温で1時間攪拌した。再び、氷冷下、飽和アンモニア−エタノール溶液20mlを加え1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣に水を加え、クロロホルムにて抽出した。無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルキサミド1.19gを得た。
融点:240−243℃
【0477】
(3) 前項の化合物700mgをクロロホルム40mlに溶解し、氷冷下にて、トリフルオロ酢酸1.3 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣にエタノールを加えて析出する結晶を濾取し、635mgの目的化合物(8F−1)を得た。
融点:227−233℃(分解)
【0478】
実施例C−14:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン トリフルオロ酢酸塩(化合物8F−2)
【0479】
(1) 氷冷下にて、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸11.3gをメタノール400mlに溶解し、水素化ホウ素ナトリウム4.5 gを加えて30分間攪拌し、更に室温で一晩攪拌した。溶媒を減圧留去し、残渣に酢酸水を加え、クロロホルムにて抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン5.41gを得た。
融点:234−236℃
【0480】
(2) 前項の化合物700mgを1,4−ジオキサン70mlに溶解し、2,3−ジクロロ−5,6−ジシアノ−1,4−ベンゾキノン440mgを加え、一晩加熱還流した。溶媒を減圧留去し、残渣に水酸化ナトリウム水溶液を加えてクロロホルムにて抽出した。無水硫酸ナトリウムで乾燥し、溶媒を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン270mgを得た。
融点:234−236℃
【0481】
(3) 前項の化合物160mgをクロロホルム12mlに溶解し、氷冷下にて、トリフルオロ酢酸0.6 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣にエタノールを加えて析出する結晶を濾取し、150mgの目的化合物(8F−2)を得た。
融点:237−240℃
【0482】
実施例C−15:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−3−ベンジル−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(化合物8F−3)
【0483】
(1) エタノール10mlに実施例C−14(1)で得た7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン400mg、20%水酸化ナトリウム水溶液5mlを加え、そこにベンズアルデヒド350mgを加え、一晩攪拌した。酢酸水を加え、クロロホルムにて抽出した。飽和食塩水にて洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、3−ベンジル−7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン325mgを得た。
融点:234−236℃
【0484】
(2) 前項の化合物200mgをクロロホルム15mlに溶解し、氷冷下にて、トリフルオロ酢酸0.59mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣にジイソプロピルエーテルを加えて析出する結晶を濾取し、185mgの目的化合物(8F−3)を得た。
融点:237−240℃
【0485】
実施例C−16:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−3−ホルミル−1,4−ジヒドロ−6−フルオロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物8F−4)
【0486】
実施例C−8に記載の方法に準じて標記化合物(8F−4)を得た。
融点:242−250℃(分解)
【0487】
実施例C−17:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−3−ヒドロキシ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジントリフルオロ酢酸塩(化合物8F−5)
【0488】
(1) 7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸0.5 g、超酸化カリウム0.75g、エタノール5ml、水5mlからなる混合物を15分間加熱還流し、溶媒を留去した。酢酸水で中和し、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をクロロホルム−エタノールから再結晶して7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−3−ヒドロキシ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン260mgを得た。
融点:251−252℃
【0489】
(2) 前項の化合物260mg、塩化メチレン6mlおよびトリフルオロ酢酸6mlからなる混合物を室温で20時間攪拌し、溶媒を減圧留去した。残渣にアセトニトリルを加えて析出する結晶を濾取し、これをアセトニトリルで洗浄して170mgの目的化合物(8F−5)を得た。
融点:206−207℃
【0490】
実施例C−18:−−目的物(I)の製造−−:
1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−7−ビニル−1,8−ナフチリジン−3−カルボン酸(化合物9H−1)
【0491】
(1) 7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル3.6 g、ビニルトリブチルスズ3.8 g、ビストリフェニルホスフィンパラジウムジクロリド1.0 gおよびトルエン150mlからなる懸濁液を6.5 時間還流した。氷冷後、水洗し、溶媒を減圧留去した。得られた結晶をトルエンおよびエタノールで洗浄して1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−7−ビニル−1,8−ナフチリジン−3−カルボン酸エチルエステル2.7 gを得た。
融点:163−164℃
【0492】
(2) 前項の化合物0.32g、10%塩酸水15mlおよびエタノール2mlからなる懸濁液を100℃で13時間加熱し、結晶を濾取し、エタノールで洗浄して目的物9H−1(0.19g)を得た。
融点:284−288℃(分解)
【0493】
実施例C−19:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(2,6−ジメチル−4−ピリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−2)
【0494】
(1) 7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.1 g、2,6−ジメチル−4−(トリメチルスズ)ピリジン0.98g、ビストリフェニルホスフィンパラジウムジクロリド0.25gおよびトルエン51mlからなる懸濁液を6.5 時間還流した。氷冷後、水洗し、溶媒を減圧留去した。シリカゲルカラムクラマトグラフィー(溶離液 クロロホルム)により精製し、エタノールで洗浄して1,4−ジヒドロ−7−(2,6−ジメチル−4−ピリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.38gを得た。
融点:232−235℃
【0495】
(2) 実施例C−18(2)とほぼ同様に処理して目的化合物9H−2を得た。
融点:272−275℃(分解)
【0496】
実施例C−20:−−目的物(I)の製造−−:
7−エチニル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−3)
【0497】
(1) 7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.5 g、(トリメチルシリル)エチニルトリブチルスズ2.0 g、ビストリフェニルホスフィンパラジウムジクロリド0.45gおよびトルエン75mlからなる懸濁液を100℃において、アルゴン雰囲気下で3時間加熱した。氷冷後、水洗し、溶媒を減圧留去した。シリカゲルカラムクラマトグラフィー(溶離液 クロロホルム)より精製し、1,4−ジヒドロ−4−オキソ−7−(トリメチルシリル)エチニル−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.0 gを得た。
【0498】
(2) 前項で得られた化合物1.0 g、フッ化カリウム0.45gおよびエタノール25mlからなる懸濁液を2時間還流し、溶媒を減圧留去した。クロロホルムおよび水を加え、不溶物をセライト濾過により分離し、水洗後、溶媒を減圧濃縮した。これをクロロホルム−エタノールの混合物で洗浄し、7−エチニル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.34gを得た。
融点:228−231℃(分解)
【0499】
(3) 前項で得られた化合物を実施例C−18(2)とほぼ同様に処理して目的化合物9H−3を得た。
融点:>300℃
【0500】
実施例C−21:−−目的物(I)の製造−−:
実施例C−18から実施例C−20までに記載の方法またはこれに準じる方法により以下の化合物を得た。
【0501】
1,4−ジヒドロ−4−オキソ−7−フェニル−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−4);
融点:227−230℃(分解)
【0502】
1,4−ジヒドロ−7−メチル−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−5);
融点:268−269℃
【0503】
1−(5−ブロモ−2−チアゾリル)−1,4−ジヒドロ−7−(1−ピロリジニル)メチル−1,8−ナフチリジン−3−カルボン酸(化合物9H−6);
融点:238−239℃
【0504】
実施例C−22:−−目的物(I)の製造−−:
1,4−ジヒドロ−4−オキソ−7−(3−ピラゾリル)−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−7)
【0505】
(1)実施例C−20(2)で得られた7−エチニル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.34g、トリメチルシリルジアゾメタン(10%ヘキサン溶液)1.3gおよびクロロホルム20mlからなる懸濁液を5.5 時間還流した。溶媒を減圧留去し、エタノールで洗浄して1,4−ジヒドロ−4−オキソ−7−(3−ピラゾリル)−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.31gを得た。
融点:285−287℃(分解)
【0506】
(2) 前項で得られた化合物を実施例C−18(2)とほぼ同様に処理して標記目的化合物9H−7を得た。
融点:>300℃
【0507】
実施例C−23:−−目的物(I)の製造−−:
6−フルオロ−1,4−ジヒドロ−7−ヒドロキシ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9F−1)
【0508】
7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.0 gに水酸化ナトリウム水溶液10mlを加え、85℃で6.5 時間攪拌した。反応液を塩酸水で酸性となし、析出結晶を濾取した。この結晶を5%水酸化ナトリウム水溶液に溶解し、活性炭処理をした後、塩酸酸性となし、析出結晶を濾取した。結晶を水洗し、ついでエタノールで洗浄して目的化合物690mgを得た。
融点:261−264℃
【0509】
実施例C−24:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸0.85塩酸塩(化合物Cl−1)
【0510】
(1) 無水酢酸(60ml)および濃硝酸(5ml)からなる混液に、氷冷下、2,6−ジメトキシニコチン酸(8.71g)を加えた。同温度で3時間、室温で4時間攪拌後、析出結晶を濾取し、イソプロパノールおよびジイソプロピルエーテルで洗浄した。濾液を酢酸エチルで抽出し、溶媒を減圧留去して得られる結晶をイソプロパノールおよびジイソプロピルエーテルで洗浄し、先の結晶を合わせて2,6−ジメトキシ−5−ニトロニコチン酸(6.95g)を得た。
【0511】
融点:227−230℃(分解);
IR(KBr)cm-1;1706,1610;
MS(m/z):229(MH+ ) ;
1H−NMR(DMSO−d6 )δ:4.03(s,3H),4.08(s,3H),8.71(s,1H)
【0512】
(2) マロン酸エチルカリウム(18.6g)、塩化マグネシウム(11.3g)に酢酸エチル(250 ml)を加え、得られる懸濁液に、氷冷下、トリエチルアミン(28.0g)を滴下し、室温で2.5 時間攪拌した。
【0513】
一方で前項で得た化合物(18.5g)のテトラヒドロフラン(150 ml)溶液にカルボニルジイミダゾール(14.8g)を加え、70℃で1時間攪拌した。この溶液を先の懸濁液に、氷冷下、加え、室温で一夜、更に70℃で30分間攪拌した。反応液に濃塩酸を加えて酸性となし、析出結晶を濾取し、酢酸エチルで洗浄した。濾液を酢酸エチルで抽出し、溶媒を減圧留去して得られる結晶を酢酸エチルとジイソプロピルエーテルとの混合物から再結晶した。先の結晶と合わせて2,6−ジメトキシ−5−ニトロニコチノイル酢酸エチルエステル(19.9g)を得た。
【0514】
MS(m/z):299(MH+ ) ;
1H−NMR(DMSO−d6 )δ:1.19(t,3H,J=7Hz ),4.00(s,2H),4.10(s,3H),4.11(q,2H,J=7Hz),4.15(s,3H),8.78(s,1H)
【0515】
(3) 前項で得た化合物(2.2 g)、オルトギ酸エチル(1.7 g)および無水酢酸(2.4 g)からなる混合物を1.5 時間加熱還流した。反応液を減圧濃縮し、残渣にジイソプロピルエーテル(10ml)および1,4−ジオキサン(3ml)を加えた。この溶液に、氷冷下、2−アミノチアゾール(0.84g)を加え、室温で一夜攪拌した。析出結晶を濾取し、ジイソプロピルエーテルで洗浄して、2−(2,6−ジメトキシ−5−ニトロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(2.3 g)を得た。
【0516】
融点:166−170℃;
IR(KBr)cm-1;1729,1603
【0517】
(4) 前項で得た化合物(2.0 g)と1,4−ジオキサン(90ml)からなる懸濁液に炭酸カリウム(1.0 g)を加え、60℃で3時間加熱した。冷後、水を加え、20%塩酸水で中和し、析出結晶を濾取した。水、エタノールおよびジイソプロピルエーテルで、順次、洗浄して、1,4−ジヒドロ−7−メトキシ−6−ニトロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(1.7 g)を得た。
【0518】
融点:208−210℃;
IR(KBr)cm-1;1739;
MS(m/z):337(MH+ ) ;
1H−NMR(DMSO−d6 )δ:1.31(t,3H,J=7Hz),4.30(s,3H),4.33(q,2H,J=7Hz),7.85(d,1H,J=4Hz),7.88(d,1H,J=4Hz),9.08(s,1H),9.69(s,1H)
【0519】
(5) 前項で得た化合物(10.3g)、3−(t−ブトキシカルボニルアミノ)ピロリジン(5.9 g)および炭酸カリウム(4.7 g)のジメチルホルムアミド(150 ml)溶液を60℃で2時間加熱した。冷後、水を加え、酢酸エチルで抽出した。抽出液を水及び飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られる残渣を酢酸エチルおよびエタノールとの混液から再結晶して、7−(3−t−ブトキシカルボニルアミノ−1−ピロリジニル)−1,4−ジヒドロ−6−ニトロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(11.4g)を得た。
融点:204−205℃
【0520】
(6) 前項で得た化合物(1.0 g)をエタノール(100ml)および1,4−ジオキサン(50ml)に溶解し、ラネ−ニッケル(約1g)を加えて50℃で2.5 時間、水素を吸収させた。析出結晶を濾取し、ジメチルホルムアミドを加えて加熱し、不溶物を濾過した。濾液を減圧濃縮し、得られる結晶をジメチルホルムアミド、1,4−ジオキサンからなる混液およびエタノールで洗浄して、6−アミノ−7−(3−t−ブトキシカルボニルアミノ−1−ピロリジニル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(0.81g)を得た。
融点:270−272℃(分解)
【0521】
(7) 前項で得た化合物(250 mg)と濃塩酸(5ml)の混合物に、氷冷下、亜硝酸ナトリウム(60mg)の水(2ml)溶液を滴下し、同温度で10分間攪拌した。この反応液を、氷冷下、塩化銅(I)(70mg)と濃塩酸(2ml)の混合物に滴下した。同温度で1時間、60℃で30分間攪拌後、20%水酸化ナトリウム水溶液でアルカリ性となし、ついでクロロホルムで抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られる残渣をクロロホルムおよびジイソプロピルエーテルの混合液から再結晶して、7−(3−アミノ−1−ピロリジニル)−6−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(30mg)を得た。
融点:208−210℃
【0522】
(8) 実施例C−1(2)に記載の方法に準じて、前項で得たエチルエステルを加水分解して目的とする7−(3−アミノ−1−ピロリジニル)−6−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸 0.85塩酸塩(化合物Cl−1)を得た。
融点:288−291℃(分解)
【0523】
実施例C−25:−−目的物(I)の製造−−:
C−シリーズ系実施例のいずれかに記載の方法またはこれに準じる方法により以下の化合物を得た。
【0524】
【化37】

【0525】
第22表
【0526】
【表50】

【0527】
実施例C−26:−−目的物(I)の製造−−:
3−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−イル〕アクリル酸 メチルエステル 0.9 トリフルオロ酢酸塩(化合物9H−9)
【0528】
実施例C−8で得た3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(100mg)にアンモニア水3mlを加え、クロロホルムで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去して油状物を得た。
【0529】
一方で60%水素化ナトリウム(19mg)をn−ヘキサンで洗浄し、テトラヒドロフラン10mlを加えた。得られる懸濁液にホスホノ酢酸トリメチル(65mg)を室温で加え、10分間攪拌した後、氷冷し、先に得た油状物のテトラヒドロフラン(5ml)溶液を滴下した。室温で3時間攪拌後、水を加えてクロロホルムで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られる残渣をシリカゲルカラムクロマトグラフィー(溶離液クロロホルム:メタノール=50:1)で精製して油状物を得た。これを塩化メチレンに溶解し、氷冷下、トリフルオロ酢酸5滴を加え、更にジイソプロピルエーテルを加えて析出結晶を濾取し標記化合物(22mg)を得た。
【0530】
融点:230−233℃(分解);
IR(KBr)cm-1;2950,1680,1620;
MS(m/z):442(MH+ )
【0531】
実施例C−27:−−目的物(I)の製造−−:
3−アセチル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(化合物9H−10)
【0532】
(1) マロン酸エチルカリウム(572 mg)に酢酸エチル(60ml)を加え、得られる懸濁液に塩化マグネシウム(343 mg)およびトリエチルアミン(1.0 ml)を室温で加え、5時間攪拌した。
【0533】
一方で実施例C−8(2)で得た7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(1.2 g)のクロロホルム(120 ml)溶液に室温でBOP試薬(1.27g)およびトリエチルアミン(0.8 ml)を加え、20分間攪拌した。この反応液を先の反応液に室温で加え、1日攪拌した。
【0534】
反応液を水に注ぎ、クロロホルムで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=200:1)で精製して、3−{7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−イル}−3−オキソプロピオン酸エチルエステル(397 mg)を得た。
MS(m/z):572(MH+ )
【0535】
(2) 前記(1)で得た化合物(170 mg)をエタノール(2ml)に溶解し、10%塩酸水(10ml)を加えた。室温で30分間、95℃で4時間攪拌した。冷後、炭酸水素ナトリウム水でアルカリ性となし、ついでクロロホルムで抽出した。抽出液を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をジイソプロピルエーテルで結晶化させ、標記化合物(76mg)を得た。
【0536】
融点:112−114℃;
IR(KBr)cm-1;3085,1685,1620;
MS(m/z):400(MH+ )
【0537】
実施例C−28:−−目的物(I)の製造−−:
N−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕グリシンエチルエステル トリフルオロ酢酸塩(化合物9H−11)
【0538】
実施例C−11(1)に記載の方法に準じて、7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(250mg)と塩酸グリシンエチルエステル(78mg)からN−{7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕グリシンエチルエステル(290mg)を得た。
【0539】
これを塩化メチレン(9ml)に溶解し、氷冷下、トリフルオロ酢酸(1.2 ml)を加えた。室温で一日攪拌した後、反応液にジイソプロピルエーテルを加え、析出結晶を濾取し、目的とする化合物9H−11(260mg)を得た。
融点:233−236℃(分解)
【0540】
実施例C−29:−−目的物(I)の製造−−:
N−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕−L−アラニン トリフルオロ酢酸塩(化合物9H−12)
【0541】
実施例C−28と同様の方法により標記化合物を得た。
融点:168−170℃(分解)
【0542】
つぎに製剤の製造例を挙げる。
【0543】
実施例D−1:−−液剤の調製−−:
処方:−−
【0544】
【表51】

【0545】
調製法:−−化合物H−1−1−1およびソルビトールを注射用蒸留水の一部に溶解し、水酸化ナトリウムおよび残りの蒸留水を加え、溶液のpHを5.0 に調製した。この溶液をメンブランフィルター(0.22 μm)で濾過し、注射用液剤を得た。
【0546】
実施例D−2:−−凍結乾燥製剤の調製−−:
処方:−−
【0547】
【表52】

【0548】
調製法:−−化合物H−1−1−1およびマンニトールを注射用蒸留水の一部に溶解し、水酸化ナトリウムおよび残りの蒸留水を加え、溶液のpHを5.0 に調製した。この溶液をメンブランフィルター(0.22 μm)で濾過し、これを凍結乾燥して注射用粉末剤を得た。
【産業上の利用可能性】
【0549】
本発明にかかわる化合物は、リンパ性白血病腫瘍の如き非固形腫瘍のみならず、例えば、肺、乳、胃、子宮、皮膚、腸、膀胱、鼻喉などの各組織に発生する各種の固形腫瘍に対してても顕著な抗腫瘍作用を示す。また、本発明にかかわる化合物は生体に対する安全性が高い。従って、本発明にかかわる化合物は、ヒト腫瘍の治療剤または予防剤として有用である。
【図面の簡単な説明】
【0550】
【図1】ヒト鼻咽腔癌(KB)に対する抗腫瘍効果を示す図である。
【図2】ヒト乳癌(MX−1)に対する抗腫瘍効果を示す図である。
【図3】ヒト結腸癌(WiDr)に対する抗腫瘍効果を示す図である。
【図4】はヒト黒色腫(HMV−2)に対する抗腫瘍効果を示す図である。
【図5】ヒト肺癌(LX−1)に対する抗腫瘍効果を示す図である。
【技術分野】
【0001】
本発明は医薬として有用な抗腫瘍剤に関する。
【背景技術】
【0002】
2−チアゾリル基を有するピリドンカルボン酸誘導体が抗菌活性を有することは知られている。例えば、特開昭61−152682号公報(以下、Ref.1という:特許文献1)の実施例24には次の化合物が記載されている。
【0003】
【化1】

【0004】
また、このRef.1の実施例5には次の化合物が記載されている。
【0005】
【化2】

【0006】
更に、このRef.1の実施例12には、次の化合物が記載されている。
【化3】

【0007】
前記〔化2〕や〔化3〕で表される化合物は特開昭62−33176号公報(以下、Ref.2という:特許文献2)の表1にも記載されている。特開昭60−56959号公報(以下、Ref.3という:特許文献3)の実施例24-4および特開昭61−251667号公報(以下、Ref.4という:特許文献4)の実施例15には次の化合物が記載されている。
【0008】
【化4】

【0009】
特開昭60−163866号公報(以下Ref.5という:特許文献5)の実施例28-16 には次の化合物が記載されている。
【0010】
【化5】

【0011】
更に、特開平2−85255号公報(以下Ref.6という:特許文献6)の実施例8には次の化合物が記載されている。
【0012】
【化6】

【0013】
しかし、以上のRef.1〜6は、これらの化合物が抗菌作用を有することについて言及するだけであって、抗腫瘍活性や抗癌活性については全く教示していない。なお、これらの化合物はその6位にフッ素原子が置換されている点において共通している。
【0014】
また、ある種のピリドンカルボン酸誘導体が抗腫瘍活性や抗癌活性を有することも知られている。例えば、Cancer Research 52, 2818 (1992):非特許文献1は、90種類のピリドンカルボン酸誘導体の抗腫瘍作用を検討した結果、ほとんどのピリドンカルボン酸誘導体に抗腫瘍活性は認められず、認められた化合物は数種にすぎなかった、と報告している。そして、この論文には、1位に置換されているシクロプロピル基および6位と8位に置換されている2個のハロゲン原子が抗腫瘍作用の発現に重要な役割を果たしており、このような置換基をもたないピリドンカルボン酸誘導体は抗腫瘍作用を示さないことが教示されている。
【0015】
【特許文献1】特開昭61−152682号公報
【特許文献2】特開昭62−33176号公報
【特許文献3】特開昭60−56959号公報
【特許文献4】特開昭61−251667号公報
【特許文献5】特開昭60−163866号公報
【特許文献6】特開平2−85255号公報
【非特許文献1】Cancer Research 52, 2818 (1992)
【発明の開示】
【発明が解決しようとする課題】
【0016】
本発明者らは抗腫瘍作用を有する化合物を鋭意探索し、その結果として、1位にシクロプロピル基を持たないピリドンカルボン酸およびその関連化合物が顕著な抗腫瘍作用を有することを見出し、本発明を完成した。
【課題を解決するための手段】
【0017】
本発明によれば2−チアゾリル基を含む下記一般式(I)を有する化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする抗腫瘍剤が提供される。
【0018】
【化7】

【0019】
なお、前記、一般式(I)における基本骨格の各位置を示す番号は、原則として、2−チアゾリル基が結合する位置から反時計回りに順次付すこととする。従って、2−チアゾリル基が結合している位置は1位であり、R6 が結合する位置は7位となる(この番号づけは、通常の場合と異なっていることもあるが、本明細書では、説明の便宜上、このように扱うこともある)。
【0020】
以下に前記一般式(I)における各記号(置換基)について定義し、説明する。
【0021】
一般式(I)における--------- は単結合の存在または非存在を意味する。すなわち、2位の炭素原子と3位の炭素原子の間の結合および4位の炭素原子と置換基R4 の間の結合は単結合であったり、二重結合であったりする。
【0022】
XはNまたはC−Rx を意味し、ここにおいてRx は水素原子またはハロゲン原子を意味する。本明細書において、「ハロゲン」または「ハロゲン原子」なる用語は、フッ素、塩素、臭素またはヨウ素を意味し、フッ素または塩素が好適である。
【0023】
R1 およびR2 は同一または異なり、水素原子、ハロゲン原子、ニトロ基、低級アルコキシ基、低級アルキル基(該低級アルキル基は低級アルコキシカルボニルまたはカルボキシルで置換されていてもよい)、ハロゲンで置換されていてもよいフェニル基もしくはチエニル基、またはフェニルスルホニル基(該フェニル部分はハロゲンもしくはニトロで置換されていてもよい)を意味するか、あるいはR1およびR2 が一緒になってベンゼン環またはナフタレン環を形成し、該ベンゼン環またはナフタレン環はハロゲン、ニトロもしくは低級アルキルで置換されていてもよい。
【0024】
本明細書において、「低級」なる用語は、特に断らないかぎり、この用語が付された基が1〜5個の炭素原子を含むことを意味する。従って、例えばR1 の定義に含まれる低級アルキル基としては、直鎖状または分岐状のものであり、例えば、メチル基,エチル基,n−プロピル基,イソプロピル基,n−ブチル基,tert −ブチル基,ペンチル基が挙げられ、メチル基やエチル基が好適である。また、「低級アルコキシ基」は前記低級アルキル基と酸素原子とが結合したものであり、例えば、メトキシ基やエトキシ基が挙げられる。
【0025】
R3 は水素原子、ベンジル基、水酸基、カルボキシル基またはカルボキシル基に変換しうる基を意味する。
【0026】
置換基R3 の定義に含まれる「カルボキシル基に変換しうる基」としては、化学的手段または酵素学的手段により脱離してカルボキシル基に変換しうる基であればいずれでもよく、必ずしも生体内でカルボキシル基に変換される必要はない。
【0027】
このようなカルボキシル基に変換しうる基としては、ヒドロキシメチル基やホルミル基、エステル体、カルバモイル基またはアミド体が好適である。
【0028】
前記エステル体としては、メチルエステルやエチルエステルの如き低級アルキルエステル、アセトキシメチルエステルや1−アセトキシエチルエステル、ピバロイルオキシメチルエステルの如き低級アルカノイルオキシ低級アルキルエステル、1−エトキシカルボニルオキシエチルエステルの如き低級アルコキシカルボニルオキシ低級アルキルエステル、2−ジメチルアミノエチルエステルのようなジ低級アルキルアミノ低級アルキルエステル、2−(1−ピペリジニル)エチルエステル、3−ブチロラクトニルエステル、コリンエステル、フタリジルエステル、(5−メチル−2−オキソ−1,3−ジオキソール−4−イル)メチルエステルなどが挙げられる。
【0029】
R4 はオキソ基または水酸基を意味する。R4 がオキソ基であり、R3 がカルボキシル基である場合には、一般式(I)で表される化合物はピリドンカルボン酸誘導体となる。
【0030】
5位の置換基たるR5 は水素原子、アミノ基、ハロゲン原子または低級アルキル基を意味し、該低級アルキル基はハロゲンで置換されていてもよい。ここにおけるハロゲンで置換されている低級アルキル基の例としては、トリフルオロメチル基が挙げられる。
【0031】
R6 はN−C結合、C−C結合、S−C結合またはO−C結合により母核と結合している置換基を意味し、より具体的には、以下の(a)〜(e)から選ばれるいずれかの基がその例として挙げられる。
【0032】
(a):R6 は次の式(a)で表される4〜7員の単環性アミノ基である。
【0033】
【化8】

【0034】
(式中、--------- は単結合の存在または非存在を意味し、R6a1、Ra2、R6a3およびR6a4は同一または異なり、C、CH、CH2 、CH2CH2 、CH=CH、S(O)0-2 、O、NまたはN−R6a を意味し、ここでR6a は水素原子、低級アルキル基またはフェニル基を意味し、該フェニル基は低級アルコキシ、低級アルキル、ハロゲンまたはニトロで置換されていてもよい。kおよびmは同一または異なり、0または1の整数を意味する。R6a5、R6a6およびR6a7については、後述する。)
【0035】
式(a)には、例えば、次の〔化9〕で表される基が包含され、これらの基は、N−C結合(mが0の場合)またはC−C結合(mが1の場合)により母核の7位と結合している。
【0036】
【化9】

【0037】
(式中、R6a 、R6a5、R6a6、R6a7およびmは前掲と同じものを意味する。)
【0038】
式(a)における置換基R6a5は、水素原子、メチレン基または次の式(R6a −5)で表される基を意味する:
【0039】
【化10】

【0040】
〔式中、R6a51 は水素原子またはフェニル基(該フェニル基はハロゲンで置換されていてもよい)を意味するか、またはフェニルもしくはハロゲノフェニルで置換されていてもよい低級アルキル基を意味し、R6a52 は水素原子、低級アルキル基または水素原子に変換しうる基であり、nは0〜4の整数である。〕
【0041】
置換基R6a52 の定義に含まれる「水素原子に変換しうる基」としては、加水分解の如き化学的手段または酵素学的手段により水素原子に変換できるものならばいずれでもよく、必ずしも生体内で水素原子に変換される必要はない。
【0042】
このような「水素原子に変換しうる基」としては、ホルミルやアセチルの如きアシル基、エトキシカルボニルの如きオキシカルボニル基を有する基、アミノ酸残基やペプチド残基の他、例えばo−ニトロフェニルスルフェニル、トリメチルシリル、テトラヒドロピラニル、ジフェニルホスフィニルなどが挙げられ、殊にアミノ酸残基やペプチド残基が好適である。
【0043】
アミノ酸は、一般に3文字からなる英文字でもって表され、本明細書でもこれに従う。また、L−体、D−体またはこれらの混合体は、3文字の頭に「L−」、「D−」または「DL−」なる記号を付すことにより区別することにする。これらの異性体を区別することなく総称するときは、これらの記号は付さないことにする。
【0044】
アミノ酸残基としては、例えば、Gly(グリシン) 、Ala(アラニン)、Arg(アルギニン)、Asn(アスパラギン)、Asp(アスパラギン酸) 、Cys(システイン)、Glu(グルタミン酸) 、His(ヒスチジン) 、Ile(イソロイシン)、Leu(ロイシン) 、Lys(リジン)、Met(メチオニン)、Phe(フェニルアラニン) 、Pro(プロリン) 、Ser(セリン)、Thr(トレオニン) 、Trp(トリプトファン)、Tyr(チロシン)、Val(バリン)、Nva(ノルバリン) 、Hse(ホモセリン)、4-Hyp(4−ヒドロキシプロリン)、5-Hyl(5−ヒドロキシリジン) 、Orn(オルニチン) などのアミノ酸の残基が挙げられる。
【0045】
ペプチド残基としては、前述のアミノ酸が2〜5個、好ましくは2〜3個連結されたペプチド残基であり、例えば、Ala-Ala 、Gly-Phe 、Nva-Nva 、Ala-Phe、Gly-Gly 、Gly-Gly-Gly 、Ala-Met 、Met-Met 、Leu-Met 、Ala-Leu などのペプチドの残基が挙げられる。
【0046】
これらのアミノ酸やペプチドの残基における立体化学的配置は、D−体、L−体またはこれらの混合体であってもよいが、L−体が好ましい。更に、「水素原子に変換しうる基」がアミノ酸やペプチドの残基であるときは、これらの残基中にも不斉炭素原子を有することもある。不斉炭素原子を有するアミノ酸残基の例としては、Ala, Leu, Phe, Trp, Nva, Val, Met, Ser, Lys, Thr, Tyr などのアミノ酸の残基が挙げられ、不斉炭素原子を有するペプチド残基の例としては、不斉炭素原子を有するこれらのアミノ酸残基を構成成分とするものが挙げられる。
【0047】
式(a)に含まれる置換基R6a6は、水素原子、ハロゲン原子、水酸基、アジド基、ホルミル基、オキソ基、低級アルコキシ基、低級アルキルチオ基または低級アルキル基(該低級アルキル基はハロゲンもしくはヒドロキシで置換されていてもよい)を意味する。
【0048】
また、式(a)に含まれる置換基R6a7は、R6a6と同じものを意味するか、あるいは次の式(R6a −7)で表されるスピロ環状アミノ基を意味する:
【0049】
【化11】

【0050】
〔式中、pは3または4の整数を意味する。〕
なお、R6a6とR6a7とは、同一または異なるものを選択してもよい。
【0051】
(b):7位の置換基R6 は次の式(b) で表される二環性アミノ基である。
【0052】
【化12】

【0053】
(式中、--------- は単結合の存在または非存在を意味し、q,sおよびtは同一または異なり、0〜2の整数であり、qとtの和は2または3である。R6b1はC、CH、CH2またはN−R6b を意味し、ここにおいてR6b は水素原子または低級アルキル基を意味し、R6b2はC、CH、CH2 、CH2CH2 またはCH=CHを意味し、R6b3はC、CH、CH2 またはOを意味し、u、vおよびwは同一または異なり、0または1の整数であって、これらの和が1〜3であることを意味し、R6b4およびR6b5は同一または異なり、水素原子、水酸基、低級アルキル基、アミノ基、モノもしくはジ−低級アルキルアミノ基またはモノもしくはジ−低級アルキルアミノ低級アルキル基を意味する。)
【0054】
式(b)には、例えば、次の〔化13〕で表される基が包含され、これらの基はN−C結合により母核の7位と結合している。
【0055】
【化13】

【0056】
(式中、------、R6b 、R6b4およびR6b5は前掲と同じものを意味する。)
【0057】
(c):R6 は、次の式(c)で表される3〜7員の環状基である。
【0058】
【化14】

【0059】
(式中、--------- は単結合の存在または非存在を意味し、R6c1、R6c2、R6c3およびR6c4は同一または異なり、C、CH、CH2 、CH2CH2 、CH=CH、S(O)0-2 、 O、NまたはN−R6c を意味し、ここでR6c は水素原子または低級アルキル基を意味する。R6c5はO、SまたはCH2を意味し、R6c6およびR6c7は同一または異なり、水素原子、アミノ基または低級アルキル基を意味する。f、gおよびhは同一または異なり、0または1の整数を意味する。)
【0060】
式(c)には、例えば、次の〔化15〕で表される基が包含され、これらの基はC−C結合(R6c5がCH2 であるか、hが0の場合)、O−C結合(R6c5がOでありhが1の場合)またはS−C結合(R6c5がSでありhが1の場合)により母核の7位と結合している。
【0061】
【化15】

【0062】
(式中、R6c、R6c5 、R6c6 、R6c7 およびhは前掲と同じものを意味する。)
【0063】
(d):R6 は次の式(d)で表されるアミノ基である。
【0064】
【化16】

【0065】
(式中、R6d1はSまたはNHを意味し、R6d2およびRd3は同一または異なり、水素原子または低級アルキル基を意味し、iは0または1の整数を意味し、jは1〜5の整数を意味する。)
【0066】
式(d)には、低級アルキルで置換されていてもよいアミノ基(iが0の場合)、低級アルキルで置換されていてもよいアミノアルキルアミノ(iが1でR6d1 がNHの場合)および低級アルキルで置換されていてもよいアミノアルキルチオ(iが1でR6d1がSの場合)が含まれる。
【0067】
(e):R6 は、水酸基、低級アルキル基、低級アルケニル基または低級アルキニル基のいずれかである。低級アルケニル基の例としては、ビニル基が、低級アルキニル基の例としてはエチニル基が、それぞれ挙げられる。
【0068】
一般式(I)で表される本発明にかかわる化合物には、その立体異性体もしくはその光学異性体またはこれらの生理的に許容される塩あるいは場合によって存在することもあるこれらの水和物や溶媒和物が包含される。
【0069】
塩としては、その構造中に存在することもあるカルボキシル基部分の塩とアミノ基や環状アミノ基の如き塩基性置換基部分の酸付加塩とがある。
【0070】
該カルボキシル基での塩としては、例えば、ナトリウム,カリウム,マグネシウム,亜鉛,銀,アルミニウム,白金などの金属との塩、またはジメチルアミノエタノール,メチルアミノエタノール,トリエタノールアミン,グアニジン等の有機塩基との塩が挙げられる。
【0071】
また、塩基性置換基での酸付加塩としては、例えば、塩酸,臭化水素酸,ヨウ化水素酸,硫酸,リン酸などの無機酸との塩、またはメタンスルホン酸,シュウ酸,マレイン酸,フマル酸,マロン酸,乳酸,リンゴ酸,クエン酸,酒石酸,安息香酸,p−トルエンスルホン酸,アスコルビン酸,グルクロン酸,2−ヒドロキシエタンスルホン酸,ラクトビオン酸,グルコヘプトン酸, グルコン酸などの有機酸との塩が挙げられる。
【0072】
以上、詳述した本発明にかかわる化合物は、冒頭に述べた6位がフッ素原子である極一部の化合物を除き、新規である。
【0073】
本発明にかかわる化合物は、いずれも抗腫瘍剤ないし抗癌剤として優れているが、その内でも下記一般式(I−a)に包含される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物が抗腫瘍剤として好ましい。
【0074】
【化17】

【0075】
(式中、------、R1、R2 、R3 、R4 、R5 、X、R6a1 、R6a2、R6a3、R6a4、R6a5、R6a6、R6a7およびkは前掲と同じものを意味する。)
【0076】
さらに抗腫瘍剤として好適な本発明に係わる化合物は、下記一般式(I−b)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物である。
【0077】
【化18】

【0078】
(式中、Wは水素原子またはフッ素原子であり、------、R1 、R2 、R3 、R4 、R5、R6a5、R6a6およびR6a7は前掲と同じものを意味する。)
【0079】
抗腫瘍剤として特に好適な本発明にかかわる化合物は、下記一般式(I−c)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物である。
【0080】
【化19】

【0081】
(式中、R6a511は低級アルキル基であり、R6a61 およびR6a71 は、同一または異なり、水素原子、低級アルコキシ基または低級アルキル基を意味する。)
【0082】
一般式(I−c)で表される化合物の構造上の特徴は、(1)1,8−ナフチリジン骨格を基本とし、(2)1位に2−チアゾリル基が結合されており、(3)3位がカルボキシル基であり、(4)4位がオキソ基であり、(5)5位および6位にフッ素原子の如き置換基が存在せず、(6)7位に特定の置換基を有する1−ピロリジニル基が結合されている、ことにあり、特に1位と7位の置換基の組み合わせと6位にフッ素原子を含まない点にある。
【0083】
一般式(I−c)に包含される具体的化合物としては、例えば、1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩が挙げられる。
【0084】
本発明にかかわる化合物は、具体的には後記実施例に記載されているが、この他に以下の化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物が挙げられる。
【0085】
7−(3−アミノ−4−フルオロ−1−ピロリジニル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0086】
7−(3−アミノ−4−メトキシ−3−メチル−1−ピロリジニル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0087】
5,8−ジヒドロ−2−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸
【0088】
8−(4−フルオロ−2−チアゾリル)−5,8−ジヒドロ−2−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−5−オキソピリド〔2,3−d〕ピリミジン−6−カルボン酸
【0089】
5−アミノ−1−(4−フルオロ−2−チアゾリル)−1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1,8−ナフチリジン−3−カルボン酸
【0090】
5−アミノ−7−(1−アミノ−3−アザビシクロ〔3.1.0〕ヘキサ−3−イル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0091】
以下において示されることもある立体構造は、特に断らないかぎり、絶対的なものではなく相対的なものである。そして、以下の表中の「立体」の欄は7位の相対的な立体構造を示し、光学活性な化合物については(+)(−)もしくは(R)(S)で表すことにする。
【発明の効果】
【0092】
本発明にかかわる化合物は、リンパ性白血病腫瘍の如き非固形腫瘍のみならず、例えば、肺、乳、胃、子宮、皮膚、腸、膀胱、鼻喉などの各組織に発生する各種の固形腫瘍に対してても顕著な抗腫瘍作用を示す。また、本発明にかかわる化合物は生体に対する安全性が高い。従って、本発明にかかわる化合物は、ヒト腫瘍の治療剤または予防剤として有用である。
【0093】
以下において用いられることもある記号は次の意味を有する。
Me:メチル基、
Et:エチル基、
Ac:アセチル基、
Bz:ベンジル基、
Ph:フェニル基、
Bu:ブチル基、
t−:tert−。
[試験例]
【0094】
つぎに本発明にかかわる化合物の抗腫瘍活性について、試験例を挙げて説明する。市販抗癌剤たるエトポシド(EP)および市販抗菌剤たるシプロフロキサシン(CPFX)およびエノキサシン(ENX)を対照として用いた。
【0095】
試験例 1:P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0096】
P388リンパ性マウス白血病細胞を用い、MTT〔3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] 法により、試験化合物の抗腫瘍活性を試験した。
【0097】
1000〜2000個のP388リンパ性マウス白血病細胞と所定濃度の試験化合物を含む培養液の0.1 mlずつを96穴プレ−トの各穴に加え、37℃、5%炭酸ガス条件下で72時間培養した。培養後、MTT(5mg/ml)溶液の0.02mlずつを各穴に添加し、更に4時間培養した。培養液を遠心分離(4℃、2000rpm×20分)し、上清を吸引除去した。ついで0.1 mlのジメチルスルホキシドを各穴に加えて形成されているフォルマザン(formazan)を溶解し、更に0.1 mlのジメチルスルホキシドを加えた。この溶液の吸光度(OD)をマルチスキャンバイクロマティック(主波長570 nm,副波長690 nm)で測定した。未処理細胞(コントロール)の吸光度を100 %とし、最小二乗法により50%増殖抑制濃度(IC50:μg/ml)を算出した。
【0098】
結果を以下の第1表〜第9表に示す。なお、対照化合物のデータは第9表に示されている。
【0099】
第1表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【化20】

【0100】
【表1】

*:1=HCl
【0101】
【表2】

*:1=HCl、 2=1/2 HCl、 3=1/5 HCl
【0102】
【表3】

*:1=HCl
【0103】
【表4】

*:「−」=遊離体、 1=HCl
【0104】
第2表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0105】
【化21】

【0106】
【表5】

*:1=HCl
【0107】
【表6】

*:「−」=遊離体、 1=HCl
【0108】
【表7】

*:「−」=遊離体、 1=HCl
【0109】
【表8】

*:「−」=遊離体、 1=HCl
【0110】
【表9】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0111】
【化22】

【0112】
第3表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0113】
【化23】

【0114】
【表10】

*:「−」=遊離体、 1=HCl
【0115】
第4表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0116】
【化24】

【0117】
【表11】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0118】
第5表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0119】
【表12】

【0120】
第6表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0121】
【表13】

【0122】
第6表のつづき
【0123】
【表14】

【0124】
第7表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0125】
【化25】

【0126】
【表15】

*:「−」=遊離体、 1=HCl、 5=4/3 CF3COOH 、 6=3/2 HCl
【0127】
【化26】

【0128】
第8表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0129】
【化27】

【0130】
【表16】

*:1=HCl、 7=CF3COOH
【0131】
第9表 P388リンパ性マウス白血病細胞に対する抗腫瘍活性
【0132】
【表17】

【0133】
第1表〜第9表に示すように、P388リンパ性マウス白血病細胞に対する本発明にかかわる化合物のin vitroにおける抗腫瘍活性(IC50)は、優れている。一方、第9表に示すように、市販抗菌剤たるシプロフロキサシンならびにエノキサシンは、実質的に抗腫瘍活性をもたない。
【0134】
試験例 2:ヒト癌細胞に対するin vitroにおける抗腫瘍活性
【0135】
500 〜2000個のヒト癌細胞を含む培養液の0.1 mlずつを96穴プレ−トの各穴に加え、37℃、5%炭酸ガス条件下で約20時間培養した。培養後、所定濃度の試験化合物の溶液を添加し、更に72時間培養した。培養後、MTT(5mg/ml)溶液の0.01mlずつを各穴に添加し、更に4時間培養した。培養液の上清を吸引除去し、ついで0.1 mlのジメチルスルホキシドを各穴に加えて形成されているフォルマザンを溶解し、更に0.1 mlのジメチルスルホキシドを加えた。この溶液について、試験例1と同様にして50%増殖抑制濃度(IC50:μg/ml)を算出し、つぎの第10表に示す結果を得た。
【0136】
【表18】

表中の数字はIC50(μg/ml)を示す。
【0137】
【表19】

表中の数字はIC50(μg/ml)を示す。
【0138】
第10表に示すように本発明にかかわる化合物のヒト癌細胞に対するin vitroにおける抗腫瘍活性(IC50)は優れている。特に、本発明にかかわるH系化合物、すなわち6位が非置換体の化合物は、市販抗癌剤たるエトポシド(EP)と同等以上の抗腫瘍活性を示した。
【0139】
試験例 3:P388リンパ性マウス白血病細胞移植マウスにおける延命効果
【0140】
1×106個のP388リンパ性マウス白血病細胞をSLC :BDF1マウス(8〜10週齢,雌,1群7匹)の腹腔内に移植した。試験化合物(薬剤)を0.1 N−NaOHに溶解するか、または0.4 %カルボキシメチルセルロース溶液に懸濁し、これを各投与濃度になるように蒸留水または0.4 %カルボキシメチルセルロース溶液で希釈した。各溶液の0.2 mlを移植の翌日(1日目)と5日目の2回、腹腔内(ip)に投与した。30日間にわたってマウスの生死を観察し、各群の生存日数中央値を求め、下記式により延命率(ILS:%)を算出した。
【0141】
【数1】

【0142】
薬効の判定は米国の国立癌研究所の基準に従って行った。すなわち、延命率が≧75%,++(著効);20〜74%,+(有効);≦19%,−(無効)と判定した。 結果を第11表に示す。
【0143】
【表20】

【0144】
【表21】

【0145】
【表22】

【0146】
【表23】

【0147】
第11表に示すように、P388リンパ性マウス白血病細胞を移植したマウスに対する本発明にかかわる化合物による延命効果は優れている。
【0148】
試験例 4:コロン26マウス腫瘍細胞移植マウスにおける腫瘍増殖抑制効果
【0149】
SLC :CDF1雌性マウス(7〜9週齢,1群7匹)の腹部皮内にコロン26マウス腫瘍細胞の2%ブライ(brei) を0.1 ml移植した。試験化合物(薬剤)を0.1 N−NaOHで溶解し、これを各投与濃度になるように蒸留水で希釈した。各溶液の0.2 mlを移植の翌日(1日目)より9日目まで1日1回、腹腔内(ip)に投与した。移植後、21〜22日目の腫瘍径より推定腫瘍重量を求め、下記式より、対照群に対する薬剤投与群の腫瘍増殖抑制率(IR:%)を算出し、第12表の結果を得た。
【0150】
【数2】

【0151】
【表24】

【0152】
【表25】

【0153】
第12表に示すように、コロン26マウス腫瘍細胞を移植したマウスに対する本発明にかかわる化合物の腫瘍増殖抑制効果(IR)は優れている。
【0154】
以下の試験例5〜9は、ヒト癌細胞をヌードマウスに移植し、これにNaOHを含む水溶液で溶解した試験化合物を投与し、癌細胞増殖抑制の程度の強さを観察したものである。
【0155】
以下の試験例5〜9の結果は第1図〜第5図に示されており、そこには試験例4で説明した腫瘍増殖抑制率(IR)の経日変化が示されている。また、各図には各化合物の投与量(mg/kg/day)および観察最終日での腫瘍増殖抑制率も示されている。
【0156】
ここで説明の便宜上、試験化合物のヌードマウスへの投与スケジュールについて述べる。ヌードマウスにヒト癌細胞を移植した日からx日後に試験化合物をy日間投与〔腹腔内投与(ip)〕し、その後、z日間投薬を中止(休薬) し、その後、再び試験化合物をy日間投薬したとき、投薬(y日間)および休薬(z日間)のサイクルを「クール(course)」と名付けた。この場合の投薬スケジュールは次の記号により表されるものとする。
【0157】
〔(x)(y)(z)(クール)(ip)〕
【0158】
つぎに例を挙げてこの記号について説明する。但し、矢印は投薬日を示す。
【0159】
〔例〕 移植後25日目に1回投薬(ip)し、その後6日間の休薬期間をもうけた後、再度1回投薬する。これを5回繰り返す。
【0160】
【表26】

【0161】
試験例 5:ヒト鼻咽腔癌細胞移植ヌードマウスに対する抗腫瘍効果
【0162】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(9〜14週齢、1群5〜7匹)。
使用癌細胞 :ヒト鼻咽腔癌KB。
癌細胞の移植:2 〜2.5 ×106 個の癌細胞をマウスの腹部皮内に移植。
投薬スケシ゛ュール :〔(5)(1)(6)(6 クール)(ip)]。
結 果:第1図。
【0163】
試験例 6:ヒト乳癌細胞移植ヌードマウスに対する抗腫瘍効果
【0164】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(7〜9週齢、1群5〜7匹)。
使用癌細胞 :ヒト乳癌MX−1。
癌細胞の移植:2mm3 の癌組織片をマウスの背部皮下に移植。
投薬スケシ゛ュール :〔(15 〜23)(1)(6)(6 クール)(ip)]。
結 果:第2図。
【0165】
試験例 7:ヒト結腸癌細胞移植ヌードマウスに対する抗腫瘍効果
【0166】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(9週齢、1群6匹)。
使用癌細胞 :ヒト結腸癌WiDr。
癌細胞の移植:2.5 ×106 個の癌細胞をマウスの腹部皮内に移植。
投薬スケシ゛ュール :[(7)(1)(6)(6クール)(ip)]。
結 果:第3図。
【0167】
試験例 8:ヒト黒色腫移植ヌードマウスに対する抗腫瘍効果
【0168】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(8〜15週齢、1群6〜7匹)。
使用癌細胞 :黒色腫HMV−2。
癌細胞の移植:2.5 〜4.4 ×106 個の癌細胞をマウスの腹部皮内に移植。
投薬スケシ゛ュール :[(8〜10)(1)(6)(9 クール)(ip)]。
結 果:第4図。
【0169】
試験例 9:ヒト肺癌移植ヌードマウスに対する抗腫瘍効果
【0170】
以下の条件に従って実験を行った。
実験条件:
使用動物 :雌性BALB/c ヌードマウス(13週齢、1群6匹)。
使用癌細胞 :ヒト肺癌LX−1。
癌細胞の移植:2mm3 の癌組織片をマウスの背部皮下に移植。
投薬スケシ゛ュール :[(19〜26)(1)(6)(5 〜6 クール)(ip)]。
結 果:第5図。
【0171】
以上の第1図〜第5図に示すように本発明にかかわる化合物は、ヌードマウスに移植したヒト癌細胞の増殖を顕著に抑制した。
【0172】
試験例 10:急性毒性
【0173】
マウスに所定濃度の試験液を投与(0.1ml/体重10g) し、投与後14日目におけるマウスの死亡率からLD50値を算出し、次表の結果を得た。なお、次表において、H系化合物については雌性BALB/c CrSlcマウス( 1群5〜10匹、10週齢)に対する毒性を、またF系化合物については雌性JCL:ICRマウス(1群5〜10匹)に対する毒性をみた。
【0174】
【表27】

【0175】
第13表に示すように、本発明にかかわる化合物の急性毒性は、市販抗癌剤たるエトポシド(EP)と同程度である。
【0176】
以上の試験結果に示すとおり、本発明にかかわる化合物は、リンパ性白血病腫瘍の如き非固形腫瘍のみならず、例えば肺、乳、胃、子宮、皮膚、腸、膀胱、鼻咽などの各組織に発生する各種の固形腫瘍に対して顕著な抗腫瘍活性を示す。また、本発明にかかわる化合物の安全性も高い。従って、本発明にかかわる化合物はヒト腫瘍の治療剤または予防剤として有用である。
【0177】
本発明にかかわる化合物の投与量は、化合物の腫瘍抑制作用量であり、その薬力学的特性,投与方法,症状・年齢,処置形式(予防又は治療)などにより異なる。通常、1日につき、体重1kg当り約0.4 mg〜約20mg、好ましくは約1mg〜約10mg、特に好ましくは3〜6mgである。例えば、体重約50kgの患者には、1日当り合計約20mg〜約1g,好ましくは50mg〜500mg、特に好ましくは150mg〜300mgの活性成分が投与される。1日に2〜4回に分割投与してもよい。投与経路は経口、非経口のいずれでもよいが、非経口投与が推奨される。
【0178】
本発明にかかわる化合物は、製剤の形で投与されるのが一般的である。これらの製剤は、本発明にかかわる化合物と製剤担体とを配合することにより調製できる。例えば、非経口投与製剤たる液剤における製剤担体としては溶剤が必須の成分であり、このほか等張化剤、可溶化剤、無痛化剤、pH調節剤、緩衝剤、保存剤などの補助成分が、適宜、配合される。
【0179】
溶剤としては、水が一般的に用いられ、プロピレングリコールの如き有機溶媒または水と有機溶媒との混合物も用いられる。
【0180】
等張化剤としてはソルビットやマンニットの如き糖類、塩化ナトリウムなどが挙げられ、糖類が好適である。
【0181】
pH調節剤としては水酸化ナトリウムの如き塩基または塩酸やリン酸の如き酸が挙げられる。
【0182】
可溶化剤としてはポリソルベート80やプルロニックF68の如き界面活性剤、または、乳酸,メタンスルホン酸などの本発明にかかわる化合物と酸付加塩を形成しうる有機酸などが挙げられる。
【0183】
無痛化剤としては塩酸リドカインや塩酸プロカインなどが、保存剤としてはベンジルアルコールなどが、安定化剤としてはアスコルビン酸の如き抗酸化剤が、緩衝剤としてはリン酸、クエン酸、乳酸などの酸の塩などがそれぞれ挙げられる。
【0184】
注射剤や輸液剤の如き液剤は本発明にかかわる化合物を溶剤に溶解または懸濁、好ましくは溶解し、所望により溶解もしくは懸濁の前もしくは後にその他の補助成分を配合することにより調製できる。凍結乾燥製剤は、これらの液剤を凍結乾燥することにより調製でき、投与するとき溶剤で再溶解または再懸濁される。
【0185】
また、錠剤やカプセル剤、顆粒剤、細粒剤、散剤の如き固形製剤における担体としては、本発明化合物と反応せず、当分野で使用されているものならばいずれでもよいが、例えば、デンプン,マンニット,結晶セルロース,カルボキシメチルセルロースなどが使用される。
【0186】
なお、これらの製剤には、本発明にかかわる化合物とは別に、治療上有効な他の医薬成分を更に含有していてもよい。
[製造方法]
【0187】
つぎに本発明にかかわる化合物の製造方法について説明する。本発明にかかわる化合物は、基本的には、抗菌性ピリドンカルボン酸の製造方法とほぼ同様な方法により製造できる。以下には、代表的な製造方法である7位置換法による製造方法を説明する。その他の製造方法については、後記製造例において詳細に説明する。
【0188】
7位がN−C結合、S−C結合またはO−C結合により母核と結合している本発明にかかわる化合物は、次の一般式(II)
【0189】
【化28】

【0190】
(式中、Lは脱離しうる基であり、----、R1 、R2 、R3 、R4 、R5 およびXは前掲と同じものを意味する。)で表される化合物またはこれらの塩と、置換基R6 に対応するアミン類、チオール類またはアルコール類とを反応させることにより製造することができる。
【0191】
式(II)の脱離しうる基(L)は、前記アミン類などと置換して脱離し得るものならばいずれでもよく、例えば、ハロゲン原子、低級アルコキシ基、低級アルキルチオ基、低級アルキルスルフィニル基、低級アルキルスルホニル基、アリルスルホニル基、低級アルキルスルホニルオキシ基、アリルスルホニルオキシ基などが挙げられ、特にフッ素原子や塩素原子の如きハロゲン原子が好適である。
【0192】
また、一方の原料たるアミン類は、先に説明した置換基R6 に含まれるmが0である(a) 群の単環性アミノ基、(b) 群の二環性アミノ基、iが0である(d) 群のアミノ基などに対応するものがその例として挙げられる。チオール類やアルコール類としては、置換基R6 に含まれるR6c5 がSやOでありhが1である(c) 群やR6d1 がSでありiが1である(d) 群に含まれる基に対応するものが例示される。
【0193】
化合物(II)とアミン類などとの反応は、無溶媒下または適当な溶媒中、好ましくは塩基の存在下、10〜150 ℃の温度範囲で実施することができる。溶媒としては、アセトニトリルや水, エタノール, ピリジン, ジメチルスルホキシド, 1−メチル−2−ピロリドンなどが使用される。塩基は酸受容体として機能するものであり、例えば、トリエチルアミン, 1,8−ジアザビシクロ〔5.4.0 〕−7−ウンデセンまたは炭酸ナトリウムや炭酸水素ナトリウムなどの炭酸塩、水素化ナトリウム等が使用される。アミン類を使用する時は、これを過剰に用いて酸受容体としての役割を兼ねそなえさせることもできる。
【0194】
なお、原料として使用される化合物(II)も新規であり、例えば、後記製造例により製造することができる。
【0195】
本法により得られる本発明にかかわる化合物がエステル体である場合、そのエステル部分を常法により加水分解することによりカルボン酸体に変換することができる。また、逆にカルボン酸部分を常法によりエステル化したり、またはカルボキシル基に変換しうる基に導くこともできる。更に、保護されたアミノ基が存在するときは、常法により、該保護基を脱離することもできる。
【0196】
このようにして製造される本発明にかかわる化合物は、常法に従って、単離、精製される。単離・精製条件によって、塩の形、遊離カルボン酸や遊離アミンの形で得られるが、これらは、目的に応じて相互に変換され、所望の化合物が製造できる。
【0197】
化合物がラセミ体であるときは、必要なら、公知の方法を適用することにより、それぞれの光学異性体に分離することができる。化合物の立体異性体(シス型−トランス型、R体−S体)や光学活性体(+体や−体)は、必要なら、通常の方法、例えば、分別結晶法やクロマトグラフィー法などにより、互いに分離することができる。
【実施例】
【0198】
つぎに実施例を挙げて本発明にかかわる化合物の製造方法について詳細に説明する。なお、以下において、シリーズAの実施例には中間体(II)の製造方法を、シリーズBの実施例には原料アミン類の製造方法を、シリーズCの実施例には目的物(I) の製造方法を、シリーズDの実施例には製剤の製造方法を、それぞれ具体的に説明する。
【0199】
シリーズA:中間体(II)の製造法
【0200】
実施例A−1:−−中間体(II)の製造−−:
7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0201】
(1) 2,6−ジクロロピリジン(20g)をテトラヒドロフラン(200ml)に溶解し、アルゴン気流下、−78℃でn−ブチルリチウム(1.6M)のn−ヘキサン溶液(84.5ml)を30分で滴下した。同温度で1時間攪拌後、大過剰の二酸化炭素(固体)を加えた。1時間攪拌後、−10℃まで昇温させ、水、塩酸を順次加え、pH1〜2となし、酢酸エチルで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し乾固させた。得られた固体に塩化チオニル(40ml)を加え、3時間加熱還流した。過剰の塩化チオニルを減圧留去し、粗生成物を減圧蒸留して、2,6−ジクロロニコチン酸クロリド(19.8g)を得た。
【0202】
沸点:97−99℃/1mmHg;
IR(neat)cm-1:1784
【0203】
(2) 金属マグネシウム(5.36g)、マロン酸ジエチルエステル(35.4g)およびエタノール(27ml)から誘導されたエトキシマグネシウムマロン酸ジエチルエステルをテトラヒドロフラン(35ml)およびトルエン(140 ml)からなる混合溶液に溶解する。この溶液を氷冷し、攪拌下、これに前項で得た酸クロリド(44.9g)を含むテトラヒドロフラン(19ml)およびトルエン(32ml)からなる混液を滴下した。滴下終了後、室温で一夜攪拌した。減圧濃縮し、残渣に塩酸水を加え、酢酸エチルで抽出した。これを無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して油状物を得た。これに水(190 ml)およびp−トルエンスルホン酸(0.1 g)を加えて2時間還流した。冷却後、クロロホルムで抽出し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して油状物を得た。粗生成物を減圧蒸留して2,6−ジクロロニコチノイル酢酸エチルエステル(45.2g)を得た。沸点:135−140℃/2mmHg
【0204】
(3) 前項(2)で得た化合物(44.9g)、無水酢酸(43.8g)およびオルトギ酸エチル(37.7g)からなる混合物を1時間還流した。減圧乾固し、氷冷下、ジイソプロピルエーテル(500 ml)および2−アミノチアゾール(20g)を加え、室温で5時間攪拌した。析出結晶を濾取して2−(2,6−ジクロロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(52.8g)を得た。
【0205】
融点:119 −122 ℃(ジイソプロピルエーテルから再結晶);
IR(KBr)cm-1:1700
【0206】
(4) 前項(3)で得た化合物(51.7g)をジオキサン(310 ml)に溶解し、炭酸カリウム(21.4g)を加えて、60℃で1時間攪拌した。氷水を加えたのち10%塩酸水で中和し、析出する結晶を濾取した。クロロホルムおよびジイソプロピルエーテルの混液から再結晶して7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(44.6g)を得た。
【0207】
融点:176−177℃;
IR(KBr)cm-1:1724;
NMR(CDCl3 )δ:1.43(t,3H,J=6.5 Hz), 4.45(q,2H, J=6.5 Hz), 7.38(d,1H,J=3.5 Hz),7.52(d,1H,J=8.5 Hz), 7.75(d,1H,J=3.5 Hz), 8.78(d,1H,J=8.5 Hz), 10.00 (s,1H)
【0208】
実施例A−2:−−中間体(II)の製造−−:
7−クロロ−1−(4−フルオロ−2−チアゾリル)−1,4−ジヒドロ−4−オキソ−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0209】
実施例1(4)で得たエステル(250 mg)、N−フルオロ−2,6−ジクロロピリジニウムテトラフルオロボレート(240 mg)および1,2−ジクロロエタン(10ml)からなる混合物を2日間加熱還流した。反応液に水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、酢酸エチルから再結晶して標記化合物(40mg)を得た。
【0210】
融点:174−175℃;
IR(KBr)cm-1:1700;
NMR(CDCl3 )δ:1.42(t,3H,J=6.5 Hz), 4.45(q,2H, J=6.5 Hz), 7.33(d,1H,J=3.5 Hz),7.51(d,1H,J=8.5 Hz), 8.78(d,1H,J=8.5 Hz), 9.85(s,1H)
【0211】
実施例A−3:−−中間体(II)の製造−−:
5,7−ジクロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0212】
(1) 4−アミノ−2,6−ジクロロピリジン(5.5 g)、塩化第一銅(4.4g)および濃塩酸(50ml)の混合物に、氷−塩冷却下、亜硝酸ナトリウム(3.5 g)を少しずつ加えた。同温度で1時間、室温で1.5 時間攪拌後、水を加えてクロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して2,4,6−トリクロロピリジン(5.5 g)を得た。
【0213】
IR(neat)cm-1:1563, 1357, 1155, 851, 823;
NMR(CDCl3 )δ:7.31(s,2H)
【0214】
(2) 前項(1)で得た化合物(5.5 g)とテトラヒドロフラン(55ml)からなる混合物に−78℃でn−ブチルリチウム(1.6 M)のn−ヘキサン溶液(20ml)を滴下した。同温度で1時間攪拌後、大過剰の二酸化炭素(固体)を加えた。1時間攪拌後、0℃まで昇温させ、塩酸水を加えて酸性となし、酢酸エチルで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して残渣にジイソプロピルエーテルを加え、結晶を濾取して2,4,6−トリクロロニコチン酸(6.5 g)を得た。
【0215】
融点:138−141℃;
IR(KBr)cm-1:1715
【0216】
(3) 前項(2)で得た化合物(6.5 g)と塩化チオニル(25ml)からなる混合物を3時間還流した。過剰の塩化チオニルを減圧留去し、粗生成物を減圧蒸留して2,4,6−トリクロロニコチン酸クロリド(6.6 g)を得た。
【0217】
沸点:93−95℃/1mmHg;
IR(neat)cm-1:1791
【0218】
(4) マロン酸モノエチルエステル(3.6 g)とテトラヒドロフラン(30ml)からなる混合物に0℃で臭化メチルマグネシウム(3M)のエーテル溶液(19ml)を滴下した。室温で1時間攪拌後、前項(3)で得た化合物(6.6 g)とテトラヒドロフラン(30ml)の混合物を滴下し、60℃で1.5 時間加熱した。溶媒を減圧留去して残渣に塩酸水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、粗生成物を減圧蒸留して2,4,6−トリクロロニコチノイル酢酸エチルエステル(4.8 g)を得た。
【0219】
沸点:160−162℃/2mmHg;
IR(neat)cm-1:1746
【0220】
(5) 前項(4)で得た化合物(4.8 g)、無水酢酸(4.2 g)およびオルトギ酸エチル(3.6 g)からなる混合物を1.5 時間還流した。減圧乾固し、氷冷下、ジイソプロピルエーテル(100 ml)および2−アミノチアゾール(1.6 g)を加え、室温で3時間攪拌した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、酢酸エチルから再結晶して2−(2,4,6−トリクロロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(4.0 g)を得た。
【0221】
融点:126−127℃;
IR(KBr)cm-1:1691
【0222】
(6) 前項(5)で得た化合物(4.0 g)、炭酸カリウム(1.5 g)および酢酸エチル(40ml)からなる混合物を60℃で1時間加熱した。溶媒を減圧留去して残渣に水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、クロロホルムから再結晶して5,7−ジクロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(2.5 g)を得た。
【0223】
融点:226−227℃;
IR(KBr)cm-1:1737,1692
【0224】
(7) 前項(6)で得たエステル体(1.8 g)と20%塩酸水60mlの混合物を5時間加熱還流し、冷後、水を加えて析出結晶を濾取し、水洗して標記の5,7−ジクロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(1.4 g)を得た。
【0225】
融点:264−266℃;
IR(KBr)cm-1:1729
【0226】
実施例A−4:−−中間体(II)の製造−−:
5−アミノ−7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸
【0227】
(1) 実施例A−3(6)で得た化合物(500 mg)、ベンジルアミン(140mg)、トリエチルアミン(280 mg)およびトルエン(15ml)からなる混合物を30分間還流した。溶媒を減圧留去して残渣に水を加え、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣を酢酸エチルから再結晶して5−ベンジルアミノ−7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(510 mg)を得た。
【0228】
融点:141−143℃;
IR(KBr)cm-1:1733;
NMR(CDCl3 )δ:1.42(t,3H,J=7Hz), 4.41(q,2H,J=7Hz), 4.49(d,2H,J=6.5 Hz),6.47(s,1H), 7.31(d,1H,J=3.5 Hz), 7.32−7.40(m,5H), 7.70(d,1H,J=3.5 Hz), 9.87(s,1H), 11.2−11.7(m,1H)
【0229】
(2) 前項(1)で得たエステル(1.0 g)、濃硫酸(2ml)および酢酸(8ml)からなる混合物を110 ℃で5 時間攪拌し、冷後、水8mlを加え、110℃で1 時間攪拌した。析出結晶を濾取・水洗して740 mgの標記化合物を得た。
【0230】
融点:264−265℃;
IR(KBr)cm-1:1727
【0231】
実施例A−5:−−中間体(II)の製造−−:
7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−5−トリフルオロメチル−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0232】
(1) 2,6−ジクロロ−4−トリフルオロメチルピリジン(5g)とテトラヒドロフラン(50ml)からなる混合物を−78℃に冷却し、n−ブチルリチウム(1.6 M)のn−ヘキサン溶液(16ml)を滴下し、30分間攪拌した。これに大過剰の二酸化炭素(固体)を加え、1時間攪拌した。0℃まで昇温し、酢酸エチルと希塩酸を加えて抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣に塩化チオニル(20ml)を加え、6時間加熱還流した。過剰の塩化チオニルを減圧留去し、残渣を減圧蒸留して2,6−ジクロロ−4−トリフルオロメチルニコチン酸クロリド(3.8 g)を得た。
【0233】
沸点:77−78℃/2mmHg;
IR(neat)cm-1:1797
【0234】
(2) マグネシウム(0.36g)とエタノール(1.5 ml)からなる混合物に1滴の四塩化炭素を加え、マロン酸ジエチル(2.4 g)、エタノール(1.5 ml)およびトルエン(10ml)からなる混合物を滴下し、2時間攪拌した。さらに氷冷下、前項(1)で得た化合物(3.8 g)とテトラヒドロフラン(10ml)の混合物を滴下し、室温で3時間攪拌した。これに酢酸エチルと希塩酸水を加えて抽出し、有機層を水洗し、硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣に水(20ml)とp−トルエンスルホン酸(50mg)を加え、3時間加熱還流した。これにクロロホルムと水を加えて抽出し、有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去して2,6−ジクロロ−4−トリフルオロメチルニコチノイル酢酸エチルエステル(0.9 g)を得た。
【0235】
IR(neat)cm-1:1744,1721;
MS(m/z):330(MH+ )
【0236】
(3) 前項(2)で得た化合物(0.9 g)、オルトギ酸エチル(0.6 g)および無水酢酸(0.7 g)からなる混合物を140 ℃で1.5 時間加熱還流し、減圧乾固した。残渣にジイソプロピルエーテル(20ml)を加え、氷冷下、2−アミノチアゾール(0.3 g)を加え、室温で3時間攪拌後、溶媒を留去した。これにクロロホルムと水を加えて抽出し、有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して2−(2,6−ジクロロ−4−トリフルオロメチルニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(0.37g)を得た。
【0237】
IR(neat)cm-1:1713;
MS(m/z):440(MH+ )
【0238】
(4) 前項(3)で得た化合物(0.37g)、炭酸カリウム(0.13g)および酢酸エチル(10ml)からなる混合物を15分間加熱還流し、酢酸エチルと水を加えて抽出し、有機層を硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣を酢酸エチルから再結晶して標記の7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−5−トリフルオロメチル−1,8−ナフチリジン−3−カルボン酸エチルエステル(0.27g)を得た。
【0239】
融点:184−185℃;
IR(KBr)cm-1:1736,1703
【0240】
実施例A−6:−−中間体(II)の製造−−:
7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル
【0241】
(1) 特開昭61−152682号公報 (Ref.1) に記載の方法に準じて、2,6−ジクロロ−5−フルオロニコチノイル酢酸エチルエステル9.8 gをオルトギ酸エチルと無水酢酸で処理して、2−(2,6−ジクロロ−5−フルオロニコチノイル)−3−エトキシアクリル酸エチルエステルとし、次いで、この化合物に、エタノ−ル中、室温下で2−アミノチアゾ−ルとトリエチルアミンを反応させて、2−(2,6−ジクロロ−5−フルオロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル12.3gを得た。融点:125−126℃
【0242】
(2)上記化合物12.3gを無水ジオキサン中でカリウムt−ブトキシドと反応させて、7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル7.1gを得た。
融点:182−184℃
【0243】
実施例A−7:−−中間体(II)の製造−−:
5,8−ジヒドロ−2−メタンスルホニル−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステル
【0244】
(1) マロン酸モノエチルエステル(12.3g)のテトラヒドロフラン溶液(80ml)を氷冷し、臭化メチルマグネシウム(3M)のエーテル溶液(64ml)を滴下し、20分間攪拌後、4−クロロ−2−メチルチオピリミジン−5−カルボニルクロリド(8.6 g)のテトラヒドロフラン溶液(100 ml)を滴下し、室温で2時間攪拌した。反応液を氷水に注ぎ、濃塩酸でpH5〜6にして、酢酸エチルで抽出した。硫酸ナトリウで乾燥後、溶媒を減圧留去し、シリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して3−(4−クロロ−2−メチルチオピリミジン−5−イル)−3−オキソプロピオン酸エチルエステル(8.0 g)を得た。
【0245】
IR(neat)cm-1:1743;
MS(m/z):275(MH+ )
【0246】
(2) 前項(1)で得た化合物(7.95g)、オルトギ酸エチル(6.80g)および無水酢酸(7.76g)からなる混合物を130 ℃で1時間加熱還流し、減圧濃縮した。氷冷下、ジイソプロピルエーテル(100 ml)および2−アミノチアゾール(3.28g)を加え、室温で一夜攪拌して析出結晶を濾取し、ジイソプロピルエーテルで洗浄した。これを1,4−ジオキサン(70ml)に溶解し、氷冷下、炭酸カリウム(2.72g)を加え、室温で5時間攪拌した。これを氷冷し、氷水(200 ml)を加え、10%塩酸水で中和した。析出結晶を濾取し、水、1,4−ジオキサンおよびジイソプロピルエーテルで順次、洗浄して5,8−ジヒドロ−2−メチルチオ−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステル(6.0 g)を得た。
【0247】
融点:183−184℃;
IR(KBr)cm-1:1736
【0248】
(3) 前項(2)で得た化合物(5.99g)の塩化メチレン溶液(450 ml)を氷冷し、80%のm−クロロ過安息香酸(9.30g)を少量ずつ加え、室温で一夜攪拌した。チオ硫酸ナトリウム水溶液、炭酸水素ナトリウム水溶液および飽和食塩水で順次洗浄し、硫酸ナトリウムで乾燥後、溶媒を減圧留去し、酢酸エチルとジイソプロピルエーテルの混液から再結晶して標記の5,8−ジヒドロ−2−メタンスルホニル−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステル(4.48g)を得た。
【0249】
融点:185−187℃;
IR(KBr)cm-1:1741
【0250】
実施例A−8:−−中間体(II) の製造−−:
実施例A−1からA−6までに記載の方法またはこれに準じる方法により第14表に示す中間体(II)を得た。
【0251】
第14表 中間体(II)
【化29】

【0252】
【表28】

【0253】
【表29】

【0254】
【化30】

【0255】
シリーズB:原料アミン類の製造方法
【0256】
実施例B−1:−−アミン類の製造−−:
トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メチルピロリジン
【0257】
(1) トランス−3−アミノ−1−ベンジル−4−メチルピロリジン(19g)を塩化メチレン(200 ml)に溶解し、二炭酸ジ−t−ブチル(22.9g)の塩化メチレン(20ml)溶液を水冷下加えた。室温で1時間攪拌後、反応液を減圧濃縮して、トランス−1−ベンジル−3−(t−ブトキシカルボニルアミノ)−4−メチルピロリジン(28.2g)を得た。
【0258】
融点:138 −140 ℃(酢酸エチル−n−ヘキサンから再結晶);
IR(KBr)cm-1:3198,1706;
MS(m/z):291(MH+ )
【0259】
(2) 水素化ビス(2−メトキシエトキシ)アルミニウムナトリウムの70%トルエン溶液(40ml)をトルエン(150 ml)で希釈し、前項(1)で得た化合物(10g)を氷冷下、少しずつ加えた。反応液を1時間加熱還流し、氷冷後、過剰の試薬を水で分解した。不溶物を濾別し、濾液を無水硫酸マグネシウムで乾燥後、溶媒を減圧留去した。得られた残渣を塩化メチレン(100 ml)に溶解し、これに二炭酸ジ−t−ブチル(7.5 g)の塩化メチレン(10ml)溶液を氷冷下、加えた。室温で3.5 時間攪拌後、反応液を減圧濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 n−ヘキサン:酢酸エチル=5:1)で精製してトランス−1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メチルピロリジン(9.9 g)を得た。
【0260】
IR(neat)cm-1:1694;
MS(m/z):305(MH+ )
【0261】
(3) 前項(2)で得た化合物(1.52g)をエタノール(50ml)に溶解し、10%パラジウム炭素(200 mg)を加えて、50℃で理論量の水素を吸収させた。触媒を濾去後、溶媒を減圧留去して目的のトランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メチルピロリジン(950 mg)を得た。
【0262】
IR(neat)cm-1:3337,1685;
MS(m/z):215(MH+ )
【0263】
実施例B−2:−−アミン類の製造−−:
(+)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン
【0264】
(1) 特開平2−69474 号公報に記載のトランス−3−アミノ−1−ベンジル−4−メトキシピロリジン(ラセミ体、22.4g)と19.6gのL−酒石酸をメタノール(350 ml)に溶解し、室温で7時間放置した。析出したL−酒石酸塩を濾取し、メタノールと水にて再結晶して下記物性のトランス−3−アミノ−1−ベンジル−4−メトキシピロリジンL−酒石酸塩(14.1g)を得た。
【0265】
次いで、総ての母液を合わせ、溶媒を減圧下留去し、飽和食塩水を加え、炭酸カリウムにて塩基性となし、酢酸エチルで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣とD−酒石酸(6.73g)をメタノール(180 ml)に溶解し、室温で7時間放置した。析出したD−酒石酸塩を濾取し、メタノールと水にて再結晶して下記物性のトランス−3−アミノ−1−ベンジル−4−メトキシピロリジンD−酒石酸塩(9.9 g)を得た。
【0266】
L−酒石酸塩;
融点:206−208℃(分解);
〔α〕D 29 +33.0°(c=1.003 ,水);
元素分析値(%):C12H18N2O ・3/2 C4H6O6として;
計算値 C,50.11 ;H,6.31;N,6.49;
実測値 C,49.85 ;H,6.26;N,6.27;
【0267】
D−酒石酸塩;
融点:207−209℃(分解);
〔α〕D 29 −33.4°(c=1.020 ,水);
元素分析値(%):C12H18N2O ・3/2 C4H6O6として;
計算値 C,50.11 ;H,6.31;N,6.49;
実測値 C,50.35 ;H,6.32;N,6.47;
【0268】
(2) 前項(1)で得たL−酒石酸塩(3.65g)に飽和食塩水を加え、炭酸カリウムにて中和し、酢酸エチルで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して(+)−トランス−3−アミノ−1−ベンジル−4−メトキシピロリジン(1.23g)を得た。
〔α〕D 27 +32.2°(c=1.053 ,メタノール)
【0269】
(3) 前項(2)で得た化合物(5.74g)をメタノール(65ml)に溶解し、氷冷下、二炭酸ジ−t−ブチル(7.29g)を加えた。同温度で30分間、室温で4時間攪拌した。溶媒を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製して、(+)−トランス−1−ベンジル−3−(t−ブトキシカルボニルアミノ)−4−メトキシピロリジン(8.55g)を得た。
【0270】
融点:44−45℃;
〔α〕D 29 +9.5 °(c=1.044 ,メタノール)
【0271】
(4) 水素化リチウムアルミニウム(3.43g)を無水テトラヒドロフラン(150 ml)に懸濁させ、前項(3)で得た化合物(8.4 g)の無水テトラヒドロフラン(50ml)溶液を滴下し、室温で1時間攪拌した。さらに5時間加熱還流した後、氷冷下、過剰の試薬を水で分解し、不溶物を濾去した。濾液を酢酸エチルで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣を塩化メチレン(180 ml)に溶解し、氷冷下、二炭酸ジ−t−ブチル(6.3 g)を加えた。同温度で30分間、室温で2時間攪拌後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製して(+)−トランス−1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(8.26g)を得た。
〔α〕D 29 +9.9 °(c=1.002 ,メタノール)
【0272】
(5) 実施例B−1(3)項と同様にして、前項(4)で得た化合物(8.15g)から目的とする(+)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(5.59g)を得た。
【0273】
〔α〕D 29 +12.5°(c=1.051 ,メタノール);
IR(neat)cm-1:3318,1693;
MS(m/z):231(MH+ )
【0274】
実施例B−3:−−アミン類の製造−−:
(−)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン
【0275】
(1) 実施例B−2(2)項と同様にして、実施例B−2(1)で得たD−酒石酸塩(2.57g)から(−)−トランス−3−アミノ−1−ベンジル−4−メトキシピロリジン(1.01g)を得た。
〔α〕D 27 −32.7°(c=1.016 ,メタノール)
【0276】
(2) 実施例B−2(3)項と同様にして、前項で得た化合物(3.03g)から(−)−トランス−1−ベンジル−3−(t−ブトキシカルボニルアミノ)−4−メトキシピロリジン(4.5 g)を得た。
【0277】
融点:44−45℃;
〔α〕D 29 −9.5 °(c=1.080 ,メタノール)
【0278】
(3) 実施例B−2(4)項と同様にして、前項で得た化合物(4.25g)から(−)−トランス−1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(4.25g)を得た。
〔α〕D 29 −10.1°(c=1.054 ,メタノール)
【0279】
(4) 実施例B−2(5)項と同様にして、前項で得た化合物(4.25g)から目的とする(−)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジン(2.81g)を得た。
【0280】
〔α〕D 29 −12.2°(c=1.003 ,メタノール);
IR(neat)cm-1:3318,1693;
MS(m/z):231(MH+ )
【0281】
実施例B−4:−−アミン類の製造−−:
3−(N−t−ブトキシカルボニルメチルアミノ)−3−メチルピロリジン
【0282】
(1) 実施例B−1(1)と同様にして、3−アミノ−1−ベンジル−3−メチルピロリジン(20g)から1−ベンジル−3−(N−t−ブトキシカルボニルアミノ)−3−メチルピロリジン(28.3g)を得た。
【0283】
IR(neat)cm-1:3356、1716、1697;
MS(m/z):291(MH+ )
【0284】
(2) 実施例B−1(2)と同様にして、前項(1)で得た化合物(11.4g)から1−ベンジル−3−(N−t−ブトキシカルボニルメチルアミノ)−3−メチルピロリジン(7.5 g)を得た。
【0285】
IR(neat)cm-1:1697 ;
MS(m/z):305(MH+ )
【0286】
(3) 実施例B−1(3)と同様にして、前項(2)で得た化合物(7.5 g)から目的の3−(N−t−ブトキシカルボニルメチルアミノ)−3−メチルピロリジン(5.5 g)を得た。
【0287】
IR(neat)cm-1:3337、 1682;
MS(m/z):215(MH+ )
【0288】
実施例 B−5:−−アミン類の製造−−:
(1R* ,4R* ,5S* )−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン
【0289】
(1) 2−エトキシカルボニルシクロペンタノン97g,ベンジルアミン71.2mlおよびp−トルエンスルホン酸 5.9gにトルエン 500mlを加え、Dean−Stark 装置で脱水しながら2時間加熱還流した。反応液を減圧乾固し、残渣をシリカゲルカラムクロマトグラフィー(溶離液:n−ヘキサン)で精製して、2−ベンジルアミノ−1−シクロペンテン−1−カルボン酸エチル 119.6gを得た。
【0290】
融点:31−32℃;
IR(neat)cm-1:3328,2951,1656,1606;
MS(m/z): 246(MH+ );
NMR(CDCl3)δ:1.25(t,3H,J=7.5 Hz),1.80(m,2H),2.55(t,4H,J=7.5 Hz),4.15(q,2H,J=7.5 Hz),4.40(d,2H,J=6.5Hz ),7.20−7.40(m,5H),7.75(br s,1H)
【0291】
(2) 前項で得られた化合物60gをエタノール 500mlに溶解し、二酸化白金1gを加えて中圧で接触還元した。触媒を濾去した後、濾液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液:クロロホルム)で精製して、シス−2−ベンジルアミノ−1−シクロペンタンカルボン酸エチル34.0gを得た。
【0292】
IR(neat)cm-1:2955,2871,1727;
MS(m/z): 248(MH+ );
NMR(CDCl3)δ:1.25(t,3H,J=7.5 Hz),1.40−2.10(m,7H),2.95(m,1H),3.30(m,1H),3.80(s,2H),4.15(q,2H,J=7.5 Hz),7.15−7.35(m,5H)
【0293】
(3) 前項で得られた化合物85.6g,ブロモ酢酸エチル46ml,炭酸カリウム57.4gおよびヨウ化カリウム 2.9gに1000mlのジオキサンを加え、18時間加熱還流した。反応液を濾別し、濾液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液:n−ヘキサン)で精製して、シス−2−〔(N−ベンジル)エトキシカルボニルメチルアミノ〕−1−シクロペンタンカルボン酸エチル92.5gを得た。
【0294】
IR(neat)cm-1:2976,2871,1732;
MS(m/z): 334(MH+ );
NMR(CDCl3)δ:1.10−1.30(m,6H),1.50−2.10(m,6H),3.10(m,1H),3.35(s,2H),3.50−3.70(m,1H),3.85−4.30(m,6H),7.15−7.35(m,5H)
【0295】
(4)1000mlのテトラヒドロフランに60%水素化ナトリウム12.2gを懸濁させて、前項で得られた化合物92.5gのテトラヒドロフラン溶液 400mlを加えた。1時間加熱還流した後、反応液を減圧下濃縮し、残渣に1000mlの20%塩酸水を加え、6時間加熱還流した。反応液を中和し、トルエンで抽出した。有機層を無水硫酸ナトリウムで乾燥後、減圧下溶媒を留去し、シス−2−ベンジル−2−アザビシクロ〔3.3.0〕オクタン−4−オン53.7gを得た。
【0296】
IR(neat)cm-1:2952,2866,1751;
MS(m/z): 216(MH+ );
NMR(CDCl3)δ:1.50−2.05(m,6H),2.75(m,1H),2.80(m,1H),3.15(d,1H,J=16Hz),3.42(d,1H,J=13Hz),3.45−3.55(m,1H),4.03(d,1H,J=13Hz),7.20−7.40(m,5H)
【0297】
(5) ヒドロキシルアミン塩酸塩26gを水 500mlに溶解し、前項で得られた化合物53.7gのエタノール溶液 200mlを加えた。更に、20%水酸化ナトリウム水溶液80mlを加え、室温で17時間攪拌した。反応液に酢酸水を加えて、酢酸酸性とし、トルエンで洗浄した。水層をアルカリ性とし、トルエンで抽出した。有機層を無水硫酸ナトリウムで乾燥後、減圧下溶媒を留去し、シス−2−ベンジル−2−アザビシクロ〔3.3.0〕オクタン−4−オンオキシム30.6gを得た。
【0298】
融点:90−91℃IR(KBr)cm-1:3279,2958,1699;
MS(m/z): 231(MH+ );
NMR(CDCl3)δ:1.40−2.10(m,6H),2.90−4.00(m,6H),7.15−7.35(m,5H),7.80(br s,1H)
【0299】
(6) 前項で得られた化合物12gをジオキサン 120mlに溶解し、ラネーニッケル6gを加え、70℃で理論量の水素を添加した。触媒を濾去した後、濾液を減圧下濃縮し、得られた残渣を塩化メチレン 100mlに溶解し、二炭酸ジ−t−ブチル13.6gを加えた。室温で11時間攪拌後、反応液を減圧下濃縮し、得られた残渣に酢酸エチルおよびジイソプロピルエーテルを加え、析出結晶を濾取して(1R*,4R* ,5R* )−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン10.6gを得た。
【0300】
融点: 161−162 ℃;
IR(KBr)cm-1:3353,2950,1678;
MS(m/z): 317(MH+ );
NMR(CDCl3)δ:1.20−1.80(m,6H),1.40(s,9H),2.20(m,1H),3.00−3.20(m,2H),3.35(d,1H,J=13Hz),3.85(d,1H,J=13Hz),3.60−3.80(m,1H),4.55(br s,1H),7.15−7.35(m,5H)
【0301】
上記で得られた母液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液:クロロホルム)で精製して、(1R* ,4S* ,5R*)−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン 3.0gを得た。
【0302】
IR(neat)cm-1:3447,2952,1713;
MS(m/z): 317(MH+ );
NMR(CDCl3)δ:1.20−1.80(m,6H),1.45(s,9H),2.20−2.40(m,1H),2.55−3.00(m,3H),3.10−3.95(m,2H),4.10(m,1H),4.80(br s,1H),7.15−7.35(m,5H)
【0303】
(7) 前項で得られた(1R* ,4R* ,5R* )−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン10.5gをエタノール 150mlに溶解し、5%パラジウム炭素 1.0gを加え、理論量の水素を添加した。触媒を濾去した後、濾液を減圧下濃縮して、目的物 7.1gを得た。
【0304】
融点: 102−103 ℃;
IR(KBr)cm-1:3305,3184,2926,1709;
MS(m/z): 227(MH+ );
NMR(CDCl3)δ:1.40−1.90(m,6H),1.45(s,9H),2.20(m,1H),2.60−3.20(m,2H),3.65(br s,1H),3.75(m,1H),4.70(br s,1H)
【0305】
実施例B−6:−−アミン類の製造−−:
(1R* ,4S* ,5S* )−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン
【0306】
実施例B−5の(6)項で得られた(1R* ,4S* ,5R* )−2−ベンジル−4−t−ブトキシカルボニルアミノ−2−アザビシクロ〔3.3.0〕オクタン1.58g,5%パラジウム炭素 200mgおよびエタノール20mlを用いて、実施例B−5(7)項と同様に処理して目的物 940mgを得た。
【0307】
融点:85−87℃;
IR(KBr)cm-1:3372,3210,2940,1682;
MS(m/z): 227(MH+ );
NMR(CDCl3)δ:1.40−1.90(m,6H),1.45(s,9H),2.05(br s,1H),2.60−3.10(m,3H),3.70(br s,1H),4.05(m,1H),4.75(br s,1H)
【0308】
実施例B−7:−−アミン類の製造−−:
1−アミノ−3−アザビシクロ〔3.1.1〕ヘプタン
【0309】
(1) 60%水素化ナトリウム1.29gをn−ヘキサンで2回洗浄後、エーテル60mlに懸濁させた。氷冷下エーテル5mlに溶解したマロン酸ジエチル 5.0gを10分間で滴下した。この混合物を室温下30分攪拌したのち氷冷し、エーテル10mlに溶解したベンジルクロロメチルエーテル5.38gを10分間で加えて室温で一夜攪拌し、更に5時間還流した。反応液を氷水に注ぎ酢酸エチルで抽出し、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、ベンジルオキシメチルマロン酸ジエチルの粗生成物 9.0gを得た。
【0310】
これをエーテル50mlに溶解し、氷冷下水素化アルミニウムリチウム2.85gとエーテル 300mlの混合物に滴下した。同温で 1.5時間、更に室温で2時間攪拌した。氷冷下飽和酒石酸ナトリウム水を加え、一夜攪拌した。不溶物を濾別し濾液を硫酸ナトリウムで乾燥させた後、減圧下濃縮した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:エタノール=40:1〜20:1)により精製し、2−ベンジルオキシメチル−1,3−プロパンジオール1.96gを得た。
【0311】
IR(neat)cm-1:3380;
1H−NMR(CDCl3) δ:2.05(m,1H),2.35(br s,2H),3.63(d,2H,J=5.5Hz ),3.81(dd,4H,J=5.5, 5.5Hz),4.52(s,2H),7.25−7.40(m,5H)
【0312】
(2) 前項で得た化合物84.8gとピリジン 360mlからなる混合物を氷−食塩で冷却しながら、塩化p−トルエンスルホニル 206.3gを3回に分けて加え、同温で2時間、室温で一夜攪拌した。反応液を氷水に注ぎ、酢酸エチルで抽出した。希塩酸,水で洗浄したのち硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をシリカゲルクロマトグラフィー(溶離液 クロロホルム:エタノール=30:1)で精製し、2−ベンジルオキシメチル−1,3−ビス(p−トルエンスルホニルオキシ)プロパン 162.3gを得た。
【0313】
IR(neat)cm-1:1598,1361;
1H−NMR(CDCl3) δ:2.33(m,1H),2.44(s,6H),3.41(d,2H,J=6Hz),4.04(m,4H),4.34(s,2H),7.10−7.40(m,9H),7.74(d,4H,J=8Hz)
【0314】
(3) 60%水素化ナトリウム22.8gをn−ヘキサンで2回洗浄後、トルエン 350mlに懸濁させた。氷冷下トルエン 150mlに溶解したマロン酸ジエチル91.1gを25分間で滴下した。この混合物を室温下で40分攪拌した後、トルエン 300mlに溶解した前項で得た化合物 119.6gを加え、 4.5日間還流した。反応液を氷水に注ぎ酢酸エチルで抽出し、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。減圧下溶媒および未反応のマロン酸ジエチルを留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:エタノール=50:1)で精製し、3−ベンジルオキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル66.8gを得た。
【0315】
IR(neat)cm-1:1726,1263;
1H−NMR(CDCl3) δ:1.23(t,3H,J=7Hz),1.25(t,3H,J=7Hz),2.25−2.50(m,2H),2.55−2.80(m,3H),3.44(d,2H,J=6Hz),4.17(q,2H,J=7Hz),4.21(q,2H,J=7Hz),4.50(s,2H),7.20−7.40(m,5H)
【0316】
(4) 前項で得られた化合物66.8gを酢酸エチル 500mlに溶解し、5%パラジウム炭素6.68gを加え、30〜40℃で理論量の水素を添加した。触媒を濾別後、溶媒を留去し、残渣をシリカゲルクロマトグラフィー(溶離液 クロロホルム:エタノール=20:1)で精製し、3−ヒドロキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル45.0gを得た。
【0317】
IR(neat)cm-1:3452,1728,1266;
1H−NMR(CDCl3) δ:1.25(t,3H,J=7Hz),1.27(t,3H,J=7Hz),1.70(br s,1H),2.30−2.50(m,2H),2.50−2.70(m,3H),3.62(d,2H,J=5.5 Hz),4.20(q,2H,J=7Hz),4.23(q,2H,J=7Hz)
【0318】
前項で得られた3−ヒドロキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル45.0gとピリジン 350mlの混合物に氷冷下、塩化p−トルエンスルホニル48.5gを4回に分けて加えた。同温で 5.5時間、室温で13.5時間、30〜40℃で8時間攪拌後、氷水を加え、酢酸エチルで抽出した。飽和重曹水,水,希塩酸および飽和食塩水で順次洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、3−p−トルエンスルホニルオキシメチルシクロブタン−1,1−ジカルボン酸ジエチルエステルの粗生成物を得た。
【0319】
上記粗生成物,ベンジルアミン42.2g,炭酸カリウム32.4gおよびジオキサン600 mlの混合物を 4.5日間還流した。反応液に氷水を加えてクロロホルムで抽出し、飽和重曹水、次いで飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液クロロホルム:エタノール=20:1)で精製し、3−ベンジルアミノメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル32.3gを得た。
【0320】
IR(neat)cm-1:3324,2813,1727,1263;
1H−NMR(CDCl3) δ:1.23(t,3H,J=7Hz),1.25(t,3H,J=7Hz),2.15−2.30(m,2H),2.40−2.70(m,3H),2.67(d,2H,J=6Hz),3.76(s,2H),4.17(q,2H,J=7Hz),4.21(q,2H,J=7Hz),7.20−7.40(m,5H)
【0321】
(5) 前項で得られた3−ベンジルアミノメチルシクロブタン−1,1−ジカルボン酸ジエチルエステル32.3g,10%水酸化ナトリウム水溶液 120mlおよびテトラヒドロフラン 120mlからなる混合物を、室温で13.5時間、次いで50〜60℃で6時間攪拌した。減圧下濃縮し、水 100mlと活性炭を加えて濾過した。濾液に室温下、20%塩酸水54.5mlを攪拌しながら加えた。氷冷後結晶を濾取し、水およびエタノールで洗浄して、3−ベンジルアミノメチルシクロブタン−1,1−ジカルボン酸20gを得た。
【0322】
融点 : 224−226 ℃(分解);
IR(KBr)cm-1:3444,1632;
1H−NMR(DMSO−d6 ) δ:2.10−2.26(m,2H),2.30−2.45(m,2H),2.65−2.95(m,1H),3.02(d,2H,J=7Hz),4.11(s,2H),7.35−7.55(m,5H),9.00(br s,2H)
【0323】
(6) 前項で得られた化合物20gとN,N−ジメチルホルムアミド 200mlからなる混合物にカルボニルジイミダゾール37gを加え、室温で13時間、30〜40℃で5.5時間、60〜70℃で4時間攪拌した。溶媒を減圧留去し、残渣に希塩酸を加えてpH2とした。酢酸エチルで抽出し、飽和食塩水で洗浄したのち硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣にジイソプロピルエーテル−n−ヘキサン(2:1)を加えて析出結晶を濾取し、3−ベンジル−2−オキソ−3−アザビシクロ〔3.1.1〕ヘプタン−1−カルボン酸15.5gを得た。
【0324】
融点 : 127−128 ℃(酢酸エチルから再結晶);
IR(KBr)cm-1:2531,1750,1732;
1H−NMR(CDCl3) δ:1.85−2.00(m,2H),2.70−2.84(m,1H),2.84−2.97(m,2H),3.44(d,2H,J=2Hz),4.65(s,2H),7.20−7.45(m,5H)
【0325】
(7) 前項で得られた化合物15.5g,トリエチルアミン 9.6gおよびt−ブタノール 150mlからなる混合物を70℃に加熱し、ジフェニルホスホリルアジド26gを滴下した。この反応液を15時間還流した。減圧下濃縮し、残渣に氷水を加え、酢酸エチルで抽出した。希水酸化ナトリウム水溶液、次いで飽和食塩水で洗浄したのち、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:エタノール=50:1)で精製し、3−ベンジル−1−t−ブトキシカルボニルアミノ−3−アザビシクロ〔3.1.1〕ヘプタン−2−オン14.6gを得た。
【0326】
融点 : 106−107 ℃(塩化メチレン−ジイソプロピルエーテルから再結晶);
IR(KBr)cm-1:3402,1723,1646;
1H−NMR(CDCl3) δ:1.45(s,9H),1.70−1.83(m,2H),2.56(tt,1H,J=2.5 ,7Hz),3.10−3.35(m,2H),3.25(d,2H,J=2.5Hz ),4.60(s,2H),6.22(br s,1H),7.20−7.40(m,5H)
【0327】
(8) 前項で得られた化合物6.07g,10%塩酸水12mlおよびテトラヒドロフラン6mlからなる混合物を50〜60℃で3時間加温した。減圧下濃縮し、残渣に水を少量加え、n−ヘキサンで洗浄した。水層を水酸化ナトリウム水溶液でアルカリ性とし、クロロホルムで抽出した。飽和食塩水で洗浄したのち、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、1−アミノ−3−ベンジル−3−アザビシクロ〔3.1.1〕ヘプタン−2−オン4.09gを得た。
【0328】
IR(neat)cm-1:3381,1659,1495,1250;
1H−NMR(CDCl3) δ:1.85−2.00(m,2H),1.90(s,2H),2.10−2.25(m,2H),2.54(tt,1H,J=2.5 ,7Hz),3.26(d,2H,J=2.5Hz ),4.60(s,2H),7.20−7.40(m,5H)
【0329】
(9) 前項で得られた化合物 2.1gとテトラヒドロフラン25mlからなる混合物に、ボラン−テトラヒドロフラン錯体の 1.0M−テトラヒドロフラン溶液30mlを加えた。7時間還流した後、減圧下濃縮した。残渣にエタノール40mlを加え、9時間還流した。減圧下濃縮し、残渣に氷水を加え、酢酸エチルで抽出した。飽和重曹水、次いで飽和食塩水で洗浄した後、硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をクーゲルロールミクロ蒸留装置で蒸留して、1−アミノ−3−ベンジル−3−アザビシクロ〔3.1.1〕ヘプタン1.86gを得た。
【0330】
沸点:約100 ℃(3mmHg);
IR(neat)cm-1:3360,2791,1603;
1H−NMR(CDCl3) δ:1.51(br s,2H),1.60−1.90(m,4H),2.18(tt,1H,J=3,6Hz),2.65(s,2H),2.69(d,2H,J=3Hz),3.67(s,2H),7.15−7.40(m,5H)
【0331】
(10) 前項で得られた化合物1.86gをエタノール20mlに溶解し、5%パラジウム炭素 190mgを加え、理論量の水素を添加した。触媒を濾去し、減圧下溶媒を留去して、目的物 1.0gを得た。
【0332】
実施例B−8:−−アミン類の製造−−:
9−メチレン−1,7−ジアザスピロ〔4.4〕ノナン二塩酸塩
【0333】
(1) 2,3−ジブロモプロペン300g、3,4-ジメトキシベンジルアミン245.3g、トリエチルアミン503.7 gおよび3000mlのトルエンからなる混合物を45分間加熱還流し、冷後、水、酢酸水を加え、酢酸エチルで抽出し、水洗した。無水硫酸ナトリウムで乾燥後、溶媒を留去して残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して、2−ブロモ−3−(3,4−ジメトキシベンジルアミノ)プロペン120gを得た。
IR(neat)cm-1:2934,2833,1516
【0334】
(2) N−(t−ブトキシカルボニル)−L−プロリン 73.8 g、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(WSC)72.4gおよび1000mlのジクロロメタンからなる混合物に、氷冷下、前項で得た化合物108gとジクロロメタン100mlとの混合物を20分間かけて滴下後、室温で20時間攪拌し、これに水を加え、ついでジクロロメタンにより抽出した。無水硫酸ナトリウムで乾燥後、溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製してN−(2−ブロモプロペニル)−N−(3,4−ジメトキシベンジル)−1−(t−ブトキシカルボニル)プロリンアミド149gを得た。
IR(neat)cm-1:2974,1697
【0335】
(3) 前項で得た化合物67.7gおよびトルエン800mlからなる混合物に、氷冷下、0.5 N−カリウムヘキサメチルジシラザンのトルエン溶液800mlを20分間かけて滴下し、同温度で90分間攪拌した。これに水、酢酸水を加え、酢酸エチルで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して1−(t−ブトキシカルボニル)−7−(3.4−ジメトキシベンジル)−9−メチレン−6−オキソ−1,7−ジアザスピロ〔4.4〕ノナン29.3gを得た。
【0336】
IR(neat)cm-1:2971,1692;
MS(m/z):=403(MH+ )
【0337】
(4) 前項で得た化合物20gおよびジクロロメタン500mlからなる混合物に、氷冷下、トリフルオロ酢酸100mlを10分間かけて滴下し、室温で16時間攪拌した。これに水および水酸化ナトリウム水溶液を加え、ジクロロメタンにより抽出した。無水硫酸ナトリウムで乾燥後、溶媒を留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して7−(3,4−ジメトキシベンジル)−9−メチレン−6−オキソ−1,7−ジアザスピロ〔4.4〕ノナン10.6gを得た。
【0338】
IR(neat)cm-1:2959,1699;
MS(m/z):303(MH+ )
【0339】
(5) 前項で得た化合物10.6gおよびトルエン200mlからなる混合物に、氷冷下、水素化ビス(2−メトキシエトキシ)アルミニウムナトリウムの70%トルエン溶液20.5 mlを5分間かけて滴下し、室温で5時間攪拌した。これに食塩水および水酸化ナトリウム水溶液を加え、酢酸エチルで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製して7−(3,4−ジメトキシベンジル)−9−メチレン−1,7−ジアザスピロ〔4.4〕ノナン7.8 gを得た。
【0340】
IR(neat)cm-1:2953,1516;
MS(m/z):289(MH+ )
【0341】
(6) 前項で得た化合物0.23g、クロロ蟻酸1−クロロエチル0.57gおよび1,2−ジクロロエタン10mlからなる混合物を2時間加熱還流し、溶媒を留去した。残渣にメタノ−ル10mlを加え、1時間加熱還流し、溶媒を留去して目的とする9−メチレン−1,7−ジアザスピロ〔4.4〕ノナン二塩酸塩0.12gを得た。本化合物は、後記化合物6F−6の製造原料として使用した。
【0342】
IR(neat)cm-1:3400,2917,1631;
MS(m/z):139(MH+ );
1H−NMR(DMSO−d6 ) δ:1.8 −2.1 (m,4H), 3.0 −3.3(m,4H), 3.6.−3.9 (m,2H) 5.26(t,1H,J=2Hz),5.43(t,1H,J=2Hz)
【0343】
実施例B−9:−−アミン類の製造−−:
3−ヒドロキシ−3−トリフルオロメチルピロリジン
【0344】
(1) 1−ベンジル−3−ピロリドン14.5gにテトラヒドロフラン150ml、テトラ−n−ブチルアンモニウムフルオリドの1M−テトラヒドロフラン溶液0.92mlを加えた。混合物に氷冷下、トリメチルシリルトリフルオロメタン16.5gを加え、30分間攪拌した。反応液を室温にし、更に、3時間攪拌した。そこにテトラ−n−ブチルアンモニウムフルオリドの1M−テトラヒドロフラン溶液30mlを加えて、室温で4時間攪拌した。反応終了後、水と酢酸エチルを加えて抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム)で精製し、1−ベンジル−3−ヒドロキシ−3−トリフルオロメチルピロリジン13.3gを得た。
融点60−61℃
【0345】
(2) 前項で得られた化合物1.0 gにエタノール15ml、10%パラジウム炭素100mgを加え60℃で理論量の水素を吸収させた。触媒を濾去し、溶媒を減圧乾固し、目的のアミン630mgを得た。
【0346】
実施例 B−10:−−アミン類の製造−−:
(1R,5S,8R)−8−(tert−ブトキシカルボニルアミノ)−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン
【0347】
(1) D−酒石酸を原料にしてJ. Org. Chem. 60, 103-108 (1995)の記載に従って製造した(3S,4R,5S)−1−ベンジル−3,4−ビス(tert−ブチルジメチルシリルオキシ)−5−(2−ヒドロキシエチル)−2−ピロリジノン125.5gに60% 酢酸水1200mlを加え、一夜還流した。減圧濃縮後、残渣に濃アンモニア水300ml およびメタノール500ml を加え、室温で一夜攪拌した。反応液を減圧濃縮し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=10:1)で精製して、(3S,4R,5S)−1−ベンジル−3,4−ジヒドロキシ−5−(2−ヒドロキシエチル)−2−ピロリジノン35g を得た。
【0348】
IR (neat) 3370, 1682 cm-1;
MS (m/z) : 252 (MH+ )
【0349】
1H-NMR (CDCl3)δ:7.10-7.32(m, 5H), 5.52(br s, 2H), 4.90(d, 1H, J=15.0Hz), 4.50(d, 1H, J=7.5Hz), 4.21(br t, 1H, J=7.5Hz), 3.94(d, 1H, J=15.0Hz),3.55(br s, 3H), 2.20-2.00(br s, 1H), 1.86(br s, 2H)
【0350】
(2) 前項で得た化合物35g をピリジン400ml に加え、氷冷したところにp−トルエンスルホニルクロリド26.6g を加え、一晩攪拌した。反応溶液に水、クロロホルムを加え生成物を有機層に抽出した後、10%塩酸水で洗浄し、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、油状の(1R,5S,8S)−6−ベンジル−8−ヒドロキシ−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン24g を得た。
【0351】
IR (neat):3390, 1692 cm -1;
MS m/z:234 (MH+ )
【0352】
1H-NMR (CDCl3)δ:7.40-7.18(m, 5H), 4.84(d, 1H, J=15.0Hz), 4.49(br, 1H),4.42(dd, 1H, J=6.5, 1.7Hz), 4.32(br, 1H), 4.16-4.06(m, 2H), 3.92-3.66(m, 2H), 1.92-1.82(m, 2H)
【0353】
(3) 前項で得た化合物14g を塩化メチレン250ml に加え、氷冷したところにピリジン14.6mlを加え、次にゆっくりトリフルオロメタンスルホン酸無水物13.1mlを加えた。2時間後、反応液にジメチルホルムアミド550ml および酢酸カリウム58.9g を加え、一晩攪拌した。不溶物を濾過し、減圧濃縮して得た残渣に水およびクロロホルムを加え、生成物を有機層に抽出した後、溶媒を減圧留去して、粗製の(1R,5S,8S)−8−アセトキシ−6−ベンジル−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタンを得た。
【0354】
この化合物にエタール500ml と濃アンモニア水200ml を加え、室温で一晩攪拌し、減圧濃縮した。残渣に水およびクロロホルムを加え、生成物を有機層に抽出後、溶媒を減圧留去し、シリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=30:1)で精製して(1R,5S,8R)−6−ベンジル−8−ヒドロキシ−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン9.2gを得た。
【0355】
IR (neat):3381, 1694 cm -1;
MS m/z:234 (MH+ )
【0356】
1H-NMR (CDCl3)δ:7.40-7.20(m, 5H), 4.93(d, 1H, J=15.0Hz), 4.50(dd, 1H,J=6.0, 5.0Hz), 4.28(d, 1H, J=6.0Hz), 4.09(d, 1H, J=15.0Hz), 4.08-3.93(m,2H), 3.80-3.66(m, 1H), 3.22(br s, 1H), 2.24-2.11(m, 1H), 2.01-1.81(m, 1H)
【0357】
(4) 前項で得た化合物9.2gを塩化メチレン100ml に加え、氷冷したところにピリジン9.5ml を加え、次にゆっくりトリフルオロメタンスルホン酸無水物9.1mlを加えた。2時間後、反応液にジメチルホルムアミド300ml およびアジ化ナトリウム24.4g を加え、一晩攪拌した。減圧濃縮して得た残渣に水およびクロロホルムを加え、生成物を有機層に抽出した。希塩酸水で洗浄し、無水硫酸マグネシウムで乾燥した後、溶媒を減圧留去して(1R,5S,8S)−8−アジド−6−ベンジル−7−オキソ−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン7.4gを得た。
【0358】
IR (neat) : 2109, 1694 cm -1;
1H-NMR (CDCl3)δ:7.40-7.20(m, 5H), 4.93(d, 1H, J=15.0Hz), 4.23(dd, 1H,J=6.0, 1.5Hz), 4.16-4.02(m, 3H), 3.94-3.82(m, 1H), 3.81-3.67(m, 1H), 2.00-1.80(m, 2H)
【0359】
(5) 前項で得た化合物7.4gをテトラヒドロフラン300ml に加え、氷冷したところにボラン−テトラヒドロフラン錯体の1.0 モル−テトラヒドロフラン溶液116ml を加えた。30分後加熱し、一晩還流した。反応液を室温に冷却し、過剰のボランをエタノールで処理した。減圧濃縮後、残渣にエタノール600ml を加え、一晩還流した。減圧濃縮後、残渣に10% 塩酸水を加え、生成物を水層に抽出し、クロロホルムで洗浄した。20% NaOH水でアルカリ性にした後、クロロホルムで抽出した。無水硫酸マグネシウムで乾燥し、溶媒を減圧留去して(1S,5S,8R)−8−アミノ−6−ベンジル−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン5.5gを得た。
【0360】
続いてこの化合物をメタノール100ml に加えて氷冷し、これに二炭酸−ジ−tert−ブチル7.2gを加え、一晩攪拌した。減圧濃縮して得た残渣をシリカゲルカラムクロマトグラフィー(溶離液 n−ヘキサン:酢酸エチル=6:1)に付し、(1S,5S,8R)−6−ベンジル−8−(tert−ブトキシカルボニルアミノ)−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン7.0gを得た。
【0361】
融点115−116℃(酢酸エチルから再結晶);
〔α〕D 27 +2.3 °(c=1.023,メタノール)
【0362】
(6) 前項で得た化合物5.4gをエタノール100ml に溶解し、5%パラジウム炭素350mg を加え、40℃で理論量の水素を吸収させた。触媒を濾去し、溶媒を減圧留去した後、得られた粗結晶をエチルエーテル−ジイソプロピルエーテルから再結晶して、最終目的物たる(1R,5S,8R)−8−(tert−ブトキシカルボニルアミノ)−2−オキサ−6−アザビシクロ〔3.3.0〕オクタン3.5gを得た。
【0363】
融点110−111℃;
IR (KBr) : 3377, 3228, 1680 cm-1;
〔α〕D 29 −44.4°(c=1.026, メタノール)
【0364】
シリーズC:目的物の製造方法
【0365】
実施例C−1:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(ラセミ体)およびその関連化合物
【0366】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(7.1 g)とトランス−3−メトキシ−4−メチルアミノピロリジン二塩酸塩(6.0 g)およびアセトニトリル(150 ml)からなる懸濁液にトリエチルアミン(18ml)を加えた。室温で5時間攪拌し、減圧下、反応液を濃縮し、炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出した。抽出液を無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=6:1)で精製して1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(6.1 g)を得た。
融点:73−76℃
【0367】
(2) 上記エステル(6.0 g)および18%塩酸水(100 ml)からなる溶液を100 ℃で28時間攪拌した。析出結晶を濾取し、エタノールおよびジイソプロピルエーテルからなる混液で洗浄して4.45gの1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物H−1−1−1)(4.45g)を得た。
融点:270−273℃
【0368】
(3) 前記(2)で得た塩酸塩(51.5g)、水(500 ml)およびアンモニア水(40ml)からなる溶液を50℃で一夜攪拌した。これにアセトニトリルを加え、減圧濃縮し、析出結晶を濾取した。得られた結晶を水およびアセトニトリルで洗浄して32.6gの1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物H-1-1-0)を得た。
融点:290−292℃(分解)
【0369】
(4) 前項(3)で得た化合物(2.0 g)、乳酸(3.1 g)および蒸留水(4ml)からなる混合物を60℃で加熱溶解した。室温に冷却後、エタノール(70ml)を加え、析出結晶を濾取し、エタノールで洗浄して2gの乳酸塩(化合物H-1-1-2 )を得た。
融点:288−291℃(分解)
【0370】
(5) 前項(1)で得たエステル(1.89g)、N−t−ブトキシカルボニル−L−アラニン(1.26g)および塩化メチレン(80ml)からなる混合物に1.27gのWSCを加え、室温で3時間攪拌した。水洗後、無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)により精製して7−{トランス−3−〔N−(N−t−ブトキシカルボニル−L−アラニル)〕メチルアミノ−4−メトキシ−1−ピロリジニル}−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(2.15g)を得た。
【0371】
融点:120−123℃;
〔α〕D 28 +10.2°(c=1.0 ,クロロホルム)
【0372】
このエチルエステル(1.71g)、0.5 N塩酸水(42ml)、エタノール(22ml)からなる混合物を80℃で17.5時間加熱攪拌した。この溶液を減圧濃縮し、析出結晶を濾取し、10%塩酸水およびエタノールで洗浄して7−〔トランス−3−(N−L−アラニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩1.16gを得た。
【0373】
融点:230−233℃;
〔α〕D 29 +8.4 °(c=1.0 ,水)
【0374】
実施例C−2:−−目的物(I)の製造−−:
(+)−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(光学活性体)およびその関連化合物
【0375】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルと実施例B−2で得た(+)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジンを用い、実施例C−1(1)と同様にして(−)−7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(非結晶体)を得た。
〔α〕D 29 −9.1 °(c=1.006 ,クロロホルム)
【0376】
(2) 実施例C−1(2)に記載の方法に準じて、前項(1)で得たエチルエステル体から標記塩酸塩(化合物H−1−2)を得た。
【0377】
融点:278−282℃(分解);
〔α〕D 29 +24.8°(c=0.500 ,水)
【0378】
(3) 前記(2)で得た塩酸塩(28.1g)、水(300 ml)およびアンモニア水(25ml)からなる溶液を50℃で一夜攪拌し、ついで減圧濃縮した。析出結晶を濾取し、水およびエタノールで洗浄して目的のカルボン酸体(化合物H−1−2−1)(19.5g)を得た。
【0379】
融点:268−271℃;
〔α〕D 30 +53.1°(c=1.005 ,1N NaOH)
【0380】
(4) 前記(3)項で得たカルボン酸体6.22gを蒸留水150mlに溶解し、氷冷下にて、1.002 N−水酸化ナトリウム水溶液14.8mlを加え、直ちに10分間攪拌した。溶媒を減圧留去し、残渣にアセトニトリルおよびジイソプロピルエーテルを加えて析出する結晶を濾取し、目的とするナトリウム塩(化合物H−1−2−2)6.28gを得た。
融点:189−190℃(分解)
【0381】
(5) 前記(3)で得た化合物(300mg)と水(1.2 ml)からなる懸濁液にメタンスルホン酸(140mg)を加え、60℃で加熱溶解した。熱時濾過し、濾液を室温で冷却した。これにアセトン(10ml)を加え、析出結晶を濾取し、アセトンで洗浄して標記化合物のメタンスルホン酸塩(化合物H−1−2−3)を得た。
【0382】
融点:283−285℃(分解);
〔α〕D 28 +46.9°(c=1.00,1N NaOH)
【0383】
(6) 実施例C−1(4)に記載の方法に準じて、前記(3)で得た化合物から標記化合物の乳酸塩(化合物H−1−2−4)を得た。
【0384】
融点:273−275℃(分解);
〔α〕D 27 +44.7°(c=1.00,1N NaOH)
【0385】
(7) 前記(3)で得た化合物(350mg)およびグルコン酸(約50%、1.1 g)を水(1ml)に加熱(60℃)溶解した。放冷後、アセトン(100ml)を加え、析出する固体を水−メタノールから再結晶し、析出結晶を濾取し、メタノールで洗浄して標記化合物のグルコン酸塩(化合物H−1−2−5)を得た。
【0386】
融点:129−132℃;
〔α〕D 28 +36.7°(c=0.36,1N NaOH)
【0387】
(8) 前記(1)で得た化合物を塩酸−エタノール(30%)で処理して、(−)−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(化合物H−1−2−6)を得た。
【0388】
融点:184−185℃;
〔α〕D 28 −16.9°(c=0.503, クロロホルム)
【0389】
実施例C−3:−−目的物(I)の製造−−:
(−)−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(光学活性体)およびその塩
【0390】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルと実施例B−3で得た(−)−トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシピロリジンを用い、実施例C−1(1)と同様にして(+)−7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(非結晶体)を得た。
〔α〕D 29 +9.0 °(c=1.002 ,クロロホルム)
【0391】
(2) 実施例C−1(2)に記載の方法に準じて、前項(1)で得たエチルエステル体から標記化合物の塩酸塩(化合物H−1−3)を得た。
【0392】
融点:278−282℃(分解);
〔α〕D 29 −25.2°(c=0.504 ,水)
【0393】
(3) 実施例C−2(3)に記載の方法に準じて、前記(2)で得た化合物から目的のカルボン酸体(化合物H−1−3−1)を得た。
【0394】
融点:277−279℃(分解);
〔α〕D 29 −59.9°(c=1.00,1N NaOH)
【0395】
(4) 実施例C−2(5)に記載の方法に準じて、前記(3)で得た化合物から標記化合物のメタンスルホン酸塩(化合物H−1−3−2)を得た。
【0396】
融点:287−289℃(分解);
〔α〕D 30 −47.2°(c=1.00,1N NaOH)
【0397】
実施例C−4:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(シス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸およびその関連化合物
【0398】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルとシス−3−メトキシ−4−メチルアミノピロリジンを用い、実施例C−1(1)と同様にして1,4−ジヒドロ−7−(シス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルを得た。
融点253−259℃(分解)
【0399】
(2) 実施例C−1(2)に記載の方法に準じて、前項(1)で得たエチルエステル体から標記化合物の塩酸塩(化合物H−1−4)を得た。
融点:263−269℃(分解)
【0400】
実施例 C−5:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチチリジン−3−カルボン酸塩酸塩(化合物2F−1)
【0401】
(1) 実施例A(6)で得た7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチル6.5 g,3−アミノピロリジン1.7 g,トリエチルアミン5.6 gおよびアセトニトリル65mlの混合物を30分間加熱還流した。冷後、結晶を濾取し、エタノ−ルから再結晶して、7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(化合物2F−1のエステル体)7.1gを得た。
融点:218−220℃。
【0402】
(2) 上記エステル7.1gと10%塩酸水200mlの混合物を1時間加熱還流した。冷後、結晶を濾取し、水−エタノ−ルから再結晶して、6.9gの7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1)を得た。
融点:294−296℃(分解)
【0403】
(3) 上記塩酸塩を常法に従って処理し、7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物2F−1の遊離体)を得た。
融点:253−254℃(分解)
【0404】
(4) (R)−3−アミノピロリジンを用い、前記と同様に反応・処理して下記化合物を得た。
【0405】
7−〔(R)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル;
融点:254−257℃
【0406】
7−〔(R)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1−1)
【0407】
融点:297−300℃(分解);
[α]D 28=−21.0O (1N NaOH ,c=0.1 )
【0408】
(5) (S)−3−アミノピロリジンを用い、前記と同様に反応・処理して下記化合物を得た。
【0409】
7−〔(S)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル;
融点:256−259℃
【0410】
7−〔(S)−3−アミノ−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1−2)
【0411】
融点:>300℃;
[α]D 28=+20.0O (1N NaOH ,c=0.1 )
【0412】
(6) 実施例C−1(5)の記載に準じて、7−〔3−(N−L−アラニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸塩酸塩(化合物2F−1−3)を得た。;
融点:236−239℃
【0413】
実施例C−6;−−目的物(I)の製造−−:
上記実施例C−1からC−5までに記載の方法またはこれに準じる方法により、以下の第15表〜第21表に示す化合物およびそのエチルエステルを得た。
【0414】
第15表 目的化合物(I)
【0415】
【化31】

【0416】
【表30】

*:1=HCl、 2=1/2 HCl、 3=1/5 HCl
**:(分)は分解点を示す。以下、同様。
【0417】
【表31】

*:1=HCl
【0418】
【表32】

*:「−」=遊離体、 1=HCl
【0419】
第16表 目的化合物(I)
【化32】

【0420】
【表33】

*:1=HCl
【0421】
【表34】

*:「−」=遊離体、 1=HCl
【0422】
【表35】

*:「−」=遊離体、 1=HCl
【0423】
【表36】

*:「−」=遊離体、 1=HCl
【0424】
【表37】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0425】
【表38】

*:「−」=遊離体、 1=HCl
【0426】
【化33】

【0427】
第17表 目的化合物(I)
【0428】
【化34】

【0429】
【表39】

*:「−」=遊離体、 1=HCl
【0430】
第18表 目的化合物(I)
【0431】
【化35】

【0432】
【表40】

*:「−」=遊離体、 1=HCl、 4=1/2 H2SO4
【0433】
【表41】

*:「−」=遊離体、 1=HCl、
**:3位エチルエステル体
【0434】
第19表 目的化合物(I)
【0435】
【表42】

【0436】
第19表のつづき
【0437】
【表43】

【0438】
第20表 目的化合物(I)
【0439】
【表44】

【0440】
第20表のつづき
【0441】
【表45】

【0442】
第20表のつづき
【0443】
【表46】

【0444】
第21表 目的化合物(I)
【0445】
【化36】

【0446】
【表47】

*:水中(c=0.1)で測定。
**:DMSO中(c=0.1 )で測定。
【0447】
【表48】

*:水中(c=0.1)で測定。
**:2塩酸塩。
【0448】
【表49】

*:水中(c=0.1)で測定。
**:水中(c=0.5)で測定。
【0449】
実施例C−7:−−目的物(I)の製造−−:
2−(3−アミノ−1−ピロリジニル)−5,8−ジヒドロ−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸
【0450】
実施例A−7で得た5,8−ジヒドロ−2−メタンスルホニル−5−オキソ−8−(2−チアゾリル)ピリド〔2,3−d〕ピリミジン−6−カルボン酸エチルエステルと3−アミノピロリジンとを実施例C−1とほぼ同様な方法により反応させ、標記化合物(9N−1)を得た。
融点:288−291℃(分解)
【0451】
実施例C−8:−−目的物(I)の製造−−:
3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物7H−1)
【0452】
(1) 実施例A−1(4)で得た7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(8.49g)、トランス−3−メトキシ−4−メチルアミノピロリジン二塩酸塩(6.5 g)およびアセトニトリル(400 ml)からなる懸濁液にトリエチルアミン(13.4ml)を加えた。室温で一夜攪拌後、反応液を減圧濃縮し、炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣に塩化メチレン(500 ml)を加え、氷冷下、二炭酸ジ−t−ブチル(6.4 g)を加えた。室温で一夜攪拌後、反応液を減圧濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100 :1)で精製して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(9.1 g)を得た。
【0453】
IR(KBr)cm-1:1735,1695;
MS(m/z):530(MH+ )
【0454】
(2) 前項(1)で得た化合物(8.95g)とエタノール(150 ml)の混合物に氷冷下、1N水酸化ナトリウム水溶液(150 ml)を加え、同温度で30分間、室温で一夜攪拌した。酢酸水で酸性となし、クロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(7.19g)を得た。
【0455】
融点 185−188℃;
IR(KBr)cm-1:1715,1690;
MS(m/z):502(MH+ )
【0456】
(3) 前項(2)で得た化合物(7.15g)とメタノール(400 ml)からなる混合物に、氷冷下、水素化ホウ素ナトリウム(2.16g)を加え、同温度で15分間、室温で一夜攪拌した。溶媒を減圧留去し、ついでクロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100 :1)で精製して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(3.9 g)を得た。
【0457】
IR(neat)cm-1:1690;
MS(m/z):460(MH+ )
【0458】
(4) 前項(3)で得た化合物(3.8 g)をテトラヒドロフラン(500 ml)に溶解し、−78℃でn−ブチルリチウム(1.6 M)のn−ヘキサン溶液(6.1ml)を滴下した。同温度で30分間攪拌後、ギ酸エチル(1.34ml)を加え、ゆっくり昇温させ、一夜攪拌した。溶媒を減圧留去し、残渣に酢酸水を加えクロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−3−ホルミル−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(3.87g)を得た。
【0459】
IR(neat)cm-1:1690,1615;
MS(m/z):488(MH+ )
【0460】
(5) 前項(4)で得た化合物(3.6 g)を1,4−ジオキサン(160 ml)に溶解し、2,3−ジクロロ−5,6−ジシアノ−1,4−ベンゾキノン(2.51g)をゆっくり加えた。2時間攪拌後、溶媒を減圧留去し、残渣に水酸化ナトリウム水溶液を加え、クロロホルムで抽出した。飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100 :1)で精製して7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−3−ホルミル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(1.73g)を得た。
【0461】
融点 130−132℃;
IR(KBr)cm-1:1695,1645,1615;
MS(m/z):486(MH+ )
【0462】
(6) 前項(5)で得た化合物(1.65g)、10%塩酸水(10ml)およびエタノール(40ml)からなる混液を50−60℃で7時間加熱した。析出結晶を濾取し、エタノールおよびジイソプロピルエーテルで洗浄して3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物7H−1)(1.05g)を得た。
【0463】
融点 255−263℃(分解);
IR(KBr)cm-1:3460,1695,1645;
MS(m/z):386(MH+ )
【0464】
実施例C−9:−−目的物(I)の製造−−:
1,2,3,4−テトラヒドロ−4−ヒドロキシ−3−ヒドロキシメチル−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−1−(2−チアゾリル)−1,8−ナフチリジン(化合物7H−2)
【0465】
氷冷下にて、4.90gの1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステルを無水テトラヒドロフラン150mlに溶解し、水素化リチウムアルミニウム3.00gを加え、30分間攪拌し、更に、室温で一晩攪拌した。反応液を水にゆっくり加え、塩化アンモニウム水溶液、炭酸水素ナトリウム水溶液を、順次加えた。これをクロロホルムにて抽出し、飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製し目的とする化合物7H−2(1.60g)を得た。融点:69−70℃
【0466】
実施例C−10:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸 2−ヒドロキシエチルエステル 4/3トリフルオロ酢酸塩(化合物7H−3)
【0467】
(1) 氷冷下にて、1.00gの7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸を塩化メチレン90mlに溶解し、エチレングリコール1.24g、WSC420mg、4−ジメチルアミノピリジン50mgを加えて30分間攪拌し、更に、室温で一晩攪拌した。水を加え、これをクロロホルムにて抽出し、飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=50:1)で精製し、1,4−ジヒドロ−7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸2−ヒドロキシエチルエステル(590mg)を得た。
融点:101−105℃
【0468】
(2) 前項の化合物250mgを塩化メチレン3mlに溶解し、氷冷下にて、トリフルオロ酢酸1.0 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。ジイソプロピルエーテルを加え析出結晶を濾取し、目的とする化合物7H−3(150mg)を得た。
融点:125−127℃
【0469】
実施例C−11:−−目的物(I)の製造−−:
1−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕−3−ヒドロキシピロリジン 3/2塩酸塩(化合物7H−4)
【0470】
(1) 氷冷下にて、250mgの7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸を塩化メチレン20mlに溶解し、これに3−ピロリジノール52mg、ベンゾトリアゾール−1−イロキシトリス(ジメチルアミノ)ホスホニウムヘキサフルオロホスフェート(BOP試薬)265mgおよびトリエチルアミン0.17mlを加えて30分間攪拌し、更に、室温で一晩攪拌した。水を加え、これをクロロホルムにて抽出し、飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=20:1)で精製し、1−{7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル}−3−ヒドロキシピロリジン(280mg)を得た。
融点:127−129℃
【0471】
(2) 前項の化合物275mgをエタノール5mlに溶解し、氷冷下にて、10%エタノール−塩酸3.0 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。ジイソプロピルエーテルを加え析出結晶を濾取し、目的とする化合物7H−4(163mg)を得た。
融点:189−193℃(分解)
【0472】
実施例C−12:−−目的物(I)の製造−−:
3−ヒドロキシメチル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物7H−5)
【0473】
氷冷下にて、実施例C−8で得た110mgの3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジンの塩酸塩をメタノール30mlに溶解し、これに塩化セリウム七水和物108mg、水素化ホウ素ナトリウム30mgを加えて30分間攪拌し、クロロホルムおよび酢酸水溶液を加えた。炭酸水素ナトリウム水溶液でアルカリ性となし、クロロホルムにて抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去し、エタノール−塩酸溶液を加えて析出結晶を濾取し、69mgの目的化合物7H−5を得た。
融点:263−268℃(分解)
【0474】
実施例C−13:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボキサミド トリフルオロ酢酸塩(化合物8F−1)
【0475】
(1) 氷冷下にて、メタノール150mlに9.00gの7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル、1N−水酸化ナトリウム水溶液150mlを加え、30分間攪拌し、更に、室温で一晩攪拌した。酢酸水溶液を加え、クロロホルムにて抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸8.50gを得た。
融点:220−224℃
【0476】
(2) 前項の化合物2.20gをクロロホルム20mlに溶解し、氷冷下にて、トリエチルアミン0.97ml、クロロ蟻酸エチル604mgを加え、1時間攪拌し、更に、室温で1時間攪拌した。再び、氷冷下、飽和アンモニア−エタノール溶液20mlを加え1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣に水を加え、クロロホルムにて抽出した。無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルキサミド1.19gを得た。
融点:240−243℃
【0477】
(3) 前項の化合物700mgをクロロホルム40mlに溶解し、氷冷下にて、トリフルオロ酢酸1.3 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣にエタノールを加えて析出する結晶を濾取し、635mgの目的化合物(8F−1)を得た。
融点:227−233℃(分解)
【0478】
実施例C−14:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン トリフルオロ酢酸塩(化合物8F−2)
【0479】
(1) 氷冷下にて、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸11.3gをメタノール400mlに溶解し、水素化ホウ素ナトリウム4.5 gを加えて30分間攪拌し、更に室温で一晩攪拌した。溶媒を減圧留去し、残渣に酢酸水を加え、クロロホルムにて抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン5.41gを得た。
融点:234−236℃
【0480】
(2) 前項の化合物700mgを1,4−ジオキサン70mlに溶解し、2,3−ジクロロ−5,6−ジシアノ−1,4−ベンゾキノン440mgを加え、一晩加熱還流した。溶媒を減圧留去し、残渣に水酸化ナトリウム水溶液を加えてクロロホルムにて抽出した。無水硫酸ナトリウムで乾燥し、溶媒を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン270mgを得た。
融点:234−236℃
【0481】
(3) 前項の化合物160mgをクロロホルム12mlに溶解し、氷冷下にて、トリフルオロ酢酸0.6 mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣にエタノールを加えて析出する結晶を濾取し、150mgの目的化合物(8F−2)を得た。
融点:237−240℃
【0482】
実施例C−15:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−3−ベンジル−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(化合物8F−3)
【0483】
(1) エタノール10mlに実施例C−14(1)で得た7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,2,3,4−テトラヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン400mg、20%水酸化ナトリウム水溶液5mlを加え、そこにベンズアルデヒド350mgを加え、一晩攪拌した。酢酸水を加え、クロロホルムにて抽出した。飽和食塩水にて洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=100:1)で精製し、3−ベンジル−7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン325mgを得た。
融点:234−236℃
【0484】
(2) 前項の化合物200mgをクロロホルム15mlに溶解し、氷冷下にて、トリフルオロ酢酸0.59mlを加え、1時間攪拌し、更に、室温で一晩攪拌した。溶媒を減圧留去し、残渣にジイソプロピルエーテルを加えて析出する結晶を濾取し、185mgの目的化合物(8F−3)を得た。
融点:237−240℃
【0485】
実施例C−16:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−3−ホルミル−1,4−ジヒドロ−6−フルオロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(化合物8F−4)
【0486】
実施例C−8に記載の方法に準じて標記化合物(8F−4)を得た。
融点:242−250℃(分解)
【0487】
実施例C−17:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−フルオロ−1,4−ジヒドロ−3−ヒドロキシ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジントリフルオロ酢酸塩(化合物8F−5)
【0488】
(1) 7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸0.5 g、超酸化カリウム0.75g、エタノール5ml、水5mlからなる混合物を15分間加熱還流し、溶媒を留去した。酢酸水で中和し、クロロホルムで抽出した。無水硫酸ナトリウムで乾燥し、溶媒を減圧留去した。残渣をクロロホルム−エタノールから再結晶して7−〔3−(N−t−ブトキシカルボニルアミノ)−1−ピロリジニル〕−6−フルオロ−1,4−ジヒドロ−3−ヒドロキシ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン260mgを得た。
融点:251−252℃
【0489】
(2) 前項の化合物260mg、塩化メチレン6mlおよびトリフルオロ酢酸6mlからなる混合物を室温で20時間攪拌し、溶媒を減圧留去した。残渣にアセトニトリルを加えて析出する結晶を濾取し、これをアセトニトリルで洗浄して170mgの目的化合物(8F−5)を得た。
融点:206−207℃
【0490】
実施例C−18:−−目的物(I)の製造−−:
1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−7−ビニル−1,8−ナフチリジン−3−カルボン酸(化合物9H−1)
【0491】
(1) 7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル3.6 g、ビニルトリブチルスズ3.8 g、ビストリフェニルホスフィンパラジウムジクロリド1.0 gおよびトルエン150mlからなる懸濁液を6.5 時間還流した。氷冷後、水洗し、溶媒を減圧留去した。得られた結晶をトルエンおよびエタノールで洗浄して1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−7−ビニル−1,8−ナフチリジン−3−カルボン酸エチルエステル2.7 gを得た。
融点:163−164℃
【0492】
(2) 前項の化合物0.32g、10%塩酸水15mlおよびエタノール2mlからなる懸濁液を100℃で13時間加熱し、結晶を濾取し、エタノールで洗浄して目的物9H−1(0.19g)を得た。
融点:284−288℃(分解)
【0493】
実施例C−19:−−目的物(I)の製造−−:
1,4−ジヒドロ−7−(2,6−ジメチル−4−ピリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−2)
【0494】
(1) 7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.1 g、2,6−ジメチル−4−(トリメチルスズ)ピリジン0.98g、ビストリフェニルホスフィンパラジウムジクロリド0.25gおよびトルエン51mlからなる懸濁液を6.5 時間還流した。氷冷後、水洗し、溶媒を減圧留去した。シリカゲルカラムクラマトグラフィー(溶離液 クロロホルム)により精製し、エタノールで洗浄して1,4−ジヒドロ−7−(2,6−ジメチル−4−ピリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.38gを得た。
融点:232−235℃
【0495】
(2) 実施例C−18(2)とほぼ同様に処理して目的化合物9H−2を得た。
融点:272−275℃(分解)
【0496】
実施例C−20:−−目的物(I)の製造−−:
7−エチニル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−3)
【0497】
(1) 7−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.5 g、(トリメチルシリル)エチニルトリブチルスズ2.0 g、ビストリフェニルホスフィンパラジウムジクロリド0.45gおよびトルエン75mlからなる懸濁液を100℃において、アルゴン雰囲気下で3時間加熱した。氷冷後、水洗し、溶媒を減圧留去した。シリカゲルカラムクラマトグラフィー(溶離液 クロロホルム)より精製し、1,4−ジヒドロ−4−オキソ−7−(トリメチルシリル)エチニル−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.0 gを得た。
【0498】
(2) 前項で得られた化合物1.0 g、フッ化カリウム0.45gおよびエタノール25mlからなる懸濁液を2時間還流し、溶媒を減圧留去した。クロロホルムおよび水を加え、不溶物をセライト濾過により分離し、水洗後、溶媒を減圧濃縮した。これをクロロホルム−エタノールの混合物で洗浄し、7−エチニル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.34gを得た。
融点:228−231℃(分解)
【0499】
(3) 前項で得られた化合物を実施例C−18(2)とほぼ同様に処理して目的化合物9H−3を得た。
融点:>300℃
【0500】
実施例C−21:−−目的物(I)の製造−−:
実施例C−18から実施例C−20までに記載の方法またはこれに準じる方法により以下の化合物を得た。
【0501】
1,4−ジヒドロ−4−オキソ−7−フェニル−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−4);
融点:227−230℃(分解)
【0502】
1,4−ジヒドロ−7−メチル−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−5);
融点:268−269℃
【0503】
1−(5−ブロモ−2−チアゾリル)−1,4−ジヒドロ−7−(1−ピロリジニル)メチル−1,8−ナフチリジン−3−カルボン酸(化合物9H−6);
融点:238−239℃
【0504】
実施例C−22:−−目的物(I)の製造−−:
1,4−ジヒドロ−4−オキソ−7−(3−ピラゾリル)−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9H−7)
【0505】
(1)実施例C−20(2)で得られた7−エチニル−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.34g、トリメチルシリルジアゾメタン(10%ヘキサン溶液)1.3gおよびクロロホルム20mlからなる懸濁液を5.5 時間還流した。溶媒を減圧留去し、エタノールで洗浄して1,4−ジヒドロ−4−オキソ−7−(3−ピラゾリル)−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル0.31gを得た。
融点:285−287℃(分解)
【0506】
(2) 前項で得られた化合物を実施例C−18(2)とほぼ同様に処理して標記目的化合物9H−7を得た。
融点:>300℃
【0507】
実施例C−23:−−目的物(I)の製造−−:
6−フルオロ−1,4−ジヒドロ−7−ヒドロキシ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(化合物9F−1)
【0508】
7−クロロ−6−フルオロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル1.0 gに水酸化ナトリウム水溶液10mlを加え、85℃で6.5 時間攪拌した。反応液を塩酸水で酸性となし、析出結晶を濾取した。この結晶を5%水酸化ナトリウム水溶液に溶解し、活性炭処理をした後、塩酸酸性となし、析出結晶を濾取した。結晶を水洗し、ついでエタノールで洗浄して目的化合物690mgを得た。
融点:261−264℃
【0509】
実施例C−24:−−目的物(I)の製造−−:
7−(3−アミノ−1−ピロリジニル)−6−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸0.85塩酸塩(化合物Cl−1)
【0510】
(1) 無水酢酸(60ml)および濃硝酸(5ml)からなる混液に、氷冷下、2,6−ジメトキシニコチン酸(8.71g)を加えた。同温度で3時間、室温で4時間攪拌後、析出結晶を濾取し、イソプロパノールおよびジイソプロピルエーテルで洗浄した。濾液を酢酸エチルで抽出し、溶媒を減圧留去して得られる結晶をイソプロパノールおよびジイソプロピルエーテルで洗浄し、先の結晶を合わせて2,6−ジメトキシ−5−ニトロニコチン酸(6.95g)を得た。
【0511】
融点:227−230℃(分解);
IR(KBr)cm-1;1706,1610;
MS(m/z):229(MH+ ) ;
1H−NMR(DMSO−d6 )δ:4.03(s,3H),4.08(s,3H),8.71(s,1H)
【0512】
(2) マロン酸エチルカリウム(18.6g)、塩化マグネシウム(11.3g)に酢酸エチル(250 ml)を加え、得られる懸濁液に、氷冷下、トリエチルアミン(28.0g)を滴下し、室温で2.5 時間攪拌した。
【0513】
一方で前項で得た化合物(18.5g)のテトラヒドロフラン(150 ml)溶液にカルボニルジイミダゾール(14.8g)を加え、70℃で1時間攪拌した。この溶液を先の懸濁液に、氷冷下、加え、室温で一夜、更に70℃で30分間攪拌した。反応液に濃塩酸を加えて酸性となし、析出結晶を濾取し、酢酸エチルで洗浄した。濾液を酢酸エチルで抽出し、溶媒を減圧留去して得られる結晶を酢酸エチルとジイソプロピルエーテルとの混合物から再結晶した。先の結晶と合わせて2,6−ジメトキシ−5−ニトロニコチノイル酢酸エチルエステル(19.9g)を得た。
【0514】
MS(m/z):299(MH+ ) ;
1H−NMR(DMSO−d6 )δ:1.19(t,3H,J=7Hz ),4.00(s,2H),4.10(s,3H),4.11(q,2H,J=7Hz),4.15(s,3H),8.78(s,1H)
【0515】
(3) 前項で得た化合物(2.2 g)、オルトギ酸エチル(1.7 g)および無水酢酸(2.4 g)からなる混合物を1.5 時間加熱還流した。反応液を減圧濃縮し、残渣にジイソプロピルエーテル(10ml)および1,4−ジオキサン(3ml)を加えた。この溶液に、氷冷下、2−アミノチアゾール(0.84g)を加え、室温で一夜攪拌した。析出結晶を濾取し、ジイソプロピルエーテルで洗浄して、2−(2,6−ジメトキシ−5−ニトロニコチノイル)−3−(2−チアゾリルアミノ)アクリル酸エチルエステル(2.3 g)を得た。
【0516】
融点:166−170℃;
IR(KBr)cm-1;1729,1603
【0517】
(4) 前項で得た化合物(2.0 g)と1,4−ジオキサン(90ml)からなる懸濁液に炭酸カリウム(1.0 g)を加え、60℃で3時間加熱した。冷後、水を加え、20%塩酸水で中和し、析出結晶を濾取した。水、エタノールおよびジイソプロピルエーテルで、順次、洗浄して、1,4−ジヒドロ−7−メトキシ−6−ニトロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(1.7 g)を得た。
【0518】
融点:208−210℃;
IR(KBr)cm-1;1739;
MS(m/z):337(MH+ ) ;
1H−NMR(DMSO−d6 )δ:1.31(t,3H,J=7Hz),4.30(s,3H),4.33(q,2H,J=7Hz),7.85(d,1H,J=4Hz),7.88(d,1H,J=4Hz),9.08(s,1H),9.69(s,1H)
【0519】
(5) 前項で得た化合物(10.3g)、3−(t−ブトキシカルボニルアミノ)ピロリジン(5.9 g)および炭酸カリウム(4.7 g)のジメチルホルムアミド(150 ml)溶液を60℃で2時間加熱した。冷後、水を加え、酢酸エチルで抽出した。抽出液を水及び飽和食塩水で洗浄後、硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られる残渣を酢酸エチルおよびエタノールとの混液から再結晶して、7−(3−t−ブトキシカルボニルアミノ−1−ピロリジニル)−1,4−ジヒドロ−6−ニトロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(11.4g)を得た。
融点:204−205℃
【0520】
(6) 前項で得た化合物(1.0 g)をエタノール(100ml)および1,4−ジオキサン(50ml)に溶解し、ラネ−ニッケル(約1g)を加えて50℃で2.5 時間、水素を吸収させた。析出結晶を濾取し、ジメチルホルムアミドを加えて加熱し、不溶物を濾過した。濾液を減圧濃縮し、得られる結晶をジメチルホルムアミド、1,4−ジオキサンからなる混液およびエタノールで洗浄して、6−アミノ−7−(3−t−ブトキシカルボニルアミノ−1−ピロリジニル)−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(0.81g)を得た。
融点:270−272℃(分解)
【0521】
(7) 前項で得た化合物(250 mg)と濃塩酸(5ml)の混合物に、氷冷下、亜硝酸ナトリウム(60mg)の水(2ml)溶液を滴下し、同温度で10分間攪拌した。この反応液を、氷冷下、塩化銅(I)(70mg)と濃塩酸(2ml)の混合物に滴下した。同温度で1時間、60℃で30分間攪拌後、20%水酸化ナトリウム水溶液でアルカリ性となし、ついでクロロホルムで抽出した。抽出液を硫酸ナトリウムで乾燥後、溶媒を減圧留去し、得られる残渣をクロロホルムおよびジイソプロピルエーテルの混合液から再結晶して、7−(3−アミノ−1−ピロリジニル)−6−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸エチルエステル(30mg)を得た。
融点:208−210℃
【0522】
(8) 実施例C−1(2)に記載の方法に準じて、前項で得たエチルエステルを加水分解して目的とする7−(3−アミノ−1−ピロリジニル)−6−クロロ−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸 0.85塩酸塩(化合物Cl−1)を得た。
融点:288−291℃(分解)
【0523】
実施例C−25:−−目的物(I)の製造−−:
C−シリーズ系実施例のいずれかに記載の方法またはこれに準じる方法により以下の化合物を得た。
【0524】
【化37】

【0525】
第22表
【0526】
【表50】

【0527】
実施例C−26:−−目的物(I)の製造−−:
3−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−イル〕アクリル酸 メチルエステル 0.9 トリフルオロ酢酸塩(化合物9H−9)
【0528】
実施例C−8で得た3−ホルミル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン塩酸塩(100mg)にアンモニア水3mlを加え、クロロホルムで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、溶媒を減圧留去して油状物を得た。
【0529】
一方で60%水素化ナトリウム(19mg)をn−ヘキサンで洗浄し、テトラヒドロフラン10mlを加えた。得られる懸濁液にホスホノ酢酸トリメチル(65mg)を室温で加え、10分間攪拌した後、氷冷し、先に得た油状物のテトラヒドロフラン(5ml)溶液を滴下した。室温で3時間攪拌後、水を加えてクロロホルムで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られる残渣をシリカゲルカラムクロマトグラフィー(溶離液クロロホルム:メタノール=50:1)で精製して油状物を得た。これを塩化メチレンに溶解し、氷冷下、トリフルオロ酢酸5滴を加え、更にジイソプロピルエーテルを加えて析出結晶を濾取し標記化合物(22mg)を得た。
【0530】
融点:230−233℃(分解);
IR(KBr)cm-1;2950,1680,1620;
MS(m/z):442(MH+ )
【0531】
実施例C−27:−−目的物(I)の製造−−:
3−アセチル−1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン(化合物9H−10)
【0532】
(1) マロン酸エチルカリウム(572 mg)に酢酸エチル(60ml)を加え、得られる懸濁液に塩化マグネシウム(343 mg)およびトリエチルアミン(1.0 ml)を室温で加え、5時間攪拌した。
【0533】
一方で実施例C−8(2)で得た7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(1.2 g)のクロロホルム(120 ml)溶液に室温でBOP試薬(1.27g)およびトリエチルアミン(0.8 ml)を加え、20分間攪拌した。この反応液を先の反応液に室温で加え、1日攪拌した。
【0534】
反応液を水に注ぎ、クロロホルムで抽出した。飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた残渣をシリカゲルカラムクロマトグラフィー(溶離液 クロロホルム:メタノール=200:1)で精製して、3−{7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−イル}−3−オキソプロピオン酸エチルエステル(397 mg)を得た。
MS(m/z):572(MH+ )
【0535】
(2) 前記(1)で得た化合物(170 mg)をエタノール(2ml)に溶解し、10%塩酸水(10ml)を加えた。室温で30分間、95℃で4時間攪拌した。冷後、炭酸水素ナトリウム水でアルカリ性となし、ついでクロロホルムで抽出した。抽出液を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、残渣をジイソプロピルエーテルで結晶化させ、標記化合物(76mg)を得た。
【0536】
融点:112−114℃;
IR(KBr)cm-1;3085,1685,1620;
MS(m/z):400(MH+ )
【0537】
実施例C−28:−−目的物(I)の製造−−:
N−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕グリシンエチルエステル トリフルオロ酢酸塩(化合物9H−11)
【0538】
実施例C−11(1)に記載の方法に準じて、7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸(250mg)と塩酸グリシンエチルエステル(78mg)からN−{7−〔トランス−3−(N−t−ブトキシカルボニルメチルアミノ)−4−メトキシ−1−ピロリジニル〕−1,4−ジヒドロ−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕グリシンエチルエステル(290mg)を得た。
【0539】
これを塩化メチレン(9ml)に溶解し、氷冷下、トリフルオロ酢酸(1.2 ml)を加えた。室温で一日攪拌した後、反応液にジイソプロピルエーテルを加え、析出結晶を濾取し、目的とする化合物9H−11(260mg)を得た。
融点:233−236℃(分解)
【0540】
実施例C−29:−−目的物(I)の製造−−:
N−〔1,4−ジヒドロ−7−(トランス−3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボニル〕−L−アラニン トリフルオロ酢酸塩(化合物9H−12)
【0541】
実施例C−28と同様の方法により標記化合物を得た。
融点:168−170℃(分解)
【0542】
つぎに製剤の製造例を挙げる。
【0543】
実施例D−1:−−液剤の調製−−:
処方:−−
【0544】
【表51】

【0545】
調製法:−−化合物H−1−1−1およびソルビトールを注射用蒸留水の一部に溶解し、水酸化ナトリウムおよび残りの蒸留水を加え、溶液のpHを5.0 に調製した。この溶液をメンブランフィルター(0.22 μm)で濾過し、注射用液剤を得た。
【0546】
実施例D−2:−−凍結乾燥製剤の調製−−:
処方:−−
【0547】
【表52】

【0548】
調製法:−−化合物H−1−1−1およびマンニトールを注射用蒸留水の一部に溶解し、水酸化ナトリウムおよび残りの蒸留水を加え、溶液のpHを5.0 に調製した。この溶液をメンブランフィルター(0.22 μm)で濾過し、これを凍結乾燥して注射用粉末剤を得た。
【産業上の利用可能性】
【0549】
本発明にかかわる化合物は、リンパ性白血病腫瘍の如き非固形腫瘍のみならず、例えば、肺、乳、胃、子宮、皮膚、腸、膀胱、鼻喉などの各組織に発生する各種の固形腫瘍に対してても顕著な抗腫瘍作用を示す。また、本発明にかかわる化合物は生体に対する安全性が高い。従って、本発明にかかわる化合物は、ヒト腫瘍の治療剤または予防剤として有用である。
【図面の簡単な説明】
【0550】
【図1】ヒト鼻咽腔癌(KB)に対する抗腫瘍効果を示す図である。
【図2】ヒト乳癌(MX−1)に対する抗腫瘍効果を示す図である。
【図3】ヒト結腸癌(WiDr)に対する抗腫瘍効果を示す図である。
【図4】はヒト黒色腫(HMV−2)に対する抗腫瘍効果を示す図である。
【図5】ヒト肺癌(LX−1)に対する抗腫瘍効果を示す図である。
【特許請求の範囲】
【請求項1】
下記一般式(I)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする抗腫瘍剤。
【化1】

(式中、--------- は単結合の存在または非存在を意味する。XはNまたはC−Rx を意味し、ここにおいてRx は水素原子またはハロゲン原子を意味する。R1およびR2 は同一または異なり、水素原子、ハロゲン原子、ニトロ基、低級アルコキシ基、低級アルキル基(該低級アルキル基は低級アルコキシカルボニルまたはカルボキシルで置換されていてもよい)、ハロゲンで置換されていてもよいフェニル基もしくはチエニル基、またはフェニルスルホニル基(該フェニル部分はハロゲンもしくはニトロで置換されていてもよい)を意味するか、あるいはR1およびR2 が一緒になってベンゼン環またはナフタレン環を形成し、該ベンゼン環またはナフタレン環はハロゲン、ニトロもしくは低級アルキルで置換されていてもよい。R3は水素原子、ベンジル基、水酸基、カルボキシル基またはカルボキシル基に変換しうる基を意味する。R4 はオキソ基または水酸基を意味する。R5は水素原子、アミノ基、ハロゲン原子または低級アルキル基を意味し、該低級アルキル基はハロゲンで置換されていてもよい。R6 はN−C結合、C−C結合、S−C結合またはO−C結合により母核と結合している置換基を意味する。但し、1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩を除く。)
【請求項2】
一般式(I)におけるR6 が下記の(a)〜(e)から選ばれるいずれかの基である請求項第1項記載の抗腫瘍剤。
〔ここにおいてR6 は、(a)次の式(a)で表される4〜7員の単環性アミノ基:
【化2】

(式中、--------- は単結合の存在または非存在を意味し、R6a1、R6a2、R6a3およびR6a4は同一または異なり、C、CH、CH2、CH2 CH2 、CH=CH、S(O)0-2 、O、NまたはN−R6a を意味し、ここでR6a は水素原子、低級アルキル基またはフェニル基を意味し、該フェニル基は低級アルコキシ、低級アルキル、ハロゲンまたはニトロで置換されていてもよい。kおよびmは同一または異なり、0または1の整数を意味する。R6a5は水素原子、メチレン基または次の式(R6a −5)で表される基を意味する:
【化3】

〔式中、R6a51 は水素原子またはフェニル基(該フェニル基はハロゲンで置換されていてもよい)を意味するか、またはフェニルもしくはハロゲノフェニルで置換されていてもよい低級アルキル基を意味し、R6a52 は水素原子、低級アルキル基または水素原子に変換しうる基であり、nは0〜4の整数である。〕
R6a6は水素原子、ハロゲン原子、水酸基、アジド基、ホルミル基、オキソ基、低級アルコキシ基、低級アルキルチオ基または低級アルキル基(該低級アルキル基はハロゲンもしくはヒドロキシで置換されていてもよい)を意味する。R6a7はR6a6と同じものを意味するか、あるいは次の式(R6a −7)で表されるスピロ環状アミノ基を意味する:
【化4】

〔式中、pは3または4の整数を意味する。〕、
(b)次の式(b)で表される二環性アミノ基:
【化5】

(式中、--------- は単結合の存在または非存在を意味し、q,sおよびtは同一または異なり、0〜2の整数であり、qとtの和は2または3である。R6b1はC、CH、CH2またはN−R6b を意味し、ここにおいてR6b は水素原子または低級アルキル基を意味し、R6b2はC、CH、CH2 、CH2CH2 またはCH=CHを意味し、R6b3はC、CH、CH2 またはOを意味し、u、vおよびwは同一または異なり、0または1の整数であって、これらの和が1〜3であることを意味し、R6b4およびR6b5は同一または異なり、水素原子、水酸基、低級アルキル基、アミノ基、モノもしくはジ−低級アルキルアミノ基またはモノもしくはジ−低級アルキルアミノ低級アルキル基を意味する。)、
(c)次の式(c)で表される3〜7員の環状基:
【化6】

(式中、--------- は単結合の存在または非存在を意味し、R6c1、R6c2、R6c3およびR6c4は同一または異なり、C、CH、CH2、CH2 CH2 、CH=CH、S(O)0-2 、O、NまたはN−R6c を意味し、ここでR6c は水素原子または低級アルキル基を意味する。R6c5はO、SまたはCH2 を意味し、R6c6およびR6c7は同一または異なり、水素原子、アミノ基または低級アルキル基を意味する。f、gおよびhは同一または異なり、0または1の整数を意味する。)、
(d)次の式(d)で表されるアミノ基:
【化7】

(式中、R6d1はSまたはNHを意味し、R6d2およびR6d3は同一または異なり、水素原子または低級アルキル基を意味し、iは0または1の整数を意味し、jは1〜5の整数を意味する。)および
(e)水酸基、低級アルキル基、低級アルケニル基または低級アルキニル基から選ばれるいずれかの基である。〕
【請求項3】
下記一般式(I−a)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする請求項第1項または第2項記載の抗腫瘍剤。
【化8】

(式中、------、R1 、R2 、R3 、R4 、R5、X、R6a1、R6a2、R6a3、R6a4、R6a5、R6a6、R6a7およびkは請求項第2項に記載のものと同じものを意味する。)
【請求項4】
下記一般式(I−b)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする請求項第3項記載の抗腫瘍剤。
【化9】

(式中、Wは水素原子またはフッ素原子であり、------、R1 、R2 、R3 、R4、R5 、R6a5、R6a6およびRa7は請求項第2項に記載のものと同じものを意味する。)
【請求項5】
下記一般式(I−c)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする請求項第3項または第4項記載の抗腫瘍剤。
【化10】

(式中、R6a511は低級アルキル基であり、R6a61 およびR6a71 は同一または異なり、水素原子、低級アルコキシ基または低級アルキル基を意味する。)
【請求項6】
下記一般式(I−c)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物からなる医薬〔但し、1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩を有効成分とする抗腫瘍剤を除く。〕。
【化11】

(式中、R6a511は低級アルキル基であり、R6a61 およびR6a71 は同一または異なり、水素原子、低級アルコキシ基または低級アルキル基を意味する。)
【請求項7】
1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩からなる請求項第6項記載の医薬。
【請求項1】
下記一般式(I)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする抗腫瘍剤。
【化1】

(式中、--------- は単結合の存在または非存在を意味する。XはNまたはC−Rx を意味し、ここにおいてRx は水素原子またはハロゲン原子を意味する。R1およびR2 は同一または異なり、水素原子、ハロゲン原子、ニトロ基、低級アルコキシ基、低級アルキル基(該低級アルキル基は低級アルコキシカルボニルまたはカルボキシルで置換されていてもよい)、ハロゲンで置換されていてもよいフェニル基もしくはチエニル基、またはフェニルスルホニル基(該フェニル部分はハロゲンもしくはニトロで置換されていてもよい)を意味するか、あるいはR1およびR2 が一緒になってベンゼン環またはナフタレン環を形成し、該ベンゼン環またはナフタレン環はハロゲン、ニトロもしくは低級アルキルで置換されていてもよい。R3は水素原子、ベンジル基、水酸基、カルボキシル基またはカルボキシル基に変換しうる基を意味する。R4 はオキソ基または水酸基を意味する。R5は水素原子、アミノ基、ハロゲン原子または低級アルキル基を意味し、該低級アルキル基はハロゲンで置換されていてもよい。R6 はN−C結合、C−C結合、S−C結合またはO−C結合により母核と結合している置換基を意味する。但し、1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩を除く。)
【請求項2】
一般式(I)におけるR6 が下記の(a)〜(e)から選ばれるいずれかの基である請求項第1項記載の抗腫瘍剤。
〔ここにおいてR6 は、(a)次の式(a)で表される4〜7員の単環性アミノ基:
【化2】

(式中、--------- は単結合の存在または非存在を意味し、R6a1、R6a2、R6a3およびR6a4は同一または異なり、C、CH、CH2、CH2 CH2 、CH=CH、S(O)0-2 、O、NまたはN−R6a を意味し、ここでR6a は水素原子、低級アルキル基またはフェニル基を意味し、該フェニル基は低級アルコキシ、低級アルキル、ハロゲンまたはニトロで置換されていてもよい。kおよびmは同一または異なり、0または1の整数を意味する。R6a5は水素原子、メチレン基または次の式(R6a −5)で表される基を意味する:
【化3】

〔式中、R6a51 は水素原子またはフェニル基(該フェニル基はハロゲンで置換されていてもよい)を意味するか、またはフェニルもしくはハロゲノフェニルで置換されていてもよい低級アルキル基を意味し、R6a52 は水素原子、低級アルキル基または水素原子に変換しうる基であり、nは0〜4の整数である。〕
R6a6は水素原子、ハロゲン原子、水酸基、アジド基、ホルミル基、オキソ基、低級アルコキシ基、低級アルキルチオ基または低級アルキル基(該低級アルキル基はハロゲンもしくはヒドロキシで置換されていてもよい)を意味する。R6a7はR6a6と同じものを意味するか、あるいは次の式(R6a −7)で表されるスピロ環状アミノ基を意味する:
【化4】

〔式中、pは3または4の整数を意味する。〕、
(b)次の式(b)で表される二環性アミノ基:
【化5】

(式中、--------- は単結合の存在または非存在を意味し、q,sおよびtは同一または異なり、0〜2の整数であり、qとtの和は2または3である。R6b1はC、CH、CH2またはN−R6b を意味し、ここにおいてR6b は水素原子または低級アルキル基を意味し、R6b2はC、CH、CH2 、CH2CH2 またはCH=CHを意味し、R6b3はC、CH、CH2 またはOを意味し、u、vおよびwは同一または異なり、0または1の整数であって、これらの和が1〜3であることを意味し、R6b4およびR6b5は同一または異なり、水素原子、水酸基、低級アルキル基、アミノ基、モノもしくはジ−低級アルキルアミノ基またはモノもしくはジ−低級アルキルアミノ低級アルキル基を意味する。)、
(c)次の式(c)で表される3〜7員の環状基:
【化6】

(式中、--------- は単結合の存在または非存在を意味し、R6c1、R6c2、R6c3およびR6c4は同一または異なり、C、CH、CH2、CH2 CH2 、CH=CH、S(O)0-2 、O、NまたはN−R6c を意味し、ここでR6c は水素原子または低級アルキル基を意味する。R6c5はO、SまたはCH2 を意味し、R6c6およびR6c7は同一または異なり、水素原子、アミノ基または低級アルキル基を意味する。f、gおよびhは同一または異なり、0または1の整数を意味する。)、
(d)次の式(d)で表されるアミノ基:
【化7】

(式中、R6d1はSまたはNHを意味し、R6d2およびR6d3は同一または異なり、水素原子または低級アルキル基を意味し、iは0または1の整数を意味し、jは1〜5の整数を意味する。)および
(e)水酸基、低級アルキル基、低級アルケニル基または低級アルキニル基から選ばれるいずれかの基である。〕
【請求項3】
下記一般式(I−a)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする請求項第1項または第2項記載の抗腫瘍剤。
【化8】

(式中、------、R1 、R2 、R3 、R4 、R5、X、R6a1、R6a2、R6a3、R6a4、R6a5、R6a6、R6a7およびkは請求項第2項に記載のものと同じものを意味する。)
【請求項4】
下記一般式(I−b)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする請求項第3項記載の抗腫瘍剤。
【化9】

(式中、Wは水素原子またはフッ素原子であり、------、R1 、R2 、R3 、R4、R5 、R6a5、R6a6およびRa7は請求項第2項に記載のものと同じものを意味する。)
【請求項5】
下記一般式(I−c)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物を有効成分とする請求項第3項または第4項記載の抗腫瘍剤。
【化10】

(式中、R6a511は低級アルキル基であり、R6a61 およびR6a71 は同一または異なり、水素原子、低級アルコキシ基または低級アルキル基を意味する。)
【請求項6】
下記一般式(I−c)で表される化合物、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩、あるいは前記のいずれかの水和物もしくは溶媒和物からなる医薬〔但し、1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩を有効成分とする抗腫瘍剤を除く。〕。
【化11】

(式中、R6a511は低級アルキル基であり、R6a61 およびR6a71 は同一または異なり、水素原子、低級アルコキシ基または低級アルキル基を意味する。)
【請求項7】
1,4−ジヒドロ−7−(3−メトキシ−4−メチルアミノ−1−ピロリジニル)−4−オキソ−1−(2−チアゾリル)−1,8−ナフチリジン−3−カルボン酸、その立体異性体もしくは光学異性体またはこれらの生理的に許容される塩からなる請求項第6項記載の医薬。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2009−13176(P2009−13176A)
【公開日】平成21年1月22日(2009.1.22)
【国際特許分類】
【出願番号】特願2008−182068(P2008−182068)
【出願日】平成20年7月11日(2008.7.11)
【分割の表示】特願平8−351948の分割
【原出願日】平成8年12月10日(1996.12.10)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【Fターム(参考)】
【公開日】平成21年1月22日(2009.1.22)
【国際特許分類】
【出願日】平成20年7月11日(2008.7.11)
【分割の表示】特願平8−351948の分割
【原出願日】平成8年12月10日(1996.12.10)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【Fターム(参考)】
[ Back to top ]

