抗腫瘍剤
【課題】腫瘍に対し強い毒性を有し、かつ副作用が少ない新規抗腫瘍剤を提供すること。更に詳しくは腫瘍に対して優れた選択毒性を有する抗腫瘍剤を提供すること。本発明の抗腫瘍剤は、特に好ましくは抗中枢神経系腫瘍剤として用いられる。
【解決手段】グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有する抗腫瘍剤。
【解決手段】グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有する抗腫瘍剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、腫瘍に対し強い毒性を有し、かつ副作用が少ない新規抗腫瘍剤に関する。更に詳しくは本発明は、腫瘍に対して優れた選択毒性を有する抗腫瘍剤に関する。本発明の抗腫瘍剤は、特に好ましくは抗中枢神経系腫瘍剤として用いられる。
【0002】
本発明において腫瘍とは、良性腫瘍及び悪性腫瘍(がん)を含むものである。
【0003】
本発明における毒性とは、細胞の増殖を抑制することを言う。当該細胞の増殖の抑制は細胞分裂の抑制や細胞死等に起因するものである。
【0004】
本発明における選択毒性とは、腫瘍細胞に対してのみ強い毒性を示し、正常細胞には毒性を示さないことをいう。即ち、副作用が現れない、又は現れても軽微であり、かつ、一過的であることを意味する。
【背景技術】
【0005】
正常細胞が腫瘍化してしまうと、腫瘍を治療するために外科的な手術、放射線治療、抗腫瘍剤の投与等が行われる。
【0006】
また、抗腫瘍剤の創製のために、細胞レベルでの試験、マウスでの試験、臨床試験など、さまざまな試験が行われている。
【0007】
マヌマイシンA及びアドリアマイシンは従来の抗腫瘍剤に使用されている。
【0008】
マヌマイシンAは下記化1に示す化合物である。
【0009】
【化1】

アドリアマイシンは下記化2に示す化合物である。
【0010】
【化2】

【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Loo et al, 1989. Serum-free mouse embryo (SFME) cells : growthresponse in vitro. J. Cell. Physiol., 139: 484-491.
【非特許文献2】Sakai et al, 1990. Proc. Natl. Acad. Sci. USA, 87: 8378-8382.
【非特許文献3】D’ Alessandro et al, 1994. Growth Factors, 11: 53-69.
【0012】
上記非特許文献1〜3に記載されている通り、Serum-free mouse embryo cells(以下、SFME細胞と称する。)は中枢神経系の正常幹細胞として知られている。
【0013】
【非特許文献4】Nomura et al, 1993. Establishment of a metastatic murine cell linecarrying the human c-Ha-ras. In VitroCell. Dev. Biol,. 29A:614-616. 上記非特許文献4にはhuman c-Ha-ras and mouse c-myc co-transfected highly metastatic serum-freemouse embryo-1 cells(以下、r/mHM-SFME-1細胞と称する。)の確立についての記載がある。
【0014】
【非特許文献5】Akao, T. 1998. Distribution of enzymes involved in the metabolism ofglycyrrhizin in various organs of rat. Biol.Pharmaceu. Bull. 21:1036-1044. 上記非特許文献5には、グリチルリチンを経口投与すると、グリチルリチンはグリチルレチン酸に加水分解されることの記載がある。上記グリチルリチンとは、アグリコンとしてのグリチルレチン酸に糖が結合した配糖体である。
【発明の概要】
【発明が解決しようとする課題】
【0015】
従来の抗腫瘍剤の多くは腫瘍細胞よりも優先的に正常細胞に毒性を示し、これが抗腫瘍剤の副作用が大きいという問題を引き起こしていると考えられる。そこで、正常細胞よりも優先的に腫瘍細胞の増殖を抑制する有効成分を含有する抗腫瘍剤が望まれる。より効果的で、かつ、より安全な腫瘍の予防及び治療薬が望まれる中で、植物由来の化合物や抽出物等が新薬の創製に大きな役割を果たすことが期待される。グリチルリチンは甘草抽出物に含まれるサポニンで、甘味料として世界的に利用されている。当該グリチルリチンは経口投与すると、糖とグリチルレチン酸に加水分解される。当該グリチルレチン酸はウィルス感染、炎症、アナフィラキシーの治療剤等として利用されている。
【0016】
本願発明者は鋭意研究を重ねた結果、グリチルレチン酸が、腫瘍、特に中枢神経系腫瘍に対し強い毒性を有することを見出し、かつ、副作用を軽減することが可能であること、さらには優れた選択毒性を示すことをも発見した。本願発明は、これらの知見に基づいて完成させたものである。
【0017】
本発明は腫瘍に対し強い毒性を有し、かつ副作用が少ない新規抗腫瘍剤を提供すること、更に詳しくは本発明は、腫瘍に対して優れた選択毒性を有する抗腫瘍剤を提供することを解決すべき課題とする。本発明の抗腫瘍剤は、特に好ましくは抗中枢神経系腫瘍剤として用いられる。
【課題を解決するための手段】
【0018】
(第1発明)
上記課題を解決するための本願第1発明の構成は、グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有する抗腫瘍剤である。
【0019】
グリチルレチン酸の誘導体とは、限定はされないが、グリチルレチン酸の配糖体を少なくとも含む。誘導体として、例えば、グリチルリチン、グリチルレチン酸ステアリル等を含む。
【0020】
グリチルレチン酸及びグリチルレチン酸の誘導体の薬学的に許容される塩とは、限定はされないが、例えばナトリウム塩、カリウム塩、アンモニウム塩、コリン塩、有機アミン塩等を含む。
【0021】
(第2発明)
上記課題を解決するための本願第2発明の構成は、前記第1発明に係る抗腫瘍剤が抗中枢神経系腫瘍剤である、抗腫瘍剤である。
【0022】
中枢神経系腫瘍とは、中枢神経系に発生し又は中枢神経系に転移した腫瘍を言い、例えば脳腫瘍、脊髄腫瘍等が例示される。
【0023】
脳腫瘍とは、神経上皮性腫瘍、髄膜および関連組織由来性腫瘍、胚細胞性腫瘍等をいう。また、脊髄腫瘍とは、硬膜外腫瘍、硬膜内髄外腫瘍、髄内腫瘍等をいう。
【0024】
(第3発明)
上記課題を解決するための本願第3発明の構成は、前記抗腫瘍剤が、直接投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜20mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。
【0025】
上記の第3発明において、「グリチルレチン酸換算で」とは、有効成分がグリチルレチン酸の誘導体、グリチルレチン酸及びその誘導体の薬学的に許容される塩である場合は、上記の投与量はグリチルレチン酸としてのmg数に換算して計算されることを意味する。
【0026】
上記投与量の単位である「mg/kg」は、投与される患者の体重1kg当たりの投与量(mg)を意味する。
【0027】
上記直接投与法とは、抗腫瘍剤を患部に直接投与する方法であって、具体的にはカテーテルを使用する方法、脊髄注射による方法等を例示することができる。
【0028】
(第4発明)
上記課題を解決するための本願第4発明の構成は、前記抗腫瘍剤が、全身投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜2mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。
【0029】
上記の第4発明において、「グリチルレチン酸換算で」とは、第3発明における場合と同じ意味である。
【0030】
上記全身投与法とは、投与された抗腫瘍剤の有効成分が血液、リンパ液等を介して全身に行き渡る抗腫瘍剤の投与法をいう。具体的には、経口投与、経皮吸収、血管投与、皮下注射、腹腔内投与等を例示できる。
【発明の効果】
【0031】
(第1発明)
上記第1発明によって、腫瘍に対し強い毒性を有し、かつ、副作用が少ない、有効な抗腫瘍剤が提供される。
【0032】
(第2発明)
上記第2発明によって、有効な抗中枢神経系腫瘍剤としての抗腫瘍剤が提供される。対象疾患が中枢神経系腫瘍である場合、腫瘍に対し強い毒性を有し、かつ副作用が少ない、という効果はより顕著になる。また、正常細胞よりも優先的に腫瘍細胞の増殖を抑制するという効果が顕著になる。
【0033】
(第3発明及び第4発明)
上記第3発明及び第4発明によって、優れた選択毒性を有する抗腫瘍剤が、直接投与法又は全身投与法における有効な投与プロトコールを規定されたものとして提供される。
【0034】
特に上記第3発明により、優れた選択毒性を有し、かつ、より早く抗腫瘍活性が発揮される抗腫瘍剤が提供される。上記全身投与法、特に経口投与の場合は、WHO等のグリチルレチン酸の許容摂取量を考慮して前記有効成分の投与量を決めることが好ましいが、直接投与法では抗腫瘍剤が患部に直接投与されるので、より多量の前記有効成分を患部に投与できる。より多量の有効成分の投与は、より強い抗腫瘍活性に繋がる。また、抗腫瘍剤の患部への到達が早いので、より早く抗腫瘍活性が発揮される。また、摘出が難しい部位にできた腫瘍の治療が可能となるし、体力的な問題等で摘出手術が難しい患者の腫瘍の治療も可能となる。
【0035】
優れた選択毒性を有するということは、早期腫瘍治療や末期がん治療における強烈な吐き気や全身倦怠感、さらには頭髪の脱落などといった抗腫瘍剤にしばしばみられる副作用の回避を可能とし、より安全性が高く、また患者のQOL(クオリティー・オブ・ライフ)を高める治療が可能となる。
【図面の簡単な説明】
【0036】
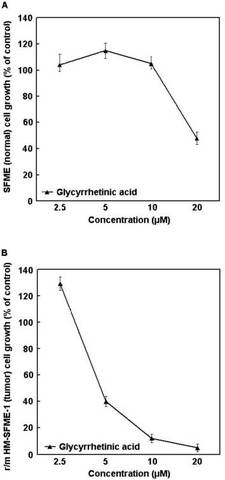
【図1】実施例1の試験結果を示すグラフである。各濃度における点は平均値であり、各点には標準偏差も示してある。
【0037】
【図2】実施例2及び実施例2に対する比較例の微速度顕微観察の結果を示してある。各フレームの右下には試験開始後の経過時間(h)を示してある。
【0038】
【図3】実施例3、実施例3に対する比較例における試験の結果を示してある。グラフ中の各棒は生存細胞数の平均値を表し、各棒には標準偏差も示してある。生存細胞数はコントロール(0μM)との比較(%)で示している。
【0039】
【図4】実施例5及び実施例5に対する比較例の試験結果を示してある。各フレームの右下には試験開始後の経過時間(h)を示してある。
【発明を実施するための形態】
【0040】
次に、本発明を実施するための形態を、その最良の形態を含めて説明する。以下、「本発明」とは、上記第1発明〜第4発明を一括して称するものである。
【0041】
本願第1発明の構成は、グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有する抗腫瘍剤である。また、本願第2発明の構成は、前記第1発明に係る抗腫瘍剤が抗中枢神経系腫瘍剤である、抗腫瘍剤である。
【0042】
本発明の抗腫瘍剤は腫瘍細胞(即ち、腫瘍)に対して毒性を示し、殺腫瘍、腫瘍転移防止、腫瘍再発防止又は腫瘍予防等の目的で使用される。また、本発明の抗中枢神経系腫瘍剤は中枢神経系腫瘍に対して毒性を示し、殺中枢神経系腫瘍、中枢神経系腫瘍の転移防止、中枢神経系腫瘍再発防止又は中枢神経系腫瘍の予防等の目的で使用される。
【0043】
中枢神経系腫瘍とは、中枢神経系に発生し又は中枢神経系に転移した腫瘍を言い、例えば脳腫瘍、脊髄腫瘍等が例示される。即ち、抗中枢神経系腫瘍剤は抗脳腫瘍剤、抗脊髄腫瘍剤等を含む。
【0044】
脳腫瘍とは、神経上皮性腫瘍(神経膠芽腫瘍、星細胞腫瘍、乏突起神経膠腫瘍、髄芽腫瘍、上衣細胞腫瘍、脈絡叢乳頭腫瘍、神経細胞由来の腫瘍、松果体部腫瘍を含む)、髄膜および関連組織由来性腫瘍(髄腹腫瘍、黒色腫瘍を含む)、胚細胞性腫瘍(胚芽腫瘍、良性奇形腫瘍、悪性奇形腫瘍、胎児性腫瘍、絨毛上皮腫瘍、卵黄嚢腫瘍を含む)等をいうので、抗脳腫瘍剤は、抗神経上皮性腫瘍剤、抗髄膜および関連組織由来性腫瘍剤、抗胚細胞性腫瘍剤等を含む。
【0045】
また、脊髄腫瘍とは、硬膜外腫瘍、硬膜内髄外腫瘍、髄内腫瘍等をいうので、抗脊髄腫瘍剤は、抗硬膜外腫瘍剤、抗硬膜内髄外腫瘍剤、抗髄内腫瘍剤等を含む。
【0046】
〔SFME細胞及びr/mHM-SFME-1細胞〕
Balb/c系統マウスは、動物実験において一般的に使用されてきたマウスである。後述の実施例で本発明の効果の実証のために用いるSFME細胞は、受精後16日のBalb/c系統マウス胚から作出された中枢神経系の正常幹細胞である。当該SFME細胞は上記の通りin vivoにおいて正常細胞、即ち腫瘍化していない細胞である。
【0047】
また、r/mHM-SFME-1細胞は、SFME細胞にヒトがん由来活性型c-Ha-ras1遺伝子(細胞をがん化させる遺伝子。以下、ras遺伝子と称する。)及びマウスc-myc遺伝子(前記ras遺伝子の効力を強める遺伝子)を導入したものであり、肺への高転移能を持つがん細胞である。SFME細胞とr/mHM-SFME-1細胞の相違点は、r/mHM-SFME-1細胞ががん化している点である。
【0048】
正常細胞から良性腫瘍となり、最終的に悪性腫瘍、即ちがんとなるのが腫瘍の進行である。腫瘍の種類により良性腫瘍からがんへの移行の速度に差があるが、良性腫瘍も悪性腫瘍も、もとは正常細胞であったものである。ゆえに、腫瘍の研究を進めるにあたっては、由来が同じである細胞を用いることが好ましい。SFME細胞及びr/mHM-SFME-1細胞は由来が同じであることから、各細胞を用いた試験の結果を比較することは腫瘍、特に中枢神経系腫瘍の発生、治療、予防及び再発防止等を研究するのに好ましいということができる。即ち、抗腫瘍剤、抗中枢神経系腫瘍剤の創製に有用である。中枢神経系腫瘍とは脳腫瘍、脊髄腫瘍等を含むので、上記試験は脳腫瘍、脊髄腫瘍等の発生、治療、予防及び再発防止等を研究するのにも好ましい。
【0049】
〔グリチルレチン酸〕
本発明に用いるグリチルレチン酸は、下記化3に示す化合物である。
【0050】
【化3】

グリチルレチン酸は市販されており、容易に入手することができる。また、甘草にはグリチルリチンが含まれており、当該グリチルリチンを加水分解することによってもグリチルレチン酸を入手することができる。
【0051】
〔グリチルレチン酸の誘導体、塩〕
本発明の抗腫瘍剤の有効成分としては、グリチルレチン酸の各種誘導体も使用できる。グリチルレチン酸の誘導体には、グリチルレチン酸をアグリコンとする配糖体、特にグリチルリチンが少なくとも含まれる。グリチルリチンは経口投与によってグリチルレチン酸に加水分解されるので、グリチルレチン酸と同等の作用・効果を期待できる。グリチルレチン酸の誘導体としては、グリチルリチン、グリチルレチン酸ステアリル等を例示することができる。更に、本発明の抗腫瘍剤の有効成分としては、グリチルレチン酸及びその誘導体の薬学的に許容される塩も使用できる。例えばナトリウム塩、カリウム塩、アンモニウム塩、コリン塩、有機アミン塩等を使用できる。例えば、有効成分がグリチルレチン酸の塩である場合は、液体等の担体に溶けることでグリチルレチン酸としての作用・効果が期待できることはいうまでもない。
【0052】
上記誘導体や塩は、グリチルレチン酸から縮合反応等の常法により得ることができる。
【0053】
〔抗腫瘍剤及び抗中枢神経系腫瘍剤〕
本発明の有効成分とは、グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上をいう。当該有効成分は実質的にグリチルレチン酸として作用し、腫瘍に対し強い毒性を有し、かつ副作用が少ないという効果を示す。また、投与量、投与形式等によっては優れた選択毒性を示す。
【0054】
上記有効成分は、腫瘍に対する毒性を有するので、腫瘍を治療・予防・再発防止する種々の用途に用いることができる。更に、当該有効成分は中枢神経系腫瘍を治療・予防・再発防止する種々の用途に用いることが好ましい。上記有効成分を含有することで、新規抗腫瘍剤、抗中枢神経系腫瘍剤とすることができる。更に、抗脳腫瘍剤、抗脊髄腫瘍剤等とすることができる。
【0055】
本発明の投与対象は特に限定されないが、哺乳類が好ましく、ヒトが特に好ましい。
【0056】
本発明の対象疾患となる腫瘍は特に限定されないが、例えば、中枢神経系腫瘍、悪性黒色腫瘍、悪性リンパ腫瘍、咽頭腫瘍、喉頭腫瘍、胃腫瘍、カポジ肉腫、肝臓腫瘍、筋肉腫瘍、結腸腫瘍、血管腫瘍、骨髄腫瘍、甲状腺腫瘍、睾丸腫瘍、膵臓腫瘍、消化器腫瘍、食道腫瘍、大腸腫瘍、上顎腫瘍、舌腫瘍、口唇腫瘍、口腔腫瘍、胆嚢腫瘍、胆管腫瘍、胆道腫瘍、直腸腫瘍、乳腫瘍、尿管腫瘍、肉腫、骨肉腫瘍、白血病、肺腫瘍、神経芽腫瘍、真性多血症、膀胱腫瘍、卵巣腫瘍、子宮腫瘍、前立腺腫瘍、皮膚腫瘍、基底細胞腫瘍、皮膚付属器腫瘍、皮膚転移腫瘍および皮膚黒色腫などの各種良性及び悪性腫瘍を例示することができる。これらの中でも中枢神経系腫瘍を好ましく例示できる。
【0057】
本発明の抗腫瘍剤の剤形は特に限定されない。本願第3発明においては、液剤、注射剤を好ましく例示できる。前記有効成分を医薬として使用する場合、通常、適当な添加剤と混和し、製剤化したものを使用する。ただし、前記有効成分を原体のまま医薬として使用することを否定するものではない。
【0058】
前記有効成分は常法で薬学的に許容される液体、固体等の公知の各種担体と混合し、また必要に応じて安定化剤、着色剤、矯味剤、矯臭剤、賦形剤、溶剤、界面活性剤、乳化剤、懸濁化剤、分散剤、保存剤、溶解補助剤、等張化剤、緩衝剤、無痛化剤、保湿剤、結合剤、被覆剤、潤沢剤、崩壊剤、などを加え、液剤、経口投与剤、錠剤、粉剤、坐剤、外用剤、軟膏、貼布剤、点眼剤、注射剤、散剤、顆粒剤、糖衣剤、カプセル剤、ピル、懸濁剤、アンプル、注射液、などあらゆる医薬品としての製剤が可能である。
【0059】
本発明に用いる前記有効成分は、既知の抗腫瘍剤と併用することにより抗腫瘍効果を高めることも可能である。上記既知の抗腫瘍剤とは、例えば、フルオロウラシル、シタラビン、シスプラチン、アドリアマイシン、マヌマイシン等を例示できる。その際には、本発明の効果を損ねない程度に併用剤との量比を適宜調整することが好ましい。
【0060】
本願第1発明及び第2発明の抗腫瘍剤の投与形式は特に限定されない。経口投与、経皮吸収、血管投与、皮下注射、腹腔内投与等の全身投与法や、カテーテルを使用する方法、脊髄注射による方法等の直接投与法といった既知の様々な形式の投与が可能である。
【0061】
本願第1発明及び第2発明の抗腫瘍剤に含まれる上記有効成分の投与量は、症状、年齢、性別、体重、剤形あるいは投与形式により異なるが、週1日以上、投与日1日当たりグリチルレチン酸換算で0.002〜200mg/kgが好ましい。投与回数は1回または数回に分けて投与することができる。投与計画としては、連日投与、間欠投与又はこれらの組み合わせがある。これらの投与においては医師の判断によることが必要である。
【0062】
上記直接投与法によれば、患部に直接抗腫瘍剤が投与されるので、より早く抗腫瘍活性が発揮される。また、摘出が難しい部位にできた腫瘍の治療が可能となる。また、体力的な問題等で摘出手術が難しい患者の腫瘍の治療が可能となる。
【0063】
対象疾患が中枢神経系腫瘍である場合は、正常細胞よりも優先的に腫瘍細胞の増殖を抑制するという効果が顕著になる。前記直接投与法を採用すれば、中枢神経系腫瘍に対する当該効果はより顕著になる。
【0064】
本発明の抗腫瘍剤、抗中枢神経系腫瘍剤が、腫瘍、特に中枢神経系腫瘍に対して強い毒性を有し、かつ、副作用が少ないことのメカニズムは必ずしも明らかではない。しかし、本願発明者は本発明の研究を通して、本発明が、腫瘍細胞内、特に中枢神経系腫瘍の腫瘍細胞内においてH-Ras遺伝子のダウンレギュレーション、活性酸素量の上昇、グルタチオン量の低下、細胞骨格蛋白質破壊というさまざまな現象を引き起こすことを通じて腫瘍細胞に対し強い毒性を有し、かつ、上記の現象が正常細胞内においては起こりにくいので副作用が少ない、と推測している。
【0065】
また、本願発明者は、従来の抗腫瘍剤に使用されるマヌマイシンAは中枢神経系腫瘍のがん細胞よりも優先的に正常細胞に毒性を示すのに対し、グリチルレチン酸は正常細胞よりも優先的に中枢神経系腫瘍のがん細胞に毒性を示すことを見出した。グリチルレチン酸のこのような性質も腫瘍、特に中枢神経系腫瘍に対し強い毒性を有し、かつ、副作用が少ないという効果に寄与していると考えられる。
【0066】
〔選択毒性〕
上記本願第3発明の構成は、前記抗腫瘍剤が、直接投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜20mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。また、上記本願第4発明の構成は、前記抗腫瘍剤が、全身投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜2mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。
【0067】
本願発明者は鋭意検討を行った結果、抗腫瘍剤に含まれる上記有効成分を特定の投与量の範囲内で投与することにより、腫瘍、特に中枢神経系腫瘍に対して優れた選択毒性が得られることを見出した。
【0068】
優れた選択毒性が得られる上記有効成分の投与量は、症状、年齢、性別、体重、剤形あるいは投与形式により異なるが、抗腫瘍剤が上記全身投与法によって投与される場合は、週1日以上、投与日1日当たりグリチルレチン酸換算で0.002〜2mg/kgであり、より好ましくは0.002〜0.2mg/kgであり、更に好ましくは0.05〜0.2mg/kgである。
【0069】
また、抗腫瘍剤が前記直接投与法によって投与される場合は、週1日以上、投与日1日当たりグリチルレチン酸換算で0.002〜20mg/kgであり、より好ましくは0.02〜20mg/kgであり、更に好ましくは0.2〜20mg/kgである。
【0070】
投与回数は1回または数回に分けて投与することができる。投与計画としては、連日投与、間欠投与又はこれらの組み合わせがある。これらの投与においては医師の判断によることが必要である。
【0071】
上記優れた選択毒性が発揮されるメカニズムは必ずしも明らかではないが、グリチルレチン酸が、正常細胞よりも腫瘍細胞に優先的な毒性を示し、かつ、適切にグリチルレチン酸投与量を調節していることによって選択毒性が発揮されていると本願発明者は推測している。
【0072】
〔MTT試験〕
MTT〔3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2Htetrazolium bromide〕は分子式C18H16BrN5Sで示されるテトラゾリウム塩の1種である。MTTは細胞内に取り込まれると細胞内のミトコンドリア中にある脱水素酵素によってフォルマザンに変化し、青色を呈する。しかし、細胞が死んでいる場合はこのような反応は起こらない。よって、この色の変化の度合いを利用することで、細胞の生死を判断することができる。即ち、薬剤が正常細胞や腫瘍細胞に与える毒性の評価を行うことができる。
【実施例】
【0073】
以下に本発明の実施例と比較例を説明するが、本発明の技術的範囲は、これらによって限定されない。
【0074】
〔試薬〕
グリチルレチン酸及びマヌマイシンAは和光純薬工業株式会社製のものを使用した。アドリアマイシンは協和発酵工業株式会社製のものを使用した。
【0075】
〔細胞の系統及び継代〕
SFME細胞は九州大学白畑實隆先生から分譲して頂いた。当該SFME細胞は受精後16日のBalb/c系統マウス胚から作出された中枢神経系の正常幹細胞である。当該SFME細胞は上記の通り正常細胞、即ち腫瘍化していない細胞である。
【0076】
R/mHM-SFME-1細胞は、SFME細胞にras遺伝子及びマウスc-myc遺伝子を導入したものであり、肺への高転移能を持つがん細胞である。本実施例におけるSFME細胞との違いは、r/mHM-SFME-1細胞が、がん化している点である。R/mHM-SFME-1細胞は、SFME細胞にras遺伝子およびマウスc-myc遺伝子を導入して得られた細胞種でBalb/c系統マウスに腫瘍原性を示す。SFME細胞又はr/mHM-SFME-1細胞をそれぞれリン酸緩衝生理食塩水に浮遊させ、6週齢のBalb/cマウスに移植すると、SFME細胞は正常細胞であるため腫瘍塊を示さないのに対し、r/mHM-SFME-1細胞は移植部位に腫瘍塊を示し、また肺には目視できるほどの明らかな転移腫瘍塊が観察される。さらに肺の腫瘍塊にはr/mHM-SFME-1細胞由来のras遺伝子が検出されることから、r/mHM-SFME-1細胞が腫瘍形成能や肺への高い転移能を保持していることが明らかとなっている。
【0077】
本実施例で使用する基礎栄養培地は、Dulbecco’s modified Eagle’s培地とnutrient mixture F-12 Ham培地を体積比1:1で混合したDME/F-12培地に1.2g/Lの炭酸水素ナトリウム、10nMの亜セレン酸ナトリウム、10μg/mLの硫酸ゲンタマイシンをそれぞれ添加して調製した。本基礎栄養培地は以下の実施例群及びそれらに対する比較例群において適宜使用した。
【0078】
ウシフィブロネクチン(Biomedical Technologies社製)で予備コーティングした直径60mmのシャーレに、10μg/mLのインスリン、25μg/mLのトランスフェリン、50ng/mLのepidermal growth factor(以下、EGFと称する)をそれぞれ添加したDME/F-12培地を入れ、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下でSFME細胞を継代した。
【0079】
R/mHM-SFME-1細胞は、EGFを添加しなかった点を除いて、上記SFME細胞の継代と同様の方法で継代した。
【0080】
上記継代したSFME細胞及びr/mHM-SFME-1細胞は、それぞれの第1世代と同一の特徴を有するものであった。
【0081】
〔実施例1〕
96穴マイクロプレートの各穴(以下、当該穴をウェルと称する)には1×104個のSFME細胞又はr/mHM-SFME-1細胞を播種した(各ウェルは50%コンフルエントであった)。SFME細胞及びr/mHM-SFME-1細胞それぞれについて4ウェルを1セットとし、2.5μM、5μM、10μM、20μMとなるようにグリチルレチン酸を添加して、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で24時間培養を行った。培養後、MTT試験により生存細胞数を測定した。
【0082】
MTT試験は、培養細胞の各ウェルにMTT溶液10μLを加え、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で4時間反応させ、生成したフォルマザン量をマイクロプレートリーダーを使用し570nmの吸光度にて測定した。
【0083】
各試験は6連行った。SFME細胞の試験結果のグラフを図1Aに示す。試験の結果、2.5〜10μMのグリチルレチン酸を添加したSFME細胞のウェルでは細胞数の減少が見られなかった。20μMのグリチルレチン酸を添加したSFME細胞のウェルでは平均48%の細胞が生存していた。
【0084】
一方、r/mHM-SFME-1細胞の試験結果のグラフを図1Bに示す。2.5μMのグリチルレチン酸を添加したr/mHM-SFME-1細胞のウェルでは細胞数の減少が見られなかったが、5〜20μMのグリチルレチン酸を添加したr/mHM-SFME-1細胞のウェルではそれぞれ平均40%、15%、5%の細胞がそれぞれ生存していた。よって、5μM以上のグリチルレチン酸を添加したウェルでは、強い中枢神経系のがんに対する毒性が確認された。
【0085】
図1A及び図1Bから明らかであるように、グリチルレチン酸の添加量5μM〜10μMにおいては正常細胞であるSFME細胞の数は減少せずにがん細胞であるr/mHM-SFME-1細胞の数のみが増殖抑制を示している。即ち、グリチルレチン酸は上記濃度範囲において中枢神経系のがんに対して選択毒性を示した。
【0086】
〔実施例2〕
直径60mmのシャーレに上記した基礎栄養培地を注ぎ、r/mHM-SFME-1細胞を播種して50%コンフルエントとした。グリチルレチン酸を10μMとなるように添加し、小型インキュベーターを用いて20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で細胞の培養を行いながら細胞の挙動を顕微鏡(CK30、オリンパス株式会社製)で96時間観察した。顕微鏡の拡大倍率は10倍とし、微速度顕微観察はdigital imaging system(DIGA XP22V、パナソニック株式会社製)を用いて行った。
【0087】
実施例2における微速度顕微観察の結果を図2Bに示す。グリチルレチン酸の添加直後からがん細胞特有の活発な細胞の増殖は停止し、自己細胞死(アポトーシス)に典型的な挙動である細胞の収縮とブレビングが観察された。R/mHM-SFME-1細胞は徐々に死んでいき、グリチルレチン酸の添加後96時間ではr/mHM-SFME-1細胞は死滅していた。また、r/mHM-SFME-1細胞は破裂することが観察され、以後、腫瘍細胞として再生することはなかった。
【0088】
〔実施例2に対する比較例〕
グリチルレチン酸を添加しなかった点を除いては、上記実施例2に記載した実験手順と同様に試験を行った。
【0089】
R/mHM-SFME-1細胞は活発に増殖し、試験開始後48時間でコンフルエント達した。実施例2に対する比較例における微速度顕微観察の結果を図2Aに示す。
【0090】
〔実施例3〕
96穴マイクロプレートの各ウェルには1×104個のSFME細胞又はr/mHM-SFME-1細胞を播種した(各ウェルは50%コンフルエントであった)。SFME細胞及びr/mHM-SFME-1細胞それぞれについて5ウェルを1セットとし、0μM(添加なし)、2.5μM、5μM、10μM、20μMとなるようにグリチルレチン酸を添加して、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で24時間培養を行った。培養後、MTT試験により生存細胞数を測定した。各試験は6連行った。試験の結果を図3Cに示す。
【0091】
〔実施例3に対する比較例〕
実施例3における0μM(添加なし)、2.5μM、5μM、10μM、20μMとなるようにグリチルレチン酸を添加すること代えて、0μM(添加なし)、0.1μM、1μM、10μM、100μMとなるようにアドリアマイシンの添加又は0μM(添加なし)、0.625μM、1.25μM、2.5μM、5μMとなるようにマヌマイシンAの添加を行った点以外は、実施例3に記載した実験手順と同様に試験を行った。
【0092】
アドリアマイシンを添加した試験の結果は図3Aに、マヌマイシンAを添加した試験の結果は図3Bに、それぞれ示す。
【0093】
図3A〜Cは棒グラフであり、グラフ中の各棒は生存細胞数の平均値を表し、各棒には標準偏差も示してある。生存細胞数はコントロール(0μM)との比較(%)で示してある。図3から明らかであるように、アドリアマイシンは正常細胞であるSFME細胞の増殖抑制を顕著に示した。マヌマイシンAは各濃度でわずかにではあるが、がん細胞であるr/mHM-SFME-1細胞の増殖抑制がSFME細胞の増殖抑制を上回った。グリチルレチン酸はr/mHM-SFME-1細胞の増殖抑制が顕著に大きかった。即ち、グリチルレチン酸は中枢神経系のがんに強い毒性を示し、かつ、副作用が少ないことが示された。
【0094】
〔実施例4〕
続いて、グリチルレチン酸について、SFME細胞及びr/mHM-SFME-1細胞における50%阻害濃度(以下、IC50と称する)を調べた。
【0095】
本実施例においてIC50とは、グリチルレチン酸を加えた試験とグリチルレチン酸を加えないコントロール試験とを比較して、50%の細胞増殖を抑制する濃度を意味する。即ち、上記グリチルレチン酸を加えた試験の生存細胞数は、コントロール試験の生存細胞数の半分であることを意味する。
【0096】
各細胞におけるグリチルレチン酸のIC50は以下の実験手順によって測定した。直径60mmのシャーレに上記した基礎栄養培地を注ぎ、SFME細胞又はr/mHM-SFME-1細胞を播種して50%コンフルエントとした。グリチルレチン酸を0〜50μMの濃度で添加し、小型インキュベーターを用いて20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で細胞の培養を行い、MTT試験により生存細胞数および細胞増殖率(%)を測定した。
【0097】
SFME細胞のIC50は19μMであった。一方、r/mHM-SFME-1細胞のIC50は4.8μMであった。
【0098】
〔実施例4に対する比較例〕
グリチルレチン酸をアドリアマイシン又はマヌマイシンAに変更した点以外は、実施例4に記載した実験手順と同様に試験を行った。
【0099】
SFME細胞のIC50はアドリアマイシンが0.8μM、マヌマイシンAが3.5μMであった。一方、r/mHM-SFME-1細胞のIC50はアドリアマイシンが24μM、マヌマイシンAが2.5μMであった。
【0100】
アドリアマイシンではSFME細胞のIC50が顕著に低く、アドリアマイシンは正常細胞に対して大きな毒性を示した。マヌマイシンAではr/mHM-SFME-1細胞のIC50がSFME細胞のIC50に比べて少々低かった。グリチルレチン酸ではr/mHM-SFME-1細胞のIC50がSFME細胞のIC50に比べて約1/4であった。これらの結果は、グリチルレチン酸は中枢神経系のがんに対し毒性が強く、かつ、副作用が少ないことを裏付けるものであった。
【0101】
〔実施例5〕
直径60mmのシャーレに上記した基礎栄養培地を注ぎ、r/mHM-SFME-1細胞を播種して50%コンフルエントとした。90%阻害濃度(以下、IC90と称する)である18μMとなるようにグリチルレチン酸を添加し、小型インキュベーターを用いて20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で細胞の培養を行いながら細胞の挙動を顕微鏡(CK30、オリンパス株式会社製)で観察した。顕微鏡の拡大倍率は10倍とし、微速度顕微観察はdigital imaging system(DIGA XP22V、パナソニック株式会社製)を用いて行った。
【0102】
一方、SFME細胞を用いた試験では、IC90である27μMとなるようにグリチルレチン酸を添加した点を除いては、上記の実験手順と同様に試験を行った。
【0103】
本実施例においてIC90とはグリチルレチン酸を加えた試験とグリチルレチン酸を加えないコントロール試験とを比較して、90%の細胞増殖を抑制する濃度を意味する。
【0104】
がん細胞であるr/mHM-SFME-1細胞の細胞死はグリチルレチン酸の添加後1時間以内で観察されたが、SFME細胞の試験ではグリチルレチン酸の添加後4時間を経過しなければ細胞死は観察されなかった。よって、グリチルレチン酸は正常細胞よりも先に中枢神経系のがん細胞に毒性を示した。これらの試験結果を図4Bに示す。
【0105】
がんの治療においては、早期腫瘍治療や末期がん治療に関わらず、副作用の心配が無ければ高濃度で抗腫瘍剤を投与することにより早い抗腫瘍効果の発揮を期待することができる。本実施例により、IC90値という高濃度のグリチルレチン酸の投与で、投与後1時間以内という短時間で選択毒性を確認できた。
【0106】
〔実施例5に対する比較例〕
グリチルレチン酸をマヌマイシンAに変更した点を除いては、上記の実施例5の実験手順と同様に試験を行った。なお、r/mHM-SFME-1細胞でのマヌマイシンAのIC90は5.5μMであり、SFME細胞でのマヌマイシンAのIC90は7.2μMであった。
【0107】
SFME細胞の試験ではマヌマイシンAの添加後2時間で細胞死が観察された。一方、r/mHM-SFME-1細胞の細胞死はマヌマイシンAの添加後8時間まで観察されなかった。よって、マヌマイシンAは中枢神経系のがん細胞よりも優先的に正常細胞に毒性を示した。これらの試験結果を図4Aに示す。
【産業上の利用可能性】
【0108】
本発明によって腫瘍に対し強い毒性を有し、かつ副作用が少ない新規抗腫瘍剤が提供される。更に詳しくは腫瘍に対して優れた選択毒性を有する抗腫瘍剤が提供される。本発明の抗腫瘍剤は、特に好ましくは抗中枢神経系腫瘍剤として用いられる。
【技術分野】
【0001】
本発明は、腫瘍に対し強い毒性を有し、かつ副作用が少ない新規抗腫瘍剤に関する。更に詳しくは本発明は、腫瘍に対して優れた選択毒性を有する抗腫瘍剤に関する。本発明の抗腫瘍剤は、特に好ましくは抗中枢神経系腫瘍剤として用いられる。
【0002】
本発明において腫瘍とは、良性腫瘍及び悪性腫瘍(がん)を含むものである。
【0003】
本発明における毒性とは、細胞の増殖を抑制することを言う。当該細胞の増殖の抑制は細胞分裂の抑制や細胞死等に起因するものである。
【0004】
本発明における選択毒性とは、腫瘍細胞に対してのみ強い毒性を示し、正常細胞には毒性を示さないことをいう。即ち、副作用が現れない、又は現れても軽微であり、かつ、一過的であることを意味する。
【背景技術】
【0005】
正常細胞が腫瘍化してしまうと、腫瘍を治療するために外科的な手術、放射線治療、抗腫瘍剤の投与等が行われる。
【0006】
また、抗腫瘍剤の創製のために、細胞レベルでの試験、マウスでの試験、臨床試験など、さまざまな試験が行われている。
【0007】
マヌマイシンA及びアドリアマイシンは従来の抗腫瘍剤に使用されている。
【0008】
マヌマイシンAは下記化1に示す化合物である。
【0009】
【化1】

アドリアマイシンは下記化2に示す化合物である。
【0010】
【化2】

【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Loo et al, 1989. Serum-free mouse embryo (SFME) cells : growthresponse in vitro. J. Cell. Physiol., 139: 484-491.
【非特許文献2】Sakai et al, 1990. Proc. Natl. Acad. Sci. USA, 87: 8378-8382.
【非特許文献3】D’ Alessandro et al, 1994. Growth Factors, 11: 53-69.
【0012】
上記非特許文献1〜3に記載されている通り、Serum-free mouse embryo cells(以下、SFME細胞と称する。)は中枢神経系の正常幹細胞として知られている。
【0013】
【非特許文献4】Nomura et al, 1993. Establishment of a metastatic murine cell linecarrying the human c-Ha-ras. In VitroCell. Dev. Biol,. 29A:614-616. 上記非特許文献4にはhuman c-Ha-ras and mouse c-myc co-transfected highly metastatic serum-freemouse embryo-1 cells(以下、r/mHM-SFME-1細胞と称する。)の確立についての記載がある。
【0014】
【非特許文献5】Akao, T. 1998. Distribution of enzymes involved in the metabolism ofglycyrrhizin in various organs of rat. Biol.Pharmaceu. Bull. 21:1036-1044. 上記非特許文献5には、グリチルリチンを経口投与すると、グリチルリチンはグリチルレチン酸に加水分解されることの記載がある。上記グリチルリチンとは、アグリコンとしてのグリチルレチン酸に糖が結合した配糖体である。
【発明の概要】
【発明が解決しようとする課題】
【0015】
従来の抗腫瘍剤の多くは腫瘍細胞よりも優先的に正常細胞に毒性を示し、これが抗腫瘍剤の副作用が大きいという問題を引き起こしていると考えられる。そこで、正常細胞よりも優先的に腫瘍細胞の増殖を抑制する有効成分を含有する抗腫瘍剤が望まれる。より効果的で、かつ、より安全な腫瘍の予防及び治療薬が望まれる中で、植物由来の化合物や抽出物等が新薬の創製に大きな役割を果たすことが期待される。グリチルリチンは甘草抽出物に含まれるサポニンで、甘味料として世界的に利用されている。当該グリチルリチンは経口投与すると、糖とグリチルレチン酸に加水分解される。当該グリチルレチン酸はウィルス感染、炎症、アナフィラキシーの治療剤等として利用されている。
【0016】
本願発明者は鋭意研究を重ねた結果、グリチルレチン酸が、腫瘍、特に中枢神経系腫瘍に対し強い毒性を有することを見出し、かつ、副作用を軽減することが可能であること、さらには優れた選択毒性を示すことをも発見した。本願発明は、これらの知見に基づいて完成させたものである。
【0017】
本発明は腫瘍に対し強い毒性を有し、かつ副作用が少ない新規抗腫瘍剤を提供すること、更に詳しくは本発明は、腫瘍に対して優れた選択毒性を有する抗腫瘍剤を提供することを解決すべき課題とする。本発明の抗腫瘍剤は、特に好ましくは抗中枢神経系腫瘍剤として用いられる。
【課題を解決するための手段】
【0018】
(第1発明)
上記課題を解決するための本願第1発明の構成は、グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有する抗腫瘍剤である。
【0019】
グリチルレチン酸の誘導体とは、限定はされないが、グリチルレチン酸の配糖体を少なくとも含む。誘導体として、例えば、グリチルリチン、グリチルレチン酸ステアリル等を含む。
【0020】
グリチルレチン酸及びグリチルレチン酸の誘導体の薬学的に許容される塩とは、限定はされないが、例えばナトリウム塩、カリウム塩、アンモニウム塩、コリン塩、有機アミン塩等を含む。
【0021】
(第2発明)
上記課題を解決するための本願第2発明の構成は、前記第1発明に係る抗腫瘍剤が抗中枢神経系腫瘍剤である、抗腫瘍剤である。
【0022】
中枢神経系腫瘍とは、中枢神経系に発生し又は中枢神経系に転移した腫瘍を言い、例えば脳腫瘍、脊髄腫瘍等が例示される。
【0023】
脳腫瘍とは、神経上皮性腫瘍、髄膜および関連組織由来性腫瘍、胚細胞性腫瘍等をいう。また、脊髄腫瘍とは、硬膜外腫瘍、硬膜内髄外腫瘍、髄内腫瘍等をいう。
【0024】
(第3発明)
上記課題を解決するための本願第3発明の構成は、前記抗腫瘍剤が、直接投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜20mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。
【0025】
上記の第3発明において、「グリチルレチン酸換算で」とは、有効成分がグリチルレチン酸の誘導体、グリチルレチン酸及びその誘導体の薬学的に許容される塩である場合は、上記の投与量はグリチルレチン酸としてのmg数に換算して計算されることを意味する。
【0026】
上記投与量の単位である「mg/kg」は、投与される患者の体重1kg当たりの投与量(mg)を意味する。
【0027】
上記直接投与法とは、抗腫瘍剤を患部に直接投与する方法であって、具体的にはカテーテルを使用する方法、脊髄注射による方法等を例示することができる。
【0028】
(第4発明)
上記課題を解決するための本願第4発明の構成は、前記抗腫瘍剤が、全身投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜2mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。
【0029】
上記の第4発明において、「グリチルレチン酸換算で」とは、第3発明における場合と同じ意味である。
【0030】
上記全身投与法とは、投与された抗腫瘍剤の有効成分が血液、リンパ液等を介して全身に行き渡る抗腫瘍剤の投与法をいう。具体的には、経口投与、経皮吸収、血管投与、皮下注射、腹腔内投与等を例示できる。
【発明の効果】
【0031】
(第1発明)
上記第1発明によって、腫瘍に対し強い毒性を有し、かつ、副作用が少ない、有効な抗腫瘍剤が提供される。
【0032】
(第2発明)
上記第2発明によって、有効な抗中枢神経系腫瘍剤としての抗腫瘍剤が提供される。対象疾患が中枢神経系腫瘍である場合、腫瘍に対し強い毒性を有し、かつ副作用が少ない、という効果はより顕著になる。また、正常細胞よりも優先的に腫瘍細胞の増殖を抑制するという効果が顕著になる。
【0033】
(第3発明及び第4発明)
上記第3発明及び第4発明によって、優れた選択毒性を有する抗腫瘍剤が、直接投与法又は全身投与法における有効な投与プロトコールを規定されたものとして提供される。
【0034】
特に上記第3発明により、優れた選択毒性を有し、かつ、より早く抗腫瘍活性が発揮される抗腫瘍剤が提供される。上記全身投与法、特に経口投与の場合は、WHO等のグリチルレチン酸の許容摂取量を考慮して前記有効成分の投与量を決めることが好ましいが、直接投与法では抗腫瘍剤が患部に直接投与されるので、より多量の前記有効成分を患部に投与できる。より多量の有効成分の投与は、より強い抗腫瘍活性に繋がる。また、抗腫瘍剤の患部への到達が早いので、より早く抗腫瘍活性が発揮される。また、摘出が難しい部位にできた腫瘍の治療が可能となるし、体力的な問題等で摘出手術が難しい患者の腫瘍の治療も可能となる。
【0035】
優れた選択毒性を有するということは、早期腫瘍治療や末期がん治療における強烈な吐き気や全身倦怠感、さらには頭髪の脱落などといった抗腫瘍剤にしばしばみられる副作用の回避を可能とし、より安全性が高く、また患者のQOL(クオリティー・オブ・ライフ)を高める治療が可能となる。
【図面の簡単な説明】
【0036】
【図1】実施例1の試験結果を示すグラフである。各濃度における点は平均値であり、各点には標準偏差も示してある。
【0037】
【図2】実施例2及び実施例2に対する比較例の微速度顕微観察の結果を示してある。各フレームの右下には試験開始後の経過時間(h)を示してある。
【0038】
【図3】実施例3、実施例3に対する比較例における試験の結果を示してある。グラフ中の各棒は生存細胞数の平均値を表し、各棒には標準偏差も示してある。生存細胞数はコントロール(0μM)との比較(%)で示している。
【0039】
【図4】実施例5及び実施例5に対する比較例の試験結果を示してある。各フレームの右下には試験開始後の経過時間(h)を示してある。
【発明を実施するための形態】
【0040】
次に、本発明を実施するための形態を、その最良の形態を含めて説明する。以下、「本発明」とは、上記第1発明〜第4発明を一括して称するものである。
【0041】
本願第1発明の構成は、グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有する抗腫瘍剤である。また、本願第2発明の構成は、前記第1発明に係る抗腫瘍剤が抗中枢神経系腫瘍剤である、抗腫瘍剤である。
【0042】
本発明の抗腫瘍剤は腫瘍細胞(即ち、腫瘍)に対して毒性を示し、殺腫瘍、腫瘍転移防止、腫瘍再発防止又は腫瘍予防等の目的で使用される。また、本発明の抗中枢神経系腫瘍剤は中枢神経系腫瘍に対して毒性を示し、殺中枢神経系腫瘍、中枢神経系腫瘍の転移防止、中枢神経系腫瘍再発防止又は中枢神経系腫瘍の予防等の目的で使用される。
【0043】
中枢神経系腫瘍とは、中枢神経系に発生し又は中枢神経系に転移した腫瘍を言い、例えば脳腫瘍、脊髄腫瘍等が例示される。即ち、抗中枢神経系腫瘍剤は抗脳腫瘍剤、抗脊髄腫瘍剤等を含む。
【0044】
脳腫瘍とは、神経上皮性腫瘍(神経膠芽腫瘍、星細胞腫瘍、乏突起神経膠腫瘍、髄芽腫瘍、上衣細胞腫瘍、脈絡叢乳頭腫瘍、神経細胞由来の腫瘍、松果体部腫瘍を含む)、髄膜および関連組織由来性腫瘍(髄腹腫瘍、黒色腫瘍を含む)、胚細胞性腫瘍(胚芽腫瘍、良性奇形腫瘍、悪性奇形腫瘍、胎児性腫瘍、絨毛上皮腫瘍、卵黄嚢腫瘍を含む)等をいうので、抗脳腫瘍剤は、抗神経上皮性腫瘍剤、抗髄膜および関連組織由来性腫瘍剤、抗胚細胞性腫瘍剤等を含む。
【0045】
また、脊髄腫瘍とは、硬膜外腫瘍、硬膜内髄外腫瘍、髄内腫瘍等をいうので、抗脊髄腫瘍剤は、抗硬膜外腫瘍剤、抗硬膜内髄外腫瘍剤、抗髄内腫瘍剤等を含む。
【0046】
〔SFME細胞及びr/mHM-SFME-1細胞〕
Balb/c系統マウスは、動物実験において一般的に使用されてきたマウスである。後述の実施例で本発明の効果の実証のために用いるSFME細胞は、受精後16日のBalb/c系統マウス胚から作出された中枢神経系の正常幹細胞である。当該SFME細胞は上記の通りin vivoにおいて正常細胞、即ち腫瘍化していない細胞である。
【0047】
また、r/mHM-SFME-1細胞は、SFME細胞にヒトがん由来活性型c-Ha-ras1遺伝子(細胞をがん化させる遺伝子。以下、ras遺伝子と称する。)及びマウスc-myc遺伝子(前記ras遺伝子の効力を強める遺伝子)を導入したものであり、肺への高転移能を持つがん細胞である。SFME細胞とr/mHM-SFME-1細胞の相違点は、r/mHM-SFME-1細胞ががん化している点である。
【0048】
正常細胞から良性腫瘍となり、最終的に悪性腫瘍、即ちがんとなるのが腫瘍の進行である。腫瘍の種類により良性腫瘍からがんへの移行の速度に差があるが、良性腫瘍も悪性腫瘍も、もとは正常細胞であったものである。ゆえに、腫瘍の研究を進めるにあたっては、由来が同じである細胞を用いることが好ましい。SFME細胞及びr/mHM-SFME-1細胞は由来が同じであることから、各細胞を用いた試験の結果を比較することは腫瘍、特に中枢神経系腫瘍の発生、治療、予防及び再発防止等を研究するのに好ましいということができる。即ち、抗腫瘍剤、抗中枢神経系腫瘍剤の創製に有用である。中枢神経系腫瘍とは脳腫瘍、脊髄腫瘍等を含むので、上記試験は脳腫瘍、脊髄腫瘍等の発生、治療、予防及び再発防止等を研究するのにも好ましい。
【0049】
〔グリチルレチン酸〕
本発明に用いるグリチルレチン酸は、下記化3に示す化合物である。
【0050】
【化3】

グリチルレチン酸は市販されており、容易に入手することができる。また、甘草にはグリチルリチンが含まれており、当該グリチルリチンを加水分解することによってもグリチルレチン酸を入手することができる。
【0051】
〔グリチルレチン酸の誘導体、塩〕
本発明の抗腫瘍剤の有効成分としては、グリチルレチン酸の各種誘導体も使用できる。グリチルレチン酸の誘導体には、グリチルレチン酸をアグリコンとする配糖体、特にグリチルリチンが少なくとも含まれる。グリチルリチンは経口投与によってグリチルレチン酸に加水分解されるので、グリチルレチン酸と同等の作用・効果を期待できる。グリチルレチン酸の誘導体としては、グリチルリチン、グリチルレチン酸ステアリル等を例示することができる。更に、本発明の抗腫瘍剤の有効成分としては、グリチルレチン酸及びその誘導体の薬学的に許容される塩も使用できる。例えばナトリウム塩、カリウム塩、アンモニウム塩、コリン塩、有機アミン塩等を使用できる。例えば、有効成分がグリチルレチン酸の塩である場合は、液体等の担体に溶けることでグリチルレチン酸としての作用・効果が期待できることはいうまでもない。
【0052】
上記誘導体や塩は、グリチルレチン酸から縮合反応等の常法により得ることができる。
【0053】
〔抗腫瘍剤及び抗中枢神経系腫瘍剤〕
本発明の有効成分とは、グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上をいう。当該有効成分は実質的にグリチルレチン酸として作用し、腫瘍に対し強い毒性を有し、かつ副作用が少ないという効果を示す。また、投与量、投与形式等によっては優れた選択毒性を示す。
【0054】
上記有効成分は、腫瘍に対する毒性を有するので、腫瘍を治療・予防・再発防止する種々の用途に用いることができる。更に、当該有効成分は中枢神経系腫瘍を治療・予防・再発防止する種々の用途に用いることが好ましい。上記有効成分を含有することで、新規抗腫瘍剤、抗中枢神経系腫瘍剤とすることができる。更に、抗脳腫瘍剤、抗脊髄腫瘍剤等とすることができる。
【0055】
本発明の投与対象は特に限定されないが、哺乳類が好ましく、ヒトが特に好ましい。
【0056】
本発明の対象疾患となる腫瘍は特に限定されないが、例えば、中枢神経系腫瘍、悪性黒色腫瘍、悪性リンパ腫瘍、咽頭腫瘍、喉頭腫瘍、胃腫瘍、カポジ肉腫、肝臓腫瘍、筋肉腫瘍、結腸腫瘍、血管腫瘍、骨髄腫瘍、甲状腺腫瘍、睾丸腫瘍、膵臓腫瘍、消化器腫瘍、食道腫瘍、大腸腫瘍、上顎腫瘍、舌腫瘍、口唇腫瘍、口腔腫瘍、胆嚢腫瘍、胆管腫瘍、胆道腫瘍、直腸腫瘍、乳腫瘍、尿管腫瘍、肉腫、骨肉腫瘍、白血病、肺腫瘍、神経芽腫瘍、真性多血症、膀胱腫瘍、卵巣腫瘍、子宮腫瘍、前立腺腫瘍、皮膚腫瘍、基底細胞腫瘍、皮膚付属器腫瘍、皮膚転移腫瘍および皮膚黒色腫などの各種良性及び悪性腫瘍を例示することができる。これらの中でも中枢神経系腫瘍を好ましく例示できる。
【0057】
本発明の抗腫瘍剤の剤形は特に限定されない。本願第3発明においては、液剤、注射剤を好ましく例示できる。前記有効成分を医薬として使用する場合、通常、適当な添加剤と混和し、製剤化したものを使用する。ただし、前記有効成分を原体のまま医薬として使用することを否定するものではない。
【0058】
前記有効成分は常法で薬学的に許容される液体、固体等の公知の各種担体と混合し、また必要に応じて安定化剤、着色剤、矯味剤、矯臭剤、賦形剤、溶剤、界面活性剤、乳化剤、懸濁化剤、分散剤、保存剤、溶解補助剤、等張化剤、緩衝剤、無痛化剤、保湿剤、結合剤、被覆剤、潤沢剤、崩壊剤、などを加え、液剤、経口投与剤、錠剤、粉剤、坐剤、外用剤、軟膏、貼布剤、点眼剤、注射剤、散剤、顆粒剤、糖衣剤、カプセル剤、ピル、懸濁剤、アンプル、注射液、などあらゆる医薬品としての製剤が可能である。
【0059】
本発明に用いる前記有効成分は、既知の抗腫瘍剤と併用することにより抗腫瘍効果を高めることも可能である。上記既知の抗腫瘍剤とは、例えば、フルオロウラシル、シタラビン、シスプラチン、アドリアマイシン、マヌマイシン等を例示できる。その際には、本発明の効果を損ねない程度に併用剤との量比を適宜調整することが好ましい。
【0060】
本願第1発明及び第2発明の抗腫瘍剤の投与形式は特に限定されない。経口投与、経皮吸収、血管投与、皮下注射、腹腔内投与等の全身投与法や、カテーテルを使用する方法、脊髄注射による方法等の直接投与法といった既知の様々な形式の投与が可能である。
【0061】
本願第1発明及び第2発明の抗腫瘍剤に含まれる上記有効成分の投与量は、症状、年齢、性別、体重、剤形あるいは投与形式により異なるが、週1日以上、投与日1日当たりグリチルレチン酸換算で0.002〜200mg/kgが好ましい。投与回数は1回または数回に分けて投与することができる。投与計画としては、連日投与、間欠投与又はこれらの組み合わせがある。これらの投与においては医師の判断によることが必要である。
【0062】
上記直接投与法によれば、患部に直接抗腫瘍剤が投与されるので、より早く抗腫瘍活性が発揮される。また、摘出が難しい部位にできた腫瘍の治療が可能となる。また、体力的な問題等で摘出手術が難しい患者の腫瘍の治療が可能となる。
【0063】
対象疾患が中枢神経系腫瘍である場合は、正常細胞よりも優先的に腫瘍細胞の増殖を抑制するという効果が顕著になる。前記直接投与法を採用すれば、中枢神経系腫瘍に対する当該効果はより顕著になる。
【0064】
本発明の抗腫瘍剤、抗中枢神経系腫瘍剤が、腫瘍、特に中枢神経系腫瘍に対して強い毒性を有し、かつ、副作用が少ないことのメカニズムは必ずしも明らかではない。しかし、本願発明者は本発明の研究を通して、本発明が、腫瘍細胞内、特に中枢神経系腫瘍の腫瘍細胞内においてH-Ras遺伝子のダウンレギュレーション、活性酸素量の上昇、グルタチオン量の低下、細胞骨格蛋白質破壊というさまざまな現象を引き起こすことを通じて腫瘍細胞に対し強い毒性を有し、かつ、上記の現象が正常細胞内においては起こりにくいので副作用が少ない、と推測している。
【0065】
また、本願発明者は、従来の抗腫瘍剤に使用されるマヌマイシンAは中枢神経系腫瘍のがん細胞よりも優先的に正常細胞に毒性を示すのに対し、グリチルレチン酸は正常細胞よりも優先的に中枢神経系腫瘍のがん細胞に毒性を示すことを見出した。グリチルレチン酸のこのような性質も腫瘍、特に中枢神経系腫瘍に対し強い毒性を有し、かつ、副作用が少ないという効果に寄与していると考えられる。
【0066】
〔選択毒性〕
上記本願第3発明の構成は、前記抗腫瘍剤が、直接投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜20mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。また、上記本願第4発明の構成は、前記抗腫瘍剤が、全身投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜2mg/kg投与される、前記第1発明又は第2発明に記載の抗腫瘍剤である。
【0067】
本願発明者は鋭意検討を行った結果、抗腫瘍剤に含まれる上記有効成分を特定の投与量の範囲内で投与することにより、腫瘍、特に中枢神経系腫瘍に対して優れた選択毒性が得られることを見出した。
【0068】
優れた選択毒性が得られる上記有効成分の投与量は、症状、年齢、性別、体重、剤形あるいは投与形式により異なるが、抗腫瘍剤が上記全身投与法によって投与される場合は、週1日以上、投与日1日当たりグリチルレチン酸換算で0.002〜2mg/kgであり、より好ましくは0.002〜0.2mg/kgであり、更に好ましくは0.05〜0.2mg/kgである。
【0069】
また、抗腫瘍剤が前記直接投与法によって投与される場合は、週1日以上、投与日1日当たりグリチルレチン酸換算で0.002〜20mg/kgであり、より好ましくは0.02〜20mg/kgであり、更に好ましくは0.2〜20mg/kgである。
【0070】
投与回数は1回または数回に分けて投与することができる。投与計画としては、連日投与、間欠投与又はこれらの組み合わせがある。これらの投与においては医師の判断によることが必要である。
【0071】
上記優れた選択毒性が発揮されるメカニズムは必ずしも明らかではないが、グリチルレチン酸が、正常細胞よりも腫瘍細胞に優先的な毒性を示し、かつ、適切にグリチルレチン酸投与量を調節していることによって選択毒性が発揮されていると本願発明者は推測している。
【0072】
〔MTT試験〕
MTT〔3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2Htetrazolium bromide〕は分子式C18H16BrN5Sで示されるテトラゾリウム塩の1種である。MTTは細胞内に取り込まれると細胞内のミトコンドリア中にある脱水素酵素によってフォルマザンに変化し、青色を呈する。しかし、細胞が死んでいる場合はこのような反応は起こらない。よって、この色の変化の度合いを利用することで、細胞の生死を判断することができる。即ち、薬剤が正常細胞や腫瘍細胞に与える毒性の評価を行うことができる。
【実施例】
【0073】
以下に本発明の実施例と比較例を説明するが、本発明の技術的範囲は、これらによって限定されない。
【0074】
〔試薬〕
グリチルレチン酸及びマヌマイシンAは和光純薬工業株式会社製のものを使用した。アドリアマイシンは協和発酵工業株式会社製のものを使用した。
【0075】
〔細胞の系統及び継代〕
SFME細胞は九州大学白畑實隆先生から分譲して頂いた。当該SFME細胞は受精後16日のBalb/c系統マウス胚から作出された中枢神経系の正常幹細胞である。当該SFME細胞は上記の通り正常細胞、即ち腫瘍化していない細胞である。
【0076】
R/mHM-SFME-1細胞は、SFME細胞にras遺伝子及びマウスc-myc遺伝子を導入したものであり、肺への高転移能を持つがん細胞である。本実施例におけるSFME細胞との違いは、r/mHM-SFME-1細胞が、がん化している点である。R/mHM-SFME-1細胞は、SFME細胞にras遺伝子およびマウスc-myc遺伝子を導入して得られた細胞種でBalb/c系統マウスに腫瘍原性を示す。SFME細胞又はr/mHM-SFME-1細胞をそれぞれリン酸緩衝生理食塩水に浮遊させ、6週齢のBalb/cマウスに移植すると、SFME細胞は正常細胞であるため腫瘍塊を示さないのに対し、r/mHM-SFME-1細胞は移植部位に腫瘍塊を示し、また肺には目視できるほどの明らかな転移腫瘍塊が観察される。さらに肺の腫瘍塊にはr/mHM-SFME-1細胞由来のras遺伝子が検出されることから、r/mHM-SFME-1細胞が腫瘍形成能や肺への高い転移能を保持していることが明らかとなっている。
【0077】
本実施例で使用する基礎栄養培地は、Dulbecco’s modified Eagle’s培地とnutrient mixture F-12 Ham培地を体積比1:1で混合したDME/F-12培地に1.2g/Lの炭酸水素ナトリウム、10nMの亜セレン酸ナトリウム、10μg/mLの硫酸ゲンタマイシンをそれぞれ添加して調製した。本基礎栄養培地は以下の実施例群及びそれらに対する比較例群において適宜使用した。
【0078】
ウシフィブロネクチン(Biomedical Technologies社製)で予備コーティングした直径60mmのシャーレに、10μg/mLのインスリン、25μg/mLのトランスフェリン、50ng/mLのepidermal growth factor(以下、EGFと称する)をそれぞれ添加したDME/F-12培地を入れ、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下でSFME細胞を継代した。
【0079】
R/mHM-SFME-1細胞は、EGFを添加しなかった点を除いて、上記SFME細胞の継代と同様の方法で継代した。
【0080】
上記継代したSFME細胞及びr/mHM-SFME-1細胞は、それぞれの第1世代と同一の特徴を有するものであった。
【0081】
〔実施例1〕
96穴マイクロプレートの各穴(以下、当該穴をウェルと称する)には1×104個のSFME細胞又はr/mHM-SFME-1細胞を播種した(各ウェルは50%コンフルエントであった)。SFME細胞及びr/mHM-SFME-1細胞それぞれについて4ウェルを1セットとし、2.5μM、5μM、10μM、20μMとなるようにグリチルレチン酸を添加して、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で24時間培養を行った。培養後、MTT試験により生存細胞数を測定した。
【0082】
MTT試験は、培養細胞の各ウェルにMTT溶液10μLを加え、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で4時間反応させ、生成したフォルマザン量をマイクロプレートリーダーを使用し570nmの吸光度にて測定した。
【0083】
各試験は6連行った。SFME細胞の試験結果のグラフを図1Aに示す。試験の結果、2.5〜10μMのグリチルレチン酸を添加したSFME細胞のウェルでは細胞数の減少が見られなかった。20μMのグリチルレチン酸を添加したSFME細胞のウェルでは平均48%の細胞が生存していた。
【0084】
一方、r/mHM-SFME-1細胞の試験結果のグラフを図1Bに示す。2.5μMのグリチルレチン酸を添加したr/mHM-SFME-1細胞のウェルでは細胞数の減少が見られなかったが、5〜20μMのグリチルレチン酸を添加したr/mHM-SFME-1細胞のウェルではそれぞれ平均40%、15%、5%の細胞がそれぞれ生存していた。よって、5μM以上のグリチルレチン酸を添加したウェルでは、強い中枢神経系のがんに対する毒性が確認された。
【0085】
図1A及び図1Bから明らかであるように、グリチルレチン酸の添加量5μM〜10μMにおいては正常細胞であるSFME細胞の数は減少せずにがん細胞であるr/mHM-SFME-1細胞の数のみが増殖抑制を示している。即ち、グリチルレチン酸は上記濃度範囲において中枢神経系のがんに対して選択毒性を示した。
【0086】
〔実施例2〕
直径60mmのシャーレに上記した基礎栄養培地を注ぎ、r/mHM-SFME-1細胞を播種して50%コンフルエントとした。グリチルレチン酸を10μMとなるように添加し、小型インキュベーターを用いて20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で細胞の培養を行いながら細胞の挙動を顕微鏡(CK30、オリンパス株式会社製)で96時間観察した。顕微鏡の拡大倍率は10倍とし、微速度顕微観察はdigital imaging system(DIGA XP22V、パナソニック株式会社製)を用いて行った。
【0087】
実施例2における微速度顕微観察の結果を図2Bに示す。グリチルレチン酸の添加直後からがん細胞特有の活発な細胞の増殖は停止し、自己細胞死(アポトーシス)に典型的な挙動である細胞の収縮とブレビングが観察された。R/mHM-SFME-1細胞は徐々に死んでいき、グリチルレチン酸の添加後96時間ではr/mHM-SFME-1細胞は死滅していた。また、r/mHM-SFME-1細胞は破裂することが観察され、以後、腫瘍細胞として再生することはなかった。
【0088】
〔実施例2に対する比較例〕
グリチルレチン酸を添加しなかった点を除いては、上記実施例2に記載した実験手順と同様に試験を行った。
【0089】
R/mHM-SFME-1細胞は活発に増殖し、試験開始後48時間でコンフルエント達した。実施例2に対する比較例における微速度顕微観察の結果を図2Aに示す。
【0090】
〔実施例3〕
96穴マイクロプレートの各ウェルには1×104個のSFME細胞又はr/mHM-SFME-1細胞を播種した(各ウェルは50%コンフルエントであった)。SFME細胞及びr/mHM-SFME-1細胞それぞれについて5ウェルを1セットとし、0μM(添加なし)、2.5μM、5μM、10μM、20μMとなるようにグリチルレチン酸を添加して、20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で24時間培養を行った。培養後、MTT試験により生存細胞数を測定した。各試験は6連行った。試験の結果を図3Cに示す。
【0091】
〔実施例3に対する比較例〕
実施例3における0μM(添加なし)、2.5μM、5μM、10μM、20μMとなるようにグリチルレチン酸を添加すること代えて、0μM(添加なし)、0.1μM、1μM、10μM、100μMとなるようにアドリアマイシンの添加又は0μM(添加なし)、0.625μM、1.25μM、2.5μM、5μMとなるようにマヌマイシンAの添加を行った点以外は、実施例3に記載した実験手順と同様に試験を行った。
【0092】
アドリアマイシンを添加した試験の結果は図3Aに、マヌマイシンAを添加した試験の結果は図3Bに、それぞれ示す。
【0093】
図3A〜Cは棒グラフであり、グラフ中の各棒は生存細胞数の平均値を表し、各棒には標準偏差も示してある。生存細胞数はコントロール(0μM)との比較(%)で示してある。図3から明らかであるように、アドリアマイシンは正常細胞であるSFME細胞の増殖抑制を顕著に示した。マヌマイシンAは各濃度でわずかにではあるが、がん細胞であるr/mHM-SFME-1細胞の増殖抑制がSFME細胞の増殖抑制を上回った。グリチルレチン酸はr/mHM-SFME-1細胞の増殖抑制が顕著に大きかった。即ち、グリチルレチン酸は中枢神経系のがんに強い毒性を示し、かつ、副作用が少ないことが示された。
【0094】
〔実施例4〕
続いて、グリチルレチン酸について、SFME細胞及びr/mHM-SFME-1細胞における50%阻害濃度(以下、IC50と称する)を調べた。
【0095】
本実施例においてIC50とは、グリチルレチン酸を加えた試験とグリチルレチン酸を加えないコントロール試験とを比較して、50%の細胞増殖を抑制する濃度を意味する。即ち、上記グリチルレチン酸を加えた試験の生存細胞数は、コントロール試験の生存細胞数の半分であることを意味する。
【0096】
各細胞におけるグリチルレチン酸のIC50は以下の実験手順によって測定した。直径60mmのシャーレに上記した基礎栄養培地を注ぎ、SFME細胞又はr/mHM-SFME-1細胞を播種して50%コンフルエントとした。グリチルレチン酸を0〜50μMの濃度で添加し、小型インキュベーターを用いて20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で細胞の培養を行い、MTT試験により生存細胞数および細胞増殖率(%)を測定した。
【0097】
SFME細胞のIC50は19μMであった。一方、r/mHM-SFME-1細胞のIC50は4.8μMであった。
【0098】
〔実施例4に対する比較例〕
グリチルレチン酸をアドリアマイシン又はマヌマイシンAに変更した点以外は、実施例4に記載した実験手順と同様に試験を行った。
【0099】
SFME細胞のIC50はアドリアマイシンが0.8μM、マヌマイシンAが3.5μMであった。一方、r/mHM-SFME-1細胞のIC50はアドリアマイシンが24μM、マヌマイシンAが2.5μMであった。
【0100】
アドリアマイシンではSFME細胞のIC50が顕著に低く、アドリアマイシンは正常細胞に対して大きな毒性を示した。マヌマイシンAではr/mHM-SFME-1細胞のIC50がSFME細胞のIC50に比べて少々低かった。グリチルレチン酸ではr/mHM-SFME-1細胞のIC50がSFME細胞のIC50に比べて約1/4であった。これらの結果は、グリチルレチン酸は中枢神経系のがんに対し毒性が強く、かつ、副作用が少ないことを裏付けるものであった。
【0101】
〔実施例5〕
直径60mmのシャーレに上記した基礎栄養培地を注ぎ、r/mHM-SFME-1細胞を播種して50%コンフルエントとした。90%阻害濃度(以下、IC90と称する)である18μMとなるようにグリチルレチン酸を添加し、小型インキュベーターを用いて20%(v/v)酸素、5%(v/v)二酸化炭素、37℃の湿った空気下で細胞の培養を行いながら細胞の挙動を顕微鏡(CK30、オリンパス株式会社製)で観察した。顕微鏡の拡大倍率は10倍とし、微速度顕微観察はdigital imaging system(DIGA XP22V、パナソニック株式会社製)を用いて行った。
【0102】
一方、SFME細胞を用いた試験では、IC90である27μMとなるようにグリチルレチン酸を添加した点を除いては、上記の実験手順と同様に試験を行った。
【0103】
本実施例においてIC90とはグリチルレチン酸を加えた試験とグリチルレチン酸を加えないコントロール試験とを比較して、90%の細胞増殖を抑制する濃度を意味する。
【0104】
がん細胞であるr/mHM-SFME-1細胞の細胞死はグリチルレチン酸の添加後1時間以内で観察されたが、SFME細胞の試験ではグリチルレチン酸の添加後4時間を経過しなければ細胞死は観察されなかった。よって、グリチルレチン酸は正常細胞よりも先に中枢神経系のがん細胞に毒性を示した。これらの試験結果を図4Bに示す。
【0105】
がんの治療においては、早期腫瘍治療や末期がん治療に関わらず、副作用の心配が無ければ高濃度で抗腫瘍剤を投与することにより早い抗腫瘍効果の発揮を期待することができる。本実施例により、IC90値という高濃度のグリチルレチン酸の投与で、投与後1時間以内という短時間で選択毒性を確認できた。
【0106】
〔実施例5に対する比較例〕
グリチルレチン酸をマヌマイシンAに変更した点を除いては、上記の実施例5の実験手順と同様に試験を行った。なお、r/mHM-SFME-1細胞でのマヌマイシンAのIC90は5.5μMであり、SFME細胞でのマヌマイシンAのIC90は7.2μMであった。
【0107】
SFME細胞の試験ではマヌマイシンAの添加後2時間で細胞死が観察された。一方、r/mHM-SFME-1細胞の細胞死はマヌマイシンAの添加後8時間まで観察されなかった。よって、マヌマイシンAは中枢神経系のがん細胞よりも優先的に正常細胞に毒性を示した。これらの試験結果を図4Aに示す。
【産業上の利用可能性】
【0108】
本発明によって腫瘍に対し強い毒性を有し、かつ副作用が少ない新規抗腫瘍剤が提供される。更に詳しくは腫瘍に対して優れた選択毒性を有する抗腫瘍剤が提供される。本発明の抗腫瘍剤は、特に好ましくは抗中枢神経系腫瘍剤として用いられる。
【特許請求の範囲】
【請求項1】
グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有することを特徴とする抗腫瘍剤。
【請求項2】
前記抗腫瘍剤が抗中枢神経系腫瘍剤であることを特徴とする請求項1に記載の抗腫瘍剤。
【請求項3】
前記抗腫瘍剤が、直接投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜20mg/kg投与されることを特徴とする、請求項1又は請求項2に記載の抗腫瘍剤。
【請求項4】
前記抗腫瘍剤が、全身投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜2mg/kg投与されることを特徴とする、請求項1又は請求項2に記載の抗腫瘍剤。
【請求項1】
グリチルレチン酸、グリチルレチン酸の誘導体及びそれらの薬学的に許容される塩から選ばれる1種以上を有効成分として含有することを特徴とする抗腫瘍剤。
【請求項2】
前記抗腫瘍剤が抗中枢神経系腫瘍剤であることを特徴とする請求項1に記載の抗腫瘍剤。
【請求項3】
前記抗腫瘍剤が、直接投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜20mg/kg投与されることを特徴とする、請求項1又は請求項2に記載の抗腫瘍剤。
【請求項4】
前記抗腫瘍剤が、全身投与法によって、週1日以上、投与日1日当たり有効成分量としてグリチルレチン酸換算で0.002〜2mg/kg投与されることを特徴とする、請求項1又は請求項2に記載の抗腫瘍剤。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−46617(P2011−46617A)
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2009−194114(P2009−194114)
【出願日】平成21年8月25日(2009.8.25)
【出願人】(599002043)学校法人 名城大学 (142)
【Fターム(参考)】
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成21年8月25日(2009.8.25)
【出願人】(599002043)学校法人 名城大学 (142)
【Fターム(参考)】
[ Back to top ]

