抗腫瘍効果を有するmiR−7発現プラスミド
【課題】EGFR依存的に生存する腫瘍細胞に対し、EGFRの抑制を蛋白レベルではなく、mRNAレベルで抑制する方法を提供する。
【解決手段】ヒトDNA配列内に存在する、特定な配列からなる、20〜220塩基長のオリゴ(又はポリ)ヌクレオチドであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含miR-7発現プラスミド。
【解決手段】ヒトDNA配列内に存在する、特定な配列からなる、20〜220塩基長のオリゴ(又はポリ)ヌクレオチドであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含miR-7発現プラスミド。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、miR-7を効果的に細胞内に導入しうるプラスミドに関する。より詳しくは、生体に導入効率がよく、毒性の低いmiR-7発現プラスミドに関する。
【背景技術】
【0002】
上皮成長因子受容体(Epidermal Growth Factor Receptor; EGFR)が、上皮系腫瘍においてその増殖及び生存維持に重要な役割を果たしていることは既知のことである。そのEGFRを標的とした分子標的薬には、EGFRのチロシンキナーゼを選択的に阻害する、エルロチニブ(erlotinib)、ゲフィチニブ(gefitinib)などがある。EGFRに特有の変異、例えばエクソン19にコードされるアミノ酸が一部欠失したもの(delE746-A750)、エクソン21にコードされる858番目のアミノ酸であるロイシンがアルギニンに置換されたもの(L858R)、エクソン20にコードされる719番目のグリシンがセリン、アラニン、又はシステインへ置換されたもの(G719X)などが存在する肺癌患者に対して、これらの薬剤が臨床的に著効例を示すといわれている。かかる変異は、非喫煙者アジア人女性の肺腺癌患者において、ほぼ半数に認められる変異であることが徐々に明らかになっている(非特許文献1)。逆に、本願発明者らが開発したトランスジェニックマウスモデルにおいて、肺に前記の特有の変異が存在するEGFR(mutation EGFR)を強発現させると、臨床で見られるような肺腺癌が生じることが証明された。そのようなマウスモデルは、ヒトと同様にゲフィチニブ又はエルロチニブを投与すると腫瘍が劇的に縮小することが報告されている(非特許文献2)。したがって、現在市販されているエルロチニブやゲフィチニブは、主としてEGFRリン酸化活性部位を特異的に阻害することにより、EGFR依存的に生存する腫瘍細胞に細胞死をもたらし、臨床的に劇的な効果をあげていると考えられる。
【0003】
分子標的薬は、EGFRのリン酸化部位を効率的に阻害することで抗腫瘍活性をもたらしているが、主にEGFRの二次的変異(T790M in EGFR exon20)により、約半年から1年ほどでほぼ確実に分子標的薬に対して耐性となってしまい、患者は癌死から免れる事が出来ない。そこで、その耐性化過程を再現するため。本発明者らはゲフィチニブを、本来著効する変異(delE746-A750 in EGFR exon 19)を有するヒト肺腺癌細胞株(PC-9)に対し、長期低用量持続投与することにより、臨床で発生する耐性と同様な細胞株(RPC-9)を得、臨床にみられる前述の二次的変異を同様に獲得した。このことにより、従来技術であるEGFRリン酸化部位の抑制では、その分子標的薬の暴露下においても耐性化が生じるということが臨床的に観察され、さらにはin vitroでも証明された(非特許文献3)。
【0004】
生物の遺伝子情報が解明されるにつれ、蛋白質をコードしていない非コードのDNAの割合が、高等生物ほど非常に多いことが判明されている。また、ヒトでは全ゲノムの2/3からRNAが転写されると推定されていることから、生物種の複雑さに応じて非コードRNAの種類と量が増加すると推定され、非コードのRNAであるmicro RNAが発見された。micro RNAは、18〜22塩基の非コードRNAの総称で、ヒトの遺伝子の約1/3がmicro RNAで制御されていると考えられている。micro RNAのプロセシングについては既に各種報告がなされている。このmicro RNAは真核生物で発現し、高度に保存されており、ヒトでは約1000種類あるものと推定されている。micro RNAに関し、低分子核酸の検出方法が特許文献1に開示されている。
【0005】
micro RNAは、遺伝子発現の制御において重要な役割を担っている。micro RNAは、核内ではPri-micro RNAとしてDNAから転写され、ヘアピン二本鎖RNA(dsRNA)前駆体となる。dsRNAは細胞質内に移行し、Dicerの作用により成熟したmicro RNAが生成される。生成したmicro RNAはRISC(RNA-induced silencing complex)複合体に取込まれ、遺伝子機能制御に関与する。micro RNAは、例えばRNA干渉(RNAi)とよく似た作用を有するが、その作用は不明な点が多い。例えばRNAiは標的RNAを切断することにより翻訳を抑制するが、micro RNAの多くは標的RNAを切断せずに翻訳抑制すると考えられている。また、micro RNAは、発生、分化、細胞周期や癌疾患などに関与している可能性が報告され、例えば肺癌、結腸癌、胸部癌、前立腺癌、膀胱癌や膵臓癌患者の腫瘍組織では特定のmicro RNAからそれぞれの腫瘍タイプと正常サンプルとを識別できることが明らかとなっている(特許文献2)。
【0006】
前述のEGFRを標的とした分子標的薬、即ちチロシンキナーゼ阻害薬に対する臨床的、理論的に証明されている耐性機序では、耐性細胞におけるEGFR依存性は持続していることがイムノブロッティング法により予測されている。したがって、分子標的療法で耐性化した肺癌を代表とする腫瘍において、EGFRを別の手段で抑制することで、その耐性化に関わらず腫瘍抑制効果をもたらしうることが予測される。micro RNA-7(以下、「miR-7」という。)が脳腫瘍細胞中のEGFRを阻害し、Aktパスウェイを抑制すること(非特許文献4)や、miR-7がp21-activated kinase 1 (Pak1)を阻害することが報告されている(非特許文献5)。非特許文献4では、miR-7を発現するプラスミドについて言及している。また、miR-7が肺癌、乳癌、脳腫瘍由来の細胞株に発現しているEGFRを標的とし、抑制作用を示すことが報告されている(非特許文献6)。しかしながら、これらの文献には肺癌のin vivo(生体)のレベルで有効であるという記載は全くない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特表2006−510372号公報
【特許文献2】特表2008−511678号公報
【非特許文献】
【0008】
【非特許文献1】Cancer Sci 98: 1817-1824, 2007
【非特許文献2】Cancer Sci 99: 1747-1753, 2008
【非特許文献3】Cancer Res 67: 7807-7814, 2007
【非特許文献4】Cancer Res 68: 3566-3572, 2008
【非特許文献5】Cancer Res 68: 8195-8200, 2008
【非特許文献6】J. Biol. Chem. 284: 5731-5741, 2009
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、EGFR依存的に生存する腫瘍細胞に対し、EGFRの抑制を蛋白レベルではなくその鋳型となるmRNAレベルで行なう方法を提供することを課題とする。即ち、mRNAレベルで抑制するために有効なmiR-7を、効果的に細胞内に導入しうるプラスミドを提供することを課題とする。より詳しくは、生体に導入効率がよく、毒性の低いmiR-7発現プラスミドを提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、上記課題を解決するためにEGFRを効率的に抑制するmiR-7を発現するのに有効なDNA配列を検索したところ、ヒトDNA配列内に存在する、配列表の配列番号1に示す塩基配列を見出し、当該塩基配列より選択される特定の配列をプラスミドベクターに導入することで、miR-7を効果的に細胞内に導入しうるプラスミドの作製に成功し、本発明を完成した。
【0011】
すなわち本発明は、以下よりなる。
1.配列表の配列番号1に示す塩基配列から選択される20〜220塩基長のオリゴ(又はポリ)ヌクレオチドであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むことを特徴とする、miR-7発現プラスミド。
2.miR-7をコードするDNAが、以下に示すいずれかの塩基配列からなる前項1に記載のmiR-7発現プラスミド:
1)TGGAAGACTAGTGATTTTGTTGT(配列番号2);
2)上記配列番号2に示す塩基配列のうち、1〜3個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
3.miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる前項1又は2に記載のmiR-7発現プラスミド:
1)CTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCA(配列番号3);
2)上記配列番号3に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
4.miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる前項1〜3のいずれか1に記載のmiR-7発現プラスミド:
1)CCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACG(配列番号4);
2)上記配列番号4に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
5.配列表の配列番号1に示す塩基配列から選択されるオリゴ(又はポリ)ヌクレオチドであって、以下の配列番号5に示す塩基配列からなるオリゴヌクレオチドをフォワードプライマーとし、以下の配列番号6に示すオリゴヌクレオチドをリバースプライマーとして増幅させて得られるオリゴ(又はポリ)ヌクレオチドを含む、前項1〜4のいずれか1に記載のmiR-7発現プラスミド。
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【発明の効果】
【0012】
本発明のmiR-7発現プラスミドは、in vitro及びin vivoにおいて、抗腫瘍効果を持つことが明らかとなった。本発明のmiR-7発現プラスミドは、臨床上問題とされている肺腺癌EGFR分子標的薬耐性モデルにおいて、強力な抗腫瘍効果をin vivoで証明することができた。この抗腫瘍効果は、EGFRをmRNAレベルで直接抑制することにより発揮されることはin vitroにおいても確認され、上市されているいずれの分子標的薬とも全く異なる機序で抗腫瘍効果を発揮しうるため、単体のみでの使用のみならず併用療法も期待することができる。さらには頭頚部癌や食道癌、大腸癌などに見られるEGFR高発現型の固形癌に対しても有用性が期待される。
【図面の簡単な説明】
【0013】
【図1】miR-7及びその前駆体であるmiR-7-2の構造を示す図である。
【図2】miR-7と、ヒトEGFRの3'-UTR領域におけるmiR-7の認識部位、認識態様を示す図である。
【図3】配列表の配列番号1に示す塩基配列を示す図である。ここにおいて、枠で囲む領域、即ち配列番号2で示される部分は、miR-7をコードする配列であり、下線で示す領域、即ち配列番号3で示す部分は、miR-7の前駆体であるmiR-7-2をコードする配列である。
【図4】プラスミドベクターへの導入ポリヌクレオチド配列(配列番号12)を示す図である。ここにおいて、配列番号2で示される部分は、miR-7をコードする配列であり、配列番号3で示す部分は、miR-7の前駆体であるmiR-7-2をコードする配列である。(実施例1参照)
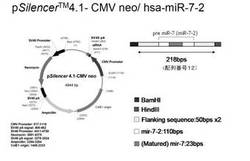
【図5】本発明のmiR-7発現プラスミドの一例を示す図である。(実施例1)
【図6】本発明のmiR-7発現プラスミドの効果をin vitroで確認する際の、実験フローを示す図である。(実験例1−4)。
【図7】本発明のmiR-7発現プラスミドの、RPC-9細胞における発現効率を確認した結果を示す図である。(実験例1)
【図8】本発明のmiR-7発現プラスミドの、PC-9細胞及びRPC-9細胞に対する細胞死誘導効果を、顕微鏡により確認した結果を示す図である。(実験例2)
【図9】本発明のmiR-7発現プラスミドの、PC-9細胞に対する細胞死誘導効果を、細胞数の計測により確認した結果を示す図である。(実験例2)
【図10】本発明のmiR-7発現プラスミドの、RPC-9細胞に対する細胞死誘導効果を、細胞数の計測により確認した結果を示す図である。(実験例2)
【図11】本発明のmiR-7発現プラスミドの、抗EGFR-3'UTR作用を確認するための、ルシフェラーゼ発現ベクターの構造を示す図である。(実験例3)
【図12】本発明のmiR-7発現プラスミドの、抗EGFR-3'UTR作用を確認するための、ルシフェラーゼアッセイのフローを示す図である。(実験例3)
【図13】本発明のmiR-7発現プラスミドの、抗EGFR-3'UTR作用を確認した結果を示す図である。(実験例3)
【図14】本発明のmiR-7発現プラスミドによる、蛋白質の発現抑制効果をイムノブロッティングにて確認した結果を示す図である。(実験例4)
【図15】免疫不全マウスによる腫瘍移植動物モデルの作製フローを示す図である。(実験例5)
【図16】耐性株RPC9腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す写真である。(実験例5)
【図17】耐性株RPC9腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す図である。(実験例5)
【図18】本発明のmiR-7発現プラスミドの、H3255細胞およびH1975細胞に対する細胞増殖抑制効果を、顕微鏡により確認した結果を示す図である。(実験例6)
【図19】本発明のmiR-7発現プラスミドの、H3255細胞およびH1975細胞に対する細胞増殖抑制効果を、細胞数の計測により確認した結果を示す図である。(実験例6)
【図20】本発明のmiR-7発現プラスミドによる、H3255細胞およびH1975細胞における蛋白質の発現抑制効果をイムノブロッティングにて確認した結果を示す図である。(実験例7)
【図21】耐性株H1975腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す写真である。(実験例8)
【図22】耐性株H1975腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す図である。(実験例8)
【発明を実施するための形態】
【0014】
本発明は、miR-7を効果的に細胞内に導入しうるプラスミドに関する。より詳しくは、生体に導入効率がよく、毒性の低いmiR-7発現プラスミドに関する。
【0015】
miR-7は、以下の配列番号7に示す塩基配列からなり、その前駆体であるpre miR-7の1種であると確認されているmiR-7-2は、以下の配列番号8に示す塩基配列からなる(図1参照)。miR-7は、配列番号9−11のいずれかで特定されるEGFRの3'-UTR領域の少なくとも3箇所を認識することが公知である。ここで、配列番号9−11のいずれかで特定されるEGFRの3'-UTR領域は、miR-7を構成する塩基配列と必ずしも完全一致している必要はなく、互いにハイブリダイズ可能な配列であればよい(図2参照)。
miR-7:uggaagacuagugauuuuguugu(配列番号7)
miR-7-2:guggaccggcuggccccaucuggaagacuagugauuuuguuguugucuuacugcgcucaacaacaaaucccagucuaccuaauggugccagccaucgca(配列番号8)
EGFR 3'-UTR領域 (442-464):GACTGACTTGTTTGTCTTCCA(配列番号9)
EGFR 3'-UTR領域 (726-747):ACTTGAATTGTTTGTCTTCCA(配列番号10)
EGFR 3'-UTR領域 (357-377):TTACTTGAATGGGCTCTTCCA(配列番号11)
【0016】
本発明のmiR-7発現プラスミドを調製するための適切なプラスミドベクターは、自体公知の、又は今後開発されるあらゆるプラスミドベクターのうちmicro RNAを発現可能なものであればよく、特に限定されない。このようなプラスミドベクターとして、例えば大腸菌由来のプラスミドベクター(例えばpBR322、pBR325、pUC18又はpUC118等)、枯草菌由来のプラスミドベクター(例えばpUB110、pTP5又はpC194)、酵母由来のプラスミドベクター(例えばpsH19又はpSH15)等が挙げられる。
【0017】
本発明のmiR-7発現プラスミドには、配列表の配列番号1に示す塩基配列から選択される20〜220塩基長、好ましくは110〜220塩基長、最も好ましくは、210〜218塩基長のDNAであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドが含まれる。ここで、配列表の配列番号1に示す塩基配列は図3に示すとおりである。
【0018】
本発明のmiR-7発現プラスミドに含まれるmiR-7をコードするDNAを含むオリゴ(若しくはポリ)ヌクレオチド又はその相補配列からなるオリゴ(若しくはポリ)ヌクレオチドは、少なくとも以下に示すいずれかの塩基配列からなるオリゴ(又はポリ)ヌクレオチドを含んでいれば良い。ここで、配列表の配列番号2に示す塩基配列は、配列番号1に示す塩基配列から選択される部分である(図3参照)。
1)TGGAAGACTAGTGATTTTGTTGT(配列番号2);
2)上記配列番号2に示す塩基配列のうち、1〜3個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【0019】
上述のmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むプラスミドには、さらに以下に示すいずれかの塩基配列からなるオリゴ(又はポリ)ヌクレオチドを含むのが好適である。以下に示す配列はmiR-7の前駆型であり、Pre-miR-7、即ちmiR-7-2をコードするDNAである。ここで、配列表の配列番号3に示す塩基配列は、配列番号1に示す塩基配列から選択され、配列番号2に示す塩基配列を含む塩基配列からなる(図3参照)。
1)CTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCA(配列番号3);
2)上記配列番号3に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【0020】
上述のmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むプラスミドには、さらに以下に示すいずれかの塩基配列からなるオリゴ(又はポリ)ヌクレオチドを含むのが最も好適である。以下に示す配列は、miR-7-2の前駆型、即ちpri-miR-7(-2)をコードするDNAである。ここで、配列表の配列番号4に示す塩基配列は、配列番号1に示す塩基配列から選択され、配列番号2、3に示す塩基配列を含む塩基配列からなる(図3、4参照)。
1)CCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACG(配列番号4);
2)上記配列番号4に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【0021】
具体的には、例えば配列番号4に示す塩基配列からなるポリヌクレオチドの5'末端側にCTGA、3'末端側にGTTを付加したポリヌクレオチド(配列番号12)をプラスミドベクターに導入することができる(図4参照)。
【0022】
CTGACCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACGTGTT(配列番号12)
【0023】
本発明のmiR-7発現プラスミドを作製するために、上述したいずれかのオリゴ(又はポリ)ヌクレオチドを、自体公知の、若しくは今後開発される新たなプラスミドベクターに導入することが必要である。そのようなオリゴ(又はポリ)ヌクレオチドは、例えばポリメラーゼ・チェーン・リアクション(PCR)のような遺伝子増幅方法により作製することができる。上記に示すいずれかのオリゴ(又はポリ)ヌクレオチドを作製するために、プライマーを調製することが必要である。例えば、上記配列番号12に示す塩基配列からなるポリヌクレオチドを調製するために、以下の配列番号5及び6に示す塩基配列からなるプライマーを作製することができる。プライマーとして用いるオリゴヌクレオチドの合成は、自体公知の方法によることができる。本発明は、以下のプライマーにも及ぶ。鋳型となるDNAは、miR-7をコードするDNAが含まれるものであればよく、例えばヒト第7染色体に位置するDNAが挙げられ、具体的には配列番号1に示す塩基配列からなるポリヌクレオチドを鋳型とすることができる。
【0024】
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【0025】
本発明のmiR-7発現プラスミドに含まれるプロモータや選択マーカーの導入は、自体公知の方法や、今後開発されるあらゆる方法によることができる。例えば、制限酵素処理、クレノー断片処理による末端の平滑化、ライゲーション反応などを用いて導入することができる。
【0026】
上述したいずれかのオリゴ(又はポリ)ヌクレオチドを含む本発明のmiR-7発現プラスミドには、miR-7を発現させるためにプロモータを備えることができる。このプロモータは、miR-7を発現し得るものであれば、その種類、数、位置などは任意に定めることができる。miR-7発現プラスミドの簡易な構成としては、上記に示すいずれかのオリゴ(又はポリ)ヌクレオチドの上流に、プロモータをそれぞれ備えたタンデム型に配置することができる。ステムループ型でmiR-7を発現するプラスミドの場合は、上述のいずれかのオリゴ(又はポリ)ヌクレオチドと、その相補配列からなるオリゴ(又はポリ)ヌクレオチドの間に、リンカーDNAにより接続したユニットを配置することができ、このユニットの片側にプロモータを連結することにより、ステム型miR-7発現プラスミドを構築することができる。なおリンカーDNAの長さや配列には特に限定はないが、miR-7の生成を阻害するようなターミネーション配列などでなく、成熟RNAまで生成された際にステム部分の対合に支障のないリンカーの長さ、配列であればよい。
【0027】
また、タンデム型、ステム型発現プラスミドのいずれの場合にも、上述のいずれかのオリゴ(又はポリ)ヌクレオチドの5'末端にプロモータからの転写を促進し得る配列を備えてもよい。具体的にはタンデム型の場合には、アンチセンスコードDNAとセンスコードDNAとの5'末端それぞれに、また、ステム型の場合には上記ユニットの5'末端に、プロモータからの転写を促進し得る配列を備えることにより、miR-7の生成を効率化してもよい。例えば、ATTやTTAなどの塩基配列からなるオリゴヌクレオチドを付加することができる。
【0028】
上述したタンデム型、ステム型のいずれの場合でも、プロモータはmicro RNAを発現し得るものであれば、pol II系、pol III系のいずれであってもよい。miR-7のような短いRNAの発現には、好ましくはpol III系を用いることができる。このpol III系のプロモータとしては、例えば、U6プロモータ、tRNAプロモータ、レトロウイルス性LTRプロモータ、アデノウイルスVA1プロモータ、5S rRNAプロモータ、7SK RNAプロモータ、7SL RNAプロモータ、H1 RNAプロモータなどを挙げることができる。なお、上記U6プロモータはRNAの3'末端に例えば4塩基のウリジン塩基を付加することができる。また、pol III系のプロモータを用いた場合には、短いRNAのみを発現させ適切に転写を終結させるために、さらにセンスコードDNA、アンチセンスコードDNAの3'末端にターミネーターを備えることができる。ターミネーターは、プロモータの転写を終結し得る配列であれば、特に限定はなく、例えば、A(アデニン)塩基が4つ以上連続した配列、パリンドローム構造を形成し得る配列などを用いることができる。
【0029】
一方、pol II系プロモータとしては、サイトメガロウイルス(CMV)プロモータ、T7プロモータ、T3プロモータ、SP6プロモータ、RSVプロモータ、EF-1αプロモータ、β-アクチンプロモータ、γ-グロブリンプロモータ、SRαプロモータなどを挙げることができる。ただし、pol II系を用いた場合には、pol III系のような短いRNAではなく、ある程度の長さのRNAとして合成される。そのため、pol II系のプロモータを用いた場合には、このある程度の長さとして合成されるRNAより、例えばリボザイムなどのRNAをセルフプロセッシングにより切断し得る手段を用いて、アンチセンスRNA又はセンスRNAを生成させることもできる。Pol II系プロモータの直後にステムループ配列を挿入し、その後ろにpolyA付加シグナルをいれて、ステムループRNAを生成させることもできる。
【0030】
本発明のmiR-7発現プラスミドには、必要に応じて、プラスミドが導入された細胞を選択し得る選択マーカーなどをさらに保持させることができる。選択マーカーとしては、ネオマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子、ピューロマイシン耐性遺伝子のような薬剤耐性マーカー、ガラクトシダーゼなどの酵素活性を指標に選択し得るマーカー、あるいはGFPなどの蛍光発光などを指標に選択し得るマーカーなどが挙げられる。また、EGFレセプター、B7-2、又はCD4などの表面抗原を指標に選択し得る選択マーカーなどを用いてもよい。このように選択マーカーを用いることにより、該プラスミドが導入された細胞、すなわち、miR-7発現プラスミドが導入された細胞のみを選択することができる。
【0031】
本発明のmiR-7発現プラスミドを、そのまま細胞内の染色体に導入し、細胞内でアンチセンスRNA、センスRNAを発現させmiR-7を発現させることもできるが、効率的な細胞導入などを行うために、上記miR-7発現プラスミドをベクターに保持させることが好ましい。ここで使用されるベクターは、導入したい細胞などに対応して選択することができる。例えば哺乳動物細胞では、レトロウイルスベクター、アデノウイルスベクター、アデノ関連ウイルスベクター、ワクシニアウイルスベクター、レンチウイルスベクター、ヘルペスウイルスベクター、アルファウイルスベクター、EBウイルスベクター、パピローマウイルスベクター、フォーミーウイルスベクターなどのウイルスベクターやカチオニックリポソーム、リガンドDNA複合体、ジーンガンなどの非ウイルスベクターなどが挙げられるが(Y. Niitsuら, Molecular Medicine 35: 1385-1395 (1998))、これらに限定されるものではない。
【0032】
本発明のmiR-7発現プラスミドは、当該プラスミドと親和性を有する任意の蛋白質、糖、ステロイド、又は脂質に含ませることができる。例えば、天然化合物(ヒストン、プロタミン、スペルミン、スペルミジン、及び可動性の高い基を有する蛋白質など)、合成カチオン性化合物(DEAE-デキストラン、ポリブレン、ポリリジン、ポリヒスチジン、ポリペプチド、ポリアミドアミンカスケードポリマーもしくはデンドリマー、リポポリアミン、及びポリエチレンイミンなど)、及びカチオン性脂質又はカチオン性リポソーム製剤(トランスフェクタム(R)(Promega)、ドータップ(R)(Roche)、ヒュージーン6(R)(Roche)、エックストリームジーンQ2(R)(Roche)、ジーンジェイマー(R)(Stratagene)、ジーンポーター(R)(Gene Therapy Systems)、イフェクテン(R)(Quiagen)、スーパーフェクト(R)(Quiagen)、リポフェクチン(LIPOFECTIN)(R)(Invitrogen)、リポフェクトエース(R)(Invitrogen)、リポフェクタミン(R)(Invitrogen)、リポフェクタミン2000(R)(Invitrogen)、LipoTrustTM(北海道システムサイエンス))などを挙げることができる。特に好適には、カチオン性リポソーム製剤とともに使用することができる。
【0033】
miR-7発現プラスミドを含むベクターを導入する宿主細胞は、プロモータの種類にもよるが、哺乳類細胞が好ましく、より好ましくは、マウスもしくはラット等の齧歯類又は他の動物(例えば、ヤギもしくはウシのような他の哺乳動物又は鳥類)、霊長類及び非霊長類等に由来する細胞が挙げられる。ヒト細胞としては、形質転換細胞が安定に培養できるものであれば特に限定されず、例えば、リンパ球、造血細胞、肝細胞、心臓細胞、血管内皮細胞、脾臓細胞や各種腫瘍細胞が挙げられる。各種腫瘍細胞としては、肺癌、肝臓癌、神経膠芽腫、骨髄腫、胃癌、膵臓癌、脳腫瘍、大腸癌、腎癌、膀胱癌、卵巣癌、子宮頸癌、前立腺癌及び白血病等由来の細胞が挙げられる。特に肺癌由来の細胞が好ましい。肺癌としては、いずれの組織型の肺癌であってもよいが、例えば、腺癌、扁平上皮癌、大細胞癌、大細胞神経内分泌癌及び腺扁平上皮癌などの非小細胞癌並びに小細胞癌が挙げられる。好ましい細胞の具体的な例としては、ヒト腎臓由来HEK293細胞、ヒト子宮頸癌由来Hela細胞、ヒト結腸癌由来CACO-2細胞、ヒト白血病T細胞由来Jurkat細胞、ヒト肺癌由来PC-9やRPC-9細胞、H3255やH1975細胞等が挙げられ、特に好ましくはヒト肺癌由来PC-9やRPC-9細胞、H3255やH1975細胞が挙げられる。
【0034】
本発明は、本発明のmiR-7発現プラスミドを含む抗腫瘍剤にも及ぶ。本発明の抗腫瘍剤は、分子標的薬に対して耐性を持つ腫瘍、特に分子標的薬に対して耐性を持つ肺癌に対しても治療効果を発揮すると考えられる。
【実施例】
【0035】
本発明の理解を助けるために、参考例において、本発明を完成するに至った経緯を説明し、さらに実施例、実験例を示して具体的に本発明を説明するが、本発明はこれらの実施例、実験例に限定されるものでないことはいうまでもない。
【0036】
(参考例)miR-7を発現するのに有効なDNA配列の検索
背景技術の欄でも示したように、EGFRのリン酸化部位を効率的に阻害する分子標的薬に対する臨床的、理論的に証明されている耐性について、耐性細胞おけるEGFR依存性が持続されていることが、イムノブロッティングの結果より予測された。したがって、EGFRの発現自体を効率的に抑制することができれば、ふたたび腫瘍縮小効果が得られると考えた。micro RNAは、標的となるmRNAをRNAレベルで抑制することにより、結果的に蛋白質の発現量を制御することは公知であり、miR-7とEGFRの関係についても公知である(非特許文献4−6)。本発明者らは、さらに検討を重ね、EGFRを効率的に抑制するmicro RNAをin silicoで予測し、ヒトEGFRの3'UTR領域においてmiR-7とマッチする箇所を確認した(図2参照)。さらに検討を重ね、miR-7を発現するのに有効なDNA配列を検索したところ、ヒトDNA配列内に存在する、配列表の配列番号1に示す配列を見出した。
【0037】
(実施例1)miR-7発現プラスミドの作製
上記の参考例により見出したmiR-7の発現効率にかかわると考えられるイントロン配列より選択されるポリヌクレオチドを汎用型の発現ベクターに挿入し、miR-7発現プラスミドの作製について検討した。その結果、配列番号4に示す塩基配列の5'末端及び3'末端に、各々下線で示した4個のヌクレオチドを含む配列からなるポリヌクレオチド(配列番号12)をプラスミドベクターに導入することで、効果的にmiR-7が発現しうることを確認した。
【0038】
CTGACCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACGTGTT(配列番号12)
【0039】
本実施例において、汎用型の発現ベクターは、市販のpSilencerTM4.1- CMV neo(Ambion)を用いた。市販のプラスミドベクターに導入するポリヌクレオチドは、配列表の配列番号1に示す塩基配列からなるポリヌクレオチドを鋳型とし、以下の配列番号5及び6を用いてPCRの手法により増幅を行ない、作製した。作製したポリヌクレオチドのプラスミドベクターへの導入方法そのものは、汎用的な方法に従った。作製したmiR-7発現プラスミドの概要を図5に示した。
【0040】
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【0041】
(実験例1)細胞へmiR-7発現プラスミドの導入効果
ヒト肺腺癌細胞株PC-9の分子標的薬耐性株であるヒト肺腺癌細胞株RPC-9(以下、「耐性株RPC-9」という。)を用いて、実施例1で作製したプラスミドの効果をin vitroで確認した。in vitroでの、実験フローを図6に示した。
【0042】
実施例1で作製したmiR-7発現プラスミドについて、耐性株RPC-9への導入効果を定量的PCRにより確認した。各細胞を70%コンフルエントにした後にトリプシンで処理し、約10×105個/mLの細胞に対し、48時間後に核酸導入試薬LipotrustTM EX(北海道システムサイエンス)のプロトコルに従い、リポソームに導入されたプラスミドを細胞溶液10mLあたり24μgトランスフェクションし、当該プラスミドを細胞へ導入した。37℃下で細胞の培養を継続し、24時間後に細胞を回収した。回収した細胞を、miR-7発現解析に用いた。定量的PCRにはTaqMan法(Applied Biosystems)を用いた。定量的PCRの内部標準としてU44を用いて、導入されたmiR-7発現量を解析した。比較対照用のコントロールプラスミドとして、市販のpSilencerTM4.1- CMV neo(Ambion)(発現しても蛋白に変化をきたさないことが分かっているsiRNAが導入されたもの(http://www.ambion.com/techlib/misc/vectors/4.1_cmv_neo.html))を用いた。
【0043】
その結果、比較対照用のコントロールプラスミドを導入した場合と比較して、本実施例のmiR-7発現プラスミドの場合は、miR-7が約30〜35倍程度強発現することが証明された(表1、図7)。
【0044】
【表1】

【0045】
(実験例2)miR-7発現プラスミドの各細胞への細胞死誘導効果
実施例1で作製したmiR-7発現プラスミドについて、ヒト肺腺癌細胞株PC-9及び耐性株RPC-9に及ぼす細胞死誘導効果を顕微鏡検鏡及び細胞数のカウントにより確認した。各細胞を70%コンフルエントにした後にトリプシンで処理し、約10×105個/mLの細胞に対し、48時間後にLipotrustTM EX(北海道システムサイエンス)のプロトコルに従いリポソームに導入されたプラスミドを、細胞溶液10mLあたり24μgトランスフェクションした。37℃下で培養を継続し、72時間にトリプシンで細胞を回収し、トリパンブルー染色で細胞数をカウントした。
【0046】
その結果、miR-7発現用ベクターを導入した場合に、コントロールに比べて細胞死誘導効果が明らかに優れていることが確認された(図8−10)。
【0047】
(実験例3)細胞におけるmiR-7発現プラスミドの抗EGFR-3'UTR作用の確認
ヒト肺腺癌細胞株(耐性株)RPC-9におけるmiR-7発現プラスミドの抗EGFR-3'UTR作用を、ルシフェラーゼアッセイにより確認した。miR-7の標的であるEGFR-3'UTRが阻害されることによって蛍光が阻害されるルシフェラーゼ発現ベクターを構築し、実施例1で作製したプラスミドをルシフェラーゼ発現ベクターに作用させ、ルシフェラーゼの発光度によりEGFR-3'UTRの作用へ及ぼす影響を調べた(図11参照)。ルシフェラーゼの発光は、デュアル-ルシフェラーゼ定量システム(ホモジニアス長時間発光タイプDual-GloTM Luciferase Assay System)により確認した(図12)。その結果、miR-7発現ベクターをRPC-9細胞株にトランスフェクトすると、ルシフェラーゼ活性は阻害され、miR-7が確かにEGFR-3'UTRを阻害することが証明された(図13)。
【0048】
(実験例4)miR-7発現プラスミドによる蛋白質の発現抑制効果
イムノブロッティングにより、miR-7発現プラスミドによるヒト肺腺癌細胞株PC-9及び耐性株RPC-9における蛋白質の発現抑制効果を確認した。イムノブロッティングは、ECL法(GE Healthcare社)により行なった。具体的には、Ichihara, E., K. Ohashi, et al. (2009). "Effects of vandetanib on lung adenocarcinoma cells harboring epidermal growth factor receptor T790M mutation in vivo." Cancer Res 69(12): 5091-5098.のimmunoblottingの項に示す方法により行なった。その結果、miR-7発現プラスミドが導入された細胞では、EGFRの抑制と、その下流の最も重要な蛋白であるAKTのリン酸化が抑制されることを確認した(図14)。
【0049】
以上により、実施例1で作製したmiR-7発現プラスミドは、in vitroにおいてEGFR発現抑制効果を持つことが明らかとなった。
【0050】
(実験例5)in vivoでのmiR-7発現プラスミドによる抗腫瘍効果の確認
免疫不全マウスを用いて、実施例1で作製したmiR-7発現プラスミドによる抗腫瘍効果をin vivoで確認した。7週齢の雌免疫不全マウスに、耐性株RPC-9を皮下注射し、約1週間で皮下に測定可能な腫瘍を形成させる異種移植(xenograft)モデルを樹立した(図15)。これに対し、実施例1で作製したmiR-7発現プラスミド各々3μg相当をカチオニックリポソームを用いて直接注入し、その抗腫瘍活性を測定した。その結果、実験系においては週1回の投与を2回投与するのみで60%のマウスに腫瘍の完全消失を得た(図16、17)。
【0051】
以上により、臨床上問題とされている肺腺癌EGFR分子標的薬耐性モデルにおいて、本発明のmiR-7発現プラスミドは、強力な抗腫瘍効果を有することをin vivoで証明することができた。
【0052】
(実験例6)miR-7発現プラスミドの各細胞への細胞増殖抑制効果
実施例1で作製したmiR-7発現プラスミドについて、ヒト肺腺癌細胞株H3255及び分子標的薬耐性株であるヒト肺腺癌細胞株H1975(以下、「耐性株H1975」という。)に及ぼす細胞増殖抑制効果を顕微鏡検鏡及び細胞数のカウントにより確認した。ヒト肺腺癌細胞株H3255はEGFR exon 21の変異(L858R point mutation)を持つ細胞株であり、分子標的薬ゲフィチニブ高感受性株であることが分かっている。また耐性株H1975は、EGFR exon 21の変異(L858R point mutation)を持つが、T790M変異が加わることにより、分子標的薬への耐性を獲得したものである。H3255細胞およびH1975細胞を用いた以外は、実験例2と同様の手法により実験を行った。
【0053】
その結果、miR-7発現用ベクターを導入した場合に、コントロールに比べて細胞増殖抑制効果が明らかに優れていることが確認された(図18,19)。
【0054】
(実験例7)miR-7発現プラスミドによる蛋白質の発現抑制効果
イムノブロッティングにより、実施例1で作製したmiR-7発現プラスミドによるヒト肺腺癌細胞株H3255及び耐性株H1975における蛋白質の発現抑制効果を確認した。H3255細胞およびH1975細胞を用いた以外は、実験例4と同様の手法により実験を行った。
【0055】
その結果、miR-7発現プラスミドが導入された細胞では、EGFRの抑制と、その下流の最も重要な蛋白であるAKTのリン酸化が抑制されることを確認した(図20)。実施例1で作製したmiR-7発現プラスミドは、in vitroにおいて、EGFR exon 21の変異を持つ細胞に対してEGFR発現抑制効果を持つことが明らかとなった。
【0056】
(実験例8)n vivoでのmiR-7発現プラスミドによる抗腫瘍効果の確認
免疫不全マウスを用いて、実施例1で作製したmiR-7発現プラスミドによる抗腫瘍効果をin vivoで確認した。異種移植(xenograft)モデルの樹立に、耐性株H1975を用いた以外は、実験例5と同様の手法により実験を行った。
【0057】
その結果、臨床上問題とされている肺腺癌EGFR分子標的薬耐性モデルにおいて、本発明のmiR-7発現プラスミドは、強力な抗腫瘍効果を有することをin vivoで証明することができた(図21,22)。
【産業上の利用可能性】
【0058】
EGFRを標的とした分子標的薬は、EGFR依存性の高い肺腺癌において劇的な効果をもたらすが、上記背景技術の欄で示した如く、分子標的薬に対して耐性を生じることが分かっている。以上詳述したように、本発明のmiR-7発現プラスミドにより、EGFRのmRNAレベルが抑制され、当該分子標的薬に対する耐性を克服することが可能である。また、従来型の分子標的薬のターゲットは、EGFRのチロシンキナーゼ、即ち蛋白質であるのに対し、本発明のmiR-7発現プラスミドは、EGFRにおけるmRNAレベルで抑制し、蛋白質の発現を抑制することをターゲットとする。このため、単に蛋白質の変異による耐性克服のみならず、従来療法との併用によって、さらに強い臨床効果を得ることも期待される。肺癌は日本だけでも年間罹患率は7万人を超え、年間死亡数も6万人を超えている。そのうちの半数が肺腺癌であり、かつその半数がEGFR変異を有するが、本発明において証明されている効果は、国内だけでも少なくとも年間約2万人に及ぶものと考えられる。また、EGFRは種々の固形癌に対する重要なシグナルとなるため、固形癌に広く応用できることが期待される。
【技術分野】
【0001】
本発明は、miR-7を効果的に細胞内に導入しうるプラスミドに関する。より詳しくは、生体に導入効率がよく、毒性の低いmiR-7発現プラスミドに関する。
【背景技術】
【0002】
上皮成長因子受容体(Epidermal Growth Factor Receptor; EGFR)が、上皮系腫瘍においてその増殖及び生存維持に重要な役割を果たしていることは既知のことである。そのEGFRを標的とした分子標的薬には、EGFRのチロシンキナーゼを選択的に阻害する、エルロチニブ(erlotinib)、ゲフィチニブ(gefitinib)などがある。EGFRに特有の変異、例えばエクソン19にコードされるアミノ酸が一部欠失したもの(delE746-A750)、エクソン21にコードされる858番目のアミノ酸であるロイシンがアルギニンに置換されたもの(L858R)、エクソン20にコードされる719番目のグリシンがセリン、アラニン、又はシステインへ置換されたもの(G719X)などが存在する肺癌患者に対して、これらの薬剤が臨床的に著効例を示すといわれている。かかる変異は、非喫煙者アジア人女性の肺腺癌患者において、ほぼ半数に認められる変異であることが徐々に明らかになっている(非特許文献1)。逆に、本願発明者らが開発したトランスジェニックマウスモデルにおいて、肺に前記の特有の変異が存在するEGFR(mutation EGFR)を強発現させると、臨床で見られるような肺腺癌が生じることが証明された。そのようなマウスモデルは、ヒトと同様にゲフィチニブ又はエルロチニブを投与すると腫瘍が劇的に縮小することが報告されている(非特許文献2)。したがって、現在市販されているエルロチニブやゲフィチニブは、主としてEGFRリン酸化活性部位を特異的に阻害することにより、EGFR依存的に生存する腫瘍細胞に細胞死をもたらし、臨床的に劇的な効果をあげていると考えられる。
【0003】
分子標的薬は、EGFRのリン酸化部位を効率的に阻害することで抗腫瘍活性をもたらしているが、主にEGFRの二次的変異(T790M in EGFR exon20)により、約半年から1年ほどでほぼ確実に分子標的薬に対して耐性となってしまい、患者は癌死から免れる事が出来ない。そこで、その耐性化過程を再現するため。本発明者らはゲフィチニブを、本来著効する変異(delE746-A750 in EGFR exon 19)を有するヒト肺腺癌細胞株(PC-9)に対し、長期低用量持続投与することにより、臨床で発生する耐性と同様な細胞株(RPC-9)を得、臨床にみられる前述の二次的変異を同様に獲得した。このことにより、従来技術であるEGFRリン酸化部位の抑制では、その分子標的薬の暴露下においても耐性化が生じるということが臨床的に観察され、さらにはin vitroでも証明された(非特許文献3)。
【0004】
生物の遺伝子情報が解明されるにつれ、蛋白質をコードしていない非コードのDNAの割合が、高等生物ほど非常に多いことが判明されている。また、ヒトでは全ゲノムの2/3からRNAが転写されると推定されていることから、生物種の複雑さに応じて非コードRNAの種類と量が増加すると推定され、非コードのRNAであるmicro RNAが発見された。micro RNAは、18〜22塩基の非コードRNAの総称で、ヒトの遺伝子の約1/3がmicro RNAで制御されていると考えられている。micro RNAのプロセシングについては既に各種報告がなされている。このmicro RNAは真核生物で発現し、高度に保存されており、ヒトでは約1000種類あるものと推定されている。micro RNAに関し、低分子核酸の検出方法が特許文献1に開示されている。
【0005】
micro RNAは、遺伝子発現の制御において重要な役割を担っている。micro RNAは、核内ではPri-micro RNAとしてDNAから転写され、ヘアピン二本鎖RNA(dsRNA)前駆体となる。dsRNAは細胞質内に移行し、Dicerの作用により成熟したmicro RNAが生成される。生成したmicro RNAはRISC(RNA-induced silencing complex)複合体に取込まれ、遺伝子機能制御に関与する。micro RNAは、例えばRNA干渉(RNAi)とよく似た作用を有するが、その作用は不明な点が多い。例えばRNAiは標的RNAを切断することにより翻訳を抑制するが、micro RNAの多くは標的RNAを切断せずに翻訳抑制すると考えられている。また、micro RNAは、発生、分化、細胞周期や癌疾患などに関与している可能性が報告され、例えば肺癌、結腸癌、胸部癌、前立腺癌、膀胱癌や膵臓癌患者の腫瘍組織では特定のmicro RNAからそれぞれの腫瘍タイプと正常サンプルとを識別できることが明らかとなっている(特許文献2)。
【0006】
前述のEGFRを標的とした分子標的薬、即ちチロシンキナーゼ阻害薬に対する臨床的、理論的に証明されている耐性機序では、耐性細胞におけるEGFR依存性は持続していることがイムノブロッティング法により予測されている。したがって、分子標的療法で耐性化した肺癌を代表とする腫瘍において、EGFRを別の手段で抑制することで、その耐性化に関わらず腫瘍抑制効果をもたらしうることが予測される。micro RNA-7(以下、「miR-7」という。)が脳腫瘍細胞中のEGFRを阻害し、Aktパスウェイを抑制すること(非特許文献4)や、miR-7がp21-activated kinase 1 (Pak1)を阻害することが報告されている(非特許文献5)。非特許文献4では、miR-7を発現するプラスミドについて言及している。また、miR-7が肺癌、乳癌、脳腫瘍由来の細胞株に発現しているEGFRを標的とし、抑制作用を示すことが報告されている(非特許文献6)。しかしながら、これらの文献には肺癌のin vivo(生体)のレベルで有効であるという記載は全くない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特表2006−510372号公報
【特許文献2】特表2008−511678号公報
【非特許文献】
【0008】
【非特許文献1】Cancer Sci 98: 1817-1824, 2007
【非特許文献2】Cancer Sci 99: 1747-1753, 2008
【非特許文献3】Cancer Res 67: 7807-7814, 2007
【非特許文献4】Cancer Res 68: 3566-3572, 2008
【非特許文献5】Cancer Res 68: 8195-8200, 2008
【非特許文献6】J. Biol. Chem. 284: 5731-5741, 2009
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、EGFR依存的に生存する腫瘍細胞に対し、EGFRの抑制を蛋白レベルではなくその鋳型となるmRNAレベルで行なう方法を提供することを課題とする。即ち、mRNAレベルで抑制するために有効なmiR-7を、効果的に細胞内に導入しうるプラスミドを提供することを課題とする。より詳しくは、生体に導入効率がよく、毒性の低いmiR-7発現プラスミドを提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、上記課題を解決するためにEGFRを効率的に抑制するmiR-7を発現するのに有効なDNA配列を検索したところ、ヒトDNA配列内に存在する、配列表の配列番号1に示す塩基配列を見出し、当該塩基配列より選択される特定の配列をプラスミドベクターに導入することで、miR-7を効果的に細胞内に導入しうるプラスミドの作製に成功し、本発明を完成した。
【0011】
すなわち本発明は、以下よりなる。
1.配列表の配列番号1に示す塩基配列から選択される20〜220塩基長のオリゴ(又はポリ)ヌクレオチドであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むことを特徴とする、miR-7発現プラスミド。
2.miR-7をコードするDNAが、以下に示すいずれかの塩基配列からなる前項1に記載のmiR-7発現プラスミド:
1)TGGAAGACTAGTGATTTTGTTGT(配列番号2);
2)上記配列番号2に示す塩基配列のうち、1〜3個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
3.miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる前項1又は2に記載のmiR-7発現プラスミド:
1)CTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCA(配列番号3);
2)上記配列番号3に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
4.miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる前項1〜3のいずれか1に記載のmiR-7発現プラスミド:
1)CCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACG(配列番号4);
2)上記配列番号4に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
5.配列表の配列番号1に示す塩基配列から選択されるオリゴ(又はポリ)ヌクレオチドであって、以下の配列番号5に示す塩基配列からなるオリゴヌクレオチドをフォワードプライマーとし、以下の配列番号6に示すオリゴヌクレオチドをリバースプライマーとして増幅させて得られるオリゴ(又はポリ)ヌクレオチドを含む、前項1〜4のいずれか1に記載のmiR-7発現プラスミド。
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【発明の効果】
【0012】
本発明のmiR-7発現プラスミドは、in vitro及びin vivoにおいて、抗腫瘍効果を持つことが明らかとなった。本発明のmiR-7発現プラスミドは、臨床上問題とされている肺腺癌EGFR分子標的薬耐性モデルにおいて、強力な抗腫瘍効果をin vivoで証明することができた。この抗腫瘍効果は、EGFRをmRNAレベルで直接抑制することにより発揮されることはin vitroにおいても確認され、上市されているいずれの分子標的薬とも全く異なる機序で抗腫瘍効果を発揮しうるため、単体のみでの使用のみならず併用療法も期待することができる。さらには頭頚部癌や食道癌、大腸癌などに見られるEGFR高発現型の固形癌に対しても有用性が期待される。
【図面の簡単な説明】
【0013】
【図1】miR-7及びその前駆体であるmiR-7-2の構造を示す図である。
【図2】miR-7と、ヒトEGFRの3'-UTR領域におけるmiR-7の認識部位、認識態様を示す図である。
【図3】配列表の配列番号1に示す塩基配列を示す図である。ここにおいて、枠で囲む領域、即ち配列番号2で示される部分は、miR-7をコードする配列であり、下線で示す領域、即ち配列番号3で示す部分は、miR-7の前駆体であるmiR-7-2をコードする配列である。
【図4】プラスミドベクターへの導入ポリヌクレオチド配列(配列番号12)を示す図である。ここにおいて、配列番号2で示される部分は、miR-7をコードする配列であり、配列番号3で示す部分は、miR-7の前駆体であるmiR-7-2をコードする配列である。(実施例1参照)
【図5】本発明のmiR-7発現プラスミドの一例を示す図である。(実施例1)
【図6】本発明のmiR-7発現プラスミドの効果をin vitroで確認する際の、実験フローを示す図である。(実験例1−4)。
【図7】本発明のmiR-7発現プラスミドの、RPC-9細胞における発現効率を確認した結果を示す図である。(実験例1)
【図8】本発明のmiR-7発現プラスミドの、PC-9細胞及びRPC-9細胞に対する細胞死誘導効果を、顕微鏡により確認した結果を示す図である。(実験例2)
【図9】本発明のmiR-7発現プラスミドの、PC-9細胞に対する細胞死誘導効果を、細胞数の計測により確認した結果を示す図である。(実験例2)
【図10】本発明のmiR-7発現プラスミドの、RPC-9細胞に対する細胞死誘導効果を、細胞数の計測により確認した結果を示す図である。(実験例2)
【図11】本発明のmiR-7発現プラスミドの、抗EGFR-3'UTR作用を確認するための、ルシフェラーゼ発現ベクターの構造を示す図である。(実験例3)
【図12】本発明のmiR-7発現プラスミドの、抗EGFR-3'UTR作用を確認するための、ルシフェラーゼアッセイのフローを示す図である。(実験例3)
【図13】本発明のmiR-7発現プラスミドの、抗EGFR-3'UTR作用を確認した結果を示す図である。(実験例3)
【図14】本発明のmiR-7発現プラスミドによる、蛋白質の発現抑制効果をイムノブロッティングにて確認した結果を示す図である。(実験例4)
【図15】免疫不全マウスによる腫瘍移植動物モデルの作製フローを示す図である。(実験例5)
【図16】耐性株RPC9腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す写真である。(実験例5)
【図17】耐性株RPC9腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す図である。(実験例5)
【図18】本発明のmiR-7発現プラスミドの、H3255細胞およびH1975細胞に対する細胞増殖抑制効果を、顕微鏡により確認した結果を示す図である。(実験例6)
【図19】本発明のmiR-7発現プラスミドの、H3255細胞およびH1975細胞に対する細胞増殖抑制効果を、細胞数の計測により確認した結果を示す図である。(実験例6)
【図20】本発明のmiR-7発現プラスミドによる、H3255細胞およびH1975細胞における蛋白質の発現抑制効果をイムノブロッティングにて確認した結果を示す図である。(実験例7)
【図21】耐性株H1975腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す写真である。(実験例8)
【図22】耐性株H1975腫瘍移植動物モデルによる、本発明のmiR-7発現プラスミドの、in vivoでの抗腫瘍効果を示す図である。(実験例8)
【発明を実施するための形態】
【0014】
本発明は、miR-7を効果的に細胞内に導入しうるプラスミドに関する。より詳しくは、生体に導入効率がよく、毒性の低いmiR-7発現プラスミドに関する。
【0015】
miR-7は、以下の配列番号7に示す塩基配列からなり、その前駆体であるpre miR-7の1種であると確認されているmiR-7-2は、以下の配列番号8に示す塩基配列からなる(図1参照)。miR-7は、配列番号9−11のいずれかで特定されるEGFRの3'-UTR領域の少なくとも3箇所を認識することが公知である。ここで、配列番号9−11のいずれかで特定されるEGFRの3'-UTR領域は、miR-7を構成する塩基配列と必ずしも完全一致している必要はなく、互いにハイブリダイズ可能な配列であればよい(図2参照)。
miR-7:uggaagacuagugauuuuguugu(配列番号7)
miR-7-2:guggaccggcuggccccaucuggaagacuagugauuuuguuguugucuuacugcgcucaacaacaaaucccagucuaccuaauggugccagccaucgca(配列番号8)
EGFR 3'-UTR領域 (442-464):GACTGACTTGTTTGTCTTCCA(配列番号9)
EGFR 3'-UTR領域 (726-747):ACTTGAATTGTTTGTCTTCCA(配列番号10)
EGFR 3'-UTR領域 (357-377):TTACTTGAATGGGCTCTTCCA(配列番号11)
【0016】
本発明のmiR-7発現プラスミドを調製するための適切なプラスミドベクターは、自体公知の、又は今後開発されるあらゆるプラスミドベクターのうちmicro RNAを発現可能なものであればよく、特に限定されない。このようなプラスミドベクターとして、例えば大腸菌由来のプラスミドベクター(例えばpBR322、pBR325、pUC18又はpUC118等)、枯草菌由来のプラスミドベクター(例えばpUB110、pTP5又はpC194)、酵母由来のプラスミドベクター(例えばpsH19又はpSH15)等が挙げられる。
【0017】
本発明のmiR-7発現プラスミドには、配列表の配列番号1に示す塩基配列から選択される20〜220塩基長、好ましくは110〜220塩基長、最も好ましくは、210〜218塩基長のDNAであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドが含まれる。ここで、配列表の配列番号1に示す塩基配列は図3に示すとおりである。
【0018】
本発明のmiR-7発現プラスミドに含まれるmiR-7をコードするDNAを含むオリゴ(若しくはポリ)ヌクレオチド又はその相補配列からなるオリゴ(若しくはポリ)ヌクレオチドは、少なくとも以下に示すいずれかの塩基配列からなるオリゴ(又はポリ)ヌクレオチドを含んでいれば良い。ここで、配列表の配列番号2に示す塩基配列は、配列番号1に示す塩基配列から選択される部分である(図3参照)。
1)TGGAAGACTAGTGATTTTGTTGT(配列番号2);
2)上記配列番号2に示す塩基配列のうち、1〜3個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【0019】
上述のmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むプラスミドには、さらに以下に示すいずれかの塩基配列からなるオリゴ(又はポリ)ヌクレオチドを含むのが好適である。以下に示す配列はmiR-7の前駆型であり、Pre-miR-7、即ちmiR-7-2をコードするDNAである。ここで、配列表の配列番号3に示す塩基配列は、配列番号1に示す塩基配列から選択され、配列番号2に示す塩基配列を含む塩基配列からなる(図3参照)。
1)CTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCA(配列番号3);
2)上記配列番号3に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【0020】
上述のmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むプラスミドには、さらに以下に示すいずれかの塩基配列からなるオリゴ(又はポリ)ヌクレオチドを含むのが最も好適である。以下に示す配列は、miR-7-2の前駆型、即ちpri-miR-7(-2)をコードするDNAである。ここで、配列表の配列番号4に示す塩基配列は、配列番号1に示す塩基配列から選択され、配列番号2、3に示す塩基配列を含む塩基配列からなる(図3、4参照)。
1)CCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACG(配列番号4);
2)上記配列番号4に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【0021】
具体的には、例えば配列番号4に示す塩基配列からなるポリヌクレオチドの5'末端側にCTGA、3'末端側にGTTを付加したポリヌクレオチド(配列番号12)をプラスミドベクターに導入することができる(図4参照)。
【0022】
CTGACCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACGTGTT(配列番号12)
【0023】
本発明のmiR-7発現プラスミドを作製するために、上述したいずれかのオリゴ(又はポリ)ヌクレオチドを、自体公知の、若しくは今後開発される新たなプラスミドベクターに導入することが必要である。そのようなオリゴ(又はポリ)ヌクレオチドは、例えばポリメラーゼ・チェーン・リアクション(PCR)のような遺伝子増幅方法により作製することができる。上記に示すいずれかのオリゴ(又はポリ)ヌクレオチドを作製するために、プライマーを調製することが必要である。例えば、上記配列番号12に示す塩基配列からなるポリヌクレオチドを調製するために、以下の配列番号5及び6に示す塩基配列からなるプライマーを作製することができる。プライマーとして用いるオリゴヌクレオチドの合成は、自体公知の方法によることができる。本発明は、以下のプライマーにも及ぶ。鋳型となるDNAは、miR-7をコードするDNAが含まれるものであればよく、例えばヒト第7染色体に位置するDNAが挙げられ、具体的には配列番号1に示す塩基配列からなるポリヌクレオチドを鋳型とすることができる。
【0024】
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【0025】
本発明のmiR-7発現プラスミドに含まれるプロモータや選択マーカーの導入は、自体公知の方法や、今後開発されるあらゆる方法によることができる。例えば、制限酵素処理、クレノー断片処理による末端の平滑化、ライゲーション反応などを用いて導入することができる。
【0026】
上述したいずれかのオリゴ(又はポリ)ヌクレオチドを含む本発明のmiR-7発現プラスミドには、miR-7を発現させるためにプロモータを備えることができる。このプロモータは、miR-7を発現し得るものであれば、その種類、数、位置などは任意に定めることができる。miR-7発現プラスミドの簡易な構成としては、上記に示すいずれかのオリゴ(又はポリ)ヌクレオチドの上流に、プロモータをそれぞれ備えたタンデム型に配置することができる。ステムループ型でmiR-7を発現するプラスミドの場合は、上述のいずれかのオリゴ(又はポリ)ヌクレオチドと、その相補配列からなるオリゴ(又はポリ)ヌクレオチドの間に、リンカーDNAにより接続したユニットを配置することができ、このユニットの片側にプロモータを連結することにより、ステム型miR-7発現プラスミドを構築することができる。なおリンカーDNAの長さや配列には特に限定はないが、miR-7の生成を阻害するようなターミネーション配列などでなく、成熟RNAまで生成された際にステム部分の対合に支障のないリンカーの長さ、配列であればよい。
【0027】
また、タンデム型、ステム型発現プラスミドのいずれの場合にも、上述のいずれかのオリゴ(又はポリ)ヌクレオチドの5'末端にプロモータからの転写を促進し得る配列を備えてもよい。具体的にはタンデム型の場合には、アンチセンスコードDNAとセンスコードDNAとの5'末端それぞれに、また、ステム型の場合には上記ユニットの5'末端に、プロモータからの転写を促進し得る配列を備えることにより、miR-7の生成を効率化してもよい。例えば、ATTやTTAなどの塩基配列からなるオリゴヌクレオチドを付加することができる。
【0028】
上述したタンデム型、ステム型のいずれの場合でも、プロモータはmicro RNAを発現し得るものであれば、pol II系、pol III系のいずれであってもよい。miR-7のような短いRNAの発現には、好ましくはpol III系を用いることができる。このpol III系のプロモータとしては、例えば、U6プロモータ、tRNAプロモータ、レトロウイルス性LTRプロモータ、アデノウイルスVA1プロモータ、5S rRNAプロモータ、7SK RNAプロモータ、7SL RNAプロモータ、H1 RNAプロモータなどを挙げることができる。なお、上記U6プロモータはRNAの3'末端に例えば4塩基のウリジン塩基を付加することができる。また、pol III系のプロモータを用いた場合には、短いRNAのみを発現させ適切に転写を終結させるために、さらにセンスコードDNA、アンチセンスコードDNAの3'末端にターミネーターを備えることができる。ターミネーターは、プロモータの転写を終結し得る配列であれば、特に限定はなく、例えば、A(アデニン)塩基が4つ以上連続した配列、パリンドローム構造を形成し得る配列などを用いることができる。
【0029】
一方、pol II系プロモータとしては、サイトメガロウイルス(CMV)プロモータ、T7プロモータ、T3プロモータ、SP6プロモータ、RSVプロモータ、EF-1αプロモータ、β-アクチンプロモータ、γ-グロブリンプロモータ、SRαプロモータなどを挙げることができる。ただし、pol II系を用いた場合には、pol III系のような短いRNAではなく、ある程度の長さのRNAとして合成される。そのため、pol II系のプロモータを用いた場合には、このある程度の長さとして合成されるRNAより、例えばリボザイムなどのRNAをセルフプロセッシングにより切断し得る手段を用いて、アンチセンスRNA又はセンスRNAを生成させることもできる。Pol II系プロモータの直後にステムループ配列を挿入し、その後ろにpolyA付加シグナルをいれて、ステムループRNAを生成させることもできる。
【0030】
本発明のmiR-7発現プラスミドには、必要に応じて、プラスミドが導入された細胞を選択し得る選択マーカーなどをさらに保持させることができる。選択マーカーとしては、ネオマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子、ピューロマイシン耐性遺伝子のような薬剤耐性マーカー、ガラクトシダーゼなどの酵素活性を指標に選択し得るマーカー、あるいはGFPなどの蛍光発光などを指標に選択し得るマーカーなどが挙げられる。また、EGFレセプター、B7-2、又はCD4などの表面抗原を指標に選択し得る選択マーカーなどを用いてもよい。このように選択マーカーを用いることにより、該プラスミドが導入された細胞、すなわち、miR-7発現プラスミドが導入された細胞のみを選択することができる。
【0031】
本発明のmiR-7発現プラスミドを、そのまま細胞内の染色体に導入し、細胞内でアンチセンスRNA、センスRNAを発現させmiR-7を発現させることもできるが、効率的な細胞導入などを行うために、上記miR-7発現プラスミドをベクターに保持させることが好ましい。ここで使用されるベクターは、導入したい細胞などに対応して選択することができる。例えば哺乳動物細胞では、レトロウイルスベクター、アデノウイルスベクター、アデノ関連ウイルスベクター、ワクシニアウイルスベクター、レンチウイルスベクター、ヘルペスウイルスベクター、アルファウイルスベクター、EBウイルスベクター、パピローマウイルスベクター、フォーミーウイルスベクターなどのウイルスベクターやカチオニックリポソーム、リガンドDNA複合体、ジーンガンなどの非ウイルスベクターなどが挙げられるが(Y. Niitsuら, Molecular Medicine 35: 1385-1395 (1998))、これらに限定されるものではない。
【0032】
本発明のmiR-7発現プラスミドは、当該プラスミドと親和性を有する任意の蛋白質、糖、ステロイド、又は脂質に含ませることができる。例えば、天然化合物(ヒストン、プロタミン、スペルミン、スペルミジン、及び可動性の高い基を有する蛋白質など)、合成カチオン性化合物(DEAE-デキストラン、ポリブレン、ポリリジン、ポリヒスチジン、ポリペプチド、ポリアミドアミンカスケードポリマーもしくはデンドリマー、リポポリアミン、及びポリエチレンイミンなど)、及びカチオン性脂質又はカチオン性リポソーム製剤(トランスフェクタム(R)(Promega)、ドータップ(R)(Roche)、ヒュージーン6(R)(Roche)、エックストリームジーンQ2(R)(Roche)、ジーンジェイマー(R)(Stratagene)、ジーンポーター(R)(Gene Therapy Systems)、イフェクテン(R)(Quiagen)、スーパーフェクト(R)(Quiagen)、リポフェクチン(LIPOFECTIN)(R)(Invitrogen)、リポフェクトエース(R)(Invitrogen)、リポフェクタミン(R)(Invitrogen)、リポフェクタミン2000(R)(Invitrogen)、LipoTrustTM(北海道システムサイエンス))などを挙げることができる。特に好適には、カチオン性リポソーム製剤とともに使用することができる。
【0033】
miR-7発現プラスミドを含むベクターを導入する宿主細胞は、プロモータの種類にもよるが、哺乳類細胞が好ましく、より好ましくは、マウスもしくはラット等の齧歯類又は他の動物(例えば、ヤギもしくはウシのような他の哺乳動物又は鳥類)、霊長類及び非霊長類等に由来する細胞が挙げられる。ヒト細胞としては、形質転換細胞が安定に培養できるものであれば特に限定されず、例えば、リンパ球、造血細胞、肝細胞、心臓細胞、血管内皮細胞、脾臓細胞や各種腫瘍細胞が挙げられる。各種腫瘍細胞としては、肺癌、肝臓癌、神経膠芽腫、骨髄腫、胃癌、膵臓癌、脳腫瘍、大腸癌、腎癌、膀胱癌、卵巣癌、子宮頸癌、前立腺癌及び白血病等由来の細胞が挙げられる。特に肺癌由来の細胞が好ましい。肺癌としては、いずれの組織型の肺癌であってもよいが、例えば、腺癌、扁平上皮癌、大細胞癌、大細胞神経内分泌癌及び腺扁平上皮癌などの非小細胞癌並びに小細胞癌が挙げられる。好ましい細胞の具体的な例としては、ヒト腎臓由来HEK293細胞、ヒト子宮頸癌由来Hela細胞、ヒト結腸癌由来CACO-2細胞、ヒト白血病T細胞由来Jurkat細胞、ヒト肺癌由来PC-9やRPC-9細胞、H3255やH1975細胞等が挙げられ、特に好ましくはヒト肺癌由来PC-9やRPC-9細胞、H3255やH1975細胞が挙げられる。
【0034】
本発明は、本発明のmiR-7発現プラスミドを含む抗腫瘍剤にも及ぶ。本発明の抗腫瘍剤は、分子標的薬に対して耐性を持つ腫瘍、特に分子標的薬に対して耐性を持つ肺癌に対しても治療効果を発揮すると考えられる。
【実施例】
【0035】
本発明の理解を助けるために、参考例において、本発明を完成するに至った経緯を説明し、さらに実施例、実験例を示して具体的に本発明を説明するが、本発明はこれらの実施例、実験例に限定されるものでないことはいうまでもない。
【0036】
(参考例)miR-7を発現するのに有効なDNA配列の検索
背景技術の欄でも示したように、EGFRのリン酸化部位を効率的に阻害する分子標的薬に対する臨床的、理論的に証明されている耐性について、耐性細胞おけるEGFR依存性が持続されていることが、イムノブロッティングの結果より予測された。したがって、EGFRの発現自体を効率的に抑制することができれば、ふたたび腫瘍縮小効果が得られると考えた。micro RNAは、標的となるmRNAをRNAレベルで抑制することにより、結果的に蛋白質の発現量を制御することは公知であり、miR-7とEGFRの関係についても公知である(非特許文献4−6)。本発明者らは、さらに検討を重ね、EGFRを効率的に抑制するmicro RNAをin silicoで予測し、ヒトEGFRの3'UTR領域においてmiR-7とマッチする箇所を確認した(図2参照)。さらに検討を重ね、miR-7を発現するのに有効なDNA配列を検索したところ、ヒトDNA配列内に存在する、配列表の配列番号1に示す配列を見出した。
【0037】
(実施例1)miR-7発現プラスミドの作製
上記の参考例により見出したmiR-7の発現効率にかかわると考えられるイントロン配列より選択されるポリヌクレオチドを汎用型の発現ベクターに挿入し、miR-7発現プラスミドの作製について検討した。その結果、配列番号4に示す塩基配列の5'末端及び3'末端に、各々下線で示した4個のヌクレオチドを含む配列からなるポリヌクレオチド(配列番号12)をプラスミドベクターに導入することで、効果的にmiR-7が発現しうることを確認した。
【0038】
CTGACCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACGTGTT(配列番号12)
【0039】
本実施例において、汎用型の発現ベクターは、市販のpSilencerTM4.1- CMV neo(Ambion)を用いた。市販のプラスミドベクターに導入するポリヌクレオチドは、配列表の配列番号1に示す塩基配列からなるポリヌクレオチドを鋳型とし、以下の配列番号5及び6を用いてPCRの手法により増幅を行ない、作製した。作製したポリヌクレオチドのプラスミドベクターへの導入方法そのものは、汎用的な方法に従った。作製したmiR-7発現プラスミドの概要を図5に示した。
【0040】
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【0041】
(実験例1)細胞へmiR-7発現プラスミドの導入効果
ヒト肺腺癌細胞株PC-9の分子標的薬耐性株であるヒト肺腺癌細胞株RPC-9(以下、「耐性株RPC-9」という。)を用いて、実施例1で作製したプラスミドの効果をin vitroで確認した。in vitroでの、実験フローを図6に示した。
【0042】
実施例1で作製したmiR-7発現プラスミドについて、耐性株RPC-9への導入効果を定量的PCRにより確認した。各細胞を70%コンフルエントにした後にトリプシンで処理し、約10×105個/mLの細胞に対し、48時間後に核酸導入試薬LipotrustTM EX(北海道システムサイエンス)のプロトコルに従い、リポソームに導入されたプラスミドを細胞溶液10mLあたり24μgトランスフェクションし、当該プラスミドを細胞へ導入した。37℃下で細胞の培養を継続し、24時間後に細胞を回収した。回収した細胞を、miR-7発現解析に用いた。定量的PCRにはTaqMan法(Applied Biosystems)を用いた。定量的PCRの内部標準としてU44を用いて、導入されたmiR-7発現量を解析した。比較対照用のコントロールプラスミドとして、市販のpSilencerTM4.1- CMV neo(Ambion)(発現しても蛋白に変化をきたさないことが分かっているsiRNAが導入されたもの(http://www.ambion.com/techlib/misc/vectors/4.1_cmv_neo.html))を用いた。
【0043】
その結果、比較対照用のコントロールプラスミドを導入した場合と比較して、本実施例のmiR-7発現プラスミドの場合は、miR-7が約30〜35倍程度強発現することが証明された(表1、図7)。
【0044】
【表1】

【0045】
(実験例2)miR-7発現プラスミドの各細胞への細胞死誘導効果
実施例1で作製したmiR-7発現プラスミドについて、ヒト肺腺癌細胞株PC-9及び耐性株RPC-9に及ぼす細胞死誘導効果を顕微鏡検鏡及び細胞数のカウントにより確認した。各細胞を70%コンフルエントにした後にトリプシンで処理し、約10×105個/mLの細胞に対し、48時間後にLipotrustTM EX(北海道システムサイエンス)のプロトコルに従いリポソームに導入されたプラスミドを、細胞溶液10mLあたり24μgトランスフェクションした。37℃下で培養を継続し、72時間にトリプシンで細胞を回収し、トリパンブルー染色で細胞数をカウントした。
【0046】
その結果、miR-7発現用ベクターを導入した場合に、コントロールに比べて細胞死誘導効果が明らかに優れていることが確認された(図8−10)。
【0047】
(実験例3)細胞におけるmiR-7発現プラスミドの抗EGFR-3'UTR作用の確認
ヒト肺腺癌細胞株(耐性株)RPC-9におけるmiR-7発現プラスミドの抗EGFR-3'UTR作用を、ルシフェラーゼアッセイにより確認した。miR-7の標的であるEGFR-3'UTRが阻害されることによって蛍光が阻害されるルシフェラーゼ発現ベクターを構築し、実施例1で作製したプラスミドをルシフェラーゼ発現ベクターに作用させ、ルシフェラーゼの発光度によりEGFR-3'UTRの作用へ及ぼす影響を調べた(図11参照)。ルシフェラーゼの発光は、デュアル-ルシフェラーゼ定量システム(ホモジニアス長時間発光タイプDual-GloTM Luciferase Assay System)により確認した(図12)。その結果、miR-7発現ベクターをRPC-9細胞株にトランスフェクトすると、ルシフェラーゼ活性は阻害され、miR-7が確かにEGFR-3'UTRを阻害することが証明された(図13)。
【0048】
(実験例4)miR-7発現プラスミドによる蛋白質の発現抑制効果
イムノブロッティングにより、miR-7発現プラスミドによるヒト肺腺癌細胞株PC-9及び耐性株RPC-9における蛋白質の発現抑制効果を確認した。イムノブロッティングは、ECL法(GE Healthcare社)により行なった。具体的には、Ichihara, E., K. Ohashi, et al. (2009). "Effects of vandetanib on lung adenocarcinoma cells harboring epidermal growth factor receptor T790M mutation in vivo." Cancer Res 69(12): 5091-5098.のimmunoblottingの項に示す方法により行なった。その結果、miR-7発現プラスミドが導入された細胞では、EGFRの抑制と、その下流の最も重要な蛋白であるAKTのリン酸化が抑制されることを確認した(図14)。
【0049】
以上により、実施例1で作製したmiR-7発現プラスミドは、in vitroにおいてEGFR発現抑制効果を持つことが明らかとなった。
【0050】
(実験例5)in vivoでのmiR-7発現プラスミドによる抗腫瘍効果の確認
免疫不全マウスを用いて、実施例1で作製したmiR-7発現プラスミドによる抗腫瘍効果をin vivoで確認した。7週齢の雌免疫不全マウスに、耐性株RPC-9を皮下注射し、約1週間で皮下に測定可能な腫瘍を形成させる異種移植(xenograft)モデルを樹立した(図15)。これに対し、実施例1で作製したmiR-7発現プラスミド各々3μg相当をカチオニックリポソームを用いて直接注入し、その抗腫瘍活性を測定した。その結果、実験系においては週1回の投与を2回投与するのみで60%のマウスに腫瘍の完全消失を得た(図16、17)。
【0051】
以上により、臨床上問題とされている肺腺癌EGFR分子標的薬耐性モデルにおいて、本発明のmiR-7発現プラスミドは、強力な抗腫瘍効果を有することをin vivoで証明することができた。
【0052】
(実験例6)miR-7発現プラスミドの各細胞への細胞増殖抑制効果
実施例1で作製したmiR-7発現プラスミドについて、ヒト肺腺癌細胞株H3255及び分子標的薬耐性株であるヒト肺腺癌細胞株H1975(以下、「耐性株H1975」という。)に及ぼす細胞増殖抑制効果を顕微鏡検鏡及び細胞数のカウントにより確認した。ヒト肺腺癌細胞株H3255はEGFR exon 21の変異(L858R point mutation)を持つ細胞株であり、分子標的薬ゲフィチニブ高感受性株であることが分かっている。また耐性株H1975は、EGFR exon 21の変異(L858R point mutation)を持つが、T790M変異が加わることにより、分子標的薬への耐性を獲得したものである。H3255細胞およびH1975細胞を用いた以外は、実験例2と同様の手法により実験を行った。
【0053】
その結果、miR-7発現用ベクターを導入した場合に、コントロールに比べて細胞増殖抑制効果が明らかに優れていることが確認された(図18,19)。
【0054】
(実験例7)miR-7発現プラスミドによる蛋白質の発現抑制効果
イムノブロッティングにより、実施例1で作製したmiR-7発現プラスミドによるヒト肺腺癌細胞株H3255及び耐性株H1975における蛋白質の発現抑制効果を確認した。H3255細胞およびH1975細胞を用いた以外は、実験例4と同様の手法により実験を行った。
【0055】
その結果、miR-7発現プラスミドが導入された細胞では、EGFRの抑制と、その下流の最も重要な蛋白であるAKTのリン酸化が抑制されることを確認した(図20)。実施例1で作製したmiR-7発現プラスミドは、in vitroにおいて、EGFR exon 21の変異を持つ細胞に対してEGFR発現抑制効果を持つことが明らかとなった。
【0056】
(実験例8)n vivoでのmiR-7発現プラスミドによる抗腫瘍効果の確認
免疫不全マウスを用いて、実施例1で作製したmiR-7発現プラスミドによる抗腫瘍効果をin vivoで確認した。異種移植(xenograft)モデルの樹立に、耐性株H1975を用いた以外は、実験例5と同様の手法により実験を行った。
【0057】
その結果、臨床上問題とされている肺腺癌EGFR分子標的薬耐性モデルにおいて、本発明のmiR-7発現プラスミドは、強力な抗腫瘍効果を有することをin vivoで証明することができた(図21,22)。
【産業上の利用可能性】
【0058】
EGFRを標的とした分子標的薬は、EGFR依存性の高い肺腺癌において劇的な効果をもたらすが、上記背景技術の欄で示した如く、分子標的薬に対して耐性を生じることが分かっている。以上詳述したように、本発明のmiR-7発現プラスミドにより、EGFRのmRNAレベルが抑制され、当該分子標的薬に対する耐性を克服することが可能である。また、従来型の分子標的薬のターゲットは、EGFRのチロシンキナーゼ、即ち蛋白質であるのに対し、本発明のmiR-7発現プラスミドは、EGFRにおけるmRNAレベルで抑制し、蛋白質の発現を抑制することをターゲットとする。このため、単に蛋白質の変異による耐性克服のみならず、従来療法との併用によって、さらに強い臨床効果を得ることも期待される。肺癌は日本だけでも年間罹患率は7万人を超え、年間死亡数も6万人を超えている。そのうちの半数が肺腺癌であり、かつその半数がEGFR変異を有するが、本発明において証明されている効果は、国内だけでも少なくとも年間約2万人に及ぶものと考えられる。また、EGFRは種々の固形癌に対する重要なシグナルとなるため、固形癌に広く応用できることが期待される。
【特許請求の範囲】
【請求項1】
配列表の配列番号1に示す塩基配列から選択される20〜220塩基長のオリゴ(又はポリ)ヌクレオチドであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むことを特徴とする、miR-7発現プラスミド。
【請求項2】
miR-7をコードするDNAが、以下に示すいずれかの塩基配列からなる請求項1に記載のmiR-7発現プラスミド:
1)TGGAAGACTAGTGATTTTGTTGT(配列番号2);
2)上記配列番号2に示す塩基配列のうち、1〜3個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【請求項3】
miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる請求項1又は2に記載のmiR-7発現プラスミド:
1)CTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCA(配列番号3);
2)上記配列番号3に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【請求項4】
miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる請求項1〜3のいずれか1に記載のmiR-7発現プラスミド:
1)CCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACG(配列番号4);
2)上記配列番号4に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【請求項5】
配列表の配列番号1に示す塩基配列から選択されるオリゴ(又はポリ)ヌクレオチドであって、以下の配列番号5に示す塩基配列からなるオリゴヌクレオチドをフォワードプライマーとし、以下の配列番号6に示すオリゴヌクレオチドをリバースプライマーとして増幅させて得られるオリゴ(又はポリ)ヌクレオチドを含む、請求項1〜4のいずれか1に記載のmiR-7発現プラスミド。
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【請求項1】
配列表の配列番号1に示す塩基配列から選択される20〜220塩基長のオリゴ(又はポリ)ヌクレオチドであって、少なくともmiR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチド又はその相補配列からなるオリゴ(又はポリ)ヌクレオチドを含むことを特徴とする、miR-7発現プラスミド。
【請求項2】
miR-7をコードするDNAが、以下に示すいずれかの塩基配列からなる請求項1に記載のmiR-7発現プラスミド:
1)TGGAAGACTAGTGATTTTGTTGT(配列番号2);
2)上記配列番号2に示す塩基配列のうち、1〜3個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【請求項3】
miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる請求項1又は2に記載のmiR-7発現プラスミド:
1)CTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCA(配列番号3);
2)上記配列番号3に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【請求項4】
miR-7をコードするDNAを含むオリゴ(又はポリ)ヌクレオチドが、以下に示すいずれかの塩基配列からなる請求項1〜3のいずれか1に記載のmiR-7発現プラスミド:
1)CCTGGTGGCGAGGGGAGGGGGGTGGTCCTCGAACGCCTTGCAGAACTGGCCTGGATACAGAGTGGACCGGCTGGCCCCATCTGGAAGACTAGTGATTTTGTTGTTGTCTTACTGCGCTCAACAACAAATCCCAGTCTACCTAATGGTGCCAGCCATCGCAGCGGGGTGCAGGAAATGGGGGCAGCCCCCCTTTTTGGCTATCCTTCCACG(配列番号4);
2)上記配列番号4に示す塩基配列のうち、1〜10個のヌクレオチドが、置換、欠失、付加若しくは挿入されてなる塩基配列;
3)上記1)又は2)に示す塩基配列の相補配列。
【請求項5】
配列表の配列番号1に示す塩基配列から選択されるオリゴ(又はポリ)ヌクレオチドであって、以下の配列番号5に示す塩基配列からなるオリゴヌクレオチドをフォワードプライマーとし、以下の配列番号6に示すオリゴヌクレオチドをリバースプライマーとして増幅させて得られるオリゴ(又はポリ)ヌクレオチドを含む、請求項1〜4のいずれか1に記載のmiR-7発現プラスミド。
フォワードプライマー:5'-ATTGGATCCCTGACCTGGTGGCGAGGGGA-3'(配列番号5)
リバースプライマー:5'-TTAAAGCTTAACACGTGGAAGGATAGCCA-3'(配列番号6)
【図2】


【図6】


【図7】


【図9】


【図10】


【図12】


【図13】


【図17】


【図19】


【図22】


【図1】


【図3】


【図4】


【図5】


【図8】


【図11】


【図14】


【図15】


【図16】


【図18】


【図20】


【図21】




【図6】


【図7】


【図9】


【図10】


【図12】


【図13】


【図17】


【図19】


【図22】


【図1】


【図3】


【図4】


【図5】


【図8】


【図11】


【図14】


【図15】


【図16】


【図18】


【図20】


【図21】


【公開番号】特開2011−188849(P2011−188849A)
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願番号】特願2010−241627(P2010−241627)
【出願日】平成22年10月28日(2010.10.28)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願日】平成22年10月28日(2010.10.28)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
[ Back to top ]

