抗腫瘍効果増強活性測定法
【課題】癌治療が直面する困難を克服するため、バイオケミカル・モジュレーションを利用した抗癌剤の開発、及び、無数に存在する抗癌剤と他の薬剤との組合せにつき、臨床応用に反映する上で、より正確で且つ感度のよい、測定系の開発。
【解決手段】癌患者からの切除して得られた癌細胞や癌組織の三次元初代培養細胞及び/又は三次元初代培養組織を使用した三次元初代培養物実験評価系による測定法であり、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行うもので、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することで、的確且つ感度良く、モデユレーターの抗癌剤に対する効果増強活性を測定できる。
【解決手段】癌患者からの切除して得られた癌細胞や癌組織の三次元初代培養細胞及び/又は三次元初代培養組織を使用した三次元初代培養物実験評価系による測定法であり、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行うもので、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することで、的確且つ感度良く、モデユレーターの抗癌剤に対する効果増強活性を測定できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、三次元初代培養組織又は三次元初代培養細胞実験評価系によるバイオケミカル・モジュレーターの各種抗癌剤に対する抗腫瘍効果増強活性の測定方法に関する。
【背景技術】
【0002】
本邦の抗癌剤のうち、患者のQOLを考慮した経口抗癌剤の開発が5-フルオロウラシル(5-fluorouracil: 5-FU)を代表とするフッ化ピリミジン系代謝拮抗剤を中心に進んでいる。
5-FUは、ウラシルが正常組織と比較して腫瘍組織に選択的に取り込まれやすいことから、現在もさまざまな固形腫瘍の治療に用いられている。また、現在でもなお、5-FUの抗腫瘍効果増強と副作用の軽減を目指したバイオケミカル・モジュレーター(Biochemical Modulator)の創薬開発が試みられている。
【0003】
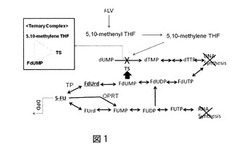
図1に示すように、5-FUの殺腫瘍細胞機序は主に
1)5-FUの活性代謝体FUTPのRNAへの取り込まれた後RNA機能障害、
2)チミジル酸合成酵素(thymidylate synthase: TS)阻害によりDNA合成阻害
を引き起こすというものである。
この2)の機序において、5-FUはフルオロデオキシウリジン(fluorodeoxyuridine: FdUrd)からフルオロデオキシウリジン モノフォスフェート(fluorodeoxyuridine monophosphate: FdUMP)に代謝され、還元型葉酸(locovorin: LV)の代謝物である5,10-CH2-THF(5,10-methylenete trahydroforate)と共にTSと共有結合し強固な三者結合体を形成し、dUMP(deoxyuridine monophosphate)からdTMP(deoxythymidine monophosphate)への酵素変換作用を阻害する。その結果、腫瘍中のdTMP及びdTTPを枯渇させ、DNA合成阻害を引き起こす。
【0004】
この作用は5-FUの代謝物であるFdUrd単独でも強い阻害作用がある。なお、細胞内に取り込まれた5-FUはまず5-FUの分解反応の律速酵素であるDPD(dihydropyrimidine dehydrogenase)により分解をうけ、最終的にフッ化アラニン(F-β-Ara)へと分解する。
5-FU単剤で使用された場合の奏功率は、20%以下と効力が弱く、このため、臨床効果を改善すべく、5-FUの効力を高めるバイオケミカル・モジュレーターが開発されてきたが、それらのうち、最も臨床効果が優れているS-1(ティーエスワン: TS-1)が近年本邦で開発された。
【0005】
S-1は、5-FUの血中濃度を最大限に高め、且つ、それに付随して増大する消化管毒性を軽減させるために、5-FUのマスク化合物であるテガフール(FT)に、DPD阻害剤であるギメラシル(CDHP: 5-chloro-2,4-dihydroxypyridine)とOPRT(Orotate phosphoribosyl transferase)阻害剤であるオテラシルカリウム(Oteracil potassium: Oxo)を特異のモル比(1:0.4:1)で配合した経口抗癌剤である。
このS-1のバイオケミカル・モジュレーション作用の一つは、肝臓に多く分布するDPDをCDHPにより可逆的に阻害することで血中及び腫瘍中の5-FUを高濃度に維持させ抗腫瘍効果を増強すると考えられている。
【0006】
また、5-FUの臨床効果を改善すべく、バイオケミカル・モジュレーター研究の中で、大腸癌において、LVと5-FUの併用療法が単剤よりすぐれた臨床効果が発揮されたとの報告があり、大腸癌の化学療法の標準治療となっている。
【0007】
しかし、このような5-FUの効果を高める創薬開発にも関らず、無効例が多く、癌患者における5-FUに対するBiochemical Modulation (BM又はBCM)効果を、投与前に予測する事が出来れば、不用な投与による患者の不利益を回避できる。
また、新規のBM効果薬の創薬開発において、高感度で簡便な抗腫瘍増強作用を定量できるin vitroの系の開発により、より強力で奏功率の高いBM効果剤が生み出されることが期待できる。
【0008】
後者において、現在のBM理論に基づく、抗癌剤の抗腫瘍効果の測定方法は、担癌実験小動物を使用したin vivo アッセイが主体である。実際のアッセイの概要は、癌細胞を免疫不全状態の実験小動物体内に植え付けたあと、候補化合物を投与し、同実験小動物体内に生着し、増殖した腫瘍の減少や、個体の生存率などで抗腫瘍効果を検討する。したがって、本in vivo実験評価系において、検討できる候補化合物は少数に限られることとなり、ケミカルライブラリー等の抗腫瘍増強作用が未知の化合物などのランダムスクリーニングやさらに高速で大量測定可能なハイスループットスクリーニング(HTS)などへ展開可能な測定系がないのが現状である。
【0009】
In vitro 実験評価系において、BM効果活性を含む抗癌剤の抗腫瘍効果を測定する場合、ヒト実験室標準腫瘍細胞株を利用したアッセイ系が報告されている。具体例をあげると、CDHPによる5-FUの抗腫瘍活性(IC50:50% inhibition concentration)に関しては、5-FU単独によるIC50値を、CDHP併用により2.3倍程度しか増強できない。一方、癌患者から手術などの切除した腫瘍細胞や組織を利用した初代培養系による測定方法も報告されているが、CDHP併用により5-FUの抗腫瘍活性(5-FU単独によるIC50値)を増強したとの報告もいまだなされていない。
【0010】
また、LVについて、同様に、実験室標準腫瘍細胞株を使用したアッセイでは、5-FUの抗腫瘍効果(IC50値)をLV併用した場合、単独添加に比べた増強効果は10倍以下であり、既存のアッセイ系の感度が非常に低い。
したがって、抗癌剤治療の臨床効果予測に、あるいは、創薬開発の実践においても、担癌実験小動物を使用したアッセイに比べ、既存のin vitroアッセイ系は信頼性が低く、未だ、代替アッセイとして実用化されていないのが現況である。
【0011】
本邦では、癌患者に、S-1などのBM作用がある抗癌剤を投薬前に抗腫瘍効果を予測するin vitroからin vivoまでの基礎研究や臨床研究など、多方面から研究され、報告されてきた。とりわけ、S-1や5-FU療法の効果予測を実現化するために、5-FUの代謝経路の律速酵素の遺伝子やタンパク発現と臨床効果との相関性に関する研究は、数多く報告されてきたが、発表ごとに、あるいは、報告者により、さまざまな結論が出され、内容に大きな乖離があり、どの因子が効果を予測できるか特定するに至っていない。また、癌患者から取り出した腫瘍組織や腫瘍細胞を使用した既存の初代培養系における測定系においても、活性の増強を検出した報告がないままである。
【0012】
生体内では細胞や組織は三次元的な環境下で増殖や維持が図られていることから、近年、三次元培養法の開発が進められてきた。こうした中で、動物組織に損傷を与えることなく容易に包埋が可能で、且つ、培養後、組織に損傷を与えることなく容易に回収あるいは継代することが可能な動物組織培養用担体並びにこれを用いる動物組織培養方法が提供されている〔特許文献1:特許第3190145号〕。また、初代癌細胞や初代癌細胞塊の増殖性に優れ、該細胞や細胞塊に損傷を与えることなく容易に包埋が可能で、且つ培養後、該細胞や該細胞塊に損傷を与えることなく容易に回収あるいは継代することが可能な初代癌細胞及び初代癌細胞塊培養用担体、およびこれを用いる初代癌細胞や初代癌細胞塊の培養方法も提供されている〔特許文献2:特許第3190147号〕。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特許第3190145号
【特許文献2】特許第3190147号
【発明の概要】
【発明が解決しようとする課題】
【0014】
癌治療が直面する困難を克服するため、S-1(TS-1)を含めてバイオケミカル・モジュレーション(Biochemical Modulation: BM)を利用した抗癌剤の開発が求められている。Biochemical Modulationとは、ある抗癌剤(Effctor)に他の薬剤(Modulator)を併用することにより、生化学的あるいは薬理学的に明らかな作用機序から、effectorの抗腫瘍効果の増強や副作用の軽減を図り、理論的に裏付けされた併用療法の事を指すものである。しかし、創薬開発の上流において、ModulatorとEffctorの組み合わせなど、その可能性は無数に存在し、また現況では、感度や実施可能被試験検体化合物数などの点において、新規作用機序などの未知のBiochemical Modulationの発見や開発を目的とした探索研究レベルで、開発競争に打ち勝つ、満足できる測定系がない。また臨床治療効果においても、患者個別にBiochemical Modulation効果を予測可能な測定系がないのが現状である。もし、癌患者個別に抗癌剤の効果を、投与前に予測する事が出来れば、不要な投与による癌患者の不利益を軽減でき、また異なる抗癌剤を選択することも可能となる。
【課題を解決するための手段】
【0015】
本発明者等は、上記課題を解決すべく鋭意検討したところ、抗癌剤の抗腫瘍効果を高めるBM作用がある抗癌剤のin vitroにおける実験評価系を開発し、特定の抗癌剤だけでなく、BM作用がある抗癌剤に広く適用すべく、三次元初代組織培養系を応用すれば、抗癌剤に対するバイオケミカル・モデユレーターの抗腫瘍増強効果を、簡便かつ高感度で、精度よく定量できることを見出すのに成功し、三次元初代組織培養測定系を発明した。
本発明者等は、癌患者からの切除癌組織の三次元初代組織培養物を使用することにより、実際に癌臨床で投薬治療される抗癌剤であって、BM作用がある抗癌剤において、その感受性増強効果を検出することが可能であることを確認した。本発明は、かかる知見に基づいて完成したものである。
【0016】
本発明は、次なるものを提供している。
〔1〕三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織を使用した三次元初代培養物実験評価系による測定法であり、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行うもので、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することを特徴とするモデユレーターの抗癌剤に対する効果増強活性測定法。
〔2〕エフェクター存在下に、
(a)モジュレーターが存在する場合、
並びに、
(b)モジュレーターが存在しない場合、
の両方のそれぞれで、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付すことを特徴とする上記〔1〕に記載の測定法。
〔3〕抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、活性測定を行うものであることを特徴とする上記〔1〕又は〔2〕に記載の測定法。
〔4〕初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、次に培地をゾル状態とした後(ゾル化した後)、活性測定を行うものであることを特徴とする上記〔1〕〜〔3〕のいずれか一に記載の測定法。
〔5〕初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生存活性または生細胞数の測定を行うものであることを特徴とする上記〔1〕〜〔4〕のいずれか一に記載の測定法。
〔6〕生存活性の測定試薬が、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行うものであることを特徴とする上記〔4〕又は〔5〕に記載の測定法。
〔7〕抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行うものであることを特徴とする上記〔6〕に記載の測定法。
〔8〕三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織を混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする上記〔1〕〜〔7〕のいずれか一に記載の測定法。
〔9〕三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織と細胞培養用生理活性物質とを混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする上記〔1〕〜〔7〕のいずれか一に記載の測定法。
〔10〕培地をゾル状態とすること(ゾル化すること)が、三次元初代培養された初代腫瘍細胞及び/又は初代腫瘍組織を含むゲルを、ゾル−ゲル転移温度より低い温度で液体状態(ゾル状態)とするものであることを特徴とする上記〔4〕〜〔9〕のいずれか一に記載の測定法。
〔11〕エフェクターが、抗癌剤又はその生体内代謝誘導体であることを特徴とする上記〔1〕に記載の測定法。
〔12〕抗癌剤が、分子標的薬、アルキル化剤、代謝拮抗剤、植物アルカロイド、抗癌性抗生物質、プラチナ製剤、ホルモン剤及び生物学的応答調節剤からなる群から選択されたものであることを特徴とする上記〔11〕に記載の測定法。
〔13〕モジュレーターが、酵素阻害剤、ホルモン拮抗剤、受容体に対するリガンド、モノクローナル抗体を包含する抗体、サイトカイン類、細胞成長因子類、細胞成長因子阻害物質、代謝促進剤及び代謝阻害剤からなる群から選択されたものであることを特徴とする上記〔1〕に記載の測定法。
〔14〕フルオロデオキシウリジン(FdUrd)とギメラシル(CDHP)とを有効成分として含有していることを特徴とする抗癌剤。
〔15〕タキソールとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
〔16〕ゾメタとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
【発明の効果】
【0017】
本発明の測定法により、抗癌剤の抗腫瘍増強活性の的確且つ感度の良い検出が可能となり、抗癌剤に対するバイオケミカル・モジュレーターの新規な増強効果を感度良く見出すことができる。さらに、癌患者から手術などで切除して得られた腫瘍細胞や腫瘍組織の初代培養系を使用することにより、投薬前に抗癌剤の抗腫瘍効果の予測が可能となる。また、担癌実験動物から得た腫瘍組織を初代培養することにより、検体のランダム化が図れ、多くの被検体の使用が可能となり、実施期間の短縮化また増強活性の強さから、感度良く、未知の陽性検体を拾い上げが可能であるとの利点を発揮する。抗癌剤とそのモジュレーターの間の殺細胞効果への増強効果を感度良く検出でき、しかも患者の個別化も図れることから、投与前の事前の効果予測にも応用可能である。
本発明の測定法は、バイオケミカル・モジュレーターのうち、副作用軽減に対する効果予測にも有用であり、正常組織を初代培養することにより、抗癌剤に対する毒性やさらに毒性増強する効果なども感度良く検出できるし、患者個別レベルでの予測も可能にし、ヒトへの感受性予測ばかりでなく、副作用の面でも予測可能とするものである。
本発明のその他の目的、特徴、優秀性及びその有する観点は、以下の記載より当業者にとっては明白であろう。しかしながら、以下の記載及び具体的な実施例等の記載を含めた本件明細書の記載は本発明の好ましい態様を示すものであり、説明のためにのみ示されているものであることを理解されたい。本明細書に開示した本発明の意図及び範囲内で、種々の変化及び/又は改変(あるいは修飾)をなすことは、以下の記載及び本明細書のその他の部分からの知識により、当業者には容易に明らかであろう。本明細書で引用されている全ての特許文献及び参考文献は、説明の目的で引用されているもので、それらは本明細書の一部としてその内容はここに含めて解釈されるべきものである。
【図面の簡単な説明】
【0018】
【図1】5-FUの代謝と抗腫瘍効果作用を説明する模式図をしめす。
【発明を実施するための形態】
【0019】
本発明は、抗癌剤の抗腫瘍効果を高めるBM作用がある抗癌配合剤のin vitroにおける実験評価系を開発し、特定の抗癌剤だけでなく、BM作用がある抗癌配合剤に広く適用できる、三次元初代組織培養系を応用している、抗癌剤に対するバイオケミカル・モデユレーターの抗腫瘍増強効果を、簡便かつ高感度で、精度よく定量することを可能ならしめる、三次元初代組織培養測定系を提供するものである。
本発明では、癌患者からの切除癌組織の三次元初代組織培養物を使用して、実際に、癌臨床で投薬治療される抗癌剤(抗癌配合剤)であって、BM作用がある抗癌剤(抗癌配合剤)において、その感受性増強効果を検出することが可能であることを確認した。
【0020】
本発明の一つの態様では、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織を使用した三次元初代培養物実験評価系による測定法が提供されているのであり、該測定法では、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行い、そして、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することを特徴とするモデユレーターの抗癌剤に対する効果増強活性測定法が提供される。
本抗腫瘍効果増強活性測定法では、(a)モジュレーターが存在する場合に得られた結果と(b)モジュレーターが存在しない場合に得られた結果とを比較することで、抗腫瘍活性増強活性を測定するもの、あるいは、評価するものであってよい。
本発明で「三次元培養」とは、ゾル−ゲル転移温度を有し、該転移温度より低い温度で可逆的にゾル状態を示すような高分子化合物を培養用の担体として使用し、必要に応じて、当該培養用担体に、細胞培養用生理活性物質を配合せしめて培養用の組成物として、それを用いて、当該培養用担体又は培養用組成物中の該高分子化合物をゲル状態にした培地中で、該ゲル物質に培養されるべき細胞及び/又は組織が包埋された状態で培養されることを意味する。
【0021】
本発明において、三次元培養には、ゾル−ゲル転移温度を有し、該転移温度より低い温度で可逆的にゾル状態を示すような高分子化合物を腫瘍細胞及び/又は初代腫瘍組織の培養用の担体として用いる。当該培養用担体は、例えば、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示すことを特徴とするものである。当該培養用担体には、細胞培養用生理活性物質を配合して、培養用の組成物として提供されることができる。上記高分子化合物の親水性部分は、上記したゾル−ゲル転移温度より低い温度で該高分子化合物が水溶性になるために必要であり、また疎水性部分は、該高分子がゾル−ゲル転移温度より高い温度でゲル状態に変化するために必要である。換言すれば、該疎水性部分間の結合がゲルの架橋点の形成のために必要である。
【0022】
上記高分子化合物中の疎水性部分間の結合、即ち、疎水性結合は、その結合力が温度の上昇と共に強くなるという性質を有するために、温度上昇と共に架橋の強さおよび架橋密度が増大し、本発明の三次元培養においては、初代腫瘍細胞及び/又は初代腫瘍組織培養時の温度(ゾル−ゲル転移温度より高い温度)でゲル化状態に変化することが可能である。また、上記疎水性結合力の温度依存性が可逆的であるという性質によって、そのゾル−ゲル転移を可逆的に起こさせることができる。一方、上記高分子化合物中の親水性部分は、前述したように、該高分子化合物が初代腫瘍細胞及び/又は初代腫瘍組織培養時の温度より低い温度(ゾル−ゲル転移温度より低い温度)で水溶性に変化するために必要であると同時に、上記温度より高い温度で疎水性結合力が増大しすぎて上記高分子化合物が凝集沈澱してしまうことを防止しつつ、含水ゲルの状態を形成するためにも必要とされるものである。
【0023】
本発明において、「ゾル状態」「ゲル状態」および「ゾル−ゲル転移温度」は、以下のように定義される。この定義については文献: Polymer Journal., 18(5), pp.411-416(1986)を参照することができる。高分子溶液(担体として使用すべき高分子溶液)1mLを内径1cmの試験管に入れ、所定の温度(一定温度)とした水浴中で12時間保持する。この後、試験管の上下を逆にした場合に、溶液/空気の界面(メニスカス)が溶液の自重で変形した場合(溶液が流出した場合を含む)には、上記所定温度において高分子溶液は「ゾル状態」であると定義する。一方、上記試験管の上下を逆にしても、上記した溶液/空気の界面(メニスカス)が溶液の自重で変形しない場合には、該溶液は、上記所定温度において「ゲル状態」であると定義する。また、上記した「所定温度」を徐々に(例えば1℃きざみで)上昇させて、「ゾル状態」が「ゲル状態」に転移する温度を求めた場合、これによって求められる転移温度を「ゾル−ゲル転移温度」と定義する(この際、「所定温度」を例えば1℃きざみで下降させ、「ゲル状態」が「ゾル状態」に転移する温度を求めてもよい。
【0024】
培養用担体において、上記ゾル−ゲル転移温度は0℃より高く、60℃以下であることが好ましく、更には4℃以上50℃以下(特に4℃以上40℃以下)であることが、初代腫瘍細胞及び/又は初代腫瘍組織の熱的損傷を防ぐ点から好ましい。このように好適なゾル−ゲル転移温度を有する高分子化合物は、当該分野で知られる化合物の中から容易に選択することができる。
三次元培養をするにあたっては、培養時の温度(b℃)と、培養終了後腫瘍細胞ないし腫瘍組織を回収あるいは単離する時の温度(c℃)との間に、上記したゾル−ゲル転移温度(a℃)を設定することが必要である。すなわち上記した3種の温度a℃、b℃、およびc℃の間にはb>a>cの関係があることが必要である。より具体的には(b−a)は1〜40℃、更には2〜30℃であることが好ましく、また(a−c)は1〜40℃、更には2〜30℃であることが好ましい。
【0025】
上述したような好適なゾル−ゲル転移温度は、例えば、培養用担体に用いられる高分子化合物中の疎水性部分と親水性部分の組成、および疎水性度、親水性度、分子量などをそれぞれ調節することによって達成することが可能である。このような疎水性部分と親水性部分とを含む高分子化合物の具体例としては、例えば、ポリプロピレンオキサイドとポリエチレンオキサイドのブロック共重合体などに代表されるポリアルキレンオキサイドブロック共重合体;メチルセルロース、ヒドロキシプロピルセルロースなどのエーテル化セルロース;キトサン誘導体(K. R. Holme. et al. Macromolecules, 24, 3828(1991));プルラン誘導体(出口茂ら、Polymer Preprints. Japan. 19, 936(1990))などの変性多糖類;ポリN-置換(メタ)アクリルアミド誘導体、ポリビニルアルコール部分酢化物、ポリビニルメチルエーテルなどに代表される温度感応性高分子と水溶性高分子化合物との結合体(例えば松田武久ら、Polymer Preprints. Japan. 39(8), 2559(1990))などがあげられるが、これらに限定されるものではない。
【0026】
培地中の上記高分子化合物の濃度は、設定されるゾル−ゲル転移温度等によっても異なるが、後述するような所定の培地との混合物中で用いる場合、一般に0.1〜30wt%の濃度、更には1〜20wt%の濃度であることが好ましい。本発明において、上述したような高分子化合物と組み合わせて用いるべき培地としては、公知の細胞培養用培地を特に制限なく使用することができる。
本発明で細胞培養用生理活性物質とは、培養中の腫瘍細胞及び/又は腫瘍組織に対し、何らかの生理活性を付与する作用を有する物質をいい、細胞増殖・分化因子、細胞接着因子等を包含する意味で用いる。細胞増殖・分化因子としては腫瘍成長因子-β(TGF-β)、血小板由来成長因子(PDGF)、線維芽細胞成長因子(FGF)、上皮成長因子(EGF)、インターロイキン群などがあげられる。これらの細胞増殖・分化因子は、上記した高分子(担体)100部(重量部、以下同じ)に対して10-7〜10-3部(更には10-6〜10-4部)程度用いることが好ましい。細胞接着因子としては、コラーゲン、フィブロネクチン、ビトロネクチン、ラミニン、ブロテオグリカン、グリコサミノグリカンなどの細胞外マトリックスやゼラチンなどがあげられる。これらの細胞接着因子は、上記した高分子(担体)100部に対して、0.01〜50部(更には0.1〜10部)程度用いることが好ましい。
【0027】
本発明で「初代腫瘍細胞及び/又は初代腫瘍組織」とは、ヒトをはじめとした動物から直接採取した腫瘍細胞(特には、悪性腫瘍細胞、すなわち、癌細胞を包含する)及び/又は腫瘍細胞を含む組織をさし、細胞核の偏在性、大きさおよび濃染性の有無などを指標として腫瘍細胞、さらには、癌細胞か否かが判定される。
本初代腫瘍細胞及び/又は初代腫瘍組織とは、例えば、癌患者の患部から切除されたヒト腫瘍細胞や切除ヒト腫瘍組織、さらには、担癌実験動物から得た腫瘍組織などが挙げられる。該腫瘍細胞は、悪性腫瘍細胞である癌細胞が包含されるし、該腫瘍組織は、悪性腫瘍組織である癌組織が包含される。
本発明では、初代培養系を使用することにより、投薬前に抗癌剤の抗腫瘍効果の予測が可能となる。また、担癌実験動物から得た腫瘍組織を初代培養することにより、検体のランダム化を図ることも可能であり、多くの被検体を使用することが可能であり、実施期間の短縮化も可能で、さらに、感度も良く、且つ、正確性が高いことから、未知の陽性検体を拾い上げることも可能である。
【0028】
本発明で「三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織」とは、上記「初代腫瘍細胞及び/又は初代腫瘍組織」を三次元培養している状態にあるもの、あるいは、該三次元培養中の培養物を、培地をゾル状態にして、簡単な回収操作を施して収穫された状態のものを意味してよい。ここで、簡単な回収操作とは、液体状態の培地から濾過、遠心などにより分離すること、得られた細胞及び/又は組織を生理食塩水、培地などですすぎ洗いすることなどで、細胞及び/又は組織に、傷害及び/又は損傷、重大な悪影響などを与えることのない穏やかな手法を指している。こうした穏やかな手法は、当該分野で当業者及びに知られており、そうした公知の手法の中から適宜選択して使用できる。
【0029】
本発明の三次元初代培養物実験評価系とは、例えば、三次元培養の状態の下で、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、活性の有無や活性の程度の測定対象となるエフェクターやバイオケミカル・モデユレーター(単に、「モジュレーター」ともいう)の影響又は作用を受けるようにしてある測定及び/又は評価を行うためのものを指していてよい。
本発明で行う三次元培養方法を、好ましい一例を示しながら、以下に記載する。
先づ、所望の培地中に、培養用担体である上記高分子化合物を、該高分子化合物のゾル−ゲル転移温度よりも低い温度で均一に溶解する。この時に、適宜、上記した細胞培養用生理活性物質も同時に溶解することも可能である。次に該高分子化合物の培地溶液中に初代腫瘍細胞及び/又は初代腫瘍組織を混合分散させる。次にこの混合物の温度を上記ゾル−ゲル転移温度より高く上げることによって、該混合物を速やかに且つ容易にゲル化させることが可能である。かくして、ゲル化された高分子化合物を含有している培地中に細胞及び/又は組織は包埋されることとなる。こうしてゲル化された培地中で包埋された状態で当該初代腫瘍細胞及び/又は初代腫瘍組織は培養されるし、エフェクターやモデユレーターの作用や影響を受けることとなる。
【0030】
特に、本発明の三次元初代培養物実験評価系では、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合、の両方のそれぞれで、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付すことを行う。これにより、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織は、それらが損傷なく、及び/又は、傷害を受けることなく、その活性の測定に付されていることとなる。
ここで、「そのままの三次元培養の状態」とは、ゲル化された培地中で包埋された状態で当該初代腫瘍細胞及び/又は初代腫瘍組織が培養されたり、エフェクターやモデユレーターやその他の試薬などの作用や影響を受けることとなる状態を意味してよい。
【0031】
一つの典型的な態様では、抗腫瘍活性増強活性測定は、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、活性測定を行う。例えば、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、次に培地をゾル状態とした後(ゾル化した後)、活性測定を行うものである。初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生存活性または生細胞数の測定を行う。生存活性の測定試薬が、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、例えば、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行う。抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行う。
【0032】
上記ゲル中で培養された初代腫瘍細胞及び/又は初代腫瘍組織を回収あるいは該ゲルから分離する方法としては、最も簡便で容易な方法では、該ゲルのゾル−ゲル転移温度より低く温度を下げることによって該ゲルをゾル状態にして、該細胞及び/又は組織懸濁液をつくる手法が挙げられる。この手法によれば、遠心分離などによって該培養腫瘍細胞及び/又は培養腫瘍組織を該ゲルから全く損傷なく分離することができる。
【0033】
本発明で、エフェクターとは、悪性腫瘍細胞及び/又は悪性腫瘍組織に作用して、抗腫瘍活性を発揮する化合物分子を意味し、典型的には、悪性腫瘍細胞及び/又は悪性腫瘍組織に対して、増殖抑制、細胞傷害活性、アポトーシス誘起活性、死滅作用、細胞毒性、タンパク質合成阻害作用、DNAやRNAなどの核酸合成阻害作用などからなる群から選択された活性のいずれかを示すなどして抗腫瘍活性を示すものが挙げられる。一つの典型的な態様では、当該エフェクターとしては、抗癌剤又はその生体内代謝誘導体などが挙げられる。
抗癌剤は、抗癌作用を示すものが包含され、当該分野で知られたもの、さらに当該分野で候補化合物として知られているものだけでなく、新規に発見されたもの、及び/又は、新規に合成されたもの、天然物由来のものなども包含されてよい。本抗癌剤としては、例えば、分子標的薬、アルキル化剤、代謝拮抗剤、植物アルカロイド、抗癌性抗生物質、プラチナ製剤、ホルモン剤、生物学的応答調節剤などが包含される。
【0034】
分子標的薬とは、癌細胞の持つ特異的な性質を分子レベルでとらえ、それを標的として効率よく作用するようにつくられた薬であり、癌細胞を狙って作用するため、副作用をより少なく抑えながら治療効果を高めると期待されている。アルキル化剤は、細胞障害性抗癌剤の代表的な薬であり、例えば、アルキル化剤はアルキル基などの原子団を癌細胞のDNAに付着させて、らせん状にねじれた二本のDNAを異常な形で結合させて、DNAのコピーができないようにするなどの働きを有するとされる。代謝拮抗剤は、典型的な例では、癌細胞が分裂・増殖する際に、核酸の材料となる物質と化学的構造が似ている物質でDNAの合成を妨げ、癌細胞の代謝を阻害して、増殖を抑制するなどの抗癌剤が挙げられる。また、代謝拮抗剤は、細胞分裂の過程で必要とされるタンパク質などの合成に必要な酵素、主としてDNA合成に必要な酵素など働きを阻害することにより、細胞分裂をできなくしたり、DNA合成ができなくなるようにして、癌細胞の増殖を抑えるものも含まれる。
【0035】
植物アルカロイドとしては、強い毒性のある植物成分を応用した抗癌剤が挙げられる。例えば、ビンクリスチンやドセタキセルなどの微小管阻害剤、イリノテカンやエトポシドなどのトポイソメラーゼ阻害剤などが包含される。抗腫瘍性抗生物質は、微生物が産生する抗生物質あるいはそれを基礎に開発されたもので、例えば、癌細胞の細胞膜を破壊したり、DNAまたはRNAの複製・合成を阻害する働きを有するものが挙げられる。プラチナ製剤は、プラチナ(白金)の化合物又は錯体を活性成分とするもので、アルキル化剤などと同様に、DNAの二重らせん構造に結合してDNAの複製を阻害するほか、癌細胞を自滅(アポトーシス)へ導くはたらきもあるとされている。ホルモン剤は、癌の種類によっては、特定のホルモンによって増殖が促進されることがあり、そのホルモンの分泌が止まると、癌病巣も縮小するとの仕組みを利用して癌の増殖を抑える治療法を利用するもので、例えば、乳癌の治療などでは、特に効果が得られている。
【0036】
ホルモンは、反作用をもつ別のホルモンによって分泌が促進されたり、抑制されたりする性質があり、そのため、男性ホルモンのテストステロンにより増殖が促進される前立腺癌の治療にはエストロゲンなどの女性ホルモン剤が用いられ、反対にエストロゲンにより増殖が促進される乳癌の治療では、それを抑える男性ホルモン剤が用いられる。生物学的応答調節剤は、体内の生物学的反応を引き出して治療を行う薬で、体の自然な防御システムである免疫反応などを治療に結び付けようとするものも包含されるもので、例えば、免疫調節剤なども含まれる。これには、免疫賦活剤(免疫システムを刺激して、そのはたらきを活性させる薬)、インターフェロンなどのサイトカインも含まれる。特定の癌に対する免疫を高めるものだけでなく、免疫作用全般の向上を狙って使用されるものも包含される。癌細胞の特定の遺伝子が発現するように誘導したり、リンパ球の一種であるナチュラルキラー(NK)細胞のはたらきを活性化したり、患者の免疫反応を間接的に引き起こしたりして、癌細胞を攻撃するものなども含まれる。
【0037】
抗癌剤としては、当該分野で様々なものが知られており、代表的なものとしては、例えば、イブリツモマブチウキセタン、イマチニブ、エルロチニブ、ゲフィチニブ、ゲムツズマブオゾガマイシン、スニチニブ、セツキシマブ、ソラフェニブ、タミバロテン、トラスツズマブ、トレチノイン、パニツムマブ、ベバシズマブ、ベバシズマブ、ボルテゾミブ、リツキシマブ、イホスファミド、シクロホスファミド、ダカルバジン、テモゾロミド、ニムスチン、ブスルファン、プロカルバジン、メルファラン、ラニムスチン、エノシタビン、カペシタビン、カルモフール、クラドリビン、ゲムシタビン、シタラビン、シタラビンオクホスファート、テガフール、ドキシフルリジン、ネララビン、ヒドロキシカルバミド、フルオロウラシル、フルダラビン、ペメトレキセド、ペントスタチン、メルカプトプリン、メトトレキサート、イリノテカン、エトポシド、ソブゾキサン、ドセタキセル、ノギテカン、パクリタキセル、ビノレルビン、ビンクリスチン、ビンデシン、ビンブラスチン、アクチノマイシンD、アクラルビシン、アムルビシン、イダルビシン、エピルビシン、ジノスタチンスチマラマー、ダウノルビシン、ドキソルビシン、ピラルビシン、ブレオマイシン、ペプロマイシン、マイトマイシンC、ミトキサントロン、オキサリプラチン、カルボプラチン、シスプラチン、ネダプラチン、アナストロゾール、エキセメスタン、エストラムスチン、エチニルエストラジオール、クロルマジノン、ゴセレリン、タモキシフェン、デキサメタゾン、トレミフェン、ビカルタミド、フルタミド、プレドニゾロン、ホスフェストロール、ミトタン、メチルテストステロン、メドロキシプロゲステロン、メピチオスタン、リュープロレリン、レトロゾール、ゾメタ、インターフェロン-α、インターフェロン-β、インターフェロン-γ、インターロイキン、ウベニメクス、乾燥BCG、レンチナンなどが挙げられが、それに限定されるものではない。一つの具体的な態様では、エフェクターとしては、例えば、5-FU、FT、FdUrd、FUMP、FUDP、FUTP、FdUMP、FdUDP、FdUTPなどが挙げられる。
【0038】
本発明で、モジュレーターとは、エフェクターの示す活性の効果を変える作用を持つもの、例えば、エフェクターの示す活性の効果の増強作用を示すもの、及び/又は、エフェクターの副作用の軽減作用をもたらすもので、バイオケミカル・モジュレーターとも呼ばれるものを指している。特には、抗癌剤をエフェクターとし、抗癌剤の薬理動態を修飾し、その効果を高めたり、及び/又は、その副作用を軽減したりするなどの働きを持つものである。当該分野で、バイオケミカル・モジュレーション(Biochemical Modulation: BM又はBCM)の概念で使用されるもの、あるいは、使用が意図されるものが包含されてよい。BMの概念に基づく代表例として知られるものとしては、5-FUの系が挙げられる。本モジュレーターとしては、当該分野で知られたもの、さらに当該分野で候補化合物として知られているものだけでなく、新規に発見されたもの、及び/又は、新規に合成されたもの、天然物由来のものなども包含されてよい。一つの典型的な態様では、当該モジュレーターとしては、酵素阻害剤、ホルモン拮抗剤、受容体に対するリガンド、モノクローナル抗体を包含する抗体、サイトカイン類、細胞成長因子類、細胞成長因子阻害物質、代謝促進剤、代謝阻害剤、それらの代謝誘導体、それらの前駆体などが包含されてよい。モジュレーターとしては、当該分野で様々なものが知られており、代表的なものとしては、例えば、CDHP、LV、Oxoなどが挙げられる。
【0039】
抗腫瘍活性増強活性は、当該分野で様々な方法で評価されており、そうした当該分野で知られた手法の中から、適宜、選択して適用してよいが、例えば、細胞増殖、及び/又は、細胞毒性測定する手法を用いて行うものであってよい。
本発明において、抗腫瘍活性増強活性測定処理は、細胞及び/又は組織の生存活性(viability)の測定試薬を使用して、細胞数を測定することで行うものであってよく、例えば、水溶性発色性基質が、細胞内脱水素還元酵素により還元されて、高感度の水溶性色素を生成し、その色素の吸光度を測定し、生細胞数と生成される測定対象色素の量とが比例関係にあることを利用して測定するものであってよいし、生きている細胞の代謝活性を測定して、細胞及び/又は組織の生存活性や細胞数を測定するものであってよい。一つの具体的態様では、当該測定は、数値化して結果を評価することにより行われる。水溶性発色性基質としては、例えば、WST-8(株式会社同仁化学研究所)などを挙げることができる。
本発明では、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織が無傷状態で抗腫瘍活性増強活性測定処理に付されている、すなわち、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付されていることが、大きな特徴でもある。これにより、臨床下にある腫瘍細胞又は腫瘍組織に極めて類似した生存環境下での測定が達成されているものと考えられ、より有用な活性測定が可能になると思われる。
【0040】
本発明に従った一つの具体的態様では、抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性の測定試薬で処理し、活性測定を行うものであってよい。本測定法では、例えば、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性の測定試薬で処理し、次に培地をゾル状態とした後、すなわち、ゾル化した後、活性測定を行うものである。また、本測定法では、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生細胞数の測定を行う。こうした生存活性の測定試薬としては、上記したように、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行うものであってよい。さらに、抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行うものであることともできる。
【0041】
本発明の三次元初代培養組織又は三次元初代培養細胞実験評価系を使用し、本発明の抗腫瘍効果増強活性測定法を適用すると、BM理論による抗癌剤の抗腫瘍増強活性の検出について、CDHPだけでなく、LVにおいても、5-FUとFdUrdの殺細胞効果への増強効果を感度良く検出できる。かくして、FdUrdとCDHPとを有効成分とする抗癌配合剤、さらには、タキソールとCDHPとを有効成分とする抗癌配合剤、ゾメタとCDHPとを有効成分とする抗癌配合剤など、BM理論による新規な抗腫瘍増強活性の付与された抗癌剤が提供される途が拓かれることとなる。
以下に実施例を掲げ、本発明を具体的に説明するが、この実施例は単に本発明の説明のため、その具体的な態様の参考のために提供されているものである。これらの例示は本発明の特定の具体的な態様を説明するためのものであるが、本願で開示する発明の範囲を限定したり、あるいは制限することを表すものではない。本発明では、本明細書の思想に基づく様々な実施形態が可能であることは理解されるべきである。
全ての実施例は、他に詳細に記載するもの以外は、標準的な技術を用いて実施したもの、又は実施することのできるものであり、これは当業者にとり周知で慣用的なものである。
【実施例1】
【0042】
〔材料・方法〕
1) 抗癌剤およびバイオケミカルモジュレーター
5-FU は協和発酵工業株式会社より購入した。還元型葉酸ロイコボリン(LV)は、協和発酵キリン株式会社より購入した。ギメラシル(CDHP)は大鵬薬品工業株式会社から提供を受けた。フルオロデオキシウリジン(FdUrd)は、和光純薬工業株式会社より購入した。
【0043】
2) 組織培養用試薬とその他の試薬
タンパク測定用試薬、BCA試薬は、ThermoScientific社製を使用した。抗生物質含むHanks液とPBS(-)溶液は、日水製薬株式会社から購入した。
抗生物質と17%の牛胎児血清を含むRPMI-1640培地(以下、血清培地と略)は、日水製薬株式会社から購入した。WST-8溶液は、同仁化学薬品株式会社から購入した。組織を包埋する培養基材である熱可逆性ゲル、TGP(Thermo-reversible Gelation Polymer)は、国際先端技術総合研究所株式会社で化学合成したものを使用した。
【0044】
3) 初代3次元組織培養系によるバイオケミカル・モジュレーターの活性測定方法
3−1 癌組織の裁断から播種・包埋工程
病院施設内の倫理委員会規定に従った同意書において、試験材料提供に承諾していただいた胃癌患者からの新鮮手術切除胃癌組織材料(1.0cm角程度の大きさ)と、切除正常胃組織材料あるいは、免疫不全実験小動物に各種固形癌を移植後、増殖した新鮮切除腫瘍を、安全キャビネット内に搬入し、Hanks液で数回洗浄する。洗浄後、固形腫瘍組織をメスで切片を多数切り分け、さらに裁断機(Mcllwain tissue chopper; The Mickle Laboratory Engineering Co.Ltd, 英国)を用いて、癌組織細切片(1mm角程度)に裁断する。
48穴(48well)プレートの各well中に、4℃に冷却したTGP(10%)を混入した血清を含むRPMI-1640培養液(血清培地と略)を0.15 mlづつ注入する。TGP溶液を含む各wellに、裁断した癌組織切片を、5〜7個を目安に入れ、37℃に加温してTGP溶液をゲル化し、癌組織を完全に包埋する。
【0045】
3―2 各種抗癌剤とBM剤との接触培養
ゲル化後に、4段階に濃度を希釈した各抗癌剤単独あるいはBM剤と混合した血清培地0.35mlを各wellに計16well添加する。また同様に、抗癌剤あるいはBM剤を含まない対照群(Control)に、血清培地0.35ml を各well、計7well添加する。抗癌剤あるいはBM剤を混合した抗癌剤と接触培養を37℃、5% CO2大気下炭酸ガスインキュベーター内、6日間の条件で行う。胃癌組織と抗癌剤を含まないブランク群も上記操作と同様に行う。
【0046】
3−3 生細胞の測定と補正
培養終了後、WST-8試薬を添加し、癌組織中の細胞内脱水素酵素量を測定することによりバイアビィリテーを評価した。
すなわち、各wellにWST-8試薬25μLを添加し、一晩、炭酸ガスインキュベーター内で反応後、培地を冷却し、ゾル化した後、その吸光度をマイクロプレートリーダー(Viento XS、大日本住友製薬株式会社)にて、OD450nmの波長で測定する。測定終了後、残存組織片をPBSで3回洗浄し、続いてBCA試薬を用いて、組織中のタンパク質量を測定した。
なお、残存組織片の蛋白質量は、マイクロプレートリーダーでOD562nmの波長の吸光度を測定することにより定量した。ここで、タンパク質量は、BSA(牛血清アルブミン)を標準タンパクに使用した。
【0047】
3−4 生残率の計算とIC50値の算出
各wellの生残率(%)は以下の式に従い算出した。
【0048】
【数1】

【0049】
なお、各ΔOD値は、ブランク値を引いた数値を表すか、あるいは、
【数2】

【0050】
以上のどちらかの式に従って、各被試験抗癌剤の濃度に対する生残率(%)を求め、その用量反応曲線からIC50(μg/ml)を算出する。すなわち、Microsoft社のエクセル(2007)を使用し、X軸(横軸)に抗癌剤濃度を、Y軸(縦軸)に生残率をプロットし、エクセル関数から得られた一次回帰式の傾きとY軸切片から、IC50値を算出した。
【0051】
〔結果〕
1) CDHPによる抗癌剤の抗腫瘍効果増強活性について
CDHPによる5-FUとFdUrdの殺細胞効果増強活性に関する結果を表1にまとめた。
なお、CDHP単独による胃癌組織への細胞毒性(IC50)は133mcg/ml以上であった。5-FUは600mcg/mlからFdUrdは113mcg/mlからそれぞれ、10倍希釈連続4段階による濃度を添加した。5-FUとCDHPあるいはFdUrdとCDHPとのモル比はそれぞれ(5:1)とし、CDHPを両抗癌剤それぞれと混合して添加した。
【0052】
【表1】

【0053】
E.I.はEnhancement Index(促進係数)の略であり、CDHPによる5-FUあるいはFdUrdに対する殺細胞効果の増強活性を示す係数である。
E.I.の数値は以下の式から導き出される。
E.I.= (5-FUのIC50値)/(5-FU+CDHPのIC50値)
あるいは
E.I.= (FdUrdのIC50値)/(FdUrd+CDHPのIC50値)。
なお、E.I.値は1.5以上を記載した。
【0054】
表1の結果から、5-FUに対するCDHPの殺細胞効果増強活性は、調べた4症例において認められ、その増強活性比(促進係数)は1.7から24倍であった。
一方、FdUrdに対するCDHPの殺細胞効果増強活性は、調べた5症例において認められ、その増強活性比(促進係数)は2.6から38倍であった。
【0055】
2) LVによる抗癌剤の抗腫瘍効果増強活性について
LVによる5-FUとFdUrdの殺細胞効果増強活性に関する結果を表2にまとめた。
なお、LV単独による胃癌組織への細胞毒性(IC50)は、236mcg/ml以上であった。5-FUは600mcg/mlから、FdUrdは113mcg/mlから、それぞれ、10倍希釈連続4段階による濃度を添加した。5-FUとLVとのモル比は(1:1)としまた、FdUrdとLVとのモル比は(1:10)とし、LVを両抗癌剤それぞれと混合して添加した。
【0056】
【表2】

【0057】
E.I.はEnhancement Indexの略であり、LVによる5-FUあるいはFdUrdに対する殺細胞効果の増強活性を示す係数である。
E.I.の数値は以下の式から導き出される。
E.I.= (5-FUのIC50値)/(5-FU+LVのIC50値)
あるいは
E.I.= (FdUrdのIC50値) / (FdUrd+LVのIC50値)。
なお、E.I.値は1.5以上を記載した。
【0058】
表2の結果から、5-FUに対するLVの殺細胞増強活性は、調べた4症例において認められ、その増強活性比(促進係数)は、2.6から11倍であった。一方、FdUrdに対するLVの殺細胞効果増強活性は調べた3症例に認められ、その増強活性比(促進係数)は、3.7倍から350倍であった。
【0059】
3) 正常胃組織への毒性について
5-FU単独あるいは、CDHPとの併用とLVとの併用によるヒト初代培養正常胃組織粘膜に対する毒性について、本実験系を使用し、実施した結果を、表3にまとめた。
【0060】
【表3】

【0061】
調べた7症例のうち、CDHPによる毒性増強活性を認めた症例は、1症例(NM081120A)であり、その増強活性比(促進係数)は、12倍であった。またLVによる毒性増強活性を認めた症例は、1症例(NM090105A)であり、その増強活性比(促進係数)は、6.9倍以上であった。表3中の7症例は、表1あるいは表2の症例と同一症例を含み、これら7症例のうち、5-FUの感受性が癌組織の方が高い症例は、6症例であった。一方、癌組織よりも正常胃組織の感受性が高い症例は、1症例(NM090119A)だけであった。
【0062】
〔考察〕
本邦で開発されたS-1(TS-1)は、5-FUをエフェクター(Effector)とし、CDHPが効果増強のモジュレーター(Modulator)として、オタスタットカリウム(Oxo)が副作用軽減のModulatorとして作用するバイオケミカル・モジュレーション(Biochemical Modulation: BM)理論に基づく代表的な抗癌剤である。
Biochemical Modulationとは、ある抗癌剤(Effctor)に他の薬剤(Modulator)を併用することにより、生化学的あるいは薬理学的に明らかな作用機序から、effectorの抗腫瘍効果の増強や副作用の軽減を図り、理論的に裏付けされた併用療法の事を指す。しかし、創薬開発の上流において、ModulatorとEffctorの組み合わせなど、その可能性は無数に存在し、また現況では、感度や実施可能被試験検体化合物数などの点において、新規作用機序などの未知のBiochemical Modulationの発見や開発を目的とした探索研究レベルで、開発競争に打ち勝つ、満足できる測定系がない。
また臨床治療効果においても、患者個別にBiochemical Modulation効果を予測可能な測定系がないのが現状である。もし、癌患者個別にS-1の効果を、投与前に予測する事が出来れば、不要な投与による癌患者の不利益を軽減でき、また異なる抗癌剤の選択することができる。
【0063】
本発明は、その実施例(表1に示す)の結果から、CDHPを含む5-FUの効果を定量的に測定可能とし、また患者個別に、CDHPによる増強活性を検出可能であることを示唆している。
CDHPは、図1に示す5-FUの代謝経路図より、5-FUの分解酵素であるDPDの強力な阻害剤であることは周知の事実である。したがって、5-FUの殺細胞効果に対して、増強する活性を認めた本実施内容は、CDHPの作用機序と一致する。
一方、5-FUの代謝物であるFdUrdの殺細胞効果に対する増強活性は、DPD阻害作用とは異なるCDHPの新規作用機序に基づく増強活性と示唆される。このようにフッ化ピリミジン系抗癌剤に対するバイオケミカル・モジュレーターの新規な増強効果を感度良く見出すことができる、本発明の手法は、今後の創薬開発においても、非常に有効なもので、本発明の方法の使用により新たなBM薬開発が可能であることが予想される。すなわち、癌患者から手術などで切除して得られた腫瘍細胞や腫瘍組織の初代培養系を使用することにより、投薬前に抗癌剤の抗腫瘍効果の予測が可能となる。また、担癌実験動物から得た腫瘍組織を初代培養することにより、検体のランダム化が図れ、多くの被検体の使用が可能となり、実施期間の短縮化また増強活性の強さから、感度良く、未知の陽性検体を拾い上げが可能であることと十分に予想される。
【0064】
上記のデータは、本発明の技術によれば、BM理論による抗癌剤の抗腫瘍増強活性の検出について、CDHPだけでなく、LVにおいても、5-FUとFdUrdの殺細胞効果への増強効果を感度良く検出でき(表2に示す)、しかも患者個別化も図れることから、投与前の事前の効果予測にも十分に応用可能であることを示唆する実施結果と思われる。
5-FUの感受性予測に寄与すると考えられている因子、DPD、TP、OPRTやTSなどの5-FUの腫瘍細胞中代謝経路上の律速酵素群や抗腫瘍効果の標的酵素に関して、基礎的な研究報告がある。すなわち、ヒト実験室馴化細胞株を培養し、得た細胞中の活性と、同細胞株をヌードマウス皮下移植したヒト腫瘍中の発現量あるいは酵素活性とを比較すると、桁違いの差があり、腫瘍中の発現量や酵素活性は1000倍以上高いと報告されている。したがって、同細胞株をin vitro で評価しても、ヌードマウスなどのin vivo の系の代替法にはならず、むしろ、皮下移植後、増殖した腫瘍を切除し、in vitro で本発明方法による3次元初代組織培養実験評価方法で感受性を評価する方が代替法になると十分に予想できる。
【0065】
本発明方法による実施例において、CDHPにおいてはその増強活性比を35倍、またLVにおいては350倍の増強活性比を検出できており、このような倍率は、上記予想を支持するデータと思われる。
バイオケミカル・モジュレーターのうち、副作用軽減に対する効果予測には、表3の実施例で示したように正常組織を初代培養することにより、Effctorである抗癌剤に対する毒性やさらに毒性増強する効果なども感度良く検出できており、さらに、5-FUの化合物の特徴であるウラシルが正常細胞に比べ癌細胞へ取り込みやすい性質も患者個別レベルで予測でき、ヒトへの感受性予測ばかりでなく、本実施例は、副作用の面でも予測可能であることを示唆するものである。
【産業上の利用可能性】
【0066】
本発明の技術は、今後の創薬開発においても、非常に有効なもので、本発明の方法の使用により新たなBM薬開発が可能である。本発明の測定法により、BM理論による抗癌剤の抗腫瘍増強活性の検出を感度良く実施でき、臨床応用に有用であり、さらに、患者個別化も図れ、投与前の事前の効果予測にも応用できる。さらに、副作用軽減に対する効果予測や、個々の患者毎の効果の違いを予測することを可能にし、治療前の効果・毒性・副作用評価系として利用できる。
本発明は、前述の説明及び実施例に特に記載した以外も、実行できることは明らかである。上述の教示に鑑みて、本発明の多くの改変及び変形が可能であり、従ってそれらも本件添付の請求の範囲の範囲内のものである。
【技術分野】
【0001】
本発明は、三次元初代培養組織又は三次元初代培養細胞実験評価系によるバイオケミカル・モジュレーターの各種抗癌剤に対する抗腫瘍効果増強活性の測定方法に関する。
【背景技術】
【0002】
本邦の抗癌剤のうち、患者のQOLを考慮した経口抗癌剤の開発が5-フルオロウラシル(5-fluorouracil: 5-FU)を代表とするフッ化ピリミジン系代謝拮抗剤を中心に進んでいる。
5-FUは、ウラシルが正常組織と比較して腫瘍組織に選択的に取り込まれやすいことから、現在もさまざまな固形腫瘍の治療に用いられている。また、現在でもなお、5-FUの抗腫瘍効果増強と副作用の軽減を目指したバイオケミカル・モジュレーター(Biochemical Modulator)の創薬開発が試みられている。
【0003】
図1に示すように、5-FUの殺腫瘍細胞機序は主に
1)5-FUの活性代謝体FUTPのRNAへの取り込まれた後RNA機能障害、
2)チミジル酸合成酵素(thymidylate synthase: TS)阻害によりDNA合成阻害
を引き起こすというものである。
この2)の機序において、5-FUはフルオロデオキシウリジン(fluorodeoxyuridine: FdUrd)からフルオロデオキシウリジン モノフォスフェート(fluorodeoxyuridine monophosphate: FdUMP)に代謝され、還元型葉酸(locovorin: LV)の代謝物である5,10-CH2-THF(5,10-methylenete trahydroforate)と共にTSと共有結合し強固な三者結合体を形成し、dUMP(deoxyuridine monophosphate)からdTMP(deoxythymidine monophosphate)への酵素変換作用を阻害する。その結果、腫瘍中のdTMP及びdTTPを枯渇させ、DNA合成阻害を引き起こす。
【0004】
この作用は5-FUの代謝物であるFdUrd単独でも強い阻害作用がある。なお、細胞内に取り込まれた5-FUはまず5-FUの分解反応の律速酵素であるDPD(dihydropyrimidine dehydrogenase)により分解をうけ、最終的にフッ化アラニン(F-β-Ara)へと分解する。
5-FU単剤で使用された場合の奏功率は、20%以下と効力が弱く、このため、臨床効果を改善すべく、5-FUの効力を高めるバイオケミカル・モジュレーターが開発されてきたが、それらのうち、最も臨床効果が優れているS-1(ティーエスワン: TS-1)が近年本邦で開発された。
【0005】
S-1は、5-FUの血中濃度を最大限に高め、且つ、それに付随して増大する消化管毒性を軽減させるために、5-FUのマスク化合物であるテガフール(FT)に、DPD阻害剤であるギメラシル(CDHP: 5-chloro-2,4-dihydroxypyridine)とOPRT(Orotate phosphoribosyl transferase)阻害剤であるオテラシルカリウム(Oteracil potassium: Oxo)を特異のモル比(1:0.4:1)で配合した経口抗癌剤である。
このS-1のバイオケミカル・モジュレーション作用の一つは、肝臓に多く分布するDPDをCDHPにより可逆的に阻害することで血中及び腫瘍中の5-FUを高濃度に維持させ抗腫瘍効果を増強すると考えられている。
【0006】
また、5-FUの臨床効果を改善すべく、バイオケミカル・モジュレーター研究の中で、大腸癌において、LVと5-FUの併用療法が単剤よりすぐれた臨床効果が発揮されたとの報告があり、大腸癌の化学療法の標準治療となっている。
【0007】
しかし、このような5-FUの効果を高める創薬開発にも関らず、無効例が多く、癌患者における5-FUに対するBiochemical Modulation (BM又はBCM)効果を、投与前に予測する事が出来れば、不用な投与による患者の不利益を回避できる。
また、新規のBM効果薬の創薬開発において、高感度で簡便な抗腫瘍増強作用を定量できるin vitroの系の開発により、より強力で奏功率の高いBM効果剤が生み出されることが期待できる。
【0008】
後者において、現在のBM理論に基づく、抗癌剤の抗腫瘍効果の測定方法は、担癌実験小動物を使用したin vivo アッセイが主体である。実際のアッセイの概要は、癌細胞を免疫不全状態の実験小動物体内に植え付けたあと、候補化合物を投与し、同実験小動物体内に生着し、増殖した腫瘍の減少や、個体の生存率などで抗腫瘍効果を検討する。したがって、本in vivo実験評価系において、検討できる候補化合物は少数に限られることとなり、ケミカルライブラリー等の抗腫瘍増強作用が未知の化合物などのランダムスクリーニングやさらに高速で大量測定可能なハイスループットスクリーニング(HTS)などへ展開可能な測定系がないのが現状である。
【0009】
In vitro 実験評価系において、BM効果活性を含む抗癌剤の抗腫瘍効果を測定する場合、ヒト実験室標準腫瘍細胞株を利用したアッセイ系が報告されている。具体例をあげると、CDHPによる5-FUの抗腫瘍活性(IC50:50% inhibition concentration)に関しては、5-FU単独によるIC50値を、CDHP併用により2.3倍程度しか増強できない。一方、癌患者から手術などの切除した腫瘍細胞や組織を利用した初代培養系による測定方法も報告されているが、CDHP併用により5-FUの抗腫瘍活性(5-FU単独によるIC50値)を増強したとの報告もいまだなされていない。
【0010】
また、LVについて、同様に、実験室標準腫瘍細胞株を使用したアッセイでは、5-FUの抗腫瘍効果(IC50値)をLV併用した場合、単独添加に比べた増強効果は10倍以下であり、既存のアッセイ系の感度が非常に低い。
したがって、抗癌剤治療の臨床効果予測に、あるいは、創薬開発の実践においても、担癌実験小動物を使用したアッセイに比べ、既存のin vitroアッセイ系は信頼性が低く、未だ、代替アッセイとして実用化されていないのが現況である。
【0011】
本邦では、癌患者に、S-1などのBM作用がある抗癌剤を投薬前に抗腫瘍効果を予測するin vitroからin vivoまでの基礎研究や臨床研究など、多方面から研究され、報告されてきた。とりわけ、S-1や5-FU療法の効果予測を実現化するために、5-FUの代謝経路の律速酵素の遺伝子やタンパク発現と臨床効果との相関性に関する研究は、数多く報告されてきたが、発表ごとに、あるいは、報告者により、さまざまな結論が出され、内容に大きな乖離があり、どの因子が効果を予測できるか特定するに至っていない。また、癌患者から取り出した腫瘍組織や腫瘍細胞を使用した既存の初代培養系における測定系においても、活性の増強を検出した報告がないままである。
【0012】
生体内では細胞や組織は三次元的な環境下で増殖や維持が図られていることから、近年、三次元培養法の開発が進められてきた。こうした中で、動物組織に損傷を与えることなく容易に包埋が可能で、且つ、培養後、組織に損傷を与えることなく容易に回収あるいは継代することが可能な動物組織培養用担体並びにこれを用いる動物組織培養方法が提供されている〔特許文献1:特許第3190145号〕。また、初代癌細胞や初代癌細胞塊の増殖性に優れ、該細胞や細胞塊に損傷を与えることなく容易に包埋が可能で、且つ培養後、該細胞や該細胞塊に損傷を与えることなく容易に回収あるいは継代することが可能な初代癌細胞及び初代癌細胞塊培養用担体、およびこれを用いる初代癌細胞や初代癌細胞塊の培養方法も提供されている〔特許文献2:特許第3190147号〕。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特許第3190145号
【特許文献2】特許第3190147号
【発明の概要】
【発明が解決しようとする課題】
【0014】
癌治療が直面する困難を克服するため、S-1(TS-1)を含めてバイオケミカル・モジュレーション(Biochemical Modulation: BM)を利用した抗癌剤の開発が求められている。Biochemical Modulationとは、ある抗癌剤(Effctor)に他の薬剤(Modulator)を併用することにより、生化学的あるいは薬理学的に明らかな作用機序から、effectorの抗腫瘍効果の増強や副作用の軽減を図り、理論的に裏付けされた併用療法の事を指すものである。しかし、創薬開発の上流において、ModulatorとEffctorの組み合わせなど、その可能性は無数に存在し、また現況では、感度や実施可能被試験検体化合物数などの点において、新規作用機序などの未知のBiochemical Modulationの発見や開発を目的とした探索研究レベルで、開発競争に打ち勝つ、満足できる測定系がない。また臨床治療効果においても、患者個別にBiochemical Modulation効果を予測可能な測定系がないのが現状である。もし、癌患者個別に抗癌剤の効果を、投与前に予測する事が出来れば、不要な投与による癌患者の不利益を軽減でき、また異なる抗癌剤を選択することも可能となる。
【課題を解決するための手段】
【0015】
本発明者等は、上記課題を解決すべく鋭意検討したところ、抗癌剤の抗腫瘍効果を高めるBM作用がある抗癌剤のin vitroにおける実験評価系を開発し、特定の抗癌剤だけでなく、BM作用がある抗癌剤に広く適用すべく、三次元初代組織培養系を応用すれば、抗癌剤に対するバイオケミカル・モデユレーターの抗腫瘍増強効果を、簡便かつ高感度で、精度よく定量できることを見出すのに成功し、三次元初代組織培養測定系を発明した。
本発明者等は、癌患者からの切除癌組織の三次元初代組織培養物を使用することにより、実際に癌臨床で投薬治療される抗癌剤であって、BM作用がある抗癌剤において、その感受性増強効果を検出することが可能であることを確認した。本発明は、かかる知見に基づいて完成したものである。
【0016】
本発明は、次なるものを提供している。
〔1〕三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織を使用した三次元初代培養物実験評価系による測定法であり、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行うもので、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することを特徴とするモデユレーターの抗癌剤に対する効果増強活性測定法。
〔2〕エフェクター存在下に、
(a)モジュレーターが存在する場合、
並びに、
(b)モジュレーターが存在しない場合、
の両方のそれぞれで、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付すことを特徴とする上記〔1〕に記載の測定法。
〔3〕抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、活性測定を行うものであることを特徴とする上記〔1〕又は〔2〕に記載の測定法。
〔4〕初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、次に培地をゾル状態とした後(ゾル化した後)、活性測定を行うものであることを特徴とする上記〔1〕〜〔3〕のいずれか一に記載の測定法。
〔5〕初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生存活性または生細胞数の測定を行うものであることを特徴とする上記〔1〕〜〔4〕のいずれか一に記載の測定法。
〔6〕生存活性の測定試薬が、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行うものであることを特徴とする上記〔4〕又は〔5〕に記載の測定法。
〔7〕抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行うものであることを特徴とする上記〔6〕に記載の測定法。
〔8〕三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織を混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする上記〔1〕〜〔7〕のいずれか一に記載の測定法。
〔9〕三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織と細胞培養用生理活性物質とを混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする上記〔1〕〜〔7〕のいずれか一に記載の測定法。
〔10〕培地をゾル状態とすること(ゾル化すること)が、三次元初代培養された初代腫瘍細胞及び/又は初代腫瘍組織を含むゲルを、ゾル−ゲル転移温度より低い温度で液体状態(ゾル状態)とするものであることを特徴とする上記〔4〕〜〔9〕のいずれか一に記載の測定法。
〔11〕エフェクターが、抗癌剤又はその生体内代謝誘導体であることを特徴とする上記〔1〕に記載の測定法。
〔12〕抗癌剤が、分子標的薬、アルキル化剤、代謝拮抗剤、植物アルカロイド、抗癌性抗生物質、プラチナ製剤、ホルモン剤及び生物学的応答調節剤からなる群から選択されたものであることを特徴とする上記〔11〕に記載の測定法。
〔13〕モジュレーターが、酵素阻害剤、ホルモン拮抗剤、受容体に対するリガンド、モノクローナル抗体を包含する抗体、サイトカイン類、細胞成長因子類、細胞成長因子阻害物質、代謝促進剤及び代謝阻害剤からなる群から選択されたものであることを特徴とする上記〔1〕に記載の測定法。
〔14〕フルオロデオキシウリジン(FdUrd)とギメラシル(CDHP)とを有効成分として含有していることを特徴とする抗癌剤。
〔15〕タキソールとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
〔16〕ゾメタとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
【発明の効果】
【0017】
本発明の測定法により、抗癌剤の抗腫瘍増強活性の的確且つ感度の良い検出が可能となり、抗癌剤に対するバイオケミカル・モジュレーターの新規な増強効果を感度良く見出すことができる。さらに、癌患者から手術などで切除して得られた腫瘍細胞や腫瘍組織の初代培養系を使用することにより、投薬前に抗癌剤の抗腫瘍効果の予測が可能となる。また、担癌実験動物から得た腫瘍組織を初代培養することにより、検体のランダム化が図れ、多くの被検体の使用が可能となり、実施期間の短縮化また増強活性の強さから、感度良く、未知の陽性検体を拾い上げが可能であるとの利点を発揮する。抗癌剤とそのモジュレーターの間の殺細胞効果への増強効果を感度良く検出でき、しかも患者の個別化も図れることから、投与前の事前の効果予測にも応用可能である。
本発明の測定法は、バイオケミカル・モジュレーターのうち、副作用軽減に対する効果予測にも有用であり、正常組織を初代培養することにより、抗癌剤に対する毒性やさらに毒性増強する効果なども感度良く検出できるし、患者個別レベルでの予測も可能にし、ヒトへの感受性予測ばかりでなく、副作用の面でも予測可能とするものである。
本発明のその他の目的、特徴、優秀性及びその有する観点は、以下の記載より当業者にとっては明白であろう。しかしながら、以下の記載及び具体的な実施例等の記載を含めた本件明細書の記載は本発明の好ましい態様を示すものであり、説明のためにのみ示されているものであることを理解されたい。本明細書に開示した本発明の意図及び範囲内で、種々の変化及び/又は改変(あるいは修飾)をなすことは、以下の記載及び本明細書のその他の部分からの知識により、当業者には容易に明らかであろう。本明細書で引用されている全ての特許文献及び参考文献は、説明の目的で引用されているもので、それらは本明細書の一部としてその内容はここに含めて解釈されるべきものである。
【図面の簡単な説明】
【0018】
【図1】5-FUの代謝と抗腫瘍効果作用を説明する模式図をしめす。
【発明を実施するための形態】
【0019】
本発明は、抗癌剤の抗腫瘍効果を高めるBM作用がある抗癌配合剤のin vitroにおける実験評価系を開発し、特定の抗癌剤だけでなく、BM作用がある抗癌配合剤に広く適用できる、三次元初代組織培養系を応用している、抗癌剤に対するバイオケミカル・モデユレーターの抗腫瘍増強効果を、簡便かつ高感度で、精度よく定量することを可能ならしめる、三次元初代組織培養測定系を提供するものである。
本発明では、癌患者からの切除癌組織の三次元初代組織培養物を使用して、実際に、癌臨床で投薬治療される抗癌剤(抗癌配合剤)であって、BM作用がある抗癌剤(抗癌配合剤)において、その感受性増強効果を検出することが可能であることを確認した。
【0020】
本発明の一つの態様では、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織を使用した三次元初代培養物実験評価系による測定法が提供されているのであり、該測定法では、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行い、そして、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することを特徴とするモデユレーターの抗癌剤に対する効果増強活性測定法が提供される。
本抗腫瘍効果増強活性測定法では、(a)モジュレーターが存在する場合に得られた結果と(b)モジュレーターが存在しない場合に得られた結果とを比較することで、抗腫瘍活性増強活性を測定するもの、あるいは、評価するものであってよい。
本発明で「三次元培養」とは、ゾル−ゲル転移温度を有し、該転移温度より低い温度で可逆的にゾル状態を示すような高分子化合物を培養用の担体として使用し、必要に応じて、当該培養用担体に、細胞培養用生理活性物質を配合せしめて培養用の組成物として、それを用いて、当該培養用担体又は培養用組成物中の該高分子化合物をゲル状態にした培地中で、該ゲル物質に培養されるべき細胞及び/又は組織が包埋された状態で培養されることを意味する。
【0021】
本発明において、三次元培養には、ゾル−ゲル転移温度を有し、該転移温度より低い温度で可逆的にゾル状態を示すような高分子化合物を腫瘍細胞及び/又は初代腫瘍組織の培養用の担体として用いる。当該培養用担体は、例えば、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示すことを特徴とするものである。当該培養用担体には、細胞培養用生理活性物質を配合して、培養用の組成物として提供されることができる。上記高分子化合物の親水性部分は、上記したゾル−ゲル転移温度より低い温度で該高分子化合物が水溶性になるために必要であり、また疎水性部分は、該高分子がゾル−ゲル転移温度より高い温度でゲル状態に変化するために必要である。換言すれば、該疎水性部分間の結合がゲルの架橋点の形成のために必要である。
【0022】
上記高分子化合物中の疎水性部分間の結合、即ち、疎水性結合は、その結合力が温度の上昇と共に強くなるという性質を有するために、温度上昇と共に架橋の強さおよび架橋密度が増大し、本発明の三次元培養においては、初代腫瘍細胞及び/又は初代腫瘍組織培養時の温度(ゾル−ゲル転移温度より高い温度)でゲル化状態に変化することが可能である。また、上記疎水性結合力の温度依存性が可逆的であるという性質によって、そのゾル−ゲル転移を可逆的に起こさせることができる。一方、上記高分子化合物中の親水性部分は、前述したように、該高分子化合物が初代腫瘍細胞及び/又は初代腫瘍組織培養時の温度より低い温度(ゾル−ゲル転移温度より低い温度)で水溶性に変化するために必要であると同時に、上記温度より高い温度で疎水性結合力が増大しすぎて上記高分子化合物が凝集沈澱してしまうことを防止しつつ、含水ゲルの状態を形成するためにも必要とされるものである。
【0023】
本発明において、「ゾル状態」「ゲル状態」および「ゾル−ゲル転移温度」は、以下のように定義される。この定義については文献: Polymer Journal., 18(5), pp.411-416(1986)を参照することができる。高分子溶液(担体として使用すべき高分子溶液)1mLを内径1cmの試験管に入れ、所定の温度(一定温度)とした水浴中で12時間保持する。この後、試験管の上下を逆にした場合に、溶液/空気の界面(メニスカス)が溶液の自重で変形した場合(溶液が流出した場合を含む)には、上記所定温度において高分子溶液は「ゾル状態」であると定義する。一方、上記試験管の上下を逆にしても、上記した溶液/空気の界面(メニスカス)が溶液の自重で変形しない場合には、該溶液は、上記所定温度において「ゲル状態」であると定義する。また、上記した「所定温度」を徐々に(例えば1℃きざみで)上昇させて、「ゾル状態」が「ゲル状態」に転移する温度を求めた場合、これによって求められる転移温度を「ゾル−ゲル転移温度」と定義する(この際、「所定温度」を例えば1℃きざみで下降させ、「ゲル状態」が「ゾル状態」に転移する温度を求めてもよい。
【0024】
培養用担体において、上記ゾル−ゲル転移温度は0℃より高く、60℃以下であることが好ましく、更には4℃以上50℃以下(特に4℃以上40℃以下)であることが、初代腫瘍細胞及び/又は初代腫瘍組織の熱的損傷を防ぐ点から好ましい。このように好適なゾル−ゲル転移温度を有する高分子化合物は、当該分野で知られる化合物の中から容易に選択することができる。
三次元培養をするにあたっては、培養時の温度(b℃)と、培養終了後腫瘍細胞ないし腫瘍組織を回収あるいは単離する時の温度(c℃)との間に、上記したゾル−ゲル転移温度(a℃)を設定することが必要である。すなわち上記した3種の温度a℃、b℃、およびc℃の間にはb>a>cの関係があることが必要である。より具体的には(b−a)は1〜40℃、更には2〜30℃であることが好ましく、また(a−c)は1〜40℃、更には2〜30℃であることが好ましい。
【0025】
上述したような好適なゾル−ゲル転移温度は、例えば、培養用担体に用いられる高分子化合物中の疎水性部分と親水性部分の組成、および疎水性度、親水性度、分子量などをそれぞれ調節することによって達成することが可能である。このような疎水性部分と親水性部分とを含む高分子化合物の具体例としては、例えば、ポリプロピレンオキサイドとポリエチレンオキサイドのブロック共重合体などに代表されるポリアルキレンオキサイドブロック共重合体;メチルセルロース、ヒドロキシプロピルセルロースなどのエーテル化セルロース;キトサン誘導体(K. R. Holme. et al. Macromolecules, 24, 3828(1991));プルラン誘導体(出口茂ら、Polymer Preprints. Japan. 19, 936(1990))などの変性多糖類;ポリN-置換(メタ)アクリルアミド誘導体、ポリビニルアルコール部分酢化物、ポリビニルメチルエーテルなどに代表される温度感応性高分子と水溶性高分子化合物との結合体(例えば松田武久ら、Polymer Preprints. Japan. 39(8), 2559(1990))などがあげられるが、これらに限定されるものではない。
【0026】
培地中の上記高分子化合物の濃度は、設定されるゾル−ゲル転移温度等によっても異なるが、後述するような所定の培地との混合物中で用いる場合、一般に0.1〜30wt%の濃度、更には1〜20wt%の濃度であることが好ましい。本発明において、上述したような高分子化合物と組み合わせて用いるべき培地としては、公知の細胞培養用培地を特に制限なく使用することができる。
本発明で細胞培養用生理活性物質とは、培養中の腫瘍細胞及び/又は腫瘍組織に対し、何らかの生理活性を付与する作用を有する物質をいい、細胞増殖・分化因子、細胞接着因子等を包含する意味で用いる。細胞増殖・分化因子としては腫瘍成長因子-β(TGF-β)、血小板由来成長因子(PDGF)、線維芽細胞成長因子(FGF)、上皮成長因子(EGF)、インターロイキン群などがあげられる。これらの細胞増殖・分化因子は、上記した高分子(担体)100部(重量部、以下同じ)に対して10-7〜10-3部(更には10-6〜10-4部)程度用いることが好ましい。細胞接着因子としては、コラーゲン、フィブロネクチン、ビトロネクチン、ラミニン、ブロテオグリカン、グリコサミノグリカンなどの細胞外マトリックスやゼラチンなどがあげられる。これらの細胞接着因子は、上記した高分子(担体)100部に対して、0.01〜50部(更には0.1〜10部)程度用いることが好ましい。
【0027】
本発明で「初代腫瘍細胞及び/又は初代腫瘍組織」とは、ヒトをはじめとした動物から直接採取した腫瘍細胞(特には、悪性腫瘍細胞、すなわち、癌細胞を包含する)及び/又は腫瘍細胞を含む組織をさし、細胞核の偏在性、大きさおよび濃染性の有無などを指標として腫瘍細胞、さらには、癌細胞か否かが判定される。
本初代腫瘍細胞及び/又は初代腫瘍組織とは、例えば、癌患者の患部から切除されたヒト腫瘍細胞や切除ヒト腫瘍組織、さらには、担癌実験動物から得た腫瘍組織などが挙げられる。該腫瘍細胞は、悪性腫瘍細胞である癌細胞が包含されるし、該腫瘍組織は、悪性腫瘍組織である癌組織が包含される。
本発明では、初代培養系を使用することにより、投薬前に抗癌剤の抗腫瘍効果の予測が可能となる。また、担癌実験動物から得た腫瘍組織を初代培養することにより、検体のランダム化を図ることも可能であり、多くの被検体を使用することが可能であり、実施期間の短縮化も可能で、さらに、感度も良く、且つ、正確性が高いことから、未知の陽性検体を拾い上げることも可能である。
【0028】
本発明で「三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織」とは、上記「初代腫瘍細胞及び/又は初代腫瘍組織」を三次元培養している状態にあるもの、あるいは、該三次元培養中の培養物を、培地をゾル状態にして、簡単な回収操作を施して収穫された状態のものを意味してよい。ここで、簡単な回収操作とは、液体状態の培地から濾過、遠心などにより分離すること、得られた細胞及び/又は組織を生理食塩水、培地などですすぎ洗いすることなどで、細胞及び/又は組織に、傷害及び/又は損傷、重大な悪影響などを与えることのない穏やかな手法を指している。こうした穏やかな手法は、当該分野で当業者及びに知られており、そうした公知の手法の中から適宜選択して使用できる。
【0029】
本発明の三次元初代培養物実験評価系とは、例えば、三次元培養の状態の下で、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、活性の有無や活性の程度の測定対象となるエフェクターやバイオケミカル・モデユレーター(単に、「モジュレーター」ともいう)の影響又は作用を受けるようにしてある測定及び/又は評価を行うためのものを指していてよい。
本発明で行う三次元培養方法を、好ましい一例を示しながら、以下に記載する。
先づ、所望の培地中に、培養用担体である上記高分子化合物を、該高分子化合物のゾル−ゲル転移温度よりも低い温度で均一に溶解する。この時に、適宜、上記した細胞培養用生理活性物質も同時に溶解することも可能である。次に該高分子化合物の培地溶液中に初代腫瘍細胞及び/又は初代腫瘍組織を混合分散させる。次にこの混合物の温度を上記ゾル−ゲル転移温度より高く上げることによって、該混合物を速やかに且つ容易にゲル化させることが可能である。かくして、ゲル化された高分子化合物を含有している培地中に細胞及び/又は組織は包埋されることとなる。こうしてゲル化された培地中で包埋された状態で当該初代腫瘍細胞及び/又は初代腫瘍組織は培養されるし、エフェクターやモデユレーターの作用や影響を受けることとなる。
【0030】
特に、本発明の三次元初代培養物実験評価系では、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合、の両方のそれぞれで、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付すことを行う。これにより、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織は、それらが損傷なく、及び/又は、傷害を受けることなく、その活性の測定に付されていることとなる。
ここで、「そのままの三次元培養の状態」とは、ゲル化された培地中で包埋された状態で当該初代腫瘍細胞及び/又は初代腫瘍組織が培養されたり、エフェクターやモデユレーターやその他の試薬などの作用や影響を受けることとなる状態を意味してよい。
【0031】
一つの典型的な態様では、抗腫瘍活性増強活性測定は、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、活性測定を行う。例えば、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性(viability)の測定試薬で処理し、次に培地をゾル状態とした後(ゾル化した後)、活性測定を行うものである。初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生存活性または生細胞数の測定を行う。生存活性の測定試薬が、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、例えば、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行う。抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行う。
【0032】
上記ゲル中で培養された初代腫瘍細胞及び/又は初代腫瘍組織を回収あるいは該ゲルから分離する方法としては、最も簡便で容易な方法では、該ゲルのゾル−ゲル転移温度より低く温度を下げることによって該ゲルをゾル状態にして、該細胞及び/又は組織懸濁液をつくる手法が挙げられる。この手法によれば、遠心分離などによって該培養腫瘍細胞及び/又は培養腫瘍組織を該ゲルから全く損傷なく分離することができる。
【0033】
本発明で、エフェクターとは、悪性腫瘍細胞及び/又は悪性腫瘍組織に作用して、抗腫瘍活性を発揮する化合物分子を意味し、典型的には、悪性腫瘍細胞及び/又は悪性腫瘍組織に対して、増殖抑制、細胞傷害活性、アポトーシス誘起活性、死滅作用、細胞毒性、タンパク質合成阻害作用、DNAやRNAなどの核酸合成阻害作用などからなる群から選択された活性のいずれかを示すなどして抗腫瘍活性を示すものが挙げられる。一つの典型的な態様では、当該エフェクターとしては、抗癌剤又はその生体内代謝誘導体などが挙げられる。
抗癌剤は、抗癌作用を示すものが包含され、当該分野で知られたもの、さらに当該分野で候補化合物として知られているものだけでなく、新規に発見されたもの、及び/又は、新規に合成されたもの、天然物由来のものなども包含されてよい。本抗癌剤としては、例えば、分子標的薬、アルキル化剤、代謝拮抗剤、植物アルカロイド、抗癌性抗生物質、プラチナ製剤、ホルモン剤、生物学的応答調節剤などが包含される。
【0034】
分子標的薬とは、癌細胞の持つ特異的な性質を分子レベルでとらえ、それを標的として効率よく作用するようにつくられた薬であり、癌細胞を狙って作用するため、副作用をより少なく抑えながら治療効果を高めると期待されている。アルキル化剤は、細胞障害性抗癌剤の代表的な薬であり、例えば、アルキル化剤はアルキル基などの原子団を癌細胞のDNAに付着させて、らせん状にねじれた二本のDNAを異常な形で結合させて、DNAのコピーができないようにするなどの働きを有するとされる。代謝拮抗剤は、典型的な例では、癌細胞が分裂・増殖する際に、核酸の材料となる物質と化学的構造が似ている物質でDNAの合成を妨げ、癌細胞の代謝を阻害して、増殖を抑制するなどの抗癌剤が挙げられる。また、代謝拮抗剤は、細胞分裂の過程で必要とされるタンパク質などの合成に必要な酵素、主としてDNA合成に必要な酵素など働きを阻害することにより、細胞分裂をできなくしたり、DNA合成ができなくなるようにして、癌細胞の増殖を抑えるものも含まれる。
【0035】
植物アルカロイドとしては、強い毒性のある植物成分を応用した抗癌剤が挙げられる。例えば、ビンクリスチンやドセタキセルなどの微小管阻害剤、イリノテカンやエトポシドなどのトポイソメラーゼ阻害剤などが包含される。抗腫瘍性抗生物質は、微生物が産生する抗生物質あるいはそれを基礎に開発されたもので、例えば、癌細胞の細胞膜を破壊したり、DNAまたはRNAの複製・合成を阻害する働きを有するものが挙げられる。プラチナ製剤は、プラチナ(白金)の化合物又は錯体を活性成分とするもので、アルキル化剤などと同様に、DNAの二重らせん構造に結合してDNAの複製を阻害するほか、癌細胞を自滅(アポトーシス)へ導くはたらきもあるとされている。ホルモン剤は、癌の種類によっては、特定のホルモンによって増殖が促進されることがあり、そのホルモンの分泌が止まると、癌病巣も縮小するとの仕組みを利用して癌の増殖を抑える治療法を利用するもので、例えば、乳癌の治療などでは、特に効果が得られている。
【0036】
ホルモンは、反作用をもつ別のホルモンによって分泌が促進されたり、抑制されたりする性質があり、そのため、男性ホルモンのテストステロンにより増殖が促進される前立腺癌の治療にはエストロゲンなどの女性ホルモン剤が用いられ、反対にエストロゲンにより増殖が促進される乳癌の治療では、それを抑える男性ホルモン剤が用いられる。生物学的応答調節剤は、体内の生物学的反応を引き出して治療を行う薬で、体の自然な防御システムである免疫反応などを治療に結び付けようとするものも包含されるもので、例えば、免疫調節剤なども含まれる。これには、免疫賦活剤(免疫システムを刺激して、そのはたらきを活性させる薬)、インターフェロンなどのサイトカインも含まれる。特定の癌に対する免疫を高めるものだけでなく、免疫作用全般の向上を狙って使用されるものも包含される。癌細胞の特定の遺伝子が発現するように誘導したり、リンパ球の一種であるナチュラルキラー(NK)細胞のはたらきを活性化したり、患者の免疫反応を間接的に引き起こしたりして、癌細胞を攻撃するものなども含まれる。
【0037】
抗癌剤としては、当該分野で様々なものが知られており、代表的なものとしては、例えば、イブリツモマブチウキセタン、イマチニブ、エルロチニブ、ゲフィチニブ、ゲムツズマブオゾガマイシン、スニチニブ、セツキシマブ、ソラフェニブ、タミバロテン、トラスツズマブ、トレチノイン、パニツムマブ、ベバシズマブ、ベバシズマブ、ボルテゾミブ、リツキシマブ、イホスファミド、シクロホスファミド、ダカルバジン、テモゾロミド、ニムスチン、ブスルファン、プロカルバジン、メルファラン、ラニムスチン、エノシタビン、カペシタビン、カルモフール、クラドリビン、ゲムシタビン、シタラビン、シタラビンオクホスファート、テガフール、ドキシフルリジン、ネララビン、ヒドロキシカルバミド、フルオロウラシル、フルダラビン、ペメトレキセド、ペントスタチン、メルカプトプリン、メトトレキサート、イリノテカン、エトポシド、ソブゾキサン、ドセタキセル、ノギテカン、パクリタキセル、ビノレルビン、ビンクリスチン、ビンデシン、ビンブラスチン、アクチノマイシンD、アクラルビシン、アムルビシン、イダルビシン、エピルビシン、ジノスタチンスチマラマー、ダウノルビシン、ドキソルビシン、ピラルビシン、ブレオマイシン、ペプロマイシン、マイトマイシンC、ミトキサントロン、オキサリプラチン、カルボプラチン、シスプラチン、ネダプラチン、アナストロゾール、エキセメスタン、エストラムスチン、エチニルエストラジオール、クロルマジノン、ゴセレリン、タモキシフェン、デキサメタゾン、トレミフェン、ビカルタミド、フルタミド、プレドニゾロン、ホスフェストロール、ミトタン、メチルテストステロン、メドロキシプロゲステロン、メピチオスタン、リュープロレリン、レトロゾール、ゾメタ、インターフェロン-α、インターフェロン-β、インターフェロン-γ、インターロイキン、ウベニメクス、乾燥BCG、レンチナンなどが挙げられが、それに限定されるものではない。一つの具体的な態様では、エフェクターとしては、例えば、5-FU、FT、FdUrd、FUMP、FUDP、FUTP、FdUMP、FdUDP、FdUTPなどが挙げられる。
【0038】
本発明で、モジュレーターとは、エフェクターの示す活性の効果を変える作用を持つもの、例えば、エフェクターの示す活性の効果の増強作用を示すもの、及び/又は、エフェクターの副作用の軽減作用をもたらすもので、バイオケミカル・モジュレーターとも呼ばれるものを指している。特には、抗癌剤をエフェクターとし、抗癌剤の薬理動態を修飾し、その効果を高めたり、及び/又は、その副作用を軽減したりするなどの働きを持つものである。当該分野で、バイオケミカル・モジュレーション(Biochemical Modulation: BM又はBCM)の概念で使用されるもの、あるいは、使用が意図されるものが包含されてよい。BMの概念に基づく代表例として知られるものとしては、5-FUの系が挙げられる。本モジュレーターとしては、当該分野で知られたもの、さらに当該分野で候補化合物として知られているものだけでなく、新規に発見されたもの、及び/又は、新規に合成されたもの、天然物由来のものなども包含されてよい。一つの典型的な態様では、当該モジュレーターとしては、酵素阻害剤、ホルモン拮抗剤、受容体に対するリガンド、モノクローナル抗体を包含する抗体、サイトカイン類、細胞成長因子類、細胞成長因子阻害物質、代謝促進剤、代謝阻害剤、それらの代謝誘導体、それらの前駆体などが包含されてよい。モジュレーターとしては、当該分野で様々なものが知られており、代表的なものとしては、例えば、CDHP、LV、Oxoなどが挙げられる。
【0039】
抗腫瘍活性増強活性は、当該分野で様々な方法で評価されており、そうした当該分野で知られた手法の中から、適宜、選択して適用してよいが、例えば、細胞増殖、及び/又は、細胞毒性測定する手法を用いて行うものであってよい。
本発明において、抗腫瘍活性増強活性測定処理は、細胞及び/又は組織の生存活性(viability)の測定試薬を使用して、細胞数を測定することで行うものであってよく、例えば、水溶性発色性基質が、細胞内脱水素還元酵素により還元されて、高感度の水溶性色素を生成し、その色素の吸光度を測定し、生細胞数と生成される測定対象色素の量とが比例関係にあることを利用して測定するものであってよいし、生きている細胞の代謝活性を測定して、細胞及び/又は組織の生存活性や細胞数を測定するものであってよい。一つの具体的態様では、当該測定は、数値化して結果を評価することにより行われる。水溶性発色性基質としては、例えば、WST-8(株式会社同仁化学研究所)などを挙げることができる。
本発明では、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織が無傷状態で抗腫瘍活性増強活性測定処理に付されている、すなわち、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付されていることが、大きな特徴でもある。これにより、臨床下にある腫瘍細胞又は腫瘍組織に極めて類似した生存環境下での測定が達成されているものと考えられ、より有用な活性測定が可能になると思われる。
【0040】
本発明に従った一つの具体的態様では、抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性の測定試薬で処理し、活性測定を行うものであってよい。本測定法では、例えば、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性の測定試薬で処理し、次に培地をゾル状態とした後、すなわち、ゾル化した後、活性測定を行うものである。また、本測定法では、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生細胞数の測定を行う。こうした生存活性の測定試薬としては、上記したように、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行うものであってよい。さらに、抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行うものであることともできる。
【0041】
本発明の三次元初代培養組織又は三次元初代培養細胞実験評価系を使用し、本発明の抗腫瘍効果増強活性測定法を適用すると、BM理論による抗癌剤の抗腫瘍増強活性の検出について、CDHPだけでなく、LVにおいても、5-FUとFdUrdの殺細胞効果への増強効果を感度良く検出できる。かくして、FdUrdとCDHPとを有効成分とする抗癌配合剤、さらには、タキソールとCDHPとを有効成分とする抗癌配合剤、ゾメタとCDHPとを有効成分とする抗癌配合剤など、BM理論による新規な抗腫瘍増強活性の付与された抗癌剤が提供される途が拓かれることとなる。
以下に実施例を掲げ、本発明を具体的に説明するが、この実施例は単に本発明の説明のため、その具体的な態様の参考のために提供されているものである。これらの例示は本発明の特定の具体的な態様を説明するためのものであるが、本願で開示する発明の範囲を限定したり、あるいは制限することを表すものではない。本発明では、本明細書の思想に基づく様々な実施形態が可能であることは理解されるべきである。
全ての実施例は、他に詳細に記載するもの以外は、標準的な技術を用いて実施したもの、又は実施することのできるものであり、これは当業者にとり周知で慣用的なものである。
【実施例1】
【0042】
〔材料・方法〕
1) 抗癌剤およびバイオケミカルモジュレーター
5-FU は協和発酵工業株式会社より購入した。還元型葉酸ロイコボリン(LV)は、協和発酵キリン株式会社より購入した。ギメラシル(CDHP)は大鵬薬品工業株式会社から提供を受けた。フルオロデオキシウリジン(FdUrd)は、和光純薬工業株式会社より購入した。
【0043】
2) 組織培養用試薬とその他の試薬
タンパク測定用試薬、BCA試薬は、ThermoScientific社製を使用した。抗生物質含むHanks液とPBS(-)溶液は、日水製薬株式会社から購入した。
抗生物質と17%の牛胎児血清を含むRPMI-1640培地(以下、血清培地と略)は、日水製薬株式会社から購入した。WST-8溶液は、同仁化学薬品株式会社から購入した。組織を包埋する培養基材である熱可逆性ゲル、TGP(Thermo-reversible Gelation Polymer)は、国際先端技術総合研究所株式会社で化学合成したものを使用した。
【0044】
3) 初代3次元組織培養系によるバイオケミカル・モジュレーターの活性測定方法
3−1 癌組織の裁断から播種・包埋工程
病院施設内の倫理委員会規定に従った同意書において、試験材料提供に承諾していただいた胃癌患者からの新鮮手術切除胃癌組織材料(1.0cm角程度の大きさ)と、切除正常胃組織材料あるいは、免疫不全実験小動物に各種固形癌を移植後、増殖した新鮮切除腫瘍を、安全キャビネット内に搬入し、Hanks液で数回洗浄する。洗浄後、固形腫瘍組織をメスで切片を多数切り分け、さらに裁断機(Mcllwain tissue chopper; The Mickle Laboratory Engineering Co.Ltd, 英国)を用いて、癌組織細切片(1mm角程度)に裁断する。
48穴(48well)プレートの各well中に、4℃に冷却したTGP(10%)を混入した血清を含むRPMI-1640培養液(血清培地と略)を0.15 mlづつ注入する。TGP溶液を含む各wellに、裁断した癌組織切片を、5〜7個を目安に入れ、37℃に加温してTGP溶液をゲル化し、癌組織を完全に包埋する。
【0045】
3―2 各種抗癌剤とBM剤との接触培養
ゲル化後に、4段階に濃度を希釈した各抗癌剤単独あるいはBM剤と混合した血清培地0.35mlを各wellに計16well添加する。また同様に、抗癌剤あるいはBM剤を含まない対照群(Control)に、血清培地0.35ml を各well、計7well添加する。抗癌剤あるいはBM剤を混合した抗癌剤と接触培養を37℃、5% CO2大気下炭酸ガスインキュベーター内、6日間の条件で行う。胃癌組織と抗癌剤を含まないブランク群も上記操作と同様に行う。
【0046】
3−3 生細胞の測定と補正
培養終了後、WST-8試薬を添加し、癌組織中の細胞内脱水素酵素量を測定することによりバイアビィリテーを評価した。
すなわち、各wellにWST-8試薬25μLを添加し、一晩、炭酸ガスインキュベーター内で反応後、培地を冷却し、ゾル化した後、その吸光度をマイクロプレートリーダー(Viento XS、大日本住友製薬株式会社)にて、OD450nmの波長で測定する。測定終了後、残存組織片をPBSで3回洗浄し、続いてBCA試薬を用いて、組織中のタンパク質量を測定した。
なお、残存組織片の蛋白質量は、マイクロプレートリーダーでOD562nmの波長の吸光度を測定することにより定量した。ここで、タンパク質量は、BSA(牛血清アルブミン)を標準タンパクに使用した。
【0047】
3−4 生残率の計算とIC50値の算出
各wellの生残率(%)は以下の式に従い算出した。
【0048】
【数1】

【0049】
なお、各ΔOD値は、ブランク値を引いた数値を表すか、あるいは、
【数2】

【0050】
以上のどちらかの式に従って、各被試験抗癌剤の濃度に対する生残率(%)を求め、その用量反応曲線からIC50(μg/ml)を算出する。すなわち、Microsoft社のエクセル(2007)を使用し、X軸(横軸)に抗癌剤濃度を、Y軸(縦軸)に生残率をプロットし、エクセル関数から得られた一次回帰式の傾きとY軸切片から、IC50値を算出した。
【0051】
〔結果〕
1) CDHPによる抗癌剤の抗腫瘍効果増強活性について
CDHPによる5-FUとFdUrdの殺細胞効果増強活性に関する結果を表1にまとめた。
なお、CDHP単独による胃癌組織への細胞毒性(IC50)は133mcg/ml以上であった。5-FUは600mcg/mlからFdUrdは113mcg/mlからそれぞれ、10倍希釈連続4段階による濃度を添加した。5-FUとCDHPあるいはFdUrdとCDHPとのモル比はそれぞれ(5:1)とし、CDHPを両抗癌剤それぞれと混合して添加した。
【0052】
【表1】

【0053】
E.I.はEnhancement Index(促進係数)の略であり、CDHPによる5-FUあるいはFdUrdに対する殺細胞効果の増強活性を示す係数である。
E.I.の数値は以下の式から導き出される。
E.I.= (5-FUのIC50値)/(5-FU+CDHPのIC50値)
あるいは
E.I.= (FdUrdのIC50値)/(FdUrd+CDHPのIC50値)。
なお、E.I.値は1.5以上を記載した。
【0054】
表1の結果から、5-FUに対するCDHPの殺細胞効果増強活性は、調べた4症例において認められ、その増強活性比(促進係数)は1.7から24倍であった。
一方、FdUrdに対するCDHPの殺細胞効果増強活性は、調べた5症例において認められ、その増強活性比(促進係数)は2.6から38倍であった。
【0055】
2) LVによる抗癌剤の抗腫瘍効果増強活性について
LVによる5-FUとFdUrdの殺細胞効果増強活性に関する結果を表2にまとめた。
なお、LV単独による胃癌組織への細胞毒性(IC50)は、236mcg/ml以上であった。5-FUは600mcg/mlから、FdUrdは113mcg/mlから、それぞれ、10倍希釈連続4段階による濃度を添加した。5-FUとLVとのモル比は(1:1)としまた、FdUrdとLVとのモル比は(1:10)とし、LVを両抗癌剤それぞれと混合して添加した。
【0056】
【表2】

【0057】
E.I.はEnhancement Indexの略であり、LVによる5-FUあるいはFdUrdに対する殺細胞効果の増強活性を示す係数である。
E.I.の数値は以下の式から導き出される。
E.I.= (5-FUのIC50値)/(5-FU+LVのIC50値)
あるいは
E.I.= (FdUrdのIC50値) / (FdUrd+LVのIC50値)。
なお、E.I.値は1.5以上を記載した。
【0058】
表2の結果から、5-FUに対するLVの殺細胞増強活性は、調べた4症例において認められ、その増強活性比(促進係数)は、2.6から11倍であった。一方、FdUrdに対するLVの殺細胞効果増強活性は調べた3症例に認められ、その増強活性比(促進係数)は、3.7倍から350倍であった。
【0059】
3) 正常胃組織への毒性について
5-FU単独あるいは、CDHPとの併用とLVとの併用によるヒト初代培養正常胃組織粘膜に対する毒性について、本実験系を使用し、実施した結果を、表3にまとめた。
【0060】
【表3】

【0061】
調べた7症例のうち、CDHPによる毒性増強活性を認めた症例は、1症例(NM081120A)であり、その増強活性比(促進係数)は、12倍であった。またLVによる毒性増強活性を認めた症例は、1症例(NM090105A)であり、その増強活性比(促進係数)は、6.9倍以上であった。表3中の7症例は、表1あるいは表2の症例と同一症例を含み、これら7症例のうち、5-FUの感受性が癌組織の方が高い症例は、6症例であった。一方、癌組織よりも正常胃組織の感受性が高い症例は、1症例(NM090119A)だけであった。
【0062】
〔考察〕
本邦で開発されたS-1(TS-1)は、5-FUをエフェクター(Effector)とし、CDHPが効果増強のモジュレーター(Modulator)として、オタスタットカリウム(Oxo)が副作用軽減のModulatorとして作用するバイオケミカル・モジュレーション(Biochemical Modulation: BM)理論に基づく代表的な抗癌剤である。
Biochemical Modulationとは、ある抗癌剤(Effctor)に他の薬剤(Modulator)を併用することにより、生化学的あるいは薬理学的に明らかな作用機序から、effectorの抗腫瘍効果の増強や副作用の軽減を図り、理論的に裏付けされた併用療法の事を指す。しかし、創薬開発の上流において、ModulatorとEffctorの組み合わせなど、その可能性は無数に存在し、また現況では、感度や実施可能被試験検体化合物数などの点において、新規作用機序などの未知のBiochemical Modulationの発見や開発を目的とした探索研究レベルで、開発競争に打ち勝つ、満足できる測定系がない。
また臨床治療効果においても、患者個別にBiochemical Modulation効果を予測可能な測定系がないのが現状である。もし、癌患者個別にS-1の効果を、投与前に予測する事が出来れば、不要な投与による癌患者の不利益を軽減でき、また異なる抗癌剤の選択することができる。
【0063】
本発明は、その実施例(表1に示す)の結果から、CDHPを含む5-FUの効果を定量的に測定可能とし、また患者個別に、CDHPによる増強活性を検出可能であることを示唆している。
CDHPは、図1に示す5-FUの代謝経路図より、5-FUの分解酵素であるDPDの強力な阻害剤であることは周知の事実である。したがって、5-FUの殺細胞効果に対して、増強する活性を認めた本実施内容は、CDHPの作用機序と一致する。
一方、5-FUの代謝物であるFdUrdの殺細胞効果に対する増強活性は、DPD阻害作用とは異なるCDHPの新規作用機序に基づく増強活性と示唆される。このようにフッ化ピリミジン系抗癌剤に対するバイオケミカル・モジュレーターの新規な増強効果を感度良く見出すことができる、本発明の手法は、今後の創薬開発においても、非常に有効なもので、本発明の方法の使用により新たなBM薬開発が可能であることが予想される。すなわち、癌患者から手術などで切除して得られた腫瘍細胞や腫瘍組織の初代培養系を使用することにより、投薬前に抗癌剤の抗腫瘍効果の予測が可能となる。また、担癌実験動物から得た腫瘍組織を初代培養することにより、検体のランダム化が図れ、多くの被検体の使用が可能となり、実施期間の短縮化また増強活性の強さから、感度良く、未知の陽性検体を拾い上げが可能であることと十分に予想される。
【0064】
上記のデータは、本発明の技術によれば、BM理論による抗癌剤の抗腫瘍増強活性の検出について、CDHPだけでなく、LVにおいても、5-FUとFdUrdの殺細胞効果への増強効果を感度良く検出でき(表2に示す)、しかも患者個別化も図れることから、投与前の事前の効果予測にも十分に応用可能であることを示唆する実施結果と思われる。
5-FUの感受性予測に寄与すると考えられている因子、DPD、TP、OPRTやTSなどの5-FUの腫瘍細胞中代謝経路上の律速酵素群や抗腫瘍効果の標的酵素に関して、基礎的な研究報告がある。すなわち、ヒト実験室馴化細胞株を培養し、得た細胞中の活性と、同細胞株をヌードマウス皮下移植したヒト腫瘍中の発現量あるいは酵素活性とを比較すると、桁違いの差があり、腫瘍中の発現量や酵素活性は1000倍以上高いと報告されている。したがって、同細胞株をin vitro で評価しても、ヌードマウスなどのin vivo の系の代替法にはならず、むしろ、皮下移植後、増殖した腫瘍を切除し、in vitro で本発明方法による3次元初代組織培養実験評価方法で感受性を評価する方が代替法になると十分に予想できる。
【0065】
本発明方法による実施例において、CDHPにおいてはその増強活性比を35倍、またLVにおいては350倍の増強活性比を検出できており、このような倍率は、上記予想を支持するデータと思われる。
バイオケミカル・モジュレーターのうち、副作用軽減に対する効果予測には、表3の実施例で示したように正常組織を初代培養することにより、Effctorである抗癌剤に対する毒性やさらに毒性増強する効果なども感度良く検出できており、さらに、5-FUの化合物の特徴であるウラシルが正常細胞に比べ癌細胞へ取り込みやすい性質も患者個別レベルで予測でき、ヒトへの感受性予測ばかりでなく、本実施例は、副作用の面でも予測可能であることを示唆するものである。
【産業上の利用可能性】
【0066】
本発明の技術は、今後の創薬開発においても、非常に有効なもので、本発明の方法の使用により新たなBM薬開発が可能である。本発明の測定法により、BM理論による抗癌剤の抗腫瘍増強活性の検出を感度良く実施でき、臨床応用に有用であり、さらに、患者個別化も図れ、投与前の事前の効果予測にも応用できる。さらに、副作用軽減に対する効果予測や、個々の患者毎の効果の違いを予測することを可能にし、治療前の効果・毒性・副作用評価系として利用できる。
本発明は、前述の説明及び実施例に特に記載した以外も、実行できることは明らかである。上述の教示に鑑みて、本発明の多くの改変及び変形が可能であり、従ってそれらも本件添付の請求の範囲の範囲内のものである。
【特許請求の範囲】
【請求項1】
三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織を使用した三次元初代培養物実験評価系による測定法であり、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行うもので、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することを特徴とするモジュレーターの抗癌剤に対する効果増強活性測定法。
【請求項2】
エフェクター存在下に、
(a)モジュレーターが存在する場合、
並びに、
(b)モジュレーターが存在しない場合、
の両方のそれぞれで、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付すことを特徴とする請求項1に記載の測定法。
【請求項3】
抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性の測定試薬で処理し、活性測定を行うものであることを特徴とする請求項1又は2に記載の測定法。
【請求項4】
初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性の測定試薬で処理し、次に培地をゾル状態とした後(ゾル化した後)、活性測定を行うものであることを特徴とする請求項1〜3のいずれか一に記載の測定法。
【請求項5】
初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生細胞数の測定を行うものであることを特徴とする請求項1〜4のいずれか一に記載の測定法。
【請求項6】
生存活性の測定試薬が、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行うものであることを特徴とする請求項4又は5に記載の測定法。
【請求項7】
抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行うものであることを特徴とする請求項6に記載の測定法。
【請求項8】
三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織を混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする請求項1〜7のいずれか一に記載の測定法。
【請求項9】
三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織と細胞培養用生理活性物質とを混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする請求項1〜7のいずれか一に記載の測定法。
【請求項10】
培地をゾル状態とすること(ゾル化すること)が、三次元初代培養された初代腫瘍細胞及び/又は初代腫瘍組織を含むゲルを、ゾル−ゲル転移温度より低い温度で液体状態(ゾル状態)とするものであることを特徴とする請求項4〜9のいずれか一に記載の測定法。
【請求項11】
エフェクターが、抗癌剤又はその生体内代謝誘導体であることを特徴とする請求項1に記載の測定法。
【請求項12】
抗癌剤が、分子標的薬、アルキル化剤、代謝拮抗剤、植物アルカロイド、抗癌性抗生物質、プラチナ製剤、ホルモン剤及び生物学的応答調節剤からなる群から選択されたものであることを特徴とする請求項11に記載の測定法。
【請求項13】
モジュレーターが、酵素阻害剤、ホルモン拮抗剤、受容体に対するリガンド、モノクローナル抗体を包含する抗体、サイトカイン類、細胞成長因子類、細胞成長因子阻害物質、代謝促進剤及び代謝阻害剤からなる群から選択されたものであることを特徴とする請求項1に記載の測定法。
【請求項14】
フルオロデオキシウリジン(FdUrd)とギメラシル(CDHP)とを有効成分として含有していることを特徴とする抗癌剤。
【請求項15】
タキソールとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
【請求項16】
ゾメタとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
【請求項1】
三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織を使用した三次元初代培養物実験評価系による測定法であり、エフェクター存在下に、(a)モジュレーターが存在する場合、並びに、(b)モジュレーターが存在しない場合で、それぞれ測定を行うもので、当該三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織に対する抗腫瘍活性増強活性を測定することを特徴とするモジュレーターの抗癌剤に対する効果増強活性測定法。
【請求項2】
エフェクター存在下に、
(a)モジュレーターが存在する場合、
並びに、
(b)モジュレーターが存在しない場合、
の両方のそれぞれで、初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養の状態で使用して、抗腫瘍活性増強活性測定処理に付すことを特徴とする請求項1に記載の測定法。
【請求項3】
抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織を三次元培養の状態下に細胞及び/又は組織の生存活性の測定試薬で処理し、活性測定を行うものであることを特徴とする請求項1又は2に記載の測定法。
【請求項4】
初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織をそのままの三次元培養状態で細胞及び/又は組織の生存活性の測定試薬で処理し、次に培地をゾル状態とした後(ゾル化した後)、活性測定を行うものであることを特徴とする請求項1〜3のいずれか一に記載の測定法。
【請求項5】
初代腫瘍細胞又は初代腫瘍組織を三次元培養し、得られた三次元初代培養腫瘍細胞又は三次元初代培養腫瘍組織につき、その生細胞数の測定を行うものであることを特徴とする請求項1〜4のいずれか一に記載の測定法。
【請求項6】
生存活性の測定試薬が、水溶性色素又は色素源物質を含有し且つ生細胞及び/又は生組織の細胞膜透過性を有するもので、生細胞数の測定を、その生細胞数に比例する色素の吸光度を測定して行うものであることを特徴とする請求項4又は5に記載の測定法。
【請求項7】
抗腫瘍活性増強活性測定が、三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織の生細胞数に比例する色素の吸光度を測定し且つ数値化して行うものであることを特徴とする請求項6に記載の測定法。
【請求項8】
三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織を混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする請求項1〜7のいずれか一に記載の測定法。
【請求項9】
三次元初代培養腫瘍細胞及び/又は三次元初代培養腫瘍組織が、分子内に疎水性部分と親水性部分とを有し、ゾル−ゲル転移温度を有する高分子化合物を含み、且つ、該ゾル−ゲル転移温度より低い温度で可逆的に液体状態(ゾル状態)を示す培養用担体を、該担体のゾル−ゲル転移温度より低い温度で所定の培地と混合し、該混合物中に初代腫瘍細胞及び/又は初代腫瘍組織と細胞培養用生理活性物質とを混入し、前記ゾル−ゲル転移温度より高い温度で上記混合物をゲル状態として、上記初代腫瘍細胞及び/又は初代腫瘍組織の培養を行っているものであることを特徴とする請求項1〜7のいずれか一に記載の測定法。
【請求項10】
培地をゾル状態とすること(ゾル化すること)が、三次元初代培養された初代腫瘍細胞及び/又は初代腫瘍組織を含むゲルを、ゾル−ゲル転移温度より低い温度で液体状態(ゾル状態)とするものであることを特徴とする請求項4〜9のいずれか一に記載の測定法。
【請求項11】
エフェクターが、抗癌剤又はその生体内代謝誘導体であることを特徴とする請求項1に記載の測定法。
【請求項12】
抗癌剤が、分子標的薬、アルキル化剤、代謝拮抗剤、植物アルカロイド、抗癌性抗生物質、プラチナ製剤、ホルモン剤及び生物学的応答調節剤からなる群から選択されたものであることを特徴とする請求項11に記載の測定法。
【請求項13】
モジュレーターが、酵素阻害剤、ホルモン拮抗剤、受容体に対するリガンド、モノクローナル抗体を包含する抗体、サイトカイン類、細胞成長因子類、細胞成長因子阻害物質、代謝促進剤及び代謝阻害剤からなる群から選択されたものであることを特徴とする請求項1に記載の測定法。
【請求項14】
フルオロデオキシウリジン(FdUrd)とギメラシル(CDHP)とを有効成分として含有していることを特徴とする抗癌剤。
【請求項15】
タキソールとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
【請求項16】
ゾメタとCDHPとを有効成分として含有していることを特徴とする抗癌剤。
【図1】




【公開番号】特開2010−246406(P2010−246406A)
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願番号】特願2009−96006(P2009−96006)
【出願日】平成21年4月10日(2009.4.10)
【出願人】(305061771)国際先端技術総合研究所株式会社 (3)
【Fターム(参考)】
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願日】平成21年4月10日(2009.4.10)
【出願人】(305061771)国際先端技術総合研究所株式会社 (3)
【Fターム(参考)】
[ Back to top ]

