抗腫瘍活性剤
【課題】 がんの予防に有用な成分を含有する、抗腫瘍活性を示す組成物の提供。
【解決手段】 担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有することを特徴とする抗腫瘍活性剤。ここで、抗腫瘍活性は、抗変異原活性、抗ウロキナーゼ活性及びDPPHラジカル捕捉活性からなる群から選択される少なくとも一種を指標として評価されるものである。
【解決手段】 担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有することを特徴とする抗腫瘍活性剤。ここで、抗腫瘍活性は、抗変異原活性、抗ウロキナーゼ活性及びDPPHラジカル捕捉活性からなる群から選択される少なくとも一種を指標として評価されるものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アンニンコウ(学名:Grifola gargal)から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有する抗腫瘍活性剤に関する。
【背景技術】
【0002】
戦前の日本人の主たる死因は、結核、胃腸炎、肺炎及び脳血管疾患であり、悪性新生物や心疾患によって死亡する人は少なかった。しかし、戦後は、悪性新生物又は心疾患で死亡する人の割合が急速に上昇し、現在では、これらと脳血管疾患が三大死因となっている。
【0003】
このような状況に対応するためには、生活習慣の改善によるがん予防が重要である。その一次予防策として、食品の持つ生体調節機能の利用に関心が高まっている。キノコ類は、古くから食用としてばかりでなく薬用としても利用されるなど、生体調節機能を持つ食品として知られている。例えば、シイタケやニンギョウタケの成分が抗コレステロール作用を示すこと、マイタケやヒメマツタケの成分が抗腫瘍作用を示すこと、マイタケの成分が抗糖尿作用を示すこと、及びシメジモドキの成分がACE阻害活性を示すことなどが報告がされている。
【0004】
ところで、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するキノコであるアンニンコウ(和名)(学名:グリフォラ・ガルガル(Grifola gargal)は、アルゼンチンの南緯40度以南に広がるパタゴニア地方に自生するキノコである。チリでは食用とされているが、このキノコに含まれている成分やそれらの成分が示す生理活性については、未だ十分に解明されているとはいえない。わずかに、本出願人らが、このキノコに含まれている成分が、破骨細胞形成阻害活性を示すこと(特許文献1乃至3)と、免疫賦活作用及び動脈硬化指数低下作用を示すこと(特許文献4)を明らかにしているにすぎない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−96644
【特許文献2】特開2009−51793
【特許文献3】特開2010−18563
【特許文献4】特開2006−284200
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明者らは、がんの予防に有用な成分の探索を行うこととした。そのような探索に当たり、対象をアンニンコウに絞り、アンニンコウ中の成分を種々の溶媒によって抽出し、得られた抽出物の抗腫瘍活性について研究することとした。本発明の目的は、アンニンコウに由来する抗腫瘍活性剤を提供することと、抗腫瘍活性剤の製造方法を提供することにある。
【課題を解決するための手段】
【0007】
本発明者等は、アンニンコウに抗腫瘍活性を示す成分が含有されているか否かについて研究を行い、その結果として、本発明を完成させた。
【0008】
即ち、本発明は、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有することを特徴とする、抗腫瘍活性剤に関する。
【0009】
上記抗腫瘍活性剤の一態様は、アンニンコウから水で抽出される成分を含有する抗腫瘍活性剤であり、その場合、抗腫瘍活性の指標としては、抗ウロキナーゼ活性及び/又はDPPHラジカル捕捉活性が採用され得る。また、アンニンコウから水で抽出される成分には、ポリフェノール類が含有され得る。
【0010】
上記抗腫瘍活性剤の他の態様は、アンニンコウから無極性溶媒で抽出される成分を含有する抗腫瘍活性剤であり、その場合、抗腫瘍活性の指標としては、抗変異原活性及び/又は抗ウロキナーゼ活性が採用され得る。無極性溶媒の例としては、ヘキサン及び酢酸エチルを挙げることが出来る。
【0011】
また、本発明は、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から無極性溶媒を用いて抽出を行う工程(1)、工程(1)の抽出残渣から、極性非プロトン性溶媒を用いて抽出を行う(2a)及び/又は水以外の極性プロトン性溶媒を用いて抽出を行う(2b)工程(2)、及び工程(2)の抽出残渣から、水抽出を行う工程(3)を含む、アンニンコウから水で抽出される成分を含む抗腫瘍活性剤の製造方法に関する。
【発明の効果】
【0012】
本発明により、抗腫瘍活性剤が提供される。本発明の抗腫瘍活性剤に含有されている有効成分は、食用キノコに含有されている成分であるので、安全性が非常に高く、また、副作用は生起されないことが期待される。
【図面の簡単な説明】
【0013】
【図1】アンニンコウからの有機溶媒抽出物の抗変異原性を示すグラフである。
【図2】シイタケからの有機溶媒抽出物の抗変異原性を示すグラフである。
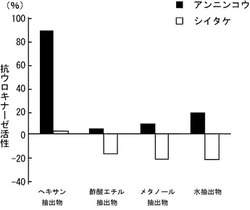
【図3】アンニンコウとシイタケの各々からの有機溶媒抽出物と水抽出物の抗ウロキナーゼ活性を示すグラフである。
【図4】アンニンコウとシイタケの各々からの有機溶媒抽出物と水抽出物のDPPHラジカル捕捉活性を示すグラフである。
【図5】アンニンコウとシイタケの各々からの有機溶媒抽出物と水抽出物のポリフェノール含有量を示すグラフである。
【発明を実施するための形態】
【0014】
本発明の抗腫瘍活性剤は、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウから水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有し、抗腫瘍活性剤を示すものである。水で抽出される成分及び/又は無極性溶媒で抽出される成分を、主成分とするものであることが好ましい。「主成分とする」とは、抗腫瘍活性剤中の抗腫瘍活性を示す成分(有効成分)中の50重量%以上を占めることをいい、より好ましくは有効成分中の60重量%以上、更により好ましくは70重量%以上を、前記した水で抽出される成分及び/又は無極性溶媒で抽出される成分が占めることをいう。
【0015】
抽出に使用される水の温度は、特に限定されない。冷水でも、熱水でもよい。また、抽出に使用される無極性溶媒としては、ヘキサン、ベンゼン、トルエン、ジエチルエーテル、クロロホルム、酢酸エチル及び塩化メチレン等が挙げられる。無極性の抽出溶媒としては、ヘキサン、ベンゼン及び酢酸エチル等がよく使用され、好ましいが、本発明における抗腫瘍活性を示す成分の抽出には、ヘキサン及び酢酸エチルがより好ましく、ヘキサンが特に好ましい。
【0016】
本発明の抗腫瘍活性剤の調製に用いるアンニンコウは、子実体でも菌糸体でもよいが、子実体が好ましい。なお、アンニンコウの人工栽培方法は、例えば特開2007−20560号公報に開示されている。
【0017】
アンニンコウからの溶媒抽出の方法は、アンニンコウ中の成分を溶媒中に溶出させることが出来る方法であればよく、特に限定されない。例えば、アンニンコウの子実体を凍結乾燥し、粉末化したものを溶媒に入れ、得られた混合物を撹拌するか又は得られた混合物を容器に入れて超音波洗浄器中に放置することにより、溶媒抽出を行うことが出来る。
【0018】
なお、アンニンコウから無極性溶媒で抽出を行った残渣には極性成分が残存しているので、この残渣から水抽出を行ってもよい。逆に、アンニンコウから水抽出を行った残渣には非極性成分が残存しているので、この残渣から無極性溶媒抽出を行ってもよい。
【0019】
水抽出を行った場合には、得られた水溶液をそのまま使用してもよいし、水分をある程度蒸発させて濃縮してもよいし、あるいは、凍結乾燥、噴霧乾燥、得られた水溶液にエタノールを加えての共沸等の方法により、溶媒(水−エタノール)を除去してもよい。溶媒を完全に除去してなるものが、水抽出物である。水抽出を行って得られた水溶液やその濃縮物は、水抽出物の水溶液である。
【0020】
無極性溶媒抽出を行った後には、例えば次のようにして無極性溶媒抽出物の調製を行う。先ず、得られた無極性溶媒溶液から、蒸留等の方法によって溶媒を除去する。次いで、残留物を人体への摂取が認められている有機溶媒xであって、抽出に使用した溶媒と相溶性又は混和性を示す有機溶媒xに溶解させ、その後、蒸留等の方法によって有機溶媒xを除去する(以下、「有機溶媒xを使用した洗浄」ということがある)。このような有機溶媒xを使用した洗浄を1回以上行うことにより、抽出に使用した溶媒を完全に除去する。このようにして得られた成分又は成分の混合物が、無極性溶媒抽出物である。なお、有機溶媒xの例として、エタノールが挙げられる。
【0021】
より純度の高い水抽出物を得るためには、アンニンコウから直接水抽出を行うのではなく、水抽出に先立ち、無極性溶媒、極性非プロトン性溶媒、水以外の極性プロトン性溶媒の中の少なくとも一種を用いた抽出を行い、そのような溶媒で不純物を抽出、除去することが好ましい。無極性溶媒の例は、前記したとおりである。極性非プロトン性溶媒の例としては、テトラヒドロフラン、アセトン、アセトニトリル、N,N−ジメチルホルムアミド及びジメチルスルホキシド等が挙げられる。また、水以外の極性プロトン性溶媒の例としては、酢酸、1−ブタノール、2−プロパノール、1−プロパノール、エタノール、メタノール及びギ酸等が挙げられる。抽出は、極性の低い溶媒から高い溶媒へという順序で行う。すなわち、無極性溶媒、極性非プロトン性溶媒、水以外の極性プロトン性溶媒、水の順で抽出を行う。無極性溶媒、極性非プロトン性溶媒及び水以外の極性プロトン性溶媒の各々について、複数の溶媒を用いてもよく、その場合にも、極性の低い方を先に使用する。また、水抽出に先立ち、無極性溶媒、極性非プロトン性溶媒及び水以外の極性プロトン性溶媒の全てを使用しなくてもよい。
【0022】
水抽出物を調製するためのより好ましい方法は、無極性溶媒を用いて抽出を行う工程(1)、工程(1)の抽出残渣から、極性非プロトン性溶媒を用いて抽出を行う(2a)及び/又は水以外の極性プロトン性溶媒を用いて抽出を行う(2b)工程(2)、及び工程(2)の抽出残渣から、水抽出を行う工程(3)を含む方法である。極性非プロトン性溶媒と水以外の極性プロトン性溶媒は、両者を使用してもよいし、一方のみを使用してもよい。但し、両者を使用する場合には、極性非プロトン性溶媒を先に使用する。
【0023】
より純度の高い水抽出物を得るためには、(1)アンニンコウからヘキサン抽出を行い、(2)(1)の残渣から酢酸エチル抽出を行い、(3)(2)の残渣からメタノール抽出を行い、(4)(3)の残渣から水抽出を行うという方法を実施することが好ましい。このような工程を経て得られた水抽出物には、極性の高い成分のみが含有されている。
【0024】
本発明の抗腫瘍活性剤が抗腫瘍活性を示すことは、例えば、抗変異原活性、抗ウロキナーゼ活性及びDPPHラジカル捕捉活性からなる群から選択される少なくとも一種の活性を測定することによって判断することが出来る。これらの活性は、本発明の抗腫瘍活性剤を検体として測定してもよいし、アンニンコウからの無極性溶媒抽出物や水抽出物を検体として測定してもよい。
【0025】
アンニンコウからの水抽出物の抗腫瘍活性を測定する場合には、抗ウロキナーゼ活性及び/又はDPPHラジカル捕捉活性を測定することが好ましい。アンニンコウからの無極性溶媒抽出物の抗腫瘍活性を測定する場合には、抗変異原活性及び/又は抗ウロキナーゼ活性を測定することが好ましい。これらの測定方法は公知であるが、実施例において具体的に記載する。
【0026】
アンニンコウからの水抽出物、無極性溶媒抽出物の各々における、抗腫瘍活性を示す成分の正体は必ずしも明らかではないが、水抽出物については、その活性の少なくとも一部は、ポリフェノール類によって示されていると考えられる。
【0027】
本発明の抗腫瘍活性剤は、アンニンコウからの水抽出物及び/又は無極性溶媒抽出物を含有する。その他の成分は、含有していても含有していなくてもよい。また、その剤型も限定されない。本発明に係る抗腫瘍活性剤は、経口投与を目的として、例えば錠剤、カプセル剤、顆粒剤、細粒剤、散剤等の剤型で、また、非経口投与を目的として、例えば注射剤、吸入剤、座剤、経皮吸収剤等の剤型で提供され得る。従って、このような分野で前記剤型とするために一般的に使用されている添加剤、賦形剤、結合剤、崩壊剤、矯味・矯臭剤、溶剤等が、その他の成分として使用され得る。また、上記必須成分と相乗又は相加効果を示す他の化合物も、その他の成分として使用され得る。その他の成分として、前記水抽出物や無極性溶媒抽出物の抗腫瘍活性に悪影響を与えないものであれば、いずれも使用することが出来る。
【0028】
本発明の抗腫瘍活性剤の摂取量は、特に限定されないが、成人1日当たり、水抽出物や無極性溶媒抽出物の乾燥粉末の量に換算して、0.3乃至2g/kg−体重程度であることが好ましく、0.5乃至1.2g/kg−体重程度であることがさらに好ましい。
【実施例】
【0029】
以下に、実施例により、本発明を具体的に説明する。
【0030】
(実施例1)キノコからの有効成分の抽出
(1)アンニンコウの乾燥粉末の調製
アンニンコウ(株式会社岩出菌学研究所にて人工栽培したもの)の子実体を凍結乾燥した。得られた凍結乾燥品をミキサーに入れ、約1分間粉砕し、粉末とした。
【0031】
(2)シイタケ(学名:Lentinus edodes)の乾燥粉末の調製
対照用として、一般的な食用キノコであるシイタケを選択した。市販の岐阜県産シイタケを、アンニンコウと同様に凍結乾燥し、得られた凍結乾燥品をミキサーに入れ、約1分間粉砕し、粉末とした。
【0032】
(3)キノコからの有効成分の抽出
(3−1)ヘキサン抽出物の調製
三角フラスコに、キノコ(アンニンコウ又はシイタケ)の乾燥粉末1gに対してヘキサン(試薬特級)25mlの割合で、キノコの乾燥粉末とヘキサンとを入れた。このフラスコを水を張った超音波洗浄器に入れ、60分間、超音波抽出を行った。キノコを取り出した後、抽出液中のヘキサンを、減圧下に残渣が乾固するまで留去した。この残渣が以下の実験で使用した「ヘキサン抽出物」である。
【0033】
(3−2)酢酸エチル抽出物の調製
(3−1)において超音波抽出を行った後にヘキサン溶液から分離されたキノコの乾燥粉末に、(3−1)で使用したヘキサンと同量の酢酸エチル(試薬特級)を加え、(3−1)と同様の条件で超音波抽出を行った。キノコを取り出した後、抽出液中の酢酸エチルを、減圧下に残渣が乾固するまで留去した。この残渣が以下の実験で使用した「酢酸エチル抽出物」である。この「酢酸エチル抽出物」には、主として、ヘキサンへの溶解性は低いが酢酸エチルには溶解する疎水性成分が含まれている。
【0034】
(3−3)メタノール抽出物の調製
(3−2)において超音波抽出を行った後に酢酸エチル溶液から分離されたキノコの乾燥粉末に、(3−1)で使用したヘキサンと同量のメタノール(試薬特級)を加え、(3−1)と同様の条件で超音波抽出を行った。キノコを取り出した後、抽出液中のメタノールを、減圧下に残渣が乾固するまで留去した。この残渣が以下の実験で使用した「メタノール抽出物」である。この「メタノール抽出物」には、主として、メタノールに溶解する親水性成分が含まれている。
【0035】
(3−4)水抽出物の調製
(3−3)において超音波抽出を行った後にメタノール溶液から分離されたキノコの乾燥粉末に、(3−1)で使用したヘキサンと同量の蒸留水を加え、(3−1)と同様の条件で超音波抽出を行った。濾過によってキノコを除去した後の水溶液を凍結乾燥した。この凍結乾燥物が「水抽出物」である。この「水抽出物」には、主として、メタノールには溶解せず、水には溶解する親水性(極性)の高い成分が含まれている。この水抽出物に固形分濃度が10mg/mlとなるように蒸留水を加え、「水抽出物の水溶液」として、以下の実験で使用した。
【0036】
(3−5)実験用試料の調製
(3−1)乃至(3−3)で得られた残渣は、各々、適切な濃度となるようにジメチルスルホキシド(DMSO;試薬特級)に溶解して使用した。(3−4)で得られた「水抽出物の水溶液」は、そのままの濃度で使用した。
【0037】
(実施例2)抗変異原性試験
抗変異原性試験は、Ames試験の変法であるプレインキュベーション法で行った(参考文献: 労働省安全部化学物質調査課,微生物を用いる変異原性試験の具体的手法とその解説,「新・微生物を用いる変異原性試験ガイドブック」,改訂第1版、中央ろうどう災害防止協会(東京),53−79頁,1986年)。
【0038】
菌株には、フレームシフト型の変異原性に対して高い検出感度をもつSalmonella typhimurium T98株を用い、対照物質として直接変異原物質である1−ニトロピレン(1−NP;Sigma−Aldrich Fine Chemicals,USA)を使用した。
【0039】
液体培地で前もって培養しておいたT98株の菌液を多数の試験管に取り、各試験管につき、(A)1−NPを0.1μg添加、(B)何も添加しない、(C)1−NPを0.1μg添加し且つ実施例1の(3−1)乃至(3−3)で調製されたヘキサン、酢酸エチル又はメタノール抽出物(以下、「有機溶媒抽出物」ということがある)のDMSO溶液を、有機溶媒抽出物の量が40,80,120,160又は200μgとなるように添加、又は(D)実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液を、有機溶媒抽出物の量が40,80,120,160又は200μgとなるように添加、という作業を行った。これらの試験管を、37℃にて20分間、プレインキュベーションした。各試験管に、少量の栄養素を含んだ軟寒天を加えて混合した。Ames試験用寒天プレート上に、試験管の内容物を均一に広げた。37℃にて48時間培養し、菌を増殖させた。
【0040】
発生したコロニー数をカウントし、下記式に従い、抗変異原活性(%)を求めた。
抗変異原率(%)={1−(C−D/A−B)}×100
A: 1−NPのみを添加した場合の復帰変異コロニー数
B: 何も添加しない場合の自然復帰コロニー数
C: 1−NPと有機溶媒抽出物のDMSO溶液とを添加した場合の復帰変異コロニー数
D: 有機溶媒抽出物のDMSO溶液のみを添加した場合の自然復帰コロニー数
【0041】
結果を図1及び図2に示す。図1は、キノコとしてアンニンコウを使用した場合の結果であり、図2は、シイタケを使用した場合の結果である。アンニンコウ由来成分の抗変異原活性は、ヘキサン抽出物を200μg/プレートで添加した場合の65.4%が最も高かった。また、酢酸エチル抽出物を200μg/プレートで添加した場合にも、41.0%という高い抗変異原活性が示された。したがって、アンニンコウに含有される主たる抗変異原性物質は、疎水性(極性の低い)成分であると考えられた。また、対照として使用したシイタケからの有機溶媒抽出物は、抗変異原活性をほとんど示さなかった。
【0042】
(実施例3) 抗ウロキナーゼ活性試験
がんの浸潤・転移には、がん細胞の癒着、がん細胞による組織のタンパク質分解、がん細胞のリンパ管を通じた転移など、多くの過程がある。これらの過程において、ウロキナーゼ型プラスミノーゲン(uPA)とウロキナーゼ型プラスミノーゲン受容体(uPAR)は、重要な役割を果たしている。よって、uPAとuPARの阻害作用を測定することにより、がんの浸潤・転移を抑制する活性の有無を推察することができる。
【0043】
抗ウロキナーゼ活性試験(参考文献: Jankun, J., Selman, S., Swiercz, R., and Skrzypczak−Jankun, E., Nature, 387(6633), p.561, 1997)には、ウロキナーゼ(calbiochem,USA)と、活性測定用の発色基質としてS−2444(Chromogenix,Italy)を用いた。これらを溶解する緩衝液は、2−アミノ−2−ヒドロキシメチル−1,3−プロパンジオール;Tris,関東化学株式会社,東京),ツィーン(Tween)80(Difco laboratories,USA)及びポリエチレングリコール(PEG8000,Sigma Chemical Co.,USA)を用いて調製した。
【0044】
Trisを50mM濃度で含有し、ツィーン80を0.01重量%で含有し、PEG8000を0.1重量%で含有するTris緩衝液(pH8.8)を調製した。Tris緩衝液にウロキナーゼを7.5単位となるように加え、ウロキナーゼ溶液を調製した。このウロキナーゼ溶液20μlに、有機溶媒抽出物のDMSO溶液(有機溶媒抽出物の濃度は10mg/ml)又は水抽出物水溶液(水抽出物の固形分濃度は10mg/ml)を10μl加え、撹拌下に40℃の湯浴中で15分間反応させた。次いで、S−2444を2mM濃度で含有するTris緩衝液を50μlと、Tris緩衝液のみを120μl加え、更に10分間反応させた。
【0045】
対照として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、代わりにウロキナーゼ溶液にTris緩衝液を180μl加え、それ以外は同様に処理したものを用意した。また、ブランク(ウロキナーゼ及びS−2444無添加)として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液10μlにTris緩衝液190μlを加え、それ以外は同様に処理したものを用意した。
【0046】
405nmにおける吸光度を測定した。得られた吸光度より、下記式に従い、抗ウロキナーゼ活性を算出した。
抗ウロキナーゼ活性(%)=[{A−(B−C)}/A]×100
A: 対照の吸光度
B: 実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液又は(3−4)で調製された水抽出物水溶液を混合したときの吸光度
C: ブランクの吸光度
【0047】
結果を図3に示す。キノコとしてアンニンコウを使用した場合、ヘキサン抽出物に高い抗ウロキナーゼ活性(88.6%)が、また水抽出物にも抗ウロキナーゼ活性(17.2%)があることが分かった。したがって、アンニンコウには、極性の低い(疎水性)物質と極性の高い(親水性)物質の二種類の抗ウロキナーゼ活性を示す物質が存在することが示唆された。図1の結果と併せて考察すると、極性の低い物質は、抗変異原性物質と関連する可能性もあると考えられた。また、カテキン類が抗ウロキナーゼ活性を有することが報告されていることを考慮すると、極性の高い物質は、ポリフェノール類又はその関連物質である可能性があると推察された。一方、シイタケからの抽出物には、抗ウロキナーゼ活性はほとんど見られなかった。
【0048】
(実施例4) DPPHラジカル捕捉活性試験
酸化も、遺伝子を傷つけることにより、発がんに寄与する。そこで、抗酸化活性を、DDPHラジカル捕捉能試験法(参考文献: S. Blois, Nature, 181, p.p.1199−1200, 1958;須田郁夫,抗酸化機能,食品機能研究法,第一版,光琳(東京),218−220頁,2000年)によって測定した。
【0049】
DDPHラジカル捕捉能試験は、定法である比色法によって行った。実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液(有機溶媒抽出物の濃度は10mg/ml)又は(3−4)で調製された水抽出物水溶液(水抽出物の固形分濃度は10mg/ml)300μlに、400mM濃度の1,1−ジフェニル−2−ピクリルヒドラジル(DPPH;1,1−Diphenyl−2−picrylhydrazyl;和光純薬工業株式会社,大阪)水溶液を300μlとリン酸緩衝液(pH6.0)を600μl添加し、常温にて反応させた。
【0050】
対照として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、トロロックス(Trolox(登録商標);6−ヒドロキシ−2,5,7,8−テトラメチルクロマン−2−カルボン酸)の水溶液600μl(トロロックス含有量;60nmol)を加え、それ以外は同様に処理したものを用意した。また、ブランクとして、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、蒸留水300μlを加え、それ以外は同様に処理したものを用意した。
【0051】
DPPH溶液の添加から20分後に、反応溶液の吸光度を、517nmにて測定した。得られた吸光度より、下記式に従い、DPPHラジカル捕捉活性(トロロックス当量)を算出した。
DPPHラジカル捕捉活性(nmol/100μg)=(A−B/C−B)×T/S
A: 実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液又は(3−4)で調製された水抽出物水溶液を混合したときの吸光度
B: ブランクの吸光度
C: 対照の吸光度
T: トロロックスの絶対量
S: 有機溶媒抽出物又は水抽出物の絶対量
【0052】
結果を図4に示す。キノコとしてアンニンコウを使用した場合、水抽出物に高いDPPHラジカル捕捉活性が認められた。具体的には、トロロックス当量で37.2nmol/100μgであった。また、キノコとしてシイタケを使用した場合にも、水抽出物に高い(32.6nmol/100μg)DPPHラジカル捕捉活性が認められた。シイタケの水抽出物は抗ウロキナーゼ活性を示さなかったことから、抗ウロキナーゼ活性を示す物質とDPPHラジカル捕捉活性を示す物質とは、異なる物質であると推察された。
【0053】
(実施例5) 総ポリフェノール量の測定
抗ウロキナーゼ活性を示している物質の候補として、ポリフェノール類が考えられる。そこで、アンニンコウ及びシイタケからの有機溶媒抽出物と水抽出物について、総ポリフェノール量を測定した。
【0054】
総ポリフェノール量の測定には、フェノール試薬(和光純薬工業株式会社,大阪)とクロロゲン酸・5水和物(和光純薬工業株式会社,大阪)とを用い、Folin−Denis法(参考文献: 津志田藤二郎,ポリフェノールの分析法,「食品機能研究法」,第一版,光琳(東京),318−321頁,2000年)で測定した。
【0055】
実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液(有機溶媒抽出物の濃度は10mg/ml)又は(3−4)で調製された水抽出物水溶液(水抽出物の固形分濃度は10mg/ml)100μlに、フェノール試薬を1ml添加し、混合した後、10%炭酸ナトリウム水溶液を1ml添加した。
【0056】
対照として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、クロロゲン酸水溶液を100μl(クロロゲン酸を20μg含有)加え、それ以外は同様に処理したものを用意した。また、ブランクとして、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、蒸留水1mlを加え、それ以外は同様に処理したものを用意した。
【0057】
10%炭酸ナトリウム水溶液の添加後、暗所に1時間静置し、その後760nmにおいて吸光度を測定した。試料溶液中の総ポリフェノール量は、以下の通り、このクロロゲン酸を添加した場合の吸光度より、クロロゲン酸当量に換算して求めた。
クロロゲン酸当量(μg/100μg)=(A−B/C−B)×T/S
A: 実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液又は(3−4)で調製された水抽出物水溶液を混合したときの吸光度
B: ブランクの吸光度
C: 対照の吸光度
T: クロロゲン酸の絶対量
S: 有機溶媒抽出物又は水抽出物の絶対量
【0058】
結果を図5に示す。アンニンコウからの水抽出物は、多量のポリフェノールを含有しており、したがって、ポリフェノール類が抗ウロキナーゼ活性とラジカル捕捉活性の少なくとも一部を担っていると推察された。一方、アンニンコウからのヘキサン抽出物が示す抗ウロキナーゼ活性は、ポリフェノール類によるのではなく、疎水性物質によるものと推察された。
【0059】
シイタケからの水抽出物のポリフェノール量は、アンニンコウに比べて1/5程度と少なく、そのために抗ウロキナーゼ活性が示されなかった可能性がある。また、シイタケ水抽出物のラジカル捕捉活性に関しては、ポリフェノール以外の物質によるか、又は、シイタケにはラジカル捕捉活性が著しく高いポリフェノールが含有されているかのいずれかであると推察された。
【技術分野】
【0001】
本発明は、アンニンコウ(学名:Grifola gargal)から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有する抗腫瘍活性剤に関する。
【背景技術】
【0002】
戦前の日本人の主たる死因は、結核、胃腸炎、肺炎及び脳血管疾患であり、悪性新生物や心疾患によって死亡する人は少なかった。しかし、戦後は、悪性新生物又は心疾患で死亡する人の割合が急速に上昇し、現在では、これらと脳血管疾患が三大死因となっている。
【0003】
このような状況に対応するためには、生活習慣の改善によるがん予防が重要である。その一次予防策として、食品の持つ生体調節機能の利用に関心が高まっている。キノコ類は、古くから食用としてばかりでなく薬用としても利用されるなど、生体調節機能を持つ食品として知られている。例えば、シイタケやニンギョウタケの成分が抗コレステロール作用を示すこと、マイタケやヒメマツタケの成分が抗腫瘍作用を示すこと、マイタケの成分が抗糖尿作用を示すこと、及びシメジモドキの成分がACE阻害活性を示すことなどが報告がされている。
【0004】
ところで、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するキノコであるアンニンコウ(和名)(学名:グリフォラ・ガルガル(Grifola gargal)は、アルゼンチンの南緯40度以南に広がるパタゴニア地方に自生するキノコである。チリでは食用とされているが、このキノコに含まれている成分やそれらの成分が示す生理活性については、未だ十分に解明されているとはいえない。わずかに、本出願人らが、このキノコに含まれている成分が、破骨細胞形成阻害活性を示すこと(特許文献1乃至3)と、免疫賦活作用及び動脈硬化指数低下作用を示すこと(特許文献4)を明らかにしているにすぎない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−96644
【特許文献2】特開2009−51793
【特許文献3】特開2010−18563
【特許文献4】特開2006−284200
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明者らは、がんの予防に有用な成分の探索を行うこととした。そのような探索に当たり、対象をアンニンコウに絞り、アンニンコウ中の成分を種々の溶媒によって抽出し、得られた抽出物の抗腫瘍活性について研究することとした。本発明の目的は、アンニンコウに由来する抗腫瘍活性剤を提供することと、抗腫瘍活性剤の製造方法を提供することにある。
【課題を解決するための手段】
【0007】
本発明者等は、アンニンコウに抗腫瘍活性を示す成分が含有されているか否かについて研究を行い、その結果として、本発明を完成させた。
【0008】
即ち、本発明は、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有することを特徴とする、抗腫瘍活性剤に関する。
【0009】
上記抗腫瘍活性剤の一態様は、アンニンコウから水で抽出される成分を含有する抗腫瘍活性剤であり、その場合、抗腫瘍活性の指標としては、抗ウロキナーゼ活性及び/又はDPPHラジカル捕捉活性が採用され得る。また、アンニンコウから水で抽出される成分には、ポリフェノール類が含有され得る。
【0010】
上記抗腫瘍活性剤の他の態様は、アンニンコウから無極性溶媒で抽出される成分を含有する抗腫瘍活性剤であり、その場合、抗腫瘍活性の指標としては、抗変異原活性及び/又は抗ウロキナーゼ活性が採用され得る。無極性溶媒の例としては、ヘキサン及び酢酸エチルを挙げることが出来る。
【0011】
また、本発明は、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から無極性溶媒を用いて抽出を行う工程(1)、工程(1)の抽出残渣から、極性非プロトン性溶媒を用いて抽出を行う(2a)及び/又は水以外の極性プロトン性溶媒を用いて抽出を行う(2b)工程(2)、及び工程(2)の抽出残渣から、水抽出を行う工程(3)を含む、アンニンコウから水で抽出される成分を含む抗腫瘍活性剤の製造方法に関する。
【発明の効果】
【0012】
本発明により、抗腫瘍活性剤が提供される。本発明の抗腫瘍活性剤に含有されている有効成分は、食用キノコに含有されている成分であるので、安全性が非常に高く、また、副作用は生起されないことが期待される。
【図面の簡単な説明】
【0013】
【図1】アンニンコウからの有機溶媒抽出物の抗変異原性を示すグラフである。
【図2】シイタケからの有機溶媒抽出物の抗変異原性を示すグラフである。
【図3】アンニンコウとシイタケの各々からの有機溶媒抽出物と水抽出物の抗ウロキナーゼ活性を示すグラフである。
【図4】アンニンコウとシイタケの各々からの有機溶媒抽出物と水抽出物のDPPHラジカル捕捉活性を示すグラフである。
【図5】アンニンコウとシイタケの各々からの有機溶媒抽出物と水抽出物のポリフェノール含有量を示すグラフである。
【発明を実施するための形態】
【0014】
本発明の抗腫瘍活性剤は、担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウから水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有し、抗腫瘍活性剤を示すものである。水で抽出される成分及び/又は無極性溶媒で抽出される成分を、主成分とするものであることが好ましい。「主成分とする」とは、抗腫瘍活性剤中の抗腫瘍活性を示す成分(有効成分)中の50重量%以上を占めることをいい、より好ましくは有効成分中の60重量%以上、更により好ましくは70重量%以上を、前記した水で抽出される成分及び/又は無極性溶媒で抽出される成分が占めることをいう。
【0015】
抽出に使用される水の温度は、特に限定されない。冷水でも、熱水でもよい。また、抽出に使用される無極性溶媒としては、ヘキサン、ベンゼン、トルエン、ジエチルエーテル、クロロホルム、酢酸エチル及び塩化メチレン等が挙げられる。無極性の抽出溶媒としては、ヘキサン、ベンゼン及び酢酸エチル等がよく使用され、好ましいが、本発明における抗腫瘍活性を示す成分の抽出には、ヘキサン及び酢酸エチルがより好ましく、ヘキサンが特に好ましい。
【0016】
本発明の抗腫瘍活性剤の調製に用いるアンニンコウは、子実体でも菌糸体でもよいが、子実体が好ましい。なお、アンニンコウの人工栽培方法は、例えば特開2007−20560号公報に開示されている。
【0017】
アンニンコウからの溶媒抽出の方法は、アンニンコウ中の成分を溶媒中に溶出させることが出来る方法であればよく、特に限定されない。例えば、アンニンコウの子実体を凍結乾燥し、粉末化したものを溶媒に入れ、得られた混合物を撹拌するか又は得られた混合物を容器に入れて超音波洗浄器中に放置することにより、溶媒抽出を行うことが出来る。
【0018】
なお、アンニンコウから無極性溶媒で抽出を行った残渣には極性成分が残存しているので、この残渣から水抽出を行ってもよい。逆に、アンニンコウから水抽出を行った残渣には非極性成分が残存しているので、この残渣から無極性溶媒抽出を行ってもよい。
【0019】
水抽出を行った場合には、得られた水溶液をそのまま使用してもよいし、水分をある程度蒸発させて濃縮してもよいし、あるいは、凍結乾燥、噴霧乾燥、得られた水溶液にエタノールを加えての共沸等の方法により、溶媒(水−エタノール)を除去してもよい。溶媒を完全に除去してなるものが、水抽出物である。水抽出を行って得られた水溶液やその濃縮物は、水抽出物の水溶液である。
【0020】
無極性溶媒抽出を行った後には、例えば次のようにして無極性溶媒抽出物の調製を行う。先ず、得られた無極性溶媒溶液から、蒸留等の方法によって溶媒を除去する。次いで、残留物を人体への摂取が認められている有機溶媒xであって、抽出に使用した溶媒と相溶性又は混和性を示す有機溶媒xに溶解させ、その後、蒸留等の方法によって有機溶媒xを除去する(以下、「有機溶媒xを使用した洗浄」ということがある)。このような有機溶媒xを使用した洗浄を1回以上行うことにより、抽出に使用した溶媒を完全に除去する。このようにして得られた成分又は成分の混合物が、無極性溶媒抽出物である。なお、有機溶媒xの例として、エタノールが挙げられる。
【0021】
より純度の高い水抽出物を得るためには、アンニンコウから直接水抽出を行うのではなく、水抽出に先立ち、無極性溶媒、極性非プロトン性溶媒、水以外の極性プロトン性溶媒の中の少なくとも一種を用いた抽出を行い、そのような溶媒で不純物を抽出、除去することが好ましい。無極性溶媒の例は、前記したとおりである。極性非プロトン性溶媒の例としては、テトラヒドロフラン、アセトン、アセトニトリル、N,N−ジメチルホルムアミド及びジメチルスルホキシド等が挙げられる。また、水以外の極性プロトン性溶媒の例としては、酢酸、1−ブタノール、2−プロパノール、1−プロパノール、エタノール、メタノール及びギ酸等が挙げられる。抽出は、極性の低い溶媒から高い溶媒へという順序で行う。すなわち、無極性溶媒、極性非プロトン性溶媒、水以外の極性プロトン性溶媒、水の順で抽出を行う。無極性溶媒、極性非プロトン性溶媒及び水以外の極性プロトン性溶媒の各々について、複数の溶媒を用いてもよく、その場合にも、極性の低い方を先に使用する。また、水抽出に先立ち、無極性溶媒、極性非プロトン性溶媒及び水以外の極性プロトン性溶媒の全てを使用しなくてもよい。
【0022】
水抽出物を調製するためのより好ましい方法は、無極性溶媒を用いて抽出を行う工程(1)、工程(1)の抽出残渣から、極性非プロトン性溶媒を用いて抽出を行う(2a)及び/又は水以外の極性プロトン性溶媒を用いて抽出を行う(2b)工程(2)、及び工程(2)の抽出残渣から、水抽出を行う工程(3)を含む方法である。極性非プロトン性溶媒と水以外の極性プロトン性溶媒は、両者を使用してもよいし、一方のみを使用してもよい。但し、両者を使用する場合には、極性非プロトン性溶媒を先に使用する。
【0023】
より純度の高い水抽出物を得るためには、(1)アンニンコウからヘキサン抽出を行い、(2)(1)の残渣から酢酸エチル抽出を行い、(3)(2)の残渣からメタノール抽出を行い、(4)(3)の残渣から水抽出を行うという方法を実施することが好ましい。このような工程を経て得られた水抽出物には、極性の高い成分のみが含有されている。
【0024】
本発明の抗腫瘍活性剤が抗腫瘍活性を示すことは、例えば、抗変異原活性、抗ウロキナーゼ活性及びDPPHラジカル捕捉活性からなる群から選択される少なくとも一種の活性を測定することによって判断することが出来る。これらの活性は、本発明の抗腫瘍活性剤を検体として測定してもよいし、アンニンコウからの無極性溶媒抽出物や水抽出物を検体として測定してもよい。
【0025】
アンニンコウからの水抽出物の抗腫瘍活性を測定する場合には、抗ウロキナーゼ活性及び/又はDPPHラジカル捕捉活性を測定することが好ましい。アンニンコウからの無極性溶媒抽出物の抗腫瘍活性を測定する場合には、抗変異原活性及び/又は抗ウロキナーゼ活性を測定することが好ましい。これらの測定方法は公知であるが、実施例において具体的に記載する。
【0026】
アンニンコウからの水抽出物、無極性溶媒抽出物の各々における、抗腫瘍活性を示す成分の正体は必ずしも明らかではないが、水抽出物については、その活性の少なくとも一部は、ポリフェノール類によって示されていると考えられる。
【0027】
本発明の抗腫瘍活性剤は、アンニンコウからの水抽出物及び/又は無極性溶媒抽出物を含有する。その他の成分は、含有していても含有していなくてもよい。また、その剤型も限定されない。本発明に係る抗腫瘍活性剤は、経口投与を目的として、例えば錠剤、カプセル剤、顆粒剤、細粒剤、散剤等の剤型で、また、非経口投与を目的として、例えば注射剤、吸入剤、座剤、経皮吸収剤等の剤型で提供され得る。従って、このような分野で前記剤型とするために一般的に使用されている添加剤、賦形剤、結合剤、崩壊剤、矯味・矯臭剤、溶剤等が、その他の成分として使用され得る。また、上記必須成分と相乗又は相加効果を示す他の化合物も、その他の成分として使用され得る。その他の成分として、前記水抽出物や無極性溶媒抽出物の抗腫瘍活性に悪影響を与えないものであれば、いずれも使用することが出来る。
【0028】
本発明の抗腫瘍活性剤の摂取量は、特に限定されないが、成人1日当たり、水抽出物や無極性溶媒抽出物の乾燥粉末の量に換算して、0.3乃至2g/kg−体重程度であることが好ましく、0.5乃至1.2g/kg−体重程度であることがさらに好ましい。
【実施例】
【0029】
以下に、実施例により、本発明を具体的に説明する。
【0030】
(実施例1)キノコからの有効成分の抽出
(1)アンニンコウの乾燥粉末の調製
アンニンコウ(株式会社岩出菌学研究所にて人工栽培したもの)の子実体を凍結乾燥した。得られた凍結乾燥品をミキサーに入れ、約1分間粉砕し、粉末とした。
【0031】
(2)シイタケ(学名:Lentinus edodes)の乾燥粉末の調製
対照用として、一般的な食用キノコであるシイタケを選択した。市販の岐阜県産シイタケを、アンニンコウと同様に凍結乾燥し、得られた凍結乾燥品をミキサーに入れ、約1分間粉砕し、粉末とした。
【0032】
(3)キノコからの有効成分の抽出
(3−1)ヘキサン抽出物の調製
三角フラスコに、キノコ(アンニンコウ又はシイタケ)の乾燥粉末1gに対してヘキサン(試薬特級)25mlの割合で、キノコの乾燥粉末とヘキサンとを入れた。このフラスコを水を張った超音波洗浄器に入れ、60分間、超音波抽出を行った。キノコを取り出した後、抽出液中のヘキサンを、減圧下に残渣が乾固するまで留去した。この残渣が以下の実験で使用した「ヘキサン抽出物」である。
【0033】
(3−2)酢酸エチル抽出物の調製
(3−1)において超音波抽出を行った後にヘキサン溶液から分離されたキノコの乾燥粉末に、(3−1)で使用したヘキサンと同量の酢酸エチル(試薬特級)を加え、(3−1)と同様の条件で超音波抽出を行った。キノコを取り出した後、抽出液中の酢酸エチルを、減圧下に残渣が乾固するまで留去した。この残渣が以下の実験で使用した「酢酸エチル抽出物」である。この「酢酸エチル抽出物」には、主として、ヘキサンへの溶解性は低いが酢酸エチルには溶解する疎水性成分が含まれている。
【0034】
(3−3)メタノール抽出物の調製
(3−2)において超音波抽出を行った後に酢酸エチル溶液から分離されたキノコの乾燥粉末に、(3−1)で使用したヘキサンと同量のメタノール(試薬特級)を加え、(3−1)と同様の条件で超音波抽出を行った。キノコを取り出した後、抽出液中のメタノールを、減圧下に残渣が乾固するまで留去した。この残渣が以下の実験で使用した「メタノール抽出物」である。この「メタノール抽出物」には、主として、メタノールに溶解する親水性成分が含まれている。
【0035】
(3−4)水抽出物の調製
(3−3)において超音波抽出を行った後にメタノール溶液から分離されたキノコの乾燥粉末に、(3−1)で使用したヘキサンと同量の蒸留水を加え、(3−1)と同様の条件で超音波抽出を行った。濾過によってキノコを除去した後の水溶液を凍結乾燥した。この凍結乾燥物が「水抽出物」である。この「水抽出物」には、主として、メタノールには溶解せず、水には溶解する親水性(極性)の高い成分が含まれている。この水抽出物に固形分濃度が10mg/mlとなるように蒸留水を加え、「水抽出物の水溶液」として、以下の実験で使用した。
【0036】
(3−5)実験用試料の調製
(3−1)乃至(3−3)で得られた残渣は、各々、適切な濃度となるようにジメチルスルホキシド(DMSO;試薬特級)に溶解して使用した。(3−4)で得られた「水抽出物の水溶液」は、そのままの濃度で使用した。
【0037】
(実施例2)抗変異原性試験
抗変異原性試験は、Ames試験の変法であるプレインキュベーション法で行った(参考文献: 労働省安全部化学物質調査課,微生物を用いる変異原性試験の具体的手法とその解説,「新・微生物を用いる変異原性試験ガイドブック」,改訂第1版、中央ろうどう災害防止協会(東京),53−79頁,1986年)。
【0038】
菌株には、フレームシフト型の変異原性に対して高い検出感度をもつSalmonella typhimurium T98株を用い、対照物質として直接変異原物質である1−ニトロピレン(1−NP;Sigma−Aldrich Fine Chemicals,USA)を使用した。
【0039】
液体培地で前もって培養しておいたT98株の菌液を多数の試験管に取り、各試験管につき、(A)1−NPを0.1μg添加、(B)何も添加しない、(C)1−NPを0.1μg添加し且つ実施例1の(3−1)乃至(3−3)で調製されたヘキサン、酢酸エチル又はメタノール抽出物(以下、「有機溶媒抽出物」ということがある)のDMSO溶液を、有機溶媒抽出物の量が40,80,120,160又は200μgとなるように添加、又は(D)実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液を、有機溶媒抽出物の量が40,80,120,160又は200μgとなるように添加、という作業を行った。これらの試験管を、37℃にて20分間、プレインキュベーションした。各試験管に、少量の栄養素を含んだ軟寒天を加えて混合した。Ames試験用寒天プレート上に、試験管の内容物を均一に広げた。37℃にて48時間培養し、菌を増殖させた。
【0040】
発生したコロニー数をカウントし、下記式に従い、抗変異原活性(%)を求めた。
抗変異原率(%)={1−(C−D/A−B)}×100
A: 1−NPのみを添加した場合の復帰変異コロニー数
B: 何も添加しない場合の自然復帰コロニー数
C: 1−NPと有機溶媒抽出物のDMSO溶液とを添加した場合の復帰変異コロニー数
D: 有機溶媒抽出物のDMSO溶液のみを添加した場合の自然復帰コロニー数
【0041】
結果を図1及び図2に示す。図1は、キノコとしてアンニンコウを使用した場合の結果であり、図2は、シイタケを使用した場合の結果である。アンニンコウ由来成分の抗変異原活性は、ヘキサン抽出物を200μg/プレートで添加した場合の65.4%が最も高かった。また、酢酸エチル抽出物を200μg/プレートで添加した場合にも、41.0%という高い抗変異原活性が示された。したがって、アンニンコウに含有される主たる抗変異原性物質は、疎水性(極性の低い)成分であると考えられた。また、対照として使用したシイタケからの有機溶媒抽出物は、抗変異原活性をほとんど示さなかった。
【0042】
(実施例3) 抗ウロキナーゼ活性試験
がんの浸潤・転移には、がん細胞の癒着、がん細胞による組織のタンパク質分解、がん細胞のリンパ管を通じた転移など、多くの過程がある。これらの過程において、ウロキナーゼ型プラスミノーゲン(uPA)とウロキナーゼ型プラスミノーゲン受容体(uPAR)は、重要な役割を果たしている。よって、uPAとuPARの阻害作用を測定することにより、がんの浸潤・転移を抑制する活性の有無を推察することができる。
【0043】
抗ウロキナーゼ活性試験(参考文献: Jankun, J., Selman, S., Swiercz, R., and Skrzypczak−Jankun, E., Nature, 387(6633), p.561, 1997)には、ウロキナーゼ(calbiochem,USA)と、活性測定用の発色基質としてS−2444(Chromogenix,Italy)を用いた。これらを溶解する緩衝液は、2−アミノ−2−ヒドロキシメチル−1,3−プロパンジオール;Tris,関東化学株式会社,東京),ツィーン(Tween)80(Difco laboratories,USA)及びポリエチレングリコール(PEG8000,Sigma Chemical Co.,USA)を用いて調製した。
【0044】
Trisを50mM濃度で含有し、ツィーン80を0.01重量%で含有し、PEG8000を0.1重量%で含有するTris緩衝液(pH8.8)を調製した。Tris緩衝液にウロキナーゼを7.5単位となるように加え、ウロキナーゼ溶液を調製した。このウロキナーゼ溶液20μlに、有機溶媒抽出物のDMSO溶液(有機溶媒抽出物の濃度は10mg/ml)又は水抽出物水溶液(水抽出物の固形分濃度は10mg/ml)を10μl加え、撹拌下に40℃の湯浴中で15分間反応させた。次いで、S−2444を2mM濃度で含有するTris緩衝液を50μlと、Tris緩衝液のみを120μl加え、更に10分間反応させた。
【0045】
対照として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、代わりにウロキナーゼ溶液にTris緩衝液を180μl加え、それ以外は同様に処理したものを用意した。また、ブランク(ウロキナーゼ及びS−2444無添加)として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液10μlにTris緩衝液190μlを加え、それ以外は同様に処理したものを用意した。
【0046】
405nmにおける吸光度を測定した。得られた吸光度より、下記式に従い、抗ウロキナーゼ活性を算出した。
抗ウロキナーゼ活性(%)=[{A−(B−C)}/A]×100
A: 対照の吸光度
B: 実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液又は(3−4)で調製された水抽出物水溶液を混合したときの吸光度
C: ブランクの吸光度
【0047】
結果を図3に示す。キノコとしてアンニンコウを使用した場合、ヘキサン抽出物に高い抗ウロキナーゼ活性(88.6%)が、また水抽出物にも抗ウロキナーゼ活性(17.2%)があることが分かった。したがって、アンニンコウには、極性の低い(疎水性)物質と極性の高い(親水性)物質の二種類の抗ウロキナーゼ活性を示す物質が存在することが示唆された。図1の結果と併せて考察すると、極性の低い物質は、抗変異原性物質と関連する可能性もあると考えられた。また、カテキン類が抗ウロキナーゼ活性を有することが報告されていることを考慮すると、極性の高い物質は、ポリフェノール類又はその関連物質である可能性があると推察された。一方、シイタケからの抽出物には、抗ウロキナーゼ活性はほとんど見られなかった。
【0048】
(実施例4) DPPHラジカル捕捉活性試験
酸化も、遺伝子を傷つけることにより、発がんに寄与する。そこで、抗酸化活性を、DDPHラジカル捕捉能試験法(参考文献: S. Blois, Nature, 181, p.p.1199−1200, 1958;須田郁夫,抗酸化機能,食品機能研究法,第一版,光琳(東京),218−220頁,2000年)によって測定した。
【0049】
DDPHラジカル捕捉能試験は、定法である比色法によって行った。実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液(有機溶媒抽出物の濃度は10mg/ml)又は(3−4)で調製された水抽出物水溶液(水抽出物の固形分濃度は10mg/ml)300μlに、400mM濃度の1,1−ジフェニル−2−ピクリルヒドラジル(DPPH;1,1−Diphenyl−2−picrylhydrazyl;和光純薬工業株式会社,大阪)水溶液を300μlとリン酸緩衝液(pH6.0)を600μl添加し、常温にて反応させた。
【0050】
対照として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、トロロックス(Trolox(登録商標);6−ヒドロキシ−2,5,7,8−テトラメチルクロマン−2−カルボン酸)の水溶液600μl(トロロックス含有量;60nmol)を加え、それ以外は同様に処理したものを用意した。また、ブランクとして、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、蒸留水300μlを加え、それ以外は同様に処理したものを用意した。
【0051】
DPPH溶液の添加から20分後に、反応溶液の吸光度を、517nmにて測定した。得られた吸光度より、下記式に従い、DPPHラジカル捕捉活性(トロロックス当量)を算出した。
DPPHラジカル捕捉活性(nmol/100μg)=(A−B/C−B)×T/S
A: 実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液又は(3−4)で調製された水抽出物水溶液を混合したときの吸光度
B: ブランクの吸光度
C: 対照の吸光度
T: トロロックスの絶対量
S: 有機溶媒抽出物又は水抽出物の絶対量
【0052】
結果を図4に示す。キノコとしてアンニンコウを使用した場合、水抽出物に高いDPPHラジカル捕捉活性が認められた。具体的には、トロロックス当量で37.2nmol/100μgであった。また、キノコとしてシイタケを使用した場合にも、水抽出物に高い(32.6nmol/100μg)DPPHラジカル捕捉活性が認められた。シイタケの水抽出物は抗ウロキナーゼ活性を示さなかったことから、抗ウロキナーゼ活性を示す物質とDPPHラジカル捕捉活性を示す物質とは、異なる物質であると推察された。
【0053】
(実施例5) 総ポリフェノール量の測定
抗ウロキナーゼ活性を示している物質の候補として、ポリフェノール類が考えられる。そこで、アンニンコウ及びシイタケからの有機溶媒抽出物と水抽出物について、総ポリフェノール量を測定した。
【0054】
総ポリフェノール量の測定には、フェノール試薬(和光純薬工業株式会社,大阪)とクロロゲン酸・5水和物(和光純薬工業株式会社,大阪)とを用い、Folin−Denis法(参考文献: 津志田藤二郎,ポリフェノールの分析法,「食品機能研究法」,第一版,光琳(東京),318−321頁,2000年)で測定した。
【0055】
実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液(有機溶媒抽出物の濃度は10mg/ml)又は(3−4)で調製された水抽出物水溶液(水抽出物の固形分濃度は10mg/ml)100μlに、フェノール試薬を1ml添加し、混合した後、10%炭酸ナトリウム水溶液を1ml添加した。
【0056】
対照として、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、クロロゲン酸水溶液を100μl(クロロゲン酸を20μg含有)加え、それ以外は同様に処理したものを用意した。また、ブランクとして、有機溶媒抽出物のDMSO溶液又は水抽出物水溶液を使用せず、蒸留水1mlを加え、それ以外は同様に処理したものを用意した。
【0057】
10%炭酸ナトリウム水溶液の添加後、暗所に1時間静置し、その後760nmにおいて吸光度を測定した。試料溶液中の総ポリフェノール量は、以下の通り、このクロロゲン酸を添加した場合の吸光度より、クロロゲン酸当量に換算して求めた。
クロロゲン酸当量(μg/100μg)=(A−B/C−B)×T/S
A: 実施例1の(3−1)乃至(3−3)で調製された有機溶媒抽出物のDMSO溶液又は(3−4)で調製された水抽出物水溶液を混合したときの吸光度
B: ブランクの吸光度
C: 対照の吸光度
T: クロロゲン酸の絶対量
S: 有機溶媒抽出物又は水抽出物の絶対量
【0058】
結果を図5に示す。アンニンコウからの水抽出物は、多量のポリフェノールを含有しており、したがって、ポリフェノール類が抗ウロキナーゼ活性とラジカル捕捉活性の少なくとも一部を担っていると推察された。一方、アンニンコウからのヘキサン抽出物が示す抗ウロキナーゼ活性は、ポリフェノール類によるのではなく、疎水性物質によるものと推察された。
【0059】
シイタケからの水抽出物のポリフェノール量は、アンニンコウに比べて1/5程度と少なく、そのために抗ウロキナーゼ活性が示されなかった可能性がある。また、シイタケ水抽出物のラジカル捕捉活性に関しては、ポリフェノール以外の物質によるか、又は、シイタケにはラジカル捕捉活性が著しく高いポリフェノールが含有されているかのいずれかであると推察された。
【特許請求の範囲】
【請求項1】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有することを特徴とする、抗腫瘍活性剤。
【請求項2】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分を含有する、請求項1に記載の抗腫瘍活性剤。
【請求項3】
抗腫瘍活性の指標が抗ウロキナーゼ活性及び/又はDPPHラジカル捕捉活性である、請求項2に記載の抗腫瘍活性剤。
【請求項4】
ポリフェノール類を含有する、請求項3に記載の抗腫瘍活性剤。
【請求項5】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から無極性溶媒で抽出される成分を含有する、請求項1に記載の抗腫瘍活性剤。
【請求項6】
無極性溶媒がヘキサン又は酢酸エチルである、請求項5に記載の抗腫瘍活性剤。
【請求項7】
無極性溶媒がヘキサンである、請求項6に記載の抗腫瘍活性剤。
【請求項8】
抗腫瘍活性の指標が抗変異原活性及び/又は抗ウロキナーゼ活性である、請求項5乃至7のいずれか一項に記載の抗腫瘍活性剤。
【請求項9】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から無極性溶媒を用いて抽出を行う工程(1)、工程(1)の抽出残渣から、極性非プロトン性溶媒を用いて抽出を行う(2a)及び/又は水以外の極性プロトン性溶媒を用いて抽出を行う(2b)工程(2)、及び工程(2)の抽出残渣から、水抽出を行う工程(3)を含む、請求項2乃至4のいずれか一項に記載の抗腫瘍活性剤の製造方法。
【請求項1】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分、及び/又は、無極性溶媒で抽出される成分を含有することを特徴とする、抗腫瘍活性剤。
【請求項2】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から水で抽出される成分を含有する、請求項1に記載の抗腫瘍活性剤。
【請求項3】
抗腫瘍活性の指標が抗ウロキナーゼ活性及び/又はDPPHラジカル捕捉活性である、請求項2に記載の抗腫瘍活性剤。
【請求項4】
ポリフェノール類を含有する、請求項3に記載の抗腫瘍活性剤。
【請求項5】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から無極性溶媒で抽出される成分を含有する、請求項1に記載の抗腫瘍活性剤。
【請求項6】
無極性溶媒がヘキサン又は酢酸エチルである、請求項5に記載の抗腫瘍活性剤。
【請求項7】
無極性溶媒がヘキサンである、請求項6に記載の抗腫瘍活性剤。
【請求項8】
抗腫瘍活性の指標が抗変異原活性及び/又は抗ウロキナーゼ活性である、請求項5乃至7のいずれか一項に記載の抗腫瘍活性剤。
【請求項9】
担子菌類、ヒダナシタケ目、サルノコシカケ科、マイタケ属に属するアンニンコウ(学名:グリフォラ・ガルガル(Grifola gargal))から無極性溶媒を用いて抽出を行う工程(1)、工程(1)の抽出残渣から、極性非プロトン性溶媒を用いて抽出を行う(2a)及び/又は水以外の極性プロトン性溶媒を用いて抽出を行う(2b)工程(2)、及び工程(2)の抽出残渣から、水抽出を行う工程(3)を含む、請求項2乃至4のいずれか一項に記載の抗腫瘍活性剤の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−256127(P2011−256127A)
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2010−131045(P2010−131045)
【出願日】平成22年6月8日(2010.6.8)
【出願人】(000141381)株式会社岩出菌学研究所 (14)
【Fターム(参考)】
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願日】平成22年6月8日(2010.6.8)
【出願人】(000141381)株式会社岩出菌学研究所 (14)
【Fターム(参考)】
[ Back to top ]

