抗薬物抗体アッセイ法
【課題】抗薬物抗体の測定法と、そのようなアッセイ法を用いるためのキットを提供する。
【解決手段】捕獲薬物抗体が少なくとも2つの異なる抗体部位で固相に結合した薬物抗体の混合物であり、トレーサー薬物抗体が少なくとも2つの異なる抗体部位で検出可能な標識に結合した薬物抗体の混合物であることを特徴とする、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイ法を用いて、試料における薬物抗体に対する抗体を免疫学的に測定する。
【解決手段】捕獲薬物抗体が少なくとも2つの異なる抗体部位で固相に結合した薬物抗体の混合物であり、トレーサー薬物抗体が少なくとも2つの異なる抗体部位で検出可能な標識に結合した薬物抗体の混合物であることを特徴とする、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイ法を用いて、試料における薬物抗体に対する抗体を免疫学的に測定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗薬物抗体の測定法と、そのようなアッセイ法を用いるためのキットを含む。
【背景技術】
【0002】
発明の背景
モノクローナル抗体による標準的な固相イムノアッセイ法は、固相において吸収/固定された抗体(捕獲抗体)、抗原、および酵素に結合させた抗原のもう1つのエピトープに対する抗体(トレーサー抗体)の間の複合体の形成を伴う。このように、サンドイッチ:固相-捕獲抗体-抗原-トレーサー抗体が形成される。サンドイッチによって触媒される反応において、抗体結合酵素の活性は、インキュベーション培地における抗原濃度に比例する。標準的なサンドイッチ法はまた、捕獲およびトレーサー抗体が抗原の異なるエピトープに結合することから、二重抗原架橋イムノアッセイとも呼ばれる。Hoesel, W., et al., in J. Immunol. Methods 294 (2004) 101-110(非特許文献1)は、それによってアミノ基および炭水化物にカップリングした固定rhEPOの混合物を用いる抗EPO二重抗原架橋アッセイを報告している。二重抗原架橋ELISAのようなイムノアッセイは、抗体薬に対する患者の免疫原性の答えを調べるために一般的なアッセイタイプである。Mire-Sluis, A.R., et al., J. Immunol. Methods 289 (2004) 1-16(非特許文献2)は、生物工学産物に対する宿主抗体の検出を用いてイムノアッセイの設計および最適化に関する推奨を要約している。Mire-Sluis et al.によれば、周知の抗薬物抗体アッセイフォーマットは、かなりの短所を示す。抗薬物抗体アッセイは、たとえば、WO 2005/045058(特許文献1)およびWO 90/006515(特許文献2)において言及されている。抗イディオタイプ抗体アッセイは、たとえば、US 5,219,730(特許文献3);WO 87/002778(特許文献4);EP 0 139 389(特許文献5);およびEP 0 170 302(特許文献6)において言及されている。Wadhwa, M., et al., in J. Immunol. Methods 278 (2003) 1-17(非特許文献3)は、治療的生物学的物質によって誘導された望ましくない抗体の検出、測定、および特徴付けに関する戦略を報告している。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】WO 2005/045058
【特許文献2】WO 90/006515
【特許文献3】US 5,219,730
【特許文献4】WO 87/002778
【特許文献5】EP 0 139 389
【特許文献6】EP 0 170 302
【非特許文献】
【0004】
【非特許文献1】Hoesel, W., et al., in J. Immunol. Methods 294 (2004) 101-110
【非特許文献2】Mire-Sluis, A.R., et al., J. Immunol. Methods 289 (2004) 1-16
【非特許文献3】Wadhwa, M., et al., in J. Immunol. Methods 278 (2003) 1-17
【発明の概要】
【0005】
発明の概要
本発明は、二重抗原架橋イムノアッセイ法を用いて試料中の薬物抗体に対する抗体の免疫学的測定のための方法および手段を提供する。
【0006】
本発明は、捕獲薬物抗体が、それらが固相に結合される抗体部位が異なる少なくとも2つの薬物抗体を含む薬物抗体の混合物であって、トレーサー薬物抗体が、それらが検出可能な標識に結合される抗体部位が異なる少なくとも2つの薬物抗体を含む薬物抗体の混合物であることを特徴とする、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイ法を用いて、試料における薬物抗体に対する抗体の免疫学的測定のための方法を提供する。
【0007】
好ましくは、その結合パートナーに対する薬物抗体の結合は、N末端および/またはε-末端アミノ基(リジン)、異なるリジンのε-アミノ基、薬物抗体のアミノ酸骨格のカルボキシ-、スルフヒドリル-、ヒドロキシル-および/またはフェノール官能基、ならびに/または薬物抗体の糖鎖構造の糖アルコール基による化学結合によって行われる。
【0008】
好ましくは、捕獲薬物抗体混合物は、その結合パートナーに対するアミノ基および糖鎖構造によって結合された薬物抗体を含む。
【0009】
好ましくは、捕獲薬物抗体混合物および/またはトレーサー薬物抗体混合物は、その結合パートナーに対して少なくとも2つの異なるアミノ基を通して結合した薬物抗体を含む。異なるアミノ基によるそのようなカップリングは、化学保護物質によるε-アミノ基の一部のアシル化によって、たとえば最初の段階におけるシトラコニル化によって行うことができる。第二段階において、残りのアミノ基によって結合を行う。次に、シトラコニル化を除去して、残りの遊離のアミノ基を通して薬物抗体を結合パートナーに結合させる、すなわち得られた薬物抗体を、シトラコニル化によって保護されていないアミノ基を通して結合パートナーに結合させる。
【0010】
適した化学保護基は、保護されていない側鎖アミンで結合を形成し、N末端での結合より不安定であり、それらの結合とは異なる。そのような多くの化学保護物質が公知である(たとえば、欧州特許出願EP 0 651 761を参照されたい)。好ましい化学保護基には、マレイン酸またはシトラコニン酸無水物のような環状ジカルボン酸無水物が含まれる。
【0011】
好ましくは、捕獲薬物抗体は、受動吸着によって固相に結合され、したがって、少なくとも2つの異なる抗体部位で固相に結合される。受動吸着は、たとえばButler, J.E., in "Solid Phases in Immunoassay" 205-225;Diamandis, E.P., and Christopoulos, T.K. (Editors): Immunoassays (1996) Academic Press San Diegoによって記述されている。
【0012】
好ましくは、トレーサー薬物抗体混合物は、その結合パートナーに対してアミノ基および糖鎖構造を通して結合された薬物抗体を含む。
【0013】
好ましくは、捕獲薬物抗体対トレーサー薬物抗体の比は、1:10〜50:1(比は異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)である。
【0014】
好ましくは、アミノ結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)対炭水化物結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)の比はそのような混合物において1:10〜10:1(比は、異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)である。
【0015】
本発明の好ましい態様において、捕獲薬物抗体は、特異的結合対を通して結合(固定)される。そのような結合対(第一の成分/第二の成分)は、たとえばストレプトアビジンまたはアビジン/ビオチン、抗体/抗原(たとえば、Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press, 1996を参照されたい)、レクチン/多糖類、ステロイド/ステロイド結合タンパク質、ホルモン/ホルモン受容体、酵素/基質、IgG/プロテインAおよび/またはG等である。好ましくは捕獲薬物抗体はビオチンに結合され、固定は、固定されたアビジンまたはストレプトアビジンによって行われる。
【0016】
本発明の好ましい態様において、トレーサー薬物抗体は、検出可能な標識に結合され、好ましくは特異的結合対を通して結合される。そのような結合対(第一の成分/第二の成分)は、たとえばストレプトアビジンまたはアビジン/ビオチン、抗体/抗原(たとえば、Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press, 1996を参照されたい)、レクチン/多糖類、ステロイド/ステロイド結合タンパク質、ホルモン/ホルモン受容体、酵素/基質、IgG/プロテインAおよび/またはG等である。好ましくは、トレーサー薬物抗体は、ジゴキシゲニンおよびジゴキシゲニンに対する抗体によって検出可能な標識に結合される。または、トレーサー薬物抗体は、ルテニウムビスピリジル錯体のようなエレクトロケミルミネッセント標識に結合される。
【図面の簡単な説明】
【0017】
【図1】抗薬物抗体の検出のための架橋アッセイ ビオチン化薬物抗体(Capture-BI)をストレプトアビジンコーティングマイクロタイタープレート(SA-MTP)に結合させる。抗薬物抗体は、ジゴキシゲニン標識トレーサー薬物抗体(Tracer-DIG;DIG=ジゴキシニル化)と共に、捕獲薬物抗体(Capture-BI;BI=ビオチニル化)に架橋する。固定された複合体をポリクローナル抗ジゴキシゲニン西洋ワサビペルオキシダーゼ結合体(pAB<DIG>-POD)によって検出する。ポリクローナルウサギ抗薬物抗体(rpAB)を標準物質として用いる。
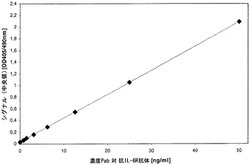
【図2】実施例1および4の結合体を用いる架橋ELISA変化型1の標準曲線: 5%ヒト血清を有するPBS-T緩衝液(リン酸緩衝生理食塩液、0.05容積%Tween(登録商標)20)において希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図3】実施例2および5の結合体を用いる架橋ELISA変化型2の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図4】実施例3および6の結合体を用いる架橋ELISA変化型3の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図5】実施例1、3、および4、6の結合体を用いる架橋ELISA変化型4の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図6】実施例1、2、3および4、5、6の結合体を用いる架橋ELISA変化型5の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図7】固相固定のための受動吸着を用いる架橋ELISA変化型1の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【発明を実施するための形態】
【0018】
発明の詳細な説明
本発明に係る「薬物抗体」という用語は、個体の試料が投与後に薬物抗体を含むことが疑われるように、個体に投与することができる抗体を示す。本発明に従って行われる1つのアッセイ法において、薬物抗体、捕獲薬物抗体、およびトレーサー薬物抗体は、「同じ」抗体分子、たとえば同じ発現ベクターによって組換えによって産生され、同じアミノ酸配列を含む分子を含む。薬物抗体(治療的モノクローナル抗体)は、腫瘍遺伝子疾患(たとえば、非ホジキンリンパ腫、乳癌、および結腸直腸癌を含む血液および固形悪性腫瘍)のような様々な疾患の処置のために広く用いられている。そのような抗体は、たとえばLevene, A.P., et al., Journal of the Royal Society of Medicine 98 (2005) 146-152において記述されている。そのような抗体は、たとえばCD20、CD22、HLA-DR、CD33、CD52、EGFR、G250、GD3、HER2、PSMA、CD56、VEGF、VEGF2、CEA、Levis Y抗原、IL-6受容体、またはIGF-1受容体に対する抗体である。治療抗体はまた、Groner, B., et al., Curr. Mol. Med. 4 (2004)539-547;およびHarris, M., Lancet Oncol. 5 (2004) 292-302によって記述される。
【0019】
例示的な(好ましくはモノクローナル)抗体は、IL-6受容体に対する抗体(mAB IL-6R)である。そのような抗体は、たとえばMihara et al., Clin. Immunol. 98 (2001) 319-326;Nishimoto, N., et al, Blood 106 (2005) 2627-2632、臨床試験第NCT00046774号、またはWO 2004/096274によって記述されている。
【0020】
例示的な(好ましくはモノクローナル)抗体は、IGF-1受容体に対する抗体(mAB IGF-1R)である。そのような抗体は、たとえば、WO 2004/087756またはWO 2005/005635において記述されている。
【0021】
抗薬物抗体は、薬物抗体の可変領域、定常領域、または糖構造のような、薬物抗体の任意の領域に対して向けられる抗体である。そのような抗薬物抗体は、患者の免疫原性反応として抗体治療の際に起こる可能性がある(Pan, Y., et al., FASEB J. 9 (1995) 43-49を参照されたい)。
【0022】
モノクローナル抗体は、タンパク質として多くの反応性側鎖を含有する。抗体のそのような反応性の化学基は、たとえばアミノ基(リジン、α-アミノ基)、チオール基(シスチン、システイン、およびメチオニン)、カルボン酸基(アスパラギン酸、グルタミン酸)および糖-アルコール基である。
【0023】
本発明に係るイムノアッセイ法の固相支持体は当技術分野において広く記述されている(たとえばButler, J.E., Methods 22 (2000) 4-23を参照されたい。
【0024】
異なるイムノアッセイ法の原理は、たとえばHage, D. S., in Anal. Chem. 71 (1999) 294R-304Rによって記述されている。Lu, B., et al., Analyst 121 (1996) 29R-32Rは、イムノアッセイ法において用いるための抗体の方向性の固定を報告している。アビジン-ビオチン媒介イムノアッセイ法は、たとえばWilchek, M., and Bayer, E.A., Methods Enzymol. 184 (1990) 467-469によって報告されている。
【0025】
モノクローナル抗体およびその定常ドメインは、タンパク質として、表面、タンパク質、PEG、セルロースもしくはポリスチロールのようなポリマー、酵素、または結合パートナーのメンバーのような、結合パートナーとカップリングするための多くの反応性側鎖を含有する。抗体の化学反応基は、たとえばアミノ基(リジン、α-アミノ基)、チオール基(シスチン、システイン、およびメチオニン)、カルボン酸基(アスパラギン酸、グルタミン酸)、および糖アルコール基である。そのような抗体は、たとえばAslam M., and Dent A., Bioconjugation, MacMillan Ref. Ltd. 1998, pp. 50-100によって記述されている。
【0026】
タンパク質の最も一般的な反応性基の1つは、アミノ酸リジンの脂肪族ε-アミンである。一般的に、ほぼ全ての抗体が、豊富なリジンを含有する。リジンアミンは、pH 8.0より上で妥当に良好な求核性(pKa=9.18)を有し、したがって、多数の試薬と容易かつきれいに反応して安定な結合を形成する。
【0027】
抗体における他の一般的な反応基は、硫黄含有アミノ酸シスチンおよびその還元産物システイン(またはハーフシスチン)からのチオール残基である。システインは、アミンより求核性が高く、一般的にタンパク質における最も反応性の高い官能基である遊離のチオール基を含有する。チオールは一般的に、中性pHで反応性であり、したがってアミンの存在下で選択的に他の分子とカップリングすることができる。
【0028】
遊離のスルフヒドリル基は、比較的反応性であることから、これらの基を有するタンパク質は、しばしばジスルフィド基またはジスルフィド結合としてのその酸化型でそれらと共に存在する。免疫グロブリンMはジスルフィド連結五量体の例であるが、免疫グロブリンGのサブユニットは内部ジスルフィド架橋によって結合される。そのようなタンパク質において、反応性の遊離のチオールを生成するためには、ジチオスレイトール(DTT)のような試薬によるジスルフィド結合の還元が必要である。しかし、この方法はまた、これらの抗体における鎖の連結を分解して、鎖を適切に折り畳ませる再構築が可能でない可能性がある。シスチンおよびシステインのほかに、いくつかのタンパク質はまた、チオエーテル連結において硫黄を含有するアミノ酸メチオニンを有する。メチオニンの選択的改変は一般的に行うことが難しく、一般的に薬物および他の分子を抗体に付着させる方法としてほとんど用いられない。文献は、反応性のアミノ基によって多数のスルフヒドリル基を導入する効率的な方法を提供するために、Traut試薬(2-イミノチオラン)、スクシニミジル(アセチルチオ)アセテート(SATA)、およびスルホスクシニミジル6-[3-(2-ピリジルジチオ)プロピオンアミド]ヘキサノエート(Sulfo-LC-SPDP)のようないくつかのチオール化クロスリンク試薬を用いることを報告している。
【0029】
生体結合化学は、化学的または生物学的手段によって、他の生体分子、低分子、およびポリマーに生体分子を連結させることである。これには、抗体およびその断片、核酸およびその類似体、ならびにリポソーム成分(または他の生物学的活性分子)の、互いの、または有用な特性を付加する任意の分子基との結合が含まれる。これらの分子基には、放射性核種、薬物、毒素、酵素、金属キレート、蛍光体、ハプテン、およびその他が含まれる。
【0030】
抗体におけるもう1つの一般的な反応基は、カルボン酸(アスパラギン酸、グルタミン酸)である。タンパク質は、C-末端部分およびアスパラギン酸およびグルタミン酸の側鎖内でカルボン酸基を含有する。水中でのカルボン酸の比較的低い反応性のために、通常、タンパク質および他の生体分子を選択的に改変するためにこれらの基を用いることは難しい。これを行う場合、水溶性のカルボジイミドを用いることによって、カルボン酸基を通常、反応性のエステルに変換し、アミン、ヒドラジド、またはヒドラジンのような求核試薬に反応させる。アミン含有試薬は、タンパク質上の他のアミンの存在下で活性化カルボン酸と選択的に反応するためには、弱い塩基性でなければならない。タンパク質のクロスリンクは、pHが8.0より上昇した場合に起こりうる。
【0031】
過ヨウ素酸ナトリウムは、炭水化物部分内の糖のアルコール部分をアルデヒドに酸化するために用いることができる。それぞれのアルデヒド基は、カルボン酸に関して記述されるように、アミン、ヒドラジド、またはヒドラジンと反応することができる。炭水化物部分は、抗体の結晶可能な断片(Fc)領域において主に見いだされることから、抗原結合部位から離れた炭水化物の部位特異的改変を通して結合を行うことができる。
【0032】
アミン反応性試薬は、リジンおよびタンパク質のα-アミノ基と主に反応する。反応性のエステル、特にN-ヒドロキシ-シクシニミド(NHS)エステルはアミン基の改変のために最も一般的に用いられる試薬である。水性環境における反応に関して最適なpHはpH 8.0〜9.0である。イソチオシアネートは、アミン改変試薬であり、タンパク質とチオウレア結合を形成する。それらは、水溶液(最適にpH 9.0〜9.5)においてタンパク質アミンと反応する。アルデヒドは、脂肪族および芳香族アミン、ヒドラジン、およびヒドラジドと軽度の水性条件で反応して、イミン中間体(シッフ塩基)を形成する。シッフ塩基を、軽度または強い還元剤(ホウ化水素ナトリウム、またはシアノホウ化水素ナトリウムのような)によって選択的に還元させて、安定なアルキルアミン結合を誘導することができる。
【0033】
アミンを改変するために用いられている他の試薬は、酸無水物である。たとえば、ジエチレントリアミン五酢酸無水物(DTPA)は、2つのアミン反応性のアンヒドリド基を含有する二官能キレート物質である。これは、タンパク質のN末端およびε-アミン基と反応して、アミド連結を形成することができる。アンヒドリド環は開環して、配位錯体において金属に堅固に結合することができる多価の金属キレート形成アームを作製する。
【0034】
チオール反応性試薬は、タンパク質上のチオール基にカップリングしてチオエーテルカップリング産物を形成する試薬である。これらの試薬は、わずかに酸性から中性pHで急速に反応し、したがってアミン基の存在下で選択的に反応させることができる。
【0035】
ハロアセチル誘導体、たとえばヨードアセトアミドはチオエーテル結合を形成して、チオール改変のための試薬である。抗体において、反応は、内因性に存在するか、または抗体の様々な部分でシスチンのジスルフィドの還元に起因するシステイン基で起こる。
【0036】
さらに有用な試薬はマレイミドである。チオール反応性試薬とマレイミドとの反応はヨードアセトアミドと本質的に同じである。マレイミドは、わずかに酸性から中性pHで急速に反応する。
【0037】
アミン、ヒドラジド、およびヒドラジンはアルデヒドであり、カルボン酸反応性試薬(アミド、ヒドラゾン、またはアルキルアミン結合の形成)である。アミン、ヒドラジド、およびヒドラジンは、水溶性カルボジイミドによるカルボキシル基の活性化後、タンパク質のカルボン酸とカップリングすることができる。アミン含有試薬は、それがリジンのより塩基性の高いε-アミンの存在下でカルボジイミド活性化タンパク質と選択的に反応して、安定なアミド結合を形成するように、弱塩基性でなければならない。
【0038】
アミン、ヒドラジド、およびヒドラジンはまた、抗体上の炭水化物残基の過ヨウ素酸塩酸化によって抗体上に生成されうるアルデヒド基と反応することができる。このシナリオにおいて、シッフ塩基中間体が形成され、これをシアノホウ化水素ナトリウム(軽度および選択的)またはホウ化水素ナトリウム(強い)水溶性還元剤による中間体の還元を通して、アルキルアミンに還元することができる。
【0039】
「試料」という用語には、生物またはこれまで生きていた生物からの任意の量の物質が含まれるがこれらに限定されるわけではない。そのような生物には、ヒト、マウス、サル、ラット、ウサギ、および他の動物が含まれるがこれらに限定されるわけではない。そのような物質には、臨床でのルーチンで最も広く用いられる試料源である個体からの全血、血清、または血漿が含まれるがこれらに限定されるわけではない。
【0040】
「固相」という用語は、非液体物質を意味し、これには、ポリマー、金属(常磁性、強磁性粒子)、ガラス、およびセラミックのような材料で作製された粒子(微粒子およびビーズを含む);シリカ、アルミナ、およびポリマーゲルのようなゲル物質;ポリマー、金属、ガラス、および/またはセラミック製であってもよいキャピラリー;ゼオライトおよび他の多孔性物質;電極;マイクロタイタープレート;固体小片;ならびにキュベット、チューブ、または他の分光光度計試料容器が含まれる。アッセイの固相成分は、「固相」がその表面上で、捕獲薬物抗体と相互作用することが意図される少なくとも1つの部分を含むという点において、アッセイが接触する可能性がある不活性な固体表面とは区別される。固相は、チューブ、小片、キュベット、もしくはマイクロタイタープレートのような静止成分であってもよく、またはビーズおよび微粒子のような非静止成分であってもよい。微粒子はまた、均一なアッセイフォーマットに関する固相として用いることができる。タンパク質および他の物質を非共有的または共有的に付着させる多様な微粒子を用いてもよい。そのような粒子には、ポリスチレンおよびポリ(メチルメタクリレート)のようなポリマー粒子;金ナノ粒子および金コロイドのような金粒子;ならびにシリカ、ガラス、および金属酸化物粒子のようなセラミック粒子が含まれる。たとえば、参照により本明細書に組み入れられる、Martin, C.R., et al., Analytical Chemistry-News & Features, May 1, 1998, 322A-327Aを参照されたい。
【0041】
色素原(蛍光または発光基および色素)、酵素、NMR-活性基または金属粒子、ハプテン、たとえばジゴキシゲニンは、検出可能な標識の例である。検出可能な標識はまた、光活性化可能なクロスリンク基、たとえばアジドまたはアジリン基となりうる。エレクトロケモルミネッセンスによって検出可能な金属キレートもまた、好ましいシグナル放出基であり、ルテニウムキレート、たとえばルテニウム(ビスピリジル)32+キレートは特に好ましい。適したルテニウム標識基は、たとえばEP 0 580 979、WO 90/05301、WO 90/11511、およびWO 92/14138において記述されている。
【0042】
本発明は、捕獲薬物抗体が、固相に結合する抗体部位が異なる薬物抗体の少なくとも2つを含む薬物抗体の混合物であり、トレーサー薬物抗体が、検出可能な標識に結合される抗体部位が異なる薬物抗体の少なくとも2つを含む薬物抗体の混合物である、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイを用いて試料における薬物抗体に対する抗体の免疫学的測定のための方法を提供する。
【0043】
本発明に係る方法において有用な捕獲薬物抗体は、固相に結合される。結合は好ましくはN末端および/またはε-アミノ基(リジン)、異なるリジンのε-アミノ基、薬物抗体のアミノ酸骨格のカルボキシ-、スルフヒドリル-、ヒドロキシル-、および/またはフェノール官能基、ならびに/または薬物抗体の糖鎖構造の糖アルコール基を通しての化学結合によって行われる。本発明に従う方法において有用な捕獲抗体は、固相に結合された少なくとも2つの薬物抗体が、それらが固相に結合される部位が異なる、固相に結合した少なくとも2つの薬物抗体の混合物である。たとえば、固相に結合された少なくとも2つの薬物抗体の混合物は、アミノ酸骨格のアミノ酸を通して固相に結合された薬物抗体と、薬物抗体の糖鎖構造の糖アルコール基を通して固相に結合された薬物抗体とを含んでもよい。同様に、たとえば、固相に結合された少なくとも2つの薬物抗体の混合物は、そのアミノ酸骨格の異なるアミノ酸残基を通して固相に結合された薬物抗体を含んでもよい。「異なるアミノ酸残基」という表現は、たとえばリジンとアスパラギン酸、もしくはチロシンとグルタミン酸のような異なる種類の2つのアミノ酸、または薬物抗体のアミノ酸骨格の2つの数が異なるアミノ酸残基のいずれかを指す。後者の場合は、アミノ酸は同じ種類または異なる種類となりうる。「抗体部位が異なる」および「部位」という表現は、部位の種類の差、たとえばアミノ酸もしくは糖アルコール基の差、または薬物抗体が固相に結合されるアミノ酸骨格のアミノ酸の数の差を指す。同じことが本発明に従う方法において有用なトレーサー薬物抗体についても当てはまる。
【0044】
以下の実施例および図面は、本発明の理解を助けるために提供され、その真の範囲は添付の特許請求の範囲に記載される。記載の技法に改変を行うことができ、それらも本発明の趣旨に含まれると理解される。
【実施例】
【0045】
実施例1
D-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによる抗体mAB IL-6Rのビオチニル化
IL-6受容体に対する抗体(mAB IL-6R)を、緩衝液(100 mM リン酸カリウム緩衝液(以降K-PO4として示す)、pH 8.5)に対して透析した。次に、溶液をタンパク質濃度10 mg/mlに調節した。D-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。60分後、L-リジンを加えることによって反応を停止させた。過剰量の標識試薬を、150 mM NaCl、pH 7.5を添加した25 mM K-PO4に対する透析によって除去した。
【0046】
実施例2
無水シトラコニン酸による処置後のD-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによるmAB IL-6Rのビオチニル化
mAB IL-6Rを100 mM K-PO4、pH 8.4に対して透析した。次に、溶液をタンパク質濃度20 mg/mlに調節した。無水シトラコニン酸をDMSOに溶解して、モル比1:5で抗体溶液に加えた。120分後、反応を100 mM K-PO4、pH 8.4によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって停止させた。抗体溶液をタンパク質濃度約4 mg/mlに調節した。D-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。L-リジンを加えることによって反応を60分後に停止させた。余剰の標識試薬を200 mM酢酸ナトリウム緩衝液pH 5.0に対して透析することによって除去した。Sephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって、抗体溶液を150 mM NaCl、pH 7.2を添加した25 mM K-PO4に移した。
【0047】
実施例3
ビオチンヒドラジドによるmAB IL-6Rのビオチニル化
mAB IL-6Rを100 mM酢酸ナトリウム緩衝液、pH 5.5に対して透析した、次に、溶液をタンパク質濃度20 mg/mlに調節した。過ヨウ素酸ナトリウムを100 mM酢酸ナトリウム緩衝液、pH 5.5に溶解して、最終濃度10 mMとなるように抗体溶液に加えた。反応を、100 mM酢酸ナトリウム緩衝液、pH 5.5によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって30分後に停止させた。抗体溶液をタンパク質濃度約5 mg/mlとなるように加えた。ビオチンヒドラジドをDMSOに溶解して、モル比1:50で抗体溶液に加えた。ホウ化水素ナトリウムを最終濃度15 mMとなるように加えることによって、120分後に反応を停止させた。30分後、抗体溶液を150 mM NaCl、pH 7.2を添加した25 mM K-PO4に対して透析した。
【0048】
実施例4
ジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによるmAB IL-6Rのジゴキシゲニル化
mAB IL-6Rをジゴキシゲニル化緩衝液(100 mM K-PO4、pH 8.5)に対して透析した。次に、溶液をタンパク質濃度10 mg/mlに調節した。ジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。60分後、L-リジンを加えることによって反応を停止させた。余剰の標識試薬を、150 mM NaCl、pH 7.5を添加した25 mM K-PO4に対する透析によって除去した。
【0049】
実施例5
無水シトラコニン酸による処置後のジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによるmAB IL-6Rのジゴキシゲニル化
mAB IL-6Rを100 mM K-PO4、pH 8.4に対して透析した。次に、溶液をタンパク質濃度20 mg/mlに調節した。無水シトラコニン酸をDMSOに溶解して、モル比1:5で抗体溶液に加えた。100 mM K-PO4、pH 8.4によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって、120分後に反応を停止させた。抗体溶液を、タンパク質濃度約4 mg/mlに調節した。ジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。L-リジンを加えることによって、反応を60分後に停止させた。200 mM酢酸ナトリウム緩衝液、pH 5.0に対して透析することにより、余剰の標識試薬を除去した。抗体溶液をSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって25 mM K-PO4および150 mM NaCl、pH 7.2を有する緩衝液に移した。
【0050】
実施例6
ジゴキシゲニン-X-ヒドラジドによるmAB IL-6Rのジゴキシゲニル化
mAB IL-6Rを100 mM酢酸ナトリウム緩衝液、pH 5.5に対して透析した。次に、溶液をタンパク質濃度20 mg/mlに調節した。過ヨウ素酸ナトリウムを100 mM酢酸ナトリウム緩衝液、pH 5.5に溶解して、最終濃度10 mMとなるように抗体溶液に加えた。反応を、100 mM酢酸ナトリウム緩衝液、pH 5.5によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって30分後に停止させた。抗体溶液をタンパク質濃度約5 mg/mlに調節した。ジゴキシゲニン-X-ヒドラジドをDMSOに溶解して、モル比1:50で抗体溶液に加えた。ホウ化水素ナトリウムを最終濃度15 mMとなるように加えることによって、120分後に反応を停止させた。30分後、抗体溶液を150 mM NaCl、pH 7.2を添加した25 mM K-PO4に対して透析した。
【0051】
実施例7
mAB IL-6Rに対する抗体を検出するための架橋ELISA
ビオチニル化mAB IL-6Rを第一段階においてストレプトアビジンコーティングマイクロタイタープレート(SA-MTP)のウェルに結合させた(結合させた)。万能緩衝液によって洗浄することにより、非結合(未結合)抗体を除去した。次に、試料および参照標準物質(5%ヒト血清を加えたポリクローナルウサギ抗mAB IL-6R抗体)をウェルにおいてインキュベートした。抗mAB IL-6R抗体を固定mAB IL-6Rに結合させた。未結合の物質を洗浄して除去した後、西洋ワサビペルオキシダーゼ標識抗ジゴキシゲニン抗体とのインキュベーション後に、結合した抗mAB IL-6R抗体をジゴキシゲニル化mAB IL-6Rによって検出した(図1を参照されたい)。抗体-酵素結合体は、ABTS(登録商標)基質の色反応を触媒した。シグナルをELISAリーダーによって405 nm(参照波長:490 nm)で測定した。各血清試料の吸光度の値を3個ずつ決定した。
【0052】
架橋ELISAの異なる5つの変化型を行った:
− 変化型1 実施例1および4の結合体を用いる
− 変化型2 実施例2および5の結合体を用いる
− 変化型3 実施例3および6の結合体を用いる
− 変化型4 実施例1および3の混合結合体と実施例4および6の混合結合体を用いる
− 変化型5 実施例1〜3の混合結合体と実施例4〜6の混合結合体を用いる
【0053】
異なるELISA変化型において得られた参照標準シグナルおよび曲線を表1および図2〜6に示す。
【0054】
(表1)異なるELISA変化型における参照標準シグナル

【0055】
異なる標準曲線を有する試料分析を表2に示す。
【0056】
(表2)血清試料の分析

【0057】
表1に示すように、結合体は全て抗mAB IL-6R抗体の検出のために用いることができる。同じウサギポリクローナル抗mAB IL-6R抗体を用いると、全てのアッセイ変化型に関する参照標準曲線は非常に類似である(図2〜6)。
【0058】
実施例8
固相で固定するためのストレプトアビジン/ビオチン相互作用を用いる抗mAB IGF-1R抗体の検出のための架橋ELISA
IGF-1Rに対するビオチニル化抗体(mAB IGF-1R、薬物抗体)を第一段階においてストレプトアビジンコーティングマイクロタイタープレート(SA-MTP)のウェルに結合(結合)させた。非結合(未結合)抗体を万能緩衝液による洗浄によって除去した。次に、試料および参照物質(5%ヒト血清中にポリクローナルウサギ抗mAB IGF-1R抗体を加えた)をウェルにおいてインキュベートした。抗mAB IGF-1R抗体を固定mAB IGF-1Rに結合させた。未結合の物質を洗浄した後、結合した抗mAB IGF-1R抗体を、ジゴキシゲニル化mAB IGF-1Rの後に西洋ワサビペルオキシダーゼ標識抗ジゴキシゲニン抗体とのインキュベーションによって検出した。抗体-酵素結合体は、ABTS(登録商標)基質の発色反応を触媒した。シグナルをELISAリーダーによって波長405 nmで測定した(参照波長:490 nm)。各血清試料の吸光度の値を3個ずつ決定した。
【0059】
架橋ELISAの異なる3つの変化型を行った:
− 変化型1 実施例1および4に従って作製された結合体を用いる
− 変化型2 実施例2および5に従って作製された結合体を用いる
− 変化型3 実施例1および2に従って作製された混合結合体と実施例4および5に従って作製された混合結合体を用いる
【0060】
ビオチニル化およびジゴキシゲニル化mAB IGF-1Rの試薬変種は全て、mAB IL-6Rに関して先に記述したとおりに(実施例1、2、4および5)合成した。
【0061】
異なるELISA変化型において得られた参照標準シグナルを表3に示す。
【0062】
(表3)異なるELISA変化型における参照標準シグナル

【0063】
異なる標準曲線を有する試料分析を表4に示す。
【0064】
(表4)血清試料の分析

【0065】
表3は、抗mAB IGF-1R抗体を検出するために、全ての結合体を用いることができることを示している。同じウサギポリクローナル抗mAB IGF-1R抗体を用いると、全てのアッセイ変化型に関する参照標準は非常に類似である(表3)。
【0066】
実施例9
固相で結合(結合)するための受動吸着を用いて抗mAB IGF-1R抗体を検出するための架橋ELISA
マイクロタイタープレート(MTP)(Maxisorb(登録商標)、Nunc)に炭酸緩衝液(pH 9.6)においてmAB IGF-1Rを室温で1時間コーティングした。PBS-Tween(登録商標)20によって3回洗浄した後、MTPのウェル全てをPBS/3%(w/v)BSA(ウシ血清アルブミン)によって室温で1時間ブロックした後、再度洗浄した。次に、試料および参照標準物質(5%ヒト血清を加えたポリクローナルウサギ抗mAB IGF-1R抗体)をインキュベートした。抗mAB IGF-1R抗体を固定mAB IGF-1Rに結合させた。未結合の物質を洗浄後、結合した抗mAB IGF-1R抗体を、ジゴキシゲニル化mAB IGF-1Rの後に西洋ワサビペルオキシダーゼ標識抗ジゴキシゲニン抗体と共にインキュベートすることによって検出した。抗体-酵素結合体は、ABTS(登録商標)基質の発色反応を触媒した。シグナルをELISAリーダーによって波長405 nmで測定した(参照波長490 nm)。それぞれの血清試料の吸光度を3個ずつ決定した。
【0067】
架橋ELISAの異なる3つの変化型を行った:
− 変化型1 実施例4に従って作製された結合体を用いる
− 変化型2 実施例5に従って作製された結合体を用いる
− 変化型3 実施例4および5に従って作製された混合結合体を用いる
【0068】
ジゴキシゲニル化mAB IGF-1Rの試薬変種は全て、mAB IL-6Rに関して先に記述したように(実施例4および5)合成した。異なるELISA変化型における参照標準シグナルを表5および図7に示す。
【0069】
(表5)参照標準シグナル

【0070】
表5は、固相上のmAB IGF-1Rに結合(固定)させるために受動吸着を用いる本発明に従う架橋アッセイを、抗mAB IGF-1R抗体を検出するために行うことができることを示す。同じウサギポリクローナル抗mAB IGF-1R抗体を用いると、3つのアッセイ変化型全ての参照標準値は非常に類似である(表5)。
【技術分野】
【0001】
本発明は、抗薬物抗体の測定法と、そのようなアッセイ法を用いるためのキットを含む。
【背景技術】
【0002】
発明の背景
モノクローナル抗体による標準的な固相イムノアッセイ法は、固相において吸収/固定された抗体(捕獲抗体)、抗原、および酵素に結合させた抗原のもう1つのエピトープに対する抗体(トレーサー抗体)の間の複合体の形成を伴う。このように、サンドイッチ:固相-捕獲抗体-抗原-トレーサー抗体が形成される。サンドイッチによって触媒される反応において、抗体結合酵素の活性は、インキュベーション培地における抗原濃度に比例する。標準的なサンドイッチ法はまた、捕獲およびトレーサー抗体が抗原の異なるエピトープに結合することから、二重抗原架橋イムノアッセイとも呼ばれる。Hoesel, W., et al., in J. Immunol. Methods 294 (2004) 101-110(非特許文献1)は、それによってアミノ基および炭水化物にカップリングした固定rhEPOの混合物を用いる抗EPO二重抗原架橋アッセイを報告している。二重抗原架橋ELISAのようなイムノアッセイは、抗体薬に対する患者の免疫原性の答えを調べるために一般的なアッセイタイプである。Mire-Sluis, A.R., et al., J. Immunol. Methods 289 (2004) 1-16(非特許文献2)は、生物工学産物に対する宿主抗体の検出を用いてイムノアッセイの設計および最適化に関する推奨を要約している。Mire-Sluis et al.によれば、周知の抗薬物抗体アッセイフォーマットは、かなりの短所を示す。抗薬物抗体アッセイは、たとえば、WO 2005/045058(特許文献1)およびWO 90/006515(特許文献2)において言及されている。抗イディオタイプ抗体アッセイは、たとえば、US 5,219,730(特許文献3);WO 87/002778(特許文献4);EP 0 139 389(特許文献5);およびEP 0 170 302(特許文献6)において言及されている。Wadhwa, M., et al., in J. Immunol. Methods 278 (2003) 1-17(非特許文献3)は、治療的生物学的物質によって誘導された望ましくない抗体の検出、測定、および特徴付けに関する戦略を報告している。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】WO 2005/045058
【特許文献2】WO 90/006515
【特許文献3】US 5,219,730
【特許文献4】WO 87/002778
【特許文献5】EP 0 139 389
【特許文献6】EP 0 170 302
【非特許文献】
【0004】
【非特許文献1】Hoesel, W., et al., in J. Immunol. Methods 294 (2004) 101-110
【非特許文献2】Mire-Sluis, A.R., et al., J. Immunol. Methods 289 (2004) 1-16
【非特許文献3】Wadhwa, M., et al., in J. Immunol. Methods 278 (2003) 1-17
【発明の概要】
【0005】
発明の概要
本発明は、二重抗原架橋イムノアッセイ法を用いて試料中の薬物抗体に対する抗体の免疫学的測定のための方法および手段を提供する。
【0006】
本発明は、捕獲薬物抗体が、それらが固相に結合される抗体部位が異なる少なくとも2つの薬物抗体を含む薬物抗体の混合物であって、トレーサー薬物抗体が、それらが検出可能な標識に結合される抗体部位が異なる少なくとも2つの薬物抗体を含む薬物抗体の混合物であることを特徴とする、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイ法を用いて、試料における薬物抗体に対する抗体の免疫学的測定のための方法を提供する。
【0007】
好ましくは、その結合パートナーに対する薬物抗体の結合は、N末端および/またはε-末端アミノ基(リジン)、異なるリジンのε-アミノ基、薬物抗体のアミノ酸骨格のカルボキシ-、スルフヒドリル-、ヒドロキシル-および/またはフェノール官能基、ならびに/または薬物抗体の糖鎖構造の糖アルコール基による化学結合によって行われる。
【0008】
好ましくは、捕獲薬物抗体混合物は、その結合パートナーに対するアミノ基および糖鎖構造によって結合された薬物抗体を含む。
【0009】
好ましくは、捕獲薬物抗体混合物および/またはトレーサー薬物抗体混合物は、その結合パートナーに対して少なくとも2つの異なるアミノ基を通して結合した薬物抗体を含む。異なるアミノ基によるそのようなカップリングは、化学保護物質によるε-アミノ基の一部のアシル化によって、たとえば最初の段階におけるシトラコニル化によって行うことができる。第二段階において、残りのアミノ基によって結合を行う。次に、シトラコニル化を除去して、残りの遊離のアミノ基を通して薬物抗体を結合パートナーに結合させる、すなわち得られた薬物抗体を、シトラコニル化によって保護されていないアミノ基を通して結合パートナーに結合させる。
【0010】
適した化学保護基は、保護されていない側鎖アミンで結合を形成し、N末端での結合より不安定であり、それらの結合とは異なる。そのような多くの化学保護物質が公知である(たとえば、欧州特許出願EP 0 651 761を参照されたい)。好ましい化学保護基には、マレイン酸またはシトラコニン酸無水物のような環状ジカルボン酸無水物が含まれる。
【0011】
好ましくは、捕獲薬物抗体は、受動吸着によって固相に結合され、したがって、少なくとも2つの異なる抗体部位で固相に結合される。受動吸着は、たとえばButler, J.E., in "Solid Phases in Immunoassay" 205-225;Diamandis, E.P., and Christopoulos, T.K. (Editors): Immunoassays (1996) Academic Press San Diegoによって記述されている。
【0012】
好ましくは、トレーサー薬物抗体混合物は、その結合パートナーに対してアミノ基および糖鎖構造を通して結合された薬物抗体を含む。
【0013】
好ましくは、捕獲薬物抗体対トレーサー薬物抗体の比は、1:10〜50:1(比は異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)である。
【0014】
好ましくは、アミノ結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)対炭水化物結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)の比はそのような混合物において1:10〜10:1(比は、異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)である。
【0015】
本発明の好ましい態様において、捕獲薬物抗体は、特異的結合対を通して結合(固定)される。そのような結合対(第一の成分/第二の成分)は、たとえばストレプトアビジンまたはアビジン/ビオチン、抗体/抗原(たとえば、Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press, 1996を参照されたい)、レクチン/多糖類、ステロイド/ステロイド結合タンパク質、ホルモン/ホルモン受容体、酵素/基質、IgG/プロテインAおよび/またはG等である。好ましくは捕獲薬物抗体はビオチンに結合され、固定は、固定されたアビジンまたはストレプトアビジンによって行われる。
【0016】
本発明の好ましい態様において、トレーサー薬物抗体は、検出可能な標識に結合され、好ましくは特異的結合対を通して結合される。そのような結合対(第一の成分/第二の成分)は、たとえばストレプトアビジンまたはアビジン/ビオチン、抗体/抗原(たとえば、Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press, 1996を参照されたい)、レクチン/多糖類、ステロイド/ステロイド結合タンパク質、ホルモン/ホルモン受容体、酵素/基質、IgG/プロテインAおよび/またはG等である。好ましくは、トレーサー薬物抗体は、ジゴキシゲニンおよびジゴキシゲニンに対する抗体によって検出可能な標識に結合される。または、トレーサー薬物抗体は、ルテニウムビスピリジル錯体のようなエレクトロケミルミネッセント標識に結合される。
【図面の簡単な説明】
【0017】
【図1】抗薬物抗体の検出のための架橋アッセイ ビオチン化薬物抗体(Capture-BI)をストレプトアビジンコーティングマイクロタイタープレート(SA-MTP)に結合させる。抗薬物抗体は、ジゴキシゲニン標識トレーサー薬物抗体(Tracer-DIG;DIG=ジゴキシニル化)と共に、捕獲薬物抗体(Capture-BI;BI=ビオチニル化)に架橋する。固定された複合体をポリクローナル抗ジゴキシゲニン西洋ワサビペルオキシダーゼ結合体(pAB<DIG>-POD)によって検出する。ポリクローナルウサギ抗薬物抗体(rpAB)を標準物質として用いる。
【図2】実施例1および4の結合体を用いる架橋ELISA変化型1の標準曲線: 5%ヒト血清を有するPBS-T緩衝液(リン酸緩衝生理食塩液、0.05容積%Tween(登録商標)20)において希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図3】実施例2および5の結合体を用いる架橋ELISA変化型2の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図4】実施例3および6の結合体を用いる架橋ELISA変化型3の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図5】実施例1、3、および4、6の結合体を用いる架橋ELISA変化型4の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図6】実施例1、2、3および4、5、6の結合体を用いる架橋ELISA変化型5の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【図7】固相固定のための受動吸着を用いる架橋ELISA変化型1の標準曲線: 5%ヒト血清を有するPBS-Tにおいて希釈したrpABの様々な濃度に関する吸光度(OD)を示す。
【発明を実施するための形態】
【0018】
発明の詳細な説明
本発明に係る「薬物抗体」という用語は、個体の試料が投与後に薬物抗体を含むことが疑われるように、個体に投与することができる抗体を示す。本発明に従って行われる1つのアッセイ法において、薬物抗体、捕獲薬物抗体、およびトレーサー薬物抗体は、「同じ」抗体分子、たとえば同じ発現ベクターによって組換えによって産生され、同じアミノ酸配列を含む分子を含む。薬物抗体(治療的モノクローナル抗体)は、腫瘍遺伝子疾患(たとえば、非ホジキンリンパ腫、乳癌、および結腸直腸癌を含む血液および固形悪性腫瘍)のような様々な疾患の処置のために広く用いられている。そのような抗体は、たとえばLevene, A.P., et al., Journal of the Royal Society of Medicine 98 (2005) 146-152において記述されている。そのような抗体は、たとえばCD20、CD22、HLA-DR、CD33、CD52、EGFR、G250、GD3、HER2、PSMA、CD56、VEGF、VEGF2、CEA、Levis Y抗原、IL-6受容体、またはIGF-1受容体に対する抗体である。治療抗体はまた、Groner, B., et al., Curr. Mol. Med. 4 (2004)539-547;およびHarris, M., Lancet Oncol. 5 (2004) 292-302によって記述される。
【0019】
例示的な(好ましくはモノクローナル)抗体は、IL-6受容体に対する抗体(mAB IL-6R)である。そのような抗体は、たとえばMihara et al., Clin. Immunol. 98 (2001) 319-326;Nishimoto, N., et al, Blood 106 (2005) 2627-2632、臨床試験第NCT00046774号、またはWO 2004/096274によって記述されている。
【0020】
例示的な(好ましくはモノクローナル)抗体は、IGF-1受容体に対する抗体(mAB IGF-1R)である。そのような抗体は、たとえば、WO 2004/087756またはWO 2005/005635において記述されている。
【0021】
抗薬物抗体は、薬物抗体の可変領域、定常領域、または糖構造のような、薬物抗体の任意の領域に対して向けられる抗体である。そのような抗薬物抗体は、患者の免疫原性反応として抗体治療の際に起こる可能性がある(Pan, Y., et al., FASEB J. 9 (1995) 43-49を参照されたい)。
【0022】
モノクローナル抗体は、タンパク質として多くの反応性側鎖を含有する。抗体のそのような反応性の化学基は、たとえばアミノ基(リジン、α-アミノ基)、チオール基(シスチン、システイン、およびメチオニン)、カルボン酸基(アスパラギン酸、グルタミン酸)および糖-アルコール基である。
【0023】
本発明に係るイムノアッセイ法の固相支持体は当技術分野において広く記述されている(たとえばButler, J.E., Methods 22 (2000) 4-23を参照されたい。
【0024】
異なるイムノアッセイ法の原理は、たとえばHage, D. S., in Anal. Chem. 71 (1999) 294R-304Rによって記述されている。Lu, B., et al., Analyst 121 (1996) 29R-32Rは、イムノアッセイ法において用いるための抗体の方向性の固定を報告している。アビジン-ビオチン媒介イムノアッセイ法は、たとえばWilchek, M., and Bayer, E.A., Methods Enzymol. 184 (1990) 467-469によって報告されている。
【0025】
モノクローナル抗体およびその定常ドメインは、タンパク質として、表面、タンパク質、PEG、セルロースもしくはポリスチロールのようなポリマー、酵素、または結合パートナーのメンバーのような、結合パートナーとカップリングするための多くの反応性側鎖を含有する。抗体の化学反応基は、たとえばアミノ基(リジン、α-アミノ基)、チオール基(シスチン、システイン、およびメチオニン)、カルボン酸基(アスパラギン酸、グルタミン酸)、および糖アルコール基である。そのような抗体は、たとえばAslam M., and Dent A., Bioconjugation, MacMillan Ref. Ltd. 1998, pp. 50-100によって記述されている。
【0026】
タンパク質の最も一般的な反応性基の1つは、アミノ酸リジンの脂肪族ε-アミンである。一般的に、ほぼ全ての抗体が、豊富なリジンを含有する。リジンアミンは、pH 8.0より上で妥当に良好な求核性(pKa=9.18)を有し、したがって、多数の試薬と容易かつきれいに反応して安定な結合を形成する。
【0027】
抗体における他の一般的な反応基は、硫黄含有アミノ酸シスチンおよびその還元産物システイン(またはハーフシスチン)からのチオール残基である。システインは、アミンより求核性が高く、一般的にタンパク質における最も反応性の高い官能基である遊離のチオール基を含有する。チオールは一般的に、中性pHで反応性であり、したがってアミンの存在下で選択的に他の分子とカップリングすることができる。
【0028】
遊離のスルフヒドリル基は、比較的反応性であることから、これらの基を有するタンパク質は、しばしばジスルフィド基またはジスルフィド結合としてのその酸化型でそれらと共に存在する。免疫グロブリンMはジスルフィド連結五量体の例であるが、免疫グロブリンGのサブユニットは内部ジスルフィド架橋によって結合される。そのようなタンパク質において、反応性の遊離のチオールを生成するためには、ジチオスレイトール(DTT)のような試薬によるジスルフィド結合の還元が必要である。しかし、この方法はまた、これらの抗体における鎖の連結を分解して、鎖を適切に折り畳ませる再構築が可能でない可能性がある。シスチンおよびシステインのほかに、いくつかのタンパク質はまた、チオエーテル連結において硫黄を含有するアミノ酸メチオニンを有する。メチオニンの選択的改変は一般的に行うことが難しく、一般的に薬物および他の分子を抗体に付着させる方法としてほとんど用いられない。文献は、反応性のアミノ基によって多数のスルフヒドリル基を導入する効率的な方法を提供するために、Traut試薬(2-イミノチオラン)、スクシニミジル(アセチルチオ)アセテート(SATA)、およびスルホスクシニミジル6-[3-(2-ピリジルジチオ)プロピオンアミド]ヘキサノエート(Sulfo-LC-SPDP)のようないくつかのチオール化クロスリンク試薬を用いることを報告している。
【0029】
生体結合化学は、化学的または生物学的手段によって、他の生体分子、低分子、およびポリマーに生体分子を連結させることである。これには、抗体およびその断片、核酸およびその類似体、ならびにリポソーム成分(または他の生物学的活性分子)の、互いの、または有用な特性を付加する任意の分子基との結合が含まれる。これらの分子基には、放射性核種、薬物、毒素、酵素、金属キレート、蛍光体、ハプテン、およびその他が含まれる。
【0030】
抗体におけるもう1つの一般的な反応基は、カルボン酸(アスパラギン酸、グルタミン酸)である。タンパク質は、C-末端部分およびアスパラギン酸およびグルタミン酸の側鎖内でカルボン酸基を含有する。水中でのカルボン酸の比較的低い反応性のために、通常、タンパク質および他の生体分子を選択的に改変するためにこれらの基を用いることは難しい。これを行う場合、水溶性のカルボジイミドを用いることによって、カルボン酸基を通常、反応性のエステルに変換し、アミン、ヒドラジド、またはヒドラジンのような求核試薬に反応させる。アミン含有試薬は、タンパク質上の他のアミンの存在下で活性化カルボン酸と選択的に反応するためには、弱い塩基性でなければならない。タンパク質のクロスリンクは、pHが8.0より上昇した場合に起こりうる。
【0031】
過ヨウ素酸ナトリウムは、炭水化物部分内の糖のアルコール部分をアルデヒドに酸化するために用いることができる。それぞれのアルデヒド基は、カルボン酸に関して記述されるように、アミン、ヒドラジド、またはヒドラジンと反応することができる。炭水化物部分は、抗体の結晶可能な断片(Fc)領域において主に見いだされることから、抗原結合部位から離れた炭水化物の部位特異的改変を通して結合を行うことができる。
【0032】
アミン反応性試薬は、リジンおよびタンパク質のα-アミノ基と主に反応する。反応性のエステル、特にN-ヒドロキシ-シクシニミド(NHS)エステルはアミン基の改変のために最も一般的に用いられる試薬である。水性環境における反応に関して最適なpHはpH 8.0〜9.0である。イソチオシアネートは、アミン改変試薬であり、タンパク質とチオウレア結合を形成する。それらは、水溶液(最適にpH 9.0〜9.5)においてタンパク質アミンと反応する。アルデヒドは、脂肪族および芳香族アミン、ヒドラジン、およびヒドラジドと軽度の水性条件で反応して、イミン中間体(シッフ塩基)を形成する。シッフ塩基を、軽度または強い還元剤(ホウ化水素ナトリウム、またはシアノホウ化水素ナトリウムのような)によって選択的に還元させて、安定なアルキルアミン結合を誘導することができる。
【0033】
アミンを改変するために用いられている他の試薬は、酸無水物である。たとえば、ジエチレントリアミン五酢酸無水物(DTPA)は、2つのアミン反応性のアンヒドリド基を含有する二官能キレート物質である。これは、タンパク質のN末端およびε-アミン基と反応して、アミド連結を形成することができる。アンヒドリド環は開環して、配位錯体において金属に堅固に結合することができる多価の金属キレート形成アームを作製する。
【0034】
チオール反応性試薬は、タンパク質上のチオール基にカップリングしてチオエーテルカップリング産物を形成する試薬である。これらの試薬は、わずかに酸性から中性pHで急速に反応し、したがってアミン基の存在下で選択的に反応させることができる。
【0035】
ハロアセチル誘導体、たとえばヨードアセトアミドはチオエーテル結合を形成して、チオール改変のための試薬である。抗体において、反応は、内因性に存在するか、または抗体の様々な部分でシスチンのジスルフィドの還元に起因するシステイン基で起こる。
【0036】
さらに有用な試薬はマレイミドである。チオール反応性試薬とマレイミドとの反応はヨードアセトアミドと本質的に同じである。マレイミドは、わずかに酸性から中性pHで急速に反応する。
【0037】
アミン、ヒドラジド、およびヒドラジンはアルデヒドであり、カルボン酸反応性試薬(アミド、ヒドラゾン、またはアルキルアミン結合の形成)である。アミン、ヒドラジド、およびヒドラジンは、水溶性カルボジイミドによるカルボキシル基の活性化後、タンパク質のカルボン酸とカップリングすることができる。アミン含有試薬は、それがリジンのより塩基性の高いε-アミンの存在下でカルボジイミド活性化タンパク質と選択的に反応して、安定なアミド結合を形成するように、弱塩基性でなければならない。
【0038】
アミン、ヒドラジド、およびヒドラジンはまた、抗体上の炭水化物残基の過ヨウ素酸塩酸化によって抗体上に生成されうるアルデヒド基と反応することができる。このシナリオにおいて、シッフ塩基中間体が形成され、これをシアノホウ化水素ナトリウム(軽度および選択的)またはホウ化水素ナトリウム(強い)水溶性還元剤による中間体の還元を通して、アルキルアミンに還元することができる。
【0039】
「試料」という用語には、生物またはこれまで生きていた生物からの任意の量の物質が含まれるがこれらに限定されるわけではない。そのような生物には、ヒト、マウス、サル、ラット、ウサギ、および他の動物が含まれるがこれらに限定されるわけではない。そのような物質には、臨床でのルーチンで最も広く用いられる試料源である個体からの全血、血清、または血漿が含まれるがこれらに限定されるわけではない。
【0040】
「固相」という用語は、非液体物質を意味し、これには、ポリマー、金属(常磁性、強磁性粒子)、ガラス、およびセラミックのような材料で作製された粒子(微粒子およびビーズを含む);シリカ、アルミナ、およびポリマーゲルのようなゲル物質;ポリマー、金属、ガラス、および/またはセラミック製であってもよいキャピラリー;ゼオライトおよび他の多孔性物質;電極;マイクロタイタープレート;固体小片;ならびにキュベット、チューブ、または他の分光光度計試料容器が含まれる。アッセイの固相成分は、「固相」がその表面上で、捕獲薬物抗体と相互作用することが意図される少なくとも1つの部分を含むという点において、アッセイが接触する可能性がある不活性な固体表面とは区別される。固相は、チューブ、小片、キュベット、もしくはマイクロタイタープレートのような静止成分であってもよく、またはビーズおよび微粒子のような非静止成分であってもよい。微粒子はまた、均一なアッセイフォーマットに関する固相として用いることができる。タンパク質および他の物質を非共有的または共有的に付着させる多様な微粒子を用いてもよい。そのような粒子には、ポリスチレンおよびポリ(メチルメタクリレート)のようなポリマー粒子;金ナノ粒子および金コロイドのような金粒子;ならびにシリカ、ガラス、および金属酸化物粒子のようなセラミック粒子が含まれる。たとえば、参照により本明細書に組み入れられる、Martin, C.R., et al., Analytical Chemistry-News & Features, May 1, 1998, 322A-327Aを参照されたい。
【0041】
色素原(蛍光または発光基および色素)、酵素、NMR-活性基または金属粒子、ハプテン、たとえばジゴキシゲニンは、検出可能な標識の例である。検出可能な標識はまた、光活性化可能なクロスリンク基、たとえばアジドまたはアジリン基となりうる。エレクトロケモルミネッセンスによって検出可能な金属キレートもまた、好ましいシグナル放出基であり、ルテニウムキレート、たとえばルテニウム(ビスピリジル)32+キレートは特に好ましい。適したルテニウム標識基は、たとえばEP 0 580 979、WO 90/05301、WO 90/11511、およびWO 92/14138において記述されている。
【0042】
本発明は、捕獲薬物抗体が、固相に結合する抗体部位が異なる薬物抗体の少なくとも2つを含む薬物抗体の混合物であり、トレーサー薬物抗体が、検出可能な標識に結合される抗体部位が異なる薬物抗体の少なくとも2つを含む薬物抗体の混合物である、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイを用いて試料における薬物抗体に対する抗体の免疫学的測定のための方法を提供する。
【0043】
本発明に係る方法において有用な捕獲薬物抗体は、固相に結合される。結合は好ましくはN末端および/またはε-アミノ基(リジン)、異なるリジンのε-アミノ基、薬物抗体のアミノ酸骨格のカルボキシ-、スルフヒドリル-、ヒドロキシル-、および/またはフェノール官能基、ならびに/または薬物抗体の糖鎖構造の糖アルコール基を通しての化学結合によって行われる。本発明に従う方法において有用な捕獲抗体は、固相に結合された少なくとも2つの薬物抗体が、それらが固相に結合される部位が異なる、固相に結合した少なくとも2つの薬物抗体の混合物である。たとえば、固相に結合された少なくとも2つの薬物抗体の混合物は、アミノ酸骨格のアミノ酸を通して固相に結合された薬物抗体と、薬物抗体の糖鎖構造の糖アルコール基を通して固相に結合された薬物抗体とを含んでもよい。同様に、たとえば、固相に結合された少なくとも2つの薬物抗体の混合物は、そのアミノ酸骨格の異なるアミノ酸残基を通して固相に結合された薬物抗体を含んでもよい。「異なるアミノ酸残基」という表現は、たとえばリジンとアスパラギン酸、もしくはチロシンとグルタミン酸のような異なる種類の2つのアミノ酸、または薬物抗体のアミノ酸骨格の2つの数が異なるアミノ酸残基のいずれかを指す。後者の場合は、アミノ酸は同じ種類または異なる種類となりうる。「抗体部位が異なる」および「部位」という表現は、部位の種類の差、たとえばアミノ酸もしくは糖アルコール基の差、または薬物抗体が固相に結合されるアミノ酸骨格のアミノ酸の数の差を指す。同じことが本発明に従う方法において有用なトレーサー薬物抗体についても当てはまる。
【0044】
以下の実施例および図面は、本発明の理解を助けるために提供され、その真の範囲は添付の特許請求の範囲に記載される。記載の技法に改変を行うことができ、それらも本発明の趣旨に含まれると理解される。
【実施例】
【0045】
実施例1
D-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによる抗体mAB IL-6Rのビオチニル化
IL-6受容体に対する抗体(mAB IL-6R)を、緩衝液(100 mM リン酸カリウム緩衝液(以降K-PO4として示す)、pH 8.5)に対して透析した。次に、溶液をタンパク質濃度10 mg/mlに調節した。D-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。60分後、L-リジンを加えることによって反応を停止させた。過剰量の標識試薬を、150 mM NaCl、pH 7.5を添加した25 mM K-PO4に対する透析によって除去した。
【0046】
実施例2
無水シトラコニン酸による処置後のD-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによるmAB IL-6Rのビオチニル化
mAB IL-6Rを100 mM K-PO4、pH 8.4に対して透析した。次に、溶液をタンパク質濃度20 mg/mlに調節した。無水シトラコニン酸をDMSOに溶解して、モル比1:5で抗体溶液に加えた。120分後、反応を100 mM K-PO4、pH 8.4によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって停止させた。抗体溶液をタンパク質濃度約4 mg/mlに調節した。D-ビオチノイル-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。L-リジンを加えることによって反応を60分後に停止させた。余剰の標識試薬を200 mM酢酸ナトリウム緩衝液pH 5.0に対して透析することによって除去した。Sephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって、抗体溶液を150 mM NaCl、pH 7.2を添加した25 mM K-PO4に移した。
【0047】
実施例3
ビオチンヒドラジドによるmAB IL-6Rのビオチニル化
mAB IL-6Rを100 mM酢酸ナトリウム緩衝液、pH 5.5に対して透析した、次に、溶液をタンパク質濃度20 mg/mlに調節した。過ヨウ素酸ナトリウムを100 mM酢酸ナトリウム緩衝液、pH 5.5に溶解して、最終濃度10 mMとなるように抗体溶液に加えた。反応を、100 mM酢酸ナトリウム緩衝液、pH 5.5によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって30分後に停止させた。抗体溶液をタンパク質濃度約5 mg/mlとなるように加えた。ビオチンヒドラジドをDMSOに溶解して、モル比1:50で抗体溶液に加えた。ホウ化水素ナトリウムを最終濃度15 mMとなるように加えることによって、120分後に反応を停止させた。30分後、抗体溶液を150 mM NaCl、pH 7.2を添加した25 mM K-PO4に対して透析した。
【0048】
実施例4
ジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによるmAB IL-6Rのジゴキシゲニル化
mAB IL-6Rをジゴキシゲニル化緩衝液(100 mM K-PO4、pH 8.5)に対して透析した。次に、溶液をタンパク質濃度10 mg/mlに調節した。ジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。60分後、L-リジンを加えることによって反応を停止させた。余剰の標識試薬を、150 mM NaCl、pH 7.5を添加した25 mM K-PO4に対する透析によって除去した。
【0049】
実施例5
無水シトラコニン酸による処置後のジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルによるmAB IL-6Rのジゴキシゲニル化
mAB IL-6Rを100 mM K-PO4、pH 8.4に対して透析した。次に、溶液をタンパク質濃度20 mg/mlに調節した。無水シトラコニン酸をDMSOに溶解して、モル比1:5で抗体溶液に加えた。100 mM K-PO4、pH 8.4によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって、120分後に反応を停止させた。抗体溶液を、タンパク質濃度約4 mg/mlに調節した。ジゴキシゲニン3-O-メチルカルボニル-ε-アミノカプロン酸-N-ヒドロキシスクシニミドエステルをDMSOに溶解して、モル比1:5で抗体溶液に加えた。L-リジンを加えることによって、反応を60分後に停止させた。200 mM酢酸ナトリウム緩衝液、pH 5.0に対して透析することにより、余剰の標識試薬を除去した。抗体溶液をSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって25 mM K-PO4および150 mM NaCl、pH 7.2を有する緩衝液に移した。
【0050】
実施例6
ジゴキシゲニン-X-ヒドラジドによるmAB IL-6Rのジゴキシゲニル化
mAB IL-6Rを100 mM酢酸ナトリウム緩衝液、pH 5.5に対して透析した。次に、溶液をタンパク質濃度20 mg/mlに調節した。過ヨウ素酸ナトリウムを100 mM酢酸ナトリウム緩衝液、pH 5.5に溶解して、最終濃度10 mMとなるように抗体溶液に加えた。反応を、100 mM酢酸ナトリウム緩衝液、pH 5.5によって平衡にしたSephadex(登録商標)G25を有するカラムにおけるクロマトグラフィーによって30分後に停止させた。抗体溶液をタンパク質濃度約5 mg/mlに調節した。ジゴキシゲニン-X-ヒドラジドをDMSOに溶解して、モル比1:50で抗体溶液に加えた。ホウ化水素ナトリウムを最終濃度15 mMとなるように加えることによって、120分後に反応を停止させた。30分後、抗体溶液を150 mM NaCl、pH 7.2を添加した25 mM K-PO4に対して透析した。
【0051】
実施例7
mAB IL-6Rに対する抗体を検出するための架橋ELISA
ビオチニル化mAB IL-6Rを第一段階においてストレプトアビジンコーティングマイクロタイタープレート(SA-MTP)のウェルに結合させた(結合させた)。万能緩衝液によって洗浄することにより、非結合(未結合)抗体を除去した。次に、試料および参照標準物質(5%ヒト血清を加えたポリクローナルウサギ抗mAB IL-6R抗体)をウェルにおいてインキュベートした。抗mAB IL-6R抗体を固定mAB IL-6Rに結合させた。未結合の物質を洗浄して除去した後、西洋ワサビペルオキシダーゼ標識抗ジゴキシゲニン抗体とのインキュベーション後に、結合した抗mAB IL-6R抗体をジゴキシゲニル化mAB IL-6Rによって検出した(図1を参照されたい)。抗体-酵素結合体は、ABTS(登録商標)基質の色反応を触媒した。シグナルをELISAリーダーによって405 nm(参照波長:490 nm)で測定した。各血清試料の吸光度の値を3個ずつ決定した。
【0052】
架橋ELISAの異なる5つの変化型を行った:
− 変化型1 実施例1および4の結合体を用いる
− 変化型2 実施例2および5の結合体を用いる
− 変化型3 実施例3および6の結合体を用いる
− 変化型4 実施例1および3の混合結合体と実施例4および6の混合結合体を用いる
− 変化型5 実施例1〜3の混合結合体と実施例4〜6の混合結合体を用いる
【0053】
異なるELISA変化型において得られた参照標準シグナルおよび曲線を表1および図2〜6に示す。
【0054】
(表1)異なるELISA変化型における参照標準シグナル

【0055】
異なる標準曲線を有する試料分析を表2に示す。
【0056】
(表2)血清試料の分析

【0057】
表1に示すように、結合体は全て抗mAB IL-6R抗体の検出のために用いることができる。同じウサギポリクローナル抗mAB IL-6R抗体を用いると、全てのアッセイ変化型に関する参照標準曲線は非常に類似である(図2〜6)。
【0058】
実施例8
固相で固定するためのストレプトアビジン/ビオチン相互作用を用いる抗mAB IGF-1R抗体の検出のための架橋ELISA
IGF-1Rに対するビオチニル化抗体(mAB IGF-1R、薬物抗体)を第一段階においてストレプトアビジンコーティングマイクロタイタープレート(SA-MTP)のウェルに結合(結合)させた。非結合(未結合)抗体を万能緩衝液による洗浄によって除去した。次に、試料および参照物質(5%ヒト血清中にポリクローナルウサギ抗mAB IGF-1R抗体を加えた)をウェルにおいてインキュベートした。抗mAB IGF-1R抗体を固定mAB IGF-1Rに結合させた。未結合の物質を洗浄した後、結合した抗mAB IGF-1R抗体を、ジゴキシゲニル化mAB IGF-1Rの後に西洋ワサビペルオキシダーゼ標識抗ジゴキシゲニン抗体とのインキュベーションによって検出した。抗体-酵素結合体は、ABTS(登録商標)基質の発色反応を触媒した。シグナルをELISAリーダーによって波長405 nmで測定した(参照波長:490 nm)。各血清試料の吸光度の値を3個ずつ決定した。
【0059】
架橋ELISAの異なる3つの変化型を行った:
− 変化型1 実施例1および4に従って作製された結合体を用いる
− 変化型2 実施例2および5に従って作製された結合体を用いる
− 変化型3 実施例1および2に従って作製された混合結合体と実施例4および5に従って作製された混合結合体を用いる
【0060】
ビオチニル化およびジゴキシゲニル化mAB IGF-1Rの試薬変種は全て、mAB IL-6Rに関して先に記述したとおりに(実施例1、2、4および5)合成した。
【0061】
異なるELISA変化型において得られた参照標準シグナルを表3に示す。
【0062】
(表3)異なるELISA変化型における参照標準シグナル

【0063】
異なる標準曲線を有する試料分析を表4に示す。
【0064】
(表4)血清試料の分析

【0065】
表3は、抗mAB IGF-1R抗体を検出するために、全ての結合体を用いることができることを示している。同じウサギポリクローナル抗mAB IGF-1R抗体を用いると、全てのアッセイ変化型に関する参照標準は非常に類似である(表3)。
【0066】
実施例9
固相で結合(結合)するための受動吸着を用いて抗mAB IGF-1R抗体を検出するための架橋ELISA
マイクロタイタープレート(MTP)(Maxisorb(登録商標)、Nunc)に炭酸緩衝液(pH 9.6)においてmAB IGF-1Rを室温で1時間コーティングした。PBS-Tween(登録商標)20によって3回洗浄した後、MTPのウェル全てをPBS/3%(w/v)BSA(ウシ血清アルブミン)によって室温で1時間ブロックした後、再度洗浄した。次に、試料および参照標準物質(5%ヒト血清を加えたポリクローナルウサギ抗mAB IGF-1R抗体)をインキュベートした。抗mAB IGF-1R抗体を固定mAB IGF-1Rに結合させた。未結合の物質を洗浄後、結合した抗mAB IGF-1R抗体を、ジゴキシゲニル化mAB IGF-1Rの後に西洋ワサビペルオキシダーゼ標識抗ジゴキシゲニン抗体と共にインキュベートすることによって検出した。抗体-酵素結合体は、ABTS(登録商標)基質の発色反応を触媒した。シグナルをELISAリーダーによって波長405 nmで測定した(参照波長490 nm)。それぞれの血清試料の吸光度を3個ずつ決定した。
【0067】
架橋ELISAの異なる3つの変化型を行った:
− 変化型1 実施例4に従って作製された結合体を用いる
− 変化型2 実施例5に従って作製された結合体を用いる
− 変化型3 実施例4および5に従って作製された混合結合体を用いる
【0068】
ジゴキシゲニル化mAB IGF-1Rの試薬変種は全て、mAB IL-6Rに関して先に記述したように(実施例4および5)合成した。異なるELISA変化型における参照標準シグナルを表5および図7に示す。
【0069】
(表5)参照標準シグナル

【0070】
表5は、固相上のmAB IGF-1Rに結合(固定)させるために受動吸着を用いる本発明に従う架橋アッセイを、抗mAB IGF-1R抗体を検出するために行うことができることを示す。同じウサギポリクローナル抗mAB IGF-1R抗体を用いると、3つのアッセイ変化型全ての参照標準値は非常に類似である(表5)。
【特許請求の範囲】
【請求項1】
以下を特徴とする、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイ法を用いて試料中の薬物抗体に対する抗体を免疫学的に測定するための方法;
i)捕獲薬物抗体が、固相に結合される抗体部位が異なる少なくとも2つの該薬物抗体を含む該薬物抗体の混合物であり;および
ii)トレーサー薬物抗体が、検出可能な標識に結合される抗体部位が異なる少なくとも2つの該薬物抗体を含む該薬物抗体の混合物である。
【請求項2】
その結合パートナーに対する薬物抗体の結合が、N末端および/またはε-アミノ基(リジン)、異なるリジンのε-アミノ基、薬物抗体のアミノ酸骨格のカルボキシ-、スルフヒドリル-、ヒドロキシル-、および/またはフェノール官能基、ならびに/または薬物抗体の糖鎖構造の糖アルコール基による化学結合によって行われることを特徴とする、請求項1記載の方法。
【請求項3】
トレーサー薬物抗体混合物が、その結合パートナーに対してアミノ基および糖鎖構造によって結合された薬物抗体を含むことを特徴とする、請求項1または2記載の方法。
【請求項4】
捕獲薬物抗体混合物が、その結合パートナーに対してアミノ基および糖鎖構造によって結合された薬物抗体を含むことを特徴とする、請求項1〜3のいずれか一項記載の方法。
【請求項5】
捕獲薬物抗体の固相に対する結合が受動吸着によって行われることを特徴とする、請求項1〜3のいずれか一項記載の方法。
【請求項6】
捕獲薬物抗体対トレーサー薬物抗体の比が1:10〜50:1(比は、異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)であることを特徴とする、請求項1〜5のいずれか一項記載の方法。
【請求項7】
アミノ結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)対炭水化物結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)の比率がそのような混合物において1:10〜10:1(比は、異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)であることを特徴とする、請求項1〜6のいずれか一項記載の方法。
【請求項8】
捕獲薬物抗体が、特異的結合対を通して固定されることを特徴とする、請求項1〜4および6〜7のいずれか一項記載の方法。
【請求項9】
捕獲薬物抗体がビオチンに結合され、固定が、固定されたアビジンまたはストレプトアビジンを通して行われることを特徴とする、請求項8記載の方法。
【請求項10】
トレーサー薬物抗体が、特異的結合対を通して検出可能な標識に結合されることを特徴とする、請求項1〜9のいずれか一項記載の方法。
【請求項11】
トレーサー薬物抗体がジゴキシゲニンに結合され、検出可能な標識に対する連結が、ジゴキシゲニンに対する抗体を通して行われることを特徴とする、請求項10記載の方法。
【請求項1】
以下を特徴とする、捕獲薬物抗体とトレーサー薬物抗体とを含む二重抗原架橋イムノアッセイ法を用いて試料中の薬物抗体に対する抗体を免疫学的に測定するための方法;
i)捕獲薬物抗体が、固相に結合される抗体部位が異なる少なくとも2つの該薬物抗体を含む該薬物抗体の混合物であり;および
ii)トレーサー薬物抗体が、検出可能な標識に結合される抗体部位が異なる少なくとも2つの該薬物抗体を含む該薬物抗体の混合物である。
【請求項2】
その結合パートナーに対する薬物抗体の結合が、N末端および/またはε-アミノ基(リジン)、異なるリジンのε-アミノ基、薬物抗体のアミノ酸骨格のカルボキシ-、スルフヒドリル-、ヒドロキシル-、および/またはフェノール官能基、ならびに/または薬物抗体の糖鎖構造の糖アルコール基による化学結合によって行われることを特徴とする、請求項1記載の方法。
【請求項3】
トレーサー薬物抗体混合物が、その結合パートナーに対してアミノ基および糖鎖構造によって結合された薬物抗体を含むことを特徴とする、請求項1または2記載の方法。
【請求項4】
捕獲薬物抗体混合物が、その結合パートナーに対してアミノ基および糖鎖構造によって結合された薬物抗体を含むことを特徴とする、請求項1〜3のいずれか一項記載の方法。
【請求項5】
捕獲薬物抗体の固相に対する結合が受動吸着によって行われることを特徴とする、請求項1〜3のいずれか一項記載の方法。
【請求項6】
捕獲薬物抗体対トレーサー薬物抗体の比が1:10〜50:1(比は、異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)であることを特徴とする、請求項1〜5のいずれか一項記載の方法。
【請求項7】
アミノ結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)対炭水化物結合薬物抗体(トレーサーまたは捕獲薬物抗体のいずれか)の比率がそのような混合物において1:10〜10:1(比は、異なりうる結合体の分子量とは無関係に、抗体分子の比率を意味する)であることを特徴とする、請求項1〜6のいずれか一項記載の方法。
【請求項8】
捕獲薬物抗体が、特異的結合対を通して固定されることを特徴とする、請求項1〜4および6〜7のいずれか一項記載の方法。
【請求項9】
捕獲薬物抗体がビオチンに結合され、固定が、固定されたアビジンまたはストレプトアビジンを通して行われることを特徴とする、請求項8記載の方法。
【請求項10】
トレーサー薬物抗体が、特異的結合対を通して検出可能な標識に結合されることを特徴とする、請求項1〜9のいずれか一項記載の方法。
【請求項11】
トレーサー薬物抗体がジゴキシゲニンに結合され、検出可能な標識に対する連結が、ジゴキシゲニンに対する抗体を通して行われることを特徴とする、請求項10記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−73266(P2012−73266A)
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願番号】特願2011−250266(P2011−250266)
【出願日】平成23年11月16日(2011.11.16)
【分割の表示】特願2008−557656(P2008−557656)の分割
【原出願日】平成19年3月7日(2007.3.7)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願日】平成23年11月16日(2011.11.16)
【分割の表示】特願2008−557656(P2008−557656)の分割
【原出願日】平成19年3月7日(2007.3.7)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
[ Back to top ]

