抗血栓性材料
【課題】血小板の粘着及び血液凝固因子の活性化の両方を低減した抗血栓性材料を実現できるようにする。
【解決手段】抗血栓性材料は、基材の表面に形成された炭素質膜からなる抗血栓性材料を対象とする。炭素が互いに結合して形成された膜本体と、膜本体に導入された窒素性官能基及びカルボキシル基とを備えている。膜本体の表面におけるゼータ電位が−8mV以上である。
【解決手段】抗血栓性材料は、基材の表面に形成された炭素質膜からなる抗血栓性材料を対象とする。炭素が互いに結合して形成された膜本体と、膜本体に導入された窒素性官能基及びカルボキシル基とを備えている。膜本体の表面におけるゼータ電位が−8mV以上である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗血栓性材料に関し、特に血液と直接接触する医療器具等に用いる抗血栓性材料に関する。
【背景技術】
【0002】
医療技術の進歩に伴い、医療器具と血液とが接触する機会が増加している。このため、血液及び生体組織との適合性(生体適合性)の重要度が高くなっている。中でも、血液の凝固を防ぐ抗血栓性が、血液と接触する医療器具においては非常に重要である。医療器具に抗血栓性を付与する方法として、現在のところ親水性の高分子材料による医療器具の被覆が主に行われている。また、医療器具の表面にヘパリン等の抗血栓性の材料を固定したり、ヘパリンを除放する高分子材料を固定したりする方法も知られている。
【0003】
しかし、医療器具を高分子材料により被覆する場合には、医療器具と高分子材料とを十分密着させることが困難であるという問題がある。医療器具の基材は金属製である場合が多く、基材から高分子材料が剥がれ落ちてしまうことが多い。また、ヘパリン等を固定する場合にも同じ問題が生じる。特に、ヘパリンを用いる場合には、動物由来のため感染症の問題が生じたり、過剰投与による血量の増大等の問題が生じたりすることが知られている。
【0004】
これらの問題を解決する方法として、ダイヤモンド様薄膜(DLC膜)に代表される炭素質膜による医療器具の被覆が注目を集めている。炭素質膜は、金属及びその他の材料の表面に強固な皮膜として形成できる。このため、高分子材料と比べて医療器具の基材から剥がれにくいという効果が得られる。さらに、炭素質膜は、耐摩耗性及び耐蝕性に優れているため、医療器具の耐久性を向上させることができるという特徴を有している。
【0005】
炭素質膜は、平滑で不活性な材料であるため、それ自体もある程度の生体適合性を有している。炭素質膜の抗血栓性をさらに向上させる方法として、医療器具を被覆する炭素質膜にプラズマを照射することにより、炭素質膜に反応性の部位を形成し、形成した反応性の部位を用いて炭素質膜に親水性を付与する方法が知られている(例えば、特許文献1を参照。)。
【特許文献1】国際公開第2005/97673号パンフレット
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、前記従来の炭素質膜を親水性とすることによる抗血栓性の向上には、以下のような問題があることを本願発明者らは見いだした。
【0007】
血栓の原因となる血液の凝固は、血小板の凝集による血液凝固因子の活性化と、異物による血液凝固因子の活性化とが関係している。このため、医療器具に抗血栓性を付与するためには、医療器具の表面への血小板の粘着の防止と、医療器具による血液凝固因子の活性化の防止とが必要となる。
【0008】
本願発明者らの検討の結果、カルボキシル基の導入により親水性を付与した炭素質膜は、血小板の粘着数を低減する効果は非常に高いが、血液凝固因子の活性化を防止する効果が低いことが明らかとなった。
【0009】
本発明は、本願発明者らが見いだした前記の知見に基づいてなされたものであり、血小板の粘着及び血液凝固因子の活性化の両方を低減した抗血栓性材料を実現できるようにすることを目的とする。
【課題を解決するための手段】
【0010】
前記の目的を達成するため、本発明は抗血栓性材料を、表面におけるゼータ電位が−8mV以上である炭素質膜により構成する。
【0011】
具体的に、本発明に係る抗血栓性材料は、基材の表面に形成された炭素質膜からなる抗血栓性材料を対象とし、炭素が互いに結合して形成された膜本体と、膜本体に導入された窒素性官能基及びカルボキシル基とを備え、膜本体の表面におけるゼータ電位が−8mV以上であることを特徴とする。
【0012】
炭素質膜の膜表面のゼータ電位は、抗血栓性に大きく影響を与え、ゼータ電位が低い場合には、TAT生成量が増大する。しかし、本発明に係る抗血栓性材料は、アミノ基とカルボキシル基との両方を備えており、膜本体の表面におけるゼータ電位が−8mV以上である。このため、TAT生成量を抑えることができ且つ血小板の粘着数も低減することができる。
【0013】
本発明の抗血栓性材料において、窒素性官能基とカルボキシル基との比率は、2.5以上且つ4以下であることが好ましい。
【0014】
本発明の抗血栓性材料において、膜本体の表面における接触角は、60度以上且つ70度以下であることが好ましい。
【発明の効果】
【0015】
本発明に係る抗血栓性材料によれば、血小板の粘着及び血液凝固因子の活性化の両方を低減した抗血栓性材料を実現できる。
【発明を実施するための最良の形態】
【0016】
本発明に係る抗血栓性材料は、基材の表面に形成された炭素質膜である。炭素質膜は、SP2(グラファイト)結合した炭素及びSP3(ダイヤモンド)結合した炭素を含む炭素骨格を主成分とし、いわゆるダイヤモンド様薄膜(DLC膜)に代表される薄膜である。
【0017】
炭素質膜にプラズマを照射することにより、炭素−炭素結合等が開裂し、反応性の部位ができる。この反応性の部位と酸素とが反応することによりカルボキシル基が生成する。これにより、炭素質膜の表面は親水性となる。従来は、炭素質膜の表面を親水性とすることにより、抗血栓性を向上させようとしていた。
【0018】
炭素質膜の表面を親水性とすることにより、血小板の粘着を抑えることができ、血小板に対する適合性は向上する。しかし、本願発明者らの検討の結果、炭素質膜にカルボキシル基を導入すると、炭素質膜の表面におけるゼータ電位が低下し、トロンビン−アンチトロンビンIII複合体(TAT)の産生量が増大し、血液凝固因子に対する適合性が低下してしまうことが明らかとなった。
【0019】
以下に、本発明に係る抗血栓性材料について、実施例を用いてさらに詳細に説明する。
【0020】
(一実施例)
−炭素質膜の形成−
本実施例において基材には、ステンレス(SUS316)板を用いた。血小板粘着試験用には、6mm角の試料を作成し、トロンビン・アンチトロンビンIII複合体の定量用には、直径46mmの試料を作成した。
【0021】
基材をイオン化蒸着装置のチャンバ内にセットし、チャンバーにアルゴンガス(Ar)を圧力が10-1Pa〜10-3Pa(10-3Torr〜10-5Torr)となるように導入した後、放電を行うことによりArイオン発生させ、発生したArイオンを基材の表面に衝突させるボンバードクリーニングを約30分間行った。
【0022】
続いて、チャンバにテトラメチルシラン(Si(CH3)4)を3分間導入し、珪素(Si)及び炭素(C)を主成分とするアモルファス状で膜厚が20nmの中間層を形成した。
【0023】
中間層を形成した後、C6H6ガスをチャンバーに導入し、ガス圧を10-1Paとした。C6H6を30ml/分の速度で連続的に導入しながら放電を行うことによりC6H6をイオン化し、イオン化蒸着を約2分間行った。厚さ30nmのDLC膜である炭素質膜を基材の表面に形成した。
【0024】
炭素質膜を形成する際のターゲット電圧は1.5kV、ターゲット電流は50mA、フィラメント電圧は14V、フィラメント電流は30A、アノード電圧は50V、アノード電流は0.6A、リフレクタ電圧は50V、リフレクタ電流は6mAとした。また、形成時における基材の温度は約160℃であった。
【0025】
なお、中間層は基材と炭素質膜との密着性を向上させるために設けており、基材とDLC膜との密着性を十分に確保できる場合には省略してもよい。
【0026】
本実施例においては、基材に金属を用いたが、どのような材質であってもよい。具体的には、特に限定されるものではないが例えば、鉄、ニッケル、クロム、銅、チタン、白金、タングステン又はタンタル等の金属を基材として用いることができる。また、これらの合金である、SUS316L等のステンレス鋼、Ti−Ni合金若しくはCu−Al−Mn合金等の形状記憶合金、Cu−Zn合金、Ni−Al合金、チタン合金、タンタル合金、プラチナ合金又はタングステン合金等の合金を用いることもできる。また、アルミ、シリコン若しくはジルコン等の酸化物、窒化物若しくは炭化物等の生体不活性なセラミックス又はアパタイト若しくは生体ガラス等の生体活性を有するセラミックスでもよい。さらに、ポリメタクリル酸メチル(PMMA)、高密度ポリエチレン若しくはポリアセタール等の高分子樹脂又はポリジメチルシロキサン等のシリコンポリマー若しくはポリテトラフルオロエチレン等のフッ素系ポリマー等であってもよい。
【0027】
また、形状も板状に限らずどのような形状であってもよく、医療器具等の状態に成形されたものであっても、成形前の材料の状態であってもよい。
【0028】
炭素質膜の形成は、スパッタ法に代えて、DCマグネトロンスパッタ法、RFマグネトロンスパッタ法、化学気相堆積法(CVD法)、プラズマCVD法、プラズマイオン注入法、重畳型RFプラズマイオン注入法、イオンプレーティング法、アークイオンプレーティング法、イオンビーム蒸着法又はレーザーアブレーション法等を用いてもよい。
【0029】
炭素質膜の膜厚は、特に限定されるものではないが、0.005μm〜3μmの範囲が好ましく、より好ましくは0.01μm〜1μmの範囲である。
【0030】
また、炭素質膜は、シリコン(Si)を含有していてもよい。炭素質膜を形成する際に、炭素源に加えてシリコン源を同時に供給すれば、Siを含む炭素質膜が形成できる。
【0031】
また、炭素質膜は、フッ素(F)を含有していてもよい。炭素質膜を形成する際に、炭素源に加えてフッ素源を同時に供給すれば、Fを含む炭素質膜が形成できる。
【0032】
中間層は、基材の種類に応じて種々のものを用いることができるが、シリコン(Si)と炭素(C)、チタン(Ti)と炭素(C)又はクロム(Cr)と炭素(C)からなるアモルファス膜等の公知のものを用いることができる。その厚みは特に限定されるものではないが、0.005μm〜0.3μmの範囲が好ましく、より好ましくは0.01μm〜0.1μmの範囲である。
【0033】
中間層はスパッタ法に代えて、CVD法、プラズマCVD法、溶射法、イオンプレーティング法又はアークイオンプレーティング法等を用いて形成してもよい。
【0034】
−プラズマ照射−
次に、得られた炭素質膜の抗血栓性を向上させるため、プラズマ照射を行った。プラズマ照射は、図1に示すような平行平板型のプラズマ照射装置により行った。プラズマ照射装置のチャンバ10内に炭素質膜を形成した基材11をセットした後、チャンバ10内の圧力を所定の圧力まで排気した。チャンバ10内の圧力を高真空状態とする場合には、ターボ分子ポンプを用いて排気を行った。次に、チャンバ10内にガスを所定の流量で導入し、平行平板電極12Aと12Bとの間に高周波電力を印加することによりプラズマを発生させた。高周波電力は、マッチングボックス14を介して接続された高周波電源15を用いて印加した。ガス流量の調整はマスフローコントローラ13により行った。
【0035】
本実施例においては、アルゴン(Ar)、酸素(O2)、アセチレン(C2H2)、アンモニア(NH3)及びC2H2とO2との混合ガス(C2H2/O2)の5種類のガスを用いて表1に示すような5種類の条件についてプラズマ照射を行った。なお、プラズマの照射時間は1つのガスにつき15秒とした。
【0036】
【表1】

表1において、高真空とは、ターボ分子ポンプを用いて一旦チャンバ内を高真空状態とした後、ガスを導入したことを示している。本実施例においては、高真空状態の場合における到達真空度は5×10-3Paであり、通常のプラズマ照射における到達真空度は2Paであった。
【0037】
なお、プラズマ照射装置は、どのような構造のものを用いてもよい。また、放電形式についても、どのようなものを用いてもよく、例えば平行平板方式、アフターグロー放電方式、電磁誘導型及び有磁場型等を用いればよい。プラズマ照射条件は特に限定されない。例えば、プラズマ発生用の電源としては、商用周波数(50Hz又は60Hz)、高周波(ラジオ周波数)又はマイクロ波領域等の各種の電源周波数を用いることができる。さらに、原料ガスの圧力制御方法や供給構造についても特に限定するものではない。しかし、であまりエッチングレートが大きいプラズマ照射条件を用いると、炭素質膜にダメージを与えるおそれがある。
【0038】
−接触角の測定−
接触角の測定には、Erma社製ゴニオメーター式接触角測定機G−I型を用い、医療用材料の表面上に15μlの水滴を置き、50秒後に左の接触角、70秒後に右の接触角を測定した。なお、測定値は10点の平均値である。
【0039】
−組成評価−
得られた、プラズマ照射炭素質膜の組成は、X線光電子分光分析(XPS)法を用いて評価した。測定には、日本電子株式会社製の光電子分光装置JPS−9010MCを用いた。X線源にはAlを用い、加速電圧が12.5kVで、エミッション電流が17.5mAの条件でX線を発生させた。試料中から任意に選択した直径5mmのエリアについて測定を行った。また、X線を試料に対して垂直に入射させ、検出角度を0度とすることにより、5nm程度の深さまでの組成を測定している。
【0040】
結合エネルギーの測定領域は、274eV〜294eV、389eV〜409eV及び522eV〜542eVとし、それぞれC1s、N1s及びO1sのピークを得た。得られたピークの面積比を比較することにより炭素に対する酸素の存在比O/C及び炭素に対する窒素の存在比N/Cを求めた。また、C1sピークは、カーブフィッティングによりC−C成分、C−O成分、C=O成分及びO=C−O成分に分割した。O=C−O成分のC1sピークに対する面積比を求めることによりカルボキシル基成分(O=C−O)の全炭素に対する存在比O=C−O/Cを求めた。
【0041】
−血小板に対する適合性評価−
血小板に対する適合性は、血小板を材料表面に所定時間接触させ、試料表面に粘着した血小板数の大小により適合性の良否を判定した。
【0042】
血小板の試料への粘着数は、以下のようにして測定した。まず、6mm×6mmに調整した試料の表面に血小板浮遊血漿130μlを置く。続いて、プラスチックシャーレで蓋をした常態で、37℃にて60分間インキュベートした。インキュベート終了後、試料をpH7.4のリン酸バッファー(PBS)にて3回洗浄した。次いで1%グルタルアルデヒド/PBSに試料を浸漬し、4℃にて60分間静置することにより、粘着した血小板を固定した。続いてこの試料をPBS、PBS/蒸留水(75/25)、PBS/蒸留水(50/50)、PBS/蒸留水(25/75)及び蒸留水を順に用いて3回ずつ洗浄した。洗浄済みの試料を凍結乾燥した後、試料に対し白金蒸着を行った。白金蒸着を行った試料の表面を走査型電子鏡(日本電子、SEM−840)を用い拡大率1000倍にてランダムに5視野について写真撮影し、5視野の粘着血小板数を合計し、単位面積あたりの血小板数を求めた。
【0043】
血小板浮遊血漿は、以下のようにして調整した。健常者から採取した全血を、クエン酸加血(全血/3.8%クエン酸ナトリウム溶液=95/5vol/vol)とし、これを室温にて1500rpmで10分間遠心し、上澄から血小板多血漿(PRP)を1ml採取した。残りの血液をさらに3000rpmで10分間遠心し、上澄から血小板貧血漿(PPR)を1mlを採取した。次いで血球カウンター(シスメックス社、Sysmex K-1000)にてPRP及びPPP中の血小板数を計測した。PRPをPPPにより希釈することにより血小板数が10万個/μlの血小板浮遊血漿を調製した。
【0044】
−血液凝固因子に対する適合性評価−
血液凝固因子に対する適合性は、トロンビン・アンチトロンビンIII複合体(TAT)の生成量を定量することにより行った。
【0045】
血液凝固因子(凝固系)が活性化することにより産生され、血液凝固反応を主に司る酵素となるトロンビンはアンチトロンビンIIIによって速やかにトロンビン・アンチトロンビンIII複合体(TAT)となって失活する。そのため、産生トロンビン量を直接定量することは困難なことが知られており、TATの血中濃度を求めることで、産生トロンビン量を見積もることが一般的に行われている。従って、凝固系に対する適合性は、試料と全血とを所定時間接触させた際のTATの産生量から判断した。
【0046】
アクリル製のC形スペーサ(内径:40mm、外径:46mm、厚さ:0.8mm)の片面にpoly(2-methoxyethyl acrylate)をコートしたポリエチレンテレフタレート(PET)製のシート(φ=46mm)を両面接着テープにより接着する。C型スペーサのもう一方の面には、直径46mmの試料を両面接着テープにより貼り付け、容積1000μlの試料チャンバを作製する。
【0047】
健常人より採血したヘパリン化全血(2IU/ml)を試料チャンバに1000μl注入し、セロファンテープにて封をした。血球沈降を防ぐため、このチャンバーを垂直回転ローターに取り付けて回転(約4.7rpm)させながら37℃で120分間インキュベートした。インキュベート終了後、チャンバーから全血を回収し3.8%クエン酸Na水溶液110μlを加え、10℃、3000rpm、10分の条件で遠心分離した。
【0048】
上澄みとして得られた血漿中のTAT濃度を市販のTAT用酵素免疫定量法キット(Enzyme Research Laboratories社製TAT−EIA)とマイクロプレートリーダー(Molecular Device社製、Thermo Max)とを用いて定量した。ELISAの操作はキット付属のマニュアルに従って実施した(測定波長450nm)。なお、C型スペーサの両面にpoly(2-methoxyethyl acrylate)をコートしたPETフィルムを接着した場合をコントロールとした。
【0049】
−表面電位の評価−
得られた、プラズマ照射炭素質膜について、以下のようにして表面電位を測定した。測定には、大塚電子株式会社製のゼータ電位・粒径測定システムELS−Zを用いた。得られたプラズマ照射炭素質膜を平板試料用セルに密着させ、セル内にモニタ用粒子を注入した。モニタ用粒子は10mMの塩化ナトリウム(NaCl)溶液中に分散させた大塚電子株式会社製のものを用いた。セル深さ方向の各レベルについてモニタ粒子の電気泳動を行い、セル内部の見かけの速度分布を測定した。電気泳動は、平均電場が17.33V/cmで、平均電流が1.02mAの条件で行った。得られた見かけの速度分布を森・岡本の式に基づいて解析することにより、プラズマ照射炭素質膜表面の表面電位を求めた。なお、平板試料用セルは、セル表面の電荷の影響を抑えるため、ポリアクリルアミドによりコーティング処理して用いた。
【0050】
−炭素質膜の評価結果−
まず、プラズマ照射後の炭素質膜について水に対する接触角を測定し、どの程度親水性となっているかを評価した。図2は、得られたプラズマ照射炭素質膜の水に対する接触角の値の経時変化を示している。図2に示すように大部分のサンプルにおいては、接触角の値は経時的に変化し、プラズマを照射した後、接触角の値が安定するまでに10日程度かかることが明らかになった。
【0051】
このように、接触角が経時的に変化する理由は明確ではない。しかし、プラズマを照射した後、大気中に暴露されたサンプルの表面において、さらに何らかの反応が進行するためであると考えられる。プラズマ照射を行った炭素質膜を医療器具等に用いる場合、プラズマ照射直後に使用されることはない。従って、プラズマ照射を行った炭素質膜を評価する場合には、安定状態となった後のサンプルについて評価することが非常に重要である。以後の評価は、接触角の値が安定するプラズマ照射後10日以上経過したサンプルを用いて行った。
【0052】
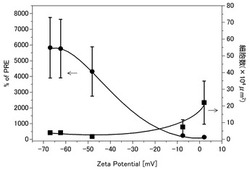
図3は、プラズマ照射後の炭素質膜のゼータ電位と、血液適合性との関係を示している。図3に示すように、血小板の粘着数はゼータ電位が低い場合に低く、ゼータ電位が高くなるに従い徐々に上昇した。しかし、ゼータ電位が+2mV程度の場合においても、血小板の粘着数は20×104μm2程度であり、ポリエチレンテレフタレート(PET)及びステンレス(SUS316)と同程度の適合性を示した。一方、TATの生成量はゼータ電位が低い場合には非常に高く、ゼータ電位が高くなると急激に低下した。
【0053】
以上の結果は、血小板だけでなく血液凝固因子に対しても適合性を示すためには、ゼータ電位がある程度以上高いことが必要であり、−8mV以上であることが好ましいことを示している。また、ゼータ電位が高くなると血小板に対する適合性が徐々に悪化するが、他の材料に比べて十分に高い適合性を示し、少なくとも+2mV程度であれば問題ない。
【0054】
ゼータ電位が高く、TATの生成量が低いサンプルは、O2プラズマ照射後にNH3プラズマを照射した場合(O2+NH3:約−8mV)及びNH3プラズマを照射した場合(約+2mV)である。このことから、ゼータ電位の上昇は、炭素質膜の表面にイオン化した際に正に帯電する官能基が導入されたことによるのではないかと考えられる。
【0055】
プラズマ照射後の炭素質膜に導入された窒素がどのような状態となっているかは明確ではない。しかし、アミノ基、アミド基及びアミン基等の窒素を含む官能基(窒素性官能基)を形成していると考えられる。窒素性官能基の詳細な分析は困難であるが、XPS測定においてN1sピークは、398.9eVに出現した。これは、アミン及びアミドのN1sの束縛エネルギー(400±1eV)からずれており、今回のサンプルにおいては、窒素性官能基のうちの少なくとも一部はアミノ基となっていると考えられる。
【0056】
図4は、プラズマ照射後の炭素質膜の表面に形成された官能基とゼータ電位との関係を示している。図4において、横軸は炭素に対する窒素の存在比N/Cと、炭素に対するO=C−O成分の存在比O=C−O/Cとの比を示している。先に述べたように、炭素質膜中の窒素は、窒素性官能基となっていると推測される。従って、N/O=C−Oは、窒素性官能基とカルボキシル基との比率を表している。窒素性官能基の存在比率が高くなると、ゼータ電位の値が高くなっていことが明らかである。
【0057】
このように、炭素質膜の表面におけるゼータ電位の値は、窒素性官能基とカルボキシル基との比率によって決まる。従って、血小板及び血液凝固因子の両方に対して適合性を示すためには、窒素性官能基とカルボキシル基との比率が2.5以上であることが好ましい。窒素性官能基の導入量は多い方が好ましいと考えられるが、あまりに高くなるとゼータ電位が上昇し、血小板に対する適合性が悪化するおそれがある。また、炭素質膜の表面に導入できる窒素性官能基の理論的な上限も考慮すると、窒素性官能基とカルボキシル基の比率は、4程度が上限になると考えられる。
【0058】
ゼータ電位が高いO2+NH3又はNH3を照射した場合には、プラズマ照射後10日以上経過した際の接触角が60°以上であった。一方、ゼータ電位が低い他のサンプルについては、いずれも接触角が50°以下であった。このことから、ゼータ電位が高い炭素質膜は、親水性のカルボキシル基が過度に導入されていないと考えられる。
【0059】
このように、炭素質膜の表面には、ゼータ電位を低下させるカルボキシル基が過度に導入されていないことが好ましく、接触角が60°以上であることが好ましい。一方、プラズマ照射していない炭素質膜は接触角が80°程度ある。プラズマ照射していない炭素質膜は、血小板の粘着数が55×104μm2程度あり、プラズマ照射した炭素質膜よりも遙かに血小板に対する適合性に劣る。従って、炭素質膜の接触角はあまり高すぎない方がよく、70°以下であることが好ましい。
【0060】
以上のような、カルボキシル基と窒素性官能基との両方が形成され、ゼータ電位の値が高い炭素質膜は、アンモニアのプラズマを照射することにより形成すればよい。また、他のプラズマを照射した後に、アンモニアのプラズマを照射してもよい。プラズマ照射時におけるチャンバ内の到達真空度が高い方が、空気中の酸素の影響を受けることがなく好ましい。
【0061】
なお、アンモニアに代えて他の塩基性窒素含有化合物を用いることも可能である。塩基性窒素含有化合物としては、一般式がNR1R2R3により示される有機アミン類(但し、R1、R2及びR3は水素、−CH3、−C2H5、−C3H7又は−C4H8であり、R1、R2及びR3は互いに同一であっても、異なっていてもよい。)又はベンジルアミン及びその2級、3級アミン等が挙げられる。但し、アンモニアがコスト、取り扱いの容易さから好ましい。
【産業上の利用可能性】
【0062】
本発明に係る抗血栓性材料は、血小板の粘着及び血液凝固因子の活性化の両方を低減でき、特に血液と直接接触する医療器具等に用いる抗血栓性材料等として有用である。
【図面の簡単な説明】
【0063】
【図1】本発明の一実施例において用いたプラズマ照射装置を示す概略図である。
【図2】本発明の一実施例に係る炭素質膜の接触角の変動を示すグラフである。
【図3】本発明の一実施例に係る炭素質膜のゼータ電位と血液適合性との関係を示すグラフである。
【図4】本発明の一実施例に係る炭素質膜に形成された官能基とゼータ電位との関係を示すグラフである。
【符号の説明】
【0064】
10 チャンバ
11 基材
12A 平行平板電極
13 マスフローコントローラ
14 マッチングボックス
15 高周波電源
【技術分野】
【0001】
本発明は、抗血栓性材料に関し、特に血液と直接接触する医療器具等に用いる抗血栓性材料に関する。
【背景技術】
【0002】
医療技術の進歩に伴い、医療器具と血液とが接触する機会が増加している。このため、血液及び生体組織との適合性(生体適合性)の重要度が高くなっている。中でも、血液の凝固を防ぐ抗血栓性が、血液と接触する医療器具においては非常に重要である。医療器具に抗血栓性を付与する方法として、現在のところ親水性の高分子材料による医療器具の被覆が主に行われている。また、医療器具の表面にヘパリン等の抗血栓性の材料を固定したり、ヘパリンを除放する高分子材料を固定したりする方法も知られている。
【0003】
しかし、医療器具を高分子材料により被覆する場合には、医療器具と高分子材料とを十分密着させることが困難であるという問題がある。医療器具の基材は金属製である場合が多く、基材から高分子材料が剥がれ落ちてしまうことが多い。また、ヘパリン等を固定する場合にも同じ問題が生じる。特に、ヘパリンを用いる場合には、動物由来のため感染症の問題が生じたり、過剰投与による血量の増大等の問題が生じたりすることが知られている。
【0004】
これらの問題を解決する方法として、ダイヤモンド様薄膜(DLC膜)に代表される炭素質膜による医療器具の被覆が注目を集めている。炭素質膜は、金属及びその他の材料の表面に強固な皮膜として形成できる。このため、高分子材料と比べて医療器具の基材から剥がれにくいという効果が得られる。さらに、炭素質膜は、耐摩耗性及び耐蝕性に優れているため、医療器具の耐久性を向上させることができるという特徴を有している。
【0005】
炭素質膜は、平滑で不活性な材料であるため、それ自体もある程度の生体適合性を有している。炭素質膜の抗血栓性をさらに向上させる方法として、医療器具を被覆する炭素質膜にプラズマを照射することにより、炭素質膜に反応性の部位を形成し、形成した反応性の部位を用いて炭素質膜に親水性を付与する方法が知られている(例えば、特許文献1を参照。)。
【特許文献1】国際公開第2005/97673号パンフレット
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、前記従来の炭素質膜を親水性とすることによる抗血栓性の向上には、以下のような問題があることを本願発明者らは見いだした。
【0007】
血栓の原因となる血液の凝固は、血小板の凝集による血液凝固因子の活性化と、異物による血液凝固因子の活性化とが関係している。このため、医療器具に抗血栓性を付与するためには、医療器具の表面への血小板の粘着の防止と、医療器具による血液凝固因子の活性化の防止とが必要となる。
【0008】
本願発明者らの検討の結果、カルボキシル基の導入により親水性を付与した炭素質膜は、血小板の粘着数を低減する効果は非常に高いが、血液凝固因子の活性化を防止する効果が低いことが明らかとなった。
【0009】
本発明は、本願発明者らが見いだした前記の知見に基づいてなされたものであり、血小板の粘着及び血液凝固因子の活性化の両方を低減した抗血栓性材料を実現できるようにすることを目的とする。
【課題を解決するための手段】
【0010】
前記の目的を達成するため、本発明は抗血栓性材料を、表面におけるゼータ電位が−8mV以上である炭素質膜により構成する。
【0011】
具体的に、本発明に係る抗血栓性材料は、基材の表面に形成された炭素質膜からなる抗血栓性材料を対象とし、炭素が互いに結合して形成された膜本体と、膜本体に導入された窒素性官能基及びカルボキシル基とを備え、膜本体の表面におけるゼータ電位が−8mV以上であることを特徴とする。
【0012】
炭素質膜の膜表面のゼータ電位は、抗血栓性に大きく影響を与え、ゼータ電位が低い場合には、TAT生成量が増大する。しかし、本発明に係る抗血栓性材料は、アミノ基とカルボキシル基との両方を備えており、膜本体の表面におけるゼータ電位が−8mV以上である。このため、TAT生成量を抑えることができ且つ血小板の粘着数も低減することができる。
【0013】
本発明の抗血栓性材料において、窒素性官能基とカルボキシル基との比率は、2.5以上且つ4以下であることが好ましい。
【0014】
本発明の抗血栓性材料において、膜本体の表面における接触角は、60度以上且つ70度以下であることが好ましい。
【発明の効果】
【0015】
本発明に係る抗血栓性材料によれば、血小板の粘着及び血液凝固因子の活性化の両方を低減した抗血栓性材料を実現できる。
【発明を実施するための最良の形態】
【0016】
本発明に係る抗血栓性材料は、基材の表面に形成された炭素質膜である。炭素質膜は、SP2(グラファイト)結合した炭素及びSP3(ダイヤモンド)結合した炭素を含む炭素骨格を主成分とし、いわゆるダイヤモンド様薄膜(DLC膜)に代表される薄膜である。
【0017】
炭素質膜にプラズマを照射することにより、炭素−炭素結合等が開裂し、反応性の部位ができる。この反応性の部位と酸素とが反応することによりカルボキシル基が生成する。これにより、炭素質膜の表面は親水性となる。従来は、炭素質膜の表面を親水性とすることにより、抗血栓性を向上させようとしていた。
【0018】
炭素質膜の表面を親水性とすることにより、血小板の粘着を抑えることができ、血小板に対する適合性は向上する。しかし、本願発明者らの検討の結果、炭素質膜にカルボキシル基を導入すると、炭素質膜の表面におけるゼータ電位が低下し、トロンビン−アンチトロンビンIII複合体(TAT)の産生量が増大し、血液凝固因子に対する適合性が低下してしまうことが明らかとなった。
【0019】
以下に、本発明に係る抗血栓性材料について、実施例を用いてさらに詳細に説明する。
【0020】
(一実施例)
−炭素質膜の形成−
本実施例において基材には、ステンレス(SUS316)板を用いた。血小板粘着試験用には、6mm角の試料を作成し、トロンビン・アンチトロンビンIII複合体の定量用には、直径46mmの試料を作成した。
【0021】
基材をイオン化蒸着装置のチャンバ内にセットし、チャンバーにアルゴンガス(Ar)を圧力が10-1Pa〜10-3Pa(10-3Torr〜10-5Torr)となるように導入した後、放電を行うことによりArイオン発生させ、発生したArイオンを基材の表面に衝突させるボンバードクリーニングを約30分間行った。
【0022】
続いて、チャンバにテトラメチルシラン(Si(CH3)4)を3分間導入し、珪素(Si)及び炭素(C)を主成分とするアモルファス状で膜厚が20nmの中間層を形成した。
【0023】
中間層を形成した後、C6H6ガスをチャンバーに導入し、ガス圧を10-1Paとした。C6H6を30ml/分の速度で連続的に導入しながら放電を行うことによりC6H6をイオン化し、イオン化蒸着を約2分間行った。厚さ30nmのDLC膜である炭素質膜を基材の表面に形成した。
【0024】
炭素質膜を形成する際のターゲット電圧は1.5kV、ターゲット電流は50mA、フィラメント電圧は14V、フィラメント電流は30A、アノード電圧は50V、アノード電流は0.6A、リフレクタ電圧は50V、リフレクタ電流は6mAとした。また、形成時における基材の温度は約160℃であった。
【0025】
なお、中間層は基材と炭素質膜との密着性を向上させるために設けており、基材とDLC膜との密着性を十分に確保できる場合には省略してもよい。
【0026】
本実施例においては、基材に金属を用いたが、どのような材質であってもよい。具体的には、特に限定されるものではないが例えば、鉄、ニッケル、クロム、銅、チタン、白金、タングステン又はタンタル等の金属を基材として用いることができる。また、これらの合金である、SUS316L等のステンレス鋼、Ti−Ni合金若しくはCu−Al−Mn合金等の形状記憶合金、Cu−Zn合金、Ni−Al合金、チタン合金、タンタル合金、プラチナ合金又はタングステン合金等の合金を用いることもできる。また、アルミ、シリコン若しくはジルコン等の酸化物、窒化物若しくは炭化物等の生体不活性なセラミックス又はアパタイト若しくは生体ガラス等の生体活性を有するセラミックスでもよい。さらに、ポリメタクリル酸メチル(PMMA)、高密度ポリエチレン若しくはポリアセタール等の高分子樹脂又はポリジメチルシロキサン等のシリコンポリマー若しくはポリテトラフルオロエチレン等のフッ素系ポリマー等であってもよい。
【0027】
また、形状も板状に限らずどのような形状であってもよく、医療器具等の状態に成形されたものであっても、成形前の材料の状態であってもよい。
【0028】
炭素質膜の形成は、スパッタ法に代えて、DCマグネトロンスパッタ法、RFマグネトロンスパッタ法、化学気相堆積法(CVD法)、プラズマCVD法、プラズマイオン注入法、重畳型RFプラズマイオン注入法、イオンプレーティング法、アークイオンプレーティング法、イオンビーム蒸着法又はレーザーアブレーション法等を用いてもよい。
【0029】
炭素質膜の膜厚は、特に限定されるものではないが、0.005μm〜3μmの範囲が好ましく、より好ましくは0.01μm〜1μmの範囲である。
【0030】
また、炭素質膜は、シリコン(Si)を含有していてもよい。炭素質膜を形成する際に、炭素源に加えてシリコン源を同時に供給すれば、Siを含む炭素質膜が形成できる。
【0031】
また、炭素質膜は、フッ素(F)を含有していてもよい。炭素質膜を形成する際に、炭素源に加えてフッ素源を同時に供給すれば、Fを含む炭素質膜が形成できる。
【0032】
中間層は、基材の種類に応じて種々のものを用いることができるが、シリコン(Si)と炭素(C)、チタン(Ti)と炭素(C)又はクロム(Cr)と炭素(C)からなるアモルファス膜等の公知のものを用いることができる。その厚みは特に限定されるものではないが、0.005μm〜0.3μmの範囲が好ましく、より好ましくは0.01μm〜0.1μmの範囲である。
【0033】
中間層はスパッタ法に代えて、CVD法、プラズマCVD法、溶射法、イオンプレーティング法又はアークイオンプレーティング法等を用いて形成してもよい。
【0034】
−プラズマ照射−
次に、得られた炭素質膜の抗血栓性を向上させるため、プラズマ照射を行った。プラズマ照射は、図1に示すような平行平板型のプラズマ照射装置により行った。プラズマ照射装置のチャンバ10内に炭素質膜を形成した基材11をセットした後、チャンバ10内の圧力を所定の圧力まで排気した。チャンバ10内の圧力を高真空状態とする場合には、ターボ分子ポンプを用いて排気を行った。次に、チャンバ10内にガスを所定の流量で導入し、平行平板電極12Aと12Bとの間に高周波電力を印加することによりプラズマを発生させた。高周波電力は、マッチングボックス14を介して接続された高周波電源15を用いて印加した。ガス流量の調整はマスフローコントローラ13により行った。
【0035】
本実施例においては、アルゴン(Ar)、酸素(O2)、アセチレン(C2H2)、アンモニア(NH3)及びC2H2とO2との混合ガス(C2H2/O2)の5種類のガスを用いて表1に示すような5種類の条件についてプラズマ照射を行った。なお、プラズマの照射時間は1つのガスにつき15秒とした。
【0036】
【表1】

表1において、高真空とは、ターボ分子ポンプを用いて一旦チャンバ内を高真空状態とした後、ガスを導入したことを示している。本実施例においては、高真空状態の場合における到達真空度は5×10-3Paであり、通常のプラズマ照射における到達真空度は2Paであった。
【0037】
なお、プラズマ照射装置は、どのような構造のものを用いてもよい。また、放電形式についても、どのようなものを用いてもよく、例えば平行平板方式、アフターグロー放電方式、電磁誘導型及び有磁場型等を用いればよい。プラズマ照射条件は特に限定されない。例えば、プラズマ発生用の電源としては、商用周波数(50Hz又は60Hz)、高周波(ラジオ周波数)又はマイクロ波領域等の各種の電源周波数を用いることができる。さらに、原料ガスの圧力制御方法や供給構造についても特に限定するものではない。しかし、であまりエッチングレートが大きいプラズマ照射条件を用いると、炭素質膜にダメージを与えるおそれがある。
【0038】
−接触角の測定−
接触角の測定には、Erma社製ゴニオメーター式接触角測定機G−I型を用い、医療用材料の表面上に15μlの水滴を置き、50秒後に左の接触角、70秒後に右の接触角を測定した。なお、測定値は10点の平均値である。
【0039】
−組成評価−
得られた、プラズマ照射炭素質膜の組成は、X線光電子分光分析(XPS)法を用いて評価した。測定には、日本電子株式会社製の光電子分光装置JPS−9010MCを用いた。X線源にはAlを用い、加速電圧が12.5kVで、エミッション電流が17.5mAの条件でX線を発生させた。試料中から任意に選択した直径5mmのエリアについて測定を行った。また、X線を試料に対して垂直に入射させ、検出角度を0度とすることにより、5nm程度の深さまでの組成を測定している。
【0040】
結合エネルギーの測定領域は、274eV〜294eV、389eV〜409eV及び522eV〜542eVとし、それぞれC1s、N1s及びO1sのピークを得た。得られたピークの面積比を比較することにより炭素に対する酸素の存在比O/C及び炭素に対する窒素の存在比N/Cを求めた。また、C1sピークは、カーブフィッティングによりC−C成分、C−O成分、C=O成分及びO=C−O成分に分割した。O=C−O成分のC1sピークに対する面積比を求めることによりカルボキシル基成分(O=C−O)の全炭素に対する存在比O=C−O/Cを求めた。
【0041】
−血小板に対する適合性評価−
血小板に対する適合性は、血小板を材料表面に所定時間接触させ、試料表面に粘着した血小板数の大小により適合性の良否を判定した。
【0042】
血小板の試料への粘着数は、以下のようにして測定した。まず、6mm×6mmに調整した試料の表面に血小板浮遊血漿130μlを置く。続いて、プラスチックシャーレで蓋をした常態で、37℃にて60分間インキュベートした。インキュベート終了後、試料をpH7.4のリン酸バッファー(PBS)にて3回洗浄した。次いで1%グルタルアルデヒド/PBSに試料を浸漬し、4℃にて60分間静置することにより、粘着した血小板を固定した。続いてこの試料をPBS、PBS/蒸留水(75/25)、PBS/蒸留水(50/50)、PBS/蒸留水(25/75)及び蒸留水を順に用いて3回ずつ洗浄した。洗浄済みの試料を凍結乾燥した後、試料に対し白金蒸着を行った。白金蒸着を行った試料の表面を走査型電子鏡(日本電子、SEM−840)を用い拡大率1000倍にてランダムに5視野について写真撮影し、5視野の粘着血小板数を合計し、単位面積あたりの血小板数を求めた。
【0043】
血小板浮遊血漿は、以下のようにして調整した。健常者から採取した全血を、クエン酸加血(全血/3.8%クエン酸ナトリウム溶液=95/5vol/vol)とし、これを室温にて1500rpmで10分間遠心し、上澄から血小板多血漿(PRP)を1ml採取した。残りの血液をさらに3000rpmで10分間遠心し、上澄から血小板貧血漿(PPR)を1mlを採取した。次いで血球カウンター(シスメックス社、Sysmex K-1000)にてPRP及びPPP中の血小板数を計測した。PRPをPPPにより希釈することにより血小板数が10万個/μlの血小板浮遊血漿を調製した。
【0044】
−血液凝固因子に対する適合性評価−
血液凝固因子に対する適合性は、トロンビン・アンチトロンビンIII複合体(TAT)の生成量を定量することにより行った。
【0045】
血液凝固因子(凝固系)が活性化することにより産生され、血液凝固反応を主に司る酵素となるトロンビンはアンチトロンビンIIIによって速やかにトロンビン・アンチトロンビンIII複合体(TAT)となって失活する。そのため、産生トロンビン量を直接定量することは困難なことが知られており、TATの血中濃度を求めることで、産生トロンビン量を見積もることが一般的に行われている。従って、凝固系に対する適合性は、試料と全血とを所定時間接触させた際のTATの産生量から判断した。
【0046】
アクリル製のC形スペーサ(内径:40mm、外径:46mm、厚さ:0.8mm)の片面にpoly(2-methoxyethyl acrylate)をコートしたポリエチレンテレフタレート(PET)製のシート(φ=46mm)を両面接着テープにより接着する。C型スペーサのもう一方の面には、直径46mmの試料を両面接着テープにより貼り付け、容積1000μlの試料チャンバを作製する。
【0047】
健常人より採血したヘパリン化全血(2IU/ml)を試料チャンバに1000μl注入し、セロファンテープにて封をした。血球沈降を防ぐため、このチャンバーを垂直回転ローターに取り付けて回転(約4.7rpm)させながら37℃で120分間インキュベートした。インキュベート終了後、チャンバーから全血を回収し3.8%クエン酸Na水溶液110μlを加え、10℃、3000rpm、10分の条件で遠心分離した。
【0048】
上澄みとして得られた血漿中のTAT濃度を市販のTAT用酵素免疫定量法キット(Enzyme Research Laboratories社製TAT−EIA)とマイクロプレートリーダー(Molecular Device社製、Thermo Max)とを用いて定量した。ELISAの操作はキット付属のマニュアルに従って実施した(測定波長450nm)。なお、C型スペーサの両面にpoly(2-methoxyethyl acrylate)をコートしたPETフィルムを接着した場合をコントロールとした。
【0049】
−表面電位の評価−
得られた、プラズマ照射炭素質膜について、以下のようにして表面電位を測定した。測定には、大塚電子株式会社製のゼータ電位・粒径測定システムELS−Zを用いた。得られたプラズマ照射炭素質膜を平板試料用セルに密着させ、セル内にモニタ用粒子を注入した。モニタ用粒子は10mMの塩化ナトリウム(NaCl)溶液中に分散させた大塚電子株式会社製のものを用いた。セル深さ方向の各レベルについてモニタ粒子の電気泳動を行い、セル内部の見かけの速度分布を測定した。電気泳動は、平均電場が17.33V/cmで、平均電流が1.02mAの条件で行った。得られた見かけの速度分布を森・岡本の式に基づいて解析することにより、プラズマ照射炭素質膜表面の表面電位を求めた。なお、平板試料用セルは、セル表面の電荷の影響を抑えるため、ポリアクリルアミドによりコーティング処理して用いた。
【0050】
−炭素質膜の評価結果−
まず、プラズマ照射後の炭素質膜について水に対する接触角を測定し、どの程度親水性となっているかを評価した。図2は、得られたプラズマ照射炭素質膜の水に対する接触角の値の経時変化を示している。図2に示すように大部分のサンプルにおいては、接触角の値は経時的に変化し、プラズマを照射した後、接触角の値が安定するまでに10日程度かかることが明らかになった。
【0051】
このように、接触角が経時的に変化する理由は明確ではない。しかし、プラズマを照射した後、大気中に暴露されたサンプルの表面において、さらに何らかの反応が進行するためであると考えられる。プラズマ照射を行った炭素質膜を医療器具等に用いる場合、プラズマ照射直後に使用されることはない。従って、プラズマ照射を行った炭素質膜を評価する場合には、安定状態となった後のサンプルについて評価することが非常に重要である。以後の評価は、接触角の値が安定するプラズマ照射後10日以上経過したサンプルを用いて行った。
【0052】
図3は、プラズマ照射後の炭素質膜のゼータ電位と、血液適合性との関係を示している。図3に示すように、血小板の粘着数はゼータ電位が低い場合に低く、ゼータ電位が高くなるに従い徐々に上昇した。しかし、ゼータ電位が+2mV程度の場合においても、血小板の粘着数は20×104μm2程度であり、ポリエチレンテレフタレート(PET)及びステンレス(SUS316)と同程度の適合性を示した。一方、TATの生成量はゼータ電位が低い場合には非常に高く、ゼータ電位が高くなると急激に低下した。
【0053】
以上の結果は、血小板だけでなく血液凝固因子に対しても適合性を示すためには、ゼータ電位がある程度以上高いことが必要であり、−8mV以上であることが好ましいことを示している。また、ゼータ電位が高くなると血小板に対する適合性が徐々に悪化するが、他の材料に比べて十分に高い適合性を示し、少なくとも+2mV程度であれば問題ない。
【0054】
ゼータ電位が高く、TATの生成量が低いサンプルは、O2プラズマ照射後にNH3プラズマを照射した場合(O2+NH3:約−8mV)及びNH3プラズマを照射した場合(約+2mV)である。このことから、ゼータ電位の上昇は、炭素質膜の表面にイオン化した際に正に帯電する官能基が導入されたことによるのではないかと考えられる。
【0055】
プラズマ照射後の炭素質膜に導入された窒素がどのような状態となっているかは明確ではない。しかし、アミノ基、アミド基及びアミン基等の窒素を含む官能基(窒素性官能基)を形成していると考えられる。窒素性官能基の詳細な分析は困難であるが、XPS測定においてN1sピークは、398.9eVに出現した。これは、アミン及びアミドのN1sの束縛エネルギー(400±1eV)からずれており、今回のサンプルにおいては、窒素性官能基のうちの少なくとも一部はアミノ基となっていると考えられる。
【0056】
図4は、プラズマ照射後の炭素質膜の表面に形成された官能基とゼータ電位との関係を示している。図4において、横軸は炭素に対する窒素の存在比N/Cと、炭素に対するO=C−O成分の存在比O=C−O/Cとの比を示している。先に述べたように、炭素質膜中の窒素は、窒素性官能基となっていると推測される。従って、N/O=C−Oは、窒素性官能基とカルボキシル基との比率を表している。窒素性官能基の存在比率が高くなると、ゼータ電位の値が高くなっていことが明らかである。
【0057】
このように、炭素質膜の表面におけるゼータ電位の値は、窒素性官能基とカルボキシル基との比率によって決まる。従って、血小板及び血液凝固因子の両方に対して適合性を示すためには、窒素性官能基とカルボキシル基との比率が2.5以上であることが好ましい。窒素性官能基の導入量は多い方が好ましいと考えられるが、あまりに高くなるとゼータ電位が上昇し、血小板に対する適合性が悪化するおそれがある。また、炭素質膜の表面に導入できる窒素性官能基の理論的な上限も考慮すると、窒素性官能基とカルボキシル基の比率は、4程度が上限になると考えられる。
【0058】
ゼータ電位が高いO2+NH3又はNH3を照射した場合には、プラズマ照射後10日以上経過した際の接触角が60°以上であった。一方、ゼータ電位が低い他のサンプルについては、いずれも接触角が50°以下であった。このことから、ゼータ電位が高い炭素質膜は、親水性のカルボキシル基が過度に導入されていないと考えられる。
【0059】
このように、炭素質膜の表面には、ゼータ電位を低下させるカルボキシル基が過度に導入されていないことが好ましく、接触角が60°以上であることが好ましい。一方、プラズマ照射していない炭素質膜は接触角が80°程度ある。プラズマ照射していない炭素質膜は、血小板の粘着数が55×104μm2程度あり、プラズマ照射した炭素質膜よりも遙かに血小板に対する適合性に劣る。従って、炭素質膜の接触角はあまり高すぎない方がよく、70°以下であることが好ましい。
【0060】
以上のような、カルボキシル基と窒素性官能基との両方が形成され、ゼータ電位の値が高い炭素質膜は、アンモニアのプラズマを照射することにより形成すればよい。また、他のプラズマを照射した後に、アンモニアのプラズマを照射してもよい。プラズマ照射時におけるチャンバ内の到達真空度が高い方が、空気中の酸素の影響を受けることがなく好ましい。
【0061】
なお、アンモニアに代えて他の塩基性窒素含有化合物を用いることも可能である。塩基性窒素含有化合物としては、一般式がNR1R2R3により示される有機アミン類(但し、R1、R2及びR3は水素、−CH3、−C2H5、−C3H7又は−C4H8であり、R1、R2及びR3は互いに同一であっても、異なっていてもよい。)又はベンジルアミン及びその2級、3級アミン等が挙げられる。但し、アンモニアがコスト、取り扱いの容易さから好ましい。
【産業上の利用可能性】
【0062】
本発明に係る抗血栓性材料は、血小板の粘着及び血液凝固因子の活性化の両方を低減でき、特に血液と直接接触する医療器具等に用いる抗血栓性材料等として有用である。
【図面の簡単な説明】
【0063】
【図1】本発明の一実施例において用いたプラズマ照射装置を示す概略図である。
【図2】本発明の一実施例に係る炭素質膜の接触角の変動を示すグラフである。
【図3】本発明の一実施例に係る炭素質膜のゼータ電位と血液適合性との関係を示すグラフである。
【図4】本発明の一実施例に係る炭素質膜に形成された官能基とゼータ電位との関係を示すグラフである。
【符号の説明】
【0064】
10 チャンバ
11 基材
12A 平行平板電極
13 マスフローコントローラ
14 マッチングボックス
15 高周波電源
【特許請求の範囲】
【請求項1】
基材の表面に形成された炭素質膜からなる抗血栓性材料であって、
炭素が互いに結合して形成された膜本体と、
前記膜本体に導入された窒素性官能基及びカルボキシル基とを備え、
前記膜本体の表面におけるゼータ電位が−8mV以上であることをことを特徴とする抗血栓性材料。
【請求項2】
前記窒素性官能基とカルボキシル基との比率は、2.5以上且つ4以下であることを特徴とする請求項1に記載の抗血栓性材料。
【請求項3】
前記膜本体の表面における接触角は、60度以上且つ70度以下であることを特徴とする請求項1又は2に記載の抗血栓性材料。
【請求項1】
基材の表面に形成された炭素質膜からなる抗血栓性材料であって、
炭素が互いに結合して形成された膜本体と、
前記膜本体に導入された窒素性官能基及びカルボキシル基とを備え、
前記膜本体の表面におけるゼータ電位が−8mV以上であることをことを特徴とする抗血栓性材料。
【請求項2】
前記窒素性官能基とカルボキシル基との比率は、2.5以上且つ4以下であることを特徴とする請求項1に記載の抗血栓性材料。
【請求項3】
前記膜本体の表面における接触角は、60度以上且つ70度以下であることを特徴とする請求項1又は2に記載の抗血栓性材料。
【図2】


【図3】


【図4】


【図1】




【図3】


【図4】


【図1】


【公開番号】特開2009−279268(P2009−279268A)
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願番号】特願2008−135935(P2008−135935)
【出願日】平成20年5月23日(2008.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年1月23日発行の第25回「プラズマセンシング研究会」プロシーディングス及び平成20年5月8日発行の第57回高分子学会予稿集にて発表
【出願人】(000125369)学校法人東海大学 (352)
【出願人】(391003668)トーヨーエイテック株式会社 (145)
【Fターム(参考)】
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願日】平成20年5月23日(2008.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年1月23日発行の第25回「プラズマセンシング研究会」プロシーディングス及び平成20年5月8日発行の第57回高分子学会予稿集にて発表
【出願人】(000125369)学校法人東海大学 (352)
【出願人】(391003668)トーヨーエイテック株式会社 (145)
【Fターム(参考)】
[ Back to top ]

