抗酸化剤
【課題】 安価に製造可能で、優れた抗酸化能を示すペプチドを有効成分とする抗酸化剤を提供する。
【解決手段】 魚肉をプロテアーゼで加水分解処理して得られた、H−Ile−Trp−His−His−Thr−OH、又はH−Leu−Lys−Tyr−Pro−OHで表される、少なくともいずれかのペプチドを有効成分とする抗酸化剤とする。また、魚肉として、少なくともマグロ血合肉又はカツオ血合肉のいずれかを用い、プロテアーゼとして、バチルス属由来のプロテアーゼを用いる。
【解決手段】 魚肉をプロテアーゼで加水分解処理して得られた、H−Ile−Trp−His−His−Thr−OH、又はH−Leu−Lys−Tyr−Pro−OHで表される、少なくともいずれかのペプチドを有効成分とする抗酸化剤とする。また、魚肉として、少なくともマグロ血合肉又はカツオ血合肉のいずれかを用い、プロテアーゼとして、バチルス属由来のプロテアーゼを用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、魚肉をプロテアーゼで加水分解して得られたペプチドを有効成分とする抗酸化剤に関し、特に下記式(1)又は(2)で表されるペプチドの少なくともいずれかを含む抗酸化剤に関する。

【背景技術】
【0002】
従来から活性酸素は、糖尿病や動脈硬化といった生活習慣病やがんなど様々な病気の原因になることが知られている。また、活性酸素は皮膚のしわや白内障、認知症などの老化現象の原因になるとも言われている。
このため、健康に長生きするためには、活性酸素の影響から身を守ることが重要であり、近年、活性酸素や抗酸化物質についての研究が盛んに行われている。
【0003】
活性酸素とは、非常に不安定で強い酸化力をもつ物質であり、狭義にはヒドロキシラジカル(・OH)、一重項酸素(1O2)、スーパーオキシドアニオンラジカル(・O2−)、過酸化水素等(H2O2)を指し、広義にはこれらにオゾンや一酸化窒素、二酸化窒素、過酸化脂質等が含まれる。
このうち、ヒドロキシラジカルは、最も反応性の強い活性酸素であり、スーパーオキシドアニオンラジカル、過酸化水素から生成する。また、一重項酸素も酸化力の強い活性酸素であり、共に人体で作られる酵素により無害化することはできない。
【0004】
抗酸化物質とは、このような活性酸素を無害化する物質であり、スカベンジャーとも呼ばれている。
スカベンジャーの代表例としては、SOD(スーパーオキシドディスムターゼ)、カタラーゼ、グルタチオンがあり、それぞれスーパーオキシドアニオンラジカル、過酸化水素、ヒドロキシラジカルを消去する活性を有する。また、ビタミンC、ビタミンE等の各種ビタミン類、βカロテンなどのカロテノイド類、ポリフェノールなどにも活性酸素除去効果があり、これらを含む様々なドリンク剤やサプリメント等が開発されている。
【0005】
このように、人体に悪影響をもたらす活性酸素を除去して生活習慣病等に罹ることを防止するとともに、老化防止にも役立つと言われる抗酸化物質は、高齢化社会をむかえた現代において極めて有用である。
このため、高い機能性を有し、安価に提供可能な優れた抗酸化物質の提供が強く求められている。
【0006】
ここで、このような抗酸化物質に関する先行技術としては、例えば特許文献1に記載の抗酸化組成物を挙げることができる。
この先行技術によれば、卵黄タンパク質を加水分解することで、優れた抗酸化効果を有する組成物を得ることができるとされている。
【0007】
また、特許文献2に記載の抗酸化組成物によれば、L−プロリン及びカテキン類を使用することで、安全性と抗酸化力に優れた組成物を提供できるとされている。
さらに、特許文献3に記載の発酵豆科植物由来の抗酸化組成物によれば、発酵させた豆科植物から抗酸化組成物を抽出する際に、乳化剤を用いることで、従来の抗酸化組成物より抗酸化性を著しく向上できるとされている。
【0008】
【特許文献1】特開2001−328919号公報
【特許文献2】特開2004−331724号公報
【特許文献3】特開2006−70146号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかしながら、特許文献1に記載の抗酸化組成物は、過酸化脂質の発生を防止し、肌の保護、保湿効果に優れた使用感のよい化粧料に特化したものとなっている。このため、加工食品などに加えてその酸化を防止することに適切なものとは言えない。
また、特許文献2に記載の抗酸化組成物は、複数の異なる原料から有効成分を抽出し、これらを所定の割合に混合して得られるものであり、製造コストを低減することについては考慮されていない。このため、抗酸化物質を安価に提供することが難しいという問題がある。
【0010】
さらに、特許文献3に記載の抗酸化組成物は、発酵させた大豆胚芽などから製造するものであるが、特許文献2に記載の抗酸化組成物と同様に、製造コストを低減することについては考慮されていない。
このため、加工食品などの酸化を防止することの可能な、優れた抗酸化能を有する物質を、より安価に提供可能な技術の開発が求められていた。
【0011】
そこで、本発明者らは鋭意研究した結果、魚肉の缶詰などを製造する際に生じる、通常は飼料や肥料に加工される加工残渣に着目し、マグロやカツオの血合肉において抗酸化物質を探索して、優れた抗酸化能を示すペプチドを特定することに成功し、本発明を完成させた。
【0012】
本発明は、上記の事情にかんがみなされたものであり、魚肉をプロテアーゼで加水分解処理することにより得られる、下記式(1)又は(2)で表されるペプチドの少なくともいずれかを有効成分とする抗酸化剤の提供を目的とする。

【課題を解決するための手段】
【0013】
上記目的を達成するため、本発明の抗酸化剤は、魚肉をプロテアーゼで加水分解処理して得られたH−Ile−Trp−His−His−Thr−OH(以下、IWHHTと称する場合がある。)で表されるペプチドを有効成分とする。
また、本発明の抗酸化剤は、魚肉をプロテアーゼで加水分解処理して得られたH−Leu−Lys−Tyr−Pro−OH(以下、LKYPと称する場合がある。)で表されるペプチドを有効成分とする。
【0014】
後述するように、IWHHT及びLKYPは、いずれも優れた抗酸化能を有するため、それぞれのペプチドを有効成分として含む物質は、抗酸化剤として好適に使用することが可能である。
特に、これらは魚肉のタンパク質を分解して得られるものであり、これらのペプチドを含む組成物は、例えば加工食品に添加する酸化防止剤や、抗酸化サプリメントなどの抗酸化剤として好適に利用することが可能である。
【0015】
また、原料の魚肉としては、少なくともマグロ血合肉又はカツオ血合肉のいずれかを用いることが好ましい。
すなわち、IWHHTは、普通肉には劣るものの通常は飼料や肥料に加工される血合肉を原料としても遜色のない収率を得ることができるため、これらを用いることによって、製造コストを低減することが可能である。
また、LKYPは、普通肉からはあまり得ることができず、血合肉が原料として適している。
【0016】
また、プロテアーゼとしては、バチルス属由来のプロテアーゼを用いることが好ましい。
例えば、バチルス属由来のサモアーゼやアロアーゼを用いることで、IWHHT又はLKYPを有効成分として含む抗酸化剤を適切に製造することが可能である。
【発明の効果】
【0017】
本発明によれば、優れた抗酸化能を有する下記式(1)又は(2)で表されるペプチドの少なくともいずれかを有効成分とする抗酸化剤を提供することが可能となる。

【0018】
また、(1)のペプチドは、マグロやカツオの加工残渣である血合肉を原料としても、普通肉を原料とした場合と遜色なく生成させることができる。また(2)のペプチドは、血合肉を原料とした場合にはじめて十分に生成させることができる。
このため、これらのペプチドを含む抗酸化剤は、マグロやカツオの血合肉を原料に用いることで、安価に製造することが可能である。
【発明を実施するための最良の形態】
【0019】
以下、本発明の実施形態について具体的に説明する。
<1.原料魚肉>
本発明におけるペプチド(IWHHT、LKYP)の原料としては、主にクロマグロ、ミナミマグロ、ビンナガ、キハダ、メバチ、カツオ等を用いることが好ましい。
また、特に、これらの魚肉のうち、食品加工において、非食部として飼料や肥料に加工されている血合肉を用いることがより好ましい。
【0020】
すなわち、IWHHTは、普通肉よりは劣るものの血合肉から十分に生成できるものであるため、血合肉を用いることでIWHHTを有効成分として含む抗酸化剤の製造コストを低減させることが可能となる。
また、LKYPは、普通肉よりも血合肉から十分に生成できるものであるため、原料として血合肉を用いることが好ましい。
【0021】
<2.プロテアーゼ(蛋白質分解酵素)>
本発明で使用するプロテアーゼとしては、特に限定されるものではなく、例えば、バチルス属の微生物由来である「サモアーゼ(大和化成株式会社)」、「アロアーゼAP−10(ヤクルト薬品工業株式会社)」、「オリエンターゼ90N(エイチビイアイ株式会社)」、「プロテアーゼN(天野エンザイム株式会社)」等の市販されているものが使用でき、目的とするペプチドの生成効率が良いという観点において、「サモアーゼ(大和化成株式会社)」がより好ましく用いられる。
これらのプロテアーゼを用いてタンパク質を加水分解することにより、本発明における上記各ペプチドを生成することができ、これを単離することが可能となる。
【0022】
<3.抗酸化剤の製造方法>
(1)ペプチド(IWHHT、LKYP)を単離する場合
まず、IWHHT、又はLKYPのいずれか一方のペプチドからなる純粋な組成物を含む抗酸化剤を製造する方法について説明する。
【0023】
(A)血合肉の酵素処理工程
血合肉のpHを調整した後、プロテアーゼを添加して、血合肉におけるタンパク質の加水分解を行う。
酵素処理時のpH、温度の範囲としては、使用する酵素の至適条件に応じて適宜決定すればよいが、例えば「サモアーゼ(大和化成株式会社)」を用いる場合、pH6.0〜9.0、温度60〜80℃とすることが好ましく、特にpH6.5、温度70℃とすることが好ましい。
【0024】
(B)酵素失活工程
次に、得られた加水分解処理物を加熱して、プロテアーゼを失活させる。
(C)固液分離工程
プロテアーゼを失活させた後、濾過により固液分離を行い、濾液を得る。
【0025】
(D)エタノール沈殿処理工程
次に、濾液にエタノールを添加してタンパク質を沈殿させ、遠心分離機もしくは濾過により沈殿を除去し、濃縮乾固する。
このときのエタノール濃度は20〜99%(v/v)とすることが好ましく、特に70%(v/v)とすることが好ましい。
【0026】
(E)強酸性陽イオン交換樹脂処理工程
次に、濃縮乾固して得られたサンプルをリン酸緩衝液に溶解させて陽イオン交換樹脂にアプライし、ペプチド(IWHHT、LKYP等)を吸着させる。そして、塩基性水溶液を用いて塩基性画分を溶出させ、得られた画分を濃縮乾固する。
溶出液は特に限定されるものではないが、例えば、0.01〜10%(v/v)のアンモニア水溶液を用いることが好ましく、5%(v/v)のアンモニア水溶液を用いることがより好ましい。
【0027】
(F)固相抽出処理工程
次に、得られたサンプルを水に溶解させて、ODSカートリッジにアプライし、有機溶媒で溶出して濃縮乾固する。
溶出液は特に限定されるものではないが、例えば、10〜99%(v/v)のメタノール水溶液を用いることが好ましく、50%(v/v)のメタノール水溶液を用いることがより好ましい。
【0028】
(G)逆相クロマトグラフィー処理工程
次に、得られたサンプルを逆相系の高速液体クロマトグラフィーに供し、本発明のペプチド(IWHHT、LKYP)を含む画分をそれぞれ単離する。
その条件としては、使用する充填剤、カラムサイズにより異なるため、特に限定されるものではないが、逆相系カラムにサンプルをインジェクションした後、アセトニトリルやメタノールなどの有機溶媒を用いて溶出させる。
【0029】
例えば、次の条件において、高速液体クロマトグラフィーに供することができる。
カラム 日本ウォーターズ(株)Sun Fire C18 4.6×150mm
検出 220nm
流速 1ml/min
溶出 0.1%トリフルオロ酢酸水溶液(TFAaq):アセトニトリル(ACCN)=90:10→80:20(15min)
この場合、4.8分前後にIWHHTを含む画分、8.5分前後にLKYPを含む画分を得ることができる。
【0030】
このようにして単離したペプチド(IWHHT、LKYP)は、いずれも優れた抗酸化能を有し、例えば加工食品に添加する酸化防止剤や、抗酸化サプリメントなどの抗酸化剤として好適に利用することが可能である。
【0031】
(2)工業的量産方法(IWHHT、LKYPを含む組成物の製造方法)
次に、IWHHT、LKYPを含む組成物の工業的量産方法について説明する。
まず、(A)血合肉の酵素処理工程、及び(B)酵素失活工程については、上述したペプチドの単離の場合と同様の工程により行うことができる。
【0032】
(C)活性炭処理工程
次に、酵素を失活させた処理物に、活性炭を添加し、タンパク質を除去するとともに、脱色、脱臭を行う。
このとき、タンパク質の除去、脱色及び脱臭を効果的に行う観点から、添加する活性炭としては、例えば賦活精製された活性炭、例えばフタムラ化学株式会社製 太閤活性炭A等を用いることが好ましい。
【0033】
また、同様の観点から、このような活性炭を、酵素処理液に含まれる固形量の0.1〜30%の比率で添加することが好ましい。
さらに、以上の効果を十分に得るために、活性炭処理工程は、10〜100℃で1時間以上行うことが好ましい。
その後、濾過等により活性炭を除去することにより、処理物を得ることができる。処理物は必要に応じて、適宜、濃縮・希釈等により濃度調整しても良い。
【0034】
(D)噴霧乾燥処理工程
次に、活性炭処理工程により得られた処理物を噴霧乾燥して、IWHHT及びLKYPを含む組成物を得る。このようにして得られた本発明のペプチドを含む組成物は優れた抗酸化能を有し、例えば加工食品に添加する酸化防止剤や、抗酸化サプリメントなどの抗酸化剤として好適に利用することが可能である。
(E)製品化工程
最後に、得られた組成物を有効成分として含む抗酸化剤を製造する。この抗酸化剤は、例えば缶詰、菓子、飲料など、一般的な加工食品への酸化抑止剤として好適に用いることが可能である。
また、一般的に、生体内物質の酸化が原因とされる疾病、例えば癌、糖尿病、動脈硬化、神経疾患等に対する予防効果を期待したサプリメントの形態に加工することも好ましい。
【実施例】
【0035】
(実施例1)
<IWHHT、LKYPを含む供試サンプルの作成>
(1)キハダマグロ血合肉約60gに水90mlを加え、pH6.5に調整した後、サモアーゼ(サモアーゼPC10;大和化成株式会社)を0.6g添加し、70℃にて16時間加水分解処理を行った。
(2)次に、加水分解処理物を、100℃にて10分間加熱し、サモアーゼを失活させた。
【0036】
(3)サモアーゼ失活後、得られた処理物を濾過に供し、濾液に70%になるようにエタノールを添加してタンパク質を沈澱させ、遠心分離機(EX−126;株式会社トミー精工社製)にて沈澱を除去した後、濃縮乾固した。
このとき、遠心分離は、3000G、10分間の条件で行った。また、濃縮乾固は、エバポレーターにより行った。
【0037】
(4)次に、陽イオン交換樹脂(UBK503;三菱化学株式会社製)8.0gを30分間水洗し、100mlの0.5MHClにて30分間攪拌した。また、pHが6になるまで水洗を繰り返し、100mlの0.5MNaOHにて30分間攪拌した。さらに、pHが6になるまで水洗を繰り返し、樹脂をカラムに充填した。そして、0.5MHClを100ml通液した後、pHが6になるまで水を通液した。更にこのカラムにリン酸緩衝液(pH5.0)を100ml通液し、平衡化を行った。
【0038】
(5)次に、リン酸緩衝液10mlに上記濃縮乾固したサンプルを溶解させた。
そして、このリン酸緩衝液をカラムにアプライし、IWHHT、LKYPを含む各種ペプチドを樹脂に吸着させた。
さらに、カラムに水100mlを通液して樹脂を洗浄した後、5%NH3AQ100mlにて塩基性画分を溶出させ、得られた画分を濃縮乾固した。
【0039】
(6)次に、予めODSカートリッジ(Vac3cc;Waters社製)に、100%メタノール5mlを通液させ、さらに水5mlを通液させた。また、上記陽イオン交換により得られた濃縮乾固したサンプルを水に溶解させた。そして、この溶液を、ODSカートリッジにアプライした。
(7)次に、ODSカートリッジを10%メタノール水溶液5mlで洗浄した後、50%メタノール水溶液(v/v)5mlで溶出を行った。そして、得られた溶出液を濃縮乾固したものを、供試サンプルとした。
【0040】
<供試サンプルからのIWHHT、LKYPの精製>
(1)上記のようにして得られた供試サンプルを、下記の分析条件にて逆相クロマトグラフィーに供し、分画を行った。その結果を図1に示す。

【0041】
図1において、第4,14,15番目のピークをそれぞれ、ピークA,B,Cとしている。以下、ピークA及びピークCの画分を用いて精製を行った。
すなわち、ピークA及びピークCの画分を、以下の条件でさらに2回逆相クロマトグラフィーに供して、当該ピークにおけるペプチドを分離した。図2は、ピークAの3回目の逆相クロマトグラフィー分析結果を示す図であり、図3は、ピークCの3回目の逆相クロマトグラフィー分析結果を示す図である。
【0042】

【0043】

【0044】
(実施例2)
<分離精製したペプチドのアミノ酸配列解析>
(1)塩酸加水分解によるアミノ酸組成分析
実施例1によりピークA、ピークCの画分からそれぞれ得られた精製ペプチドを塩酸で加水分解し、各ペプチドに含まれるアミノ酸成分の割合を分析した。図4は、ピークAのアミノ酸組成分析結果を示す図であり、図5は、ピークCのアミノ酸組成分析結果を示す図である。
【0045】
図4に示される通り、ピークAのペプチドのアミノ酸組成比はThr:Ile:His=1:1:2であった。
また、図5に示される通り、ピークCのペプチドのアミノ酸組成比はLeu:Lys:Pro=1:1:1であった。
【0046】
(2)マススペクトルの計測
次に、ピークAのペプチド、及びピークCのペプチドについて、それぞれのマススペクトルを測定した。図6は、ピークAのマススペクトル分析結果を示す図であり、図7は、ピークCのマススペクトル分析結果を示す図である。
図6に示される通り、ピークAの〔M+H〕+は693であった。また、図7に示される通り、ピークCの〔M+H〕+は520であった。
【0047】
(3)N末端から5サイクルまでのアミノ酸配列解析
次に、ピークAのペプチドを試料として、プロテインシークエンサーにより、N末端から5サイクルまでのアミノ酸配列を解析した。その結果を図8〜図12に示す。これらの図は、それぞれ1サイクル目〜5サイクル目までのピークAのアミノ酸配列解析結果を示している。
これにより、ピークAにおけるペプチドは、Ile−Trp−His−His−Thr(IWHHT)のアミノ酸配列を有することが明らかになった。
【0048】
このアミノ酸配列からなるペプチドの分子量Mは692であり、これにプロトンが付加した〔M+H〕+は693である。これは、上記ピークAのマススペクトル分析結果と整合性のとれるものである。
以上のことを総合的に考慮すると、ピークAにおけるペプチドは、H−Ile−Trp−His−His−Thr−OHで表されるものであると判断することができる。なお、上述したピークAのアミノ酸組成分析結果にはTrpが含まれていないが、これは加水分解によりTrp自体が分解されたためであると考えられる。
【0049】
次に、ピークCのペプチドを試料として、プロテインシークエンサーにより、N末端から5サイクルまでのアミノ酸配列を解析した。その結果を図13に示す。
同図に示される通り、ピークCにおけるペプチドのアミノ酸配列は、Leu−Lys−Tyr−Pro(LKYP)であった。
このアミノ酸配列からなるペプチドの分子量Mは519であり、これにプロトンが付加した〔M+H〕+は520である。これは、上記ピークCのマススペクトル分析結果と整合性のとれるものである。
【0050】
以上のことを総合的に考慮すると、ピークCにおけるペプチドは、H−Leu−Lys−Tyr−Pro−OHで表されるものであると判断することができる。なお、上述したピークCのアミノ酸組成分析結果にはTyrが含まれていないが、これは塩酸で加水分解する際にフェノール含有の塩酸を用いなかったため、Tyrがハロゲン化されてクロロチロシンとなり検出できなかったものと考えられる。
【0051】
(実施例3)
<由来原料ごとのペプチドの収率分析>
次に、本発明におけるペプチド(IWHHT、LKYP)について、由来原料ごとの収率の違いを比較した。
原料としては、キハダ血合肉、カツオ血合肉、ビンナガ血合肉、キハダ普通肉(赤身肉)を用いた。また、ペプチドの抽出、精製は、実施例1に示す方法と同様の方法で行った。その結果を図14に示す。
【0052】
図14に示される通り、キハダ血合肉、カツオ血合肉、ビンナガ血合肉のIWHHT収率は、キハダ普通肉よりは劣るものの、従来は魚肉を加工する際の副産物として処分されてきた血合肉から、抗酸化剤を製造するために十分な量のIWHHTを得ることができている。
これにより、本発明の抗酸化剤の原料として、血合肉を好適に使用できることが確認された。
また、LKYPについては、キハダ普通肉からは得ることができず、各種血合肉が原料として適していることが確認された。
【0053】
(試験例1)
<ヒドロキシラジカル(・OH)消去能の分析>
本発明の抗酸化剤におけるIWHHT、LKYPの抗酸化能を確認するため、以下のように、ヒドロキシラジカル(・OH)消去活性について試験を行った。
【0054】
(1)試験管に92mM5,5ジメチル−1−ピロリン−N−オキサイド(DMPO)20μl、0.1mMジエチレントリアミンペンタ酢酸(DETAPAC)水溶液25μl、0.2mM硫酸鉄(II)水溶液50μl、及び0.1mMリン酸緩衝液(pH7.4)を混合し、この溶液に0.5%(w/w)のペプチド水溶液30μlを添加した。また、この溶液に水30μlを添加したものを対照とした。
【0055】
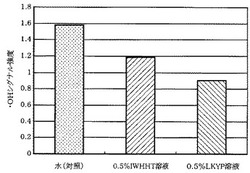
(2)次いで、それぞれの溶液ごとに1mM過酸化水素水50μlを加えて混合し、ESR測定用特殊偏平セルに吸い取り、ESR装置(JES−FR30;日本電子株式会社製)にセットした。
そして、過酸化水素水50μlを加えてから正確に40秒後にシグナルの測定を行った。シグナル強度は、Mn2+のシグナルを対照とした相対値とした。その結果を図15に示す。
(3)同図に示される通り、IWHHT及びLKYPは、ヒドロキシラジカル消去能を有していることが確認された。
【0056】
(試験例2)
<一重項酸素(1O2)消去能の分析>
本発明の抗酸化剤におけるIWHHT、LKYPの抗酸化能を確認するため、以下のように、一重項酸素(1O2)消去活性について試験を行った。なお、以下の試験において、試薬の希釈及び調製は、リン酸緩衝生理食塩水(PBS)を用いて行った。
【0057】
(1)IWHHT、LKYPのそれぞれについて、試験管に50mMリボフラビン溶液150μl、及び0.2M2,2,6,6−テトラメチル−4−ピペリドン塩酸塩(TMPD)50μlを混合し、この溶液に0.025%(w/w)のペプチド溶液300μlを添加、混合した。また、この溶液にPBS300μlを添加、混合したものを対照とした。
【0058】
(2)次いで、各溶液をESR測定用特殊偏平セルに吸い取り、紫外線照射灯(MODEL UVG−11;ULTRA−VIOLET PRODUCT社)を用いて254nmの紫外線を1cmの距離から7分間照射した後、ESR装置(JES−FR30;日本電子株式会社製)にセットして、シグナルの測定を行った。シグナル強度は、Mn2+のシグナルを対照とした相対値とした。その結果を図16に示す。
(3)同図に示される通り、IWHHT及びLKYPは、一重項酸素消去能を有していることが確認された。
【産業上の利用可能性】
【0059】
本発明の抗酸化剤は、一般的な加工食品への酸化抑止剤として好適に用いることが可能である。また、生体内物質の酸化が原因とされる疾病、例えば癌、糖尿病、動脈硬化、神経疾患等に対する予防効果を期待したサプリメントの材料として用いることも可能である。
【図面の簡単な説明】
【0060】
【図1】本発明の実施例1における供試サンプルの逆相クロマトグラフィー分析結果を示す図である。
【図2】本発明の実施例1のピークAの逆相クロマトグラフィー分析結果を示す図である。
【図3】本発明の実施例1のピークCの逆相クロマトグラフィー分析結果を示す図である。
【図4】本発明の実施例2のピークAのアミノ酸組成分析結果を示す図である。
【図5】本発明の実施例2のピークCのアミノ酸組成分析結果を示す図である。
【図6】本発明の実施例2のピークAのマススペクトル分析結果を示す図である。
【図7】本発明の実施例2のピークCのマススペクトル分析結果を示す図である。
【図8】本発明の実施例2のピークAのアミノ酸配列解析結果(1サイクル目)を示す図である。
【図9】本発明の実施例2のピークAのアミノ酸配列解析結果(2サイクル目)を示す図である。
【図10】本発明の実施例2のピークAのアミノ酸配列解析結果(3サイクル目)を示す図である。
【図11】本発明の実施例2のピークAのアミノ酸配列解析結果(4サイクル目)を示す図である。
【図12】本発明の実施例2のピークAのアミノ酸配列解析結果(5サイクル目)を示す図である。
【図13】本発明の実施例2のピークCのアミノ酸配列解析結果を示す図である。
【図14】本発明の実施例3における由来原料ごとのペプチド収量を示す図である。
【図15】本発明の試験例1におけるヒドロキシラジカル消去能の分析結果を示す図である。
【図16】本発明の試験例2における一重項酸素消去能の分析結果を示す図である。
【技術分野】
【0001】
本発明は、魚肉をプロテアーゼで加水分解して得られたペプチドを有効成分とする抗酸化剤に関し、特に下記式(1)又は(2)で表されるペプチドの少なくともいずれかを含む抗酸化剤に関する。

【背景技術】
【0002】
従来から活性酸素は、糖尿病や動脈硬化といった生活習慣病やがんなど様々な病気の原因になることが知られている。また、活性酸素は皮膚のしわや白内障、認知症などの老化現象の原因になるとも言われている。
このため、健康に長生きするためには、活性酸素の影響から身を守ることが重要であり、近年、活性酸素や抗酸化物質についての研究が盛んに行われている。
【0003】
活性酸素とは、非常に不安定で強い酸化力をもつ物質であり、狭義にはヒドロキシラジカル(・OH)、一重項酸素(1O2)、スーパーオキシドアニオンラジカル(・O2−)、過酸化水素等(H2O2)を指し、広義にはこれらにオゾンや一酸化窒素、二酸化窒素、過酸化脂質等が含まれる。
このうち、ヒドロキシラジカルは、最も反応性の強い活性酸素であり、スーパーオキシドアニオンラジカル、過酸化水素から生成する。また、一重項酸素も酸化力の強い活性酸素であり、共に人体で作られる酵素により無害化することはできない。
【0004】
抗酸化物質とは、このような活性酸素を無害化する物質であり、スカベンジャーとも呼ばれている。
スカベンジャーの代表例としては、SOD(スーパーオキシドディスムターゼ)、カタラーゼ、グルタチオンがあり、それぞれスーパーオキシドアニオンラジカル、過酸化水素、ヒドロキシラジカルを消去する活性を有する。また、ビタミンC、ビタミンE等の各種ビタミン類、βカロテンなどのカロテノイド類、ポリフェノールなどにも活性酸素除去効果があり、これらを含む様々なドリンク剤やサプリメント等が開発されている。
【0005】
このように、人体に悪影響をもたらす活性酸素を除去して生活習慣病等に罹ることを防止するとともに、老化防止にも役立つと言われる抗酸化物質は、高齢化社会をむかえた現代において極めて有用である。
このため、高い機能性を有し、安価に提供可能な優れた抗酸化物質の提供が強く求められている。
【0006】
ここで、このような抗酸化物質に関する先行技術としては、例えば特許文献1に記載の抗酸化組成物を挙げることができる。
この先行技術によれば、卵黄タンパク質を加水分解することで、優れた抗酸化効果を有する組成物を得ることができるとされている。
【0007】
また、特許文献2に記載の抗酸化組成物によれば、L−プロリン及びカテキン類を使用することで、安全性と抗酸化力に優れた組成物を提供できるとされている。
さらに、特許文献3に記載の発酵豆科植物由来の抗酸化組成物によれば、発酵させた豆科植物から抗酸化組成物を抽出する際に、乳化剤を用いることで、従来の抗酸化組成物より抗酸化性を著しく向上できるとされている。
【0008】
【特許文献1】特開2001−328919号公報
【特許文献2】特開2004−331724号公報
【特許文献3】特開2006−70146号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかしながら、特許文献1に記載の抗酸化組成物は、過酸化脂質の発生を防止し、肌の保護、保湿効果に優れた使用感のよい化粧料に特化したものとなっている。このため、加工食品などに加えてその酸化を防止することに適切なものとは言えない。
また、特許文献2に記載の抗酸化組成物は、複数の異なる原料から有効成分を抽出し、これらを所定の割合に混合して得られるものであり、製造コストを低減することについては考慮されていない。このため、抗酸化物質を安価に提供することが難しいという問題がある。
【0010】
さらに、特許文献3に記載の抗酸化組成物は、発酵させた大豆胚芽などから製造するものであるが、特許文献2に記載の抗酸化組成物と同様に、製造コストを低減することについては考慮されていない。
このため、加工食品などの酸化を防止することの可能な、優れた抗酸化能を有する物質を、より安価に提供可能な技術の開発が求められていた。
【0011】
そこで、本発明者らは鋭意研究した結果、魚肉の缶詰などを製造する際に生じる、通常は飼料や肥料に加工される加工残渣に着目し、マグロやカツオの血合肉において抗酸化物質を探索して、優れた抗酸化能を示すペプチドを特定することに成功し、本発明を完成させた。
【0012】
本発明は、上記の事情にかんがみなされたものであり、魚肉をプロテアーゼで加水分解処理することにより得られる、下記式(1)又は(2)で表されるペプチドの少なくともいずれかを有効成分とする抗酸化剤の提供を目的とする。

【課題を解決するための手段】
【0013】
上記目的を達成するため、本発明の抗酸化剤は、魚肉をプロテアーゼで加水分解処理して得られたH−Ile−Trp−His−His−Thr−OH(以下、IWHHTと称する場合がある。)で表されるペプチドを有効成分とする。
また、本発明の抗酸化剤は、魚肉をプロテアーゼで加水分解処理して得られたH−Leu−Lys−Tyr−Pro−OH(以下、LKYPと称する場合がある。)で表されるペプチドを有効成分とする。
【0014】
後述するように、IWHHT及びLKYPは、いずれも優れた抗酸化能を有するため、それぞれのペプチドを有効成分として含む物質は、抗酸化剤として好適に使用することが可能である。
特に、これらは魚肉のタンパク質を分解して得られるものであり、これらのペプチドを含む組成物は、例えば加工食品に添加する酸化防止剤や、抗酸化サプリメントなどの抗酸化剤として好適に利用することが可能である。
【0015】
また、原料の魚肉としては、少なくともマグロ血合肉又はカツオ血合肉のいずれかを用いることが好ましい。
すなわち、IWHHTは、普通肉には劣るものの通常は飼料や肥料に加工される血合肉を原料としても遜色のない収率を得ることができるため、これらを用いることによって、製造コストを低減することが可能である。
また、LKYPは、普通肉からはあまり得ることができず、血合肉が原料として適している。
【0016】
また、プロテアーゼとしては、バチルス属由来のプロテアーゼを用いることが好ましい。
例えば、バチルス属由来のサモアーゼやアロアーゼを用いることで、IWHHT又はLKYPを有効成分として含む抗酸化剤を適切に製造することが可能である。
【発明の効果】
【0017】
本発明によれば、優れた抗酸化能を有する下記式(1)又は(2)で表されるペプチドの少なくともいずれかを有効成分とする抗酸化剤を提供することが可能となる。

【0018】
また、(1)のペプチドは、マグロやカツオの加工残渣である血合肉を原料としても、普通肉を原料とした場合と遜色なく生成させることができる。また(2)のペプチドは、血合肉を原料とした場合にはじめて十分に生成させることができる。
このため、これらのペプチドを含む抗酸化剤は、マグロやカツオの血合肉を原料に用いることで、安価に製造することが可能である。
【発明を実施するための最良の形態】
【0019】
以下、本発明の実施形態について具体的に説明する。
<1.原料魚肉>
本発明におけるペプチド(IWHHT、LKYP)の原料としては、主にクロマグロ、ミナミマグロ、ビンナガ、キハダ、メバチ、カツオ等を用いることが好ましい。
また、特に、これらの魚肉のうち、食品加工において、非食部として飼料や肥料に加工されている血合肉を用いることがより好ましい。
【0020】
すなわち、IWHHTは、普通肉よりは劣るものの血合肉から十分に生成できるものであるため、血合肉を用いることでIWHHTを有効成分として含む抗酸化剤の製造コストを低減させることが可能となる。
また、LKYPは、普通肉よりも血合肉から十分に生成できるものであるため、原料として血合肉を用いることが好ましい。
【0021】
<2.プロテアーゼ(蛋白質分解酵素)>
本発明で使用するプロテアーゼとしては、特に限定されるものではなく、例えば、バチルス属の微生物由来である「サモアーゼ(大和化成株式会社)」、「アロアーゼAP−10(ヤクルト薬品工業株式会社)」、「オリエンターゼ90N(エイチビイアイ株式会社)」、「プロテアーゼN(天野エンザイム株式会社)」等の市販されているものが使用でき、目的とするペプチドの生成効率が良いという観点において、「サモアーゼ(大和化成株式会社)」がより好ましく用いられる。
これらのプロテアーゼを用いてタンパク質を加水分解することにより、本発明における上記各ペプチドを生成することができ、これを単離することが可能となる。
【0022】
<3.抗酸化剤の製造方法>
(1)ペプチド(IWHHT、LKYP)を単離する場合
まず、IWHHT、又はLKYPのいずれか一方のペプチドからなる純粋な組成物を含む抗酸化剤を製造する方法について説明する。
【0023】
(A)血合肉の酵素処理工程
血合肉のpHを調整した後、プロテアーゼを添加して、血合肉におけるタンパク質の加水分解を行う。
酵素処理時のpH、温度の範囲としては、使用する酵素の至適条件に応じて適宜決定すればよいが、例えば「サモアーゼ(大和化成株式会社)」を用いる場合、pH6.0〜9.0、温度60〜80℃とすることが好ましく、特にpH6.5、温度70℃とすることが好ましい。
【0024】
(B)酵素失活工程
次に、得られた加水分解処理物を加熱して、プロテアーゼを失活させる。
(C)固液分離工程
プロテアーゼを失活させた後、濾過により固液分離を行い、濾液を得る。
【0025】
(D)エタノール沈殿処理工程
次に、濾液にエタノールを添加してタンパク質を沈殿させ、遠心分離機もしくは濾過により沈殿を除去し、濃縮乾固する。
このときのエタノール濃度は20〜99%(v/v)とすることが好ましく、特に70%(v/v)とすることが好ましい。
【0026】
(E)強酸性陽イオン交換樹脂処理工程
次に、濃縮乾固して得られたサンプルをリン酸緩衝液に溶解させて陽イオン交換樹脂にアプライし、ペプチド(IWHHT、LKYP等)を吸着させる。そして、塩基性水溶液を用いて塩基性画分を溶出させ、得られた画分を濃縮乾固する。
溶出液は特に限定されるものではないが、例えば、0.01〜10%(v/v)のアンモニア水溶液を用いることが好ましく、5%(v/v)のアンモニア水溶液を用いることがより好ましい。
【0027】
(F)固相抽出処理工程
次に、得られたサンプルを水に溶解させて、ODSカートリッジにアプライし、有機溶媒で溶出して濃縮乾固する。
溶出液は特に限定されるものではないが、例えば、10〜99%(v/v)のメタノール水溶液を用いることが好ましく、50%(v/v)のメタノール水溶液を用いることがより好ましい。
【0028】
(G)逆相クロマトグラフィー処理工程
次に、得られたサンプルを逆相系の高速液体クロマトグラフィーに供し、本発明のペプチド(IWHHT、LKYP)を含む画分をそれぞれ単離する。
その条件としては、使用する充填剤、カラムサイズにより異なるため、特に限定されるものではないが、逆相系カラムにサンプルをインジェクションした後、アセトニトリルやメタノールなどの有機溶媒を用いて溶出させる。
【0029】
例えば、次の条件において、高速液体クロマトグラフィーに供することができる。
カラム 日本ウォーターズ(株)Sun Fire C18 4.6×150mm
検出 220nm
流速 1ml/min
溶出 0.1%トリフルオロ酢酸水溶液(TFAaq):アセトニトリル(ACCN)=90:10→80:20(15min)
この場合、4.8分前後にIWHHTを含む画分、8.5分前後にLKYPを含む画分を得ることができる。
【0030】
このようにして単離したペプチド(IWHHT、LKYP)は、いずれも優れた抗酸化能を有し、例えば加工食品に添加する酸化防止剤や、抗酸化サプリメントなどの抗酸化剤として好適に利用することが可能である。
【0031】
(2)工業的量産方法(IWHHT、LKYPを含む組成物の製造方法)
次に、IWHHT、LKYPを含む組成物の工業的量産方法について説明する。
まず、(A)血合肉の酵素処理工程、及び(B)酵素失活工程については、上述したペプチドの単離の場合と同様の工程により行うことができる。
【0032】
(C)活性炭処理工程
次に、酵素を失活させた処理物に、活性炭を添加し、タンパク質を除去するとともに、脱色、脱臭を行う。
このとき、タンパク質の除去、脱色及び脱臭を効果的に行う観点から、添加する活性炭としては、例えば賦活精製された活性炭、例えばフタムラ化学株式会社製 太閤活性炭A等を用いることが好ましい。
【0033】
また、同様の観点から、このような活性炭を、酵素処理液に含まれる固形量の0.1〜30%の比率で添加することが好ましい。
さらに、以上の効果を十分に得るために、活性炭処理工程は、10〜100℃で1時間以上行うことが好ましい。
その後、濾過等により活性炭を除去することにより、処理物を得ることができる。処理物は必要に応じて、適宜、濃縮・希釈等により濃度調整しても良い。
【0034】
(D)噴霧乾燥処理工程
次に、活性炭処理工程により得られた処理物を噴霧乾燥して、IWHHT及びLKYPを含む組成物を得る。このようにして得られた本発明のペプチドを含む組成物は優れた抗酸化能を有し、例えば加工食品に添加する酸化防止剤や、抗酸化サプリメントなどの抗酸化剤として好適に利用することが可能である。
(E)製品化工程
最後に、得られた組成物を有効成分として含む抗酸化剤を製造する。この抗酸化剤は、例えば缶詰、菓子、飲料など、一般的な加工食品への酸化抑止剤として好適に用いることが可能である。
また、一般的に、生体内物質の酸化が原因とされる疾病、例えば癌、糖尿病、動脈硬化、神経疾患等に対する予防効果を期待したサプリメントの形態に加工することも好ましい。
【実施例】
【0035】
(実施例1)
<IWHHT、LKYPを含む供試サンプルの作成>
(1)キハダマグロ血合肉約60gに水90mlを加え、pH6.5に調整した後、サモアーゼ(サモアーゼPC10;大和化成株式会社)を0.6g添加し、70℃にて16時間加水分解処理を行った。
(2)次に、加水分解処理物を、100℃にて10分間加熱し、サモアーゼを失活させた。
【0036】
(3)サモアーゼ失活後、得られた処理物を濾過に供し、濾液に70%になるようにエタノールを添加してタンパク質を沈澱させ、遠心分離機(EX−126;株式会社トミー精工社製)にて沈澱を除去した後、濃縮乾固した。
このとき、遠心分離は、3000G、10分間の条件で行った。また、濃縮乾固は、エバポレーターにより行った。
【0037】
(4)次に、陽イオン交換樹脂(UBK503;三菱化学株式会社製)8.0gを30分間水洗し、100mlの0.5MHClにて30分間攪拌した。また、pHが6になるまで水洗を繰り返し、100mlの0.5MNaOHにて30分間攪拌した。さらに、pHが6になるまで水洗を繰り返し、樹脂をカラムに充填した。そして、0.5MHClを100ml通液した後、pHが6になるまで水を通液した。更にこのカラムにリン酸緩衝液(pH5.0)を100ml通液し、平衡化を行った。
【0038】
(5)次に、リン酸緩衝液10mlに上記濃縮乾固したサンプルを溶解させた。
そして、このリン酸緩衝液をカラムにアプライし、IWHHT、LKYPを含む各種ペプチドを樹脂に吸着させた。
さらに、カラムに水100mlを通液して樹脂を洗浄した後、5%NH3AQ100mlにて塩基性画分を溶出させ、得られた画分を濃縮乾固した。
【0039】
(6)次に、予めODSカートリッジ(Vac3cc;Waters社製)に、100%メタノール5mlを通液させ、さらに水5mlを通液させた。また、上記陽イオン交換により得られた濃縮乾固したサンプルを水に溶解させた。そして、この溶液を、ODSカートリッジにアプライした。
(7)次に、ODSカートリッジを10%メタノール水溶液5mlで洗浄した後、50%メタノール水溶液(v/v)5mlで溶出を行った。そして、得られた溶出液を濃縮乾固したものを、供試サンプルとした。
【0040】
<供試サンプルからのIWHHT、LKYPの精製>
(1)上記のようにして得られた供試サンプルを、下記の分析条件にて逆相クロマトグラフィーに供し、分画を行った。その結果を図1に示す。

【0041】
図1において、第4,14,15番目のピークをそれぞれ、ピークA,B,Cとしている。以下、ピークA及びピークCの画分を用いて精製を行った。
すなわち、ピークA及びピークCの画分を、以下の条件でさらに2回逆相クロマトグラフィーに供して、当該ピークにおけるペプチドを分離した。図2は、ピークAの3回目の逆相クロマトグラフィー分析結果を示す図であり、図3は、ピークCの3回目の逆相クロマトグラフィー分析結果を示す図である。
【0042】

【0043】

【0044】
(実施例2)
<分離精製したペプチドのアミノ酸配列解析>
(1)塩酸加水分解によるアミノ酸組成分析
実施例1によりピークA、ピークCの画分からそれぞれ得られた精製ペプチドを塩酸で加水分解し、各ペプチドに含まれるアミノ酸成分の割合を分析した。図4は、ピークAのアミノ酸組成分析結果を示す図であり、図5は、ピークCのアミノ酸組成分析結果を示す図である。
【0045】
図4に示される通り、ピークAのペプチドのアミノ酸組成比はThr:Ile:His=1:1:2であった。
また、図5に示される通り、ピークCのペプチドのアミノ酸組成比はLeu:Lys:Pro=1:1:1であった。
【0046】
(2)マススペクトルの計測
次に、ピークAのペプチド、及びピークCのペプチドについて、それぞれのマススペクトルを測定した。図6は、ピークAのマススペクトル分析結果を示す図であり、図7は、ピークCのマススペクトル分析結果を示す図である。
図6に示される通り、ピークAの〔M+H〕+は693であった。また、図7に示される通り、ピークCの〔M+H〕+は520であった。
【0047】
(3)N末端から5サイクルまでのアミノ酸配列解析
次に、ピークAのペプチドを試料として、プロテインシークエンサーにより、N末端から5サイクルまでのアミノ酸配列を解析した。その結果を図8〜図12に示す。これらの図は、それぞれ1サイクル目〜5サイクル目までのピークAのアミノ酸配列解析結果を示している。
これにより、ピークAにおけるペプチドは、Ile−Trp−His−His−Thr(IWHHT)のアミノ酸配列を有することが明らかになった。
【0048】
このアミノ酸配列からなるペプチドの分子量Mは692であり、これにプロトンが付加した〔M+H〕+は693である。これは、上記ピークAのマススペクトル分析結果と整合性のとれるものである。
以上のことを総合的に考慮すると、ピークAにおけるペプチドは、H−Ile−Trp−His−His−Thr−OHで表されるものであると判断することができる。なお、上述したピークAのアミノ酸組成分析結果にはTrpが含まれていないが、これは加水分解によりTrp自体が分解されたためであると考えられる。
【0049】
次に、ピークCのペプチドを試料として、プロテインシークエンサーにより、N末端から5サイクルまでのアミノ酸配列を解析した。その結果を図13に示す。
同図に示される通り、ピークCにおけるペプチドのアミノ酸配列は、Leu−Lys−Tyr−Pro(LKYP)であった。
このアミノ酸配列からなるペプチドの分子量Mは519であり、これにプロトンが付加した〔M+H〕+は520である。これは、上記ピークCのマススペクトル分析結果と整合性のとれるものである。
【0050】
以上のことを総合的に考慮すると、ピークCにおけるペプチドは、H−Leu−Lys−Tyr−Pro−OHで表されるものであると判断することができる。なお、上述したピークCのアミノ酸組成分析結果にはTyrが含まれていないが、これは塩酸で加水分解する際にフェノール含有の塩酸を用いなかったため、Tyrがハロゲン化されてクロロチロシンとなり検出できなかったものと考えられる。
【0051】
(実施例3)
<由来原料ごとのペプチドの収率分析>
次に、本発明におけるペプチド(IWHHT、LKYP)について、由来原料ごとの収率の違いを比較した。
原料としては、キハダ血合肉、カツオ血合肉、ビンナガ血合肉、キハダ普通肉(赤身肉)を用いた。また、ペプチドの抽出、精製は、実施例1に示す方法と同様の方法で行った。その結果を図14に示す。
【0052】
図14に示される通り、キハダ血合肉、カツオ血合肉、ビンナガ血合肉のIWHHT収率は、キハダ普通肉よりは劣るものの、従来は魚肉を加工する際の副産物として処分されてきた血合肉から、抗酸化剤を製造するために十分な量のIWHHTを得ることができている。
これにより、本発明の抗酸化剤の原料として、血合肉を好適に使用できることが確認された。
また、LKYPについては、キハダ普通肉からは得ることができず、各種血合肉が原料として適していることが確認された。
【0053】
(試験例1)
<ヒドロキシラジカル(・OH)消去能の分析>
本発明の抗酸化剤におけるIWHHT、LKYPの抗酸化能を確認するため、以下のように、ヒドロキシラジカル(・OH)消去活性について試験を行った。
【0054】
(1)試験管に92mM5,5ジメチル−1−ピロリン−N−オキサイド(DMPO)20μl、0.1mMジエチレントリアミンペンタ酢酸(DETAPAC)水溶液25μl、0.2mM硫酸鉄(II)水溶液50μl、及び0.1mMリン酸緩衝液(pH7.4)を混合し、この溶液に0.5%(w/w)のペプチド水溶液30μlを添加した。また、この溶液に水30μlを添加したものを対照とした。
【0055】
(2)次いで、それぞれの溶液ごとに1mM過酸化水素水50μlを加えて混合し、ESR測定用特殊偏平セルに吸い取り、ESR装置(JES−FR30;日本電子株式会社製)にセットした。
そして、過酸化水素水50μlを加えてから正確に40秒後にシグナルの測定を行った。シグナル強度は、Mn2+のシグナルを対照とした相対値とした。その結果を図15に示す。
(3)同図に示される通り、IWHHT及びLKYPは、ヒドロキシラジカル消去能を有していることが確認された。
【0056】
(試験例2)
<一重項酸素(1O2)消去能の分析>
本発明の抗酸化剤におけるIWHHT、LKYPの抗酸化能を確認するため、以下のように、一重項酸素(1O2)消去活性について試験を行った。なお、以下の試験において、試薬の希釈及び調製は、リン酸緩衝生理食塩水(PBS)を用いて行った。
【0057】
(1)IWHHT、LKYPのそれぞれについて、試験管に50mMリボフラビン溶液150μl、及び0.2M2,2,6,6−テトラメチル−4−ピペリドン塩酸塩(TMPD)50μlを混合し、この溶液に0.025%(w/w)のペプチド溶液300μlを添加、混合した。また、この溶液にPBS300μlを添加、混合したものを対照とした。
【0058】
(2)次いで、各溶液をESR測定用特殊偏平セルに吸い取り、紫外線照射灯(MODEL UVG−11;ULTRA−VIOLET PRODUCT社)を用いて254nmの紫外線を1cmの距離から7分間照射した後、ESR装置(JES−FR30;日本電子株式会社製)にセットして、シグナルの測定を行った。シグナル強度は、Mn2+のシグナルを対照とした相対値とした。その結果を図16に示す。
(3)同図に示される通り、IWHHT及びLKYPは、一重項酸素消去能を有していることが確認された。
【産業上の利用可能性】
【0059】
本発明の抗酸化剤は、一般的な加工食品への酸化抑止剤として好適に用いることが可能である。また、生体内物質の酸化が原因とされる疾病、例えば癌、糖尿病、動脈硬化、神経疾患等に対する予防効果を期待したサプリメントの材料として用いることも可能である。
【図面の簡単な説明】
【0060】
【図1】本発明の実施例1における供試サンプルの逆相クロマトグラフィー分析結果を示す図である。
【図2】本発明の実施例1のピークAの逆相クロマトグラフィー分析結果を示す図である。
【図3】本発明の実施例1のピークCの逆相クロマトグラフィー分析結果を示す図である。
【図4】本発明の実施例2のピークAのアミノ酸組成分析結果を示す図である。
【図5】本発明の実施例2のピークCのアミノ酸組成分析結果を示す図である。
【図6】本発明の実施例2のピークAのマススペクトル分析結果を示す図である。
【図7】本発明の実施例2のピークCのマススペクトル分析結果を示す図である。
【図8】本発明の実施例2のピークAのアミノ酸配列解析結果(1サイクル目)を示す図である。
【図9】本発明の実施例2のピークAのアミノ酸配列解析結果(2サイクル目)を示す図である。
【図10】本発明の実施例2のピークAのアミノ酸配列解析結果(3サイクル目)を示す図である。
【図11】本発明の実施例2のピークAのアミノ酸配列解析結果(4サイクル目)を示す図である。
【図12】本発明の実施例2のピークAのアミノ酸配列解析結果(5サイクル目)を示す図である。
【図13】本発明の実施例2のピークCのアミノ酸配列解析結果を示す図である。
【図14】本発明の実施例3における由来原料ごとのペプチド収量を示す図である。
【図15】本発明の試験例1におけるヒドロキシラジカル消去能の分析結果を示す図である。
【図16】本発明の試験例2における一重項酸素消去能の分析結果を示す図である。
【特許請求の範囲】
【請求項1】
魚肉をプロテアーゼで加水分解処理して得られたH−Ile−Trp−His−His−Thr−OHで表されるペプチドを有効成分とすることを特徴とする抗酸化剤。
【請求項2】
魚肉をプロテアーゼで加水分解処理して得られたH−Leu−Lys−Tyr−Pro−OHで表されるペプチドを有効成分とすることを特徴とする抗酸化剤。
【請求項3】
前記魚肉として、少なくともマグロ血合肉又はカツオ血合肉のいずれかを用いることを特徴とする請求項1又は2記載の抗酸化剤。
【請求項4】
前記プロテアーゼとして、バチルス属由来のプロテアーゼを用いることを特徴とする請求項1〜3のいずれかに記載の抗酸化剤。
【請求項1】
魚肉をプロテアーゼで加水分解処理して得られたH−Ile−Trp−His−His−Thr−OHで表されるペプチドを有効成分とすることを特徴とする抗酸化剤。
【請求項2】
魚肉をプロテアーゼで加水分解処理して得られたH−Leu−Lys−Tyr−Pro−OHで表されるペプチドを有効成分とすることを特徴とする抗酸化剤。
【請求項3】
前記魚肉として、少なくともマグロ血合肉又はカツオ血合肉のいずれかを用いることを特徴とする請求項1又は2記載の抗酸化剤。
【請求項4】
前記プロテアーゼとして、バチルス属由来のプロテアーゼを用いることを特徴とする請求項1〜3のいずれかに記載の抗酸化剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2009−91306(P2009−91306A)
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願番号】特願2007−264348(P2007−264348)
【出願日】平成19年10月10日(2007.10.10)
【出願人】(390033145)焼津水産化学工業株式会社 (80)
【出願人】(591273960)はごろもフーズ株式会社 (7)
【Fターム(参考)】
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願日】平成19年10月10日(2007.10.10)
【出願人】(390033145)焼津水産化学工業株式会社 (80)
【出願人】(591273960)はごろもフーズ株式会社 (7)
【Fターム(参考)】
[ Back to top ]

