抗酸菌生育阻害剤の候補化合物のスクリーニング方法および該方法により得られる抗酸菌生育阻害剤
【課題】ヒト等の真核生物に対しては無害であり、抗酸菌の生育を選択的に阻害する抗酸菌生育阻害剤の候補化合物を高効率でスクリーニングする方法および該方法により得られる抗酸菌生育阻害剤を提供する。
【解決手段】1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する選択的阻害活性を有する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定する抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
【解決手段】1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する選択的阻害活性を有する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定する抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗酸菌生育阻害剤の候補化合物をスクリーニングする技術に関するものである。
【背景技術】
【0002】
抗酸菌は、マイコバクテリウム科マイコバクテリウム属に属する真正細菌の総称であり、その呼称は、細胞壁に多量の脂肪酸を含むためグラム染色法等の通常の染色法に対し難染性を示すが、強力に染色された後は、酸アルコール処理による脱色に抵抗性を示すことに因んでいる。抗酸菌の中には、ヒトや動物に対する病原性を有するものが多数存在し、その代表例としては、結核菌(Mycobaterium tuberculosis)、らい菌(Mycobacterium leprae)、非結核性抗酸菌(病原性のものとしては、Mycobacterium avium、Mycobacterium kansasii等)が挙げられる。抗酸菌により引き起こされる疾患には、根治が困難なものや、最悪の場合には死に至るものも多いため、有効な薬剤の開発が重要な課題である。
【0003】
従来、結核の治療には、ストレプトマイシン、カナマイシン等の抗結核薬が用いられている。非結核性抗酸菌感染症の治療には、抗結核薬と、イソニコチン酸ヒドラジド、リファンピシン、エタンブトール等の一般抗生物質とを組み合わせた多剤併用療法が用いられている。しかし、これらの薬剤療法には、薬剤耐性の発現、副作用等の問題がある。また、適用可能な薬剤の種類が限定されているため、副作用が生じた場合に代替可能な薬剤がなく、減感作を行いながら投与を続行せざるを得ないという問題が生じる場合もある。
【0004】
抗酸菌の細胞壁の構成成分であるリポアラビノマンナン(LAM)ならびにその前駆体であるホスファチジルイノシトールマンノシド(PIM)およびホスファチジルイノシトール(PI)が、抗酸菌の生育や宿主への感染の成立において重要な役割を果たしていることが近年の研究で明らかになった(例えば、非特許文献1および2参照)。そこで、抗酸菌におけるこれらの細胞壁構成リン脂質の生合成を阻害する化合物が、抗酸菌に由来する疾患の新規な治療薬として注目を集めている。
【0005】
例えば、特許文献1には、抗酸菌の細胞壁の構成成分であるリポマンナン(LM)および/またはリポアラビノマンナン(LAM)の生合成を阻害する物質をスクリーニングする物質のスクリーニング方法が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−185163号公報
【非特許文献】
【0007】
【非特許文献1】Morita, Y. S., Patterson, J. H., Billman-Jacobe, H., and McConville, M. J. Biochem J 378, 589-597 (2004)
【非特許文献2】Morita, Y. S., Velasquez, R., Taig, E., Waller, R. F., Patterson, J. H., Tull, D., Williams, S. J., Billman-Jacobe, H., and McConville, M. J. J Biol Chem 280, 21645-21652 (2005)
【発明の概要】
【発明が解決しようとする課題】
【0008】
LMおよび/またはLAMの生合成経路は複数の反応からなるが、特許文献1記載のスクリーニング方法では、特定の反応に限定せず、そのいずれかを阻害する物質全般を広くスクリーニング対象としているため、スクリーニング効率が低いという課題が存在する。 また、LMおよびLAMの前駆体であるホスファチジルイノシトール(PI)の生合成経路には、抗酸菌と真核生物に共通する反応も存在するため、特許文献1記載のスクリーニング方法で得られる化合物の中には、治療対象である真核生物の生理機能にも悪影響を及ぼすものが含まれるおそれがある。
【0009】
本発明は上記課題に鑑みてなされたものであり、抗酸菌の生育を選択的に阻害し、ヒト等の真核生物に対しては無害である抗酸菌生育阻害剤の候補化合物を高効率でスクリーニングする方法および該方法により得られる抗酸菌生育阻害剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、抗酸菌におけるホスファチジルイノシトールの生合成経路について鋭意検討を行った結果、真核生物におけるそれとは一部異なる反応経路を有することを新たに見いだし、その反応をターゲットとすることにより、真核生物の生理機能に悪影響を与えることなく抗酸菌の生育を選択的に阻害する抗酸菌生育阻害剤の候補化合物を高効率でスクリーニングする方法を完成するに至った。
【0011】
すなわち、本発明は、次の態様に係るものである。
(1) 1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP(シチジン二リン酸)−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応を選択的に阻害する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定する抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
(2) 前記被検化合物の存在下および非存在下で前記反応を触媒する酵素の活性を測定し、それぞれの場合における酵素活性の比から、各被検化合物について前記阻害活性の有無を判定する前記(1)記載の抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
(3) 前記被検化合物による、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合阻害の有無を測定する前記(2)記載の抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
(4) 前記(1)から(3)のいずれかに記載のスクリーニング方法を用いて得られ、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する阻害活性を有する抗酸菌生育阻害剤。
(5) 前記反応を触媒する酵素(PIP合成酵素)の活性を阻害する前記(4)記載の抗酸菌生育阻害剤。
(6) CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合を阻害する前記(5)記載の抗酸菌生育阻害剤。
(7) 抗酸菌生育阻害剤におけるmyo−イノシトールの1−位のヒドロキシル基が、ヒ酸エステル基(−O−As(=O)(OH)2)、硫酸エステル基(−O−S(=O)2−OH)、チオリン酸エステル基(−O−P(=S)(OH)2)、リン酸チオエステル基(−S−P(=O)(OH)2)、ホスホロチオエート基(−O−P(=O)(OH)(OS))、ホスフィン酸基(−P(=O)(OH)2)、および亜ホスホン酸基(−P(OH)2)からなる群より選択される官能基で置換された化合物である前記(4)から(6)のいずれかに記載の抗酸菌生育阻害剤。
【0012】
なお、本発明において「スクリーニング」には、人工的に構築した酵素反応系等のアッセイ系を用いて試験管内(in vitro)で行うスクリーニング、培養細胞等を用いて生体内(in vivo)で行うスクリーニング、および酵素の反応中心や阻害活性を有することが知られている既知の化合物の立体構造等に基づいてコンピュータを用いて(in silico)行われるスクリーニングの全てが含まれる。
また、本発明における「被検化合物群」には、単一の被検化合物のみからなるものも含まれる。
【発明の効果】
【0013】
本発明によれば、ヒト等の真核生物に対しては無害であり、抗酸菌の生育を選択的に阻害する抗酸菌生育阻害剤の候補化合物を高効率でスクリーニングする方法が提供される。 また、本発明によると、ヒト等の真核生物に対しては無害であり、抗酸菌の生育を選択的に阻害する抗酸菌生育阻害剤およびそれを有効成分とする医薬組成物が提供される。
【図面の簡単な説明】
【0014】
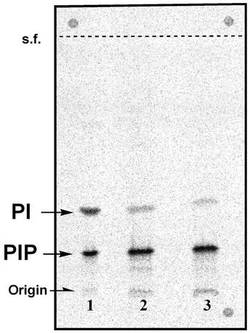
【図1】E.smegmatis細胞壁および組換え大腸菌を酵素標品とした酵素反応系における[14C]標識された生成物のTLC(薄層クロマトグラム)である。
【図2】E.smegmatis細胞壁を酵素標品とした酵素反応系におけるPIPおよびPIの濃度の経時変化を示すグラフである。
【発明を実施するための形態】
【0015】
本発明の第1の実施の形態に係る抗酸菌生育阻害剤の候補化合物のスクリーニング方法(以下、「スクリーニング方法」と略称する場合がある。)について説明する。
本実施の形態に係るスクリーニング方法において、1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP(シチジン二リン酸)−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応を選択的に阻害する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定する。
【0016】
従来、抗酸菌におけるホスファチジルイノシトールの生合成経路は、真核生物におけるホスファチジルイノシトールの生合成経路と同様、下記の(1)〜(3)の反応(化1参照)からなると信じられていた(例えば、Salman, M., Lonsdale, J. T., Besra, G. S., and Brennan, P. J., Biochim. Biophys. Acta 1436, 437-450 (1999)参照)。
(1)グルコース6−リン酸 → 1L−myo−イノシトール1−リン酸
(2)1L−myo−イノシトール1−リン酸 →
myo−イノシトール+リン酸
(3)myo−イノシトール+CDP−ジアシルグリセロール →
ホスファチジルイノシトール(PI)+CMP
【0017】
【化1】

【0018】
なお、式中、R1およびR2は、それぞれ飽和または不飽和炭化水素基を表す。生体内において、ジアシルグリセロールはホスファチジン酸を経由して合成されるため、通常、R1は飽和炭化水素基であり、R2は不飽和炭化水素基である。
【0019】
しかしながら、本発明者は、抗酸菌におけるホスファチジルイノシトールの生合成経路について再検討を行った結果、正しくは、下記の(1)、(2’)および(3’)の反応(化2参照)からなることを見いだした。
(1)グルコース6−リン酸 → 1L−myo−イノシトール1−リン酸
(2’)1L−myo−イノシトール1−リン酸+CDP−ジアシルグリセロール → ホスファチジルイノシトールリン酸(PIP)+CMP
(3’)PIP → ホスファチジルイノシトール(PI)+リン酸
【0020】
【化2】

【0021】
上記のうち反応(2’)は、抗酸菌に特有なもので真核生物に存在しないため、これを選択的に阻害することにより、真核生物に何ら悪影響を及ぼすことなく抗酸菌の生育のみを特異的に阻害することが可能となる。また、スクリーニングの対象が上記反応に限定されているため、効率よくスクリーニングを行うことができる。
【0022】
抗酸菌生育阻害剤の標的となる抗酸菌の種類について特に制限はないが、好ましくは、ヒトや動物に対し病原性を有するものであり、その具体例としては、結核菌(Mycobaterium tuberculosis)、らい菌(Mycobacterium leprae)、非結核性抗酸菌(Mycobacterium avium、Mycobacterium kansasii等)が挙げられる。
【0023】
被検化合物群を構成する被検化合物の数についても特に制限はなく、1または複数のいずれであってもよい。被検化合物は、天然に存在するものおよび人工的に合成されたものであってもよく、低分子および高分子(合成高分子、ペプチド、多糖、オリゴヌクレオチド等)のいずれであってもよい。また、被検化合物はランダムに選択されたものであってもよく、コンビナトリアルケミストリー等の手法を用いて系統的に得られる一連の類縁体であってもよい。
【0024】
CDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する阻害様式については、真核生物における生理活性を阻害しない限りにおいて特に制限はなく、例えば、該反応を触媒するPIP合成酵素の阻害、PIP合成酵素をコードする遺伝子の発現阻害のいずれであってもよい。
【0025】
前者の場合において、酵素活性の阻害様式については特に制限はなく、拮抗阻害、非拮抗阻害のいずれであってもよく、例えば、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合を阻害するものであってもよい。
また、後者の場合における遺伝子の発現阻害の様式についても特に制限はなく、siRNAを用いたRNA干渉および他の発現阻害のいずれであってもよい。
【0026】
スクリーニングの方法について特に制限はなく、通常医薬分野において用いられる任意のスクリーニング方法を用いることができる。スクリーニング方法の具体例としては、人工的に構築した酵素反応系等のアッセイ系を用いて試験管内(in vitro)で行うスクリーニング、培養細胞等を用いて生体内(in vivo)で行うスクリーニング、および酵素の反応中心や阻害活性を有することが知られている既知の化合物の立体構造等に基づいてコンピュータを用いて(in silico)行われるスクリーニングが挙げられる。
【0027】
好ましいスクリーニング方法の一例としては、被検化合物の存在下および非存在下で上記の反応(2’)を触媒する酵素(PIP合成酵素)の活性を測定し、それぞれの場合における酵素活性の比から、各被検化合物についてPIP合成酵素に対する阻害活性の有無を判定する方法が挙げられる。
【0028】
上記の反応(2’)を触媒するPIP合成酵素は、抗酸菌に特有なもので、真核生物に存在し、上記の反応(3)を触媒するCDP−ジアシルグリセロール−イノシトール3−ホスファチジルトランスフェラーゼ(EC 2.7.8.11)とは異なるものである。 したがって、上記の反応(2’)を触媒する酵素についての阻害活性の有無に基づいて、抗酸菌生育阻害剤の候補化合物を効率よく選定することが可能となる。
【0029】
被検化合物によるPIP合成酵素の阻害機構に特に制限はなく、酵素・基質複合体に結合して反応の進行を阻害する基質阻害、基質結合部位に競合的に結合して反応開始を妨げる拮抗阻害、酵素または酵素・基質複合体の、基質と別の部位に結合して反応の進行を阻害する非拮抗阻害、酵素・基質複合体のみの、基質と別の部位に結合して反応の進行を阻害する不拮抗阻害、これらのうち任意の2以上の組み合わせにより反応の進行を阻害する混合型阻害のいずれであってもよい。これらのうち特に好ましいのは、被検化合物がPIP合成酵素の基質結合部位に競合的に結合し、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合を阻害する拮抗型阻害である。したがって、本実施の形態に係るスクリーニング方法は、被検化合物による、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合阻害の有無を測定するものであることが好ましい。
【0030】
被検化合物の阻害活性をin vitroでスクリーニングするための評価系(アッセイ系)に用いられるPIP合成酵素は、抗酸菌の菌体から単離精製したものであってもよく、菌体をホモジナイズしたものをそのまま用いてもよく、あるいは、PIP合成酵素をコードする遺伝子を大腸菌等に導入し発現させたものを用いてもよい。
抗酸菌としては、治療対象となる疾患の原因となる抗酸菌を用いてもよいが、M. smegmatis等の病原性を有しない抗酸菌を用いてもよい。
【0031】
酵素活性(反応速度)または被検化合物の阻害活性は、一定時間後に反応液中に含まれる基質濃度または生成物(PIP)濃度により求めることができる。被検化合物の存在下および非存在下にLineweaver-Brukプロットの比較より、被検化合物の阻害機構を判定することもできる。
基質濃度または生成物濃度は、基質にラジオアイソトープを用いた生成物の放射能測定、高速液体クロマトグラフィー等の任意の公知の手段を用いて行うことができる。
【0032】
PIP合成酵素の阻害活性に基づいて、被検化合物が上記式(2’)の反応を阻害する活性を判定する場合、例えば、被検化合物の存在下および非存在下でPIP合成酵素の活性を測定し、それぞれの場合における酵素活性の比、すなわち、後者に対する前者の比が所定の値以下の場合に、被検化合物は上記式(2’)の反応を阻害すると判定し、候補化合物として選定することができる。
【0033】
次に、本発明の第2の実施の形態に係る抗酸菌生育阻害剤について説明する。本発明の第2の実施の形態に係る抗酸菌生育阻害剤は本発明の第1の実施の形態に係るスクリーニング方法を用いて得られ、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する選択的な阻害活性を有する。
【0034】
CDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する阻害様式については、真核生物における生理活性を阻害しない限りにおいて特に制限はなく、PIP合成酵素の阻害、PIP合成酵素をコードする遺伝子の発現阻害のいずれであってもよいが、好ましくは、本実施の形態に係る抗酸菌生育阻害剤は、PIP合成酵素の活性を阻害するものである。
【0035】
PIP合成酵素の阻害機構に特に制限はなく、前述の拮抗阻害、非拮抗阻害、不拮抗阻害、および混合型阻害のいずれであってもよい。しかし、これらのうち特に好ましい抗酸菌生育阻害剤は、PIP合成酵素の基質結合部位に競合的に結合し、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合を阻害する拮抗型阻害によりPIP合成酵素の活性を阻害する化合物である。
【0036】
本実施の形態に係る抗酸菌生育阻害剤の具体例としては、抗酸菌生育阻害剤におけるmyo−イノシトールの1−位のヒドロキシル基が、ヒ酸エステル基(−O−As(=O)(OH)2)、硫酸エステル基(−O−S(=O)2−OH)、チオリン酸エステル基(−O−P(=S)(OH)2)、リン酸チオエステル基(−S−P(=O)(OH)2)、ホスホロチオエート基(−O−P(=O)(OH)(OS))、ホスフィン酸基(−P(=O)(OH)2)、および亜ホスホン酸基(−P(OH)2)からなる群より選択される官能基で置換された化合物、すなわち、下記の式に示す構造を有する化合物が挙げられる。
【0037】
【化3】

【0038】
これらの化合物は、PIP合成酵素の基質の1つであるイノシトール1−リン酸と類似の構造を有しており、いずれも任意の公知の反応を用いて合成することができる。
【実施例】
【0039】
本発明の作用効果を確認するために行った実施例について説明する。本実施例では、抗酸菌類におけるホスファチジルイノシトール(PI)の生合成経路を検証するために、CDP−ジアシルグリセロール、[14C]イノシトール1−リン酸および[3H]イノシトールを基質として抗酸菌の一種であるM. smegmatisおよびM. bovis, BCGに由来する酵素を作用させ、生成物である脂溶性画分に[14C]および[3H]のいずれの放射性ラベルが取り込まれるかについて、液体シンチレーションカウンターによる放射能測定により検討した。これらの基質のうち、[3H]イノシトールについては市販のものを使用した。
【0040】
(1)CDP−ジアシルグリセロールの調製
市販のホスファチジン酸(1,2-Dioleoyl-sn-glycero-3-phosphate)から、CMP-morpholidateを用いてCDP−ジアシルグリセロールを有機合成した。
【0041】
(2)[14C]イノシトール1−リン酸の調製
1L−[14C]イノシトール1−リン酸は市販されていないので、[14C]グルコース6−リン酸からメタン生成古細菌のホモジネートの上清を用いて酵素的に調製した(Morii, H., Kiyonari, S., Ishino, Y., Koga, Y. A novel biosynthetic pathway of archaetidyl-myo-inositol via archaetidyl-myo-inositol 1-phosphate from CDP-archaeol and D-glucose 6-phosphate in methanoarchaeon Methanothermobacter thermautotrophicus cells. J. Biol. Chem. Vol.284, 30766-30774 (2009)参照)。
【0042】
(3)PIP合成酵素の調製
M. smegmatisを培養し、菌体を50mM MOPS緩衝液(pH7.9)、5μM 2−メルカプトエタノールに懸濁し、超音波で破砕してホモジネートを調製し、遠心(27,000×g、15min)した。その沈殿物からPercoll密度勾配遠心により細胞壁画分を得た。上清は超遠心(100,000×g、1h)し、超遠心上清と粗細胞膜標品に分けた。また、ホモジネートの遠心沈殿物を緩衝液で懸濁し、軽く遠心(3,000rpm、10min)して得られる上清(細胞壁を含む)を、PIP合成酵素の標品として使用した。
【0043】
(4)遺伝子組換え操作によるPIP合成酵素の発現
メタン菌のAIP合成酵素とホモロガスな抗酸菌タンパク質の遺伝子AAG17336(M.smegmatis)、NP_856290(M. bovis, BCG)を組み込んだプラスミド(pET21a-AAG17336、pET21a-NP_856290)を構築し、これを大腸菌(E.coli)に導入し、PIP合成酵素を発現させた。
【0044】
(5)酵素活性測定
CDP−ジアシルグリセロールと[14C]イノシトール1−リン酸または[3H]イノシトールに緩衝液を加え、酵素としてM. smegmatisの細胞壁またはPIP合成酵素を発現させたE.coliのホモジネートを加えて反応させた後、有機溶媒可溶性生成物の放射能を測定した。
【0045】
(6)PIP合成酵素活性測定
0.2mM CDP−ジアシルグリセロール、0.1mM [14C]イノシトール1−リン酸(4Ci/mol)(19nmol、2800Bq/アッセイ)、50mM MOPS緩衝液(pH7.9)、5μM 2−メルカプトエタノール、10mM MgCl2、0.4%CHAPS、酵素溶液(タンパク量100μgまたは200μg)(全容量0.2ml)を37℃で1時間反応させた。(脂質基質は[14C]イノシトール1−リン酸と0.4%CHAPSと酵素溶液以外の反応溶液中で室温、20分間超音波処理して懸濁した。)反応後、0.1M HCl/メタノールと1M MgCl2(pH2)を加え、Bligh−Dyer法の比率で水層とクロロホルム層に分画し、クロロホルム可溶性生成物の放射能を測定した。
【0046】
(7)PI合成酵素活性測定
上記のPIP合成酵素活性測定の0.1mM [14C]イノシトール1−リン酸を2.5μM [3H]イノシトール(4Ci/mmol)(0.5nmol、74kBq/アッセイ)に代え、さらに0.1mM ATP、5mMグルコースを反応溶液中に加えて、上記(6)と同様に測定した。
【0047】
(8)生成物の分離
酵素反応生成物をシリカゲルTLCで展開後、IPプレート(富士フイルム製BAS−MS2025またはBAS−TR2025)を用いて放射線強度に比例する蛍光イメージを取得し、イメージングアナライザー(富士フイルム製FLA5000)を用いてPIPとPIの量比を求めた。
【0048】
<結果と考察>
(1)PIP合成酵素活性
M. smegmatisの細胞壁を酵素標品として、[14C]イノシトール1−リン酸と、CDP−ジアシルグリセロールを反応させると、[14C]のラベルが脂質画分に取り込まれた。この生成物をTLCで調べると2つのスポットが検出された(図1のレーン1参照)。Rf値の高いスポットはPIとRf値が一致し、Rf値の低いスポットはイノシトール1−リン酸とCDP−ジアシルグリセロールが反応して生成したホスファチジルイノシトールリン酸(PIP)と考えられる。PIとPIP濃度の経時変化を図2に示した。
【0049】
[14C]PIPをTLCで精製して、M. smegmatisのホモジネートとインキュベートすると[14C]PIが生成した。表1にM. smegmatis細胞壁および組換え大腸菌を用いた場合における、脂質(PIPおよびPI)への[14C]イノシトール1−リン酸および[3H]イノシトールの取り込みについての結果を示す。メタン菌のAIP合成酵素とホモロガスな抗酸菌タンパク質の遺伝子AAG17336(M. smegmatis)とNP_856290 (M. bovis, BCG)を大腸菌で発現させた株を用いて調べると、PIP合成酵素の高い活性が検出された(表1参照)。なお、上記遺伝子を組み込まないプラスミドのみを導入した大腸菌のホモジネートがPIP合成活性を殆ど示さなかったことから、PIP合成酵素は大腸菌およびプラスミドそのものの発現産物に由来するものではないことが確認された。
【0050】
各スポットの放射線強度より求めた各生成物の生成量比は、PIPが95%、PIが5%であった(図1のレーン2、3参照)。M. smegmatisの細胞壁以外の画分、ホモジネートの超遠心上清と粗細胞膜標品のPIP合成活性を表2に示した。
【0051】
【表1】

【0052】
【表2】

【0053】
(2)PI合成酵素活性
M. smegmatisの細胞壁を酵素標品とした場合、[3H]イノシトールの脂質への取り込み活性が観測されたが、その活性は[14C]イノシトール1−リン酸の取り込み活性の約1/1000に過ぎなかった(表2参照)。また、メタン菌のAIP合成酵素とホモロガスな抗酸菌タンパク質の遺伝子AAG17336 (M. smegmatis)、NP_856290 (M. bovis, BCG)を大腸菌で発現させた株を酵素標品として使用した場合、[3H]イノシトールは脂質へほとんど取り込まれなかった(表1参照)。粗細胞壁を酵素とした場合、[3H]ラベルの生成物をTLCで調べると2つのスポットが検出された。Rf値の高いスポットはPIとRf値が一致し、Rf値の低いスポットは、PIP合成酵素活性測定の生成物[14C]PIPとRf値が一致した。活性測定混合物中のATP濃度を10倍の1mMにすると、活性は1.6倍高くなった。しかし、ATPを加えなくても高い活性が検出された。CDP−ジアシルグリセロールを加えなくても活性があった。
【0054】
M. smegmatisの細胞壁による[3H]イノシトールの脂質への取り込み機構は不明である。しかし、その取り込み量は[14C]イノシトール1−リン酸の約1/1000と非常に低いこと、並びに大腸菌の遺伝子組み換え体はイノシトール1−リン酸のみを利用することから、抗酸菌のPIの主要生合成経路は、既に報告されている経路(真核生物と同じ経路)ではなく、古細菌類と同様の中間体(PIP)を経由する経路であると考えられる。
【0055】
以上の結果は、ラジオアイソトープを用いた上記アッセイ系が、抗酸菌におけるPIの合成経路の確認に有効であることのみならず、PIP合成酵素の活性のアッセイにも有用であることを示している。
【技術分野】
【0001】
本発明は、抗酸菌生育阻害剤の候補化合物をスクリーニングする技術に関するものである。
【背景技術】
【0002】
抗酸菌は、マイコバクテリウム科マイコバクテリウム属に属する真正細菌の総称であり、その呼称は、細胞壁に多量の脂肪酸を含むためグラム染色法等の通常の染色法に対し難染性を示すが、強力に染色された後は、酸アルコール処理による脱色に抵抗性を示すことに因んでいる。抗酸菌の中には、ヒトや動物に対する病原性を有するものが多数存在し、その代表例としては、結核菌(Mycobaterium tuberculosis)、らい菌(Mycobacterium leprae)、非結核性抗酸菌(病原性のものとしては、Mycobacterium avium、Mycobacterium kansasii等)が挙げられる。抗酸菌により引き起こされる疾患には、根治が困難なものや、最悪の場合には死に至るものも多いため、有効な薬剤の開発が重要な課題である。
【0003】
従来、結核の治療には、ストレプトマイシン、カナマイシン等の抗結核薬が用いられている。非結核性抗酸菌感染症の治療には、抗結核薬と、イソニコチン酸ヒドラジド、リファンピシン、エタンブトール等の一般抗生物質とを組み合わせた多剤併用療法が用いられている。しかし、これらの薬剤療法には、薬剤耐性の発現、副作用等の問題がある。また、適用可能な薬剤の種類が限定されているため、副作用が生じた場合に代替可能な薬剤がなく、減感作を行いながら投与を続行せざるを得ないという問題が生じる場合もある。
【0004】
抗酸菌の細胞壁の構成成分であるリポアラビノマンナン(LAM)ならびにその前駆体であるホスファチジルイノシトールマンノシド(PIM)およびホスファチジルイノシトール(PI)が、抗酸菌の生育や宿主への感染の成立において重要な役割を果たしていることが近年の研究で明らかになった(例えば、非特許文献1および2参照)。そこで、抗酸菌におけるこれらの細胞壁構成リン脂質の生合成を阻害する化合物が、抗酸菌に由来する疾患の新規な治療薬として注目を集めている。
【0005】
例えば、特許文献1には、抗酸菌の細胞壁の構成成分であるリポマンナン(LM)および/またはリポアラビノマンナン(LAM)の生合成を阻害する物質をスクリーニングする物質のスクリーニング方法が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−185163号公報
【非特許文献】
【0007】
【非特許文献1】Morita, Y. S., Patterson, J. H., Billman-Jacobe, H., and McConville, M. J. Biochem J 378, 589-597 (2004)
【非特許文献2】Morita, Y. S., Velasquez, R., Taig, E., Waller, R. F., Patterson, J. H., Tull, D., Williams, S. J., Billman-Jacobe, H., and McConville, M. J. J Biol Chem 280, 21645-21652 (2005)
【発明の概要】
【発明が解決しようとする課題】
【0008】
LMおよび/またはLAMの生合成経路は複数の反応からなるが、特許文献1記載のスクリーニング方法では、特定の反応に限定せず、そのいずれかを阻害する物質全般を広くスクリーニング対象としているため、スクリーニング効率が低いという課題が存在する。 また、LMおよびLAMの前駆体であるホスファチジルイノシトール(PI)の生合成経路には、抗酸菌と真核生物に共通する反応も存在するため、特許文献1記載のスクリーニング方法で得られる化合物の中には、治療対象である真核生物の生理機能にも悪影響を及ぼすものが含まれるおそれがある。
【0009】
本発明は上記課題に鑑みてなされたものであり、抗酸菌の生育を選択的に阻害し、ヒト等の真核生物に対しては無害である抗酸菌生育阻害剤の候補化合物を高効率でスクリーニングする方法および該方法により得られる抗酸菌生育阻害剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、抗酸菌におけるホスファチジルイノシトールの生合成経路について鋭意検討を行った結果、真核生物におけるそれとは一部異なる反応経路を有することを新たに見いだし、その反応をターゲットとすることにより、真核生物の生理機能に悪影響を与えることなく抗酸菌の生育を選択的に阻害する抗酸菌生育阻害剤の候補化合物を高効率でスクリーニングする方法を完成するに至った。
【0011】
すなわち、本発明は、次の態様に係るものである。
(1) 1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP(シチジン二リン酸)−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応を選択的に阻害する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定する抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
(2) 前記被検化合物の存在下および非存在下で前記反応を触媒する酵素の活性を測定し、それぞれの場合における酵素活性の比から、各被検化合物について前記阻害活性の有無を判定する前記(1)記載の抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
(3) 前記被検化合物による、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合阻害の有無を測定する前記(2)記載の抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
(4) 前記(1)から(3)のいずれかに記載のスクリーニング方法を用いて得られ、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する阻害活性を有する抗酸菌生育阻害剤。
(5) 前記反応を触媒する酵素(PIP合成酵素)の活性を阻害する前記(4)記載の抗酸菌生育阻害剤。
(6) CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合を阻害する前記(5)記載の抗酸菌生育阻害剤。
(7) 抗酸菌生育阻害剤におけるmyo−イノシトールの1−位のヒドロキシル基が、ヒ酸エステル基(−O−As(=O)(OH)2)、硫酸エステル基(−O−S(=O)2−OH)、チオリン酸エステル基(−O−P(=S)(OH)2)、リン酸チオエステル基(−S−P(=O)(OH)2)、ホスホロチオエート基(−O−P(=O)(OH)(OS))、ホスフィン酸基(−P(=O)(OH)2)、および亜ホスホン酸基(−P(OH)2)からなる群より選択される官能基で置換された化合物である前記(4)から(6)のいずれかに記載の抗酸菌生育阻害剤。
【0012】
なお、本発明において「スクリーニング」には、人工的に構築した酵素反応系等のアッセイ系を用いて試験管内(in vitro)で行うスクリーニング、培養細胞等を用いて生体内(in vivo)で行うスクリーニング、および酵素の反応中心や阻害活性を有することが知られている既知の化合物の立体構造等に基づいてコンピュータを用いて(in silico)行われるスクリーニングの全てが含まれる。
また、本発明における「被検化合物群」には、単一の被検化合物のみからなるものも含まれる。
【発明の効果】
【0013】
本発明によれば、ヒト等の真核生物に対しては無害であり、抗酸菌の生育を選択的に阻害する抗酸菌生育阻害剤の候補化合物を高効率でスクリーニングする方法が提供される。 また、本発明によると、ヒト等の真核生物に対しては無害であり、抗酸菌の生育を選択的に阻害する抗酸菌生育阻害剤およびそれを有効成分とする医薬組成物が提供される。
【図面の簡単な説明】
【0014】
【図1】E.smegmatis細胞壁および組換え大腸菌を酵素標品とした酵素反応系における[14C]標識された生成物のTLC(薄層クロマトグラム)である。
【図2】E.smegmatis細胞壁を酵素標品とした酵素反応系におけるPIPおよびPIの濃度の経時変化を示すグラフである。
【発明を実施するための形態】
【0015】
本発明の第1の実施の形態に係る抗酸菌生育阻害剤の候補化合物のスクリーニング方法(以下、「スクリーニング方法」と略称する場合がある。)について説明する。
本実施の形態に係るスクリーニング方法において、1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP(シチジン二リン酸)−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応を選択的に阻害する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定する。
【0016】
従来、抗酸菌におけるホスファチジルイノシトールの生合成経路は、真核生物におけるホスファチジルイノシトールの生合成経路と同様、下記の(1)〜(3)の反応(化1参照)からなると信じられていた(例えば、Salman, M., Lonsdale, J. T., Besra, G. S., and Brennan, P. J., Biochim. Biophys. Acta 1436, 437-450 (1999)参照)。
(1)グルコース6−リン酸 → 1L−myo−イノシトール1−リン酸
(2)1L−myo−イノシトール1−リン酸 →
myo−イノシトール+リン酸
(3)myo−イノシトール+CDP−ジアシルグリセロール →
ホスファチジルイノシトール(PI)+CMP
【0017】
【化1】

【0018】
なお、式中、R1およびR2は、それぞれ飽和または不飽和炭化水素基を表す。生体内において、ジアシルグリセロールはホスファチジン酸を経由して合成されるため、通常、R1は飽和炭化水素基であり、R2は不飽和炭化水素基である。
【0019】
しかしながら、本発明者は、抗酸菌におけるホスファチジルイノシトールの生合成経路について再検討を行った結果、正しくは、下記の(1)、(2’)および(3’)の反応(化2参照)からなることを見いだした。
(1)グルコース6−リン酸 → 1L−myo−イノシトール1−リン酸
(2’)1L−myo−イノシトール1−リン酸+CDP−ジアシルグリセロール → ホスファチジルイノシトールリン酸(PIP)+CMP
(3’)PIP → ホスファチジルイノシトール(PI)+リン酸
【0020】
【化2】

【0021】
上記のうち反応(2’)は、抗酸菌に特有なもので真核生物に存在しないため、これを選択的に阻害することにより、真核生物に何ら悪影響を及ぼすことなく抗酸菌の生育のみを特異的に阻害することが可能となる。また、スクリーニングの対象が上記反応に限定されているため、効率よくスクリーニングを行うことができる。
【0022】
抗酸菌生育阻害剤の標的となる抗酸菌の種類について特に制限はないが、好ましくは、ヒトや動物に対し病原性を有するものであり、その具体例としては、結核菌(Mycobaterium tuberculosis)、らい菌(Mycobacterium leprae)、非結核性抗酸菌(Mycobacterium avium、Mycobacterium kansasii等)が挙げられる。
【0023】
被検化合物群を構成する被検化合物の数についても特に制限はなく、1または複数のいずれであってもよい。被検化合物は、天然に存在するものおよび人工的に合成されたものであってもよく、低分子および高分子(合成高分子、ペプチド、多糖、オリゴヌクレオチド等)のいずれであってもよい。また、被検化合物はランダムに選択されたものであってもよく、コンビナトリアルケミストリー等の手法を用いて系統的に得られる一連の類縁体であってもよい。
【0024】
CDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する阻害様式については、真核生物における生理活性を阻害しない限りにおいて特に制限はなく、例えば、該反応を触媒するPIP合成酵素の阻害、PIP合成酵素をコードする遺伝子の発現阻害のいずれであってもよい。
【0025】
前者の場合において、酵素活性の阻害様式については特に制限はなく、拮抗阻害、非拮抗阻害のいずれであってもよく、例えば、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合を阻害するものであってもよい。
また、後者の場合における遺伝子の発現阻害の様式についても特に制限はなく、siRNAを用いたRNA干渉および他の発現阻害のいずれであってもよい。
【0026】
スクリーニングの方法について特に制限はなく、通常医薬分野において用いられる任意のスクリーニング方法を用いることができる。スクリーニング方法の具体例としては、人工的に構築した酵素反応系等のアッセイ系を用いて試験管内(in vitro)で行うスクリーニング、培養細胞等を用いて生体内(in vivo)で行うスクリーニング、および酵素の反応中心や阻害活性を有することが知られている既知の化合物の立体構造等に基づいてコンピュータを用いて(in silico)行われるスクリーニングが挙げられる。
【0027】
好ましいスクリーニング方法の一例としては、被検化合物の存在下および非存在下で上記の反応(2’)を触媒する酵素(PIP合成酵素)の活性を測定し、それぞれの場合における酵素活性の比から、各被検化合物についてPIP合成酵素に対する阻害活性の有無を判定する方法が挙げられる。
【0028】
上記の反応(2’)を触媒するPIP合成酵素は、抗酸菌に特有なもので、真核生物に存在し、上記の反応(3)を触媒するCDP−ジアシルグリセロール−イノシトール3−ホスファチジルトランスフェラーゼ(EC 2.7.8.11)とは異なるものである。 したがって、上記の反応(2’)を触媒する酵素についての阻害活性の有無に基づいて、抗酸菌生育阻害剤の候補化合物を効率よく選定することが可能となる。
【0029】
被検化合物によるPIP合成酵素の阻害機構に特に制限はなく、酵素・基質複合体に結合して反応の進行を阻害する基質阻害、基質結合部位に競合的に結合して反応開始を妨げる拮抗阻害、酵素または酵素・基質複合体の、基質と別の部位に結合して反応の進行を阻害する非拮抗阻害、酵素・基質複合体のみの、基質と別の部位に結合して反応の進行を阻害する不拮抗阻害、これらのうち任意の2以上の組み合わせにより反応の進行を阻害する混合型阻害のいずれであってもよい。これらのうち特に好ましいのは、被検化合物がPIP合成酵素の基質結合部位に競合的に結合し、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合を阻害する拮抗型阻害である。したがって、本実施の形態に係るスクリーニング方法は、被検化合物による、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合阻害の有無を測定するものであることが好ましい。
【0030】
被検化合物の阻害活性をin vitroでスクリーニングするための評価系(アッセイ系)に用いられるPIP合成酵素は、抗酸菌の菌体から単離精製したものであってもよく、菌体をホモジナイズしたものをそのまま用いてもよく、あるいは、PIP合成酵素をコードする遺伝子を大腸菌等に導入し発現させたものを用いてもよい。
抗酸菌としては、治療対象となる疾患の原因となる抗酸菌を用いてもよいが、M. smegmatis等の病原性を有しない抗酸菌を用いてもよい。
【0031】
酵素活性(反応速度)または被検化合物の阻害活性は、一定時間後に反応液中に含まれる基質濃度または生成物(PIP)濃度により求めることができる。被検化合物の存在下および非存在下にLineweaver-Brukプロットの比較より、被検化合物の阻害機構を判定することもできる。
基質濃度または生成物濃度は、基質にラジオアイソトープを用いた生成物の放射能測定、高速液体クロマトグラフィー等の任意の公知の手段を用いて行うことができる。
【0032】
PIP合成酵素の阻害活性に基づいて、被検化合物が上記式(2’)の反応を阻害する活性を判定する場合、例えば、被検化合物の存在下および非存在下でPIP合成酵素の活性を測定し、それぞれの場合における酵素活性の比、すなわち、後者に対する前者の比が所定の値以下の場合に、被検化合物は上記式(2’)の反応を阻害すると判定し、候補化合物として選定することができる。
【0033】
次に、本発明の第2の実施の形態に係る抗酸菌生育阻害剤について説明する。本発明の第2の実施の形態に係る抗酸菌生育阻害剤は本発明の第1の実施の形態に係るスクリーニング方法を用いて得られ、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する選択的な阻害活性を有する。
【0034】
CDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する阻害様式については、真核生物における生理活性を阻害しない限りにおいて特に制限はなく、PIP合成酵素の阻害、PIP合成酵素をコードする遺伝子の発現阻害のいずれであってもよいが、好ましくは、本実施の形態に係る抗酸菌生育阻害剤は、PIP合成酵素の活性を阻害するものである。
【0035】
PIP合成酵素の阻害機構に特に制限はなく、前述の拮抗阻害、非拮抗阻害、不拮抗阻害、および混合型阻害のいずれであってもよい。しかし、これらのうち特に好ましい抗酸菌生育阻害剤は、PIP合成酵素の基質結合部位に競合的に結合し、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸とPIP合成酵素との結合を阻害する拮抗型阻害によりPIP合成酵素の活性を阻害する化合物である。
【0036】
本実施の形態に係る抗酸菌生育阻害剤の具体例としては、抗酸菌生育阻害剤におけるmyo−イノシトールの1−位のヒドロキシル基が、ヒ酸エステル基(−O−As(=O)(OH)2)、硫酸エステル基(−O−S(=O)2−OH)、チオリン酸エステル基(−O−P(=S)(OH)2)、リン酸チオエステル基(−S−P(=O)(OH)2)、ホスホロチオエート基(−O−P(=O)(OH)(OS))、ホスフィン酸基(−P(=O)(OH)2)、および亜ホスホン酸基(−P(OH)2)からなる群より選択される官能基で置換された化合物、すなわち、下記の式に示す構造を有する化合物が挙げられる。
【0037】
【化3】

【0038】
これらの化合物は、PIP合成酵素の基質の1つであるイノシトール1−リン酸と類似の構造を有しており、いずれも任意の公知の反応を用いて合成することができる。
【実施例】
【0039】
本発明の作用効果を確認するために行った実施例について説明する。本実施例では、抗酸菌類におけるホスファチジルイノシトール(PI)の生合成経路を検証するために、CDP−ジアシルグリセロール、[14C]イノシトール1−リン酸および[3H]イノシトールを基質として抗酸菌の一種であるM. smegmatisおよびM. bovis, BCGに由来する酵素を作用させ、生成物である脂溶性画分に[14C]および[3H]のいずれの放射性ラベルが取り込まれるかについて、液体シンチレーションカウンターによる放射能測定により検討した。これらの基質のうち、[3H]イノシトールについては市販のものを使用した。
【0040】
(1)CDP−ジアシルグリセロールの調製
市販のホスファチジン酸(1,2-Dioleoyl-sn-glycero-3-phosphate)から、CMP-morpholidateを用いてCDP−ジアシルグリセロールを有機合成した。
【0041】
(2)[14C]イノシトール1−リン酸の調製
1L−[14C]イノシトール1−リン酸は市販されていないので、[14C]グルコース6−リン酸からメタン生成古細菌のホモジネートの上清を用いて酵素的に調製した(Morii, H., Kiyonari, S., Ishino, Y., Koga, Y. A novel biosynthetic pathway of archaetidyl-myo-inositol via archaetidyl-myo-inositol 1-phosphate from CDP-archaeol and D-glucose 6-phosphate in methanoarchaeon Methanothermobacter thermautotrophicus cells. J. Biol. Chem. Vol.284, 30766-30774 (2009)参照)。
【0042】
(3)PIP合成酵素の調製
M. smegmatisを培養し、菌体を50mM MOPS緩衝液(pH7.9)、5μM 2−メルカプトエタノールに懸濁し、超音波で破砕してホモジネートを調製し、遠心(27,000×g、15min)した。その沈殿物からPercoll密度勾配遠心により細胞壁画分を得た。上清は超遠心(100,000×g、1h)し、超遠心上清と粗細胞膜標品に分けた。また、ホモジネートの遠心沈殿物を緩衝液で懸濁し、軽く遠心(3,000rpm、10min)して得られる上清(細胞壁を含む)を、PIP合成酵素の標品として使用した。
【0043】
(4)遺伝子組換え操作によるPIP合成酵素の発現
メタン菌のAIP合成酵素とホモロガスな抗酸菌タンパク質の遺伝子AAG17336(M.smegmatis)、NP_856290(M. bovis, BCG)を組み込んだプラスミド(pET21a-AAG17336、pET21a-NP_856290)を構築し、これを大腸菌(E.coli)に導入し、PIP合成酵素を発現させた。
【0044】
(5)酵素活性測定
CDP−ジアシルグリセロールと[14C]イノシトール1−リン酸または[3H]イノシトールに緩衝液を加え、酵素としてM. smegmatisの細胞壁またはPIP合成酵素を発現させたE.coliのホモジネートを加えて反応させた後、有機溶媒可溶性生成物の放射能を測定した。
【0045】
(6)PIP合成酵素活性測定
0.2mM CDP−ジアシルグリセロール、0.1mM [14C]イノシトール1−リン酸(4Ci/mol)(19nmol、2800Bq/アッセイ)、50mM MOPS緩衝液(pH7.9)、5μM 2−メルカプトエタノール、10mM MgCl2、0.4%CHAPS、酵素溶液(タンパク量100μgまたは200μg)(全容量0.2ml)を37℃で1時間反応させた。(脂質基質は[14C]イノシトール1−リン酸と0.4%CHAPSと酵素溶液以外の反応溶液中で室温、20分間超音波処理して懸濁した。)反応後、0.1M HCl/メタノールと1M MgCl2(pH2)を加え、Bligh−Dyer法の比率で水層とクロロホルム層に分画し、クロロホルム可溶性生成物の放射能を測定した。
【0046】
(7)PI合成酵素活性測定
上記のPIP合成酵素活性測定の0.1mM [14C]イノシトール1−リン酸を2.5μM [3H]イノシトール(4Ci/mmol)(0.5nmol、74kBq/アッセイ)に代え、さらに0.1mM ATP、5mMグルコースを反応溶液中に加えて、上記(6)と同様に測定した。
【0047】
(8)生成物の分離
酵素反応生成物をシリカゲルTLCで展開後、IPプレート(富士フイルム製BAS−MS2025またはBAS−TR2025)を用いて放射線強度に比例する蛍光イメージを取得し、イメージングアナライザー(富士フイルム製FLA5000)を用いてPIPとPIの量比を求めた。
【0048】
<結果と考察>
(1)PIP合成酵素活性
M. smegmatisの細胞壁を酵素標品として、[14C]イノシトール1−リン酸と、CDP−ジアシルグリセロールを反応させると、[14C]のラベルが脂質画分に取り込まれた。この生成物をTLCで調べると2つのスポットが検出された(図1のレーン1参照)。Rf値の高いスポットはPIとRf値が一致し、Rf値の低いスポットはイノシトール1−リン酸とCDP−ジアシルグリセロールが反応して生成したホスファチジルイノシトールリン酸(PIP)と考えられる。PIとPIP濃度の経時変化を図2に示した。
【0049】
[14C]PIPをTLCで精製して、M. smegmatisのホモジネートとインキュベートすると[14C]PIが生成した。表1にM. smegmatis細胞壁および組換え大腸菌を用いた場合における、脂質(PIPおよびPI)への[14C]イノシトール1−リン酸および[3H]イノシトールの取り込みについての結果を示す。メタン菌のAIP合成酵素とホモロガスな抗酸菌タンパク質の遺伝子AAG17336(M. smegmatis)とNP_856290 (M. bovis, BCG)を大腸菌で発現させた株を用いて調べると、PIP合成酵素の高い活性が検出された(表1参照)。なお、上記遺伝子を組み込まないプラスミドのみを導入した大腸菌のホモジネートがPIP合成活性を殆ど示さなかったことから、PIP合成酵素は大腸菌およびプラスミドそのものの発現産物に由来するものではないことが確認された。
【0050】
各スポットの放射線強度より求めた各生成物の生成量比は、PIPが95%、PIが5%であった(図1のレーン2、3参照)。M. smegmatisの細胞壁以外の画分、ホモジネートの超遠心上清と粗細胞膜標品のPIP合成活性を表2に示した。
【0051】
【表1】

【0052】
【表2】

【0053】
(2)PI合成酵素活性
M. smegmatisの細胞壁を酵素標品とした場合、[3H]イノシトールの脂質への取り込み活性が観測されたが、その活性は[14C]イノシトール1−リン酸の取り込み活性の約1/1000に過ぎなかった(表2参照)。また、メタン菌のAIP合成酵素とホモロガスな抗酸菌タンパク質の遺伝子AAG17336 (M. smegmatis)、NP_856290 (M. bovis, BCG)を大腸菌で発現させた株を酵素標品として使用した場合、[3H]イノシトールは脂質へほとんど取り込まれなかった(表1参照)。粗細胞壁を酵素とした場合、[3H]ラベルの生成物をTLCで調べると2つのスポットが検出された。Rf値の高いスポットはPIとRf値が一致し、Rf値の低いスポットは、PIP合成酵素活性測定の生成物[14C]PIPとRf値が一致した。活性測定混合物中のATP濃度を10倍の1mMにすると、活性は1.6倍高くなった。しかし、ATPを加えなくても高い活性が検出された。CDP−ジアシルグリセロールを加えなくても活性があった。
【0054】
M. smegmatisの細胞壁による[3H]イノシトールの脂質への取り込み機構は不明である。しかし、その取り込み量は[14C]イノシトール1−リン酸の約1/1000と非常に低いこと、並びに大腸菌の遺伝子組み換え体はイノシトール1−リン酸のみを利用することから、抗酸菌のPIの主要生合成経路は、既に報告されている経路(真核生物と同じ経路)ではなく、古細菌類と同様の中間体(PIP)を経由する経路であると考えられる。
【0055】
以上の結果は、ラジオアイソトープを用いた上記アッセイ系が、抗酸菌におけるPIの合成経路の確認に有効であることのみならず、PIP合成酵素の活性のアッセイにも有用であることを示している。
【特許請求の範囲】
【請求項1】
1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応を選択的に阻害する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定することを特徴とする抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
【請求項2】
前記被検化合物の存在下および非存在下で前記反応を触媒する酵素の活性を測定し、それぞれの場合における酵素活性の比から、各被検化合物について前記阻害活性の有無を判定することを特徴とする請求項1記載のスクリーニング方法。
【請求項3】
前記被検化合物による、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合阻害の有無を測定することを特徴とする請求項2記載のスクリーニング方法。
【請求項4】
請求項1から3のいずれか1項記載のスクリーニング方法を用いて得られ、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する選択的な阻害活性を有することを特徴とする抗酸菌生育阻害剤。
【請求項5】
前記反応を触媒する酵素の活性を阻害することを特徴とする請求項4記載の抗酸菌生育阻害剤。
【請求項6】
CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合を阻害することを特徴とする請求項5記載の抗酸菌生育阻害剤。
【請求項7】
抗酸菌生育阻害剤におけるmyo−イノシトールの1−位のヒドロキシル基が、ヒ酸エステル基(−O−As(=O)(OH)2)、硫酸エステル基(−O−S(=O)2−OH)、チオリン酸エステル基(−O−P(=S)(OH)2)、リン酸チオエステル基(−S−P(=O)(OH)2)、ホスホロチオエート基(−O−P(=O)(OH)(OS))、ホスフィン酸基(−P(=O)(OH)2)、および亜ホスホン酸基(−P(OH)2)からなる群より選択される官能基で置換された化合物であることを特徴とする請求項4から6のいずれか1項記載の抗酸菌生育阻害剤。
【請求項1】
1または複数の被検化合物からなる被検化合物群の中から、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応を選択的に阻害する被検化合物をスクリーニングし、抗酸菌生育阻害剤の候補化合物として選定することを特徴とする抗酸菌生育阻害剤の候補化合物のスクリーニング方法。
【請求項2】
前記被検化合物の存在下および非存在下で前記反応を触媒する酵素の活性を測定し、それぞれの場合における酵素活性の比から、各被検化合物について前記阻害活性の有無を判定することを特徴とする請求項1記載のスクリーニング方法。
【請求項3】
前記被検化合物による、CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合阻害の有無を測定することを特徴とする請求項2記載のスクリーニング方法。
【請求項4】
請求項1から3のいずれか1項記載のスクリーニング方法を用いて得られ、抗酸菌の菌体内においてCDP−ジアシルグリセロールとイノシトール1−リン酸とからホスファチジルイノシトールリン酸(PIP)を合成する反応に対する選択的な阻害活性を有することを特徴とする抗酸菌生育阻害剤。
【請求項5】
前記反応を触媒する酵素の活性を阻害することを特徴とする請求項4記載の抗酸菌生育阻害剤。
【請求項6】
CDP−ジアシルグリセロールおよび/またはイノシトール1−リン酸と前記酵素との結合を阻害することを特徴とする請求項5記載の抗酸菌生育阻害剤。
【請求項7】
抗酸菌生育阻害剤におけるmyo−イノシトールの1−位のヒドロキシル基が、ヒ酸エステル基(−O−As(=O)(OH)2)、硫酸エステル基(−O−S(=O)2−OH)、チオリン酸エステル基(−O−P(=S)(OH)2)、リン酸チオエステル基(−S−P(=O)(OH)2)、ホスホロチオエート基(−O−P(=O)(OH)(OS))、ホスフィン酸基(−P(=O)(OH)2)、および亜ホスホン酸基(−P(OH)2)からなる群より選択される官能基で置換された化合物であることを特徴とする請求項4から6のいずれか1項記載の抗酸菌生育阻害剤。
【図2】


【図1】




【図1】


【公開番号】特開2011−110027(P2011−110027A)
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願番号】特願2009−272247(P2009−272247)
【出願日】平成21年11月30日(2009.11.30)
【出願人】(506087705)学校法人産業医科大学 (24)
【Fターム(参考)】
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願日】平成21年11月30日(2009.11.30)
【出願人】(506087705)学校法人産業医科大学 (24)
【Fターム(参考)】
[ Back to top ]

