抗IL28B抗体及びこれを用いたIL28Bの測定方法
【課題】IL28Bの免疫測定を可能にする新規な手段を提供すること。
【解決手段】インターロイキン28Bと抗原抗体反応により結合し、インターロイキン28Aとは実質的に結合しない抗体又はその抗原結合性断片を作出した。該抗体は、IL28Bのアミノ酸配列中のaa97-136の領域をエピトープとし、120番目のGを特異的に認識する。該抗体と、該抗体とは異なる領域をエピトープとしてIL28Bに結合する抗体とを用いて、IL28Bの免疫測定系を確立した。IL28Bはペグインターフェロン+リバビリン併用療法によるHCV治療効果の予測マーカーとして期待されており、本発明によれば、HCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかが予測可能になる。
【解決手段】インターロイキン28Bと抗原抗体反応により結合し、インターロイキン28Aとは実質的に結合しない抗体又はその抗原結合性断片を作出した。該抗体は、IL28Bのアミノ酸配列中のaa97-136の領域をエピトープとし、120番目のGを特異的に認識する。該抗体と、該抗体とは異なる領域をエピトープとしてIL28Bに結合する抗体とを用いて、IL28Bの免疫測定系を確立した。IL28Bはペグインターフェロン+リバビリン併用療法によるHCV治療効果の予測マーカーとして期待されており、本発明によれば、HCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかが予測可能になる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、インターロイキン28Bに特異的に結合する抗体、及び該抗体を用いたIL28Bの測定方法に関する。
【背景技術】
【0002】
わが国のC型肝炎ウイルス(HCV)感染者は約200万人存在するとされ、我が国における最大の感染症である。HCVは一旦感染すると6〜8割が慢性肝炎に移行し、自然に治ることはほとんどなく、多くは肝硬変・肝癌へと進展し、本邦では年間約2万5千人が肝がんで死亡しているのが現状である。そのHCVの根治治療は、ペグインターフェロン+リバビリン併用療法で根治させることができるようになったが、日本人に最も多いGenotype 1型高ウイルス量の症例では50%程度の根治しか得られず、約20%はペグインターフェロン+リバビリン併用療法が全く効かないのが現状である。ペグインターフェロン+リバビリン併用療法は重い副作用を高頻度に発生し、かつ非常に高価であるため、特に全く効かない患者には負担となっている。
【0003】
ペグインターフェロン+リバビリン併用療法の治療効果とインターロイキン28B (IL28B) 遺伝子多型に強い関連があること、さらに併用治療の効果のなかった患者はIL28B遺伝子発現レベルが有意に低いことが報告されており (非特許文献1)、IL28BはHCV治療効果予測マーカーとして期待されている。しかしながら、IL28B特異的抗体は存在せず、IL28B特異的測定方法およびキットも存在しないのが現状である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4350950号
【非特許文献】
【0005】
【非特許文献1】Nature Genetics, vol. 41, No. 10, 2009, p.1105-1109
【発明の概要】
【発明が解決しようとする課題】
【0006】
従って、本発明は、IL28Bの免疫測定を可能にする新規な手段を提供することにある。
【課題を解決するための手段】
【0007】
本願発明者らは、組換えIL28Bを免疫原とし、抗体スクリーニングに組換えIL28Bと組換えIL28Aを用いてモノクローナル抗体を作製したところ、IL28Bに結合し、IL28Aとは実質的に結合しない抗体を取得することに成功した。得られた抗体のエピトープ解析の結果、IL28Bのアミノ酸配列中のaa97-136の領域をエピトープとし、IL28Bの120番目のG(グリシン)をIL28Aの120番目のV(バリン)に置換したIL28B-G120Vには反応が認められなくなること見出し、該抗体がIL28Aとは異なるアミノ酸であるIL28Bの120番目のGを特異的に認識できることを見出した。さらに、該抗体とIL28Bとの結合には114番目のDと124番目のDも重要であることを見出した。また、該抗体及び該抗体とは異なる領域をエピトープとしてIL28Bに結合する抗体を用いたサンドイッチ免疫測定の方法を確立し、免疫測定キットの提供を可能とすることにより、本願発明を完成した。
【0008】
すなわち、本発明は、インターロイキン28Bと抗原抗体反応により結合し、インターロイキン28Aとは実質的に結合しない抗体又はその抗原結合性断片を提供する。また、本発明は、上記本発明の抗体又はその抗原結合性断片を用いた免疫測定により、試料中のイン
【0009】
ターロイキン28Bを測定することを含む、インターロイキン28Bの測定方法を提供する。さらに、本発明は、上記本発明の抗体又はその抗原結合性断片を含む、インターロイキン28Bの免疫測定キットを提供する。さらに、本発明は、上記本発明の方法によりHCV感染患者から分離した試料中のインターロイキン28Bを測定して、該患者におけるインターロイキン28B発現量を調べ、該発現量を指標としてHCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかを予測することを含む、HCV感染症に対するペグインターフェロン+リバビリン併用療法の治療効果の予測方法を提供する。
【発明の効果】
【0010】
本発明により、IL28BをIL28Aと区別して結合可能な抗体が初めて提供された。本発明の抗体によれば、分泌タンパク質としてわずか7残基の違いしかないIL28AとIL28Bを区別し、IL28Bを特異的に検出・定量することが可能になる。HCV感染症に対するペグインターフェロン+リバビリン併用療法の治療効果とIL28B遺伝子多型に強い関連があることや、該併用治療の効果のなかった患者はIL28B遺伝子発現レベルが有意に低いことが知られており、IL28Bは該併用療法でHCV感染症を治療できるかどうかを事前に予測するマーカーとして期待されている。しかしながら、遺伝子多型解析は煩雑で時間を要し、かつ高価である。本発明によれば、IL28Bを簡便・迅速で安価な免疫測定によって測定可能になるので、HCV感染症の治療現場にも貢献できる。
【図面の簡単な説明】
【0011】
【図1】IL28AとIL28Bのアミノ酸配列のアラインメントを示す。
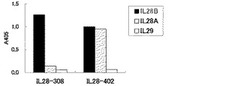
【図2】実施例で作出した2種類のモノクローナル抗体IL28-308及びIL28-402について、固相ELISAによりIL28B、IL28A及びIL29との反応性を調べた結果を示す。
【図3】実施例で確立したサンドイッチELISAにより、IL28B及びIL28Aを測定した結果を示す。
【発明を実施するための形態】
【0012】
上記の通り、本発明の抗体は、インターロイキン28B(IL28B)と抗原抗体反応により結合し、インターロイキン28A(IL28A)とは実質的に結合しないものである。以下、このような結合性を「IL28Bと特異的に結合する」と表現することがある。また、該抗体を「抗IL28B抗体」と呼ぶことがある。
【0013】
ここで、「実質的に結合しない」とは、IL28Aとは検出可能なレベルで結合しない(すなわち、IL28Aとの結合がバックグラウンド以下である)か、又は検出し得るレベルで結合しても、その結合の程度がごく微弱であってIL28Bとの結合よりも明らかに少なく、当業者であればIL28Bとは結合していないと判断する程度にしか結合しないことを意味する。好ましくは、本発明の抗IL28B抗体は、IL28Bとのみ結合し、IL28Aとは検出可能なレベルで結合しない抗体である。例えば、下記実施例では作出した抗体とIL28Aとの結合性をELISAにより調べているが、このような方法で調べた場合にバックグラウンド程度以下のレベルでしか結合を検出できなければ、検出可能なレベルで結合していないと判断することができる。本発明の抗IL28B抗体はまた、IL29とも実質的に結合せず、好ましくは検出可能なレベルで結合しない。
【0014】
IL28A、IL28B及びIL29自体は公知のタンパク質であり、GenBankにもアクセッション番号AY129148、AY129149、AY129150としてそれぞれ登録されている。これらの登録されている配列を配列表の配列番号1〜6に示す。配列番号4に示したIL28Bのアミノ酸配列中、第1番〜第25番アミノ酸(aa1-25)の領域がシグナルペプチドであり、aa26-200の領域が成熟タンパク質として分泌される領域である。
【0015】
【表1】

【0016】
本発明において、任意のアミノ酸残基の位置は、シグナルペプチドを含むIL28Bの全長200残基のアミノ酸配列を基準に示す。例えば、IL28Bの「第120番アミノ酸」とは、配列番号4に示すアミノ酸配列中の120番目のアミノ酸を指す。該残基は、シグナルペプチドを除いた成熟型のIL28BにおいてはN末端から95番目である。
【0017】
IL28Bは、IL28A及びIL29と相同性の高いタンパク質である。特に、IL28BとIL28Aは相同性が非常に高く、両者の間で相違するアミノ酸は、全長200残基中では8残基、分泌タンパク質領域中では7残基である(図1)。本発明の抗体は、このように非常に相同性の高いIL28Aと区別してIL28Bに特異的に結合できる。
【0018】
抗IL28B抗体は、好ましくは、IL28Bのaa97-136の領域内のエピトープと結合する。ここで、「aa97-136の領域内のエピトープ」という表現には、aa97-136の領域の全長から成るエピトープ及びaa97-136の領域内の一部の領域から成るエピトープが包含される。下記実施例で作出された抗IL28B抗体は、IL28Bのaa97-136から成る部分断片に結合し、IL28Aの同領域から成る部分断片には結合しない。また、IL28B及びIL28Aの両者に結合する抗体は、異なる領域をエピトープとすることが確認されている。従って、aa97-136の領域内のいずれかの領域(全長又はその一部)をエピトープとする抗体は、IL28Bに特異的に結合できる抗体である。
【0019】
抗IL28B抗体は、IL28Bのうち特定のアミノ酸残基を認識し得る。「アミノ酸残基を認識する」とは、その残基自身又はその残基により形成される抗原分子表面の部分構造に結合することをいい、IL28B分子表面に表出した該残基に抗IL28B抗体が結合する場合の他、その残基自身は分子構造の内部に位置するが、抗IL28B抗体が結合するIL28B分子表面の部分構造(糖鎖構造等の表面修飾も含む)を定める重要な残基である場合も包含する。
【0020】
例えば、抗IL28B抗体は、IL28Bの第120番アミノ酸を認識する。第120番アミノ酸は、IL28Bではグリシンだが、IL28Aではバリンである。下記実施例で作出された抗IL28B抗体は、IL28Bの第120番アミノ酸をバリンに置換したIL28B変異体には結合せず、その一方、IL28Aの第120番アミノ酸をグリシンに置換したIL28A変異体には結合する。従って、該抗IL28B抗体は、IL28Bの第120番アミノ酸を認識する抗体である。
【0021】
また、抗IL28B抗体は、第120番アミノ酸の他、第114番及び第124番アミノ酸も認識し得る。第114番及び第124番アミノ酸は、IL28BでもIL28Aでもアスパラギン酸で同一であるが、下記実施例の抗IL28B抗体は、これらのアミノ酸残基を置換した場合にも結合できなくなる。従って、これらの残基も抗IL28B抗体のエピトープを構成する重要な残基であり得る。
【0022】
本発明の抗体はポリクローナル抗体でもモノクローナル抗体でもよいが、免疫測定等のためには、再現性の高いモノクローナル抗体が好ましい。
【0023】
本発明の抗IL28B抗体は、例えば、IL28Bの分泌タンパク質領域(配列番号4のaa26-200)を免疫原として用いて、周知のハイブリドーマ法により調製することができる。具体的には、例えば、シグナルペプチドを除いた成熟型のIL28Bを周知の遺伝子工学的手法により調製し、これを免疫原として用いて動物(ヒトを除く)を免疫して、該動物体内で抗体を誘起する。該動物から脾細胞やリンパ球のような抗体産生細胞を回収し、これをミエローマ細胞等の不死化細胞と融合させることにより、ハイブリドーマを作製することができる。IL28BとIL28Aとをスクリーニング抗原として使用し、該ハイブリドーマから、IL28Bと結合しIL28Aとは結合しないハイブリドーマを選択し、これを増殖させて培養上清から抗IL28Bモノクローナル抗体を得ることができる。
【0024】
本発明の抗体から抗原結合性断片を調製することも可能である。「抗原結合性断片」とは、例えば免疫グロブリンのFab断片やF(ab')2断片のような、当該抗体の対応抗原に対する結合性(抗原抗体反応性)を維持している抗体断片を意味する。このような抗原結合性断片も免疫測定に利用可能であることは周知であり、もとの抗体と同様に有用である。Fab断片やF(ab')2断片は、周知の通り、モノクローナル抗体をパパインやペプシンのようなタンパク分解酵素で処理することにより得ることができる。なお、抗原結合性断片は、Fab断片やF(ab')2断片に限定されるものではなく、対応抗原との結合性を維持しているいかなる断片であってもよく、遺伝子工学的手法により調製されたものであってもよい。また、例えば、遺伝子工学的手法により、一本鎖可変領域 (scFv: single chain fragment of variable region) を大腸菌内で発現させた抗体を用いることもできる。scFvの作製方法も周知であり、上記の通りに作製したハイブリドーマのmRNAを抽出し、一本鎖cDNAを調製し、免疫グロブリンH鎖及びL鎖に特異的なプライマーを用いてPCRを行なって免疫グロブリンH鎖遺伝子及びL鎖遺伝子を増幅し、これらをリンカーで連結し、適切な制限酵素部位を付与してプラスミドベクターに導入し、それで大腸菌を形質転換し、大腸菌からscFvを回収することによりscFvを作製することができる。このようなscFvも「抗原結合性断片」として本発明の範囲に包含される。
【0025】
本発明の抗体又はその抗原結合性断片を用いた免疫測定によれば、分泌タンパク質としてわずか7残基の違いしかないIL28AとIL28Bを区別し、IL28Bを特異的に検出・定量することができる。本発明は、抗体又はその抗原結合性断片を用いた免疫測定により、試料中のインターロイキン28Bを測定することを含む、インターロイキン28Bの測定方法も提供する。なお、本発明において、「測定」という語には、検出、定量、半定量が包含される。
【0026】
免疫測定自体はこの分野において周知であり、本発明の測定方法ではいずれを用いても良い。すなわち、免疫測定法を反応形式に基づいて分類すると、サンドイッチ法、競合法、凝集法、ウェスタンブロット法等があり、また、標識に基づいて分類すると、酵素免疫分析、放射免疫分析、蛍光免疫分析等があるが、これらのいずれもが本発明で言う「免疫測定」に包含され、本発明の測定方法に採用することができる。特に限定されないが、具体例を挙げると、免疫沈降、ELISA、免疫染色、イムノクロマトグラフィー等の手法を好ましく採用することができる。医療現場で迅速・簡便にPandemic (H1N1) 2009を検出する観点からは、サンドイッチELISAやイムノクロマトグラフィー等のサンドイッチ法がより好ましい。
【0027】
各免疫測定に必要な試薬類も周知であり、用いる抗体が本発明の抗体又はその抗原結合性断片であること以外は、通常の免疫測定用キットを用いて免疫測定を行なうことができる。すなわち、本発明は、上記した本発明の抗体又はその抗原結合性断片を含む、本発明の測定方法を実施するための測定キットも提供する。抗体又はその抗原結合性断片以外でキットに含まれる試薬類は、公知の通常の免疫測定用キットと同様で良い。
【0028】
試料については何ら限定されず、IL28Bを含有し得る試料であればいかなるものであってもよい。生体から分離した生体由来試料でもよいし、生体に由来しない試料(例えば実験室で遺伝子工学的手法により調製したIL28B試料など)であってもよい。例えば、生体由来の試料としては、血液試料(全血、血漿、血清等)、細胞抽出液、組織試料等が挙げられるが、これらに限定されない。生体は、特に限定されないが、ヒト、イヌ、ネコ、ウサギ、マウス、ハムスター等の哺乳動物である。
【0029】
これらの免疫測定法自体は周知であり、本明細書で説明する必要はないが、簡単に記載すると、例えば、サンドイッチ法では、IL28Bに結合する抗体を固相に不動化し(固相化抗体)、試料と反応させ、洗浄後、固相化抗体とは異なる部位でIL28Bに結合する標識した抗体(標識抗体)を反応させ、洗浄後、固相に結合した標識抗体を測定する。固相化抗体と標識抗体の少なくともいずれか一方にIL28Bと特異的に結合する抗IL28B抗体を用いることで、試料中のIL28BをIL28Aと区別して測定することができる。固相化抗体及び標識抗体は、一方を抗IL28B抗体とし、他方をIL28Aとも結合できる抗IL28A/B抗体としてもよいし、あるいは、互いに異なる部位でIL28B分子に結合する2種の抗IL28B抗体を用いてもよい。抗IL28A/B抗体は、例えば、上述した抗IL28B抗体の作製方法中のハイブリドーマのスクリーニング工程において、IL28AとIL28Bの両者に結合する抗体を産生するハイブリドーマを選択することにより得ることができる。固相化抗体と標識抗体は、いずれもポリクローナル抗体でもモノクローナル抗体でもよいが、測定精度を高める観点からは両者をモノクローナル抗体とすることが好ましい。なお、免疫測定では、抗体に代えて該抗体の抗原結合性断片を用いることもできる。
【0030】
固相化抗体と標識抗体の両者をモノクローナル抗体とする場合、モノクローナル抗体の組み合わせが好ましいかどうかは、実際に免疫測定を行なってみることで容易に調べることができる。所望により、抗体の認識部位の同定を行なって、異なるエピトープを認識するかどうかを調べてもよい。抗体の認識部位の同定は、この分野で周知の常法により行なうことができる。簡潔に説明すると、例えば、対応抗原であるIL28Bタンパク質をトリプシン等のようなタンパク質分解酵素により部分消化し、認識部位を調べるべき抗体を結合させたアフィニティーカラムに部分消化物溶液を通じて消化物を結合させ、次いで結合した消化物を溶出させて常法の質量分析を行なうことにより、抗体の認識部位を同定することができる。
【0031】
HCV感染症はペグインターフェロン+リバビリン併用療法で根治できるが、日本人に最も多いGenotype 1型高ウイルス量の症例では根治率が低く、約20%は該併用療法が全く効かない。近年、該併用療法の効果がなかった患者ではIL28B遺伝子発現レベルが有意に低いことが報告されており (非特許文献1)、IL28BはHCV治療効果予測マーカーとして使用できると考えられる。すなわち、HCV感染患者から分離した試料を本発明の方法に付してIL28Bを測定し、該患者におけるIL28B発現量を調べ、この発現量測定値に基づいて、HCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかを事前に予測することが可能になる。
【0032】
例えば、併用療法が効果的であった既知の患者群についてIL28B発現量を調べて「効果あり基準値」を定めておき、HCV感染患者における測定値をこの効果あり基準値と対比することで、該HCV感染患者の併用治療効果を予測できる。効果あり基準値と有意差があった場合、該患者は上記の併用療法が効果的でないと予測されるので、高価で副作用も多い上記併用療法の適用を事前に避けることができる。効果あり基準値と有意差がなかった場合、該患者は上記の併用療法で根治できる可能性が高いと予測されるので、上記併用療法を積極的に適用する判断の一助となる。効果あり基準値に加え、併用療法の効果がなかった既知の患者群のIL28B発現量の平均値(効果なし基準値)も定めておき、これと測定値とをさらに対比しても良い。
【実施例】
【0033】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0034】
1.抗ヒトIL28Bモノクローナル抗体の作製
免疫原として、組換えヒトIL28B(rIL28B)を用いた。ヒトIL28Bの配列情報(配列番号3)をもとにしてオリゴDNAを組合せたDNA断片から、シグナルペプチドを除いた成熟型IL28BのcDNA(配列番号4中のaa26〜aa200の領域をコードする領域)をPCRにより遺伝子人工合成し、精製後、公知の発現ベクターに組み込んで大腸菌に導入し、発現したrIL28Bをカラムにて回収・精製して得た。これをマウスに免疫し(腹腔内投与、投与量約20μg/匹、免疫回数3〜4回)、常法のハイブリドーマ法により、免疫原に対する抗体を産生するハイブリドーマを作製した。
【0035】
抗体スクリーニングはELISAとWestern blotting(WB)で実施した。スクリーニング抗原としては、バキュロウイルス−昆虫細胞発現系を用いて常法により作製した組換えヒトIL28B及び組換えヒトIL28A(いずれもシグナルペプチドを含まない成熟型、それぞれ配列番号4及び配列番号2中のaa26〜aa200の領域)を使用した。抗原固相ELISAの具体的手順を以下に示す。
【0036】
組換えIL28Bまたは組換えIL28AをPBSで0.5μg/mlに調製し、この溶液を96穴アッセイプレートに50μl/wellずつ加え、37℃で1時間コーティングさせた。PBSTで洗浄後、ハイブリドーマ培養上清を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、POD標識抗マウスIgG抗体を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ABTS基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0037】
組換えヒトIL28Bと反応し、組換えヒトIL28Aには反応しない抗体をスクリーニングしたところ、IL28Bに特異的なモノクローナル抗体が複数ライン得られた。IL28BとIL28Aの両者に結合する抗体も複数得られた。得られた抗体については、WBで反応性を確認した。結果の一部を下記表2に示す。
【0038】
【表2】

【0039】
2.IL28 mAb IL28-308及びIL28-402の交叉反応性試験
組換えIL28B, IL28A, IL29を結合させたアッセイプレートを用いて、抗体の交叉反応性を調べた。組換えIL29はR&D systems社から購入した(#1598-IL-025)。
【0040】
組換えIL28B、組換えIL28A、または組換えIL29をPBSで0.5μg/mlに調製した溶液を96穴アッセイプレートに100μl/wellずつ加え、37℃で1時間コーティングさせた。PBSTで洗浄後、1% skim milk-PBSを250μl/wellずつ加え、37℃で1時間マスキングした。抗体を1%BSA-PBSで200ng/mlに希釈し、100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、POD標識抗マウスIgG抗体を100μl/wellずつ加え、37℃で1時間反応させ、PBSTで洗浄後、ABTS基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0041】
結果を図2に示す。IL28-308はIL28Bに反応し、IL28AおよびIL29には反応しなかった(IL28B特異的抗体)。IL28-402はIL28BおよびIL28Aに反応し、IL29には反応しなかった(IL28特異的抗体)。
【0042】
3.IL28 mAb IL28-308及びIL28-402のエピトープ解析
IL28BとIL28Aの組換えdeletion mutant及びpoint mutantを作製し、上記で得られたIL28-308及びIL28-402についてWBで抗体エピトープを解析した。point mutantは、成熟型のIL28AとIL28Bの間で異なる7アミノ酸をターゲットとして、IL28Bの1残基をIL28A型に、あるいはIL28Aの1残基をIL28B型に置換して作製した。WBの結果を下記表3に示す。
【0043】
【表3】

【0044】
IL28-308は、IL28Bに反応し、IL28Aに反応しなかった。この抗体は、IL28Bのaa97-136の領域に反応し、IL28Aのaa97-136の領域には反応しなかった。IL28Bのaa97-136の領域中でIL28Aと異なるアミノ酸は120番目のグリシンの1残基であり、該残基はIL28Aではバリンである。この残基における点置換変異体との反応性を調べた結果、IL28-308はIL28B G120Vには反応せず、IL28A V120Gに反応した。なお、IL28Bの120番目に相当するIL29のアミノ酸はグルタミンであり、120番目のグリシンはIL28Bに特異的なアミノ酸である。
【0045】
IL28Bの120番目のグリシン以外にIL28Aと異なるアミノ酸は6箇所であり、32番目、74番目、76番目、96番目、137番目、160番目である。これらの箇所においてIL28A型に置換したIL28Bのpoint mutant(IL28B R32A, K74R, R76H, V96M, L137FおよびH160Y)との反応性を調べると、IL28-308はこれら置換変異体とは反応した。
【0046】
これらの結果から、IL28-308はIL28Bのaa97-136の領域内にエピトープを有し、120番目のグリシンを認識することが分かった。
【0047】
一方、IL28-402は、IL28BとIL28Aに反応し、IL28-308とは異なる領域(aa97-136以外の領域)をエピトープとする抗体であることが分かった。
【0048】
4.IL28 mAb IL28-308の詳細エピトープ解析
IL28Bの114番目から125番目の間のアミノ酸残基をアラニンに置換したIL28Bのアラニンpoint mutantを作製し、WBで抗体エピトープをさらに詳細に解析した。WBの結果を下記表4に示す。
【0049】
【表4】

【0050】
IL28-308は、置換変異体G120Vの他、D114A及びD124Aにも反応しなかった。このことから、抗体IL28-308とIL28Bとの結合には120番目のGの他に114番目のDおよび124番目のDも重要であることが分かった。
【0051】
5.IL28 mAb IL28-402のエピトープ解析
IL28Bの組換えdeletion mutantを作製し、WBで抗体エピトープを解析した。結果を表5に示す。
【0052】
【表5】

【0053】
IL28-402は、aa60-200領域とは反応せず、aa26-60領域と反応した。このことから、抗体IL28-402はIL28Bのaa26-60の領域にエピトープを有する抗体であることが分かった。
【0054】
6.サンドイッチELISAによるIL28Bの測定系の確立
取得できた抗体のうち、先行して精製できた抗体をビオチン標識して、各種IL28 mAbとのサンドイッチの組み合わせを検討した。標識抗体として、IL28-308(抗B)、IL28-314(抗B)、IL28-402(抗A/B)の3ラインを用いた。また、固相抗体として、これら3ラインの他にIL28-302(抗B)、307(抗B)、316(抗A/B)を用いた。その結果、標識402は302, 307, 308, 314, 316と、標識308及び標識314は402とサンドイッチが成立することが確認された。
【0055】
次いで、固相IL28-402と標識IL28-308を用いたサンドイッチELISAにより、rIL28BとrIL28Aの測定を行なった。IL28-402を0.1Mクエン酸緩衝液(pH3.5)で10μg/mlに調製し、この溶液を96穴アッセイプレートに100μl/wellずつ加え、37℃で1時間コーティングさせた。1%BSA-PBSでマスキングし、PBSTで洗浄後、rIL28BまたはrIL28Aを段階希釈した抗原溶液を100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ビオチン化IL28-308を100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ストレプトアビジン結合アルカリホスファターゼを100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、p-NPP基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0056】
結果を図3に示す。固相IL28-402と標識IL28-308を用いたサンドイッチELISAは、IL28Bを濃度依存的に測定し、IL28Aとの交叉反応は実質的に認められなかった。IL28B特異的測定方法を確立できたことが確認された。
【技術分野】
【0001】
本発明は、インターロイキン28Bに特異的に結合する抗体、及び該抗体を用いたIL28Bの測定方法に関する。
【背景技術】
【0002】
わが国のC型肝炎ウイルス(HCV)感染者は約200万人存在するとされ、我が国における最大の感染症である。HCVは一旦感染すると6〜8割が慢性肝炎に移行し、自然に治ることはほとんどなく、多くは肝硬変・肝癌へと進展し、本邦では年間約2万5千人が肝がんで死亡しているのが現状である。そのHCVの根治治療は、ペグインターフェロン+リバビリン併用療法で根治させることができるようになったが、日本人に最も多いGenotype 1型高ウイルス量の症例では50%程度の根治しか得られず、約20%はペグインターフェロン+リバビリン併用療法が全く効かないのが現状である。ペグインターフェロン+リバビリン併用療法は重い副作用を高頻度に発生し、かつ非常に高価であるため、特に全く効かない患者には負担となっている。
【0003】
ペグインターフェロン+リバビリン併用療法の治療効果とインターロイキン28B (IL28B) 遺伝子多型に強い関連があること、さらに併用治療の効果のなかった患者はIL28B遺伝子発現レベルが有意に低いことが報告されており (非特許文献1)、IL28BはHCV治療効果予測マーカーとして期待されている。しかしながら、IL28B特異的抗体は存在せず、IL28B特異的測定方法およびキットも存在しないのが現状である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4350950号
【非特許文献】
【0005】
【非特許文献1】Nature Genetics, vol. 41, No. 10, 2009, p.1105-1109
【発明の概要】
【発明が解決しようとする課題】
【0006】
従って、本発明は、IL28Bの免疫測定を可能にする新規な手段を提供することにある。
【課題を解決するための手段】
【0007】
本願発明者らは、組換えIL28Bを免疫原とし、抗体スクリーニングに組換えIL28Bと組換えIL28Aを用いてモノクローナル抗体を作製したところ、IL28Bに結合し、IL28Aとは実質的に結合しない抗体を取得することに成功した。得られた抗体のエピトープ解析の結果、IL28Bのアミノ酸配列中のaa97-136の領域をエピトープとし、IL28Bの120番目のG(グリシン)をIL28Aの120番目のV(バリン)に置換したIL28B-G120Vには反応が認められなくなること見出し、該抗体がIL28Aとは異なるアミノ酸であるIL28Bの120番目のGを特異的に認識できることを見出した。さらに、該抗体とIL28Bとの結合には114番目のDと124番目のDも重要であることを見出した。また、該抗体及び該抗体とは異なる領域をエピトープとしてIL28Bに結合する抗体を用いたサンドイッチ免疫測定の方法を確立し、免疫測定キットの提供を可能とすることにより、本願発明を完成した。
【0008】
すなわち、本発明は、インターロイキン28Bと抗原抗体反応により結合し、インターロイキン28Aとは実質的に結合しない抗体又はその抗原結合性断片を提供する。また、本発明は、上記本発明の抗体又はその抗原結合性断片を用いた免疫測定により、試料中のイン
【0009】
ターロイキン28Bを測定することを含む、インターロイキン28Bの測定方法を提供する。さらに、本発明は、上記本発明の抗体又はその抗原結合性断片を含む、インターロイキン28Bの免疫測定キットを提供する。さらに、本発明は、上記本発明の方法によりHCV感染患者から分離した試料中のインターロイキン28Bを測定して、該患者におけるインターロイキン28B発現量を調べ、該発現量を指標としてHCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかを予測することを含む、HCV感染症に対するペグインターフェロン+リバビリン併用療法の治療効果の予測方法を提供する。
【発明の効果】
【0010】
本発明により、IL28BをIL28Aと区別して結合可能な抗体が初めて提供された。本発明の抗体によれば、分泌タンパク質としてわずか7残基の違いしかないIL28AとIL28Bを区別し、IL28Bを特異的に検出・定量することが可能になる。HCV感染症に対するペグインターフェロン+リバビリン併用療法の治療効果とIL28B遺伝子多型に強い関連があることや、該併用治療の効果のなかった患者はIL28B遺伝子発現レベルが有意に低いことが知られており、IL28Bは該併用療法でHCV感染症を治療できるかどうかを事前に予測するマーカーとして期待されている。しかしながら、遺伝子多型解析は煩雑で時間を要し、かつ高価である。本発明によれば、IL28Bを簡便・迅速で安価な免疫測定によって測定可能になるので、HCV感染症の治療現場にも貢献できる。
【図面の簡単な説明】
【0011】
【図1】IL28AとIL28Bのアミノ酸配列のアラインメントを示す。
【図2】実施例で作出した2種類のモノクローナル抗体IL28-308及びIL28-402について、固相ELISAによりIL28B、IL28A及びIL29との反応性を調べた結果を示す。
【図3】実施例で確立したサンドイッチELISAにより、IL28B及びIL28Aを測定した結果を示す。
【発明を実施するための形態】
【0012】
上記の通り、本発明の抗体は、インターロイキン28B(IL28B)と抗原抗体反応により結合し、インターロイキン28A(IL28A)とは実質的に結合しないものである。以下、このような結合性を「IL28Bと特異的に結合する」と表現することがある。また、該抗体を「抗IL28B抗体」と呼ぶことがある。
【0013】
ここで、「実質的に結合しない」とは、IL28Aとは検出可能なレベルで結合しない(すなわち、IL28Aとの結合がバックグラウンド以下である)か、又は検出し得るレベルで結合しても、その結合の程度がごく微弱であってIL28Bとの結合よりも明らかに少なく、当業者であればIL28Bとは結合していないと判断する程度にしか結合しないことを意味する。好ましくは、本発明の抗IL28B抗体は、IL28Bとのみ結合し、IL28Aとは検出可能なレベルで結合しない抗体である。例えば、下記実施例では作出した抗体とIL28Aとの結合性をELISAにより調べているが、このような方法で調べた場合にバックグラウンド程度以下のレベルでしか結合を検出できなければ、検出可能なレベルで結合していないと判断することができる。本発明の抗IL28B抗体はまた、IL29とも実質的に結合せず、好ましくは検出可能なレベルで結合しない。
【0014】
IL28A、IL28B及びIL29自体は公知のタンパク質であり、GenBankにもアクセッション番号AY129148、AY129149、AY129150としてそれぞれ登録されている。これらの登録されている配列を配列表の配列番号1〜6に示す。配列番号4に示したIL28Bのアミノ酸配列中、第1番〜第25番アミノ酸(aa1-25)の領域がシグナルペプチドであり、aa26-200の領域が成熟タンパク質として分泌される領域である。
【0015】
【表1】

【0016】
本発明において、任意のアミノ酸残基の位置は、シグナルペプチドを含むIL28Bの全長200残基のアミノ酸配列を基準に示す。例えば、IL28Bの「第120番アミノ酸」とは、配列番号4に示すアミノ酸配列中の120番目のアミノ酸を指す。該残基は、シグナルペプチドを除いた成熟型のIL28BにおいてはN末端から95番目である。
【0017】
IL28Bは、IL28A及びIL29と相同性の高いタンパク質である。特に、IL28BとIL28Aは相同性が非常に高く、両者の間で相違するアミノ酸は、全長200残基中では8残基、分泌タンパク質領域中では7残基である(図1)。本発明の抗体は、このように非常に相同性の高いIL28Aと区別してIL28Bに特異的に結合できる。
【0018】
抗IL28B抗体は、好ましくは、IL28Bのaa97-136の領域内のエピトープと結合する。ここで、「aa97-136の領域内のエピトープ」という表現には、aa97-136の領域の全長から成るエピトープ及びaa97-136の領域内の一部の領域から成るエピトープが包含される。下記実施例で作出された抗IL28B抗体は、IL28Bのaa97-136から成る部分断片に結合し、IL28Aの同領域から成る部分断片には結合しない。また、IL28B及びIL28Aの両者に結合する抗体は、異なる領域をエピトープとすることが確認されている。従って、aa97-136の領域内のいずれかの領域(全長又はその一部)をエピトープとする抗体は、IL28Bに特異的に結合できる抗体である。
【0019】
抗IL28B抗体は、IL28Bのうち特定のアミノ酸残基を認識し得る。「アミノ酸残基を認識する」とは、その残基自身又はその残基により形成される抗原分子表面の部分構造に結合することをいい、IL28B分子表面に表出した該残基に抗IL28B抗体が結合する場合の他、その残基自身は分子構造の内部に位置するが、抗IL28B抗体が結合するIL28B分子表面の部分構造(糖鎖構造等の表面修飾も含む)を定める重要な残基である場合も包含する。
【0020】
例えば、抗IL28B抗体は、IL28Bの第120番アミノ酸を認識する。第120番アミノ酸は、IL28Bではグリシンだが、IL28Aではバリンである。下記実施例で作出された抗IL28B抗体は、IL28Bの第120番アミノ酸をバリンに置換したIL28B変異体には結合せず、その一方、IL28Aの第120番アミノ酸をグリシンに置換したIL28A変異体には結合する。従って、該抗IL28B抗体は、IL28Bの第120番アミノ酸を認識する抗体である。
【0021】
また、抗IL28B抗体は、第120番アミノ酸の他、第114番及び第124番アミノ酸も認識し得る。第114番及び第124番アミノ酸は、IL28BでもIL28Aでもアスパラギン酸で同一であるが、下記実施例の抗IL28B抗体は、これらのアミノ酸残基を置換した場合にも結合できなくなる。従って、これらの残基も抗IL28B抗体のエピトープを構成する重要な残基であり得る。
【0022】
本発明の抗体はポリクローナル抗体でもモノクローナル抗体でもよいが、免疫測定等のためには、再現性の高いモノクローナル抗体が好ましい。
【0023】
本発明の抗IL28B抗体は、例えば、IL28Bの分泌タンパク質領域(配列番号4のaa26-200)を免疫原として用いて、周知のハイブリドーマ法により調製することができる。具体的には、例えば、シグナルペプチドを除いた成熟型のIL28Bを周知の遺伝子工学的手法により調製し、これを免疫原として用いて動物(ヒトを除く)を免疫して、該動物体内で抗体を誘起する。該動物から脾細胞やリンパ球のような抗体産生細胞を回収し、これをミエローマ細胞等の不死化細胞と融合させることにより、ハイブリドーマを作製することができる。IL28BとIL28Aとをスクリーニング抗原として使用し、該ハイブリドーマから、IL28Bと結合しIL28Aとは結合しないハイブリドーマを選択し、これを増殖させて培養上清から抗IL28Bモノクローナル抗体を得ることができる。
【0024】
本発明の抗体から抗原結合性断片を調製することも可能である。「抗原結合性断片」とは、例えば免疫グロブリンのFab断片やF(ab')2断片のような、当該抗体の対応抗原に対する結合性(抗原抗体反応性)を維持している抗体断片を意味する。このような抗原結合性断片も免疫測定に利用可能であることは周知であり、もとの抗体と同様に有用である。Fab断片やF(ab')2断片は、周知の通り、モノクローナル抗体をパパインやペプシンのようなタンパク分解酵素で処理することにより得ることができる。なお、抗原結合性断片は、Fab断片やF(ab')2断片に限定されるものではなく、対応抗原との結合性を維持しているいかなる断片であってもよく、遺伝子工学的手法により調製されたものであってもよい。また、例えば、遺伝子工学的手法により、一本鎖可変領域 (scFv: single chain fragment of variable region) を大腸菌内で発現させた抗体を用いることもできる。scFvの作製方法も周知であり、上記の通りに作製したハイブリドーマのmRNAを抽出し、一本鎖cDNAを調製し、免疫グロブリンH鎖及びL鎖に特異的なプライマーを用いてPCRを行なって免疫グロブリンH鎖遺伝子及びL鎖遺伝子を増幅し、これらをリンカーで連結し、適切な制限酵素部位を付与してプラスミドベクターに導入し、それで大腸菌を形質転換し、大腸菌からscFvを回収することによりscFvを作製することができる。このようなscFvも「抗原結合性断片」として本発明の範囲に包含される。
【0025】
本発明の抗体又はその抗原結合性断片を用いた免疫測定によれば、分泌タンパク質としてわずか7残基の違いしかないIL28AとIL28Bを区別し、IL28Bを特異的に検出・定量することができる。本発明は、抗体又はその抗原結合性断片を用いた免疫測定により、試料中のインターロイキン28Bを測定することを含む、インターロイキン28Bの測定方法も提供する。なお、本発明において、「測定」という語には、検出、定量、半定量が包含される。
【0026】
免疫測定自体はこの分野において周知であり、本発明の測定方法ではいずれを用いても良い。すなわち、免疫測定法を反応形式に基づいて分類すると、サンドイッチ法、競合法、凝集法、ウェスタンブロット法等があり、また、標識に基づいて分類すると、酵素免疫分析、放射免疫分析、蛍光免疫分析等があるが、これらのいずれもが本発明で言う「免疫測定」に包含され、本発明の測定方法に採用することができる。特に限定されないが、具体例を挙げると、免疫沈降、ELISA、免疫染色、イムノクロマトグラフィー等の手法を好ましく採用することができる。医療現場で迅速・簡便にPandemic (H1N1) 2009を検出する観点からは、サンドイッチELISAやイムノクロマトグラフィー等のサンドイッチ法がより好ましい。
【0027】
各免疫測定に必要な試薬類も周知であり、用いる抗体が本発明の抗体又はその抗原結合性断片であること以外は、通常の免疫測定用キットを用いて免疫測定を行なうことができる。すなわち、本発明は、上記した本発明の抗体又はその抗原結合性断片を含む、本発明の測定方法を実施するための測定キットも提供する。抗体又はその抗原結合性断片以外でキットに含まれる試薬類は、公知の通常の免疫測定用キットと同様で良い。
【0028】
試料については何ら限定されず、IL28Bを含有し得る試料であればいかなるものであってもよい。生体から分離した生体由来試料でもよいし、生体に由来しない試料(例えば実験室で遺伝子工学的手法により調製したIL28B試料など)であってもよい。例えば、生体由来の試料としては、血液試料(全血、血漿、血清等)、細胞抽出液、組織試料等が挙げられるが、これらに限定されない。生体は、特に限定されないが、ヒト、イヌ、ネコ、ウサギ、マウス、ハムスター等の哺乳動物である。
【0029】
これらの免疫測定法自体は周知であり、本明細書で説明する必要はないが、簡単に記載すると、例えば、サンドイッチ法では、IL28Bに結合する抗体を固相に不動化し(固相化抗体)、試料と反応させ、洗浄後、固相化抗体とは異なる部位でIL28Bに結合する標識した抗体(標識抗体)を反応させ、洗浄後、固相に結合した標識抗体を測定する。固相化抗体と標識抗体の少なくともいずれか一方にIL28Bと特異的に結合する抗IL28B抗体を用いることで、試料中のIL28BをIL28Aと区別して測定することができる。固相化抗体及び標識抗体は、一方を抗IL28B抗体とし、他方をIL28Aとも結合できる抗IL28A/B抗体としてもよいし、あるいは、互いに異なる部位でIL28B分子に結合する2種の抗IL28B抗体を用いてもよい。抗IL28A/B抗体は、例えば、上述した抗IL28B抗体の作製方法中のハイブリドーマのスクリーニング工程において、IL28AとIL28Bの両者に結合する抗体を産生するハイブリドーマを選択することにより得ることができる。固相化抗体と標識抗体は、いずれもポリクローナル抗体でもモノクローナル抗体でもよいが、測定精度を高める観点からは両者をモノクローナル抗体とすることが好ましい。なお、免疫測定では、抗体に代えて該抗体の抗原結合性断片を用いることもできる。
【0030】
固相化抗体と標識抗体の両者をモノクローナル抗体とする場合、モノクローナル抗体の組み合わせが好ましいかどうかは、実際に免疫測定を行なってみることで容易に調べることができる。所望により、抗体の認識部位の同定を行なって、異なるエピトープを認識するかどうかを調べてもよい。抗体の認識部位の同定は、この分野で周知の常法により行なうことができる。簡潔に説明すると、例えば、対応抗原であるIL28Bタンパク質をトリプシン等のようなタンパク質分解酵素により部分消化し、認識部位を調べるべき抗体を結合させたアフィニティーカラムに部分消化物溶液を通じて消化物を結合させ、次いで結合した消化物を溶出させて常法の質量分析を行なうことにより、抗体の認識部位を同定することができる。
【0031】
HCV感染症はペグインターフェロン+リバビリン併用療法で根治できるが、日本人に最も多いGenotype 1型高ウイルス量の症例では根治率が低く、約20%は該併用療法が全く効かない。近年、該併用療法の効果がなかった患者ではIL28B遺伝子発現レベルが有意に低いことが報告されており (非特許文献1)、IL28BはHCV治療効果予測マーカーとして使用できると考えられる。すなわち、HCV感染患者から分離した試料を本発明の方法に付してIL28Bを測定し、該患者におけるIL28B発現量を調べ、この発現量測定値に基づいて、HCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかを事前に予測することが可能になる。
【0032】
例えば、併用療法が効果的であった既知の患者群についてIL28B発現量を調べて「効果あり基準値」を定めておき、HCV感染患者における測定値をこの効果あり基準値と対比することで、該HCV感染患者の併用治療効果を予測できる。効果あり基準値と有意差があった場合、該患者は上記の併用療法が効果的でないと予測されるので、高価で副作用も多い上記併用療法の適用を事前に避けることができる。効果あり基準値と有意差がなかった場合、該患者は上記の併用療法で根治できる可能性が高いと予測されるので、上記併用療法を積極的に適用する判断の一助となる。効果あり基準値に加え、併用療法の効果がなかった既知の患者群のIL28B発現量の平均値(効果なし基準値)も定めておき、これと測定値とをさらに対比しても良い。
【実施例】
【0033】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0034】
1.抗ヒトIL28Bモノクローナル抗体の作製
免疫原として、組換えヒトIL28B(rIL28B)を用いた。ヒトIL28Bの配列情報(配列番号3)をもとにしてオリゴDNAを組合せたDNA断片から、シグナルペプチドを除いた成熟型IL28BのcDNA(配列番号4中のaa26〜aa200の領域をコードする領域)をPCRにより遺伝子人工合成し、精製後、公知の発現ベクターに組み込んで大腸菌に導入し、発現したrIL28Bをカラムにて回収・精製して得た。これをマウスに免疫し(腹腔内投与、投与量約20μg/匹、免疫回数3〜4回)、常法のハイブリドーマ法により、免疫原に対する抗体を産生するハイブリドーマを作製した。
【0035】
抗体スクリーニングはELISAとWestern blotting(WB)で実施した。スクリーニング抗原としては、バキュロウイルス−昆虫細胞発現系を用いて常法により作製した組換えヒトIL28B及び組換えヒトIL28A(いずれもシグナルペプチドを含まない成熟型、それぞれ配列番号4及び配列番号2中のaa26〜aa200の領域)を使用した。抗原固相ELISAの具体的手順を以下に示す。
【0036】
組換えIL28Bまたは組換えIL28AをPBSで0.5μg/mlに調製し、この溶液を96穴アッセイプレートに50μl/wellずつ加え、37℃で1時間コーティングさせた。PBSTで洗浄後、ハイブリドーマ培養上清を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、POD標識抗マウスIgG抗体を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ABTS基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0037】
組換えヒトIL28Bと反応し、組換えヒトIL28Aには反応しない抗体をスクリーニングしたところ、IL28Bに特異的なモノクローナル抗体が複数ライン得られた。IL28BとIL28Aの両者に結合する抗体も複数得られた。得られた抗体については、WBで反応性を確認した。結果の一部を下記表2に示す。
【0038】
【表2】

【0039】
2.IL28 mAb IL28-308及びIL28-402の交叉反応性試験
組換えIL28B, IL28A, IL29を結合させたアッセイプレートを用いて、抗体の交叉反応性を調べた。組換えIL29はR&D systems社から購入した(#1598-IL-025)。
【0040】
組換えIL28B、組換えIL28A、または組換えIL29をPBSで0.5μg/mlに調製した溶液を96穴アッセイプレートに100μl/wellずつ加え、37℃で1時間コーティングさせた。PBSTで洗浄後、1% skim milk-PBSを250μl/wellずつ加え、37℃で1時間マスキングした。抗体を1%BSA-PBSで200ng/mlに希釈し、100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、POD標識抗マウスIgG抗体を100μl/wellずつ加え、37℃で1時間反応させ、PBSTで洗浄後、ABTS基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0041】
結果を図2に示す。IL28-308はIL28Bに反応し、IL28AおよびIL29には反応しなかった(IL28B特異的抗体)。IL28-402はIL28BおよびIL28Aに反応し、IL29には反応しなかった(IL28特異的抗体)。
【0042】
3.IL28 mAb IL28-308及びIL28-402のエピトープ解析
IL28BとIL28Aの組換えdeletion mutant及びpoint mutantを作製し、上記で得られたIL28-308及びIL28-402についてWBで抗体エピトープを解析した。point mutantは、成熟型のIL28AとIL28Bの間で異なる7アミノ酸をターゲットとして、IL28Bの1残基をIL28A型に、あるいはIL28Aの1残基をIL28B型に置換して作製した。WBの結果を下記表3に示す。
【0043】
【表3】

【0044】
IL28-308は、IL28Bに反応し、IL28Aに反応しなかった。この抗体は、IL28Bのaa97-136の領域に反応し、IL28Aのaa97-136の領域には反応しなかった。IL28Bのaa97-136の領域中でIL28Aと異なるアミノ酸は120番目のグリシンの1残基であり、該残基はIL28Aではバリンである。この残基における点置換変異体との反応性を調べた結果、IL28-308はIL28B G120Vには反応せず、IL28A V120Gに反応した。なお、IL28Bの120番目に相当するIL29のアミノ酸はグルタミンであり、120番目のグリシンはIL28Bに特異的なアミノ酸である。
【0045】
IL28Bの120番目のグリシン以外にIL28Aと異なるアミノ酸は6箇所であり、32番目、74番目、76番目、96番目、137番目、160番目である。これらの箇所においてIL28A型に置換したIL28Bのpoint mutant(IL28B R32A, K74R, R76H, V96M, L137FおよびH160Y)との反応性を調べると、IL28-308はこれら置換変異体とは反応した。
【0046】
これらの結果から、IL28-308はIL28Bのaa97-136の領域内にエピトープを有し、120番目のグリシンを認識することが分かった。
【0047】
一方、IL28-402は、IL28BとIL28Aに反応し、IL28-308とは異なる領域(aa97-136以外の領域)をエピトープとする抗体であることが分かった。
【0048】
4.IL28 mAb IL28-308の詳細エピトープ解析
IL28Bの114番目から125番目の間のアミノ酸残基をアラニンに置換したIL28Bのアラニンpoint mutantを作製し、WBで抗体エピトープをさらに詳細に解析した。WBの結果を下記表4に示す。
【0049】
【表4】

【0050】
IL28-308は、置換変異体G120Vの他、D114A及びD124Aにも反応しなかった。このことから、抗体IL28-308とIL28Bとの結合には120番目のGの他に114番目のDおよび124番目のDも重要であることが分かった。
【0051】
5.IL28 mAb IL28-402のエピトープ解析
IL28Bの組換えdeletion mutantを作製し、WBで抗体エピトープを解析した。結果を表5に示す。
【0052】
【表5】

【0053】
IL28-402は、aa60-200領域とは反応せず、aa26-60領域と反応した。このことから、抗体IL28-402はIL28Bのaa26-60の領域にエピトープを有する抗体であることが分かった。
【0054】
6.サンドイッチELISAによるIL28Bの測定系の確立
取得できた抗体のうち、先行して精製できた抗体をビオチン標識して、各種IL28 mAbとのサンドイッチの組み合わせを検討した。標識抗体として、IL28-308(抗B)、IL28-314(抗B)、IL28-402(抗A/B)の3ラインを用いた。また、固相抗体として、これら3ラインの他にIL28-302(抗B)、307(抗B)、316(抗A/B)を用いた。その結果、標識402は302, 307, 308, 314, 316と、標識308及び標識314は402とサンドイッチが成立することが確認された。
【0055】
次いで、固相IL28-402と標識IL28-308を用いたサンドイッチELISAにより、rIL28BとrIL28Aの測定を行なった。IL28-402を0.1Mクエン酸緩衝液(pH3.5)で10μg/mlに調製し、この溶液を96穴アッセイプレートに100μl/wellずつ加え、37℃で1時間コーティングさせた。1%BSA-PBSでマスキングし、PBSTで洗浄後、rIL28BまたはrIL28Aを段階希釈した抗原溶液を100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ビオチン化IL28-308を100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ストレプトアビジン結合アルカリホスファターゼを100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、p-NPP基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0056】
結果を図3に示す。固相IL28-402と標識IL28-308を用いたサンドイッチELISAは、IL28Bを濃度依存的に測定し、IL28Aとの交叉反応は実質的に認められなかった。IL28B特異的測定方法を確立できたことが確認された。
【特許請求の範囲】
【請求項1】
インターロイキン28Bと抗原抗体反応により結合し、インターロイキン28Aとは実質的に結合しない抗体又はその抗原結合性断片。
【請求項2】
インターロイキン29と実質的に結合しない請求項1記載の抗体又はその抗原結合性断片。
【請求項3】
インターロイキン28Bの第97番〜第136番アミノ酸の領域内のエピトープに結合する請求項1又は2記載の抗体又はその抗原結合性断片。
【請求項4】
インターロイキン28Bの第120番アミノ酸を認識する請求項3記載の抗体又はその抗原結合性断片。
【請求項5】
インターロイキン28Bの第114番及び第124番アミノ酸をさらに認識する請求項4記載の抗体又はその抗原結合性断片。
【請求項6】
第120番アミノ酸をグリシンに置換したインターロイキン28A変異体と結合し、第120番アミノ酸をバリンに置換したインターロイキン28B変異体とは結合しない請求項4記載の抗体又はその抗原結合性断片。
【請求項7】
前記抗体がモノクローナル抗体である請求項1ないし6のいずれか1項に記載の抗体又はその抗原結合性断片。
【請求項8】
請求項1ないし7のいずれか1項に記載の抗体又はその抗原結合性断片を用いた免疫測定により、試料中のインターロイキン28Bを測定することを含む、インターロイキン28Bの測定方法。
【請求項9】
前記免疫測定は、固相に固定化された固相化抗体と標識された標識抗体とを用いたサンドイッチ法により行なわれ、請求項1ないし7のいずれか1項に記載の抗体又はその抗原結合性断片が固相化抗体及び標識抗体の少なくともいずれか一方に用いられる請求項8記載の方法。
【請求項10】
請求項1ないし7のいずれか1項に記載の抗体又はその抗原結合性断片を含む、インターロイキン28Bの免疫測定キット。
【請求項11】
前記抗体又はその抗原結合性断片が、固相に固定化された固相化抗体及び標識された標識抗体の少なくともいずれか一方の形態で含まれる請求項10記載のキット。
【請求項12】
請求項8又は9記載の方法により、HCV感染患者から分離した試料中のインターロイキン28Bを測定してインターロイキン28B発現量を調べ、該発現量を指標としてHCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかを予測することを含む、HCV感染症に対するペグインターフェロン+リバビリン併用療法の治療効果の予測方法。
【請求項1】
インターロイキン28Bと抗原抗体反応により結合し、インターロイキン28Aとは実質的に結合しない抗体又はその抗原結合性断片。
【請求項2】
インターロイキン29と実質的に結合しない請求項1記載の抗体又はその抗原結合性断片。
【請求項3】
インターロイキン28Bの第97番〜第136番アミノ酸の領域内のエピトープに結合する請求項1又は2記載の抗体又はその抗原結合性断片。
【請求項4】
インターロイキン28Bの第120番アミノ酸を認識する請求項3記載の抗体又はその抗原結合性断片。
【請求項5】
インターロイキン28Bの第114番及び第124番アミノ酸をさらに認識する請求項4記載の抗体又はその抗原結合性断片。
【請求項6】
第120番アミノ酸をグリシンに置換したインターロイキン28A変異体と結合し、第120番アミノ酸をバリンに置換したインターロイキン28B変異体とは結合しない請求項4記載の抗体又はその抗原結合性断片。
【請求項7】
前記抗体がモノクローナル抗体である請求項1ないし6のいずれか1項に記載の抗体又はその抗原結合性断片。
【請求項8】
請求項1ないし7のいずれか1項に記載の抗体又はその抗原結合性断片を用いた免疫測定により、試料中のインターロイキン28Bを測定することを含む、インターロイキン28Bの測定方法。
【請求項9】
前記免疫測定は、固相に固定化された固相化抗体と標識された標識抗体とを用いたサンドイッチ法により行なわれ、請求項1ないし7のいずれか1項に記載の抗体又はその抗原結合性断片が固相化抗体及び標識抗体の少なくともいずれか一方に用いられる請求項8記載の方法。
【請求項10】
請求項1ないし7のいずれか1項に記載の抗体又はその抗原結合性断片を含む、インターロイキン28Bの免疫測定キット。
【請求項11】
前記抗体又はその抗原結合性断片が、固相に固定化された固相化抗体及び標識された標識抗体の少なくともいずれか一方の形態で含まれる請求項10記載のキット。
【請求項12】
請求項8又は9記載の方法により、HCV感染患者から分離した試料中のインターロイキン28Bを測定してインターロイキン28B発現量を調べ、該発現量を指標としてHCV感染患者がペグインターフェロン+リバビリン併用療法で治療できるかどうかを予測することを含む、HCV感染症に対するペグインターフェロン+リバビリン併用療法の治療効果の予測方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−153664(P2012−153664A)
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願番号】特願2011−15176(P2011−15176)
【出願日】平成23年1月27日(2011.1.27)
【出願人】(306008724)富士レビオ株式会社 (55)
【Fターム(参考)】
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願日】平成23年1月27日(2011.1.27)
【出願人】(306008724)富士レビオ株式会社 (55)
【Fターム(参考)】
[ Back to top ]

