抗NP−H289抗体及びそれを用いた免疫測定方法
【課題】Pandemic (H1N1) 2009を他のヒトA型インフルエンザウイルスと区別して簡便かつ迅速に検出可能な手段を提供すること。
【解決手段】A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質と抗原抗体反応により結合し、第289番アミノ酸がチロシンである核タンパク質とは実質的に結合しない抗体又はその抗原結合性断片を提供した。Pandemic (H1N1) 2009以外のA型インフルエンザウイルスではほとんど全ての株において第289番アミノ酸がチロシンであり、これがヒスチジンとなる変異はPandemic (H1N1) 2009に特徴的な変異である。従って、本発明の抗体又はその抗原結合性断片によれば、Pandemic (H1N1) 2009を他のA型インフルエンザウイルスと区別して簡便迅速に検出できる。
【解決手段】A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質と抗原抗体反応により結合し、第289番アミノ酸がチロシンである核タンパク質とは実質的に結合しない抗体又はその抗原結合性断片を提供した。Pandemic (H1N1) 2009以外のA型インフルエンザウイルスではほとんど全ての株において第289番アミノ酸がチロシンであり、これがヒスチジンとなる変異はPandemic (H1N1) 2009に特徴的な変異である。従って、本発明の抗体又はその抗原結合性断片によれば、Pandemic (H1N1) 2009を他のA型インフルエンザウイルスと区別して簡便迅速に検出できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、A型インフルエンザウイルスの核タンパク質のうち第289番アミノ酸がヒスチジンである核タンパク質に特異的に結合する抗体又はその抗原結合性断片、及び該抗体又はその抗原結合性断片を用いた免疫測定方法に関する。
【背景技術】
【0002】
2009年4月、世界保健機構(WHO)は、これまでにヒトで感染の報告がない新型のインフルエンザウイルスの発生を確認した。この新型インフルエンザウイルスは、ブタに由来する抗原型H1N1のA型インフルエンザウイルスであり、短期間のうちに全世界に蔓延して大流行を引き起こしている。WHOでは現在この新型インフルエンザウイルスを「Pandemic (H1N1) 2009」と呼んでいる。日本においては一般に「新型インフルエンザウイルス」と呼ばれている。
【0003】
現在市販されているインフルエンザウイルス検出のための簡易キットは、核タンパク質(NP)に対する抗体を利用しているものが多いが、これらはA型共通に反応する。新型インフルエンザウイルスはA型であるから、市販の簡易キットで検出されるが、新型のみを検出することはできない。そのため、新型インフルエンザの確定診断を行なうためには、PCRで最終的な確認をする必要がある(非特許文献1〜4参照)。PCR法は測定感度は高いが、コスト、操作及び設備の面で問題となる場合がある。例えば、PCRを行なうための設備を持たない国・地域においては、確定診断するためにWHOや他国を頼らざるを得ない。
【0004】
新型インフルエンザウイルスのみに反応する抗体が存在すれば、PCRのための設備を持たない国・地域であっても、簡便な操作で迅速に新型インフルエンザの確定診断を行なうことが可能になる。しかしながら、A型の中で新型インフルエンザウイルスPandemic (H1N1) 2009のみを認識できる抗体は報告されていない。例えば、市販のインフルエンザウイルス亜型鑑別キットの中には、新型には弱く結合し、季節性には強く結合する抗体を利用したものが存在するが、このような抗体のみでは定性的な判定が困難である。また、非特許文献5には、H5亜型トリインフルエンザウイルス及び新型インフルエンザウイルスのNPに反応し、季節性インフルエンザウイルスのNPには反応しない抗体が記載され、この抗体とH5亜型のNPには反応しない抗体とを用いたイムノクロマトグラフィーによる簡易検査キットが開示されているが、この抗体もまた、新型インフルエンザウイルスのみに反応する抗体ではない。非特許文献5の抗体の場合、H5亜型には反応しない抗体と同時に検査することが必須となる。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】NITE/NIID Protocol for Sequencing Influenza A (H1N1) SWL Viral Genome Segments, version 1.2 (30 May 2009)
【非特許文献2】WHO "Sequencing primers and protocol", 12 May 2009 (first published 29 April 2009)
【非特許文献3】WHO "WHO information for laboratory diagnosis of pandemic (H1N1) 2009 virus in humans-reviced", publication date: 23 November 2009
【非特許文献4】吉田宏、「新型インフルエンザ対策は地道に」、"第4回 流行先回りする備えを"、[online]、2009年9月18日、Science Portal(独立行政法人科学技術振興機構)、[平成22年1月4日検索]、インターネット<http://scienceportal.jp/HotTopics/interview/interview43/04.html>
【非特許文献5】Journal of Clinical Microbiology, Mar. 2010, vol. 48, No. 3, p. 703-708
【発明の概要】
【発明が解決しようとする課題】
【0006】
従って、本発明は、Pandemic (H1N1) 2009を他のヒトA型インフルエンザウイルスと区別して簡便かつ迅速に検出可能な手段を提供することを目的とする。
【課題を解決するための手段】
【0007】
本願発明者らは、新型インフルエンザウイルスの組換えNP全長タンパク質を免疫原とし、スクリーニングに新型インフルエンザウイルス、季節性H1亜型ウイルス、季節性H3亜型ウイルス及びH5亜型トリインフルエンザウイルスの組換えNP全長タンパク質を用いてモノクローナル抗体を作製したところ、新型インフルエンザウイルスに特異的に反応する複数の抗体を取得することに成功した。得られた抗体のエピトープ解析の結果、断片化されたNPに対しては該抗体の反応性が失われること、新型インフルエンザウイルスNPの第289番目のヒスチジンをチロシンに置換すると該抗体が認識しなくなることを見出し、さらに、データベース解析により、新型以外のA型インフルエンザウイルスではほとんど全ての株において第289番アミノ酸がチロシンであり、これがヒスチジンとなる変異は新型インフルエンザウイルスに特徴的な変異であることを見出し、本願発明を完成した。
【0008】
すなわち、本発明は、A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質と抗原抗体反応により結合し、第289番アミノ酸がチロシンである核タンパク質とは実質的に結合しない抗体又はその抗原結合性断片を提供する。また、本発明は、上記本発明の抗体又はその抗原結合性断片を用いた免疫測定法により、検体中の、第289番アミノ酸がヒスチジンであるA型インフルエンザウイルス核タンパク質を測定することを含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスの免疫測定方法を提供する。さらに、本発明は、上記本発明の抗体又はその抗原結合性断片を含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスを測定するための免疫測定キットを提供する。
【発明の効果】
【0009】
本発明により、新型インフルエンザウイルスであるブタ由来ヒトA型インフルエンザウイルスPandemic (H1N1) 2009のみを特異的に検出できる新規な抗Pandemic (H1N1) 2009抗体及びその抗原結合性断片が提供された。従来法では、Pandemic (H1N1) 2009であるか否かを確定するためには、PCR等によりウイルスのゲノム配列を確認する必要があった。A型と新型との間で反応の強弱に差異のある抗体も知られているが、このような抗体では定性的な判断が困難である。また、非特許文献5の抗体の場合、H5亜型に反応しない抗体と同時に検査しなければPandemic(H1N1)2009の検出ができない。一方、本発明の抗Pandemic (H1N1) 2009抗体又はその抗原結合性断片によれば、該抗体又はその抗原結合性断片との反応性のみに基づいて新型インフルエンザウイルスPandemic (H1N1) 2009を検出可能になる。本発明の抗Pandemic (H1N1) 2009抗体又はその抗原結合性断片を用いて簡易キットを作製すれば、複数のキットを組み合わせて使用したり、あるいはPCR等によりゲノム配列を最終的に確認することなく、単独のキットのみで迅速・簡便にPandemic (H1N1) 2009を検出可能になる。本発明の抗体又はその抗原結合性断片は他のA型との交差反応性も極めて低く、定性的な判断を簡便・迅速に行なうことができるため、臨床現場で非常に有利である。また、本発明の抗体は、抗原との特異的結合に重要な領域が一アミノ酸レベルで特定されていることが大きな特徴である。将来、Pandemic(H1N1)2009以外のさらなる新型インフルエンザウイルスが発生した場合、そのNPの第289番アミノ酸がヒスチジンであれば、本発明の抗体を用いて該ウイルスを免疫測定することができる。本発明は、インフルエンザウイルスの診断に非常に有用である。
【図面の簡単な説明】
【0010】
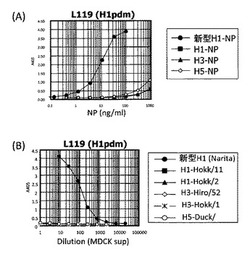
【図1】実施例で作製した抗体の反応性をサンドイッチELISAにより確認した結果を表すグラフである。(A)抗原として精製組換えNPを使用。(B)培養ウイルス抗原を使用。
【図2】抗体NT-L119のエピトープ解析のために作製した、A/Narita/1/2009(H1N1)の組換えNP断片を示す図である。
【図3】実施例で作製した、免疫測定器具(イムノクロマト器具)の模式断面図である。
【図4】実施例で作製した、免疫測定器具(イムノクロマト器具)の模式平面図である。
【発明を実施するための形態】
【0011】
上記の通り、本発明の抗体は、A型インフルエンザウイルスの核タンパク質(NP)のうち、第289番アミノ酸がヒスチジンであるNP(「NP-H289」)と抗原抗体反応により結合し、第289番アミノ酸がチロシンであるNP(「NP-Y289」)とは実質的に結合しないものである。以下、該抗体を「抗NP-H289抗体」と呼ぶことがある。
【0012】
ここで、「実質的に結合しない」とは、NP-Y289とは検出可能なレベルで結合しないか、又は検出し得るレベルで結合しても、その結合の程度がごく微弱であってNP-H289との結合よりも明らかに少なく、当業者であればNP-Y289とは結合していないと判断する程度にしか結合しないことを意味する。例えば、下記実施例では、本発明の抗体を用いたイムノクロマトグラフィーにより各種A型インフルエンザウイルスとの反応性を調べているが、このような方法で調べた場合に検出ゾーンに標識酵素による発色が検出されなければ、検出可能なレベルで結合していないと判断することができる。好ましくは、本発明の抗体は、NP-H289とのみ結合し、NP-Y289とは検出可能なレベルで結合しないものである。
【0013】
配列番号2に示すアミノ酸配列は、Pandemic(H1N1)2009の分離株の一つであるA/Narita/1/2009(H1N1)のNPのアミノ酸配列であり、配列番号1はそれをコードするNP遺伝子の塩基配列である。これらの配列はGenBankにもアクセッション番号GQ169303で登録されている。本発明でいう「第289番アミノ酸」とは、この配列番号2のアミノ酸配列を基準として位置を表現したものである。Pandemic(H1N1)2009も含めA型インフルエンザウイルスには多数の分離株が存在し、それらのNPのアミノ酸配列も公知であり、NPのアミノ酸数は通常498である。もっとも、NPの鎖長が異なる分離株が存在する場合であっても、当業者であれば、公知の手法で適宜ギャップを挿入しながら他のNP配列と配列番号2のアミノ酸配列とを整列化し、いずれの残基が本発明に言う「第289番アミノ酸」に該当するかを容易に特定できる。
【0014】
本発明の抗体としては、特に限定されないが、免疫測定に用いる際の再現性の観点からモノクローナル抗体が好ましい。
【0015】
本発明の抗体は、第289番アミノ酸がヒスチジンであるA型インフルエンザウイルスの全長NP(例えば、配列番号2に示すアミノ酸配列から成るPandemic(H1N1)2009の組換えNP)を免疫原として使用し、周知の常法に従い、該NPを適宜アジュバントとともに動物(ヒトを除く)に免疫することで作製することができる。組換えタンパク質の作製方法も周知であり、当業者であれば、組換えNP-H289をコードする塩基配列(例えば配列番号1)を参照して適宜プライマーを設計し、インフルエンザウイルスゲノムRNAを鋳型としてRT-PCRによりcDNAを合成し、これを適当な発現ベクターに組み込んで宿主細胞内に導入し、発現したNP-H289を回収することで容易に得ることができる。免疫された動物体内では、NP-H289に対する抗体が誘起される。
【0016】
モノクローナル抗体の作製方法も周知の常法である。具体的には、例えば、免疫した動物から採取した脾細胞やリンパ球のような抗体産生細胞をミエローマ細胞と融合させてハイブリドーマを調製し、次いで、得られたハイブリドーマから、全長NP-H289に結合し全長NP-Y289には結合しない抗体を産生するハイブリドーマを選択し、これを増殖することで、培養上清から所望の結合性を有するモノクローナル抗体を回収できる。
【0017】
本発明の抗体から抗原結合性断片を調製することも可能である。「抗原結合性断片」とは、例えば免疫グロブリンのFab断片やF(ab')2断片のような、当該抗体の対応抗原に対する結合性(抗原抗体反応性)を維持している抗体断片を意味する。このような抗原結合性断片も免疫測定に利用可能であることは周知であり、もとの抗体と同様に有用である。Fab断片やF(ab')2断片は、周知の通り、モノクローナル抗体をパパインやペプシンのようなタンパク分解酵素で処理することにより得ることができる。なお、抗原結合性断片は、Fab断片やF(ab')2断片に限定されるものではなく、対応抗原との結合性を維持しているいかなる断片であってもよく、遺伝子工学的手法により調製されたものであってもよい。また、例えば、遺伝子工学的手法により、一本鎖可変領域 (scFv: single chain fragment of variable region) を大腸菌内で発現させた抗体を用いることもできる。scFvの作製方法も周知であり、上記の通りに作製したハイブリドーマのmRNAを抽出し、一本鎖cDNAを調製し、免疫グロブリンH鎖及びL鎖に特異的なプライマーを用いてPCRを行なって免疫グロブリンH鎖遺伝子及びL鎖遺伝子を増幅し、これらをリンカーで連結し、適切な制限酵素部位を付与してプラスミドベクターに導入し、それで大腸菌を形質転換し、大腸菌からscFvを回収することによりscFvを作製することができる。このようなscFvも「抗原結合性断片」として本発明の範囲に包含される。以下、単に「抗体」といった場合には、文脈からそうではないことが明らかな場合を除き、抗原結合性断片も包含されるものとする。
【0018】
本発明の抗体は、全長NPのうちで第289番アミノ酸がヒスチジンであるものを特異的に認識して結合するが、NPを下記実施例のように半分程度以下のサイズに断片化すると、第289番アミノ酸を含む断片であっても結合しなくなる。このことから、本発明の抗体は、第289番アミノ酸がヒスチジンであることによって形成されるNP分子の立体構造(表面形状)を認識しているものと推察される。
【0019】
2005年以降にデータベースNCBI Influenza Virus Resourceに登録されたA型インフルエンザウイルスのうち、ヒトから分離された季節性(H1亜型及びH3亜型)、Pandemic(H1N1)2009及びH5亜型のウイルス株のNP配列について、第289番アミノ酸を調べると、812株のPandemic(H1N1)2009全てがヒスチジンであるが、季節性ではおよそ950株のうちのわずか3株を除き全てチロシンであり、H5亜型ウイルスでも全てチロシンである。従って、本発明の抗体を用いて免疫測定を行えば、インフルエンザウイルスに感染したヒトからPandemic(H1N1)2009のみを特異的に検出することができる。本発明の抗体は、ヒトのインフルエンザの検査に極めて有用である。
【0020】
本発明が提供する免疫測定方法は、本発明の抗体又はその抗原結合性断片を用いて、第289番アミノ酸がヒスチジンであるNPを有するA型インフルエンザウイルスを免疫測定する方法である。本発明の抗体は、NP-Y289には実質的に結合せず、NP-H289にのみ結合するため、本発明の免疫測定方法によれば、第289番アミノ酸がヒスチジンであるNPが検体中に存在するか否か、あるいは検体中のA型インフルエンザウイルスNPについて第289番アミノ酸がヒスチジンであるか否かを調べることができる。また、上記した通り、これまでにヒトに感染しヒトから分離された膨大な数のA型インフルエンザウイルス分離株のうち、Pandemic(H1N1)2009は高頻度にNP-H289を有するので、本発明の免疫測定方法はとりわけヒトのインフルエンザについてPandemic(H1N1)2009かどうかを調べるために有用である。なお、本発明において、「測定」という語は、定量、半定量及び検出を包含し、定量的ではない「検出」の意味でも用いられるものとする。
【0021】
免疫測定自体はこの分野において周知であり、反応様式で分類すると、サンドイッチ法、競合法、凝集法、ウェスタンブロット法等がある。また、標識で分類すると、放射免疫測定、蛍光免疫測定、酵素免疫測定、ビオチン免疫測定等があり、いずれの方法を用いてもNP-H289を有するA型インフルエンザウイルスを免疫測定することができる。特に限定されないが、サンドイッチ法、競合法及び凝集法は、操作が簡便で大掛かりな装置等を必要としないため、本発明の測定方法として好ましく適用することができる。中でも、医療現場で迅速・簡便にPandemic (H1N1) 2009を検出するために実施する場合には、サンドイッチELISAやイムノクロマトグラフィー等のサンドイッチ法がより好ましい。
【0022】
これらの免疫測定法自体は周知であり、本明細書で説明する必要はないが、簡単に記載すると、例えば、サンドイッチ法では、抗A型インフルエンザウイルスNP抗体を固相に固定化し、検体と反応させ、洗浄後、標識された抗A型インフルエンザウイルスNP抗体を反応させ、洗浄後、固相に結合した標識抗体を測定する。固相化抗体及び標識抗体の少なくともいずれか一方として、本発明の抗NP-H289抗体を用いることにより、NP-H289を有するPandemic (H1N1) 2009を測定することができる。
【0023】
この分野で周知の通り、インフルエンザウイルスのNPは3量体で存在しているので、固相化抗体と標識抗体が同一の抗体であっても、インフルエンザウイルスNPのサンドイッチアッセイが可能である。従って、本発明の方法においては、抗NP-H289抗体を固相化抗体と標識抗体の両者に用いることも可能である。抗NP-H289抗体を固相化抗体及び標識抗体のいずれか一方にのみ用いる場合、他方としては、例えば、第289番アミノ酸がヒスチジンであるA型NP及びヒスチジンではないA型NP(具体例としてはNP-Y289)の両者と結合する、A型を共通して認識可能な抗体を用いることができる。Pandemic (H1N1) 2009を検出するために本発明の方法を実施する場合であれば、抗NP-H289抗体とは異なる部位でPandemic(H1N1)2009のNPと結合する抗Pandemic(H1N1)2009 NP抗体を他方の抗体として用いることもできる。抗NP-H289抗体を固相に固定化し、A型を共通して認識可能な抗体を標識抗体として用いた場合、A型を共通して認識可能な抗体(標識抗体と同一の抗体でもよいし、異なる抗体でもよい)をさらに固相に固定化すれば、NP-H289ではないPandemic(H1N1)2009以外のA型インフルエンザウイルスのNPをNP-H289と同時に測定することができる。ここで、A型を共通して認識可能な抗体とは、具体的には、A型インフルエンザウイルスの各種亜型のNPに共通して結合するA型検出用抗体であり、B型インフルエンザウイルスNPとは実質的に、好ましくは検出可能なレベルで結合しないものである。そのような抗ヒトA型インフルエンザウイルスNP抗体は各種のものが公知であり、市販のインフルエンザ検査キットにも用いられている。なお、上述したように、抗体に代えて、該抗体の抗原結合性断片を用いることもできる。
【0024】
検体中のウイルスを定量する場合には、ELISA等の、マイクロプレートのウェルやビーズを固相とするサンドイッチ法を好ましく用いることができる。一方、検体中のウイルスを医療現場において迅速、簡便に検出したい場合には、イムノクロマトグラフィー(しばしば「イムノクロマト」と略される)が好ましく用いられる。イムノクロマトグラフィー自体及びそれに用いられる器具(以下、「イムノクロマト器具」と呼ぶことがある)は周知であり、下記実施例にも具体的に記載されている。以下、Pandemic(H1N1)2009を検出するためのイムノクロマト器具を例として、ラテラルフロー方式のイムノクロマトグラフィーについて説明する。
【0025】
ニトロセルロース膜のような多孔性素材から成るマトリックスは、通常、帯状に形成される。このマトリックス上に、抗NP-H289モノクローナル抗体が固相化された検出ゾーンが設けられ、その上流側(後述する展開液が流れる方向における上流側)に、標識した抗A型NPモノクローナル抗体を点着した標識試薬ゾーンが設けられる。この標識抗体は、NP-Y289にも結合する、A型インフルエンザウイルスNPを共通して認識する抗体であってよいし、また、固相化した抗NP-H289抗体とは異なる部位でPandemic(H1N1)2009のNPに特異的に結合する第2の抗体であってもよい。
【0026】
標識試薬ゾーンには検体が添加され、かつ、標識抗体は、標識試薬ゾーンから流出してマトリクス内を流れる必要があるので、通常、標識試薬ゾーンは、標識抗体を点着した多孔性のパッドにより構成される。マトリックスの上流端には、展開液を貯蔵した展開液槽が設けられている。さらに、通常、上記検出ゾーンの下流に、標識抗体の展開が起きたかどうかを確認するための、標識に対する抗体を固相化した展開確認部と、さらにその下流に、流れて来た展開液を吸収するための多孔性の吸収パッドが設けられた展開液吸収ゾーンが設けられる。さらに、標識が酵素である場合には、標識試薬ゾーンよりも上流に、標識酵素の基質を点着した基質ゾーンが設けられている。
【0027】
使用時には、検体を標識試薬ゾーンに添加し、展開液槽を破って展開液をマトリックスの上端部に施す。展開液は、マトリックスの毛管現象により下流に向かって流れる。展開液が基質ゾーンを通過する際に基質が展開液中に溶出され、基質を含む展開液が流れていく。展開液が標識試薬ゾーンを通過する際に、標識抗体と検体とが展開液中に溶出され、基質、標識抗体及び検体を含む展開液が流れていく。検体中にPandemic(H1N1)2009が含まれる場合には、該ウイルスのNP(NP-H289)と標識抗体が、抗原抗体反応により結合する。これらの混合物が検出ゾーンまで流れてくると、検出ゾーンにおいて、固相化抗体と該ウイルスのNPとが抗原抗体反応により結合する。その結果、該ウイルスのNPを介して標識抗体が検出ゾーンに固定される。従って、検出ゾーンに固定された標識を測定することにより、該ウイルスを検出することができる。検体中にPandemic(H1N1)2009が含まれていない場合には、固相化抗体には何も結合されないので、標識抗体は検出ゾーンに固定されず、より下流に流れていく。従って、検出ゾーンでは標識は検出されない。検出ゾーンの下流の展開液確認部には、標識に対する抗体が固相化されているので、標識抗体は展開液確認部に固定される。展開液確認部に標識が検出された場合には、展開液はそこまで正しく流れて来たということが確認される。展開液は、さらにその下流の吸収パッドに吸収される。
【0028】
なお、上記したイムノクロマト器具の例では、抗NP-H289モノクローナル抗体を固相化抗体とし、NP-H289及びNP-Y289の両者と結合する抗ヒトA型インフルエンザウイルスモノクローナル抗体を標識抗体として説明したが、固相化抗体と標識抗体はこの逆であってもよい。また、用いる抗体は抗原結合性断片でもよい。
【0029】
イムノクロマト器具には、Pandemic(H1N1)2009を特異的に検出するNP-H289検出ゾーンに加えて、他の検出ゾーンをさらに設けてもよい。例えば、Pandemic(H1N1)2009以外のA型インフルエンザウイルスも共通して検出できるA型共通検出ゾーンを設けてもよい。この場合、標識抗体はA型のNPを共通して認識する抗A型NP抗体とし、NP-H289検出ゾーンには本発明の抗体を、そしてA型検出ゾーンにはA型のNPを共通して認識する抗A型NP抗体(標識抗体と同一の抗体でもよいし、異なる抗体でもよい)を固相化すればよい。このような同時測定器具は、ヒト検体中のインフルエンザウイルスが季節性かPandemic (H1N1) 2009かを一回の操作で判別できるので好ましい。
【0030】
本発明の免疫測定方法に適用される検体としては、NP-H289を有するインフルエンザウイルスが含まれているか否かを検出したい検体であれば特に限定されず、Pandemic(H1N1)2009の免疫測定のために本発明の免疫測定方法を実施する場合には、ヒトから分離した検体であればよい。具体例としては、血液(全血、血漿、血清を包含)、唾液、痰等の体液や、粘膜のぬぐい液、器具や設備のぬぐい液等を挙げることができるが、これらに限定されるものではない。
【実施例】
【0031】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0032】
1.抗Pandemic(H1N1)2009インフルエンザウイルスモノクローナル抗体の作製
免疫原として、Pandemic(H1N1)2009インフルエンザウイルスであるA/Narita/1/2009(H1N1)の組換え全長NPを常法により作製した。具体的には、該ウイルス株のゲノムRNAからRT-PCRによりNPをコードするcDNAを合成し、精製後、公知の発現ベクターに組み込んで大腸菌に導入し、発現したrNPをカラムにて回収・精製して得た。これをマウスに免疫し、常法のハイブリドーマ法により、免疫原に対する抗体を産生するハイブリドーマを作製した。スクリーニングは、常法により作製した下記表1に示す4種の組換え全長NPを抗原として用いたサンドイッチELISAにより実施した。
【0033】
【表1】

【0034】
FVA2-11とのサンドイッチELISA:
抗マウスIgG抗体をPBSで1μg/mlに調製した溶液を96穴アッセイプレートに50μl/wellずつ加え、37℃で1時間コーティングさせた。PBSTで洗浄後、抗NP抗体溶液を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、rNPを50μl/wellずつ加え、37℃で1時間反応させ、PBSTで洗浄後、アルカリホスファターゼ標識FVA2-11を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、p-NPP基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。なお、FVA2-11は、市販のインフルエンザ検出キットにも使用されている公知の抗A型NP抗体であり、A型を共通して認識可能な抗体である(文献:Gui-Rong BAI et.al.:Improvement of a Rapid Diagnosis Kit to Detect Either Influenza A or B Virus Infection. J.Vet.Med.Sci.68(1);1-6,2006、及びWO/2005/007697)。
【0035】
A/Narita/1/2009(H1N1)に反応し、A/New Caledonia/20/99(H1N1)、A/Kitakyushu/159/93(H3N2)及びA/duck/Hokkaido/Vac-1/04(H5N1)に反応しない抗体をスクリーニングしたところ、Pandemic(H1N1)2009に特異的なモノクローナル抗体が複数ライン得られた。得られた抗体について、各種インフルエンザウイルスの精製組換えNP及び培養ウイルス抗原を用いてサンドイッチELISAにより詳細に反応性を確認したところ、NT-L119は季節性インフルエンザウイルスとの交差反応性が1%以下であり、感度も非常に高いことが確認された(図1)。以下、このモノクローナル抗体NT-L119を用いて実験を行なった。
【0036】
2.抗Pandemic(H1N1)2009インフルエンザmAb NT-L119のエピトープ解析
(1) A/Narita/1/2009(H1N1)の組換えNP断片を用いた解析
新型インフルエンザウイルスA/Narita/1/2009(H1N1)の組換えNPの断片(図2)を作製し、ウエスタンブロッティングによりNT-L119の反応性を調べた。その結果、NT-L119はこれらのNP断片には反応を示さなかった。NT-L119はlinear epitopeではなくNPの立体構造(conformational epitope)を認識しているものと考えられる。
【0037】
(2) キメラNPを用いたELISA反応阻害アッセイ
下記表2に示す通り、A/Narita/1/2009(H1N1): pdmH1、A/Kitakyushu/159/93(H3N2): H3、及びA/duck/Hokkaido/Vac-1/04(H5N1): H5のキメラNPを作製し、下記の手順でELISA反応阻害アッセイを行なった。
【0038】
抗NP抗体(FVA2-11又はNT-L119)をPBSで5μg/mlに調製した溶液を96穴アッセイプレートに100μl/wellずつ加え、37℃で1時間コーティングさせた。1%スキムミルク-PBSでマスキングし、PBSTで洗浄後、ビオチン標識したpdmH1全長組換えNPと各キメラ組換えNPの混合溶液を100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ストレプトアビジン結合アルカリホスファターゼを100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、p-NPP基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0039】
この方法では、プレートに固相化した抗NP抗体に結合したビオチン標識pdmH1 rNPが測定される。キメラrNPが競合して固相化抗体に結合すると、ビオチン標識rNPと抗体との結合が阻害され、測定値が低くなる。これにより、キメラrNPによる阻害の有無を調べることができる。
【0040】
結果を表2に示す。NT-L119抗体とpdmH1全長NPとの結合は、N末側(aa1-333)がpdmH1である組換えNPにより阻害された。すなわち、NT-L119とNPとの結合にはNPのN末端側領域(aa1-333)が重要であることが確認された。
【0041】
【表2】

【0042】
(3) NP点変異体を用いたELISA反応阻害アッセイ
pdmH1 NPの点変異体として、第100番アミノ酸をバリンからアルギニンに置換したもの(V100R)、第190番アミノ酸をアラニンからバリンに置換したもの(A190V)、及び第289番アミノ酸をヒスチジンからチロシンに置換したもの(H289Y)を作製し、これらを競合抗原として用いて上記と同様にELISA反応阻害アッセイを行なった。
【0043】
結果は表3に示す通りであり、NT-L119抗体とpdmH1 NPとの反応には289番目のヒスチジンが重要であることが確認された。
【0044】
【表3】

【0045】
3.データベースNCBI Influenza Virus Resourceを用いたインフルエンザNP 289番目アミノ酸の解析
NCBI Influenza Virus Resourceには、現在までに同定されたインフルエンザウイルスの配列情報が登録されている。このデータベースを用いて、2005年〜2008年及び2009年7月〜12月の期間にヒトから分離されたA型インフルエンザウイルスのNPの第289番アミノ酸を調べた。その結果、表4に示す通り、Pandemic(H1N1)2009以外のインフルエンザウイルスではほぼ全ての株でチロシンであり、289番のヒスチジンはPandemic(H1N1)2009に特徴的なアミノ酸であった。H289であるNPを認識するNT-L119は、Pandemic(H1N1)2009を特異的に検出する抗体として有用である。
【0046】
【表4】

【0047】
4.A型インフルエンザ及びpdm(H1N1)2009同時測定用イムノクロマト器具の作製及び評価
(1) イムノクロマト器具の作製
A型インフルエンザウイルスを共通して検出可能な抗A型インフルエンザウイルスNP抗体と、Pandemic(H1N1)2009のNPを特異的に検出する抗体を用いて、A型インフルエンザウイルスと新型インフルエンザウイルスを同時に検出するイムノクロマト器具を作製した。
【0048】
図3及び図4に示すように、巾5mm、長さ50mmのニトロセルロース膜(ミリポア社製)のマトリクス2の展開液吸収ゾーン5側の末端から16mmと13.5mmの位置に、A型のNPを共通して認識する抗体FVA2-11の水溶液及びPandemic(H1N1)2009特異的抗体NT-L119の水溶液をそれぞれ点着して乾燥させ、検出ゾーン6a及び6bを作成した。さらに、マトリクス2の展開液吸収ゾーン5側の末端から11mmの位置に抗アルカリホスファターゼ抗体(ウサギ)を点着し乾燥させ、展開確認部10を作成した。次いで、アルカリホスファターゼ標識したFVA2-11の水溶液をパッドに点着し乾燥させ、酵素標識試薬パッド4から成る標識試薬ゾーンを作成した。
【0049】
展開液パッド3は、巾6mm、長さ20mmのろ紙(ミリポア社製)上に、基質として5−ブロモ−4−クロロ−3−インドリルリン酸(BCIP)100μgを巾6.0mmのライン状に点着して乾燥させて作成した。前記マトリクス2、展開液パッド3、酵素標識試薬パッド4及び吸収パッド5(巾10mm、長さ15mm、厚さ1mmのろ紙(ワットマン社製))を、展開液槽11を有するプラスチックケースに固定して、図3及び図4に示すA型インフルエンザ及びpdm(H1N1)2009同時測定用イムノクロマト器具とした。
【0050】
(2) 組換えNPに対する反応性
A/Narita/1/2009 (H1N1): pdmH1、A/New Caledonia/20/99(H1N1): H1、A/Kitakyushu/159/93(H3N2): H3、及びA/duck/Hokkaido/Vac-1/04(H5N1): H5の組換えNP試料を用いて、上記で作製したイムノクロマト器具の検出感度を確認した。rNP試料は、下記表5に示す通り5000〜1.25 ng/mlの濃度で用いた。イムノクロマト器具の検体添加ゾーン8に試料30μLを添加した後、変形部材に設けた押し込み部12を下方に加圧して変形させて、変形部材に付設された突起部13によって展開液パッド3を展開液槽11に挿入して展開液を展開液パッド3に供給して測定を開始した。測定開始15分後、展開確認部10の発色によって展開液の展開を確認した後、検出ゾーン6a(FVA2-11)及び6b(NT-L119)の発色を目視で測定した。結果は表5に示す通りであり、NT-L119は5000 ng/mlの高濃度であってもpdmH1以外のNPには反応せず、また、pdmH1のNPは1.25 ng/mlの低濃度でも検出でき、このイムノクロマト器具の感度と特異性が十分に高いことが確認された。
【0051】
【表5】

【0052】
(3) ウイルス株に対する反応性
各種インフルエンザウイルス株を用いてイムノクロマト器具の反応性を確認した。ウイルス株を孵化鶏卵培養して得た漿尿液を試料とし、試料希釈液として界面活性剤を含むトリス緩衝液(pH8.0)を使用した。結果は表6に示す通りであり、NPの第289番アミノ酸がヒスチジンであるブタ及びブタ由来ヒトインフルエンザウイルスに対しては、FVA2-11点着ゾーンとNT-L119点着ゾーンの両者が発色したが、NPの第289番アミノ酸がチロシンであるヒトインフルエンザウイルスに対しては、NT-L119点着ゾーンの発色が見られなかった。
【0053】
【表6】

【0054】
(4) ヒト臨床検体に対する反応性
PCR検査でPandemic(H1N1)2009陽性が確認されたヒト臨床検体(希釈鼻腔吸引液)20例を用いてイムノクロマト器具の反応性を確認した。結果を表7に示す。PCR検査ではウイルスゲノムを検出するため、抗原タンパク質を検出する抗体検査と比較して感染のより初期の段階でもウイルスを検出できる。PCR検査で陽性であった検体のうち2例において、FVA2-11点着ゾーンとNT-L119点着ゾーンのいずれも発色が認められなかった。これは、該2例においてNPが抗体で検出できる量まで蓄積していなかったためと考えられる。NT-L119は、イムノクロマト器具に適用した場合でも、インフルエンザ検査キットで既に実用化されているFVA2-11と同等の感度を発揮できることが確認された。
【0055】
【表7】

【技術分野】
【0001】
本発明は、A型インフルエンザウイルスの核タンパク質のうち第289番アミノ酸がヒスチジンである核タンパク質に特異的に結合する抗体又はその抗原結合性断片、及び該抗体又はその抗原結合性断片を用いた免疫測定方法に関する。
【背景技術】
【0002】
2009年4月、世界保健機構(WHO)は、これまでにヒトで感染の報告がない新型のインフルエンザウイルスの発生を確認した。この新型インフルエンザウイルスは、ブタに由来する抗原型H1N1のA型インフルエンザウイルスであり、短期間のうちに全世界に蔓延して大流行を引き起こしている。WHOでは現在この新型インフルエンザウイルスを「Pandemic (H1N1) 2009」と呼んでいる。日本においては一般に「新型インフルエンザウイルス」と呼ばれている。
【0003】
現在市販されているインフルエンザウイルス検出のための簡易キットは、核タンパク質(NP)に対する抗体を利用しているものが多いが、これらはA型共通に反応する。新型インフルエンザウイルスはA型であるから、市販の簡易キットで検出されるが、新型のみを検出することはできない。そのため、新型インフルエンザの確定診断を行なうためには、PCRで最終的な確認をする必要がある(非特許文献1〜4参照)。PCR法は測定感度は高いが、コスト、操作及び設備の面で問題となる場合がある。例えば、PCRを行なうための設備を持たない国・地域においては、確定診断するためにWHOや他国を頼らざるを得ない。
【0004】
新型インフルエンザウイルスのみに反応する抗体が存在すれば、PCRのための設備を持たない国・地域であっても、簡便な操作で迅速に新型インフルエンザの確定診断を行なうことが可能になる。しかしながら、A型の中で新型インフルエンザウイルスPandemic (H1N1) 2009のみを認識できる抗体は報告されていない。例えば、市販のインフルエンザウイルス亜型鑑別キットの中には、新型には弱く結合し、季節性には強く結合する抗体を利用したものが存在するが、このような抗体のみでは定性的な判定が困難である。また、非特許文献5には、H5亜型トリインフルエンザウイルス及び新型インフルエンザウイルスのNPに反応し、季節性インフルエンザウイルスのNPには反応しない抗体が記載され、この抗体とH5亜型のNPには反応しない抗体とを用いたイムノクロマトグラフィーによる簡易検査キットが開示されているが、この抗体もまた、新型インフルエンザウイルスのみに反応する抗体ではない。非特許文献5の抗体の場合、H5亜型には反応しない抗体と同時に検査することが必須となる。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】NITE/NIID Protocol for Sequencing Influenza A (H1N1) SWL Viral Genome Segments, version 1.2 (30 May 2009)
【非特許文献2】WHO "Sequencing primers and protocol", 12 May 2009 (first published 29 April 2009)
【非特許文献3】WHO "WHO information for laboratory diagnosis of pandemic (H1N1) 2009 virus in humans-reviced", publication date: 23 November 2009
【非特許文献4】吉田宏、「新型インフルエンザ対策は地道に」、"第4回 流行先回りする備えを"、[online]、2009年9月18日、Science Portal(独立行政法人科学技術振興機構)、[平成22年1月4日検索]、インターネット<http://scienceportal.jp/HotTopics/interview/interview43/04.html>
【非特許文献5】Journal of Clinical Microbiology, Mar. 2010, vol. 48, No. 3, p. 703-708
【発明の概要】
【発明が解決しようとする課題】
【0006】
従って、本発明は、Pandemic (H1N1) 2009を他のヒトA型インフルエンザウイルスと区別して簡便かつ迅速に検出可能な手段を提供することを目的とする。
【課題を解決するための手段】
【0007】
本願発明者らは、新型インフルエンザウイルスの組換えNP全長タンパク質を免疫原とし、スクリーニングに新型インフルエンザウイルス、季節性H1亜型ウイルス、季節性H3亜型ウイルス及びH5亜型トリインフルエンザウイルスの組換えNP全長タンパク質を用いてモノクローナル抗体を作製したところ、新型インフルエンザウイルスに特異的に反応する複数の抗体を取得することに成功した。得られた抗体のエピトープ解析の結果、断片化されたNPに対しては該抗体の反応性が失われること、新型インフルエンザウイルスNPの第289番目のヒスチジンをチロシンに置換すると該抗体が認識しなくなることを見出し、さらに、データベース解析により、新型以外のA型インフルエンザウイルスではほとんど全ての株において第289番アミノ酸がチロシンであり、これがヒスチジンとなる変異は新型インフルエンザウイルスに特徴的な変異であることを見出し、本願発明を完成した。
【0008】
すなわち、本発明は、A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質と抗原抗体反応により結合し、第289番アミノ酸がチロシンである核タンパク質とは実質的に結合しない抗体又はその抗原結合性断片を提供する。また、本発明は、上記本発明の抗体又はその抗原結合性断片を用いた免疫測定法により、検体中の、第289番アミノ酸がヒスチジンであるA型インフルエンザウイルス核タンパク質を測定することを含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスの免疫測定方法を提供する。さらに、本発明は、上記本発明の抗体又はその抗原結合性断片を含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスを測定するための免疫測定キットを提供する。
【発明の効果】
【0009】
本発明により、新型インフルエンザウイルスであるブタ由来ヒトA型インフルエンザウイルスPandemic (H1N1) 2009のみを特異的に検出できる新規な抗Pandemic (H1N1) 2009抗体及びその抗原結合性断片が提供された。従来法では、Pandemic (H1N1) 2009であるか否かを確定するためには、PCR等によりウイルスのゲノム配列を確認する必要があった。A型と新型との間で反応の強弱に差異のある抗体も知られているが、このような抗体では定性的な判断が困難である。また、非特許文献5の抗体の場合、H5亜型に反応しない抗体と同時に検査しなければPandemic(H1N1)2009の検出ができない。一方、本発明の抗Pandemic (H1N1) 2009抗体又はその抗原結合性断片によれば、該抗体又はその抗原結合性断片との反応性のみに基づいて新型インフルエンザウイルスPandemic (H1N1) 2009を検出可能になる。本発明の抗Pandemic (H1N1) 2009抗体又はその抗原結合性断片を用いて簡易キットを作製すれば、複数のキットを組み合わせて使用したり、あるいはPCR等によりゲノム配列を最終的に確認することなく、単独のキットのみで迅速・簡便にPandemic (H1N1) 2009を検出可能になる。本発明の抗体又はその抗原結合性断片は他のA型との交差反応性も極めて低く、定性的な判断を簡便・迅速に行なうことができるため、臨床現場で非常に有利である。また、本発明の抗体は、抗原との特異的結合に重要な領域が一アミノ酸レベルで特定されていることが大きな特徴である。将来、Pandemic(H1N1)2009以外のさらなる新型インフルエンザウイルスが発生した場合、そのNPの第289番アミノ酸がヒスチジンであれば、本発明の抗体を用いて該ウイルスを免疫測定することができる。本発明は、インフルエンザウイルスの診断に非常に有用である。
【図面の簡単な説明】
【0010】
【図1】実施例で作製した抗体の反応性をサンドイッチELISAにより確認した結果を表すグラフである。(A)抗原として精製組換えNPを使用。(B)培養ウイルス抗原を使用。
【図2】抗体NT-L119のエピトープ解析のために作製した、A/Narita/1/2009(H1N1)の組換えNP断片を示す図である。
【図3】実施例で作製した、免疫測定器具(イムノクロマト器具)の模式断面図である。
【図4】実施例で作製した、免疫測定器具(イムノクロマト器具)の模式平面図である。
【発明を実施するための形態】
【0011】
上記の通り、本発明の抗体は、A型インフルエンザウイルスの核タンパク質(NP)のうち、第289番アミノ酸がヒスチジンであるNP(「NP-H289」)と抗原抗体反応により結合し、第289番アミノ酸がチロシンであるNP(「NP-Y289」)とは実質的に結合しないものである。以下、該抗体を「抗NP-H289抗体」と呼ぶことがある。
【0012】
ここで、「実質的に結合しない」とは、NP-Y289とは検出可能なレベルで結合しないか、又は検出し得るレベルで結合しても、その結合の程度がごく微弱であってNP-H289との結合よりも明らかに少なく、当業者であればNP-Y289とは結合していないと判断する程度にしか結合しないことを意味する。例えば、下記実施例では、本発明の抗体を用いたイムノクロマトグラフィーにより各種A型インフルエンザウイルスとの反応性を調べているが、このような方法で調べた場合に検出ゾーンに標識酵素による発色が検出されなければ、検出可能なレベルで結合していないと判断することができる。好ましくは、本発明の抗体は、NP-H289とのみ結合し、NP-Y289とは検出可能なレベルで結合しないものである。
【0013】
配列番号2に示すアミノ酸配列は、Pandemic(H1N1)2009の分離株の一つであるA/Narita/1/2009(H1N1)のNPのアミノ酸配列であり、配列番号1はそれをコードするNP遺伝子の塩基配列である。これらの配列はGenBankにもアクセッション番号GQ169303で登録されている。本発明でいう「第289番アミノ酸」とは、この配列番号2のアミノ酸配列を基準として位置を表現したものである。Pandemic(H1N1)2009も含めA型インフルエンザウイルスには多数の分離株が存在し、それらのNPのアミノ酸配列も公知であり、NPのアミノ酸数は通常498である。もっとも、NPの鎖長が異なる分離株が存在する場合であっても、当業者であれば、公知の手法で適宜ギャップを挿入しながら他のNP配列と配列番号2のアミノ酸配列とを整列化し、いずれの残基が本発明に言う「第289番アミノ酸」に該当するかを容易に特定できる。
【0014】
本発明の抗体としては、特に限定されないが、免疫測定に用いる際の再現性の観点からモノクローナル抗体が好ましい。
【0015】
本発明の抗体は、第289番アミノ酸がヒスチジンであるA型インフルエンザウイルスの全長NP(例えば、配列番号2に示すアミノ酸配列から成るPandemic(H1N1)2009の組換えNP)を免疫原として使用し、周知の常法に従い、該NPを適宜アジュバントとともに動物(ヒトを除く)に免疫することで作製することができる。組換えタンパク質の作製方法も周知であり、当業者であれば、組換えNP-H289をコードする塩基配列(例えば配列番号1)を参照して適宜プライマーを設計し、インフルエンザウイルスゲノムRNAを鋳型としてRT-PCRによりcDNAを合成し、これを適当な発現ベクターに組み込んで宿主細胞内に導入し、発現したNP-H289を回収することで容易に得ることができる。免疫された動物体内では、NP-H289に対する抗体が誘起される。
【0016】
モノクローナル抗体の作製方法も周知の常法である。具体的には、例えば、免疫した動物から採取した脾細胞やリンパ球のような抗体産生細胞をミエローマ細胞と融合させてハイブリドーマを調製し、次いで、得られたハイブリドーマから、全長NP-H289に結合し全長NP-Y289には結合しない抗体を産生するハイブリドーマを選択し、これを増殖することで、培養上清から所望の結合性を有するモノクローナル抗体を回収できる。
【0017】
本発明の抗体から抗原結合性断片を調製することも可能である。「抗原結合性断片」とは、例えば免疫グロブリンのFab断片やF(ab')2断片のような、当該抗体の対応抗原に対する結合性(抗原抗体反応性)を維持している抗体断片を意味する。このような抗原結合性断片も免疫測定に利用可能であることは周知であり、もとの抗体と同様に有用である。Fab断片やF(ab')2断片は、周知の通り、モノクローナル抗体をパパインやペプシンのようなタンパク分解酵素で処理することにより得ることができる。なお、抗原結合性断片は、Fab断片やF(ab')2断片に限定されるものではなく、対応抗原との結合性を維持しているいかなる断片であってもよく、遺伝子工学的手法により調製されたものであってもよい。また、例えば、遺伝子工学的手法により、一本鎖可変領域 (scFv: single chain fragment of variable region) を大腸菌内で発現させた抗体を用いることもできる。scFvの作製方法も周知であり、上記の通りに作製したハイブリドーマのmRNAを抽出し、一本鎖cDNAを調製し、免疫グロブリンH鎖及びL鎖に特異的なプライマーを用いてPCRを行なって免疫グロブリンH鎖遺伝子及びL鎖遺伝子を増幅し、これらをリンカーで連結し、適切な制限酵素部位を付与してプラスミドベクターに導入し、それで大腸菌を形質転換し、大腸菌からscFvを回収することによりscFvを作製することができる。このようなscFvも「抗原結合性断片」として本発明の範囲に包含される。以下、単に「抗体」といった場合には、文脈からそうではないことが明らかな場合を除き、抗原結合性断片も包含されるものとする。
【0018】
本発明の抗体は、全長NPのうちで第289番アミノ酸がヒスチジンであるものを特異的に認識して結合するが、NPを下記実施例のように半分程度以下のサイズに断片化すると、第289番アミノ酸を含む断片であっても結合しなくなる。このことから、本発明の抗体は、第289番アミノ酸がヒスチジンであることによって形成されるNP分子の立体構造(表面形状)を認識しているものと推察される。
【0019】
2005年以降にデータベースNCBI Influenza Virus Resourceに登録されたA型インフルエンザウイルスのうち、ヒトから分離された季節性(H1亜型及びH3亜型)、Pandemic(H1N1)2009及びH5亜型のウイルス株のNP配列について、第289番アミノ酸を調べると、812株のPandemic(H1N1)2009全てがヒスチジンであるが、季節性ではおよそ950株のうちのわずか3株を除き全てチロシンであり、H5亜型ウイルスでも全てチロシンである。従って、本発明の抗体を用いて免疫測定を行えば、インフルエンザウイルスに感染したヒトからPandemic(H1N1)2009のみを特異的に検出することができる。本発明の抗体は、ヒトのインフルエンザの検査に極めて有用である。
【0020】
本発明が提供する免疫測定方法は、本発明の抗体又はその抗原結合性断片を用いて、第289番アミノ酸がヒスチジンであるNPを有するA型インフルエンザウイルスを免疫測定する方法である。本発明の抗体は、NP-Y289には実質的に結合せず、NP-H289にのみ結合するため、本発明の免疫測定方法によれば、第289番アミノ酸がヒスチジンであるNPが検体中に存在するか否か、あるいは検体中のA型インフルエンザウイルスNPについて第289番アミノ酸がヒスチジンであるか否かを調べることができる。また、上記した通り、これまでにヒトに感染しヒトから分離された膨大な数のA型インフルエンザウイルス分離株のうち、Pandemic(H1N1)2009は高頻度にNP-H289を有するので、本発明の免疫測定方法はとりわけヒトのインフルエンザについてPandemic(H1N1)2009かどうかを調べるために有用である。なお、本発明において、「測定」という語は、定量、半定量及び検出を包含し、定量的ではない「検出」の意味でも用いられるものとする。
【0021】
免疫測定自体はこの分野において周知であり、反応様式で分類すると、サンドイッチ法、競合法、凝集法、ウェスタンブロット法等がある。また、標識で分類すると、放射免疫測定、蛍光免疫測定、酵素免疫測定、ビオチン免疫測定等があり、いずれの方法を用いてもNP-H289を有するA型インフルエンザウイルスを免疫測定することができる。特に限定されないが、サンドイッチ法、競合法及び凝集法は、操作が簡便で大掛かりな装置等を必要としないため、本発明の測定方法として好ましく適用することができる。中でも、医療現場で迅速・簡便にPandemic (H1N1) 2009を検出するために実施する場合には、サンドイッチELISAやイムノクロマトグラフィー等のサンドイッチ法がより好ましい。
【0022】
これらの免疫測定法自体は周知であり、本明細書で説明する必要はないが、簡単に記載すると、例えば、サンドイッチ法では、抗A型インフルエンザウイルスNP抗体を固相に固定化し、検体と反応させ、洗浄後、標識された抗A型インフルエンザウイルスNP抗体を反応させ、洗浄後、固相に結合した標識抗体を測定する。固相化抗体及び標識抗体の少なくともいずれか一方として、本発明の抗NP-H289抗体を用いることにより、NP-H289を有するPandemic (H1N1) 2009を測定することができる。
【0023】
この分野で周知の通り、インフルエンザウイルスのNPは3量体で存在しているので、固相化抗体と標識抗体が同一の抗体であっても、インフルエンザウイルスNPのサンドイッチアッセイが可能である。従って、本発明の方法においては、抗NP-H289抗体を固相化抗体と標識抗体の両者に用いることも可能である。抗NP-H289抗体を固相化抗体及び標識抗体のいずれか一方にのみ用いる場合、他方としては、例えば、第289番アミノ酸がヒスチジンであるA型NP及びヒスチジンではないA型NP(具体例としてはNP-Y289)の両者と結合する、A型を共通して認識可能な抗体を用いることができる。Pandemic (H1N1) 2009を検出するために本発明の方法を実施する場合であれば、抗NP-H289抗体とは異なる部位でPandemic(H1N1)2009のNPと結合する抗Pandemic(H1N1)2009 NP抗体を他方の抗体として用いることもできる。抗NP-H289抗体を固相に固定化し、A型を共通して認識可能な抗体を標識抗体として用いた場合、A型を共通して認識可能な抗体(標識抗体と同一の抗体でもよいし、異なる抗体でもよい)をさらに固相に固定化すれば、NP-H289ではないPandemic(H1N1)2009以外のA型インフルエンザウイルスのNPをNP-H289と同時に測定することができる。ここで、A型を共通して認識可能な抗体とは、具体的には、A型インフルエンザウイルスの各種亜型のNPに共通して結合するA型検出用抗体であり、B型インフルエンザウイルスNPとは実質的に、好ましくは検出可能なレベルで結合しないものである。そのような抗ヒトA型インフルエンザウイルスNP抗体は各種のものが公知であり、市販のインフルエンザ検査キットにも用いられている。なお、上述したように、抗体に代えて、該抗体の抗原結合性断片を用いることもできる。
【0024】
検体中のウイルスを定量する場合には、ELISA等の、マイクロプレートのウェルやビーズを固相とするサンドイッチ法を好ましく用いることができる。一方、検体中のウイルスを医療現場において迅速、簡便に検出したい場合には、イムノクロマトグラフィー(しばしば「イムノクロマト」と略される)が好ましく用いられる。イムノクロマトグラフィー自体及びそれに用いられる器具(以下、「イムノクロマト器具」と呼ぶことがある)は周知であり、下記実施例にも具体的に記載されている。以下、Pandemic(H1N1)2009を検出するためのイムノクロマト器具を例として、ラテラルフロー方式のイムノクロマトグラフィーについて説明する。
【0025】
ニトロセルロース膜のような多孔性素材から成るマトリックスは、通常、帯状に形成される。このマトリックス上に、抗NP-H289モノクローナル抗体が固相化された検出ゾーンが設けられ、その上流側(後述する展開液が流れる方向における上流側)に、標識した抗A型NPモノクローナル抗体を点着した標識試薬ゾーンが設けられる。この標識抗体は、NP-Y289にも結合する、A型インフルエンザウイルスNPを共通して認識する抗体であってよいし、また、固相化した抗NP-H289抗体とは異なる部位でPandemic(H1N1)2009のNPに特異的に結合する第2の抗体であってもよい。
【0026】
標識試薬ゾーンには検体が添加され、かつ、標識抗体は、標識試薬ゾーンから流出してマトリクス内を流れる必要があるので、通常、標識試薬ゾーンは、標識抗体を点着した多孔性のパッドにより構成される。マトリックスの上流端には、展開液を貯蔵した展開液槽が設けられている。さらに、通常、上記検出ゾーンの下流に、標識抗体の展開が起きたかどうかを確認するための、標識に対する抗体を固相化した展開確認部と、さらにその下流に、流れて来た展開液を吸収するための多孔性の吸収パッドが設けられた展開液吸収ゾーンが設けられる。さらに、標識が酵素である場合には、標識試薬ゾーンよりも上流に、標識酵素の基質を点着した基質ゾーンが設けられている。
【0027】
使用時には、検体を標識試薬ゾーンに添加し、展開液槽を破って展開液をマトリックスの上端部に施す。展開液は、マトリックスの毛管現象により下流に向かって流れる。展開液が基質ゾーンを通過する際に基質が展開液中に溶出され、基質を含む展開液が流れていく。展開液が標識試薬ゾーンを通過する際に、標識抗体と検体とが展開液中に溶出され、基質、標識抗体及び検体を含む展開液が流れていく。検体中にPandemic(H1N1)2009が含まれる場合には、該ウイルスのNP(NP-H289)と標識抗体が、抗原抗体反応により結合する。これらの混合物が検出ゾーンまで流れてくると、検出ゾーンにおいて、固相化抗体と該ウイルスのNPとが抗原抗体反応により結合する。その結果、該ウイルスのNPを介して標識抗体が検出ゾーンに固定される。従って、検出ゾーンに固定された標識を測定することにより、該ウイルスを検出することができる。検体中にPandemic(H1N1)2009が含まれていない場合には、固相化抗体には何も結合されないので、標識抗体は検出ゾーンに固定されず、より下流に流れていく。従って、検出ゾーンでは標識は検出されない。検出ゾーンの下流の展開液確認部には、標識に対する抗体が固相化されているので、標識抗体は展開液確認部に固定される。展開液確認部に標識が検出された場合には、展開液はそこまで正しく流れて来たということが確認される。展開液は、さらにその下流の吸収パッドに吸収される。
【0028】
なお、上記したイムノクロマト器具の例では、抗NP-H289モノクローナル抗体を固相化抗体とし、NP-H289及びNP-Y289の両者と結合する抗ヒトA型インフルエンザウイルスモノクローナル抗体を標識抗体として説明したが、固相化抗体と標識抗体はこの逆であってもよい。また、用いる抗体は抗原結合性断片でもよい。
【0029】
イムノクロマト器具には、Pandemic(H1N1)2009を特異的に検出するNP-H289検出ゾーンに加えて、他の検出ゾーンをさらに設けてもよい。例えば、Pandemic(H1N1)2009以外のA型インフルエンザウイルスも共通して検出できるA型共通検出ゾーンを設けてもよい。この場合、標識抗体はA型のNPを共通して認識する抗A型NP抗体とし、NP-H289検出ゾーンには本発明の抗体を、そしてA型検出ゾーンにはA型のNPを共通して認識する抗A型NP抗体(標識抗体と同一の抗体でもよいし、異なる抗体でもよい)を固相化すればよい。このような同時測定器具は、ヒト検体中のインフルエンザウイルスが季節性かPandemic (H1N1) 2009かを一回の操作で判別できるので好ましい。
【0030】
本発明の免疫測定方法に適用される検体としては、NP-H289を有するインフルエンザウイルスが含まれているか否かを検出したい検体であれば特に限定されず、Pandemic(H1N1)2009の免疫測定のために本発明の免疫測定方法を実施する場合には、ヒトから分離した検体であればよい。具体例としては、血液(全血、血漿、血清を包含)、唾液、痰等の体液や、粘膜のぬぐい液、器具や設備のぬぐい液等を挙げることができるが、これらに限定されるものではない。
【実施例】
【0031】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0032】
1.抗Pandemic(H1N1)2009インフルエンザウイルスモノクローナル抗体の作製
免疫原として、Pandemic(H1N1)2009インフルエンザウイルスであるA/Narita/1/2009(H1N1)の組換え全長NPを常法により作製した。具体的には、該ウイルス株のゲノムRNAからRT-PCRによりNPをコードするcDNAを合成し、精製後、公知の発現ベクターに組み込んで大腸菌に導入し、発現したrNPをカラムにて回収・精製して得た。これをマウスに免疫し、常法のハイブリドーマ法により、免疫原に対する抗体を産生するハイブリドーマを作製した。スクリーニングは、常法により作製した下記表1に示す4種の組換え全長NPを抗原として用いたサンドイッチELISAにより実施した。
【0033】
【表1】

【0034】
FVA2-11とのサンドイッチELISA:
抗マウスIgG抗体をPBSで1μg/mlに調製した溶液を96穴アッセイプレートに50μl/wellずつ加え、37℃で1時間コーティングさせた。PBSTで洗浄後、抗NP抗体溶液を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、rNPを50μl/wellずつ加え、37℃で1時間反応させ、PBSTで洗浄後、アルカリホスファターゼ標識FVA2-11を50μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、p-NPP基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。なお、FVA2-11は、市販のインフルエンザ検出キットにも使用されている公知の抗A型NP抗体であり、A型を共通して認識可能な抗体である(文献:Gui-Rong BAI et.al.:Improvement of a Rapid Diagnosis Kit to Detect Either Influenza A or B Virus Infection. J.Vet.Med.Sci.68(1);1-6,2006、及びWO/2005/007697)。
【0035】
A/Narita/1/2009(H1N1)に反応し、A/New Caledonia/20/99(H1N1)、A/Kitakyushu/159/93(H3N2)及びA/duck/Hokkaido/Vac-1/04(H5N1)に反応しない抗体をスクリーニングしたところ、Pandemic(H1N1)2009に特異的なモノクローナル抗体が複数ライン得られた。得られた抗体について、各種インフルエンザウイルスの精製組換えNP及び培養ウイルス抗原を用いてサンドイッチELISAにより詳細に反応性を確認したところ、NT-L119は季節性インフルエンザウイルスとの交差反応性が1%以下であり、感度も非常に高いことが確認された(図1)。以下、このモノクローナル抗体NT-L119を用いて実験を行なった。
【0036】
2.抗Pandemic(H1N1)2009インフルエンザmAb NT-L119のエピトープ解析
(1) A/Narita/1/2009(H1N1)の組換えNP断片を用いた解析
新型インフルエンザウイルスA/Narita/1/2009(H1N1)の組換えNPの断片(図2)を作製し、ウエスタンブロッティングによりNT-L119の反応性を調べた。その結果、NT-L119はこれらのNP断片には反応を示さなかった。NT-L119はlinear epitopeではなくNPの立体構造(conformational epitope)を認識しているものと考えられる。
【0037】
(2) キメラNPを用いたELISA反応阻害アッセイ
下記表2に示す通り、A/Narita/1/2009(H1N1): pdmH1、A/Kitakyushu/159/93(H3N2): H3、及びA/duck/Hokkaido/Vac-1/04(H5N1): H5のキメラNPを作製し、下記の手順でELISA反応阻害アッセイを行なった。
【0038】
抗NP抗体(FVA2-11又はNT-L119)をPBSで5μg/mlに調製した溶液を96穴アッセイプレートに100μl/wellずつ加え、37℃で1時間コーティングさせた。1%スキムミルク-PBSでマスキングし、PBSTで洗浄後、ビオチン標識したpdmH1全長組換えNPと各キメラ組換えNPの混合溶液を100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、ストレプトアビジン結合アルカリホスファターゼを100μl/wellずつ加え、37℃で1時間反応させた。PBSTで洗浄後、p-NPP基質系で発色を行い、マイクロプレートリーダーにてA405nmの吸光度を測定した。
【0039】
この方法では、プレートに固相化した抗NP抗体に結合したビオチン標識pdmH1 rNPが測定される。キメラrNPが競合して固相化抗体に結合すると、ビオチン標識rNPと抗体との結合が阻害され、測定値が低くなる。これにより、キメラrNPによる阻害の有無を調べることができる。
【0040】
結果を表2に示す。NT-L119抗体とpdmH1全長NPとの結合は、N末側(aa1-333)がpdmH1である組換えNPにより阻害された。すなわち、NT-L119とNPとの結合にはNPのN末端側領域(aa1-333)が重要であることが確認された。
【0041】
【表2】

【0042】
(3) NP点変異体を用いたELISA反応阻害アッセイ
pdmH1 NPの点変異体として、第100番アミノ酸をバリンからアルギニンに置換したもの(V100R)、第190番アミノ酸をアラニンからバリンに置換したもの(A190V)、及び第289番アミノ酸をヒスチジンからチロシンに置換したもの(H289Y)を作製し、これらを競合抗原として用いて上記と同様にELISA反応阻害アッセイを行なった。
【0043】
結果は表3に示す通りであり、NT-L119抗体とpdmH1 NPとの反応には289番目のヒスチジンが重要であることが確認された。
【0044】
【表3】

【0045】
3.データベースNCBI Influenza Virus Resourceを用いたインフルエンザNP 289番目アミノ酸の解析
NCBI Influenza Virus Resourceには、現在までに同定されたインフルエンザウイルスの配列情報が登録されている。このデータベースを用いて、2005年〜2008年及び2009年7月〜12月の期間にヒトから分離されたA型インフルエンザウイルスのNPの第289番アミノ酸を調べた。その結果、表4に示す通り、Pandemic(H1N1)2009以外のインフルエンザウイルスではほぼ全ての株でチロシンであり、289番のヒスチジンはPandemic(H1N1)2009に特徴的なアミノ酸であった。H289であるNPを認識するNT-L119は、Pandemic(H1N1)2009を特異的に検出する抗体として有用である。
【0046】
【表4】

【0047】
4.A型インフルエンザ及びpdm(H1N1)2009同時測定用イムノクロマト器具の作製及び評価
(1) イムノクロマト器具の作製
A型インフルエンザウイルスを共通して検出可能な抗A型インフルエンザウイルスNP抗体と、Pandemic(H1N1)2009のNPを特異的に検出する抗体を用いて、A型インフルエンザウイルスと新型インフルエンザウイルスを同時に検出するイムノクロマト器具を作製した。
【0048】
図3及び図4に示すように、巾5mm、長さ50mmのニトロセルロース膜(ミリポア社製)のマトリクス2の展開液吸収ゾーン5側の末端から16mmと13.5mmの位置に、A型のNPを共通して認識する抗体FVA2-11の水溶液及びPandemic(H1N1)2009特異的抗体NT-L119の水溶液をそれぞれ点着して乾燥させ、検出ゾーン6a及び6bを作成した。さらに、マトリクス2の展開液吸収ゾーン5側の末端から11mmの位置に抗アルカリホスファターゼ抗体(ウサギ)を点着し乾燥させ、展開確認部10を作成した。次いで、アルカリホスファターゼ標識したFVA2-11の水溶液をパッドに点着し乾燥させ、酵素標識試薬パッド4から成る標識試薬ゾーンを作成した。
【0049】
展開液パッド3は、巾6mm、長さ20mmのろ紙(ミリポア社製)上に、基質として5−ブロモ−4−クロロ−3−インドリルリン酸(BCIP)100μgを巾6.0mmのライン状に点着して乾燥させて作成した。前記マトリクス2、展開液パッド3、酵素標識試薬パッド4及び吸収パッド5(巾10mm、長さ15mm、厚さ1mmのろ紙(ワットマン社製))を、展開液槽11を有するプラスチックケースに固定して、図3及び図4に示すA型インフルエンザ及びpdm(H1N1)2009同時測定用イムノクロマト器具とした。
【0050】
(2) 組換えNPに対する反応性
A/Narita/1/2009 (H1N1): pdmH1、A/New Caledonia/20/99(H1N1): H1、A/Kitakyushu/159/93(H3N2): H3、及びA/duck/Hokkaido/Vac-1/04(H5N1): H5の組換えNP試料を用いて、上記で作製したイムノクロマト器具の検出感度を確認した。rNP試料は、下記表5に示す通り5000〜1.25 ng/mlの濃度で用いた。イムノクロマト器具の検体添加ゾーン8に試料30μLを添加した後、変形部材に設けた押し込み部12を下方に加圧して変形させて、変形部材に付設された突起部13によって展開液パッド3を展開液槽11に挿入して展開液を展開液パッド3に供給して測定を開始した。測定開始15分後、展開確認部10の発色によって展開液の展開を確認した後、検出ゾーン6a(FVA2-11)及び6b(NT-L119)の発色を目視で測定した。結果は表5に示す通りであり、NT-L119は5000 ng/mlの高濃度であってもpdmH1以外のNPには反応せず、また、pdmH1のNPは1.25 ng/mlの低濃度でも検出でき、このイムノクロマト器具の感度と特異性が十分に高いことが確認された。
【0051】
【表5】

【0052】
(3) ウイルス株に対する反応性
各種インフルエンザウイルス株を用いてイムノクロマト器具の反応性を確認した。ウイルス株を孵化鶏卵培養して得た漿尿液を試料とし、試料希釈液として界面活性剤を含むトリス緩衝液(pH8.0)を使用した。結果は表6に示す通りであり、NPの第289番アミノ酸がヒスチジンであるブタ及びブタ由来ヒトインフルエンザウイルスに対しては、FVA2-11点着ゾーンとNT-L119点着ゾーンの両者が発色したが、NPの第289番アミノ酸がチロシンであるヒトインフルエンザウイルスに対しては、NT-L119点着ゾーンの発色が見られなかった。
【0053】
【表6】

【0054】
(4) ヒト臨床検体に対する反応性
PCR検査でPandemic(H1N1)2009陽性が確認されたヒト臨床検体(希釈鼻腔吸引液)20例を用いてイムノクロマト器具の反応性を確認した。結果を表7に示す。PCR検査ではウイルスゲノムを検出するため、抗原タンパク質を検出する抗体検査と比較して感染のより初期の段階でもウイルスを検出できる。PCR検査で陽性であった検体のうち2例において、FVA2-11点着ゾーンとNT-L119点着ゾーンのいずれも発色が認められなかった。これは、該2例においてNPが抗体で検出できる量まで蓄積していなかったためと考えられる。NT-L119は、イムノクロマト器具に適用した場合でも、インフルエンザ検査キットで既に実用化されているFVA2-11と同等の感度を発揮できることが確認された。
【0055】
【表7】

【特許請求の範囲】
【請求項1】
A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質と抗原抗体反応により結合し、第289番アミノ酸がチロシンである核タンパク質とは実質的に結合しない抗体又はその抗原結合性断片。
【請求項2】
前記抗体がモノクローナル抗体である請求項1記載の抗体又はその抗原結合性断片。
【請求項3】
請求項1又は2記載の抗体又はその抗原結合性断片を用いた免疫測定法により、検体中の、第289番アミノ酸がヒスチジンであるA型インフルエンザウイルス核タンパク質を測定することを含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスの免疫測定方法。
【請求項4】
ヒトから分離した検体について行なわれるブタ由来ヒトA型インフルエンザウイルスPandemic (H1N1) 2009の免疫測定方法である請求項3記載の方法。
【請求項5】
前記免疫測定は、固相に固定化された固相化抗体と標識された標識抗体とを用いたサンドイッチ法により行なわれ、請求項1又は2記載の抗体又はその抗原結合性断片が固相化抗体及び標識抗体の少なくともいずれか一方に用いられる請求項3又は4記載の方法。
【請求項6】
請求項1又は2記載の抗体又はその抗原結合性断片が固相化抗体として用いられる請求項5記載の方法。
【請求項7】
A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する抗体又はその抗原結合性断片が標識抗体として用いられ、かつ、A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する、前記標識抗体と同一の又は異なる抗体又はその抗原結合性断片がさらなる固相化抗体として用いられ、第289番アミノ酸がヒスチジンではない核タンパク質が同時に測定される請求項6記載の方法。
【請求項8】
イムノクロマトグラフィーによる請求項5ないし7のいずれか1項に記載の方法。
【請求項9】
請求項1又は2記載の抗体又はその抗原結合性断片を含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスを測定するための免疫測定キット。
【請求項10】
ブタ由来ヒトA型インフルエンザウイルスPandemic (H1N1) 2009の免疫測定キットである請求項9記載のキット。
【請求項11】
請求項1又は2記載の抗体又はその抗原結合性断片が、固相に固定化された固相化抗体及び標識された標識抗体の少なくともいずれか一方の形態で含まれる請求項9又は10記載のキット。
【請求項12】
請求項1又は2記載の抗体又はその抗原結合性断片が固相化抗体の形態で含まれる請求項11記載のキット。
【請求項13】
A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する、標識された抗体又はその抗原結合性断片を標識抗体として含み、かつ、A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する、前記標識抗体と同一の又は異なる抗体又はその抗原結合性断片がさらに前記固相に固定化されている、請求項12記載のキット。
【請求項14】
前記固相がイムノクロマトグラフィー用の固相である請求項11ないし13のいずれか1項に記載のキット。
【請求項1】
A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質と抗原抗体反応により結合し、第289番アミノ酸がチロシンである核タンパク質とは実質的に結合しない抗体又はその抗原結合性断片。
【請求項2】
前記抗体がモノクローナル抗体である請求項1記載の抗体又はその抗原結合性断片。
【請求項3】
請求項1又は2記載の抗体又はその抗原結合性断片を用いた免疫測定法により、検体中の、第289番アミノ酸がヒスチジンであるA型インフルエンザウイルス核タンパク質を測定することを含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスの免疫測定方法。
【請求項4】
ヒトから分離した検体について行なわれるブタ由来ヒトA型インフルエンザウイルスPandemic (H1N1) 2009の免疫測定方法である請求項3記載の方法。
【請求項5】
前記免疫測定は、固相に固定化された固相化抗体と標識された標識抗体とを用いたサンドイッチ法により行なわれ、請求項1又は2記載の抗体又はその抗原結合性断片が固相化抗体及び標識抗体の少なくともいずれか一方に用いられる請求項3又は4記載の方法。
【請求項6】
請求項1又は2記載の抗体又はその抗原結合性断片が固相化抗体として用いられる請求項5記載の方法。
【請求項7】
A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する抗体又はその抗原結合性断片が標識抗体として用いられ、かつ、A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する、前記標識抗体と同一の又は異なる抗体又はその抗原結合性断片がさらなる固相化抗体として用いられ、第289番アミノ酸がヒスチジンではない核タンパク質が同時に測定される請求項6記載の方法。
【請求項8】
イムノクロマトグラフィーによる請求項5ないし7のいずれか1項に記載の方法。
【請求項9】
請求項1又は2記載の抗体又はその抗原結合性断片を含む、第289番アミノ酸がヒスチジンである核タンパク質を有するA型インフルエンザウイルスを測定するための免疫測定キット。
【請求項10】
ブタ由来ヒトA型インフルエンザウイルスPandemic (H1N1) 2009の免疫測定キットである請求項9記載のキット。
【請求項11】
請求項1又は2記載の抗体又はその抗原結合性断片が、固相に固定化された固相化抗体及び標識された標識抗体の少なくともいずれか一方の形態で含まれる請求項9又は10記載のキット。
【請求項12】
請求項1又は2記載の抗体又はその抗原結合性断片が固相化抗体の形態で含まれる請求項11記載のキット。
【請求項13】
A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する、標識された抗体又はその抗原結合性断片を標識抗体として含み、かつ、A型インフルエンザウイルスの核タンパク質のうち、第289番アミノ酸がヒスチジンである核タンパク質及びヒスチジンではない核タンパク質の両者に結合する、前記標識抗体と同一の又は異なる抗体又はその抗原結合性断片がさらに前記固相に固定化されている、請求項12記載のキット。
【請求項14】
前記固相がイムノクロマトグラフィー用の固相である請求項11ないし13のいずれか1項に記載のキット。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−46443(P2012−46443A)
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2010−189043(P2010−189043)
【出願日】平成22年8月26日(2010.8.26)
【出願人】(306008724)富士レビオ株式会社 (55)
【Fターム(参考)】
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成22年8月26日(2010.8.26)
【出願人】(306008724)富士レビオ株式会社 (55)
【Fターム(参考)】
[ Back to top ]

