抗Nogo−Aモノクローナル抗体の製造方法
【課題】小胞体膜貫通蛋白質の一部であるレチキュロンファミリーに属するNogoのスプライシングアイソフォームNogo−Aを特異的に認識する抗Nogo−Aモノクローナル抗体及びその製造方法や、該モノクローナル抗体を含有するNogo−Aの検出試薬等を提供すること。
【解決手段】マウス胚の背軸嗅球から得たポリA RNAを逆転写し、得られたcDNAを哺乳類動物用発現ベクターに挿入した後、COS−7細胞にトランスフェクションし、COS−7細胞上に発現したタンパク質を、E14.5マウスの終脳から単離した嗅球軸索を用いて免疫したハムスターのリンパ球と、マウスのミエローマ細胞とを用いて作製したモノクローナル抗体NG1と反応させて免疫染色し、免疫陽性細胞から単離したcDNAクローンをサブクローンし、DNAシーケンサーを用いて配列を決定し、抗原分子Nogo−Aを同定する。
【解決手段】マウス胚の背軸嗅球から得たポリA RNAを逆転写し、得られたcDNAを哺乳類動物用発現ベクターに挿入した後、COS−7細胞にトランスフェクションし、COS−7細胞上に発現したタンパク質を、E14.5マウスの終脳から単離した嗅球軸索を用いて免疫したハムスターのリンパ球と、マウスのミエローマ細胞とを用いて作製したモノクローナル抗体NG1と反応させて免疫染色し、免疫陽性細胞から単離したcDNAクローンをサブクローンし、DNAシーケンサーを用いて配列を決定し、抗原分子Nogo−Aを同定する。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】
本発明は、ミエリンにおける軸索反発因子であるNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法、より詳しくは、嗅索(LOT)で免疫した非ヒト動物の脾細胞を用いて作製したハイブリドーマの培養上澄液を終脳の切片上で免疫化学的方法によりスクリーニングすることによって得られるNogo−Aを特異的に認識するモノクローナル抗体の製造方法や、かかるモノクローナル抗体を含有するNogo−Aの検出試薬等に関する。
【0002】
【従来の技術】
目的とするタンパク質に対する抗体を入手することは、その同定・機能解析において重要な位置を占めるが、動物に目的とする抗原を投与して免疫する従来の方法は、多種・多量の抗原と長い時間、多大な労力を要することから、近年、ファージ抗体ライブラリーを用いて抗体を作製する方法が確立されている。かかる方法は、繊維状ファージのコートタンパク質に抗体を融合させることにより、ファージの表面上に抗体を提示(ディスプレイ)するシステムを応用したもので、抗体遺伝子をPCRで増幅して多種類の抗体遺伝子を含むライブラリーを作製し、これをファージ上に提示させることによってファージディスプレイライブラリーとするものであって、このファージシステム(例えば、非特許文献1参照。)によるとヒトの抗体の抗原を同定することが可能となる。このファージ抗体ライブラリーを用いるスクリーニング方法は、ファージディスプレイ法と呼ばれ、従来から種々の細胞表面レセプターと特異的に結合するリガンドや種々の抗原を同定するために使用されている。ファージ抗体ライブラリーの作製方法やそれを用いたイムノチューブ法、マグネティックビーズ法等のスクリーニング法についても既に数多く報告されている(例えば、非特許文献2、3参照。)。
【0003】
その他、膜分子のクローニング方法として、例えばCOS7細胞とSV40の複製起点を含んだ発現ベクターによる一過性発現を利用して、動物細胞発現ベクターで作製されたcDNAライブラリーをCOS7細胞に導入し、細胞表面上にcDNAライブラリー由来の膜蛋白質を発現させ、目的とする膜分子を発現している細胞をその膜分子に対する抗体やリガンドを用いてパニングあるいはFACSで濃縮し、プラスミドDNAを回収して再びCOS7細胞にトランスフェクションし、濃縮操作を繰り返す方法や、発現ベクターcDNAライブラリーをいくつかの小さなプールに分け、COS7細胞に導入し、アイソトープで標識した抗体やリガンドを用いて膜分子の発現を検出し、陽性プールをさらに少数のプラスミドからなるプールに分けてトランスフェクションを繰り返しクローン化する方法が知られている(例えば、非特許文献4参照。)。
【0004】
また、ヒト細胞からポリアデニル化RNAを単離し、単離されたポリアデニル化RNAを用いて2本鎖cDNAを作り、この2本鎖cDNAをクローニングベクターに挿入して組換え発現ベクターを作製し、この組換え発現ベクターで宿主をトランスフォームして前記抗原を発現させ、リューマチ性関節炎患者の血清からの抗体を用いて、前記抗体が前記発現抗原に結合することを、抗ヒトIgM抗体−アルカリホフファターゼ複合体とアルカリホスファターゼ顕色基質とによって検出することによりトランスフォームされた宿主を選択する、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用抗原をコードする組換えDNAの作製方法(例えば、特許文献1参照。)も知られている。
【0005】
他方、神経軸索の成長等に関して以下の知見が報告されている。
神経系の発達は、軸索が活発に成長する能力によって特徴づけられている。成長円錐という特異化された先端によって率先されることにより、多くの軸索が胚脳中において活発に伸張する(例えば、非特許文献5、6参照。)。しかし、中枢神経系が成熟すると、軸索は成長能力を喪失する(例えば、非特許文献7参照。)。中枢軸索の再生に関する研究がこれまで盛んに行なわれてきたが、臨床において軸索の再生を誘導することはたいへん難しいとされている。胚軸索と成体軸索は成長能力に関して異なっているが、これは成体神経系における成長抑制環境が原因の一つであると考えられている(例えば、非特許文献8参照。)。例えば、インビボ及びインビトロの両方における過去の研究から、中枢ミエリンが成体神経系における軸索成長の阻止に関与していることがすでに明らかにされている(例えば、非特許文献9、10参照。)。
【0006】
嗅覚体系は、嗅球及びそれが終脳中まで成長した嗅索(LOT)とよばれるものから成り立っている。嗅索は単純であり(例えば、非特許文献11、12参照。)器官培養により簡単に再生できることから(例えば、非特許文献13参照。)、軸索ガイダンスの細胞機構及び分子機構に関する有益な情報を提供してきた(例えば、非特許文献14〜17参照。)。また、ミエリンにおける軸索反発因子(axonal repulsive factor)であるNogo(例えば、非特許文献18〜22参照。)が成体神経系中において希突起膠細胞により産出されることは、過去の研究からすでに知られている(例えば、非特許文献23〜25参照。)。また、Nogoが中枢軸索の成長を阻止することもすでに知られている(例えば、非特許文献26、27参照。)。
【0007】
抗Nogoモノクローナル抗体として知られているIN−1が、中枢神経系において軸索の再生をインビトロとインビボの両方で増進させることが報告されている(例えば、非特許文献28〜34参照。)。Nogoは、小胞体(ER)膜貫通蛋白質の一部であるレチキュロン(Reticulon)ファミリーに属している(例えば、非特許文献35、36参照。)。レチキュロンファミリーの他のメンバーと同様に、Nogoは主にERに局在しているが、細胞表面にも存在している(例えば、非特許文献19、20、31参照。)。Nogoには、3つのスプライシングアイソフォーム、Nogo−A、Nogo−B及びNogo−Cがあり、これらはC−末端ドメインが共通しているが、N−末端配列が相違している。Nogo−Aは最も長いアイソフォームで、ラットでは1163個のアミノ酸残基からなっている。Nogo−Bは、Nogo−AのN−末端部分と、スプライスされた共通のC−末端ドメインを有している。Nogo−Cは最も短いアイソフォームで、共通のC−末端ドメイン以外に、N−末端上にある独特の短いアミノ酸を含んでいる。最近の研究により、Nogoは、反発作用に対する2つの機能的ドメイン、すなわち、共通するC−末端ドメインにある66アミノ酸配列と、Nogo−Aに特異的なN−末端配列をもつことがわかっている(例えば、非特許文献38参照。)。
【0008】
【特許文献1】
特表平10−513257号公報
【非特許文献1】
Proc.Acad.Sci.USA 80, 1194−1198, 1983
【非特許文献2】
Science 249, 386−390 1990
【非特許文献3】
Methods in Enzymology 217, 228−257 1993
【非特許文献4】
Proc.Acad.Sci.USA 84, 3365−3369, 1987
【非特許文献5】
Science 233, 740−746, 1986
【非特許文献6】
Science 274, 1123−1131, 1996
【非特許文献7】
Curr. Opin. Neurobiol 11, 89−94, 2001
【非特許文献8】
Nature 296, 150−152, 1982
【非特許文献9】
Neuron 24, 639−647, 1999
【非特許文献10】
J. Neurosci. 8, 2381−2393, 1988
【非特許文献11】
Brain Res. Rev. 11, 1−45, 1986
【非特許文献12】
J. Comp. Neurol. 223, 177−202, 1984
【非特許文献13】
J. Neurobiol. 29, 127−137, 1996
【非特許文献14】
J. Neurobiol. 32, 415−425, 1997
【非特許文献15】
J. Neurobiol. 38, 93−104, 1999
【非特許文献16】
J. Neurobiol. 21, 2373−2379, 2001
【非特許文献17】
Nature 343, 269−343, 1990
【非特許文献18】
J. Cell Biol. 106, 1281−1288, 1988
【非特許文献19】
Nature 403, 434−438, 2000
【非特許文献20】
Nature 403, 439−444, 2000
【非特許文献21】
Nature 403, 383−384, 2000
【非特許文献22】
J. Biol. Chem. 273, 19283−19293, 1998
【非特許文献23】
Neuron 1, 85−96, 1988
【非特許文献24】
J. Neurocytol. 23, 209−217, 1994
【非特許文献25】
J. Neurosci. 9, 1126−1133, 1989
【非特許文献26】
Nature 378, 498−501, 1995
【非特許文献27】
Nature 343, 269−343, 1990
【非特許文献28】
Nature 378, 498−501, 1995
【非特許文献29】
J. Neurosci. 20, 8061−8068, 2000
【非特許文献30】
J. Neurosci. 20, 2275−2286, 2000
【非特許文献31】
Neuron 1, 85−96, 1988
【非特許文献32】
J. Neurosci. 12, 2112−2119, 1992
【非特許文献33】
J. Neurosci. 9, 1126−1133, 1989
【非特許文献34】
Nature 343, 269−343, 1990
【非特許文献35】
Genomics 32, 191−199, 1996
【非特許文献36】
J. Biol. Chem. 268, 13439−13447, 1993
【非特許文献37】
Neuron 1, 85−96, 1988
【非特許文献38】
Nature 409, 341−346, 2001
【0009】
【発明が解決しようとする課題】
本発明の課題は、小胞体膜貫通蛋白質の一部であるレチキュロンファミリーに属するNogoのスプライシングアイソフォームNogo−Aを特異的に認識する抗Nogo−Aモノクローナル抗体及びその製造方法や、該モノクローナル抗体を含有するNogo−Aの検出試薬等を提供することにある。
【0010】
【課題を解決するための手段】
これまでモノクローナル抗体の抗原分子同定法には、ファージライブラリーを用いた発現スクリーニングの系が実用化されていたが、この系では半ば変性した蛋白質断片を抗体に認識させるので、抗原蛋白質の立体構造を認識するような抗体については適用できず、かかる方法では同定できない抗原が多数存在していた。本発明者らは、マウス胚の背軸嗅球から得たポリA RNAを逆転写し、得られたcDNAを哺乳類動物用発現ベクターに挿入した後、COS−7細胞にトランスフェクションし、COS−7細胞上に立体構造を形成して発現したタンパク質を、E14.5マウスの終脳から単離した嗅球軸索を用いて免疫したハムスターのリンパ球と、マウスのミエローマ細胞とを用いて作製したモノクローナル抗体NG1と反応させて免疫染色し、免疫陽性細胞から単離したcDNAクローンをサブクローンし、DNAシーケンサーを用いて配列を決定し、新規モノクローナル抗体NG1の抗原分子Nogo−Aを同定することができることを見い出し、本発明を完成するに至った。
【0011】
すなわち本発明は、嗅索で免疫した非ヒト動物の脾細胞と、前記非ヒト動物と異種のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる、免疫組織化学的方法によりスクリーニングすることを特徴とする抗Nogo−Aモノクローナル抗体の製造方法(請求項1)や、Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させ、かかるNogo−Aを発現した哺乳類培養細胞を、免疫組織化学的方法によりスクリーニングしたモノクローナル抗体で免疫染色することを特徴とする請求項1記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項2)や、哺乳類培養細胞が、COS細胞であることを特徴とする請求項2記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項3)や、嗅索で免疫したハムスターの脾細胞とマウスのミエローマ細胞とを融合することを特徴とする請求項1〜3のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項4)や、モノクローナル抗体が、Nogo−Aに対して特異的に反応し、Nogo−B及びNogo−C並びにレチキュロン1Aに対して交差反応せず、かつ、発生期の神経系における成長中の軸索を強く認識するモノクローナル抗体であることを特徴とする請求項1〜4のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項5)や、モノクローナル抗体が、希突起膠細胞の細胞体に強く結合し、ミエリン化軸索にはほとんど結合しないモノクローナル抗体であることを特徴とする請求項5記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項6)や、モノクローナル抗体が、培養嗅球ニューロンの神経突起の成長円錐を強く認識するモノクローナル抗体であることを特徴とする請求項5又は6記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項7)に関する。
【0012】
また本発明は、請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体(請求項8)や、請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの検出試薬(請求項9)や、請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの過剰発現に起因する疾病の予防・治療薬(請求項10)や、請求項1〜5のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有(請求項11)や、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体産生能を有することを特徴とするハイブリドーマ(請求項12)や、ハイブリドーマが、Hamster−Mouse hybridoma NG1(FERM BP−8263)であることを特徴とする請求項12記載のハイブリドーマ(請求項13)に関する。
【0013】
【発明の実施の形態】
本発明のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法としては、嗅球軸索で免疫した非ヒト動物(例えばハムスター)の脾細胞と、前記非ヒト動物と異種(例えばマウス)のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる、免疫組織化学的方法によりスクリーニングすることを特徴とする抗Nogo−Aモノクローナル抗体であれば特に制限されるものではないが、Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させ、かかるNogo−Aを発現した哺乳類培養細胞を、免疫組織化学的方法によりスクリーニングしたモノクローナル抗体、すなわち、嗅球軸索で免疫した非ヒト動物の脾細胞と、前記非ヒト動物と異種のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる免疫組織化学的方法によりスクリーニングしたモノクローナル抗体で免疫染色することにより、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体を再現性よく製造することができる。また、本発明のハイブリドーマとしては、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体産生能を有するものであれば特に制限されないが、Hamster−Mouse hybridoma NG1を具体的に例示することができる。このHamster−Mouse hybridoma NG1は独立行政法人産業技術総合研究所特許生物寄託センターに寄託番号FERM BP−8263として寄託されている。
【0014】
上記モノクローナル抗体での免疫染色方法としては、例えば、ペルオキシダーゼ、アルカリフォスファターゼ、β−ガラクトシダーゼ等で酵素標識されたモノクローナル抗体を、抗原抗体反応により細胞表面上に立体構造を形成した状態で発現している膜タンパク質に反応させた後、前記酵素の基質及び発色剤の添加によって色素を生成させ、呈色した色素を観察する酵素免疫染色方法や、FITC等で蛍光標識されたモノクローナル抗体を、抗原抗体反応により細胞表面上に立体構造を形成した状態で発現している膜タンパク質に反応させた後、蛍光顕微鏡で観察する蛍光免疫染色方法を挙げることができる。
【0015】
Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させるには、哺乳類培養細胞用発現ベクターを好適に用いることができる。かかる哺乳類培養細胞用発現ベクターとしては、真核細胞中に蛋白質を効率的に発現可能とし、且つコンピテント細胞に形質転換することができるプラスミドベクターやトランスフェクションすることができるファージベクターであればどのようなものでもよく、発現ベクターの複製を可能とする複製オリジン、発現のためのプロモーター、スプライスシグナル、ポリA付加シグナル、薬剤選択マーカー、エンハンサー等を必要に応じて選択し、組み合わせて構築することができる。発現ベクターの複製を可能とする複製オリジンとしては、SV40ウィルス、パピローマウィルス、EBウィルス等を挙げることができ、また発現のためのプロモーターとしては、β−アクチンプロモーター、チミジンキナーゼプロモーター、SV40プロモ−ター、アデノウィルス主要後期プロモーター、サイトメガロウィルスプロモーター等を挙げることができる。さらに、スプライスシグナル、ポリA付加シグナル、クローン選択を効率化するための薬剤選択マーカー、細胞特異的に働くエンハンサーの他、導入遺伝子の発現を制御する転写制御遺伝子等を付加してもよい。具体的には、上記プラスミドベクターとしてpCAGGS(Gene 108, 193−200, 1991)、pcDL−SRα296(Molecularand CellularBiology 8, 466−472, 1988)、pEF−BOS(Nucleic Acid Research 18, 5322, 1990)等を好適に例示することができるが、これらの中でも、サイトメガロウィルスのエンハンサー、チキンβ−アクチンプロモーター、ラビットβ−グロビン3’スプライスシグナル、ラビットβ−グロビン3’隣接領域、SV40複製オリジンを有し、哺乳動物細胞中で組込んだ遺伝子を高い効率で発現することができるpCAGGSが特に好ましい。
【0016】
また、上記哺乳類培養細胞としては、哺乳類培養細胞用発現ベクターにNogo−AのcDNAを組み込んだ、抗原タンパク質Nogo−Aをトランジェントにあるいはステイブルに細胞表面上に立体構造を形成した状態で発現させることができる、哺乳類由来の培養細胞であれば特に制限されるものではなく、COS細胞、BHK21細胞、HeLa細胞、L細胞、NIH3T3細胞、neuro2a細胞等を例示することができるが、上記抗原タンパク質Nogo−Aを効率よくトランジェントに発現させうる点でCOS細胞が好ましい。
【0017】
本発明のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られる抗Nogo−Aモノクローナル抗体としては、Nogo−Aに対して特異的に反応し、Nogo−B及びNogo−C並びにレチキュロン1Aに対して交差反応せず、かつ、発生期の神経系における成長中の軸索を強く認識するモノクローナル抗体、好ましくは、希突起膠細胞の細胞体に強く結合し、ミエリン化軸索にはほとんど結合しないモノクローナル抗体や培養嗅球ニューロンの神経突起の成長円錐を強く認識するモノクローナル抗体であるNG1を好適に例示することができる。そして、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られる抗Nogo−Aモノクローナル抗体は、Nogo−Aの検出試薬として有利に用いることができる。
【0018】
本発明のNogo−Aの過剰発現に起因する疾病の予防・治療薬としては、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られるNogo−Aの細胞外ドメインに結合する抗Nogo−Aモノクローナル抗体を含有する薬剤であれば特に制限されるものではなく、また、本発明のNogo−Aの過剰発現に起因する疾病の診断薬としては、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られるNogo−Aの細胞外ドメインに結合する抗Nogo−Aモノクローナル抗体を含有する試薬であれば特に制限されるものではない。上記Nogo−Aの過剰発現に起因する疾病としては、神経変性疾患、神経損傷などが考えられる。
【0019】
また、本発明の上記予防・治療薬を医薬品として用いる場合は、薬学的に許容される通常の担体、結合剤、安定化剤、賦形剤、希釈剤、pH緩衝剤、崩壊剤、可溶化剤、溶解補助剤、等張剤などの各種調剤用配合成分を添加することができる。これら予防・治療薬を用いる予防・治療方法においては、患者の性別・体重・症状に見合った適切な投与量の上記予防・治療薬を、経口的又は非経口的に投与することができる。すなわち通常用いられる投与形態、例えば粉末、顆粒、カプセル剤、シロップ剤、懸濁液等の剤型で経口的に投与することができ、あるいは、例えば溶液、乳剤、懸濁液等の剤型にしたものを注射の型で非経口投与することができる他、スプレー剤の型で鼻孔内投与することもできる。
【0020】
【実施例】
以下、実施例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらの例示に限定されるものではない。
実施例1[モノクローナル抗体NG1が認識する抗原分子の同定]
実施例1A(実験材料と方法)
(マウス)
日本エスエルシー株式会社からICRマウスを購入した。腟栓が見つかった日の昼を、胚日齢0.5日(E0.5)とみなした。生後2〜3ヶ月の成体マウスを本実験において用いた。また、オリエンタル酵母工業株式会社から、生後8週間のアルメニアンハムスターを購入した。本実験における手法は、国立遺伝学研究所動物委員会による承認をうけている。
【0021】
(モノクロナール抗体の作製)
E14.5である約300個のマウス胚から嗅索(LOT)を機械的に切除し、リン酸バッファー(PBS)中で4%のパラホルムアルデヒド(PFA)を用いて固定し、PBS中で洗浄及び懸濁をした後、これを免疫源としてアルメニアンハムスターの後足に注射した。この免疫処理を3週間ごとに4回繰り返し、最後の追加抗原刺激免疫処理を行なってから3日後に、鼠径リンパ節及び膝窩リンパ節を回収して、それらをマウス骨髄腫細胞(NS1)と公知の方法を用いて融合させた(J. Immunol. 130, 309−312, 1983、J. Neurosci. 18, 7800−7810, 1998、Dev. Biol. 122, 90−100, 1987)。E14.5のマウス終脳由来の免疫ハイブリドーマ培養物の培養上澄液を免疫組織化学的方法によってスクリーニングした。クローニングを行なうため、先端の尖ったガラス製キャピラリーを用いてハイブリドーマ細胞個体を取りだし、10%のウシ胎児血清(JRH Bioscience社製)及び10%のハイブリドーマクローニング因子(Igen社製)を添加したダルベッコ改変イーグル培地(DMEM)(Sigma社製)を含む96ウェル細胞プレート(Becton Dickinson社製)上に蒔いた。
【0022】
(免疫組織化学法)
マウス胚の脳を、4%パラホルムアルデヒド(PFA)を含むPBSに4℃下で一晩固定し、20%スクロースを含むPBSに一晩浸し、OCTコンパウンド(Sakura Finetechnical社製)中で凍結させた。これを凍結切片作製装置(クリオスタット)上で厚さ14〜20μmの切片に分け、ガラススライド(松浪ガラス社製)上に載せた。かかる切片を、1%スキムミルク/TBST(10mMのTris−HCL、pH7.4、130mMのNaCl、0.1%のTween20)を有するモノクローナル抗体NG1ハイブリドーマクローンの培養上澄液を1/10に希釈した溶液中で一晩インキュベーションし、TESTを用いて洗浄した後、蛍光発光(FITC)が結合している抗アルメニアンハムスターIgG(Jackson Immunoresearch社製)を用いて結合抗体を視覚化した。ラビット抗グルタチオン−S−トランスフェラーゼπ抗体(Medical Biological Laboratories社製)及びCy3結合抗ラビットIgG抗体(Jackson社製)を用いてラビット抗希突起膠細胞を染色した。ホールマウント免疫染色法は、公知の方法(J.Neurobiol. 29, 127−137, 1996、J. Neurosci. 20, 5802−5812, 2000)に準拠した方法で行った。すなわち、E13.5マウス胚の終脳半球を切断し、24〜28時間、5%のスキムミルク/TBSTを用いてモノクローナル抗体NG1培養上澄液を10倍に希釈した溶液中においてインキュベーションした。この免疫反応を視覚化するために、ビオチン化した抗アルメニアンハムスターIgG抗体(Jackson社製)及びElite ABC Kit(Vector Laboratories, Burlingame, CA)を用いて処理した。
【0023】
(嗅球神経の分離培養)
Masuda−Nakagawa(Neurosci. Res. 23, 171, 1999)及びMori(Neurosci. Res. 24, 160, 2000)に記載の方法に従い、E14.5の嗅球をトリプシン処理し、穏やかなピペット処理を行なうことにより単一細胞に分離した。ポリリシン(Sigma社製)によりコーティングした4ウェルチャンバースライド(Nalge Nunc社製)の各ウェルに細胞密度が1×105細胞となるように調整した。神経膠細胞を用いて条件づけ、B−27 component(Invitrogen社製)を補った神経細胞培養用基礎培地Neurobasal mediumを用いてCO2インキュベーター中において5日間、かかる細胞を培養した。培養が終了してから2時間、4%のPFAで得られた細胞を固定し、上記方法によりモノクロナール抗体を用いてかかる細胞に対して免疫染色を行なった。
【0024】
(モノクローナル抗体NG1の抗原の発現クローニング)
モノクローナル抗体NG1の抗原の発現クローニングは以下のように行った。E14.5のマウス胚の背軸嗅球から得たポリA RNAを、cDNAライブラリー構築キット(Stratagene社製)を用いてcDNAに逆転写した。真核細胞中に蛋白質を効率的に発現可能とし、且つコンピテント細胞に形質転換するプラスミドベクターpCAGGS(大阪大学宮崎純一博士より供与)中に、前記cDNAを挿入することにより、約100クローンのプラスミドのプールを調製し、トランスフェクション試薬(FuGene 6; Roche社製)を用いてCOS−7細胞中にトランスフェクションした。続けて2日間、PBS中の4%のPFAを用いて固定し、モノクローナル抗体NG1を用いて免疫染色した。免疫応答細胞は、蛍光顕微鏡を用いてスクリーニングした(Axioplan 2; Carl Zeiss社製)。スクリーニングで得た約240個のプールから、強い免疫陽性細胞を産出するプールを同定した。かかるプールをさらに小さなプールに分け、単一ポジティブcDNAクローンが得られるまでアッセイを繰り返した。単離したcDNAクローンをサブクローンし、DNAシーケンサー(CEQ2000;Beckman社製)を用いて配列を決定した。また、マウスNogo−Aのヌクレオチド配列をデータベースに登録した(アクセッションNo.:AB073672)。
【0025】
実施例1B(結果)
(モノクローナル抗体NG1の作製)
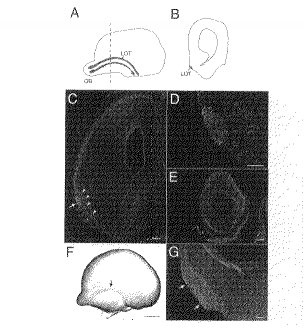
E14.5のマウスの終脳から機械で切除した嗅球軸索を用いてハムスターを免疫した。かかるハムスターから調製したリンパ球をマウス骨髄腫細胞と融合させた。ハイブリドーマ細胞の培養上澄液を、嗅球軸索からなるLOTに結合させるため、切片上で免疫組織化学的にスクリーニングした(図1A、B)。スクリーニングを行った約2000のハイブリドーマ細胞株から、LOTへの強い結合を示したモノクローナル抗体NG1を単離した。かかるモノクローナル抗体NG1を用いた免疫染色パターンを以下に示す。
【0026】
(モノクローナル抗体NG1による中枢嗅覚系の免疫染色)
嗅球軸索の盛んな伸長が、E14.5の終脳に認められている(J. Neurobiol. 29, 127−137, 1996)が、モノクローナル抗体NG1は、LOTにおける成長中の軸索を強く標識した(図1C)。これらの軸索は均一には染色されず、ところどころに強く標識される部位が斑点状に認められた(図1D)が、こうした斑点に対応する構造は同定できなかった。LOTのより深い領域では、嗅覚皮質中で腺維の染色も認められた(図1C)。これは、嗅覚皮質の内在ニューロン(intrinsic neuron)の突起部が染色されたものと思われる。嗅球においては、嗅球を通る多くの腺維が至るところで染色されていた(図1E)。LOTへと伸長している軸索も同様に染色されているが、こうした伸長ニューロンの細胞体は、はっきりとは染色されていなかった(図1E)。
【0027】
胚形成期の終脳のホールマウント調製物において、嗅球軸索がモノクローナル抗体NG1によって強く染色されているのが認められた(図1E)。標識した軸索は、嗅覚皮質でアーチ形の突起部を形成しており、これは、以前に報告(J. Neurosci. 21, 2373−2379, 2001、J. Neurobiol. 29, 127−137, 1996)されている嗅球軸索用マーカーによる染色と類似している。しかし、終脳の他の部分では、モノクローナル抗体NG1による標識は弱いものだった。このことは、弱いものではあるが至るところで生じている抗原の発現が、発生期の神経系において、モノクローナル抗体NG1に認識されたことを示唆している。
出生後も、LOTはモノクローナル抗体NG1により染色された(図1G)。しかし、その場合は、終脳の他の部位で染色が広範囲に及ぶことは少なかった。それ以前の発生ステージの場合と比較して、軸索には斑点が見られず、もっと均一に染色されていた。
【0028】
(神経系の他の部位の免疫染色パターン)
一般に、モノクローナル抗体NG1は、長く成長した軸索を強く標識していた。内包、前交連、脳梁、分界条といった主要な軸索経路はすべて、胚形成期中に強く染色された(図2R>2A、B)。分化したニューロンが豊富な、皮質板などの領域も染色された(図1C、2A)。脳とは別個に、嗅神経及び視神経は、かかるモノクローナル抗体に強く染色された(図2C、D)。モノクローナル抗体NG1は、末梢神経及び筋肉も標識したが、他の非神経組織は標識しなかった(図2D)。これは、神経系及び筋肉においてかかる抗原の特異的発現がモノクローナル抗体NG1に認識されたことを示唆している。発生が進行するにつれ、モノクローナル抗体NG1による軸索の標識の鮮明度は低下していった。P7の時点で、まだ基線レベルより強く染色される軸索もあった(図2E、F)が、周辺部に弱い染色部位が偏在していたため、不鮮明だった。
【0029】
(モノクローナル抗体NG1による成長円錐の標識)
モノクローナル抗体NG1は、発生期の神経系における成長中の軸索を強く標識するため、培養中に盛んに伸長する神経突起における、モノクローナル抗体NG1が認識する抗原の細胞中の局在について調べた。モノクローナル抗体NG1は、嗅球ニューロンの神経突起の遠位部分を優先的に標識した(図3)。遠位末端(distal tip)の成長円錐はとくに強く標識された。細胞体及び神経突起で、小胞染色が明瞭に認められることもあった。生存ニューロンを、固定を行わずにモノクローナル抗体と共にインキュベーションしたところ、細胞表面の標識は検出されなかった。これは、モノクローナル抗体NG1に対するエピトープが、これらのニューロンの細胞質中に存在することを示唆している。
【0030】
(モノクローナル抗体NG1が認識する抗原分子の同定)
モノクローナル抗体NG1が認識する抗原を同定するため、COS7細胞中でcDNAライブラリーを発現させ、モノクローナル抗体NG1に免疫反応性をもつ生成物を産生するクローンをスクリーニングした。およそ24,000のcDNAクローンを分析した後、#4−1D9というクローンが、強い免疫陽性をもつ物質を産生することがわかった(図4R>4B)。挿入物のヌクレオチド配列から、Nogoのマウス相同物をコードする1つのオープンリーディングフレームが判明した。単離したcDNAクローンである#4−1D9は、Nogo−Aを部分的にコードしており、完全な配列の3’側半分をカバーしている(図4A)。COS−7でかかるクローンを発現させたとき、N−末端から推定593番目の残基上の内部メチオニンで翻訳が始まり、C−末端の最後まで続くと推測された(図4R>4Aの#4−1D9)。Nogoの共通するC−末端ドメインには、2つの疎水性ドメインが含まれており、これらはER中で膜貫通ドメインとして機能すると考えられている(J. Cell. Sci. 107, 2403−2416, 1994)。#4−1D9クローンが産生した免疫反応性生成物は、実際に、COS−7細胞中に広がるレース様の網状組織に分布していた(図4B)。これは、ERの典型的な分布を示すものである。
【0031】
モノクローナル抗体NG1があらゆる形のNogoを認識するのか、それともNogo−Aだけを認識するのかを調べるため、cDNAクローンから共通のC−末端ドメインを切除した(図4Aの#4−1D9ΔC)。その場合もやはりモノクローナル抗体NG1は、前記の切除を受けた蛋白質を認識したが、C−末端上のERにおける保存シグナルの欠失により、その分布は細胞質全体に広がった(図4C)。この結果により、モノクローナル抗体NG1はNogo−Aに特異的に結合するが、その他の形のNogoには結合しないことがわかった。モノクローナル抗体NG1が認識するNogo−A特異的ドメインには、レチキュロンファミリーの他のメンバーとの相同性がまったくない。そのため、モノクローナル抗体NG1が他のレチキュロン蛋白質とも結合するとは考えにくい。事実、本発明者らは、モノクローナル抗体NG1がCOS−7細胞中で発現しているレチキュロン1Aとは結合しないことを確認している。
【0032】
(モノクローナル抗体NG1による、成体神経系中の希突起膠細胞の標識)
モノクローナル抗体NG1が切片中のNogo−Aを認識するかどうかを調べるため、成体の中枢神経系の切片をモノクローナル抗体NG1で免疫染色した。成体神経系の軸索は、モノクローナル抗体NG1によってはほとんど染色されなかった。そのかわり、脳全体に散在する細胞体が強く染色されているのが観察された(図5A、B)。モノクローナル抗体NG1陽性細胞の形態及び分布から、それらが希突起膠細胞であることがわかった。このことは、希突起膠細胞のマーカーであるグルタチオン−S−トランスフェラーゼ(GST)π(EMBO J. 19, 341−348, 2000)によるかかる切片の二重免疫染色で確認された(図5C、D)。
【0033】
成体の脊髄におけるNogo−A蛋白質の分布については、これまでにいくつかの研究報告がある(Nature 403, 434−438, 2000、J. Neurocytol. 23, 209−217, 1994)。それらに従い、成体の脊髄切片をモノクローナル抗体NG1で染色した。かかるモノクローナル抗体により、脊髄の白質全体に分布している希突起膠細胞及びその突起部分が強く染色された(図5E)。この染色パターンは、報告されている、Nogo−Aに対するポリクローナル抗体を用いた場合の免疫染色(Nature 403, 434−438, 2000)と同一だった。しかし、本来Nogo−Aに対する抗体であるモノクローナル抗体IN−1を用いた染色(J. Neurocytol. 23, 209−217, 1994)と比較すると、モノクローナル抗体NG1による染色では、希突起膠細胞の細胞体がより鮮明に浮かびあがっており、かかる抗体自体は、ミエリン化軸索にはほとんど結合していなかった。染色パターンがこのように異なる理由は、現在のところ不明である。
【0034】
本実施例において、本発明者らは、発生期の神経系における成長中の軸索と強く結合するモノクローナル抗体NG1を作製し、このモノクローナル抗体がNogo−A蛋白質と特異的に結合することを示した。成体の神経系をこのモノクローナル抗体で染色した場合の染色パターンは、報告されているNogo−Aの発現と一致するものだった(Nature 403 434−438, 2000、Nature 403 439−444, 2000)。発生期のニューロンにはNogo mRNAの強い発現が見られるとの最近の報告(Exp. Neurol. 169, 319−328, 2001)と考えあわせ、モノクローナル抗体NG1は発生期の神経系中のNogo−Aを認識すると結論づけることができる。本発明により、モノクローナル抗体NG1が発生期の神経系中のNogo−Aを認識するということから、盛んに成長している軸索中で、軸索成長の阻害因子であるNogoが強く発現しているという、やや意外な新たな知見が得られた。
【0035】
【発明の効果】
本発明により製造される抗Nogo−Aモノクローナル抗体は、神経機能の研究に広く利用できるのみならず、Nogo−Aの細胞外ドメインを認識するため、この軸索伸長抑制因子の活性を阻害できる可能性が高く、様々な神経再生に応用できる可能性がある。また、抗Nogo−Aモノクローナル抗体NG1は、抗Nogoモノクローナル抗体として知られているIN−1に比べてNogo−Aに対する特異的結合活性が大きい。
【図面の簡単な説明】
【図1】モノクローナル抗体NG1による中枢嗅覚系の免疫染色の様子を示す図である。
(A、B):終脳の側面(A)及び冠状面(B)の概略図。(A)の左部分が吻側であり、(B)の左部分が側面である。(A)(B)共にその上部が背面となっている。嗅球(OB)軸索が、終脳内部の尾側に伸長し、終脳表面で外側嗅索(LOT)を形成している。
(C):モノクローナル抗体NG1で染色したE14.5の終脳の冠状切片。LOT(矢印)が強く染色されている点に注意。嗅覚皮質(矢頭)及び皮質板も、かかるモノクローナル抗体で染色されている。
(D):高拡大率でのLOT。軸索は均一に染色されておらず、強く標識された部位が斑点となっている。
(E):前記モノクローナル抗体で染色した、大量の繊維をもつE14.5の嗅球。
(F):モノクローナル抗体NG1による、E13.5の終脳の全量免疫染色。他の終脳部位と同様に、LOT(矢印)を形成している嗅球軸索でも染色が認められる。
(G):モノクローナル抗体NG1で染色したP0の終脳。LOT(矢印)は、やはり他の部位よりも強く染色されている。
スケールバーは50μm(A−D及びF)、500μm(E)を表す。
【図2】モノクローナル抗体NG1による、神経系の他部位の免疫染色の様子を示す図である。
(A):モノクローナル抗体NG1で染色したE14.5の前脳の冠状切片。内包(矢印)及び髄条(矢頭)において軸索が強く染色されている点に注意。
(B):E14.5の前脳の後部水平部位(posterior level)上の切片。分界条(矢印)中の軸索の束が強く標識されている。
(C):E14.5の嗅上皮から伸長している嗅覚神経(矢頭)の強い染色。(D):E14.5の眼球の、強く標識された視神経(矢印)。眼筋(矢頭)も前記モノクローナル抗体によって染色されている。
(E):P7の前交連(矢印)は、やはり前記モノクローナル抗体によって強く染色されている。
(F):P7の脳梁(矢印)は、周辺部位よりもやや強いレベルで染色されている。
スケールバーは50μmを表す。
【図3】モノクローナル抗体NG1による、培養した嗅球ニューロンの免疫染色の様子を示す図である。
E14.5の嗅球ニューロンを解離し(dissociate)、5日間培養した。神経突起の成長円錐(矢印)が、モノクローナル抗体NG1によって強く標識されている。スケールバーは50μmを表す。
【図4】モノクローナル抗体NG1によるNogo−A蛋白質の認識の様子を示す図である。
(A):Nogoの3つのアイソフォームの蛋白質構造。Nogo−Aには、Nogo−Bのアミノ酸配列がすべて含まれている。Nogo−Cは、N−末端(縞のボックス)上に、独特の配列を有している。3種類のアイソフォームすべてに共通するC−末端領域におけるグレーのボックスは、ER中で膜貫通ドメインとして機能する疎水性アミノ酸配列を示している。単離したcDNAクローンである#4−1D9の構造が、かかる3つのNogoアイソフォームの下に示されている。翻訳は、左側の点線部分、すなわちNogo−Aのほぼ中央にあたる位置で始まるとされている。底部にあるcDNA構造物の#4−1D9ΔCにおいては、共通するC−末端ドメインは、右側の点線部分で欠失し、Nogo−A特異的な316のアミノ酸からなるトランケート蛋白質が後に残っている。
(B):#4−1D9クローンを用いてトランスフェクションし、モノクローナル抗体NG1で免疫染色を行ったCOS細胞。ERの特徴であるレース様の網状組織が染色されている。
(C):#4−1D9ΔCを用いてトランスフェクションし、モノクローナル抗体NG1で免疫染色を行ったCOS細胞。細胞質が広く染色されている。
スケールバーは50μmを表す。
【図5】モノクローナル抗体NG1による成体神経系の免疫染色の様子を示す図である。(A、B):脳梁近辺の成体終脳の切片。モノクローナル抗体NG1は、終脳全体に散在する細胞体を染色している。切片(B)は、(A)の拡大率を高くしたものである。
(C、D):抗GST抗体で染色して希突起膠細胞を視覚化した(A、B)の同一の図。同じ細胞(矢頭)が、(B)及び(D)において標識されている。
(E):モノクローナル抗体NG1で染色した成体の脊髄切片。白質中の希突起膠細胞及びその突起部が強く染色されていることに注意。灰白質中でいくつかのニューロンが染色されているのは、二次抗体の非特異的結合によるものである。
スケールバーは50μmを表す。
【図6】発現ベクターpCAGGSを示す図である。
【0001】
【発明の属する技術分野】
本発明は、ミエリンにおける軸索反発因子であるNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法、より詳しくは、嗅索(LOT)で免疫した非ヒト動物の脾細胞を用いて作製したハイブリドーマの培養上澄液を終脳の切片上で免疫化学的方法によりスクリーニングすることによって得られるNogo−Aを特異的に認識するモノクローナル抗体の製造方法や、かかるモノクローナル抗体を含有するNogo−Aの検出試薬等に関する。
【0002】
【従来の技術】
目的とするタンパク質に対する抗体を入手することは、その同定・機能解析において重要な位置を占めるが、動物に目的とする抗原を投与して免疫する従来の方法は、多種・多量の抗原と長い時間、多大な労力を要することから、近年、ファージ抗体ライブラリーを用いて抗体を作製する方法が確立されている。かかる方法は、繊維状ファージのコートタンパク質に抗体を融合させることにより、ファージの表面上に抗体を提示(ディスプレイ)するシステムを応用したもので、抗体遺伝子をPCRで増幅して多種類の抗体遺伝子を含むライブラリーを作製し、これをファージ上に提示させることによってファージディスプレイライブラリーとするものであって、このファージシステム(例えば、非特許文献1参照。)によるとヒトの抗体の抗原を同定することが可能となる。このファージ抗体ライブラリーを用いるスクリーニング方法は、ファージディスプレイ法と呼ばれ、従来から種々の細胞表面レセプターと特異的に結合するリガンドや種々の抗原を同定するために使用されている。ファージ抗体ライブラリーの作製方法やそれを用いたイムノチューブ法、マグネティックビーズ法等のスクリーニング法についても既に数多く報告されている(例えば、非特許文献2、3参照。)。
【0003】
その他、膜分子のクローニング方法として、例えばCOS7細胞とSV40の複製起点を含んだ発現ベクターによる一過性発現を利用して、動物細胞発現ベクターで作製されたcDNAライブラリーをCOS7細胞に導入し、細胞表面上にcDNAライブラリー由来の膜蛋白質を発現させ、目的とする膜分子を発現している細胞をその膜分子に対する抗体やリガンドを用いてパニングあるいはFACSで濃縮し、プラスミドDNAを回収して再びCOS7細胞にトランスフェクションし、濃縮操作を繰り返す方法や、発現ベクターcDNAライブラリーをいくつかの小さなプールに分け、COS7細胞に導入し、アイソトープで標識した抗体やリガンドを用いて膜分子の発現を検出し、陽性プールをさらに少数のプラスミドからなるプールに分けてトランスフェクションを繰り返しクローン化する方法が知られている(例えば、非特許文献4参照。)。
【0004】
また、ヒト細胞からポリアデニル化RNAを単離し、単離されたポリアデニル化RNAを用いて2本鎖cDNAを作り、この2本鎖cDNAをクローニングベクターに挿入して組換え発現ベクターを作製し、この組換え発現ベクターで宿主をトランスフォームして前記抗原を発現させ、リューマチ性関節炎患者の血清からの抗体を用いて、前記抗体が前記発現抗原に結合することを、抗ヒトIgM抗体−アルカリホフファターゼ複合体とアルカリホスファターゼ顕色基質とによって検出することによりトランスフォームされた宿主を選択する、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用抗原をコードする組換えDNAの作製方法(例えば、特許文献1参照。)も知られている。
【0005】
他方、神経軸索の成長等に関して以下の知見が報告されている。
神経系の発達は、軸索が活発に成長する能力によって特徴づけられている。成長円錐という特異化された先端によって率先されることにより、多くの軸索が胚脳中において活発に伸張する(例えば、非特許文献5、6参照。)。しかし、中枢神経系が成熟すると、軸索は成長能力を喪失する(例えば、非特許文献7参照。)。中枢軸索の再生に関する研究がこれまで盛んに行なわれてきたが、臨床において軸索の再生を誘導することはたいへん難しいとされている。胚軸索と成体軸索は成長能力に関して異なっているが、これは成体神経系における成長抑制環境が原因の一つであると考えられている(例えば、非特許文献8参照。)。例えば、インビボ及びインビトロの両方における過去の研究から、中枢ミエリンが成体神経系における軸索成長の阻止に関与していることがすでに明らかにされている(例えば、非特許文献9、10参照。)。
【0006】
嗅覚体系は、嗅球及びそれが終脳中まで成長した嗅索(LOT)とよばれるものから成り立っている。嗅索は単純であり(例えば、非特許文献11、12参照。)器官培養により簡単に再生できることから(例えば、非特許文献13参照。)、軸索ガイダンスの細胞機構及び分子機構に関する有益な情報を提供してきた(例えば、非特許文献14〜17参照。)。また、ミエリンにおける軸索反発因子(axonal repulsive factor)であるNogo(例えば、非特許文献18〜22参照。)が成体神経系中において希突起膠細胞により産出されることは、過去の研究からすでに知られている(例えば、非特許文献23〜25参照。)。また、Nogoが中枢軸索の成長を阻止することもすでに知られている(例えば、非特許文献26、27参照。)。
【0007】
抗Nogoモノクローナル抗体として知られているIN−1が、中枢神経系において軸索の再生をインビトロとインビボの両方で増進させることが報告されている(例えば、非特許文献28〜34参照。)。Nogoは、小胞体(ER)膜貫通蛋白質の一部であるレチキュロン(Reticulon)ファミリーに属している(例えば、非特許文献35、36参照。)。レチキュロンファミリーの他のメンバーと同様に、Nogoは主にERに局在しているが、細胞表面にも存在している(例えば、非特許文献19、20、31参照。)。Nogoには、3つのスプライシングアイソフォーム、Nogo−A、Nogo−B及びNogo−Cがあり、これらはC−末端ドメインが共通しているが、N−末端配列が相違している。Nogo−Aは最も長いアイソフォームで、ラットでは1163個のアミノ酸残基からなっている。Nogo−Bは、Nogo−AのN−末端部分と、スプライスされた共通のC−末端ドメインを有している。Nogo−Cは最も短いアイソフォームで、共通のC−末端ドメイン以外に、N−末端上にある独特の短いアミノ酸を含んでいる。最近の研究により、Nogoは、反発作用に対する2つの機能的ドメイン、すなわち、共通するC−末端ドメインにある66アミノ酸配列と、Nogo−Aに特異的なN−末端配列をもつことがわかっている(例えば、非特許文献38参照。)。
【0008】
【特許文献1】
特表平10−513257号公報
【非特許文献1】
Proc.Acad.Sci.USA 80, 1194−1198, 1983
【非特許文献2】
Science 249, 386−390 1990
【非特許文献3】
Methods in Enzymology 217, 228−257 1993
【非特許文献4】
Proc.Acad.Sci.USA 84, 3365−3369, 1987
【非特許文献5】
Science 233, 740−746, 1986
【非特許文献6】
Science 274, 1123−1131, 1996
【非特許文献7】
Curr. Opin. Neurobiol 11, 89−94, 2001
【非特許文献8】
Nature 296, 150−152, 1982
【非特許文献9】
Neuron 24, 639−647, 1999
【非特許文献10】
J. Neurosci. 8, 2381−2393, 1988
【非特許文献11】
Brain Res. Rev. 11, 1−45, 1986
【非特許文献12】
J. Comp. Neurol. 223, 177−202, 1984
【非特許文献13】
J. Neurobiol. 29, 127−137, 1996
【非特許文献14】
J. Neurobiol. 32, 415−425, 1997
【非特許文献15】
J. Neurobiol. 38, 93−104, 1999
【非特許文献16】
J. Neurobiol. 21, 2373−2379, 2001
【非特許文献17】
Nature 343, 269−343, 1990
【非特許文献18】
J. Cell Biol. 106, 1281−1288, 1988
【非特許文献19】
Nature 403, 434−438, 2000
【非特許文献20】
Nature 403, 439−444, 2000
【非特許文献21】
Nature 403, 383−384, 2000
【非特許文献22】
J. Biol. Chem. 273, 19283−19293, 1998
【非特許文献23】
Neuron 1, 85−96, 1988
【非特許文献24】
J. Neurocytol. 23, 209−217, 1994
【非特許文献25】
J. Neurosci. 9, 1126−1133, 1989
【非特許文献26】
Nature 378, 498−501, 1995
【非特許文献27】
Nature 343, 269−343, 1990
【非特許文献28】
Nature 378, 498−501, 1995
【非特許文献29】
J. Neurosci. 20, 8061−8068, 2000
【非特許文献30】
J. Neurosci. 20, 2275−2286, 2000
【非特許文献31】
Neuron 1, 85−96, 1988
【非特許文献32】
J. Neurosci. 12, 2112−2119, 1992
【非特許文献33】
J. Neurosci. 9, 1126−1133, 1989
【非特許文献34】
Nature 343, 269−343, 1990
【非特許文献35】
Genomics 32, 191−199, 1996
【非特許文献36】
J. Biol. Chem. 268, 13439−13447, 1993
【非特許文献37】
Neuron 1, 85−96, 1988
【非特許文献38】
Nature 409, 341−346, 2001
【0009】
【発明が解決しようとする課題】
本発明の課題は、小胞体膜貫通蛋白質の一部であるレチキュロンファミリーに属するNogoのスプライシングアイソフォームNogo−Aを特異的に認識する抗Nogo−Aモノクローナル抗体及びその製造方法や、該モノクローナル抗体を含有するNogo−Aの検出試薬等を提供することにある。
【0010】
【課題を解決するための手段】
これまでモノクローナル抗体の抗原分子同定法には、ファージライブラリーを用いた発現スクリーニングの系が実用化されていたが、この系では半ば変性した蛋白質断片を抗体に認識させるので、抗原蛋白質の立体構造を認識するような抗体については適用できず、かかる方法では同定できない抗原が多数存在していた。本発明者らは、マウス胚の背軸嗅球から得たポリA RNAを逆転写し、得られたcDNAを哺乳類動物用発現ベクターに挿入した後、COS−7細胞にトランスフェクションし、COS−7細胞上に立体構造を形成して発現したタンパク質を、E14.5マウスの終脳から単離した嗅球軸索を用いて免疫したハムスターのリンパ球と、マウスのミエローマ細胞とを用いて作製したモノクローナル抗体NG1と反応させて免疫染色し、免疫陽性細胞から単離したcDNAクローンをサブクローンし、DNAシーケンサーを用いて配列を決定し、新規モノクローナル抗体NG1の抗原分子Nogo−Aを同定することができることを見い出し、本発明を完成するに至った。
【0011】
すなわち本発明は、嗅索で免疫した非ヒト動物の脾細胞と、前記非ヒト動物と異種のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる、免疫組織化学的方法によりスクリーニングすることを特徴とする抗Nogo−Aモノクローナル抗体の製造方法(請求項1)や、Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させ、かかるNogo−Aを発現した哺乳類培養細胞を、免疫組織化学的方法によりスクリーニングしたモノクローナル抗体で免疫染色することを特徴とする請求項1記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項2)や、哺乳類培養細胞が、COS細胞であることを特徴とする請求項2記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項3)や、嗅索で免疫したハムスターの脾細胞とマウスのミエローマ細胞とを融合することを特徴とする請求項1〜3のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項4)や、モノクローナル抗体が、Nogo−Aに対して特異的に反応し、Nogo−B及びNogo−C並びにレチキュロン1Aに対して交差反応せず、かつ、発生期の神経系における成長中の軸索を強く認識するモノクローナル抗体であることを特徴とする請求項1〜4のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項5)や、モノクローナル抗体が、希突起膠細胞の細胞体に強く結合し、ミエリン化軸索にはほとんど結合しないモノクローナル抗体であることを特徴とする請求項5記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項6)や、モノクローナル抗体が、培養嗅球ニューロンの神経突起の成長円錐を強く認識するモノクローナル抗体であることを特徴とする請求項5又は6記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法(請求項7)に関する。
【0012】
また本発明は、請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体(請求項8)や、請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの検出試薬(請求項9)や、請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの過剰発現に起因する疾病の予防・治療薬(請求項10)や、請求項1〜5のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有(請求項11)や、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体産生能を有することを特徴とするハイブリドーマ(請求項12)や、ハイブリドーマが、Hamster−Mouse hybridoma NG1(FERM BP−8263)であることを特徴とする請求項12記載のハイブリドーマ(請求項13)に関する。
【0013】
【発明の実施の形態】
本発明のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法としては、嗅球軸索で免疫した非ヒト動物(例えばハムスター)の脾細胞と、前記非ヒト動物と異種(例えばマウス)のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる、免疫組織化学的方法によりスクリーニングすることを特徴とする抗Nogo−Aモノクローナル抗体であれば特に制限されるものではないが、Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させ、かかるNogo−Aを発現した哺乳類培養細胞を、免疫組織化学的方法によりスクリーニングしたモノクローナル抗体、すなわち、嗅球軸索で免疫した非ヒト動物の脾細胞と、前記非ヒト動物と異種のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる免疫組織化学的方法によりスクリーニングしたモノクローナル抗体で免疫染色することにより、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体を再現性よく製造することができる。また、本発明のハイブリドーマとしては、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体産生能を有するものであれば特に制限されないが、Hamster−Mouse hybridoma NG1を具体的に例示することができる。このHamster−Mouse hybridoma NG1は独立行政法人産業技術総合研究所特許生物寄託センターに寄託番号FERM BP−8263として寄託されている。
【0014】
上記モノクローナル抗体での免疫染色方法としては、例えば、ペルオキシダーゼ、アルカリフォスファターゼ、β−ガラクトシダーゼ等で酵素標識されたモノクローナル抗体を、抗原抗体反応により細胞表面上に立体構造を形成した状態で発現している膜タンパク質に反応させた後、前記酵素の基質及び発色剤の添加によって色素を生成させ、呈色した色素を観察する酵素免疫染色方法や、FITC等で蛍光標識されたモノクローナル抗体を、抗原抗体反応により細胞表面上に立体構造を形成した状態で発現している膜タンパク質に反応させた後、蛍光顕微鏡で観察する蛍光免疫染色方法を挙げることができる。
【0015】
Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させるには、哺乳類培養細胞用発現ベクターを好適に用いることができる。かかる哺乳類培養細胞用発現ベクターとしては、真核細胞中に蛋白質を効率的に発現可能とし、且つコンピテント細胞に形質転換することができるプラスミドベクターやトランスフェクションすることができるファージベクターであればどのようなものでもよく、発現ベクターの複製を可能とする複製オリジン、発現のためのプロモーター、スプライスシグナル、ポリA付加シグナル、薬剤選択マーカー、エンハンサー等を必要に応じて選択し、組み合わせて構築することができる。発現ベクターの複製を可能とする複製オリジンとしては、SV40ウィルス、パピローマウィルス、EBウィルス等を挙げることができ、また発現のためのプロモーターとしては、β−アクチンプロモーター、チミジンキナーゼプロモーター、SV40プロモ−ター、アデノウィルス主要後期プロモーター、サイトメガロウィルスプロモーター等を挙げることができる。さらに、スプライスシグナル、ポリA付加シグナル、クローン選択を効率化するための薬剤選択マーカー、細胞特異的に働くエンハンサーの他、導入遺伝子の発現を制御する転写制御遺伝子等を付加してもよい。具体的には、上記プラスミドベクターとしてpCAGGS(Gene 108, 193−200, 1991)、pcDL−SRα296(Molecularand CellularBiology 8, 466−472, 1988)、pEF−BOS(Nucleic Acid Research 18, 5322, 1990)等を好適に例示することができるが、これらの中でも、サイトメガロウィルスのエンハンサー、チキンβ−アクチンプロモーター、ラビットβ−グロビン3’スプライスシグナル、ラビットβ−グロビン3’隣接領域、SV40複製オリジンを有し、哺乳動物細胞中で組込んだ遺伝子を高い効率で発現することができるpCAGGSが特に好ましい。
【0016】
また、上記哺乳類培養細胞としては、哺乳類培養細胞用発現ベクターにNogo−AのcDNAを組み込んだ、抗原タンパク質Nogo−Aをトランジェントにあるいはステイブルに細胞表面上に立体構造を形成した状態で発現させることができる、哺乳類由来の培養細胞であれば特に制限されるものではなく、COS細胞、BHK21細胞、HeLa細胞、L細胞、NIH3T3細胞、neuro2a細胞等を例示することができるが、上記抗原タンパク質Nogo−Aを効率よくトランジェントに発現させうる点でCOS細胞が好ましい。
【0017】
本発明のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られる抗Nogo−Aモノクローナル抗体としては、Nogo−Aに対して特異的に反応し、Nogo−B及びNogo−C並びにレチキュロン1Aに対して交差反応せず、かつ、発生期の神経系における成長中の軸索を強く認識するモノクローナル抗体、好ましくは、希突起膠細胞の細胞体に強く結合し、ミエリン化軸索にはほとんど結合しないモノクローナル抗体や培養嗅球ニューロンの神経突起の成長円錐を強く認識するモノクローナル抗体であるNG1を好適に例示することができる。そして、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られる抗Nogo−Aモノクローナル抗体は、Nogo−Aの検出試薬として有利に用いることができる。
【0018】
本発明のNogo−Aの過剰発現に起因する疾病の予防・治療薬としては、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られるNogo−Aの細胞外ドメインに結合する抗Nogo−Aモノクローナル抗体を含有する薬剤であれば特に制限されるものではなく、また、本発明のNogo−Aの過剰発現に起因する疾病の診断薬としては、Nogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法により得られるNogo−Aの細胞外ドメインに結合する抗Nogo−Aモノクローナル抗体を含有する試薬であれば特に制限されるものではない。上記Nogo−Aの過剰発現に起因する疾病としては、神経変性疾患、神経損傷などが考えられる。
【0019】
また、本発明の上記予防・治療薬を医薬品として用いる場合は、薬学的に許容される通常の担体、結合剤、安定化剤、賦形剤、希釈剤、pH緩衝剤、崩壊剤、可溶化剤、溶解補助剤、等張剤などの各種調剤用配合成分を添加することができる。これら予防・治療薬を用いる予防・治療方法においては、患者の性別・体重・症状に見合った適切な投与量の上記予防・治療薬を、経口的又は非経口的に投与することができる。すなわち通常用いられる投与形態、例えば粉末、顆粒、カプセル剤、シロップ剤、懸濁液等の剤型で経口的に投与することができ、あるいは、例えば溶液、乳剤、懸濁液等の剤型にしたものを注射の型で非経口投与することができる他、スプレー剤の型で鼻孔内投与することもできる。
【0020】
【実施例】
以下、実施例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらの例示に限定されるものではない。
実施例1[モノクローナル抗体NG1が認識する抗原分子の同定]
実施例1A(実験材料と方法)
(マウス)
日本エスエルシー株式会社からICRマウスを購入した。腟栓が見つかった日の昼を、胚日齢0.5日(E0.5)とみなした。生後2〜3ヶ月の成体マウスを本実験において用いた。また、オリエンタル酵母工業株式会社から、生後8週間のアルメニアンハムスターを購入した。本実験における手法は、国立遺伝学研究所動物委員会による承認をうけている。
【0021】
(モノクロナール抗体の作製)
E14.5である約300個のマウス胚から嗅索(LOT)を機械的に切除し、リン酸バッファー(PBS)中で4%のパラホルムアルデヒド(PFA)を用いて固定し、PBS中で洗浄及び懸濁をした後、これを免疫源としてアルメニアンハムスターの後足に注射した。この免疫処理を3週間ごとに4回繰り返し、最後の追加抗原刺激免疫処理を行なってから3日後に、鼠径リンパ節及び膝窩リンパ節を回収して、それらをマウス骨髄腫細胞(NS1)と公知の方法を用いて融合させた(J. Immunol. 130, 309−312, 1983、J. Neurosci. 18, 7800−7810, 1998、Dev. Biol. 122, 90−100, 1987)。E14.5のマウス終脳由来の免疫ハイブリドーマ培養物の培養上澄液を免疫組織化学的方法によってスクリーニングした。クローニングを行なうため、先端の尖ったガラス製キャピラリーを用いてハイブリドーマ細胞個体を取りだし、10%のウシ胎児血清(JRH Bioscience社製)及び10%のハイブリドーマクローニング因子(Igen社製)を添加したダルベッコ改変イーグル培地(DMEM)(Sigma社製)を含む96ウェル細胞プレート(Becton Dickinson社製)上に蒔いた。
【0022】
(免疫組織化学法)
マウス胚の脳を、4%パラホルムアルデヒド(PFA)を含むPBSに4℃下で一晩固定し、20%スクロースを含むPBSに一晩浸し、OCTコンパウンド(Sakura Finetechnical社製)中で凍結させた。これを凍結切片作製装置(クリオスタット)上で厚さ14〜20μmの切片に分け、ガラススライド(松浪ガラス社製)上に載せた。かかる切片を、1%スキムミルク/TBST(10mMのTris−HCL、pH7.4、130mMのNaCl、0.1%のTween20)を有するモノクローナル抗体NG1ハイブリドーマクローンの培養上澄液を1/10に希釈した溶液中で一晩インキュベーションし、TESTを用いて洗浄した後、蛍光発光(FITC)が結合している抗アルメニアンハムスターIgG(Jackson Immunoresearch社製)を用いて結合抗体を視覚化した。ラビット抗グルタチオン−S−トランスフェラーゼπ抗体(Medical Biological Laboratories社製)及びCy3結合抗ラビットIgG抗体(Jackson社製)を用いてラビット抗希突起膠細胞を染色した。ホールマウント免疫染色法は、公知の方法(J.Neurobiol. 29, 127−137, 1996、J. Neurosci. 20, 5802−5812, 2000)に準拠した方法で行った。すなわち、E13.5マウス胚の終脳半球を切断し、24〜28時間、5%のスキムミルク/TBSTを用いてモノクローナル抗体NG1培養上澄液を10倍に希釈した溶液中においてインキュベーションした。この免疫反応を視覚化するために、ビオチン化した抗アルメニアンハムスターIgG抗体(Jackson社製)及びElite ABC Kit(Vector Laboratories, Burlingame, CA)を用いて処理した。
【0023】
(嗅球神経の分離培養)
Masuda−Nakagawa(Neurosci. Res. 23, 171, 1999)及びMori(Neurosci. Res. 24, 160, 2000)に記載の方法に従い、E14.5の嗅球をトリプシン処理し、穏やかなピペット処理を行なうことにより単一細胞に分離した。ポリリシン(Sigma社製)によりコーティングした4ウェルチャンバースライド(Nalge Nunc社製)の各ウェルに細胞密度が1×105細胞となるように調整した。神経膠細胞を用いて条件づけ、B−27 component(Invitrogen社製)を補った神経細胞培養用基礎培地Neurobasal mediumを用いてCO2インキュベーター中において5日間、かかる細胞を培養した。培養が終了してから2時間、4%のPFAで得られた細胞を固定し、上記方法によりモノクロナール抗体を用いてかかる細胞に対して免疫染色を行なった。
【0024】
(モノクローナル抗体NG1の抗原の発現クローニング)
モノクローナル抗体NG1の抗原の発現クローニングは以下のように行った。E14.5のマウス胚の背軸嗅球から得たポリA RNAを、cDNAライブラリー構築キット(Stratagene社製)を用いてcDNAに逆転写した。真核細胞中に蛋白質を効率的に発現可能とし、且つコンピテント細胞に形質転換するプラスミドベクターpCAGGS(大阪大学宮崎純一博士より供与)中に、前記cDNAを挿入することにより、約100クローンのプラスミドのプールを調製し、トランスフェクション試薬(FuGene 6; Roche社製)を用いてCOS−7細胞中にトランスフェクションした。続けて2日間、PBS中の4%のPFAを用いて固定し、モノクローナル抗体NG1を用いて免疫染色した。免疫応答細胞は、蛍光顕微鏡を用いてスクリーニングした(Axioplan 2; Carl Zeiss社製)。スクリーニングで得た約240個のプールから、強い免疫陽性細胞を産出するプールを同定した。かかるプールをさらに小さなプールに分け、単一ポジティブcDNAクローンが得られるまでアッセイを繰り返した。単離したcDNAクローンをサブクローンし、DNAシーケンサー(CEQ2000;Beckman社製)を用いて配列を決定した。また、マウスNogo−Aのヌクレオチド配列をデータベースに登録した(アクセッションNo.:AB073672)。
【0025】
実施例1B(結果)
(モノクローナル抗体NG1の作製)
E14.5のマウスの終脳から機械で切除した嗅球軸索を用いてハムスターを免疫した。かかるハムスターから調製したリンパ球をマウス骨髄腫細胞と融合させた。ハイブリドーマ細胞の培養上澄液を、嗅球軸索からなるLOTに結合させるため、切片上で免疫組織化学的にスクリーニングした(図1A、B)。スクリーニングを行った約2000のハイブリドーマ細胞株から、LOTへの強い結合を示したモノクローナル抗体NG1を単離した。かかるモノクローナル抗体NG1を用いた免疫染色パターンを以下に示す。
【0026】
(モノクローナル抗体NG1による中枢嗅覚系の免疫染色)
嗅球軸索の盛んな伸長が、E14.5の終脳に認められている(J. Neurobiol. 29, 127−137, 1996)が、モノクローナル抗体NG1は、LOTにおける成長中の軸索を強く標識した(図1C)。これらの軸索は均一には染色されず、ところどころに強く標識される部位が斑点状に認められた(図1D)が、こうした斑点に対応する構造は同定できなかった。LOTのより深い領域では、嗅覚皮質中で腺維の染色も認められた(図1C)。これは、嗅覚皮質の内在ニューロン(intrinsic neuron)の突起部が染色されたものと思われる。嗅球においては、嗅球を通る多くの腺維が至るところで染色されていた(図1E)。LOTへと伸長している軸索も同様に染色されているが、こうした伸長ニューロンの細胞体は、はっきりとは染色されていなかった(図1E)。
【0027】
胚形成期の終脳のホールマウント調製物において、嗅球軸索がモノクローナル抗体NG1によって強く染色されているのが認められた(図1E)。標識した軸索は、嗅覚皮質でアーチ形の突起部を形成しており、これは、以前に報告(J. Neurosci. 21, 2373−2379, 2001、J. Neurobiol. 29, 127−137, 1996)されている嗅球軸索用マーカーによる染色と類似している。しかし、終脳の他の部分では、モノクローナル抗体NG1による標識は弱いものだった。このことは、弱いものではあるが至るところで生じている抗原の発現が、発生期の神経系において、モノクローナル抗体NG1に認識されたことを示唆している。
出生後も、LOTはモノクローナル抗体NG1により染色された(図1G)。しかし、その場合は、終脳の他の部位で染色が広範囲に及ぶことは少なかった。それ以前の発生ステージの場合と比較して、軸索には斑点が見られず、もっと均一に染色されていた。
【0028】
(神経系の他の部位の免疫染色パターン)
一般に、モノクローナル抗体NG1は、長く成長した軸索を強く標識していた。内包、前交連、脳梁、分界条といった主要な軸索経路はすべて、胚形成期中に強く染色された(図2R>2A、B)。分化したニューロンが豊富な、皮質板などの領域も染色された(図1C、2A)。脳とは別個に、嗅神経及び視神経は、かかるモノクローナル抗体に強く染色された(図2C、D)。モノクローナル抗体NG1は、末梢神経及び筋肉も標識したが、他の非神経組織は標識しなかった(図2D)。これは、神経系及び筋肉においてかかる抗原の特異的発現がモノクローナル抗体NG1に認識されたことを示唆している。発生が進行するにつれ、モノクローナル抗体NG1による軸索の標識の鮮明度は低下していった。P7の時点で、まだ基線レベルより強く染色される軸索もあった(図2E、F)が、周辺部に弱い染色部位が偏在していたため、不鮮明だった。
【0029】
(モノクローナル抗体NG1による成長円錐の標識)
モノクローナル抗体NG1は、発生期の神経系における成長中の軸索を強く標識するため、培養中に盛んに伸長する神経突起における、モノクローナル抗体NG1が認識する抗原の細胞中の局在について調べた。モノクローナル抗体NG1は、嗅球ニューロンの神経突起の遠位部分を優先的に標識した(図3)。遠位末端(distal tip)の成長円錐はとくに強く標識された。細胞体及び神経突起で、小胞染色が明瞭に認められることもあった。生存ニューロンを、固定を行わずにモノクローナル抗体と共にインキュベーションしたところ、細胞表面の標識は検出されなかった。これは、モノクローナル抗体NG1に対するエピトープが、これらのニューロンの細胞質中に存在することを示唆している。
【0030】
(モノクローナル抗体NG1が認識する抗原分子の同定)
モノクローナル抗体NG1が認識する抗原を同定するため、COS7細胞中でcDNAライブラリーを発現させ、モノクローナル抗体NG1に免疫反応性をもつ生成物を産生するクローンをスクリーニングした。およそ24,000のcDNAクローンを分析した後、#4−1D9というクローンが、強い免疫陽性をもつ物質を産生することがわかった(図4R>4B)。挿入物のヌクレオチド配列から、Nogoのマウス相同物をコードする1つのオープンリーディングフレームが判明した。単離したcDNAクローンである#4−1D9は、Nogo−Aを部分的にコードしており、完全な配列の3’側半分をカバーしている(図4A)。COS−7でかかるクローンを発現させたとき、N−末端から推定593番目の残基上の内部メチオニンで翻訳が始まり、C−末端の最後まで続くと推測された(図4R>4Aの#4−1D9)。Nogoの共通するC−末端ドメインには、2つの疎水性ドメインが含まれており、これらはER中で膜貫通ドメインとして機能すると考えられている(J. Cell. Sci. 107, 2403−2416, 1994)。#4−1D9クローンが産生した免疫反応性生成物は、実際に、COS−7細胞中に広がるレース様の網状組織に分布していた(図4B)。これは、ERの典型的な分布を示すものである。
【0031】
モノクローナル抗体NG1があらゆる形のNogoを認識するのか、それともNogo−Aだけを認識するのかを調べるため、cDNAクローンから共通のC−末端ドメインを切除した(図4Aの#4−1D9ΔC)。その場合もやはりモノクローナル抗体NG1は、前記の切除を受けた蛋白質を認識したが、C−末端上のERにおける保存シグナルの欠失により、その分布は細胞質全体に広がった(図4C)。この結果により、モノクローナル抗体NG1はNogo−Aに特異的に結合するが、その他の形のNogoには結合しないことがわかった。モノクローナル抗体NG1が認識するNogo−A特異的ドメインには、レチキュロンファミリーの他のメンバーとの相同性がまったくない。そのため、モノクローナル抗体NG1が他のレチキュロン蛋白質とも結合するとは考えにくい。事実、本発明者らは、モノクローナル抗体NG1がCOS−7細胞中で発現しているレチキュロン1Aとは結合しないことを確認している。
【0032】
(モノクローナル抗体NG1による、成体神経系中の希突起膠細胞の標識)
モノクローナル抗体NG1が切片中のNogo−Aを認識するかどうかを調べるため、成体の中枢神経系の切片をモノクローナル抗体NG1で免疫染色した。成体神経系の軸索は、モノクローナル抗体NG1によってはほとんど染色されなかった。そのかわり、脳全体に散在する細胞体が強く染色されているのが観察された(図5A、B)。モノクローナル抗体NG1陽性細胞の形態及び分布から、それらが希突起膠細胞であることがわかった。このことは、希突起膠細胞のマーカーであるグルタチオン−S−トランスフェラーゼ(GST)π(EMBO J. 19, 341−348, 2000)によるかかる切片の二重免疫染色で確認された(図5C、D)。
【0033】
成体の脊髄におけるNogo−A蛋白質の分布については、これまでにいくつかの研究報告がある(Nature 403, 434−438, 2000、J. Neurocytol. 23, 209−217, 1994)。それらに従い、成体の脊髄切片をモノクローナル抗体NG1で染色した。かかるモノクローナル抗体により、脊髄の白質全体に分布している希突起膠細胞及びその突起部分が強く染色された(図5E)。この染色パターンは、報告されている、Nogo−Aに対するポリクローナル抗体を用いた場合の免疫染色(Nature 403, 434−438, 2000)と同一だった。しかし、本来Nogo−Aに対する抗体であるモノクローナル抗体IN−1を用いた染色(J. Neurocytol. 23, 209−217, 1994)と比較すると、モノクローナル抗体NG1による染色では、希突起膠細胞の細胞体がより鮮明に浮かびあがっており、かかる抗体自体は、ミエリン化軸索にはほとんど結合していなかった。染色パターンがこのように異なる理由は、現在のところ不明である。
【0034】
本実施例において、本発明者らは、発生期の神経系における成長中の軸索と強く結合するモノクローナル抗体NG1を作製し、このモノクローナル抗体がNogo−A蛋白質と特異的に結合することを示した。成体の神経系をこのモノクローナル抗体で染色した場合の染色パターンは、報告されているNogo−Aの発現と一致するものだった(Nature 403 434−438, 2000、Nature 403 439−444, 2000)。発生期のニューロンにはNogo mRNAの強い発現が見られるとの最近の報告(Exp. Neurol. 169, 319−328, 2001)と考えあわせ、モノクローナル抗体NG1は発生期の神経系中のNogo−Aを認識すると結論づけることができる。本発明により、モノクローナル抗体NG1が発生期の神経系中のNogo−Aを認識するということから、盛んに成長している軸索中で、軸索成長の阻害因子であるNogoが強く発現しているという、やや意外な新たな知見が得られた。
【0035】
【発明の効果】
本発明により製造される抗Nogo−Aモノクローナル抗体は、神経機能の研究に広く利用できるのみならず、Nogo−Aの細胞外ドメインを認識するため、この軸索伸長抑制因子の活性を阻害できる可能性が高く、様々な神経再生に応用できる可能性がある。また、抗Nogo−Aモノクローナル抗体NG1は、抗Nogoモノクローナル抗体として知られているIN−1に比べてNogo−Aに対する特異的結合活性が大きい。
【図面の簡単な説明】
【図1】モノクローナル抗体NG1による中枢嗅覚系の免疫染色の様子を示す図である。
(A、B):終脳の側面(A)及び冠状面(B)の概略図。(A)の左部分が吻側であり、(B)の左部分が側面である。(A)(B)共にその上部が背面となっている。嗅球(OB)軸索が、終脳内部の尾側に伸長し、終脳表面で外側嗅索(LOT)を形成している。
(C):モノクローナル抗体NG1で染色したE14.5の終脳の冠状切片。LOT(矢印)が強く染色されている点に注意。嗅覚皮質(矢頭)及び皮質板も、かかるモノクローナル抗体で染色されている。
(D):高拡大率でのLOT。軸索は均一に染色されておらず、強く標識された部位が斑点となっている。
(E):前記モノクローナル抗体で染色した、大量の繊維をもつE14.5の嗅球。
(F):モノクローナル抗体NG1による、E13.5の終脳の全量免疫染色。他の終脳部位と同様に、LOT(矢印)を形成している嗅球軸索でも染色が認められる。
(G):モノクローナル抗体NG1で染色したP0の終脳。LOT(矢印)は、やはり他の部位よりも強く染色されている。
スケールバーは50μm(A−D及びF)、500μm(E)を表す。
【図2】モノクローナル抗体NG1による、神経系の他部位の免疫染色の様子を示す図である。
(A):モノクローナル抗体NG1で染色したE14.5の前脳の冠状切片。内包(矢印)及び髄条(矢頭)において軸索が強く染色されている点に注意。
(B):E14.5の前脳の後部水平部位(posterior level)上の切片。分界条(矢印)中の軸索の束が強く標識されている。
(C):E14.5の嗅上皮から伸長している嗅覚神経(矢頭)の強い染色。(D):E14.5の眼球の、強く標識された視神経(矢印)。眼筋(矢頭)も前記モノクローナル抗体によって染色されている。
(E):P7の前交連(矢印)は、やはり前記モノクローナル抗体によって強く染色されている。
(F):P7の脳梁(矢印)は、周辺部位よりもやや強いレベルで染色されている。
スケールバーは50μmを表す。
【図3】モノクローナル抗体NG1による、培養した嗅球ニューロンの免疫染色の様子を示す図である。
E14.5の嗅球ニューロンを解離し(dissociate)、5日間培養した。神経突起の成長円錐(矢印)が、モノクローナル抗体NG1によって強く標識されている。スケールバーは50μmを表す。
【図4】モノクローナル抗体NG1によるNogo−A蛋白質の認識の様子を示す図である。
(A):Nogoの3つのアイソフォームの蛋白質構造。Nogo−Aには、Nogo−Bのアミノ酸配列がすべて含まれている。Nogo−Cは、N−末端(縞のボックス)上に、独特の配列を有している。3種類のアイソフォームすべてに共通するC−末端領域におけるグレーのボックスは、ER中で膜貫通ドメインとして機能する疎水性アミノ酸配列を示している。単離したcDNAクローンである#4−1D9の構造が、かかる3つのNogoアイソフォームの下に示されている。翻訳は、左側の点線部分、すなわちNogo−Aのほぼ中央にあたる位置で始まるとされている。底部にあるcDNA構造物の#4−1D9ΔCにおいては、共通するC−末端ドメインは、右側の点線部分で欠失し、Nogo−A特異的な316のアミノ酸からなるトランケート蛋白質が後に残っている。
(B):#4−1D9クローンを用いてトランスフェクションし、モノクローナル抗体NG1で免疫染色を行ったCOS細胞。ERの特徴であるレース様の網状組織が染色されている。
(C):#4−1D9ΔCを用いてトランスフェクションし、モノクローナル抗体NG1で免疫染色を行ったCOS細胞。細胞質が広く染色されている。
スケールバーは50μmを表す。
【図5】モノクローナル抗体NG1による成体神経系の免疫染色の様子を示す図である。(A、B):脳梁近辺の成体終脳の切片。モノクローナル抗体NG1は、終脳全体に散在する細胞体を染色している。切片(B)は、(A)の拡大率を高くしたものである。
(C、D):抗GST抗体で染色して希突起膠細胞を視覚化した(A、B)の同一の図。同じ細胞(矢頭)が、(B)及び(D)において標識されている。
(E):モノクローナル抗体NG1で染色した成体の脊髄切片。白質中の希突起膠細胞及びその突起部が強く染色されていることに注意。灰白質中でいくつかのニューロンが染色されているのは、二次抗体の非特異的結合によるものである。
スケールバーは50μmを表す。
【図6】発現ベクターpCAGGSを示す図である。
【特許請求の範囲】
【請求項1】
嗅索で免疫した非ヒト動物の脾細胞と、前記非ヒト動物と異種のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる、免疫組織化学的方法によりスクリーニングすることを特徴とする抗Nogo−Aモノクローナル抗体の製造方法。
【請求項2】
Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させ、かかるNogo−Aを発現した哺乳類培養細胞を、免疫組織化学的方法によりスクリーニングしたモノクローナル抗体で免疫染色することを特徴とする請求項1記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項3】
哺乳類培養細胞が、COS細胞であることを特徴とする請求項2記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項4】
嗅索で免疫したハムスターの脾細胞とマウスのミエローマ細胞とを融合することを特徴とする請求項1〜3のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項5】
モノクローナル抗体が、Nogo−Aに対して特異的に反応し、Nogo−B及びNogo−C並びにレチキュロン1Aに対して交差反応せず、かつ、発生期の神経系における成長中の軸索を強く認識するモノクローナル抗体であることを特徴とする請求項1〜4のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項6】
モノクローナル抗体が、希突起膠細胞の細胞体に強く結合し、ミエリン化軸索にはほとんど結合しないモノクローナル抗体であることを特徴とする請求項5記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項7】
モノクローナル抗体が、培養嗅球ニューロンの神経突起の成長円錐を強く認識するモノクローナル抗体であることを特徴とする請求項5又は6記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項8】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体。
【請求項9】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの検出試薬。
【請求項10】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの過剰発現に起因する疾病の予防・治療薬。
【請求項11】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの過剰発現に起因する疾病の診断薬。
【請求項12】
Nogo−Aの細胞外ドメインに結合するモノクローナル抗体産生能を有することを特徴とするハイブリドーマ。
【請求項13】
ハイブリドーマが、Hamster−Mouse hybridoma NG1(FERM BP−8263)であることを特徴とする請求項12記載のハイブリドーマ。
【請求項1】
嗅索で免疫した非ヒト動物の脾細胞と、前記非ヒト動物と異種のミエローマ細胞とを融合することによって得られるハイブリドーマを培養し、ハイブリドーマの培養上澄液を前記非ヒト動物と異種の終脳の切片上で反応させる、免疫組織化学的方法によりスクリーニングすることを特徴とする抗Nogo−Aモノクローナル抗体の製造方法。
【請求項2】
Nogo−AのcDNAを哺乳類培養細胞に導入し、前記Nogo−Aを哺乳類培養細胞上に発現させ、かかるNogo−Aを発現した哺乳類培養細胞を、免疫組織化学的方法によりスクリーニングしたモノクローナル抗体で免疫染色することを特徴とする請求項1記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項3】
哺乳類培養細胞が、COS細胞であることを特徴とする請求項2記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項4】
嗅索で免疫したハムスターの脾細胞とマウスのミエローマ細胞とを融合することを特徴とする請求項1〜3のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項5】
モノクローナル抗体が、Nogo−Aに対して特異的に反応し、Nogo−B及びNogo−C並びにレチキュロン1Aに対して交差反応せず、かつ、発生期の神経系における成長中の軸索を強く認識するモノクローナル抗体であることを特徴とする請求項1〜4のいずれか記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項6】
モノクローナル抗体が、希突起膠細胞の細胞体に強く結合し、ミエリン化軸索にはほとんど結合しないモノクローナル抗体であることを特徴とする請求項5記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項7】
モノクローナル抗体が、培養嗅球ニューロンの神経突起の成長円錐を強く認識するモノクローナル抗体であることを特徴とする請求項5又は6記載のNogo−Aの細胞外ドメインに結合するモノクローナル抗体の製造方法。
【請求項8】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体。
【請求項9】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの検出試薬。
【請求項10】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの過剰発現に起因する疾病の予防・治療薬。
【請求項11】
請求項1〜7のいずれか記載の製造方法により得られるNogo−Aの細胞外ドメインに結合するモノクローナル抗体を含有することを特徴とするNogo−Aの過剰発現に起因する疾病の診断薬。
【請求項12】
Nogo−Aの細胞外ドメインに結合するモノクローナル抗体産生能を有することを特徴とするハイブリドーマ。
【請求項13】
ハイブリドーマが、Hamster−Mouse hybridoma NG1(FERM BP−8263)であることを特徴とする請求項12記載のハイブリドーマ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2004−81195(P2004−81195A)
【公開日】平成16年3月18日(2004.3.18)
【国際特許分類】
【出願番号】特願2003−40215(P2003−40215)
【出願日】平成15年2月18日(2003.2.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り
【出願人】(396020800)科学技術振興事業団 (35)
【Fターム(参考)】
【公開日】平成16年3月18日(2004.3.18)
【国際特許分類】
【出願日】平成15年2月18日(2003.2.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り
【出願人】(396020800)科学技術振興事業団 (35)
【Fターム(参考)】
[ Back to top ]

