抗PD−1抗体または抗PD−L1抗体を含む抗癌剤
【課題】癌、特に転移性癌の治療に非常に有用に使用できる、抗PD−1抗体または抗PD−L1抗体を含む抗癌剤の提供。
【解決手段】本発明の抗癌剤は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させることを特徴とし、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される。
【解決手段】本発明の抗癌剤は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させることを特徴とし、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗PD−1抗体または抗PD−L1抗体を含む抗癌剤に係り、さらに詳しくは、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させる抗PD−1抗体または抗PD−L1抗体を含む抗癌剤に関する。
【背景技術】
【0002】
ナチュラルキラー(NKT)細胞は、T細胞の受容体とNK細胞特異的な表面標識子を発現しており、多様な免疫疾患、例えば自己免疫疾患、感染性疾患、癌等で免疫調節作用および免疫強化作用を行っているT細胞である。NKT細胞は、胸腺、肝、骨髄などの器官に多く存在し、脾臓、リンパ節、血液には少量存在する。
【0003】
一般に、T細胞は、主要組織適合性複合体(MHC)クラスIまたはMHCクラスIIに提示された小さいペプチド抗原を認知するが、これに対し、NKT細胞は、MHCクラスI様分子(MHC class 1 like-molecule)としてのCD1dによって提示された糖脂質抗原を認識する。NKT細胞の重要な種である第1型NKT細胞は、不変性ナチュラルキラーT細胞(invariant natural killer T cells;iNKT細胞)とも呼ばれる。マウスの場合、Vα14−Jα18(ヒトの場合にはVα24−Jα18)からなる不変性ナチュラルキラーT細胞受容体(TCR)を有する。また、α−ガラクトシルセラミド(α-galactosylceramide;α−GC)などのリガンドでT細胞受容体に刺激を加えると、iNKT細胞はIL−4、IFN−γ、IL−12、GM−CSFなどの多様なサイトカインを速く生成する。このように速くて強力なリガンドに対する反応によって、iNKT細胞は先天的免疫反応と後天的免疫反応に関与する多様な免疫細胞の活性を統制または増強させることができる。したがって、iNKT細胞の免疫調節作用は、例えば抗癌効果の増進や自己免疫疾患の調節などと多様な疾患で解明されており、癌または自己免疫疾患に対する免疫治療方法の一つとして研究されている。
【0004】
ところが、iNKT細胞は、T細胞受容体による1次刺激の後、反復的なリガンド刺激によってアネルギー状態に至って反応性が大幅減少するという傾向を示す。例えば、生体内でα−GCで刺激を受ける場合、同じリガンドで2次刺激を与えたとき、iNKT細胞の分裂またはサイトカインの生成が減少する。このようなiNKT細胞のアネルギーはiNKT細胞を標的とした免疫治療において足かせになる。
【0005】
一般的なT細胞におけるアネルギーは、T細胞受容体の刺激が補助刺激分子(co-stimulatory molecule)の不十分な刺激と共に与えられるときに起ると知られている。CD28、CD40L、ICOSなどの補助刺激因子がiNKT細胞の生成および活性化に関連していることは既に知られている。最近では、4−1BBが補助刺激因子としてiNKT細胞に作用して活性化の促進に寄与し、iNKT細胞によって媒介されるアレルギー性肺炎症に影響を与えるという研究結果の発表がある(非特許文献1)。また、PD−1(programmed death-1)、B7H3、B7H4などの補助阻害分子が、T細胞受容体で刺激されたT細胞へ抑制信号を送ることにより、T細胞を免疫性欠如または免疫耐性に陥るようにすると報告されている。また、リンパ球性脈絡髄膜炎ウイルス(lymphocytic choriomeningitis virus;LCMV)感染モデルにおいて抗原を積載している樹枝状細胞によってCD8T細胞が免疫耐性に陥るが、この際、PD−1分子の信号伝達を阻害すると、CD8T細胞のアネルギー現象が克服されるということを確認したことがある。また、慢性感染モデルで発生する免疫能力枯渇CD8T細胞の場合にもPD−1/PD−L1の相互作用を遮断すると、その反応性が回復するということが報告されている。
【0006】
一方、PD−1は、55kDaのI型膜貫通タンパク質であって、Ig相と遺伝子の一部を成しており、免疫グロブリン分子群に属するT細胞の補助阻害分子としてよく知られている。すなわち、PD−1は活性化されたB細胞、T細胞および骨髄細胞上に発現される受容体のCD28群(例えば、CD28、CTLA−4、ICOSおよびBTLAを含む)に属する抑制因子の一員である。PD−1に対するリガンドとしてはPD−L1およびPD−L2があり、これらのリガンドはPD−1と結合するときにT細胞の活性化を下向き調節するものと知られている。PD−1は、一般的なT細胞では正常細胞のときに発現されず、活性化されると発現が増加するものと知られている。これに対し、PD−L1は、正常状態のT細胞でもある程度発現し、活性化されるとその発現が増加するものと報告されている。PD−L1は多数のヒト癌で多量発見され、PD−1とPD−L1の相互作用はT細胞に刺激または抑制信号を伝達する。すなわち、PD−1とPD−L1間の相互作用により腫瘍侵襲性リンパ球が減少し、T細胞受容体媒介増殖が減少し、癌細胞による免疫回避現象が発生する。PD−1は、PD−1欠乏動物では多様な自己免疫性表現型、例えば自己免疫性心筋梗塞、関節炎および腎臓炎を同伴するループス様症候群が誘発されるうえ、自己免疫性脳脊髄炎、全身紅斑性ループス病、移植片対宿主病(Graft versus host disease; GVHD)、第1型糖尿病およびリウマチ性関節炎において重要な役割を果たすものとして明らかになっている。老齢のPD−1欠乏マウスは、自己免疫疾患を示すことから、PD−1が自己免疫性および免疫耐性に関連して重要な役割を果たすことが示される。特に、PD−1信号は慢性感染におけるT細胞の免疫能枯渇の誘導に必須的である。
【0007】
従来では、NKT細胞のリガンドであるα−GCがT細胞受容体を刺激してiNKT細胞の多様なサイトカインを速く生成させることにより、抗癌剤として使用されてきた。ところが、iNKT細胞にα−CGで反復的な刺激を与えると、アネルギー状態に至って反応性が大きく減少する傾向を示すので、効果的な抗癌効果を見せていない。したがって、iNKT細胞リガンドの投与により発生するアネルギー状態のiNKT細胞の反応性を回復させることが可能な抗癌剤の開発が切実に求められている。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Kim, D. H., W. S. Chang, Y. S. Lee, K. A. Lee, Y. K. Kim, B. S. Kwon, and C. Y. Kang. 2008. 4-1BB engagement costimulates NKT cell activation and exacerbates NKT cell ligand-induced airway hyperresponsiveness and inflammation. J Immunol 180:2062-2068.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明者らは、iNKT細胞リガンドの投与により発生するアネルギー状態のiNKT細胞の反応性を回復させることが可能な抗癌剤に対して研究したところ、抗PD−1抗体または抗PD−L1抗体を用いてPD−1またはPD−L1の信号伝達を遮断することにより、iNKT細胞リガンドの投与により発生するiNKT細胞のアネルギー誘導を防ぐことができ、既にアネルギー状態にあるiNKT細胞の場合にもサイトカインの分泌能力を回復させてiNKT細胞の反応性を回復させ、B16F10黒色腫癌細胞を用いた肺転移モデルで肺結節の数を著しく減少させてiNKT細胞の抗癌免疫反応を効果的に誘導することを見出し、本発明を完成することになった。
本発明の目的は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させることを特徴とし、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される、抗癌剤を提供することにある。
【課題を解決するための手段】
【0010】
上記目的を達成するために、本発明は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させることを特徴とし、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される、抗癌剤を提供する。
【0011】
また、本発明は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞に抗PD−1抗体または抗PD−L1抗体を処理してiNKT細胞の反応性を回復させる方法を提供する。
【0012】
前記iNKT細胞リガンドは、α−ガラクトシルセラミド、α−グルクロノシルセラミド、ホスファチジルイノシトールテトラマンノシド、イソグロボトリヘキソシルセラミド、ガングリオシドGD3、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、スルファチド、β−ガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、α−ガラクトシルセラミドの類似体であるβ−アノマーガラクトシルセラミドおよびα−アノマーガラクトシルセラミド、並びにバクテリア脂質抗原よりなる群から選択できる。
【0013】
前記抗PD−1抗体または抗PD−L1抗体は、モノクローナル抗体またはポリクローナル抗体である。
【発明の効果】
【0014】
本発明の抗癌剤は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させるのに効果がある。
【図面の簡単な説明】
【0015】
【図1】正常C57BL/6マウスにα−GCを投与した後、時間帯別(0時間、6時間、72時間、7日、一ヶ月、二ヶ月)に脾臓細胞を摘出してiNKT細胞におけるPD−1、PD−L1およびPD−L2の発現程度を示すグラフである。
【図2】正常C57BL/6マウスから脾臓細胞を摘出し、脾臓細胞を対照ラットIgG、抗PD−1抗体、抗PD−L1抗体または抗PD−L2抗体の存在下にα−GCと共に培養した後、上澄み液で生成されるIFN−γとIL−4の量をELISAによって測定して示すグラフである(インビトロ)。
【図3】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体を腹腔注射し、24時間後にα−GCを投与した後、0時間、2時間、6時間、12時間、24時間、48時間、72時間後に血清を得、血液内IFN−γとIL−4の量をELISAによって測定して示すグラフである(インビボ)。
【図4】図3で血液内IFN−γとIL−4がiNKT細胞に由来したものかを確認するために、細胞内サイトカイン染色法を用いてIFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した結果を示す図である。
【図5】正常C57BL/6マウスにα−GCを投与してiNKT細胞のアネルギーを誘導した後、7日および一ヶ月の後に脾臓細胞を摘出し、脾臓細胞を対照ラットIgG、抗PD−1抗体、抗PD−L1抗体または抗PD−L2抗体の存在下にα−GCと共に培養した後、上澄み液で生成されるIFN−γとIL−4の量をELISAによって測定して示すグラフである(インビトロ)。
【図6】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体を腹腔注射し、24時間後にα−GCを投与した後、14日目にα−GCを再投与し、2時間および12時間の後に血清を得、血液内IFN−γとIL−4の量をELISAによって測定して示すグラフである(インビボ)。
【図7】2時間後に得た脾臓細胞を用いて細胞内サイトカイン染色法を用いてIFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した結果を示す図である(インビボ)。
【図8】12時間後に得た脾臓細胞を用いてiNKT細胞およびNK細胞におけるCD69発現をフローサイトメトリーで測定した図である(インビボ)。
【図9】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体または抗PD−L1抗体を腹腔注射し、24時間後に皮膚癌細胞を静脈注射した後、0日、4日、8日目に対照ラットIgG、抗PD−1抗体または抗PD−L1抗体と共にα−GCを投与した後、14日後に肺の重量を測定し、転移された肺と通常の肺との重量差異をグラフによって示す図である。
【図10】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体、または抗PD−L1抗体を腹腔注射し、24時間後にα−GCを投与した後、7日後に皮膚癌細胞を静脈注射し、0日、4日、8日目にα−GCを投与した後、14日後に肺を分離し、癌細胞転移によって発生した肺結節の数(A)および分離した肺を光学顕微鏡によって観察した図(B)である。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
【0017】
本発明の抗PD−1抗体または抗PD−L1抗体は、PD−1またはPD−L1の信号伝達を遮断することにより、iNKT細胞リガンドの投与により発生するiNKT細胞のアネルギー誘導を防ぐことができ、既にアネルギー状態にあるiNKT細胞の場合にもサイトカインの分泌能力を回復させてiNKT細胞の反応性を回復させることができる。また、本発明の抗PD−1抗体または抗PD−L1抗体は、B16F10黒色腫癌細胞を用いた肺転移モデルでiNKT細胞のアネルギー誘導を阻害して肺結節の数を著しく減少させることにより、iNKT細胞の抗癌免疫反応を効果的に誘導することができるうえ、優れた癌転移抑制効果を有する。したがって、本発明に係る抗PD−1抗体または抗PD−L1抗体を含む抗癌剤は、癌、特に転移性癌の治療に非常に有用に使用できる。
【0018】
前記癌は、人体の各種癌、婦人科腫瘍、内分泌系癌、中枢神経系腫瘍、輸尿管癌などがあり、具体的には、肺癌、胃癌、肝癌、骨癌、膵臓癌、皮膚癌、頭頸部癌、皮膚黒色腫、子宮癌、卵巣癌、直腸癌、大腸癌、結腸癌、乳房癌、子宮肉腫、喇叭管癌腫、子宮内膜癌種、子宮頚部癌腫、膣癌腫、外陰部癌腫、食道癌、喉頭癌、小腸癌、甲状腺癌、副甲状腺癌、軟部組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性または急性白血病、幼年期の固型腫瘍、分化リンパ腫、膀胱癌、腎臓癌、腎臓細胞癌腫、腎臓骨盤癌腫、第1中枢神経系リンパ腫、脊髄軸腫瘍、脳幹神経膠腫または脳下垂体アデノーマを含む。
【0019】
本発明の組成物は、抗PD−1抗体または抗PD−L1抗体と共に、抗癌効果を有する公知の有効成分を少なくとも1種含有することができる。
【0020】
本発明の組成物は、投与のために、前述した有効成分以外に、薬学的に許容される担体をさらに少なくとも1種含んで製造することができる。薬学的に許容される担体は、食塩水、滅菌水、リンガー溶液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エタノール、およびこれら成分の少なくとも1成分を混合して使用することができ、必要に応じて抗酸化剤、緩衝液、静菌剤など他の通常の添加剤を加えることができる。また、希釈剤、分散剤、界面活性剤、結合剤および潤滑剤をさらに添加して水溶液、懸濁液、乳濁液などの注射用剤形、丸薬、カプセル、顆粒または錠剤に製剤化することができる。ひいては、当分野の適正な方法、または文献『Remington's Pharmaceutical Science(最近版), Mack Publishing Company, Easton PA』に開示されている方法を用いて、各疾患に応じてまたは成分に応じて好ましく製剤化することができる。
【0021】
本発明の組成物は、目的の方法に応じて経口投与または非経口投与(例えば、静脈内、皮下、腹腔内または局所に適用)を行うことができ、投与量は、患者の体重、年齢、性別、健康状態、食餌、投与時間、投与方法、排泄率および疾患の重症度などに応じてその範囲が多様である。前記抗PD−1抗体または抗PD−L1抗体は、1日投与量が約0.01〜1000mg/kg、好ましくは約0.1〜100mg/kgであり、1日1回〜数回にわたって投与することがさらに好ましい。
【0022】
本発明の組成物は、癌の予防および治療のために、単独で、または手術、ホルモン治療、薬物治療および生物学的反応調節剤を使用する方法と併用することができる。
【0023】
以下、本発明の理解を助けるために好適な実施例を提示する。しかし、下記実施例は本発明をより容易に理解するために提供されるものに過ぎず、本発明を限定するものではない。
【実施例1】
【0024】
iNKT細胞におけるPD−1およびPDリガンドの発現
1.実験動物
6〜8週齢の雌C56BL/6マウスをオリエントバイオから購入した。全てのマウスは病原体のない特殊環境で飼育された。
【0025】
2.試薬および抗体
α−GCは0.5%ツイン20含有のPBSに溶かした。マウスのPD−1(RMP1−14、ラット IgG2a)、PD−L1(MIH−5、ラット IgG2a)、PD−L2(Ty25、ラット IgG2a)に対する阻害抗体を生産する融合細胞は、ヤマザキなどの方法で生産された[Yamazaki, T., H. Akiba, H. Iwai, H. Matsuda, M. Aoki, Y. Tanno, T. Shin, H. Tsuchiya, D. M. Pardoll, K. Okumura, M. Azuma, and H. Yagita. 2002. Expression of programmed death 1 ligands by murine T cells and APC. J Immunol 169:5538-5545.; Tsushima, F., H. Iwai, N. Otsuki, M. Abe, S. Hirose, T. Yamazaki, H. Akiba, H. Yagita, Y. Takahashi, K. Omura, K. Okumura, and M. Azuma. 2003. Preferential contribution of B7-H1 to programmed death-1-mediated regulation of hapten-specific allergic inflammatory responses. Eur J Immunol 33:2773-2782.; Yamazaki, T., H. Akiba, A. Koyanagi, M. Azuma, H. Yagita, and K. Okumura. 2005. Blockade of B7-H1 on macrophages suppresses CD4+ T cell proliferation by augmenting IFN-gamma-induced nitric oxide production. J Immunol 175:1586-1592.]。全てのクローンは10%FBS(Gibco)と1%ペニシリン/ストレプトマイシン(BioWhittaker)を含有したRPMI1640(Gibco)培地で培養した。全ての抗体はカプリル酸を用いた精製によってヌードマウスの腹水から得た。対照ラットIgGは正常ラットの血清から同一の方法で得た。
【0026】
3.α−GC投与後のiNKT細胞におけるPD−1およびPDリガンドの発現
正常C57BL/6マウスに2μgのα−GCを投与した後、時間帯別(0時間、6時間、72時間、7日、一ヶ月、二ヶ月)に脾臓細胞を摘出した。細胞は、PE結合抗PD−1モノクローナル抗体、PE−結合抗PD−L1モノクローナル抗体、PE−結合抗PD−L2モノクローナル抗体、PE結合同型対照モノクローナル抗体でそれぞれ染色した。iNKT細胞は、B220―TCR−βintα−GC/CD1d:Ig+である細胞と指定した。PD−1、PD−L1、PD−L2の発現(白色グラフ)はFACSによって測定した。その結果は図1に示し、灰色グラフは同型対照モノクローナル抗体の発現結果である。
【0027】
図1に示すように、正常状態のiNKT細胞におけるPD−1は少ない水準で発現されており、活性化された後にはその発現が増加した。このような増加した性向は2ヶ月間持続した。これに対し、PD−L1は、正常状態のiNKT細胞で発現されていて、活性化された後にはしばらく増加し、さらに正常状態の水準に戻る傾向を示した。PD−L2はiNKT細胞で発現されないものと確認された。
【実施例2】
【0028】
実施例2:PD−1、PD−L1およびPD−L2がiNKT細胞の活性化に及ぼす影響
PD−1、PD−L1およびPD−L2がiNKT細胞の活性化に及ぼす影響を確認するために、インビトロおよびインビボで次の実験を行った。
【0029】
1.インビトロにおけるiNKT細胞の活性化
正常C57BL/6マウスから脾臓細胞を摘出し、摘出した脾臓細胞5×105を50μg/mLの対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体の存在下に100ng/mLのα−GCと共に3日間培養した。その後、上澄み液を回収してIFN−γとIL−4をELISAによって測定した。その結果は図2に示した。
【0030】
図2に示すように、抗PD−1抗体を加えた場合、IFN−γの分泌が対照IgGに比べて大きく増加した。IL−4も、少ないが、有意的に増加する傾向を示した。抗PD−L1抗体を加えた場合にはIFN−γの分泌が増加し、抗PD−L2抗体を加えた場合にはあまり影響がないことを確認した。
【0031】
2.インビボにおけるiNKT細胞の活性化
正常C57BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体を腹腔注射し、24時間後に2μgのα−GCを投与した。0時間、2時間、6時間、12時間、48時間、72時間後に血清を得、血液内IFN−γとIL−4の数値をELISAによって測定した。
【0032】
また、血液内で増加したIFN−γが明確にiNKT細胞に由来したものかを確認するために、細胞内サイトカイン染色法を用いてフローサイトメトリーで分析した。すなわち、α−GC投与2時間後に脾臓細胞を摘出し、提出した脾臓細胞5×106をゴルジプラグ(Golgi plug)と共に2時間培養してサイトカインを蓄積させた。細胞内サイトカイン染色はBD Cytofix/Cytoperm Plus with Golgiplug kitを使用し、製作者のプロトコル(BD Biosciences)に応じて進行した。iNKT細胞はB220―TCR−βintα−GC/CD1d:Ig+の細胞と指定した後、IFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した。
【0033】
血液内IFN−γとIL−4の数値は図3に示し、IFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した結果は図4に示した。
【0034】
図3に示すように、α−GCを投与した後、iNKT細胞が活性化されると、血液内IFN−γは12時間以内に最高値を示し、IL−4は2時間以内に最高値を示した。抗PD−1抗体または抗−PD−L1抗体を投与した場合、最高点における血液内IFN−γの量が対照群よりさらに大きく増加することを確認した。ところが、IL−4の場合は若干の差異を示したが、有意的な結果を示してはいない。
【0035】
また、図4に示すように、抗PD−1抗体または抗PD−L1抗体によって相互作用を遮断した場合、IFN−γを生産しているiNKT細胞が対照群に比べて増加していることを確認した。これに対し、IL−4を生産するiNKT細胞は、対照群とは大きい差異を示していない。したがって、PD−1/PD−L1の相互作用を遮断すると、iNKT細胞の活性化中に補助阻害信号を伝達してiNKT細胞のIFN−γの分泌を増加させるということが分かる。
【実施例3】
【0036】
PD−1およびPD−L1の相互作用の遮断がアネルギー状態のiNKT細胞の反応性回復に及ぼす影響
PD−1およびPD−L1の相互作用を遮断すると、アネルギー状態であるiNKT細胞の反応性を回復させることができるかを確認するために、インビトロおよびインビボで次の実験を行った。
【0037】
1.インビトロにおけるアネルギー状態のiNKT細胞の反応性回復
α−GCによって反応性が低くなる現象は、α−GC投与後3日から現れ始め7〜30日まで持続的に確認された。したがって、正常C57BL/6マウスに2μgのα−GCを投与してiNKT細胞のアネルギーを誘導した後、7日および一ヶ月の後に脾臓細胞を摘出した。摘出した脾臓細胞5×105を50μg/mLの対照ラットIgG、抗PD−1抗体、抗PD−L1または抗PD−L2抗体の存在下に100ng/mLのα−GCと共に3日間培養した。正常マウスから得た脾臓細胞も100ng/mLのα−GCの存在下に3日間培養し、これを「活性化(activation)」と表示した。その後、上澄み液を回収してIFN−γとIL−4をELISAによって測定した[*:p<0.05および**:p<0.01(対照ラットIgGに対して)]。その結果は図5に示した。
【0038】
図5に示すように、7日前にα−GCを予め処理してiNKT細胞のアネルギーを誘導したマウスの脾臓細胞は、対照IgGと共にさらにα−GCで刺激を与えると、IFN−γとIL−4の生産が大きく減少することを確認した。これに対し、iNKT細胞のアネルギーが誘導された状態の脾臓細胞を抗PD−1抗体または抗PD−L1抗体と共にα−GCでさらに刺激する場合、IFN−γとIL−4の生産が大きく増加することを確認した(A)。また、このような傾向は1ヶ月〜2ヶ月間持続された(B)。したがって、α−GCによる再刺激の際に、PD−1/PD−L1の相互作用を遮断すると、アネルギー状態であるiNKT細胞の非反応性を克服することができるものと思われる。
【0039】
2.インビボにおけるアネルギー状態のiNKT細胞の反応性回復
正常C57BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体または抗PD−L1抗体を腹腔注射し、24時間後に2μgのα−GCを投与した。その後、14日目に2μgのα−GCを再投与した。α−GCの再投与2時間後および12時間後に血清を得た。2時間後に得た血清ではIL−4の数値を、12時間後に得た血清ではIFN−γをELISAによって測定した。
【0040】
また、α−GC再投与2時間後および12時間後に摘出した脾臓細胞5×106をゴルジプラグと共に2時間培養してサイトカインを蓄積させた。2時間後に得た脾臓細胞は、BD Cytofix/Cytoperm Plus with Golgiplug kitを用いた細胞内サイトカイン染色に使用した。12時間後に得た脾臓細胞は、iNKT細胞およびNK細胞におけるCD69発現の測定に使用した。iNKT細胞はB220―TCR−βintα−GC/CD1d:Ig+である細胞と指定し、NK細胞はB220―TCR−β―NK1.1highである細胞と指定した。IFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析し、iNKT細胞およびNK細胞におけるCD69発現はフローサイトメトリーで測定した。
血液内IFN−γとIL−4の数値は図6に示し、IFN−γ+またはIL−4+iNKT細胞をFACSによって分析した結果は図7に示し、iNKT細胞およびNK細胞におけるCD69発現は図8に示した。
図6に示すように、対照ラットIgGと一番目のα−GCの投与後、2番目のα−GC投与によるIFN−γおよびIL−4の分泌は著しく減少し、抗PD−1抗体と一番目のα−GCの投与後、2番目のα−GC投与によるIFN−γおよびIL−4の分泌は大きく増加した。
また、図7に示すように、サイトカインの分泌がiNKT細胞で起ることを確認した。
また、図8に示すように、抗PD−1抗体と一番目のα−GCを投与した後、2番目のα−GCを投与した場合、CD69発現がiNKT細胞とNK細胞で同一に増加した。したがって、iNKT細胞のアネルギー誘導におけるPD−1/PD−L1の相互作用が重要な役割を果たすものと思われる。
【実施例4】
【0041】
抗PD−1抗体または抗PD−L1抗体が活性化されたiNKT細胞の抗癌効果に及ぼす影響
抗PD−1抗体または抗PD−L1抗体がB16F10黒色腫癌細胞を用いた肺転移モデルで活性化されたiNKT細胞の抗癌効果に及ぼす影響を調べるために、次の実験を行った。
1.肺の重量測定
皮膚癌細胞(B16F10、ATCC)は10%FBSと1%ペニシリン/ストレプトマイシンを含有したDMEM培地で培養した。C56BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体、または抗PD−L1抗体を腹腔注射し、24時間後に皮膚癌細胞(B16F10)2×105を静脈注射で接種した。その後、0日、4日、8日目に200μgの対照ラットIgG、抗PD−1抗体または抗PD−L1抗体と共に500ngのα−GCを投与した。14日後に肺の重量を測定し、転移された肺と通常の肺との重量差をグラフによって図9に示した。
【0042】
図9に示すように、抗PD−1抗体と共にα−GCを投与した場合、癌細胞が転移された肺の重量が対照ラットIgGと共にα−GCを投与した場合より大きく減少したことを確認した。
【0043】
2.肺結節の数測定
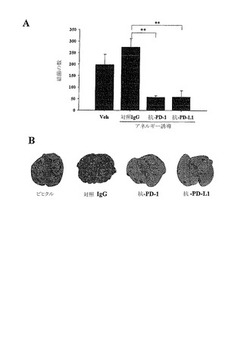
アネルギーが誘導されたiNKT細胞の抗癌効果回復を測定するために、正常C57BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体、または抗PD−L1抗体を腹腔注射し、24時間後に2μgのαGCを投与してアネルギーを誘導した。7日後に皮膚癌細胞(B16F10)5×105を静脈注射した後、0日、4日、8日目に500ngのα−GCを処理してiNKT細胞の抗癌効果を誘導した。14日後に肺を分離した後、癌細胞転移により発生した肺結節の数を数えた(A)。そして、分離した肺を光学顕微鏡によって観察した(B)。その結果は図10に示した。
【0044】
図10に示すように、対照IgGを処理し、α−GCを投与してiNKT細胞のアネルギーを誘導した場合には、アネルギー状態がそのまま維持されて通常の癌転移対照群とほぼ類似した結果を示すことにより、正常な抗癌効果を見せていない。これに対し、抗PD−1抗体および抗PD−L1抗体を処理してα−GCによるアネルギーの誘導を防いだ場合には、B16F10黒色腫癌細胞を用いた肺転移モデルで肺結節の数を著しく減少させてiNKT細胞の抗癌効果を著しく増加させ、優れた癌転移抑制効果を示すことを確認した。よって、iNKT細胞のアネルギー誘導の際に抗PD−1抗体または抗PD−L1抗体を処理してPD−1またはPD−L1の信号伝達を遮断すると、iNKT細胞の抗癌効果を持続させることができることが分かる。
【0045】
次に、本発明の組成物のための製剤例を例示する。
【0046】
製剤例1:散剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
乳糖 1.5g
タルク 0.5g
これらの成分を混合し、気密布に充填して散剤を製造した。
製剤例2:錠剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
ラクトース 7.9g
結晶性セルロース 1.5g
ステアリン酸マグネシウム 0.5g
これらの成分を混合した後、直接打錠法(direct tableting method)によって錠剤を製造した。
製剤例3:カプセル剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
トウモロコシ澱粉 5g
カルボキシセルロース 4.9g
これらの成分を混合して粉末を製造した後、前記粉末を通常のカプセル剤の製造方法に応じて硬質カプセルに充填してカプセル剤を製造した。
製剤例4:注射剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
注射用滅菌蒸留水 適量
pH調節剤 適量
通常の注射剤の製造方法によって1アンプル当り(2mL)前記成分含量で製造した。
製剤例5:液剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
異性化糖 10g
マンニトール 5g
精製水 適量
通常の液剤の製造方法によって精製水にそれぞれの成分を加えて溶解させ、レモン香を適量加えた後、前記の成分を混合した。その後、精製水を加えて全体100mLに調節した後、茶色瓶に充填し、滅菌させて液剤を製造した。
【産業上の利用可能性】
【0047】
本発明の抗PD−1抗体または抗PD−L1抗体は、PD−1またはPD−L1の信号伝達を遮断することにより、iNKT細胞リガンドの投与により発生するiNKT細胞のアネルギー誘導を防ぐことができ、既にアネルギー状態にあるiNKT細胞の場合にもサイトカインの分泌能力を回復させてiNKT細胞の反応性を回復させ、B16F10黒色腫癌細胞を用いた肺転移モデルで肺結節の数を著しく減少させてiNKT細胞の抗癌免疫反応を効果的に誘導することができるうえ、優れた癌転移抑制効果を示す。よって、本発明に係る抗PD−1抗体または抗PD−L1抗体を含む抗癌剤は、癌、特に転移性癌の治療に非常に有用に使用することができる。
【技術分野】
【0001】
本発明は、抗PD−1抗体または抗PD−L1抗体を含む抗癌剤に係り、さらに詳しくは、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させる抗PD−1抗体または抗PD−L1抗体を含む抗癌剤に関する。
【背景技術】
【0002】
ナチュラルキラー(NKT)細胞は、T細胞の受容体とNK細胞特異的な表面標識子を発現しており、多様な免疫疾患、例えば自己免疫疾患、感染性疾患、癌等で免疫調節作用および免疫強化作用を行っているT細胞である。NKT細胞は、胸腺、肝、骨髄などの器官に多く存在し、脾臓、リンパ節、血液には少量存在する。
【0003】
一般に、T細胞は、主要組織適合性複合体(MHC)クラスIまたはMHCクラスIIに提示された小さいペプチド抗原を認知するが、これに対し、NKT細胞は、MHCクラスI様分子(MHC class 1 like-molecule)としてのCD1dによって提示された糖脂質抗原を認識する。NKT細胞の重要な種である第1型NKT細胞は、不変性ナチュラルキラーT細胞(invariant natural killer T cells;iNKT細胞)とも呼ばれる。マウスの場合、Vα14−Jα18(ヒトの場合にはVα24−Jα18)からなる不変性ナチュラルキラーT細胞受容体(TCR)を有する。また、α−ガラクトシルセラミド(α-galactosylceramide;α−GC)などのリガンドでT細胞受容体に刺激を加えると、iNKT細胞はIL−4、IFN−γ、IL−12、GM−CSFなどの多様なサイトカインを速く生成する。このように速くて強力なリガンドに対する反応によって、iNKT細胞は先天的免疫反応と後天的免疫反応に関与する多様な免疫細胞の活性を統制または増強させることができる。したがって、iNKT細胞の免疫調節作用は、例えば抗癌効果の増進や自己免疫疾患の調節などと多様な疾患で解明されており、癌または自己免疫疾患に対する免疫治療方法の一つとして研究されている。
【0004】
ところが、iNKT細胞は、T細胞受容体による1次刺激の後、反復的なリガンド刺激によってアネルギー状態に至って反応性が大幅減少するという傾向を示す。例えば、生体内でα−GCで刺激を受ける場合、同じリガンドで2次刺激を与えたとき、iNKT細胞の分裂またはサイトカインの生成が減少する。このようなiNKT細胞のアネルギーはiNKT細胞を標的とした免疫治療において足かせになる。
【0005】
一般的なT細胞におけるアネルギーは、T細胞受容体の刺激が補助刺激分子(co-stimulatory molecule)の不十分な刺激と共に与えられるときに起ると知られている。CD28、CD40L、ICOSなどの補助刺激因子がiNKT細胞の生成および活性化に関連していることは既に知られている。最近では、4−1BBが補助刺激因子としてiNKT細胞に作用して活性化の促進に寄与し、iNKT細胞によって媒介されるアレルギー性肺炎症に影響を与えるという研究結果の発表がある(非特許文献1)。また、PD−1(programmed death-1)、B7H3、B7H4などの補助阻害分子が、T細胞受容体で刺激されたT細胞へ抑制信号を送ることにより、T細胞を免疫性欠如または免疫耐性に陥るようにすると報告されている。また、リンパ球性脈絡髄膜炎ウイルス(lymphocytic choriomeningitis virus;LCMV)感染モデルにおいて抗原を積載している樹枝状細胞によってCD8T細胞が免疫耐性に陥るが、この際、PD−1分子の信号伝達を阻害すると、CD8T細胞のアネルギー現象が克服されるということを確認したことがある。また、慢性感染モデルで発生する免疫能力枯渇CD8T細胞の場合にもPD−1/PD−L1の相互作用を遮断すると、その反応性が回復するということが報告されている。
【0006】
一方、PD−1は、55kDaのI型膜貫通タンパク質であって、Ig相と遺伝子の一部を成しており、免疫グロブリン分子群に属するT細胞の補助阻害分子としてよく知られている。すなわち、PD−1は活性化されたB細胞、T細胞および骨髄細胞上に発現される受容体のCD28群(例えば、CD28、CTLA−4、ICOSおよびBTLAを含む)に属する抑制因子の一員である。PD−1に対するリガンドとしてはPD−L1およびPD−L2があり、これらのリガンドはPD−1と結合するときにT細胞の活性化を下向き調節するものと知られている。PD−1は、一般的なT細胞では正常細胞のときに発現されず、活性化されると発現が増加するものと知られている。これに対し、PD−L1は、正常状態のT細胞でもある程度発現し、活性化されるとその発現が増加するものと報告されている。PD−L1は多数のヒト癌で多量発見され、PD−1とPD−L1の相互作用はT細胞に刺激または抑制信号を伝達する。すなわち、PD−1とPD−L1間の相互作用により腫瘍侵襲性リンパ球が減少し、T細胞受容体媒介増殖が減少し、癌細胞による免疫回避現象が発生する。PD−1は、PD−1欠乏動物では多様な自己免疫性表現型、例えば自己免疫性心筋梗塞、関節炎および腎臓炎を同伴するループス様症候群が誘発されるうえ、自己免疫性脳脊髄炎、全身紅斑性ループス病、移植片対宿主病(Graft versus host disease; GVHD)、第1型糖尿病およびリウマチ性関節炎において重要な役割を果たすものとして明らかになっている。老齢のPD−1欠乏マウスは、自己免疫疾患を示すことから、PD−1が自己免疫性および免疫耐性に関連して重要な役割を果たすことが示される。特に、PD−1信号は慢性感染におけるT細胞の免疫能枯渇の誘導に必須的である。
【0007】
従来では、NKT細胞のリガンドであるα−GCがT細胞受容体を刺激してiNKT細胞の多様なサイトカインを速く生成させることにより、抗癌剤として使用されてきた。ところが、iNKT細胞にα−CGで反復的な刺激を与えると、アネルギー状態に至って反応性が大きく減少する傾向を示すので、効果的な抗癌効果を見せていない。したがって、iNKT細胞リガンドの投与により発生するアネルギー状態のiNKT細胞の反応性を回復させることが可能な抗癌剤の開発が切実に求められている。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Kim, D. H., W. S. Chang, Y. S. Lee, K. A. Lee, Y. K. Kim, B. S. Kwon, and C. Y. Kang. 2008. 4-1BB engagement costimulates NKT cell activation and exacerbates NKT cell ligand-induced airway hyperresponsiveness and inflammation. J Immunol 180:2062-2068.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明者らは、iNKT細胞リガンドの投与により発生するアネルギー状態のiNKT細胞の反応性を回復させることが可能な抗癌剤に対して研究したところ、抗PD−1抗体または抗PD−L1抗体を用いてPD−1またはPD−L1の信号伝達を遮断することにより、iNKT細胞リガンドの投与により発生するiNKT細胞のアネルギー誘導を防ぐことができ、既にアネルギー状態にあるiNKT細胞の場合にもサイトカインの分泌能力を回復させてiNKT細胞の反応性を回復させ、B16F10黒色腫癌細胞を用いた肺転移モデルで肺結節の数を著しく減少させてiNKT細胞の抗癌免疫反応を効果的に誘導することを見出し、本発明を完成することになった。
本発明の目的は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させることを特徴とし、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される、抗癌剤を提供することにある。
【課題を解決するための手段】
【0010】
上記目的を達成するために、本発明は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させることを特徴とし、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される、抗癌剤を提供する。
【0011】
また、本発明は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞に抗PD−1抗体または抗PD−L1抗体を処理してiNKT細胞の反応性を回復させる方法を提供する。
【0012】
前記iNKT細胞リガンドは、α−ガラクトシルセラミド、α−グルクロノシルセラミド、ホスファチジルイノシトールテトラマンノシド、イソグロボトリヘキソシルセラミド、ガングリオシドGD3、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、スルファチド、β−ガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、α−ガラクトシルセラミドの類似体であるβ−アノマーガラクトシルセラミドおよびα−アノマーガラクトシルセラミド、並びにバクテリア脂質抗原よりなる群から選択できる。
【0013】
前記抗PD−1抗体または抗PD−L1抗体は、モノクローナル抗体またはポリクローナル抗体である。
【発明の効果】
【0014】
本発明の抗癌剤は、iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させるのに効果がある。
【図面の簡単な説明】
【0015】
【図1】正常C57BL/6マウスにα−GCを投与した後、時間帯別(0時間、6時間、72時間、7日、一ヶ月、二ヶ月)に脾臓細胞を摘出してiNKT細胞におけるPD−1、PD−L1およびPD−L2の発現程度を示すグラフである。
【図2】正常C57BL/6マウスから脾臓細胞を摘出し、脾臓細胞を対照ラットIgG、抗PD−1抗体、抗PD−L1抗体または抗PD−L2抗体の存在下にα−GCと共に培養した後、上澄み液で生成されるIFN−γとIL−4の量をELISAによって測定して示すグラフである(インビトロ)。
【図3】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体を腹腔注射し、24時間後にα−GCを投与した後、0時間、2時間、6時間、12時間、24時間、48時間、72時間後に血清を得、血液内IFN−γとIL−4の量をELISAによって測定して示すグラフである(インビボ)。
【図4】図3で血液内IFN−γとIL−4がiNKT細胞に由来したものかを確認するために、細胞内サイトカイン染色法を用いてIFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した結果を示す図である。
【図5】正常C57BL/6マウスにα−GCを投与してiNKT細胞のアネルギーを誘導した後、7日および一ヶ月の後に脾臓細胞を摘出し、脾臓細胞を対照ラットIgG、抗PD−1抗体、抗PD−L1抗体または抗PD−L2抗体の存在下にα−GCと共に培養した後、上澄み液で生成されるIFN−γとIL−4の量をELISAによって測定して示すグラフである(インビトロ)。
【図6】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体を腹腔注射し、24時間後にα−GCを投与した後、14日目にα−GCを再投与し、2時間および12時間の後に血清を得、血液内IFN−γとIL−4の量をELISAによって測定して示すグラフである(インビボ)。
【図7】2時間後に得た脾臓細胞を用いて細胞内サイトカイン染色法を用いてIFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した結果を示す図である(インビボ)。
【図8】12時間後に得た脾臓細胞を用いてiNKT細胞およびNK細胞におけるCD69発現をフローサイトメトリーで測定した図である(インビボ)。
【図9】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体または抗PD−L1抗体を腹腔注射し、24時間後に皮膚癌細胞を静脈注射した後、0日、4日、8日目に対照ラットIgG、抗PD−1抗体または抗PD−L1抗体と共にα−GCを投与した後、14日後に肺の重量を測定し、転移された肺と通常の肺との重量差異をグラフによって示す図である。
【図10】正常C57BL/6マウスに対照ラットIgG、抗PD−1抗体、または抗PD−L1抗体を腹腔注射し、24時間後にα−GCを投与した後、7日後に皮膚癌細胞を静脈注射し、0日、4日、8日目にα−GCを投与した後、14日後に肺を分離し、癌細胞転移によって発生した肺結節の数(A)および分離した肺を光学顕微鏡によって観察した図(B)である。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
【0017】
本発明の抗PD−1抗体または抗PD−L1抗体は、PD−1またはPD−L1の信号伝達を遮断することにより、iNKT細胞リガンドの投与により発生するiNKT細胞のアネルギー誘導を防ぐことができ、既にアネルギー状態にあるiNKT細胞の場合にもサイトカインの分泌能力を回復させてiNKT細胞の反応性を回復させることができる。また、本発明の抗PD−1抗体または抗PD−L1抗体は、B16F10黒色腫癌細胞を用いた肺転移モデルでiNKT細胞のアネルギー誘導を阻害して肺結節の数を著しく減少させることにより、iNKT細胞の抗癌免疫反応を効果的に誘導することができるうえ、優れた癌転移抑制効果を有する。したがって、本発明に係る抗PD−1抗体または抗PD−L1抗体を含む抗癌剤は、癌、特に転移性癌の治療に非常に有用に使用できる。
【0018】
前記癌は、人体の各種癌、婦人科腫瘍、内分泌系癌、中枢神経系腫瘍、輸尿管癌などがあり、具体的には、肺癌、胃癌、肝癌、骨癌、膵臓癌、皮膚癌、頭頸部癌、皮膚黒色腫、子宮癌、卵巣癌、直腸癌、大腸癌、結腸癌、乳房癌、子宮肉腫、喇叭管癌腫、子宮内膜癌種、子宮頚部癌腫、膣癌腫、外陰部癌腫、食道癌、喉頭癌、小腸癌、甲状腺癌、副甲状腺癌、軟部組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性または急性白血病、幼年期の固型腫瘍、分化リンパ腫、膀胱癌、腎臓癌、腎臓細胞癌腫、腎臓骨盤癌腫、第1中枢神経系リンパ腫、脊髄軸腫瘍、脳幹神経膠腫または脳下垂体アデノーマを含む。
【0019】
本発明の組成物は、抗PD−1抗体または抗PD−L1抗体と共に、抗癌効果を有する公知の有効成分を少なくとも1種含有することができる。
【0020】
本発明の組成物は、投与のために、前述した有効成分以外に、薬学的に許容される担体をさらに少なくとも1種含んで製造することができる。薬学的に許容される担体は、食塩水、滅菌水、リンガー溶液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エタノール、およびこれら成分の少なくとも1成分を混合して使用することができ、必要に応じて抗酸化剤、緩衝液、静菌剤など他の通常の添加剤を加えることができる。また、希釈剤、分散剤、界面活性剤、結合剤および潤滑剤をさらに添加して水溶液、懸濁液、乳濁液などの注射用剤形、丸薬、カプセル、顆粒または錠剤に製剤化することができる。ひいては、当分野の適正な方法、または文献『Remington's Pharmaceutical Science(最近版), Mack Publishing Company, Easton PA』に開示されている方法を用いて、各疾患に応じてまたは成分に応じて好ましく製剤化することができる。
【0021】
本発明の組成物は、目的の方法に応じて経口投与または非経口投与(例えば、静脈内、皮下、腹腔内または局所に適用)を行うことができ、投与量は、患者の体重、年齢、性別、健康状態、食餌、投与時間、投与方法、排泄率および疾患の重症度などに応じてその範囲が多様である。前記抗PD−1抗体または抗PD−L1抗体は、1日投与量が約0.01〜1000mg/kg、好ましくは約0.1〜100mg/kgであり、1日1回〜数回にわたって投与することがさらに好ましい。
【0022】
本発明の組成物は、癌の予防および治療のために、単独で、または手術、ホルモン治療、薬物治療および生物学的反応調節剤を使用する方法と併用することができる。
【0023】
以下、本発明の理解を助けるために好適な実施例を提示する。しかし、下記実施例は本発明をより容易に理解するために提供されるものに過ぎず、本発明を限定するものではない。
【実施例1】
【0024】
iNKT細胞におけるPD−1およびPDリガンドの発現
1.実験動物
6〜8週齢の雌C56BL/6マウスをオリエントバイオから購入した。全てのマウスは病原体のない特殊環境で飼育された。
【0025】
2.試薬および抗体
α−GCは0.5%ツイン20含有のPBSに溶かした。マウスのPD−1(RMP1−14、ラット IgG2a)、PD−L1(MIH−5、ラット IgG2a)、PD−L2(Ty25、ラット IgG2a)に対する阻害抗体を生産する融合細胞は、ヤマザキなどの方法で生産された[Yamazaki, T., H. Akiba, H. Iwai, H. Matsuda, M. Aoki, Y. Tanno, T. Shin, H. Tsuchiya, D. M. Pardoll, K. Okumura, M. Azuma, and H. Yagita. 2002. Expression of programmed death 1 ligands by murine T cells and APC. J Immunol 169:5538-5545.; Tsushima, F., H. Iwai, N. Otsuki, M. Abe, S. Hirose, T. Yamazaki, H. Akiba, H. Yagita, Y. Takahashi, K. Omura, K. Okumura, and M. Azuma. 2003. Preferential contribution of B7-H1 to programmed death-1-mediated regulation of hapten-specific allergic inflammatory responses. Eur J Immunol 33:2773-2782.; Yamazaki, T., H. Akiba, A. Koyanagi, M. Azuma, H. Yagita, and K. Okumura. 2005. Blockade of B7-H1 on macrophages suppresses CD4+ T cell proliferation by augmenting IFN-gamma-induced nitric oxide production. J Immunol 175:1586-1592.]。全てのクローンは10%FBS(Gibco)と1%ペニシリン/ストレプトマイシン(BioWhittaker)を含有したRPMI1640(Gibco)培地で培養した。全ての抗体はカプリル酸を用いた精製によってヌードマウスの腹水から得た。対照ラットIgGは正常ラットの血清から同一の方法で得た。
【0026】
3.α−GC投与後のiNKT細胞におけるPD−1およびPDリガンドの発現
正常C57BL/6マウスに2μgのα−GCを投与した後、時間帯別(0時間、6時間、72時間、7日、一ヶ月、二ヶ月)に脾臓細胞を摘出した。細胞は、PE結合抗PD−1モノクローナル抗体、PE−結合抗PD−L1モノクローナル抗体、PE−結合抗PD−L2モノクローナル抗体、PE結合同型対照モノクローナル抗体でそれぞれ染色した。iNKT細胞は、B220―TCR−βintα−GC/CD1d:Ig+である細胞と指定した。PD−1、PD−L1、PD−L2の発現(白色グラフ)はFACSによって測定した。その結果は図1に示し、灰色グラフは同型対照モノクローナル抗体の発現結果である。
【0027】
図1に示すように、正常状態のiNKT細胞におけるPD−1は少ない水準で発現されており、活性化された後にはその発現が増加した。このような増加した性向は2ヶ月間持続した。これに対し、PD−L1は、正常状態のiNKT細胞で発現されていて、活性化された後にはしばらく増加し、さらに正常状態の水準に戻る傾向を示した。PD−L2はiNKT細胞で発現されないものと確認された。
【実施例2】
【0028】
実施例2:PD−1、PD−L1およびPD−L2がiNKT細胞の活性化に及ぼす影響
PD−1、PD−L1およびPD−L2がiNKT細胞の活性化に及ぼす影響を確認するために、インビトロおよびインビボで次の実験を行った。
【0029】
1.インビトロにおけるiNKT細胞の活性化
正常C57BL/6マウスから脾臓細胞を摘出し、摘出した脾臓細胞5×105を50μg/mLの対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体の存在下に100ng/mLのα−GCと共に3日間培養した。その後、上澄み液を回収してIFN−γとIL−4をELISAによって測定した。その結果は図2に示した。
【0030】
図2に示すように、抗PD−1抗体を加えた場合、IFN−γの分泌が対照IgGに比べて大きく増加した。IL−4も、少ないが、有意的に増加する傾向を示した。抗PD−L1抗体を加えた場合にはIFN−γの分泌が増加し、抗PD−L2抗体を加えた場合にはあまり影響がないことを確認した。
【0031】
2.インビボにおけるiNKT細胞の活性化
正常C57BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体、抗PD−L1抗体、または抗PD−L2抗体を腹腔注射し、24時間後に2μgのα−GCを投与した。0時間、2時間、6時間、12時間、48時間、72時間後に血清を得、血液内IFN−γとIL−4の数値をELISAによって測定した。
【0032】
また、血液内で増加したIFN−γが明確にiNKT細胞に由来したものかを確認するために、細胞内サイトカイン染色法を用いてフローサイトメトリーで分析した。すなわち、α−GC投与2時間後に脾臓細胞を摘出し、提出した脾臓細胞5×106をゴルジプラグ(Golgi plug)と共に2時間培養してサイトカインを蓄積させた。細胞内サイトカイン染色はBD Cytofix/Cytoperm Plus with Golgiplug kitを使用し、製作者のプロトコル(BD Biosciences)に応じて進行した。iNKT細胞はB220―TCR−βintα−GC/CD1d:Ig+の細胞と指定した後、IFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した。
【0033】
血液内IFN−γとIL−4の数値は図3に示し、IFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析した結果は図4に示した。
【0034】
図3に示すように、α−GCを投与した後、iNKT細胞が活性化されると、血液内IFN−γは12時間以内に最高値を示し、IL−4は2時間以内に最高値を示した。抗PD−1抗体または抗−PD−L1抗体を投与した場合、最高点における血液内IFN−γの量が対照群よりさらに大きく増加することを確認した。ところが、IL−4の場合は若干の差異を示したが、有意的な結果を示してはいない。
【0035】
また、図4に示すように、抗PD−1抗体または抗PD−L1抗体によって相互作用を遮断した場合、IFN−γを生産しているiNKT細胞が対照群に比べて増加していることを確認した。これに対し、IL−4を生産するiNKT細胞は、対照群とは大きい差異を示していない。したがって、PD−1/PD−L1の相互作用を遮断すると、iNKT細胞の活性化中に補助阻害信号を伝達してiNKT細胞のIFN−γの分泌を増加させるということが分かる。
【実施例3】
【0036】
PD−1およびPD−L1の相互作用の遮断がアネルギー状態のiNKT細胞の反応性回復に及ぼす影響
PD−1およびPD−L1の相互作用を遮断すると、アネルギー状態であるiNKT細胞の反応性を回復させることができるかを確認するために、インビトロおよびインビボで次の実験を行った。
【0037】
1.インビトロにおけるアネルギー状態のiNKT細胞の反応性回復
α−GCによって反応性が低くなる現象は、α−GC投与後3日から現れ始め7〜30日まで持続的に確認された。したがって、正常C57BL/6マウスに2μgのα−GCを投与してiNKT細胞のアネルギーを誘導した後、7日および一ヶ月の後に脾臓細胞を摘出した。摘出した脾臓細胞5×105を50μg/mLの対照ラットIgG、抗PD−1抗体、抗PD−L1または抗PD−L2抗体の存在下に100ng/mLのα−GCと共に3日間培養した。正常マウスから得た脾臓細胞も100ng/mLのα−GCの存在下に3日間培養し、これを「活性化(activation)」と表示した。その後、上澄み液を回収してIFN−γとIL−4をELISAによって測定した[*:p<0.05および**:p<0.01(対照ラットIgGに対して)]。その結果は図5に示した。
【0038】
図5に示すように、7日前にα−GCを予め処理してiNKT細胞のアネルギーを誘導したマウスの脾臓細胞は、対照IgGと共にさらにα−GCで刺激を与えると、IFN−γとIL−4の生産が大きく減少することを確認した。これに対し、iNKT細胞のアネルギーが誘導された状態の脾臓細胞を抗PD−1抗体または抗PD−L1抗体と共にα−GCでさらに刺激する場合、IFN−γとIL−4の生産が大きく増加することを確認した(A)。また、このような傾向は1ヶ月〜2ヶ月間持続された(B)。したがって、α−GCによる再刺激の際に、PD−1/PD−L1の相互作用を遮断すると、アネルギー状態であるiNKT細胞の非反応性を克服することができるものと思われる。
【0039】
2.インビボにおけるアネルギー状態のiNKT細胞の反応性回復
正常C57BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体または抗PD−L1抗体を腹腔注射し、24時間後に2μgのα−GCを投与した。その後、14日目に2μgのα−GCを再投与した。α−GCの再投与2時間後および12時間後に血清を得た。2時間後に得た血清ではIL−4の数値を、12時間後に得た血清ではIFN−γをELISAによって測定した。
【0040】
また、α−GC再投与2時間後および12時間後に摘出した脾臓細胞5×106をゴルジプラグと共に2時間培養してサイトカインを蓄積させた。2時間後に得た脾臓細胞は、BD Cytofix/Cytoperm Plus with Golgiplug kitを用いた細胞内サイトカイン染色に使用した。12時間後に得た脾臓細胞は、iNKT細胞およびNK細胞におけるCD69発現の測定に使用した。iNKT細胞はB220―TCR−βintα−GC/CD1d:Ig+である細胞と指定し、NK細胞はB220―TCR−β―NK1.1highである細胞と指定した。IFN−γ+またはIL−4+iNKT細胞をフローサイトメトリーで分析し、iNKT細胞およびNK細胞におけるCD69発現はフローサイトメトリーで測定した。
血液内IFN−γとIL−4の数値は図6に示し、IFN−γ+またはIL−4+iNKT細胞をFACSによって分析した結果は図7に示し、iNKT細胞およびNK細胞におけるCD69発現は図8に示した。
図6に示すように、対照ラットIgGと一番目のα−GCの投与後、2番目のα−GC投与によるIFN−γおよびIL−4の分泌は著しく減少し、抗PD−1抗体と一番目のα−GCの投与後、2番目のα−GC投与によるIFN−γおよびIL−4の分泌は大きく増加した。
また、図7に示すように、サイトカインの分泌がiNKT細胞で起ることを確認した。
また、図8に示すように、抗PD−1抗体と一番目のα−GCを投与した後、2番目のα−GCを投与した場合、CD69発現がiNKT細胞とNK細胞で同一に増加した。したがって、iNKT細胞のアネルギー誘導におけるPD−1/PD−L1の相互作用が重要な役割を果たすものと思われる。
【実施例4】
【0041】
抗PD−1抗体または抗PD−L1抗体が活性化されたiNKT細胞の抗癌効果に及ぼす影響
抗PD−1抗体または抗PD−L1抗体がB16F10黒色腫癌細胞を用いた肺転移モデルで活性化されたiNKT細胞の抗癌効果に及ぼす影響を調べるために、次の実験を行った。
1.肺の重量測定
皮膚癌細胞(B16F10、ATCC)は10%FBSと1%ペニシリン/ストレプトマイシンを含有したDMEM培地で培養した。C56BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体、または抗PD−L1抗体を腹腔注射し、24時間後に皮膚癌細胞(B16F10)2×105を静脈注射で接種した。その後、0日、4日、8日目に200μgの対照ラットIgG、抗PD−1抗体または抗PD−L1抗体と共に500ngのα−GCを投与した。14日後に肺の重量を測定し、転移された肺と通常の肺との重量差をグラフによって図9に示した。
【0042】
図9に示すように、抗PD−1抗体と共にα−GCを投与した場合、癌細胞が転移された肺の重量が対照ラットIgGと共にα−GCを投与した場合より大きく減少したことを確認した。
【0043】
2.肺結節の数測定
アネルギーが誘導されたiNKT細胞の抗癌効果回復を測定するために、正常C57BL/6マウスに200μgの対照ラットIgG、抗PD−1抗体、または抗PD−L1抗体を腹腔注射し、24時間後に2μgのαGCを投与してアネルギーを誘導した。7日後に皮膚癌細胞(B16F10)5×105を静脈注射した後、0日、4日、8日目に500ngのα−GCを処理してiNKT細胞の抗癌効果を誘導した。14日後に肺を分離した後、癌細胞転移により発生した肺結節の数を数えた(A)。そして、分離した肺を光学顕微鏡によって観察した(B)。その結果は図10に示した。
【0044】
図10に示すように、対照IgGを処理し、α−GCを投与してiNKT細胞のアネルギーを誘導した場合には、アネルギー状態がそのまま維持されて通常の癌転移対照群とほぼ類似した結果を示すことにより、正常な抗癌効果を見せていない。これに対し、抗PD−1抗体および抗PD−L1抗体を処理してα−GCによるアネルギーの誘導を防いだ場合には、B16F10黒色腫癌細胞を用いた肺転移モデルで肺結節の数を著しく減少させてiNKT細胞の抗癌効果を著しく増加させ、優れた癌転移抑制効果を示すことを確認した。よって、iNKT細胞のアネルギー誘導の際に抗PD−1抗体または抗PD−L1抗体を処理してPD−1またはPD−L1の信号伝達を遮断すると、iNKT細胞の抗癌効果を持続させることができることが分かる。
【0045】
次に、本発明の組成物のための製剤例を例示する。
【0046】
製剤例1:散剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
乳糖 1.5g
タルク 0.5g
これらの成分を混合し、気密布に充填して散剤を製造した。
製剤例2:錠剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
ラクトース 7.9g
結晶性セルロース 1.5g
ステアリン酸マグネシウム 0.5g
これらの成分を混合した後、直接打錠法(direct tableting method)によって錠剤を製造した。
製剤例3:カプセル剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
トウモロコシ澱粉 5g
カルボキシセルロース 4.9g
これらの成分を混合して粉末を製造した後、前記粉末を通常のカプセル剤の製造方法に応じて硬質カプセルに充填してカプセル剤を製造した。
製剤例4:注射剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
注射用滅菌蒸留水 適量
pH調節剤 適量
通常の注射剤の製造方法によって1アンプル当り(2mL)前記成分含量で製造した。
製剤例5:液剤の製造
抗PD−1抗体または抗PD−L1抗体 0.1g
異性化糖 10g
マンニトール 5g
精製水 適量
通常の液剤の製造方法によって精製水にそれぞれの成分を加えて溶解させ、レモン香を適量加えた後、前記の成分を混合した。その後、精製水を加えて全体100mLに調節した後、茶色瓶に充填し、滅菌させて液剤を製造した。
【産業上の利用可能性】
【0047】
本発明の抗PD−1抗体または抗PD−L1抗体は、PD−1またはPD−L1の信号伝達を遮断することにより、iNKT細胞リガンドの投与により発生するiNKT細胞のアネルギー誘導を防ぐことができ、既にアネルギー状態にあるiNKT細胞の場合にもサイトカインの分泌能力を回復させてiNKT細胞の反応性を回復させ、B16F10黒色腫癌細胞を用いた肺転移モデルで肺結節の数を著しく減少させてiNKT細胞の抗癌免疫反応を効果的に誘導することができるうえ、優れた癌転移抑制効果を示す。よって、本発明に係る抗PD−1抗体または抗PD−L1抗体を含む抗癌剤は、癌、特に転移性癌の治療に非常に有用に使用することができる。
【特許請求の範囲】
【請求項1】
iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させ、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される、抗癌剤。
【請求項2】
前記iNKT細胞リガンドは、α−ガラクトシルセラミド、α−グルクロノシルセラミド、ホスファチジルイノシトールテトラマンノシド、イソグロボトリヘキソシルセラミド、ガングリオシドGD3、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、スルファチド、β−ガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、α−ガラクトシルセラミドの類似体であるβ−アノマーガラクトシルセラミドおよびα−アノマーガラクトシルセラミド、並びにバクテリア脂質抗原よりなる群から選択されることを特徴とする、請求項1に記載の抗癌剤。
【請求項3】
前記抗PD−1抗体または抗PD−L1抗体は、モノクローナル抗体またはポリクローナル抗体であることを特徴とする、請求項1に記載の抗癌剤。
【請求項4】
前記癌は、肺癌、胃癌、肝癌、骨癌、膵臓癌、皮膚癌、頭頸部癌、皮膚黒色腫、子宮癌、卵巣癌、直腸癌、大腸癌、結腸癌、乳房癌、子宮肉腫、喇叭管癌腫、子宮内膜癌種、子宮頚部癌腫、膣癌腫、外陰部癌腫、食道癌、喉頭癌、小腸癌、甲状腺癌、副甲状腺癌、軟部組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性または急性白血病、幼年期の固型腫瘍、分化リンパ腫、膀胱癌、腎臓癌、腎臓細胞癌腫、腎臓骨盤癌腫、第1中枢神経系リンパ腫、脊髄軸腫瘍、脳幹神経膠腫、および脳下垂体アデノーマよりなる群から選ばれることを特徴とする、請求項1に記載の抗癌剤。
【請求項5】
iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞に抗PD−1抗体または抗PD−L1抗体を処理してiNKT細胞の反応性を回復させる方法。
【請求項6】
前記iNKT細胞リガンドは、α−ガラクトシルセラミド、α−グルクロノシルセラミド、ホスファチジルイノシトールテトラマンノシド、イソグロボトリヘキソシルセラミド、ガングリオシドGD3、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、スルファチド、β−ガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、α−ガラクトシルセラミドの類似体であるβ−アノマーガラクトシルセラミドおよびα−アノマーガラクトシルセラミド、並びにバクテリア脂質抗原よりなる群から選択されることを特徴とする、請求項5に記載の方法。
【請求項7】
前記抗PD−1抗体または抗PD−L1抗体は、モノクローナル抗体またはポリクローナル抗体であることを特徴とする、請求項5に記載の方法。
【請求項1】
iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞の反応性を回復させ、第1抗癌剤としてのiNKT細胞リガンドと第2抗癌剤としての抗PD−1抗体または抗PD−L1抗体から構成される、抗癌剤。
【請求項2】
前記iNKT細胞リガンドは、α−ガラクトシルセラミド、α−グルクロノシルセラミド、ホスファチジルイノシトールテトラマンノシド、イソグロボトリヘキソシルセラミド、ガングリオシドGD3、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、スルファチド、β−ガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、α−ガラクトシルセラミドの類似体であるβ−アノマーガラクトシルセラミドおよびα−アノマーガラクトシルセラミド、並びにバクテリア脂質抗原よりなる群から選択されることを特徴とする、請求項1に記載の抗癌剤。
【請求項3】
前記抗PD−1抗体または抗PD−L1抗体は、モノクローナル抗体またはポリクローナル抗体であることを特徴とする、請求項1に記載の抗癌剤。
【請求項4】
前記癌は、肺癌、胃癌、肝癌、骨癌、膵臓癌、皮膚癌、頭頸部癌、皮膚黒色腫、子宮癌、卵巣癌、直腸癌、大腸癌、結腸癌、乳房癌、子宮肉腫、喇叭管癌腫、子宮内膜癌種、子宮頚部癌腫、膣癌腫、外陰部癌腫、食道癌、喉頭癌、小腸癌、甲状腺癌、副甲状腺癌、軟部組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性または急性白血病、幼年期の固型腫瘍、分化リンパ腫、膀胱癌、腎臓癌、腎臓細胞癌腫、腎臓骨盤癌腫、第1中枢神経系リンパ腫、脊髄軸腫瘍、脳幹神経膠腫、および脳下垂体アデノーマよりなる群から選ばれることを特徴とする、請求項1に記載の抗癌剤。
【請求項5】
iNKT細胞リガンドの投与によりアネルギーが誘導されたiNKT細胞に抗PD−1抗体または抗PD−L1抗体を処理してiNKT細胞の反応性を回復させる方法。
【請求項6】
前記iNKT細胞リガンドは、α−ガラクトシルセラミド、α−グルクロノシルセラミド、ホスファチジルイノシトールテトラマンノシド、イソグロボトリヘキソシルセラミド、ガングリオシドGD3、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、スルファチド、β−ガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、α−ガラクトシルセラミドの類似体であるβ−アノマーガラクトシルセラミドおよびα−アノマーガラクトシルセラミド、並びにバクテリア脂質抗原よりなる群から選択されることを特徴とする、請求項5に記載の方法。
【請求項7】
前記抗PD−1抗体または抗PD−L1抗体は、モノクローナル抗体またはポリクローナル抗体であることを特徴とする、請求項5に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2010−83863(P2010−83863A)
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願番号】特願2009−82501(P2009−82501)
【出願日】平成21年3月30日(2009.3.30)
【出願人】(509089214)エスエヌユー アール アンド ディービー ファウンデーション (1)
【Fターム(参考)】
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願日】平成21年3月30日(2009.3.30)
【出願人】(509089214)エスエヌユー アール アンド ディービー ファウンデーション (1)
【Fターム(参考)】
[ Back to top ]

