抽出分離方法
【課題】抽出剤を用いて高レベル放射性廃液中のアクチノイドと希土類元素を抽出分離する方法であり、従来の抽出剤と比較して、その抽出剤の合成・取り扱いが容易で、従来の抽出剤よりも分離係数が大きい抽出分離方法を提供する。
【解決手段】本発明の第1の抽出分離方法は、抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する方法である。本発明の第2の抽出分離方法は、抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する方法である。
【解決手段】本発明の第1の抽出分離方法は、抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する方法である。本発明の第2の抽出分離方法は、抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高レベル放射性廃液中のアメリシウムを代表とする3価マイナーアクチノイドを効果的に抽出・分離・除去する技術に関するものである。
【背景技術】
【0002】
使用済み核燃料の再処理によってウランとプルトニウムを分離・回収した後のいわゆる高レベル放射性廃液中には様々な放射性元素が含まれている。この中で特に問題となるのは半減期が非常に長いマイナーアクチノイドのアメリシウムなどの超ウラン元素である。これらの選択的除去が可能となれば高レベル放射性廃液の処理問題は大幅に低減される。このため以前より各国において超ウラン元素の分離・除去の研究が長期間にわたり続けられてきた。
【0003】
ここで問題となるのはアメリシウムなどの3価の超ウラン元素と化学的性質が類似した3価の希土類元素の存在である。超ウラン元素をそのまま高レベル放射性廃液から直接分離できることが最も好ましいが、それは非常に困難なので、現在各国ともまず超ウラン元素を希土類元素と共に高レベル放射性廃液から一括して分離し、それから両者の分離を行うという方策を指向している。
【0004】
超ウラン元素と希土類元素とを一括して抽出・分離する抽出剤として、米国では、オクチル(フェニル)−N,N−ジイソブチルカーバモイルメチレンホスフィンオキシド[octyl(phenyl)-N,N-diisobutylcarbamoylmethylene phosphine oxide](CMPO)が開発され、これを用いた分離プロセスであるTRUEX法が開発された。
また、フランスでは、N,N’−ジメチル−N,N’−ジブチルテトラデシルマロンアミド[N,N'-dimethyl -N,N'-dibutyltetradecyl malonamide](DMDBTDMA)のようなジアミド型抽出剤の研究が行われ、これを用いる分離プロセスであるDIAMEX法が開発された。
【0005】
また、わが国においては、日本原子力研究所においてDMDBTDMAを遥かに上回る分離性能を有するN,N,N’,N’−テトラオクチル−3−オキサペンタン−1,5−ジアミン(N,N,N',N'-tetraoctyl-3-oxapentane-1,5-diamide)(TODGA)が開発された(非特許文献1)。これらの抽出剤では超ウラン元素と希土類元素とが3M程度の濃度の硝酸水溶液である高レベル放射性廃液中より一括して抽出・分離され、稀薄濃度の硝酸中に逆抽出される。
【0006】
一方、このような逆抽出液から超ウラン元素を選択的に抽出することにより希土類元素との分離を達成する抽出剤の検索も各国で行われてきた。
中国のZhuらは、ビス(2,4,4’−トリメチルフェニル)ジチオホスフィン酸[bis(2,4,4'-trimethylpentyl)dithiophosphinic acid]であるCyanex301がこのような目的に適していることを見出した(非特許文献2)。ユーロピウムからのアメリシウムの分離係数は6000以上と報告されている。しかし、このCyanex301は、空気により容易に酸化を受け易く、場合によっては1週間程度で酸化されることにより両者の分離機能を失う。
【0007】
ドイツのKolarikらは2, 6−ジ(5,6−ジプロピル−1,2,4−トリアジン−3−イル)−ピリジン[2,6-di(5,6-dipropyl-1,2,4-triazin-3-yl)-pyridine](DPTP)がこのような目的に適した抽出剤であることを見出した(非特許文献3)。しかし、この抽出剤は合成が煩雑で、抽出中に沈殿物を生ずるなどの問題点を抱えている。
【0008】
また、井上勝利らは、ジチオカーバメイトの官能基を有するキトサン誘導体(ジチオカ−バメイト型O,O’−デカノイルキトサン)がユウロピウムからのアメリシウムの分離係数が約1200を示し、分離目的に適した抽出剤であることを見出した(特許文献1)。しかし、この抽出剤の合成は、DPTPより改良されてはいるが、それでもかなりの煩雑さを残している。この他にも、後述するin−situ抽出剤生成抽出や他の抽出剤(例えば、N,N,N’,N”−テトラメチルピリジルエチレンジアミンとジ−2−エチルヘキシル−リン酸とを含む抽出剤等。)などが開発されている(例えば特許文献2参照)。
【非特許文献1】館盛勝一,日本原子力学会誌,42巻,2000年,p.1124−1129
【非特許文献2】「Solvent Extraction Ion Exchange」,14巻,1996年,p.61−68
【非特許文献3】「Solvent Extraction Ion Exchange」,17巻,1999年,p.1155−1170
【特許文献1】特開2003−185792号公報
【特許文献2】特開2004−108837号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、Cyanex301、DPTP、そしてジチオカーバメイト型O,O’−デカノイルキトサン等よりも容易に合成できる抽出剤を使用して、従来の抽出剤以上の分離係数で、マイナーアクチノイドと希土類元素を抽出分離できる抽出分離方法を提供するものである。さらに、in−situ抽出剤生成抽出が可能な抽出分離方法を提供するものである。
【課題を解決するための手段】
【0010】
本発明者は、前記課題を解決すべく鋭意研究を重ねた結果、二つのイオウが配位するジチオカーバメイト官能基を持つ化合物はf軌道電子が結合に関与するか否かを識別する有力な手段であると考えた。3価アクチノイドの5f軌道電子は6sと6p軌道電子の外側に一部はみ出しているが、3価ランタノイドの4f軌道電子は5sと5p軌道電子の内側のみにある。この差が3価アクチノイドと3価希土類元素の化学的の振る舞いに差を生じさせることにより、3価アクチノイドを極めて選択的に抽出できるであろうと考えた。また、特許文献1に記載のジチオカーバメイト型O,O’−デカノイルキトサンは、そのジチオカーバメイト官能基以外の母核が極めて大きいため、金属イオンとの錯形成を抑制し、形成した電荷0を持つ抽出化学種の有機溶媒への移行をも抑制しているものと考えた。これを解決する方法として母核の小さなジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いることとして、本発明を完成するに至った。
【0011】
本発明は、以下の構成を含む。
[1] 抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
[2] 抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
[3] 前記抽出有機溶媒がニトロベンゼンであることを特徴とする[2]記載の抽出分離方法。
[4] 前記水溶液が放射性廃液であることを特徴とする[1]〜[3]のいずれかに記載の抽出分離方法。
[5] 前記マイナーアクチノイドがアメリシウムであり、前記希土類元素がユウロピウムであることを特徴とする[1]〜[4]のいずれかに記載の抽出分離方法。
[6] 前記抽出分離をpH=6〜7の液性下で行うことを特徴とする[1]〜[5]のいずれかに記載の抽出分離方法。
【発明の効果】
【0012】
本発明によれば、高い分離係数で、マイナーアクチノイドと希土類元素とを抽出分離することができる。また、その際に用いる抽出剤は簡単に合成できて、その取り扱いも容易である。したがって、高レベル放射性廃液の処理問題を解決できる。
【発明を実施するための最良の形態】
【0013】
本発明の第1の形態は、抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する方法である。
ここで、マイナーアクチノイドとは、ネプツニウム(Np)、アメリシウム(Am)、キュリウム(Cm)、バークリウム(Bk)、カリホルニウム(Cf)、アインスタイニウム(Es)、フェルミウム(Fm)、メンデレビウム(Md)、ノーベリウム(No)、ローレンシウム(Lr)のことである。ただし、本発明では、マイナーアクチノイドの中でも、水溶液中にて3価が化学的に安定で、しかも長半減期放射性核種を含むアメリシウム、キュリウム、バークリウム及びカリホルニウムが好適である。本発明は、アメリシウム、キュリウム、バークリウム及びカリホルニウムの分離に対してとりわけ効果を発揮するからである。
【0014】
ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)は、例えば、Zhong Yunらの発表(非特許文献4)を参考にして合成することができる。非特許文献4では、0.66Mのジオクチルアミン(DOA)を10mlのメタノールに溶かし、この溶液に0.028Mの二硫化炭素(CS2)を加え、1時間攪拌することにより、ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を合成している。
具体的には、ジオクチルアミン(DOA)をエタノールに溶解し、濃アンモニア水を加え攪拌しながら過剰量(2倍)の二硫化炭素(CS2)をゆっくりと加える。室温で1時間攪拌した後、0.1M塩酸を用いてゆっくりと溶液を中和する。溶液をエバポレートすることでエタノールと残留CS2を除去する。残った褐色の粘性液体を有機溶媒(ヘキサン)に溶解し純水と振り混ぜることで水溶性の不純物(主に溶媒のエタノールとその反応物)を除去する。有機相を無水硫酸マグネシウムで乾燥した後、エバポレートすることで目的の化合物たるジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を得る。これを本発明の第1の形態における抽出剤として使用することができる。
[非特許文献4] 「Chemical Journal on Internet」,13巻,6号,2001年,p.27
【0015】
溶媒抽出は基本的に抽出剤を合成し精製したものを用いるのが一般的である。しかし、Fuzinagaらは、in−situ抽出剤生成抽出というあらたな抽出方法(非特許文献5)を開発している。
[非特許文献5] 「Analytical Sciences」,7巻,1991年,p29−30
非特許文献5に記載の方法は、キレート抽出剤原料の試薬(数種の有機溶媒)を有機溶媒中で混合することによりキレート抽出剤を生じさせ、そのキレート抽出剤が目的の水相中の金属イオンを有機相中に抽出する方法である。特にキレート試薬が高価である場合や不安定の場合には有効な方法である。
本発明の第2の形態は、(DOA+・DODTC−)の合成が比較的簡単であることを利用して、上記in−situ抽出剤生成抽出を適用するものである。すなわち、本発明の第2の形態は、抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する抽出分離方法である。具体的には、抽出有機溶媒に二硫化炭素とジオクチルアミンを加えて、抽出有機溶媒中で(DOA+・DODTC−)を合成し、これを抽出剤として利用する方法である
この場合には、抽出有機溶媒にDOAと、DOAの2倍のモル数のCS2とを加えるのが望ましい。
また、(DOA+・DODTC−)の合成がより簡単で、かつ、マイナーアクチノイドの抽出率がより高くなることから、前記抽出有機溶媒はニトロベンゼンであることが好ましい。
【0016】
本発明の抽出分離方法は、前記水溶液が放射性廃液である場合にとりわけ効果を発揮する。
また、本発明の抽出分離方法は、前記マイナーアクチノイドがアメリシウムであり、前記希土類元素がユウロピウムである場合にとりわけ効果を発揮する。
さらに、本発明の抽出分離方法は、前記抽出分離をpH=6〜7の液性下で行うことが好ましい。本発明の抽出分離方法をpH=6〜7の液性下で行えば、マイナーアクチノイドをより選択的に抽出分離できる。なお、pHが6より小さくても、7より大きくてもマイナーアクチノイドの選択性が低下する傾向にある。
【実施例】
【0017】
以下に本発明の実施例について説明するが、本発明はこれらに限定されるものではない。
[実施例1]
25℃の恒温水槽中で抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、3価ランタノイド、アクチノイドイオンの溶媒抽出を行う。ランタノイド(3価)としては152,154Eu(3価)、マイナーアクチノイド(3価)としては241Am(3価)を用いる。
まず、0.090Mに調整した(DOA+・DODTC−)−ニトロベンゼン溶液(1.00ml)を同量の初期水素イオン濃度に調整した後に1.00Mの(H,Na)NO3水溶液と混合し、トレーサ量の241Am(3価)と152,154Eu(3価)を含む0.10MのHClO4水溶液を1μl加え、25℃の水中で1時間恒温振とうする。ついで、遠心分離した後、各相を同量分取し、各相の放射能をNaI(Tl)固体シンチレーションカウンター(アロカ社製ARC−2000)又は高純度Ge半導体検出器(セイコー・イージーアンドジー社製4MX20P4)を用いて測定する。測定により得られた各相のγ線の放射能量より分配比(D=有機相の放射能/水相の放射能)を算出する。また、水相の分配平衡後のpHをpHメーターにより測定する。
【0018】
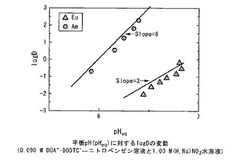
0.090Mの(DOA+・DODTC−)−ニトロベンゼン溶液を用いた時の、1.00Mの(H,Na)NO3水溶液の水素イオン濃度と分配平衡後の水溶液pHの関係を図1に示す。図1によれば、ニトロベンゼン中の(DOA+・DODTC−)濃度と1.00Mの(H,Na)NO3水溶液の初期水素イオン濃度から、分配平衡後の水溶液相のpHは容易に調整でき、その再現性は極めてよいことが判る。
241Am(3価)及び152,154Eu(3価)の抽出分配平衡後のpHと、分配比(D)との関係を図2に示す。 図2によれば、pH=6.5付近で、Euに比べAmが1.0×104倍以上抽出されている。分離係数は、pH=6.5において1.66×104であり、3価マイナーアクチノイド(アメリシウム)の値が3価希土類元素(ユウロピウム)の値と比較して格段に大きなことが判る。また、pHに対するlogDの傾きはEuで3、Amで6であった。EuとAmでpHに対するlogDの傾きが異なる様子は、有機相中の(DOA+・DODTC−)濃度が酸による分解等により変化して、有機相の色の変化することから示唆された。
【0019】
[実施例2]
0.79681gのジオクチルアミン(DOA)と0.25126gの二硫化炭素(CS2)をニトロベンゼンに溶解し、そして混合した後に20.0mlの溶液とする。これはDOAとCS2のそれぞれが0.165Mに相当する。その調整したニトロベンゼン溶液(X)と、初期水素イオン濃度に調整した1.00Mの(H,Na)NO3水溶液、トレーサ量の241Am(3価)または152,154Eu(3価)を含む0.10MのHClO4水溶液1μlを合わせた水溶液(Y)とを、体積比X:Y=1:1で混合し、25℃の恒温水槽中で1時間恒温振とうする。
そして、遠心分離後、各相を同量分取し、各相の放射能をNaI(Tl)固体シンチレーションカウンター又は高純度Ge半導体検出器を用いて測定する。測定により得られた各相のγ線の放射能量より分配比(D)を算出する。また、水相の分配平衡後のpHをpHメーターにより測定する。
(0.165M DOA + 0.165M CS2)−ニトロベンゼン溶液を用いた時の、1.00Mの(H,Na)NO3水溶液の水素イオン濃度と分配平衡後の水溶液pHとの関係を図3に示す。 図3によれば、分配平衡後の水溶液のpHは容易に調整でき、その再現性も極めてよいことが判る。
241Am(3価)及び152,154Eu(3価)の抽出分配平衡後のpHと、分配比(D)との関係を図4に示す。Euに比べAmがより良く抽出されており、分離係数は、pH=6.5において2.28×104である。この値は、抽出剤としてCyanex301(非特許文献2)を用いた場合のユウロピウムからのアメリシウムの分離係数である約6000よりも遥かに大きい。
また、ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)の原料たるジオクチルアミン(DOA)と二硫化炭素(CS2)をニトロベンゼンに溶解してのin−situ抽出剤生成抽出によっても、ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いた時とほぼ同じ分配比を示していることが判る。
(DOA+・DODTC−)による抽出及びin−situ抽出剤生成抽出における平衡pHと、抽出百分率との関係を図5に示す。図5によれば、(DOA+・DODTC−)による抽出と、DOA+CS2を用いるin−situ抽出剤生成抽出はいずれも、同様に3価マイナーアクチノイド(アメリシウム)と3価希土類元素(ユウロピウム)をpH=6.5付近でほぼ完全に分離できることが判る。
なお、分離係数とは、アメリシウムの分配比/ユウロピウムの分配比の比を言う。
【0020】
なお、特許文献1に記載の発明によれば、分離係数は、pH = 3.0で86、pH =3.55で333、pH = 4.0で1227とされており、これら分離係数は、実施例1及び実施例2に比べると一桁以上も小さな値である。また、特許文献2に記載の発明によれば、アメリシウムの分配比が22であるのに対してLa〜Gdの希土類元素の分配比は約0.5以下であり、これも、実施例1及び実施例2に比べると分離係数は約3桁も低い。
【0021】
上述した結果より、ジオクチルアミンジオクチルジチオカーバメイト(DOA+・DODTC−)を用いた溶媒抽出法による抽出分離方法である実施例1、並びに、ジオクチルアミン(DOA)と二硫化炭素(CS2)を抽出有機溶媒に溶解してのin−situ抽出剤生成による抽出分離方法である実施例2によれば、マイナーアクチノイド(アメリシウム)を希土類元素(ユウロピウム)から選択的に抽出・分離するのに非常に有効であることは明らかである。
なお、本発明の抽出分離方法によれば、水素イオン濃度を調整することにより、抽出されたマイナーアクチノイド(アメリシウム)を水溶液に戻すことも容易である。
【図面の簡単な説明】
【0022】
【図1】1.00M (H,Na)NO3水溶液の1.00mlと0.10M HClO4水溶液の1μlからなる水溶液の初期水素イオン濃度([H+]initial)と、それらと0.090M (DOA+・DODTC−)−ニトロベンゼンの1.00mlを25℃の恒温水槽中で1時間恒温振とうした後の水相の平衡pH (pHeq)との関係を示すグラフである。
【図2】0.090M (DOA+・DODTC−)−ニトロベンゼン溶液及び1.00M (H,Na)NO3水溶液における分配平衡後の水相のpHと、Eu(3価)とAm(3価)の分配比(D)の対数値との関係を示すグラフである。
【図3】1.00M (H,Na)NO3水溶液の1.00mlと0.10M HClO4水溶液の1μlからなる水溶液の初期水素イオン濃度([H+]initial)と、それらと(0.165M DOA+0.165M CS2)−ニトロベンゼンの1.00mlを25℃の恒温水槽中で1時間恒温振とうした後の水相の平衡pH (pHeq)との関係を示すグラフである。
【図4】(0.090M (DOA+・DODTC−)−ニトロベンゼン溶液、又は(0.165M DOA+0.165M CS2)−ニトロベンゼン溶液及び1.00M (H,Na)NO3水溶液における分配平衡後の水相のpHと、Eu(3価)とAm(3価)の分配比(D)の対数値(logD)との関係を示すグラフである。
【図5】(DOA+・DODTC−)による抽出及びin−situ抽出剤生成抽出における平衡pHと、Eu(3価)及びAm(3価)の抽出百分率との関係を示すグラフである。
【技術分野】
【0001】
本発明は、高レベル放射性廃液中のアメリシウムを代表とする3価マイナーアクチノイドを効果的に抽出・分離・除去する技術に関するものである。
【背景技術】
【0002】
使用済み核燃料の再処理によってウランとプルトニウムを分離・回収した後のいわゆる高レベル放射性廃液中には様々な放射性元素が含まれている。この中で特に問題となるのは半減期が非常に長いマイナーアクチノイドのアメリシウムなどの超ウラン元素である。これらの選択的除去が可能となれば高レベル放射性廃液の処理問題は大幅に低減される。このため以前より各国において超ウラン元素の分離・除去の研究が長期間にわたり続けられてきた。
【0003】
ここで問題となるのはアメリシウムなどの3価の超ウラン元素と化学的性質が類似した3価の希土類元素の存在である。超ウラン元素をそのまま高レベル放射性廃液から直接分離できることが最も好ましいが、それは非常に困難なので、現在各国ともまず超ウラン元素を希土類元素と共に高レベル放射性廃液から一括して分離し、それから両者の分離を行うという方策を指向している。
【0004】
超ウラン元素と希土類元素とを一括して抽出・分離する抽出剤として、米国では、オクチル(フェニル)−N,N−ジイソブチルカーバモイルメチレンホスフィンオキシド[octyl(phenyl)-N,N-diisobutylcarbamoylmethylene phosphine oxide](CMPO)が開発され、これを用いた分離プロセスであるTRUEX法が開発された。
また、フランスでは、N,N’−ジメチル−N,N’−ジブチルテトラデシルマロンアミド[N,N'-dimethyl -N,N'-dibutyltetradecyl malonamide](DMDBTDMA)のようなジアミド型抽出剤の研究が行われ、これを用いる分離プロセスであるDIAMEX法が開発された。
【0005】
また、わが国においては、日本原子力研究所においてDMDBTDMAを遥かに上回る分離性能を有するN,N,N’,N’−テトラオクチル−3−オキサペンタン−1,5−ジアミン(N,N,N',N'-tetraoctyl-3-oxapentane-1,5-diamide)(TODGA)が開発された(非特許文献1)。これらの抽出剤では超ウラン元素と希土類元素とが3M程度の濃度の硝酸水溶液である高レベル放射性廃液中より一括して抽出・分離され、稀薄濃度の硝酸中に逆抽出される。
【0006】
一方、このような逆抽出液から超ウラン元素を選択的に抽出することにより希土類元素との分離を達成する抽出剤の検索も各国で行われてきた。
中国のZhuらは、ビス(2,4,4’−トリメチルフェニル)ジチオホスフィン酸[bis(2,4,4'-trimethylpentyl)dithiophosphinic acid]であるCyanex301がこのような目的に適していることを見出した(非特許文献2)。ユーロピウムからのアメリシウムの分離係数は6000以上と報告されている。しかし、このCyanex301は、空気により容易に酸化を受け易く、場合によっては1週間程度で酸化されることにより両者の分離機能を失う。
【0007】
ドイツのKolarikらは2, 6−ジ(5,6−ジプロピル−1,2,4−トリアジン−3−イル)−ピリジン[2,6-di(5,6-dipropyl-1,2,4-triazin-3-yl)-pyridine](DPTP)がこのような目的に適した抽出剤であることを見出した(非特許文献3)。しかし、この抽出剤は合成が煩雑で、抽出中に沈殿物を生ずるなどの問題点を抱えている。
【0008】
また、井上勝利らは、ジチオカーバメイトの官能基を有するキトサン誘導体(ジチオカ−バメイト型O,O’−デカノイルキトサン)がユウロピウムからのアメリシウムの分離係数が約1200を示し、分離目的に適した抽出剤であることを見出した(特許文献1)。しかし、この抽出剤の合成は、DPTPより改良されてはいるが、それでもかなりの煩雑さを残している。この他にも、後述するin−situ抽出剤生成抽出や他の抽出剤(例えば、N,N,N’,N”−テトラメチルピリジルエチレンジアミンとジ−2−エチルヘキシル−リン酸とを含む抽出剤等。)などが開発されている(例えば特許文献2参照)。
【非特許文献1】館盛勝一,日本原子力学会誌,42巻,2000年,p.1124−1129
【非特許文献2】「Solvent Extraction Ion Exchange」,14巻,1996年,p.61−68
【非特許文献3】「Solvent Extraction Ion Exchange」,17巻,1999年,p.1155−1170
【特許文献1】特開2003−185792号公報
【特許文献2】特開2004−108837号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、Cyanex301、DPTP、そしてジチオカーバメイト型O,O’−デカノイルキトサン等よりも容易に合成できる抽出剤を使用して、従来の抽出剤以上の分離係数で、マイナーアクチノイドと希土類元素を抽出分離できる抽出分離方法を提供するものである。さらに、in−situ抽出剤生成抽出が可能な抽出分離方法を提供するものである。
【課題を解決するための手段】
【0010】
本発明者は、前記課題を解決すべく鋭意研究を重ねた結果、二つのイオウが配位するジチオカーバメイト官能基を持つ化合物はf軌道電子が結合に関与するか否かを識別する有力な手段であると考えた。3価アクチノイドの5f軌道電子は6sと6p軌道電子の外側に一部はみ出しているが、3価ランタノイドの4f軌道電子は5sと5p軌道電子の内側のみにある。この差が3価アクチノイドと3価希土類元素の化学的の振る舞いに差を生じさせることにより、3価アクチノイドを極めて選択的に抽出できるであろうと考えた。また、特許文献1に記載のジチオカーバメイト型O,O’−デカノイルキトサンは、そのジチオカーバメイト官能基以外の母核が極めて大きいため、金属イオンとの錯形成を抑制し、形成した電荷0を持つ抽出化学種の有機溶媒への移行をも抑制しているものと考えた。これを解決する方法として母核の小さなジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いることとして、本発明を完成するに至った。
【0011】
本発明は、以下の構成を含む。
[1] 抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
[2] 抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
[3] 前記抽出有機溶媒がニトロベンゼンであることを特徴とする[2]記載の抽出分離方法。
[4] 前記水溶液が放射性廃液であることを特徴とする[1]〜[3]のいずれかに記載の抽出分離方法。
[5] 前記マイナーアクチノイドがアメリシウムであり、前記希土類元素がユウロピウムであることを特徴とする[1]〜[4]のいずれかに記載の抽出分離方法。
[6] 前記抽出分離をpH=6〜7の液性下で行うことを特徴とする[1]〜[5]のいずれかに記載の抽出分離方法。
【発明の効果】
【0012】
本発明によれば、高い分離係数で、マイナーアクチノイドと希土類元素とを抽出分離することができる。また、その際に用いる抽出剤は簡単に合成できて、その取り扱いも容易である。したがって、高レベル放射性廃液の処理問題を解決できる。
【発明を実施するための最良の形態】
【0013】
本発明の第1の形態は、抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する方法である。
ここで、マイナーアクチノイドとは、ネプツニウム(Np)、アメリシウム(Am)、キュリウム(Cm)、バークリウム(Bk)、カリホルニウム(Cf)、アインスタイニウム(Es)、フェルミウム(Fm)、メンデレビウム(Md)、ノーベリウム(No)、ローレンシウム(Lr)のことである。ただし、本発明では、マイナーアクチノイドの中でも、水溶液中にて3価が化学的に安定で、しかも長半減期放射性核種を含むアメリシウム、キュリウム、バークリウム及びカリホルニウムが好適である。本発明は、アメリシウム、キュリウム、バークリウム及びカリホルニウムの分離に対してとりわけ効果を発揮するからである。
【0014】
ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)は、例えば、Zhong Yunらの発表(非特許文献4)を参考にして合成することができる。非特許文献4では、0.66Mのジオクチルアミン(DOA)を10mlのメタノールに溶かし、この溶液に0.028Mの二硫化炭素(CS2)を加え、1時間攪拌することにより、ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を合成している。
具体的には、ジオクチルアミン(DOA)をエタノールに溶解し、濃アンモニア水を加え攪拌しながら過剰量(2倍)の二硫化炭素(CS2)をゆっくりと加える。室温で1時間攪拌した後、0.1M塩酸を用いてゆっくりと溶液を中和する。溶液をエバポレートすることでエタノールと残留CS2を除去する。残った褐色の粘性液体を有機溶媒(ヘキサン)に溶解し純水と振り混ぜることで水溶性の不純物(主に溶媒のエタノールとその反応物)を除去する。有機相を無水硫酸マグネシウムで乾燥した後、エバポレートすることで目的の化合物たるジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を得る。これを本発明の第1の形態における抽出剤として使用することができる。
[非特許文献4] 「Chemical Journal on Internet」,13巻,6号,2001年,p.27
【0015】
溶媒抽出は基本的に抽出剤を合成し精製したものを用いるのが一般的である。しかし、Fuzinagaらは、in−situ抽出剤生成抽出というあらたな抽出方法(非特許文献5)を開発している。
[非特許文献5] 「Analytical Sciences」,7巻,1991年,p29−30
非特許文献5に記載の方法は、キレート抽出剤原料の試薬(数種の有機溶媒)を有機溶媒中で混合することによりキレート抽出剤を生じさせ、そのキレート抽出剤が目的の水相中の金属イオンを有機相中に抽出する方法である。特にキレート試薬が高価である場合や不安定の場合には有効な方法である。
本発明の第2の形態は、(DOA+・DODTC−)の合成が比較的簡単であることを利用して、上記in−situ抽出剤生成抽出を適用するものである。すなわち、本発明の第2の形態は、抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離する抽出分離方法である。具体的には、抽出有機溶媒に二硫化炭素とジオクチルアミンを加えて、抽出有機溶媒中で(DOA+・DODTC−)を合成し、これを抽出剤として利用する方法である
この場合には、抽出有機溶媒にDOAと、DOAの2倍のモル数のCS2とを加えるのが望ましい。
また、(DOA+・DODTC−)の合成がより簡単で、かつ、マイナーアクチノイドの抽出率がより高くなることから、前記抽出有機溶媒はニトロベンゼンであることが好ましい。
【0016】
本発明の抽出分離方法は、前記水溶液が放射性廃液である場合にとりわけ効果を発揮する。
また、本発明の抽出分離方法は、前記マイナーアクチノイドがアメリシウムであり、前記希土類元素がユウロピウムである場合にとりわけ効果を発揮する。
さらに、本発明の抽出分離方法は、前記抽出分離をpH=6〜7の液性下で行うことが好ましい。本発明の抽出分離方法をpH=6〜7の液性下で行えば、マイナーアクチノイドをより選択的に抽出分離できる。なお、pHが6より小さくても、7より大きくてもマイナーアクチノイドの選択性が低下する傾向にある。
【実施例】
【0017】
以下に本発明の実施例について説明するが、本発明はこれらに限定されるものではない。
[実施例1]
25℃の恒温水槽中で抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、3価ランタノイド、アクチノイドイオンの溶媒抽出を行う。ランタノイド(3価)としては152,154Eu(3価)、マイナーアクチノイド(3価)としては241Am(3価)を用いる。
まず、0.090Mに調整した(DOA+・DODTC−)−ニトロベンゼン溶液(1.00ml)を同量の初期水素イオン濃度に調整した後に1.00Mの(H,Na)NO3水溶液と混合し、トレーサ量の241Am(3価)と152,154Eu(3価)を含む0.10MのHClO4水溶液を1μl加え、25℃の水中で1時間恒温振とうする。ついで、遠心分離した後、各相を同量分取し、各相の放射能をNaI(Tl)固体シンチレーションカウンター(アロカ社製ARC−2000)又は高純度Ge半導体検出器(セイコー・イージーアンドジー社製4MX20P4)を用いて測定する。測定により得られた各相のγ線の放射能量より分配比(D=有機相の放射能/水相の放射能)を算出する。また、水相の分配平衡後のpHをpHメーターにより測定する。
【0018】
0.090Mの(DOA+・DODTC−)−ニトロベンゼン溶液を用いた時の、1.00Mの(H,Na)NO3水溶液の水素イオン濃度と分配平衡後の水溶液pHの関係を図1に示す。図1によれば、ニトロベンゼン中の(DOA+・DODTC−)濃度と1.00Mの(H,Na)NO3水溶液の初期水素イオン濃度から、分配平衡後の水溶液相のpHは容易に調整でき、その再現性は極めてよいことが判る。
241Am(3価)及び152,154Eu(3価)の抽出分配平衡後のpHと、分配比(D)との関係を図2に示す。 図2によれば、pH=6.5付近で、Euに比べAmが1.0×104倍以上抽出されている。分離係数は、pH=6.5において1.66×104であり、3価マイナーアクチノイド(アメリシウム)の値が3価希土類元素(ユウロピウム)の値と比較して格段に大きなことが判る。また、pHに対するlogDの傾きはEuで3、Amで6であった。EuとAmでpHに対するlogDの傾きが異なる様子は、有機相中の(DOA+・DODTC−)濃度が酸による分解等により変化して、有機相の色の変化することから示唆された。
【0019】
[実施例2]
0.79681gのジオクチルアミン(DOA)と0.25126gの二硫化炭素(CS2)をニトロベンゼンに溶解し、そして混合した後に20.0mlの溶液とする。これはDOAとCS2のそれぞれが0.165Mに相当する。その調整したニトロベンゼン溶液(X)と、初期水素イオン濃度に調整した1.00Mの(H,Na)NO3水溶液、トレーサ量の241Am(3価)または152,154Eu(3価)を含む0.10MのHClO4水溶液1μlを合わせた水溶液(Y)とを、体積比X:Y=1:1で混合し、25℃の恒温水槽中で1時間恒温振とうする。
そして、遠心分離後、各相を同量分取し、各相の放射能をNaI(Tl)固体シンチレーションカウンター又は高純度Ge半導体検出器を用いて測定する。測定により得られた各相のγ線の放射能量より分配比(D)を算出する。また、水相の分配平衡後のpHをpHメーターにより測定する。
(0.165M DOA + 0.165M CS2)−ニトロベンゼン溶液を用いた時の、1.00Mの(H,Na)NO3水溶液の水素イオン濃度と分配平衡後の水溶液pHとの関係を図3に示す。 図3によれば、分配平衡後の水溶液のpHは容易に調整でき、その再現性も極めてよいことが判る。
241Am(3価)及び152,154Eu(3価)の抽出分配平衡後のpHと、分配比(D)との関係を図4に示す。Euに比べAmがより良く抽出されており、分離係数は、pH=6.5において2.28×104である。この値は、抽出剤としてCyanex301(非特許文献2)を用いた場合のユウロピウムからのアメリシウムの分離係数である約6000よりも遥かに大きい。
また、ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)の原料たるジオクチルアミン(DOA)と二硫化炭素(CS2)をニトロベンゼンに溶解してのin−situ抽出剤生成抽出によっても、ジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いた時とほぼ同じ分配比を示していることが判る。
(DOA+・DODTC−)による抽出及びin−situ抽出剤生成抽出における平衡pHと、抽出百分率との関係を図5に示す。図5によれば、(DOA+・DODTC−)による抽出と、DOA+CS2を用いるin−situ抽出剤生成抽出はいずれも、同様に3価マイナーアクチノイド(アメリシウム)と3価希土類元素(ユウロピウム)をpH=6.5付近でほぼ完全に分離できることが判る。
なお、分離係数とは、アメリシウムの分配比/ユウロピウムの分配比の比を言う。
【0020】
なお、特許文献1に記載の発明によれば、分離係数は、pH = 3.0で86、pH =3.55で333、pH = 4.0で1227とされており、これら分離係数は、実施例1及び実施例2に比べると一桁以上も小さな値である。また、特許文献2に記載の発明によれば、アメリシウムの分配比が22であるのに対してLa〜Gdの希土類元素の分配比は約0.5以下であり、これも、実施例1及び実施例2に比べると分離係数は約3桁も低い。
【0021】
上述した結果より、ジオクチルアミンジオクチルジチオカーバメイト(DOA+・DODTC−)を用いた溶媒抽出法による抽出分離方法である実施例1、並びに、ジオクチルアミン(DOA)と二硫化炭素(CS2)を抽出有機溶媒に溶解してのin−situ抽出剤生成による抽出分離方法である実施例2によれば、マイナーアクチノイド(アメリシウム)を希土類元素(ユウロピウム)から選択的に抽出・分離するのに非常に有効であることは明らかである。
なお、本発明の抽出分離方法によれば、水素イオン濃度を調整することにより、抽出されたマイナーアクチノイド(アメリシウム)を水溶液に戻すことも容易である。
【図面の簡単な説明】
【0022】
【図1】1.00M (H,Na)NO3水溶液の1.00mlと0.10M HClO4水溶液の1μlからなる水溶液の初期水素イオン濃度([H+]initial)と、それらと0.090M (DOA+・DODTC−)−ニトロベンゼンの1.00mlを25℃の恒温水槽中で1時間恒温振とうした後の水相の平衡pH (pHeq)との関係を示すグラフである。
【図2】0.090M (DOA+・DODTC−)−ニトロベンゼン溶液及び1.00M (H,Na)NO3水溶液における分配平衡後の水相のpHと、Eu(3価)とAm(3価)の分配比(D)の対数値との関係を示すグラフである。
【図3】1.00M (H,Na)NO3水溶液の1.00mlと0.10M HClO4水溶液の1μlからなる水溶液の初期水素イオン濃度([H+]initial)と、それらと(0.165M DOA+0.165M CS2)−ニトロベンゼンの1.00mlを25℃の恒温水槽中で1時間恒温振とうした後の水相の平衡pH (pHeq)との関係を示すグラフである。
【図4】(0.090M (DOA+・DODTC−)−ニトロベンゼン溶液、又は(0.165M DOA+0.165M CS2)−ニトロベンゼン溶液及び1.00M (H,Na)NO3水溶液における分配平衡後の水相のpHと、Eu(3価)とAm(3価)の分配比(D)の対数値(logD)との関係を示すグラフである。
【図5】(DOA+・DODTC−)による抽出及びin−situ抽出剤生成抽出における平衡pHと、Eu(3価)及びAm(3価)の抽出百分率との関係を示すグラフである。
【特許請求の範囲】
【請求項1】
抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
【請求項2】
抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
【請求項3】
前記抽出有機溶媒がニトロベンゼンであることを特徴とする請求項2記載の抽出分離方法。
【請求項4】
前記水溶液が放射性廃液であることを特徴とする請求項1〜3のいずれかに記載の抽出分離方法。
【請求項5】
前記マイナーアクチノイドがアメリシウムであり、前記希土類元素がユウロピウムであることを特徴とする請求項1〜4のいずれかに記載の抽出分離方法。
【請求項6】
前記抽出分離をpH=6〜7の液性下で行うことを特徴とする請求項1〜5のいずれかに記載の抽出分離方法。
【請求項1】
抽出剤としてジオクチルアンモニウムジオクチルジチオカーバメイト(DOA+・DODTC−)を用いて、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
【請求項2】
抽出有機溶媒、二硫化炭素(CS2)、及びジオクチルアミン(DOA)を用いたin−situ抽出剤生成抽出により、マイナーアクチノイドと希土類元素とが共存する水溶液中からマイナーアクチノイドを選択的に抽出分離することを特徴とする抽出分離方法。
【請求項3】
前記抽出有機溶媒がニトロベンゼンであることを特徴とする請求項2記載の抽出分離方法。
【請求項4】
前記水溶液が放射性廃液であることを特徴とする請求項1〜3のいずれかに記載の抽出分離方法。
【請求項5】
前記マイナーアクチノイドがアメリシウムであり、前記希土類元素がユウロピウムであることを特徴とする請求項1〜4のいずれかに記載の抽出分離方法。
【請求項6】
前記抽出分離をpH=6〜7の液性下で行うことを特徴とする請求項1〜5のいずれかに記載の抽出分離方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2007−114195(P2007−114195A)
【公開日】平成19年5月10日(2007.5.10)
【国際特許分類】
【出願番号】特願2006−257218(P2006−257218)
【出願日】平成18年9月22日(2006.9.22)
【出願人】(304023318)国立大学法人静岡大学 (416)
【Fターム(参考)】
【公開日】平成19年5月10日(2007.5.10)
【国際特許分類】
【出願日】平成18年9月22日(2006.9.22)
【出願人】(304023318)国立大学法人静岡大学 (416)
【Fターム(参考)】
[ Back to top ]

