持続放出コーティングまたはマトリックスおよびNMDA受容体アンタゴニストを含む組成物、そのようなNMDAアンタゴニストの被験体への投与方法
【課題】望ましくない副作用を回避しつつ、疾患の症状または損傷効果を処置するために十分に多い量のNMDArアンタゴニストを被験体に送達の方法および組成物を提供。
【解決手段】NMDArアンタゴニスト、およびポリマーマトリックス、ヒドロキシプロピルメチルセルロースおよびポリマーコーティングを用いてコーティングされたなどの持続放出マトリックス、または持続放出ビーズマトリックスなどの持続放出構成要素を含有する組成物。
【解決手段】NMDArアンタゴニスト、およびポリマーマトリックス、ヒドロキシプロピルメチルセルロースおよびポリマーコーティングを用いてコーティングされたなどの持続放出マトリックス、または持続放出ビーズマトリックスなどの持続放出構成要素を含有する組成物。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、N-メチル-D-アスパラギン酸受容体(NMDAr)アンタゴニストを含有する組成物およびそのような組成物を用いるための方法に関する。
【背景技術】
【0002】
発明の背景
急性および慢性神経学的および神経精神病学的疾患は、世界中の死亡、身体障害、および経済的支出の主な原因に含まれる。これらの障害を処置する際の主な難問の1つは、正常および異常な神経機能の両方を制御する経路の間に高い度合いの相互作用があることである。
【0003】
N-メチル-D-アスパラギン酸(NMDA)受容体を含む、興奮性アミノ酸受容体は、脳における興奮性シナプス伝達(すなわちニューロンの刺激)の重要な仲介因子であり、正常および異常な中枢神経系(CNS)機能の両方の広範囲の局面に関与する。NMDA受容体およびこれに会合するカルシウム(Ca2+)透過性イオンチャネルは、脳および脊髄における一般的な興奮性神経伝達物質であるグルタミン酸、および共アゴニスト、グリシンによって活性化される。NMDA受容体(NMDAr)活性およびその結果のCa2+流入は、長期増強(学習および記憶に相互関連があるもの)に必要である。
【0004】
異常なグルタミン酸受容体活性が、多数のCNS関連状態に関連付けられてきており、これには例えば、抑うつおよび他の神経精神病学的状態、パーキンソン病、癲癇、疼痛、ALS(筋萎縮性側索硬化症またはルー・ゲーリック病)、およびハンチントン病が含まれる。このような状態において、上昇したレベルのグルタミン酸から生じるNMDA受容体の異常な活性化は、この受容体のイオンチャネルの持続した活性を導き(しばしば数ミリ秒ではなく数分間続く)、それによってCa2+の増加を可能にし得る。これは、患者に対して、症候性および神経破壊的効果の両方を引き起こす。
【0005】
メマンチンおよびアマンタジンなどの特定のNMDArアンタゴニストは、血液脳関門を容易に横断し、脳組織周囲の細胞外液および全身血清において、類似の濃度を達成する。理想的には、NMDArアンタゴニストは、衰弱させる副作用の非存在下で、疾患の症状または損傷効果を減少させるのに十分な濃度で存在すべきである。しかし、現在の剤形では、これらの薬剤は、比較的長い半減期を有するにもかかわらず、頻繁に投与する必要があり、かつ治療剤への最初の曝露に関連する副作用を回避するため、治療開始時に用量漸増を必要とする。これは、適切な患者コンプライアンスを達成する際の困難につながり、これは神経学的または神経精神障害に使用する治療様式の複雑な投薬スケジュールによってさらに増悪する。
【0006】
したがって、神経学的障害の進行を処置しかつ遅延させるには、よりよい方法および組成物が必要である。
【発明の概要】
【0007】
発明の概要
一般的に、本発明は、望ましくない副作用、特にCNS副作用を回避しつつ、根底にある疾患の症状または損傷効果を処置するために十分に多い量のNMDArアンタゴニストを被験体に送達するために投与される、薬学的組成物を提供する。これらの組成物を使用して、現在使用されているより低い頻度で(すなわち1日2回(b.i.d.)または1日3回(t.i.d.)に対して、1日1回(q.d.))、NMDArアンタゴニストを投与することも可能であり、患者のコンプライアンスおよび介護人の便宜が改善される。これらの組成物は、治療開始から治療的に有効な量でNMDArアンタゴニストを提供して、患者のコンプライアンスおよび順守をさらに改善し、かつより短い期間で、NMDArアンタゴニストの治療的に有効な定常状態濃度を達成可能であるため、特に有用である。この結果、有効性がより早期に示され、かつ時間が最も重要である疾患および状態に関して、これらの治療剤の有用性が増加する。さらに、本発明の組成物は、その設計のため、より高い用量のNMDArアンタゴニストが安全に投与されることを可能にし、やはり多様な徴候に対するこれらの作用剤(agent)の有用性を増加させる。このような組成物を作製し、投薬し、かつ用いるための方法も提供する。
【0008】
NMDArアンタゴニストは、望ましくは、望ましくない副作用を減少させつつ、NMDArアンタゴニストの治療的利点を最大限にするため、即時放出構成要素を伴うまたは伴わない、制御放出(controlled release)または延長放出(extended release)型で提供される。修正放出(modified release)構成要素(本明細書において、制御、延長または遅延放出構成要素と称される)の非存在下では、NMDArアンタゴニストは、数分から数時間の期間に渡って放出され、かつ体液内に輸送される。好ましい態様において、本発明の組成物は、NMDArアンタゴニスト、およびコーティングされた持続放出(sustained release)マトリックス、持続放出マトリックス、または持続放出ビーズマトリックスなどの持続放出構成要素を含有する。1つの例において、ポリマーマトリックス(例えばEudragit)、ヒドロキシプロピルメチルセルロース(HPMC)およびポリマーコーティング(例えばEudragit)を用いて、即時放出構成要素を伴わずに、メマンチン(例えば5〜80mg)を処方する。このような製剤を圧縮して固形錠剤または顆粒にして、かつOpadry(登録商標)またはSurelease(登録商標)などの制御放出物質でコーティングする。
【0009】
NMDArアンタゴニスト
NMDArアンタゴニストは、メマンチン(1-アミノ-3,5-ジメチルアダマンタン)、リマンタジン(1-(1-アミノエチル)アダマンタン)、またはアマンタジン(1-アミノ-アダマンタン)ならびに以下に記載する他のものなどのアミノアダマンチン誘導体であってもよい。
【0010】
賦形剤
製剤を産生するために用いられる賦形剤には、増量剤、潤滑剤、流動促進剤、および放出制御剤が含まれてもよい。多くのこのような物質は、"Remington: The Science and Practice of Pharmacy, Twentieth Edition," Lippincott Williams & Wilkins, Philadelphia, PAに見出され、かつ当業者に一般的に公知である。用いられる特定の賦形剤は、標的投薬頻度、薬剤放出および吸収の傾き、ならびに投与経路を含む、投与量の投与に関する要件によって決定されるであろう。1つの態様において、製剤はカゼイン塩を含有しない。
【0011】
剤形
NMDArアンタゴニストを、懸濁物、カプセル、錠剤、座薬、ローション、パッチ、またはデバイス(例えば皮下移植可能送達デバイスまたは吸入ポンプ)として処方してもよい。好ましい態様において、剤形は、例えばカプセルとして、経口投与用に提供される。
【0012】
放出プロフィール
本明細書記載の組成物は、NMDArアンタゴニストが、即時放出(IR)製剤のものよりも遅いインビトロ溶解プロフィールを有するように処方される。本明細書において用いられる場合、メマンチンの即時放出(IR)製剤は、現在市販されている5mgおよび10mg錠剤(すなわちForest Laboratories, Inc.のナメンダ(Namenda)、またはナメンダと実質的に同じ放出プロフィールを有する製剤)を意味し;かつアマンタジンの即時放出(IR)製剤は、現在市販されている100mg錠剤(すなわちEndo Pharmaceuticals, Inc.のシンメトレル、またはシンメトレルと実質的に同じ放出プロフィールを有する製剤)を意味する。これらの組成物は、即時放出、持続もしくは延長放出、遅延放出構成要素、またはその組み合わせを含有することも可能である。したがって、本発明の組成物は、放出されるNMDArアンタゴニストの画分が、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-10.9*t)未満であるように処方されてもよく、式中、tは時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。したがって、放出されるNMDArアンタゴニストの画分は、中性pH(例えば水または緩衝水溶液)または酸性(例えば0.1N HCl)溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いると、15分間で93%未満、かつ12時間で7.7%〜100%である。任意で、放出されるNMDArアンタゴニストの画分は、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-0.972*t)未満であるかまたはそれと等しくてもよく、式中、tは時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。任意で、放出されるNMDArアンタゴニストの画分は、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(-2.75 + 2.75*e(0.21*t))より大きいかまたはそれと等しく、かつl-e(-0.40*t)未満であるかまたはそれと等しくてもよく、式中、tは時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。したがって、放出されるNMDArアンタゴニストの画分は、中性pH(例えば水または緩衝水溶液)または酸性(例えば0.1N HCl)溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いると、1時間で0.1%〜62%、2時間で0.2%〜86%、6時間で0.6%〜100%、10時間で2.9%〜100%、かつ12時間で7.7%〜100%の間の範囲であることも可能である。任意で、放出されるNMDArアンタゴニストの画分は、中性pH(例えば水または緩衝水溶液)または酸性(例えば0.1N HCl)溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いると、1時間で0.6%〜33%、2時間で1.4%〜55%、6時間で6.9%〜91%、10時間で19.7%〜98%、かつ12時間で31%〜100%の間の範囲であってもよい。任意で、NMDA受容体アンタゴニストは、中性のpHを有する溶解媒質中、酸性(例えば0.1N HCl)溶解媒質中で測定した場合に、1時間で0.1%〜20%、2時間で5%〜30%、6時間で40%〜80%の間の範囲の、10時間で70%またはそれを超える(例えば70%〜90%)、かつ12時間で90%またはそれを超える(例えば90〜95%)放出プロフィールを有してもよい。例えば、メマンチンを含有する製剤は、中性pH(例えば水または緩衝水溶液)を有する溶解媒質中または酸性(例えば0.1N HCl)溶解媒質中、1時間で0〜60%または0.1〜20%、2時間で0〜86%または5〜30%、6時間で0.6〜100%または40〜80%、10時間で3〜100%または50%もしくはそれを超える(例えば50%〜90%)、かつ12時間で7.7〜100%の間の範囲の放出プロフィールを有してもよい。
【0013】
1つの態様において、NMDArアンタゴニストは、水中、37±0.5℃の温度で、50rpmのUSP II型(パドル)溶解システムを用いて得られるように、15分間で、25%、15%、10%、または5%未満;30分間で、50%、30%、25%、20%、15%、または10%未満、かつ16時間で、60%、65%、70%、75%、80%、85%、90%、95%より高いインビトロ溶解プロフィールを有する。望ましくは、NMDArアンタゴニストは、10時間で、1.2のpHを有する溶解媒質中、少なくとも65%、70%、75%、80%、85%、90%、または95%の溶解を有する。
【0014】
望ましくは、本明細書記載の組成物は、図2A〜2Cに示す溶解プロフィールと実質的に同一のインビトロプロフィールを有し、かつ実質的に一定の1日用量で被験体に投与された際、図2Dに示すものと実質的に同一の血清濃度プロフィールを達成する。
【0015】
インビボでの放出の初期速度
本明細書において用いられる場合、「C」は、患者試料(例えば血液、血清、および脳脊髄液)などの生物学的試料において、活性薬学的成分の濃度を指す。生物学的試料中の薬剤の濃度は、当技術分野において公知である、任意の標準的アッセイ法によって決定され得る。用語「Cmax」は、生物学的試料中の薬剤の所与の用量によって到達する最大濃度を指す。用語「Cmean」は、長期に渡る、試料中の薬剤の平均濃度を指す。CmaxおよびCmeanは、薬剤の投与に比較して特定の期間を指すようさらに定義されてもよい。特定の患者試料種において、最大濃度(「Cmax」)に到達するために必要な時間は、「Tmax」と称される。濃度の変化は、「dC」と称され、かつ規定した時間に渡る変化は「dC/dT」である。
【0016】
望ましくは、NMDArアンタゴニストは、0から即時放出(IR)製剤のTmaxの期間内の定義された期間に渡って、dC/dTとして測定される生物学的試料中の変化の速度およびdC/dT速度が、IR製剤(例えばメマンチンの市販されているIR製剤、ナメンダ)の速度の約80%、70%、60%、50%、40%、30%、20%、または10%未満であるように、同量のアンタゴニストのIR製剤に関して観察されるものより遅い速度で、被験体試料内に放出される。いくつかの態様において、dC/dT速度は、IR製剤の速度の約80%、70%、60%、50%、40%、30%、20%、または10%未満である。同様に、溶解研究において測定されるような、本発明由来のNMDArアンタゴニストの放出速度は、最初の1、2、4、6、8、10、または12時間に渡って、同じNMDArアンタゴニストのIR製剤の速度の80%、70%、60%、50%、40%、30%、20%、または10%未満である。
【0017】
好ましい態様において、非用量漸増の1日あたり2回または1日あたり1回型で、剤形を提供する。このような場合、時間の関数としての濃度の変化(dC/dT)が改変されるように、濃度の傾斜(またはTmax効果)を減少させて、薬剤の用量漸増の必要性を減少させるかまたは排除してもよい。dC/dTの減少は、例えば、比較的比例する方式で、Tmaxを増加させることによって、達成可能である。したがって、Tmax値の2倍増加は、ほぼ2の係数でdC/dTを減少させ得る。したがって、Tmaxの関連する遅延を伴い、即時放出(いわゆるIR)剤形よりも有意に減少した速度で放出されるように、NMDArアンタゴニストを提供することも可能である。24時間、16時間、8時間、4時間、2時間、または少なくとも1時間までのTmaxのシフトを提供するように、薬学的組成物を処方することも可能である。dC/dTの関連する減少は、ほぼ0.05、0.10、0.25、0.5または少なくとも0.8の係数によってもよい。特定の態様において、これは、NMDArアンタゴニストの30%、50%、75%、90%、または95%未満が、こうした投与の1時間以内に、循環系または神経系内に放出されることによって、達成される。
【0018】
任意で、修正放出製剤は、同じNMDArアンタゴニストの同じ投与量のIR製剤のものの75%、50%、40%、30%、20%または10%未満の初期(例えば投与2時間後〜投与4時間後)の傾きを有する血漿濃度曲線を示してもよい。所与の個体の正確な傾きは、用いるNMDArアンタゴニスト、送達する量、またはいくつかの活性薬学的作用剤、患者が食事をしたかもしくはしていないかを含む他の要因にしたがって、多様であろう。他の用量、例えば上述のものに関しては、傾きは、用量に直接関連して多様である。
【0019】
本明細書記載の持続放出製剤または投与法を用いて、NMDArアンタゴニストは、投与の最初の3日、5日、7日、9日、10日、12日、15日、または20日経過以内に、被験体において、治療的に有効な定常状態血漿濃度に到達する。例えば、本明細書記載の製剤は、実質的に一定の1日用量(例えば1日あたり、15mg〜80mgの間、好ましくは20mg〜65mg、かつより好ましくは20mg〜45mgの間の用量)で投与された際、用量漸増療法を用いた場合にこうした血漿濃度に到達するのに必要な時間のおよそ70%、60%、50%、40%、30%、またはそれ未満で、定常状態血漿濃度に到達し得る。
【0020】
Cmax減少、Tmax延長
本発明の好ましい態様において、NMDArアンタゴニストの少なくとも75%、90%、95%、97%、98%、99%または100%さえ、修正または延長放出剤形で提供され、かつこの組成物の被験体(例えばヒトなどの哺乳動物)への投与の際、NMDArアンタゴニストは、こうした投与のおよそ1、1.5、2時間後〜少なくとも6、9、12、18、21、24時間後に、およそ2.5、2、1.5、または1.0のCmax/Cmeanを有する。望ましい場合、NMDArアンタゴニストの放出は、単相または多相(例えば二相)であってもよい。望ましくは、NMDArアンタゴニストの99%、98%、95%、90%、85%、80%、70%、50%、または30%が、こうした投与の1時間以内では、延長放出剤形中に残っている。
【0021】
投薬頻度減少
本発明の組成物および方法はまた、投薬頻度の減少も可能にする。例えば、IR型で投薬した際に、通常、1日あたり2〜4回投与されるNMDArアンタゴニストを、本明細書記載の製剤を用いた場合は、被験体に1日あたり1回または2回提供することも可能である。いくつかの態様において、本明細書記載の組成物は、さらにより頻繁でなく、例えば2日おき、3日おき、毎週、または毎月投与される。
【0022】
非用量漸増
NMDArアンタゴニストの即時放出(IR)製剤は、典型的には、しばしば作用剤の治療量以下から開始して、用量漸増様式で投与される。薬学的組成物に関して、投薬制御または個別化は、医師によって管理され得るが、本明細書記載の組成物は、治療開始から、本質的に一定の治療的有効用量で投与可能であり、それによって、患者および介護人のコンプライアンス、順守、および便宜が改善される。
【0023】
さらに、本明細書記載の組成物は、同じ作用剤のIR製剤に関して観察されるものと同等かまたはそれより少ない副作用で、より高い用量のNMDArアンタゴニストの使用を可能にし、本明細書記載の徴候に対するNMDArアンタゴニストの有用性を増加させる。
【0024】
治療濃度および効果までの時間の減少
治療開始から、治療的有効用量の本明細書記載の組成物を投与することによって、より短い期間(例えば用量漸増療法のものより20%、30%、50%、70%、90%少ない期間)で作用剤の定常状態レベルへの到達が可能になり、したがって、抑うつ、激越、双極性障害、および薬剤依存、退薬、または耐容性を含む、疼痛および神経精神障害などのより急性の障害の処置が可能になる。
【0025】
処置を受け入れられる状態
本発明の組成物を使用して、NMDA受容体活性の脱制御と関連する症状、またはこうした活性の減少から利益を得るであろう状態を処置するかまたは減少させることも可能である。さらに、多くのNMDArアンタゴニストは、他の公知の活性(例えばアマンタジンのドーパミン作用活性、リマンタジンの抗ウイルス活性)を有する。本発明の組成物はまた、このような状態を有するかまたは有するリスクがある任意の被験体において、こうした活性と関連する状態を処置するか、予防するか、または減少させるためにも有用である。例示的な状態には、発作性障害、疼痛症候群、神経変性疾患(運動ニューロン病、ミエロパシー、神経根障害、および交感神経系の障害を含む)、痴呆、脳血管性の病態、運動障害、脳外傷(brain trauma)、脳神経障害、神経精神障害、および他疾患ニューロパシー(ウイルス関連ニューロパシー、糖尿病関連ニューロパシー、ギラン・バレー症候群、タンパク質異常血症、トランスサイレチン誘導性ニューロパシー、および手根管症候群を含む)が含まれる。
【0026】
投与の別経路
1つの態様において、本明細書記載の組成物を、NMDArアンタゴニストの経口投与用の錠剤もしくはカプセルとして、または経皮送達用のパッチとして処方する。または、これらの投与経路のために、組成物を別の方式で(例えば経口投与用の懸濁物として)調製してもよいし、または特に、他の投与経路、静脈内、局所、鼻内、局所下、経上皮、皮下、もしくは吸入送達用に調製してもよい。
【0027】
別に定義しない限り、本明細書に用いるすべての技術的および科学的用語は、本発明が属する技術分野の一般的な当業者に一般的に理解されるのと同じ意味を有する。本発明の実施または試験において、本明細書記載のものと類似かまたは同等の方法および材料を用いてもよいが、適切な方法および材料を以下に記載する。本明細書に言及するすべての刊行物、特許出願、特許、および他の参考文献は、その全体が参照により本明細書に組み入れられる。不一致の場合は、定義を含めた本明細書によって統制される。さらに、材料、方法、および例は、例示のみであり、かつ限定するとは意図されない。すべての割合およびパーセントは、別に明記しない限り重量による。
【0028】
本発明の他の特徴および利点は、以下の詳細な説明および特許請求の範囲から明らかであろう。
【0029】
発明の詳細な説明
一般的に、本発明は、治療的に有効であるために十分に高いが、NMDArアンタゴニストに関連する有害事象を回避するために十分に低い速度で、所望の期間に渡って、血清または血漿濃度を提供するため、延長または修正放出のために処方されたNMDArアンタゴニストを含有する薬学的組成物を特徴とする。薬剤放出の制御は、薬剤の生物学的利用能の度合いを維持しつつ、ピーク血漿レベルを減少させかつ遅延させるために、特に望ましい。したがって、即時放出製剤と通常関連する衰弱させる副作用を最小限にしつつ、治療レベルが達成される。さらに、ピーク血清または血漿レベルを得る時間が遅延され、かつ治療的有効血清または血漿レベルにある期間が延長される結果として、投与頻度が、例えば、1日1回または2回の投与量に減少し、それによって患者のコンプライアンスおよび順守が改善される。例えば、Tmaxをより長い時間にシフトさせ、それによって薬剤のdC/dTを減少させる、制御放出法の使用を通じて、NMDArアンタゴニストの投与と関連する精神病および認知障害を含む副作用の重症度および頻度を減少させ得る。薬剤のdC/dTを減少させると、Tmaxが増加するだけでなく、Tmaxでの薬剤濃度が減少し、かつCmax/Cmean比が減少して、所与の期間に渡って、処置されている被験体に、薬剤がより安定した量で提供され、適切な徴候に対する投与量の増加が可能になる。
【0030】
NMDArアンタゴニスト制御放出製剤の作製
被験体への投与に際して、規定の期間に渡り、標的とされる速度でNMDArアンタゴニストが放出されるようにする、1つまたは複数のさらなる成分と、所望の単数または複数のNMDArアンタゴニストを組み合わせることによって、本発明記載の薬学的組成物を調製する。放出プロフィール、すなわち所望の時間に渡るNMDArアンタゴニストの放出の度合いは、制御された条件下で、USP溶解装置を用いて、放出を測定することによって、所与の時間に関して、好適に決定可能である。好ましい放出プロフィールは、中性液中で、NMDArアンタゴニストの取り込み速度を遅延させる一方、治療的に有効なレベルのNMDArアンタゴニストを提供するものである。一般の当業者は、NMDArアンタゴニストおよび以下に記載する処方法を用いて、所望の放出プロフィールを持つ組み合わせを調製可能である。
【0031】
NMDArアンタゴニスト
本発明の方法および組成物において、任意のNMDArアンタゴニストが使用可能であり、特に本発明の組成物中で使用した際に非毒性であるものが使用可能である。用語「非毒性」は、相対的な意味で用いられ、かつヒトに対する投与に関して、米国食品医薬品局(「FDA」)によって認可されているか、または確立された規制基準および実施を順守して、ヒトもしくは動物への投与に関して、FDAもしくは任意の国の類似の監督官庁による認可を受け入れる余地がある、任意の物質を指すよう意図される。
【0032】
用語「NMDArアンタゴニスト」には、本明細書で用いられる場合、任意のアミノ−アダマンタン化合物が含まれ、これには例えば、メマンチン(1-アミノ-3,5-ジメチルアダマンタン)、リマンタジン(1-(1-アミノエチル)アダマンタン)、アマンタジン(1-アミノ-アダマンタン)、ならびにその薬学的に許容される塩が含まれる。メマンチンは、例えば、米国特許第3,391,142号、第5,891,885号、第5,919,826号、および第6,187,338号に記載される。アマンタジンは、例えば、米国特許第3,152,180号、第5,891,885号、第5,919,826号、および第6,187,338号に記載される。さらなるアミノアダマンタン化合物は、例えば、米国特許第4,346,112号、第5,061,703号、第5,334,618号、第6,444,702号、第6,620,845号、および第6,662,845号に記載される。これらの特許はすべて、参照により本明細書に組み入れられる。
【0033】
使用可能なさらなるNMDArアンタゴニストには、例えば、アミノシクロヘキサン(すなわちネラメキサン)、ケタミン、エリプロディル、イフェンプロディル、ジゾシルピン、レマセミド、イアモトリジン、リルゾール、アプチガネル、フェンシクリジン、フルピルチン、セルフォテル、フェルバメート、スペルミン、スペルミジン、レベモパミル、デキストロメトルファン((+)-3-ヒドロキシ-N-メチルモルフィナン)およびその代謝産物、デキストロルファン((+)-3-ヒドロキシ-N-メチルモルフィナン)、その薬学的に許容される塩、誘導体もしくはエステル、または前述のいずれかの代謝前駆体が含まれる。
【0034】
任意で、本発明のNMDArアンタゴニストはメマンチンであって、かつアマンタジンまたはデキストロメトルファンではなくてもよい。
【0035】
投薬、PK、およびTox
薬学的組成物を処方して、1〜200mg/日、1〜80mg/日、2〜80mg/日、5〜80mg/日、5〜65mg/日、5〜40mg/日、15〜45mg/日、または10〜20mg/日の間の範囲の量のメマンチン;15〜900mg/日、15〜800mg/日、15〜700mg/日、15〜600mg/日、15〜500mg/日、25〜500mg/日、15〜400mg/日、25〜300mg/日、100〜300mg/日、または100〜200mg/日の間の範囲の量のアマンタジン;1〜5000mg/日、1〜1000mg/日、および100〜800mg/日、または200〜500mg/日の間の範囲の量のデキストロメトルファンを提供してもよい。小児科用量は、典型的には、成人に関して決定されるものより低いであろう。
【0036】
表1は、メマンチン、アマンタジン、およびリマンタジンの例示的な薬物動態学的特性(例えばTmaxおよびT1/2)を示す。
【0037】
(表1)選択されるNMDArアンタゴニストに関するヒトにおける薬物動態およびTox

【0038】
賦形剤
「薬学的にまたは薬理学的に許容される」には、必要に応じて、動物、またはヒトに投与された際、不都合な、アレルギー性のまたは他の有害な反応を生じない、分子実体および組成物が含まれる。「薬学的に許容されるキャリアー」には、あらゆる溶媒、分散媒質、コーティング、抗細菌および抗真菌剤、等張性および吸収遅延剤等が含まれる。薬学的活性物質のためのこのような媒質および作用剤の使用は、当技術分野に周知である。任意の慣用的媒質または作用剤が活性成分と不適合である場合を除いて、治療組成物でのこのような媒質または作用剤の使用が意図される。補助的活性成分もまた、組成物内に取り込まれ得る。「薬学的に許容される塩」には、酸付加塩、および例えば塩酸もしくはリン酸などの無機酸、または酢酸、シュウ酸、酒石酸、マンデル酸等の有機酸で形成されるものが含まれる。遊離カルボキシル基で形成される塩はまた、例えば、ナトリウム、カリウム、アンモニウム、カルシウム、または水酸化鉄などの無機塩基、およびイソプロピルアミン、トリメチルアミン、ヒスチジン、プロカイン等の有機塩基に由来することも可能である。
【0039】
薬学的または薬理学的組成物の調製は、本開示を踏まえて、当業者に公知である。処方および投与の一般的な技術は、"Remington: The Science and Practice of Pharmacy, Twentieth Edition," Lippincott Williams & Wilkins, Philadelphia, PAに見出される。錠剤、カプセル、丸剤、粉末、顆粒、糖衣錠、ジェル、スラリー、軟膏、溶液、座薬、注射剤、吸入剤、およびエアロゾルが、このような製剤の例である。
【0040】
例えば、当技術分野に公知のさらなる方法を用いて、延長または修正放出経口製剤を調製してもよい。例えば、活性薬学的成分のいずれかまたは両方の適切な延長放出型は、マトリックス錠剤またはカプセル組成物であることも可能である。適切なマトリックス形成材料には、例えば、ワックス(例えばカルナバ、蜜蝋、パラフィン蝋、セレシン、セラック蝋、脂肪酸、および脂肪アルコール)、油、硬化油または脂肪(例えば硬化菜種油、ヒマシ油、牛脂、ヤシ油、および大豆油)、およびポリマー(例えばヒドロキシプロピルセルロース、ポリビニルピロリドン、ヒドロキシプロピルメチルセルロース、およびポリエチレングリコール)が含まれる。他の適切なマトリックス錠剤化材料は、他のキャリアー、および充填剤を伴う、微結晶性セルロース、粉末化セルロース、ヒドロキシプロピルセルロース、エチルセルロースである。錠剤はまた、顆粒、コーティングされた粉末、またはペレットも含有してもよい。錠剤はまた、多層であってもよい。活性成分が、顕著に異なる薬物動態学的プロフィールを有する場合、多層錠剤が特に好ましい。任意で、完成した錠剤は、コーティングされていてもまたはいなくてもよい。
【0041】
コーティング組成物は、典型的には、不溶性マトリックスポリマー(コーティング組成物のおよそ15〜85重量%)および水溶性材料(例えばコーティング組成物のおよそ15〜85重量%)を含有する。任意で、腸溶性ポリマー(コーティング組成物のおよそ1〜99重量%)を用いてもまたはこのようなポリマーが含まれてもよい。適切な水溶性材料には、ポリエチレングリコール、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ポリビニルアルコールなどのポリマー、ならびに糖(例えばラクトース、スクロース、フルクトース、マンニトール等)、塩(例えば塩化ナトリウム、塩化カリウム等)、有機酸(例えばフマル酸、コハク酸、乳酸、および酒石酸)、およびその混合物などの単量体材料が含まれる。適切な腸溶性ポリマーには、ヒドロキシプロピルメチルセルロース、酢酸コハク酸、ヒドロキシプロピルメチルセルロース、フタル酸、酢酸フタル酸ポリビニル、酢酸フタル酸セルロース、酢酸トリメリト酸セルロース、セラック、ゼイン、およびカルボキシル基を含有するポリメタクリレートが含まれる。
【0042】
主な構成要素もしくは構成要素混合物のガラス遷移温度またはコーティング組成物を適用するのに用いられる溶媒などのコーティング・ブレンドの特性にしたがって、コーティング組成物を可塑化してもよい。適切な可塑剤が、コーティング組成物の0〜50重量%添加されてもよいし、かつこのような可塑剤には、例えばフタル酸ジエチル、クエン酸エステル、ポリエチレングリコール、グリセロール、アセチル化グリセリド、アセチル化クエン酸エステル、セバシン酸ジブチル、およびヒマシ油が含まれてもよい。望ましい場合、コーティング組成物は充填剤を含んでもよい。充填剤の量は、コーティング組成物の総重量に基づいて、1重量%〜およそ99重量%であってもよく、かつ二酸化ケイ素、二酸化チタン、タルク、カオリン、アルミナ、デンプン、粉末化セルロース、MCC、またはポラクリリンカリウムなどの不溶性物質であってもよい。
【0043】
コーティング組成物を、有機溶媒もしくは水性溶媒またはその混合物中の溶液またはラテックスとして適用してもよい。溶液を適用する場合、溶媒は、溶解される固体の総重量に基づいて、およそ25〜99重量%の量で存在してもよい。適切な溶媒は、水、低次アルコール、低次塩素化炭化水素、ケトン、またはその混合物である。ラテックスを適用する場合、溶媒は、ラテックス中のポリマー性材料の量に基づいて、およそ25〜97重量%の量で存在する。溶媒は、主に水であってもよい。
【0044】
任意の以下の賦形剤またはその組み合わせを用いて、NMDArアンタゴニストを処方してもよい。

【0045】
本明細書記載の薬学的組成物にはまた、溶媒、分散媒質、コーティング、抗細菌剤および抗真菌剤、等張性および吸収遅延剤などのキャリアーが含まれてもよい。薬学的活性物質用のこのような媒質および作用剤の使用は、当技術分野に周知である。薬学的に許容される塩、例えば、塩酸、臭化水素酸、リン酸、または硫酸などの無機酸の塩、ならびに酢酸、プロピオン酸、マロン酸、または安息香酸などの有機酸の塩もまた、組成物中に使用可能である。組成物はまた、水、生理食塩水、グリセロール、およびエタノールなどの液体、ならびに湿潤剤、乳化剤、またはpH緩衝剤などの物質もまた含有してもよい。米国特許第5,422,120号、WO 95/13796、WO 91/14445、またはEP 524,968 Blに記載されるものなどのリポソームもまた、キャリアーとして使用可能である。
【0046】
修正または延長放出製剤を調製するための方法
NMDArアンタゴニストが延長放出製剤において提供される、本明細書記載の組成物を調製するのに適した方法には、米国特許第4,606,909号(参照により本明細書に組み入れられる)に記載されるものが含まれる。この参考文献は、多数の個々にコーティングされたかまたはマイクロカプセル化された単位が、被験体の胃において、製剤(例えば丸剤または錠剤)の崩壊に際して利用可能になる、多数単位の制御放出製剤を記載する(例えば、第3欄、第26行から第5欄、第10行および第6欄、第29行から第9欄、第16行を参照されたい)。これらの個々にコーティングされたかまたはマイクロカプセル化された単位は、各々、難溶性活性物質の粒子を含有する、断面的に実質的に均質なコアを含有し、コアは、胃の条件に実質的に耐性であるが胃腸管で一般的な条件下では侵食可能なコーティング剤で、コーティングされている。
【0047】
本発明の組成物は、また、例えば、米国特許第4,769,027号に開示される方法を用いて、処方されてもよい。したがって、延長放出製剤は、薬学的に許容される材料(例えば糖/デンプン、塩、およびワックス)の小球(prill)を伴い、NMDArアンタゴニストを含有する透水性ポリマーマトリックスでコーティングされ、かつ次に、内部に分散された水溶性微粒子孔形成物質を含有する、透水性フィルムでオーバーコーティングされていてもよい。
【0048】
生体適合性、生体分解性微小カプセル送達システムを伴い、米国特許第4,897,268号に記載されるように、NMDArアンタゴニスト組成物をさらに調製してもよい。したがって、例えば異なる速度で生体分解する異なるコポリマー賦形剤において個々にメマンチン量をマイクロカプセル化することによって得られる、フリーフロー球状粒子のブレンドを含有する組成物として、NMDArアンタゴニストを処方し、それによって、あらかじめ決定された速度で、循環内にメマンチンを放出してもよい。これらの粒子の量は、コア活性成分が、投与後迅速に放出され、かつそれによって、最初の期間、活性成分を送達するようなコポリマー賦形剤のものであってもよい。第二の量の粒子は、第一の量の送達が減少し始めたときに、カプセル化された成分の送達が開始されるような種類の賦形剤のものである。第三の量の成分は、第二の量の送達が減少し始めたときに送達開始を生じる、さらに異なる賦形剤でカプセル化されていてもよい。送達速度は、例えば、ポリ(D,L-ラクチド−コ−グリコリド)カプセル化におけるラクチド/グリコリド比を変化させることによって、改変させてもよい。使用可能な他のポリマーには、ポリアセタールポリマー、ポリオルトエステル、ポリエステルアミド、ポリカプロラクトンおよびそのコポリマー、ポリカーボネート、ポリヒドロキシブテレートおよびそのコポリマー、ポリマレアミド、コポリアキサレートおよび多糖が含まれる。
【0049】
または、多層制御放出薬学的剤形を特徴とする、米国特許第5,395,626号に記載されるように、組成物を調製してもよい。剤形は、各々が、NMDArアンタゴニストを含有するコアに関して、多層を有し、それによって、薬剤含有コアおよび少なくとも1つの他の薬剤活性層が、制御放出障壁層でオーバーコーティングされ、したがって、多層コーティング粒子からの水溶性薬剤の少なくとも2つの制御放出層を提供する、複数のコーティングされた粒子を含有する。
【0050】
放出プロフィール(溶解速度)
上述のように、NMDArアンタゴニストは、修正または延長放出型で提供され得る。延長または修正薬剤放出は、一般的に、例えば酵素またはpHに応じたプロセスによって、コーティングもしくはマトリックスを通じた分散によるか、またはコーティングもしくはマトリックスの侵食によるかのいずれかで、制御される。NMDArアンタゴニストは、本明細書に記載されるような延長もしくは修正放出のため、または当技術分野の標準的技術を用いて、処方可能である。1つの例において、NMDArアンタゴニストの少なくとも50%、75%、90%、95%、96%、97%、98%、99%、または99%を超えてさえも、延長放出剤形において提供される。
【0051】
任意で、本明細書記載の組成物は、図2A〜2Cに示す溶解プロフィールと実質的に同一のインビトロプロフィールを有してもよく、かつ被験体への投与に際して、実質的に一定の1日用量で、図2Dに示すものと実質的に同一の血清濃度プロフィールを達成してもよい。多様な溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて、本発明の組成物の溶解プロフィールを決定することも可能である。1つの例において、放出画分は、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-10.9*t)未満である。別の例において、放出画分は、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-0.972*t)未満であるかまたはそれと等しい。どちらの例でも、用語「t」は時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。したがって、NMDArアンタゴニストは、USP 2型(パドル)溶解を用いると、1時間で0.1%〜62%、2時間で0.2%〜86%、6時間で0.6%〜100%、10時間で2.9%〜100%、かつ12時間で7.7%〜100%の間の範囲のインビトロ溶解プロフィールを有することも可能である。任意で、放出プロフィールは、1時間で0.1%〜20%、2時間で5%〜30%、6時間で40%〜80%、10時間で50%〜90%、かつ12時間で90%〜95%の間の範囲であってもよい。望ましくは、NMDArアンタゴニストは、中性pHを持つ溶液(例えば水)中で、酸性溶解媒質中の溶解プロフィールと実質的に同じインビトロ溶解プロフィールを有する(図2A〜2Cを参照されたい)。
【0052】
1つの態様において、NMDArアンタゴニストは、水中、37±0.5℃の温度で、50rpmのUSP II型(パドル)溶解システムを用いて得られるように、15分間で、15%、10%、または5%未満、30分間で、25%、20%、15%、または10%未満、かつ16時間で、60%より高いインビトロ溶解プロフィールを有する。望ましくは、NMDArアンタゴニストは、10時間で、1.2のpHを有する溶解媒質中、少なくとも65%、70%、75%、80%、85%、90%、または95%の溶解を有する。
【0053】
インビボ初期速度、Tmax遅延、Cmax/Cmean減少
即時放出製剤を含有してもまたは含有しなくてもよい修正放出製剤として、NMDArアンタゴニストを提供する。望ましい場合、Tmaxの関連する遅延を伴い、即時放出(IR)剤形よりも有意に減少した速度で放出されるように、NMDArアンタゴニストを処方してもよい。24時間、16時間、8時間、4時間、2時間、または少なくとも1時間までのTmaxのシフトを提供するように、薬学的組成物を処方することも可能である。dC/dTの関連する減少は、ほぼ0.05、0.10、0.25、0.5または少なくとも0.8の係数によってもよい。さらに、被験体内にNMDArアンタゴニストを導入したおよそ2時間後〜少なくとも8時間後、およそ2またはそれ未満のCmax/Cmeanを生じる速度で放出されるように、NMDArアンタゴニストを提供してもよい。任意で、持続放出製剤は、同じNMDArアンタゴニストの同じ投与量のIR製剤のものの75%、50%、40%、30%、20%または10%未満の初期(例えば投与0、1、2時間後〜投与4、6、8時間後)の傾きを有する血漿濃度曲線を示してもよい。所与の個体の正確な傾きは、用いるNMDArアンタゴニスト、または患者が食事をしたかもしくはしていないかを含む他の要因にしたがって、多様であろう。他の用量、例えば上述のものに関しては、傾きは、用量に直接関連して多様である。血漿濃度の初期の傾きの決定は、例えば参照により本明細書に組み入れられる、米国特許第6,913,768号に記載される。
【0054】
したがって、被験体(例えばヒトなどの哺乳動物)への投与に際して、NMDArアンタゴニストは、こうした投与のおよそ1、1.5、2時間後〜少なくとも6、8、9、12、18、21、24時間後に、およそ2.5、2、1.5、または1.0のCmax/Cmeanを有する。所望の場合、NMDArアンタゴニストの放出は、単相または多相(例えば二相)であってもよい。一般の当業者は、NMDArアンタゴニストおよび当技術分野に公知であるかまたは以下に記載する処方法を用いて、所望の放出プロフィールを持つ組成物を調製可能である。
【0055】
投薬頻度および用量漸増
本発明にしたがって、こうした状態を有するかまたは有するリスクがある被験体(例えばヒト)に、本明細書記載の任意の組成物を投与する(例えば1日1回、2日おき、3日おき、毎週、または毎月)。NMDArアンタゴニストの即時製剤は、典型的には、用量漸増方式で投与されるが、本明細書記載の組成物は、本質的に、設定期間に渡って、一定の治療的に有効な用量で投与可能である。例えば、メマンチンの持続放出製剤を含有する組成物を、メマンチン10〜300mg、10〜200mg、10〜100mg、または10〜50mg(例えば10mg、11.25mg、12.5mg、15mg、20mg、22.5mg、25mg、30mg、33.75mg、37.5mg、40mg、45mg、50mg、60mg、65mg、67.5mg、70mg、75mg、80mg、120mg、180mg、240mgまたは300mg)を含有する単位用量で、1日2回、1日1回、2日ごとに1回、または3日ごとに1回投与してもよい。
【0056】
1つの態様において、本明細書記載の方法を用いて組成物を調製し、このような組成物は、メマンチンまたはアマンタジンおよび放出修正賦形剤を含む。賦形剤は、メマンチン(例えばナメンダ)またはアマンタジン(例えばシンメトレル)の即時放出(IR)製剤に比較して、メマンチンまたはアマンタジンと関連する急性毒性を改善するかまたは減少させるのに十分な量で存在する。このような組成物の使用は、このような作用剤の投与の安全性を増加させ、これらの薬学的産物の現在入手可能な型と比較した際、NMDArアンタゴニストの類似であるかまたはより高い用量を用いて、投薬頻度の減少を可能にする。
【0057】
治療濃度および効果までの時間の減少
メマンチンの即時放出(IR)製剤(例えばナメンダ)は、典型的には、低用量で投与され(例えば5mg/日)、かつ治療的に有効な定常状態血清濃度に到達するまで、ゆっくり時間をかけて、増加した頻度および用量で進行性に投与される。FDAが認可した製造者のラベルにしたがうと、メマンチンの即時放出(IR)製剤であるナメンダは、まず、1日あたり5mgの用量で、被験体に投与される。1週間の順応期間の後、被験体にこの用量を1日2回投与する。次に、1日あたり5mgおよび10mgの投薬で被験体に投与し、かつ最終的に10mgのナメンダを1日2回投与する。図2Dは、Simulations Plusの薬物動態学的ソフトウェア、GastroPlusによって予測されるような、各日の平均血清濃度を示す。この投薬療法を用いると、治療開始30日以内に、治療的に有効な定常状態血清濃度を達成可能である。しかし、(22.5mgのメマンチン)を含む修正放出製剤を用いると、用量漸増療法を用いずに、実質的により速やかに治療的に有効な定常状態血清濃度が達成可能である。図2Dに示すように、このような濃度は、治療開始の13日以内に達成されると予測される。さらに、持続放出製剤に関する各吸収期間中の傾きは、ナメンダの傾きより少ない(すなわちそれほど急でない)。したがって、投与される用量が、即時放出製剤のものより高い場合であっても、持続放出製剤のdC/dTは、即時放出製剤に比較して減少する。このモデルに基づいて、メマンチンの持続放出製剤は、治療開始から、かつ処置期間全体に渡って、ほぼ完全強度用量である量(または治療的に有効な用量に効果的に到達する量)で、被験体に投与可能である。したがって、用量漸増は必要とされないであろう。
【0058】
したがって、1つの態様において、本明細書記載の方法を用いて組成物を調製し、このような組成物は、同じ被験体にあらかじめ治療量以下の同じ活性剤(すなわちメマンチンまたはアマンタジン)を投与することなく、被験体に投与するための、治療的に有効な量のメマンチンまたはアマンタジンおよび賦形剤を含む。具体的には、治療的に有効な量のメマンチンが典型的には1日あたり20mgである、アルツハイマー病などの徴候に対して、被験体へのメマンチンの投与を、治療量以下(例えばナメンダに関して、FDAが認可する製造者のラベルに現在示されるように、1日あたり5mg)でなく、1日あたり22.5mgまたはそれより多い量で開始する。
【0059】
本発明の主題による被験体の処置を、当技術分野に公知の方法を用いて監視することも可能である。組成物を用いた処置の有効性は、好ましくは、定量的な方式で被験体の症状を調べることによって、例えば状態の症状もしくは損傷効果の頻度もしくは重症度の減少、または症状悪化を持ちこたえる時間の増加に注目することによって、評価される。成功する処置において、被験体の状態は、改善されているであろう(すなわち、症状もしくは損傷効果の頻度もしくは重症度が減少しているか、または進行を持ちこたえる時間が増加しているであろう)。先のパラグラフに記載するモデルでは、用量漸増アプローチよりも、25%、40%、50%、60%、70%、75%、80%少ない時間で、NMDArアンタゴニストの定常状態(および有効)濃度に到達する。
【0060】
別の態様において、本明細書記載の方法を用いて組成物を調製し、このような組成物は、メマンチンまたはアマンタジンおよび放出修正賦形剤を含み、賦形剤は、ナメンダなどのメマンチンの、またはシンメトレルなどのアマンタジンの即時放出(IR)製剤に比較して、メマンチンまたはアマンタジンと関連する用量依存性毒性を改善するかまたは減少させるのに十分な量で存在する。これらの組成物の使用は、これらの作用剤のより安全な投与を可能にし、かつ現在入手可能な型のメマンチン(用量あたり5mgおよび10mg〜1日あたり20mg)およびアマンタジン(漸増を伴い、1日あたり100mg〜300mg)の有用な範囲を超えて、適切な徴候に対して、より高レベルの安全な使用を可能にしさえする。
【0061】
処置に適した徴候
本発明にしたがった処置に適した状態には、発作性障害、疼痛症候群、神経変性疾患(運動ニューロン病、ミエロパシー、神経根障害、および交感神経系の障害)、痴呆、脳血管性の病態、運動障害、脳外傷、脳神経障害、神経精神障害、および他疾患ニューロパシー(ウイルス関連ニューロパシー、糖尿病関連ニューロパシー、ギラン・バレー症候群、タンパク質異常血症、トランスサイレチン誘導性ニューロパシー、および手根管症候群を含む)が含まれる。
【0062】
本明細書において、発作性障害には、複雑部分発作、単純部分発作、続発性全身化を伴う部分発作、全身性発作(欠神、大発作(強直間代性)、癲癇重積症、強直、無緊張、ミオクローヌスを含む)、新生児および幼児痙攣、薬剤誘導性発作、外傷誘導性発作、および熱性発作、ならびに若年性ミオクローヌス癲癇、レノックス・ガストー、内側側頭葉癲癇、夜間前頭葉癲癇、精神遅滞を伴う進行性癲癇、および進行性ミオクローヌス癲癇などのさらなる特異的癲癇症候群、ならびにCNS腫瘤病変に関連する発作が含まれる。
【0063】
疼痛症候群には、例えば、頭痛(例えば偏頭痛、緊張性、および群発性)、急性疼痛、慢性疼痛、ニューロパシー性疼痛、侵害受容性疼痛、中心性疼痛および炎症性疼痛、薬剤誘導性ニューロパシー性疼痛、灼熱痛、複合性局所疼痛症候群I型およびII型、ならびに反射性交感神経性ジストロフィ(RSDS)が含まれる。
【0064】
神経変性疾患には、アルツハイマー病、パーキンソン病、多発性硬化症、ハンチントン病、ALS、脊髄性筋萎縮症、筋ジストロフィー、プリオン関連疾患、小脳性運動失調症、フリードリッヒ運動失調症、SCA、ウィルソン病、RP、ギラン・バレー症候群、副腎脳白質ジストロフィ症、メンケス症候群、皮質下梗塞を伴った常染色体優性脳動脈症(CADASIL)、シャルコー・マリー・ツース病、神経線維腫症、フォンヒッペル・リンダウ病、脆弱X染色体、痙性対麻痺、結節性硬化症コンプレックス、ワーデンバーグ症候群、脊髄運動萎縮症、テイ・サックス病、サンドホフ病、家族性痙性対麻痺、ミエロパシー、神経根障害、外傷、放射線、薬剤および感染に関連する脳症、ならびに交感神経系の障害(例えばシャイ・ドレーガー(家族性自律神経障害)、糖尿病性ニューロパシー、薬剤誘導性およびアルコール性ニューロパシー)が含まれる。
【0065】
痴呆には、アルツハイマー病、パーキンソン病、ピック病、前頭側頭痴呆、血管性痴呆、正常圧水頭症、ハンチントン病、およびMCIが含まれる。
【0066】
本発明にしたがった処置を受け入れられる脳血管性の病態には、脳血管疾患および脳卒中(例えば血栓性、塞栓性、血栓塞栓性、出血性(AVMおよび漿果状動脈瘤を含む)、静脈収縮性、および静脈性)が含まれる。
【0067】
運動障害に含まれるのは、パーキンソン病、ジストニア、良性本態性振戦、遅発性ジストニア、遅発性ジスキネジーおよびトゥーレット症候群である。
【0068】
本明細書に用いられる場合の脳外傷には、外傷性脳および脊髄傷害、ならびに放射線による脳傷害が含まれる。
【0069】
脳神経障害には、三叉神経ニューロパシー、三叉神経神経痛、メニエール症候群、舌咽神経痛、嚥下困難、音声障害、脳神経麻痺およびベル麻痺が含まれる。
【0070】
神経精神障害には、パニック症候群、一般的不安障害、すべての種類の恐怖症症候群、躁病、躁うつ性疾病、軽躁病、単極性抑うつ、抑うつ、ストレス障害、PTSD、身体表現性障害、人格障害、精神病、および統合失調症、ならびに薬剤依存/耽溺(例えばアルコール、精神興奮薬(例えばクラック、コカイン、スピード、メス(meth))、オピオイド、およびニコチン)、ならびに薬剤誘導性精神障害が含まれる。
【0071】
本明細書記載の組成物および方法で処置可能な他疾患ニューロパシーには、ギラン・バレー、糖尿病関連ニューロパシー、タンパク質異常血症、トランスサイレチン誘導性ニューロパシー、HIV、ヘルペスウイルス(帯状疱疹を含む)または他のウイルス感染に関連するニューロパシー、ライム病に関連するニューロパシー、手根管症候群、足根管症候群、アミロイド誘導性ニューロパシー、ハンセン病ニューロパシー、ベル麻痺、圧迫性ニューロパシー、サルコイドーシス誘導性ニューロパシー、頭側多発性神経炎、重金属誘導性ニューロパシー、遷移金属誘導性ニューロパシー、薬剤誘導性ニューロパシー、髄膜炎後症候群、ポリオ後症候群、プリオン病、および放射線関連ニューロパシー症候群が含まれる。
【0072】
本発明を用いた処置を受け入れられる他の疾患には、疲労症候群(例えば慢性疲労症候群および線維筋痛)、運動失調症候群(ataxic syndrome)、オリーブ橋小脳変性、線条体黒質変性、および軸索性脳損傷(axonic brain damage)が含まれる。
【0073】
本組成物中のNMDArアンタゴニストは、即時放出製剤よりも短い期間で(例えば、投与後最初の5日、7日、9日、10日、12日、15日、または20日経過以内に)、治療的に有効な定常状態に到達するため、本発明は、抑うつ、激越、不安、大発作などの発作性障害、癲癇重積症、偏頭痛疼痛処置および予防、アルツハイマー病、パーキンソン病、ならびに外傷性脳および脊髄傷害などの神経精神障害の処置に特に有用である。
【0074】
また、本発明によって可能になる、より高い用量は、アルツハイマー病、パーキンソン病、および血管性痴呆を含む痴呆、頭痛および偏頭痛を含む疼痛症候群、発作性障害、運動障害、ならびに脳外傷に特に重要であると期待される。
【0075】
さらに、治療開始から、治療的に有効な量で、1日あたり1回またはそれより低い頻度の投与で送達されるように開発された、提供される剤形の使用が、容易かつ簡便であることは、アルツハイマー病およびパーキンソン病を含む痴呆、発作性障害、疼痛症候群、ならびに脳血管性の病態の処置に価値がある。
【0076】
別の特定の投与経路のための製剤
特定の種類の送達のため、薬学的組成物を最適化してもよい。例えば、当技術分野に周知の薬学的に許容されるキャリアーを用いて、経口送達のための薬学的組成物を処方する。このキャリアーは、組成物において、作用剤が、被験体による経口摂取のため、例えば錠剤、丸剤、カプセル、溶液、懸濁物、持続放出製剤;粉末、液体またはジェルとして処方されることを可能にする。
【0077】
NMDArアンタゴニストはまた、加圧パック、ネブライザー、または乾燥粉末吸入装置からのエアロゾルスプレー調製物において送達可能である。ネブライザーにおいて使用可能な適切な噴霧剤には、例えば、ジクロロジフルオロ-メタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタンおよび二酸化炭素が含まれる。加圧エアロゾルの場合、化合物の制御された量を送達するように、バルブを提供することによって、投与量を決定することも可能である。
【0078】
吸入または吹送用の組成物には、薬学的に許容される、水性もしくは有機溶媒、またはその混合物中の溶液および懸濁物、ならびに粉末が含まれる。液体または固体組成物は、上述のような適切な薬学的に許容される賦形剤を含有してもよい。好ましくは、組成物は、局所または全身性効果のため、経口、鼻内または呼吸経路によって投与される。好ましくは薬学的に許容される無菌溶媒中の組成物を、不活性ガスの使用によって噴霧してもよい。噴霧される溶液を、噴霧化デバイスから直接呼吸してもよいし、または噴霧化デバイスをフェイス・マスク、テントまたは断続的陽圧呼吸機に取り付けてもよい。適切な方式で製剤を送達するデバイスから、溶液、懸濁物または粉末組成物を、好ましくは経口または鼻投与してもよい。
【0079】
いくつかの態様において、例えば、CNSへの嗅覚路を通じた活性剤の輸送を可能にする吸入よりも、篩板に鼻内送達して、かつ全身投与を減少させてもよい。この投与経路に一般的に用いられるデバイスは、米国特許第6,715,485号に含まれる。この経路を介して送達される組成物は、CNS投薬の増加または体全体の負荷の減少を可能にし、特定の薬剤に関連する全身性毒性リスクを減少させ得る。
【0080】
他の投与様式に適したさらなる製剤には、直腸カプセルまたは座薬が含まれる。座薬に関しては、伝統的結合剤およびキャリアーには、例えば、ポリアルキレングリコールまたはトリグリセリドが含まれてもよく;このような座薬は、0.5%〜10%、好ましくは1%〜2%の範囲の活性成分を含有する混合物から形成され得る。
【0081】
連続長期送達、例えば30日、60日、90日、180日、または1年までの送達を提供する、容器中の送達のための組成物を、任意で処方してもよい。例えば、チタンなどの生体適合性材料の容器を提供してもよい。長期送達製剤は、患者コンプライアンスの改善を確実にし、かつ組成物の安定性を増強するため、慢性状態の被験体で特に有用である。
【0082】
任意で、すべて参照により本明細書に組み入れられる、米国特許第6,919,373号、第6,923,800号、第6,929,803号、第6,939,556号、および第6,930,128号に記載される、OROS(登録商標)技術を用いて、NMDA受容体アンタゴニストを調製してもよい。この技術は、24時間までの正確な制御放出薬剤送達を提供するため、浸透を使用し、かつほとんど溶解性でないかまたは非常に溶解性である薬剤を含む、ある範囲の化合物で、この技術が使用可能である。OROS(登録商標)技術を用いて、多量の薬剤用量を送達可能であり、多量の薬剤を装填する要件を満たす。特定の領域の胃腸管を標的とすることによって、OROS(登録商標)技術は、より効率的な薬剤吸収および増強された生物学的利用能を提供し得る。OROS(登録商標)の浸透駆動力および放出時間までの薬剤の保護から、しばしば胃のpHおよび運動性によって引き起こされる、薬剤吸収および代謝の変動性が排除される。
【0083】
連続長期送達用の製剤は、例えば、米国特許第6,797,283号;第6,764,697号;第6,635,268号および第6,648,083号に提供される。
【0084】
所望の場合、構成要素をキット中に提供してもよい。キットにはさらに、キットを用いるための使用説明書が含まれてもよい。
【0085】
修正放出製剤を作製するためのさらなる方法
修正放出製剤を作製するためのさらなる方法は、例えば、すべて参照により本明細書に組み入れられる、米国特許第5,422,123号、第5,601,845号、第5,912,013号、および第6,194,000号に記載される。
【0086】
または、本発明の組成物を経皮投与してもよい。一般的に、例えば、その全体が参照により本明細書に組み入れられる、米国特許第5,186,938号および第6,183,770号、第4,861,800号、第6,743,211号、第6,945,952号、第4,284,444号、ならびにWO 89/09051に記載されるものを含む、当技術分野にやはり公知の方法を用いて、経皮パッチ中の送達用の調製を行ってもよい。パッチは、吸収に問題を有する薬剤では、特に有用な態様である。12時間、24時間、3日間、および7日間の期間に渡って、皮膚浸透性活性成分の放出を制御するパッチを作製してもよい。1つの例において、不揮発性液に、NMDArアンタゴニストの2倍過剰1日量を入れる。本明細書で使用する作用剤の量を考慮すると、好ましい放出は、12〜72時間であろう。
【0087】
この型の経皮調製物は、1%〜50%の活性成分を含有するであろう。本発明の組成物は、粘性不揮発性液の形で提供される。好ましくは、NMDArアンタゴニストは、少なくとも10-9モル/cm2/時間の皮膚浸透速度を有するであろう。少なくとも5%の活性物質が、24時間の期間内に皮膚を通じて流動するであろう。当技術分野の標準法によって、皮膚を通じた特定の製剤の浸透を測定してもよい(例えば、Franz et al., J. Invest. Derm. 64:194-195 (1975))。パッチの形のNMDArアンタゴニストの提供は、これらの作用剤が比較的高い皮膚流動を有することを考慮すると、有用である。
【0088】
いくつかの態様において、例えば、CNSへの嗅覚路を通じた活性剤の輸送を可能にする吸入よりも、鼻内、頬側、または舌下経路を介して脳まで、組成物を送達し、かつ全身投与を減少させてもよい。この投与経路に一般的に用いられるデバイスは、米国特許第6,715,485号に含まれる。この経路を介して送達される組成物は、CNS投薬の増加または体全体の負荷の減少を可能にし、特定の薬剤に関連する全身性毒性リスクを減少させ得る。
【0089】
例えば米国特許第3,992,518号;第5,660,848号;および第5,756,115号に記載されるものなどの、当技術分野に公知の方法を用いて、皮下移植可能デバイスにおける送達用の薬学的組成物の調製を行ってもよい。
【0090】
本明細書記載の処方および方法を用いて、本発明者らは、修正放出プロフィールを有するNMDArアンタゴニスト(例えばメマンチンおよびアマンタジン)の多くの製剤(50を超える)を産生した。例示的な製剤を実施例に提供する。
【0091】
本発明は、以下の限定されない実施例に例示されるであろう。
【0092】
実施例
実施例1
インビトロのアミノアダマンタンに関する放出プロフィールの測定
50rpmの速度で、USP II型装置によって、アミノアダマンタンの放出に関して、アミノアダマンタンを含有する組成物を分析した。用いた溶解媒質は、水、0.1N HCl、または2時間の時点でリン酸緩衝液を用いてpH 6.8に調整された0.1N HClであった。溶解媒質を37±0.5℃に平衡化させた。
【0093】
アマンタジンのUSP参照アッセイ法を用いて、本明細書で調製した組成物から放出されるメマンチンの画分を測定した。簡潔には、(所与の時点で溶解装置から)0.6mLの試料を15mLの培養試験管に入れた。1.6mLの0.1%ブロモクレゾールパープル(酢酸中)を添加し、かつ5秒間ボルテックスで撹拌した。混合物をおよそ5分間静置した。3mLのクロロホルムを添加し、かつ5秒間ボルテックスで撹拌した。次に溶液を5分間遠心分離した(速度50rpm)。使い捨てピペットで最上層を移した。試料を1cmフローセルに抜き取り、かつ37℃、408nmで吸光度を測定し、かつ同じアミノアダマンタンの公知の量を用いて用意した標準曲線に対して比較した。決定した量を、試料の溶解時間に対してプロットした。
【0094】
実施例2
腸溶性コーティングでコーティングされる、メマンチン含有コアの調製
以下のように、かつ例えば米国特許第4,606,909号に記載されるように、メマンチン含有コアを調製する。0.97kgのメマンチン、0.2kgのラウリル硫酸ナトリウム、0.5kgの微結晶性セルロース、5.93kgのサッカロース粉末、および2.4kgのタルクを用いて、コア(24%タルクを含有する)を調製する。0.5mmふるいを用いて粉砕装置を通過させることによって、メマンチンおよびラウリル硫酸ナトリウムを同時粉砕する。粉砕した混合物をプラネットミキサー中で微結晶性セルロース、サッカロース、およびタルクと混合する。生じた混合物10kgを0.8kgの精製水で湿らせ、かつ混合物がわずかにごつごつするまでプラネットミキサー中で混合する。0.5mmふるいを通じて、湿った混合物を押し出す。ふるいを通過する最初の数キログラムの押出物は粉末状であり、かつこれを再度押し出す。生じた押出物は、紐を形成し、10〜30cmの長さで切れる。2kgの押し出された紐を、marumerizer(商標)中でコンパクトな形状のコアに形成し、かつ生じたコンパクトな形状のコアを、流動層乾燥機中で乾燥させ、かつ分離装置(上部のふるい(0.71mm)および底部のふるい(0.46mm))を通じてふるいにかける。同じ技術を用いて、0.97kgのメマンチン、0.2kgのラウリル硫酸ナトリウム、1.0kgの微結晶性セルロース、6.83kgのサッカロース粉末、および1.0kgのタルクを用いて、コア(10%タルクを含有する)を調製する。
【0095】
それぞれ24%タルクおよび10%タルクを含有するコアに関して、pH 7.5でメマンチンの放出を測定する。24%から10%にタルク含量を減少させると、コアから放出されるメマンチンの重量が減少する。
【0096】
9.0kgのEudragit(商標)S 12,5を、0.135kgのクエン酸アセチルトリブチル、0.9kgのタルク、および7.965kgのイソプロパノールと一緒にホモジナイズすることによって、メマンチンの放出をさらに遅延させる腸溶性コーティング懸濁物を調製する。10%タルクを含有する10kgの上述のコアを、流動層中で、このコーティング懸濁物4.167kgでコーティングし、かつ生じたペレットをタルカムで覆う。薬学的剤形を調製するため、各カプセルが25mgのメマンチンを含有するように、1000のこれらのペレットをカプセルNo.1に満たす。
【0097】
実施例3
アマンタジン延長放出カプセルの調製
以下のようにまたは例えば米国特許第5,395,626号に記載されるように、アマンタジン延長放出カプセルを処方してもよい。
【0098】
A. 組成物:単位用量
アマンタジン延長放出カプセル用の理論的な定量的組成(単位用量あたり)を以下に提供する。

1ヒドロキシプロピルメチルセルロース、ポリエチレングリコール、プロピレングリコールの混合物。
2精製水、USPは処理中に蒸発する。
3ヒドロキシプロピルメチルセルロースおよびポリエチレングリコールの混合物。
4エチルセルロース、セバシン酸ジブチル、オレイン酸、アンモニウム処理水および煙霧シリカの混合物の25%水性分散物の固形含量のみ。分散物中の水は処理中に蒸発する。
5白色、不透明の硬ゼラチンカプセル、サイズ00。
6充填前に各バッチをアッセイし、かつ必要に応じてカプセル重量を調整して、カプセルあたり200mgアマンタジンを実現する。
【0099】
アマンタジン延長放出カプセルの定量的バッチ組成を以下に示す(理論的バッチ量、25,741カプセル)。
工程1:アマンタジンHClビーズの調製(ビーズ組立て#1)

【0100】
工程1から得られるアマンタジンビーズを以下のように用いる。
工程2:透明および持続放出ビーズコーティング#1

【0101】
工程2から得られる持続放出ビーズを以下のように用いる。
工程3:アマンタジンHClビーズ(組立て#2)

【0102】
工程3から得られるアマンタジンビーズを以下のように処方する。
工程4:透明および持続放出ビーズコーティング#2

【0103】
工程5:カプセル充填――サイズ00のゼラチンカプセルに、工程4で調製したアマンタジンビーズ339mgを充填する。
【0104】
実施例4〜11
リマンチジンの延長放出製剤
延長放出用のNMDArアンタゴニスト、リマンチジンを以下のように処方する(例えば、米国特許第5,912,013号を参照されたい)。
【0105】
実施例4
コアペレット

コーティング

【0106】
実施例5
実施例4由来のコアペレットに対するコーティング

【0107】
実施例6
実施例4由来のコアペレットに対するコーティング

【0108】
実施例7
コアペレット

実施例4と同様のコーティング
【0109】
実施例8
実施例8と同様のコアペレット、実施例5と同様のコーティング
【0110】
実施例9
実施例8と同様のコアペレット、実施例6と同様のコーティング
【0111】
実施例10
実施例9と同様のコアペレットに対するコーティング

【0112】
実施例11
実施例4と同様のコアペレット、実施例10と同様のコーティング
【0113】
実施例12
メマンチン制御放出調製物
各々、特徴的なインビトロ溶解プロフィールに関連する、メマンチンの異なる持続放出錠剤製剤を開発した。以下にさらに詳細に記載するように、持続放出製剤は、治療的に優れた薬物動態学的プロフィールに至る。持続放出マトリックスまたは持続放出コーティング錠剤を用いて、持続放出プロフィールを達成した。活性の物理的特性、製剤組成の説明、小規模産生プロセスの概要、および有効な分析法を以下に示す。
【0114】
薬剤物質情報

【0115】
製剤組成

【0116】
製剤#1:持続放出マトリックスを用いて処方されるメマンチン
製剤#1を以下のように産生した。以下の表に示すように、メマンチンを処方した。

【0117】
APIをまず、Avicel PH102とともにバッグ混合し、かつ18メッシュスクリーンを通じてふるいにかける。次に、低剪断ミキサー中で混合物を乾燥させる。混合物をEudragitで湿った塊にし、かつ40〜45℃のオーブン中で造粒を12時間乾燥させる。次に、0.8mmスクリーンに設定したAlexanderwerkミルを通じて、造粒を通過乾燥させ、中間体活性ブレンドを産生する。30メッシュスクリーンを通じて、HPMCをふるいにかけた。スクリーンにかけたHPMCを等量の中間体活性ブレンドとあらかじめ混合し、この混合物を本明細書において、1292-12と称し、かつ2分間バッグ混合した。次に、このブレンドを、低剪断ブレンダー中、ステアリン酸マグネシウムで潤滑化した。このブレンド由来の試料を、105℃に設定したComputrac MAx 2000上のLOD(乾燥減量)試験のために収集した。次いで、最終ブレンドを圧縮し、かつ0.25インチに設定したD3B標準円形凹型パンチ工具を用いて、錠剤にパンチする。この製剤の溶解プロフィールを、図6に提供する(%表示事項(Label claim)対時間)。
【0118】
製剤2:持続放出コーティングマトリックスを用いて処方されるメマンチン

*303.3gのEudragit RS-30D水性分散物は、91gの固形ポリマーおよび212.3gの液体を含有する。
【0119】
塩酸メマンチンをまず、Avicel PH102とともに1分間バッグ混合する。乾燥したブレンドを、18メッシュスクリーンを通じてふるいにかけてポリ袋に入れ、かつ1分間バッグ混合する。混合物を低剪断ミキサー内に装填し、かつ2分間乾燥させる。ブレンドをEudragitで湿った塊にし、かつ40〜45℃のオーブン中で造粒を12時間乾燥させた。次に、乾燥した造粒を、0.8mmスクリーンに設定したAlexanderwerkミルに通す。次に、ふるいにかけたステアリン酸マグネシウム(30メッシュ)を、製粉した混合物に添加し、かつバッグ混合した。次に最終ブレンドを圧縮し、かつ0.25インチD3B標準円形パンチ工具を用いて、錠剤にパンチした。
【0120】
コート錠剤を以下のように調製した。コートを調製するため、Eudragit RL-30DおよびEudragit RS-30Dを、ボルテックスで撹拌しながら、バブルを含まない精製水に添加した。次に、TECを添加して、かつ>30分間混合する。タルクをゆっくりと添加し、かつ混合して、均一な分散物を得る。次に、60メッシュふるいを通じて、コーティングされていないもの(coating desertion)をスクリーニングした。コーティングパラメーターは以下のとおりである(O’Hara Lab II-X 15”pna):インレット温度:37〜40℃;アウトレット温度:25〜28℃;空気流速:150〜175 CFM;パン速度:8〜9rpm;およびスプレー距離:6〜8”。
【0121】
次に錠剤をコーティングした。排出温度およびコーティング速度(重量変化/分)をまず較正し、かつ設定した時間に渡って、錠剤をコーティングした。一定の温度(37〜40℃)で錠剤が3分間回転するようにし、かつ次に、錠剤を冷却し、かつ乾燥させるため、強制換気オーブン(40℃)に、24時間移した。
【0122】
実施例13
フィルムコーティング製剤
Opadry(登録商標)サブコートを用いまたは用いず、かつSurelease(登録商標)オーバーコートを用い、メマンチン錠剤にコーティングすることによって、フィルムコーティング錠剤を処方した。2% Surelease(登録商標)オーバーコートを用い、2% Opadry(登録商標)をベースとするコーティングは、望ましい放出プロフィールを提示した。
【0123】
実施例14
マトリックスコア錠剤
以下の表に示すように、マトリックスコア錠剤を処方した(外見=良、重量=167mg;硬さ=5.1kg;もろさ100revs:0.6%)。低コーティング重量増大は、コーティングの迅速な水和と関連し、一方、高コーティング重量増大は、コーティングの緩慢な水和と関連した。

【0124】
コーティングされたビーズまたは顆粒を圧縮して錠剤にした。圧縮中、蜂の巣様構造を確立する。錠剤は、ビーズおよび顆粒に崩壊し、次いで、これらの個々の特性が、メマンチンの放出を制御する。任意で、HPMCサブコートを用いてもよい。水は、Sureleaseコーティングに浸透し、損なわれずに残り、したがって、コアおよび外部コーティングの間に、HPMCサブコートを捕捉する。水溶性HPMCサブコートが水和する。これは水溶性であるが、大分子量ポリマーであり、水不溶性エチルセルロースコーティングを通じて分散することは不可能である。薬剤の放出は、水がコアに到達するまで起こらないであろう。したがって、遅延は、錠剤中のHPMCの量の関数として、変化するはずである。水がコアの外表面に到達し、かつメマンチンが溶解する。高い水溶性は、高濃度勾配を確立する。溶解したメマンチンは次に、水和したHPMC層および多孔性エチルセルロースコーティングを通じて分散する。したがって、高レベルのエチルセルロースコーティングは、外部コーティングによる放出速度を制御し、一方、より低いレベルのエチルセルロースコーティングは、侵食、水和されたHPMCからの脱落を生じ、かつ放出の制御は、マトリックスビーズに支配される。
【0125】
実施例15
メマンチンの持続放出製剤のインビトロ溶解プロフィール
メマンチンの多様な持続放出製剤を以下のように調製した。
【0126】
マトリックス錠剤製剤5001-6601

【0127】
コーティングされた錠剤製剤5001-6701

【0128】
コーティングされた錠剤製剤5001-680

【0129】
コーティングされた錠剤製剤5001-6804

【0130】
コーティングされたビーズ製剤5001-6990

【0131】
コーティングされたビーズ製剤5001-6991

【0132】
コーティングされたビーズ製剤5001-6992

【0133】
コーティングされたビーズ製剤5001-6993

【0134】
メマンチンの持続放出製剤およびナメンダの例示的なインビトロ溶解プロフィールを図2A〜2Cおよび3A〜3Bに示す。中性媒質中の持続放出メマンチン製剤の溶解プロフィール(図2A)は、酸性溶解媒質中のその溶解プロフィール(図2B)と実質的に同一である。
【0135】
図2Cは、マトリックス錠剤からのメマンチンの放出プロフィールに対する媒質の影響を示すグラフである。50RPMで装置2を用いるR&D法を用いて、試験を行った。3つの媒質を使用した:容器1および2=水;容器3および4=pH 1.2の緩衝液;容器5および6=pH 1.2の緩衝液を2時間、次いで、pHを6.8に調整する。最初の2時間に関するプロフィールにおいて、またはpH 1.2の緩衝液で得られるプロフィールと水で得られるプロフィールとの間で、有意な相違はなかった。しかし、pH 6.8を有する緩衝液に転換すると、放出が緩慢になった。したがって、試験した最適媒質は、水であり得る(水中でおよそ22.5mgの塩酸メマンチンを含有する溶液のpHは7.7であり、約9〜10のpKaを有する塩基の低濃度溶液と一致する)。
【0136】
コーティングされたペレット(22.5mg)としての塩酸メマンチンSRカプセルの製剤
メマンチンを以下の表に示すように処方した。

【0137】
次に、Wursterコーティング装置を用いて、メマンチンペレットをコーティングした。コーティング製剤Iおよびコーティング製剤IIのエチルセルロース:HPMC比は、それぞれ、9:1および8:2であった(以下の表を参照されたい)。

【0138】
コーティングされたら、これを手動で充填することによって、メマンチンペレットをカプセル化した。各カプセルは、22.5mgのメマンチンを含有した。カプセルサイズは「3」であった。
【0139】
次に、溶解媒質として水(500mL)を用い、50rpmのUSP II(パドル)システムで、上記製剤の溶解プロフィールを決定した。異なるコーティングレベル(%w/w)を使用した。1、2、4、6、8、および12時間の時点で、各メマンチンカプセル(22.5mg)の放出プロフィールを決定した(以下の表を参照されたい)。
【0140】
異なるコーティングレベル(%w/w)のコーティング製法Iでコーティングされたペレットを充填した塩酸メマンチンSRカプセル22.5mgの放出データ

【0141】
異なるコーティングレベル(%w/w)のコーティング製法IIでコーティングされたペレットを充填した塩酸メマンチンSRカプセル22.5mgの放出データ

【0142】
薬剤放出は、非直線方式で、12時間まで持続した。ほとんどの場合で、ペレットは、2時間後に、より迅速な放出を示した。ほぼ100%の薬剤放出で、12時間までの放出プロフィールを直線化するため、薬剤層形成およびコーティング組成を変化させてもよい。
【0143】
実施例16
メマンチン持続放出の予測される血漿プロフィール
実施例14に記載する製剤および溶解プロフィールを用い、Simulations Plusの薬物動態学的ソフトウェア、GastroPlusを用いて、メマンチンの単回または複数回投与から生じる血清濃度を計算した(図2Dを参照されたい)。持続放出製剤のいずれかの投与は、ナメンダよりはるかに迅速に、治療的に有効な定常状態血清濃度を達成する(処置治療開始から30日に対して13日)。さらに、持続放出製剤の初期の傾きは、即時放出製剤で得られる傾きより緩い。
【0144】
実施例17
メマンチンの延長放出を提供するパッチ
上述のように、局所投与のため、NMDAアンタゴニストの延長放出製剤を処方してもよい。例えば、参照により本明細書に組み入れられる米国特許第6,770,295号および第6,746,689号に記載されるように、メマンチン経皮パッチ製剤を調製してもよい。
【0145】
接着性アクリレート中の薬剤を調製するため、5gのメマンチンを11gのエタノール中に溶解し、かつ20gのDurotak 387-2287(National Starch & Chemicals, U.S.A.)に添加する。コーティング装置(例えばRK Print Coat Instr. Ltd, KCC 202型制御コーティング装置)を用いて、薬剤ジェルを裏打ち膜(Scotchpak 1012;3M Corp., U.S.A.)上にコーティングする。湿った層の厚さは400μmである。ラミネートを室温で20分間、かつ次いで、40℃で30分間乾燥させる。乾燥薬剤ジェル上に、ポリエステル放出ライナーをラミネート加工する。シートを切ってパッチにし、かつ使用するまで2〜8℃に保管する(袋で包装する)。パッチ中のメマンチン濃度は、5.6〜8mg/cm2の間の範囲である。
【0146】
実施例18
メマンチンの延長放出を提供するパッチ
メマンチンの延長放出を可能にするパッチを以下のように調製してもよい。マトリックスパッチは、アクリレートポリマー中のメマンチンおよび皮内浸透剤の混合物を含むアクリレートマトリックスでコーティングされた、1mm厚のポリオレフィン・フォーム(密封性裏打ちとして)で構成される。メマンチン(20重量パーセント);アクリレートポリマー(Durotak.RTM. 387-2052、75重量パーセント);皮内浸透剤;アルミニウムアセチルアセトネート(Al(ACAC)3、0.4重量パーセント、架橋剤として);およびエタノールを、均一になるまで混合することによって、マトリックスを調製する。次いで、手動コーティング装置を用いて、均一混合物を、約270μmの平均厚まで、ポリオレフィン箔上にコーティングする。約50℃で約1時間、コーティングした箔を乾燥させて、エタノールを蒸発させる。生じるパッチは、およそ50g/m2乾燥重量である。
【0147】
実施例19
メマンチンSR製剤に関する用量増加耐容性の決定
メマンチンSRに関する投薬増加の安全性および耐容性を決定するための研究を以下に記載する。この研究結果は、1日あたり1回投与される20mgを超える最大投与可能用量を確立するとともに、非用量漸増投薬療法(すなわち投薬期間全体に渡る、実質的に同一用量のメマンチンの投与)の耐容性を確認すると期待される。

【0148】
実施例20
アマンタジンSR製剤に関する用量増加耐容性の決定
アマンタジンSRに関する投薬増加の安全性および耐容性を決定するための研究を以下に記載する。この研究結果は、1日あたり1回投与される200mgを超える最大投与可能用量を確立するとともに、非用量漸増投薬療法(すなわち投薬期間全体に渡る、実質的に同一用量のメマンチンの投与)の耐容性を確認すると期待される。

【0149】
実施例21
制御放出製剤でのNMDA受容体関連障害の処置
アルツハイマー型痴呆と診断された患者に、1日1回、持続放出製剤(例えば実施例13に記載するように処方)中の22.5mgのメマンチンを投与する。Periclou et al., Annals of Pharmacotherapy 38:1389-94 (2004)に記載されるように、質量分析検出と連結させたHPLCを用いて、メマンチン血漿濃度を決定してもよい。この治療開始の10日以内に、治療的に有効な定常状態血清濃度に到達する。
【0150】
実施例22
大うつ病の処置
大うつ病と診断された患者に、1日1回、実施例13に記載するように処方したメマンチンを22.5mgまたはそれより多く、最大耐容用量まで(実施例20のプロトコルを用いて決定されるようなもの)、投与する。この治療開始の10日以内に、治療的に有効な定常状態血清濃度に到達する。
【0151】
実施例23
パーキンソン病患者におけるジスキネジーの処置
ジスキネジーを経験しているパーキンソン病患者に、1日用量400mgの持続放出アマンタジン製剤を投与する。UPDRSスコアリングを用いて、ジスキネジーの改善を測定する。
【0152】
実施例24
アルツハイマー病または難治性抑うつ患者において、ナメンダ(Namenda)(登録商標)にメマンチンSR製剤を比較する臨床試験

【0153】
上記活性対照二重盲検試験各々において、メマンチンSRが定常状態血漿治療レベルに到達するのに必要な時間を、メマンチンIRのものと比較する。試験対象患者基準に対して患者をスクリーニングし、かつ試験集団に承認する。干渉する薬剤を4週間洗い出した後、患者をベースラインにスコアリングし、かつ過剰カプセル化法を用いて、盲検方式で試験薬剤を患者に投与する。各患者に対して、1週間間隔で、終点の測定を行う。
【0154】
本発明者らのコンピュータシミュレーションに基づくと、メマンチンSRの完全用量を投与されている患者は、メマンチンIRを投与されている患者に必要な40日でなく、8日で、定常状態に到達すると期待される。したがって、処置経過中、より早期に有益な効果が期待される。
【0155】
実施例25
多発性硬化症患者における、アマンタジンSR製剤の有効性を評価する臨床試験

【0156】
上記活性対照二重盲検試験各々において、アマンタジンSRをプラセボに比較して、効果を測定する。試験対象患者基準に対して患者をスクリーニングし、かつ試験集団に承認する。干渉する薬剤を4週間洗い出した後、患者をベースラインにスコアリングし、かつ過剰カプセル化法を用いて、盲検方式で試験薬剤を患者に投与する。各患者に対して、1週間間隔で、終点の測定を行う。
【0157】
アマンタジンSRを投与された患者は、抑うつまたは疲労の改善に相関する試験基準において、改善されたスコアを示すと期待される。
【0158】
実施例26
薬剤誘導性ジスキネジー患者における、アマンタジンSR製剤の有効性を評価する臨床試験

【0159】
他の態様
本発明を、その詳細な説明と組み合わせて記載してきたが、前述の説明は例示を意図し、かつ本発明の範囲を限定することを意図せず、本発明は、付随する特許請求の範囲によって定義される。他の側面、利点、および修正が、特許請求の範囲内に含まれる。
【図面の簡単な説明】
【0160】
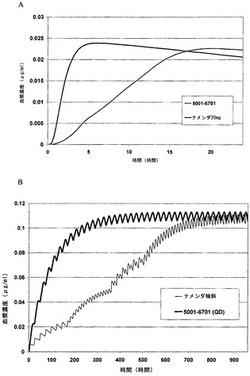
【図1A】単回用量のメマンチンの即時放出(IR)製剤(ナメンダ)またはメマンチンの持続放出製剤(NPI-6701)の投与後、Gastro-Plusソフトウェアパッケージv.4.0.2によって予測されるような、24時間の期間に渡るメマンチン血漿濃度を示すグラフである。持続放出製剤は、即時放出(IR)製剤のものの約20%の初期相中のdC/dTを示す。
【図1B】メマンチンの即時放出(IR)製剤(ナメンダ)およびメマンチンの持続放出製剤(NPI-6701)の投与後、Gastro-Plusソフトウェアパッケージv.4.0.2によって予測されるような、28日間の期間に渡るメマンチン血漿濃度を示すグラフである。US FDAが認可した製造者のラベルに準拠した用量漸増療法を用いて、ナメンダを投与すると、約30日以内に、定常状態治療的有効血漿濃度に到達する。一定用量(例えば22.5mg/日)でメマンチンの持続放出製剤を投与すると、約13日以内に定常治療的有効血漿濃度が達成され、これは約60%の減少である。
【図2A】メマンチンの多様な持続放出製剤(NPI-6601、NPI-6701、NPI-6801、NPI-6990、およびNPI-6804)およびナメンダに関するインビトロ溶解プロフィールを示すグラフおよび表である。溶解プロフィールは、溶解媒質として水を用いて、USP II(パドル)システムで得られた。
【図2B】溶解媒質として0.1N塩酸溶液pH=1.2を用いて、USP II(パドル)システムで得られた、メマンチンの多様な持続放出製剤(NPI-6601、NPI-6701、NPI-6801、NPI-6990、およびNPI-6804)およびナメンダに関する溶解プロフィールを示すグラフである。
【図2C】中性(例えば水)および酸性(pH 1.2)溶解媒質を用いて、持続放出型として処方されたメマンチンの溶解プロフィールを示すグラフである。
【図2D】ナメンダ(10mg b.i.d.または20mgの単回用量)またはメマンチンの多様な持続放出製剤(すなわち、22.5mgの単回用量で投与される、NPI-6601、NPI-6701、NPI-6801、NPI-6804、およびNPI-6990)の投与後、Gastro-Plusソフトウェアパッケージv.4.0.2によって予測されるような、24時間の期間に渡るメマンチン血漿濃度を示すグラフおよび表である。
【図3A】多様な持続放出メマンチンビーズ/カプセル製剤に関する溶解プロフィールを示すグラフおよび表である。実験溶解プロフィールは、媒質として水(pH=7)を用いて、USP IIパドルシステムから得られた。
【図3B】単純2ビーズ混成カプセル(13%の5001-6991および87%の5001-6992)の予測される溶解プロフィールを示すグラフおよび表である。
【図4】メマンチンの修正放出製剤およびメマンチンのIR製剤(ナメンダ)に関する溶解プロフィールを示すグラフである。
【図1】

【技術分野】
【0001】
発明の分野
本発明は、N-メチル-D-アスパラギン酸受容体(NMDAr)アンタゴニストを含有する組成物およびそのような組成物を用いるための方法に関する。
【背景技術】
【0002】
発明の背景
急性および慢性神経学的および神経精神病学的疾患は、世界中の死亡、身体障害、および経済的支出の主な原因に含まれる。これらの障害を処置する際の主な難問の1つは、正常および異常な神経機能の両方を制御する経路の間に高い度合いの相互作用があることである。
【0003】
N-メチル-D-アスパラギン酸(NMDA)受容体を含む、興奮性アミノ酸受容体は、脳における興奮性シナプス伝達(すなわちニューロンの刺激)の重要な仲介因子であり、正常および異常な中枢神経系(CNS)機能の両方の広範囲の局面に関与する。NMDA受容体およびこれに会合するカルシウム(Ca2+)透過性イオンチャネルは、脳および脊髄における一般的な興奮性神経伝達物質であるグルタミン酸、および共アゴニスト、グリシンによって活性化される。NMDA受容体(NMDAr)活性およびその結果のCa2+流入は、長期増強(学習および記憶に相互関連があるもの)に必要である。
【0004】
異常なグルタミン酸受容体活性が、多数のCNS関連状態に関連付けられてきており、これには例えば、抑うつおよび他の神経精神病学的状態、パーキンソン病、癲癇、疼痛、ALS(筋萎縮性側索硬化症またはルー・ゲーリック病)、およびハンチントン病が含まれる。このような状態において、上昇したレベルのグルタミン酸から生じるNMDA受容体の異常な活性化は、この受容体のイオンチャネルの持続した活性を導き(しばしば数ミリ秒ではなく数分間続く)、それによってCa2+の増加を可能にし得る。これは、患者に対して、症候性および神経破壊的効果の両方を引き起こす。
【0005】
メマンチンおよびアマンタジンなどの特定のNMDArアンタゴニストは、血液脳関門を容易に横断し、脳組織周囲の細胞外液および全身血清において、類似の濃度を達成する。理想的には、NMDArアンタゴニストは、衰弱させる副作用の非存在下で、疾患の症状または損傷効果を減少させるのに十分な濃度で存在すべきである。しかし、現在の剤形では、これらの薬剤は、比較的長い半減期を有するにもかかわらず、頻繁に投与する必要があり、かつ治療剤への最初の曝露に関連する副作用を回避するため、治療開始時に用量漸増を必要とする。これは、適切な患者コンプライアンスを達成する際の困難につながり、これは神経学的または神経精神障害に使用する治療様式の複雑な投薬スケジュールによってさらに増悪する。
【0006】
したがって、神経学的障害の進行を処置しかつ遅延させるには、よりよい方法および組成物が必要である。
【発明の概要】
【0007】
発明の概要
一般的に、本発明は、望ましくない副作用、特にCNS副作用を回避しつつ、根底にある疾患の症状または損傷効果を処置するために十分に多い量のNMDArアンタゴニストを被験体に送達するために投与される、薬学的組成物を提供する。これらの組成物を使用して、現在使用されているより低い頻度で(すなわち1日2回(b.i.d.)または1日3回(t.i.d.)に対して、1日1回(q.d.))、NMDArアンタゴニストを投与することも可能であり、患者のコンプライアンスおよび介護人の便宜が改善される。これらの組成物は、治療開始から治療的に有効な量でNMDArアンタゴニストを提供して、患者のコンプライアンスおよび順守をさらに改善し、かつより短い期間で、NMDArアンタゴニストの治療的に有効な定常状態濃度を達成可能であるため、特に有用である。この結果、有効性がより早期に示され、かつ時間が最も重要である疾患および状態に関して、これらの治療剤の有用性が増加する。さらに、本発明の組成物は、その設計のため、より高い用量のNMDArアンタゴニストが安全に投与されることを可能にし、やはり多様な徴候に対するこれらの作用剤(agent)の有用性を増加させる。このような組成物を作製し、投薬し、かつ用いるための方法も提供する。
【0008】
NMDArアンタゴニストは、望ましくは、望ましくない副作用を減少させつつ、NMDArアンタゴニストの治療的利点を最大限にするため、即時放出構成要素を伴うまたは伴わない、制御放出(controlled release)または延長放出(extended release)型で提供される。修正放出(modified release)構成要素(本明細書において、制御、延長または遅延放出構成要素と称される)の非存在下では、NMDArアンタゴニストは、数分から数時間の期間に渡って放出され、かつ体液内に輸送される。好ましい態様において、本発明の組成物は、NMDArアンタゴニスト、およびコーティングされた持続放出(sustained release)マトリックス、持続放出マトリックス、または持続放出ビーズマトリックスなどの持続放出構成要素を含有する。1つの例において、ポリマーマトリックス(例えばEudragit)、ヒドロキシプロピルメチルセルロース(HPMC)およびポリマーコーティング(例えばEudragit)を用いて、即時放出構成要素を伴わずに、メマンチン(例えば5〜80mg)を処方する。このような製剤を圧縮して固形錠剤または顆粒にして、かつOpadry(登録商標)またはSurelease(登録商標)などの制御放出物質でコーティングする。
【0009】
NMDArアンタゴニスト
NMDArアンタゴニストは、メマンチン(1-アミノ-3,5-ジメチルアダマンタン)、リマンタジン(1-(1-アミノエチル)アダマンタン)、またはアマンタジン(1-アミノ-アダマンタン)ならびに以下に記載する他のものなどのアミノアダマンチン誘導体であってもよい。
【0010】
賦形剤
製剤を産生するために用いられる賦形剤には、増量剤、潤滑剤、流動促進剤、および放出制御剤が含まれてもよい。多くのこのような物質は、"Remington: The Science and Practice of Pharmacy, Twentieth Edition," Lippincott Williams & Wilkins, Philadelphia, PAに見出され、かつ当業者に一般的に公知である。用いられる特定の賦形剤は、標的投薬頻度、薬剤放出および吸収の傾き、ならびに投与経路を含む、投与量の投与に関する要件によって決定されるであろう。1つの態様において、製剤はカゼイン塩を含有しない。
【0011】
剤形
NMDArアンタゴニストを、懸濁物、カプセル、錠剤、座薬、ローション、パッチ、またはデバイス(例えば皮下移植可能送達デバイスまたは吸入ポンプ)として処方してもよい。好ましい態様において、剤形は、例えばカプセルとして、経口投与用に提供される。
【0012】
放出プロフィール
本明細書記載の組成物は、NMDArアンタゴニストが、即時放出(IR)製剤のものよりも遅いインビトロ溶解プロフィールを有するように処方される。本明細書において用いられる場合、メマンチンの即時放出(IR)製剤は、現在市販されている5mgおよび10mg錠剤(すなわちForest Laboratories, Inc.のナメンダ(Namenda)、またはナメンダと実質的に同じ放出プロフィールを有する製剤)を意味し;かつアマンタジンの即時放出(IR)製剤は、現在市販されている100mg錠剤(すなわちEndo Pharmaceuticals, Inc.のシンメトレル、またはシンメトレルと実質的に同じ放出プロフィールを有する製剤)を意味する。これらの組成物は、即時放出、持続もしくは延長放出、遅延放出構成要素、またはその組み合わせを含有することも可能である。したがって、本発明の組成物は、放出されるNMDArアンタゴニストの画分が、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-10.9*t)未満であるように処方されてもよく、式中、tは時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。したがって、放出されるNMDArアンタゴニストの画分は、中性pH(例えば水または緩衝水溶液)または酸性(例えば0.1N HCl)溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いると、15分間で93%未満、かつ12時間で7.7%〜100%である。任意で、放出されるNMDArアンタゴニストの画分は、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-0.972*t)未満であるかまたはそれと等しくてもよく、式中、tは時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。任意で、放出されるNMDArアンタゴニストの画分は、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(-2.75 + 2.75*e(0.21*t))より大きいかまたはそれと等しく、かつl-e(-0.40*t)未満であるかまたはそれと等しくてもよく、式中、tは時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。したがって、放出されるNMDArアンタゴニストの画分は、中性pH(例えば水または緩衝水溶液)または酸性(例えば0.1N HCl)溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いると、1時間で0.1%〜62%、2時間で0.2%〜86%、6時間で0.6%〜100%、10時間で2.9%〜100%、かつ12時間で7.7%〜100%の間の範囲であることも可能である。任意で、放出されるNMDArアンタゴニストの画分は、中性pH(例えば水または緩衝水溶液)または酸性(例えば0.1N HCl)溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いると、1時間で0.6%〜33%、2時間で1.4%〜55%、6時間で6.9%〜91%、10時間で19.7%〜98%、かつ12時間で31%〜100%の間の範囲であってもよい。任意で、NMDA受容体アンタゴニストは、中性のpHを有する溶解媒質中、酸性(例えば0.1N HCl)溶解媒質中で測定した場合に、1時間で0.1%〜20%、2時間で5%〜30%、6時間で40%〜80%の間の範囲の、10時間で70%またはそれを超える(例えば70%〜90%)、かつ12時間で90%またはそれを超える(例えば90〜95%)放出プロフィールを有してもよい。例えば、メマンチンを含有する製剤は、中性pH(例えば水または緩衝水溶液)を有する溶解媒質中または酸性(例えば0.1N HCl)溶解媒質中、1時間で0〜60%または0.1〜20%、2時間で0〜86%または5〜30%、6時間で0.6〜100%または40〜80%、10時間で3〜100%または50%もしくはそれを超える(例えば50%〜90%)、かつ12時間で7.7〜100%の間の範囲の放出プロフィールを有してもよい。
【0013】
1つの態様において、NMDArアンタゴニストは、水中、37±0.5℃の温度で、50rpmのUSP II型(パドル)溶解システムを用いて得られるように、15分間で、25%、15%、10%、または5%未満;30分間で、50%、30%、25%、20%、15%、または10%未満、かつ16時間で、60%、65%、70%、75%、80%、85%、90%、95%より高いインビトロ溶解プロフィールを有する。望ましくは、NMDArアンタゴニストは、10時間で、1.2のpHを有する溶解媒質中、少なくとも65%、70%、75%、80%、85%、90%、または95%の溶解を有する。
【0014】
望ましくは、本明細書記載の組成物は、図2A〜2Cに示す溶解プロフィールと実質的に同一のインビトロプロフィールを有し、かつ実質的に一定の1日用量で被験体に投与された際、図2Dに示すものと実質的に同一の血清濃度プロフィールを達成する。
【0015】
インビボでの放出の初期速度
本明細書において用いられる場合、「C」は、患者試料(例えば血液、血清、および脳脊髄液)などの生物学的試料において、活性薬学的成分の濃度を指す。生物学的試料中の薬剤の濃度は、当技術分野において公知である、任意の標準的アッセイ法によって決定され得る。用語「Cmax」は、生物学的試料中の薬剤の所与の用量によって到達する最大濃度を指す。用語「Cmean」は、長期に渡る、試料中の薬剤の平均濃度を指す。CmaxおよびCmeanは、薬剤の投与に比較して特定の期間を指すようさらに定義されてもよい。特定の患者試料種において、最大濃度(「Cmax」)に到達するために必要な時間は、「Tmax」と称される。濃度の変化は、「dC」と称され、かつ規定した時間に渡る変化は「dC/dT」である。
【0016】
望ましくは、NMDArアンタゴニストは、0から即時放出(IR)製剤のTmaxの期間内の定義された期間に渡って、dC/dTとして測定される生物学的試料中の変化の速度およびdC/dT速度が、IR製剤(例えばメマンチンの市販されているIR製剤、ナメンダ)の速度の約80%、70%、60%、50%、40%、30%、20%、または10%未満であるように、同量のアンタゴニストのIR製剤に関して観察されるものより遅い速度で、被験体試料内に放出される。いくつかの態様において、dC/dT速度は、IR製剤の速度の約80%、70%、60%、50%、40%、30%、20%、または10%未満である。同様に、溶解研究において測定されるような、本発明由来のNMDArアンタゴニストの放出速度は、最初の1、2、4、6、8、10、または12時間に渡って、同じNMDArアンタゴニストのIR製剤の速度の80%、70%、60%、50%、40%、30%、20%、または10%未満である。
【0017】
好ましい態様において、非用量漸増の1日あたり2回または1日あたり1回型で、剤形を提供する。このような場合、時間の関数としての濃度の変化(dC/dT)が改変されるように、濃度の傾斜(またはTmax効果)を減少させて、薬剤の用量漸増の必要性を減少させるかまたは排除してもよい。dC/dTの減少は、例えば、比較的比例する方式で、Tmaxを増加させることによって、達成可能である。したがって、Tmax値の2倍増加は、ほぼ2の係数でdC/dTを減少させ得る。したがって、Tmaxの関連する遅延を伴い、即時放出(いわゆるIR)剤形よりも有意に減少した速度で放出されるように、NMDArアンタゴニストを提供することも可能である。24時間、16時間、8時間、4時間、2時間、または少なくとも1時間までのTmaxのシフトを提供するように、薬学的組成物を処方することも可能である。dC/dTの関連する減少は、ほぼ0.05、0.10、0.25、0.5または少なくとも0.8の係数によってもよい。特定の態様において、これは、NMDArアンタゴニストの30%、50%、75%、90%、または95%未満が、こうした投与の1時間以内に、循環系または神経系内に放出されることによって、達成される。
【0018】
任意で、修正放出製剤は、同じNMDArアンタゴニストの同じ投与量のIR製剤のものの75%、50%、40%、30%、20%または10%未満の初期(例えば投与2時間後〜投与4時間後)の傾きを有する血漿濃度曲線を示してもよい。所与の個体の正確な傾きは、用いるNMDArアンタゴニスト、送達する量、またはいくつかの活性薬学的作用剤、患者が食事をしたかもしくはしていないかを含む他の要因にしたがって、多様であろう。他の用量、例えば上述のものに関しては、傾きは、用量に直接関連して多様である。
【0019】
本明細書記載の持続放出製剤または投与法を用いて、NMDArアンタゴニストは、投与の最初の3日、5日、7日、9日、10日、12日、15日、または20日経過以内に、被験体において、治療的に有効な定常状態血漿濃度に到達する。例えば、本明細書記載の製剤は、実質的に一定の1日用量(例えば1日あたり、15mg〜80mgの間、好ましくは20mg〜65mg、かつより好ましくは20mg〜45mgの間の用量)で投与された際、用量漸増療法を用いた場合にこうした血漿濃度に到達するのに必要な時間のおよそ70%、60%、50%、40%、30%、またはそれ未満で、定常状態血漿濃度に到達し得る。
【0020】
Cmax減少、Tmax延長
本発明の好ましい態様において、NMDArアンタゴニストの少なくとも75%、90%、95%、97%、98%、99%または100%さえ、修正または延長放出剤形で提供され、かつこの組成物の被験体(例えばヒトなどの哺乳動物)への投与の際、NMDArアンタゴニストは、こうした投与のおよそ1、1.5、2時間後〜少なくとも6、9、12、18、21、24時間後に、およそ2.5、2、1.5、または1.0のCmax/Cmeanを有する。望ましい場合、NMDArアンタゴニストの放出は、単相または多相(例えば二相)であってもよい。望ましくは、NMDArアンタゴニストの99%、98%、95%、90%、85%、80%、70%、50%、または30%が、こうした投与の1時間以内では、延長放出剤形中に残っている。
【0021】
投薬頻度減少
本発明の組成物および方法はまた、投薬頻度の減少も可能にする。例えば、IR型で投薬した際に、通常、1日あたり2〜4回投与されるNMDArアンタゴニストを、本明細書記載の製剤を用いた場合は、被験体に1日あたり1回または2回提供することも可能である。いくつかの態様において、本明細書記載の組成物は、さらにより頻繁でなく、例えば2日おき、3日おき、毎週、または毎月投与される。
【0022】
非用量漸増
NMDArアンタゴニストの即時放出(IR)製剤は、典型的には、しばしば作用剤の治療量以下から開始して、用量漸増様式で投与される。薬学的組成物に関して、投薬制御または個別化は、医師によって管理され得るが、本明細書記載の組成物は、治療開始から、本質的に一定の治療的有効用量で投与可能であり、それによって、患者および介護人のコンプライアンス、順守、および便宜が改善される。
【0023】
さらに、本明細書記載の組成物は、同じ作用剤のIR製剤に関して観察されるものと同等かまたはそれより少ない副作用で、より高い用量のNMDArアンタゴニストの使用を可能にし、本明細書記載の徴候に対するNMDArアンタゴニストの有用性を増加させる。
【0024】
治療濃度および効果までの時間の減少
治療開始から、治療的有効用量の本明細書記載の組成物を投与することによって、より短い期間(例えば用量漸増療法のものより20%、30%、50%、70%、90%少ない期間)で作用剤の定常状態レベルへの到達が可能になり、したがって、抑うつ、激越、双極性障害、および薬剤依存、退薬、または耐容性を含む、疼痛および神経精神障害などのより急性の障害の処置が可能になる。
【0025】
処置を受け入れられる状態
本発明の組成物を使用して、NMDA受容体活性の脱制御と関連する症状、またはこうした活性の減少から利益を得るであろう状態を処置するかまたは減少させることも可能である。さらに、多くのNMDArアンタゴニストは、他の公知の活性(例えばアマンタジンのドーパミン作用活性、リマンタジンの抗ウイルス活性)を有する。本発明の組成物はまた、このような状態を有するかまたは有するリスクがある任意の被験体において、こうした活性と関連する状態を処置するか、予防するか、または減少させるためにも有用である。例示的な状態には、発作性障害、疼痛症候群、神経変性疾患(運動ニューロン病、ミエロパシー、神経根障害、および交感神経系の障害を含む)、痴呆、脳血管性の病態、運動障害、脳外傷(brain trauma)、脳神経障害、神経精神障害、および他疾患ニューロパシー(ウイルス関連ニューロパシー、糖尿病関連ニューロパシー、ギラン・バレー症候群、タンパク質異常血症、トランスサイレチン誘導性ニューロパシー、および手根管症候群を含む)が含まれる。
【0026】
投与の別経路
1つの態様において、本明細書記載の組成物を、NMDArアンタゴニストの経口投与用の錠剤もしくはカプセルとして、または経皮送達用のパッチとして処方する。または、これらの投与経路のために、組成物を別の方式で(例えば経口投与用の懸濁物として)調製してもよいし、または特に、他の投与経路、静脈内、局所、鼻内、局所下、経上皮、皮下、もしくは吸入送達用に調製してもよい。
【0027】
別に定義しない限り、本明細書に用いるすべての技術的および科学的用語は、本発明が属する技術分野の一般的な当業者に一般的に理解されるのと同じ意味を有する。本発明の実施または試験において、本明細書記載のものと類似かまたは同等の方法および材料を用いてもよいが、適切な方法および材料を以下に記載する。本明細書に言及するすべての刊行物、特許出願、特許、および他の参考文献は、その全体が参照により本明細書に組み入れられる。不一致の場合は、定義を含めた本明細書によって統制される。さらに、材料、方法、および例は、例示のみであり、かつ限定するとは意図されない。すべての割合およびパーセントは、別に明記しない限り重量による。
【0028】
本発明の他の特徴および利点は、以下の詳細な説明および特許請求の範囲から明らかであろう。
【0029】
発明の詳細な説明
一般的に、本発明は、治療的に有効であるために十分に高いが、NMDArアンタゴニストに関連する有害事象を回避するために十分に低い速度で、所望の期間に渡って、血清または血漿濃度を提供するため、延長または修正放出のために処方されたNMDArアンタゴニストを含有する薬学的組成物を特徴とする。薬剤放出の制御は、薬剤の生物学的利用能の度合いを維持しつつ、ピーク血漿レベルを減少させかつ遅延させるために、特に望ましい。したがって、即時放出製剤と通常関連する衰弱させる副作用を最小限にしつつ、治療レベルが達成される。さらに、ピーク血清または血漿レベルを得る時間が遅延され、かつ治療的有効血清または血漿レベルにある期間が延長される結果として、投与頻度が、例えば、1日1回または2回の投与量に減少し、それによって患者のコンプライアンスおよび順守が改善される。例えば、Tmaxをより長い時間にシフトさせ、それによって薬剤のdC/dTを減少させる、制御放出法の使用を通じて、NMDArアンタゴニストの投与と関連する精神病および認知障害を含む副作用の重症度および頻度を減少させ得る。薬剤のdC/dTを減少させると、Tmaxが増加するだけでなく、Tmaxでの薬剤濃度が減少し、かつCmax/Cmean比が減少して、所与の期間に渡って、処置されている被験体に、薬剤がより安定した量で提供され、適切な徴候に対する投与量の増加が可能になる。
【0030】
NMDArアンタゴニスト制御放出製剤の作製
被験体への投与に際して、規定の期間に渡り、標的とされる速度でNMDArアンタゴニストが放出されるようにする、1つまたは複数のさらなる成分と、所望の単数または複数のNMDArアンタゴニストを組み合わせることによって、本発明記載の薬学的組成物を調製する。放出プロフィール、すなわち所望の時間に渡るNMDArアンタゴニストの放出の度合いは、制御された条件下で、USP溶解装置を用いて、放出を測定することによって、所与の時間に関して、好適に決定可能である。好ましい放出プロフィールは、中性液中で、NMDArアンタゴニストの取り込み速度を遅延させる一方、治療的に有効なレベルのNMDArアンタゴニストを提供するものである。一般の当業者は、NMDArアンタゴニストおよび以下に記載する処方法を用いて、所望の放出プロフィールを持つ組み合わせを調製可能である。
【0031】
NMDArアンタゴニスト
本発明の方法および組成物において、任意のNMDArアンタゴニストが使用可能であり、特に本発明の組成物中で使用した際に非毒性であるものが使用可能である。用語「非毒性」は、相対的な意味で用いられ、かつヒトに対する投与に関して、米国食品医薬品局(「FDA」)によって認可されているか、または確立された規制基準および実施を順守して、ヒトもしくは動物への投与に関して、FDAもしくは任意の国の類似の監督官庁による認可を受け入れる余地がある、任意の物質を指すよう意図される。
【0032】
用語「NMDArアンタゴニスト」には、本明細書で用いられる場合、任意のアミノ−アダマンタン化合物が含まれ、これには例えば、メマンチン(1-アミノ-3,5-ジメチルアダマンタン)、リマンタジン(1-(1-アミノエチル)アダマンタン)、アマンタジン(1-アミノ-アダマンタン)、ならびにその薬学的に許容される塩が含まれる。メマンチンは、例えば、米国特許第3,391,142号、第5,891,885号、第5,919,826号、および第6,187,338号に記載される。アマンタジンは、例えば、米国特許第3,152,180号、第5,891,885号、第5,919,826号、および第6,187,338号に記載される。さらなるアミノアダマンタン化合物は、例えば、米国特許第4,346,112号、第5,061,703号、第5,334,618号、第6,444,702号、第6,620,845号、および第6,662,845号に記載される。これらの特許はすべて、参照により本明細書に組み入れられる。
【0033】
使用可能なさらなるNMDArアンタゴニストには、例えば、アミノシクロヘキサン(すなわちネラメキサン)、ケタミン、エリプロディル、イフェンプロディル、ジゾシルピン、レマセミド、イアモトリジン、リルゾール、アプチガネル、フェンシクリジン、フルピルチン、セルフォテル、フェルバメート、スペルミン、スペルミジン、レベモパミル、デキストロメトルファン((+)-3-ヒドロキシ-N-メチルモルフィナン)およびその代謝産物、デキストロルファン((+)-3-ヒドロキシ-N-メチルモルフィナン)、その薬学的に許容される塩、誘導体もしくはエステル、または前述のいずれかの代謝前駆体が含まれる。
【0034】
任意で、本発明のNMDArアンタゴニストはメマンチンであって、かつアマンタジンまたはデキストロメトルファンではなくてもよい。
【0035】
投薬、PK、およびTox
薬学的組成物を処方して、1〜200mg/日、1〜80mg/日、2〜80mg/日、5〜80mg/日、5〜65mg/日、5〜40mg/日、15〜45mg/日、または10〜20mg/日の間の範囲の量のメマンチン;15〜900mg/日、15〜800mg/日、15〜700mg/日、15〜600mg/日、15〜500mg/日、25〜500mg/日、15〜400mg/日、25〜300mg/日、100〜300mg/日、または100〜200mg/日の間の範囲の量のアマンタジン;1〜5000mg/日、1〜1000mg/日、および100〜800mg/日、または200〜500mg/日の間の範囲の量のデキストロメトルファンを提供してもよい。小児科用量は、典型的には、成人に関して決定されるものより低いであろう。
【0036】
表1は、メマンチン、アマンタジン、およびリマンタジンの例示的な薬物動態学的特性(例えばTmaxおよびT1/2)を示す。
【0037】
(表1)選択されるNMDArアンタゴニストに関するヒトにおける薬物動態およびTox

【0038】
賦形剤
「薬学的にまたは薬理学的に許容される」には、必要に応じて、動物、またはヒトに投与された際、不都合な、アレルギー性のまたは他の有害な反応を生じない、分子実体および組成物が含まれる。「薬学的に許容されるキャリアー」には、あらゆる溶媒、分散媒質、コーティング、抗細菌および抗真菌剤、等張性および吸収遅延剤等が含まれる。薬学的活性物質のためのこのような媒質および作用剤の使用は、当技術分野に周知である。任意の慣用的媒質または作用剤が活性成分と不適合である場合を除いて、治療組成物でのこのような媒質または作用剤の使用が意図される。補助的活性成分もまた、組成物内に取り込まれ得る。「薬学的に許容される塩」には、酸付加塩、および例えば塩酸もしくはリン酸などの無機酸、または酢酸、シュウ酸、酒石酸、マンデル酸等の有機酸で形成されるものが含まれる。遊離カルボキシル基で形成される塩はまた、例えば、ナトリウム、カリウム、アンモニウム、カルシウム、または水酸化鉄などの無機塩基、およびイソプロピルアミン、トリメチルアミン、ヒスチジン、プロカイン等の有機塩基に由来することも可能である。
【0039】
薬学的または薬理学的組成物の調製は、本開示を踏まえて、当業者に公知である。処方および投与の一般的な技術は、"Remington: The Science and Practice of Pharmacy, Twentieth Edition," Lippincott Williams & Wilkins, Philadelphia, PAに見出される。錠剤、カプセル、丸剤、粉末、顆粒、糖衣錠、ジェル、スラリー、軟膏、溶液、座薬、注射剤、吸入剤、およびエアロゾルが、このような製剤の例である。
【0040】
例えば、当技術分野に公知のさらなる方法を用いて、延長または修正放出経口製剤を調製してもよい。例えば、活性薬学的成分のいずれかまたは両方の適切な延長放出型は、マトリックス錠剤またはカプセル組成物であることも可能である。適切なマトリックス形成材料には、例えば、ワックス(例えばカルナバ、蜜蝋、パラフィン蝋、セレシン、セラック蝋、脂肪酸、および脂肪アルコール)、油、硬化油または脂肪(例えば硬化菜種油、ヒマシ油、牛脂、ヤシ油、および大豆油)、およびポリマー(例えばヒドロキシプロピルセルロース、ポリビニルピロリドン、ヒドロキシプロピルメチルセルロース、およびポリエチレングリコール)が含まれる。他の適切なマトリックス錠剤化材料は、他のキャリアー、および充填剤を伴う、微結晶性セルロース、粉末化セルロース、ヒドロキシプロピルセルロース、エチルセルロースである。錠剤はまた、顆粒、コーティングされた粉末、またはペレットも含有してもよい。錠剤はまた、多層であってもよい。活性成分が、顕著に異なる薬物動態学的プロフィールを有する場合、多層錠剤が特に好ましい。任意で、完成した錠剤は、コーティングされていてもまたはいなくてもよい。
【0041】
コーティング組成物は、典型的には、不溶性マトリックスポリマー(コーティング組成物のおよそ15〜85重量%)および水溶性材料(例えばコーティング組成物のおよそ15〜85重量%)を含有する。任意で、腸溶性ポリマー(コーティング組成物のおよそ1〜99重量%)を用いてもまたはこのようなポリマーが含まれてもよい。適切な水溶性材料には、ポリエチレングリコール、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ポリビニルアルコールなどのポリマー、ならびに糖(例えばラクトース、スクロース、フルクトース、マンニトール等)、塩(例えば塩化ナトリウム、塩化カリウム等)、有機酸(例えばフマル酸、コハク酸、乳酸、および酒石酸)、およびその混合物などの単量体材料が含まれる。適切な腸溶性ポリマーには、ヒドロキシプロピルメチルセルロース、酢酸コハク酸、ヒドロキシプロピルメチルセルロース、フタル酸、酢酸フタル酸ポリビニル、酢酸フタル酸セルロース、酢酸トリメリト酸セルロース、セラック、ゼイン、およびカルボキシル基を含有するポリメタクリレートが含まれる。
【0042】
主な構成要素もしくは構成要素混合物のガラス遷移温度またはコーティング組成物を適用するのに用いられる溶媒などのコーティング・ブレンドの特性にしたがって、コーティング組成物を可塑化してもよい。適切な可塑剤が、コーティング組成物の0〜50重量%添加されてもよいし、かつこのような可塑剤には、例えばフタル酸ジエチル、クエン酸エステル、ポリエチレングリコール、グリセロール、アセチル化グリセリド、アセチル化クエン酸エステル、セバシン酸ジブチル、およびヒマシ油が含まれてもよい。望ましい場合、コーティング組成物は充填剤を含んでもよい。充填剤の量は、コーティング組成物の総重量に基づいて、1重量%〜およそ99重量%であってもよく、かつ二酸化ケイ素、二酸化チタン、タルク、カオリン、アルミナ、デンプン、粉末化セルロース、MCC、またはポラクリリンカリウムなどの不溶性物質であってもよい。
【0043】
コーティング組成物を、有機溶媒もしくは水性溶媒またはその混合物中の溶液またはラテックスとして適用してもよい。溶液を適用する場合、溶媒は、溶解される固体の総重量に基づいて、およそ25〜99重量%の量で存在してもよい。適切な溶媒は、水、低次アルコール、低次塩素化炭化水素、ケトン、またはその混合物である。ラテックスを適用する場合、溶媒は、ラテックス中のポリマー性材料の量に基づいて、およそ25〜97重量%の量で存在する。溶媒は、主に水であってもよい。
【0044】
任意の以下の賦形剤またはその組み合わせを用いて、NMDArアンタゴニストを処方してもよい。

【0045】
本明細書記載の薬学的組成物にはまた、溶媒、分散媒質、コーティング、抗細菌剤および抗真菌剤、等張性および吸収遅延剤などのキャリアーが含まれてもよい。薬学的活性物質用のこのような媒質および作用剤の使用は、当技術分野に周知である。薬学的に許容される塩、例えば、塩酸、臭化水素酸、リン酸、または硫酸などの無機酸の塩、ならびに酢酸、プロピオン酸、マロン酸、または安息香酸などの有機酸の塩もまた、組成物中に使用可能である。組成物はまた、水、生理食塩水、グリセロール、およびエタノールなどの液体、ならびに湿潤剤、乳化剤、またはpH緩衝剤などの物質もまた含有してもよい。米国特許第5,422,120号、WO 95/13796、WO 91/14445、またはEP 524,968 Blに記載されるものなどのリポソームもまた、キャリアーとして使用可能である。
【0046】
修正または延長放出製剤を調製するための方法
NMDArアンタゴニストが延長放出製剤において提供される、本明細書記載の組成物を調製するのに適した方法には、米国特許第4,606,909号(参照により本明細書に組み入れられる)に記載されるものが含まれる。この参考文献は、多数の個々にコーティングされたかまたはマイクロカプセル化された単位が、被験体の胃において、製剤(例えば丸剤または錠剤)の崩壊に際して利用可能になる、多数単位の制御放出製剤を記載する(例えば、第3欄、第26行から第5欄、第10行および第6欄、第29行から第9欄、第16行を参照されたい)。これらの個々にコーティングされたかまたはマイクロカプセル化された単位は、各々、難溶性活性物質の粒子を含有する、断面的に実質的に均質なコアを含有し、コアは、胃の条件に実質的に耐性であるが胃腸管で一般的な条件下では侵食可能なコーティング剤で、コーティングされている。
【0047】
本発明の組成物は、また、例えば、米国特許第4,769,027号に開示される方法を用いて、処方されてもよい。したがって、延長放出製剤は、薬学的に許容される材料(例えば糖/デンプン、塩、およびワックス)の小球(prill)を伴い、NMDArアンタゴニストを含有する透水性ポリマーマトリックスでコーティングされ、かつ次に、内部に分散された水溶性微粒子孔形成物質を含有する、透水性フィルムでオーバーコーティングされていてもよい。
【0048】
生体適合性、生体分解性微小カプセル送達システムを伴い、米国特許第4,897,268号に記載されるように、NMDArアンタゴニスト組成物をさらに調製してもよい。したがって、例えば異なる速度で生体分解する異なるコポリマー賦形剤において個々にメマンチン量をマイクロカプセル化することによって得られる、フリーフロー球状粒子のブレンドを含有する組成物として、NMDArアンタゴニストを処方し、それによって、あらかじめ決定された速度で、循環内にメマンチンを放出してもよい。これらの粒子の量は、コア活性成分が、投与後迅速に放出され、かつそれによって、最初の期間、活性成分を送達するようなコポリマー賦形剤のものであってもよい。第二の量の粒子は、第一の量の送達が減少し始めたときに、カプセル化された成分の送達が開始されるような種類の賦形剤のものである。第三の量の成分は、第二の量の送達が減少し始めたときに送達開始を生じる、さらに異なる賦形剤でカプセル化されていてもよい。送達速度は、例えば、ポリ(D,L-ラクチド−コ−グリコリド)カプセル化におけるラクチド/グリコリド比を変化させることによって、改変させてもよい。使用可能な他のポリマーには、ポリアセタールポリマー、ポリオルトエステル、ポリエステルアミド、ポリカプロラクトンおよびそのコポリマー、ポリカーボネート、ポリヒドロキシブテレートおよびそのコポリマー、ポリマレアミド、コポリアキサレートおよび多糖が含まれる。
【0049】
または、多層制御放出薬学的剤形を特徴とする、米国特許第5,395,626号に記載されるように、組成物を調製してもよい。剤形は、各々が、NMDArアンタゴニストを含有するコアに関して、多層を有し、それによって、薬剤含有コアおよび少なくとも1つの他の薬剤活性層が、制御放出障壁層でオーバーコーティングされ、したがって、多層コーティング粒子からの水溶性薬剤の少なくとも2つの制御放出層を提供する、複数のコーティングされた粒子を含有する。
【0050】
放出プロフィール(溶解速度)
上述のように、NMDArアンタゴニストは、修正または延長放出型で提供され得る。延長または修正薬剤放出は、一般的に、例えば酵素またはpHに応じたプロセスによって、コーティングもしくはマトリックスを通じた分散によるか、またはコーティングもしくはマトリックスの侵食によるかのいずれかで、制御される。NMDArアンタゴニストは、本明細書に記載されるような延長もしくは修正放出のため、または当技術分野の標準的技術を用いて、処方可能である。1つの例において、NMDArアンタゴニストの少なくとも50%、75%、90%、95%、96%、97%、98%、99%、または99%を超えてさえも、延長放出剤形において提供される。
【0051】
任意で、本明細書記載の組成物は、図2A〜2Cに示す溶解プロフィールと実質的に同一のインビトロプロフィールを有してもよく、かつ被験体への投与に際して、実質的に一定の1日用量で、図2Dに示すものと実質的に同一の血清濃度プロフィールを達成してもよい。多様な溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて、本発明の組成物の溶解プロフィールを決定することも可能である。1つの例において、放出画分は、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-10.9*t)未満である。別の例において、放出画分は、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-0.972*t)未満であるかまたはそれと等しい。どちらの例でも、用語「t」は時間単位での時間であり、かつtはゼロより大きく、かつ17と等しいかまたはそれより小さい。したがって、NMDArアンタゴニストは、USP 2型(パドル)溶解を用いると、1時間で0.1%〜62%、2時間で0.2%〜86%、6時間で0.6%〜100%、10時間で2.9%〜100%、かつ12時間で7.7%〜100%の間の範囲のインビトロ溶解プロフィールを有することも可能である。任意で、放出プロフィールは、1時間で0.1%〜20%、2時間で5%〜30%、6時間で40%〜80%、10時間で50%〜90%、かつ12時間で90%〜95%の間の範囲であってもよい。望ましくは、NMDArアンタゴニストは、中性pHを持つ溶液(例えば水)中で、酸性溶解媒質中の溶解プロフィールと実質的に同じインビトロ溶解プロフィールを有する(図2A〜2Cを参照されたい)。
【0052】
1つの態様において、NMDArアンタゴニストは、水中、37±0.5℃の温度で、50rpmのUSP II型(パドル)溶解システムを用いて得られるように、15分間で、15%、10%、または5%未満、30分間で、25%、20%、15%、または10%未満、かつ16時間で、60%より高いインビトロ溶解プロフィールを有する。望ましくは、NMDArアンタゴニストは、10時間で、1.2のpHを有する溶解媒質中、少なくとも65%、70%、75%、80%、85%、90%、または95%の溶解を有する。
【0053】
インビボ初期速度、Tmax遅延、Cmax/Cmean減少
即時放出製剤を含有してもまたは含有しなくてもよい修正放出製剤として、NMDArアンタゴニストを提供する。望ましい場合、Tmaxの関連する遅延を伴い、即時放出(IR)剤形よりも有意に減少した速度で放出されるように、NMDArアンタゴニストを処方してもよい。24時間、16時間、8時間、4時間、2時間、または少なくとも1時間までのTmaxのシフトを提供するように、薬学的組成物を処方することも可能である。dC/dTの関連する減少は、ほぼ0.05、0.10、0.25、0.5または少なくとも0.8の係数によってもよい。さらに、被験体内にNMDArアンタゴニストを導入したおよそ2時間後〜少なくとも8時間後、およそ2またはそれ未満のCmax/Cmeanを生じる速度で放出されるように、NMDArアンタゴニストを提供してもよい。任意で、持続放出製剤は、同じNMDArアンタゴニストの同じ投与量のIR製剤のものの75%、50%、40%、30%、20%または10%未満の初期(例えば投与0、1、2時間後〜投与4、6、8時間後)の傾きを有する血漿濃度曲線を示してもよい。所与の個体の正確な傾きは、用いるNMDArアンタゴニスト、または患者が食事をしたかもしくはしていないかを含む他の要因にしたがって、多様であろう。他の用量、例えば上述のものに関しては、傾きは、用量に直接関連して多様である。血漿濃度の初期の傾きの決定は、例えば参照により本明細書に組み入れられる、米国特許第6,913,768号に記載される。
【0054】
したがって、被験体(例えばヒトなどの哺乳動物)への投与に際して、NMDArアンタゴニストは、こうした投与のおよそ1、1.5、2時間後〜少なくとも6、8、9、12、18、21、24時間後に、およそ2.5、2、1.5、または1.0のCmax/Cmeanを有する。所望の場合、NMDArアンタゴニストの放出は、単相または多相(例えば二相)であってもよい。一般の当業者は、NMDArアンタゴニストおよび当技術分野に公知であるかまたは以下に記載する処方法を用いて、所望の放出プロフィールを持つ組成物を調製可能である。
【0055】
投薬頻度および用量漸増
本発明にしたがって、こうした状態を有するかまたは有するリスクがある被験体(例えばヒト)に、本明細書記載の任意の組成物を投与する(例えば1日1回、2日おき、3日おき、毎週、または毎月)。NMDArアンタゴニストの即時製剤は、典型的には、用量漸増方式で投与されるが、本明細書記載の組成物は、本質的に、設定期間に渡って、一定の治療的に有効な用量で投与可能である。例えば、メマンチンの持続放出製剤を含有する組成物を、メマンチン10〜300mg、10〜200mg、10〜100mg、または10〜50mg(例えば10mg、11.25mg、12.5mg、15mg、20mg、22.5mg、25mg、30mg、33.75mg、37.5mg、40mg、45mg、50mg、60mg、65mg、67.5mg、70mg、75mg、80mg、120mg、180mg、240mgまたは300mg)を含有する単位用量で、1日2回、1日1回、2日ごとに1回、または3日ごとに1回投与してもよい。
【0056】
1つの態様において、本明細書記載の方法を用いて組成物を調製し、このような組成物は、メマンチンまたはアマンタジンおよび放出修正賦形剤を含む。賦形剤は、メマンチン(例えばナメンダ)またはアマンタジン(例えばシンメトレル)の即時放出(IR)製剤に比較して、メマンチンまたはアマンタジンと関連する急性毒性を改善するかまたは減少させるのに十分な量で存在する。このような組成物の使用は、このような作用剤の投与の安全性を増加させ、これらの薬学的産物の現在入手可能な型と比較した際、NMDArアンタゴニストの類似であるかまたはより高い用量を用いて、投薬頻度の減少を可能にする。
【0057】
治療濃度および効果までの時間の減少
メマンチンの即時放出(IR)製剤(例えばナメンダ)は、典型的には、低用量で投与され(例えば5mg/日)、かつ治療的に有効な定常状態血清濃度に到達するまで、ゆっくり時間をかけて、増加した頻度および用量で進行性に投与される。FDAが認可した製造者のラベルにしたがうと、メマンチンの即時放出(IR)製剤であるナメンダは、まず、1日あたり5mgの用量で、被験体に投与される。1週間の順応期間の後、被験体にこの用量を1日2回投与する。次に、1日あたり5mgおよび10mgの投薬で被験体に投与し、かつ最終的に10mgのナメンダを1日2回投与する。図2Dは、Simulations Plusの薬物動態学的ソフトウェア、GastroPlusによって予測されるような、各日の平均血清濃度を示す。この投薬療法を用いると、治療開始30日以内に、治療的に有効な定常状態血清濃度を達成可能である。しかし、(22.5mgのメマンチン)を含む修正放出製剤を用いると、用量漸増療法を用いずに、実質的により速やかに治療的に有効な定常状態血清濃度が達成可能である。図2Dに示すように、このような濃度は、治療開始の13日以内に達成されると予測される。さらに、持続放出製剤に関する各吸収期間中の傾きは、ナメンダの傾きより少ない(すなわちそれほど急でない)。したがって、投与される用量が、即時放出製剤のものより高い場合であっても、持続放出製剤のdC/dTは、即時放出製剤に比較して減少する。このモデルに基づいて、メマンチンの持続放出製剤は、治療開始から、かつ処置期間全体に渡って、ほぼ完全強度用量である量(または治療的に有効な用量に効果的に到達する量)で、被験体に投与可能である。したがって、用量漸増は必要とされないであろう。
【0058】
したがって、1つの態様において、本明細書記載の方法を用いて組成物を調製し、このような組成物は、同じ被験体にあらかじめ治療量以下の同じ活性剤(すなわちメマンチンまたはアマンタジン)を投与することなく、被験体に投与するための、治療的に有効な量のメマンチンまたはアマンタジンおよび賦形剤を含む。具体的には、治療的に有効な量のメマンチンが典型的には1日あたり20mgである、アルツハイマー病などの徴候に対して、被験体へのメマンチンの投与を、治療量以下(例えばナメンダに関して、FDAが認可する製造者のラベルに現在示されるように、1日あたり5mg)でなく、1日あたり22.5mgまたはそれより多い量で開始する。
【0059】
本発明の主題による被験体の処置を、当技術分野に公知の方法を用いて監視することも可能である。組成物を用いた処置の有効性は、好ましくは、定量的な方式で被験体の症状を調べることによって、例えば状態の症状もしくは損傷効果の頻度もしくは重症度の減少、または症状悪化を持ちこたえる時間の増加に注目することによって、評価される。成功する処置において、被験体の状態は、改善されているであろう(すなわち、症状もしくは損傷効果の頻度もしくは重症度が減少しているか、または進行を持ちこたえる時間が増加しているであろう)。先のパラグラフに記載するモデルでは、用量漸増アプローチよりも、25%、40%、50%、60%、70%、75%、80%少ない時間で、NMDArアンタゴニストの定常状態(および有効)濃度に到達する。
【0060】
別の態様において、本明細書記載の方法を用いて組成物を調製し、このような組成物は、メマンチンまたはアマンタジンおよび放出修正賦形剤を含み、賦形剤は、ナメンダなどのメマンチンの、またはシンメトレルなどのアマンタジンの即時放出(IR)製剤に比較して、メマンチンまたはアマンタジンと関連する用量依存性毒性を改善するかまたは減少させるのに十分な量で存在する。これらの組成物の使用は、これらの作用剤のより安全な投与を可能にし、かつ現在入手可能な型のメマンチン(用量あたり5mgおよび10mg〜1日あたり20mg)およびアマンタジン(漸増を伴い、1日あたり100mg〜300mg)の有用な範囲を超えて、適切な徴候に対して、より高レベルの安全な使用を可能にしさえする。
【0061】
処置に適した徴候
本発明にしたがった処置に適した状態には、発作性障害、疼痛症候群、神経変性疾患(運動ニューロン病、ミエロパシー、神経根障害、および交感神経系の障害)、痴呆、脳血管性の病態、運動障害、脳外傷、脳神経障害、神経精神障害、および他疾患ニューロパシー(ウイルス関連ニューロパシー、糖尿病関連ニューロパシー、ギラン・バレー症候群、タンパク質異常血症、トランスサイレチン誘導性ニューロパシー、および手根管症候群を含む)が含まれる。
【0062】
本明細書において、発作性障害には、複雑部分発作、単純部分発作、続発性全身化を伴う部分発作、全身性発作(欠神、大発作(強直間代性)、癲癇重積症、強直、無緊張、ミオクローヌスを含む)、新生児および幼児痙攣、薬剤誘導性発作、外傷誘導性発作、および熱性発作、ならびに若年性ミオクローヌス癲癇、レノックス・ガストー、内側側頭葉癲癇、夜間前頭葉癲癇、精神遅滞を伴う進行性癲癇、および進行性ミオクローヌス癲癇などのさらなる特異的癲癇症候群、ならびにCNS腫瘤病変に関連する発作が含まれる。
【0063】
疼痛症候群には、例えば、頭痛(例えば偏頭痛、緊張性、および群発性)、急性疼痛、慢性疼痛、ニューロパシー性疼痛、侵害受容性疼痛、中心性疼痛および炎症性疼痛、薬剤誘導性ニューロパシー性疼痛、灼熱痛、複合性局所疼痛症候群I型およびII型、ならびに反射性交感神経性ジストロフィ(RSDS)が含まれる。
【0064】
神経変性疾患には、アルツハイマー病、パーキンソン病、多発性硬化症、ハンチントン病、ALS、脊髄性筋萎縮症、筋ジストロフィー、プリオン関連疾患、小脳性運動失調症、フリードリッヒ運動失調症、SCA、ウィルソン病、RP、ギラン・バレー症候群、副腎脳白質ジストロフィ症、メンケス症候群、皮質下梗塞を伴った常染色体優性脳動脈症(CADASIL)、シャルコー・マリー・ツース病、神経線維腫症、フォンヒッペル・リンダウ病、脆弱X染色体、痙性対麻痺、結節性硬化症コンプレックス、ワーデンバーグ症候群、脊髄運動萎縮症、テイ・サックス病、サンドホフ病、家族性痙性対麻痺、ミエロパシー、神経根障害、外傷、放射線、薬剤および感染に関連する脳症、ならびに交感神経系の障害(例えばシャイ・ドレーガー(家族性自律神経障害)、糖尿病性ニューロパシー、薬剤誘導性およびアルコール性ニューロパシー)が含まれる。
【0065】
痴呆には、アルツハイマー病、パーキンソン病、ピック病、前頭側頭痴呆、血管性痴呆、正常圧水頭症、ハンチントン病、およびMCIが含まれる。
【0066】
本発明にしたがった処置を受け入れられる脳血管性の病態には、脳血管疾患および脳卒中(例えば血栓性、塞栓性、血栓塞栓性、出血性(AVMおよび漿果状動脈瘤を含む)、静脈収縮性、および静脈性)が含まれる。
【0067】
運動障害に含まれるのは、パーキンソン病、ジストニア、良性本態性振戦、遅発性ジストニア、遅発性ジスキネジーおよびトゥーレット症候群である。
【0068】
本明細書に用いられる場合の脳外傷には、外傷性脳および脊髄傷害、ならびに放射線による脳傷害が含まれる。
【0069】
脳神経障害には、三叉神経ニューロパシー、三叉神経神経痛、メニエール症候群、舌咽神経痛、嚥下困難、音声障害、脳神経麻痺およびベル麻痺が含まれる。
【0070】
神経精神障害には、パニック症候群、一般的不安障害、すべての種類の恐怖症症候群、躁病、躁うつ性疾病、軽躁病、単極性抑うつ、抑うつ、ストレス障害、PTSD、身体表現性障害、人格障害、精神病、および統合失調症、ならびに薬剤依存/耽溺(例えばアルコール、精神興奮薬(例えばクラック、コカイン、スピード、メス(meth))、オピオイド、およびニコチン)、ならびに薬剤誘導性精神障害が含まれる。
【0071】
本明細書記載の組成物および方法で処置可能な他疾患ニューロパシーには、ギラン・バレー、糖尿病関連ニューロパシー、タンパク質異常血症、トランスサイレチン誘導性ニューロパシー、HIV、ヘルペスウイルス(帯状疱疹を含む)または他のウイルス感染に関連するニューロパシー、ライム病に関連するニューロパシー、手根管症候群、足根管症候群、アミロイド誘導性ニューロパシー、ハンセン病ニューロパシー、ベル麻痺、圧迫性ニューロパシー、サルコイドーシス誘導性ニューロパシー、頭側多発性神経炎、重金属誘導性ニューロパシー、遷移金属誘導性ニューロパシー、薬剤誘導性ニューロパシー、髄膜炎後症候群、ポリオ後症候群、プリオン病、および放射線関連ニューロパシー症候群が含まれる。
【0072】
本発明を用いた処置を受け入れられる他の疾患には、疲労症候群(例えば慢性疲労症候群および線維筋痛)、運動失調症候群(ataxic syndrome)、オリーブ橋小脳変性、線条体黒質変性、および軸索性脳損傷(axonic brain damage)が含まれる。
【0073】
本組成物中のNMDArアンタゴニストは、即時放出製剤よりも短い期間で(例えば、投与後最初の5日、7日、9日、10日、12日、15日、または20日経過以内に)、治療的に有効な定常状態に到達するため、本発明は、抑うつ、激越、不安、大発作などの発作性障害、癲癇重積症、偏頭痛疼痛処置および予防、アルツハイマー病、パーキンソン病、ならびに外傷性脳および脊髄傷害などの神経精神障害の処置に特に有用である。
【0074】
また、本発明によって可能になる、より高い用量は、アルツハイマー病、パーキンソン病、および血管性痴呆を含む痴呆、頭痛および偏頭痛を含む疼痛症候群、発作性障害、運動障害、ならびに脳外傷に特に重要であると期待される。
【0075】
さらに、治療開始から、治療的に有効な量で、1日あたり1回またはそれより低い頻度の投与で送達されるように開発された、提供される剤形の使用が、容易かつ簡便であることは、アルツハイマー病およびパーキンソン病を含む痴呆、発作性障害、疼痛症候群、ならびに脳血管性の病態の処置に価値がある。
【0076】
別の特定の投与経路のための製剤
特定の種類の送達のため、薬学的組成物を最適化してもよい。例えば、当技術分野に周知の薬学的に許容されるキャリアーを用いて、経口送達のための薬学的組成物を処方する。このキャリアーは、組成物において、作用剤が、被験体による経口摂取のため、例えば錠剤、丸剤、カプセル、溶液、懸濁物、持続放出製剤;粉末、液体またはジェルとして処方されることを可能にする。
【0077】
NMDArアンタゴニストはまた、加圧パック、ネブライザー、または乾燥粉末吸入装置からのエアロゾルスプレー調製物において送達可能である。ネブライザーにおいて使用可能な適切な噴霧剤には、例えば、ジクロロジフルオロ-メタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタンおよび二酸化炭素が含まれる。加圧エアロゾルの場合、化合物の制御された量を送達するように、バルブを提供することによって、投与量を決定することも可能である。
【0078】
吸入または吹送用の組成物には、薬学的に許容される、水性もしくは有機溶媒、またはその混合物中の溶液および懸濁物、ならびに粉末が含まれる。液体または固体組成物は、上述のような適切な薬学的に許容される賦形剤を含有してもよい。好ましくは、組成物は、局所または全身性効果のため、経口、鼻内または呼吸経路によって投与される。好ましくは薬学的に許容される無菌溶媒中の組成物を、不活性ガスの使用によって噴霧してもよい。噴霧される溶液を、噴霧化デバイスから直接呼吸してもよいし、または噴霧化デバイスをフェイス・マスク、テントまたは断続的陽圧呼吸機に取り付けてもよい。適切な方式で製剤を送達するデバイスから、溶液、懸濁物または粉末組成物を、好ましくは経口または鼻投与してもよい。
【0079】
いくつかの態様において、例えば、CNSへの嗅覚路を通じた活性剤の輸送を可能にする吸入よりも、篩板に鼻内送達して、かつ全身投与を減少させてもよい。この投与経路に一般的に用いられるデバイスは、米国特許第6,715,485号に含まれる。この経路を介して送達される組成物は、CNS投薬の増加または体全体の負荷の減少を可能にし、特定の薬剤に関連する全身性毒性リスクを減少させ得る。
【0080】
他の投与様式に適したさらなる製剤には、直腸カプセルまたは座薬が含まれる。座薬に関しては、伝統的結合剤およびキャリアーには、例えば、ポリアルキレングリコールまたはトリグリセリドが含まれてもよく;このような座薬は、0.5%〜10%、好ましくは1%〜2%の範囲の活性成分を含有する混合物から形成され得る。
【0081】
連続長期送達、例えば30日、60日、90日、180日、または1年までの送達を提供する、容器中の送達のための組成物を、任意で処方してもよい。例えば、チタンなどの生体適合性材料の容器を提供してもよい。長期送達製剤は、患者コンプライアンスの改善を確実にし、かつ組成物の安定性を増強するため、慢性状態の被験体で特に有用である。
【0082】
任意で、すべて参照により本明細書に組み入れられる、米国特許第6,919,373号、第6,923,800号、第6,929,803号、第6,939,556号、および第6,930,128号に記載される、OROS(登録商標)技術を用いて、NMDA受容体アンタゴニストを調製してもよい。この技術は、24時間までの正確な制御放出薬剤送達を提供するため、浸透を使用し、かつほとんど溶解性でないかまたは非常に溶解性である薬剤を含む、ある範囲の化合物で、この技術が使用可能である。OROS(登録商標)技術を用いて、多量の薬剤用量を送達可能であり、多量の薬剤を装填する要件を満たす。特定の領域の胃腸管を標的とすることによって、OROS(登録商標)技術は、より効率的な薬剤吸収および増強された生物学的利用能を提供し得る。OROS(登録商標)の浸透駆動力および放出時間までの薬剤の保護から、しばしば胃のpHおよび運動性によって引き起こされる、薬剤吸収および代謝の変動性が排除される。
【0083】
連続長期送達用の製剤は、例えば、米国特許第6,797,283号;第6,764,697号;第6,635,268号および第6,648,083号に提供される。
【0084】
所望の場合、構成要素をキット中に提供してもよい。キットにはさらに、キットを用いるための使用説明書が含まれてもよい。
【0085】
修正放出製剤を作製するためのさらなる方法
修正放出製剤を作製するためのさらなる方法は、例えば、すべて参照により本明細書に組み入れられる、米国特許第5,422,123号、第5,601,845号、第5,912,013号、および第6,194,000号に記載される。
【0086】
または、本発明の組成物を経皮投与してもよい。一般的に、例えば、その全体が参照により本明細書に組み入れられる、米国特許第5,186,938号および第6,183,770号、第4,861,800号、第6,743,211号、第6,945,952号、第4,284,444号、ならびにWO 89/09051に記載されるものを含む、当技術分野にやはり公知の方法を用いて、経皮パッチ中の送達用の調製を行ってもよい。パッチは、吸収に問題を有する薬剤では、特に有用な態様である。12時間、24時間、3日間、および7日間の期間に渡って、皮膚浸透性活性成分の放出を制御するパッチを作製してもよい。1つの例において、不揮発性液に、NMDArアンタゴニストの2倍過剰1日量を入れる。本明細書で使用する作用剤の量を考慮すると、好ましい放出は、12〜72時間であろう。
【0087】
この型の経皮調製物は、1%〜50%の活性成分を含有するであろう。本発明の組成物は、粘性不揮発性液の形で提供される。好ましくは、NMDArアンタゴニストは、少なくとも10-9モル/cm2/時間の皮膚浸透速度を有するであろう。少なくとも5%の活性物質が、24時間の期間内に皮膚を通じて流動するであろう。当技術分野の標準法によって、皮膚を通じた特定の製剤の浸透を測定してもよい(例えば、Franz et al., J. Invest. Derm. 64:194-195 (1975))。パッチの形のNMDArアンタゴニストの提供は、これらの作用剤が比較的高い皮膚流動を有することを考慮すると、有用である。
【0088】
いくつかの態様において、例えば、CNSへの嗅覚路を通じた活性剤の輸送を可能にする吸入よりも、鼻内、頬側、または舌下経路を介して脳まで、組成物を送達し、かつ全身投与を減少させてもよい。この投与経路に一般的に用いられるデバイスは、米国特許第6,715,485号に含まれる。この経路を介して送達される組成物は、CNS投薬の増加または体全体の負荷の減少を可能にし、特定の薬剤に関連する全身性毒性リスクを減少させ得る。
【0089】
例えば米国特許第3,992,518号;第5,660,848号;および第5,756,115号に記載されるものなどの、当技術分野に公知の方法を用いて、皮下移植可能デバイスにおける送達用の薬学的組成物の調製を行ってもよい。
【0090】
本明細書記載の処方および方法を用いて、本発明者らは、修正放出プロフィールを有するNMDArアンタゴニスト(例えばメマンチンおよびアマンタジン)の多くの製剤(50を超える)を産生した。例示的な製剤を実施例に提供する。
【0091】
本発明は、以下の限定されない実施例に例示されるであろう。
【0092】
実施例
実施例1
インビトロのアミノアダマンタンに関する放出プロフィールの測定
50rpmの速度で、USP II型装置によって、アミノアダマンタンの放出に関して、アミノアダマンタンを含有する組成物を分析した。用いた溶解媒質は、水、0.1N HCl、または2時間の時点でリン酸緩衝液を用いてpH 6.8に調整された0.1N HClであった。溶解媒質を37±0.5℃に平衡化させた。
【0093】
アマンタジンのUSP参照アッセイ法を用いて、本明細書で調製した組成物から放出されるメマンチンの画分を測定した。簡潔には、(所与の時点で溶解装置から)0.6mLの試料を15mLの培養試験管に入れた。1.6mLの0.1%ブロモクレゾールパープル(酢酸中)を添加し、かつ5秒間ボルテックスで撹拌した。混合物をおよそ5分間静置した。3mLのクロロホルムを添加し、かつ5秒間ボルテックスで撹拌した。次に溶液を5分間遠心分離した(速度50rpm)。使い捨てピペットで最上層を移した。試料を1cmフローセルに抜き取り、かつ37℃、408nmで吸光度を測定し、かつ同じアミノアダマンタンの公知の量を用いて用意した標準曲線に対して比較した。決定した量を、試料の溶解時間に対してプロットした。
【0094】
実施例2
腸溶性コーティングでコーティングされる、メマンチン含有コアの調製
以下のように、かつ例えば米国特許第4,606,909号に記載されるように、メマンチン含有コアを調製する。0.97kgのメマンチン、0.2kgのラウリル硫酸ナトリウム、0.5kgの微結晶性セルロース、5.93kgのサッカロース粉末、および2.4kgのタルクを用いて、コア(24%タルクを含有する)を調製する。0.5mmふるいを用いて粉砕装置を通過させることによって、メマンチンおよびラウリル硫酸ナトリウムを同時粉砕する。粉砕した混合物をプラネットミキサー中で微結晶性セルロース、サッカロース、およびタルクと混合する。生じた混合物10kgを0.8kgの精製水で湿らせ、かつ混合物がわずかにごつごつするまでプラネットミキサー中で混合する。0.5mmふるいを通じて、湿った混合物を押し出す。ふるいを通過する最初の数キログラムの押出物は粉末状であり、かつこれを再度押し出す。生じた押出物は、紐を形成し、10〜30cmの長さで切れる。2kgの押し出された紐を、marumerizer(商標)中でコンパクトな形状のコアに形成し、かつ生じたコンパクトな形状のコアを、流動層乾燥機中で乾燥させ、かつ分離装置(上部のふるい(0.71mm)および底部のふるい(0.46mm))を通じてふるいにかける。同じ技術を用いて、0.97kgのメマンチン、0.2kgのラウリル硫酸ナトリウム、1.0kgの微結晶性セルロース、6.83kgのサッカロース粉末、および1.0kgのタルクを用いて、コア(10%タルクを含有する)を調製する。
【0095】
それぞれ24%タルクおよび10%タルクを含有するコアに関して、pH 7.5でメマンチンの放出を測定する。24%から10%にタルク含量を減少させると、コアから放出されるメマンチンの重量が減少する。
【0096】
9.0kgのEudragit(商標)S 12,5を、0.135kgのクエン酸アセチルトリブチル、0.9kgのタルク、および7.965kgのイソプロパノールと一緒にホモジナイズすることによって、メマンチンの放出をさらに遅延させる腸溶性コーティング懸濁物を調製する。10%タルクを含有する10kgの上述のコアを、流動層中で、このコーティング懸濁物4.167kgでコーティングし、かつ生じたペレットをタルカムで覆う。薬学的剤形を調製するため、各カプセルが25mgのメマンチンを含有するように、1000のこれらのペレットをカプセルNo.1に満たす。
【0097】
実施例3
アマンタジン延長放出カプセルの調製
以下のようにまたは例えば米国特許第5,395,626号に記載されるように、アマンタジン延長放出カプセルを処方してもよい。
【0098】
A. 組成物:単位用量
アマンタジン延長放出カプセル用の理論的な定量的組成(単位用量あたり)を以下に提供する。

1ヒドロキシプロピルメチルセルロース、ポリエチレングリコール、プロピレングリコールの混合物。
2精製水、USPは処理中に蒸発する。
3ヒドロキシプロピルメチルセルロースおよびポリエチレングリコールの混合物。
4エチルセルロース、セバシン酸ジブチル、オレイン酸、アンモニウム処理水および煙霧シリカの混合物の25%水性分散物の固形含量のみ。分散物中の水は処理中に蒸発する。
5白色、不透明の硬ゼラチンカプセル、サイズ00。
6充填前に各バッチをアッセイし、かつ必要に応じてカプセル重量を調整して、カプセルあたり200mgアマンタジンを実現する。
【0099】
アマンタジン延長放出カプセルの定量的バッチ組成を以下に示す(理論的バッチ量、25,741カプセル)。
工程1:アマンタジンHClビーズの調製(ビーズ組立て#1)

【0100】
工程1から得られるアマンタジンビーズを以下のように用いる。
工程2:透明および持続放出ビーズコーティング#1

【0101】
工程2から得られる持続放出ビーズを以下のように用いる。
工程3:アマンタジンHClビーズ(組立て#2)

【0102】
工程3から得られるアマンタジンビーズを以下のように処方する。
工程4:透明および持続放出ビーズコーティング#2

【0103】
工程5:カプセル充填――サイズ00のゼラチンカプセルに、工程4で調製したアマンタジンビーズ339mgを充填する。
【0104】
実施例4〜11
リマンチジンの延長放出製剤
延長放出用のNMDArアンタゴニスト、リマンチジンを以下のように処方する(例えば、米国特許第5,912,013号を参照されたい)。
【0105】
実施例4
コアペレット

コーティング

【0106】
実施例5
実施例4由来のコアペレットに対するコーティング

【0107】
実施例6
実施例4由来のコアペレットに対するコーティング

【0108】
実施例7
コアペレット

実施例4と同様のコーティング
【0109】
実施例8
実施例8と同様のコアペレット、実施例5と同様のコーティング
【0110】
実施例9
実施例8と同様のコアペレット、実施例6と同様のコーティング
【0111】
実施例10
実施例9と同様のコアペレットに対するコーティング

【0112】
実施例11
実施例4と同様のコアペレット、実施例10と同様のコーティング
【0113】
実施例12
メマンチン制御放出調製物
各々、特徴的なインビトロ溶解プロフィールに関連する、メマンチンの異なる持続放出錠剤製剤を開発した。以下にさらに詳細に記載するように、持続放出製剤は、治療的に優れた薬物動態学的プロフィールに至る。持続放出マトリックスまたは持続放出コーティング錠剤を用いて、持続放出プロフィールを達成した。活性の物理的特性、製剤組成の説明、小規模産生プロセスの概要、および有効な分析法を以下に示す。
【0114】
薬剤物質情報

【0115】
製剤組成

【0116】
製剤#1:持続放出マトリックスを用いて処方されるメマンチン
製剤#1を以下のように産生した。以下の表に示すように、メマンチンを処方した。

【0117】
APIをまず、Avicel PH102とともにバッグ混合し、かつ18メッシュスクリーンを通じてふるいにかける。次に、低剪断ミキサー中で混合物を乾燥させる。混合物をEudragitで湿った塊にし、かつ40〜45℃のオーブン中で造粒を12時間乾燥させる。次に、0.8mmスクリーンに設定したAlexanderwerkミルを通じて、造粒を通過乾燥させ、中間体活性ブレンドを産生する。30メッシュスクリーンを通じて、HPMCをふるいにかけた。スクリーンにかけたHPMCを等量の中間体活性ブレンドとあらかじめ混合し、この混合物を本明細書において、1292-12と称し、かつ2分間バッグ混合した。次に、このブレンドを、低剪断ブレンダー中、ステアリン酸マグネシウムで潤滑化した。このブレンド由来の試料を、105℃に設定したComputrac MAx 2000上のLOD(乾燥減量)試験のために収集した。次いで、最終ブレンドを圧縮し、かつ0.25インチに設定したD3B標準円形凹型パンチ工具を用いて、錠剤にパンチする。この製剤の溶解プロフィールを、図6に提供する(%表示事項(Label claim)対時間)。
【0118】
製剤2:持続放出コーティングマトリックスを用いて処方されるメマンチン

*303.3gのEudragit RS-30D水性分散物は、91gの固形ポリマーおよび212.3gの液体を含有する。
【0119】
塩酸メマンチンをまず、Avicel PH102とともに1分間バッグ混合する。乾燥したブレンドを、18メッシュスクリーンを通じてふるいにかけてポリ袋に入れ、かつ1分間バッグ混合する。混合物を低剪断ミキサー内に装填し、かつ2分間乾燥させる。ブレンドをEudragitで湿った塊にし、かつ40〜45℃のオーブン中で造粒を12時間乾燥させた。次に、乾燥した造粒を、0.8mmスクリーンに設定したAlexanderwerkミルに通す。次に、ふるいにかけたステアリン酸マグネシウム(30メッシュ)を、製粉した混合物に添加し、かつバッグ混合した。次に最終ブレンドを圧縮し、かつ0.25インチD3B標準円形パンチ工具を用いて、錠剤にパンチした。
【0120】
コート錠剤を以下のように調製した。コートを調製するため、Eudragit RL-30DおよびEudragit RS-30Dを、ボルテックスで撹拌しながら、バブルを含まない精製水に添加した。次に、TECを添加して、かつ>30分間混合する。タルクをゆっくりと添加し、かつ混合して、均一な分散物を得る。次に、60メッシュふるいを通じて、コーティングされていないもの(coating desertion)をスクリーニングした。コーティングパラメーターは以下のとおりである(O’Hara Lab II-X 15”pna):インレット温度:37〜40℃;アウトレット温度:25〜28℃;空気流速:150〜175 CFM;パン速度:8〜9rpm;およびスプレー距離:6〜8”。
【0121】
次に錠剤をコーティングした。排出温度およびコーティング速度(重量変化/分)をまず較正し、かつ設定した時間に渡って、錠剤をコーティングした。一定の温度(37〜40℃)で錠剤が3分間回転するようにし、かつ次に、錠剤を冷却し、かつ乾燥させるため、強制換気オーブン(40℃)に、24時間移した。
【0122】
実施例13
フィルムコーティング製剤
Opadry(登録商標)サブコートを用いまたは用いず、かつSurelease(登録商標)オーバーコートを用い、メマンチン錠剤にコーティングすることによって、フィルムコーティング錠剤を処方した。2% Surelease(登録商標)オーバーコートを用い、2% Opadry(登録商標)をベースとするコーティングは、望ましい放出プロフィールを提示した。
【0123】
実施例14
マトリックスコア錠剤
以下の表に示すように、マトリックスコア錠剤を処方した(外見=良、重量=167mg;硬さ=5.1kg;もろさ100revs:0.6%)。低コーティング重量増大は、コーティングの迅速な水和と関連し、一方、高コーティング重量増大は、コーティングの緩慢な水和と関連した。

【0124】
コーティングされたビーズまたは顆粒を圧縮して錠剤にした。圧縮中、蜂の巣様構造を確立する。錠剤は、ビーズおよび顆粒に崩壊し、次いで、これらの個々の特性が、メマンチンの放出を制御する。任意で、HPMCサブコートを用いてもよい。水は、Sureleaseコーティングに浸透し、損なわれずに残り、したがって、コアおよび外部コーティングの間に、HPMCサブコートを捕捉する。水溶性HPMCサブコートが水和する。これは水溶性であるが、大分子量ポリマーであり、水不溶性エチルセルロースコーティングを通じて分散することは不可能である。薬剤の放出は、水がコアに到達するまで起こらないであろう。したがって、遅延は、錠剤中のHPMCの量の関数として、変化するはずである。水がコアの外表面に到達し、かつメマンチンが溶解する。高い水溶性は、高濃度勾配を確立する。溶解したメマンチンは次に、水和したHPMC層および多孔性エチルセルロースコーティングを通じて分散する。したがって、高レベルのエチルセルロースコーティングは、外部コーティングによる放出速度を制御し、一方、より低いレベルのエチルセルロースコーティングは、侵食、水和されたHPMCからの脱落を生じ、かつ放出の制御は、マトリックスビーズに支配される。
【0125】
実施例15
メマンチンの持続放出製剤のインビトロ溶解プロフィール
メマンチンの多様な持続放出製剤を以下のように調製した。
【0126】
マトリックス錠剤製剤5001-6601

【0127】
コーティングされた錠剤製剤5001-6701

【0128】
コーティングされた錠剤製剤5001-680

【0129】
コーティングされた錠剤製剤5001-6804

【0130】
コーティングされたビーズ製剤5001-6990

【0131】
コーティングされたビーズ製剤5001-6991

【0132】
コーティングされたビーズ製剤5001-6992

【0133】
コーティングされたビーズ製剤5001-6993

【0134】
メマンチンの持続放出製剤およびナメンダの例示的なインビトロ溶解プロフィールを図2A〜2Cおよび3A〜3Bに示す。中性媒質中の持続放出メマンチン製剤の溶解プロフィール(図2A)は、酸性溶解媒質中のその溶解プロフィール(図2B)と実質的に同一である。
【0135】
図2Cは、マトリックス錠剤からのメマンチンの放出プロフィールに対する媒質の影響を示すグラフである。50RPMで装置2を用いるR&D法を用いて、試験を行った。3つの媒質を使用した:容器1および2=水;容器3および4=pH 1.2の緩衝液;容器5および6=pH 1.2の緩衝液を2時間、次いで、pHを6.8に調整する。最初の2時間に関するプロフィールにおいて、またはpH 1.2の緩衝液で得られるプロフィールと水で得られるプロフィールとの間で、有意な相違はなかった。しかし、pH 6.8を有する緩衝液に転換すると、放出が緩慢になった。したがって、試験した最適媒質は、水であり得る(水中でおよそ22.5mgの塩酸メマンチンを含有する溶液のpHは7.7であり、約9〜10のpKaを有する塩基の低濃度溶液と一致する)。
【0136】
コーティングされたペレット(22.5mg)としての塩酸メマンチンSRカプセルの製剤
メマンチンを以下の表に示すように処方した。

【0137】
次に、Wursterコーティング装置を用いて、メマンチンペレットをコーティングした。コーティング製剤Iおよびコーティング製剤IIのエチルセルロース:HPMC比は、それぞれ、9:1および8:2であった(以下の表を参照されたい)。

【0138】
コーティングされたら、これを手動で充填することによって、メマンチンペレットをカプセル化した。各カプセルは、22.5mgのメマンチンを含有した。カプセルサイズは「3」であった。
【0139】
次に、溶解媒質として水(500mL)を用い、50rpmのUSP II(パドル)システムで、上記製剤の溶解プロフィールを決定した。異なるコーティングレベル(%w/w)を使用した。1、2、4、6、8、および12時間の時点で、各メマンチンカプセル(22.5mg)の放出プロフィールを決定した(以下の表を参照されたい)。
【0140】
異なるコーティングレベル(%w/w)のコーティング製法Iでコーティングされたペレットを充填した塩酸メマンチンSRカプセル22.5mgの放出データ

【0141】
異なるコーティングレベル(%w/w)のコーティング製法IIでコーティングされたペレットを充填した塩酸メマンチンSRカプセル22.5mgの放出データ

【0142】
薬剤放出は、非直線方式で、12時間まで持続した。ほとんどの場合で、ペレットは、2時間後に、より迅速な放出を示した。ほぼ100%の薬剤放出で、12時間までの放出プロフィールを直線化するため、薬剤層形成およびコーティング組成を変化させてもよい。
【0143】
実施例16
メマンチン持続放出の予測される血漿プロフィール
実施例14に記載する製剤および溶解プロフィールを用い、Simulations Plusの薬物動態学的ソフトウェア、GastroPlusを用いて、メマンチンの単回または複数回投与から生じる血清濃度を計算した(図2Dを参照されたい)。持続放出製剤のいずれかの投与は、ナメンダよりはるかに迅速に、治療的に有効な定常状態血清濃度を達成する(処置治療開始から30日に対して13日)。さらに、持続放出製剤の初期の傾きは、即時放出製剤で得られる傾きより緩い。
【0144】
実施例17
メマンチンの延長放出を提供するパッチ
上述のように、局所投与のため、NMDAアンタゴニストの延長放出製剤を処方してもよい。例えば、参照により本明細書に組み入れられる米国特許第6,770,295号および第6,746,689号に記載されるように、メマンチン経皮パッチ製剤を調製してもよい。
【0145】
接着性アクリレート中の薬剤を調製するため、5gのメマンチンを11gのエタノール中に溶解し、かつ20gのDurotak 387-2287(National Starch & Chemicals, U.S.A.)に添加する。コーティング装置(例えばRK Print Coat Instr. Ltd, KCC 202型制御コーティング装置)を用いて、薬剤ジェルを裏打ち膜(Scotchpak 1012;3M Corp., U.S.A.)上にコーティングする。湿った層の厚さは400μmである。ラミネートを室温で20分間、かつ次いで、40℃で30分間乾燥させる。乾燥薬剤ジェル上に、ポリエステル放出ライナーをラミネート加工する。シートを切ってパッチにし、かつ使用するまで2〜8℃に保管する(袋で包装する)。パッチ中のメマンチン濃度は、5.6〜8mg/cm2の間の範囲である。
【0146】
実施例18
メマンチンの延長放出を提供するパッチ
メマンチンの延長放出を可能にするパッチを以下のように調製してもよい。マトリックスパッチは、アクリレートポリマー中のメマンチンおよび皮内浸透剤の混合物を含むアクリレートマトリックスでコーティングされた、1mm厚のポリオレフィン・フォーム(密封性裏打ちとして)で構成される。メマンチン(20重量パーセント);アクリレートポリマー(Durotak.RTM. 387-2052、75重量パーセント);皮内浸透剤;アルミニウムアセチルアセトネート(Al(ACAC)3、0.4重量パーセント、架橋剤として);およびエタノールを、均一になるまで混合することによって、マトリックスを調製する。次いで、手動コーティング装置を用いて、均一混合物を、約270μmの平均厚まで、ポリオレフィン箔上にコーティングする。約50℃で約1時間、コーティングした箔を乾燥させて、エタノールを蒸発させる。生じるパッチは、およそ50g/m2乾燥重量である。
【0147】
実施例19
メマンチンSR製剤に関する用量増加耐容性の決定
メマンチンSRに関する投薬増加の安全性および耐容性を決定するための研究を以下に記載する。この研究結果は、1日あたり1回投与される20mgを超える最大投与可能用量を確立するとともに、非用量漸増投薬療法(すなわち投薬期間全体に渡る、実質的に同一用量のメマンチンの投与)の耐容性を確認すると期待される。

【0148】
実施例20
アマンタジンSR製剤に関する用量増加耐容性の決定
アマンタジンSRに関する投薬増加の安全性および耐容性を決定するための研究を以下に記載する。この研究結果は、1日あたり1回投与される200mgを超える最大投与可能用量を確立するとともに、非用量漸増投薬療法(すなわち投薬期間全体に渡る、実質的に同一用量のメマンチンの投与)の耐容性を確認すると期待される。

【0149】
実施例21
制御放出製剤でのNMDA受容体関連障害の処置
アルツハイマー型痴呆と診断された患者に、1日1回、持続放出製剤(例えば実施例13に記載するように処方)中の22.5mgのメマンチンを投与する。Periclou et al., Annals of Pharmacotherapy 38:1389-94 (2004)に記載されるように、質量分析検出と連結させたHPLCを用いて、メマンチン血漿濃度を決定してもよい。この治療開始の10日以内に、治療的に有効な定常状態血清濃度に到達する。
【0150】
実施例22
大うつ病の処置
大うつ病と診断された患者に、1日1回、実施例13に記載するように処方したメマンチンを22.5mgまたはそれより多く、最大耐容用量まで(実施例20のプロトコルを用いて決定されるようなもの)、投与する。この治療開始の10日以内に、治療的に有効な定常状態血清濃度に到達する。
【0151】
実施例23
パーキンソン病患者におけるジスキネジーの処置
ジスキネジーを経験しているパーキンソン病患者に、1日用量400mgの持続放出アマンタジン製剤を投与する。UPDRSスコアリングを用いて、ジスキネジーの改善を測定する。
【0152】
実施例24
アルツハイマー病または難治性抑うつ患者において、ナメンダ(Namenda)(登録商標)にメマンチンSR製剤を比較する臨床試験

【0153】
上記活性対照二重盲検試験各々において、メマンチンSRが定常状態血漿治療レベルに到達するのに必要な時間を、メマンチンIRのものと比較する。試験対象患者基準に対して患者をスクリーニングし、かつ試験集団に承認する。干渉する薬剤を4週間洗い出した後、患者をベースラインにスコアリングし、かつ過剰カプセル化法を用いて、盲検方式で試験薬剤を患者に投与する。各患者に対して、1週間間隔で、終点の測定を行う。
【0154】
本発明者らのコンピュータシミュレーションに基づくと、メマンチンSRの完全用量を投与されている患者は、メマンチンIRを投与されている患者に必要な40日でなく、8日で、定常状態に到達すると期待される。したがって、処置経過中、より早期に有益な効果が期待される。
【0155】
実施例25
多発性硬化症患者における、アマンタジンSR製剤の有効性を評価する臨床試験

【0156】
上記活性対照二重盲検試験各々において、アマンタジンSRをプラセボに比較して、効果を測定する。試験対象患者基準に対して患者をスクリーニングし、かつ試験集団に承認する。干渉する薬剤を4週間洗い出した後、患者をベースラインにスコアリングし、かつ過剰カプセル化法を用いて、盲検方式で試験薬剤を患者に投与する。各患者に対して、1週間間隔で、終点の測定を行う。
【0157】
アマンタジンSRを投与された患者は、抑うつまたは疲労の改善に相関する試験基準において、改善されたスコアを示すと期待される。
【0158】
実施例26
薬剤誘導性ジスキネジー患者における、アマンタジンSR製剤の有効性を評価する臨床試験

【0159】
他の態様
本発明を、その詳細な説明と組み合わせて記載してきたが、前述の説明は例示を意図し、かつ本発明の範囲を限定することを意図せず、本発明は、付随する特許請求の範囲によって定義される。他の側面、利点、および修正が、特許請求の範囲内に含まれる。
【図面の簡単な説明】
【0160】
【図1A】単回用量のメマンチンの即時放出(IR)製剤(ナメンダ)またはメマンチンの持続放出製剤(NPI-6701)の投与後、Gastro-Plusソフトウェアパッケージv.4.0.2によって予測されるような、24時間の期間に渡るメマンチン血漿濃度を示すグラフである。持続放出製剤は、即時放出(IR)製剤のものの約20%の初期相中のdC/dTを示す。
【図1B】メマンチンの即時放出(IR)製剤(ナメンダ)およびメマンチンの持続放出製剤(NPI-6701)の投与後、Gastro-Plusソフトウェアパッケージv.4.0.2によって予測されるような、28日間の期間に渡るメマンチン血漿濃度を示すグラフである。US FDAが認可した製造者のラベルに準拠した用量漸増療法を用いて、ナメンダを投与すると、約30日以内に、定常状態治療的有効血漿濃度に到達する。一定用量(例えば22.5mg/日)でメマンチンの持続放出製剤を投与すると、約13日以内に定常治療的有効血漿濃度が達成され、これは約60%の減少である。
【図2A】メマンチンの多様な持続放出製剤(NPI-6601、NPI-6701、NPI-6801、NPI-6990、およびNPI-6804)およびナメンダに関するインビトロ溶解プロフィールを示すグラフおよび表である。溶解プロフィールは、溶解媒質として水を用いて、USP II(パドル)システムで得られた。
【図2B】溶解媒質として0.1N塩酸溶液pH=1.2を用いて、USP II(パドル)システムで得られた、メマンチンの多様な持続放出製剤(NPI-6601、NPI-6701、NPI-6801、NPI-6990、およびNPI-6804)およびナメンダに関する溶解プロフィールを示すグラフである。
【図2C】中性(例えば水)および酸性(pH 1.2)溶解媒質を用いて、持続放出型として処方されたメマンチンの溶解プロフィールを示すグラフである。
【図2D】ナメンダ(10mg b.i.d.または20mgの単回用量)またはメマンチンの多様な持続放出製剤(すなわち、22.5mgの単回用量で投与される、NPI-6601、NPI-6701、NPI-6801、NPI-6804、およびNPI-6990)の投与後、Gastro-Plusソフトウェアパッケージv.4.0.2によって予測されるような、24時間の期間に渡るメマンチン血漿濃度を示すグラフおよび表である。
【図3A】多様な持続放出メマンチンビーズ/カプセル製剤に関する溶解プロフィールを示すグラフおよび表である。実験溶解プロフィールは、媒質として水(pH=7)を用いて、USP IIパドルシステムから得られた。
【図3B】単純2ビーズ混成カプセル(13%の5001-6991および87%の5001-6992)の予測される溶解プロフィールを示すグラフおよび表である。
【図4】メマンチンの修正放出製剤およびメマンチンのIR製剤(ナメンダ)に関する溶解プロフィールを示すグラフである。
【図1】

【特許請求の範囲】
【請求項1】
修正放出(modified release)コーティングまたはマトリックスおよびN-メチル-D-アスパラギン酸(NMDA)受容体アンタゴニストを含む組成物であって、該NMDA受容体アンタゴニストが、1.2のpHを有する溶解媒質中のインビトロ溶解プロフィールと実質的に同一のインビトロ溶解プロフィールを水中で有し、該溶解プロフィールは、37±0.5℃の温度で、50rpmのUSP II型(パドル)溶解システムを用いて測定した場合に、1時間で0.1〜20%、2時間で5〜30%、6時間で40〜80%の間、10時間で70%を超えるかまたはそれと等しい、および12時間で90%を超えるかまたはそれと等しい範囲である、組成物。
【請求項2】
組成物中のNMDA受容体アンタゴニストの少なくとも95%が、制御放出(controlled release)剤形において提供される、請求項1記載の組成物。
【請求項3】
組成物中のNMDA受容体アンタゴニストの少なくとも99%が、制御放出剤形において提供される、請求項2記載の組成物。
【請求項4】
組成物中のNMDA受容体アンタゴニストの100%が、制御放出剤形において提供される、請求項3記載の組成物。
【請求項5】
NMDA受容体アンタゴニストがアミノアダマンチン誘導体である、請求項1記載の組成物。
【請求項6】
アミノアダマンタン誘導体がメマンチン、リマンタジン、またはアマンタジンである、請求項5記載の組成物。
【請求項7】
アミノアダマンタン誘導体がメマンチンである、請求項6記載の組成物。
【請求項8】
NMDA受容体アンタゴニストがアマンタジンまたはデキストロメトルファンではない、請求項1記載の組成物。
【請求項9】
経口、局所、経上皮、皮下、または吸入送達用に処方されている、請求項1記載の組成物。
【請求項10】
ローションまたはパッチとして処方されている、請求項1記載の組成物。
【請求項11】
修正放出コーティングまたはマトリックスおよびメマンチンを含む組成物であって、メマンチンが、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、1時間で0〜60%、2時間で0〜86%、6時間で0.6〜100%、10時間で3〜100%、および12時間で8〜100%の間の範囲のインビトロ溶解プロフィールを有する、組成物。
【請求項12】
メマンチンが、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、1時間で0.1〜20%、2時間で5%〜30%、6時間で40%〜80%の間、10時間で50%またはそれを超える、および12時間で90%またはそれを超える範囲のインビトロ溶解プロフィールを有する、請求項11記載の組成物。
【請求項13】
組成物中のメマンチンの少なくとも95%が、制御放出剤形において提供される、請求項11記載の組成物。
【請求項14】
組成物中のメマンチンの少なくとも99%が、制御放出剤形において提供される、請求項13記載の組成物。
【請求項15】
組成物中のメマンチンの100%が、制御放出剤形において提供される、請求項14記載の組成物。
【請求項16】
メマンチンの15%未満が15分で放出される、請求項11記載の組成物。
【請求項17】
メマンチンの15%未満が30分で放出される、請求項11記載の組成物。
【請求項18】
1.2のpHを有する溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて6時間で測定した場合に、メマンチンの少なくとも60%が放出される、請求項11記載の組成物。
【請求項19】
経口、局所、経上皮、皮下、または吸入送達用に処方されている、請求項11記載の組成物。
【請求項20】
ローションまたはパッチとして処方されている、請求項19記載の組成物。
【請求項21】
メマンチンおよび持続放出(sustained release)コーティングまたはマトリックスを含む組成物であって、放出されるメマンチンの画分が、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-10.9*t)未満であり、式中、tは時間単位での時間であり、tはゼロより大きく、かつ17と等しいかまたはそれより小さい、組成物。
【請求項22】
放出されるメマンチンの画分が、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-0.972*t)未満であるかまたはそれと等しく、式中、tは時間単位での時間であり、tはゼロより大きく、かつ17と等しいかまたはそれより小さい、請求項21記載の組成物。
【請求項23】
組成物中のメマンチンの少なくとも95%が、延長放出(extended release)剤形において提供される、請求項21記載の組成物。
【請求項24】
組成物中のメマンチンの少なくとも99%が、延長放出剤形において提供される、請求項23記載の組成物。
【請求項25】
組成物中のメマンチンの100%が、延長放出剤形において提供される、請求項24記載の組成物。
【請求項26】
メマンチンの5%未満が1時間で放出される、請求項21記載の組成物。
【請求項27】
経口、局所、経上皮、皮下、または吸入送達用に処方されている、請求項21記載の組成物。
【請求項28】
ローションまたはパッチとして処方されている、請求項21記載の組成物。
【請求項29】
神経学的状態または神経精神病学的状態の処置のための薬剤の製造における、NMDA受容体アンタゴニストを含む組成物の使用であって、該NMDA受容体アンタゴニストが、修正放出剤形において提供され、かつ治療開始から実質的に同一の用量で投与されるものとする、使用。
【請求項30】
組成物が請求項1〜28記載の組成物のいずれか1つである、請求項29記載の使用。
【請求項31】
状態が、発作性障害、疼痛症候群、神経変性疾患、痴呆、脳血管性の病態、運動障害、脳外傷(brain trauma)、脳神経障害、神経精神障害、他疾患ニューロパシー、疲労症候群、運動失調症候群(ataxic syndrome)、および軸索性脳損傷(axonic brain damage)からなる群より選択される、請求項29記載の使用。
【請求項32】
状態が、パーキンソン病、多発性硬化症、癲癇、疼痛、抑うつ、激越、アルツハイマー病、筋萎縮性側索硬化症、またはニューロパシー性疼痛である、請求項29記載の使用。
【請求項33】
組成物を24時間ごとに1回より多くは投与しないものとする、請求項29記載の使用。
【請求項34】
投与の際、組成物が、15日以内に、被験体において、治療的に有効な定常状態血漿濃度に到達する、請求項29記載の使用。
【請求項35】
投与の際、組成物が、該投与の5日以内に、被験体において、治療的に有効な定常状態血漿濃度に到達する、請求項29記載の使用。
【請求項36】
組成物を24時間ごとに1回より多くは投与しないものとし、かつNMDA受容体アンタゴニストが、30日未満で、被験体において、治療的に有効な定常状態血漿濃度に到達する、請求項29記載の使用。
【請求項37】
組成物を被験体に投与した際、NMDA受容体アンタゴニストの平均血漿濃度プロフィールが、投与2時間後〜4時間後に、同じ投与用量の同じNMDA受容体アンタゴニストのIR製剤の傾きの50%未満の傾きを有する、請求項29記載の使用。
【請求項38】
NMDA受容体アンタゴニストがアミノアダマンタンである、請求項29記載の使用。
【請求項39】
アミノアダマンタンがメマンチン、アマンタジン、またはリマンタジンである、請求項38記載の使用。
【請求項40】
アミノアダマンタンがメマンチンである、請求項39記載の使用。
【請求項41】
メマンチンが、5〜100mgの間の範囲の1日用量で投与されるものとする、請求項40記載の使用。
【請求項42】
メマンチンが、2〜80mgの間の範囲の1日用量で投与されるものとする、請求項41記載の使用。
【請求項43】
メマンチンが、5〜80mgの間の範囲の1日用量で投与されるものとする、請求項42記載の使用。
【請求項44】
メマンチンの1日用量が、5〜40mgの間の範囲である、請求項43記載の使用。
【請求項45】
メマンチンの1日用量が、20〜50mgの間の範囲である、請求項43記載の使用。
【請求項46】
メマンチンの1日用量が、20〜40mgの間の範囲である、請求項45記載の使用。
【請求項47】
組成物を投与しようとする被験体が、治療開始の1週間以内に、治療中に用いられる用量より低い用量で、NMDA受容体アンタゴニストを投与されていない、請求項29記載の使用。
【請求項48】
マトリックスまたはコーティングされたコアを提供して、NMDA受容体アンタゴニストの持続放出を提供することによる、NMDA受容体活性の脱制御と関連する状態の処置のための薬学的組成物を調製する方法であって、治療開始から実質的に同一の用量の該NMDA受容体アンタゴニストを被験体に投与する段階を伴う治療を用いて該状態を処置するのに十分な量で、該NMDA受容体アンタゴニストが存在する、方法。
【請求項49】
NMDA受容体アンタゴニストを含有する混合物を提供して、NMDA受容体アンタゴニストの即時放出を提供する段階をさらに含み、該混合物の重量が、該マトリックスまたはコーティングされたコアおよび混合物の総重量の5%未満である、請求項48記載の方法。
【請求項50】
NMDA受容体アンタゴニストがメマンチンである、請求項48記載の方法。
【請求項51】
NMDA受容体アンタゴニストがアマンタジンまたはデキストロメトルファンではない、請求項48記載の方法。
【請求項52】
マトリックスコアがワックス、不溶性マトリックスポリマー、水溶性マトリックス物質、またはその混合物である、請求項48記載の方法。
【請求項53】
コーティングされたコアが、エチルセルロース、酢酸酪酸セルロース、酢酸セルロース、四級アンモニウム基を含有するポリメタクリレート、ポリエチレングリコール、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ポリビニルアルコールからなる群より選択される多孔性増強剤(porosity enhancer)を伴うまたは伴わない拡散障壁ポリマー、ならびに単量体物質、糖、ラクトース、スクロース、フルクトース、およびマンニトール、塩、塩化ナトリウム、塩化カリウム、有機酸、フマル酸、コハク酸、乳酸、および酒石酸、およびその混合物、腸溶性ポリマー、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、酢酸フタル酸ポリビニル、酢酸フタル酸セルロース、酢酸トリメリト酸セルロース、セラック、ゼイン、およびカルボキシル基を含有するポリメタクリレートを含む薬学的に許容されるポリマーでコーティングされた、NMDA受容体アンタゴニストのコアである、請求項48記載の方法。
【請求項54】
コアおよび混合物を錠剤形態に圧縮する段階をさらに含み、該コアおよび該混合物は、該錠剤全体に分散している、請求項48記載の方法。
【請求項55】
コアおよび混合物が、該コアおよび該混合物が多層錠剤形態を形成するように、組み合わせられ、かつ錠剤形態に圧縮されている、請求項48記載の方法。
【請求項56】
コアおよび混合物が、カプセルまたはパッチに組み合わせられている、請求項48記載の方法。
【請求項57】
神経学的または神経精神病学的状態の処置のための薬剤製造における、NMDA受容体アンタゴニストを含む組成物の使用であって、組成物が修正放出剤形で提供され、かつ治療開始から実質的に同一の用量で、24時間ごとに1回より多くなく投与される、使用。
【請求項58】
組成物が請求項46にしたがって製造される、請求項57記載の使用。
【請求項1】
修正放出(modified release)コーティングまたはマトリックスおよびN-メチル-D-アスパラギン酸(NMDA)受容体アンタゴニストを含む組成物であって、該NMDA受容体アンタゴニストが、1.2のpHを有する溶解媒質中のインビトロ溶解プロフィールと実質的に同一のインビトロ溶解プロフィールを水中で有し、該溶解プロフィールは、37±0.5℃の温度で、50rpmのUSP II型(パドル)溶解システムを用いて測定した場合に、1時間で0.1〜20%、2時間で5〜30%、6時間で40〜80%の間、10時間で70%を超えるかまたはそれと等しい、および12時間で90%を超えるかまたはそれと等しい範囲である、組成物。
【請求項2】
組成物中のNMDA受容体アンタゴニストの少なくとも95%が、制御放出(controlled release)剤形において提供される、請求項1記載の組成物。
【請求項3】
組成物中のNMDA受容体アンタゴニストの少なくとも99%が、制御放出剤形において提供される、請求項2記載の組成物。
【請求項4】
組成物中のNMDA受容体アンタゴニストの100%が、制御放出剤形において提供される、請求項3記載の組成物。
【請求項5】
NMDA受容体アンタゴニストがアミノアダマンチン誘導体である、請求項1記載の組成物。
【請求項6】
アミノアダマンタン誘導体がメマンチン、リマンタジン、またはアマンタジンである、請求項5記載の組成物。
【請求項7】
アミノアダマンタン誘導体がメマンチンである、請求項6記載の組成物。
【請求項8】
NMDA受容体アンタゴニストがアマンタジンまたはデキストロメトルファンではない、請求項1記載の組成物。
【請求項9】
経口、局所、経上皮、皮下、または吸入送達用に処方されている、請求項1記載の組成物。
【請求項10】
ローションまたはパッチとして処方されている、請求項1記載の組成物。
【請求項11】
修正放出コーティングまたはマトリックスおよびメマンチンを含む組成物であって、メマンチンが、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、1時間で0〜60%、2時間で0〜86%、6時間で0.6〜100%、10時間で3〜100%、および12時間で8〜100%の間の範囲のインビトロ溶解プロフィールを有する、組成物。
【請求項12】
メマンチンが、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、1時間で0.1〜20%、2時間で5%〜30%、6時間で40%〜80%の間、10時間で50%またはそれを超える、および12時間で90%またはそれを超える範囲のインビトロ溶解プロフィールを有する、請求項11記載の組成物。
【請求項13】
組成物中のメマンチンの少なくとも95%が、制御放出剤形において提供される、請求項11記載の組成物。
【請求項14】
組成物中のメマンチンの少なくとも99%が、制御放出剤形において提供される、請求項13記載の組成物。
【請求項15】
組成物中のメマンチンの100%が、制御放出剤形において提供される、請求項14記載の組成物。
【請求項16】
メマンチンの15%未満が15分で放出される、請求項11記載の組成物。
【請求項17】
メマンチンの15%未満が30分で放出される、請求項11記載の組成物。
【請求項18】
1.2のpHを有する溶解媒質中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて6時間で測定した場合に、メマンチンの少なくとも60%が放出される、請求項11記載の組成物。
【請求項19】
経口、局所、経上皮、皮下、または吸入送達用に処方されている、請求項11記載の組成物。
【請求項20】
ローションまたはパッチとして処方されている、請求項19記載の組成物。
【請求項21】
メマンチンおよび持続放出(sustained release)コーティングまたはマトリックスを含む組成物であって、放出されるメマンチンの画分が、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-10.9*t)未満であり、式中、tは時間単位での時間であり、tはゼロより大きく、かつ17と等しいかまたはそれより小さい、組成物。
【請求項22】
放出されるメマンチンの画分が、水中、37±0.5℃の温度で、50rpmのUSP 2型(パドル)溶解システムを用いて測定した場合に、0.01(0.297 + 0.0153*e(0.515*t))より大きいかまたはそれと等しく、かつl-e(-0.972*t)未満であるかまたはそれと等しく、式中、tは時間単位での時間であり、tはゼロより大きく、かつ17と等しいかまたはそれより小さい、請求項21記載の組成物。
【請求項23】
組成物中のメマンチンの少なくとも95%が、延長放出(extended release)剤形において提供される、請求項21記載の組成物。
【請求項24】
組成物中のメマンチンの少なくとも99%が、延長放出剤形において提供される、請求項23記載の組成物。
【請求項25】
組成物中のメマンチンの100%が、延長放出剤形において提供される、請求項24記載の組成物。
【請求項26】
メマンチンの5%未満が1時間で放出される、請求項21記載の組成物。
【請求項27】
経口、局所、経上皮、皮下、または吸入送達用に処方されている、請求項21記載の組成物。
【請求項28】
ローションまたはパッチとして処方されている、請求項21記載の組成物。
【請求項29】
神経学的状態または神経精神病学的状態の処置のための薬剤の製造における、NMDA受容体アンタゴニストを含む組成物の使用であって、該NMDA受容体アンタゴニストが、修正放出剤形において提供され、かつ治療開始から実質的に同一の用量で投与されるものとする、使用。
【請求項30】
組成物が請求項1〜28記載の組成物のいずれか1つである、請求項29記載の使用。
【請求項31】
状態が、発作性障害、疼痛症候群、神経変性疾患、痴呆、脳血管性の病態、運動障害、脳外傷(brain trauma)、脳神経障害、神経精神障害、他疾患ニューロパシー、疲労症候群、運動失調症候群(ataxic syndrome)、および軸索性脳損傷(axonic brain damage)からなる群より選択される、請求項29記載の使用。
【請求項32】
状態が、パーキンソン病、多発性硬化症、癲癇、疼痛、抑うつ、激越、アルツハイマー病、筋萎縮性側索硬化症、またはニューロパシー性疼痛である、請求項29記載の使用。
【請求項33】
組成物を24時間ごとに1回より多くは投与しないものとする、請求項29記載の使用。
【請求項34】
投与の際、組成物が、15日以内に、被験体において、治療的に有効な定常状態血漿濃度に到達する、請求項29記載の使用。
【請求項35】
投与の際、組成物が、該投与の5日以内に、被験体において、治療的に有効な定常状態血漿濃度に到達する、請求項29記載の使用。
【請求項36】
組成物を24時間ごとに1回より多くは投与しないものとし、かつNMDA受容体アンタゴニストが、30日未満で、被験体において、治療的に有効な定常状態血漿濃度に到達する、請求項29記載の使用。
【請求項37】
組成物を被験体に投与した際、NMDA受容体アンタゴニストの平均血漿濃度プロフィールが、投与2時間後〜4時間後に、同じ投与用量の同じNMDA受容体アンタゴニストのIR製剤の傾きの50%未満の傾きを有する、請求項29記載の使用。
【請求項38】
NMDA受容体アンタゴニストがアミノアダマンタンである、請求項29記載の使用。
【請求項39】
アミノアダマンタンがメマンチン、アマンタジン、またはリマンタジンである、請求項38記載の使用。
【請求項40】
アミノアダマンタンがメマンチンである、請求項39記載の使用。
【請求項41】
メマンチンが、5〜100mgの間の範囲の1日用量で投与されるものとする、請求項40記載の使用。
【請求項42】
メマンチンが、2〜80mgの間の範囲の1日用量で投与されるものとする、請求項41記載の使用。
【請求項43】
メマンチンが、5〜80mgの間の範囲の1日用量で投与されるものとする、請求項42記載の使用。
【請求項44】
メマンチンの1日用量が、5〜40mgの間の範囲である、請求項43記載の使用。
【請求項45】
メマンチンの1日用量が、20〜50mgの間の範囲である、請求項43記載の使用。
【請求項46】
メマンチンの1日用量が、20〜40mgの間の範囲である、請求項45記載の使用。
【請求項47】
組成物を投与しようとする被験体が、治療開始の1週間以内に、治療中に用いられる用量より低い用量で、NMDA受容体アンタゴニストを投与されていない、請求項29記載の使用。
【請求項48】
マトリックスまたはコーティングされたコアを提供して、NMDA受容体アンタゴニストの持続放出を提供することによる、NMDA受容体活性の脱制御と関連する状態の処置のための薬学的組成物を調製する方法であって、治療開始から実質的に同一の用量の該NMDA受容体アンタゴニストを被験体に投与する段階を伴う治療を用いて該状態を処置するのに十分な量で、該NMDA受容体アンタゴニストが存在する、方法。
【請求項49】
NMDA受容体アンタゴニストを含有する混合物を提供して、NMDA受容体アンタゴニストの即時放出を提供する段階をさらに含み、該混合物の重量が、該マトリックスまたはコーティングされたコアおよび混合物の総重量の5%未満である、請求項48記載の方法。
【請求項50】
NMDA受容体アンタゴニストがメマンチンである、請求項48記載の方法。
【請求項51】
NMDA受容体アンタゴニストがアマンタジンまたはデキストロメトルファンではない、請求項48記載の方法。
【請求項52】
マトリックスコアがワックス、不溶性マトリックスポリマー、水溶性マトリックス物質、またはその混合物である、請求項48記載の方法。
【請求項53】
コーティングされたコアが、エチルセルロース、酢酸酪酸セルロース、酢酸セルロース、四級アンモニウム基を含有するポリメタクリレート、ポリエチレングリコール、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ポリビニルアルコールからなる群より選択される多孔性増強剤(porosity enhancer)を伴うまたは伴わない拡散障壁ポリマー、ならびに単量体物質、糖、ラクトース、スクロース、フルクトース、およびマンニトール、塩、塩化ナトリウム、塩化カリウム、有機酸、フマル酸、コハク酸、乳酸、および酒石酸、およびその混合物、腸溶性ポリマー、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、酢酸フタル酸ポリビニル、酢酸フタル酸セルロース、酢酸トリメリト酸セルロース、セラック、ゼイン、およびカルボキシル基を含有するポリメタクリレートを含む薬学的に許容されるポリマーでコーティングされた、NMDA受容体アンタゴニストのコアである、請求項48記載の方法。
【請求項54】
コアおよび混合物を錠剤形態に圧縮する段階をさらに含み、該コアおよび該混合物は、該錠剤全体に分散している、請求項48記載の方法。
【請求項55】
コアおよび混合物が、該コアおよび該混合物が多層錠剤形態を形成するように、組み合わせられ、かつ錠剤形態に圧縮されている、請求項48記載の方法。
【請求項56】
コアおよび混合物が、カプセルまたはパッチに組み合わせられている、請求項48記載の方法。
【請求項57】
神経学的または神経精神病学的状態の処置のための薬剤製造における、NMDA受容体アンタゴニストを含む組成物の使用であって、組成物が修正放出剤形で提供され、かつ治療開始から実質的に同一の用量で、24時間ごとに1回より多くなく投与される、使用。
【請求項58】
組成物が請求項46にしたがって製造される、請求項57記載の使用。
【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図4】




【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図4】


【公開番号】特開2009−173669(P2009−173669A)
【公開日】平成21年8月6日(2009.8.6)
【国際特許分類】
【出願番号】特願2009−73540(P2009−73540)
【出願日】平成21年3月25日(2009.3.25)
【分割の表示】特願2007−543431(P2007−543431)の分割
【原出願日】平成17年11月22日(2005.11.22)
【出願人】(507168133)アマダス ファーマシューティカルズ インコーポレイテッド (2)
【Fターム(参考)】
【公開日】平成21年8月6日(2009.8.6)
【国際特許分類】
【出願日】平成21年3月25日(2009.3.25)
【分割の表示】特願2007−543431(P2007−543431)の分割
【原出願日】平成17年11月22日(2005.11.22)
【出願人】(507168133)アマダス ファーマシューティカルズ インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

