持続放出医薬製剤
本発明は、4種の主成分:i)有効量の少なくとも1種の原薬;ii)少なくとも1種の薬剤的に許容できる、水膨脹性pH非依存性ポリマー;iii)少なくとも1種の薬剤的に許容できる、アニオンpH依存性ポリマー;及び(iv)a)少なくとも1種の薬剤的に許容できるカチオンポリマー;及びb)少なくとも1種の薬剤的に許容できるヒドロコロイドからなる群から選択される薬剤的に許容できるポリマーを含むマトリックス型徐放性医薬製剤を提供する。本製剤は、広範囲の溶解度を持つ化合物並びに疎水性又は親水性を有するという特徴のある化合物とともに使用できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、制御放出医薬組成物に関する。
【0002】
(関連出願)
本特許出願は、参照によりその開示全体が本明細書に取り込まれる「持続放出医薬製剤」という名称の2008年12月19日に出願された、米国特許出願第12/339,529号に関連し、その優先権を主張する。
【背景技術】
【0003】
薬剤開発の目的は、引き続き最適な薬剤療法の送達を達成することにある。種々の因子の中で、治療すべき病態、薬剤放出のタイミング、並びに原薬の化学的特性及び物理的特性は、最適な療法を得ることにどの程度成功するかに影響を与えうる。持続放出としても知られる、制御放出医薬品の利用は、約4時間から約24時間継続する長期間に、許容できる治療指数(薬剤の安全性及び効能)とともに、所望の薬物療法を送達できる。制御放出製剤は、患者のコンプライアンスを高めるために投薬の頻度を低減し、所望の血中濃度を維持し1日に3回から4回投与される従来の即放性医薬品に関連する変動を避けるので、副作用の重症度及び頻度を低下させることができる。
【発明の概要】
【0004】
本発明は、4種の主成分:i)有効量の少なくとも1種の原薬;ii)少なくとも1種の薬剤的に許容できる、水膨脹性pH非依存性ポリマー;少なくとも1種の薬剤的に許容できる、アニオンpH依存性ポリマー;及び(iv)a)少なくとも1種の薬剤的に許容できるカチオンポリマー;及びb)少なくとも1種の薬剤的に許容できるヒドロコロイドからなる群から選択される薬剤的に許容できるポリマーを含むマトリックス型(matrix−forming)徐放性医薬製剤を提供する。これらの製剤は経口投与されるのが典型的であり、周囲環境の特性に依存するインビトロ放出パターンを有する。胃内pHでは、これらの製剤からのインビトロ放出パターンはほぼ直線である。腸内pHでは、これらの製剤からのインビトロ放出パターンは、実質的に一次放出パターンである。所望のインビトロ放出パターンは、上述の主成分の範囲及び濃度を操作して設計できる。本発明の組成物を利用すると、種々の期間の放出パターンを、広範囲の溶解度を持つ原薬を使用して達成できる。これらの医薬組成物に、薬剤的に機能のある、又は薬剤的に機能のないコーティングを加えることもできる。経口剤形は、例えば、限定はされないが、直接打錠又は乾式もしくは湿式の造粒により調製できる錠剤或いはカプセルの形態でよい。
【図面の簡単な説明】
【0005】
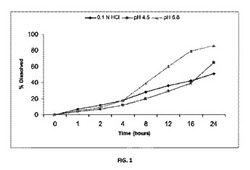
【図1】実施例1の塩酸ミノサイクリン含量(strength)50mg錠の種々の媒体での溶出プロファイル。
【図2】実施例2の遅延放出被覆した含量270mgの1−メチルニコチンアミドクロリド錠のpH6.8のリン酸緩衝液での溶出。
【図3】直接打錠に対してトップスプレー湿式造粒により調製した、実施例4のジクロフェナクカリウム含量50mg錠の比較。
【図4】実施例5のニフェジピン含量50mg錠に対してミニタブの1%SLSを含む0.1NのHClでの溶出。
【図5】実施例6のジクロフェナク含量50mg錠のpH緩衝液6.8での溶出プロファイル。
【図6】直接打錠に対して高剪断湿式造粒により調製した、実施例6の含量50mgジクロフェナクカリウム含量錠の比較。
【図7】実施例7及び8で調製したアセトアミノフェン含量50mg錠の種々の媒体での溶出。
【図8】実施例7及び8で調製したアセトアミノフェン含量50mg錠のpH緩衝液6.8での溶出。
【図9】実施例9で調製したアセトアミノフェン含量50mg錠の溶出。
【図10】実施例10で調製したニフェジピン含量50mg錠(ロット017)の種々の媒体での溶出。
【図11】実施例10で調製したニフェジピン含量50mg錠(ロット020)の種々の媒体での溶出。
【図12】実施例11で調製したニフェジピン含量50mg錠及びミニタブの0.1NのHCl媒体での溶出。
【図13】実施例12で調製したミノサイクリン含量50mg錠の種々の媒体での溶出。
【図14】実施例13で調製した、ヒプロメロース対HPS対エチルセルロースを使用した1−メチルニコチンアミドクロリド含量270mg錠のpH6.8緩衝液での溶出。
【図15】実施例16〜17の調合物を使用した速放性硫酸モルヒネ含量15及び30mg錠の溶出。
【図16】実施例20〜21の調合物を使用した、緩徐放出対速放性硫酸モルヒネ含量60mg錠の溶出。
【図17】実施例19の速放性硫酸モルヒネ含量100mg錠の溶出。
【図18】実施例20の速放性硫酸モルヒネ含量200mg錠の溶出。
【発明を実施するための形態】
【0006】
特記されない限り、本発明が、具体的な活性薬剤、ビヒクル、賦形剤、剤形などに限定されず、それらは変動しうることが理解できよう。本明細書で使用される用語は特定の実施形態を説明する目的のみのものであり、限定的ではないものとすることも理解できよう。
【0007】
本明細書及び添付の請求項では、単数形「1つの(a,an)」及び「前記(the)」は、文脈が明らかにそうでないと示さない限り複数の指示物を含む。そのため、例えば、「1種の活性薬剤」への言及は、単一の活性薬剤並びに2種以上の異なる活性薬剤の組み合わせを含み、「1種の賦形剤」への言及は、2種以上の賦形剤の混合物並びに単一の賦形剤を含む、などである。
【0008】
本発明の記載及び特許請求に際し、以下の用語は、以下に述べられる定義に従って使用されるだろう。
【0009】
「遅延放出」という用語はその従来の意味で使用され、薬物剤形の経口投与とそれからの薬物の放出との間に遅延時間が設けてある薬物製剤を意味する。「遅延放出」は、長期間にわたる薬物の段階的な放出を含むことも含まないこともあり、そのため「徐放」であることもないこともある。
【0010】
「原薬」、「医薬品原体(「API」)」、「薬理活性薬剤」、「薬物」、及び「薬剤」という用語は本明細書において交換可能に使用され、有益な生物効果、一般的には疾病又は異常な生理学的状態の治療における治療効果を有する、任意の化学化合物、錯体、又は組成物を意味する。これらの用語は、塩、エステル、アミド、プロドラッグ、活性代謝物、異性体、フラグメント、アナログ、配位化合物、及び錯体などを含むがこれらに限定されない、本明細書に具体的に言及される原薬の薬剤的に許容でき、薬理学的に活性な誘導体も包含する。「原薬」、「医薬品原体(「API」)」、「薬理活性薬剤」、「薬物」、及び「薬剤」という用語が使用される場合、又は特別な活性薬剤が具体的に特定される場合、出願者らが、活性薬剤自体、並びに薬剤的に許容でき、薬理学的に活性な塩、エステル、アミド、プロドラッグ、活性代謝物、異性体、フラグメント、アナログ、配位化合物、及び錯体などを含むように意図することが理解できよう。
【0011】
「医薬品」又は「剤形」という用語は、単回投与により治療効果を得るのに十分な量の原薬を含む、任意の形態の医薬組成物を意味する。過剰投薬なしに最も効果的な結果を効率的に生み出す投与の頻度は、親水性など、特定の活性薬剤の薬理学的特性及び物理的特性の両方を含むその特性により変わるだろう。
【0012】
活性薬剤の「有効な量」又は「治療上有効な量」という用語は、非毒性だが、所望の効果を与えるのに十分な薬剤の量を意味する。「有効」である活性薬剤の量は、個体の年齢及び全般的な状態、特定の活性薬剤又は複数の薬剤などによって、被験者毎に異なるだろう。そのため、正確な「有効量」を明示することが常に可能なわけではない。しかし、個別症例において適切な「有効」量は、通常の実験を利用して当業者により決定でき、又は担当医により推奨できる。
【0013】
「持続放出」又は「徐放」という用語は、原薬がある期間にわたって徐々に放出される医薬品を意味する。
【0014】
「一次放出パターン」という用語は式F=Kt1/2により知られるが、前式においてFは放出率(fractional release)であり、Kは定数であり、tは時間である。
【0015】
「胃内pH」という用語は、約4.5未満であるpHを意味する。
【0016】
「即放性」という用語はその従来の意味で使用される。
【0017】
「腸内pH」という用語は、約5.0から約6.8の範囲であるpHを意味する。
【0018】
「ほぼ直線」という用語は、「一次放出パターン」の定義に述べられる式に関する時、nが約ゼロであることを意味する。「マルチモデル放出パターン」という用語は、少なくとも1時間の長期間にわたり少なくとも2つの異なる溶出ピークを有する医薬品からの原薬の放出を意味する。
【0019】
「水性溶媒」という用語は、水を含む液体溶液を意味する。
【0020】
「非水性溶媒」という用語は、本質的に有機又は無機であり水を含まない、製薬分野で通常使用される溶媒を意味する。
【0021】
「薬剤的に許容できる賦形剤」又は「薬剤的に許容できる添加剤」を列挙する場合などの「薬剤的に許容できる」とは、生物学的又は他の面で有害でない物質を意味し、すなわち、そのような物質は、望ましくない生物効果を起こさず、それが含まれる組成物の他の成分のいずれとも有害な相互作用せずに、患者に投与される医薬組成物に取り込まれることができる。
【0022】
「薬剤的に機能のあるコーティング」という用語は、投与時に原薬の放出に影響し、寄与し、又は阻害する、製薬分野に公知である1種以上のコーティングを意味し、例えば、限定はされないが、原薬の遅延放出のための腸溶性コーティング;又は、例えば、制限はされないが、1種以上の原薬を含んで多重相の薬剤放出を与え、コーティング中のそのような原薬が、剤形の残りの部分に含まれる原薬と同じ又は異なるコーティングがある。
【0023】
「薬剤的に機能のないコーティング」という用語は、投与時に原薬の放出に影響せず、寄与せず、阻害もしない、製薬分野に公知である1種以上のコーティングを意味する。
【0024】
本明細書では、「ポリマー」という用語は、共有結合した複数のモノマー単位を含む分子を意味し、直鎖ポリマーの他に分岐状、樹状、及び星状ポリマーを含む。この用語は、ホモポリマー及びコポリマーの両方も含み、例えば、ランダムコポリマー、ブロックコポリマー、及びグラフトコポリマー、並びに架橋していないポリマー、及びわずかに、中程度に、大幅に架橋したポリマーも含む。
【0025】
本明細書では、「治療する」及び「治療」という用語は、症状の重症度及び/又は頻度の低下、症状及び/又は基礎病因の除去、症状及び/又はその基礎病因の発生の予防、及び損傷の向上又は改善を意味する。したがって、例えば、患者の「治療」は、高感受性個体の特定の疾患又は有害な生理学的事象の予防、並びに疾患又は疾病を阻害し、又はその後退を起こすことによる、臨床症状のある個体の治療を含む。
【0026】
「ゼロ次放出パターン」という用語は、式FαKtにより説明可能であり、放出された原薬の部分に対する時間のグラフ形態における放出パターンの少なくとも一部がほぼ直線である、医薬品からの原薬の放出の特徴付けを意味する。
【0027】
本発明は、以下を含むマトリックス型徐放性医薬製剤を提供する:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨脹性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;並びに
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【0028】
本医薬製剤は、経口又は他の投与経路用に設計でき、最終医薬品が非水性溶媒を実質的に含まないように調製できる。
【0029】
本発明は多種多様な原薬の効果的な送達を可能とするので、本発明の医薬製剤を使用して投与できる原薬は限定されない。したがって、投与される原薬(複数可)は、以下を含むがこれらに限定されない種々のクラスのそのような原薬のいずれから選択してもよい:鎮痛剤、麻酔剤、抗狭心症剤、抗関節炎剤、抗不整脈剤、抗喘息剤、抗菌剤、前立腺肥大症治療剤、抗ガン剤、抗コリン剤、抗凝固剤、抗痙攣剤、抗うつ剤、抗糖尿病剤、止瀉剤、抗てんかん剤、抗真菌剤、痛風治療剤、駆虫剤、抗ヒスタミン剤、降圧剤、消炎剤、抗マラリア剤、抗偏頭痛剤、抗ムスカリン剤、鎮吐剤、抗新生物剤、抗肥満剤、抗骨粗鬆症剤、パーキンソン病治療剤、抗原虫剤、止痒剤、抗精神病薬、解熱剤、鎮痙剤、抗甲状腺剤、抗結核剤、抗潰瘍剤、抗尿失禁剤、抗ウイルス剤、精神安定剤、食欲抑制剤、注意欠陥障害(ADD)及び注意欠陥多動性障害(ADHD)治療剤、カルシウムチャネル遮断剤、強心剤、β遮断剤、中枢神経刺激剤、認知改善剤、コルチコステロイド、COX−2阻害剤、充血緩和剤、利尿剤、胃腸剤、遺伝物質、ヒスタミン受容体拮抗剤、ホルモン遮断剤(hormonolytics)、催眠剤、血糖降下剤、免疫抑制剤、角質溶解剤、ロイコトリエン阻害剤、脂質調節剤、マクロライド、有糸分裂阻害剤、筋弛緩剤、麻薬拮抗剤、栄養補助食品、神経遮断剤、ニコチン、栄養オイル、副交感神経抑制剤、鎮痛剤、性ホルモン、交感神経興奮剤、精神安定剤、血管拡張剤、ビタミン、及びこれらの組み合わせ。当業者に認識されるとおり、また以下の議論から推測されるとおり、薬剤によっては、上述の群の2種以上により包含されるものもある。
【0030】
原薬は、疎水性でも、両親媒性でも、親水性でもよい。本明細書において「疎水性」と称される原薬の固有の水溶解度、すなわち、電気的に中性で非電離形態の原薬の水溶解度は、一般的に1重量%未満であり、典型的には0.1重量%又は0.01重量%未満である。本明細書における親水性及び両親媒性原薬(特記されない限り、「親水性」原薬と集合的に称される)は、みかけの水溶解度が、少なくとも0.1重量%であり、典型的には少なくとも1重量%である。疎水性原薬及び親水性原薬の両方は、制限なしに、本明細書に列挙された原薬クラスのいずれからでも選択できる。そのような薬剤の溶解度を分類するもう1つの方法において、本発明の製剤に製剤するために選択された薬剤(複数可)は、高い溶解度;中程度の溶解度;低い溶解度;低から中程度の溶解度;又は中程度から高い溶解度を持つことがある。同様に、これらの溶解度クラス内の原薬は、制限なしに、本明細書に列挙された原薬クラスのいずれからでも選択できる。例えば、2種以上の原薬が本製剤での使用に選択される場合、そのような原薬のそれぞれを異なる溶解度クラスから選んでよい。
【0031】
上記で引用された種々の原薬の要処方箋及び/又は一般用カテゴリーの中で、以下の非限定的な例が与えられる:抗炎症原薬及び非オピオイド鎮痛剤、例えば限定はされないが、アロキシプリン、オーラノフィン、アザプロパゾン、アザチオプリン、ベノリレート、ブトルフェノール(butorphenol)、カプサイシン、セレコキシブ、ジクロフェナク、ジフルニサル、エソナリモド、エトドラク、フェンブフェン、フェノプロフェンカルシウム、フルルビプロフェン、イブプロフェン、インドメタシン、ケトプロフェン、ケトロラク、レフルノミド、メクロフェナム酸、メフェナム酸、ナブメトン、ナプロキセン、ノバントロン、オキサプロジン、オキシフェンブタゾン、パレコキシブ、フェニルブタゾン、ピクラミラスト、ピロキシカム、ロフェコキシブ、ロピバカイン、スリンダク、テトラヒドロカンナビノール、トラマドール、トロメタミン、バルデコキシブ、及びジコノチド、並びに尿路鎮痛剤、フェナゾピリジン及びトルテロジン;
【0032】
抗狭心症原薬、例えば限定はされないが、ミベフラジル、レフルダン、ナフネフェン(nahnefene)、カルベジロール、クロマフィバン(cromafiban)、ラミフィバン、ファスジル、ラノラジン、テジサミル、ニソルジピン、及びチザニジン;
【0033】
駆虫剤、例えば限定はされないが、アルベンダゾール、ベフェニウムヒドロキシナフトエート、カンベンダゾール、ジクロロフェン、イベルメクチン、メベンダゾール、オキサムニキン、オクスフェンダゾール、パモ酸オキサンテル、プラジカンテル、パモ酸ピランテル、及びチアベンダゾール;
【0034】
抗不整脈剤、例えば、アミオダロン、ジソピラミド、酢酸フレカイニド、及び硫酸キニジン;
【0035】
抗喘息原薬、例えば限定はされないが、ジロートン、ザフィルルカスト、硫酸テルブタリン、モンテルカスト、及びアルブテロール;
【0036】
抗菌原薬、例えば限定はされないが、アラトロフロキサシン、アジスロマイシン、バクロフェン、ベネタミンペニシリン、シノキサシン、シプロフロキサシン、クラリスロマイシン、クロファジミン、クロキサシリン、デメクロサイクリン、ジリスロマイシン、ドキシサイクリン、エリスロマイシン、エチオナミド、フラゾリドン、グレパフロキサシン、イミペネム、レボフロキサシン、ロレフロキサシン(lorefloxacin)、モキシフロキサシン、ナリジクス酸、ニトロフラントイン、ノルフロキサシン、オフロキサシン、リファンピシン、リファブチン、リファペンチン、スパルフロキサシン、スピラマイシン、スルファベンズアミド、スルファドキシン、スルファメラジン、スルファセタミド、スルファジアジン、スルファフラゾール、スルファメトキサゾール、スルファピリジン、テトラサイクリン、トリメトプリム、トロバフロキサシン、及びバンコマイシン;
【0037】
抗ガン原薬及び免疫抑制剤、例えば限定はされないが、アリトレチノイン、アミノグルテチミド、アムサクリン、アナストロゾール、アザチオプリン、ベキサロテン、ビカルタミド、ビリコダル、ビサントレン、ブスルファン、カンプトテシン、カンドキサトリル、カペシタビン、シタラビン、クロラムブシル、シクロスポリン、ダカルバジン、デシタビン、エリプチシン、エストラムスチン、エトポシド、ゲムシタビン、イリノテカン、ラソフォキシフェン、レトロゾール、ロムスチン、メルファラン、メルカプトプリン、メトトレキサート、マイトマイシン、ミトタン、ミトキサントロン、モフェチル、ミコフェノレート、ネビボロール、ニルタミド、パクリタキセル、パロノセトロン、プロカルバジン、ラミプリル、ルビテカン、シロリムス、タクロリムス、タモキシフェン、テニポシド、テストラクトン、サリドマイド、チラパザミン、トポテカン、クエン酸トレミフェン、ビタミンA、ビタミンA誘導体、及びザコプリド;
【0038】
抗凝固剤及び脳卒中を予防及び治療するための他の原薬、例えば限定はされないが、シロスタゾール、シチコリン、クロピドグレル、クロマフィバン、デキサナビノール、ジクマロール、ジピリダモール、ニクマロン、オプレルベキン、ペリンドプリルエルブミン、フェニンジオン、ラミプリル、レピノタン、チクロピジン、チロフィバン、並びに有機又は無機の塩基により形成したヘパリン塩及び低分子量ヘパリン、すなわち一般的に重量平均分子量が約1000から約10,000Dであり、エノキサパリン、ダルテパリン、ダナパロイド、ガンマパリン(gammaparin)、ナドロパリン、アルデパリン、チンザパリン、セルトパリン、及びレビパリンにより例示されるヘパリン断片を含むヘパリン;
【0039】
抗糖尿病原薬には、例えば限定はされないが、アセトヘキサミド、クロルプロパミド、シグリタゾン、ファルグリタザル、グリベンクラミド、グリクラジド、グリピジド、グルカゴン、グリブリド、グリメピリド(glymepiride)、ミグリトール、ナテグリニド、ピマゲジン、ピオグリタゾン、レパグリニド、ロシグリタゾン、トラザミド、トルブタミド、トリアムプテリン(triampterine)、トログリタゾン、及びボグリボースがあり;
【0040】
抗てんかん剤、例えば限定はされないが、ベクラミド、カルバマゼピン、クロナゼパム、エトトイン、フェルバメート、フォスフェニトイン、ラモトリギン、メトイン、メトスクシミド、メチルフェノバルビトン、オキスカルバゼピン、パラメタジオン、フェナセミド、フェノバルビトン、フェニトイン、フェンスクシミド、プリミドン、スルチアム、チアガビン、トピラマート、バルプロ酸、及びビガバトリン;
【0041】
抗真菌原薬、例えば限定はされないが、アムホテリシン、ブテナフィン、硝酸ブトコナゾール、クロトリマゾール、硝酸エコナゾール、フルコナゾール、フルシトシン、グリセオフルビン、イトラコナゾール、ケトコナゾール、ミコナゾール、ナタマイシン、ナイスタチン、硝酸スルコナゾール、オキシコナゾール、テルビナフィン、テルコナゾール、チオコナゾール、及びウンデセン酸;
【0042】
抗痛風原薬、例えば限定はされないが、アロプリノール、プロベネシド、及びスルフィンピラゾン;
【0043】
抗ヒスタミン及びアレルギー医薬、例えば限定はされないが、アクリバスチン、アステミゾール、クロルフェニラミン、シンナリジン、セチリジン、クレマスチン、シクリジン、シプロヘプタジン、デスロラタジン、デクスクロルフェニラミン、ジメンヒドリナート、ジフェンヒドラミン、エピナスチン、フェキソフェナジン、フルナリジン、ロラタジン、メクリジン、ミゾラスチン、オキサトミド、及びテルフェナジン;
【0044】
降圧原薬には、例えば限定はされないが、アムロジピン、ベナゼプリル、ベニジピン、カンデサルタン、カプトプリル、カルベジロール、ダロジピン、ジリタゼム(dilitazem)、ジアゾキシド、ドキサゾシン、エナラプリル、エプレロノン(epleronone)、エポサルタン(eposartan)、フェロジピン、フェノルドパム、ホシノプリル、グアナベンズ、イロプロスト、イルベサルタン、イスラジピン、レルカルジニピン(lercardinipine)、リジノプリル、ロサルタン、ミノキシジル、ネビボロール、ニカルジビン、ニフェジピン、ニモジピン、ニソルジピン、オマパトリラト、フェノキシベンザミン、プラゾシン、キナプリル、レセルピン、セモチアジル、シタクスセンタン、テラゾシン、テルミサルタン、及びバルサルタン。
【0045】
抗マラリア剤、例えば限定はされないが、アモジアキン、クロロキン、クロルプログアニル、ハロファントリン、メフロキン、プログアニル、ピリメタミン、及び硫酸キニーネ;
【0046】
抗偏頭痛剤を含む、頭痛を治療するための原薬、例えば限定はされないが、アルモトリプタン、ブトルファノール、ジヒドロエルゴタミン、メシル酸ジヒドロエルゴタミン、エレトリプタン、エルゴタミン、フロバトリプタン、メチセルギド、ナラトリプタン、ピゾチリン、リザトリプタン、スマトリプタン、トナベルスタット(tonaberstat)、及びゾルミトリプタン;
【0047】
抗ムスカリン原薬、例えば限定はされないが、アトロピン、ベンズヘキソール、ビペリデン、エトプロパジン、ヒヨスチアミン、臭化メペンゾラート、オキシフェンサイクリミン、スコポラミン、及びトロピカミド;
【0048】
抗原虫原薬、例えば限定はされないが、アトバコン、ベンズニダゾール、クリオキノール、デコキネート、ジヨードヒドロキシキノリン、ジロキサニドフロエート、ジニトルミド、フラゾリドン、メトロニダゾール、ニモラゾール、ニトロフィラゾン(nitrofirazone)、オルニダゾール、及びチニダゾール;
【0049】
抗甲状腺原薬、例えば限定はされないが、カルビマゾール、パリカルシトール、及びプロピルチオウラシル;
【0050】
鎮咳剤、例えば限定はされないがベンゾナテート;
【0051】
抗ウイルス原薬には、例えば限定はされないが、抗ヘルペス剤アシクロビル、ファムシクロビル、ホスカルネット、ガンシクロビル、イドクスウリジン、ソリブジン、トリフルリジン、バラシクロビル、及びビダラビン、及び他の抗ウイルス剤、例えば、アバカビル、アマンタジン、アンプレナビル、デルビリジン(delviridine)、ジダノシン、エファビレンツ、インジナビル、インターフェロンアルファ、ラミブジン、ネルフィナビル、ネビラピン、リバビリン、リマンタジン、リトナビル、サキナビル、スタブジン、チプラナビル、バルガンシクロビル、ザルシタビン、及びジドブジン;及び他の抗ウイルス剤、例えば、アバカビル、インジナビル、インターフェロンアルファ、ネルフィナビル、リバビリン、リマンタジン、チプラナビル、ウルソデオキシコール酸、及びバルガンシクロビル。
【0052】
抗不安剤、鎮痛剤、及び催眠剤、例えば限定はされないが、アルプラゾラム、アミロバルビトン、バルビトン、ベンタゼパム、ブロマゼパム、ブロムペリドール、ブロチゾラム、ブトバルビトン、カルブロマール、クロルジアゼポキシド、クロルメチアゾール、クロルプロマジン、クロルプロチキセン、クロナゼパム、クロバザム、クロチアゼパム、クロザピン、デクスメチルフェニデート(d−トレオ−メチルフェニデート)ジアゼパム、ドロペリドール、エチナメート、フルナニゾン(flunanisone)、フルニトラゼパム、トリフルプロマジン、デカン酸フルペンチキソール、フルフェナジン、フルラゼパム、ガバペンチン、ガボクサドール、γ-ヒドロキシブチラート、ハロペリドール、ラモトリギン、ロラゼパム、ロルメタゼパム、メダゼパム、メプロバメート、メソリダジン、メタカロン、メチルフェニデート、ミダゾラム、モダフィニル、モリンドン、ニトラゼパム、オランザピン、オキサゼパム、ペントバルビトン、ペルフェナジンピモジド、プレガバリン、プロクロルペラジン、プソイドエフェドリン、クエチアピン、リスペリドン、セルチンドール、シラメシン、スルピリド、スネピトロン、テマゼパム、チオリダジン、トリアゾラム、ザレプロン、ゾルピデム、及びゾピクロン;
【0053】
食欲抑制剤、抗肥満原薬、及び摂食障害を治療する原薬、例えば限定はされないが、アンフェタミン、ブロモクリプチン、デキストロアンフェタミン、ジエチルプロピオン、リンチトリプト、マジンドール、メタンフェタミン、オルリスタット、フェンテルミン、及びトピラマート;
【0054】
心臓血管原薬、例えば限定はされないが、アンジオテンシン変換酵素(ACE)阻害剤、例えば、エナラプリル、ラミプリル、ペリンドプリルエルブミン、1−カルボキシメチル−3−1−カルボキシ−3−フェニル−(1S)−プロピルアミノ−2,3,4,5−テトラヒドロ−1H−(3S)−1−ベンゾアゼピン−2−オン、3−(5−アミノ−1−カルボキシ−1S−ペンチル)アミノ−2,3,4,5−テトラヒドロ−2−オキソ−3S−1H−1−ベンゾアゼピン−1酢酸、又は3−(1−エトキシカルボニル−3−フェニル−(1S)−プロピルアミノ)−2,3,4,5−テトラヒドロ−2−オキソ−(−3S)−ベンゾアゼピ酸(benzazepi acid)一塩酸塩;強心配糖体及び強心剤、例えば、アムリノン、ジゴキシン、ジギトキシン、エノキシモン、ラナトシドC、メジゴキシン、及びミルリノン;カルシウムチャネル遮断剤、例えば、ベラパミル、ニフェジピン、ニカルジペン(nicardipene)、フェロジピン、イスラジピン、ニモジピン、アムロジピン、及びジルチアゼム;β遮断剤、例えばアセブトロール、アルプレノロール、アテノロール、ラベタロール、メトプロロール、ナドロール、オキシプレノロール、ピンドロール、プロパフェノン、プロプラノロール、エスモロール、ソタロール、チモロール、及びアセブトロール;抗不整脈剤、例えば、モリシジン、ドフェチリド、イブチリド、ネシリチド、プロカインアミド、キニジン、ジソピラミド、リドカイン、フェニトイン、トカイニド、メキシレチン、フレカイニド、エンカイニド、ブレチリウム、及びアミオダロン;心保護剤、例えば、デクスラゾキサン及びロイコボリン;血管拡張薬剤、例えばニトログリセリン;利尿剤、例えば、アゼタゾラミド(azetazolamide)、アミロライド、ベンドロフルメチアジド、ブメタニド、クロロチアジド、クロルタリドン、エタクリン酸、フロセミド、ヒドロクロロチアジド、メトラゾン、ネシリチド、スピロノラクトン,及びトリアムテリン(triamterine);及び種々の心臓血管薬物、例えば、モンテプラーゼ及びコルロパム(corlopam);
【0055】
コルチコステロイド、例えば限定はされないが、ベクロメタゾン、ベタメタゾン、ブデソニド、コルチゾン、デスオキシメタゾン、デキサメタゾン、フルドロコルチゾン、フルニソリド、フルオコルトロン、プロピオン酸フルチカゾン、ヒドロコルチゾン、メチルプレドニゾロン、プレドニゾロン、プレドニゾン、及びトリアムシノロン;
【0056】
勃起障害原薬、例えば限定はされないが、ポモルフィン(pomorphine)、フェントラミン、及びバルデナフィル;
【0057】
胃腸原薬、例えば限定はされないが、アロセトロン、ビサコジル、シランセトロン、シメチジン、シサプリド、ジフェノキシレート、ドンペリドン、エソメプラゾール、ファモチジン、グラニセトロン、ランソプラゾール、ロペラミド、メサラジン、ニザチジン、オメプラゾール、オンダンセトロン、プラントプラゾール(prantoprazole)、ラベプラゾールナトリウム、ラニチジン、リスペリドン、スルファサラジン、及びテガセロッド;
【0058】
遺伝物質、例えば限定はされないが、核酸、RNA、DNA、遺伝子組換えRNA、遺伝子組換えDNA、アンチセンスRNA、アンチセンスDNA、リボザイム、リボオリゴヌクレオチド、デオキシリボヌクレオチド、アンチセンスリボオリゴヌクレオチド、及びアンチセンスデオキシリボオリゴヌクレオチド。代表的な遺伝子には、血管内皮細胞成長因子、繊維芽細胞成長因子、Bcl−2、嚢胞性線維症膜制御因子、神経成長因子、ヒト成長因子、エリスロポエチン、腫瘍壊死因子、及びインターロイキン−2をコードするもの、並びにHLA−B7など組織適合遺伝子がある。
【0059】
角質溶解剤、例えば限定はされないが、アセトレチン(acetretin)、カルシポトリエン、カルシフェジオール、カルシトリオール、コレカルシフェロール、エルゴカルシフェロール、エトレチナート、レチノイド、ターグレチン、及びタザロテン;
【0060】
一般的に疎水性と分類される脂質調節原薬には、HMG CoA還元酵素阻害剤、例えば限定はされないが、アトルバスタチン、シンバスタチン、フルバスタチン、プラバスタチン、ロバスタチン、セリバスタチン、ロスバスタチン、及びピタバスタチン、並びに他の脂質低下(抗高脂血症)原薬、例えば1−メチルニコチンアミドクロリド(1−MNA)HCl、ベザフィブレート、ベクロブラート、ビニフィブラート、シプロフィブラート、クリノフィブラート、クロフィブラート、クロフィブリン酸、エゼチミブ、エトフィブラート、フェノフィブラート、フェノフィブリン酸、ゲムフィブロジル、ナイアシン、ニコフィブラート、ピリフィブラート、プロブコール、ロニフィブラート、シンフィブラート、及びテオフィブラートがある。
【0061】
筋弛緩剤、例えば限定はされないが、シクロベンザプリン、ダントロレンナトリウム、及びチザニジンHCl;
【0062】
アルツハイマー病を治療する活性原薬を含む、神経変性疾患を治療するための薬剤、例えば限定はされないが、アカチノール、ドネゼピル(donezepil)、塩酸ドネペジル、ドロナビノール、ガランタミン、ネオトロフィン、ラサジリン、フィゾスチグミン、サリチル酸フィゾスチグミン、プロペントフィリン、クエチアピン、リバスチグミン、タクリン、塩酸タクリン、サリドマイド、及びキサリプロデン;ハンチントン病を治療するための原薬、例えば限定はされないが、フルオキセチン及びカルバマゼピン;有用な抗パーキンソン病薬物、例えば限定はされないが、アマンタジン、アポモルヒネ、ブロモクリプチン、エンタカポン、レボドパ(特にレボドパ/カルビドパ組み合わせ)、リスリド(lysuride)、ペルゴリド、プラミペキソール、ラサジリン、リルゾール、ロピニロール、セレギリン、スマニロール、トルカポン、トリヘキシフェニジル、及び塩酸トリヘキシフェニジル;及びALSを治療するための原薬、例えば限定はされないが、鎮痙剤バクロフェン、ジアゼミン(diazemine)、及びチザニジン;
【0063】
ニトレート及び他の抗狭心症原薬、例えば限定はされないが、硝酸アミル、硝酸グリセリン、二硝酸イソソルビド、一硝酸イソソルビド、及び四硝酸ペンタエリトリトール;
【0064】
神経遮断原薬、例えば、抗うつ薬物、抗躁病薬物、及び抗精神病剤があり、抗うつ病薬物には、限定はされないが(a)三環系抗うつ剤、例えば、アモキサピン、アミトリプチリン、クロミプラミン、デシプラミン、ドキセピン、イミプラミン、マプロチリン、ノルトリプチリン、プロトリプチリン、及びトリミプラミン、(b)セロトニン再取込み阻害剤、例えば、シタロプラム、フルオキセチン、フルボキサミン、パロキセチン、セルトラリン、及びベンラファキシン、(c)モノアミン酸化酵素阻害剤、例えば、フェネルジン、トラニルシプロミン、及び(−)−セレギリン、及び(d)他の抗うつ剤、例えば、アプレピタント、ブプロピオン、デュロキセチン、ゲピロン、イグメシン、ラモトリギン、マプロチリン、ミアンセリン、ミルタザピン、ネファゾドン、ラバルゾタン(rabalzotan)、スネピトロン、トラゾドン、及びベンラファキシンがあり、抗躁病剤及び抗精神病剤には、例えば限定はされないが、(a)フェノチアジン、例えば、アセトフェナジン、マレイン酸アセトフェナジン、クロルプロマジン、塩酸クロルプロマジン、フルフェナジン、塩酸フルフェナジン、エナント酸フルフェナジン、デカン酸フルフェナジン、メソリダジン、ベジル酸メソリダジン、ペルフェナジン、チオリダジン、塩酸チオリダジン、トリフルオペラジン、及び塩酸トリフルオペラジン、(b)チオキサンテン、例えば、クロルプロチキセン、チオチキセン、及び塩酸チオチキセン、及び(c)複素環薬物、例えば、カルバマゼピン、クロザピン、ドロペリドール、ハロペリドール、デカン酸ハロペリドール、コハク酸ロキサピン、モリンドン、塩酸モリンドン、オランザピン、ピモジド、クエチアピン、リスペリドン、及びセルチンドールがある。
【0065】
栄養剤、例えば限定はされないが、カルシトリオール、カロテン、ジヒドロタキステロール、必須脂肪酸、非必須脂肪酸、フィトナジオール、ビタミンA、ビタミンB2、ビタミンD、ビタミンE、及びビタミンK。
【0066】
オピオイド鎮痛剤、例えば限定はされないが、アルフェンタニル、アポモルヒネ、ブプレノルフィン、ブトルファノール、コデイン、デキストロプロポキシフェン、ジアモルフィン、ジヒドロコデイン、フェンタニル、ヒドロコドン、ヒドロモルホン、レボルファノール、メペリジン、メプタジノール、メタドン、モルヒネ、ナルブフィン、オキシコドン、オキシモルホン、ペンタゾシン、プロポキシフェン、スフェンタニル、及びトラマドール;
【0067】
ペプチド原薬には、天然、化学合成、遺伝子組換えにより作られた、及び/又は大きな分子の生化学(例えば酵素)的な断片化により作られた治療用ペプチド及びタンパク質自体があり、野生型の配列又はその活性のある断片を含みうる。具体的なペプチド薬物には、例えば限定はされないが、ペプチドホルモンアクチビン、アミリン、アンジオテンシン、心房性ナトリウム利尿ペプチド(ANP)、カルシトニン、カルシトニン遺伝子関連ペプチド、カルシトニンN末端フランキングペプチド、毛様体神経栄養因子(CNTF)、コルチコトロピン(副腎皮質刺激ホルモン、ACTH)、コルチコトロピン放出因子(CRF又はCRH)、上皮成長因子(EGF)、卵胞刺激ホルモン(FSH)、ガストリン、ガストリン抑制ペプチド(GIP)、ガストリン放出ペプチド、ゴナドトロピン放出因子(GnRF又はGNRH)、成長ホルモン放出因子(GRF、GRH)、ヒト絨毛性ゴナドトロピン(hCH)、インヒビンA、インヒビンB、インスリン、黄体形成ホルモン(LH)、黄体形成ホルモン放出ホルモン(LHRH)、αメラニン細胞刺激ホルモン、βメラニン細胞刺激ホルモン、γメラニン細胞刺激ホルモン、メラトニン、モチリン、オキシトシン(ピトシン)、膵臓ポリペプチド、副甲状腺ホルモン(PTH)、胎盤性ラクトゲン、プロラクチン(PRL)、プロラクチン放出抑制因子(PIF)、プロラクチン放出因子(PRF)、セクレチン、ソマトトロピン(成長ホルモン、GH)、ソマトスタチン(SIF、成長ホルモン放出抑制因子、GIF)、チロトロピン(甲状腺刺激ホルモン、TSH)、甲状腺刺激ホルモン放出ホルモン(TRH又はTRF)、チロキシン、血管作動性腸管ペプチド(VIP)、及びバソプレッシンがある。他のペプチド原薬は、サイトカイン、例えば、コロニー刺激因子4、ヘパリン結合性神経栄養因子(HBNF)、インターフェロンα、インターフェロンα−2a、インターフェロンα−2b、インターフェロンα−n3、インターフェロンβなど、インターロイキン−1、インターロイキン−2、インターロイキン−3、インターロイキン−4、インターロイキン−5、インターロイキン−6など、腫瘍壊死因子、腫瘍壊死因子α、顆粒球コロニー刺激因子(G−CSF)、顆粒球マクロファージコロニー刺激因子(GM−CSF)、マクロファージコロニー刺激因子、ミドカイン(MD)、及びチモポエチンである。さらに他のペプチド原薬には、エンドルフィン(例えば、デルモルフィン、ダイノルフィン、αエンドルフィン、βエンドルフィン、γエンドルフィン、σエンドルフィン、[Leu5]エンケファリン、[Met5]エンケファリン、P物質)、キニン(例えば、ブラジキニン、増強物質B、ブラジキニン増強物質C、カリジン)、LHRHアナログ(例えば、ブセレリン、デスロレリン、フェルチレリン、ゴセレリン、ヒストレリン、ロイプロリド、ルテレリン、ナファレリン、トリプトレリン)、及び凝固因子、例えば、α1アンチトリプシン、α2マクログロブリン、抗トロンビンIII、因子I(フィブリノーゲン)、因子II(プロトロンビン)、因子III(組織プロトロンビン)、因子V(プロアクセレリン)、因子VII(プロコンベルチン)、因子VIII(抗血友病グロブリン又はAHG)、因子IX(クリスマス因子、血漿トロンボプラスチン因子、又はPTC)、因子X(ステュアート−パワー(Power)因子)、因子XI(血漿トロンボプラスチン前駆体又はPTA)、因子XII(ハーゲマン因子)、ヘパリン副因子II、カリクレイン、プラスミン、プラスミノゲン、プレカリクレイン、プロテインC、プロテインS、及びトロンボモジュリン、及びこれらの組み合わせがある;
【0068】
性ホルモンには、例えば限定はされないが、黄体ホルモン(黄体ホルモン物質)、卵胞ホルモン、及びこれらの組み合わせがある。黄体ホルモンには、アセトキシプレグネノロン、アリルエストレノール、酢酸アナゲストン、酢酸クロルマジノン、シプロテロン、酢酸シプロテロン、デソゲストレル、ジヒドロゲステロン、ジメチステロン、エチステロン(17α−エチニルテストステロン)、二酢酸エチノジオール、酢酸フルロゲストン、ゲスタデン(gestadene)、ヒドロキシプロゲステロン、酢酸ヒドロキシプロゲステロン、カプロン酸ヒドロキシプロゲステロン、ヒドロキシメチルプロゲステロン、酢酸ヒドロキシメチルプロゲステロン、3−ケトデソゲストレル、レボノルゲストレル、リネストレノール、メドロゲストン、酢酸メドロキシプロゲステロン、メゲストロール、酢酸メゲストロール、酢酸メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチステロン、酢酸ノルエチステロン、ノルエチノドレル、ノルゲスチメート、ノルゲストレル、ノルゲストリエノン、ノルメチステロン、プロゲステロン、及びトリムゲストン(trimgestone)がある。この一般的なクラスに、卵胞ホルモン、例えばエストラジオール(すなわち、1,3,5−エストラトリエン−3,17β−ジオール、又は「17β−エストラジオール」)及びそのエステル、例えば、エストラジオールの安息香酸エステル、吉草酸エステル、シピオン酸エステル、ヘプタン酸エステル、デカン酸エステル、酢酸エステル、及び二酢酸エステル;17α−エストラジオール;エチニルエストラジオール(すなわち、17α−エチニルエストラジオール)及びそのエステル及びエーテル、例えば、エチニルエストラジオール−3−酢酸エステル及びエチニルエストラジオール−3−安息香酸エステル;エストリオール及びコハク酸エストリオール;リン酸ポリエストロール(polyestrol phosphate);エストロン及びそのエステル及び誘導体、例えば、酢酸エストロン、硫酸エストロン、及び硫酸ピペラジンエストロン;キネストロール;メストラノール;及び結合型ウマエストロゲンも含まれる。多くの状況において、例えば、女性の避妊及びホルモン補充療法(HRT)において、黄体ホルモンと卵胞ホルモンの組み合わせ、例えば、プロゲステロンと17β−エストラジオールが使用される。HRTには、男性ホルモン剤が含まれると有利なことがある。この目的の男性ホルモン剤には、例えば、デヒドロエピアンドロステロン(DHEA;「プラステロン」とも呼ばれる)、デヒドロエピアンドロステロン硫酸ナトリウム、4−ジヒドロテストステロン(DHT;「スタノロン」とも呼ばれる)、及びテストステロン、及びテストステロン及び4−ジヒドロテストステロンの薬剤的に許容できるエステル、典型的にはC−17位に存在するヒドロキシル基から形成されるエステル、例えば限定はされないが、エナント酸エステル、プロピオン酸エステル、シピオン酸エステル、フェニル酢酸エステル、酢酸エステル、イソ酪酸エステル、ブチルシクロヘキサンカルボン酸エステル(buciclate)、ヘプタン酸エステル、デカン酸エステル、ウンデカン酸エステル、カプリン酸エステル、及びイソカプリン酸エステルがあり;
【0069】
男性ホルモン原薬は、当分野に周知である他の目的のために投与してもよい。先に列記された男性ホルモン剤に加え、他の男性ホルモン剤には、アンドロステロン、酢酸アンドロステロン、プロピオン酸エンドロステロン、安息香酸アンドロステロン、アンドロステンジオール、アンドロステンジオール−3−酢酸エステル、及びアンドロステンジオール−17−酢酸エステル、アンドロステンジオール−3,17−二酢酸エステル、アンドロステンジオール−17−安息香酸エステル、アンドロステンジオール−3−酢酸エステル−17−安息香酸エステル、アンドロステンジオン、エチルエストレノール、オキサンドロロン、フェンプロピオン酸ナンドロロン、デカン酸ナンドロロン、フリルプロピオン酸ナンドロロン、シクロヘキサン−プロピオン酸ナンドロロン、安息香酸ナンドロロン、シクロヘキサンカルボン酸ナンドロロン、スタノゾロール、ドロモスタノロン、及びプロピオン酸ドロモスタノロンがあるが、これらに限定されない。
【0070】
注意欠陥障害(ADD)及び注意欠陥多動性障害(ADHD)を含む、ナルコレプシーを治療する活性原薬を含む刺激剤、例えば限定はされないが、アンフェタミン、デクスアンフェタミン、デクスフェンフルラミン、マジンドール、メチルフェニデート(d−トレオ−メチルフェニデート又は「デクスメチルフェニデート」を含む)、モンダフィニル(mondafinil)、ペモリン、及びシブトラミン。
【0071】
溶解度を考慮すると、例示的な疎水性活性薬剤には、限定はされないが、アセトレチン、アセチルコエンザイムQ、アルベンダゾール、アルブテロール、アミノグルテチミド、アミオダロン、アムロジピン、アンフェタミン、アンホテリシンB、アトルバスタチン、アトバコン、アジスロマイシン、バクロフェン、ベクロメタゾン、ベナゼプリル、ベンゾナテート、ベタメタゾン、ビカルタニド(bicalutanide)、ブデソニド、ブプロピオン、ブスルファン、ブテナフィン、カルシフェジオール、カルシポトリエン、カルシトリオール、カンプトテシン、カンデサルタン、カプサイシン、カルバマゼピン、カロテン類、セレコキシブ、セリバスタチン、セチリジン、クロルフェニラミン、コレカルシフェロール、シロスタゾール、シメチジン、シンナリジン、シプロフロキサシン、シサプリド、クラリスロマイシン、クレマスチン、クロミフェン、クロミプラミン、クロピドグレル、コデイン、コエンザイムQ10、シクロベンザプリン、シクロスポリン、ダナゾール、ダントロレン、デクスクロルフェニラミン、ジクロフェナク、ジクマロール、ジゴキシン、デヒドロエピアンドロステロン、ジヒドロエルゴタミン、ジヒドロタキステロール、ジリスロマイシン、ドネゼピル、エファビレンツ、エポサルタン、エルゴカルシフェロール、エルゴタミン、必須脂肪酸源、エストラジオール、エトドラク、エトポシド、ファモチジン、フェノフィブラート、フェンタニル、フェキソフェナジン、フィナステリド、フルコナゾール、フルルビプロフェン、フルバスタチン、ホスフェニトイン、フロバトリプタン、フラゾリドン、ガバペンチン、ゲムフィブロジル、グリベンクラミド、グリピジド、グリブリド、グリメピリド、グリセオフルビン、ハロファントリン、イブプロフェン、イルベサルタン、イリノテカン、硝酸イソソルビド、イソトレチノイン、イトラコナゾール、イベルメクチン、ケトコナゾール、ケトロラック、ラモトリジン、ランソプラゾール、レフルノミド、リジノプリル、ロペラミド、ロラタジン、ロバスタチン、L−チロキシン、ルテイン、リコピン、メドロキシプロゲステロン、ミフェプリストン、メフロキン、酢酸メゲストロール、メタドン、メトキサレン、メトロニダゾール、ミコナゾール、ミダゾラム、ミグリトール、ミノキシジル、ミトキサントロン、モンテルカスト、ナブメトン、ナルブフィン、ナラトリプタン、ネルフィナビル、ニフェジピン、ニソルジピン、ニルタニド(nilutanide)、ニトロフラントイン、ニザチジン、オメプラゾール、オペレベルキン(oprevelkin)、オキサプロジン、パクリタキセル、パラカルシトール(paracalcitol)、パロキセチン、ペンタゾシン、ピオグリタゾン、ピゾフェチン(pizofetin)、プラバスタチン、プレドニゾロン、プロブコール、プロゲステロン、プソイドエフェドリン、ピリドスチグミン、ラベプラゾール、ラロキシフェン、レパグリニド、リファブチン、リファペンチン、リメキソロン、リタノビル(ritanovir)、リザトリプタン、ロフェコキシブ、ロシグリタゾン、サクイナビル、セルトラリン、シブトラミン、クエン酸シルデナフィル、シンバスタチン、シロリムス、スピロノラクトン、スマトリプタン、タクリン、タクロリムス、タモキシフェン、タムスロシン、ターグレチン、タザロテン、テルミサルタン、テニポシド、テルビナフィン、テラゾシン、テトラヒドロカンナビノール、チアガビン、チクロピジン、チロフィバン、チザニジン、トピラマート、トポテカン、トレミフェン、トラマドール、トレチノイン、トログリタゾン、トロバフロキサシン、ユビデカレノン、バルサルタン、ベンラファキシン、ベルテポルフィン、ビガバトリン、ビタミンA、ビタミンD、ビタミンE、ビタミンK、ザフィルルカスト、ジロートン、ゾルミトリプタン、ゾルピデム、ゾピクロン、及びこれらの組み合わせがある。
【0072】
例示的な親水性の活性薬剤には、限定はされないが、アカルボース、アシクロビル、アセチルシステイン、塩化アセチルコリン、アラトロフロキサシン、アレンドロネート、アルグルセラーゼ、塩酸アマンタジン、アンベノミウム(ambenomium)、アミフォスチン、塩酸アミロライド、アミノカプロン酸、アンホテリシンB、抗血友病因子(ヒト)、抗血友病因子(ブタ)、抗血友病因子(遺伝子組換え)、アプロチニン、アスパラギナーゼ、アテノロール、ベシル酸アトラクリウム、アトロピン、アジスロマイシン、アズトレオナム、BCGワクチン、バシトラシン、ベカプレルミン、ベラドンナ、塩酸ベプリジル、硫酸ブレオマイシン、ヒトカルシトニン、サケカルシトニン、カルボプラチン、カペシタビン、硫酸カプレオマイシン、セファマンドールナファート(nafate)、セファゾリンナトリウム、塩酸セフェピム、セフィキシム、セフォニシドナトリウム、セフォペラゾン、セフォテタン二ナトリウム、セフォタキシム、セフォキシチンナトリウム、セフチゾキシム、セフトリアキソン、セフロキシムアクセチル、セファレキシン、セファピリンナトリウム、コレラワクチン、柔毛膜性ゴナドトロピン、シドフォビル、シスプラチン、クラドリビン、臭化クリジニウム、クリンダマイシン及びクリンダマイシン誘導体、シプロフロキサシン、クロドロネート、コリスチンメタンスルホン酸ナトリウム、硫酸コリスチン、コルチコトロピン、コシントロピン、クロモリンナトリウム、シタラビン、デルテパリンナトリウム、ダナパロイド、デフェロキサミン、デニロイキンジフチトクス、デスモプレシン、ジアトリゾ酸メグルミン及びジアトリゾ酸ナトリウム、ジサイクロミン、ジダノシン、ジリスロマイシン、塩酸ドーパミン、ドルナーゼアルファ、塩化ドキサクリウム、ドキソルビシン、エチドロン酸二ナトリウム、エナラプリラート、エンケファリン、エノキサパリン、エノキサパリンナトリウム、エフェドリン、エピネフリン、エポエチンアルファ、エリスロマイシン、塩酸エスモロール、第IX因子、ファムシクロビル、フルダラビン、フルオキセチン、ホスカメットナトリウム、ガンシクロビル、顆粒球コロニー刺激因子、顆粒球−マクロファージ刺激因子、遺伝子組換えヒト成長ホルモン、ウシ成長ホルモン、ゲンタマイシン、グルカゴン、グリコピロレート、性腺刺激ホルモン放出ホルモン及びその合成アナログ、ゴナドレリン、グレパフロキサシン、ヘモフィルスB結合型ワクチン、不活性化A型肝炎ウイルスワクチン、不活性化B型肝炎ウイルスワクチン、ヘパリンナトリウム、
【0073】
硫酸インジナビル、インフルエンザウイルスワクチン、インターロイキン−2、インターロイキン−3、ヒトインスリン、インスリンリスプロ、ブタインスリン、インスリンNPH、インスリンアスパルト、インスリングラルギン、インスリンデテミル、インターフェロンα、インターフェロンβ、臭化イプラトロピウム、イホスファミド、日本脳炎ウイルスワクチン、ラミブジン、ロイコボリンカルシウム、酢酸ロイプロリド、レボフロキサシン、リンコマイシン及びリンコマイシン誘導体、ロブカビル、ロメフロキサシン、ロラカルベフ、マンニトール、麻疹ウイルスワクチン、髄膜炎菌ワクチン、メノトロピン、臭化メペンゾラート、メサラミン、メテナミン、メトトレキサート、メトスコポラミン、塩酸メトホルミン、メトプロロール、メズロシリンナトリウム、塩化ミバクリウム、ムンプスウイルスワクチン、ネドクロミルナトリウム、臭化ネオスチグミン、メチル硫酸ネオスチグミン、ニューロンチン、ノルフロキサシン、酢酸オクトレオチド、オフロキサシン、オルパドロネート、オキシトシン、パミドロン酸二ナトリウム、臭化パンクロニウム、パロキセチン、ペルフロキサシン、イセチオン酸ペンタミジン、ペントスタチン、ペントキシフィリン、ペンシクロビル、ペンタガストリン、メシル酸フェントラミン、フェニルアラニン、サリチル酸フィゾスチグミン、ペストワクチン、ピペラシリンナトリウム、血小板由来成長因子、多価肺炎球菌ワクチン、ポリオウイルスワクチン(不活性化)、ポリオ生ワクチン(OPV)、硫酸ポリミキシンB、塩化プラリドキシム、プラムリンチド、プレガバリン、プロパフェノン、臭化プロペンタリン(propenthaline bromide)、臭化ピリドスチグミン、狂犬病ワクチン、リセドロネート、リバビリン、塩酸リマンタジン、ロタウイルスワクチン、キシナホ酸サルメテロール、シンカリド、天然痘ワクチン、ソラトール(solatol)、ソマトスタチン、スパルフロキサシン、スペクチノマイシン、スタブジン、ストレプトキナーゼ、ストレプトゾシン、塩化スキサメトニウム、塩酸タクリン、硫酸テルブタリン、チオペタ、チカルシリン、チルドロネート、チモロール、組織型プラスミノゲン活性化因子、TNFR:Fc、TNK−tPA、トランドラプリル、グルコン酸トリメトレキサート、トロスペクトマイシン、トロバフロキサシン、塩化ツボクラリン、腫瘍壊死因子、腸チフス生ワクチン、尿素、ウロキナーゼ、バンコマイシン、バラシクロビル、バルサルタン、水痘ウイルス生ワクチン、バソプレッシン及びバソプレッシン誘導体、臭化ベクロニウム、ビンブラスチン、ビンクリスチン、ビノレルビン、ビタミンB12、ワルファリンナトリウム、黄熱ワクチン、ザルシタビン、ザナミビル、ゾレドロネート、ジドブジン、及びこれらの組み合わせがある。
【0074】
もちろん、疎水性と示された特定の活性薬剤を、例えば、薬剤的に許容でき薬理的に活性な塩を形成するために電離していない活性薬剤を電離させることにより、容易に親水性形態に転化して市販することができる。逆に、親水性と示された特定の活性薬剤を、例えば、中和、エステル化などにより疎水性形態に容易に転化して市販することができる。このように、特定の活性薬剤を親水性又は疎水性であると上記のように分類したのは限定的でないものとすることを理解されたい。
【0075】
上述の活性薬剤のいずれも、本製剤を利用して組み合わせて投与することもできる。組み合わせて投与される活性薬剤は、同じ治療クラス(例えば、脂質調節剤又は抗凝固剤)でもよいし、異なる治療クラス(例えば、脂質調節剤と抗凝固剤)でもよい。非限定的な原薬合剤の例には、以下のようなものがあるが限定されない。
【0076】
黄体ホルモン物質及びエストロゲンを両方含む女性用避妊組成物;
【0077】
黄体ホルモン物質、エストロゲン、及びアンドロゲンを含む女性HRT組成物;
【0078】
複数の脂質調節剤の組み合わせ、例えば(a)フィブラートとスタチン、例えばフェノフィブラートとアトルバスタチン、フェノフィブラートとシンバスタチン、フェノフィブラートとロバスタチン、又はフェノフィブラートとプラバスタチン;(b)フィブラートとニコチン酸、例えばフェノフィブラートとナイアシン;及び(c)スタチンとニコチン酸、例えばロバスタチンとナイアシン;
【0079】
脂質調節剤と抗ウイルス剤との組み合わせ、例えば、フェノフィブラートとリトナビルなど、フィブラートとプロテアーゼ阻害剤;
【0080】
脂質調節剤と抗凝固剤との組み合わせ、例えば、(a)フェノフィブラートとアスピリンなど、フィブラートとサリチル酸エステル、(b)フェノフィブラートとクロピドグレルなど、フィブラートと他の抗凝固剤、(c)シンバスタチンとアスピリンなど、スタチンとサリチル酸エステル、及び(d)プラバスタチンとクロピドグレルなど、スタチンと他の抗凝固剤;
【0081】
脂質調節剤と抗糖尿病剤との組み合わせ、例えば、(a)フィブラートとチアゾリジンジオンなどのインスリン増感剤、例えば、フェノフィブラートとピオグリタゾン、又はフェノフィブラートとロシグリタゾン、(b)フィブラートとスルホニル尿素などのインスリン分泌刺激剤、例えば、フェノフィブラートとグリメピリド、又はフェノフィブラートとグリピジド、スタチンとチアゾリジンジオンなどのインスリン増感剤、例えば、ロバスタチンとピオグリタゾン、シンバスタチンとロシグリタゾン、プラバスタチンとピオグリタゾンなど;
【0082】
脂質調節剤と心臓血管薬物との組み合わせ、例えば、(a)フィブラートとカルシウムチャネル遮断剤、例えば、フェノフィブラートとアムロジピン、又はフェノフィブラートとイルベサルタン、又は(b)スタチンとカルシウムチャネル遮断剤、例えば、ホシノプリルとプラバスタチン;
【0083】
複数の抗凝固剤の組み合わせ、例えば、(a)アスピリンとクロピドグレルなど、サリチル酸エステルと血小板受容体結合阻害剤、(b)アスピリンとダルテパリンなど、サリチル酸エステルと低分子量ヘパリン、及び(c)クロピドグレルとエノキサパリンなど、血小板受容体結合阻害剤と低分子量ヘパリン;
【0084】
複数の抗糖尿病薬の組み合わせ、例えば、(a)インスリン増感剤とインスリン分泌刺激剤、例えば、(i)グリタゾン又はピオグリタゾンなどのチアゾリジンジオンとグリメピリドなどのスルホニル尿素、及び(ii)メトホルミンなどのビグアナイドとレパグリニドなどのメグリチニド、(b)メトホルミンとアカルボースなど、インスリン増感剤とαグリコシダーゼ阻害剤、(c)インスリン分泌刺激剤とαグリコシダーゼ阻害剤、例えば、(i)アカルボースと組み合わせたグリブリドなどのスルホニル尿素、(ii)アカルボースと、レパグリニドなどのメグリチニド、(iii)ミグリトールと、グリピジドなどのスルホニル尿素、(iv)アカルボースと、ピオグリタゾンなどのチオゾリジンジオン、又は(v)メトホルミンとピオグリタゾン;
【0085】
複数の心臓血管薬物の組み合わせ、例えば、リジノプリルとカンデサルタンなど、ACE阻害剤の組み合わせ;ロサルタンとヒドロクロロチアジドなど、ACE阻害剤と利尿剤との組み合わせ;ニフェジピンとアテノロールなど、カルシウムチャネル遮断剤とβ遮断剤との組み合わせ;フェロジピンとラミプリルなど、カルシウムチャネル遮断剤とACE阻害剤との組み合わせ;
【0086】
降圧剤と抗糖尿病剤との組み合わせ、例えば、イルベサルタンとグリピジドなど、ACE阻害剤とスルホニル尿素;
【0087】
抗ヒスタミン剤と抗喘息剤との組み合わせ、例えば、抗ヒスタミン剤とロイコトリエン受容体拮抗剤、例えば、ロラタジンとザフィルルカスト、デスロラチジンとザフィルルカスト、及びセチラジンとモンテルカスト;
【0088】
抗炎症剤と鎮痛剤との組み合わせ、例えば、COX−2阻害剤と非ステロイド抗炎症剤(NSAID)、例えば、ロフェコキシブとナプロキセン、又はCOX−2阻害剤とサリチル酸エステル、例えば、セレコキシブとアスピリン;
【0089】
抗肥満薬物と抗糖尿病薬との組み合わせ、例えば、メトホルミンと組み合わせたオルリスタットなどのリパーゼ阻害剤;
【0090】
脂質調節剤と冠動脈疾患を治療する薬物との組み合わせ、例えば、フェノフィブラートとエゼチミブ、又はラバスタチンとエゼチミブ;並びに
【0091】
他の組み合わせ、例えば、ドセタキセルとシスプラチン、チラパザミンとシスプラチン、メトクロプラミドとナプロキセンナトリウム、オキシコドンなどのオピオイド鎮痛剤と抗炎症剤、アルプロスタジルなどの勃起障害を治療する薬剤とプラゾシンなどの降圧剤/血管拡張剤。
【0092】
上述の例は単に説明のためであり、構造クラス又は機能クラスにより特定される任意の薬剤を、同じ構造クラス又は機能クラスの他の薬物により置き換えうることを強調すべきである。
【0093】
任意の原薬(複数可)は、塩、エステル、水和物、溶媒和物、配位錯体、配位化合物、アミド、プロドラッグ、活性代謝物、異性体、アナログ、フラグメントなどの形態で投与してよいが、但し、そのような塩、エステル、水和物、溶媒和物、配位錯体、配位化合物、アミド、プロドラッグ、活性代謝物、異性体、アナログ、又はフラグメントが、本発明の範疇で薬剤的に許容でき、薬理的に活性であるという条件である。塩、エステル、水和物、溶媒和物、配位錯体、配位化合物、アミド、プロドラッグ、代謝物、アナログ、フラグメント、及び活性薬剤の他の誘導体は、有機合成化学の当業者に公知であり例えばJ.March、Advanced Organic Chemistry:Reactions、Mechanisms and Structure、4th Edition(New York:Wiley−lnterscience、1992)に記載されている標準的な手順を利用して調製できる。
【0094】
例えば、酸付加塩は、遊離塩基と酸との反応を含む従来の方法を利用して遊離塩基の形態の原薬から調製される。酸付加塩の調製に好適な酸には、有機酸、例えば、酢酸、プロピオン酸、グリコール酸、ピルビン酸、シュウ酸、リンゴ酸、マロン酸、コハク酸、マレイン酸、フマル酸、酒石酸、クエン酸、安息香酸、ケイ皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、p−トルエンスルホン酸、サリチル酸など、並びに無機酸、例えば、塩化水素酸、臭化水素酸、硫酸、硝酸、リン酸などがある。酸付加塩は、好適な塩基により処理して遊離塩基に再転化することができる。逆に、活性薬剤に存在することのある酸部分の塩基性塩の調製は、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、水酸化カルシウム、トリメチルアミンなどの薬剤的に許容できる塩基を利用して類似の方法で実施できる。エステルの調製は、カルボニル炭素のRO−部分の求核攻撃を含む、従来のエステル化反応によるカルボン酸基の変換を含む。エステル化は、ヒドロキシル基と、酸クロライドなどのエステル化試薬との反応により実施することもできる。エステルは、望まれる場合、従来の水素化分解又は加水分解手順を利用して、遊離酸に再転化することができる。アミドは、好適なアミン反応物を利用してエステルから調製でき、又は、アンモニア又は低級アミンとの反応により無水物又は酸クロライドから調製できる。プロドラッグ及び活性代謝物もまた、当業者に公知であるか関連文献に記載されている技術を利用して調製できる。プロドラッグは、典型的には、個体の代謝系により修飾されるまで治療上不活性である化合物を生み出す部分の共有結合により調製される。
【0095】
活性薬剤の他の誘導体及びアナログは、有機合成化学の当業者に公知である標準的な技術を利用して調製でき、又は関連文献を参照して推測できる。さらに、キラル活性のある薬剤は、異性体的に純粋な形態でよく、異性体のラセミ混合物として投与してもよい。
【0096】
本発明の医薬製剤の他の成分は、炭水化物系ポリマーなどの少なくとも1種の水膨張性pH非依存性ポリマーを与えるが、例えば、ヒプロメロース(以前は、ヒドロキシプロピルメチルセルロースの一種として知られていた)、ヒドロキシプロピルエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、メチルセルロースであり、又は本発明とともに典型的に使用されるこれらのヒプロメロースコポリマーの他の構成グレードには、Eシリーズ及びKシリーズがあり、例えば、Dow Chemical Company(アメリカ合衆国、ミシガン州ミッドランド)又はAqualon(デラウェア州ウィルミントンにおける北アメリカ駐在)のE4M、E10M、K100LV、K4M、K15M、K25M、K100M、K200M、及び種々の分子量及びグレードの混合物がある。ヒドロキシエチルセルロースのグレードには、例えば、AqualonのNatrasol(登録商標)ポリマーHHX(分子量1,300,000)、HX(分子量1,000,000)、H(分子量1,000,000)、M(分子量720,000)、及びG(分子量1,150,000)、及びこれらの混合物がある。ヒドロキシプロピルセルロースのグレードには、例えば、AqualonのHPCポリマーMF及びMXF(分子量580,000)、及びKF及びHXF(分子量1,150,000)、及びこれらの混合物がある。グレード及びエチルセルロースには、例えば、Dow Chemical CompanyのEthocel(登録商標)ポリマー7FP、10FP、及び100FP、及びAqualonのポリマーT10EC、N7、N10、N17、N22、N50、N100、及びN200、及びこれらの混合物がある。これらの成分、及び他の全成分、添加剤、賦形剤などは薬剤的に許容できなくてはならない。
【0097】
本発明の医薬製剤の他の成分は、少なくとも少なくとも1種のアニオンpH依存性ゲル形成性コポリマーを与え、例えば、アルギン酸のナトリウム塩、カリウム塩、又はアンモニウム塩などの一価アルギン酸塩、又はこれらの組み合わせ、及びカルボキシメチルセルロースナトリウムなど、又は1種以上のアルギン酸塩とカルボキシメチルセルロースの混合物などがある。これらの成分は市販されており、容易に入手できる。
【0098】
本発明の医薬製剤の他の成分は、カチオンポリマー;及びヒドロコロイドからなる群から選択される、少なくとも少なくとも1種のポリマーを与える。カチオンポリマーは、例えば、キトサン又はその誘導体、例えば、トリメチルキトサン及び四級化(quartermised)キトサン、及びキトサン誘導物質、例えば、米国特許第5747475号に教示されているものでよい。高分子量又は低分子量キトサン製品のいずれも本発明の医薬製剤に使用でき、世界中に存在する業者から医薬グレードで入手できる。本発明の製剤に使用されるヒドロコロイドはカラギーナンでよい。カラギーナンは、イオタ、カッパ、及びラムダカラギーナンとして利用できるが、イオタが最も頻繁に使用され、ラムダが最も使用頻度が低い。例えば、カラギーナンナトリウムなどの、カラギーナンの種々の塩形態も利用可能である。イオタカラギーナンの典型的に使用されるグレードには、カラギーナンNF AEP(登録商標)ブランドコロイド(Hadley、アメリカ合衆国、ニューヨーク)、FD433(1%粘度;300〜400cps)及びFD384(1%粘度;約100cps)があるが、限定されない。他のカラギーナン製品の粘度は約50から約4000cpsの範囲である。
【0099】
本発明の成分の濃度の範囲は、それぞれの製剤の所望の放出特性により変わるだろうが、公知の慣例に従い容易に調整できる。
【0100】
より具体的には、各原薬は、適切な治療指数に対して表記された濃度又は所望の濃度と有効成分含量が一致するように、所望の量で存在する。本発明の製剤に使用できる原薬の範囲を考慮すると、利用される範囲は、利用されるか1種以上の他の原薬と組み合わせるかにかかわらず、その特定の原薬に適合されるだろう。
【0101】
一般的に:少なくとも1種の水膨張性pH非依存性ポリマーは、個別のポリマーとしてであれ集合的であれ、例えば約20パーセントから約50パーセント、及び約30から約40パーセントを含む他の範囲とともに約10パーセントから約90パーセントの範囲で使用され;
少なくとも1種のアニオンpH依存性ゲル形成性コポリマーは、個別のコポリマーとしてであれ集合的であれ、例えば、約10から約50パーセント、約10から約30パーセント、及び約15から約25パーセントを含む他の範囲とともに、約10パーセントから約90パーセントの範囲で使用され;
カチオンポリマー又はヒドロコロイドは、その使用が個別であれ集合的であれ、例えば、約0.5から約20パーセント、及び約5から約15パーセントを含む他の範囲とともに約0.1パーセントから約25パーセントの範囲。
【0102】
しかし、上述のとおり、例えば、難溶性原薬を使用する場合及び/又は放出時間を減らすために、本発明の医薬製剤中の総マトリックス配合量(total matrix load)が約30パーセント以下の場合もある。
【0103】
当業者は、例えば、原薬の水溶解度、製剤中の原薬配合量/ポリマー比、ポリマーの水溶解度及び粘度を含む複数の因子又は変数が、本発明のマトリックスからの原薬の送達速度に影響を与えうることを認識するだろう。本明細書に述べられるパラメーターを利用して、各原薬及び放出プロファイルターゲットは、ケースバイケースで扱われるべきである。出発点として、約17%の中程度の原薬薬物配合量、ジクロフェナクカリウムなどの原薬の中程度の溶解度で約12時間にわたり放出する、本発明の一製剤は、以下の処方により表されるだろう。
【0104】
【表1】

【0105】
例えば、水溶解度の高い原薬を扱うには、又は原薬の放出時間を延ばすには、製剤の修飾は下記を含むであろう:
・原薬薬物配合量を下げ、全体的なポリマー含量を高める−医薬品のサイズを通常大きくする必要があるだろう;
・ヒプロメロースの代わりにエチルセルロースなど水溶解度の低いポリマーを使う。
・利用するポリマーの分子量を高くする;
・体積に対して、錠剤形状の表面積(surface are)を最低にする。円形錠剤を使用する;
・カラギーナン及び/又はキトサンの使用量のパーセンテージ(w/w)を低下させ、高分子量で低溶解度のポリマーの使用量を高くする;かつ/又は
・水溶性錠剤希釈剤の使用を避け微結晶性セルロースなどの不溶性希釈剤を使用する。
・希釈剤濃度を下げ、ポリマー配合量を上げる。
【0106】
難溶性原薬を扱うには、及び/又は放出時間を短くするには:
・全体のポリマーマトリックス配合量を、製剤の20〜30%にまで低下させる;
・ラクトースなどの水溶性希釈剤を混合する;
・エチルセルロースなどの水不溶性ポリマーの使用を最小限にするか回避し、ヒプロメロース及びヒドロキシプロピルセルロースなどのポリマーの低分子量のものを使用する;
・製剤に界面活性剤又は可溶化剤を含ませる;
・微粒子化された原薬を使用する;かつ/又は
・マルチパーティキュレート(multi−particulate)ミニタブシステムを使用して、医薬品の表面積対体積比を最大にする。
【0107】
本発明の医薬製剤の調製は、医薬製剤の分野の当業者に公知である従来の手段により、例えば、直接打錠、乾式造粒、及び湿式造粒がある。本発明の医薬製剤を調製する以下の一般的な方法は例示として提示され、どのようにも本発明の製剤を限定しないものとする。
【0108】
直接打錠は、原薬(複数可)を含む全成分を細分(delumping)し、所望の粒径の範囲にふるうことにより実施される。サイズによって均質なブレンドが可能であるならば、各成分をそのような同じサイズ又は異なるサイズに細分することが望ましいだろう。次いで、最初のブレンド工程において成分の一部又はほとんどすべてをブレンドする必要があるかもしれないことを認識しながら、成分をブレンドし、次に、元の成分に追加の成分を加える第二又はその次のブレンド工程(複数可)が実施される。適切なブレンド工程の後、錠剤、ミニタブレット(医薬製剤業界の当業者に公知である)、1種以上のサイズの直接打錠マルチパーティキュレートは直接打錠され、最終医薬品の形態のことのある所望の製品を与え、カプセル又は他の固体投与量投与(solid−dose administration)形態に充填され、1種以上の追加の直接打錠製品に加えられて、多層の医薬品などを形成することができる。「直接打錠」という用語はそれ自体、本発明による医薬製剤の調製プロセスの一部又はすべてに関連することがある。
【0109】
当業者は、医薬品を調製するプロセス工程の一部又は全てとして湿式造粒を実施する多くの方法が存在することを認識するだろう。したがって、そのようなプロセスのそれぞれ又はいずれも、部分又は全体として、本発明の医薬製剤の調製に利用できる。本発明をどのようにも限定はしないが、通常利用される湿式造粒プロセスの一つには、例えば、湿式トップスプレー造粒がある。全成分は細分され所望のサイズにふるわれた後、得られた成分のブレンドが、慣行を利用してブレンドされた成分を流動化するスプレーガンを備えた適切な流動床プロセッサーに加えられる。生じた顆粒は、典型的には流動床中で乾燥され、所望の粒径範囲に粉砕され、最終製剤の調製に使用される。このプロセスに代わるものは高剪断湿式造粒として知られている。同様に、成分は、所望のサイズへのふるい分け又は細分され、適切なプロセッサーに加えられ、ブレンドされた成分は混合され、溶媒、典型的には水又は他の水性溶媒が造粒中に塊に噴霧された状態で頻繁に細断される。湿った顆粒は、典型的には流動床で流動化され、次いで乾燥され、粉砕される(多くの場合、追加の所望の成分が添加される)。あるいは、利用できる装置、使用される成分、及び所望の成果によっては、低剪断湿式造粒を利用することもできる。湿式造粒プロセスの生成物は、錠剤、ミニタブレット、最終医薬品の形態のこともある1種以上のサイズの直接打錠マルチパーティキュレートなどに形成され、カプセル又は他の固体投与量投与のための形態に充填され、1種以上の追加の直接打錠製品に加えられて、必要に応じて、多層医薬品などを形成できる。
【0110】
当業者は、医薬品を調製するプロセス工程の一部又は全てとして乾式造粒を実施する多数の方法が存在することも認識するだろう。乾式造粒は、最終医薬品に形成される成分の最終的なブレンドの流動特性又は他の特性を向上させるために使用されることが多い。したがって、そのようなプロセスのそれぞれ又はいずれも、部分又は全体として、本発明の医薬製剤の調製に利用できる。本発明をどのようにも限定はしないが、通常利用される乾式造粒プロセスの一つは、例えば、所望の成分の細分及び/又はふるい分け、成分のブレンディング、及び、例えば、圧縮された生成物のリボンを形成するローラーコンパクターへの成分の供給、次いで、得られたリボンの粉砕を含む。次いで、粉砕された生成物は上述のとおり圧縮され、又は追加の成分とさらにブレンドされてから圧縮される。
【0111】
錠剤形態にある本発明の医薬製剤は、水性媒体の早期の進入を防止し、該当する場合コアのコーティングの間の表面の穴あき及び崩壊を防ぐのに十分な硬さに圧縮しなければならない。錠剤を製剤する際には、錠剤の均一なバッチをつくるのに十分な量の完全な混合物が、従来の打錠機中で適切な圧力で打錠される。典型的な圧縮力は、約5から約50キロニュートン(kN)である。
【0112】
医薬に通常使用される他の任意の成分を、本医薬製剤に使用してもよい。それらには、例えば、充填剤、滑沢剤、流動促進剤、着色剤、酸化防止剤などがあり、それぞれの使用は当業者に公知である。以下は例示の目的のみのために与えられ、本発明の範囲をどのようにも限定しないものとする。充填剤には、例えば、糖類、例えば、デキストロース、スクロース、マルトース、及びラクトース、糖アルコール、例えば、マンニトール、ソルビトール、マルチトール、キシリトール、デンプン加水分解物、例えば、デキストリン、及びマルトデキストリンなど、微結晶性セルロース又は他のセルロース誘導体、リン酸水素カルシウム、リン酸三カルシウムなど、及びこれらの混合物がある。医薬品に使用される充填剤の典型的な量は、必要でないか望まれない場合はゼロにまで低くなることがあり、高活性で低用量の原薬では50パーセント(w/w)にも高くなることがある。
【0113】
滑沢剤には、例えば、長鎖脂肪酸及びその塩、例えばステアリン酸マグネシウム及びステアリン酸、タルク、グリセリド、及び蝋がある。医薬品に使用される滑沢剤の典型的な量は、約0.1から約3パーセント(w/w)の範囲になりうる。
【0114】
流動促進剤には、例えば、コロイド状二酸化ケイ素、タルクなどがある。医薬品に使用される流動促進剤の典型的な量は、約0.1から約1パーセント(w/w)の範囲になりうる。
【0115】
着色剤には、例えば、FD&C着色剤、例えば、FD&C Yellow No.6、FD&C Red No.2、FD&C Blue No.2、食用レーキなどがある。医薬品に使用される着色剤の典型的な量は、約0.1から約1パーセント(w/w)の範囲になりうる。
【0116】
酸化防止剤には、例えば、アスコルビン酸、メタ重亜硫酸ナトリウムなどがある。医薬品に使用される酸化防止剤の典型的な量は、約0.1から約1パーセント(w/w)の範囲になりうる。
【0117】
本発明の医薬製剤は、種々の目的で1種以上のコーティングにより被覆されていてよい。一般的に、医薬剤形に使用される種々のコーティングには、例えば、腸溶性コーティング、シールコーティング、フィルムコーティング、バリアコーティング、圧縮コーティング、速崩壊コーティング、及び酵素分解コーティングがある。所望の性能のために複数のコーティングを利用できる。さらに、剤形は、即放性、パルス状放出、マルチモード放出、遅延放出、ターゲット放出(targeted release)、同期放出、又はターゲット遅延放出用に設計できる。これらの用語及びそれぞれを達成するための技術は製剤分野に周知である。放出及び/又は吸収の制御のために、本医薬製剤は、種々の種類及び濃度又は厚さの膜とともにつくることができ、それぞれのコーティングに部分的又は完全に覆われていてよい。そのようなコーティングは、原薬と加えられていても、加えられていなくてもよい。1種以上の原薬がコーティングに加えられる場合、そのような原薬は、本発明の医薬製剤のマトリックスに含まれる少なくとも1種の原薬と同じでも、異なっていてもよい。
【0118】
本発明の医薬製剤を使用するカプセルを製剤する場合、カプセルは、薬剤的に許容できる適切な任意の物質から作られたハードカプセルでもソフトカプセルでもよい。
【0119】
上記又は他で言及されるコーティングは当分野で公知であるが、明確にするために以下の簡単な説明が与えられる。
【0120】
シールコーティング、又は分離層を持つコーティング(薬剤的に機能のないコーティング):厚さ20マイクロまでの薄層は、例えば、粒子の多孔性の低下、ほこりの低減、化学的保護、矯味、臭いの低減、胃腸への刺激を最低限にするなどの種々の理由で施すことができる。分離効果は、コーティングの厚さに比例する。水溶性セルロースエーテルが通常この用途に使用される。HPMCとエチルセルロースとの組み合わせ、又はEudragit(登録商標)E100(Evonik Rohm GmbH、ドイツ国、ダルムシュタット)は、通常矯味用途に使用される。
【0121】
薬剤的に機能のあるコーティングには、例えば、腸溶性コーティングがある:本明細書での「腸溶性コーティング」という用語は、キャリア又は組成物に施され、組み合わされ、混合され、又は他の方法で加えられて、典型的には医薬品中の1種以上の原薬の遅延放出を達成する、薬剤的に許容できる賦形剤の混合物に関する。コーティング(複数可)は、本医薬製剤の錠剤、カプセル、及び/又はペレット、ビーズ、ミニタブレット、顆粒、又は粒子に施すことができる。コーティングは、水性分散液により、又は適切な溶媒に溶解させた後で施すことができる。追加の添加剤及びその濃度、一次被覆材料又は複数の材料の選択は、以下の性質により決まるだろう。
【0122】
1.胃の中の溶出及び崩壊に対する抵抗;
2.胃の中にあるときの胃液の不浸透性;
3.ターゲットの腸内部位で所望の方法で溶出又は崩壊する能力;
4.貯蔵中の医薬品の物理的安定性及び化学的安定性;
5.非毒性;
6.コーティングとしての塗布の容易性(下地と相性のよい);及び
7.経済的な実用性。
【0123】
遅延放出情動(affect)を達成するために、コーティング全体が、約5未満のpHの胃腸液には溶出せずに約5以上のpHで溶出するように、十分な厚さで任意のコーティング(複数可)を施さなくてはなければならない。pH依存性の溶解度プロファイルを示す任意のアニオンポリマーを本発明の実施において腸溶性コーティングとして使用でき、下部消化管への1種以上の原薬の送達を実施できる。遅延放出医薬品の調製に使用されるコーティングの非限定的な例には以下がある。
【0124】
セラック、昆虫の樹脂状分泌物から得られる精製物。このコーティングはpHが約7以上の媒体に溶解する。
【0125】
アクリルポリマー。アクリルポリマーの性能(主に、体液への溶解度)は、置換の程度及び種類により変えることができる。好適なアクリルポリマーの例にはメタクリル酸コポリマー及びメタクリル酸アンモニオコポリマーがある。EudragitシリーズE、L、S、RL、RS、及びNEは、有機溶媒中に可溶化された状態で、水性分散液として、又は乾燥粉末として市販されている。EudragitシリーズRL、NE、及びRSは消化管内で不溶性だが、浸透性であり主に持続放出用に使用される。EudragitシリーズEは胃の中で溶解する。EudragitシリーズL、L−30D、及びSは胃の中では不溶性であるが、腸内で溶解する。
【0126】
セルロース誘導体。好適なセルロース誘導体には、例えば、エチルセルロース;セルロースの部分酢酸エステルと無水フタル酸との反応混合物(性能は置換の程度及び種類により変わることがある;酢酸フタル酸セルロース(CAP)は6より高いpHで溶解する;Aqucoat(登録商標)CMP(FMC、アメリカ合衆国、ペンシルベニア州フィラデルフィア)は水性系である;酢酸トリメリト酸セルロース;メチルセルロース;ヒドロキシプロピルメチルセルロースフタル酸エステル(HPMCP;性能は置換の程度及び種類により変わることがある;グレードには、例えば、HP−50、HP−55、HP−55S、HP−55Fがある);ヒドロキシプロピルメチルセルロースコハク酸エステル(HPMCS)(性能は置換の程度及び種類により変わることがある;グレードには、例えば、約5のpHで溶解するAS−LG(LF)、約5.5のpHで溶解するAS−MG(MF)、及びより高いpHで溶解するAS−HG(HF)がある。これらのポリマーは顆粒として、又は水性分散液のための微粉末として提供される。
【0127】
ポリ(酢酸フタル酸ビニル)(PVAP)。PVAPは、約5以上のpHで溶解し、水蒸気及び胃液に対する浸透性ははるかに低い;
【0128】
上記の材料の組み合わせも使用できる。
【0129】
コーティングは、可塑剤及び、ことによると他のコーティング賦形剤、例えば、着色剤、タルク、及び/又はステアリン酸マグネシウムを含んでよく、通常含むが、これらは当分野に周知である。そのような可塑剤には、例えば以下のものがある:クエン酸トリエチル、グリセリン三酢酸エステル、クエン酸アセチルトリエチル、ポリエチレングリコール400、フタル酸ジエチル、クエン酸トリブチル、アセチル化モノグリセリド、グリセロール、脂肪酸エステル、プロピレングリコール、及びフタル酸ジブチルがある。より詳細には、アニオン性カルボン酸アクリルポリマーは、通常10〜25重量%の可塑剤、特にフタル酸ジブチル、ポリエチレングリコール、クエン酸トリエチル、及びトリアセチンを含む。
【0130】
スプレーコーティング又はパンコーティングなどの従来の被覆技術を利用して、コーティングが施される。コーティングの厚さは、下部消化管の局所送達の所望の部位に到達するまで経口剤形が確実に完全であるように十分でなければならない。
【0131】
着色剤、粘着防止剤、界面活性剤、消泡剤、滑沢剤、ヒドロキシプロピルセルロースなどの安定剤、酸/塩基を可塑剤の他にコーティングに加えて、被覆された材料を可溶化又は分散させ、コーティング性能及び被覆された医薬品を改善することができる。
【0132】
本明細書に開示される本発明の原理における変形を当業者がなしうることを理解及び予期できようが、そのような修正は本発明の範囲内に含まれるものとする。
【実施例】
【0133】
(実験の詳細)
以下の溶出パラメーターを、実施例3、19〜20、及び21〜22を除く全ての実施例に利用した。
USP Apparatus II
パドル速度50rpm
温度37℃
試料のHPLC分析
【0134】
実施例19〜20のパドル速度は全ての時点で50rpmであったが、例外は無限でありパドル速度は追加の15分間で250rpmであった。実施例21〜22は、100rpmで回転している円筒状バスケットを使用した。
【0135】
以下の溶出媒体をそれぞれの実施例に使用した。
【表2】

【0136】
実施例1−50mg塩酸ミノサイクリン錠の直接打錠
直接打錠を利用して、50mg含量の塩酸ミノサイクリン錠を生成する1キログラムのバッチを調製した。以下の処方を利用した。
【0137】
【表3】

【0138】
40メッシュのふるいを通ったステアリン酸マグネシウム以外の全成分を、使用前に20メッシュのスクリーンで細分した。ステアリン酸マグネシウム以外の成分を4クォートV型ブレンダーに入れ、5分間ブレンドした。ステアリン酸マグネシウムをブレンダーに入れ、ブレンディングをさらに3分間続けた。約327mgの重量、約8kpの硬さ、及び約0.187インチの厚さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH105錠剤プレスでブレンドを圧縮した。
【0139】
実施例2−270mg1−MNA錠の乾式造粒及び遅延放出のためのコーティング
打錠に使用される最終ブレンドの流動を改善するために、この実施例では乾式造粒法を利用した。
【0140】
【表4】

【0141】
40メッシュのふるいを通ったステアリン酸マグネシウム以外の、2kgバッチ用の成分全てを、使用前に20メッシュのスクリーンにより細分した。前記成分及びステアリン酸マグネシウム全量の25パーセントを8クォートV型ブレンダーに入れ、10分間ブレンドした。ロール速度3rpm、供給スクリュー速度5rpm、及び圧縮力2.0トンを利用する、鋸歯状ロールを備えたVector TF Miniロールコンパクターにブレンドを通した。厚さ0.040インチのリボンをつくり、0.040インチ超のスクリーンを備えたQuadro Comilを利用して一定サイズに粉砕した。粉砕したリボンを残りの4分の3のステアリン酸マグネシウムとともにV型ブレンダーに入れ、3分間ブレンドした。約800mgの重量、約10kpの硬さ、及び約0.268インチの厚さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH105錠剤プレスでブレンドを圧縮した。
【0142】
実施例2の生成物の遅延放出コーティング
マトリックス錠剤からの1−メチルニコチンアミドの放出が、およそ2時間の遅延放出と、それに次ぐ12〜24時間にわたる放出であるように目標を定めた。40%ヒプロメロース基材マトリックス錠剤は、望まれるとおりおよそ12時間の持続放出を与えたが、コーティングなしでは原薬放出の遅延はなかった。錠剤を被覆して、錠剤からの1−メチルニコチンアミドの放出を遅延させた。この戦略は、水和すると膨張する錠剤の性質を利用するものであった。錠剤に水半透過性コーティングを施すと、錠剤への水の浸入が遅れ、そのために膨張が遅れる。ついには、十分な水がコーティングに浸透し、膨張及び圧力増加が起こり、その後コーティングの破壊が起こる。破壊と同時に、錠剤はマトリックス錠剤として原薬の放出を始める。錠剤に施されるコーティングの厚さ及び/又は施されるコーティングの水透過性により遅延が制御される。エチルセルロース(Colorcon Surelease(登録商標);アメリカ合衆国、ペンシルベニア州ウェストポイント)を半透過性コーティングとして選択し、低分子量で低粘度の細孔形成剤ヒプロメロース(Dow E5LV)を混合して透過性を上昇させた。
【0143】
直接打錠により製造した270mgのメチルニコチンアミドマトリックス錠剤に、スプレーガンを2つ備えたAccelacota24インチコーティングパンで(プラセボシャム(placebo sham)によりコーティングパンの充填量を8kgに嵩増しして)被覆した。1%重量増のシールコーティングである非機能性コーティングOpadry(登録商標)IIWhite(Colorcon処方番号57U18539)を錠剤に施して、錠剤の浸食及びコーティングの剥離問題を防いだ。以下のパラメーターを利用して、コーティングパン中で錠剤のコアにOpadry(登録商標)を施した。
吸気温度約75℃ 吸気流量約200cfm
スプレー速度:40g/分 パン速度:12rpm
床温度約:45℃ ガン床距離:5インチ
排気温度約45℃ コーティング懸濁液:固形分15%
噴霧量:533g パン充填量:8kg(0.5kg活性、7.5kgプラセボ)
【0144】
半透過性コーティングは、プロペラ型攪拌翼を備えた寸胴なべ中で20gのヒプロメロースE5LVを900gのMilli−Q水に混合して製造した。1227g分のエチルセルロース系Surelease(登録商標)19040懸濁液(固形分25%)を、攪拌しているヒプロメロース溶液に加え、固形分を15%にした。
【0145】
5%のDow E5LVヒプロメロースで修飾したエチルセルロース系Surelease(登録商標)を、以下の処理パラメーターを利用して、シールコートされた錠剤に施した。
吸気温度約75℃ 吸気流量約200cfm
スプレー速度:40g/分 パン速度:12rpm
床温度約50℃ ガン床距離:5インチ
排気温度約50℃ コーティング懸濁液:固形分15%
噴霧量:2090g パン充填量:8kg(0.5kg活性、7.5kgプラセボ)
【0146】
錠剤の試料を、3%及び4%重量増の修飾されたSurelease(登録商標)コーティングとともに取り除いた。被覆された錠剤を、オーブン内で周囲雰囲気中で、40℃で18時間乾燥/硬化させた。1−メチルニコチンアミドの放出は、コーティング量によって1〜2時間遅れた。さらに、被覆された生成物の放出は、被覆されていない錠剤に対して、より直線の放出プロファイルを与えた。
【0147】
実施例3−流動床中の水性湿式トップスプレー造粒
この実施例では、流動床トップスプレー造粒を使用して、50mg含量のニフェジピン錠剤を製造する。ステアリン酸マグネシウム以外の、2kgバッチの成分すべてを20メッシュのふるいにかけ、トップスプレー用のスプレーガンを備えたNiro MP−1流動床プロセッサーに入れた。
【0148】
【表5】

【0149】
吸気温度65℃で材料を流動化し、30/g/分で30psiの噴霧圧力で水を噴霧する。全部で450gの水を噴霧する。顆粒を流動床中で約2.0%のLODに乾燥させる。乾燥させた顆粒を、0.040インチ超タイプスクリーンを備えたQuadro Comilを使用して一定サイズに粉砕する。粉砕した顆粒をステアリン酸マグネシウムとともにV型ブレンダーに入れ、3分間ブレンドする。約300mgの重量、約8kpの硬さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH105錠剤プレスで、ブレンドを圧縮した。
【0150】
実施例4−湿式造粒−水性高剪断50mgジクロフェナクカリウム錠
【0151】
【表6】

【0152】
高剪断水性造粒を利用した。ステアリン酸マグネシウム(40メッシュふるいでふるった)以外の、1kgバッチの成分全てを、20メッシュのふるいでふるい、Niro PP−1高剪断造粒機に入れた。攪拌翼速度300rpmでチョッパーを使わずに、材料を3分間混合した。攪拌翼を300rpmで運転しチョッパーを1500rpmの低速に設定した状態で、およそ3分にわたり、攪拌されている塊に350gの水を噴霧した。さらに1分間混合して、顆粒を生成させた。湿った顆粒を吸気温度65℃でNiro MP−1流動床で流動化し、流動床中で約2.2%のLODに乾燥させた。乾燥させた顆粒を、0.050インチ超タイプスクリーンを備えたQuadra Comilを利用して一定サイズに粉砕した。粉砕した顆粒をステアリン酸マグネシウムと合わせ、3分間バッグブレンド(bag blend)した。約300mgの重量、約10kpの硬さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH103錠剤プレスで、ブレンドを圧縮した。
【0153】
実施例5−50mgニフェジピン錠及び低剪断湿式造粒を利用して界面活性剤とともに、又は界面活性剤なしで製造したミニタブレットを含むマルチパーティキュレートカプセル
ニフェジピン錠及びミニタブレットを、以下に示す製剤あたりのSLS界面活性剤とともに、又は界面活性剤なしで微粒子化ニフェジピンを利用して製造した。
【0154】
【表7】

【0155】
これらの実施例において、100gバッチの成分(ステアリン酸マグネシウム以外)を20メッシュのふるいでふるい、Kitchen Aideプラネタリーミキサーに入れ、1分間混合した。50gの水又は水に溶かした53gの6%ラウリル硫酸ナトリウム(SLS)を、約5分かけて混合材料にゆっくりと注いだ。次いで、顆粒をステンレススチールのトレイに拡げ、50℃のオーブンでおよそ245時間、2〜3パーセントのLOD水分含量まで乾燥させた。乾燥済み顆粒(SLSを含むもの又は含まないもの)を、正方形タイプの攪拌翼及び0.050インチ超タイプスクリーンを使用して、Comilにより粉砕した。ステアリン酸マグネシウムを40メッシュのふるいでふるい、細分した1%ステアリン酸マグネシウムを、各顆粒に入れて72回転回させてバッグブレンドした。錠剤(3/8インチ円形標準凹形)を、ターゲット錠剤重量300mg、硬さ8kpでSLSを含む顆粒から圧縮した。
【0156】
SLSを含む顆粒及び含まない顆粒の両方から作られるミニタブレットを、ターゲット重量約20mg及び硬さ3kpで、直径0.0984インチ円形標準凹形器具を使用して圧縮した。カプセルあたり15のミニタブ(充填重量300mg)を、サイズ1ハードゼラチンカプセルに入れ、マルチパーティキュレートシステムを与えた。
【0157】
実施例6−直接打錠及び高剪断湿式造粒により調製したジクロフェナク錠
ジクロフェナクカリウム含量50mg錠:ロット003A、B、D、Eを実施例1で利用した直接打錠により調製し、ロット041を実施例4で利用した高剪断湿式造粒により調製した。
【0158】
【表8】

【0159】
実施例7−実施例1で利用した直接打錠により調製したアセトアミノフェン(含量50mg錠)ロット011A−E
【0160】
【表9】

【0161】
実施例8−実施例1で利用した直接打錠により調製したアセトアミノフェン(含量50mg錠)ロット013A−B
【0162】
【表10】

【0163】
実施例9−遅延放出被覆されたアセトアミノフェン(含量50mg錠)
ロット011及び13の錠剤は、実施例1で利用した直接打錠により調製し、実施例2で利用した1%重量増のヒプロメロースシールコートにより被覆し、それに次いで2、3、又は4%重量のエチルセルロース/ヒプロメロースコート(半透過性コーティング)により被覆した。錠剤を、コーティング量によって、ロット033−1/2%、1/3%、又は1/4%と割り当てた。
【0164】
実施例10−ニフェジピン(含量50mg錠)錠を、実施例1で利用した直接打錠により調製した。
【0165】
【表11】

【0166】
実施例11−ニフェジピン(微粒子化)錠剤ロット037及びミニタブレットロット039(内部界面活性剤含む)及びミニタブレットロット040(内部界面活性剤含まない)。錠剤は全て、実施例5で利用した低剪断湿式造粒により調製した。
【0167】
【表12】

【0168】
実施例12−塩酸ミノサイクリン含量50mg錠(ロット022)を、実施例1で利用した直接打錠により調製した。
【0169】
【表13】

【0170】
実施例13−ロット005及び018の1−メチルニコチンアミドクロリド含量270mg錠を実施例1で利用した直接打錠により調製し、ロット009Aを実施例2で使用した乾式造粒により調製した。
【0171】
【表14】

【0172】
実施例14:予備造粒(pre−granulated)した「緩徐」放出ブレンドの調製
予備造粒した緩徐放出ブレンドを、高剪断造粒を利用して1kgのバッチとして調製した。ポリマーをNiro PP−1造粒機に入れ、攪拌翼速度300rpm及び低速のチョッパーの設定で16分にわたり700gの水と混合した。水を入れてからさらに3分間混合を延長した。Niro MP−1流動床プロセッサー内で、吸気温度55〜65℃で30分間、LOD値4.8%に顆粒を乾燥させた(造粒前には基準の水分値は7.9%であった)。075R又は055R丸穴スクリーンを備えたQuadro(登録商標)Comil(登録商標)に、50%スピードで顆粒を通した。
【0173】
【表15】

【0174】
実施例15:予備造粒した「速」放性ブレンドの調製
ポリマーをNiro PMA 65高剪断造粒機に入れ、低速の攪拌翼の速度及びチョッパーなしで3分間予備混合した。次いで、低速の攪拌翼速度及び低速のチョッパー速度で混合しながら、全体で10500gの水を、650g/分でポリマーに噴霧した。湿っているポリマーをさらに3分間混合し、次いで、Niro MP−3流動床乾燥機に移し、吸気温度約70℃、空気の体積およそ200CMHで乾燥させた。ポリマーをLODにより測定して3.4%の水分含量に乾燥させた。乾燥させた顆粒を、攪拌翼速度30%で、円形攪拌翼及び055R(0.055インチ直径丸穴スクリーン)を備えた197S型Quadro Comilで粉砕した。
【0175】
【表16】

1 精製水は処理の間に除かれるので、処方の一部として考えられていない。精製水消滅期間は精製水分注後24時間である。
【0176】
実施例16〜18:15、30、及び60mg速放性硫酸モルヒネ持続放出錠の調製
これらの製剤を、バッグブレンディング及び直接打錠プロセスで調製した。適切な量の医薬品原体、実施例15の速放性ブレンドに示した成分、及びProSolv HD 90を適切なバッグに加え、120転回ブレンドした。実施例15の成分は、予備造粒ではなく直接打錠した。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0177】
【表17】

【0178】
実施例19〜20:100mg及び200mg速放性硫酸モルヒネ持続放出錠の調製
これらの製剤をバッグブレンディング及び直接打錠プロセスで調製した。適切な量の医薬品原体、実施例14の緩徐放出ブレンド、又は実施例15の速放性ブレンドに示された成分のそれぞれ、及びProSolv HD 90を適切なバッグに加え、120転回ブレンドした。実施例15の成分は、予備造粒ではなく直接打錠した。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0179】
【表18】

【0180】
実施例21〜22:図15に示す溶出試験に使用する、60mg緩徐放出及び速放性硫酸モルヒネ持続放出錠の調製
これらの製剤は、バッグブレンディング及び直接打錠プロセスにより調製した。適切な量の医薬品原体、それぞれ実施例15又は16の緩徐放出又は速放性ブレンド、及びProSolv HD 90を、適切なバッグに加え、120転回ブレンドした。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0181】
【表19】

【0182】
実施例23〜24:40mg緩徐放出及び速放性塩酸オキシコドン持続放出錠の調製
これらの製剤を、バッグブレンディング及び直接打錠プロセスにより調製した。適切な量の医薬品原体、それぞれ実施例15又は16の緩徐放出又は速放性ブレンド、及びProSolv HD 90を適切なバッグに加え、120転回ブレンドした。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0183】
【表20】

【0184】
当業者は、通常の実験のみを利用して、本明細書に記載した本発明の具体的な実施形態の多くの等価物を認識し、又は確認できるだろう。そのような等価物は、以下の請求項の範囲に包含されるものとする。
【技術分野】
【0001】
本発明は、制御放出医薬組成物に関する。
【0002】
(関連出願)
本特許出願は、参照によりその開示全体が本明細書に取り込まれる「持続放出医薬製剤」という名称の2008年12月19日に出願された、米国特許出願第12/339,529号に関連し、その優先権を主張する。
【背景技術】
【0003】
薬剤開発の目的は、引き続き最適な薬剤療法の送達を達成することにある。種々の因子の中で、治療すべき病態、薬剤放出のタイミング、並びに原薬の化学的特性及び物理的特性は、最適な療法を得ることにどの程度成功するかに影響を与えうる。持続放出としても知られる、制御放出医薬品の利用は、約4時間から約24時間継続する長期間に、許容できる治療指数(薬剤の安全性及び効能)とともに、所望の薬物療法を送達できる。制御放出製剤は、患者のコンプライアンスを高めるために投薬の頻度を低減し、所望の血中濃度を維持し1日に3回から4回投与される従来の即放性医薬品に関連する変動を避けるので、副作用の重症度及び頻度を低下させることができる。
【発明の概要】
【0004】
本発明は、4種の主成分:i)有効量の少なくとも1種の原薬;ii)少なくとも1種の薬剤的に許容できる、水膨脹性pH非依存性ポリマー;少なくとも1種の薬剤的に許容できる、アニオンpH依存性ポリマー;及び(iv)a)少なくとも1種の薬剤的に許容できるカチオンポリマー;及びb)少なくとも1種の薬剤的に許容できるヒドロコロイドからなる群から選択される薬剤的に許容できるポリマーを含むマトリックス型(matrix−forming)徐放性医薬製剤を提供する。これらの製剤は経口投与されるのが典型的であり、周囲環境の特性に依存するインビトロ放出パターンを有する。胃内pHでは、これらの製剤からのインビトロ放出パターンはほぼ直線である。腸内pHでは、これらの製剤からのインビトロ放出パターンは、実質的に一次放出パターンである。所望のインビトロ放出パターンは、上述の主成分の範囲及び濃度を操作して設計できる。本発明の組成物を利用すると、種々の期間の放出パターンを、広範囲の溶解度を持つ原薬を使用して達成できる。これらの医薬組成物に、薬剤的に機能のある、又は薬剤的に機能のないコーティングを加えることもできる。経口剤形は、例えば、限定はされないが、直接打錠又は乾式もしくは湿式の造粒により調製できる錠剤或いはカプセルの形態でよい。
【図面の簡単な説明】
【0005】
【図1】実施例1の塩酸ミノサイクリン含量(strength)50mg錠の種々の媒体での溶出プロファイル。
【図2】実施例2の遅延放出被覆した含量270mgの1−メチルニコチンアミドクロリド錠のpH6.8のリン酸緩衝液での溶出。
【図3】直接打錠に対してトップスプレー湿式造粒により調製した、実施例4のジクロフェナクカリウム含量50mg錠の比較。
【図4】実施例5のニフェジピン含量50mg錠に対してミニタブの1%SLSを含む0.1NのHClでの溶出。
【図5】実施例6のジクロフェナク含量50mg錠のpH緩衝液6.8での溶出プロファイル。
【図6】直接打錠に対して高剪断湿式造粒により調製した、実施例6の含量50mgジクロフェナクカリウム含量錠の比較。
【図7】実施例7及び8で調製したアセトアミノフェン含量50mg錠の種々の媒体での溶出。
【図8】実施例7及び8で調製したアセトアミノフェン含量50mg錠のpH緩衝液6.8での溶出。
【図9】実施例9で調製したアセトアミノフェン含量50mg錠の溶出。
【図10】実施例10で調製したニフェジピン含量50mg錠(ロット017)の種々の媒体での溶出。
【図11】実施例10で調製したニフェジピン含量50mg錠(ロット020)の種々の媒体での溶出。
【図12】実施例11で調製したニフェジピン含量50mg錠及びミニタブの0.1NのHCl媒体での溶出。
【図13】実施例12で調製したミノサイクリン含量50mg錠の種々の媒体での溶出。
【図14】実施例13で調製した、ヒプロメロース対HPS対エチルセルロースを使用した1−メチルニコチンアミドクロリド含量270mg錠のpH6.8緩衝液での溶出。
【図15】実施例16〜17の調合物を使用した速放性硫酸モルヒネ含量15及び30mg錠の溶出。
【図16】実施例20〜21の調合物を使用した、緩徐放出対速放性硫酸モルヒネ含量60mg錠の溶出。
【図17】実施例19の速放性硫酸モルヒネ含量100mg錠の溶出。
【図18】実施例20の速放性硫酸モルヒネ含量200mg錠の溶出。
【発明を実施するための形態】
【0006】
特記されない限り、本発明が、具体的な活性薬剤、ビヒクル、賦形剤、剤形などに限定されず、それらは変動しうることが理解できよう。本明細書で使用される用語は特定の実施形態を説明する目的のみのものであり、限定的ではないものとすることも理解できよう。
【0007】
本明細書及び添付の請求項では、単数形「1つの(a,an)」及び「前記(the)」は、文脈が明らかにそうでないと示さない限り複数の指示物を含む。そのため、例えば、「1種の活性薬剤」への言及は、単一の活性薬剤並びに2種以上の異なる活性薬剤の組み合わせを含み、「1種の賦形剤」への言及は、2種以上の賦形剤の混合物並びに単一の賦形剤を含む、などである。
【0008】
本発明の記載及び特許請求に際し、以下の用語は、以下に述べられる定義に従って使用されるだろう。
【0009】
「遅延放出」という用語はその従来の意味で使用され、薬物剤形の経口投与とそれからの薬物の放出との間に遅延時間が設けてある薬物製剤を意味する。「遅延放出」は、長期間にわたる薬物の段階的な放出を含むことも含まないこともあり、そのため「徐放」であることもないこともある。
【0010】
「原薬」、「医薬品原体(「API」)」、「薬理活性薬剤」、「薬物」、及び「薬剤」という用語は本明細書において交換可能に使用され、有益な生物効果、一般的には疾病又は異常な生理学的状態の治療における治療効果を有する、任意の化学化合物、錯体、又は組成物を意味する。これらの用語は、塩、エステル、アミド、プロドラッグ、活性代謝物、異性体、フラグメント、アナログ、配位化合物、及び錯体などを含むがこれらに限定されない、本明細書に具体的に言及される原薬の薬剤的に許容でき、薬理学的に活性な誘導体も包含する。「原薬」、「医薬品原体(「API」)」、「薬理活性薬剤」、「薬物」、及び「薬剤」という用語が使用される場合、又は特別な活性薬剤が具体的に特定される場合、出願者らが、活性薬剤自体、並びに薬剤的に許容でき、薬理学的に活性な塩、エステル、アミド、プロドラッグ、活性代謝物、異性体、フラグメント、アナログ、配位化合物、及び錯体などを含むように意図することが理解できよう。
【0011】
「医薬品」又は「剤形」という用語は、単回投与により治療効果を得るのに十分な量の原薬を含む、任意の形態の医薬組成物を意味する。過剰投薬なしに最も効果的な結果を効率的に生み出す投与の頻度は、親水性など、特定の活性薬剤の薬理学的特性及び物理的特性の両方を含むその特性により変わるだろう。
【0012】
活性薬剤の「有効な量」又は「治療上有効な量」という用語は、非毒性だが、所望の効果を与えるのに十分な薬剤の量を意味する。「有効」である活性薬剤の量は、個体の年齢及び全般的な状態、特定の活性薬剤又は複数の薬剤などによって、被験者毎に異なるだろう。そのため、正確な「有効量」を明示することが常に可能なわけではない。しかし、個別症例において適切な「有効」量は、通常の実験を利用して当業者により決定でき、又は担当医により推奨できる。
【0013】
「持続放出」又は「徐放」という用語は、原薬がある期間にわたって徐々に放出される医薬品を意味する。
【0014】
「一次放出パターン」という用語は式F=Kt1/2により知られるが、前式においてFは放出率(fractional release)であり、Kは定数であり、tは時間である。
【0015】
「胃内pH」という用語は、約4.5未満であるpHを意味する。
【0016】
「即放性」という用語はその従来の意味で使用される。
【0017】
「腸内pH」という用語は、約5.0から約6.8の範囲であるpHを意味する。
【0018】
「ほぼ直線」という用語は、「一次放出パターン」の定義に述べられる式に関する時、nが約ゼロであることを意味する。「マルチモデル放出パターン」という用語は、少なくとも1時間の長期間にわたり少なくとも2つの異なる溶出ピークを有する医薬品からの原薬の放出を意味する。
【0019】
「水性溶媒」という用語は、水を含む液体溶液を意味する。
【0020】
「非水性溶媒」という用語は、本質的に有機又は無機であり水を含まない、製薬分野で通常使用される溶媒を意味する。
【0021】
「薬剤的に許容できる賦形剤」又は「薬剤的に許容できる添加剤」を列挙する場合などの「薬剤的に許容できる」とは、生物学的又は他の面で有害でない物質を意味し、すなわち、そのような物質は、望ましくない生物効果を起こさず、それが含まれる組成物の他の成分のいずれとも有害な相互作用せずに、患者に投与される医薬組成物に取り込まれることができる。
【0022】
「薬剤的に機能のあるコーティング」という用語は、投与時に原薬の放出に影響し、寄与し、又は阻害する、製薬分野に公知である1種以上のコーティングを意味し、例えば、限定はされないが、原薬の遅延放出のための腸溶性コーティング;又は、例えば、制限はされないが、1種以上の原薬を含んで多重相の薬剤放出を与え、コーティング中のそのような原薬が、剤形の残りの部分に含まれる原薬と同じ又は異なるコーティングがある。
【0023】
「薬剤的に機能のないコーティング」という用語は、投与時に原薬の放出に影響せず、寄与せず、阻害もしない、製薬分野に公知である1種以上のコーティングを意味する。
【0024】
本明細書では、「ポリマー」という用語は、共有結合した複数のモノマー単位を含む分子を意味し、直鎖ポリマーの他に分岐状、樹状、及び星状ポリマーを含む。この用語は、ホモポリマー及びコポリマーの両方も含み、例えば、ランダムコポリマー、ブロックコポリマー、及びグラフトコポリマー、並びに架橋していないポリマー、及びわずかに、中程度に、大幅に架橋したポリマーも含む。
【0025】
本明細書では、「治療する」及び「治療」という用語は、症状の重症度及び/又は頻度の低下、症状及び/又は基礎病因の除去、症状及び/又はその基礎病因の発生の予防、及び損傷の向上又は改善を意味する。したがって、例えば、患者の「治療」は、高感受性個体の特定の疾患又は有害な生理学的事象の予防、並びに疾患又は疾病を阻害し、又はその後退を起こすことによる、臨床症状のある個体の治療を含む。
【0026】
「ゼロ次放出パターン」という用語は、式FαKtにより説明可能であり、放出された原薬の部分に対する時間のグラフ形態における放出パターンの少なくとも一部がほぼ直線である、医薬品からの原薬の放出の特徴付けを意味する。
【0027】
本発明は、以下を含むマトリックス型徐放性医薬製剤を提供する:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨脹性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;並びに
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【0028】
本医薬製剤は、経口又は他の投与経路用に設計でき、最終医薬品が非水性溶媒を実質的に含まないように調製できる。
【0029】
本発明は多種多様な原薬の効果的な送達を可能とするので、本発明の医薬製剤を使用して投与できる原薬は限定されない。したがって、投与される原薬(複数可)は、以下を含むがこれらに限定されない種々のクラスのそのような原薬のいずれから選択してもよい:鎮痛剤、麻酔剤、抗狭心症剤、抗関節炎剤、抗不整脈剤、抗喘息剤、抗菌剤、前立腺肥大症治療剤、抗ガン剤、抗コリン剤、抗凝固剤、抗痙攣剤、抗うつ剤、抗糖尿病剤、止瀉剤、抗てんかん剤、抗真菌剤、痛風治療剤、駆虫剤、抗ヒスタミン剤、降圧剤、消炎剤、抗マラリア剤、抗偏頭痛剤、抗ムスカリン剤、鎮吐剤、抗新生物剤、抗肥満剤、抗骨粗鬆症剤、パーキンソン病治療剤、抗原虫剤、止痒剤、抗精神病薬、解熱剤、鎮痙剤、抗甲状腺剤、抗結核剤、抗潰瘍剤、抗尿失禁剤、抗ウイルス剤、精神安定剤、食欲抑制剤、注意欠陥障害(ADD)及び注意欠陥多動性障害(ADHD)治療剤、カルシウムチャネル遮断剤、強心剤、β遮断剤、中枢神経刺激剤、認知改善剤、コルチコステロイド、COX−2阻害剤、充血緩和剤、利尿剤、胃腸剤、遺伝物質、ヒスタミン受容体拮抗剤、ホルモン遮断剤(hormonolytics)、催眠剤、血糖降下剤、免疫抑制剤、角質溶解剤、ロイコトリエン阻害剤、脂質調節剤、マクロライド、有糸分裂阻害剤、筋弛緩剤、麻薬拮抗剤、栄養補助食品、神経遮断剤、ニコチン、栄養オイル、副交感神経抑制剤、鎮痛剤、性ホルモン、交感神経興奮剤、精神安定剤、血管拡張剤、ビタミン、及びこれらの組み合わせ。当業者に認識されるとおり、また以下の議論から推測されるとおり、薬剤によっては、上述の群の2種以上により包含されるものもある。
【0030】
原薬は、疎水性でも、両親媒性でも、親水性でもよい。本明細書において「疎水性」と称される原薬の固有の水溶解度、すなわち、電気的に中性で非電離形態の原薬の水溶解度は、一般的に1重量%未満であり、典型的には0.1重量%又は0.01重量%未満である。本明細書における親水性及び両親媒性原薬(特記されない限り、「親水性」原薬と集合的に称される)は、みかけの水溶解度が、少なくとも0.1重量%であり、典型的には少なくとも1重量%である。疎水性原薬及び親水性原薬の両方は、制限なしに、本明細書に列挙された原薬クラスのいずれからでも選択できる。そのような薬剤の溶解度を分類するもう1つの方法において、本発明の製剤に製剤するために選択された薬剤(複数可)は、高い溶解度;中程度の溶解度;低い溶解度;低から中程度の溶解度;又は中程度から高い溶解度を持つことがある。同様に、これらの溶解度クラス内の原薬は、制限なしに、本明細書に列挙された原薬クラスのいずれからでも選択できる。例えば、2種以上の原薬が本製剤での使用に選択される場合、そのような原薬のそれぞれを異なる溶解度クラスから選んでよい。
【0031】
上記で引用された種々の原薬の要処方箋及び/又は一般用カテゴリーの中で、以下の非限定的な例が与えられる:抗炎症原薬及び非オピオイド鎮痛剤、例えば限定はされないが、アロキシプリン、オーラノフィン、アザプロパゾン、アザチオプリン、ベノリレート、ブトルフェノール(butorphenol)、カプサイシン、セレコキシブ、ジクロフェナク、ジフルニサル、エソナリモド、エトドラク、フェンブフェン、フェノプロフェンカルシウム、フルルビプロフェン、イブプロフェン、インドメタシン、ケトプロフェン、ケトロラク、レフルノミド、メクロフェナム酸、メフェナム酸、ナブメトン、ナプロキセン、ノバントロン、オキサプロジン、オキシフェンブタゾン、パレコキシブ、フェニルブタゾン、ピクラミラスト、ピロキシカム、ロフェコキシブ、ロピバカイン、スリンダク、テトラヒドロカンナビノール、トラマドール、トロメタミン、バルデコキシブ、及びジコノチド、並びに尿路鎮痛剤、フェナゾピリジン及びトルテロジン;
【0032】
抗狭心症原薬、例えば限定はされないが、ミベフラジル、レフルダン、ナフネフェン(nahnefene)、カルベジロール、クロマフィバン(cromafiban)、ラミフィバン、ファスジル、ラノラジン、テジサミル、ニソルジピン、及びチザニジン;
【0033】
駆虫剤、例えば限定はされないが、アルベンダゾール、ベフェニウムヒドロキシナフトエート、カンベンダゾール、ジクロロフェン、イベルメクチン、メベンダゾール、オキサムニキン、オクスフェンダゾール、パモ酸オキサンテル、プラジカンテル、パモ酸ピランテル、及びチアベンダゾール;
【0034】
抗不整脈剤、例えば、アミオダロン、ジソピラミド、酢酸フレカイニド、及び硫酸キニジン;
【0035】
抗喘息原薬、例えば限定はされないが、ジロートン、ザフィルルカスト、硫酸テルブタリン、モンテルカスト、及びアルブテロール;
【0036】
抗菌原薬、例えば限定はされないが、アラトロフロキサシン、アジスロマイシン、バクロフェン、ベネタミンペニシリン、シノキサシン、シプロフロキサシン、クラリスロマイシン、クロファジミン、クロキサシリン、デメクロサイクリン、ジリスロマイシン、ドキシサイクリン、エリスロマイシン、エチオナミド、フラゾリドン、グレパフロキサシン、イミペネム、レボフロキサシン、ロレフロキサシン(lorefloxacin)、モキシフロキサシン、ナリジクス酸、ニトロフラントイン、ノルフロキサシン、オフロキサシン、リファンピシン、リファブチン、リファペンチン、スパルフロキサシン、スピラマイシン、スルファベンズアミド、スルファドキシン、スルファメラジン、スルファセタミド、スルファジアジン、スルファフラゾール、スルファメトキサゾール、スルファピリジン、テトラサイクリン、トリメトプリム、トロバフロキサシン、及びバンコマイシン;
【0037】
抗ガン原薬及び免疫抑制剤、例えば限定はされないが、アリトレチノイン、アミノグルテチミド、アムサクリン、アナストロゾール、アザチオプリン、ベキサロテン、ビカルタミド、ビリコダル、ビサントレン、ブスルファン、カンプトテシン、カンドキサトリル、カペシタビン、シタラビン、クロラムブシル、シクロスポリン、ダカルバジン、デシタビン、エリプチシン、エストラムスチン、エトポシド、ゲムシタビン、イリノテカン、ラソフォキシフェン、レトロゾール、ロムスチン、メルファラン、メルカプトプリン、メトトレキサート、マイトマイシン、ミトタン、ミトキサントロン、モフェチル、ミコフェノレート、ネビボロール、ニルタミド、パクリタキセル、パロノセトロン、プロカルバジン、ラミプリル、ルビテカン、シロリムス、タクロリムス、タモキシフェン、テニポシド、テストラクトン、サリドマイド、チラパザミン、トポテカン、クエン酸トレミフェン、ビタミンA、ビタミンA誘導体、及びザコプリド;
【0038】
抗凝固剤及び脳卒中を予防及び治療するための他の原薬、例えば限定はされないが、シロスタゾール、シチコリン、クロピドグレル、クロマフィバン、デキサナビノール、ジクマロール、ジピリダモール、ニクマロン、オプレルベキン、ペリンドプリルエルブミン、フェニンジオン、ラミプリル、レピノタン、チクロピジン、チロフィバン、並びに有機又は無機の塩基により形成したヘパリン塩及び低分子量ヘパリン、すなわち一般的に重量平均分子量が約1000から約10,000Dであり、エノキサパリン、ダルテパリン、ダナパロイド、ガンマパリン(gammaparin)、ナドロパリン、アルデパリン、チンザパリン、セルトパリン、及びレビパリンにより例示されるヘパリン断片を含むヘパリン;
【0039】
抗糖尿病原薬には、例えば限定はされないが、アセトヘキサミド、クロルプロパミド、シグリタゾン、ファルグリタザル、グリベンクラミド、グリクラジド、グリピジド、グルカゴン、グリブリド、グリメピリド(glymepiride)、ミグリトール、ナテグリニド、ピマゲジン、ピオグリタゾン、レパグリニド、ロシグリタゾン、トラザミド、トルブタミド、トリアムプテリン(triampterine)、トログリタゾン、及びボグリボースがあり;
【0040】
抗てんかん剤、例えば限定はされないが、ベクラミド、カルバマゼピン、クロナゼパム、エトトイン、フェルバメート、フォスフェニトイン、ラモトリギン、メトイン、メトスクシミド、メチルフェノバルビトン、オキスカルバゼピン、パラメタジオン、フェナセミド、フェノバルビトン、フェニトイン、フェンスクシミド、プリミドン、スルチアム、チアガビン、トピラマート、バルプロ酸、及びビガバトリン;
【0041】
抗真菌原薬、例えば限定はされないが、アムホテリシン、ブテナフィン、硝酸ブトコナゾール、クロトリマゾール、硝酸エコナゾール、フルコナゾール、フルシトシン、グリセオフルビン、イトラコナゾール、ケトコナゾール、ミコナゾール、ナタマイシン、ナイスタチン、硝酸スルコナゾール、オキシコナゾール、テルビナフィン、テルコナゾール、チオコナゾール、及びウンデセン酸;
【0042】
抗痛風原薬、例えば限定はされないが、アロプリノール、プロベネシド、及びスルフィンピラゾン;
【0043】
抗ヒスタミン及びアレルギー医薬、例えば限定はされないが、アクリバスチン、アステミゾール、クロルフェニラミン、シンナリジン、セチリジン、クレマスチン、シクリジン、シプロヘプタジン、デスロラタジン、デクスクロルフェニラミン、ジメンヒドリナート、ジフェンヒドラミン、エピナスチン、フェキソフェナジン、フルナリジン、ロラタジン、メクリジン、ミゾラスチン、オキサトミド、及びテルフェナジン;
【0044】
降圧原薬には、例えば限定はされないが、アムロジピン、ベナゼプリル、ベニジピン、カンデサルタン、カプトプリル、カルベジロール、ダロジピン、ジリタゼム(dilitazem)、ジアゾキシド、ドキサゾシン、エナラプリル、エプレロノン(epleronone)、エポサルタン(eposartan)、フェロジピン、フェノルドパム、ホシノプリル、グアナベンズ、イロプロスト、イルベサルタン、イスラジピン、レルカルジニピン(lercardinipine)、リジノプリル、ロサルタン、ミノキシジル、ネビボロール、ニカルジビン、ニフェジピン、ニモジピン、ニソルジピン、オマパトリラト、フェノキシベンザミン、プラゾシン、キナプリル、レセルピン、セモチアジル、シタクスセンタン、テラゾシン、テルミサルタン、及びバルサルタン。
【0045】
抗マラリア剤、例えば限定はされないが、アモジアキン、クロロキン、クロルプログアニル、ハロファントリン、メフロキン、プログアニル、ピリメタミン、及び硫酸キニーネ;
【0046】
抗偏頭痛剤を含む、頭痛を治療するための原薬、例えば限定はされないが、アルモトリプタン、ブトルファノール、ジヒドロエルゴタミン、メシル酸ジヒドロエルゴタミン、エレトリプタン、エルゴタミン、フロバトリプタン、メチセルギド、ナラトリプタン、ピゾチリン、リザトリプタン、スマトリプタン、トナベルスタット(tonaberstat)、及びゾルミトリプタン;
【0047】
抗ムスカリン原薬、例えば限定はされないが、アトロピン、ベンズヘキソール、ビペリデン、エトプロパジン、ヒヨスチアミン、臭化メペンゾラート、オキシフェンサイクリミン、スコポラミン、及びトロピカミド;
【0048】
抗原虫原薬、例えば限定はされないが、アトバコン、ベンズニダゾール、クリオキノール、デコキネート、ジヨードヒドロキシキノリン、ジロキサニドフロエート、ジニトルミド、フラゾリドン、メトロニダゾール、ニモラゾール、ニトロフィラゾン(nitrofirazone)、オルニダゾール、及びチニダゾール;
【0049】
抗甲状腺原薬、例えば限定はされないが、カルビマゾール、パリカルシトール、及びプロピルチオウラシル;
【0050】
鎮咳剤、例えば限定はされないがベンゾナテート;
【0051】
抗ウイルス原薬には、例えば限定はされないが、抗ヘルペス剤アシクロビル、ファムシクロビル、ホスカルネット、ガンシクロビル、イドクスウリジン、ソリブジン、トリフルリジン、バラシクロビル、及びビダラビン、及び他の抗ウイルス剤、例えば、アバカビル、アマンタジン、アンプレナビル、デルビリジン(delviridine)、ジダノシン、エファビレンツ、インジナビル、インターフェロンアルファ、ラミブジン、ネルフィナビル、ネビラピン、リバビリン、リマンタジン、リトナビル、サキナビル、スタブジン、チプラナビル、バルガンシクロビル、ザルシタビン、及びジドブジン;及び他の抗ウイルス剤、例えば、アバカビル、インジナビル、インターフェロンアルファ、ネルフィナビル、リバビリン、リマンタジン、チプラナビル、ウルソデオキシコール酸、及びバルガンシクロビル。
【0052】
抗不安剤、鎮痛剤、及び催眠剤、例えば限定はされないが、アルプラゾラム、アミロバルビトン、バルビトン、ベンタゼパム、ブロマゼパム、ブロムペリドール、ブロチゾラム、ブトバルビトン、カルブロマール、クロルジアゼポキシド、クロルメチアゾール、クロルプロマジン、クロルプロチキセン、クロナゼパム、クロバザム、クロチアゼパム、クロザピン、デクスメチルフェニデート(d−トレオ−メチルフェニデート)ジアゼパム、ドロペリドール、エチナメート、フルナニゾン(flunanisone)、フルニトラゼパム、トリフルプロマジン、デカン酸フルペンチキソール、フルフェナジン、フルラゼパム、ガバペンチン、ガボクサドール、γ-ヒドロキシブチラート、ハロペリドール、ラモトリギン、ロラゼパム、ロルメタゼパム、メダゼパム、メプロバメート、メソリダジン、メタカロン、メチルフェニデート、ミダゾラム、モダフィニル、モリンドン、ニトラゼパム、オランザピン、オキサゼパム、ペントバルビトン、ペルフェナジンピモジド、プレガバリン、プロクロルペラジン、プソイドエフェドリン、クエチアピン、リスペリドン、セルチンドール、シラメシン、スルピリド、スネピトロン、テマゼパム、チオリダジン、トリアゾラム、ザレプロン、ゾルピデム、及びゾピクロン;
【0053】
食欲抑制剤、抗肥満原薬、及び摂食障害を治療する原薬、例えば限定はされないが、アンフェタミン、ブロモクリプチン、デキストロアンフェタミン、ジエチルプロピオン、リンチトリプト、マジンドール、メタンフェタミン、オルリスタット、フェンテルミン、及びトピラマート;
【0054】
心臓血管原薬、例えば限定はされないが、アンジオテンシン変換酵素(ACE)阻害剤、例えば、エナラプリル、ラミプリル、ペリンドプリルエルブミン、1−カルボキシメチル−3−1−カルボキシ−3−フェニル−(1S)−プロピルアミノ−2,3,4,5−テトラヒドロ−1H−(3S)−1−ベンゾアゼピン−2−オン、3−(5−アミノ−1−カルボキシ−1S−ペンチル)アミノ−2,3,4,5−テトラヒドロ−2−オキソ−3S−1H−1−ベンゾアゼピン−1酢酸、又は3−(1−エトキシカルボニル−3−フェニル−(1S)−プロピルアミノ)−2,3,4,5−テトラヒドロ−2−オキソ−(−3S)−ベンゾアゼピ酸(benzazepi acid)一塩酸塩;強心配糖体及び強心剤、例えば、アムリノン、ジゴキシン、ジギトキシン、エノキシモン、ラナトシドC、メジゴキシン、及びミルリノン;カルシウムチャネル遮断剤、例えば、ベラパミル、ニフェジピン、ニカルジペン(nicardipene)、フェロジピン、イスラジピン、ニモジピン、アムロジピン、及びジルチアゼム;β遮断剤、例えばアセブトロール、アルプレノロール、アテノロール、ラベタロール、メトプロロール、ナドロール、オキシプレノロール、ピンドロール、プロパフェノン、プロプラノロール、エスモロール、ソタロール、チモロール、及びアセブトロール;抗不整脈剤、例えば、モリシジン、ドフェチリド、イブチリド、ネシリチド、プロカインアミド、キニジン、ジソピラミド、リドカイン、フェニトイン、トカイニド、メキシレチン、フレカイニド、エンカイニド、ブレチリウム、及びアミオダロン;心保護剤、例えば、デクスラゾキサン及びロイコボリン;血管拡張薬剤、例えばニトログリセリン;利尿剤、例えば、アゼタゾラミド(azetazolamide)、アミロライド、ベンドロフルメチアジド、ブメタニド、クロロチアジド、クロルタリドン、エタクリン酸、フロセミド、ヒドロクロロチアジド、メトラゾン、ネシリチド、スピロノラクトン,及びトリアムテリン(triamterine);及び種々の心臓血管薬物、例えば、モンテプラーゼ及びコルロパム(corlopam);
【0055】
コルチコステロイド、例えば限定はされないが、ベクロメタゾン、ベタメタゾン、ブデソニド、コルチゾン、デスオキシメタゾン、デキサメタゾン、フルドロコルチゾン、フルニソリド、フルオコルトロン、プロピオン酸フルチカゾン、ヒドロコルチゾン、メチルプレドニゾロン、プレドニゾロン、プレドニゾン、及びトリアムシノロン;
【0056】
勃起障害原薬、例えば限定はされないが、ポモルフィン(pomorphine)、フェントラミン、及びバルデナフィル;
【0057】
胃腸原薬、例えば限定はされないが、アロセトロン、ビサコジル、シランセトロン、シメチジン、シサプリド、ジフェノキシレート、ドンペリドン、エソメプラゾール、ファモチジン、グラニセトロン、ランソプラゾール、ロペラミド、メサラジン、ニザチジン、オメプラゾール、オンダンセトロン、プラントプラゾール(prantoprazole)、ラベプラゾールナトリウム、ラニチジン、リスペリドン、スルファサラジン、及びテガセロッド;
【0058】
遺伝物質、例えば限定はされないが、核酸、RNA、DNA、遺伝子組換えRNA、遺伝子組換えDNA、アンチセンスRNA、アンチセンスDNA、リボザイム、リボオリゴヌクレオチド、デオキシリボヌクレオチド、アンチセンスリボオリゴヌクレオチド、及びアンチセンスデオキシリボオリゴヌクレオチド。代表的な遺伝子には、血管内皮細胞成長因子、繊維芽細胞成長因子、Bcl−2、嚢胞性線維症膜制御因子、神経成長因子、ヒト成長因子、エリスロポエチン、腫瘍壊死因子、及びインターロイキン−2をコードするもの、並びにHLA−B7など組織適合遺伝子がある。
【0059】
角質溶解剤、例えば限定はされないが、アセトレチン(acetretin)、カルシポトリエン、カルシフェジオール、カルシトリオール、コレカルシフェロール、エルゴカルシフェロール、エトレチナート、レチノイド、ターグレチン、及びタザロテン;
【0060】
一般的に疎水性と分類される脂質調節原薬には、HMG CoA還元酵素阻害剤、例えば限定はされないが、アトルバスタチン、シンバスタチン、フルバスタチン、プラバスタチン、ロバスタチン、セリバスタチン、ロスバスタチン、及びピタバスタチン、並びに他の脂質低下(抗高脂血症)原薬、例えば1−メチルニコチンアミドクロリド(1−MNA)HCl、ベザフィブレート、ベクロブラート、ビニフィブラート、シプロフィブラート、クリノフィブラート、クロフィブラート、クロフィブリン酸、エゼチミブ、エトフィブラート、フェノフィブラート、フェノフィブリン酸、ゲムフィブロジル、ナイアシン、ニコフィブラート、ピリフィブラート、プロブコール、ロニフィブラート、シンフィブラート、及びテオフィブラートがある。
【0061】
筋弛緩剤、例えば限定はされないが、シクロベンザプリン、ダントロレンナトリウム、及びチザニジンHCl;
【0062】
アルツハイマー病を治療する活性原薬を含む、神経変性疾患を治療するための薬剤、例えば限定はされないが、アカチノール、ドネゼピル(donezepil)、塩酸ドネペジル、ドロナビノール、ガランタミン、ネオトロフィン、ラサジリン、フィゾスチグミン、サリチル酸フィゾスチグミン、プロペントフィリン、クエチアピン、リバスチグミン、タクリン、塩酸タクリン、サリドマイド、及びキサリプロデン;ハンチントン病を治療するための原薬、例えば限定はされないが、フルオキセチン及びカルバマゼピン;有用な抗パーキンソン病薬物、例えば限定はされないが、アマンタジン、アポモルヒネ、ブロモクリプチン、エンタカポン、レボドパ(特にレボドパ/カルビドパ組み合わせ)、リスリド(lysuride)、ペルゴリド、プラミペキソール、ラサジリン、リルゾール、ロピニロール、セレギリン、スマニロール、トルカポン、トリヘキシフェニジル、及び塩酸トリヘキシフェニジル;及びALSを治療するための原薬、例えば限定はされないが、鎮痙剤バクロフェン、ジアゼミン(diazemine)、及びチザニジン;
【0063】
ニトレート及び他の抗狭心症原薬、例えば限定はされないが、硝酸アミル、硝酸グリセリン、二硝酸イソソルビド、一硝酸イソソルビド、及び四硝酸ペンタエリトリトール;
【0064】
神経遮断原薬、例えば、抗うつ薬物、抗躁病薬物、及び抗精神病剤があり、抗うつ病薬物には、限定はされないが(a)三環系抗うつ剤、例えば、アモキサピン、アミトリプチリン、クロミプラミン、デシプラミン、ドキセピン、イミプラミン、マプロチリン、ノルトリプチリン、プロトリプチリン、及びトリミプラミン、(b)セロトニン再取込み阻害剤、例えば、シタロプラム、フルオキセチン、フルボキサミン、パロキセチン、セルトラリン、及びベンラファキシン、(c)モノアミン酸化酵素阻害剤、例えば、フェネルジン、トラニルシプロミン、及び(−)−セレギリン、及び(d)他の抗うつ剤、例えば、アプレピタント、ブプロピオン、デュロキセチン、ゲピロン、イグメシン、ラモトリギン、マプロチリン、ミアンセリン、ミルタザピン、ネファゾドン、ラバルゾタン(rabalzotan)、スネピトロン、トラゾドン、及びベンラファキシンがあり、抗躁病剤及び抗精神病剤には、例えば限定はされないが、(a)フェノチアジン、例えば、アセトフェナジン、マレイン酸アセトフェナジン、クロルプロマジン、塩酸クロルプロマジン、フルフェナジン、塩酸フルフェナジン、エナント酸フルフェナジン、デカン酸フルフェナジン、メソリダジン、ベジル酸メソリダジン、ペルフェナジン、チオリダジン、塩酸チオリダジン、トリフルオペラジン、及び塩酸トリフルオペラジン、(b)チオキサンテン、例えば、クロルプロチキセン、チオチキセン、及び塩酸チオチキセン、及び(c)複素環薬物、例えば、カルバマゼピン、クロザピン、ドロペリドール、ハロペリドール、デカン酸ハロペリドール、コハク酸ロキサピン、モリンドン、塩酸モリンドン、オランザピン、ピモジド、クエチアピン、リスペリドン、及びセルチンドールがある。
【0065】
栄養剤、例えば限定はされないが、カルシトリオール、カロテン、ジヒドロタキステロール、必須脂肪酸、非必須脂肪酸、フィトナジオール、ビタミンA、ビタミンB2、ビタミンD、ビタミンE、及びビタミンK。
【0066】
オピオイド鎮痛剤、例えば限定はされないが、アルフェンタニル、アポモルヒネ、ブプレノルフィン、ブトルファノール、コデイン、デキストロプロポキシフェン、ジアモルフィン、ジヒドロコデイン、フェンタニル、ヒドロコドン、ヒドロモルホン、レボルファノール、メペリジン、メプタジノール、メタドン、モルヒネ、ナルブフィン、オキシコドン、オキシモルホン、ペンタゾシン、プロポキシフェン、スフェンタニル、及びトラマドール;
【0067】
ペプチド原薬には、天然、化学合成、遺伝子組換えにより作られた、及び/又は大きな分子の生化学(例えば酵素)的な断片化により作られた治療用ペプチド及びタンパク質自体があり、野生型の配列又はその活性のある断片を含みうる。具体的なペプチド薬物には、例えば限定はされないが、ペプチドホルモンアクチビン、アミリン、アンジオテンシン、心房性ナトリウム利尿ペプチド(ANP)、カルシトニン、カルシトニン遺伝子関連ペプチド、カルシトニンN末端フランキングペプチド、毛様体神経栄養因子(CNTF)、コルチコトロピン(副腎皮質刺激ホルモン、ACTH)、コルチコトロピン放出因子(CRF又はCRH)、上皮成長因子(EGF)、卵胞刺激ホルモン(FSH)、ガストリン、ガストリン抑制ペプチド(GIP)、ガストリン放出ペプチド、ゴナドトロピン放出因子(GnRF又はGNRH)、成長ホルモン放出因子(GRF、GRH)、ヒト絨毛性ゴナドトロピン(hCH)、インヒビンA、インヒビンB、インスリン、黄体形成ホルモン(LH)、黄体形成ホルモン放出ホルモン(LHRH)、αメラニン細胞刺激ホルモン、βメラニン細胞刺激ホルモン、γメラニン細胞刺激ホルモン、メラトニン、モチリン、オキシトシン(ピトシン)、膵臓ポリペプチド、副甲状腺ホルモン(PTH)、胎盤性ラクトゲン、プロラクチン(PRL)、プロラクチン放出抑制因子(PIF)、プロラクチン放出因子(PRF)、セクレチン、ソマトトロピン(成長ホルモン、GH)、ソマトスタチン(SIF、成長ホルモン放出抑制因子、GIF)、チロトロピン(甲状腺刺激ホルモン、TSH)、甲状腺刺激ホルモン放出ホルモン(TRH又はTRF)、チロキシン、血管作動性腸管ペプチド(VIP)、及びバソプレッシンがある。他のペプチド原薬は、サイトカイン、例えば、コロニー刺激因子4、ヘパリン結合性神経栄養因子(HBNF)、インターフェロンα、インターフェロンα−2a、インターフェロンα−2b、インターフェロンα−n3、インターフェロンβなど、インターロイキン−1、インターロイキン−2、インターロイキン−3、インターロイキン−4、インターロイキン−5、インターロイキン−6など、腫瘍壊死因子、腫瘍壊死因子α、顆粒球コロニー刺激因子(G−CSF)、顆粒球マクロファージコロニー刺激因子(GM−CSF)、マクロファージコロニー刺激因子、ミドカイン(MD)、及びチモポエチンである。さらに他のペプチド原薬には、エンドルフィン(例えば、デルモルフィン、ダイノルフィン、αエンドルフィン、βエンドルフィン、γエンドルフィン、σエンドルフィン、[Leu5]エンケファリン、[Met5]エンケファリン、P物質)、キニン(例えば、ブラジキニン、増強物質B、ブラジキニン増強物質C、カリジン)、LHRHアナログ(例えば、ブセレリン、デスロレリン、フェルチレリン、ゴセレリン、ヒストレリン、ロイプロリド、ルテレリン、ナファレリン、トリプトレリン)、及び凝固因子、例えば、α1アンチトリプシン、α2マクログロブリン、抗トロンビンIII、因子I(フィブリノーゲン)、因子II(プロトロンビン)、因子III(組織プロトロンビン)、因子V(プロアクセレリン)、因子VII(プロコンベルチン)、因子VIII(抗血友病グロブリン又はAHG)、因子IX(クリスマス因子、血漿トロンボプラスチン因子、又はPTC)、因子X(ステュアート−パワー(Power)因子)、因子XI(血漿トロンボプラスチン前駆体又はPTA)、因子XII(ハーゲマン因子)、ヘパリン副因子II、カリクレイン、プラスミン、プラスミノゲン、プレカリクレイン、プロテインC、プロテインS、及びトロンボモジュリン、及びこれらの組み合わせがある;
【0068】
性ホルモンには、例えば限定はされないが、黄体ホルモン(黄体ホルモン物質)、卵胞ホルモン、及びこれらの組み合わせがある。黄体ホルモンには、アセトキシプレグネノロン、アリルエストレノール、酢酸アナゲストン、酢酸クロルマジノン、シプロテロン、酢酸シプロテロン、デソゲストレル、ジヒドロゲステロン、ジメチステロン、エチステロン(17α−エチニルテストステロン)、二酢酸エチノジオール、酢酸フルロゲストン、ゲスタデン(gestadene)、ヒドロキシプロゲステロン、酢酸ヒドロキシプロゲステロン、カプロン酸ヒドロキシプロゲステロン、ヒドロキシメチルプロゲステロン、酢酸ヒドロキシメチルプロゲステロン、3−ケトデソゲストレル、レボノルゲストレル、リネストレノール、メドロゲストン、酢酸メドロキシプロゲステロン、メゲストロール、酢酸メゲストロール、酢酸メレンゲストロール、ノルエチンドロン、酢酸ノルエチンドロン、ノルエチステロン、酢酸ノルエチステロン、ノルエチノドレル、ノルゲスチメート、ノルゲストレル、ノルゲストリエノン、ノルメチステロン、プロゲステロン、及びトリムゲストン(trimgestone)がある。この一般的なクラスに、卵胞ホルモン、例えばエストラジオール(すなわち、1,3,5−エストラトリエン−3,17β−ジオール、又は「17β−エストラジオール」)及びそのエステル、例えば、エストラジオールの安息香酸エステル、吉草酸エステル、シピオン酸エステル、ヘプタン酸エステル、デカン酸エステル、酢酸エステル、及び二酢酸エステル;17α−エストラジオール;エチニルエストラジオール(すなわち、17α−エチニルエストラジオール)及びそのエステル及びエーテル、例えば、エチニルエストラジオール−3−酢酸エステル及びエチニルエストラジオール−3−安息香酸エステル;エストリオール及びコハク酸エストリオール;リン酸ポリエストロール(polyestrol phosphate);エストロン及びそのエステル及び誘導体、例えば、酢酸エストロン、硫酸エストロン、及び硫酸ピペラジンエストロン;キネストロール;メストラノール;及び結合型ウマエストロゲンも含まれる。多くの状況において、例えば、女性の避妊及びホルモン補充療法(HRT)において、黄体ホルモンと卵胞ホルモンの組み合わせ、例えば、プロゲステロンと17β−エストラジオールが使用される。HRTには、男性ホルモン剤が含まれると有利なことがある。この目的の男性ホルモン剤には、例えば、デヒドロエピアンドロステロン(DHEA;「プラステロン」とも呼ばれる)、デヒドロエピアンドロステロン硫酸ナトリウム、4−ジヒドロテストステロン(DHT;「スタノロン」とも呼ばれる)、及びテストステロン、及びテストステロン及び4−ジヒドロテストステロンの薬剤的に許容できるエステル、典型的にはC−17位に存在するヒドロキシル基から形成されるエステル、例えば限定はされないが、エナント酸エステル、プロピオン酸エステル、シピオン酸エステル、フェニル酢酸エステル、酢酸エステル、イソ酪酸エステル、ブチルシクロヘキサンカルボン酸エステル(buciclate)、ヘプタン酸エステル、デカン酸エステル、ウンデカン酸エステル、カプリン酸エステル、及びイソカプリン酸エステルがあり;
【0069】
男性ホルモン原薬は、当分野に周知である他の目的のために投与してもよい。先に列記された男性ホルモン剤に加え、他の男性ホルモン剤には、アンドロステロン、酢酸アンドロステロン、プロピオン酸エンドロステロン、安息香酸アンドロステロン、アンドロステンジオール、アンドロステンジオール−3−酢酸エステル、及びアンドロステンジオール−17−酢酸エステル、アンドロステンジオール−3,17−二酢酸エステル、アンドロステンジオール−17−安息香酸エステル、アンドロステンジオール−3−酢酸エステル−17−安息香酸エステル、アンドロステンジオン、エチルエストレノール、オキサンドロロン、フェンプロピオン酸ナンドロロン、デカン酸ナンドロロン、フリルプロピオン酸ナンドロロン、シクロヘキサン−プロピオン酸ナンドロロン、安息香酸ナンドロロン、シクロヘキサンカルボン酸ナンドロロン、スタノゾロール、ドロモスタノロン、及びプロピオン酸ドロモスタノロンがあるが、これらに限定されない。
【0070】
注意欠陥障害(ADD)及び注意欠陥多動性障害(ADHD)を含む、ナルコレプシーを治療する活性原薬を含む刺激剤、例えば限定はされないが、アンフェタミン、デクスアンフェタミン、デクスフェンフルラミン、マジンドール、メチルフェニデート(d−トレオ−メチルフェニデート又は「デクスメチルフェニデート」を含む)、モンダフィニル(mondafinil)、ペモリン、及びシブトラミン。
【0071】
溶解度を考慮すると、例示的な疎水性活性薬剤には、限定はされないが、アセトレチン、アセチルコエンザイムQ、アルベンダゾール、アルブテロール、アミノグルテチミド、アミオダロン、アムロジピン、アンフェタミン、アンホテリシンB、アトルバスタチン、アトバコン、アジスロマイシン、バクロフェン、ベクロメタゾン、ベナゼプリル、ベンゾナテート、ベタメタゾン、ビカルタニド(bicalutanide)、ブデソニド、ブプロピオン、ブスルファン、ブテナフィン、カルシフェジオール、カルシポトリエン、カルシトリオール、カンプトテシン、カンデサルタン、カプサイシン、カルバマゼピン、カロテン類、セレコキシブ、セリバスタチン、セチリジン、クロルフェニラミン、コレカルシフェロール、シロスタゾール、シメチジン、シンナリジン、シプロフロキサシン、シサプリド、クラリスロマイシン、クレマスチン、クロミフェン、クロミプラミン、クロピドグレル、コデイン、コエンザイムQ10、シクロベンザプリン、シクロスポリン、ダナゾール、ダントロレン、デクスクロルフェニラミン、ジクロフェナク、ジクマロール、ジゴキシン、デヒドロエピアンドロステロン、ジヒドロエルゴタミン、ジヒドロタキステロール、ジリスロマイシン、ドネゼピル、エファビレンツ、エポサルタン、エルゴカルシフェロール、エルゴタミン、必須脂肪酸源、エストラジオール、エトドラク、エトポシド、ファモチジン、フェノフィブラート、フェンタニル、フェキソフェナジン、フィナステリド、フルコナゾール、フルルビプロフェン、フルバスタチン、ホスフェニトイン、フロバトリプタン、フラゾリドン、ガバペンチン、ゲムフィブロジル、グリベンクラミド、グリピジド、グリブリド、グリメピリド、グリセオフルビン、ハロファントリン、イブプロフェン、イルベサルタン、イリノテカン、硝酸イソソルビド、イソトレチノイン、イトラコナゾール、イベルメクチン、ケトコナゾール、ケトロラック、ラモトリジン、ランソプラゾール、レフルノミド、リジノプリル、ロペラミド、ロラタジン、ロバスタチン、L−チロキシン、ルテイン、リコピン、メドロキシプロゲステロン、ミフェプリストン、メフロキン、酢酸メゲストロール、メタドン、メトキサレン、メトロニダゾール、ミコナゾール、ミダゾラム、ミグリトール、ミノキシジル、ミトキサントロン、モンテルカスト、ナブメトン、ナルブフィン、ナラトリプタン、ネルフィナビル、ニフェジピン、ニソルジピン、ニルタニド(nilutanide)、ニトロフラントイン、ニザチジン、オメプラゾール、オペレベルキン(oprevelkin)、オキサプロジン、パクリタキセル、パラカルシトール(paracalcitol)、パロキセチン、ペンタゾシン、ピオグリタゾン、ピゾフェチン(pizofetin)、プラバスタチン、プレドニゾロン、プロブコール、プロゲステロン、プソイドエフェドリン、ピリドスチグミン、ラベプラゾール、ラロキシフェン、レパグリニド、リファブチン、リファペンチン、リメキソロン、リタノビル(ritanovir)、リザトリプタン、ロフェコキシブ、ロシグリタゾン、サクイナビル、セルトラリン、シブトラミン、クエン酸シルデナフィル、シンバスタチン、シロリムス、スピロノラクトン、スマトリプタン、タクリン、タクロリムス、タモキシフェン、タムスロシン、ターグレチン、タザロテン、テルミサルタン、テニポシド、テルビナフィン、テラゾシン、テトラヒドロカンナビノール、チアガビン、チクロピジン、チロフィバン、チザニジン、トピラマート、トポテカン、トレミフェン、トラマドール、トレチノイン、トログリタゾン、トロバフロキサシン、ユビデカレノン、バルサルタン、ベンラファキシン、ベルテポルフィン、ビガバトリン、ビタミンA、ビタミンD、ビタミンE、ビタミンK、ザフィルルカスト、ジロートン、ゾルミトリプタン、ゾルピデム、ゾピクロン、及びこれらの組み合わせがある。
【0072】
例示的な親水性の活性薬剤には、限定はされないが、アカルボース、アシクロビル、アセチルシステイン、塩化アセチルコリン、アラトロフロキサシン、アレンドロネート、アルグルセラーゼ、塩酸アマンタジン、アンベノミウム(ambenomium)、アミフォスチン、塩酸アミロライド、アミノカプロン酸、アンホテリシンB、抗血友病因子(ヒト)、抗血友病因子(ブタ)、抗血友病因子(遺伝子組換え)、アプロチニン、アスパラギナーゼ、アテノロール、ベシル酸アトラクリウム、アトロピン、アジスロマイシン、アズトレオナム、BCGワクチン、バシトラシン、ベカプレルミン、ベラドンナ、塩酸ベプリジル、硫酸ブレオマイシン、ヒトカルシトニン、サケカルシトニン、カルボプラチン、カペシタビン、硫酸カプレオマイシン、セファマンドールナファート(nafate)、セファゾリンナトリウム、塩酸セフェピム、セフィキシム、セフォニシドナトリウム、セフォペラゾン、セフォテタン二ナトリウム、セフォタキシム、セフォキシチンナトリウム、セフチゾキシム、セフトリアキソン、セフロキシムアクセチル、セファレキシン、セファピリンナトリウム、コレラワクチン、柔毛膜性ゴナドトロピン、シドフォビル、シスプラチン、クラドリビン、臭化クリジニウム、クリンダマイシン及びクリンダマイシン誘導体、シプロフロキサシン、クロドロネート、コリスチンメタンスルホン酸ナトリウム、硫酸コリスチン、コルチコトロピン、コシントロピン、クロモリンナトリウム、シタラビン、デルテパリンナトリウム、ダナパロイド、デフェロキサミン、デニロイキンジフチトクス、デスモプレシン、ジアトリゾ酸メグルミン及びジアトリゾ酸ナトリウム、ジサイクロミン、ジダノシン、ジリスロマイシン、塩酸ドーパミン、ドルナーゼアルファ、塩化ドキサクリウム、ドキソルビシン、エチドロン酸二ナトリウム、エナラプリラート、エンケファリン、エノキサパリン、エノキサパリンナトリウム、エフェドリン、エピネフリン、エポエチンアルファ、エリスロマイシン、塩酸エスモロール、第IX因子、ファムシクロビル、フルダラビン、フルオキセチン、ホスカメットナトリウム、ガンシクロビル、顆粒球コロニー刺激因子、顆粒球−マクロファージ刺激因子、遺伝子組換えヒト成長ホルモン、ウシ成長ホルモン、ゲンタマイシン、グルカゴン、グリコピロレート、性腺刺激ホルモン放出ホルモン及びその合成アナログ、ゴナドレリン、グレパフロキサシン、ヘモフィルスB結合型ワクチン、不活性化A型肝炎ウイルスワクチン、不活性化B型肝炎ウイルスワクチン、ヘパリンナトリウム、
【0073】
硫酸インジナビル、インフルエンザウイルスワクチン、インターロイキン−2、インターロイキン−3、ヒトインスリン、インスリンリスプロ、ブタインスリン、インスリンNPH、インスリンアスパルト、インスリングラルギン、インスリンデテミル、インターフェロンα、インターフェロンβ、臭化イプラトロピウム、イホスファミド、日本脳炎ウイルスワクチン、ラミブジン、ロイコボリンカルシウム、酢酸ロイプロリド、レボフロキサシン、リンコマイシン及びリンコマイシン誘導体、ロブカビル、ロメフロキサシン、ロラカルベフ、マンニトール、麻疹ウイルスワクチン、髄膜炎菌ワクチン、メノトロピン、臭化メペンゾラート、メサラミン、メテナミン、メトトレキサート、メトスコポラミン、塩酸メトホルミン、メトプロロール、メズロシリンナトリウム、塩化ミバクリウム、ムンプスウイルスワクチン、ネドクロミルナトリウム、臭化ネオスチグミン、メチル硫酸ネオスチグミン、ニューロンチン、ノルフロキサシン、酢酸オクトレオチド、オフロキサシン、オルパドロネート、オキシトシン、パミドロン酸二ナトリウム、臭化パンクロニウム、パロキセチン、ペルフロキサシン、イセチオン酸ペンタミジン、ペントスタチン、ペントキシフィリン、ペンシクロビル、ペンタガストリン、メシル酸フェントラミン、フェニルアラニン、サリチル酸フィゾスチグミン、ペストワクチン、ピペラシリンナトリウム、血小板由来成長因子、多価肺炎球菌ワクチン、ポリオウイルスワクチン(不活性化)、ポリオ生ワクチン(OPV)、硫酸ポリミキシンB、塩化プラリドキシム、プラムリンチド、プレガバリン、プロパフェノン、臭化プロペンタリン(propenthaline bromide)、臭化ピリドスチグミン、狂犬病ワクチン、リセドロネート、リバビリン、塩酸リマンタジン、ロタウイルスワクチン、キシナホ酸サルメテロール、シンカリド、天然痘ワクチン、ソラトール(solatol)、ソマトスタチン、スパルフロキサシン、スペクチノマイシン、スタブジン、ストレプトキナーゼ、ストレプトゾシン、塩化スキサメトニウム、塩酸タクリン、硫酸テルブタリン、チオペタ、チカルシリン、チルドロネート、チモロール、組織型プラスミノゲン活性化因子、TNFR:Fc、TNK−tPA、トランドラプリル、グルコン酸トリメトレキサート、トロスペクトマイシン、トロバフロキサシン、塩化ツボクラリン、腫瘍壊死因子、腸チフス生ワクチン、尿素、ウロキナーゼ、バンコマイシン、バラシクロビル、バルサルタン、水痘ウイルス生ワクチン、バソプレッシン及びバソプレッシン誘導体、臭化ベクロニウム、ビンブラスチン、ビンクリスチン、ビノレルビン、ビタミンB12、ワルファリンナトリウム、黄熱ワクチン、ザルシタビン、ザナミビル、ゾレドロネート、ジドブジン、及びこれらの組み合わせがある。
【0074】
もちろん、疎水性と示された特定の活性薬剤を、例えば、薬剤的に許容でき薬理的に活性な塩を形成するために電離していない活性薬剤を電離させることにより、容易に親水性形態に転化して市販することができる。逆に、親水性と示された特定の活性薬剤を、例えば、中和、エステル化などにより疎水性形態に容易に転化して市販することができる。このように、特定の活性薬剤を親水性又は疎水性であると上記のように分類したのは限定的でないものとすることを理解されたい。
【0075】
上述の活性薬剤のいずれも、本製剤を利用して組み合わせて投与することもできる。組み合わせて投与される活性薬剤は、同じ治療クラス(例えば、脂質調節剤又は抗凝固剤)でもよいし、異なる治療クラス(例えば、脂質調節剤と抗凝固剤)でもよい。非限定的な原薬合剤の例には、以下のようなものがあるが限定されない。
【0076】
黄体ホルモン物質及びエストロゲンを両方含む女性用避妊組成物;
【0077】
黄体ホルモン物質、エストロゲン、及びアンドロゲンを含む女性HRT組成物;
【0078】
複数の脂質調節剤の組み合わせ、例えば(a)フィブラートとスタチン、例えばフェノフィブラートとアトルバスタチン、フェノフィブラートとシンバスタチン、フェノフィブラートとロバスタチン、又はフェノフィブラートとプラバスタチン;(b)フィブラートとニコチン酸、例えばフェノフィブラートとナイアシン;及び(c)スタチンとニコチン酸、例えばロバスタチンとナイアシン;
【0079】
脂質調節剤と抗ウイルス剤との組み合わせ、例えば、フェノフィブラートとリトナビルなど、フィブラートとプロテアーゼ阻害剤;
【0080】
脂質調節剤と抗凝固剤との組み合わせ、例えば、(a)フェノフィブラートとアスピリンなど、フィブラートとサリチル酸エステル、(b)フェノフィブラートとクロピドグレルなど、フィブラートと他の抗凝固剤、(c)シンバスタチンとアスピリンなど、スタチンとサリチル酸エステル、及び(d)プラバスタチンとクロピドグレルなど、スタチンと他の抗凝固剤;
【0081】
脂質調節剤と抗糖尿病剤との組み合わせ、例えば、(a)フィブラートとチアゾリジンジオンなどのインスリン増感剤、例えば、フェノフィブラートとピオグリタゾン、又はフェノフィブラートとロシグリタゾン、(b)フィブラートとスルホニル尿素などのインスリン分泌刺激剤、例えば、フェノフィブラートとグリメピリド、又はフェノフィブラートとグリピジド、スタチンとチアゾリジンジオンなどのインスリン増感剤、例えば、ロバスタチンとピオグリタゾン、シンバスタチンとロシグリタゾン、プラバスタチンとピオグリタゾンなど;
【0082】
脂質調節剤と心臓血管薬物との組み合わせ、例えば、(a)フィブラートとカルシウムチャネル遮断剤、例えば、フェノフィブラートとアムロジピン、又はフェノフィブラートとイルベサルタン、又は(b)スタチンとカルシウムチャネル遮断剤、例えば、ホシノプリルとプラバスタチン;
【0083】
複数の抗凝固剤の組み合わせ、例えば、(a)アスピリンとクロピドグレルなど、サリチル酸エステルと血小板受容体結合阻害剤、(b)アスピリンとダルテパリンなど、サリチル酸エステルと低分子量ヘパリン、及び(c)クロピドグレルとエノキサパリンなど、血小板受容体結合阻害剤と低分子量ヘパリン;
【0084】
複数の抗糖尿病薬の組み合わせ、例えば、(a)インスリン増感剤とインスリン分泌刺激剤、例えば、(i)グリタゾン又はピオグリタゾンなどのチアゾリジンジオンとグリメピリドなどのスルホニル尿素、及び(ii)メトホルミンなどのビグアナイドとレパグリニドなどのメグリチニド、(b)メトホルミンとアカルボースなど、インスリン増感剤とαグリコシダーゼ阻害剤、(c)インスリン分泌刺激剤とαグリコシダーゼ阻害剤、例えば、(i)アカルボースと組み合わせたグリブリドなどのスルホニル尿素、(ii)アカルボースと、レパグリニドなどのメグリチニド、(iii)ミグリトールと、グリピジドなどのスルホニル尿素、(iv)アカルボースと、ピオグリタゾンなどのチオゾリジンジオン、又は(v)メトホルミンとピオグリタゾン;
【0085】
複数の心臓血管薬物の組み合わせ、例えば、リジノプリルとカンデサルタンなど、ACE阻害剤の組み合わせ;ロサルタンとヒドロクロロチアジドなど、ACE阻害剤と利尿剤との組み合わせ;ニフェジピンとアテノロールなど、カルシウムチャネル遮断剤とβ遮断剤との組み合わせ;フェロジピンとラミプリルなど、カルシウムチャネル遮断剤とACE阻害剤との組み合わせ;
【0086】
降圧剤と抗糖尿病剤との組み合わせ、例えば、イルベサルタンとグリピジドなど、ACE阻害剤とスルホニル尿素;
【0087】
抗ヒスタミン剤と抗喘息剤との組み合わせ、例えば、抗ヒスタミン剤とロイコトリエン受容体拮抗剤、例えば、ロラタジンとザフィルルカスト、デスロラチジンとザフィルルカスト、及びセチラジンとモンテルカスト;
【0088】
抗炎症剤と鎮痛剤との組み合わせ、例えば、COX−2阻害剤と非ステロイド抗炎症剤(NSAID)、例えば、ロフェコキシブとナプロキセン、又はCOX−2阻害剤とサリチル酸エステル、例えば、セレコキシブとアスピリン;
【0089】
抗肥満薬物と抗糖尿病薬との組み合わせ、例えば、メトホルミンと組み合わせたオルリスタットなどのリパーゼ阻害剤;
【0090】
脂質調節剤と冠動脈疾患を治療する薬物との組み合わせ、例えば、フェノフィブラートとエゼチミブ、又はラバスタチンとエゼチミブ;並びに
【0091】
他の組み合わせ、例えば、ドセタキセルとシスプラチン、チラパザミンとシスプラチン、メトクロプラミドとナプロキセンナトリウム、オキシコドンなどのオピオイド鎮痛剤と抗炎症剤、アルプロスタジルなどの勃起障害を治療する薬剤とプラゾシンなどの降圧剤/血管拡張剤。
【0092】
上述の例は単に説明のためであり、構造クラス又は機能クラスにより特定される任意の薬剤を、同じ構造クラス又は機能クラスの他の薬物により置き換えうることを強調すべきである。
【0093】
任意の原薬(複数可)は、塩、エステル、水和物、溶媒和物、配位錯体、配位化合物、アミド、プロドラッグ、活性代謝物、異性体、アナログ、フラグメントなどの形態で投与してよいが、但し、そのような塩、エステル、水和物、溶媒和物、配位錯体、配位化合物、アミド、プロドラッグ、活性代謝物、異性体、アナログ、又はフラグメントが、本発明の範疇で薬剤的に許容でき、薬理的に活性であるという条件である。塩、エステル、水和物、溶媒和物、配位錯体、配位化合物、アミド、プロドラッグ、代謝物、アナログ、フラグメント、及び活性薬剤の他の誘導体は、有機合成化学の当業者に公知であり例えばJ.March、Advanced Organic Chemistry:Reactions、Mechanisms and Structure、4th Edition(New York:Wiley−lnterscience、1992)に記載されている標準的な手順を利用して調製できる。
【0094】
例えば、酸付加塩は、遊離塩基と酸との反応を含む従来の方法を利用して遊離塩基の形態の原薬から調製される。酸付加塩の調製に好適な酸には、有機酸、例えば、酢酸、プロピオン酸、グリコール酸、ピルビン酸、シュウ酸、リンゴ酸、マロン酸、コハク酸、マレイン酸、フマル酸、酒石酸、クエン酸、安息香酸、ケイ皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、p−トルエンスルホン酸、サリチル酸など、並びに無機酸、例えば、塩化水素酸、臭化水素酸、硫酸、硝酸、リン酸などがある。酸付加塩は、好適な塩基により処理して遊離塩基に再転化することができる。逆に、活性薬剤に存在することのある酸部分の塩基性塩の調製は、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、水酸化カルシウム、トリメチルアミンなどの薬剤的に許容できる塩基を利用して類似の方法で実施できる。エステルの調製は、カルボニル炭素のRO−部分の求核攻撃を含む、従来のエステル化反応によるカルボン酸基の変換を含む。エステル化は、ヒドロキシル基と、酸クロライドなどのエステル化試薬との反応により実施することもできる。エステルは、望まれる場合、従来の水素化分解又は加水分解手順を利用して、遊離酸に再転化することができる。アミドは、好適なアミン反応物を利用してエステルから調製でき、又は、アンモニア又は低級アミンとの反応により無水物又は酸クロライドから調製できる。プロドラッグ及び活性代謝物もまた、当業者に公知であるか関連文献に記載されている技術を利用して調製できる。プロドラッグは、典型的には、個体の代謝系により修飾されるまで治療上不活性である化合物を生み出す部分の共有結合により調製される。
【0095】
活性薬剤の他の誘導体及びアナログは、有機合成化学の当業者に公知である標準的な技術を利用して調製でき、又は関連文献を参照して推測できる。さらに、キラル活性のある薬剤は、異性体的に純粋な形態でよく、異性体のラセミ混合物として投与してもよい。
【0096】
本発明の医薬製剤の他の成分は、炭水化物系ポリマーなどの少なくとも1種の水膨張性pH非依存性ポリマーを与えるが、例えば、ヒプロメロース(以前は、ヒドロキシプロピルメチルセルロースの一種として知られていた)、ヒドロキシプロピルエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、メチルセルロースであり、又は本発明とともに典型的に使用されるこれらのヒプロメロースコポリマーの他の構成グレードには、Eシリーズ及びKシリーズがあり、例えば、Dow Chemical Company(アメリカ合衆国、ミシガン州ミッドランド)又はAqualon(デラウェア州ウィルミントンにおける北アメリカ駐在)のE4M、E10M、K100LV、K4M、K15M、K25M、K100M、K200M、及び種々の分子量及びグレードの混合物がある。ヒドロキシエチルセルロースのグレードには、例えば、AqualonのNatrasol(登録商標)ポリマーHHX(分子量1,300,000)、HX(分子量1,000,000)、H(分子量1,000,000)、M(分子量720,000)、及びG(分子量1,150,000)、及びこれらの混合物がある。ヒドロキシプロピルセルロースのグレードには、例えば、AqualonのHPCポリマーMF及びMXF(分子量580,000)、及びKF及びHXF(分子量1,150,000)、及びこれらの混合物がある。グレード及びエチルセルロースには、例えば、Dow Chemical CompanyのEthocel(登録商標)ポリマー7FP、10FP、及び100FP、及びAqualonのポリマーT10EC、N7、N10、N17、N22、N50、N100、及びN200、及びこれらの混合物がある。これらの成分、及び他の全成分、添加剤、賦形剤などは薬剤的に許容できなくてはならない。
【0097】
本発明の医薬製剤の他の成分は、少なくとも少なくとも1種のアニオンpH依存性ゲル形成性コポリマーを与え、例えば、アルギン酸のナトリウム塩、カリウム塩、又はアンモニウム塩などの一価アルギン酸塩、又はこれらの組み合わせ、及びカルボキシメチルセルロースナトリウムなど、又は1種以上のアルギン酸塩とカルボキシメチルセルロースの混合物などがある。これらの成分は市販されており、容易に入手できる。
【0098】
本発明の医薬製剤の他の成分は、カチオンポリマー;及びヒドロコロイドからなる群から選択される、少なくとも少なくとも1種のポリマーを与える。カチオンポリマーは、例えば、キトサン又はその誘導体、例えば、トリメチルキトサン及び四級化(quartermised)キトサン、及びキトサン誘導物質、例えば、米国特許第5747475号に教示されているものでよい。高分子量又は低分子量キトサン製品のいずれも本発明の医薬製剤に使用でき、世界中に存在する業者から医薬グレードで入手できる。本発明の製剤に使用されるヒドロコロイドはカラギーナンでよい。カラギーナンは、イオタ、カッパ、及びラムダカラギーナンとして利用できるが、イオタが最も頻繁に使用され、ラムダが最も使用頻度が低い。例えば、カラギーナンナトリウムなどの、カラギーナンの種々の塩形態も利用可能である。イオタカラギーナンの典型的に使用されるグレードには、カラギーナンNF AEP(登録商標)ブランドコロイド(Hadley、アメリカ合衆国、ニューヨーク)、FD433(1%粘度;300〜400cps)及びFD384(1%粘度;約100cps)があるが、限定されない。他のカラギーナン製品の粘度は約50から約4000cpsの範囲である。
【0099】
本発明の成分の濃度の範囲は、それぞれの製剤の所望の放出特性により変わるだろうが、公知の慣例に従い容易に調整できる。
【0100】
より具体的には、各原薬は、適切な治療指数に対して表記された濃度又は所望の濃度と有効成分含量が一致するように、所望の量で存在する。本発明の製剤に使用できる原薬の範囲を考慮すると、利用される範囲は、利用されるか1種以上の他の原薬と組み合わせるかにかかわらず、その特定の原薬に適合されるだろう。
【0101】
一般的に:少なくとも1種の水膨張性pH非依存性ポリマーは、個別のポリマーとしてであれ集合的であれ、例えば約20パーセントから約50パーセント、及び約30から約40パーセントを含む他の範囲とともに約10パーセントから約90パーセントの範囲で使用され;
少なくとも1種のアニオンpH依存性ゲル形成性コポリマーは、個別のコポリマーとしてであれ集合的であれ、例えば、約10から約50パーセント、約10から約30パーセント、及び約15から約25パーセントを含む他の範囲とともに、約10パーセントから約90パーセントの範囲で使用され;
カチオンポリマー又はヒドロコロイドは、その使用が個別であれ集合的であれ、例えば、約0.5から約20パーセント、及び約5から約15パーセントを含む他の範囲とともに約0.1パーセントから約25パーセントの範囲。
【0102】
しかし、上述のとおり、例えば、難溶性原薬を使用する場合及び/又は放出時間を減らすために、本発明の医薬製剤中の総マトリックス配合量(total matrix load)が約30パーセント以下の場合もある。
【0103】
当業者は、例えば、原薬の水溶解度、製剤中の原薬配合量/ポリマー比、ポリマーの水溶解度及び粘度を含む複数の因子又は変数が、本発明のマトリックスからの原薬の送達速度に影響を与えうることを認識するだろう。本明細書に述べられるパラメーターを利用して、各原薬及び放出プロファイルターゲットは、ケースバイケースで扱われるべきである。出発点として、約17%の中程度の原薬薬物配合量、ジクロフェナクカリウムなどの原薬の中程度の溶解度で約12時間にわたり放出する、本発明の一製剤は、以下の処方により表されるだろう。
【0104】
【表1】

【0105】
例えば、水溶解度の高い原薬を扱うには、又は原薬の放出時間を延ばすには、製剤の修飾は下記を含むであろう:
・原薬薬物配合量を下げ、全体的なポリマー含量を高める−医薬品のサイズを通常大きくする必要があるだろう;
・ヒプロメロースの代わりにエチルセルロースなど水溶解度の低いポリマーを使う。
・利用するポリマーの分子量を高くする;
・体積に対して、錠剤形状の表面積(surface are)を最低にする。円形錠剤を使用する;
・カラギーナン及び/又はキトサンの使用量のパーセンテージ(w/w)を低下させ、高分子量で低溶解度のポリマーの使用量を高くする;かつ/又は
・水溶性錠剤希釈剤の使用を避け微結晶性セルロースなどの不溶性希釈剤を使用する。
・希釈剤濃度を下げ、ポリマー配合量を上げる。
【0106】
難溶性原薬を扱うには、及び/又は放出時間を短くするには:
・全体のポリマーマトリックス配合量を、製剤の20〜30%にまで低下させる;
・ラクトースなどの水溶性希釈剤を混合する;
・エチルセルロースなどの水不溶性ポリマーの使用を最小限にするか回避し、ヒプロメロース及びヒドロキシプロピルセルロースなどのポリマーの低分子量のものを使用する;
・製剤に界面活性剤又は可溶化剤を含ませる;
・微粒子化された原薬を使用する;かつ/又は
・マルチパーティキュレート(multi−particulate)ミニタブシステムを使用して、医薬品の表面積対体積比を最大にする。
【0107】
本発明の医薬製剤の調製は、医薬製剤の分野の当業者に公知である従来の手段により、例えば、直接打錠、乾式造粒、及び湿式造粒がある。本発明の医薬製剤を調製する以下の一般的な方法は例示として提示され、どのようにも本発明の製剤を限定しないものとする。
【0108】
直接打錠は、原薬(複数可)を含む全成分を細分(delumping)し、所望の粒径の範囲にふるうことにより実施される。サイズによって均質なブレンドが可能であるならば、各成分をそのような同じサイズ又は異なるサイズに細分することが望ましいだろう。次いで、最初のブレンド工程において成分の一部又はほとんどすべてをブレンドする必要があるかもしれないことを認識しながら、成分をブレンドし、次に、元の成分に追加の成分を加える第二又はその次のブレンド工程(複数可)が実施される。適切なブレンド工程の後、錠剤、ミニタブレット(医薬製剤業界の当業者に公知である)、1種以上のサイズの直接打錠マルチパーティキュレートは直接打錠され、最終医薬品の形態のことのある所望の製品を与え、カプセル又は他の固体投与量投与(solid−dose administration)形態に充填され、1種以上の追加の直接打錠製品に加えられて、多層の医薬品などを形成することができる。「直接打錠」という用語はそれ自体、本発明による医薬製剤の調製プロセスの一部又はすべてに関連することがある。
【0109】
当業者は、医薬品を調製するプロセス工程の一部又は全てとして湿式造粒を実施する多くの方法が存在することを認識するだろう。したがって、そのようなプロセスのそれぞれ又はいずれも、部分又は全体として、本発明の医薬製剤の調製に利用できる。本発明をどのようにも限定はしないが、通常利用される湿式造粒プロセスの一つには、例えば、湿式トップスプレー造粒がある。全成分は細分され所望のサイズにふるわれた後、得られた成分のブレンドが、慣行を利用してブレンドされた成分を流動化するスプレーガンを備えた適切な流動床プロセッサーに加えられる。生じた顆粒は、典型的には流動床中で乾燥され、所望の粒径範囲に粉砕され、最終製剤の調製に使用される。このプロセスに代わるものは高剪断湿式造粒として知られている。同様に、成分は、所望のサイズへのふるい分け又は細分され、適切なプロセッサーに加えられ、ブレンドされた成分は混合され、溶媒、典型的には水又は他の水性溶媒が造粒中に塊に噴霧された状態で頻繁に細断される。湿った顆粒は、典型的には流動床で流動化され、次いで乾燥され、粉砕される(多くの場合、追加の所望の成分が添加される)。あるいは、利用できる装置、使用される成分、及び所望の成果によっては、低剪断湿式造粒を利用することもできる。湿式造粒プロセスの生成物は、錠剤、ミニタブレット、最終医薬品の形態のこともある1種以上のサイズの直接打錠マルチパーティキュレートなどに形成され、カプセル又は他の固体投与量投与のための形態に充填され、1種以上の追加の直接打錠製品に加えられて、必要に応じて、多層医薬品などを形成できる。
【0110】
当業者は、医薬品を調製するプロセス工程の一部又は全てとして乾式造粒を実施する多数の方法が存在することも認識するだろう。乾式造粒は、最終医薬品に形成される成分の最終的なブレンドの流動特性又は他の特性を向上させるために使用されることが多い。したがって、そのようなプロセスのそれぞれ又はいずれも、部分又は全体として、本発明の医薬製剤の調製に利用できる。本発明をどのようにも限定はしないが、通常利用される乾式造粒プロセスの一つは、例えば、所望の成分の細分及び/又はふるい分け、成分のブレンディング、及び、例えば、圧縮された生成物のリボンを形成するローラーコンパクターへの成分の供給、次いで、得られたリボンの粉砕を含む。次いで、粉砕された生成物は上述のとおり圧縮され、又は追加の成分とさらにブレンドされてから圧縮される。
【0111】
錠剤形態にある本発明の医薬製剤は、水性媒体の早期の進入を防止し、該当する場合コアのコーティングの間の表面の穴あき及び崩壊を防ぐのに十分な硬さに圧縮しなければならない。錠剤を製剤する際には、錠剤の均一なバッチをつくるのに十分な量の完全な混合物が、従来の打錠機中で適切な圧力で打錠される。典型的な圧縮力は、約5から約50キロニュートン(kN)である。
【0112】
医薬に通常使用される他の任意の成分を、本医薬製剤に使用してもよい。それらには、例えば、充填剤、滑沢剤、流動促進剤、着色剤、酸化防止剤などがあり、それぞれの使用は当業者に公知である。以下は例示の目的のみのために与えられ、本発明の範囲をどのようにも限定しないものとする。充填剤には、例えば、糖類、例えば、デキストロース、スクロース、マルトース、及びラクトース、糖アルコール、例えば、マンニトール、ソルビトール、マルチトール、キシリトール、デンプン加水分解物、例えば、デキストリン、及びマルトデキストリンなど、微結晶性セルロース又は他のセルロース誘導体、リン酸水素カルシウム、リン酸三カルシウムなど、及びこれらの混合物がある。医薬品に使用される充填剤の典型的な量は、必要でないか望まれない場合はゼロにまで低くなることがあり、高活性で低用量の原薬では50パーセント(w/w)にも高くなることがある。
【0113】
滑沢剤には、例えば、長鎖脂肪酸及びその塩、例えばステアリン酸マグネシウム及びステアリン酸、タルク、グリセリド、及び蝋がある。医薬品に使用される滑沢剤の典型的な量は、約0.1から約3パーセント(w/w)の範囲になりうる。
【0114】
流動促進剤には、例えば、コロイド状二酸化ケイ素、タルクなどがある。医薬品に使用される流動促進剤の典型的な量は、約0.1から約1パーセント(w/w)の範囲になりうる。
【0115】
着色剤には、例えば、FD&C着色剤、例えば、FD&C Yellow No.6、FD&C Red No.2、FD&C Blue No.2、食用レーキなどがある。医薬品に使用される着色剤の典型的な量は、約0.1から約1パーセント(w/w)の範囲になりうる。
【0116】
酸化防止剤には、例えば、アスコルビン酸、メタ重亜硫酸ナトリウムなどがある。医薬品に使用される酸化防止剤の典型的な量は、約0.1から約1パーセント(w/w)の範囲になりうる。
【0117】
本発明の医薬製剤は、種々の目的で1種以上のコーティングにより被覆されていてよい。一般的に、医薬剤形に使用される種々のコーティングには、例えば、腸溶性コーティング、シールコーティング、フィルムコーティング、バリアコーティング、圧縮コーティング、速崩壊コーティング、及び酵素分解コーティングがある。所望の性能のために複数のコーティングを利用できる。さらに、剤形は、即放性、パルス状放出、マルチモード放出、遅延放出、ターゲット放出(targeted release)、同期放出、又はターゲット遅延放出用に設計できる。これらの用語及びそれぞれを達成するための技術は製剤分野に周知である。放出及び/又は吸収の制御のために、本医薬製剤は、種々の種類及び濃度又は厚さの膜とともにつくることができ、それぞれのコーティングに部分的又は完全に覆われていてよい。そのようなコーティングは、原薬と加えられていても、加えられていなくてもよい。1種以上の原薬がコーティングに加えられる場合、そのような原薬は、本発明の医薬製剤のマトリックスに含まれる少なくとも1種の原薬と同じでも、異なっていてもよい。
【0118】
本発明の医薬製剤を使用するカプセルを製剤する場合、カプセルは、薬剤的に許容できる適切な任意の物質から作られたハードカプセルでもソフトカプセルでもよい。
【0119】
上記又は他で言及されるコーティングは当分野で公知であるが、明確にするために以下の簡単な説明が与えられる。
【0120】
シールコーティング、又は分離層を持つコーティング(薬剤的に機能のないコーティング):厚さ20マイクロまでの薄層は、例えば、粒子の多孔性の低下、ほこりの低減、化学的保護、矯味、臭いの低減、胃腸への刺激を最低限にするなどの種々の理由で施すことができる。分離効果は、コーティングの厚さに比例する。水溶性セルロースエーテルが通常この用途に使用される。HPMCとエチルセルロースとの組み合わせ、又はEudragit(登録商標)E100(Evonik Rohm GmbH、ドイツ国、ダルムシュタット)は、通常矯味用途に使用される。
【0121】
薬剤的に機能のあるコーティングには、例えば、腸溶性コーティングがある:本明細書での「腸溶性コーティング」という用語は、キャリア又は組成物に施され、組み合わされ、混合され、又は他の方法で加えられて、典型的には医薬品中の1種以上の原薬の遅延放出を達成する、薬剤的に許容できる賦形剤の混合物に関する。コーティング(複数可)は、本医薬製剤の錠剤、カプセル、及び/又はペレット、ビーズ、ミニタブレット、顆粒、又は粒子に施すことができる。コーティングは、水性分散液により、又は適切な溶媒に溶解させた後で施すことができる。追加の添加剤及びその濃度、一次被覆材料又は複数の材料の選択は、以下の性質により決まるだろう。
【0122】
1.胃の中の溶出及び崩壊に対する抵抗;
2.胃の中にあるときの胃液の不浸透性;
3.ターゲットの腸内部位で所望の方法で溶出又は崩壊する能力;
4.貯蔵中の医薬品の物理的安定性及び化学的安定性;
5.非毒性;
6.コーティングとしての塗布の容易性(下地と相性のよい);及び
7.経済的な実用性。
【0123】
遅延放出情動(affect)を達成するために、コーティング全体が、約5未満のpHの胃腸液には溶出せずに約5以上のpHで溶出するように、十分な厚さで任意のコーティング(複数可)を施さなくてはなければならない。pH依存性の溶解度プロファイルを示す任意のアニオンポリマーを本発明の実施において腸溶性コーティングとして使用でき、下部消化管への1種以上の原薬の送達を実施できる。遅延放出医薬品の調製に使用されるコーティングの非限定的な例には以下がある。
【0124】
セラック、昆虫の樹脂状分泌物から得られる精製物。このコーティングはpHが約7以上の媒体に溶解する。
【0125】
アクリルポリマー。アクリルポリマーの性能(主に、体液への溶解度)は、置換の程度及び種類により変えることができる。好適なアクリルポリマーの例にはメタクリル酸コポリマー及びメタクリル酸アンモニオコポリマーがある。EudragitシリーズE、L、S、RL、RS、及びNEは、有機溶媒中に可溶化された状態で、水性分散液として、又は乾燥粉末として市販されている。EudragitシリーズRL、NE、及びRSは消化管内で不溶性だが、浸透性であり主に持続放出用に使用される。EudragitシリーズEは胃の中で溶解する。EudragitシリーズL、L−30D、及びSは胃の中では不溶性であるが、腸内で溶解する。
【0126】
セルロース誘導体。好適なセルロース誘導体には、例えば、エチルセルロース;セルロースの部分酢酸エステルと無水フタル酸との反応混合物(性能は置換の程度及び種類により変わることがある;酢酸フタル酸セルロース(CAP)は6より高いpHで溶解する;Aqucoat(登録商標)CMP(FMC、アメリカ合衆国、ペンシルベニア州フィラデルフィア)は水性系である;酢酸トリメリト酸セルロース;メチルセルロース;ヒドロキシプロピルメチルセルロースフタル酸エステル(HPMCP;性能は置換の程度及び種類により変わることがある;グレードには、例えば、HP−50、HP−55、HP−55S、HP−55Fがある);ヒドロキシプロピルメチルセルロースコハク酸エステル(HPMCS)(性能は置換の程度及び種類により変わることがある;グレードには、例えば、約5のpHで溶解するAS−LG(LF)、約5.5のpHで溶解するAS−MG(MF)、及びより高いpHで溶解するAS−HG(HF)がある。これらのポリマーは顆粒として、又は水性分散液のための微粉末として提供される。
【0127】
ポリ(酢酸フタル酸ビニル)(PVAP)。PVAPは、約5以上のpHで溶解し、水蒸気及び胃液に対する浸透性ははるかに低い;
【0128】
上記の材料の組み合わせも使用できる。
【0129】
コーティングは、可塑剤及び、ことによると他のコーティング賦形剤、例えば、着色剤、タルク、及び/又はステアリン酸マグネシウムを含んでよく、通常含むが、これらは当分野に周知である。そのような可塑剤には、例えば以下のものがある:クエン酸トリエチル、グリセリン三酢酸エステル、クエン酸アセチルトリエチル、ポリエチレングリコール400、フタル酸ジエチル、クエン酸トリブチル、アセチル化モノグリセリド、グリセロール、脂肪酸エステル、プロピレングリコール、及びフタル酸ジブチルがある。より詳細には、アニオン性カルボン酸アクリルポリマーは、通常10〜25重量%の可塑剤、特にフタル酸ジブチル、ポリエチレングリコール、クエン酸トリエチル、及びトリアセチンを含む。
【0130】
スプレーコーティング又はパンコーティングなどの従来の被覆技術を利用して、コーティングが施される。コーティングの厚さは、下部消化管の局所送達の所望の部位に到達するまで経口剤形が確実に完全であるように十分でなければならない。
【0131】
着色剤、粘着防止剤、界面活性剤、消泡剤、滑沢剤、ヒドロキシプロピルセルロースなどの安定剤、酸/塩基を可塑剤の他にコーティングに加えて、被覆された材料を可溶化又は分散させ、コーティング性能及び被覆された医薬品を改善することができる。
【0132】
本明細書に開示される本発明の原理における変形を当業者がなしうることを理解及び予期できようが、そのような修正は本発明の範囲内に含まれるものとする。
【実施例】
【0133】
(実験の詳細)
以下の溶出パラメーターを、実施例3、19〜20、及び21〜22を除く全ての実施例に利用した。
USP Apparatus II
パドル速度50rpm
温度37℃
試料のHPLC分析
【0134】
実施例19〜20のパドル速度は全ての時点で50rpmであったが、例外は無限でありパドル速度は追加の15分間で250rpmであった。実施例21〜22は、100rpmで回転している円筒状バスケットを使用した。
【0135】
以下の溶出媒体をそれぞれの実施例に使用した。
【表2】

【0136】
実施例1−50mg塩酸ミノサイクリン錠の直接打錠
直接打錠を利用して、50mg含量の塩酸ミノサイクリン錠を生成する1キログラムのバッチを調製した。以下の処方を利用した。
【0137】
【表3】

【0138】
40メッシュのふるいを通ったステアリン酸マグネシウム以外の全成分を、使用前に20メッシュのスクリーンで細分した。ステアリン酸マグネシウム以外の成分を4クォートV型ブレンダーに入れ、5分間ブレンドした。ステアリン酸マグネシウムをブレンダーに入れ、ブレンディングをさらに3分間続けた。約327mgの重量、約8kpの硬さ、及び約0.187インチの厚さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH105錠剤プレスでブレンドを圧縮した。
【0139】
実施例2−270mg1−MNA錠の乾式造粒及び遅延放出のためのコーティング
打錠に使用される最終ブレンドの流動を改善するために、この実施例では乾式造粒法を利用した。
【0140】
【表4】

【0141】
40メッシュのふるいを通ったステアリン酸マグネシウム以外の、2kgバッチ用の成分全てを、使用前に20メッシュのスクリーンにより細分した。前記成分及びステアリン酸マグネシウム全量の25パーセントを8クォートV型ブレンダーに入れ、10分間ブレンドした。ロール速度3rpm、供給スクリュー速度5rpm、及び圧縮力2.0トンを利用する、鋸歯状ロールを備えたVector TF Miniロールコンパクターにブレンドを通した。厚さ0.040インチのリボンをつくり、0.040インチ超のスクリーンを備えたQuadro Comilを利用して一定サイズに粉砕した。粉砕したリボンを残りの4分の3のステアリン酸マグネシウムとともにV型ブレンダーに入れ、3分間ブレンドした。約800mgの重量、約10kpの硬さ、及び約0.268インチの厚さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH105錠剤プレスでブレンドを圧縮した。
【0142】
実施例2の生成物の遅延放出コーティング
マトリックス錠剤からの1−メチルニコチンアミドの放出が、およそ2時間の遅延放出と、それに次ぐ12〜24時間にわたる放出であるように目標を定めた。40%ヒプロメロース基材マトリックス錠剤は、望まれるとおりおよそ12時間の持続放出を与えたが、コーティングなしでは原薬放出の遅延はなかった。錠剤を被覆して、錠剤からの1−メチルニコチンアミドの放出を遅延させた。この戦略は、水和すると膨張する錠剤の性質を利用するものであった。錠剤に水半透過性コーティングを施すと、錠剤への水の浸入が遅れ、そのために膨張が遅れる。ついには、十分な水がコーティングに浸透し、膨張及び圧力増加が起こり、その後コーティングの破壊が起こる。破壊と同時に、錠剤はマトリックス錠剤として原薬の放出を始める。錠剤に施されるコーティングの厚さ及び/又は施されるコーティングの水透過性により遅延が制御される。エチルセルロース(Colorcon Surelease(登録商標);アメリカ合衆国、ペンシルベニア州ウェストポイント)を半透過性コーティングとして選択し、低分子量で低粘度の細孔形成剤ヒプロメロース(Dow E5LV)を混合して透過性を上昇させた。
【0143】
直接打錠により製造した270mgのメチルニコチンアミドマトリックス錠剤に、スプレーガンを2つ備えたAccelacota24インチコーティングパンで(プラセボシャム(placebo sham)によりコーティングパンの充填量を8kgに嵩増しして)被覆した。1%重量増のシールコーティングである非機能性コーティングOpadry(登録商標)IIWhite(Colorcon処方番号57U18539)を錠剤に施して、錠剤の浸食及びコーティングの剥離問題を防いだ。以下のパラメーターを利用して、コーティングパン中で錠剤のコアにOpadry(登録商標)を施した。
吸気温度約75℃ 吸気流量約200cfm
スプレー速度:40g/分 パン速度:12rpm
床温度約:45℃ ガン床距離:5インチ
排気温度約45℃ コーティング懸濁液:固形分15%
噴霧量:533g パン充填量:8kg(0.5kg活性、7.5kgプラセボ)
【0144】
半透過性コーティングは、プロペラ型攪拌翼を備えた寸胴なべ中で20gのヒプロメロースE5LVを900gのMilli−Q水に混合して製造した。1227g分のエチルセルロース系Surelease(登録商標)19040懸濁液(固形分25%)を、攪拌しているヒプロメロース溶液に加え、固形分を15%にした。
【0145】
5%のDow E5LVヒプロメロースで修飾したエチルセルロース系Surelease(登録商標)を、以下の処理パラメーターを利用して、シールコートされた錠剤に施した。
吸気温度約75℃ 吸気流量約200cfm
スプレー速度:40g/分 パン速度:12rpm
床温度約50℃ ガン床距離:5インチ
排気温度約50℃ コーティング懸濁液:固形分15%
噴霧量:2090g パン充填量:8kg(0.5kg活性、7.5kgプラセボ)
【0146】
錠剤の試料を、3%及び4%重量増の修飾されたSurelease(登録商標)コーティングとともに取り除いた。被覆された錠剤を、オーブン内で周囲雰囲気中で、40℃で18時間乾燥/硬化させた。1−メチルニコチンアミドの放出は、コーティング量によって1〜2時間遅れた。さらに、被覆された生成物の放出は、被覆されていない錠剤に対して、より直線の放出プロファイルを与えた。
【0147】
実施例3−流動床中の水性湿式トップスプレー造粒
この実施例では、流動床トップスプレー造粒を使用して、50mg含量のニフェジピン錠剤を製造する。ステアリン酸マグネシウム以外の、2kgバッチの成分すべてを20メッシュのふるいにかけ、トップスプレー用のスプレーガンを備えたNiro MP−1流動床プロセッサーに入れた。
【0148】
【表5】

【0149】
吸気温度65℃で材料を流動化し、30/g/分で30psiの噴霧圧力で水を噴霧する。全部で450gの水を噴霧する。顆粒を流動床中で約2.0%のLODに乾燥させる。乾燥させた顆粒を、0.040インチ超タイプスクリーンを備えたQuadro Comilを使用して一定サイズに粉砕する。粉砕した顆粒をステアリン酸マグネシウムとともにV型ブレンダーに入れ、3分間ブレンドする。約300mgの重量、約8kpの硬さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH105錠剤プレスで、ブレンドを圧縮した。
【0150】
実施例4−湿式造粒−水性高剪断50mgジクロフェナクカリウム錠
【0151】
【表6】

【0152】
高剪断水性造粒を利用した。ステアリン酸マグネシウム(40メッシュふるいでふるった)以外の、1kgバッチの成分全てを、20メッシュのふるいでふるい、Niro PP−1高剪断造粒機に入れた。攪拌翼速度300rpmでチョッパーを使わずに、材料を3分間混合した。攪拌翼を300rpmで運転しチョッパーを1500rpmの低速に設定した状態で、およそ3分にわたり、攪拌されている塊に350gの水を噴霧した。さらに1分間混合して、顆粒を生成させた。湿った顆粒を吸気温度65℃でNiro MP−1流動床で流動化し、流動床中で約2.2%のLODに乾燥させた。乾燥させた顆粒を、0.050インチ超タイプスクリーンを備えたQuadra Comilを利用して一定サイズに粉砕した。粉砕した顆粒をステアリン酸マグネシウムと合わせ、3分間バッグブレンド(bag blend)した。約300mgの重量、約10kpの硬さの錠剤を製造する直径3/8インチ円形標準凹形錠剤器具を備えた、3ステーションKorsch PH103錠剤プレスで、ブレンドを圧縮した。
【0153】
実施例5−50mgニフェジピン錠及び低剪断湿式造粒を利用して界面活性剤とともに、又は界面活性剤なしで製造したミニタブレットを含むマルチパーティキュレートカプセル
ニフェジピン錠及びミニタブレットを、以下に示す製剤あたりのSLS界面活性剤とともに、又は界面活性剤なしで微粒子化ニフェジピンを利用して製造した。
【0154】
【表7】

【0155】
これらの実施例において、100gバッチの成分(ステアリン酸マグネシウム以外)を20メッシュのふるいでふるい、Kitchen Aideプラネタリーミキサーに入れ、1分間混合した。50gの水又は水に溶かした53gの6%ラウリル硫酸ナトリウム(SLS)を、約5分かけて混合材料にゆっくりと注いだ。次いで、顆粒をステンレススチールのトレイに拡げ、50℃のオーブンでおよそ245時間、2〜3パーセントのLOD水分含量まで乾燥させた。乾燥済み顆粒(SLSを含むもの又は含まないもの)を、正方形タイプの攪拌翼及び0.050インチ超タイプスクリーンを使用して、Comilにより粉砕した。ステアリン酸マグネシウムを40メッシュのふるいでふるい、細分した1%ステアリン酸マグネシウムを、各顆粒に入れて72回転回させてバッグブレンドした。錠剤(3/8インチ円形標準凹形)を、ターゲット錠剤重量300mg、硬さ8kpでSLSを含む顆粒から圧縮した。
【0156】
SLSを含む顆粒及び含まない顆粒の両方から作られるミニタブレットを、ターゲット重量約20mg及び硬さ3kpで、直径0.0984インチ円形標準凹形器具を使用して圧縮した。カプセルあたり15のミニタブ(充填重量300mg)を、サイズ1ハードゼラチンカプセルに入れ、マルチパーティキュレートシステムを与えた。
【0157】
実施例6−直接打錠及び高剪断湿式造粒により調製したジクロフェナク錠
ジクロフェナクカリウム含量50mg錠:ロット003A、B、D、Eを実施例1で利用した直接打錠により調製し、ロット041を実施例4で利用した高剪断湿式造粒により調製した。
【0158】
【表8】

【0159】
実施例7−実施例1で利用した直接打錠により調製したアセトアミノフェン(含量50mg錠)ロット011A−E
【0160】
【表9】

【0161】
実施例8−実施例1で利用した直接打錠により調製したアセトアミノフェン(含量50mg錠)ロット013A−B
【0162】
【表10】

【0163】
実施例9−遅延放出被覆されたアセトアミノフェン(含量50mg錠)
ロット011及び13の錠剤は、実施例1で利用した直接打錠により調製し、実施例2で利用した1%重量増のヒプロメロースシールコートにより被覆し、それに次いで2、3、又は4%重量のエチルセルロース/ヒプロメロースコート(半透過性コーティング)により被覆した。錠剤を、コーティング量によって、ロット033−1/2%、1/3%、又は1/4%と割り当てた。
【0164】
実施例10−ニフェジピン(含量50mg錠)錠を、実施例1で利用した直接打錠により調製した。
【0165】
【表11】

【0166】
実施例11−ニフェジピン(微粒子化)錠剤ロット037及びミニタブレットロット039(内部界面活性剤含む)及びミニタブレットロット040(内部界面活性剤含まない)。錠剤は全て、実施例5で利用した低剪断湿式造粒により調製した。
【0167】
【表12】

【0168】
実施例12−塩酸ミノサイクリン含量50mg錠(ロット022)を、実施例1で利用した直接打錠により調製した。
【0169】
【表13】

【0170】
実施例13−ロット005及び018の1−メチルニコチンアミドクロリド含量270mg錠を実施例1で利用した直接打錠により調製し、ロット009Aを実施例2で使用した乾式造粒により調製した。
【0171】
【表14】

【0172】
実施例14:予備造粒(pre−granulated)した「緩徐」放出ブレンドの調製
予備造粒した緩徐放出ブレンドを、高剪断造粒を利用して1kgのバッチとして調製した。ポリマーをNiro PP−1造粒機に入れ、攪拌翼速度300rpm及び低速のチョッパーの設定で16分にわたり700gの水と混合した。水を入れてからさらに3分間混合を延長した。Niro MP−1流動床プロセッサー内で、吸気温度55〜65℃で30分間、LOD値4.8%に顆粒を乾燥させた(造粒前には基準の水分値は7.9%であった)。075R又は055R丸穴スクリーンを備えたQuadro(登録商標)Comil(登録商標)に、50%スピードで顆粒を通した。
【0173】
【表15】

【0174】
実施例15:予備造粒した「速」放性ブレンドの調製
ポリマーをNiro PMA 65高剪断造粒機に入れ、低速の攪拌翼の速度及びチョッパーなしで3分間予備混合した。次いで、低速の攪拌翼速度及び低速のチョッパー速度で混合しながら、全体で10500gの水を、650g/分でポリマーに噴霧した。湿っているポリマーをさらに3分間混合し、次いで、Niro MP−3流動床乾燥機に移し、吸気温度約70℃、空気の体積およそ200CMHで乾燥させた。ポリマーをLODにより測定して3.4%の水分含量に乾燥させた。乾燥させた顆粒を、攪拌翼速度30%で、円形攪拌翼及び055R(0.055インチ直径丸穴スクリーン)を備えた197S型Quadro Comilで粉砕した。
【0175】
【表16】

1 精製水は処理の間に除かれるので、処方の一部として考えられていない。精製水消滅期間は精製水分注後24時間である。
【0176】
実施例16〜18:15、30、及び60mg速放性硫酸モルヒネ持続放出錠の調製
これらの製剤を、バッグブレンディング及び直接打錠プロセスで調製した。適切な量の医薬品原体、実施例15の速放性ブレンドに示した成分、及びProSolv HD 90を適切なバッグに加え、120転回ブレンドした。実施例15の成分は、予備造粒ではなく直接打錠した。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0177】
【表17】

【0178】
実施例19〜20:100mg及び200mg速放性硫酸モルヒネ持続放出錠の調製
これらの製剤をバッグブレンディング及び直接打錠プロセスで調製した。適切な量の医薬品原体、実施例14の緩徐放出ブレンド、又は実施例15の速放性ブレンドに示された成分のそれぞれ、及びProSolv HD 90を適切なバッグに加え、120転回ブレンドした。実施例15の成分は、予備造粒ではなく直接打錠した。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0179】
【表18】

【0180】
実施例21〜22:図15に示す溶出試験に使用する、60mg緩徐放出及び速放性硫酸モルヒネ持続放出錠の調製
これらの製剤は、バッグブレンディング及び直接打錠プロセスにより調製した。適切な量の医薬品原体、それぞれ実施例15又は16の緩徐放出又は速放性ブレンド、及びProSolv HD 90を、適切なバッグに加え、120転回ブレンドした。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0181】
【表19】

【0182】
実施例23〜24:40mg緩徐放出及び速放性塩酸オキシコドン持続放出錠の調製
これらの製剤を、バッグブレンディング及び直接打錠プロセスにより調製した。適切な量の医薬品原体、それぞれ実施例15又は16の緩徐放出又は速放性ブレンド、及びProSolv HD 90を適切なバッグに加え、120転回ブレンドした。ステアリン酸マグネシウムを40メッシュのふるいを用いて分解し、さらに72転回して上述のブレンドにブレンドした。種々の錠剤の器具、硬さ、及び厚さは以下のとおりであった。
【0183】
【表20】

【0184】
当業者は、通常の実験のみを利用して、本明細書に記載した本発明の具体的な実施形態の多くの等価物を認識し、又は確認できるだろう。そのような等価物は、以下の請求項の範囲に包含されるものとする。
【特許請求の範囲】
【請求項1】
以下を含むマトリックス型徐放性医薬製剤:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨張性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;及び
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【請求項2】
以下を含む経口投与用のマトリックス型徐放性医薬製剤:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨張性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;及び
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【請求項3】
以下を含み、非水溶媒を実質的に含まないマトリックス型徐放性医薬製剤:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨張性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;及び
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【請求項4】
腸内pHでの少なくとも1種の前記原薬のインビトロ放出プロファイルがほぼ直線である、請求項2に記載の医薬製剤。
【請求項5】
胃内pHでの少なくとも1種の前記原薬のインビトロ放出プロファイルが実質的に一次放出プロファイルである、請求項2に記載の医薬製剤。
【請求項6】
胃内pHでの少なくとも1種の前記原薬のインビトロ放出プロファイルがほぼ直線である、請求項2に記載の医薬製剤。
【請求項7】
少なくとも1種の前記原薬の放出が約4時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項8】
少なくとも1種の前記原薬の放出が約8時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項9】
少なくとも1種の前記原薬の放出が約12時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項10】
少なくとも1種の前記原薬の放出が約24時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項11】
少なくとも1種の前記原薬の薬理効果が少なくとも約4時間持続する、請求項2に記載の医薬製剤。
【請求項12】
少なくとも1種の前記原薬の薬理効果が少なくとも約8時間持続する、請求項2に記載の医薬製剤。
【請求項13】
少なくとも1種の前記原薬の薬理効果が少なくとも約12時間持続する、請求項2に記載の医薬製剤。
【請求項14】
少なくとも1種の前記原薬の薬理効果が少なくとも約24時間持続する、請求項2に記載の医薬製剤。
【請求項15】
少なくとも1種の原薬の水溶解度が、高、中程度、低、低から中程度、及び中程度から高からなる群から選択される、請求項2に記載の医薬製剤。
【請求項16】
少なくとも1種の原薬が、疎水性及び親水性からなる群から選択される、請求項2に記載の医薬製剤。
【請求項17】
前記製剤が任意に被覆されており、前記コーティングが少なくとも1種の薬剤的に機能のないコーティングを含む、請求項2に記載の医薬製剤。
【請求項18】
前記製剤が任意に被覆されており、前記コーティングが少なくとも1種の薬剤的に機能のあるコーティングを含む、請求項2に記載の医薬製剤。
【請求項19】
前記製剤が任意に被覆されており、前記コーティングが1種以上の原薬をさらに含み、1種以上の前記原薬が、前記マトリックスに含まれている1種以上の原薬と同じ又は異なる、請求項2に記載の医薬製剤。
【請求項20】
錠剤形態の請求項2に記載の医薬製剤。
【請求項21】
カプセル形態の請求項2に記載の医薬製剤。
【請求項22】
前記カプセルが、少なくとも1種のミニタブ、マルチパーティキュレート、及びプラグからなる群から選択される形態の物質により満たされている、請求項21に記載の医薬製剤。
【請求項23】
前記製剤の調製における少なくとも1工程が、直接打錠を利用して調製される場合の、請求項2に記載の医薬製剤。
【請求項24】
前記製剤の調製における少なくとも1工程が、乾式造粒を利用して調製される場合の、請求項2に記載の医薬製剤。
【請求項25】
前記製剤の調製における少なくとも1工程が、湿式造粒を利用して調製される場合の、請求項2に記載の医薬製剤。
【請求項26】
二相性の放出プロファイルを有する、請求項2に記載の医薬製剤。
【請求項27】
前記少なくとも1種の原薬が1−メチルニコチンアミド又は薬剤的に許容できるその塩である、請求項2に記載の医薬製剤。
【請求項28】
前記塩が塩酸塩である、請求項27に記載の医薬製剤。
【請求項1】
以下を含むマトリックス型徐放性医薬製剤:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨張性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;及び
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【請求項2】
以下を含む経口投与用のマトリックス型徐放性医薬製剤:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨張性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;及び
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【請求項3】
以下を含み、非水溶媒を実質的に含まないマトリックス型徐放性医薬製剤:
i) 有効量の少なくとも1種の原薬;
ii) 少なくとも1種の水膨張性pH非依存性ポリマー;
iii)少なくとも1種のアニオンpH依存性ゲル形成性コポリマー;及び
iv) 以下からなる群から選択される少なくとも1種のポリマー:
a.カチオンポリマー;及び
b.ヒドロコロイド。
【請求項4】
腸内pHでの少なくとも1種の前記原薬のインビトロ放出プロファイルがほぼ直線である、請求項2に記載の医薬製剤。
【請求項5】
胃内pHでの少なくとも1種の前記原薬のインビトロ放出プロファイルが実質的に一次放出プロファイルである、請求項2に記載の医薬製剤。
【請求項6】
胃内pHでの少なくとも1種の前記原薬のインビトロ放出プロファイルがほぼ直線である、請求項2に記載の医薬製剤。
【請求項7】
少なくとも1種の前記原薬の放出が約4時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項8】
少なくとも1種の前記原薬の放出が約8時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項9】
少なくとも1種の前記原薬の放出が約12時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項10】
少なくとも1種の前記原薬の放出が約24時間を超えた期間にわたる、請求項2に記載の医薬製剤。
【請求項11】
少なくとも1種の前記原薬の薬理効果が少なくとも約4時間持続する、請求項2に記載の医薬製剤。
【請求項12】
少なくとも1種の前記原薬の薬理効果が少なくとも約8時間持続する、請求項2に記載の医薬製剤。
【請求項13】
少なくとも1種の前記原薬の薬理効果が少なくとも約12時間持続する、請求項2に記載の医薬製剤。
【請求項14】
少なくとも1種の前記原薬の薬理効果が少なくとも約24時間持続する、請求項2に記載の医薬製剤。
【請求項15】
少なくとも1種の原薬の水溶解度が、高、中程度、低、低から中程度、及び中程度から高からなる群から選択される、請求項2に記載の医薬製剤。
【請求項16】
少なくとも1種の原薬が、疎水性及び親水性からなる群から選択される、請求項2に記載の医薬製剤。
【請求項17】
前記製剤が任意に被覆されており、前記コーティングが少なくとも1種の薬剤的に機能のないコーティングを含む、請求項2に記載の医薬製剤。
【請求項18】
前記製剤が任意に被覆されており、前記コーティングが少なくとも1種の薬剤的に機能のあるコーティングを含む、請求項2に記載の医薬製剤。
【請求項19】
前記製剤が任意に被覆されており、前記コーティングが1種以上の原薬をさらに含み、1種以上の前記原薬が、前記マトリックスに含まれている1種以上の原薬と同じ又は異なる、請求項2に記載の医薬製剤。
【請求項20】
錠剤形態の請求項2に記載の医薬製剤。
【請求項21】
カプセル形態の請求項2に記載の医薬製剤。
【請求項22】
前記カプセルが、少なくとも1種のミニタブ、マルチパーティキュレート、及びプラグからなる群から選択される形態の物質により満たされている、請求項21に記載の医薬製剤。
【請求項23】
前記製剤の調製における少なくとも1工程が、直接打錠を利用して調製される場合の、請求項2に記載の医薬製剤。
【請求項24】
前記製剤の調製における少なくとも1工程が、乾式造粒を利用して調製される場合の、請求項2に記載の医薬製剤。
【請求項25】
前記製剤の調製における少なくとも1工程が、湿式造粒を利用して調製される場合の、請求項2に記載の医薬製剤。
【請求項26】
二相性の放出プロファイルを有する、請求項2に記載の医薬製剤。
【請求項27】
前記少なくとも1種の原薬が1−メチルニコチンアミド又は薬剤的に許容できるその塩である、請求項2に記載の医薬製剤。
【請求項28】
前記塩が塩酸塩である、請求項27に記載の医薬製剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【公表番号】特表2012−512896(P2012−512896A)
【公表日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願番号】特願2011−542467(P2011−542467)
【出願日】平成21年12月18日(2009.12.18)
【国際出願番号】PCT/US2009/068660
【国際公開番号】WO2010/080580
【国際公開日】平成22年7月15日(2010.7.15)
【出願人】(511148190)エイエイアイファーマ サービシズ コーポレーション (1)
【氏名又は名称原語表記】AAIPHARMA SERVICES CORP.
【Fターム(参考)】
【公表日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願日】平成21年12月18日(2009.12.18)
【国際出願番号】PCT/US2009/068660
【国際公開番号】WO2010/080580
【国際公開日】平成22年7月15日(2010.7.15)
【出願人】(511148190)エイエイアイファーマ サービシズ コーポレーション (1)
【氏名又は名称原語表記】AAIPHARMA SERVICES CORP.
【Fターム(参考)】
[ Back to top ]

