指尖脈波解析装置及びこれを用いた血管内皮機能評価システム
【課題】血管内皮機能測定に適用できる高い再現性と凡用性に優れた指尖脈波解析装置の提供を目的とする。
さらには、本装置を用いた血管内皮機能評価システムの提供も目的とする。
【解決手段】上腕に装着され、駆血及び開放するための加圧手段と、指先に装着される指尖プローブと、当該指尖プローブに設けたセンサーを用いて指尖血流変化量を光学的に測定できる光学的脈波検出手段を有することを特徴とする。
さらには、本装置を用いた血管内皮機能評価システムの提供も目的とする。
【解決手段】上腕に装着され、駆血及び開放するための加圧手段と、指先に装着される指尖プローブと、当該指尖プローブに設けたセンサーを用いて指尖血流変化量を光学的に測定できる光学的脈波検出手段を有することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は糖尿病患者、動脈硬化発症前診断、メタボリックシンドローム検診等、血管柔軟性を検査するのに効果的な指尖脈波解析装置及びこれを用いた血管内皮機能評価システムに関する。
【背景技術】
【0002】
最近、動脈硬化検査法として血流依存性血管拡張反応(FMD)が注目されている。
ここでFMD(flow-mediated dilation:血流依存性血管拡張反応)とは、血管はアセチルコリン受容体からのシグナル伝達により、アルギニンから合成された一酸化窒素(NO)を介して血管が拡張する。
また、血管は機械的刺激や「shear stress:ずり応力」にも応答して血管内皮細胞よりNOが産性され、血管が拡張する。
近年、駆血開放後に血管内の血流増加により強力なshear sressが生じ、その後、一過性に血管が拡張する現象が明らかにされ、FMDと命名された。
すなわち、FMDはNO依存性の一過性血管拡張反応と理解されている。
FMDにより血管内皮細胞から産生される一酸化窒素等の血管拡張物質に反応する血管拡張性が診断できる。
FMDを利用した検査方法としては上腕動脈の血管超音波検査で血管径変化を直接計測する方法を用いる。
しかし、FMDの上腕動脈拡張率を超音波で測定する機器(BAUS:Brachial Artery Ultrasound)は、超音波による血管内径側定を原理とするため、内径描出が一定とならず、個人差が大きく再現性も乏しい。
また、超音波エコー検査者の技量に依存するところが大きく超音波検査機器が高額(数千万円)である問題があった。
そこで、最近、FMD計測に関して、上腕動脈拡張率をエコーで測定するというデータの不安定と高額なエコー機器を使用しない上腕駆血解放後の血管拡張反応を指尖の毛細血管の圧変化でとらえるPAT技術による新しいFMD測定法が開発されている。
ここで、PAT(Peripheral Arterisl Tonometry:末梢動脈圧計側器)とは、上腕駆血開放後の血管拡張反応を指尖の末梢動脈拍動の血流量の変化として検出するものである。 例えば、非特許文献1に、上腕動脈駆血解放後の血管拡張反応に対して、指尖の血流量変動を圧変化として検出する方法が開示されている。
また、PAT技術に関して特許文献1〜3が存在する。
PATでも動脈硬化の判定が可能である報告もある(三上正俊、鍵谷昭文、小澤禎治:加圧脈波による動脈硬化診断。日本臨床生理学会雑誌35:9−18,2005)。
しかし、PAT技術によりこれまでに商品化されている機器(エンドパッド2000、Itamer社(イスラエル))は、上腕の駆血部分が手動になっており、加圧が一定でなく不安定で、駆血できているかの判断は、検者の波形による主観的判断に依存し、手動で適宣、再加圧している。
指尖脈圧の駆血前後の指尖血流量を脈圧の比率(駆血後/駆血前)で計算するため、変化率が大きく出る。
また、指尖血管圧測定プローブが1回限りの「使い捨て」であり、ランニングコストが非常に高い問題を有している。
さらには次のような課題もあった。
一般に、指尖脈波の振幅は、指尖部をセンサーに圧着させる圧力によって変化する。最適な圧力でセンサーに圧着させると、大きな振幅のきれいな脈波をセンシングすることができるが、圧力が弱すぎると、振幅が小さくノイズ成分が大きくなり、圧力が強すぎると、逆に血流が阻害されて、振幅が小さくなる。
最適な圧力は、指の太さや、血管の硬さにより異なるので、バネ式の一般のプローブでは、圧力が弱すぎたり、強すぎたりするために、脈波が精度良く取れない場合がある。
また、バネ式のプローブでは、15分間の測定を続けて指先を圧迫し続けるために、脈波の振幅が減衰してしまうこともある。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特表2000−515789号公報
【特許文献2】特表2003−527149号公報
【特許文献3】特表2004−528052号公報
【特許文献4】特公平6−9546号公報
【非特許文献】
【0004】
【非特許文献1】Bonetti PO,Pumper GM,Higano ST,et al:Non-invasive Identification of patients with early colonary atherosclerosis by assessment of digitasl reacyive hyperemia.J Am Coll cardiol 44:2137-2141,2004
【発明の概要】
【発明が解決しようとする課題】
【0005】
血管内皮機能測定に適用できる高い再現性と凡用性に優れた指尖脈波解析装置の提供を目的とする。
さらには、本装置を用いた血管内皮機能評価システムの提供も目的とする。
【課題を解決するための手段】
【0006】
本発明に係る脈波解析装置は、上腕に装着され、駆血及び開放するための加圧手段と、指先に装着される指尖プローブと、当該指尖プローブに設けたセンサーを用いて指尖血流変化量を光学的に測定できる光学的脈波検出手段を有することを特徴とする。
ここで、前記加圧手段は自動血圧計であってもよい。
なお、光学的計測手段は、特許文献4に記載の発光ダイオードにて、赤外線を照射し、毛細血管内のヘモグロビンとの反応における反射・吸収率をフォトダイオードで検知し、その反射光量により血流量を解析する技術を取り込むことができるが、本発明は、さらに指尖部とセンサーとの間に最適圧力が負荷されるように調整可能な装着圧力調整手段を有することを特徴とする。
この脈波解析装置を用いた本発明に係る血管内皮機能評価システムは、左右の手の指尖部から検知された両方の指尖脈波の振幅を合致させるように係数処理する係数処理手段を有し、一方の指尖部に対応する上腕が駆血及び血流再開された後に検知された指尖脈波から脈波ピーク値検出手段を用いて検出した、脈波ピーク値と前記係数処理して得られた脈波ベース値との差から血管内皮機能レベルを評価する評価手段、上腕の駆血前、及び血流再開された後の脈波の収縮期圧に占める反射波成分の割合AI(Augmentation Index)値から血管内皮機能レベルを評価する評価手段及び、加速度脈波の脈波特徴量として血管老化年齢指数(AG)を用いて血管内皮機能レベルを評価する評価手段のうち、少なくともいずれか1つ以上有することを特徴とする。
ここで評価手段は単独で判定してもよいが、2つ以上を組み合せることでより総合的な評価が可能となる。
【0007】
本発明において、指尖プローブに装着圧力調整手段を用いたのは次のような特徴による。
先に、プローブの装着圧力(センサーに負荷される圧力)によって指尖脈波の振幅が変化することを述べた。
これを図6に基づいて具体的に説明する。
横軸にプローブ装着圧力(指尖をセンサーに圧着させる圧力)をとり、縦軸にセンサーにより検出される脈波の振幅をとると、装着圧力の上昇につれて脈波の振幅が大きくなり、圧力の変化に対する血管容積変化の値(コンプライアンスC)が最大になる圧力(図6の点線で示した曲線の傾きが最も大きくなる圧力)と、それ以上圧力をかけると逆に脈波の振幅が減少しはじめる最大振幅圧力とが出現する。
そこで、ノイズの影響を最小限に抑え再現性の高いデータを得るには、このコンプライアンスCが最大になる圧力又は最大振幅圧力にプローブの装置圧を調整するのがよい。
なお、計測時は両方の圧力にてデータをとり、解析時に被検者の年齢や体型に応じて選択使用するとよい。
【0008】
本発明において、脈波のAI値とは、収縮期血圧に占める反射波成分の割合をいい、この値は動脈硬化の進展により変化する。
また、得られた脈波から加速度脈波を解析することでも動脈硬化の状況を評価できる。
【発明の効果】
【0009】
本発明に係る脈波解析装置は、指尖血流変化量を光学的に検知し、駆血側指尖脈波ピーク値と対象側(コントロール)ピーク値との差によって解析するので、従来の指尖脈圧比で計測する方法に対して、ノイズの影響が少なく再現性が高い。
また、AI(Augmentation Index)値、加速度脈波の脈波特微量としての血管老化年齢指数(AG)は、駆血前の値と駆血開放後の値が、内皮機能が正常の場合と、内皮機能が低下した場合では変化が見られる。
そこで、脈波の振幅の情報にAI(Augmentation Index)値、加速度脈波の脈波波形の特徴量の情報を加えて総合的に評価することにより、ノイズの影響が少なく再現性が高い結果が得られる。
従来の指尖圧プローブは「使い捨て」であるのに対して本発明に係る光学的脈波検出手段は、繰り返し使用できるので検査費用が安価になる。
また、指先をセンサーに圧着させる圧力を、被験者ごとに最適な圧力を駆血前に設定するため、ノイズの影響が少なく再現性が高いデータが得られる。
さらに、自動血圧計で駆血条件を自動制御すると、駆血状態をリアルタイムに把握し、制御できるため再現性が高い。
さらに駆血できる最低の血圧値を測定者にあわせて設定するため、被検者の身体的負担も軽減される。
【図面の簡単な説明】
【0010】
【図1】本発明に係る装置の構成例を示す。
【図2】血流量の測定原理を示す。
【図3】装置の制御例を示す。
【図4】計測データの例を示す。
【図5】データの解析例を示す。
【図6】脈波の振幅と指尖をセンサーに圧着させる圧力との関係図を示す。
【図7】AI( Augmentation Index )値の計算原理を示す。
【図8】駆血前後のAI値の変化を示す。
【図9】駆血前後の加速度脈波の特微量として血管老化年齢指数(AG)の変化を示す。
【図10】加速度脈波の例を示す。
【図11】推定RHI値算出方法 (比=駆血側値/対照側値と差=駆血側値―対照側の比較)例を示す。
【図12】エンドパッド2000による脈波同時測定による波形比較例を示す。
【発明を実施するための形態】
【0011】
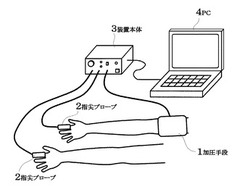
本発明に係る脈波解析装置の構成例を図1に示す。
上腕に装着するための自動血圧計等の加圧手段1と、両手指の血流変化量を光学的に計測するための指尖プローブ2と上腕の駆血条件、及び指の加圧条件を制御する装置本体3とを備え、取得したデータはリアルタイムに解析及び表示するPC4に接続されている。
【0012】
指尖プローブの下側には赤外線発光ダイオードとフォトダイオードが指尖部の内部でそれらの光軸が交差するように配置されている。
その原理を図2に模式的に示す。
発光ダイオードで照射された赤外線は血流中のヘモグロビンにて一部が吸収され、その反射光量が血流の増減で変化する。
この変化がフォトダイオードにて電圧変化として出力される。
【0013】
次に計測手段を図3で説明する。
左右の手の指尖部にそれぞれ指尖プローブ2を装着し、駆血する側を検査側とし、駆血しない側をコントロール側とする。
指尖部をフォトダイオードのセンサーに圧着させる最適圧力を求めるために、駆血前に事前測定を行う。
例えば指尖プローブに連結した空気ポンプ6と圧力センサを用いて最低血圧より30mmHg低い値から最低血圧より50mmHg高いまで徐々に加圧して、脈波をモニターし脈波の振幅が最大になった時の圧力又は、コンプライアンスCが最大になった圧力を最適圧力とし、本測定時の指尖部圧力とする。
最大の脈波振幅になる圧力を評価に用いるとノイズが小さくなり、コンプライアンスC=血管容積変化/圧力変化を指標として、最大値なる圧力を用いるとより変化しやすく鋭敏なデータの変化を入手できる。
図3に示した例では、フォトダイオードからの電圧変化を増幅回路にて増幅し、A/D変換後にコンピュータ4にてモニタリングする例になっている。
指尖部を最適圧力に維持したまま、上腕部の加圧前の測定を一定時間行う。
次に、一方の腕の上腕部を自動血圧計(加圧手段1)で加圧し、一定時間駆血する。
完全な駆血に達したかどうかを判断し、達成していない場合は駆血が達成されるまで加圧を継続する。
図3に示した例では空気ポンプ6と圧力センサ及び減圧弁の組み合せにて加圧制御した例になっている。
駆血が完全であるかどうかの判断方法は、左右の脈波の相関係数を計算し、相関係数が閾値よりも小さい時に駆血されていると判断する。
駆血達成後は圧力を維持する。
圧力の低下を監視、制御することで設定圧力を自動的に維持する。
その後、除圧し血流を再開する。
【0014】
脈波データ解析
末梢血管血流変化を指尖脈波でモニタリングしたものが図4に示すチャート例である。
図4にて上段の脈波が検査側で、下段の脈波がコントロール側である。
縦軸が脈波高、横軸が時間を示す。
加圧側では駆血により一定時間、脈波が消失していることがわかる。
図4の脈波データをPCに取り込み計算されたリアルタイム解析した例を図5に示す。
左右の脈波のベースラインの部分の誤差が最小になるように、最小誤差法を利用して係数を掛けて振幅を合せた(a,b)後、駆血側の脈波のピーク値とコントロール側の脈波ピーク値の差(ベースラインの振幅を合せた後のAのピーク)−(ベースラインの振幅を合せた後のピークB)を計算する。
ここで脈波のピーク値とは振幅の上限側のピーク値をいう。
差の駆血後2〜2.5分後の累積値を算出し、内皮機能指数(図5の縦軸)に設定する。
図5では、駆血前に左右のベースラインを合せた状態が(a,b)で、その時の脈波の振幅差はδ0=0であったものが、駆血を開放し血流を再開させた場合のA−B=δ1の値を縦軸に示す。
差の曲線をプロットして駆血後2.5分の位置、25秒間隔で平均振幅を計算し、その値を反応性駆血再灌流による血管拡張指標 RHI(reactive hyperemia index)の推定値として設定する。
これにより、内皮機能の状態を指数として表現できる。
【0015】
<AI値を評価に用いた例>
血圧波形は、図7に示すように心臓から拍出される一次波(駆出波)とさらに1次波が反射されることで形成される反射波との合成波として形成される。
この合成波は動脈硬化の進展により修飾されるためこのパラメーターを取り込むことはデータ解析上重要となる。
とくに、収縮期血圧に占める反射波成分の割合は、augmentation index (AI)として脈波から求めることができる。
本発明機器で得られた脈波の1つの波形を詳細に分析すると2つのピークがあり、初めに現れるのが駆出波でその振幅最大値をP1、次に出現するものが反射波でその振幅最大値をP2とするとAIは100×(P1−P2)/P1で表示される。
図8に本発明機器で得られた脈波から計算されたAIの経時的変化例を示す。
内皮機能が低下した動脈硬化進行症例では、駆血前後でAIが全く変化していないことがわかる。
【0016】
<加速度脈波の脈波特徴量として血管老化年齢指数(AG)を評価に用いた例>
指尖容積脈波に加えて、この波形から血液循環情報を得るために、指尖容積脈波を2階微分し、有用な情報を抽出したものが加速度脈波である。
われわれの検査機器で得られた容脈波からも容易に加速度脈波が算出できる。
図9に加速度脈波データ例を示す。
加速度脈波形は心臓の収縮期の波形であり、a,b,c,d,e波の5つの成分波がみられる(e波は前弛緩期に相当と考えられている)。
基線より上を正、下を負の象限としたとき、a波は基線より常に上に位置する陽性波、b波は基線より常に下に位置する陰性波、c波、d波、e波は生体の条件により、陽性または陰性に変化する。
波形評価のパラメーターとしては、基線をx軸として、各成分波の頂点までの距離をy座標としてとらえ、a 成分波の基線から頂点までの距離を基準にして、b,c,d,e波を解析する。
図10に本機器から得られた駆血前後の加速度脈波の変化としてAG=41−(bの絶対値)/aの変化を示す。
AGの計算式は、加速度脈波加齢指数(SDPTG aging index:SDPTGAI)=(b−c−d−e)/aを利用し、一般に男性「血管年齢」= 43.47×(b−c−d−e)/a+65.86、女性「血管年齢」=41.67×(b−c−d−e)/a+61.75が利用されているが、本機器を利用した加速度脈波データより、本機器ではAG(血管老化年齢指数)=41−(bの絶対値)/aに設定できる。
動脈硬化が進行し、内皮機能が低下すると駆血前後での加速度脈波の経時的変化が出現しなくなることがわかる。
本実施例では評価にb成分波を用いたが、c,d,e波を組み合せることも可能であり、AGを求める式も適宜変更して使用可能である。
【0017】
推定RHI値算出方法として、比=駆血側値/対照側値より、差=駆血側値―対照側値のほうがデータの安定性・再現性がよい理由を(図11)に示す。
血管内皮機能が正常な20歳台女性のデータに対して、上段は経時的に差で表示したもの 下段は経時的に比で表示したものを示す。
差で求めた値の標準偏差はSD=0.23、比で求めた値の標準偏差はSD=0.41であり、比のほうがデータのばらつきが大きくなることが分かる。
【0018】
エンドパッド2000(商品名)と本機器による脈波データの比較。
左腕を駆血側、右腕を対照として、両第2指にエンドパッド2000のプローブ、両第4指に研究機器のプローブを装着し、同時に駆血負荷を実施した脈波の経時的変化を図12に示す。
脈波振幅経過の経時的変化は両者ともほぼ一致した。
例として図12のAと‘Aの出現、Bの3つのピークと’Bの3つのピークに一致、さらに対照側に出現した予期せぬ脈波の変化Cも同様に‘Cで捉えていることがわかる。
以上、エンドパッドによる指尖脈圧変化と光学的計測法による指尖血流脈波は同じようにRHIを捉えることができることが確認できたが、本発明はセンサー圧を最適にし、RHI値の算出を差で求めたことから、データの精度及び再現性が高くなっている。
【産業上の利用可能性】
【0019】
本発明は、生体における非浸襲的な直接血管機能を検査できる方法であるため、メタボリック検診事業等に活用できる可能性がある。
動脈硬化発症前診断として、血管病変早期発見に加え、メタボロックシンドロームで要指導となった住民の健康管理事業にも貢献できる。
また、スタチン系薬剤・抗血小板薬の動脈硬化に対する生体内薬効判定が可能となる。
【符号の説明】
【0020】
1 加圧手段
2 指尖プローブ
3 装置本体
4 PC
5 空気チューブ
6 空気ポンプ
【技術分野】
【0001】
本発明は糖尿病患者、動脈硬化発症前診断、メタボリックシンドローム検診等、血管柔軟性を検査するのに効果的な指尖脈波解析装置及びこれを用いた血管内皮機能評価システムに関する。
【背景技術】
【0002】
最近、動脈硬化検査法として血流依存性血管拡張反応(FMD)が注目されている。
ここでFMD(flow-mediated dilation:血流依存性血管拡張反応)とは、血管はアセチルコリン受容体からのシグナル伝達により、アルギニンから合成された一酸化窒素(NO)を介して血管が拡張する。
また、血管は機械的刺激や「shear stress:ずり応力」にも応答して血管内皮細胞よりNOが産性され、血管が拡張する。
近年、駆血開放後に血管内の血流増加により強力なshear sressが生じ、その後、一過性に血管が拡張する現象が明らかにされ、FMDと命名された。
すなわち、FMDはNO依存性の一過性血管拡張反応と理解されている。
FMDにより血管内皮細胞から産生される一酸化窒素等の血管拡張物質に反応する血管拡張性が診断できる。
FMDを利用した検査方法としては上腕動脈の血管超音波検査で血管径変化を直接計測する方法を用いる。
しかし、FMDの上腕動脈拡張率を超音波で測定する機器(BAUS:Brachial Artery Ultrasound)は、超音波による血管内径側定を原理とするため、内径描出が一定とならず、個人差が大きく再現性も乏しい。
また、超音波エコー検査者の技量に依存するところが大きく超音波検査機器が高額(数千万円)である問題があった。
そこで、最近、FMD計測に関して、上腕動脈拡張率をエコーで測定するというデータの不安定と高額なエコー機器を使用しない上腕駆血解放後の血管拡張反応を指尖の毛細血管の圧変化でとらえるPAT技術による新しいFMD測定法が開発されている。
ここで、PAT(Peripheral Arterisl Tonometry:末梢動脈圧計側器)とは、上腕駆血開放後の血管拡張反応を指尖の末梢動脈拍動の血流量の変化として検出するものである。 例えば、非特許文献1に、上腕動脈駆血解放後の血管拡張反応に対して、指尖の血流量変動を圧変化として検出する方法が開示されている。
また、PAT技術に関して特許文献1〜3が存在する。
PATでも動脈硬化の判定が可能である報告もある(三上正俊、鍵谷昭文、小澤禎治:加圧脈波による動脈硬化診断。日本臨床生理学会雑誌35:9−18,2005)。
しかし、PAT技術によりこれまでに商品化されている機器(エンドパッド2000、Itamer社(イスラエル))は、上腕の駆血部分が手動になっており、加圧が一定でなく不安定で、駆血できているかの判断は、検者の波形による主観的判断に依存し、手動で適宣、再加圧している。
指尖脈圧の駆血前後の指尖血流量を脈圧の比率(駆血後/駆血前)で計算するため、変化率が大きく出る。
また、指尖血管圧測定プローブが1回限りの「使い捨て」であり、ランニングコストが非常に高い問題を有している。
さらには次のような課題もあった。
一般に、指尖脈波の振幅は、指尖部をセンサーに圧着させる圧力によって変化する。最適な圧力でセンサーに圧着させると、大きな振幅のきれいな脈波をセンシングすることができるが、圧力が弱すぎると、振幅が小さくノイズ成分が大きくなり、圧力が強すぎると、逆に血流が阻害されて、振幅が小さくなる。
最適な圧力は、指の太さや、血管の硬さにより異なるので、バネ式の一般のプローブでは、圧力が弱すぎたり、強すぎたりするために、脈波が精度良く取れない場合がある。
また、バネ式のプローブでは、15分間の測定を続けて指先を圧迫し続けるために、脈波の振幅が減衰してしまうこともある。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特表2000−515789号公報
【特許文献2】特表2003−527149号公報
【特許文献3】特表2004−528052号公報
【特許文献4】特公平6−9546号公報
【非特許文献】
【0004】
【非特許文献1】Bonetti PO,Pumper GM,Higano ST,et al:Non-invasive Identification of patients with early colonary atherosclerosis by assessment of digitasl reacyive hyperemia.J Am Coll cardiol 44:2137-2141,2004
【発明の概要】
【発明が解決しようとする課題】
【0005】
血管内皮機能測定に適用できる高い再現性と凡用性に優れた指尖脈波解析装置の提供を目的とする。
さらには、本装置を用いた血管内皮機能評価システムの提供も目的とする。
【課題を解決するための手段】
【0006】
本発明に係る脈波解析装置は、上腕に装着され、駆血及び開放するための加圧手段と、指先に装着される指尖プローブと、当該指尖プローブに設けたセンサーを用いて指尖血流変化量を光学的に測定できる光学的脈波検出手段を有することを特徴とする。
ここで、前記加圧手段は自動血圧計であってもよい。
なお、光学的計測手段は、特許文献4に記載の発光ダイオードにて、赤外線を照射し、毛細血管内のヘモグロビンとの反応における反射・吸収率をフォトダイオードで検知し、その反射光量により血流量を解析する技術を取り込むことができるが、本発明は、さらに指尖部とセンサーとの間に最適圧力が負荷されるように調整可能な装着圧力調整手段を有することを特徴とする。
この脈波解析装置を用いた本発明に係る血管内皮機能評価システムは、左右の手の指尖部から検知された両方の指尖脈波の振幅を合致させるように係数処理する係数処理手段を有し、一方の指尖部に対応する上腕が駆血及び血流再開された後に検知された指尖脈波から脈波ピーク値検出手段を用いて検出した、脈波ピーク値と前記係数処理して得られた脈波ベース値との差から血管内皮機能レベルを評価する評価手段、上腕の駆血前、及び血流再開された後の脈波の収縮期圧に占める反射波成分の割合AI(Augmentation Index)値から血管内皮機能レベルを評価する評価手段及び、加速度脈波の脈波特徴量として血管老化年齢指数(AG)を用いて血管内皮機能レベルを評価する評価手段のうち、少なくともいずれか1つ以上有することを特徴とする。
ここで評価手段は単独で判定してもよいが、2つ以上を組み合せることでより総合的な評価が可能となる。
【0007】
本発明において、指尖プローブに装着圧力調整手段を用いたのは次のような特徴による。
先に、プローブの装着圧力(センサーに負荷される圧力)によって指尖脈波の振幅が変化することを述べた。
これを図6に基づいて具体的に説明する。
横軸にプローブ装着圧力(指尖をセンサーに圧着させる圧力)をとり、縦軸にセンサーにより検出される脈波の振幅をとると、装着圧力の上昇につれて脈波の振幅が大きくなり、圧力の変化に対する血管容積変化の値(コンプライアンスC)が最大になる圧力(図6の点線で示した曲線の傾きが最も大きくなる圧力)と、それ以上圧力をかけると逆に脈波の振幅が減少しはじめる最大振幅圧力とが出現する。
そこで、ノイズの影響を最小限に抑え再現性の高いデータを得るには、このコンプライアンスCが最大になる圧力又は最大振幅圧力にプローブの装置圧を調整するのがよい。
なお、計測時は両方の圧力にてデータをとり、解析時に被検者の年齢や体型に応じて選択使用するとよい。
【0008】
本発明において、脈波のAI値とは、収縮期血圧に占める反射波成分の割合をいい、この値は動脈硬化の進展により変化する。
また、得られた脈波から加速度脈波を解析することでも動脈硬化の状況を評価できる。
【発明の効果】
【0009】
本発明に係る脈波解析装置は、指尖血流変化量を光学的に検知し、駆血側指尖脈波ピーク値と対象側(コントロール)ピーク値との差によって解析するので、従来の指尖脈圧比で計測する方法に対して、ノイズの影響が少なく再現性が高い。
また、AI(Augmentation Index)値、加速度脈波の脈波特微量としての血管老化年齢指数(AG)は、駆血前の値と駆血開放後の値が、内皮機能が正常の場合と、内皮機能が低下した場合では変化が見られる。
そこで、脈波の振幅の情報にAI(Augmentation Index)値、加速度脈波の脈波波形の特徴量の情報を加えて総合的に評価することにより、ノイズの影響が少なく再現性が高い結果が得られる。
従来の指尖圧プローブは「使い捨て」であるのに対して本発明に係る光学的脈波検出手段は、繰り返し使用できるので検査費用が安価になる。
また、指先をセンサーに圧着させる圧力を、被験者ごとに最適な圧力を駆血前に設定するため、ノイズの影響が少なく再現性が高いデータが得られる。
さらに、自動血圧計で駆血条件を自動制御すると、駆血状態をリアルタイムに把握し、制御できるため再現性が高い。
さらに駆血できる最低の血圧値を測定者にあわせて設定するため、被検者の身体的負担も軽減される。
【図面の簡単な説明】
【0010】
【図1】本発明に係る装置の構成例を示す。
【図2】血流量の測定原理を示す。
【図3】装置の制御例を示す。
【図4】計測データの例を示す。
【図5】データの解析例を示す。
【図6】脈波の振幅と指尖をセンサーに圧着させる圧力との関係図を示す。
【図7】AI( Augmentation Index )値の計算原理を示す。
【図8】駆血前後のAI値の変化を示す。
【図9】駆血前後の加速度脈波の特微量として血管老化年齢指数(AG)の変化を示す。
【図10】加速度脈波の例を示す。
【図11】推定RHI値算出方法 (比=駆血側値/対照側値と差=駆血側値―対照側の比較)例を示す。
【図12】エンドパッド2000による脈波同時測定による波形比較例を示す。
【発明を実施するための形態】
【0011】
本発明に係る脈波解析装置の構成例を図1に示す。
上腕に装着するための自動血圧計等の加圧手段1と、両手指の血流変化量を光学的に計測するための指尖プローブ2と上腕の駆血条件、及び指の加圧条件を制御する装置本体3とを備え、取得したデータはリアルタイムに解析及び表示するPC4に接続されている。
【0012】
指尖プローブの下側には赤外線発光ダイオードとフォトダイオードが指尖部の内部でそれらの光軸が交差するように配置されている。
その原理を図2に模式的に示す。
発光ダイオードで照射された赤外線は血流中のヘモグロビンにて一部が吸収され、その反射光量が血流の増減で変化する。
この変化がフォトダイオードにて電圧変化として出力される。
【0013】
次に計測手段を図3で説明する。
左右の手の指尖部にそれぞれ指尖プローブ2を装着し、駆血する側を検査側とし、駆血しない側をコントロール側とする。
指尖部をフォトダイオードのセンサーに圧着させる最適圧力を求めるために、駆血前に事前測定を行う。
例えば指尖プローブに連結した空気ポンプ6と圧力センサを用いて最低血圧より30mmHg低い値から最低血圧より50mmHg高いまで徐々に加圧して、脈波をモニターし脈波の振幅が最大になった時の圧力又は、コンプライアンスCが最大になった圧力を最適圧力とし、本測定時の指尖部圧力とする。
最大の脈波振幅になる圧力を評価に用いるとノイズが小さくなり、コンプライアンスC=血管容積変化/圧力変化を指標として、最大値なる圧力を用いるとより変化しやすく鋭敏なデータの変化を入手できる。
図3に示した例では、フォトダイオードからの電圧変化を増幅回路にて増幅し、A/D変換後にコンピュータ4にてモニタリングする例になっている。
指尖部を最適圧力に維持したまま、上腕部の加圧前の測定を一定時間行う。
次に、一方の腕の上腕部を自動血圧計(加圧手段1)で加圧し、一定時間駆血する。
完全な駆血に達したかどうかを判断し、達成していない場合は駆血が達成されるまで加圧を継続する。
図3に示した例では空気ポンプ6と圧力センサ及び減圧弁の組み合せにて加圧制御した例になっている。
駆血が完全であるかどうかの判断方法は、左右の脈波の相関係数を計算し、相関係数が閾値よりも小さい時に駆血されていると判断する。
駆血達成後は圧力を維持する。
圧力の低下を監視、制御することで設定圧力を自動的に維持する。
その後、除圧し血流を再開する。
【0014】
脈波データ解析
末梢血管血流変化を指尖脈波でモニタリングしたものが図4に示すチャート例である。
図4にて上段の脈波が検査側で、下段の脈波がコントロール側である。
縦軸が脈波高、横軸が時間を示す。
加圧側では駆血により一定時間、脈波が消失していることがわかる。
図4の脈波データをPCに取り込み計算されたリアルタイム解析した例を図5に示す。
左右の脈波のベースラインの部分の誤差が最小になるように、最小誤差法を利用して係数を掛けて振幅を合せた(a,b)後、駆血側の脈波のピーク値とコントロール側の脈波ピーク値の差(ベースラインの振幅を合せた後のAのピーク)−(ベースラインの振幅を合せた後のピークB)を計算する。
ここで脈波のピーク値とは振幅の上限側のピーク値をいう。
差の駆血後2〜2.5分後の累積値を算出し、内皮機能指数(図5の縦軸)に設定する。
図5では、駆血前に左右のベースラインを合せた状態が(a,b)で、その時の脈波の振幅差はδ0=0であったものが、駆血を開放し血流を再開させた場合のA−B=δ1の値を縦軸に示す。
差の曲線をプロットして駆血後2.5分の位置、25秒間隔で平均振幅を計算し、その値を反応性駆血再灌流による血管拡張指標 RHI(reactive hyperemia index)の推定値として設定する。
これにより、内皮機能の状態を指数として表現できる。
【0015】
<AI値を評価に用いた例>
血圧波形は、図7に示すように心臓から拍出される一次波(駆出波)とさらに1次波が反射されることで形成される反射波との合成波として形成される。
この合成波は動脈硬化の進展により修飾されるためこのパラメーターを取り込むことはデータ解析上重要となる。
とくに、収縮期血圧に占める反射波成分の割合は、augmentation index (AI)として脈波から求めることができる。
本発明機器で得られた脈波の1つの波形を詳細に分析すると2つのピークがあり、初めに現れるのが駆出波でその振幅最大値をP1、次に出現するものが反射波でその振幅最大値をP2とするとAIは100×(P1−P2)/P1で表示される。
図8に本発明機器で得られた脈波から計算されたAIの経時的変化例を示す。
内皮機能が低下した動脈硬化進行症例では、駆血前後でAIが全く変化していないことがわかる。
【0016】
<加速度脈波の脈波特徴量として血管老化年齢指数(AG)を評価に用いた例>
指尖容積脈波に加えて、この波形から血液循環情報を得るために、指尖容積脈波を2階微分し、有用な情報を抽出したものが加速度脈波である。
われわれの検査機器で得られた容脈波からも容易に加速度脈波が算出できる。
図9に加速度脈波データ例を示す。
加速度脈波形は心臓の収縮期の波形であり、a,b,c,d,e波の5つの成分波がみられる(e波は前弛緩期に相当と考えられている)。
基線より上を正、下を負の象限としたとき、a波は基線より常に上に位置する陽性波、b波は基線より常に下に位置する陰性波、c波、d波、e波は生体の条件により、陽性または陰性に変化する。
波形評価のパラメーターとしては、基線をx軸として、各成分波の頂点までの距離をy座標としてとらえ、a 成分波の基線から頂点までの距離を基準にして、b,c,d,e波を解析する。
図10に本機器から得られた駆血前後の加速度脈波の変化としてAG=41−(bの絶対値)/aの変化を示す。
AGの計算式は、加速度脈波加齢指数(SDPTG aging index:SDPTGAI)=(b−c−d−e)/aを利用し、一般に男性「血管年齢」= 43.47×(b−c−d−e)/a+65.86、女性「血管年齢」=41.67×(b−c−d−e)/a+61.75が利用されているが、本機器を利用した加速度脈波データより、本機器ではAG(血管老化年齢指数)=41−(bの絶対値)/aに設定できる。
動脈硬化が進行し、内皮機能が低下すると駆血前後での加速度脈波の経時的変化が出現しなくなることがわかる。
本実施例では評価にb成分波を用いたが、c,d,e波を組み合せることも可能であり、AGを求める式も適宜変更して使用可能である。
【0017】
推定RHI値算出方法として、比=駆血側値/対照側値より、差=駆血側値―対照側値のほうがデータの安定性・再現性がよい理由を(図11)に示す。
血管内皮機能が正常な20歳台女性のデータに対して、上段は経時的に差で表示したもの 下段は経時的に比で表示したものを示す。
差で求めた値の標準偏差はSD=0.23、比で求めた値の標準偏差はSD=0.41であり、比のほうがデータのばらつきが大きくなることが分かる。
【0018】
エンドパッド2000(商品名)と本機器による脈波データの比較。
左腕を駆血側、右腕を対照として、両第2指にエンドパッド2000のプローブ、両第4指に研究機器のプローブを装着し、同時に駆血負荷を実施した脈波の経時的変化を図12に示す。
脈波振幅経過の経時的変化は両者ともほぼ一致した。
例として図12のAと‘Aの出現、Bの3つのピークと’Bの3つのピークに一致、さらに対照側に出現した予期せぬ脈波の変化Cも同様に‘Cで捉えていることがわかる。
以上、エンドパッドによる指尖脈圧変化と光学的計測法による指尖血流脈波は同じようにRHIを捉えることができることが確認できたが、本発明はセンサー圧を最適にし、RHI値の算出を差で求めたことから、データの精度及び再現性が高くなっている。
【産業上の利用可能性】
【0019】
本発明は、生体における非浸襲的な直接血管機能を検査できる方法であるため、メタボリック検診事業等に活用できる可能性がある。
動脈硬化発症前診断として、血管病変早期発見に加え、メタボロックシンドロームで要指導となった住民の健康管理事業にも貢献できる。
また、スタチン系薬剤・抗血小板薬の動脈硬化に対する生体内薬効判定が可能となる。
【符号の説明】
【0020】
1 加圧手段
2 指尖プローブ
3 装置本体
4 PC
5 空気チューブ
6 空気ポンプ
【特許請求の範囲】
【請求項1】
上腕に装着され、駆血及び開放するための加圧手段と、指先に装着される指尖プローブと、当該指尖プローブに設けたセンサーを用いて指尖血流変化量を光学的に測定できる光学的脈波検出手段を有することを特徴とする脈波解析装置。
【請求項2】
前記指尖プローブは、指尖部とセンサーとの間に最適圧力が負荷されるように調整可能な装着圧力調整手段を有することを特徴とする請求項1記載の脈波解析装置。
【請求項3】
前記加圧手段は自動血圧計であることを特徴とする請求項1又は2記載の脈波解析装置。
【請求項4】
左右の手の指尖部から検知された両方の指尖脈波の振幅を合致させるように係数処理する係数処理手段を有し、
一方の指尖部に対応する上腕が駆血及び血流再開された後に検知された指尖脈波から脈波ピーク値検出手段を用いて検出した、脈波ピーク値と前記係数処理して得られた脈波ベース値との差から血管内皮機能レベルを評価する評価手段、
上腕の駆血前、及び血流再開された後の脈波の収縮期圧に占める反射波成分の割合AI(Augmentation Index)値から血管内皮機能レベルを評価する評価手段及び、
加速度脈波の脈波特徴量AG(血管老化年齢指数)を用いて血管内皮機能レベルを評価する評価手段のうち、
少なくともいずれか1つ以上有することを特徴とする血管内皮機能評価システム。
【請求項1】
上腕に装着され、駆血及び開放するための加圧手段と、指先に装着される指尖プローブと、当該指尖プローブに設けたセンサーを用いて指尖血流変化量を光学的に測定できる光学的脈波検出手段を有することを特徴とする脈波解析装置。
【請求項2】
前記指尖プローブは、指尖部とセンサーとの間に最適圧力が負荷されるように調整可能な装着圧力調整手段を有することを特徴とする請求項1記載の脈波解析装置。
【請求項3】
前記加圧手段は自動血圧計であることを特徴とする請求項1又は2記載の脈波解析装置。
【請求項4】
左右の手の指尖部から検知された両方の指尖脈波の振幅を合致させるように係数処理する係数処理手段を有し、
一方の指尖部に対応する上腕が駆血及び血流再開された後に検知された指尖脈波から脈波ピーク値検出手段を用いて検出した、脈波ピーク値と前記係数処理して得られた脈波ベース値との差から血管内皮機能レベルを評価する評価手段、
上腕の駆血前、及び血流再開された後の脈波の収縮期圧に占める反射波成分の割合AI(Augmentation Index)値から血管内皮機能レベルを評価する評価手段及び、
加速度脈波の脈波特徴量AG(血管老化年齢指数)を用いて血管内皮機能レベルを評価する評価手段のうち、
少なくともいずれか1つ以上有することを特徴とする血管内皮機能評価システム。
【図1】


【図2】


【図6】


【図7】


【図9】


【図3】


【図4】


【図5】


【図8】


【図10】


【図11】


【図12】




【図2】


【図6】


【図7】


【図9】


【図3】


【図4】


【図5】


【図8】


【図10】


【図11】


【図12】


【公開番号】特開2011−189080(P2011−189080A)
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願番号】特願2010−59907(P2010−59907)
【出願日】平成22年3月16日(2010.3.16)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願日】平成22年3月16日(2010.3.16)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
[ Back to top ]

