排水の処理方法
【課題】 ホウ素とフッ素の吸着量を増加させる。
【解決手段】 ホウ素とフッ素の少なくともいずれか一方を被吸着物質とし、被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて被吸着物質を吸着し除去するもので、ヘキサゴナル構造の多孔質から成るジルコニウムの使用が好ましい。
【解決手段】 ホウ素とフッ素の少なくともいずれか一方を被吸着物質とし、被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて被吸着物質を吸着し除去するもので、ヘキサゴナル構造の多孔質から成るジルコニウムの使用が好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、排水の処理方法に関する。さらに詳しくは、本発明はホウ素とフッ素の少なくともいずれか一方を含む排水の処理方法に関するものである。
【背景技術】
【0002】
環境中の微量元素が人の健康や生態系へ与える影響に対する関心が高まっている。これを背景として、平成11年2月に水質環境基準,ホウ素=1.0mg・dm−3(=ppm),フッ素=0.80mg・dm−3 が示され、平成13年7月より陸域でホウ素=10mg・dm−3、フッ素=8mg・dm−3、海域でホウ素=230mg・dm−3、フッ素=15mg・dm−3の排水基準値が施行された。
【0003】
ホウ酸、ホウ砂、ホウ酸塩等のホウ素化合物およびフッ化水素酸、フッ化ナトリウム、フッ化カルシウム等のフッ素化合物は工業的に有用な物質であることから工業製品などに多用されており、その製造工程でホウ素およびフッ素含有排水が生じる。また、工業製品にホウ素化合物およびフッ素化合物を含有するものがあることから、ごみ焼却場洗煙排水やごみ焼却灰の埋立処分場浸出水にホウ素およびフッ素が含まれることがある。また、排水中には、ホウ素の他にフッ素が含まれることもある。例えば石炭火力発電所の排煙脱硫装置排水においてはホウ素の他にフッ素も含まれる。そこで、排水中のホウ素並びにフッ素の微量元素を効率的に処理するため、これらホウ素並びにフッ素について吸着性能に優れた排水の処理方法の開発が求められている。
【0004】
ところで、ホウ素含有排水の処理方法としては、従来、凝集剤を添加してホウ素を不溶性沈殿物して除去する凝集沈殿処理、ホウ素を吸着剤に吸着させる吸着除去方法、有機溶媒で抽出する溶媒抽出処理、逆浸透膜を利用する逆浸透膜処理、排水を蒸発・乾固させる蒸発処理及びこれらの組み合わせ等のさまざまの処理方法が提案されている。中でも、吸着除去方法は、汚泥が発生しない優れたホウ素含有排水の処理方法と考えられる。この吸着除去方法は、排水中のホウ素を吸着剤に吸着させるもので、ホウ素処理用の吸着剤としてホウ素選択性イオン交換樹脂、活性炭、活性アルミナ等が知られている。
【0005】
【特許文献1】特開平08−238478号
【特許文献2】特開平08−89956号
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、無機吸着剤は、耐熱性や耐酸化性等に優れるため、低コスト化が期待できるものの、その吸着性能は活性炭や活性アルミナではイオン交換樹脂に比べて著しく低いという問題を有している。他方、イオン交換樹脂は活性アルミナなどの無機吸着剤よりも比較的高いホウ素吸着性能を示すものの、吸着容量に限度があるため、高濃度の排水に適用する場合、吸着塔などの装置が大きくなる問題がある。しかも、高分子材料であるため、高温での使用や樹脂の分解などに起因する性能低下が懸念される。
【0007】
本発明は、ホウ素とフッ素の少なくともいずれか一方を含む排水について、これらの被吸着物質を吸着して除去する性能に優れた排水の処理方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記の課題を解決すべく鋭意研究を重ねた結果、遷移金属を主成分とする多孔質体がホウ素とフッ素の吸着性能に優れていること、更にはこの多孔質体がヘキサゴナル構造である場合にはより吸着性能に優れることを見出すに至った。また、本発明者等は、遷移金属の多孔質体を界面活性剤を鋳型として製造する際に、通常除去される界面活性剤を孔内に残留させる場合に、より良好な吸着性能を呈することを知見するに至った。
【0009】
本発明は、かかる知見に基づくものであって、請求項1記載の排水の処理方法は、ホウ素とフッ素の少なくともいずれか一方を被吸着物質とし、被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて被吸着物質を吸着し除去するものである。
【0010】
ここで、本発明は、多孔質体がヘキサゴナル構造を有するものであることが好ましく、すなわち遷移金属は、ヘキサゴナル構造をとるジルコニウム、チタン、バナジウム、マンガン、鉄、ガリウム、タンタル、ニオブ、ハフニウムのいずれかであることが好ましく、なかでもジルコニウムであることがより好ましい。
【0011】
また、請求項5記載の排水の処理方法は、多孔質体は界面活性剤を鋳型としたものであり、孔内に界面活性剤を保持した状態で排水と接触させるようにしている。尚、請求項6に記載したように、孔内の前記界面活性剤をアルカリにより除去し、酸により処理した後に前記排水と接触させるようにしてもよい。また、請求項7記載の排水の処理方法は、被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で吸着反応を起こさせるようにしている。
【0012】
さらに、請求項8記載の排水の処理方法は、被吸着物質を吸着した多孔質体を酸により再生し、再利用するようにしている。
【発明の効果】
【0013】
しかして、本発明方法によれば、遷移金属を主成分とした多孔質体がイオン交換樹脂よりも高いホウ素並びにフッ素に対する吸着性能を示し、尚かつ大きな吸着容量を呈するので、ホウ素とフッ素を良好に吸着し、排水中に含まれるホウ素とフッ素を長期間にわたって良好に除去することができる。したがって、高濃度の排水に適用する場合にも、大きな吸着塔などの除去装置を必要としないか、あるいは大きな除去装置を使用する場合には長期間の安定除去が可能となる。
【0014】
また、吸着剤が遷移金属によって構成されているため、イオン交換樹脂よりも低コスト化が期待できると共にイオン交換樹脂のような高温での使用や樹脂の分解などに起因する性能低下の懸念がない。しかも、使用後の多孔質体の再生が可能であるため、経済的である。
【発明を実施するための最良の形態】
【0015】
本発明の排水処理方法は、被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて被吸着物質を吸着し除去するものである。ここで、排水中の吸着対象となる被吸着物質は、ホウ素とフッ素の少なくともいずれか一方であり、処理の対象となる排水は、被吸着物質を含むものであれば如何なる由来の排水であっても良い。即ち、ホウ素とフッ素のうち、ホウ素のみを被吸着物質として含む排水でも、フッ素のみを被吸着物質として含む排水でも、ホウ素とフッ素の両方を被吸着物質として含む排水でも良い。そして、排水には、例えば石炭火力発電所など火力発電所の排煙脱硫排水、半導体工業などの産業において排出される排水、ごみ焼却場洗煙排水などの排水だけでなく、ホウ素とフッ素の少なくともいずれか一方を含む水であれば、水道水、地下水、河川湖沼水なども含まれるが、これらに限定されるものではない。
【0016】
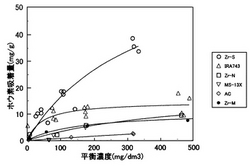
また、多孔質体としてはヘキサゴナル構造を有するものが好ましい。ヘキサゴナル構造を有する多孔質体(例えば、多孔質ジルコニウム:Zr−S)は、ヘキサゴナル構造を有しない多孔質(例えば、オキシ硝酸ジルコニウムの熱分解物:Zr−N)に比べてホウ素とフッ素の吸着量が多い(図5参照)。
【0017】
遷移金属としては多孔質体を作りうるものであれば良く、例えば、ジルコニウム(Zr)、チタン(Ti)、バナジウム(V)、マンガン(Mn)、鉄(Fe)、ガリウム(Ga)、タンタル(Ta)、ニオブ(Nb)、ハフニウム(Hf)のいずれかの使用が可能である。なかでも、ヘキサゴナル構造をとる多孔質体を構成する遷移金属例えばジルコニウムは高いホウ素とフッ素の吸着量を呈することから、その使用が好ましい。
【0018】
多孔質体は界面活性剤を鋳型として製造される。例えば、ジルコニウム・ソースと界面活性剤とを混合し、100℃に加熱保持して沈殿物を48時間熟成させる。得られた沈殿物を濾過し、乾燥させることで多孔質体を得る。ジルコニウム・ソースとしては、例えば、硫酸ジルコニウム、硫酸塩(硫酸ジルコニウム(IV)四水和物 Zr(SO4)2・4H2O)、フッ化物塩(フッ化ジルコニウム(III)ZrF3, フッ化ジルコニウム(IV)ZrF4)、塩化物塩(塩化ジルコニウム(III) ZrCl3,塩化ジルコニウム(IV) ZrCl4) 、硝酸塩(硝酸ジルコニウム(IV)五水和物 Zr(NO3)4・5H2O)、酸化物(酸化ジルコニウム ZrO2)、オキシ塩化物(二塩化酸化ジルコニウム(IV)八水和物 ZrCl2O・8H2O)、オキシ硝酸物(二硝酸酸化ジルコニウム(IV)二水和物 Zr(NO3)2O・8H2O)、酢酸塩(酢酸ジルコニウム Zr(CHCOO)4)などが挙げられるが、中でも硫酸ジルコニウムの使用が好ましい。また、界面活性剤としては、アルキルトリメチルアンモニウム[CnH2n+1N+(CH3)3]を含むのものが好ましく、電荷を中性にするための陰イオンはCl-, Br-, OH-などが挙げられる。アルキル鎖の炭素数(n)としては8〜20が好ましく、さらにはn=16であるヘキサデシルトリメチルアンモニウムブロミド([CH3(CH2)15N(CH3)3]Br)の使用がより好ましい。界面活性剤の添加量は、臨界ミセル濃度よりも大きく、液晶相の生成濃度より小さくなるようにすることが好ましく、ヘキサデシルトリメチルアンモニウムブロミドの場合0.03〜26wt%とすることが好ましく、さらには25wt%にすることがより好ましい。
【0019】
次に、界面活性剤を鋳型として多孔質体を製造する際に、本発明者等は、界面活性剤を孔内にそのまま残留させておいても吸着性能を呈することを知見するに至った。
【0020】
勿論、界面活性剤を除去してから用いてもよい。多孔質体の細孔構造と吸着能力を維持しながら細孔内の界面活性剤を除去すれば、多孔質体の吸着性能が向上する。
【0021】
具体的には、多孔質体中の界面活性剤を、アルカリにて除去した後に酸にて処理するようにすればよい。
【0022】
ここで、アルカリとは、被処理水のpHをアルカリ性領域に調節するものであり、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸カリウム、水酸化カルシウム等が挙げられ、好ましくは水酸化ナトリウムであるが、これらに限られるものではない。
【0023】
また、酸とは、硫酸(H2SO4)、塩酸(HCl)、硝酸(HNO3)、リン酸(H3PO4)、酢酸(CH3COOH)が挙げられ、好ましくは硫酸(H2SO4)であるが、これらに限られるものではない。
【0024】
ここで、Zr−Sの場合を例として以下に具体的に説明する。Zr−Sをアルカリ性溶液中に接触させると、溶液のpHを下げる方向に反応が進行する。つまり、溶液中からOH−イオンを減少させるか、もしくはH+イオンを増加させる方向に反応が進行する。従って、アルカリ性溶液中のOH−とZr−S吸着剤の硫酸イオン(SO42−)が交換しやすくなり、この陰イオン交換反応の際に界面活性剤が細孔内から押し出されることで除去される。尚、この場合のアルカリ性溶液のpHは8〜13であればよいが、好ましくは9〜12、さらに好ましくは10〜12である。
【0025】
このようにして界面活性剤の除去が可能である。しかしながら、この際に陰イオン交換反応も同時に生じるため、Zr−S吸着剤の硫酸イオン(HSO42-、SO42-)は減少する。この硫酸イオンは排水中のホウ素およびフッ素を除去する際の陰イオン交換サイトとして機能するので、酸により処理することで、陰イオン交換サイトを補充して吸着性能を高めるようにする。
【0026】
尚、被吸着物質を吸着していない多孔質体の吸着活性が小さい場合にも、酸により処理して、陰イオン交換サイトを補充するようにすることで吸着活性が向上する場合がある。
【0027】
次に、多孔質体による吸着反応は、被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で起こさせることが好ましい。ホウ素を例にとると、ホウ素はB(OH)4−の形態で無機系吸着剤に吸着するため、pHが高くなるほどB(OH)4−濃度が増大し、それにしたがってホウ素吸着量が増え、pH10を超えるとOH−濃度も増大し、吸着がB(OH)4−とOH−の競争反応になるため、ホウ素吸着量が低下する。より具体的には、ホウ素が単独で含まれる場合には、pH8〜12の範囲の領域で吸着量が多くなり、なかでもpH8〜10の範囲の領域でホウ素の吸着量がより多くなることからこの範囲の領域で吸着処理を行うことがより好ましい。つまり、被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で吸着反応を起こさせることが最も吸着量を増加させると考えられ、ホウ素についてはpH9前後で吸着反応を起こさせることで吸着量を最も増加させることができる。
【0028】
上述の多孔質体はホウ素とフッ素の吸着剤であり、この吸着剤を排水に接触させることで排水中の被吸着物質を吸着し除去する。例えば、吸着剤をペレット状、粒状、粉末状等に調製し、吸着剤を充填した吸着塔に排水を通過させることで、排水中に含まれるホウ素やフッ素の吸着除去処理を行う。
【0029】
尚、上述の多孔質体はホウ素とフッ素の除去に限られるものではなく、排水中で陰イオンの形態を取り得る物質であれば、吸着可能であると考えられる。例えば、排水中に存在する有害な重金属等も、陰イオンの形態を取り得るならば吸着可能であり、ホウ素とフッ素を除去する際に、同時に有害な重金属等も除去できるようになり、非常に有用である。
【0030】
使用後の吸着剤、即ち被吸着物質を吸着した多孔質体を酸により再生し、再利用しても良い。多孔質体を酸によって洗浄することで吸着したホウ素とフッ素を除去しつつ、陰イオン交換サイトを補充することができるので、多孔質体を再利用することができ、大変経済的である。
【0031】
ここで、酸としては、硫酸(H2SO4)、塩酸(HCl)、硝酸(HNO3)、リン酸(H3PO4)、酢酸(CH3COOH)が挙げられれ、好ましくは硫酸(H2SO4)であるが、これらに限られるものではない。
【0032】
次に、ジルコニウム多孔質体の再生において、硫酸(H2SO4)を用いた場合には、その溶液濃度を、1.0×10−2mol/lより大きく1.0mol/l未満にするのがよく、好ましくは7.5×10−2mol/l〜0.75mol/l、より好ましくは5.0×10−2mol/l〜0.5mol/l、さらに好ましくは0.25×10−2mol/l〜0.25mol/l、最も好ましくは0.1mol/lである。尚、1.0mol/l以上ではジルコニウム多孔質体が溶出してしまい、1.0×10−2mol/l以下ではほとんど再生ができない。0.1mol/lのときに良好な再生効果が得られる。
【0033】
なお、上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。
【実施例】
【0034】
以下に、実施例を挙げて本発明をさらに詳細に説明するが、本発明はこれらの実施例によりなんら限定されるものではない。
【0035】
[実施例1]
(1)実験
(1.1)供試した吸着剤
本実験では、市販の無機吸着剤2種(モレキュラシーブ13X(MS−13X),活性炭(AC))および試作したジルコニウム系無機吸着剤3種を吸着剤として使用した。また、ホウ素吸着性能を比較するため、ホウ素選択性イオン交換樹脂(アンバーライトIRA743)を用いた。
【0036】
(1.2)ジルコニウム(Zr)系吸着剤の調製
Zr系無機吸着剤は、以下に示す3種類の方法で調製した。試薬は和光純薬工業(株)製を使用した。
(a)Zr−S(水熱合成、未焼成)
焼成処理ならびにリン酸処理を施さずにジルコニウム多孔質体(Zr−S)を調製した。蒸留水85gに界面活性剤としてヘキサデシルトリメチルアンモニウムブロミド([CH3(CH2)15N(CH3)3]Br,CTMABr)2.5gを溶解した溶液と、蒸留水15gに硫酸ジルコニウム(IV)四水和物(Zr(SO4)2・4H2O)4.55gを溶解した溶液を混合し、室温で2時間撹拌した。その後、373Kにおいて48時間、加熱保持することにより沈殿物を熟成させた。得られた沈殿物を濾過後、373Kにて一晩乾燥した。乾燥固形物を粉砕し白色粉末を得た。
【0037】
(b)Zr−M(水熱合成、焼成)
手順(a)で一晩乾燥して得られる乾燥固形物中に含有するCTMABrを酸化分解により除去し、細孔をつくる目的で、空気中733Kで5時間、焼成(酸化分解処理)を行った。得られた焼成固形物を粉砕し、白色粉末を得た。
【0038】
(c)Zr−N(硝酸塩分解)
オキシ硝酸ジルコニウム(ZrO(NO3)2)を空気中、773Kで3時間焼成し、酸化分解した。得られた焼成固形物を粉砕し、白色粉末を得た。
【0039】
(1.3)吸着実験
吸着実験には所定量のホウ酸(H3BO3)、フッ化ナトリウム(NaF)を蒸留水に溶解した溶液を使用した。溶液100cm3を三角フラスコに採取し、これに所定量(0.2〜0.5g)の吸着剤を添加した後、室温にて48〜139時間振とうした。なお、ホウ素の吸着実験においては、水酸化ナトリウム(NaOH)水溶液もしくは硝酸(HNO3)を用いて実験中の溶液が所定のpHで一定となるように制御した。一方、フッ素の吸着実験ではpH制御は行わなかった。
【0040】
吸着実験開始後、所定時間経過した吸着溶液1cm3を0.45μmのフィルターを通過させて採取した。これを蒸留水で希釈(50〜100倍)し、ICP発光分析装置にて吸着質等の濃度を測定した。一部の溶液試料についてはイオンクロマトグラフ法によって溶液中イオンを同定、定量した。吸着性能の指標として、以下に示す吸着剤重量あたりの吸着量と分配係数(Kd)を用いた。
【0041】
吸着剤単位重量あたりの吸着量は、吸着実験前後の溶液の吸着質濃度より数式1から算出した。
【0042】
【数1】

ここで、C0:吸着実験前の溶液中の微量元素濃度(mg・dm−3)、C1:吸着実験後の溶液中の微量元素濃度(mg・dm−3)、V:使用した溶液量(cm3)、W:使用した吸着剤量(g)である。
【0043】
分配係数(Kd)は数式2により算出した。
【数2】

ここで、q:吸着剤単位重量あたりの微量元素吸着量(mg・g−1)、c:吸着平衡時における溶液1cm3中の吸着質濃度(mg・dm−3)である。
【0044】
(1.4)吸着剤の物性測定
吸着剤のBET比表面積は、流通式一点法によって測定した。キャリヤーガス中(N2/He=30/70)で573K、1時間保持して試料中の吸着水分を除去した後に液体窒素温度でN2の吸着測定を行った。また、細孔径分布の測定では,試料の脱気処理はZr−SおよびIRA743については373K、一晩の条件で行った。
【0045】
吸着剤のFTIR分析は,KBr錠剤法による透過吸収測定を行った。
【0046】
吸着剤の結晶構造解析(XRD)にはマック・サイエンス社のMXP18を用い線源としてCuKα、管電圧40kV、管電流100mA、走査速度4.0°min−1の条件で分析を行った。なお、2θ=10°以下の低角度の分析はFT法を用いて、ステップ幅0.002〜0.006°、計数時間4secの条件で行った。
【0047】
(2)実験結果
(2.1)Zr−S、Zr−Mの構造
調製したZr−SのXRDパターンを図1に示す。高角度側(10−70°)のXRDにおいては、シャープな回折線は観察されず、20.3、28.0、57.8°にブロードなピークが観察された。観察されたピークは全てZr(SO4)2もしくはZrO2に帰属された。
【0048】
また、Zr−Sの低角度側のXRDパターンにおいては、1本のシャープな回折線(2θ=2.200°)と3本のブロードな回折線(2θ=3.672、4.210、5.531°)が観察され、格子面間隔(d−spacing)はそれぞれ4.01、2.40、2.10、1.60nmであった。Zr−Mのホウ素除去性能と比較した結果から、Zr−Sが代表的なメソポーラスシリカのMCM41と同様のヘキサゴナル構造(六角形の細孔構造)を有すると仮定すると、観察された回折線はそれぞれ(100)、(110)、(200)、(200)の反射に帰属される。
【0049】
図2にZr−MのXRDパターンを示す。高角度側ではZr−Sと異なり、明確なピークが、2θ=30、35、50および60°に認められた。2θ=30および35°のピークはそれぞれ、Zr(SO4)2、Zr(SO4)2・5H2Oに帰属し、2θ=50および60°のピークはZrO2に帰属する。低角度側においてはZr−Sで認められた4本の回折線は消失した。これは、未焼成の場合には存在していたヘキサゴナル構造が焼成によって崩壊しZrO2などに変化したために、ヘキサゴナルに帰属するピークが消失した結果と考えられる。つまり、ヘキサゴナル構造は消失したと考えられる。
【0050】
図3にZr−SのN2吸着等温線と細孔径分布を示す。また、表1にはZr−SおよびIRA743の物理的性質をまとめた。調製直後のZr−Sの細孔内には合成時に使用した界面活性剤が充填された状態にあると考えられるが、細孔構造を保持したまま細孔内の界面活性剤を除去する前処理条件が不明であった。このため、Zr−SのN2吸着測定においては、前処理を373Kで行ったが、データの信頼性に多少難があると考えられる。それを考慮しても、Zr−Sは市販のIRA743に比べ、細孔容積は小さいものの、表面積は10倍程度大きく、細孔径も大きいことがわかった。
【0051】
【表1】

【0052】
(2.2)ホウ素吸着量のpH依存性
ホウ素濃度200mg・dm−3における各種吸着剤の分配係数KdのpH依存性を図4に示す。
【0053】
IRA743のKdは強アルカリ(pH12)領域で若干低下するものの、酸性領域から弱アルカリ性領域までほぼ等しい値を示した。一方、各無機系吸着剤のKdは、酸・アルカリ領域では低い値であるが、pH9前後で最大値を示し、特にZr−Sの場合、pH9〜10にかけて、IRA743の値を上回る値を示した。
【0054】
(2.3)ホウ素の吸着等温線
各吸着剤について、ホウ素濃度10、70、100、200および500mg・dm−3の模擬排水を用いてホウ素吸着量を測定し、室温、pH9の条件における吸着等温線を得た。得られた結果を、数式3(Langmuir式)および数式4(Freundlich式)で近似した結果とともに図5、6に示した。
【0055】
【数3】

【数4】

ここで、q:吸着剤への吸着量、qs:飽和吸着量、a:吸着平衡定数、C:ホウ素濃度、kおよび1/n:吸着定数である。
【0056】
MS−13X以外の吸着剤は、Langmuir型およびFreundlich型の吸着等温式にほぼ従うことがわかった。平衡吸着濃度が100mg・dm−3を越える濃度範囲では、Zr−Sが最も高いホウ素吸着量を示した。この濃度範囲での吸着量の序列はZr−S>IRA743>Zr−N≒Zr−M>ACとなった。
【0057】
Zr−MとZr−Nは、異なる出発物質を酸化分解した試料であるが、両者のホウ素吸着量は大きな差がないことから、調製の出発物質の差異によるホウ素吸着量への効果は小さいと考えられる。一方、Zr−SとZr−Mとでは、X線回折の結果に見られるように、構造に大きな違いがあり、かつ、ホウ素吸着量に大きな違いが認められる。ホウ素吸着量の相違は、ヘキサゴナル構造の有無も寄与している可能性があると考えられる。
【0058】
(2.4)ホウ素含有水処理能力の比較
Freundlich型吸着等温線から得られた吸着定数を基に、ホウ素処理に必要な吸着剤量の推算を、Zr−SおよびIRA743を用いた場合について試みた。推算にあたって、図7に示すような処理システムを仮定した。このシステムでは、1)各反応器ではバッチ処理を行う、2)処理する水は一段目反応器から二段目反応器へと送られる、3)二段目反応器に新しい吸着剤が添加され、一段目反応器に、二段目反応器で吸着済みとなった吸着剤が添加される、ことを想定した。
【0059】
このシステムの各段の物質収支から、数式5〜7が導き出せる。
【数5】

【数6】

【数7】

ここで、Q:処理水量、W:吸着剤量、C:ホウ素濃度、q:吸着剤への吸着量である。但し、添字は各段を出たものを示す。
【0060】
各反応器での吸着量は、数式4から数式8のように表される。
【数8】

q3=0であることから、数式6、7および8から数式9が得られる。
【数9】

C1は、この式に原水および処理水のホウ素濃度(C0、C2)を代入することにより求められる。さらに、数式7、8から導かれる以下の数式10から、必要吸着剤量が求められる。
【0061】
【数10】

一段処理を仮定した場合について、同様にして必要吸着剤量を求める式を導出すると、数式11のようになる。
【0062】
【数11】

【0063】
300mg・dm−3から200mg・dm−3にまで除去する場合について推算を行った。推算に用いた吸着係数とともに、得られた結果を表2に示した。一段処理によって300mg・dm−3から200mg・dm−3にまで除去する場合の吸着剤必要量は、Zr−Sで3.68Q、IRA743で8.84Qであることから、Zr−SはIRA743の約0.4倍の量で処理が可能であることがわかる。また、二段処理で同様に除去する場合、Zr−Sでは吸着剤の必要量が3.68Qから2.84Qまで減り、一段処理で除去する場合の約20%少ない量で処理することができる。
【0064】
【表2】

【0065】
(2.5)Zr−Sの吸着特性
無機系吸着剤の中で、ホウ素吸着で優れた結果を示したZr−Sについて、フッ素(F)の吸着性能を評価した。
【0066】
表3には各元素の吸着試験結果をまとめた。
【0067】
【表3】

【0068】
吸着開始後に溶液のpHは低下し、その挙動は吸着質の種類によって異なった。フッ素吸着の場合、吸着前のpH5.9〜6.2が吸着後には最大でpH2.7まで低下した。初期吸着濃度が高いほど平衡吸着時のpHが高くなる傾向を示した。なお、ホウ素吸着の場合は、NaOHによって実験中の溶液のpHを10に制御した。
【0069】
図8に298Kにおける吸着等温線を示す。吸着量はいずれもLangmuir型の吸着等温式で整理することができた。ホウ素に対する飽和吸着量は、56mg−Bg−1であり、市販のイオン交換樹脂(IRA743、23mg−Bg−1)の2倍の吸着量を示した。また、フッ素に対する飽和吸着量はそれぞれ101mg−Fg−1となり、分配係数はホウ素吸着の場合(102程度)よりも一桁以上高かった(103〜104)。
【0070】
吸着実験においてZr−Sから放出されたイオウ量と各種微量元素吸着量の相関を図9に示す。グラフには、イオウ量と吸着量の関係が1:1および1:2になるラインも示した。ICP−AESで測定したイオウ量とイオンクロマトグラフで測定したSO42−量がほぼ一致したため、Zr−Sから放出されたイオウは溶液中で硫酸イオン(SO42−およびHSO4−)として存在することがわかった。
【0071】
図より明らかにように、吸着質の種類によらず、イオウ放出量が多いほど微量元素の吸着量が増大した。ホウ素吸着の場合にはデータのばらつきが大きかったが、イオウ放出量が小さいときにはイオウ量とホウ素吸着量の関係は1:1であるのに対し、イオウ放出量が大きいときは1:2の関係となる傾向が認められた。一方、フッ素吸着の場合には、放出されるイオウ量と吸着量が、ほぼ1:2の関係にあることがわかった。
【0072】
以上より、巨視的には、フッ素吸着の場合は、Zr−S中のイオウとフッ素が1:2で交換し、一方、ホウ素の場合は、イオウの放出量に依存して、1:1もしくは1:2でホウ素とイオウが交換することが示唆された。
【0073】
本実験の実験条件においては、ホウ素およびフッ素は、モノアニオン(それぞれ、B(OH)4−、F−)として存在する。このため、フッ素の場合はF−イオンがSO42−イオンと2:1で交換することが示唆される。ホウ素については、イオウ放出量が小さいときにはB(OH)4−とHSO4−が1:1で交換し、イオウ放出量が大きいときにはB(OH)4−とSO42−による1:2の交換が優勢になると解釈される。
【0074】
上記推測の妥当性を検証するために、ホウ素吸着実験の前後においてZr−Sの赤外吸収分析を行った。図10にそのFTIRスペクトルを示す。吸着前のスペクトル(図10(a))には、SO42−に帰属される吸収(1100cm−1)およびHSO4−に帰属される吸収(1240、1140、1000cm−1)が観察された。すなわち、Zr−S中にはSを含有する官能基として、SO42−とHSO4−が存在することを確認された。また、メチル基(CH3−)およびメチレン基(−CH2−)に帰属される吸収(2930、2850、1640、1480cm−1)が観察されたことから、Zr−Sの合成時にメソ細孔を形成する鋳型として使用した界面活性剤(CTMABr)がZr−Sに残留していることがわかった。
【0075】
一方、ホウ素を吸着させた後のZr−Sのスペクトル(図10(b))では、CTMABrに帰属される吸収(2930、2850、1640、1480cm−1)が減少し、吸着実験によってCTMABrの一部がZr−S中から溶解して脱離することを示した。これは吸着実験前後のZr−SのCNS分析によっても裏付けられた。従って、Zr−S細孔に鋳型であるCTMABrが残留していても、被吸着物質を吸着させることが可能であることが確認された。
【0076】
尚、吸着実験によってSO42−およびHSO4−に帰属される吸収が減少するとともに、B−O伸縮振動に帰属されるブロードな吸収(1350cm−1)が出現した。このことから、HSO4−およびSO42−がB(OH)4−とイオン交換することが示唆される。すなわち、水中に存在する陰イオンのZr−Sへの吸着は、Zr−S細孔表面の硫酸イオンと陰イオン交換によって進行することが示唆された。
【0077】
[実施例2]
実施例1と同一ロットのZr−S吸着剤を用いて、0.5gずつ量りとり、一方はそのまま使用し(供試体A)、一方は蒸留水で2度洗浄し、界面活性剤を除去した後使用した(供試体B)。ホウ素濃度200ppm,pH9の条件で48時間反応させた結果、単位重量あたりのホウ素吸着量はA=11.8mg/g、B=8.5mg/gであり、有意差は見られなかった。この結果から、Zr−S吸着剤を蒸留水で洗浄した程度では孔内の界面活性剤は除去できたとしてもごく僅かであるということが確認された。また、細孔内に界面活性剤が存在しても、吸着能力にとくに影響はないことが確認された。
【0078】
[実施例3]
実施例1でホウ素およびフッ素の吸着特性を調査したが、調査対象とした陰イオン濃度範囲が非常に小さかった。そこで、実施例1で得られた結果を確認し、さらに信頼性の高いデータを得ることを目的として、本実施例にてさらに陰イオン濃度およびpHを広範囲にして調査した。
【0079】
(1).吸着実験
吸着実験には所定量のホウ酸(H3BO3)、フッ化ナトリウム(NaF)を蒸留水に溶解した溶液を使用した。飽和吸着量を精度良く測定するために、陰イオン濃度は50〜1500mgdm−3の範囲で変化させた。溶液100cm3をプラスチック製サンプル容器に採取し、これに所定量(0.1〜1.0g)のZr-Sを添加した後、室温(293〜298K)にて24〜48時間振とうした。尚、ホウ素の吸着実験においては、水酸化ナトリウム(NaOH)水溶液もしくは硝酸(HNO3)を用いて実験中の溶液が所定のpHで一定となるように制御した。一方、フッ素の吸着実験ではpH制御は行わなかった。
さらに、ホウ酸(H3BO3)、フッ化ナトリウム(NaF)濃度を500mgdm−3として、pH2〜12、pH2〜9の場合の吸着特性についてそれぞれ調査した。
【0080】
吸着実験開始後、所定時間経過した吸着溶液1cm3を0.45μmのフィルターを通過させて採取した。これを蒸留水で希釈(25〜100倍)し、ICP発光分析装置にて吸着質等の濃度を測定した。一部の溶液試料についてはイオンクロマトグラフ法によって溶液中イオンを同定、定量した。吸着時の陰イオン濃度の経時変化を追跡することにより、得られたデータの整合性と再現性を確認した。
【0081】
次に、ホウ素およびフッ素吸着実験前後のZr−Sについて、FTIR分析(KBr錠剤法による透過吸収測定)を行った。
【0082】
(2).実験結果(ホウ素)
図11に、pH9〜10におけるホウ素の吸着等温線を示す。吸着等温線はLangmuir型の吸着式で整理することができ、飽和吸着量は80mg−Bg−1と見積もられた。このとき、ホウ素吸着量とZr−Sから放出される硫酸イオンはモル比でほぼ1:1であることが見積もられた。
図12にpH2〜12におけるホウ素の吸着量を示す。ホウ素吸着量は、pH8〜11で最大となり、それよりも酸性側およびアルカリ性側では、著しく低下した。ホウ酸のpKaは9.24であり、これを境に低pH側では、H3BO3が、高pH側ではB(OH)4-が優勢な化学種となる。このため、Zr−S中の硫酸イオンと交換可能なホウ酸イオンが生成し始めるpH8〜11において高いKdを示すと解釈される。一方、これより高pHでは、B(OH)4-とOH-の競争吸着となるために吸着量が低下すると理解される。
図13には、図12に示した実験結果から、ホウ素吸着量、Zr−SからのSO42-放出量、ならびにホウ素吸着量とSO42-放出量のモル比(B/SO42-)をまとめた。ホウ素吸着量はpH8〜11で最大値を示し、その前後のpHで著しく低下したのに対し、Zr-Sから放出される硫酸イオン量はpHと共に増加し、pH9付近からほぼ一定となった。
図14に吸着実験前後のZr−SのFTIRスペクトルを示す。吸着実験によってSO42−に帰属される吸収(1100、640cm−1)およびHSO4−に帰属される吸収(1240、1140、1000cm−1)が減少するとともに、B−O伸縮振動に帰属されるブロードな吸収(1350cm−1)が出現した。このことから、HSO4−およびSO42−がB(OH)4−とイオン交換することが示唆された。実施例1にて、ホウ素については、イオウ放出量が小さいときにはB(OH)4−とHSO4−が1:1で交換し、イオウ放出量が大きいときにはB(OH)4−とSO42−による1:2の交換が優勢になると解釈された。すなわち、この結果より、Zr−Sは、ホウ酸イオンを硫酸イオンとの陰イオン交換により吸着することが示され、B(OH)4−とHSO4−の場合は1:1、B(OH)4−とSO42−の場合には1:2で陰イオン交換が生じることが示唆された。
【0083】
(3).実験結果(フッ素)
図15に298K、pH2〜8におけるフッ素の吸着等温線を示す。実験中にpH調整を行わなかったため、吸着平衡時のpHは2〜8の間で変動した。フッ素吸着もホウ素の場合と同様にLangmuir型の吸着式に従い、飽和吸着量は115mg−Fg−1と見積もられた。尚、吸着時にZr−Sから放出される硫酸イオン量とフッ素の吸着量はモル比でほぼ1:2であった。
図6にpH2〜9におけるフッ素吸着量を示す。ホウ素の場合と同様に、酸解離定数付近で吸着量が最大となる山型の分布を示した。
フッ素吸着前後のZr−SのFTIRスペクトル(図示は省略)では、フッ素吸着量の増加とともに硫酸イオンに帰属される吸収が減少したため、フッ素と硫酸イオンが陰イオン交換したと考えられる。フッ素結合に起因する赤外吸収は1200〜1400cm−1に存在すると考えられるものの、おそらくは吸収強度が小さいことに起因してその確認は困難であった。
【0084】
以上、実施例3の実験結果から以下の知見を得た。
(a)実施例1にて得られた結果と同様に、多孔質ジルコニウム化合物Zr−Sは、水中のホウ素、フッ素に対して高い吸着性能を示し、実施例1よりもさらに広範囲な陰イオン濃度で実験を行った結果、Langmuir型の吸着等温式より見積もられた飽和吸着量はそれぞれ80mg−Bg−1、115mg−Fg−1となった。
(b)陰イオンの吸着は、Zr−S中の硫酸イオンとの陰イオン交換によって進行することが確認された。
【0085】
[実施例4]
(1)実験
実施例1において、水中に存在する陰イオンのZr−Sへの吸着は、Zr−S細孔内表面の硫酸イオンと陰イオンの交換によって進行することが示唆された。そこで、濃度を変えた4種の硫酸溶液および1種の硫酸ナトリウム溶液を用いて、ホウ素が吸着したZr−Sの再生条件を検討した。
【0086】
(1.1)Zr−Sの吸着・再生実験
Zr−Sの吸着・再生実験として、ホウ酸溶液によるホウ素吸着実験およびホウ素吸着後のZr−Sからホウ素を脱離して再生するための各種再生溶液の検討をおこなった。Zr−Sの再生溶液には、濃度の異なる4種類の硫酸溶液(1×10−3mol/l、1×10−2mol/l、0.1mol/lおよび1.0mol/l)並びに1.0mol/lの硫酸ナトリウム溶液を使用した。ホウ素の吸着は、Zr−Sを100cm3の500mg/lホウ酸溶液に添加し、室温で24時間振とうさせておこなった。一方、Zr−S再生実験は、ホウ素吸着後のZr−Sを濾過分別して乾燥させた後に100cm3の再生溶液に添加し、室温で3時間振とうさせておこない、ホウ素吸着とZr−Sの再生サイクルを2回実施した(1吸着→2再生→3吸着→4再生)。尚、吸着実験開始時にはZr−Sを1g供した。
ホウ素吸着脱離特性データは以下のようにして得た。まず、所定の時間を経過した吸着溶液1cm3を0.45μmのフィルターを透過させて採取した。これを蒸留水で希釈(50〜100倍)し、ICP発光分析装置にて吸着質等の濃度を測定した。尚、吸着剤単位重量あたりの吸着量および放出量は、実施例1にて記載した数式1を用いて計算した。尚、再生をおこなった場合についても数式1を適用でき、この場合は、Co:再生実験前の溶液中の微量元素濃度(mg・dm−3)、C1:再生実験後の溶液中の微量元素濃度(mg・dm−3)、V:使用した溶液量(cm3)、W:使用した吸着剤量(g)とした。
また、吸着剤の重量変化の測定は、吸着あるいは再生処理の前後で、吸着剤を90℃で一晩乾燥して得た乾燥吸着剤を秤量することにより行った。
【0087】
(1.2)物性分析
ホウ素吸着後のZr−Sとこれを1×10−3mol/l、1×10−2mol/l、0.1mol/lおよび1.0mol/lの硫酸溶液で再生したZr−Sについて、FTIR分析(KBr錠剤法による透過吸収測定)を行った。
【0088】
(1.3)Zr−S細孔内のCHN分析
Zr−Sの合成においては,Zr−S中に均一な細孔構造を形成するために、細孔形成の鋳型として界面活性剤(CTMABr)を使用する 。このため、調製直後のZr−Sは細孔内にCTMABrが充填された状態にあると考えられる。これを確認するため、Zr−Sの炭素、水素、窒素分析(CHN分析:CHNSアナライザーPE2400、パーキンエルマー社)を行った。
【0089】
(1.4)Zr−S細孔内からの界面活性剤の溶出挙動
Zr−S吸着剤を蒸留水で洗浄した程度では界面活性剤をほとんど除去できないということが実施例2で確認された。そこで、Zr−SからのCTMABrの溶出の挙動を確認するために、Zr−Sを100cm3の純水中に分散させ、そのpHを種々変化させてICP発光分析により硫酸イオンを、全有機炭素計によりCTMABrの溶出量を測定した。尚、pHは水酸化ナトリウム(NaOH)水溶液もしくは硝酸(HNO3)を用いて変化させた。
【0090】
(2)実験結果
(2.1)Zr−Sへの吸着・脱離実験
表5にZr−Sのホウ素吸着・再生実験結果を、図11に各種濃度の硫酸溶液および硫酸ナトリウム溶液1.0mol/lの再生溶液を用いた場合のホウ素吸着・再生実験結果を示す。低濃度硫酸溶液(1×10−3,1×10−2mol/l)は、吸着剤再生時のホウ素脱離量が少なかった。また、1.0mol/l硫酸ナトリウム溶液を用いた場合にも、吸着剤再生時のホウ素脱着量が少なかった。一方、1.0mol/l硫酸溶液を用いた場合はホウ素脱着量は多いものの、Zr−Sの構成元素であるジルコニウムも同時に溶出した。これに対し、0.1 mol/l硫酸溶液を用いた場合は1.0mol/l硫酸溶液に匹敵するホウ素脱着量を示し、かつジルコニウムの溶出が認められなかった。従って、使用済み吸着剤の再生においては、1×10−2〜1.0mol/lに最適な硫酸溶液の濃度値が存在することが考えられ、0.1 mol/l硫酸溶液を用いれば、良好な再生特性が得られることが確認された。尚、1.0mol/l H2SO4溶液および1.0mol/l Na2SO4溶液を使った再生実験では、SO42-濃度が高く測定範囲を超えたためにデータが欠損している。
【0091】
【表4】

【0092】
(2.2)Zr−Sの重量評価
図11に示したように1回目の吸着実験後に回収されるZr−Sの重量は実験前の60%程度であった。さらに、吸着・再生をそれぞれ1回行った後に回収されるZr−Sの重量は実験前の10〜30%まで低下した。検討した再生溶液の中では0.1mol/l硫酸溶液を用いた場合が最も回収率が高かった。
【0093】
(2.3)FTIR分析結果
図12に0.1mol/l硫酸溶液を用いた再生実験における再生前後のZr−SのFTIRスペクトルを示す。吸着実験では硫酸イオンに帰属される吸収(1240、1140、1100、1000、640cm−1)が減少してホウ素に帰属される吸収(1350cm−1)が生成した。これに対し、再生実験では、ホウ素の吸収が消失して硫酸イオンの吸収が著しく増大することが観察され、再生処理によってZr−Sに硫酸イオンが導入されることがわかった。1.0mol/l硫酸を用いた場合も同様に再生処理によってZr−Sに硫酸イオンが導入された。一方、1×10−3mol/lおよび1×10−2mol/lの硫酸溶液を用いた場合は、処理後のZr−Sの硫酸イオンの吸収が完全には回復しなかった。以上のことからも、使用済み吸着剤の再生においては、1×10−2〜1.0mol/lに最適な硫酸溶液の濃度値が存在し、0.1 mol/l硫酸溶液を用いれば、良好な再生特性が得られることが確認された。
【0094】
(2.4)Zr−S細孔内のCHN分析結果
Zr−Sの炭素、水素、窒素分析(CHN分析)を行った結果を表6に示す。調製後のZr−Sは炭素を31.0wt%、窒素を1.9wt%含有しており、その炭素/窒素比(C/N比)はCTMABrのそれと一致した。一方、炭素/水素比(C/H比)は4.6であり、CTMABrの値と多少異なったが、これは水素測定の感度がそれほど高くないことに起因すると考えられる。以上より、Zr−S中の含有炭素はCTMABrによるものと結論し、これに基づいてZr−S中のCTMABr含有量は49.5wt%と見積もられた。
【0095】
【表5】

【0096】
(2.5)Zr−S細孔内からの界面活性剤の溶出挙動
次に、Zr−SからのCTMABrの溶出の挙動を確認した結果を図13に示す。図中において、符号○がCTMABr、符号△がSO42−である。溶液のpHを上げることによってCTMABrと硫酸イオンの溶出量が増大することが確認された。また、溶出した硫酸イオンとCTMABrのモル比(SO42−/CTMABr)はその溶出量に依らず2.5〜3程度であったことから、CTMABrは硫酸イオンに同伴して水中に溶出すると推測された。pH10〜12ではCTMABrの溶出量は0.8〜0.9mmolg−1に達し、Zr−S 1gに対して0.3gのCTMABrを放出すると見積もられた。
この結果について確認するために、吸脱着実験において溶出した炭素濃度を全有機炭素計により測定した。溶出した炭素をCTMABrと仮定して、実験前後のZr−Sの重量減に対するCTMABrの溶出とホウ素と硫酸イオンの間のアニオン交換の寄与を評価した。その結果を表4の右側に示す。表中の最初の吸着・再生サイクル(1吸着→2再生)においては,観察されたZr−Sの重量減少の70〜80%が界面活性剤の溶出と吸脱着にともなうイオン交換に起因すると見積もられた。実験操作に起因するZr−Sの回収損失も考慮すれば、吸着実験によるZr−Sの重量減少は界面活性剤であるCTMABrがZr−S細孔内から溶出したものであることが推測される。したがって、Zr−Sの細孔構造と吸着能力を維持しながら、細孔内に充填されたCTMABrを除去できれば、細孔内の被吸着物質が吸着するための面積が広くなり、また、CTMABr含有量は49.5wt%であることがCHN分析結果から見積もられたことから、このCTMABr含有量分を除去することで単位重量あたりの吸着性能が2倍に向上することが考えられる。
【0097】
以上、実施例4の実験結果から、以下の知見を得た。
(a)ホウ素吸着した使用済み吸着剤の再生においては、1×10−2〜1.0mol/lに最適な硫酸溶液の濃度値が存在することが考えられ、0.1 mol/l硫酸溶液を用いれば、良好な再生特性が得られた。
(b)ホウ素吸着の場合に、吸着・再生サイクルによってホウ酸イオンと硫酸イオンが可逆的に交換することをZr−SのFTIR測定結果から確認した。
(c)Zr−Sは細孔構造を形成する際の鋳型として界面活性剤を50wt%程度含有する。吸着実験前後で観察されたZr−Sの重量減少は、界面活性剤の溶出とイオン交換に起因することが示唆された。そこで、アルカリ性溶液にZr−Sを接触させた後、硫酸により処理することで、Zr−Sの細孔構造と吸着能力を維持しながら、細孔内に充填されたCTMABrを除去することで、界面活性剤を除去しない場合に比べて吸着能力を向上させることが可能であることが考えられる。
【図面の簡単な説明】
【0098】
【図1】調製したZr−SのXRDパターンを示し、(a)は低角側のXRDパターンを示す図、(b)は高角側のXRDパターンを示す図である。
【図2】調製したZr−MのXRDパターンを示し、(a)は低角側のXRDパターンを示す図、(b)は高角側のXRDパターンを示す図である。
【図3】(a)はZr−Sの脱着等温線を示す図、(b)はZr−Sの細孔径分布を示す図である。
【図4】各種吸着剤の分配係数KdのpH依存性を示す図である。なお、符号○は多孔質ジルコニウム(Zr−S)、符号△は市販イオン交換樹脂(IRA−743)、符号□はオキシ硝酸ジルコニウムの熱分解雑(Zr−N)、符号▽はゼオライト(13X)、符号◇は活性炭(AC)である。
【図5】各吸着剤の吸着等温線を示す図である。なお、符号○は多孔質ジルコニウム(Zr−S)、符号△は市販イオン交換樹脂(IRA−743)、符号□はオキシ硝酸ジルコニウムの熱分解雑(Zr−N)、符号▽はゼオライト(MS−13X)、符号◇は活性炭(AC)、符号●は焼成済み多孔質ジルコニウム(Zr−M)である。
【図6】各種吸着剤に関する吸着等温線を示す図である。なお、符号○は多孔質ジルコニウム(Zr−S)、符号●焼成済み多孔質ジルコニウム・(Zr−M)、符号□はオキシ硝酸ジルコニウムの熱分解雑(Zr−N)、符号△は市販イオン交換樹脂(IRA−743)、符号▽はゼオライト(MS−13X)、符号◇は活性炭(AC)である。
【図7】処理システムを示す図である。
【図8】Zr−Sにおける液相微量元素の吸着等温線(298K)を示す図である。
【図9】Zr−Sからの硫黄放出量と吸着量の相関を示す図である。
【図10】Zr−SのFTIRスペクトルを示し、(a)は調製直後(ホウ素吸着実験前)の図、(b)はホウ素吸着実験後の図である。
【図11】Zr−Sにおけるホウ素の吸着等温線(298K)を示す図である。
【図12】Zr−Sにおけるホウ素吸着量のpH依存性を示す図である。
【図13】Zr−Sにおけるホウ素吸着特性のpH依存性を示す図である。符号○がB吸着量、符号●がSO42−吸着量、符号□がB/SO42−比である。
【図14】ホウ素吸着実験におけるZr-SのFTIRスペクトルを示す図である。
【図15】Zr−Sにおけるフッ素の吸着等温線(298K)を示す図である。
【図16】Zr−Sにおけるフッ素吸着量のpH依存性を示す図である。
【図17】ホウ素吸着・再生実験結果を示す図である。符号△が試験前重量、符号▽が試験後重量である。
【図18】0.1mol/l硫酸溶液を用いた再生実験における再生前後のZr−SのFTIRスペクトルを示す図である。
【図19】Zr−Sから溶出する界面活性剤と硫酸イオン量を示す図である。符号○がCTMABr、符号△がSO42−である。
【技術分野】
【0001】
本発明は、排水の処理方法に関する。さらに詳しくは、本発明はホウ素とフッ素の少なくともいずれか一方を含む排水の処理方法に関するものである。
【背景技術】
【0002】
環境中の微量元素が人の健康や生態系へ与える影響に対する関心が高まっている。これを背景として、平成11年2月に水質環境基準,ホウ素=1.0mg・dm−3(=ppm),フッ素=0.80mg・dm−3 が示され、平成13年7月より陸域でホウ素=10mg・dm−3、フッ素=8mg・dm−3、海域でホウ素=230mg・dm−3、フッ素=15mg・dm−3の排水基準値が施行された。
【0003】
ホウ酸、ホウ砂、ホウ酸塩等のホウ素化合物およびフッ化水素酸、フッ化ナトリウム、フッ化カルシウム等のフッ素化合物は工業的に有用な物質であることから工業製品などに多用されており、その製造工程でホウ素およびフッ素含有排水が生じる。また、工業製品にホウ素化合物およびフッ素化合物を含有するものがあることから、ごみ焼却場洗煙排水やごみ焼却灰の埋立処分場浸出水にホウ素およびフッ素が含まれることがある。また、排水中には、ホウ素の他にフッ素が含まれることもある。例えば石炭火力発電所の排煙脱硫装置排水においてはホウ素の他にフッ素も含まれる。そこで、排水中のホウ素並びにフッ素の微量元素を効率的に処理するため、これらホウ素並びにフッ素について吸着性能に優れた排水の処理方法の開発が求められている。
【0004】
ところで、ホウ素含有排水の処理方法としては、従来、凝集剤を添加してホウ素を不溶性沈殿物して除去する凝集沈殿処理、ホウ素を吸着剤に吸着させる吸着除去方法、有機溶媒で抽出する溶媒抽出処理、逆浸透膜を利用する逆浸透膜処理、排水を蒸発・乾固させる蒸発処理及びこれらの組み合わせ等のさまざまの処理方法が提案されている。中でも、吸着除去方法は、汚泥が発生しない優れたホウ素含有排水の処理方法と考えられる。この吸着除去方法は、排水中のホウ素を吸着剤に吸着させるもので、ホウ素処理用の吸着剤としてホウ素選択性イオン交換樹脂、活性炭、活性アルミナ等が知られている。
【0005】
【特許文献1】特開平08−238478号
【特許文献2】特開平08−89956号
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、無機吸着剤は、耐熱性や耐酸化性等に優れるため、低コスト化が期待できるものの、その吸着性能は活性炭や活性アルミナではイオン交換樹脂に比べて著しく低いという問題を有している。他方、イオン交換樹脂は活性アルミナなどの無機吸着剤よりも比較的高いホウ素吸着性能を示すものの、吸着容量に限度があるため、高濃度の排水に適用する場合、吸着塔などの装置が大きくなる問題がある。しかも、高分子材料であるため、高温での使用や樹脂の分解などに起因する性能低下が懸念される。
【0007】
本発明は、ホウ素とフッ素の少なくともいずれか一方を含む排水について、これらの被吸着物質を吸着して除去する性能に優れた排水の処理方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記の課題を解決すべく鋭意研究を重ねた結果、遷移金属を主成分とする多孔質体がホウ素とフッ素の吸着性能に優れていること、更にはこの多孔質体がヘキサゴナル構造である場合にはより吸着性能に優れることを見出すに至った。また、本発明者等は、遷移金属の多孔質体を界面活性剤を鋳型として製造する際に、通常除去される界面活性剤を孔内に残留させる場合に、より良好な吸着性能を呈することを知見するに至った。
【0009】
本発明は、かかる知見に基づくものであって、請求項1記載の排水の処理方法は、ホウ素とフッ素の少なくともいずれか一方を被吸着物質とし、被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて被吸着物質を吸着し除去するものである。
【0010】
ここで、本発明は、多孔質体がヘキサゴナル構造を有するものであることが好ましく、すなわち遷移金属は、ヘキサゴナル構造をとるジルコニウム、チタン、バナジウム、マンガン、鉄、ガリウム、タンタル、ニオブ、ハフニウムのいずれかであることが好ましく、なかでもジルコニウムであることがより好ましい。
【0011】
また、請求項5記載の排水の処理方法は、多孔質体は界面活性剤を鋳型としたものであり、孔内に界面活性剤を保持した状態で排水と接触させるようにしている。尚、請求項6に記載したように、孔内の前記界面活性剤をアルカリにより除去し、酸により処理した後に前記排水と接触させるようにしてもよい。また、請求項7記載の排水の処理方法は、被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で吸着反応を起こさせるようにしている。
【0012】
さらに、請求項8記載の排水の処理方法は、被吸着物質を吸着した多孔質体を酸により再生し、再利用するようにしている。
【発明の効果】
【0013】
しかして、本発明方法によれば、遷移金属を主成分とした多孔質体がイオン交換樹脂よりも高いホウ素並びにフッ素に対する吸着性能を示し、尚かつ大きな吸着容量を呈するので、ホウ素とフッ素を良好に吸着し、排水中に含まれるホウ素とフッ素を長期間にわたって良好に除去することができる。したがって、高濃度の排水に適用する場合にも、大きな吸着塔などの除去装置を必要としないか、あるいは大きな除去装置を使用する場合には長期間の安定除去が可能となる。
【0014】
また、吸着剤が遷移金属によって構成されているため、イオン交換樹脂よりも低コスト化が期待できると共にイオン交換樹脂のような高温での使用や樹脂の分解などに起因する性能低下の懸念がない。しかも、使用後の多孔質体の再生が可能であるため、経済的である。
【発明を実施するための最良の形態】
【0015】
本発明の排水処理方法は、被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて被吸着物質を吸着し除去するものである。ここで、排水中の吸着対象となる被吸着物質は、ホウ素とフッ素の少なくともいずれか一方であり、処理の対象となる排水は、被吸着物質を含むものであれば如何なる由来の排水であっても良い。即ち、ホウ素とフッ素のうち、ホウ素のみを被吸着物質として含む排水でも、フッ素のみを被吸着物質として含む排水でも、ホウ素とフッ素の両方を被吸着物質として含む排水でも良い。そして、排水には、例えば石炭火力発電所など火力発電所の排煙脱硫排水、半導体工業などの産業において排出される排水、ごみ焼却場洗煙排水などの排水だけでなく、ホウ素とフッ素の少なくともいずれか一方を含む水であれば、水道水、地下水、河川湖沼水なども含まれるが、これらに限定されるものではない。
【0016】
また、多孔質体としてはヘキサゴナル構造を有するものが好ましい。ヘキサゴナル構造を有する多孔質体(例えば、多孔質ジルコニウム:Zr−S)は、ヘキサゴナル構造を有しない多孔質(例えば、オキシ硝酸ジルコニウムの熱分解物:Zr−N)に比べてホウ素とフッ素の吸着量が多い(図5参照)。
【0017】
遷移金属としては多孔質体を作りうるものであれば良く、例えば、ジルコニウム(Zr)、チタン(Ti)、バナジウム(V)、マンガン(Mn)、鉄(Fe)、ガリウム(Ga)、タンタル(Ta)、ニオブ(Nb)、ハフニウム(Hf)のいずれかの使用が可能である。なかでも、ヘキサゴナル構造をとる多孔質体を構成する遷移金属例えばジルコニウムは高いホウ素とフッ素の吸着量を呈することから、その使用が好ましい。
【0018】
多孔質体は界面活性剤を鋳型として製造される。例えば、ジルコニウム・ソースと界面活性剤とを混合し、100℃に加熱保持して沈殿物を48時間熟成させる。得られた沈殿物を濾過し、乾燥させることで多孔質体を得る。ジルコニウム・ソースとしては、例えば、硫酸ジルコニウム、硫酸塩(硫酸ジルコニウム(IV)四水和物 Zr(SO4)2・4H2O)、フッ化物塩(フッ化ジルコニウム(III)ZrF3, フッ化ジルコニウム(IV)ZrF4)、塩化物塩(塩化ジルコニウム(III) ZrCl3,塩化ジルコニウム(IV) ZrCl4) 、硝酸塩(硝酸ジルコニウム(IV)五水和物 Zr(NO3)4・5H2O)、酸化物(酸化ジルコニウム ZrO2)、オキシ塩化物(二塩化酸化ジルコニウム(IV)八水和物 ZrCl2O・8H2O)、オキシ硝酸物(二硝酸酸化ジルコニウム(IV)二水和物 Zr(NO3)2O・8H2O)、酢酸塩(酢酸ジルコニウム Zr(CHCOO)4)などが挙げられるが、中でも硫酸ジルコニウムの使用が好ましい。また、界面活性剤としては、アルキルトリメチルアンモニウム[CnH2n+1N+(CH3)3]を含むのものが好ましく、電荷を中性にするための陰イオンはCl-, Br-, OH-などが挙げられる。アルキル鎖の炭素数(n)としては8〜20が好ましく、さらにはn=16であるヘキサデシルトリメチルアンモニウムブロミド([CH3(CH2)15N(CH3)3]Br)の使用がより好ましい。界面活性剤の添加量は、臨界ミセル濃度よりも大きく、液晶相の生成濃度より小さくなるようにすることが好ましく、ヘキサデシルトリメチルアンモニウムブロミドの場合0.03〜26wt%とすることが好ましく、さらには25wt%にすることがより好ましい。
【0019】
次に、界面活性剤を鋳型として多孔質体を製造する際に、本発明者等は、界面活性剤を孔内にそのまま残留させておいても吸着性能を呈することを知見するに至った。
【0020】
勿論、界面活性剤を除去してから用いてもよい。多孔質体の細孔構造と吸着能力を維持しながら細孔内の界面活性剤を除去すれば、多孔質体の吸着性能が向上する。
【0021】
具体的には、多孔質体中の界面活性剤を、アルカリにて除去した後に酸にて処理するようにすればよい。
【0022】
ここで、アルカリとは、被処理水のpHをアルカリ性領域に調節するものであり、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸カリウム、水酸化カルシウム等が挙げられ、好ましくは水酸化ナトリウムであるが、これらに限られるものではない。
【0023】
また、酸とは、硫酸(H2SO4)、塩酸(HCl)、硝酸(HNO3)、リン酸(H3PO4)、酢酸(CH3COOH)が挙げられ、好ましくは硫酸(H2SO4)であるが、これらに限られるものではない。
【0024】
ここで、Zr−Sの場合を例として以下に具体的に説明する。Zr−Sをアルカリ性溶液中に接触させると、溶液のpHを下げる方向に反応が進行する。つまり、溶液中からOH−イオンを減少させるか、もしくはH+イオンを増加させる方向に反応が進行する。従って、アルカリ性溶液中のOH−とZr−S吸着剤の硫酸イオン(SO42−)が交換しやすくなり、この陰イオン交換反応の際に界面活性剤が細孔内から押し出されることで除去される。尚、この場合のアルカリ性溶液のpHは8〜13であればよいが、好ましくは9〜12、さらに好ましくは10〜12である。
【0025】
このようにして界面活性剤の除去が可能である。しかしながら、この際に陰イオン交換反応も同時に生じるため、Zr−S吸着剤の硫酸イオン(HSO42-、SO42-)は減少する。この硫酸イオンは排水中のホウ素およびフッ素を除去する際の陰イオン交換サイトとして機能するので、酸により処理することで、陰イオン交換サイトを補充して吸着性能を高めるようにする。
【0026】
尚、被吸着物質を吸着していない多孔質体の吸着活性が小さい場合にも、酸により処理して、陰イオン交換サイトを補充するようにすることで吸着活性が向上する場合がある。
【0027】
次に、多孔質体による吸着反応は、被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で起こさせることが好ましい。ホウ素を例にとると、ホウ素はB(OH)4−の形態で無機系吸着剤に吸着するため、pHが高くなるほどB(OH)4−濃度が増大し、それにしたがってホウ素吸着量が増え、pH10を超えるとOH−濃度も増大し、吸着がB(OH)4−とOH−の競争反応になるため、ホウ素吸着量が低下する。より具体的には、ホウ素が単独で含まれる場合には、pH8〜12の範囲の領域で吸着量が多くなり、なかでもpH8〜10の範囲の領域でホウ素の吸着量がより多くなることからこの範囲の領域で吸着処理を行うことがより好ましい。つまり、被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で吸着反応を起こさせることが最も吸着量を増加させると考えられ、ホウ素についてはpH9前後で吸着反応を起こさせることで吸着量を最も増加させることができる。
【0028】
上述の多孔質体はホウ素とフッ素の吸着剤であり、この吸着剤を排水に接触させることで排水中の被吸着物質を吸着し除去する。例えば、吸着剤をペレット状、粒状、粉末状等に調製し、吸着剤を充填した吸着塔に排水を通過させることで、排水中に含まれるホウ素やフッ素の吸着除去処理を行う。
【0029】
尚、上述の多孔質体はホウ素とフッ素の除去に限られるものではなく、排水中で陰イオンの形態を取り得る物質であれば、吸着可能であると考えられる。例えば、排水中に存在する有害な重金属等も、陰イオンの形態を取り得るならば吸着可能であり、ホウ素とフッ素を除去する際に、同時に有害な重金属等も除去できるようになり、非常に有用である。
【0030】
使用後の吸着剤、即ち被吸着物質を吸着した多孔質体を酸により再生し、再利用しても良い。多孔質体を酸によって洗浄することで吸着したホウ素とフッ素を除去しつつ、陰イオン交換サイトを補充することができるので、多孔質体を再利用することができ、大変経済的である。
【0031】
ここで、酸としては、硫酸(H2SO4)、塩酸(HCl)、硝酸(HNO3)、リン酸(H3PO4)、酢酸(CH3COOH)が挙げられれ、好ましくは硫酸(H2SO4)であるが、これらに限られるものではない。
【0032】
次に、ジルコニウム多孔質体の再生において、硫酸(H2SO4)を用いた場合には、その溶液濃度を、1.0×10−2mol/lより大きく1.0mol/l未満にするのがよく、好ましくは7.5×10−2mol/l〜0.75mol/l、より好ましくは5.0×10−2mol/l〜0.5mol/l、さらに好ましくは0.25×10−2mol/l〜0.25mol/l、最も好ましくは0.1mol/lである。尚、1.0mol/l以上ではジルコニウム多孔質体が溶出してしまい、1.0×10−2mol/l以下ではほとんど再生ができない。0.1mol/lのときに良好な再生効果が得られる。
【0033】
なお、上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。
【実施例】
【0034】
以下に、実施例を挙げて本発明をさらに詳細に説明するが、本発明はこれらの実施例によりなんら限定されるものではない。
【0035】
[実施例1]
(1)実験
(1.1)供試した吸着剤
本実験では、市販の無機吸着剤2種(モレキュラシーブ13X(MS−13X),活性炭(AC))および試作したジルコニウム系無機吸着剤3種を吸着剤として使用した。また、ホウ素吸着性能を比較するため、ホウ素選択性イオン交換樹脂(アンバーライトIRA743)を用いた。
【0036】
(1.2)ジルコニウム(Zr)系吸着剤の調製
Zr系無機吸着剤は、以下に示す3種類の方法で調製した。試薬は和光純薬工業(株)製を使用した。
(a)Zr−S(水熱合成、未焼成)
焼成処理ならびにリン酸処理を施さずにジルコニウム多孔質体(Zr−S)を調製した。蒸留水85gに界面活性剤としてヘキサデシルトリメチルアンモニウムブロミド([CH3(CH2)15N(CH3)3]Br,CTMABr)2.5gを溶解した溶液と、蒸留水15gに硫酸ジルコニウム(IV)四水和物(Zr(SO4)2・4H2O)4.55gを溶解した溶液を混合し、室温で2時間撹拌した。その後、373Kにおいて48時間、加熱保持することにより沈殿物を熟成させた。得られた沈殿物を濾過後、373Kにて一晩乾燥した。乾燥固形物を粉砕し白色粉末を得た。
【0037】
(b)Zr−M(水熱合成、焼成)
手順(a)で一晩乾燥して得られる乾燥固形物中に含有するCTMABrを酸化分解により除去し、細孔をつくる目的で、空気中733Kで5時間、焼成(酸化分解処理)を行った。得られた焼成固形物を粉砕し、白色粉末を得た。
【0038】
(c)Zr−N(硝酸塩分解)
オキシ硝酸ジルコニウム(ZrO(NO3)2)を空気中、773Kで3時間焼成し、酸化分解した。得られた焼成固形物を粉砕し、白色粉末を得た。
【0039】
(1.3)吸着実験
吸着実験には所定量のホウ酸(H3BO3)、フッ化ナトリウム(NaF)を蒸留水に溶解した溶液を使用した。溶液100cm3を三角フラスコに採取し、これに所定量(0.2〜0.5g)の吸着剤を添加した後、室温にて48〜139時間振とうした。なお、ホウ素の吸着実験においては、水酸化ナトリウム(NaOH)水溶液もしくは硝酸(HNO3)を用いて実験中の溶液が所定のpHで一定となるように制御した。一方、フッ素の吸着実験ではpH制御は行わなかった。
【0040】
吸着実験開始後、所定時間経過した吸着溶液1cm3を0.45μmのフィルターを通過させて採取した。これを蒸留水で希釈(50〜100倍)し、ICP発光分析装置にて吸着質等の濃度を測定した。一部の溶液試料についてはイオンクロマトグラフ法によって溶液中イオンを同定、定量した。吸着性能の指標として、以下に示す吸着剤重量あたりの吸着量と分配係数(Kd)を用いた。
【0041】
吸着剤単位重量あたりの吸着量は、吸着実験前後の溶液の吸着質濃度より数式1から算出した。
【0042】
【数1】

ここで、C0:吸着実験前の溶液中の微量元素濃度(mg・dm−3)、C1:吸着実験後の溶液中の微量元素濃度(mg・dm−3)、V:使用した溶液量(cm3)、W:使用した吸着剤量(g)である。
【0043】
分配係数(Kd)は数式2により算出した。
【数2】

ここで、q:吸着剤単位重量あたりの微量元素吸着量(mg・g−1)、c:吸着平衡時における溶液1cm3中の吸着質濃度(mg・dm−3)である。
【0044】
(1.4)吸着剤の物性測定
吸着剤のBET比表面積は、流通式一点法によって測定した。キャリヤーガス中(N2/He=30/70)で573K、1時間保持して試料中の吸着水分を除去した後に液体窒素温度でN2の吸着測定を行った。また、細孔径分布の測定では,試料の脱気処理はZr−SおよびIRA743については373K、一晩の条件で行った。
【0045】
吸着剤のFTIR分析は,KBr錠剤法による透過吸収測定を行った。
【0046】
吸着剤の結晶構造解析(XRD)にはマック・サイエンス社のMXP18を用い線源としてCuKα、管電圧40kV、管電流100mA、走査速度4.0°min−1の条件で分析を行った。なお、2θ=10°以下の低角度の分析はFT法を用いて、ステップ幅0.002〜0.006°、計数時間4secの条件で行った。
【0047】
(2)実験結果
(2.1)Zr−S、Zr−Mの構造
調製したZr−SのXRDパターンを図1に示す。高角度側(10−70°)のXRDにおいては、シャープな回折線は観察されず、20.3、28.0、57.8°にブロードなピークが観察された。観察されたピークは全てZr(SO4)2もしくはZrO2に帰属された。
【0048】
また、Zr−Sの低角度側のXRDパターンにおいては、1本のシャープな回折線(2θ=2.200°)と3本のブロードな回折線(2θ=3.672、4.210、5.531°)が観察され、格子面間隔(d−spacing)はそれぞれ4.01、2.40、2.10、1.60nmであった。Zr−Mのホウ素除去性能と比較した結果から、Zr−Sが代表的なメソポーラスシリカのMCM41と同様のヘキサゴナル構造(六角形の細孔構造)を有すると仮定すると、観察された回折線はそれぞれ(100)、(110)、(200)、(200)の反射に帰属される。
【0049】
図2にZr−MのXRDパターンを示す。高角度側ではZr−Sと異なり、明確なピークが、2θ=30、35、50および60°に認められた。2θ=30および35°のピークはそれぞれ、Zr(SO4)2、Zr(SO4)2・5H2Oに帰属し、2θ=50および60°のピークはZrO2に帰属する。低角度側においてはZr−Sで認められた4本の回折線は消失した。これは、未焼成の場合には存在していたヘキサゴナル構造が焼成によって崩壊しZrO2などに変化したために、ヘキサゴナルに帰属するピークが消失した結果と考えられる。つまり、ヘキサゴナル構造は消失したと考えられる。
【0050】
図3にZr−SのN2吸着等温線と細孔径分布を示す。また、表1にはZr−SおよびIRA743の物理的性質をまとめた。調製直後のZr−Sの細孔内には合成時に使用した界面活性剤が充填された状態にあると考えられるが、細孔構造を保持したまま細孔内の界面活性剤を除去する前処理条件が不明であった。このため、Zr−SのN2吸着測定においては、前処理を373Kで行ったが、データの信頼性に多少難があると考えられる。それを考慮しても、Zr−Sは市販のIRA743に比べ、細孔容積は小さいものの、表面積は10倍程度大きく、細孔径も大きいことがわかった。
【0051】
【表1】

【0052】
(2.2)ホウ素吸着量のpH依存性
ホウ素濃度200mg・dm−3における各種吸着剤の分配係数KdのpH依存性を図4に示す。
【0053】
IRA743のKdは強アルカリ(pH12)領域で若干低下するものの、酸性領域から弱アルカリ性領域までほぼ等しい値を示した。一方、各無機系吸着剤のKdは、酸・アルカリ領域では低い値であるが、pH9前後で最大値を示し、特にZr−Sの場合、pH9〜10にかけて、IRA743の値を上回る値を示した。
【0054】
(2.3)ホウ素の吸着等温線
各吸着剤について、ホウ素濃度10、70、100、200および500mg・dm−3の模擬排水を用いてホウ素吸着量を測定し、室温、pH9の条件における吸着等温線を得た。得られた結果を、数式3(Langmuir式)および数式4(Freundlich式)で近似した結果とともに図5、6に示した。
【0055】
【数3】

【数4】

ここで、q:吸着剤への吸着量、qs:飽和吸着量、a:吸着平衡定数、C:ホウ素濃度、kおよび1/n:吸着定数である。
【0056】
MS−13X以外の吸着剤は、Langmuir型およびFreundlich型の吸着等温式にほぼ従うことがわかった。平衡吸着濃度が100mg・dm−3を越える濃度範囲では、Zr−Sが最も高いホウ素吸着量を示した。この濃度範囲での吸着量の序列はZr−S>IRA743>Zr−N≒Zr−M>ACとなった。
【0057】
Zr−MとZr−Nは、異なる出発物質を酸化分解した試料であるが、両者のホウ素吸着量は大きな差がないことから、調製の出発物質の差異によるホウ素吸着量への効果は小さいと考えられる。一方、Zr−SとZr−Mとでは、X線回折の結果に見られるように、構造に大きな違いがあり、かつ、ホウ素吸着量に大きな違いが認められる。ホウ素吸着量の相違は、ヘキサゴナル構造の有無も寄与している可能性があると考えられる。
【0058】
(2.4)ホウ素含有水処理能力の比較
Freundlich型吸着等温線から得られた吸着定数を基に、ホウ素処理に必要な吸着剤量の推算を、Zr−SおよびIRA743を用いた場合について試みた。推算にあたって、図7に示すような処理システムを仮定した。このシステムでは、1)各反応器ではバッチ処理を行う、2)処理する水は一段目反応器から二段目反応器へと送られる、3)二段目反応器に新しい吸着剤が添加され、一段目反応器に、二段目反応器で吸着済みとなった吸着剤が添加される、ことを想定した。
【0059】
このシステムの各段の物質収支から、数式5〜7が導き出せる。
【数5】

【数6】

【数7】

ここで、Q:処理水量、W:吸着剤量、C:ホウ素濃度、q:吸着剤への吸着量である。但し、添字は各段を出たものを示す。
【0060】
各反応器での吸着量は、数式4から数式8のように表される。
【数8】

q3=0であることから、数式6、7および8から数式9が得られる。
【数9】

C1は、この式に原水および処理水のホウ素濃度(C0、C2)を代入することにより求められる。さらに、数式7、8から導かれる以下の数式10から、必要吸着剤量が求められる。
【0061】
【数10】

一段処理を仮定した場合について、同様にして必要吸着剤量を求める式を導出すると、数式11のようになる。
【0062】
【数11】

【0063】
300mg・dm−3から200mg・dm−3にまで除去する場合について推算を行った。推算に用いた吸着係数とともに、得られた結果を表2に示した。一段処理によって300mg・dm−3から200mg・dm−3にまで除去する場合の吸着剤必要量は、Zr−Sで3.68Q、IRA743で8.84Qであることから、Zr−SはIRA743の約0.4倍の量で処理が可能であることがわかる。また、二段処理で同様に除去する場合、Zr−Sでは吸着剤の必要量が3.68Qから2.84Qまで減り、一段処理で除去する場合の約20%少ない量で処理することができる。
【0064】
【表2】

【0065】
(2.5)Zr−Sの吸着特性
無機系吸着剤の中で、ホウ素吸着で優れた結果を示したZr−Sについて、フッ素(F)の吸着性能を評価した。
【0066】
表3には各元素の吸着試験結果をまとめた。
【0067】
【表3】

【0068】
吸着開始後に溶液のpHは低下し、その挙動は吸着質の種類によって異なった。フッ素吸着の場合、吸着前のpH5.9〜6.2が吸着後には最大でpH2.7まで低下した。初期吸着濃度が高いほど平衡吸着時のpHが高くなる傾向を示した。なお、ホウ素吸着の場合は、NaOHによって実験中の溶液のpHを10に制御した。
【0069】
図8に298Kにおける吸着等温線を示す。吸着量はいずれもLangmuir型の吸着等温式で整理することができた。ホウ素に対する飽和吸着量は、56mg−Bg−1であり、市販のイオン交換樹脂(IRA743、23mg−Bg−1)の2倍の吸着量を示した。また、フッ素に対する飽和吸着量はそれぞれ101mg−Fg−1となり、分配係数はホウ素吸着の場合(102程度)よりも一桁以上高かった(103〜104)。
【0070】
吸着実験においてZr−Sから放出されたイオウ量と各種微量元素吸着量の相関を図9に示す。グラフには、イオウ量と吸着量の関係が1:1および1:2になるラインも示した。ICP−AESで測定したイオウ量とイオンクロマトグラフで測定したSO42−量がほぼ一致したため、Zr−Sから放出されたイオウは溶液中で硫酸イオン(SO42−およびHSO4−)として存在することがわかった。
【0071】
図より明らかにように、吸着質の種類によらず、イオウ放出量が多いほど微量元素の吸着量が増大した。ホウ素吸着の場合にはデータのばらつきが大きかったが、イオウ放出量が小さいときにはイオウ量とホウ素吸着量の関係は1:1であるのに対し、イオウ放出量が大きいときは1:2の関係となる傾向が認められた。一方、フッ素吸着の場合には、放出されるイオウ量と吸着量が、ほぼ1:2の関係にあることがわかった。
【0072】
以上より、巨視的には、フッ素吸着の場合は、Zr−S中のイオウとフッ素が1:2で交換し、一方、ホウ素の場合は、イオウの放出量に依存して、1:1もしくは1:2でホウ素とイオウが交換することが示唆された。
【0073】
本実験の実験条件においては、ホウ素およびフッ素は、モノアニオン(それぞれ、B(OH)4−、F−)として存在する。このため、フッ素の場合はF−イオンがSO42−イオンと2:1で交換することが示唆される。ホウ素については、イオウ放出量が小さいときにはB(OH)4−とHSO4−が1:1で交換し、イオウ放出量が大きいときにはB(OH)4−とSO42−による1:2の交換が優勢になると解釈される。
【0074】
上記推測の妥当性を検証するために、ホウ素吸着実験の前後においてZr−Sの赤外吸収分析を行った。図10にそのFTIRスペクトルを示す。吸着前のスペクトル(図10(a))には、SO42−に帰属される吸収(1100cm−1)およびHSO4−に帰属される吸収(1240、1140、1000cm−1)が観察された。すなわち、Zr−S中にはSを含有する官能基として、SO42−とHSO4−が存在することを確認された。また、メチル基(CH3−)およびメチレン基(−CH2−)に帰属される吸収(2930、2850、1640、1480cm−1)が観察されたことから、Zr−Sの合成時にメソ細孔を形成する鋳型として使用した界面活性剤(CTMABr)がZr−Sに残留していることがわかった。
【0075】
一方、ホウ素を吸着させた後のZr−Sのスペクトル(図10(b))では、CTMABrに帰属される吸収(2930、2850、1640、1480cm−1)が減少し、吸着実験によってCTMABrの一部がZr−S中から溶解して脱離することを示した。これは吸着実験前後のZr−SのCNS分析によっても裏付けられた。従って、Zr−S細孔に鋳型であるCTMABrが残留していても、被吸着物質を吸着させることが可能であることが確認された。
【0076】
尚、吸着実験によってSO42−およびHSO4−に帰属される吸収が減少するとともに、B−O伸縮振動に帰属されるブロードな吸収(1350cm−1)が出現した。このことから、HSO4−およびSO42−がB(OH)4−とイオン交換することが示唆される。すなわち、水中に存在する陰イオンのZr−Sへの吸着は、Zr−S細孔表面の硫酸イオンと陰イオン交換によって進行することが示唆された。
【0077】
[実施例2]
実施例1と同一ロットのZr−S吸着剤を用いて、0.5gずつ量りとり、一方はそのまま使用し(供試体A)、一方は蒸留水で2度洗浄し、界面活性剤を除去した後使用した(供試体B)。ホウ素濃度200ppm,pH9の条件で48時間反応させた結果、単位重量あたりのホウ素吸着量はA=11.8mg/g、B=8.5mg/gであり、有意差は見られなかった。この結果から、Zr−S吸着剤を蒸留水で洗浄した程度では孔内の界面活性剤は除去できたとしてもごく僅かであるということが確認された。また、細孔内に界面活性剤が存在しても、吸着能力にとくに影響はないことが確認された。
【0078】
[実施例3]
実施例1でホウ素およびフッ素の吸着特性を調査したが、調査対象とした陰イオン濃度範囲が非常に小さかった。そこで、実施例1で得られた結果を確認し、さらに信頼性の高いデータを得ることを目的として、本実施例にてさらに陰イオン濃度およびpHを広範囲にして調査した。
【0079】
(1).吸着実験
吸着実験には所定量のホウ酸(H3BO3)、フッ化ナトリウム(NaF)を蒸留水に溶解した溶液を使用した。飽和吸着量を精度良く測定するために、陰イオン濃度は50〜1500mgdm−3の範囲で変化させた。溶液100cm3をプラスチック製サンプル容器に採取し、これに所定量(0.1〜1.0g)のZr-Sを添加した後、室温(293〜298K)にて24〜48時間振とうした。尚、ホウ素の吸着実験においては、水酸化ナトリウム(NaOH)水溶液もしくは硝酸(HNO3)を用いて実験中の溶液が所定のpHで一定となるように制御した。一方、フッ素の吸着実験ではpH制御は行わなかった。
さらに、ホウ酸(H3BO3)、フッ化ナトリウム(NaF)濃度を500mgdm−3として、pH2〜12、pH2〜9の場合の吸着特性についてそれぞれ調査した。
【0080】
吸着実験開始後、所定時間経過した吸着溶液1cm3を0.45μmのフィルターを通過させて採取した。これを蒸留水で希釈(25〜100倍)し、ICP発光分析装置にて吸着質等の濃度を測定した。一部の溶液試料についてはイオンクロマトグラフ法によって溶液中イオンを同定、定量した。吸着時の陰イオン濃度の経時変化を追跡することにより、得られたデータの整合性と再現性を確認した。
【0081】
次に、ホウ素およびフッ素吸着実験前後のZr−Sについて、FTIR分析(KBr錠剤法による透過吸収測定)を行った。
【0082】
(2).実験結果(ホウ素)
図11に、pH9〜10におけるホウ素の吸着等温線を示す。吸着等温線はLangmuir型の吸着式で整理することができ、飽和吸着量は80mg−Bg−1と見積もられた。このとき、ホウ素吸着量とZr−Sから放出される硫酸イオンはモル比でほぼ1:1であることが見積もられた。
図12にpH2〜12におけるホウ素の吸着量を示す。ホウ素吸着量は、pH8〜11で最大となり、それよりも酸性側およびアルカリ性側では、著しく低下した。ホウ酸のpKaは9.24であり、これを境に低pH側では、H3BO3が、高pH側ではB(OH)4-が優勢な化学種となる。このため、Zr−S中の硫酸イオンと交換可能なホウ酸イオンが生成し始めるpH8〜11において高いKdを示すと解釈される。一方、これより高pHでは、B(OH)4-とOH-の競争吸着となるために吸着量が低下すると理解される。
図13には、図12に示した実験結果から、ホウ素吸着量、Zr−SからのSO42-放出量、ならびにホウ素吸着量とSO42-放出量のモル比(B/SO42-)をまとめた。ホウ素吸着量はpH8〜11で最大値を示し、その前後のpHで著しく低下したのに対し、Zr-Sから放出される硫酸イオン量はpHと共に増加し、pH9付近からほぼ一定となった。
図14に吸着実験前後のZr−SのFTIRスペクトルを示す。吸着実験によってSO42−に帰属される吸収(1100、640cm−1)およびHSO4−に帰属される吸収(1240、1140、1000cm−1)が減少するとともに、B−O伸縮振動に帰属されるブロードな吸収(1350cm−1)が出現した。このことから、HSO4−およびSO42−がB(OH)4−とイオン交換することが示唆された。実施例1にて、ホウ素については、イオウ放出量が小さいときにはB(OH)4−とHSO4−が1:1で交換し、イオウ放出量が大きいときにはB(OH)4−とSO42−による1:2の交換が優勢になると解釈された。すなわち、この結果より、Zr−Sは、ホウ酸イオンを硫酸イオンとの陰イオン交換により吸着することが示され、B(OH)4−とHSO4−の場合は1:1、B(OH)4−とSO42−の場合には1:2で陰イオン交換が生じることが示唆された。
【0083】
(3).実験結果(フッ素)
図15に298K、pH2〜8におけるフッ素の吸着等温線を示す。実験中にpH調整を行わなかったため、吸着平衡時のpHは2〜8の間で変動した。フッ素吸着もホウ素の場合と同様にLangmuir型の吸着式に従い、飽和吸着量は115mg−Fg−1と見積もられた。尚、吸着時にZr−Sから放出される硫酸イオン量とフッ素の吸着量はモル比でほぼ1:2であった。
図6にpH2〜9におけるフッ素吸着量を示す。ホウ素の場合と同様に、酸解離定数付近で吸着量が最大となる山型の分布を示した。
フッ素吸着前後のZr−SのFTIRスペクトル(図示は省略)では、フッ素吸着量の増加とともに硫酸イオンに帰属される吸収が減少したため、フッ素と硫酸イオンが陰イオン交換したと考えられる。フッ素結合に起因する赤外吸収は1200〜1400cm−1に存在すると考えられるものの、おそらくは吸収強度が小さいことに起因してその確認は困難であった。
【0084】
以上、実施例3の実験結果から以下の知見を得た。
(a)実施例1にて得られた結果と同様に、多孔質ジルコニウム化合物Zr−Sは、水中のホウ素、フッ素に対して高い吸着性能を示し、実施例1よりもさらに広範囲な陰イオン濃度で実験を行った結果、Langmuir型の吸着等温式より見積もられた飽和吸着量はそれぞれ80mg−Bg−1、115mg−Fg−1となった。
(b)陰イオンの吸着は、Zr−S中の硫酸イオンとの陰イオン交換によって進行することが確認された。
【0085】
[実施例4]
(1)実験
実施例1において、水中に存在する陰イオンのZr−Sへの吸着は、Zr−S細孔内表面の硫酸イオンと陰イオンの交換によって進行することが示唆された。そこで、濃度を変えた4種の硫酸溶液および1種の硫酸ナトリウム溶液を用いて、ホウ素が吸着したZr−Sの再生条件を検討した。
【0086】
(1.1)Zr−Sの吸着・再生実験
Zr−Sの吸着・再生実験として、ホウ酸溶液によるホウ素吸着実験およびホウ素吸着後のZr−Sからホウ素を脱離して再生するための各種再生溶液の検討をおこなった。Zr−Sの再生溶液には、濃度の異なる4種類の硫酸溶液(1×10−3mol/l、1×10−2mol/l、0.1mol/lおよび1.0mol/l)並びに1.0mol/lの硫酸ナトリウム溶液を使用した。ホウ素の吸着は、Zr−Sを100cm3の500mg/lホウ酸溶液に添加し、室温で24時間振とうさせておこなった。一方、Zr−S再生実験は、ホウ素吸着後のZr−Sを濾過分別して乾燥させた後に100cm3の再生溶液に添加し、室温で3時間振とうさせておこない、ホウ素吸着とZr−Sの再生サイクルを2回実施した(1吸着→2再生→3吸着→4再生)。尚、吸着実験開始時にはZr−Sを1g供した。
ホウ素吸着脱離特性データは以下のようにして得た。まず、所定の時間を経過した吸着溶液1cm3を0.45μmのフィルターを透過させて採取した。これを蒸留水で希釈(50〜100倍)し、ICP発光分析装置にて吸着質等の濃度を測定した。尚、吸着剤単位重量あたりの吸着量および放出量は、実施例1にて記載した数式1を用いて計算した。尚、再生をおこなった場合についても数式1を適用でき、この場合は、Co:再生実験前の溶液中の微量元素濃度(mg・dm−3)、C1:再生実験後の溶液中の微量元素濃度(mg・dm−3)、V:使用した溶液量(cm3)、W:使用した吸着剤量(g)とした。
また、吸着剤の重量変化の測定は、吸着あるいは再生処理の前後で、吸着剤を90℃で一晩乾燥して得た乾燥吸着剤を秤量することにより行った。
【0087】
(1.2)物性分析
ホウ素吸着後のZr−Sとこれを1×10−3mol/l、1×10−2mol/l、0.1mol/lおよび1.0mol/lの硫酸溶液で再生したZr−Sについて、FTIR分析(KBr錠剤法による透過吸収測定)を行った。
【0088】
(1.3)Zr−S細孔内のCHN分析
Zr−Sの合成においては,Zr−S中に均一な細孔構造を形成するために、細孔形成の鋳型として界面活性剤(CTMABr)を使用する 。このため、調製直後のZr−Sは細孔内にCTMABrが充填された状態にあると考えられる。これを確認するため、Zr−Sの炭素、水素、窒素分析(CHN分析:CHNSアナライザーPE2400、パーキンエルマー社)を行った。
【0089】
(1.4)Zr−S細孔内からの界面活性剤の溶出挙動
Zr−S吸着剤を蒸留水で洗浄した程度では界面活性剤をほとんど除去できないということが実施例2で確認された。そこで、Zr−SからのCTMABrの溶出の挙動を確認するために、Zr−Sを100cm3の純水中に分散させ、そのpHを種々変化させてICP発光分析により硫酸イオンを、全有機炭素計によりCTMABrの溶出量を測定した。尚、pHは水酸化ナトリウム(NaOH)水溶液もしくは硝酸(HNO3)を用いて変化させた。
【0090】
(2)実験結果
(2.1)Zr−Sへの吸着・脱離実験
表5にZr−Sのホウ素吸着・再生実験結果を、図11に各種濃度の硫酸溶液および硫酸ナトリウム溶液1.0mol/lの再生溶液を用いた場合のホウ素吸着・再生実験結果を示す。低濃度硫酸溶液(1×10−3,1×10−2mol/l)は、吸着剤再生時のホウ素脱離量が少なかった。また、1.0mol/l硫酸ナトリウム溶液を用いた場合にも、吸着剤再生時のホウ素脱着量が少なかった。一方、1.0mol/l硫酸溶液を用いた場合はホウ素脱着量は多いものの、Zr−Sの構成元素であるジルコニウムも同時に溶出した。これに対し、0.1 mol/l硫酸溶液を用いた場合は1.0mol/l硫酸溶液に匹敵するホウ素脱着量を示し、かつジルコニウムの溶出が認められなかった。従って、使用済み吸着剤の再生においては、1×10−2〜1.0mol/lに最適な硫酸溶液の濃度値が存在することが考えられ、0.1 mol/l硫酸溶液を用いれば、良好な再生特性が得られることが確認された。尚、1.0mol/l H2SO4溶液および1.0mol/l Na2SO4溶液を使った再生実験では、SO42-濃度が高く測定範囲を超えたためにデータが欠損している。
【0091】
【表4】

【0092】
(2.2)Zr−Sの重量評価
図11に示したように1回目の吸着実験後に回収されるZr−Sの重量は実験前の60%程度であった。さらに、吸着・再生をそれぞれ1回行った後に回収されるZr−Sの重量は実験前の10〜30%まで低下した。検討した再生溶液の中では0.1mol/l硫酸溶液を用いた場合が最も回収率が高かった。
【0093】
(2.3)FTIR分析結果
図12に0.1mol/l硫酸溶液を用いた再生実験における再生前後のZr−SのFTIRスペクトルを示す。吸着実験では硫酸イオンに帰属される吸収(1240、1140、1100、1000、640cm−1)が減少してホウ素に帰属される吸収(1350cm−1)が生成した。これに対し、再生実験では、ホウ素の吸収が消失して硫酸イオンの吸収が著しく増大することが観察され、再生処理によってZr−Sに硫酸イオンが導入されることがわかった。1.0mol/l硫酸を用いた場合も同様に再生処理によってZr−Sに硫酸イオンが導入された。一方、1×10−3mol/lおよび1×10−2mol/lの硫酸溶液を用いた場合は、処理後のZr−Sの硫酸イオンの吸収が完全には回復しなかった。以上のことからも、使用済み吸着剤の再生においては、1×10−2〜1.0mol/lに最適な硫酸溶液の濃度値が存在し、0.1 mol/l硫酸溶液を用いれば、良好な再生特性が得られることが確認された。
【0094】
(2.4)Zr−S細孔内のCHN分析結果
Zr−Sの炭素、水素、窒素分析(CHN分析)を行った結果を表6に示す。調製後のZr−Sは炭素を31.0wt%、窒素を1.9wt%含有しており、その炭素/窒素比(C/N比)はCTMABrのそれと一致した。一方、炭素/水素比(C/H比)は4.6であり、CTMABrの値と多少異なったが、これは水素測定の感度がそれほど高くないことに起因すると考えられる。以上より、Zr−S中の含有炭素はCTMABrによるものと結論し、これに基づいてZr−S中のCTMABr含有量は49.5wt%と見積もられた。
【0095】
【表5】

【0096】
(2.5)Zr−S細孔内からの界面活性剤の溶出挙動
次に、Zr−SからのCTMABrの溶出の挙動を確認した結果を図13に示す。図中において、符号○がCTMABr、符号△がSO42−である。溶液のpHを上げることによってCTMABrと硫酸イオンの溶出量が増大することが確認された。また、溶出した硫酸イオンとCTMABrのモル比(SO42−/CTMABr)はその溶出量に依らず2.5〜3程度であったことから、CTMABrは硫酸イオンに同伴して水中に溶出すると推測された。pH10〜12ではCTMABrの溶出量は0.8〜0.9mmolg−1に達し、Zr−S 1gに対して0.3gのCTMABrを放出すると見積もられた。
この結果について確認するために、吸脱着実験において溶出した炭素濃度を全有機炭素計により測定した。溶出した炭素をCTMABrと仮定して、実験前後のZr−Sの重量減に対するCTMABrの溶出とホウ素と硫酸イオンの間のアニオン交換の寄与を評価した。その結果を表4の右側に示す。表中の最初の吸着・再生サイクル(1吸着→2再生)においては,観察されたZr−Sの重量減少の70〜80%が界面活性剤の溶出と吸脱着にともなうイオン交換に起因すると見積もられた。実験操作に起因するZr−Sの回収損失も考慮すれば、吸着実験によるZr−Sの重量減少は界面活性剤であるCTMABrがZr−S細孔内から溶出したものであることが推測される。したがって、Zr−Sの細孔構造と吸着能力を維持しながら、細孔内に充填されたCTMABrを除去できれば、細孔内の被吸着物質が吸着するための面積が広くなり、また、CTMABr含有量は49.5wt%であることがCHN分析結果から見積もられたことから、このCTMABr含有量分を除去することで単位重量あたりの吸着性能が2倍に向上することが考えられる。
【0097】
以上、実施例4の実験結果から、以下の知見を得た。
(a)ホウ素吸着した使用済み吸着剤の再生においては、1×10−2〜1.0mol/lに最適な硫酸溶液の濃度値が存在することが考えられ、0.1 mol/l硫酸溶液を用いれば、良好な再生特性が得られた。
(b)ホウ素吸着の場合に、吸着・再生サイクルによってホウ酸イオンと硫酸イオンが可逆的に交換することをZr−SのFTIR測定結果から確認した。
(c)Zr−Sは細孔構造を形成する際の鋳型として界面活性剤を50wt%程度含有する。吸着実験前後で観察されたZr−Sの重量減少は、界面活性剤の溶出とイオン交換に起因することが示唆された。そこで、アルカリ性溶液にZr−Sを接触させた後、硫酸により処理することで、Zr−Sの細孔構造と吸着能力を維持しながら、細孔内に充填されたCTMABrを除去することで、界面活性剤を除去しない場合に比べて吸着能力を向上させることが可能であることが考えられる。
【図面の簡単な説明】
【0098】
【図1】調製したZr−SのXRDパターンを示し、(a)は低角側のXRDパターンを示す図、(b)は高角側のXRDパターンを示す図である。
【図2】調製したZr−MのXRDパターンを示し、(a)は低角側のXRDパターンを示す図、(b)は高角側のXRDパターンを示す図である。
【図3】(a)はZr−Sの脱着等温線を示す図、(b)はZr−Sの細孔径分布を示す図である。
【図4】各種吸着剤の分配係数KdのpH依存性を示す図である。なお、符号○は多孔質ジルコニウム(Zr−S)、符号△は市販イオン交換樹脂(IRA−743)、符号□はオキシ硝酸ジルコニウムの熱分解雑(Zr−N)、符号▽はゼオライト(13X)、符号◇は活性炭(AC)である。
【図5】各吸着剤の吸着等温線を示す図である。なお、符号○は多孔質ジルコニウム(Zr−S)、符号△は市販イオン交換樹脂(IRA−743)、符号□はオキシ硝酸ジルコニウムの熱分解雑(Zr−N)、符号▽はゼオライト(MS−13X)、符号◇は活性炭(AC)、符号●は焼成済み多孔質ジルコニウム(Zr−M)である。
【図6】各種吸着剤に関する吸着等温線を示す図である。なお、符号○は多孔質ジルコニウム(Zr−S)、符号●焼成済み多孔質ジルコニウム・(Zr−M)、符号□はオキシ硝酸ジルコニウムの熱分解雑(Zr−N)、符号△は市販イオン交換樹脂(IRA−743)、符号▽はゼオライト(MS−13X)、符号◇は活性炭(AC)である。
【図7】処理システムを示す図である。
【図8】Zr−Sにおける液相微量元素の吸着等温線(298K)を示す図である。
【図9】Zr−Sからの硫黄放出量と吸着量の相関を示す図である。
【図10】Zr−SのFTIRスペクトルを示し、(a)は調製直後(ホウ素吸着実験前)の図、(b)はホウ素吸着実験後の図である。
【図11】Zr−Sにおけるホウ素の吸着等温線(298K)を示す図である。
【図12】Zr−Sにおけるホウ素吸着量のpH依存性を示す図である。
【図13】Zr−Sにおけるホウ素吸着特性のpH依存性を示す図である。符号○がB吸着量、符号●がSO42−吸着量、符号□がB/SO42−比である。
【図14】ホウ素吸着実験におけるZr-SのFTIRスペクトルを示す図である。
【図15】Zr−Sにおけるフッ素の吸着等温線(298K)を示す図である。
【図16】Zr−Sにおけるフッ素吸着量のpH依存性を示す図である。
【図17】ホウ素吸着・再生実験結果を示す図である。符号△が試験前重量、符号▽が試験後重量である。
【図18】0.1mol/l硫酸溶液を用いた再生実験における再生前後のZr−SのFTIRスペクトルを示す図である。
【図19】Zr−Sから溶出する界面活性剤と硫酸イオン量を示す図である。符号○がCTMABr、符号△がSO42−である。
【特許請求の範囲】
【請求項1】
ホウ素とフッ素の少なくともいずれか一方を被吸着物質とし、前記被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて前記被吸着物質を吸着し除去することを特徴とする排水の処理方法。
【請求項2】
前記多孔質体はヘキサゴナル構造を有することを特徴とする請求項1記載の排水の処理方法。
【請求項3】
前記遷移金属は、ジルコニウム、チタン、バナジウム、マンガン、鉄、ガリウム、タンタル、ニオブ、ハフニウムのいずれかであることを特徴とする請求項1又は2記載の排水の処理方法。
【請求項4】
前記遷移金属はジルコニウムであることを特徴とする請求項3記載の排水の処理方法。
【請求項5】
前記多孔質体は界面活性剤を鋳型としたものであり、孔内に前記界面活性剤を保持した状態で前記排水と接触させることを特徴とする請求項1から4のいずれか1つに記載の排水の処理方法。
【請求項6】
前記多孔質体は界面活性剤を鋳型としたものであり、孔内の前記界面活性剤をアルカリにより除去し、酸により処理した後に前記排水と接触させることを特徴とする請求項1から4のいずれか1つに記載の排水の処理方法。
【請求項7】
前記被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で吸着反応を起こさせることを特徴とする請求項1から6のいずれか1つに記載の排水の処理方法。
【請求項8】
前記被吸着物質を吸着した前記多孔質体を酸により再生し、再利用することを特徴とする排水の処理方法。
【請求項1】
ホウ素とフッ素の少なくともいずれか一方を被吸着物質とし、前記被吸着物質を含む排水を遷移金属を主成分とする多孔質体に接触させて前記被吸着物質を吸着し除去することを特徴とする排水の処理方法。
【請求項2】
前記多孔質体はヘキサゴナル構造を有することを特徴とする請求項1記載の排水の処理方法。
【請求項3】
前記遷移金属は、ジルコニウム、チタン、バナジウム、マンガン、鉄、ガリウム、タンタル、ニオブ、ハフニウムのいずれかであることを特徴とする請求項1又は2記載の排水の処理方法。
【請求項4】
前記遷移金属はジルコニウムであることを特徴とする請求項3記載の排水の処理方法。
【請求項5】
前記多孔質体は界面活性剤を鋳型としたものであり、孔内に前記界面活性剤を保持した状態で前記排水と接触させることを特徴とする請求項1から4のいずれか1つに記載の排水の処理方法。
【請求項6】
前記多孔質体は界面活性剤を鋳型としたものであり、孔内の前記界面活性剤をアルカリにより除去し、酸により処理した後に前記排水と接触させることを特徴とする請求項1から4のいずれか1つに記載の排水の処理方法。
【請求項7】
前記被吸着物質の酸解離定数(Ka)の逆対数値pKaとほぼ等しいpH領域で吸着反応を起こさせることを特徴とする請求項1から6のいずれか1つに記載の排水の処理方法。
【請求項8】
前記被吸着物質を吸着した前記多孔質体を酸により再生し、再利用することを特徴とする排水の処理方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【公開番号】特開2006−55835(P2006−55835A)
【公開日】平成18年3月2日(2006.3.2)
【国際特許分類】
【出願番号】特願2005−172242(P2005−172242)
【出願日】平成17年6月13日(2005.6.13)
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
【公開日】平成18年3月2日(2006.3.2)
【国際特許分類】
【出願日】平成17年6月13日(2005.6.13)
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
[ Back to top ]

