接着細胞用培養容器、及び接着細胞用培養容器の製造方法
【課題】 接着細胞を培養することが可能な培養バッグを、必要以上に清浄度の高い製造環境やマスキングのような複雑な製造工程を要することなく提供することを可能とする。
【解決手段】 ポリオレフィンからなる接着細胞用培養容器であって、培養容器の内面の一部又は全部における静的水接触角が95°以上であり、かつ水滑落時のヒステリシスが、前進接触角−後退接触角>25°を満足する培養容器とする。このポリオレフィンには酸化防止剤を含有させることが好ましく、特にフェノール系の酸化防止剤が好ましい。このような接触角及びヒステリシスを示す培養面を備えた接着細胞用培養容器は、ポリオレフィンに対してオゾン波長を除く紫外線を照射することにより得ることができる。
【解決手段】 ポリオレフィンからなる接着細胞用培養容器であって、培養容器の内面の一部又は全部における静的水接触角が95°以上であり、かつ水滑落時のヒステリシスが、前進接触角−後退接触角>25°を満足する培養容器とする。このポリオレフィンには酸化防止剤を含有させることが好ましく、特にフェノール系の酸化防止剤が好ましい。このような接触角及びヒステリシスを示す培養面を備えた接着細胞用培養容器は、ポリオレフィンに対してオゾン波長を除く紫外線を照射することにより得ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞の培養技術に関し、特に培養時に容器壁などを足場として必要とする接着細胞を培養するための接着細胞用培養容器、及び接着細胞用培養容器の製造方法に関する。
【背景技術】
【0002】
近年、医薬品の生産や、遺伝子治療、再生医療、免疫療法等の分野において、細胞や組織、微生物などを人工的な環境下で効率良く大量に培養することが求められている。
このような状況において、培養容器(培養バッグ)に細胞と培養液を充填して、閉鎖系で自動的に細胞を大量培養することが行われている。
このような培養容器には、細胞培養に必要なガス透過性や耐久性、製袋に必要なヒートシール強度などが必要であるため、その材料にはこれらの性質を備えたポリオレフィン系樹脂が好適に用いられている。
【0003】
ところが、ポリオレフィン系樹脂からなる培養容器を用いた場合、浮遊系の細胞は好適に培養できるが、培養時に容器壁などを足場として必要とする接着細胞は、従来は効率的に培養できないという問題があった。すなわち、接着細胞が培養容器の壁に接着するためには、通常培養面に適度な濡れ性が必要であり、親水性であることが必要である。しかし、ポリオレフィン系樹脂からなる培養容器の表面は疎水性であるため、接着細胞は培養面に十分に接着できず、高い増殖効率を得ることができなかった。
【0004】
このような問題を解決するため、培養容器の製袋を行う前に、培養容器を構成するフィルムの培養面に対して、コロナ放電(特許文献1参照)やUV−オゾン法(特許文献2,3参照)による親水化処理を行うことが提案されている。
【0005】
【特許文献1】特開平6−98756号公報
【特許文献2】特開2009−27944号公報
【特許文献3】特開2009−27945号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、これらのような親水化処理を行うと、フィルムのヒートシール強度が大きく低下するため、培養容器の製袋を適切に行うことができなくなるという新たな問題が生じていた。
そこで、このような問題を解決するために、特許文献3ではフィルムにおけるヒートシールを行う部分をマスキングして、UV−オゾン法を施すことが提案されている。しかしこの方法では、製造工程が煩雑になるという問題があった。
また、上記のようにフィルムの培養面に親水化処理を行う場合、表面処理時に培養面が露出するため、培養容器を無菌的に製造することが難しく、清浄度の高い製造環境が必要になるという問題もあった。
【0007】
そこで、本発明者らは鋭意研究し、培養容器を構成する樹脂に一定の紫外線を照射することで、培養面を親水化させることなく、かつ培養容器に培養液を入れた状態での接着細胞の培養面に対する細胞接着率を顕著に向上させることに成功し、本発明を完成させた。
すなわち、本発明は、ポリオレフィンからなる培養容器の内面の一部又は全部における静的水接触角を高い状態に維持して疎水性を保ったまま、ヒステリシス(水滑落時の前進接触角−後退接触角)を一定値より大きくすることで、細胞接着率を向上させ、接着細胞を好適に培養可能な接着細胞用培養容器、及び接着細胞用培養容器の製造方法の提供を目的とする。
【課題を解決するための手段】
【0008】
上記目的を達成するため、本発明の接着細胞用培養容器は、少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートからなる接着細胞用培養容器であって、培養容器の内面の一部又は全部における静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が下記式(1)を満足する構成としてある。
また、本発明の接着細胞用培養容器の製造方法は、少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートにオゾン発生波長を除いた紫外線照射を施し、このフィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が下記式(1)を満たすように形成する方法としてある。
また、本発明の接着細胞用培養容器の製造方法は、ポリオレフィンのペレットにオゾン発生波長を除いた紫外線照射を施し、ポリオレフィンの層を少なくとも最内層に有する単層若しくは多層のフィルム又はシートを形成し、フィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が下記式(1)を満たすように形成する方法としてある。
前進接触角−後退接触角>25°…(式1)
【発明の効果】
【0009】
本発明によれば、必要以上に清浄度の高い製造環境やマスキングのような複雑な製造工程を要することなく、接着細胞を効率的に培養し得る培養容器を製造することが可能となる。
【図面の簡単な説明】
【0010】
【図1】本発明の接着細胞用培養容器による細胞接着率の向上及びヒートシール強度低下の抑制を示す図である。
【図2】本発明における紫外線照射による接着細胞用培養容器を構成するフィルムの特性(接触角)の変化を示す図である。
【図3】本発明における紫外線照射による接着細胞用培養容器を構成するフィルムの特性(ヒステリシス)の変化を示す図である。
【図4】本発明の接着細胞用培養容器の製造工程を示す図である。
【図5】本発明の接着細胞用培養容器の製造工程における紫外線照射の対象(フィルム、培養容器、製膜中のフィルム)を示す図である。
【図6】本発明の接着細胞用培養容器を用いた細胞培養における細胞接着メカニズムを示す図である。
【図7】実施例及び比較例における接触角の測定方法、及びヒステリシスの測定方法を示す図である。
【図8】実施例及び比較例における実験条件と、細胞接着率、ヒステリシス、及びヒートシール強度を示す図である。
【図9】実施例及び比較例におけるヒステリシスと細胞接着率の関係を示す図である。
【発明を実施するための形態】
【0011】
以下、本発明の接着細胞用培養容器、及び接着細胞用培養容器の製造方法の一実施形態について詳細に説明する。
(培養容器)
1.材料
本実施形態の接着細胞用培養容器は、軟包材を材料としてフィルムを製膜し、このフィルムを用いて、袋状(バック型)に形成した培養容器である。この培養容器に培養液と細胞が封入されて細胞培養が行われる。また、培養容器は、細胞培養にあたって、押圧板により押圧されたり、一定時間毎に顕微鏡により培養細胞の撮影などが行われる。これらのことから、その材料には細胞を培養するために必要なガス透過性や耐久性、高いヒートシール強度が要求され、また内容物が確認できるように、透明性を有していることが求められる。
そこで、このような条件を満たす材料として、ポリエチレンやポリプロピレンなどのポリオレフィン系樹脂を好適に用いることができる。
また、フィルムは単層でも二層以上の多層からなるものでもよく、多層からなる場合は、異なる樹脂種や銘柄のポリオレフィン系樹脂を積層して構成することもできる。少なくとも最内層にポリオレフィンの層を有していれば、その他の層に他の樹脂を用いることもできる。なお、フィルムは、シートとして構成されていても良い。
【0012】
また、本実施形態の接着細胞用培養容器の材料として、ポリオレフィン系樹脂に酸化防止剤を含有させたものを用いることが好ましい。酸化防止剤を含有させ、一定の紫外線照射を行うことによって、後述するように接着細胞用培養容器を構成するフィルムのヒステリシスを増大させることができ、培養液を封入したときに、培養面の親水性を高め、細胞の接着性を向上させることが可能になるためである。
このような酸化防止剤としては、特に限定されるものではないが、例えばフェノール系の酸化防止剤や、リン系の酸化防止剤は細胞毒性が低く、ヒステリシスを好適に高めることができるため好ましい。
【0013】
2.紫外線照射処理
また、本実施形態の接着細胞用培養容器では、このようなポリオレフィン系樹脂に一定の紫外線を照射することで、その性質を変性させ、培養容器を構成するフィルムの特性を変化させている。
このとき、ポリオレフィン系樹脂からなるフィルムを用いて培養容器を製袋した後に、培養容器の外側から紫外線照射処理を施すことで、容器内部の培養面の特性を変化させることができる。
【0014】
このフィルム特性の変化においては、後述するように、培養面の接触角には大きな変化は見られず、従って培養面の親水化は行われない。
一方、本実施形態の接着細胞用培養容器は、一定の紫外線を照射することにより、培養面のヒステリシス(接触角ヒステリシス)が増大する。その結果、培養容器に培養液を封入したときに培養面の親水性が高くなり、細胞接着率が向上するようになっている。
【0015】
本実施形態における紫外線照射では、オゾン発生波長(185nm)を照射しない紫外線源が用いられる。例えば、オゾン発生波長を石英管などによってカットできる、主波長254nmの低圧水銀ランプなどを好適に用いることができる。
このように本実施形態の接着細胞用培養容器は、オゾン発生波長を除いた紫外線をポリオレフィン系樹脂に照射することで、照射後の培養面の接触角をほとんど変化させることなく、細胞接着率を向上させることが可能となっている。
【0016】
すなわち、本実施形態の接着細胞用培養容器は、培養面を親水化するものではないため、培養面を露出させることなく接着細胞用培養容器を製造することができる。
また、このように培養面を親水化するものではないため、フィルムのヒートシール強度の低下が少ない。このため、培養容器の製袋前にフィルムに対して紫外線照射を行っても、培養容器の製造を問題なく行うことが可能となっている。
【0017】
一方、特許文献2に記載のUV−オゾン法では、オゾン発生波長を含む紫外線照射によって、培養面の親水化が行われている(実施例において、接触角が104°から71°に低下している。)。すなわち、オゾン発生波長を含む紫外線を用いることで、空気中の酸素に起因するオゾンと材料表面の直接的な反応が起こり、培養面の親水化が行われていると考えられる。また、特許文献2では、容器材料として親水化され易く、かつ安定性が得られやすい易親水化樹脂が用いられ、特にガラス転移温度の高いものが使用されている。これらの材料は、常温で分子鎖が運動しないため、表面の親水化がなされた後、親水基が樹脂内部へ潜り込みにくくなり、親水化の安定性が得られるものと考えられる。
【0018】
これに対して、本実施形態の接着細胞用培養容器では、ポリエチレンやポリプロピレンが材料として使用されるが、これらは常温で分子鎖が運動でき、空気中では親水基が表面に存在するよりも樹脂の内側に存在する方が熱力学的に安定であるため、仮に親水性官能基が含まれていても少量であれば表面に出てきにくく、その結果、表面が親水化されにくいと考えられる。
【0019】
3.細胞接着率
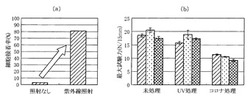
本実施形態の接着細胞用培養容器によれば、培養容器の内面に対する細胞接着率が顕著に向上する。図1(a)は、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器の細胞接着率を示している。同図における細胞接着率は、後述する実施例1及び比較例1の細胞接着率を示しており、接着細胞を28時間培養した後の、浮遊している細胞と接着している細胞の合計数に対する接着細胞数の百分率である。
【0020】
同図に示す通り、本実施形態の紫外線照射によって、細胞接着率は、3.2%から80.8%に増加している。
このように本実施形態の接着細胞用培養容器によれば、細胞接着率を顕著に増加させることができるため、接着細胞の培養効率を大きく向上させることが可能となっている。
【0021】
4.ヒートシール強度
本実施形態の接着細胞用培養容器によれば、培養容器の内面に対する細胞接着率を向上させたことによるヒートシール強度の低下を、従来よりも抑制することができる。
図1(b)は、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器と、本実施形態における紫外線照射を行わずにコロナ放電処理を行い、他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器のヒートシール強度を示している。これらのヒートシール強度は、最大試験力にもとづくものであり、それぞれ後述する実施例1,2,5(同図のUV処理)、比較例1,2,7(同図の未処理)、比較例14,15,16(同図のコロナ処理)のヒートシール強度を示している。
【0022】
同図に示す通り、従来法のコロナ放電処理では、未処理のものと比較して、ヒートシール強度が大きく低下しているのに対し、本実施形態の紫外線照射処理を行った接着細胞用培養容器では、ヒートシール強度の低下が抑制されていることがわかる。
このように本実施形態の接着細胞用培養容器によれば、ヒートシール強度低下を抑制させることができるため、製袋前に紫外線照射を行っても、接着細胞用培養容器を適切に製造することが可能となっている。
【0023】
5.接触角
次に、図2を参照して、接触角について説明する。細胞培養容器における培養面の親水性は、培養面の接触角と関連する。本実施形態における接触角は、静止した液体の表面が固体壁に接するところで液面と固体面がなす角であり(図2のθs)、静的水接触角を意味している。接触角が大きい場合には表面の疎水性が強く、接触角が小さい場合には表面の親水性が強いという関係がある。
一般に、接着細胞の培養に適する培養面の接触角は、60°〜80°程度と言われており(Jurnal of Biomedical Materials Research, Vol.28, 783-789(1994))、接触角がこの範囲内であれば培養面の親水性は高く、接着細胞が培養面に好適に接着することが知られている。
【0024】
図2には、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器における培養面の接触角が示されており、それぞれ後述する実施例1と比較例1の接触角(それぞれ101.9±1.7°、102.7±1°)に対応している。
このように、本実施形態における紫外線照射では、培養面の接触角はほとんど変化しておらず、培養面の親水化が行われていないことがわかる。
【0025】
このため、本実施形態の接着細胞用培養容器は、紫外線照射を行っているにも拘わらず、ヒートシール強度の低下が抑制されたものとなっている。
また、このように培養面が親水化されていなければ、従来は、接着細胞が培養面に十分に接着できなかったが、本実施形態の接着細胞用培養容器は、培養面を親水化させることなく、接着細胞の培養面への接着率を向上させることが可能となっている。
【0026】
また、本実施形態の接着細胞用培養容器の接触角は、95°以上であることが好ましい。接触角が95°より小さくなると、培養面の親水性が高くなり、ヒートシール強度が大きく低下してしまうためである。
このように、本実施形態における紫外線照射では、接着細胞用培養容器の内面の一部又は全部の領域における接触角が95°以上となり、ヒートシール強度の低下を抑制することが可能となっている。
【0027】
6.ヒステリシス
本実施形態における紫外線照射によれば、細胞培養容器を構成するフィルムのヒステリシスを増大させることができる。ここでいうヒステリシスは、接触角ヒステリシスであり、水滴が培養面を滑落するときの前進接触角(θa)と、後退接触角(θr)との差(滑落時ヒステリシス(θa−θr))を示している。すなわち、水平に支持した表面に水滴を摘下し、表面を徐々に傾け、液滴が転落を開始したときの前進接触角と後退接触角にもとづき算出される。このヒステリシスは、表面の動的な濡れ性を示す指標として用いられている。
【0028】
図3は、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器のヒステリシスを示しており、それぞれ後述する実施例1と比較例1のヒステリシス(それぞれ27.8°、16.1°)に対応している。
このように、本実施形態における紫外線照射によれば、培養面のヒステリシスが大きく増大しており、培養面の動的な濡れ性が高くなっていることがわかる。
このため、本実施形態の接着細胞用培養容器は、紫外線照射によって、培養面が親水化されていないにも拘わらず、その動的な濡れ性が高くなっており、その結果、細胞接着率を向上させることが可能となっている。
【0029】
本実施形態の接着細胞用培養容器におけるヒステリシスは、水滑落時の前進接触角及び後退接触角が、下記式(1)を満たす値を示すものであることが好ましい。
前進接触角−後退接触角>25°…(式1)
後述する実施例から明らかなように、ヒステリシスが、25°以下の場合は、十分な細胞接着率を得ることができないのに対し、ヒステリシスが25°よりも大きくなると、細胞接着率が顕著に向上するためである。
【0030】
また、ヒステリシスを25°より大きくする領域は、接着細胞用培養容器全体であっても、接着細胞用培養容器の内面の一部又は全部であっても良い。接着細胞用培養容器の内面の一部でも、ヒステリシスを25°よりも大きくすれば、その領域の細胞接着率を向上させることができ、細胞増殖効率が向上するためである。
【0031】
(接着細胞用培養容器の製造方法)
本実施形態の接着細胞用培養容器の製造方法は、ポリオレフィン系樹脂を材料として、オゾン発生波長を除く紫外線照射を行う点以外については、通常の方法で行うことができ、例えば図4に示すように、以下の工程を含むものとすることができる。
まず、ポリオレフィン系樹脂からなる樹脂ペレットを、押出成形やホットプレスによって製膜し、フィルム(又はシート)を形成する。
【0032】
この樹脂ペレットの製造にあたっては、ポリオレフィン系樹脂に、フェノール系又はリン系の酸化防止剤を含有させることが好ましい。このようにポリオレフィン系樹脂に酸化防止剤を含有させることで、紫外線照射を行ったときのポリオレフィン系樹脂のヒステリシスを好適に増大させることができるためである。
次に、このフィルムを製袋して、接着細胞用培養容器を製造する。
【0033】
本実施形態における紫外線照射は、図5(a)に示すように、フィルムを製袋して、培養容器を形成した後に行うことができる。すなわち、本実施形態における紫外線照射は、培養面を親水化するものではないため、培養面に直接照射しなくても良く、フィルム又はシートにより形成された閉鎖領域の外側より施すことで、培養面のヒステリシスを増大させることができる。また、このように紫外線照射を閉鎖領域の外側より施すことで、培養面の無菌性を保証しやすくなるという効果を得ることができる。
【0034】
また、本実施形態における紫外線照射は、図5(b)に示すように、製袋する前のフィルムやシートに対して行うこともできる。さらに、図5(c)に示すように、インフレーションフィルムからフィルムを巻き取る間において紫外線照射を行うこともできる。また、図4に示すように樹脂ペレットに対して紫外線照射を行うこともできる。
すなわち、本実施形態における紫外線照射は、オゾン発生波長を含まないため、照射されたフィルムの表面が親水化されず、フィルムのヒートシール強度が大きく低下することがない。
このため、製袋前にフィルムやシートに紫外線照射を行っても、適切に製袋を行うことができ、従来法のようなヒートシールを行う部分をマスキングするといった煩雑な工程を含めることなく、接着細胞用培養容器を製造することが可能となっている。
【0035】
(接着メカニズム)
次に、本実施形態の接着細胞用培養容器に接着細胞が接着するメカニズムについて説明する。
接着細胞は、一般に次のようにして培養容器などの基材に接着することが知られている。
まず、培養液に含まれる接着タンパク(例えば、フィブロネクチンやビトロネクチン)が、基材に吸着する。次に、接着細胞の表面にあるインテグリン等が、接着タンパクと相互作用して接着する。これにより、接着細胞は、基材に接着して伸展する。
【0036】
このように、接着タンパクは、細胞が接着する部位を持つが、基材が疎水性の場合には、この部位が基材表面に相互作用してしまい、細胞との相互作用が阻害されると考えられている。なお、基材の表面が過剰に親水性の場合は、そもそも接着タンパクが基材に吸着できず、接着細胞は接着することができない。
【0037】
本実施形態における紫外線照射によって、接着細胞用培養容器の培養面の接触角が変化せず、ヒステリシスが高くなる結果、細胞接着率が向上するのは、以下の理由によるものと推定される。
まず、図6に示すように、本実施形態の接着細胞用培養容器を構成するポリオレフィン系樹脂から、紫外線照射によって、樹脂由来ROO・が発生する。そして、樹脂由来ROO・が、ポリオレフィン系樹脂に含有された酸化防止剤と反応し、この酸化防止剤における自由度の増したエステル結合部分が、材料表面の環境により移動可能となる。
その結果、接着細胞用培養容器に培養液を封入して培養面が水に濡れると、親水基が培養面に露出して水を引きつけることができるようになる。その結果、ヒステリシスが高くなり、細胞接着率が向上するものと考えられる。
一方、本実施形態の接着細胞用培養容器の培養面が空気に触れている場合は、親水基が樹脂中に潜ったままの状態であるため、培養面は疎水性となり、接触角は変化しないと考えられる。
【0038】
以上説明したように、本実施形態の接着細胞用培養容器、及びその製造方法によれば、ポリオレフィン系樹脂からなる培養容器に対してオゾン発生波長を除く紫外線照射を行うことにより、培養面の接触角とヒステリシスを所定の範囲のものとし、培養面を親水化することなく、細胞接着率を向上させることができる。
このため、優れた細胞接着率を示す接着細胞用培養容器を、必要以上に清浄度の高い製造環境や、マスキングのような複雑な製造工程を要することなく、提供することが可能となっている。
【実施例】
【0039】
以下、本実施形態の接着細胞用培養容器の性能及び特性を評価するために行った実施例及び比較例について、図7〜図9を参照して説明する。
まず、実施例及び比較例において用いた培養容器に関する、1.製膜、紫外線照射、及びコロナ処理の方法、2.細胞接着性能の評価方法、3.接触角及びヒステリシスの測定方法、及び4.ヒートシール強度の測定方法について、順に説明する。
【0040】
<1.製膜、紫外線照射、及びコロナ処理の方法>
製膜は、ラボプラストミル(東洋精機製作所製)を使用して、押出成形により行った。また、一部の実施例及び比較例においては、ホットプレス(庄司鉄鋼製)を使用して製膜を行った。
【0041】
紫外線照射には、UVランプ(主波長254nm、オゾン発生波長185nmは石英管によってカット,商品名TUV15W/G15T8,フィリップス社製)を使用した。なお、実施例又は比較例において製袋後に紫外線照射をしたもの及び製袋前に紫外線照射(フィルムに対して直接紫外線照射)をしたものは、積算光量5J/cm2で行った。これは、ランプからフィルムを12cm離して2時間照射したものである。また、樹脂ペレットに紫外線照射をしたものは、積算光量10J/cm2で行った。これは、ランプ近傍にフィルムを置き2時間照射したものである。積算光量は、紫外線積算光量計UIT−150(ウシオ電機株式会社製)にて測定した。
【0042】
コロナ処理には、高周波電源装置CG−102(春日電機株式会社製)を使用した。また、この際、印加電流を3.5A、フィルムと電極間の距離を5mm、フィルム移動速度を5m/minとして、コロナ放電処理を行った。
【0043】
<2.細胞接着性能の評価方法>
まず、以下のようにして培養する接着細胞を準備した。
使用培地としてNutrient mixture F/12 Ham(シグマアルドリッチ社製)にウシ胎児血清(インビトロジェン社製)を10%添加したものを用い、接着細胞としてCHO−K1(チャイニーズハムスター卵巣)細胞株を用いて、細胞培養ディッシュ(φ6cm,ベクトン・ディッキンソン社製)において培養し、得られた接着細胞を底面より剥離回収して、計数を行った。
【0044】
次に、ペトリディッシュ(φ6cm,ベクトン・ディッキンソン社製)に、予め実施例及び比較例における各フィルムを貼付した。このとき、製袋後に紫外線照射を行ったフィルムも切り出して貼付した。
そして、それぞれのフィルム上に、新鮮な培地150μlと細胞培養ディッシュ底面より剥離回収された細胞懸濁液150μl(液の総量:300μl)を混合しスポット状に播種した。このとき、播種される細胞数は、上記回収される細胞数が実験の度に変わるため、実施例及び比較例毎に異なるが、およそ7.2〜8.9×104cells/spotであった。また、培養面積は、2cm2であった。
1日経過後(24又は28時間後)、浮遊している細胞数と、接着している細胞数を計数し、以下の式にもとづいて、細胞接着率を算出した。
(接着している細胞数)/(浮遊している細胞数+接着している細胞数)=細胞接着率
【0045】
<3.接触角及びヒステリシスの測定方法>
接触角及びヒステリシスの測定には、固液界面解析システムDropMaster 700(協和界面科学株式会社製)を使用した。
図7に示すように、接触角(θs)は、フィルム上に純水3μlを滴下して測定した。また、滑落時ヒステリシス(θa−θr)は、フィルム上に純水30μlを滴下し、1秒毎に1°ずつ測定台を傾け、滑落時の前進接触角(θa)と後退接触角(θr)を接線法により算出して得た。
【0046】
<4.ヒートシール強度の測定方法>
ヒートシール強度の測定には、ヒートシール試験装置(テスター産業株式会社製)を使用した。シール条件は、シール幅を10mm、上側シールバーのみ140℃に加熱、圧力を3kgf/cm2、シール時間を2秒間とした。
引っ張り試験には、精密万能試験機オートグラフAG−IS(島津製作所株式会社製)を使用し、試験片幅を15mm、M.D.方向に300mm/minの速度で引っ張り、最大試験力(N/15mm)によりシール強度を評価した。
【0047】
次に、図8を参照して、実施例及び比較例について説明する。同図において、EPPEは、Easy Processing PolyEthylene(易加工性ポリエチレン)を、LLDPEは、Linear Low−Density PolyEthylene(直鎖状低密度ポリエチレン)を、PPは、Polypropylene(ポリプロピレン)を、LDPEは、Low−Density PolyEthylene(低密度ポリエチレン)をそれぞれ示している。
【0048】
また、処理内容の「製袋後UV」は、フィルムを貼り合わせて、四方をシールした後に、254nm波長のUVを照射したことを示している。この紫外線照射においては、積算光量が5J/cm2となるように照射を行った。
また、処理内容の「直接UV」は、フィルムを露出した状態で254nm波長のUVを照射したことを示している。この紫外線照射においては、積算光量が5J/cm2となるように照射を行った。
【0049】
また、処理内容の「preUV」は、樹脂ペレットに254nm波長のUVを照射したことを示している。この紫外線照射においては、積算光量が10J/cm2となるように照射を行った。
また、処理内容の「コロナ処理」は、高周波電源装置CG−102(春日電機株式会社製)を使用して、印加電流を3.5A、フィルムと電極間の距離を5mm、フィルム移動速度を5m/minとして、コロナ放電処理を行ったことを示している。
【0050】
(実施例1)
細胞培養容器の内層として、予め酸化防止剤を含有しているエクセレンFX CX3007(EPPE、住友化学株式会社製)を用い、押出成形によりフィルムを製膜した。なお、外層には、エクセレンGMH CB2001(EPPE、住友化学株式会社製)を使用し、二層からなるフィルムを製膜した。
【0051】
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。
得られた培養容器に、上記のように準備した接着細胞CHO−K1(チャイニーズハムスター卵巣)細胞株を播種して培養を行った。初期播種細胞数は、7.8×104cells/spot、培養面積は、2cm2であった。
【0052】
28時間経過後、浮遊している細胞数と、接着している細胞数を計数し、細胞接着率を算出した。その結果、細胞接着率は、80.8%であった。
また、この培養容器の培養面の接触角、ヒステリシス、及びヒートシール強度を測定した。その結果、接触角は101.9°、ヒステリシスは27.8°、ヒートシール強度は15.8(N/15mm)であった。
【0053】
(実施例2)
細胞培養容器の内層として、予め酸化防止剤を含有しているエクセレンFX CX3502(EPPE、住友化学株式会社製)を用いて、押出成形によりフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。その結果、細胞接着率は87.5%、接触角は103.8°、ヒステリシスは35.9°、ヒートシール強度は18.9(N/15mm)であった。
【0054】
(実施例3)
細胞培養容器の内層として、予め酸化防止剤を含有しているエクセレンGMH CB2001(EPPE、住友化学株式会社製)を用いて、押出成形によりフィルムを製膜した。なお、外層には、カーネル KS240T(LLDPE、日本ポリエチレン株式会社製)を使用し、二層からなるフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。なお、ヒートシール強度の測定は行っていない。その結果、細胞接着率は86.1%、接触角は100.0°、ヒステリシスは26.5°であった。
【0055】
(実施例4)
細胞培養容器の内層として、予め酸化防止剤を含有しているカーネル KS240T(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。なお、ヒートシール強度の測定は行っていない。その結果、細胞接着率は82.0%、接触角は105.7°、ヒステリシスは35.0°であった。
【0056】
(実施例5)
細胞培養容器の内層として、予め酸化防止剤を含有しているカーネル KS340T(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。その結果、細胞接着率は87.1%、接触角は104.3°、ヒステリシスは40.9°、ヒートシール強度は17.3(N/15mm)であった。
【0057】
(実施例6)
単層からなる細胞培養容器の層として、予め酸化防止剤を含有しているカーネル KF283(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。さらに、初期播種細胞数を、8.9×104cells/spotとした点は、実施例1と同様にして実験を行った。なお、ヒートシール強度の測定は行っていない。その結果、細胞接着率は81.0%、接触角は95.6°、ヒステリシスは30.0°であった。
【0058】
(実施例7)
単層からなる細胞培養容器の層として、予め酸化防止剤を含有しているノバテックPP MG3F(PP、日本ポリプロ株式会社製)を用いて、ホットプレスによりフィルムを製膜した。
次に、このフィルムを露出した状態で254nm波長の紫外線照射を照射した。
得られた培養容器に、上記のように準備した接着細胞CHO−K1(チャイニーズハムスター卵巣)細胞株を播種して培養を行った。初期播種細胞数は、7.2×104cells/spot、培養面積は、2cm2であった。
【0059】
24時間経過後、浮遊している細胞数と、接着している細胞数を計数し、細胞接着率を算出した。その結果、細胞接着率は、82.7%であった。
また、この培養容器の培養面の接触角、及びヒステリシスを測定した。その結果、接触角は97.3°、ヒステリシスは25.9°であった。
【0060】
(実施例8)
単層からなる細胞培養容器の層として、予め酸化防止剤を含有しているエクセレンFX CX3007(EPPE、住友化学株式会社製)を用い、その樹脂ペレットに254nm波長の紫外線照射を照射した。その後、ホットプレスによりフィルムを製膜し、培養容器を製造した。
得られた培養容器を用いて、実施例7と同様に細胞培養を行い、細胞接着率を算出した。その結果、細胞接着率は、91.9%であった。
また、この培養容器の培養面の接触角、及びヒステリシスを測定した。その結果、接触角は102.2°、ヒステリシスは29.2°であった。
【0061】
(比較例1)
細胞培養容器の内層として、実施例1と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例1と同様にして実験を行った。その結果、細胞接着率は3.2%、接触角は102.7°、ヒステリシスは16.1°、ヒートシール強度は18.5(N/15mm)であった。
【0062】
(比較例2)
細胞培養容器の内層として、実施例2と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例2と同様にして実験を行った。その結果、細胞接着率は1.9%、接触角は103.2°、ヒステリシスは17.0°、ヒートシール強度は20.5(N/15mm)であった。
【0063】
(比較例3)
細胞培養容器の内層として、実施例3と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例3同様にして実験を行った。その結果、細胞接着率は20.7%、接触角は100.1°、ヒステリシスは17.8°であった。
【0064】
(比較例4)
細胞培養容器の内層として、酸化防止剤を含有しないエクセレンGMH CB5002(EPPE、住友化学株式会社製)を用いて、押出成形によりフィルムを製膜した。なお、外層には、カーネル KM262(LLDPE、日本ポリエチレン株式会社製)を使用し、二層からなるフィルムを製膜した。
そして、紫外線照射を行わなかったことを除き、その他の点は、実施例3と同様にして実験を行った。その結果、細胞接着率は18.6%、接触角は101.0°、ヒステリシスは15.6°であった。
【0065】
(比較例5)
細胞培養容器の内層として、比較例4と同じ樹脂を使用して、押出成形によりフィルムを製膜した。なお、外層にも比較例4と同じ樹脂を使用して、二層からなるフィルムを製膜した。
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。このように紫外線照射を行ったことを除き、その他の点は、比較例4と同様にして実験を行った。その結果、細胞接着率は12.5%、接触角は100.4°、ヒステリシスは17.1°であった。
【0066】
(比較例6)
細胞培養容器の内層として、実施例4と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例4と同様にして実験を行った。その結果、細胞接着率は13.5%、接触角は106.0°、ヒステリシスは21.9°であった。
【0067】
(比較例7)
細胞培養容器の内層として、実施例5と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例5と同様にして実験を行った。その結果、細胞接着率は17.6%、接触角は103.6°、ヒステリシスは25.0°、ヒートシール強度は17.5(N/15mm)であった。
【0068】
(比較例8)
単層からなる細胞培養容器の層として、実施例6と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例6と同様にして実験を行った。その結果、細胞接着率は39.0%、接触角は96.8°、ヒステリシスは15.0°であった。
【0069】
(比較例9)
細胞培養容器の内層として、酸化防止剤を含有しないカーネル KM262(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。なお、外層には、エクセレンGMH CB5002(EPPE、住友化学株式会社製)を使用し、二層からなるフィルムを製膜した。
そして、紫外線照射を行わなかったことを除き、その他の点は、実施例3と同様にして実験を行った。その結果、細胞接着率は16.0%、接触角は100.9°、ヒステリシスは15.6°であった。
【0070】
(比較例10)
細胞培養容器の内層として、比較例9と同じ樹脂を使用して、押出成形によりフィルムを製膜した。なお、外層にも比較例9と同じ樹脂を使用して、二層からなるフィルムを製膜した。
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。このように紫外線照射を行ったことを除き、その他の点は、比較例9と同様にして実験を行った。その結果、細胞接着率は17.3%、接触角は100.8°、ヒステリシスは16.2°であった。
【0071】
(比較例11)
単層からなる細胞培養容器の層として、酸化防止剤を含有しないUBEポリエチレン L719(LDPE、宇部丸善ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。
そして、紫外線照射を行わなかったことを除き、その他の点は、実施例3と同様にして実験を行った。その結果、細胞接着率は53.0%、接触角は102.4°、ヒステリシスは15.0°であった。
【0072】
(比較例12)
単層からなる細胞培養容器の層として、比較例11と同じ樹脂を使用して、押出成形によりフィルムを製膜した。
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。このように紫外線照射を行ったことを除き、その他の点は、比較例11と同様にして実験を行った。その結果、細胞接着率は47.9%、接触角は102.3°、ヒステリシスは17.8°であった。
【0073】
(比較例13)
単層からなる細胞培養容器の層として、実施例7と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例7と同様にして実験を行った。その結果、細胞接着率は21.1%、接触角は99.5°、ヒステリシスは16.1°であった。
【0074】
(比較例14)
細胞培養容器の内層として、実施例1と同じ樹脂を使用し、押出成形によりフィルムを製膜した。なお、外層にも実施例1と同じ樹脂を使用して、二層からなるフィルムを製膜した。
このフィルムを露出した状態でコロナ放電処理を行い、その接触角とヒートシール強度を測定した。その結果、接触角は87.6°、ヒートシール強度は11.3(N/15mm)であった。
【0075】
(比較例15)
細胞培養容器の内層として、実施例2と同じ樹脂を使用し、押出成形によりフィルムを製膜した。なお、外層にも実施例2と同じ樹脂を使用して、二層からなるフィルムを製膜した。
このフィルムを露出した状態でコロナ放電処理を行い、その接触角とヒートシール強度を測定した。その結果、接触角は91.5°、ヒートシール強度は10.6(N/15mm)であった。
【0076】
(比較例16)
細胞培養容器の内層として、実施例5と同じ樹脂を使用し、押出成形によりフィルムを製膜した。なお、外層にも実施例5と同じ樹脂を使用して、二層からなるフィルムを製膜した。
このフィルムを露出した状態でコロナ放電処理を行い、その接触角とヒートシール強度を測定した。その結果、接触角は85.8°、ヒートシール強度は9.2(N/15mm)であった。
【0077】
以上の実施例及び比較例における細胞接着率とヒステリシスの関係を、図9に示す。
同図において、塗りつぶし●は、実施例で得られた培養容器の結果を示しており、酸化防止剤を含む樹脂を使用して、254nm波長の紫外線を照射したものである。中抜き○は、比較例で得られた培養容器の結果を示しており、酸化防止剤を含む樹脂を使用して、紫外線の照射を行わなかったものである。塗りつぶし■は、比較例で得られた培養容器の結果を示しており、酸化防止剤を含まない樹脂を使用して、254nm波長の紫外線を照射したものである。中抜き□は、比較例で得られた培養容器の結果を示しており、酸化防止剤を含まない樹脂を使用して、紫外線の照射を行わなかったものである。
【0078】
これらの培養容器の内面の接触角は、いずれも95°以上であり、親水化はされていなかった(図8の実施例1−8,比較例1−13参照)。
一方、ヒステリシスが25°を超えたところで、急激に細胞接着率が増大している。
このように、上記実施例及び比較例の結果から、接着細胞用培養容器の製造において、酸化防止剤を含有するポリエチレン又はポリプロピレンなどのポリオレフィン系樹脂を用い、オゾン発生波長を除く紫外線の照射を行うことが好ましいことがわかる。
これにより、接触角が95°以上で、かつヒステリシスが25°より大きい培養面を備えた培養容器を製造することができる。そして、この培養容器を用いて接着細胞用を培養することで、高い細胞接着率を得ることが可能である。
【0079】
本発明は、以上の実施形態や実施例に限定されるものではなく、本発明の範囲内において、種々の変更実施が可能であることは言うまでもない。
例えば、上記実施例では接着細胞としてCHO−K1細胞株を用いているが、これに限定されるものではなく、接着細胞であればその他の細胞を用いることができる。また、培養液の種類や製膜、製袋方法などについても適宜変更することが可能である。また、上記実施形態や実施例では紫外線源としてオゾン発生波長を除いた低圧水銀ランプを使用しているが、接触角が95°以上で、かつヒステリシスが25°より大きい培養面が形成されるものであればこれに限定されるものではなく、例えば254nm波長のUVを照射できる高圧水銀ランプ等を使用することも可能である。
【産業上の利用可能性】
【0080】
本発明は、細胞培養容器を用いて、接着細胞を大量培養する場合に好適に利用することが可能である。
【技術分野】
【0001】
本発明は、細胞の培養技術に関し、特に培養時に容器壁などを足場として必要とする接着細胞を培養するための接着細胞用培養容器、及び接着細胞用培養容器の製造方法に関する。
【背景技術】
【0002】
近年、医薬品の生産や、遺伝子治療、再生医療、免疫療法等の分野において、細胞や組織、微生物などを人工的な環境下で効率良く大量に培養することが求められている。
このような状況において、培養容器(培養バッグ)に細胞と培養液を充填して、閉鎖系で自動的に細胞を大量培養することが行われている。
このような培養容器には、細胞培養に必要なガス透過性や耐久性、製袋に必要なヒートシール強度などが必要であるため、その材料にはこれらの性質を備えたポリオレフィン系樹脂が好適に用いられている。
【0003】
ところが、ポリオレフィン系樹脂からなる培養容器を用いた場合、浮遊系の細胞は好適に培養できるが、培養時に容器壁などを足場として必要とする接着細胞は、従来は効率的に培養できないという問題があった。すなわち、接着細胞が培養容器の壁に接着するためには、通常培養面に適度な濡れ性が必要であり、親水性であることが必要である。しかし、ポリオレフィン系樹脂からなる培養容器の表面は疎水性であるため、接着細胞は培養面に十分に接着できず、高い増殖効率を得ることができなかった。
【0004】
このような問題を解決するため、培養容器の製袋を行う前に、培養容器を構成するフィルムの培養面に対して、コロナ放電(特許文献1参照)やUV−オゾン法(特許文献2,3参照)による親水化処理を行うことが提案されている。
【0005】
【特許文献1】特開平6−98756号公報
【特許文献2】特開2009−27944号公報
【特許文献3】特開2009−27945号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、これらのような親水化処理を行うと、フィルムのヒートシール強度が大きく低下するため、培養容器の製袋を適切に行うことができなくなるという新たな問題が生じていた。
そこで、このような問題を解決するために、特許文献3ではフィルムにおけるヒートシールを行う部分をマスキングして、UV−オゾン法を施すことが提案されている。しかしこの方法では、製造工程が煩雑になるという問題があった。
また、上記のようにフィルムの培養面に親水化処理を行う場合、表面処理時に培養面が露出するため、培養容器を無菌的に製造することが難しく、清浄度の高い製造環境が必要になるという問題もあった。
【0007】
そこで、本発明者らは鋭意研究し、培養容器を構成する樹脂に一定の紫外線を照射することで、培養面を親水化させることなく、かつ培養容器に培養液を入れた状態での接着細胞の培養面に対する細胞接着率を顕著に向上させることに成功し、本発明を完成させた。
すなわち、本発明は、ポリオレフィンからなる培養容器の内面の一部又は全部における静的水接触角を高い状態に維持して疎水性を保ったまま、ヒステリシス(水滑落時の前進接触角−後退接触角)を一定値より大きくすることで、細胞接着率を向上させ、接着細胞を好適に培養可能な接着細胞用培養容器、及び接着細胞用培養容器の製造方法の提供を目的とする。
【課題を解決するための手段】
【0008】
上記目的を達成するため、本発明の接着細胞用培養容器は、少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートからなる接着細胞用培養容器であって、培養容器の内面の一部又は全部における静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が下記式(1)を満足する構成としてある。
また、本発明の接着細胞用培養容器の製造方法は、少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートにオゾン発生波長を除いた紫外線照射を施し、このフィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が下記式(1)を満たすように形成する方法としてある。
また、本発明の接着細胞用培養容器の製造方法は、ポリオレフィンのペレットにオゾン発生波長を除いた紫外線照射を施し、ポリオレフィンの層を少なくとも最内層に有する単層若しくは多層のフィルム又はシートを形成し、フィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が下記式(1)を満たすように形成する方法としてある。
前進接触角−後退接触角>25°…(式1)
【発明の効果】
【0009】
本発明によれば、必要以上に清浄度の高い製造環境やマスキングのような複雑な製造工程を要することなく、接着細胞を効率的に培養し得る培養容器を製造することが可能となる。
【図面の簡単な説明】
【0010】
【図1】本発明の接着細胞用培養容器による細胞接着率の向上及びヒートシール強度低下の抑制を示す図である。
【図2】本発明における紫外線照射による接着細胞用培養容器を構成するフィルムの特性(接触角)の変化を示す図である。
【図3】本発明における紫外線照射による接着細胞用培養容器を構成するフィルムの特性(ヒステリシス)の変化を示す図である。
【図4】本発明の接着細胞用培養容器の製造工程を示す図である。
【図5】本発明の接着細胞用培養容器の製造工程における紫外線照射の対象(フィルム、培養容器、製膜中のフィルム)を示す図である。
【図6】本発明の接着細胞用培養容器を用いた細胞培養における細胞接着メカニズムを示す図である。
【図7】実施例及び比較例における接触角の測定方法、及びヒステリシスの測定方法を示す図である。
【図8】実施例及び比較例における実験条件と、細胞接着率、ヒステリシス、及びヒートシール強度を示す図である。
【図9】実施例及び比較例におけるヒステリシスと細胞接着率の関係を示す図である。
【発明を実施するための形態】
【0011】
以下、本発明の接着細胞用培養容器、及び接着細胞用培養容器の製造方法の一実施形態について詳細に説明する。
(培養容器)
1.材料
本実施形態の接着細胞用培養容器は、軟包材を材料としてフィルムを製膜し、このフィルムを用いて、袋状(バック型)に形成した培養容器である。この培養容器に培養液と細胞が封入されて細胞培養が行われる。また、培養容器は、細胞培養にあたって、押圧板により押圧されたり、一定時間毎に顕微鏡により培養細胞の撮影などが行われる。これらのことから、その材料には細胞を培養するために必要なガス透過性や耐久性、高いヒートシール強度が要求され、また内容物が確認できるように、透明性を有していることが求められる。
そこで、このような条件を満たす材料として、ポリエチレンやポリプロピレンなどのポリオレフィン系樹脂を好適に用いることができる。
また、フィルムは単層でも二層以上の多層からなるものでもよく、多層からなる場合は、異なる樹脂種や銘柄のポリオレフィン系樹脂を積層して構成することもできる。少なくとも最内層にポリオレフィンの層を有していれば、その他の層に他の樹脂を用いることもできる。なお、フィルムは、シートとして構成されていても良い。
【0012】
また、本実施形態の接着細胞用培養容器の材料として、ポリオレフィン系樹脂に酸化防止剤を含有させたものを用いることが好ましい。酸化防止剤を含有させ、一定の紫外線照射を行うことによって、後述するように接着細胞用培養容器を構成するフィルムのヒステリシスを増大させることができ、培養液を封入したときに、培養面の親水性を高め、細胞の接着性を向上させることが可能になるためである。
このような酸化防止剤としては、特に限定されるものではないが、例えばフェノール系の酸化防止剤や、リン系の酸化防止剤は細胞毒性が低く、ヒステリシスを好適に高めることができるため好ましい。
【0013】
2.紫外線照射処理
また、本実施形態の接着細胞用培養容器では、このようなポリオレフィン系樹脂に一定の紫外線を照射することで、その性質を変性させ、培養容器を構成するフィルムの特性を変化させている。
このとき、ポリオレフィン系樹脂からなるフィルムを用いて培養容器を製袋した後に、培養容器の外側から紫外線照射処理を施すことで、容器内部の培養面の特性を変化させることができる。
【0014】
このフィルム特性の変化においては、後述するように、培養面の接触角には大きな変化は見られず、従って培養面の親水化は行われない。
一方、本実施形態の接着細胞用培養容器は、一定の紫外線を照射することにより、培養面のヒステリシス(接触角ヒステリシス)が増大する。その結果、培養容器に培養液を封入したときに培養面の親水性が高くなり、細胞接着率が向上するようになっている。
【0015】
本実施形態における紫外線照射では、オゾン発生波長(185nm)を照射しない紫外線源が用いられる。例えば、オゾン発生波長を石英管などによってカットできる、主波長254nmの低圧水銀ランプなどを好適に用いることができる。
このように本実施形態の接着細胞用培養容器は、オゾン発生波長を除いた紫外線をポリオレフィン系樹脂に照射することで、照射後の培養面の接触角をほとんど変化させることなく、細胞接着率を向上させることが可能となっている。
【0016】
すなわち、本実施形態の接着細胞用培養容器は、培養面を親水化するものではないため、培養面を露出させることなく接着細胞用培養容器を製造することができる。
また、このように培養面を親水化するものではないため、フィルムのヒートシール強度の低下が少ない。このため、培養容器の製袋前にフィルムに対して紫外線照射を行っても、培養容器の製造を問題なく行うことが可能となっている。
【0017】
一方、特許文献2に記載のUV−オゾン法では、オゾン発生波長を含む紫外線照射によって、培養面の親水化が行われている(実施例において、接触角が104°から71°に低下している。)。すなわち、オゾン発生波長を含む紫外線を用いることで、空気中の酸素に起因するオゾンと材料表面の直接的な反応が起こり、培養面の親水化が行われていると考えられる。また、特許文献2では、容器材料として親水化され易く、かつ安定性が得られやすい易親水化樹脂が用いられ、特にガラス転移温度の高いものが使用されている。これらの材料は、常温で分子鎖が運動しないため、表面の親水化がなされた後、親水基が樹脂内部へ潜り込みにくくなり、親水化の安定性が得られるものと考えられる。
【0018】
これに対して、本実施形態の接着細胞用培養容器では、ポリエチレンやポリプロピレンが材料として使用されるが、これらは常温で分子鎖が運動でき、空気中では親水基が表面に存在するよりも樹脂の内側に存在する方が熱力学的に安定であるため、仮に親水性官能基が含まれていても少量であれば表面に出てきにくく、その結果、表面が親水化されにくいと考えられる。
【0019】
3.細胞接着率
本実施形態の接着細胞用培養容器によれば、培養容器の内面に対する細胞接着率が顕著に向上する。図1(a)は、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器の細胞接着率を示している。同図における細胞接着率は、後述する実施例1及び比較例1の細胞接着率を示しており、接着細胞を28時間培養した後の、浮遊している細胞と接着している細胞の合計数に対する接着細胞数の百分率である。
【0020】
同図に示す通り、本実施形態の紫外線照射によって、細胞接着率は、3.2%から80.8%に増加している。
このように本実施形態の接着細胞用培養容器によれば、細胞接着率を顕著に増加させることができるため、接着細胞の培養効率を大きく向上させることが可能となっている。
【0021】
4.ヒートシール強度
本実施形態の接着細胞用培養容器によれば、培養容器の内面に対する細胞接着率を向上させたことによるヒートシール強度の低下を、従来よりも抑制することができる。
図1(b)は、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器と、本実施形態における紫外線照射を行わずにコロナ放電処理を行い、他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器のヒートシール強度を示している。これらのヒートシール強度は、最大試験力にもとづくものであり、それぞれ後述する実施例1,2,5(同図のUV処理)、比較例1,2,7(同図の未処理)、比較例14,15,16(同図のコロナ処理)のヒートシール強度を示している。
【0022】
同図に示す通り、従来法のコロナ放電処理では、未処理のものと比較して、ヒートシール強度が大きく低下しているのに対し、本実施形態の紫外線照射処理を行った接着細胞用培養容器では、ヒートシール強度の低下が抑制されていることがわかる。
このように本実施形態の接着細胞用培養容器によれば、ヒートシール強度低下を抑制させることができるため、製袋前に紫外線照射を行っても、接着細胞用培養容器を適切に製造することが可能となっている。
【0023】
5.接触角
次に、図2を参照して、接触角について説明する。細胞培養容器における培養面の親水性は、培養面の接触角と関連する。本実施形態における接触角は、静止した液体の表面が固体壁に接するところで液面と固体面がなす角であり(図2のθs)、静的水接触角を意味している。接触角が大きい場合には表面の疎水性が強く、接触角が小さい場合には表面の親水性が強いという関係がある。
一般に、接着細胞の培養に適する培養面の接触角は、60°〜80°程度と言われており(Jurnal of Biomedical Materials Research, Vol.28, 783-789(1994))、接触角がこの範囲内であれば培養面の親水性は高く、接着細胞が培養面に好適に接着することが知られている。
【0024】
図2には、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器における培養面の接触角が示されており、それぞれ後述する実施例1と比較例1の接触角(それぞれ101.9±1.7°、102.7±1°)に対応している。
このように、本実施形態における紫外線照射では、培養面の接触角はほとんど変化しておらず、培養面の親水化が行われていないことがわかる。
【0025】
このため、本実施形態の接着細胞用培養容器は、紫外線照射を行っているにも拘わらず、ヒートシール強度の低下が抑制されたものとなっている。
また、このように培養面が親水化されていなければ、従来は、接着細胞が培養面に十分に接着できなかったが、本実施形態の接着細胞用培養容器は、培養面を親水化させることなく、接着細胞の培養面への接着率を向上させることが可能となっている。
【0026】
また、本実施形態の接着細胞用培養容器の接触角は、95°以上であることが好ましい。接触角が95°より小さくなると、培養面の親水性が高くなり、ヒートシール強度が大きく低下してしまうためである。
このように、本実施形態における紫外線照射では、接着細胞用培養容器の内面の一部又は全部の領域における接触角が95°以上となり、ヒートシール強度の低下を抑制することが可能となっている。
【0027】
6.ヒステリシス
本実施形態における紫外線照射によれば、細胞培養容器を構成するフィルムのヒステリシスを増大させることができる。ここでいうヒステリシスは、接触角ヒステリシスであり、水滴が培養面を滑落するときの前進接触角(θa)と、後退接触角(θr)との差(滑落時ヒステリシス(θa−θr))を示している。すなわち、水平に支持した表面に水滴を摘下し、表面を徐々に傾け、液滴が転落を開始したときの前進接触角と後退接触角にもとづき算出される。このヒステリシスは、表面の動的な濡れ性を示す指標として用いられている。
【0028】
図3は、本実施形態における紫外線照射を行った接着細胞用培養容器と、本実施形態における紫外線照射を行わずに他の点については本実施形態の接着細胞用培養容器と同一条件で製造した培養容器のヒステリシスを示しており、それぞれ後述する実施例1と比較例1のヒステリシス(それぞれ27.8°、16.1°)に対応している。
このように、本実施形態における紫外線照射によれば、培養面のヒステリシスが大きく増大しており、培養面の動的な濡れ性が高くなっていることがわかる。
このため、本実施形態の接着細胞用培養容器は、紫外線照射によって、培養面が親水化されていないにも拘わらず、その動的な濡れ性が高くなっており、その結果、細胞接着率を向上させることが可能となっている。
【0029】
本実施形態の接着細胞用培養容器におけるヒステリシスは、水滑落時の前進接触角及び後退接触角が、下記式(1)を満たす値を示すものであることが好ましい。
前進接触角−後退接触角>25°…(式1)
後述する実施例から明らかなように、ヒステリシスが、25°以下の場合は、十分な細胞接着率を得ることができないのに対し、ヒステリシスが25°よりも大きくなると、細胞接着率が顕著に向上するためである。
【0030】
また、ヒステリシスを25°より大きくする領域は、接着細胞用培養容器全体であっても、接着細胞用培養容器の内面の一部又は全部であっても良い。接着細胞用培養容器の内面の一部でも、ヒステリシスを25°よりも大きくすれば、その領域の細胞接着率を向上させることができ、細胞増殖効率が向上するためである。
【0031】
(接着細胞用培養容器の製造方法)
本実施形態の接着細胞用培養容器の製造方法は、ポリオレフィン系樹脂を材料として、オゾン発生波長を除く紫外線照射を行う点以外については、通常の方法で行うことができ、例えば図4に示すように、以下の工程を含むものとすることができる。
まず、ポリオレフィン系樹脂からなる樹脂ペレットを、押出成形やホットプレスによって製膜し、フィルム(又はシート)を形成する。
【0032】
この樹脂ペレットの製造にあたっては、ポリオレフィン系樹脂に、フェノール系又はリン系の酸化防止剤を含有させることが好ましい。このようにポリオレフィン系樹脂に酸化防止剤を含有させることで、紫外線照射を行ったときのポリオレフィン系樹脂のヒステリシスを好適に増大させることができるためである。
次に、このフィルムを製袋して、接着細胞用培養容器を製造する。
【0033】
本実施形態における紫外線照射は、図5(a)に示すように、フィルムを製袋して、培養容器を形成した後に行うことができる。すなわち、本実施形態における紫外線照射は、培養面を親水化するものではないため、培養面に直接照射しなくても良く、フィルム又はシートにより形成された閉鎖領域の外側より施すことで、培養面のヒステリシスを増大させることができる。また、このように紫外線照射を閉鎖領域の外側より施すことで、培養面の無菌性を保証しやすくなるという効果を得ることができる。
【0034】
また、本実施形態における紫外線照射は、図5(b)に示すように、製袋する前のフィルムやシートに対して行うこともできる。さらに、図5(c)に示すように、インフレーションフィルムからフィルムを巻き取る間において紫外線照射を行うこともできる。また、図4に示すように樹脂ペレットに対して紫外線照射を行うこともできる。
すなわち、本実施形態における紫外線照射は、オゾン発生波長を含まないため、照射されたフィルムの表面が親水化されず、フィルムのヒートシール強度が大きく低下することがない。
このため、製袋前にフィルムやシートに紫外線照射を行っても、適切に製袋を行うことができ、従来法のようなヒートシールを行う部分をマスキングするといった煩雑な工程を含めることなく、接着細胞用培養容器を製造することが可能となっている。
【0035】
(接着メカニズム)
次に、本実施形態の接着細胞用培養容器に接着細胞が接着するメカニズムについて説明する。
接着細胞は、一般に次のようにして培養容器などの基材に接着することが知られている。
まず、培養液に含まれる接着タンパク(例えば、フィブロネクチンやビトロネクチン)が、基材に吸着する。次に、接着細胞の表面にあるインテグリン等が、接着タンパクと相互作用して接着する。これにより、接着細胞は、基材に接着して伸展する。
【0036】
このように、接着タンパクは、細胞が接着する部位を持つが、基材が疎水性の場合には、この部位が基材表面に相互作用してしまい、細胞との相互作用が阻害されると考えられている。なお、基材の表面が過剰に親水性の場合は、そもそも接着タンパクが基材に吸着できず、接着細胞は接着することができない。
【0037】
本実施形態における紫外線照射によって、接着細胞用培養容器の培養面の接触角が変化せず、ヒステリシスが高くなる結果、細胞接着率が向上するのは、以下の理由によるものと推定される。
まず、図6に示すように、本実施形態の接着細胞用培養容器を構成するポリオレフィン系樹脂から、紫外線照射によって、樹脂由来ROO・が発生する。そして、樹脂由来ROO・が、ポリオレフィン系樹脂に含有された酸化防止剤と反応し、この酸化防止剤における自由度の増したエステル結合部分が、材料表面の環境により移動可能となる。
その結果、接着細胞用培養容器に培養液を封入して培養面が水に濡れると、親水基が培養面に露出して水を引きつけることができるようになる。その結果、ヒステリシスが高くなり、細胞接着率が向上するものと考えられる。
一方、本実施形態の接着細胞用培養容器の培養面が空気に触れている場合は、親水基が樹脂中に潜ったままの状態であるため、培養面は疎水性となり、接触角は変化しないと考えられる。
【0038】
以上説明したように、本実施形態の接着細胞用培養容器、及びその製造方法によれば、ポリオレフィン系樹脂からなる培養容器に対してオゾン発生波長を除く紫外線照射を行うことにより、培養面の接触角とヒステリシスを所定の範囲のものとし、培養面を親水化することなく、細胞接着率を向上させることができる。
このため、優れた細胞接着率を示す接着細胞用培養容器を、必要以上に清浄度の高い製造環境や、マスキングのような複雑な製造工程を要することなく、提供することが可能となっている。
【実施例】
【0039】
以下、本実施形態の接着細胞用培養容器の性能及び特性を評価するために行った実施例及び比較例について、図7〜図9を参照して説明する。
まず、実施例及び比較例において用いた培養容器に関する、1.製膜、紫外線照射、及びコロナ処理の方法、2.細胞接着性能の評価方法、3.接触角及びヒステリシスの測定方法、及び4.ヒートシール強度の測定方法について、順に説明する。
【0040】
<1.製膜、紫外線照射、及びコロナ処理の方法>
製膜は、ラボプラストミル(東洋精機製作所製)を使用して、押出成形により行った。また、一部の実施例及び比較例においては、ホットプレス(庄司鉄鋼製)を使用して製膜を行った。
【0041】
紫外線照射には、UVランプ(主波長254nm、オゾン発生波長185nmは石英管によってカット,商品名TUV15W/G15T8,フィリップス社製)を使用した。なお、実施例又は比較例において製袋後に紫外線照射をしたもの及び製袋前に紫外線照射(フィルムに対して直接紫外線照射)をしたものは、積算光量5J/cm2で行った。これは、ランプからフィルムを12cm離して2時間照射したものである。また、樹脂ペレットに紫外線照射をしたものは、積算光量10J/cm2で行った。これは、ランプ近傍にフィルムを置き2時間照射したものである。積算光量は、紫外線積算光量計UIT−150(ウシオ電機株式会社製)にて測定した。
【0042】
コロナ処理には、高周波電源装置CG−102(春日電機株式会社製)を使用した。また、この際、印加電流を3.5A、フィルムと電極間の距離を5mm、フィルム移動速度を5m/minとして、コロナ放電処理を行った。
【0043】
<2.細胞接着性能の評価方法>
まず、以下のようにして培養する接着細胞を準備した。
使用培地としてNutrient mixture F/12 Ham(シグマアルドリッチ社製)にウシ胎児血清(インビトロジェン社製)を10%添加したものを用い、接着細胞としてCHO−K1(チャイニーズハムスター卵巣)細胞株を用いて、細胞培養ディッシュ(φ6cm,ベクトン・ディッキンソン社製)において培養し、得られた接着細胞を底面より剥離回収して、計数を行った。
【0044】
次に、ペトリディッシュ(φ6cm,ベクトン・ディッキンソン社製)に、予め実施例及び比較例における各フィルムを貼付した。このとき、製袋後に紫外線照射を行ったフィルムも切り出して貼付した。
そして、それぞれのフィルム上に、新鮮な培地150μlと細胞培養ディッシュ底面より剥離回収された細胞懸濁液150μl(液の総量:300μl)を混合しスポット状に播種した。このとき、播種される細胞数は、上記回収される細胞数が実験の度に変わるため、実施例及び比較例毎に異なるが、およそ7.2〜8.9×104cells/spotであった。また、培養面積は、2cm2であった。
1日経過後(24又は28時間後)、浮遊している細胞数と、接着している細胞数を計数し、以下の式にもとづいて、細胞接着率を算出した。
(接着している細胞数)/(浮遊している細胞数+接着している細胞数)=細胞接着率
【0045】
<3.接触角及びヒステリシスの測定方法>
接触角及びヒステリシスの測定には、固液界面解析システムDropMaster 700(協和界面科学株式会社製)を使用した。
図7に示すように、接触角(θs)は、フィルム上に純水3μlを滴下して測定した。また、滑落時ヒステリシス(θa−θr)は、フィルム上に純水30μlを滴下し、1秒毎に1°ずつ測定台を傾け、滑落時の前進接触角(θa)と後退接触角(θr)を接線法により算出して得た。
【0046】
<4.ヒートシール強度の測定方法>
ヒートシール強度の測定には、ヒートシール試験装置(テスター産業株式会社製)を使用した。シール条件は、シール幅を10mm、上側シールバーのみ140℃に加熱、圧力を3kgf/cm2、シール時間を2秒間とした。
引っ張り試験には、精密万能試験機オートグラフAG−IS(島津製作所株式会社製)を使用し、試験片幅を15mm、M.D.方向に300mm/minの速度で引っ張り、最大試験力(N/15mm)によりシール強度を評価した。
【0047】
次に、図8を参照して、実施例及び比較例について説明する。同図において、EPPEは、Easy Processing PolyEthylene(易加工性ポリエチレン)を、LLDPEは、Linear Low−Density PolyEthylene(直鎖状低密度ポリエチレン)を、PPは、Polypropylene(ポリプロピレン)を、LDPEは、Low−Density PolyEthylene(低密度ポリエチレン)をそれぞれ示している。
【0048】
また、処理内容の「製袋後UV」は、フィルムを貼り合わせて、四方をシールした後に、254nm波長のUVを照射したことを示している。この紫外線照射においては、積算光量が5J/cm2となるように照射を行った。
また、処理内容の「直接UV」は、フィルムを露出した状態で254nm波長のUVを照射したことを示している。この紫外線照射においては、積算光量が5J/cm2となるように照射を行った。
【0049】
また、処理内容の「preUV」は、樹脂ペレットに254nm波長のUVを照射したことを示している。この紫外線照射においては、積算光量が10J/cm2となるように照射を行った。
また、処理内容の「コロナ処理」は、高周波電源装置CG−102(春日電機株式会社製)を使用して、印加電流を3.5A、フィルムと電極間の距離を5mm、フィルム移動速度を5m/minとして、コロナ放電処理を行ったことを示している。
【0050】
(実施例1)
細胞培養容器の内層として、予め酸化防止剤を含有しているエクセレンFX CX3007(EPPE、住友化学株式会社製)を用い、押出成形によりフィルムを製膜した。なお、外層には、エクセレンGMH CB2001(EPPE、住友化学株式会社製)を使用し、二層からなるフィルムを製膜した。
【0051】
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。
得られた培養容器に、上記のように準備した接着細胞CHO−K1(チャイニーズハムスター卵巣)細胞株を播種して培養を行った。初期播種細胞数は、7.8×104cells/spot、培養面積は、2cm2であった。
【0052】
28時間経過後、浮遊している細胞数と、接着している細胞数を計数し、細胞接着率を算出した。その結果、細胞接着率は、80.8%であった。
また、この培養容器の培養面の接触角、ヒステリシス、及びヒートシール強度を測定した。その結果、接触角は101.9°、ヒステリシスは27.8°、ヒートシール強度は15.8(N/15mm)であった。
【0053】
(実施例2)
細胞培養容器の内層として、予め酸化防止剤を含有しているエクセレンFX CX3502(EPPE、住友化学株式会社製)を用いて、押出成形によりフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。その結果、細胞接着率は87.5%、接触角は103.8°、ヒステリシスは35.9°、ヒートシール強度は18.9(N/15mm)であった。
【0054】
(実施例3)
細胞培養容器の内層として、予め酸化防止剤を含有しているエクセレンGMH CB2001(EPPE、住友化学株式会社製)を用いて、押出成形によりフィルムを製膜した。なお、外層には、カーネル KS240T(LLDPE、日本ポリエチレン株式会社製)を使用し、二層からなるフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。なお、ヒートシール強度の測定は行っていない。その結果、細胞接着率は86.1%、接触角は100.0°、ヒステリシスは26.5°であった。
【0055】
(実施例4)
細胞培養容器の内層として、予め酸化防止剤を含有しているカーネル KS240T(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。なお、ヒートシール強度の測定は行っていない。その結果、細胞接着率は82.0%、接触角は105.7°、ヒステリシスは35.0°であった。
【0056】
(実施例5)
細胞培養容器の内層として、予め酸化防止剤を含有しているカーネル KS340T(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。その他の点は、実施例1と同様にして実験を行った。その結果、細胞接着率は87.1%、接触角は104.3°、ヒステリシスは40.9°、ヒートシール強度は17.3(N/15mm)であった。
【0057】
(実施例6)
単層からなる細胞培養容器の層として、予め酸化防止剤を含有しているカーネル KF283(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。さらに、初期播種細胞数を、8.9×104cells/spotとした点は、実施例1と同様にして実験を行った。なお、ヒートシール強度の測定は行っていない。その結果、細胞接着率は81.0%、接触角は95.6°、ヒステリシスは30.0°であった。
【0058】
(実施例7)
単層からなる細胞培養容器の層として、予め酸化防止剤を含有しているノバテックPP MG3F(PP、日本ポリプロ株式会社製)を用いて、ホットプレスによりフィルムを製膜した。
次に、このフィルムを露出した状態で254nm波長の紫外線照射を照射した。
得られた培養容器に、上記のように準備した接着細胞CHO−K1(チャイニーズハムスター卵巣)細胞株を播種して培養を行った。初期播種細胞数は、7.2×104cells/spot、培養面積は、2cm2であった。
【0059】
24時間経過後、浮遊している細胞数と、接着している細胞数を計数し、細胞接着率を算出した。その結果、細胞接着率は、82.7%であった。
また、この培養容器の培養面の接触角、及びヒステリシスを測定した。その結果、接触角は97.3°、ヒステリシスは25.9°であった。
【0060】
(実施例8)
単層からなる細胞培養容器の層として、予め酸化防止剤を含有しているエクセレンFX CX3007(EPPE、住友化学株式会社製)を用い、その樹脂ペレットに254nm波長の紫外線照射を照射した。その後、ホットプレスによりフィルムを製膜し、培養容器を製造した。
得られた培養容器を用いて、実施例7と同様に細胞培養を行い、細胞接着率を算出した。その結果、細胞接着率は、91.9%であった。
また、この培養容器の培養面の接触角、及びヒステリシスを測定した。その結果、接触角は102.2°、ヒステリシスは29.2°であった。
【0061】
(比較例1)
細胞培養容器の内層として、実施例1と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例1と同様にして実験を行った。その結果、細胞接着率は3.2%、接触角は102.7°、ヒステリシスは16.1°、ヒートシール強度は18.5(N/15mm)であった。
【0062】
(比較例2)
細胞培養容器の内層として、実施例2と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例2と同様にして実験を行った。その結果、細胞接着率は1.9%、接触角は103.2°、ヒステリシスは17.0°、ヒートシール強度は20.5(N/15mm)であった。
【0063】
(比較例3)
細胞培養容器の内層として、実施例3と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例3同様にして実験を行った。その結果、細胞接着率は20.7%、接触角は100.1°、ヒステリシスは17.8°であった。
【0064】
(比較例4)
細胞培養容器の内層として、酸化防止剤を含有しないエクセレンGMH CB5002(EPPE、住友化学株式会社製)を用いて、押出成形によりフィルムを製膜した。なお、外層には、カーネル KM262(LLDPE、日本ポリエチレン株式会社製)を使用し、二層からなるフィルムを製膜した。
そして、紫外線照射を行わなかったことを除き、その他の点は、実施例3と同様にして実験を行った。その結果、細胞接着率は18.6%、接触角は101.0°、ヒステリシスは15.6°であった。
【0065】
(比較例5)
細胞培養容器の内層として、比較例4と同じ樹脂を使用して、押出成形によりフィルムを製膜した。なお、外層にも比較例4と同じ樹脂を使用して、二層からなるフィルムを製膜した。
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。このように紫外線照射を行ったことを除き、その他の点は、比較例4と同様にして実験を行った。その結果、細胞接着率は12.5%、接触角は100.4°、ヒステリシスは17.1°であった。
【0066】
(比較例6)
細胞培養容器の内層として、実施例4と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例4と同様にして実験を行った。その結果、細胞接着率は13.5%、接触角は106.0°、ヒステリシスは21.9°であった。
【0067】
(比較例7)
細胞培養容器の内層として、実施例5と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例5と同様にして実験を行った。その結果、細胞接着率は17.6%、接触角は103.6°、ヒステリシスは25.0°、ヒートシール強度は17.5(N/15mm)であった。
【0068】
(比較例8)
単層からなる細胞培養容器の層として、実施例6と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例6と同様にして実験を行った。その結果、細胞接着率は39.0%、接触角は96.8°、ヒステリシスは15.0°であった。
【0069】
(比較例9)
細胞培養容器の内層として、酸化防止剤を含有しないカーネル KM262(LLDPE、日本ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。なお、外層には、エクセレンGMH CB5002(EPPE、住友化学株式会社製)を使用し、二層からなるフィルムを製膜した。
そして、紫外線照射を行わなかったことを除き、その他の点は、実施例3と同様にして実験を行った。その結果、細胞接着率は16.0%、接触角は100.9°、ヒステリシスは15.6°であった。
【0070】
(比較例10)
細胞培養容器の内層として、比較例9と同じ樹脂を使用して、押出成形によりフィルムを製膜した。なお、外層にも比較例9と同じ樹脂を使用して、二層からなるフィルムを製膜した。
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。このように紫外線照射を行ったことを除き、その他の点は、比較例9と同様にして実験を行った。その結果、細胞接着率は17.3%、接触角は100.8°、ヒステリシスは16.2°であった。
【0071】
(比較例11)
単層からなる細胞培養容器の層として、酸化防止剤を含有しないUBEポリエチレン L719(LDPE、宇部丸善ポリエチレン株式会社製)を用いて、押出成形によりフィルムを製膜した。
そして、紫外線照射を行わなかったことを除き、その他の点は、実施例3と同様にして実験を行った。その結果、細胞接着率は53.0%、接触角は102.4°、ヒステリシスは15.0°であった。
【0072】
(比較例12)
単層からなる細胞培養容器の層として、比較例11と同じ樹脂を使用して、押出成形によりフィルムを製膜した。
次に、このフィルムを袋状に貼り合わせて、四方をシールし、254nm波長の紫外線照射を照射した。このように紫外線照射を行ったことを除き、その他の点は、比較例11と同様にして実験を行った。その結果、細胞接着率は47.9%、接触角は102.3°、ヒステリシスは17.8°であった。
【0073】
(比較例13)
単層からなる細胞培養容器の層として、実施例7と同じ樹脂を使用し、紫外線照射を行わなかったことを除き、その他の点は、実施例7と同様にして実験を行った。その結果、細胞接着率は21.1%、接触角は99.5°、ヒステリシスは16.1°であった。
【0074】
(比較例14)
細胞培養容器の内層として、実施例1と同じ樹脂を使用し、押出成形によりフィルムを製膜した。なお、外層にも実施例1と同じ樹脂を使用して、二層からなるフィルムを製膜した。
このフィルムを露出した状態でコロナ放電処理を行い、その接触角とヒートシール強度を測定した。その結果、接触角は87.6°、ヒートシール強度は11.3(N/15mm)であった。
【0075】
(比較例15)
細胞培養容器の内層として、実施例2と同じ樹脂を使用し、押出成形によりフィルムを製膜した。なお、外層にも実施例2と同じ樹脂を使用して、二層からなるフィルムを製膜した。
このフィルムを露出した状態でコロナ放電処理を行い、その接触角とヒートシール強度を測定した。その結果、接触角は91.5°、ヒートシール強度は10.6(N/15mm)であった。
【0076】
(比較例16)
細胞培養容器の内層として、実施例5と同じ樹脂を使用し、押出成形によりフィルムを製膜した。なお、外層にも実施例5と同じ樹脂を使用して、二層からなるフィルムを製膜した。
このフィルムを露出した状態でコロナ放電処理を行い、その接触角とヒートシール強度を測定した。その結果、接触角は85.8°、ヒートシール強度は9.2(N/15mm)であった。
【0077】
以上の実施例及び比較例における細胞接着率とヒステリシスの関係を、図9に示す。
同図において、塗りつぶし●は、実施例で得られた培養容器の結果を示しており、酸化防止剤を含む樹脂を使用して、254nm波長の紫外線を照射したものである。中抜き○は、比較例で得られた培養容器の結果を示しており、酸化防止剤を含む樹脂を使用して、紫外線の照射を行わなかったものである。塗りつぶし■は、比較例で得られた培養容器の結果を示しており、酸化防止剤を含まない樹脂を使用して、254nm波長の紫外線を照射したものである。中抜き□は、比較例で得られた培養容器の結果を示しており、酸化防止剤を含まない樹脂を使用して、紫外線の照射を行わなかったものである。
【0078】
これらの培養容器の内面の接触角は、いずれも95°以上であり、親水化はされていなかった(図8の実施例1−8,比較例1−13参照)。
一方、ヒステリシスが25°を超えたところで、急激に細胞接着率が増大している。
このように、上記実施例及び比較例の結果から、接着細胞用培養容器の製造において、酸化防止剤を含有するポリエチレン又はポリプロピレンなどのポリオレフィン系樹脂を用い、オゾン発生波長を除く紫外線の照射を行うことが好ましいことがわかる。
これにより、接触角が95°以上で、かつヒステリシスが25°より大きい培養面を備えた培養容器を製造することができる。そして、この培養容器を用いて接着細胞用を培養することで、高い細胞接着率を得ることが可能である。
【0079】
本発明は、以上の実施形態や実施例に限定されるものではなく、本発明の範囲内において、種々の変更実施が可能であることは言うまでもない。
例えば、上記実施例では接着細胞としてCHO−K1細胞株を用いているが、これに限定されるものではなく、接着細胞であればその他の細胞を用いることができる。また、培養液の種類や製膜、製袋方法などについても適宜変更することが可能である。また、上記実施形態や実施例では紫外線源としてオゾン発生波長を除いた低圧水銀ランプを使用しているが、接触角が95°以上で、かつヒステリシスが25°より大きい培養面が形成されるものであればこれに限定されるものではなく、例えば254nm波長のUVを照射できる高圧水銀ランプ等を使用することも可能である。
【産業上の利用可能性】
【0080】
本発明は、細胞培養容器を用いて、接着細胞を大量培養する場合に好適に利用することが可能である。
【特許請求の範囲】
【請求項1】
少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートからなる接着細胞用培養容器であって、前記培養容器の内面の一部又は全部における静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が式(1)を満足することを特徴とする接着細胞用培養容器。
前進接触角−後退接触角>25°…(式1)
【請求項2】
前記ポリオレフィンが酸化防止剤を含有する請求項1記載の接着細胞用培養容器。
【請求項3】
前記酸化防止剤がフェノール系酸化防止剤である請求項1又は2記載の接着細胞培養容器。
【請求項4】
前記ポリオレフィンにオゾン発生波長を除いた紫外線が照射されることにより、前記培養容器の内面の一部又は全部が、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が前記式(1)を満たすように形成されたことを特徴とする請求項1〜3のいずれかに記載の接着細胞用培養容器。
【請求項5】
少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートにオゾン発生波長を除いた紫外線照射を施し、このフィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が式(1)を満たすように形成することを特徴とする接着細胞用培養容器の製造方法。
前進接触角−後退接触角>25°…(式1)
【請求項6】
前記紫外線照射が、前記フィルム又はシートにより形成された閉鎖領域の外側より施される請求項5記載の接着細胞用培養容器の製造方法。
【請求項7】
ポリオレフィンのペレットにオゾン発生波長を除いた紫外線照射を施し、前記ポリオレフィンの層を少なくとも最内層に有する単層若しくは多層のフィルム又はシートを形成し、前記フィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が式(1)を満たすように形成することを特徴とする接着細胞用培養容器の製造方法。
前進接触角−後退接触角>25°…(式1)
【請求項8】
前記ポリオレフィンが酸化防止剤を含有する請求項5〜7のいずれかに記載の接着細胞用培養容器の製造方法。
【請求項1】
少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートからなる接着細胞用培養容器であって、前記培養容器の内面の一部又は全部における静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が式(1)を満足することを特徴とする接着細胞用培養容器。
前進接触角−後退接触角>25°…(式1)
【請求項2】
前記ポリオレフィンが酸化防止剤を含有する請求項1記載の接着細胞用培養容器。
【請求項3】
前記酸化防止剤がフェノール系酸化防止剤である請求項1又は2記載の接着細胞培養容器。
【請求項4】
前記ポリオレフィンにオゾン発生波長を除いた紫外線が照射されることにより、前記培養容器の内面の一部又は全部が、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が前記式(1)を満たすように形成されたことを特徴とする請求項1〜3のいずれかに記載の接着細胞用培養容器。
【請求項5】
少なくとも最内層にポリオレフィンの層を有する単層若しくは多層のフィルム又はシートにオゾン発生波長を除いた紫外線照射を施し、このフィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が式(1)を満たすように形成することを特徴とする接着細胞用培養容器の製造方法。
前進接触角−後退接触角>25°…(式1)
【請求項6】
前記紫外線照射が、前記フィルム又はシートにより形成された閉鎖領域の外側より施される請求項5記載の接着細胞用培養容器の製造方法。
【請求項7】
ポリオレフィンのペレットにオゾン発生波長を除いた紫外線照射を施し、前記ポリオレフィンの層を少なくとも最内層に有する単層若しくは多層のフィルム又はシートを形成し、前記フィルム又はシートからなる培養容器の内面の一部又は全部を、静的水接触角が95°以上であり、かつ水滑落時の前進接触角及び後退接触角が式(1)を満たすように形成することを特徴とする接着細胞用培養容器の製造方法。
前進接触角−後退接触角>25°…(式1)
【請求項8】
前記ポリオレフィンが酸化防止剤を含有する請求項5〜7のいずれかに記載の接着細胞用培養容器の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−80836(P2012−80836A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2010−230543(P2010−230543)
【出願日】平成22年10月13日(2010.10.13)
【出願人】(000003768)東洋製罐株式会社 (1,150)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成22年10月13日(2010.10.13)
【出願人】(000003768)東洋製罐株式会社 (1,150)
【Fターム(参考)】
[ Back to top ]

