接触分子サンプリング装置
【課題】本発明は、生物学的対象となる分子の接触によるサンプリングのための装置(6)に関する。
【解決手段】装置(6)は、接触によるサンプリングが、得られた分子の量が信頼性ある分析を達成するのに十分であるように、その表面より大きい展開表面積を有するキャプチャーゾーン(10)を備え、一方で侵襲性でも攻撃性でもないようにされている。特に、この装置は、ミクロテクノロジー技術を用いて形成された支持体(12)に配置された層状のキャプチャーゾーン(10)を備える。このキャプチャーゾーン(10)が官能基化されることが有利である。
【解決手段】装置(6)は、接触によるサンプリングが、得られた分子の量が信頼性ある分析を達成するのに十分であるように、その表面より大きい展開表面積を有するキャプチャーゾーン(10)を備え、一方で侵襲性でも攻撃性でもないようにされている。特に、この装置は、ミクロテクノロジー技術を用いて形成された支持体(12)に配置された層状のキャプチャーゾーン(10)を備える。このキャプチャーゾーン(10)が官能基化されることが有利である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、侵襲性の臨床診断および/または追跡治療の分野に関する。より具体的には、本発明は、接触によって生物学的に興味のある分子をサンプリングするための微細なサンプリング装置に関する。この装置では、アブレーションまたは生検(biopsy)を必要とせず、その構造は、それを挿入することによって周囲の組織を損傷しないように構成されている。本発明は、特にプロテオミクスまたはゲノミクスに適している。
【0002】
本発明はまた、組織の異なる層のタンパク質構成を決定することを可能にする方法に関する。特に、この方法は腫瘍、例えば脳腫瘍のマッピングに適している。
【背景技術】
【0003】
侵襲性を著しく低下させる外科手術と同様に、臨床診断および追跡治療技術は、様々なサンプリングおよび制御操作のために必要な手段の小型化に向かっている。
【0004】
画像化の進展は、大きくこの発展に寄与してきた。特に、癌腫学、例えば二つのアプローチにより、癌腫瘍の検出限界は、同定および位置調整補助の方法を系統的に用いることによって外科手術支援において大きく改良されてきた。
【0005】
同時に、ゲノムまたはプロテオームレベルでの分子生物学は著しく診断に関わりを持つようになってきた。ある場合には、例えばアナソモパソロジスト(anathomopathologist)の目を分子分析法によって置き換えることが構想され、生物マーカーを識別して特徴付けるためのプロテオミクスおよび関連する質量分析の分野において、多くの開発が行われている。
【0006】
それにも関わらず、目標とする分子をサンプリングする方法は、依然として困難が伴うものであった。分子分析を行うために用いられる既存の手段は、全て生検の原理に基づいており、例えば、細胞または組織の全体をサンプリングし、次いで実験施設内で分析する。したがって、これらの技術は、生物的に完成されたものを悪化させる。さらに、特に脳のようないくつかの領域ではサンプリング装置の挿入が最小限にされなければならないので、それらは必ずしも用いられることができない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、その一態様において、既存のサンプリング装置の欠点を克服することを目的とする。
【課題を解決するための手段】
【0008】
分子インプリント(molecular imprint)は新しいアプローチである。これは、対象とする領域から組織を抽出し、そこにサンプリング手段を簡単に適用することによる。接触によって、関連づけられた適切な表面に、タンパク質のような多数の分子がこの手段に捕捉され、脱着され、実験施設内で分析され得る。
【0009】
したがって、本発明は生物学的対象である分子をサンプリングするために接触のみを用いることを提案する。本発明の装置上に組織のインプリントが得られ、次いで、このように装置のキャプチャーゾーンに集められた分子を分析することができる。特に、通常、平面形状の装置はサイズが小さいので、本発明の装置のキャプチャーゾーンの展開表面積が増大される。これは、捕捉された分子の量が有効な分析を可能にするのに十分であることを意味する。
【0010】
したがって、本発明のサンプリング装置は、少なくとも1つのキャプチャーゾーンを1つの面に有する支持体を備えている。キャプチャーゾーンは、その展開表面積が上方からみられるようにその表面の3倍以上大きくなっている。展開表面と突出面との間の面積の比は、20およびそれ以上の因子に達し得る。
【0011】
その用途については、本発明の装置は制限されたサイズからなり、特に“マイクロテクノロジー”的なサイズである。すなわち、その1mm×1mm以下の微視的な断面はマイクロテクノロジーの方法を用いて形成され得る。“マイクロテクノロジー”とは、特に本発明の装置の挿入断面が1mm2を越えず、好ましくは直径800μmのシリンダーに含まれるということを意味し、例えばそれは、300〜600μm×100〜300μmのオーダーの平行6面体の断面を有する。
【0012】
支持体は、第一面の反対側の面に他のキャプチャーゾーンを備えてもよい。
【0013】
本発明の装置は、一方または両方の面にいくつかの層状のキャプチャーゾーンを備え、すなわち、好ましくは実質的に画定されたインターバルゾーンによって分離されることが有利である。したがって、装置が挿入された組織において異なる深さで存在する分子を分析することが可能である。
【0014】
装置は、その異なるキャプチャーゾーンの間で分割されることが好ましい。例えば、支持体を部分的にエッチングすることによって得られる切り込みのような分離手段が、インターバルゾーンに存在する。
【0015】
キャプチャーゾーンには、様々な実施形態が提供される。キャプチャーゾーンは、キャビティを画定する底壁を備えていてもよい。展開表面積を増加させるために、底壁は、半透膜によって適切な位置に保持されたマイクロビーズの土台としての役割を果たしても良く、および/または突起を有しても良い。
【0016】
これらの突起を形成するために、例えば、マイクロテクノロジーによるシリコンエッチング技術、またはプラスチック成形品が用いられ得るが、3から50μmまたは80μm、例えば5から20μmの側面と、10から400μm、例えば50μm台の高さを有する、四角形、六角形、または八角形の角柱の組織立ったネットワークを形成するようになっている。
【0017】
キャプチャーゾーンが官能基化されることが有利であり、すなわち支持体の壁面および/またはマイクロビーズが、対象とする分子にたいして親和性のある官能基を運ぶマーカーと関連づけられる。また、このマーカーは多数種の飽和のために用いられてもよく、この場合、多数種と少数種とに特有の配位子を有するビーズの使用が好ましい。
【0018】
本発明の装置は、好ましくは操作ロッドおよびガイドスリーブと関連づけられ、分析されるべき組織内に正確に位置づけることができる。特に、スリーブは、装置が適切な位置に設けられた時にのみ、キャプチャーゾーンが周囲の媒体と接触して配置されることを可能にする手段を備えていても良い。
【0019】
本発明の他の態様によると、本発明は、マッピングするか、または目標とする区域の深さに依存して分化分析を行うことを可能にする方法に関する。いくつかの層状のキャプチャーゾーンを有する装置は分析されるべき組織内に挿入され、接触サンプリングが行われ、異なるキャプチャーゾーンによってサンプリングされた分子が分離して分析される。
【0020】
分析を実行するために、キャプチャーゾーンは、装置の分割断面を切断することによって互いに分離されるか、またはキャプチャーゾーンの支持体が測定装置において用いられても良い。
【図面の簡単な説明】
【0021】
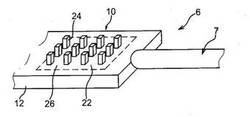
【図1】本発明の一実施形態による接触サンプリングシステム。
【図2】本発明による装置のためのキャプチャーゾーンの一実施形態。
【図3A】本発明による装置のキャプチャーゾーンの他の実施形態の断面。
【図3B】本発明による装置のキャプチャーゾーンの他の実施形態の断面。
【図4】本発明による装置のキャプチャーゾーンの他の実施形態。
【図5】装置の表面の官能基化。
【図6A】ビーズを用いる異なるタイプの官能基化。
【図6B】ビーズを用いる異なるタイプの官能基化。
【図6C】ビーズを用いる異なるタイプの官能基化。
【図7A】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7B】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7C】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7D】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7E】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図8】マッピングのための本発明による装置の使用方法。
【図9】本発明による装置(B)および官能基化(A)を用いた分析の結果。
【発明を実施するための形態】
【0022】
本発明の特徴および効果は、説明するために与えられるがそれに限定されない添付の図面を参照して以下に記載される明細書によってより理解される。
【0023】
分子の生化学、例えばゲノミクス、特にプロテオミクス、つまりタンパク質の構造の研究は、対象とされる、特に生物学的に対象とされる個々の成分の解析を可能にする。
【0024】
従って、図1に示される本発明によるサンプリングシステム1は、ガイドスリーブ2、例えばカテーテルを備えていてもよい。このガイド2は、とりわけ、このサンプリング装置の進路を画定するのに用いられる。それは、選択的に光学的なまたは放射線による監視下で、生体内あるいは例えば生検によって採取された後に、目的とするエリア3、例えば腫瘍または組織に予め配置されても良い。ガイドの端部4には、サンプリング装置6が挿入されたときにそれを保護し、サンプリング装置6が配置された時点で対象とする組織3と接触して配置されるようにするシール手段が設けられることが有利である。本発明において、シール手段5は先端が閉じられたガイド2の長軸に沿って配置されることが好ましい。このシール手段5は、例えば回転または摺動窓、あるいは部分的に再吸収性の膜であっても良い。
【0025】
サンプリング装置6は、長さが用途および挿入深さに依存し、ガイド2内に摺動可能な操作ロッド7を備えることが有利である。操作ロッド7の端部は実際のサンプリング操作に用いられる。ガイド2および操作ロッド7は組織3を損傷しないように、非侵襲性のサンプリングを可能にするように、非常に小さな径からなることが有利である。したがって、操作ロッド7の直径は数ミリメートル、さらには100μmに制限されても良く、ガイド2の外径は操作ロッド7の直径に近くなる。操作ロッドは、例えば外科用のステンレス製のものである。
【0026】
しかしながら、分子のような、対象とする領域内に存在する小数の成分の微調整した正確な解析のためには、採取された流体の量が、組織型の情報を抽出することを可能にするのに十分でなければならない。特に、直径の小さい普通の針7を用いることは、機械加工されたとしてもその表面積が小さく、その表面に捕捉された目的の分子の量が少ないので、それに続く有効な解析を困難にする。しかしながら、本発明によると、サンプリングシステムは、特に脳においても制限なしに用いられることができ、この装置6は995μm、またはそれ以下の直径を有するシリンダーに含まれる。
【0027】
本発明によると、サンプリング装置6の端部8は、展開表面積が通常の表面積よりもはるかに大きく、3から20倍以上であるような少なくとも1つのキャプチャーゾーン10を有し、これは装置6のサイズを、サンプリングを維持しつつ適切な比率で減少させることを可能にする。
【0028】
したがって、サンプリング装置6は、好ましくは操作ロッド7とは独立に設けられた支持体12を備えている。この支持体の端部には操作ロッド7が好ましくは生体適合性のある接着剤で接着することにより固定されてもよい。これは、特に二つの部分のそれぞれの製造工程の分離を可能にし、操作およびサンプリングのための従来の低コストの生体適合性の操作ロッド7を用いることを可能にする。支持体12は、生体適合性材料、特にシリコンから作られることが好ましく、それは以下に特定される。ガイドスリーブ2の異なる部分は、金またはプラスチックといった生物学でおよび/または医学で用いられるものともまた適合することが好ましい。
【0029】
支持体12は、どのような形状であっても良いが、以下の製造方法において記載されるようにウエハー状で平面状であることが有利である。その形状に関わらず、第一面14およびその反対側の第二面16を支持体12上に画定することが可能であり、支持体12が平面状でない場合、“面”および“反対側の面”という用語は、支持体の割線(secant)面に対して対称な支持体12の外表面の部分を指定する。これらの面14、16を、長さ(ロッドの方向に)が1〜3cmの範囲であり、厚さが200〜400μmで、幅が300〜800μmである支持体12上に配置することが有利である。
【0030】
支持体12の第一面14には、キャプチャーゾーン10が設けられ、このキャプチャーゾーン10は、ロッド7に容易に固定されるように十分に長い、例えば2〜5mmの近接した自由端部8を残すことが好ましい。したがって、好ましい一実施形態Pは、300μm×600μm×2cmの大きさのシリコンからなる長方形の支持体12に関連し、その構造化されたゾーンはロッド7に固定された端部から3.2mm離れたところで始まっている。
【0031】
好ましくは、さらに図示されるように、いくつかのキャプチャーゾーン10a、10b、10c、10dが支持体12の面14上にあり、インターバルゾーン18によって分離されている。示された例には、キャプチャーゾーンが4つあるが、その数は目的とする用途、特に装置6のサイズ、目的とする領域3のサイズおよびこの領域3における対象とする分子の濃度、キャプチャーゾーン10の展開表面積、および製造方法に依存することは明らかである。同様に、インターバルゾーン18は“仮想”のものであってもよい。すなわち、キャプチャーゾーン10はマクロレベルでは結果として一体となっているが、ミクロレベルではそれらを区別する手段があり、この手段はさらにそれらを分離することを可能にしてもよい。
【0032】
第二面16がキャプチャーゾーン20を有することもまた可能である。以下により明瞭に説明されるように、第二のキャプチャーゾーン20は第一のゾーン10の反対側に位置を合わせて配置されていることが好ましい。第二キャプチャーゾーン20は、第一のゾーン10と同一の型および形状からなっていてもよい。また、それらは図1に示されるように異なっていても良い。以下に示す様々な実施形態が組み合わされても良い。
【0033】
それぞれのキャプチャーゾーン10、20の展開表面積は、キャプチャーゾーン10、20の平面状の表面より3倍大きい。一実施形態が図2に示される。
【0034】
キャプチャーゾーン10は底壁22を備えている。製造方法に依存して、底壁22は支持体12に配置されてもよく、また、キャビティをそこに画定してもよい(図4参照)。底壁22は表面sを有し、また、複数の突起24を有する。キャプチャーゾーンがキャビティを備えている場合、突起24の高さはキャビティの深さと同一であることが好ましいが、それらの突起が突出することも可能である。支持体の表面がキャプチャーゾーン10および分離手段(後述する)を除いて均一な、好ましくは平面であるということもまた好ましい。この平面状の表面は、例えば、衝撃エネルギーの均一性という点からみて、質量分析のレーザー脱離下でより容易に解析することができる。
【0035】
したがって、キャプチャーゾーン10の展開表面積Sは、突起24の側壁のそれぞれの表面積が加えられた底壁22の表面sに等しい。本発明によると、これらの表面はS>3・sという関係が実証され、この因子「3」は、場合によっては、例えば「5」または「10」という値を仮定することが有利である。
【0036】
突起24はどのような形状であってもよく、例えば角柱または六角形の断面を有する柱状であってもよい。突起24は一定の間隔で、例えば四角または六角のメッシュ状のネットワークで配置されることが好ましい。好適な実施形態Pによると、表面の構造は、高さ50μm、広さ20または80μmのシリコンの八角形の柱の形状である。
【0037】
キャプチャーゾーン10には、異なる製造方法が想定され得る。例えば、支持体12がプラスチックからなる場合、予め作られた成形品に対して反転パターンを与える複製によって部品を得ることを可能にする射出成形または熱エンボス技術を用いることが可能である。したがって、低コストで、ポリエチレン、ポリメチルメタクリレート(PMMA)、ポリカーボネート、ポリジメチルシロキサン(PDMS)、パリレン、またはテフロン(登録商標)からなる支持体12に、20μmの側面と50μmの高さを有する突起24を製造することが可能である。選択肢としては、これらの材料のうち一つ、特にパリレンまたはテフロン(登録商標)を、プラスチック上に溶着することもまた可能であり、生体適合性にするために金属表面上にもまた、溶着することも可能である。
【0038】
より高い表面/体積比が望まれる場合、マイクロテクノロジー技術を用いることが可能である。例えば、文献FR−A−2846957における図7を参照して記載される方法が用いられても良い。しかしながら、この文献に記載された方法は、支持体12のみが加工されているので単純化されている、つまり、通路および/またはカバーシールを提供する構造はなんら開示されていない。この方法を用いると、シリコンからなる支持体12に、5μmの側面および100μmの高さを有する突起24を得ることが可能である。より一般的には、突起24は、深さが50〜400μmで、5〜20μmの側面(この方法を用いて80または100μmまでのサイズが可能となる場合においてさえも)を有してもよく、支持体12は方法の最後に装置が生体適合性を有するように機械加工される。特に、シリコンからなる支持体12は生体適合性のガラスと同様の性能を有するSiO2でコーティングされるように酸化される。
【0039】
キャプチャーゾーン10、20を支持体12の両側に形成するために、例えば予め作られた二つの支持体12、12’(図7E参照)を接着すること、またはシリコンもしくはプラスチック成形品にマイクロテクノロジー技術を用いて両面のあるモジュールを製造すること(図7D参照)が可能である。
【0040】
キャプチャーゾーン10の展開表面積をさらに増加させるために、突起24の間の空間26をマイクロビーズ28で充填することが可能である。マイクロビーズ28は通常マイクロ生物学において用いられる。それらの直径は、それらが官能基化され、また、生体適合性を保ったままにされるように、通常約10ナノメートル程度から約100ミクロンまでであり、多孔質または非多孔質のガラスから成っていてもよい。
【0041】
キャプチャーゾーン10の形成方法および突起24の配置に続いて、FR−A−2846957に説明されるように、突起24の間の空間26におけるビーズ28を配列(図3B)することが可能であり、これは展開表面積の定量化を容易にする。例えば、突起の間の空間26は50μm以下の幅を有する。しかしながら、他の実施形態も可能であり、特にランダムに充填してもよい。第一ビーズ28が正確に配置され、より小さい直径の第二ビーズ28’が適切な位置に配置される(図3A参照)ように、空間26を寸法決めすることも可能である。
【0042】
特に、マイクロビーズ28はキャプチャーゾーン10の展開表面積を著しく増加させる。この場合、突起24を有さず、図4に示されるように、むしろビーズ28で充填されたキャビティ32からなるキャプチャーゾーン30を有することもまた有利である。このキャプチャーゾーン30のキャビティ32は、支持体12のマイクロテクノロジーのエッチングによって形成されても良い。例えば、壁網み34を転写することによって、またはプラスチック材料を成形することによって、キャビティ32が形成されても良い。次いで、それらキャビティ32は、有利には内径を測定され、マイクロビーズ28で充填される。
【0043】
図3および4に示されるようにマイクロビーズを用いる場合、ビーズ28を多孔質膜36によって適当な位置に保持することが有利である。多孔質フィルム36は、対象とする分子がキャプチャーゾーン10、30内に移動するように選択される。1μm以下の多孔性を有するポリカーボネートからなる市販のフィルターが用いられ、シルクスクリーン印刷(例えば、ダイナテック(Dynatech)によるダイナマスク(Dynamask)によってキャビティに接着されてもよく、または、多孔性を達成するために、フォトリソグラフィーによって絶縁された感光性樹脂(例えば、エルガ(Elga)によるオーディル(Ordyl)の乾燥フィルムが用いられても良い。この技術は、1μm以上の直径を有するビーズ28にもっとも適している。
【0044】
分析されるべき媒体3と接触したキャプチャーゾーン10、30の要素の全てあるいは部分を、官能基化することは、捕捉機能の最適化を保証し、および/またはある対象とする分子を目標とするのに重要である。特に、マーカーを突起24および/またはビーズ28および/または壁22、34に固定することが可能である。
【0045】
官能基化するために、DNAプローブの固定、もしくは特定の抗体の固定、続く質量分析のための親和性マトリックスの固定が考えられる。例えば、表面に厚いSiO2の酸化物を有する図2の装置において化学的な結合を行うことが可能である。
【0046】
注目すべきことに、ビーズおよび壁が異なるように官能基化されるという事実によって、あるいは、FR−A−2846957に記載されるように特にビーズ28、28’の直径が異なる場合において、ビーズ28、28’の混合によって、同じキャプチャーゾーン10、30において、いくつかの異なる官能基を有することが可能である。
【0047】
特に、装置の壁22、24、34に関して、通常、官能基化は二つあるいは三つの
ステップにおいて為される(図5参照)。
1)タンパク質と有機支持体との間の非共有性の界面接着を可能にする、結合剤としての二官能基性の有機分子Y−E−Aを合成する。
2)結合材を非有機支持体12に固定する。この非有機支持体12は、結合官能基W(特に、シリカ酸化物層でコーティングされたシリコンからなる基板12のためのO−Siシリル化された官能基W)を得るように予め処理されていても良い。この処理は、二つのY官能基のうちの1つと表面とが反応することによって行われ、他の官能基Aは非共有結合を形成するタンパク質と反応する。
3)化学的な非親和性によって、タンパク質の吸着を可能にする末端の官能基Aがシリル化された官能基を用いて合成されることができない場合、これが得られるまで、改良された支持体が1以上のポストシラニゼーション反応(post-silanisasion reaction)を経る。
【0048】
結合官能基Aは、CH3、アルケン、アルキン、アリル誘導体、ハロゲン(Br、Cl、I、F)、有機金属誘導体、アルコール、フェノール、ジオール、エーテル、エポキシ、炭素誘導体(アルデヒド、ケトン、カルボン酸、カルボン酸塩、エステル、アミド、酸塩化物、酸無水物)、含窒素誘導体(アミン、ニトロ誘導体、ジアゾ誘導体、イミン、エナミン、オキシム、ニトリル)、含リン誘導体(ホスフィン、亜リン酸塩、リン酸塩、ホスホン酸塩)、シリコン誘導体、硫黄誘導体(硫化物、二硫化物、チオール、チオエーテル、スルホン、亜硫酸塩、硫酸塩、スルホン酸、スルホン酸塩、炭素の代わりに窒素を含むスルホニウム(azasulfonium))、セレニウム誘導体等のような存在する全ての有機、無機官能基に対応する。
【0049】
結合剤の二つの官能基A、Yの間に用いられるスペーサ基Eは、特有の特性をシラニゼーションによって得られたフィルムに付与することを可能にする。官能基Eは、組織された単一層が得られることを可能にするラジカルのうちから選ばれる。長鎖アルキレン型のラジカルEは、鎖間相互作用を可能にし(アルキレン型のラジカルEのうち、8〜24の炭素原子を有するものが特に好ましい)、二つの三重結合−C≡C−を含むラジカルEは架橋を可能にし、対になった芳香族鎖を含むラジカルEは非線形の光学特性を与え(例えば、フェニレン−ビニレンおよびフェニレン−アセチレンラジカル)、ピロール、チオフェン、またはポリシラン型のラジカルEは、電子伝導を与え、多置換多環芳香族型のラジカルEは、光/電界発光特性を与え(例えば、キノンおよびジアゾ化合物)、アルキルまたはフルオロアルキル型ラジカルE、特に、3〜24の炭素原子を有するアルキルまたはフルオロアルキル基は、クロマトグラフィーまたは電気泳動によって得られる層を用いることを可能にする。
【0050】
ビーズの官能基化のために、同様の原理が用いられる。
【0051】
サンプリングエリア10iに応じて、異なる型のビーズを置くことが可能であり、それにより層になった親和性官能基Aを有する手段を得ることが可能となる。
【0052】
例えば、シラン化されたSiO2のような親水性表面を有する基板12のために、この手段に配置されたエステルの表面官能基は、一次の水酸基を運ぶように官能化されたビーズと反応する。ビーズ28の固定化の後、この手段は展開された親水性表面を有する(図6A参照)。
【0053】
他の効果を得るために、ビーズ28の官能基化を用いることもまた可能である、つまり、配位子運搬ビーズの層を使用することによって多数種の飽和させて質量分析の感度を増加させる(動的平滑化)。例えば、二つのキャリアビーズ、つまり、大多数のタンパク質に特有の配位子を運ぶ第一のキャリアビーズと、小数のタンパク質に特有の配位子を運ぶ第二のキャリアビーズとによって覆われた表面が組織に接触する場合、小数のタンパク質と同様に多くの多数のタンパク質を捕捉し、この表面は、質量分析による分析段階において二つめの種類の容易な検出を可能にする。自然において、多数/小数タンパク質のダイナミクスは12ログ(log)なので、配列に置く前のサンプルの洗浄段階での配置についてのサイファーゲン(Ciphergen、登録商標)によって開発されたこのアプローチの利点は容易に理解される。本発明の装置を用いて、移動することなく接触サンプリングに対してこの原理を適用することが可能である。
【0054】
選択肢の1つとして、n本の試験管に、それぞれ特有の配位子を運ぶn種のタイプのビーズ28を準備し、それらを混合し、次いで配位子Y(図6BにおけるNH2参照)を介してこの手段にそれらを固定する。他の選択肢として、特有の配位子のn種のタイプを混合し、予めビーズで官能基化された手段にそれらを固定する(図6C参照)。
【0055】
また、サンプリング装置6がいくつかのキャプチャーゾーン10iを有する場合(図1参照)、それぞれのキャプチャーゾーンに同じ官能基を用いることが可能であり、または、空間微分を、例えばDNAチップにおいてよく知られる“スポッティング”法によって作ることも可能である。
【0056】
用途に依存して、および特にサンプリングされた分子について行われる分析に依存して、1つの同じ装置6のキャプチャーゾーン10a〜10dを分離することは興味深い。特に、支持体12は前述の実施形態のそれぞれにおいて得られる。
【0057】
支持体12の区分化を容易にするために、キャプチャーゾーン10、30の間のインターバルゾーン18には分離手段が設けられることが有利である。例えば、突起24および/または壁34が形成されるのと同時に、切り込みがエッチングされても良い(図7参照)。そして、インターバルゾーン18、34は容易に区分されることができる。
【0058】
異なる実施形態が考えられる。例えば、支持体12を、キャプチャーゾーン10を備えた面14と反対側の面16上で、例えばマスクおよびエッチングを用いてエッチングすることによって裂け目42を入れることが可能である(図7A参照)。切り込み44は、“前”面14に作られることができ、または等方性の化学エッチングが、例えばKOHを用いて選択されてもよい(図7B参照)。
【0059】
図4に示される1つのキャビティ32を有するタイプの装置に関して、通常インターバルゾーンは壁34から成る。この場合もまた、裂けた切り込み46を、この壁の底の後面に画定することが好ましい(図7C参照)。
【0060】
キャプチャーゾーン10、20が面14、16のそれぞれにある場合、分離手段をそれらの面のうちの1つの面にのみ配置させることも可能であり(図7D)、また、両面に配置させてもよい(図7C)。この点に関し、それらの相対する面14、16のそれぞれにキャプチャーゾーン10、20を有する装置の二つの実施形態において、1つの支持体12(図7D)または二つの支持体12、12’の接着(図7E)が示される。
【0061】
切り込み42、44、46の異なる実施形態が独立に、または組み合わせて用いられ得るということは明らかである。
【0062】
好適な実施形態Pによると、直径100mmのシリコンのウエハーが切断の後最終的な装置142を得るために機械加工される。シリコンから成る支持体12は、印が付けられているのが有利であり、特に装置の名前、位置合わせの十字、切断の目印が、例えばマスクおよびドライエッチングを用いてフォトリソグラフィーによって500nmにエッチングされる。
【0063】
後面は、切り込み46を形成するために、同様の処理(前述のマスクに合わせられたマスクを用いたフォトリソグラフィー、5〜10μmのドライエッチング、マスク樹脂の除去)を受ける。次いで、前面は、フォトリソグラフィーおよび位置を合わせたマスク、50μmの深いドライエッチング、および該樹脂の除去によるミクロ構造化のために模様が付けられてエッチングされる。次いで、この表面は生物学的および/または医学的使用を可能にするように処理される。特に、エッチング処理の間にキャビティの側面に形成されたポリマー(C4F8)が全面的な脱酸素化によって除去され、100nmにわたって湿式酸化され、次いで完全な脱酸素化が行われる。そして、最終的なSiO2層が500nmにわたる湿式酸化によって得られる。
【0064】
図8に示される本発明による装置の利用の一実施形態によると、ガイド2はまず、好ましくは監視下で目標とするエリア3内に適切な位置になるように配置され、支持体12はロッド7の端部に接着される。ロッド7は、その正確な位置取りが保証されるように、特にキャプチャーゾーン10a〜10dのそれぞれに対応する腫瘍3の領域A、B、C、Dを決定するように、光学的な制御下でガイド2に挿入される。一度キャプチャーゾーン10a〜10dが適切な位置をとると、シール手段5が開けられ、取り付けることによってサンプリングが行われる。装置自体の操作はなんら必要とされず、キャプチャーゾーン10の接触面が直接入手可能(例えば、カバーなしで)になる。これは、全体として、特に支持体12の小型化を可能にする。次いで、シール手段5は選択的に再び閉じられても良い。続いて、ロッド7はガイド2から取り除かれ、支持体12がガイドから分離され、キャプチャーゾーン10a〜10dが分析される。
【0065】
採取されたサンプルの処理のための二つのアプローチが採られ得る。
1)装置6が切られ、それぞれのゾーン10a〜10dが分離され、独立して処理される。一度ロッド7が引かれると、支持体12は分割ラインに沿って破れ、異なるゾーン10a〜10dは洗浄・抽出管50a〜50dに移される。抽出された分子A、B、C、Dはデータバンク内に保管されることができ、および/または分析、例えば特にセルディ−トフ(SELDI−TOFF、登録商標)のようなプロテオーム分析のための質量分析のために用いられるサイファーゲン配列のために配列に置かれることができる。
2)支持体12を切断しないこともまた可能であり、この支持体12はしたがって画定され、腫瘍3内に並べられた活性ゾーンA−Dを維持する。支持体12自身が、例えばレーザー補助直接脱離による最終解析装置60のための基板の役割を果たす。
【0066】
選択されたアプローチに関わらず、対象とする組織のマップが目標とするエリア3における深さに対するタンパク質組成についての結果とともに得られる。
【0067】
したがって本発明のサンプリング装置は特別に有利な特性を有する。
−サンプリングの侵襲性が少ない:特に、目標とする分子の十分な捕捉のための展開表面積を維持しつつ、装置6の、さらにはシステム1の見かけの直径が数ミリメートル、好ましくは1mmに減少される。
−サンプリングの攻撃性が少ない:組織3を切断することなく接触により(または‘固定により’)為される。
−実際にサンプリングに用いられる装置の機械加工された部分のサイズが減少され、低コストの操作ロッド7と関連づけられる支持体12を覆うだけである、
−サンプリング12のために用いられる部分の機械加工は、他の機械的な要素なしで、および、付加的な接合または接着段階なしで、接触ゾーン10、20、30の形成に減少される。
−キャプチャーゾーン10、20、30の大きな展開表面積は、小型化を補い、信頼性のある分析を提供する。
−装置6は生体内の操作において、または操作後に、または分子分析を必要とするサンプリングされた組織について生体外でさえも用いることが可能である。
−層状のキャプチャーゾーン10a〜10dの存在は、インプリントの後にサンプリングエリア3における対象とする分子の分布の分析を可能にする。
−それぞれのキャプチャーゾーン10、30は、目標とする分子および/または最終的な分析(ゲノミクス、プロテオミクス)のタイプに応じて官能基化され得る。
−それぞれのキャプチャーゾーン10a〜10dは他から分離され、ゾーン固有の技術を用いて分析され得る。
−支持装置12は分析装置と互換性を有することができる。例えば、それは、質量分析のための特有のマトリクッスを備えても良い。
−分析されるエリア3の深さ軸に沿ってマッピングすることは、装置に沿って分化された一連の活性領域A−Dに応じて決定されうる。立体鏡(stereoscopy)の下での操作方法は、装置6の正確なガイドを可能にし、また、どのエリアA−Dが検出されるのかを正確に決定する。
【実施例】
【0068】
前述の装置P(八角形の突起を有する600×300μm2のSiからなる支持体12)はシラン化されカルボン酸官能基を与えるように官能化された。生理的なpHでは、生体系および特にタンパク質は必然的に帯電している。イオン相互作用(クロマトグラフィーの原理に基づいて)がタンパク質のマーカーの特異吸着に用いられ得る。アニオン性(負に帯電)の表面のために、カルボン酸塩誘導体がもっとも頻繁に用いられる。
【0069】
カルボン酸塩およびシラン官能基は適合しないので、トリメトキシシリルウンデカン−10−酸のメチルエステルを介して間接的な合成方法が選択された。
【化1】

【0070】
酸官能基は、ウンデセン酸をスルホン酸およびメタノールと反応させた後に、メチルエステルの形状に保護される。シリル基の混和は、通常ヒドロシリル化反応によって実施される。
【0071】
例えば、トリメトキシシリルウンデカン−10−酸のメチルエステルを形成するために、10−ウンデス−1−エン酸が次の方法を用いて作られる。
−500mLのメタノールに溶解されたウンデセン酸(98%)(10.47g;11.5mL;56mmol)の溶液に、濃硫酸が加えられる(12.88g;7mL;131mmol;2.3当量)。反応は0℃で4時間行われる。
−メタノールを蒸発し、酢酸エチルに回収したのち、反応混合物を続いてEDIと塩化ナトリウムの飽和溶液とで洗浄し(×2)、無水硫酸マグネシウム上で乾燥し、次いで濃縮され無水液体(10.99g、99%)を得る。これは、次の特性を与える。
δH(200MHz; CDCl3):1.30(10H;m;H5−9)
:1.62(2H;m;H4)
:2.04(2H;m;H10)
:2.31(2H;t;H3);3JH−H=7.4Hz)
:3.67(3H;s;H1)
:4.97(2H;m;H12)
:5.81(1H;m;H11)
δC(200MHz; CDCl3):25.31
:29.26
:29.42
:29.50
:29.58
:29.66
:34.16
:34.44
:51.76(C1)
:114.51(C12)
:139.46(C11)
:174.61(C2)
−10−ウンデス−1−エン酸のメチルエステル(10.58g;53mmol)をトリメトキシレン(95%)(8.75g;9.1mL;68mmol;1.3当量と混合する。カールシュテット触媒(0.13g;0.13mmol;0.0025当量)を非常にゆっくり加える。室温で16時間反応を行う。反応生成物を蒸留により精製し、無色液体(0.5mbarで120−125℃;11.7g;70%)を得る。
δH(200MHz; CDCl3):0.65(2H;m;H12)
:1.27(14H;m;H5−11)
:1.62(2H;m;H4)
:2.30(2H;t;H3);3JH−H=7.4Hz)
:3.57(9H;s;H13)
:3.67(3H;s;H1)
δC(200MHz; CDCl3):9.21(C12)
:22.68
:25.04
:29.23
:29.38(2C)
:29.50(2C)
:33.17
:34.19
:50.55(C13)
:51.46(C1)
:174.38(C2)
δSi(200MHz; CDCl3):−41.30(s)
【0072】
熱酸化物の500nmの層でコーティングされたシリコン基板の水酸化を、3.5Mの水酸化ナトリウム溶液中で、無水トリクロロエチレン中で10−2Mシラン化溶液を用いて、2時間行う。シラン化反応を、2℃の制御温度で24時間行う。
【0073】
改良された支持体は、ヨウ化アルミニウムの溶液に接触して、カルボン酸基を解放し、次々に水酸化ナトリウム水溶液と反応させ、対応するカルボン酸塩基を得る。
【0074】
この装置は、エグゼルシス(exeresis)の後に得られた脳腫瘍(神経膠腫)の質量分析に用いられた。
【0075】
組織が手段に取り付けられ、次いで、洗浄しマトリックス上に置いた後に、表面上で分析が直接行われた。
【0076】
商標名プロテインチップ(ProteinChip、登録商標)システムシリーズ4000に基づいてサイファーゲンによって市販されるセルディ−トフ上に得られた質量分析が図9に示され、斜線部分は、多数のヘモグロビンと、トランスフェリンタンパク質とを表す。
【0077】
注目すべきことは、化学を用いない表面Bの分析において示される印は、化学的に改良された表面A(COO−を介してアニオン性である)上よりもはるかに少ないので、表面化学が重要な役割を担っている。
結果。
【技術分野】
【0001】
本発明は、侵襲性の臨床診断および/または追跡治療の分野に関する。より具体的には、本発明は、接触によって生物学的に興味のある分子をサンプリングするための微細なサンプリング装置に関する。この装置では、アブレーションまたは生検(biopsy)を必要とせず、その構造は、それを挿入することによって周囲の組織を損傷しないように構成されている。本発明は、特にプロテオミクスまたはゲノミクスに適している。
【0002】
本発明はまた、組織の異なる層のタンパク質構成を決定することを可能にする方法に関する。特に、この方法は腫瘍、例えば脳腫瘍のマッピングに適している。
【背景技術】
【0003】
侵襲性を著しく低下させる外科手術と同様に、臨床診断および追跡治療技術は、様々なサンプリングおよび制御操作のために必要な手段の小型化に向かっている。
【0004】
画像化の進展は、大きくこの発展に寄与してきた。特に、癌腫学、例えば二つのアプローチにより、癌腫瘍の検出限界は、同定および位置調整補助の方法を系統的に用いることによって外科手術支援において大きく改良されてきた。
【0005】
同時に、ゲノムまたはプロテオームレベルでの分子生物学は著しく診断に関わりを持つようになってきた。ある場合には、例えばアナソモパソロジスト(anathomopathologist)の目を分子分析法によって置き換えることが構想され、生物マーカーを識別して特徴付けるためのプロテオミクスおよび関連する質量分析の分野において、多くの開発が行われている。
【0006】
それにも関わらず、目標とする分子をサンプリングする方法は、依然として困難が伴うものであった。分子分析を行うために用いられる既存の手段は、全て生検の原理に基づいており、例えば、細胞または組織の全体をサンプリングし、次いで実験施設内で分析する。したがって、これらの技術は、生物的に完成されたものを悪化させる。さらに、特に脳のようないくつかの領域ではサンプリング装置の挿入が最小限にされなければならないので、それらは必ずしも用いられることができない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、その一態様において、既存のサンプリング装置の欠点を克服することを目的とする。
【課題を解決するための手段】
【0008】
分子インプリント(molecular imprint)は新しいアプローチである。これは、対象とする領域から組織を抽出し、そこにサンプリング手段を簡単に適用することによる。接触によって、関連づけられた適切な表面に、タンパク質のような多数の分子がこの手段に捕捉され、脱着され、実験施設内で分析され得る。
【0009】
したがって、本発明は生物学的対象である分子をサンプリングするために接触のみを用いることを提案する。本発明の装置上に組織のインプリントが得られ、次いで、このように装置のキャプチャーゾーンに集められた分子を分析することができる。特に、通常、平面形状の装置はサイズが小さいので、本発明の装置のキャプチャーゾーンの展開表面積が増大される。これは、捕捉された分子の量が有効な分析を可能にするのに十分であることを意味する。
【0010】
したがって、本発明のサンプリング装置は、少なくとも1つのキャプチャーゾーンを1つの面に有する支持体を備えている。キャプチャーゾーンは、その展開表面積が上方からみられるようにその表面の3倍以上大きくなっている。展開表面と突出面との間の面積の比は、20およびそれ以上の因子に達し得る。
【0011】
その用途については、本発明の装置は制限されたサイズからなり、特に“マイクロテクノロジー”的なサイズである。すなわち、その1mm×1mm以下の微視的な断面はマイクロテクノロジーの方法を用いて形成され得る。“マイクロテクノロジー”とは、特に本発明の装置の挿入断面が1mm2を越えず、好ましくは直径800μmのシリンダーに含まれるということを意味し、例えばそれは、300〜600μm×100〜300μmのオーダーの平行6面体の断面を有する。
【0012】
支持体は、第一面の反対側の面に他のキャプチャーゾーンを備えてもよい。
【0013】
本発明の装置は、一方または両方の面にいくつかの層状のキャプチャーゾーンを備え、すなわち、好ましくは実質的に画定されたインターバルゾーンによって分離されることが有利である。したがって、装置が挿入された組織において異なる深さで存在する分子を分析することが可能である。
【0014】
装置は、その異なるキャプチャーゾーンの間で分割されることが好ましい。例えば、支持体を部分的にエッチングすることによって得られる切り込みのような分離手段が、インターバルゾーンに存在する。
【0015】
キャプチャーゾーンには、様々な実施形態が提供される。キャプチャーゾーンは、キャビティを画定する底壁を備えていてもよい。展開表面積を増加させるために、底壁は、半透膜によって適切な位置に保持されたマイクロビーズの土台としての役割を果たしても良く、および/または突起を有しても良い。
【0016】
これらの突起を形成するために、例えば、マイクロテクノロジーによるシリコンエッチング技術、またはプラスチック成形品が用いられ得るが、3から50μmまたは80μm、例えば5から20μmの側面と、10から400μm、例えば50μm台の高さを有する、四角形、六角形、または八角形の角柱の組織立ったネットワークを形成するようになっている。
【0017】
キャプチャーゾーンが官能基化されることが有利であり、すなわち支持体の壁面および/またはマイクロビーズが、対象とする分子にたいして親和性のある官能基を運ぶマーカーと関連づけられる。また、このマーカーは多数種の飽和のために用いられてもよく、この場合、多数種と少数種とに特有の配位子を有するビーズの使用が好ましい。
【0018】
本発明の装置は、好ましくは操作ロッドおよびガイドスリーブと関連づけられ、分析されるべき組織内に正確に位置づけることができる。特に、スリーブは、装置が適切な位置に設けられた時にのみ、キャプチャーゾーンが周囲の媒体と接触して配置されることを可能にする手段を備えていても良い。
【0019】
本発明の他の態様によると、本発明は、マッピングするか、または目標とする区域の深さに依存して分化分析を行うことを可能にする方法に関する。いくつかの層状のキャプチャーゾーンを有する装置は分析されるべき組織内に挿入され、接触サンプリングが行われ、異なるキャプチャーゾーンによってサンプリングされた分子が分離して分析される。
【0020】
分析を実行するために、キャプチャーゾーンは、装置の分割断面を切断することによって互いに分離されるか、またはキャプチャーゾーンの支持体が測定装置において用いられても良い。
【図面の簡単な説明】
【0021】
【図1】本発明の一実施形態による接触サンプリングシステム。
【図2】本発明による装置のためのキャプチャーゾーンの一実施形態。
【図3A】本発明による装置のキャプチャーゾーンの他の実施形態の断面。
【図3B】本発明による装置のキャプチャーゾーンの他の実施形態の断面。
【図4】本発明による装置のキャプチャーゾーンの他の実施形態。
【図5】装置の表面の官能基化。
【図6A】ビーズを用いる異なるタイプの官能基化。
【図6B】ビーズを用いる異なるタイプの官能基化。
【図6C】ビーズを用いる異なるタイプの官能基化。
【図7A】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7B】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7C】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7D】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図7E】本発明による装置のキャプチャーゾーンを分離する手段の異なる実施形態。
【図8】マッピングのための本発明による装置の使用方法。
【図9】本発明による装置(B)および官能基化(A)を用いた分析の結果。
【発明を実施するための形態】
【0022】
本発明の特徴および効果は、説明するために与えられるがそれに限定されない添付の図面を参照して以下に記載される明細書によってより理解される。
【0023】
分子の生化学、例えばゲノミクス、特にプロテオミクス、つまりタンパク質の構造の研究は、対象とされる、特に生物学的に対象とされる個々の成分の解析を可能にする。
【0024】
従って、図1に示される本発明によるサンプリングシステム1は、ガイドスリーブ2、例えばカテーテルを備えていてもよい。このガイド2は、とりわけ、このサンプリング装置の進路を画定するのに用いられる。それは、選択的に光学的なまたは放射線による監視下で、生体内あるいは例えば生検によって採取された後に、目的とするエリア3、例えば腫瘍または組織に予め配置されても良い。ガイドの端部4には、サンプリング装置6が挿入されたときにそれを保護し、サンプリング装置6が配置された時点で対象とする組織3と接触して配置されるようにするシール手段が設けられることが有利である。本発明において、シール手段5は先端が閉じられたガイド2の長軸に沿って配置されることが好ましい。このシール手段5は、例えば回転または摺動窓、あるいは部分的に再吸収性の膜であっても良い。
【0025】
サンプリング装置6は、長さが用途および挿入深さに依存し、ガイド2内に摺動可能な操作ロッド7を備えることが有利である。操作ロッド7の端部は実際のサンプリング操作に用いられる。ガイド2および操作ロッド7は組織3を損傷しないように、非侵襲性のサンプリングを可能にするように、非常に小さな径からなることが有利である。したがって、操作ロッド7の直径は数ミリメートル、さらには100μmに制限されても良く、ガイド2の外径は操作ロッド7の直径に近くなる。操作ロッドは、例えば外科用のステンレス製のものである。
【0026】
しかしながら、分子のような、対象とする領域内に存在する小数の成分の微調整した正確な解析のためには、採取された流体の量が、組織型の情報を抽出することを可能にするのに十分でなければならない。特に、直径の小さい普通の針7を用いることは、機械加工されたとしてもその表面積が小さく、その表面に捕捉された目的の分子の量が少ないので、それに続く有効な解析を困難にする。しかしながら、本発明によると、サンプリングシステムは、特に脳においても制限なしに用いられることができ、この装置6は995μm、またはそれ以下の直径を有するシリンダーに含まれる。
【0027】
本発明によると、サンプリング装置6の端部8は、展開表面積が通常の表面積よりもはるかに大きく、3から20倍以上であるような少なくとも1つのキャプチャーゾーン10を有し、これは装置6のサイズを、サンプリングを維持しつつ適切な比率で減少させることを可能にする。
【0028】
したがって、サンプリング装置6は、好ましくは操作ロッド7とは独立に設けられた支持体12を備えている。この支持体の端部には操作ロッド7が好ましくは生体適合性のある接着剤で接着することにより固定されてもよい。これは、特に二つの部分のそれぞれの製造工程の分離を可能にし、操作およびサンプリングのための従来の低コストの生体適合性の操作ロッド7を用いることを可能にする。支持体12は、生体適合性材料、特にシリコンから作られることが好ましく、それは以下に特定される。ガイドスリーブ2の異なる部分は、金またはプラスチックといった生物学でおよび/または医学で用いられるものともまた適合することが好ましい。
【0029】
支持体12は、どのような形状であっても良いが、以下の製造方法において記載されるようにウエハー状で平面状であることが有利である。その形状に関わらず、第一面14およびその反対側の第二面16を支持体12上に画定することが可能であり、支持体12が平面状でない場合、“面”および“反対側の面”という用語は、支持体の割線(secant)面に対して対称な支持体12の外表面の部分を指定する。これらの面14、16を、長さ(ロッドの方向に)が1〜3cmの範囲であり、厚さが200〜400μmで、幅が300〜800μmである支持体12上に配置することが有利である。
【0030】
支持体12の第一面14には、キャプチャーゾーン10が設けられ、このキャプチャーゾーン10は、ロッド7に容易に固定されるように十分に長い、例えば2〜5mmの近接した自由端部8を残すことが好ましい。したがって、好ましい一実施形態Pは、300μm×600μm×2cmの大きさのシリコンからなる長方形の支持体12に関連し、その構造化されたゾーンはロッド7に固定された端部から3.2mm離れたところで始まっている。
【0031】
好ましくは、さらに図示されるように、いくつかのキャプチャーゾーン10a、10b、10c、10dが支持体12の面14上にあり、インターバルゾーン18によって分離されている。示された例には、キャプチャーゾーンが4つあるが、その数は目的とする用途、特に装置6のサイズ、目的とする領域3のサイズおよびこの領域3における対象とする分子の濃度、キャプチャーゾーン10の展開表面積、および製造方法に依存することは明らかである。同様に、インターバルゾーン18は“仮想”のものであってもよい。すなわち、キャプチャーゾーン10はマクロレベルでは結果として一体となっているが、ミクロレベルではそれらを区別する手段があり、この手段はさらにそれらを分離することを可能にしてもよい。
【0032】
第二面16がキャプチャーゾーン20を有することもまた可能である。以下により明瞭に説明されるように、第二のキャプチャーゾーン20は第一のゾーン10の反対側に位置を合わせて配置されていることが好ましい。第二キャプチャーゾーン20は、第一のゾーン10と同一の型および形状からなっていてもよい。また、それらは図1に示されるように異なっていても良い。以下に示す様々な実施形態が組み合わされても良い。
【0033】
それぞれのキャプチャーゾーン10、20の展開表面積は、キャプチャーゾーン10、20の平面状の表面より3倍大きい。一実施形態が図2に示される。
【0034】
キャプチャーゾーン10は底壁22を備えている。製造方法に依存して、底壁22は支持体12に配置されてもよく、また、キャビティをそこに画定してもよい(図4参照)。底壁22は表面sを有し、また、複数の突起24を有する。キャプチャーゾーンがキャビティを備えている場合、突起24の高さはキャビティの深さと同一であることが好ましいが、それらの突起が突出することも可能である。支持体の表面がキャプチャーゾーン10および分離手段(後述する)を除いて均一な、好ましくは平面であるということもまた好ましい。この平面状の表面は、例えば、衝撃エネルギーの均一性という点からみて、質量分析のレーザー脱離下でより容易に解析することができる。
【0035】
したがって、キャプチャーゾーン10の展開表面積Sは、突起24の側壁のそれぞれの表面積が加えられた底壁22の表面sに等しい。本発明によると、これらの表面はS>3・sという関係が実証され、この因子「3」は、場合によっては、例えば「5」または「10」という値を仮定することが有利である。
【0036】
突起24はどのような形状であってもよく、例えば角柱または六角形の断面を有する柱状であってもよい。突起24は一定の間隔で、例えば四角または六角のメッシュ状のネットワークで配置されることが好ましい。好適な実施形態Pによると、表面の構造は、高さ50μm、広さ20または80μmのシリコンの八角形の柱の形状である。
【0037】
キャプチャーゾーン10には、異なる製造方法が想定され得る。例えば、支持体12がプラスチックからなる場合、予め作られた成形品に対して反転パターンを与える複製によって部品を得ることを可能にする射出成形または熱エンボス技術を用いることが可能である。したがって、低コストで、ポリエチレン、ポリメチルメタクリレート(PMMA)、ポリカーボネート、ポリジメチルシロキサン(PDMS)、パリレン、またはテフロン(登録商標)からなる支持体12に、20μmの側面と50μmの高さを有する突起24を製造することが可能である。選択肢としては、これらの材料のうち一つ、特にパリレンまたはテフロン(登録商標)を、プラスチック上に溶着することもまた可能であり、生体適合性にするために金属表面上にもまた、溶着することも可能である。
【0038】
より高い表面/体積比が望まれる場合、マイクロテクノロジー技術を用いることが可能である。例えば、文献FR−A−2846957における図7を参照して記載される方法が用いられても良い。しかしながら、この文献に記載された方法は、支持体12のみが加工されているので単純化されている、つまり、通路および/またはカバーシールを提供する構造はなんら開示されていない。この方法を用いると、シリコンからなる支持体12に、5μmの側面および100μmの高さを有する突起24を得ることが可能である。より一般的には、突起24は、深さが50〜400μmで、5〜20μmの側面(この方法を用いて80または100μmまでのサイズが可能となる場合においてさえも)を有してもよく、支持体12は方法の最後に装置が生体適合性を有するように機械加工される。特に、シリコンからなる支持体12は生体適合性のガラスと同様の性能を有するSiO2でコーティングされるように酸化される。
【0039】
キャプチャーゾーン10、20を支持体12の両側に形成するために、例えば予め作られた二つの支持体12、12’(図7E参照)を接着すること、またはシリコンもしくはプラスチック成形品にマイクロテクノロジー技術を用いて両面のあるモジュールを製造すること(図7D参照)が可能である。
【0040】
キャプチャーゾーン10の展開表面積をさらに増加させるために、突起24の間の空間26をマイクロビーズ28で充填することが可能である。マイクロビーズ28は通常マイクロ生物学において用いられる。それらの直径は、それらが官能基化され、また、生体適合性を保ったままにされるように、通常約10ナノメートル程度から約100ミクロンまでであり、多孔質または非多孔質のガラスから成っていてもよい。
【0041】
キャプチャーゾーン10の形成方法および突起24の配置に続いて、FR−A−2846957に説明されるように、突起24の間の空間26におけるビーズ28を配列(図3B)することが可能であり、これは展開表面積の定量化を容易にする。例えば、突起の間の空間26は50μm以下の幅を有する。しかしながら、他の実施形態も可能であり、特にランダムに充填してもよい。第一ビーズ28が正確に配置され、より小さい直径の第二ビーズ28’が適切な位置に配置される(図3A参照)ように、空間26を寸法決めすることも可能である。
【0042】
特に、マイクロビーズ28はキャプチャーゾーン10の展開表面積を著しく増加させる。この場合、突起24を有さず、図4に示されるように、むしろビーズ28で充填されたキャビティ32からなるキャプチャーゾーン30を有することもまた有利である。このキャプチャーゾーン30のキャビティ32は、支持体12のマイクロテクノロジーのエッチングによって形成されても良い。例えば、壁網み34を転写することによって、またはプラスチック材料を成形することによって、キャビティ32が形成されても良い。次いで、それらキャビティ32は、有利には内径を測定され、マイクロビーズ28で充填される。
【0043】
図3および4に示されるようにマイクロビーズを用いる場合、ビーズ28を多孔質膜36によって適当な位置に保持することが有利である。多孔質フィルム36は、対象とする分子がキャプチャーゾーン10、30内に移動するように選択される。1μm以下の多孔性を有するポリカーボネートからなる市販のフィルターが用いられ、シルクスクリーン印刷(例えば、ダイナテック(Dynatech)によるダイナマスク(Dynamask)によってキャビティに接着されてもよく、または、多孔性を達成するために、フォトリソグラフィーによって絶縁された感光性樹脂(例えば、エルガ(Elga)によるオーディル(Ordyl)の乾燥フィルムが用いられても良い。この技術は、1μm以上の直径を有するビーズ28にもっとも適している。
【0044】
分析されるべき媒体3と接触したキャプチャーゾーン10、30の要素の全てあるいは部分を、官能基化することは、捕捉機能の最適化を保証し、および/またはある対象とする分子を目標とするのに重要である。特に、マーカーを突起24および/またはビーズ28および/または壁22、34に固定することが可能である。
【0045】
官能基化するために、DNAプローブの固定、もしくは特定の抗体の固定、続く質量分析のための親和性マトリックスの固定が考えられる。例えば、表面に厚いSiO2の酸化物を有する図2の装置において化学的な結合を行うことが可能である。
【0046】
注目すべきことに、ビーズおよび壁が異なるように官能基化されるという事実によって、あるいは、FR−A−2846957に記載されるように特にビーズ28、28’の直径が異なる場合において、ビーズ28、28’の混合によって、同じキャプチャーゾーン10、30において、いくつかの異なる官能基を有することが可能である。
【0047】
特に、装置の壁22、24、34に関して、通常、官能基化は二つあるいは三つの
ステップにおいて為される(図5参照)。
1)タンパク質と有機支持体との間の非共有性の界面接着を可能にする、結合剤としての二官能基性の有機分子Y−E−Aを合成する。
2)結合材を非有機支持体12に固定する。この非有機支持体12は、結合官能基W(特に、シリカ酸化物層でコーティングされたシリコンからなる基板12のためのO−Siシリル化された官能基W)を得るように予め処理されていても良い。この処理は、二つのY官能基のうちの1つと表面とが反応することによって行われ、他の官能基Aは非共有結合を形成するタンパク質と反応する。
3)化学的な非親和性によって、タンパク質の吸着を可能にする末端の官能基Aがシリル化された官能基を用いて合成されることができない場合、これが得られるまで、改良された支持体が1以上のポストシラニゼーション反応(post-silanisasion reaction)を経る。
【0048】
結合官能基Aは、CH3、アルケン、アルキン、アリル誘導体、ハロゲン(Br、Cl、I、F)、有機金属誘導体、アルコール、フェノール、ジオール、エーテル、エポキシ、炭素誘導体(アルデヒド、ケトン、カルボン酸、カルボン酸塩、エステル、アミド、酸塩化物、酸無水物)、含窒素誘導体(アミン、ニトロ誘導体、ジアゾ誘導体、イミン、エナミン、オキシム、ニトリル)、含リン誘導体(ホスフィン、亜リン酸塩、リン酸塩、ホスホン酸塩)、シリコン誘導体、硫黄誘導体(硫化物、二硫化物、チオール、チオエーテル、スルホン、亜硫酸塩、硫酸塩、スルホン酸、スルホン酸塩、炭素の代わりに窒素を含むスルホニウム(azasulfonium))、セレニウム誘導体等のような存在する全ての有機、無機官能基に対応する。
【0049】
結合剤の二つの官能基A、Yの間に用いられるスペーサ基Eは、特有の特性をシラニゼーションによって得られたフィルムに付与することを可能にする。官能基Eは、組織された単一層が得られることを可能にするラジカルのうちから選ばれる。長鎖アルキレン型のラジカルEは、鎖間相互作用を可能にし(アルキレン型のラジカルEのうち、8〜24の炭素原子を有するものが特に好ましい)、二つの三重結合−C≡C−を含むラジカルEは架橋を可能にし、対になった芳香族鎖を含むラジカルEは非線形の光学特性を与え(例えば、フェニレン−ビニレンおよびフェニレン−アセチレンラジカル)、ピロール、チオフェン、またはポリシラン型のラジカルEは、電子伝導を与え、多置換多環芳香族型のラジカルEは、光/電界発光特性を与え(例えば、キノンおよびジアゾ化合物)、アルキルまたはフルオロアルキル型ラジカルE、特に、3〜24の炭素原子を有するアルキルまたはフルオロアルキル基は、クロマトグラフィーまたは電気泳動によって得られる層を用いることを可能にする。
【0050】
ビーズの官能基化のために、同様の原理が用いられる。
【0051】
サンプリングエリア10iに応じて、異なる型のビーズを置くことが可能であり、それにより層になった親和性官能基Aを有する手段を得ることが可能となる。
【0052】
例えば、シラン化されたSiO2のような親水性表面を有する基板12のために、この手段に配置されたエステルの表面官能基は、一次の水酸基を運ぶように官能化されたビーズと反応する。ビーズ28の固定化の後、この手段は展開された親水性表面を有する(図6A参照)。
【0053】
他の効果を得るために、ビーズ28の官能基化を用いることもまた可能である、つまり、配位子運搬ビーズの層を使用することによって多数種の飽和させて質量分析の感度を増加させる(動的平滑化)。例えば、二つのキャリアビーズ、つまり、大多数のタンパク質に特有の配位子を運ぶ第一のキャリアビーズと、小数のタンパク質に特有の配位子を運ぶ第二のキャリアビーズとによって覆われた表面が組織に接触する場合、小数のタンパク質と同様に多くの多数のタンパク質を捕捉し、この表面は、質量分析による分析段階において二つめの種類の容易な検出を可能にする。自然において、多数/小数タンパク質のダイナミクスは12ログ(log)なので、配列に置く前のサンプルの洗浄段階での配置についてのサイファーゲン(Ciphergen、登録商標)によって開発されたこのアプローチの利点は容易に理解される。本発明の装置を用いて、移動することなく接触サンプリングに対してこの原理を適用することが可能である。
【0054】
選択肢の1つとして、n本の試験管に、それぞれ特有の配位子を運ぶn種のタイプのビーズ28を準備し、それらを混合し、次いで配位子Y(図6BにおけるNH2参照)を介してこの手段にそれらを固定する。他の選択肢として、特有の配位子のn種のタイプを混合し、予めビーズで官能基化された手段にそれらを固定する(図6C参照)。
【0055】
また、サンプリング装置6がいくつかのキャプチャーゾーン10iを有する場合(図1参照)、それぞれのキャプチャーゾーンに同じ官能基を用いることが可能であり、または、空間微分を、例えばDNAチップにおいてよく知られる“スポッティング”法によって作ることも可能である。
【0056】
用途に依存して、および特にサンプリングされた分子について行われる分析に依存して、1つの同じ装置6のキャプチャーゾーン10a〜10dを分離することは興味深い。特に、支持体12は前述の実施形態のそれぞれにおいて得られる。
【0057】
支持体12の区分化を容易にするために、キャプチャーゾーン10、30の間のインターバルゾーン18には分離手段が設けられることが有利である。例えば、突起24および/または壁34が形成されるのと同時に、切り込みがエッチングされても良い(図7参照)。そして、インターバルゾーン18、34は容易に区分されることができる。
【0058】
異なる実施形態が考えられる。例えば、支持体12を、キャプチャーゾーン10を備えた面14と反対側の面16上で、例えばマスクおよびエッチングを用いてエッチングすることによって裂け目42を入れることが可能である(図7A参照)。切り込み44は、“前”面14に作られることができ、または等方性の化学エッチングが、例えばKOHを用いて選択されてもよい(図7B参照)。
【0059】
図4に示される1つのキャビティ32を有するタイプの装置に関して、通常インターバルゾーンは壁34から成る。この場合もまた、裂けた切り込み46を、この壁の底の後面に画定することが好ましい(図7C参照)。
【0060】
キャプチャーゾーン10、20が面14、16のそれぞれにある場合、分離手段をそれらの面のうちの1つの面にのみ配置させることも可能であり(図7D)、また、両面に配置させてもよい(図7C)。この点に関し、それらの相対する面14、16のそれぞれにキャプチャーゾーン10、20を有する装置の二つの実施形態において、1つの支持体12(図7D)または二つの支持体12、12’の接着(図7E)が示される。
【0061】
切り込み42、44、46の異なる実施形態が独立に、または組み合わせて用いられ得るということは明らかである。
【0062】
好適な実施形態Pによると、直径100mmのシリコンのウエハーが切断の後最終的な装置142を得るために機械加工される。シリコンから成る支持体12は、印が付けられているのが有利であり、特に装置の名前、位置合わせの十字、切断の目印が、例えばマスクおよびドライエッチングを用いてフォトリソグラフィーによって500nmにエッチングされる。
【0063】
後面は、切り込み46を形成するために、同様の処理(前述のマスクに合わせられたマスクを用いたフォトリソグラフィー、5〜10μmのドライエッチング、マスク樹脂の除去)を受ける。次いで、前面は、フォトリソグラフィーおよび位置を合わせたマスク、50μmの深いドライエッチング、および該樹脂の除去によるミクロ構造化のために模様が付けられてエッチングされる。次いで、この表面は生物学的および/または医学的使用を可能にするように処理される。特に、エッチング処理の間にキャビティの側面に形成されたポリマー(C4F8)が全面的な脱酸素化によって除去され、100nmにわたって湿式酸化され、次いで完全な脱酸素化が行われる。そして、最終的なSiO2層が500nmにわたる湿式酸化によって得られる。
【0064】
図8に示される本発明による装置の利用の一実施形態によると、ガイド2はまず、好ましくは監視下で目標とするエリア3内に適切な位置になるように配置され、支持体12はロッド7の端部に接着される。ロッド7は、その正確な位置取りが保証されるように、特にキャプチャーゾーン10a〜10dのそれぞれに対応する腫瘍3の領域A、B、C、Dを決定するように、光学的な制御下でガイド2に挿入される。一度キャプチャーゾーン10a〜10dが適切な位置をとると、シール手段5が開けられ、取り付けることによってサンプリングが行われる。装置自体の操作はなんら必要とされず、キャプチャーゾーン10の接触面が直接入手可能(例えば、カバーなしで)になる。これは、全体として、特に支持体12の小型化を可能にする。次いで、シール手段5は選択的に再び閉じられても良い。続いて、ロッド7はガイド2から取り除かれ、支持体12がガイドから分離され、キャプチャーゾーン10a〜10dが分析される。
【0065】
採取されたサンプルの処理のための二つのアプローチが採られ得る。
1)装置6が切られ、それぞれのゾーン10a〜10dが分離され、独立して処理される。一度ロッド7が引かれると、支持体12は分割ラインに沿って破れ、異なるゾーン10a〜10dは洗浄・抽出管50a〜50dに移される。抽出された分子A、B、C、Dはデータバンク内に保管されることができ、および/または分析、例えば特にセルディ−トフ(SELDI−TOFF、登録商標)のようなプロテオーム分析のための質量分析のために用いられるサイファーゲン配列のために配列に置かれることができる。
2)支持体12を切断しないこともまた可能であり、この支持体12はしたがって画定され、腫瘍3内に並べられた活性ゾーンA−Dを維持する。支持体12自身が、例えばレーザー補助直接脱離による最終解析装置60のための基板の役割を果たす。
【0066】
選択されたアプローチに関わらず、対象とする組織のマップが目標とするエリア3における深さに対するタンパク質組成についての結果とともに得られる。
【0067】
したがって本発明のサンプリング装置は特別に有利な特性を有する。
−サンプリングの侵襲性が少ない:特に、目標とする分子の十分な捕捉のための展開表面積を維持しつつ、装置6の、さらにはシステム1の見かけの直径が数ミリメートル、好ましくは1mmに減少される。
−サンプリングの攻撃性が少ない:組織3を切断することなく接触により(または‘固定により’)為される。
−実際にサンプリングに用いられる装置の機械加工された部分のサイズが減少され、低コストの操作ロッド7と関連づけられる支持体12を覆うだけである、
−サンプリング12のために用いられる部分の機械加工は、他の機械的な要素なしで、および、付加的な接合または接着段階なしで、接触ゾーン10、20、30の形成に減少される。
−キャプチャーゾーン10、20、30の大きな展開表面積は、小型化を補い、信頼性のある分析を提供する。
−装置6は生体内の操作において、または操作後に、または分子分析を必要とするサンプリングされた組織について生体外でさえも用いることが可能である。
−層状のキャプチャーゾーン10a〜10dの存在は、インプリントの後にサンプリングエリア3における対象とする分子の分布の分析を可能にする。
−それぞれのキャプチャーゾーン10、30は、目標とする分子および/または最終的な分析(ゲノミクス、プロテオミクス)のタイプに応じて官能基化され得る。
−それぞれのキャプチャーゾーン10a〜10dは他から分離され、ゾーン固有の技術を用いて分析され得る。
−支持装置12は分析装置と互換性を有することができる。例えば、それは、質量分析のための特有のマトリクッスを備えても良い。
−分析されるエリア3の深さ軸に沿ってマッピングすることは、装置に沿って分化された一連の活性領域A−Dに応じて決定されうる。立体鏡(stereoscopy)の下での操作方法は、装置6の正確なガイドを可能にし、また、どのエリアA−Dが検出されるのかを正確に決定する。
【実施例】
【0068】
前述の装置P(八角形の突起を有する600×300μm2のSiからなる支持体12)はシラン化されカルボン酸官能基を与えるように官能化された。生理的なpHでは、生体系および特にタンパク質は必然的に帯電している。イオン相互作用(クロマトグラフィーの原理に基づいて)がタンパク質のマーカーの特異吸着に用いられ得る。アニオン性(負に帯電)の表面のために、カルボン酸塩誘導体がもっとも頻繁に用いられる。
【0069】
カルボン酸塩およびシラン官能基は適合しないので、トリメトキシシリルウンデカン−10−酸のメチルエステルを介して間接的な合成方法が選択された。
【化1】

【0070】
酸官能基は、ウンデセン酸をスルホン酸およびメタノールと反応させた後に、メチルエステルの形状に保護される。シリル基の混和は、通常ヒドロシリル化反応によって実施される。
【0071】
例えば、トリメトキシシリルウンデカン−10−酸のメチルエステルを形成するために、10−ウンデス−1−エン酸が次の方法を用いて作られる。
−500mLのメタノールに溶解されたウンデセン酸(98%)(10.47g;11.5mL;56mmol)の溶液に、濃硫酸が加えられる(12.88g;7mL;131mmol;2.3当量)。反応は0℃で4時間行われる。
−メタノールを蒸発し、酢酸エチルに回収したのち、反応混合物を続いてEDIと塩化ナトリウムの飽和溶液とで洗浄し(×2)、無水硫酸マグネシウム上で乾燥し、次いで濃縮され無水液体(10.99g、99%)を得る。これは、次の特性を与える。
δH(200MHz; CDCl3):1.30(10H;m;H5−9)
:1.62(2H;m;H4)
:2.04(2H;m;H10)
:2.31(2H;t;H3);3JH−H=7.4Hz)
:3.67(3H;s;H1)
:4.97(2H;m;H12)
:5.81(1H;m;H11)
δC(200MHz; CDCl3):25.31
:29.26
:29.42
:29.50
:29.58
:29.66
:34.16
:34.44
:51.76(C1)
:114.51(C12)
:139.46(C11)
:174.61(C2)
−10−ウンデス−1−エン酸のメチルエステル(10.58g;53mmol)をトリメトキシレン(95%)(8.75g;9.1mL;68mmol;1.3当量と混合する。カールシュテット触媒(0.13g;0.13mmol;0.0025当量)を非常にゆっくり加える。室温で16時間反応を行う。反応生成物を蒸留により精製し、無色液体(0.5mbarで120−125℃;11.7g;70%)を得る。
δH(200MHz; CDCl3):0.65(2H;m;H12)
:1.27(14H;m;H5−11)
:1.62(2H;m;H4)
:2.30(2H;t;H3);3JH−H=7.4Hz)
:3.57(9H;s;H13)
:3.67(3H;s;H1)
δC(200MHz; CDCl3):9.21(C12)
:22.68
:25.04
:29.23
:29.38(2C)
:29.50(2C)
:33.17
:34.19
:50.55(C13)
:51.46(C1)
:174.38(C2)
δSi(200MHz; CDCl3):−41.30(s)
【0072】
熱酸化物の500nmの層でコーティングされたシリコン基板の水酸化を、3.5Mの水酸化ナトリウム溶液中で、無水トリクロロエチレン中で10−2Mシラン化溶液を用いて、2時間行う。シラン化反応を、2℃の制御温度で24時間行う。
【0073】
改良された支持体は、ヨウ化アルミニウムの溶液に接触して、カルボン酸基を解放し、次々に水酸化ナトリウム水溶液と反応させ、対応するカルボン酸塩基を得る。
【0074】
この装置は、エグゼルシス(exeresis)の後に得られた脳腫瘍(神経膠腫)の質量分析に用いられた。
【0075】
組織が手段に取り付けられ、次いで、洗浄しマトリックス上に置いた後に、表面上で分析が直接行われた。
【0076】
商標名プロテインチップ(ProteinChip、登録商標)システムシリーズ4000に基づいてサイファーゲンによって市販されるセルディ−トフ上に得られた質量分析が図9に示され、斜線部分は、多数のヘモグロビンと、トランスフェリンタンパク質とを表す。
【0077】
注目すべきことは、化学を用いない表面Bの分析において示される印は、化学的に改良された表面A(COO−を介してアニオン性である)上よりもはるかに少ないので、表面化学が重要な役割を担っている。
結果。
【特許請求の範囲】
【請求項1】
生体内生検手術において、生物学的対象となる分子の接触によるサンプリングのためのマイクロテクノロジーサンプリング装置(6)であって、
第二の面(16)の反対側に設けられた平面状の第一の面(14)と、前記第一の面(14)に設けられた少なくとも1つの第一キャプチャーゾーン(10)とを有する、マイクロテクノロジー基板の支持体(12)と、
操作ロッドと、
生検を受ける組織へのサンプリング装置の通路を規定するガイドスリーブ(2)と、を備え、
前記第一キャプチャーゾーンの展開表面積(S)は少なくともその表面(s)の三倍以上であり、
前記支持体は、前記操作ロッドの一端に配置され、サンプリングが前記第一キャプチャーゾーンにより行われ、
前記操作ロッドは、前記ガイドスリーブ内で摺動可能であり、
前記ガイドスリーブの直径は、前記操作ロッドの直径に略等しいことを特徴とするマイクロテクノロジーサンプリング装置(6)。
【請求項2】
前記操作ロッドは、前記マイクロテクノロジー基板と平行に延びることを特徴とする請求項1に記載の装置。
【請求項3】
前記ガイドスリーブは閉じられた先端を有することを特徴とする請求項1または2に記載の装置。
【請求項4】
前記ガイドスリーブは、前記キャプチャーゾーンが周囲媒体に接触して配置されることを可能にする窓を備えることを特徴とする請求項2または3に記載の装置。
【請求項5】
前記第二面(16)に設けられた少なくとも1つの第二キャプチャーゾーン(20)をさらに備え、
前記第二キャプチャーゾーン(20)の展開表面積は、その表面より大きいことを特徴とする、請求項1乃至4のいずれか1つに記載の装置。
【請求項6】
前記第二キャプチャーゾーン(20)の展開表面積は、その表面の三倍以上であることを特徴とする、請求項5に記載の装置。
【請求項7】
第一インターバルゾーン(18)によって分離された前記第一面(14)に設けられた複数の第一キャプチャーゾーン(10a〜10d)を備えることを特徴とする、請求項1乃至6のいずれか1つに記載の装置。
【請求項8】
第二インターバルゾーン(34)によって分離された前記第二面(16)に設けられた複数の第二キャプチャーゾーンを備え、
第一ゾーンのそれぞれは、1つの第二ゾーンの反対側に設けられることを特徴とする、請求項7に記載の装置。
【請求項9】
前記第一および第二インターバルゾーン(18、34)に設けられた前記キャプチャーゾーンを分離する分離手段(42、44、46)を備えることを特徴とする、請求項7または8に記載の装置。
【請求項10】
前記分離手段は、前記第一および/または第二面(14、16)に設けられた切り込みを備えていることを特徴とする、請求項9に記載の装置。
【請求項11】
前記キャプチャーゾーン(10)は複数の突起(24)を有する底壁(22)を備えることを特徴とする、請求項1乃至10のいずれか1つに記載の装置。
【請求項12】
前記第1のキャプチャーゾンは突起を有し、前記突起(24)の高さは10μm〜400μmであり、前記突起(24)の表面は3×3μm〜80×80μmであることを特徴とする、請求項1乃至11のいずれか1つに記載の装置。
【請求項13】
前記第1のキャプチャゾーンは突起を有し、前記突起(24)は幅が50μm以下の空間(26)によって分離されることを特徴とする、請求項1乃至12のいずれか1つに記載の装置。
【請求項14】
前記第1のキャプチャゾーンは突起を有し、前記突起(24)は六角形または八角形の断面を有することを特徴とする、請求項1乃至13のいずれか1つに記載の装置。
【請求項15】
前記第1キャプチャーゾンは、官能基化された底面(22)および/または官能基化された突起(24)を有することを特徴とする、請求項1乃至14のいずれか1つに記載の装置。
【請求項16】
前記突起(24)の間の空間(26)に設けられたマイクロビーズ(28)をさらに備えることを特徴とする、請求項1乃至15のいずれか1つに記載の装置。
【請求項17】
少なくとも1つのキャプチャーゾーン(30)はキャビティ(32)と前記キャビティ(32)に配置されたマイクロビーズ(28)とを備えることを特徴とする、請求項1乃至16のいずれか1つに記載の装置。
【請求項18】
前記キャプチャーゾーン(10、30)内に設けられた前記マイクロビーズ(28)を保持する膜(36)を備えることを特徴とする、請求項16または17に記載の装置。
【請求項19】
前記マイクロビーズ(28)は官能基化されることを特徴とする、請求項16乃至18のいずれか1つに記載の装置。
【請求項20】
前記マイクロビーズ(28)の官能基化は、多数のタンパク質および小数のタンパク質に特有の少なくとも二つの異なる配位子を備えることを特徴とする、請求項19に記載の装置。
【請求項21】
前記官能基化は、シリル化官能基によって前記表面に固定された配位子の存在を備えることを特徴とする、請求項15、19、20のいずれか1つに記載の装置。
【請求項22】
組織(3)のマッピング方法であって、
組織内に請求項1乃至21のいずれか1つに記載のマイクロテクノロジーの装置(6)を配置し、
前記装置は複数の層状キャプチャーゾーン(10a−10d)を備え、1つのキャプチャーゾーン(10)はその表面の三倍以上の展開表面積を有し、
前記組織(3)は前記キャプチャーゾーン(10)と接触し、
サンプルを分析することを備えるマッピング方法。
【請求項23】
前記層状キャプチャーゾーン(10a−10d)を分離するように、前記装置(6)を区切ることを備える、請求項22に記載の方法。
【請求項1】
生体内生検手術において、生物学的対象となる分子の接触によるサンプリングのためのマイクロテクノロジーサンプリング装置(6)であって、
第二の面(16)の反対側に設けられた平面状の第一の面(14)と、前記第一の面(14)に設けられた少なくとも1つの第一キャプチャーゾーン(10)とを有する、マイクロテクノロジー基板の支持体(12)と、
操作ロッドと、
生検を受ける組織へのサンプリング装置の通路を規定するガイドスリーブ(2)と、を備え、
前記第一キャプチャーゾーンの展開表面積(S)は少なくともその表面(s)の三倍以上であり、
前記支持体は、前記操作ロッドの一端に配置され、サンプリングが前記第一キャプチャーゾーンにより行われ、
前記操作ロッドは、前記ガイドスリーブ内で摺動可能であり、
前記ガイドスリーブの直径は、前記操作ロッドの直径に略等しいことを特徴とするマイクロテクノロジーサンプリング装置(6)。
【請求項2】
前記操作ロッドは、前記マイクロテクノロジー基板と平行に延びることを特徴とする請求項1に記載の装置。
【請求項3】
前記ガイドスリーブは閉じられた先端を有することを特徴とする請求項1または2に記載の装置。
【請求項4】
前記ガイドスリーブは、前記キャプチャーゾーンが周囲媒体に接触して配置されることを可能にする窓を備えることを特徴とする請求項2または3に記載の装置。
【請求項5】
前記第二面(16)に設けられた少なくとも1つの第二キャプチャーゾーン(20)をさらに備え、
前記第二キャプチャーゾーン(20)の展開表面積は、その表面より大きいことを特徴とする、請求項1乃至4のいずれか1つに記載の装置。
【請求項6】
前記第二キャプチャーゾーン(20)の展開表面積は、その表面の三倍以上であることを特徴とする、請求項5に記載の装置。
【請求項7】
第一インターバルゾーン(18)によって分離された前記第一面(14)に設けられた複数の第一キャプチャーゾーン(10a〜10d)を備えることを特徴とする、請求項1乃至6のいずれか1つに記載の装置。
【請求項8】
第二インターバルゾーン(34)によって分離された前記第二面(16)に設けられた複数の第二キャプチャーゾーンを備え、
第一ゾーンのそれぞれは、1つの第二ゾーンの反対側に設けられることを特徴とする、請求項7に記載の装置。
【請求項9】
前記第一および第二インターバルゾーン(18、34)に設けられた前記キャプチャーゾーンを分離する分離手段(42、44、46)を備えることを特徴とする、請求項7または8に記載の装置。
【請求項10】
前記分離手段は、前記第一および/または第二面(14、16)に設けられた切り込みを備えていることを特徴とする、請求項9に記載の装置。
【請求項11】
前記キャプチャーゾーン(10)は複数の突起(24)を有する底壁(22)を備えることを特徴とする、請求項1乃至10のいずれか1つに記載の装置。
【請求項12】
前記第1のキャプチャーゾンは突起を有し、前記突起(24)の高さは10μm〜400μmであり、前記突起(24)の表面は3×3μm〜80×80μmであることを特徴とする、請求項1乃至11のいずれか1つに記載の装置。
【請求項13】
前記第1のキャプチャゾーンは突起を有し、前記突起(24)は幅が50μm以下の空間(26)によって分離されることを特徴とする、請求項1乃至12のいずれか1つに記載の装置。
【請求項14】
前記第1のキャプチャゾーンは突起を有し、前記突起(24)は六角形または八角形の断面を有することを特徴とする、請求項1乃至13のいずれか1つに記載の装置。
【請求項15】
前記第1キャプチャーゾンは、官能基化された底面(22)および/または官能基化された突起(24)を有することを特徴とする、請求項1乃至14のいずれか1つに記載の装置。
【請求項16】
前記突起(24)の間の空間(26)に設けられたマイクロビーズ(28)をさらに備えることを特徴とする、請求項1乃至15のいずれか1つに記載の装置。
【請求項17】
少なくとも1つのキャプチャーゾーン(30)はキャビティ(32)と前記キャビティ(32)に配置されたマイクロビーズ(28)とを備えることを特徴とする、請求項1乃至16のいずれか1つに記載の装置。
【請求項18】
前記キャプチャーゾーン(10、30)内に設けられた前記マイクロビーズ(28)を保持する膜(36)を備えることを特徴とする、請求項16または17に記載の装置。
【請求項19】
前記マイクロビーズ(28)は官能基化されることを特徴とする、請求項16乃至18のいずれか1つに記載の装置。
【請求項20】
前記マイクロビーズ(28)の官能基化は、多数のタンパク質および小数のタンパク質に特有の少なくとも二つの異なる配位子を備えることを特徴とする、請求項19に記載の装置。
【請求項21】
前記官能基化は、シリル化官能基によって前記表面に固定された配位子の存在を備えることを特徴とする、請求項15、19、20のいずれか1つに記載の装置。
【請求項22】
組織(3)のマッピング方法であって、
組織内に請求項1乃至21のいずれか1つに記載のマイクロテクノロジーの装置(6)を配置し、
前記装置は複数の層状キャプチャーゾーン(10a−10d)を備え、1つのキャプチャーゾーン(10)はその表面の三倍以上の展開表面積を有し、
前記組織(3)は前記キャプチャーゾーン(10)と接触し、
サンプルを分析することを備えるマッピング方法。
【請求項23】
前記層状キャプチャーゾーン(10a−10d)を分離するように、前記装置(6)を区切ることを備える、請求項22に記載の方法。
【図1】


【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図8】


【図9】




【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図8】


【図9】


【公開番号】特開2012−166041(P2012−166041A)
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2012−96156(P2012−96156)
【出願日】平成24年4月20日(2012.4.20)
【分割の表示】特願2007−553669(P2007−553669)の分割
【原出願日】平成18年2月2日(2006.2.2)
【出願人】(502124444)コミッサリア ア レネルジー アトミーク エ オ ゼネルジ ザルタナテイヴ (383)
【Fターム(参考)】
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成24年4月20日(2012.4.20)
【分割の表示】特願2007−553669(P2007−553669)の分割
【原出願日】平成18年2月2日(2006.2.2)
【出願人】(502124444)コミッサリア ア レネルジー アトミーク エ オ ゼネルジ ザルタナテイヴ (383)
【Fターム(参考)】
[ Back to top ]

