換気安定化技術
【課題】中枢性睡眠時無呼吸症(CSA)を減少させるシステムを提供する。
【解決手段】睡眠サイクルの期間中での患者の再呼吸を増加させるある方法が使用されている。過呼吸の期間での再呼吸を増加させることで、一般的には過呼吸期間から生じる過酸化を減少させ、よって補償する減呼吸期間を減少させ、中枢性睡眠時無呼吸症に関連するループゲインを有効に減少させることが可能である。鼻の閉塞及び漏れ耐性を有する口腔インターフェース24は患者のインターフェースからの気体の漏れを制御する。
【解決手段】睡眠サイクルの期間中での患者の再呼吸を増加させるある方法が使用されている。過呼吸の期間での再呼吸を増加させることで、一般的には過呼吸期間から生じる過酸化を減少させ、よって補償する減呼吸期間を減少させ、中枢性睡眠時無呼吸症に関連するループゲインを有効に減少させることが可能である。鼻の閉塞及び漏れ耐性を有する口腔インターフェース24は患者のインターフェースからの気体の漏れを制御する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、呼吸障害を処置する装置及び、呼吸障害の処置方法に関する。
【背景技術】
【0002】
中枢性睡眠時無呼吸症は、規則的かつリズムを有する神経活動のバーストを生成する睡眠時の脳がうまく機能しないことを特徴とする睡眠呼吸障害の一種である。その結果として生じるリズムを有する呼吸の中断、それは無呼吸と呼ばれる、は呼吸の速さ及び深さ、つまり肺呼吸全体、を規制する呼吸器制御系の障害を意味する。中枢性睡眠時無呼吸症は閉塞性睡眠時無呼吸症候群と対比されるべきである。閉塞性睡眠時無呼吸症候群において、無呼吸のおおよその原因は、継続して呼吸器系の筋肉へリズムを有する神経出力が発生しているにも関わらず、咽頭気道が障害を有するからである。中枢性睡眠時無呼吸症と閉塞性睡眠時無呼吸症候群との差異は明確に規定され、2つは同時に存在しうる。中枢性睡眠時無呼吸症は多くの薬が使用される状況で生じうるが、最も一般的に観察されるのは、心臓麻痺(心不全)又は脳血管不全に関連している場合である。中枢性睡眠時無呼吸症の一例にはチェーン・ストークス呼吸がある。
【0003】
呼吸器制御系は、二酸化炭素、酸素及びpHをセンシングする呼吸器系の化学受容器が適切に刺激されるときに中枢性パターン発生装置が活動のリズムあるバーストを発生させることを特徴とする負のフィードバックシステムを有する。呼吸器系筋肉への脳幹の中枢性パターン発生装置の神経出力は、基本的に中枢性パターン発生装置によって発生される神経リズムから導かれる一方で、動脈血PCO2及びPO2に関連するフィードバック信号が十分に強いとはいえない場合では、発生装置は沈黙する。換言すると、呼吸器系のリズムは、動脈血PCO2及びPO2をセンシングする末梢性化学受容器及び脳のPCO2/pHをセンシングする中枢性化学受容器を起源とする適切な入力刺激を必要とする、条件的中枢性パターン発生装置によって発生される。さらに、呼吸器系中枢性パターン発生装置によって発生する神経活動の強度は直接的に動脈血PCO2に依存し、動脈血PO2に反比例する。よって、中枢性及び末梢性の化学反射ループは動脈血PCO2及び動脈血PO2を調節する負のフィードバックシステムを形成し、これらの値を狭い限界の範囲内で一定に保持する(図1)。
【0004】
動脈血液気体のこの通常の調節は、呼吸器系の中枢性パターン発生装置の安定した換気出力によって実現される。それとは対照的に、中枢性睡眠時無呼吸症は呼吸器制御系の不安定さを意味する。その不安定さは2つの機構のうちの1つから生じうる。(1)呼吸器系の化学受容器によって適切に活性化されているにもかかわらず呼吸器系の中枢性パターン発生装置が基本的に機能しないこと、又は(2)呼吸器系の化学受容器による適切に活性化しきれていないこと、である。前者は“内在的不安定性(intrinsic instability)”、後者は“化学反射不安定性(chemoreflex instability)”と呼ばれる。理論的には、2つの機構は同時に存在しうる。中枢性睡眠時無呼吸症の一般的な形態は化学反射不安定性の機構に起因すると考えられる。
【0005】
呼吸の化学反射制御は不安定性を示すだろう。その理由は、負のフィードバック信号の遅延が過度に長いため、又は、システムのゲインが過度に大きいためである。現時点での証拠が示唆していることは、後者が、心臓麻痺(心不全)による中枢性睡眠時無呼吸症での主要なかく乱の主な要因であるということである。特に、動脈血PCO2の変化に対する制御系の全体的な応答については、中枢性睡眠時無呼吸症を有する心臓麻痺(心不全)の患者では、睡眠障害に伴う呼吸を有していない患者の3倍にもなる。この増加したゲインは中枢性化学反射ループに属しているものと思われるが、末梢性化学反射ループの大きなゲインであることも排除できない。従って、中枢性睡眠時無呼吸症の基本的機構は、制御系が大きなループゲインを取ることで、睡眠中でのフィードバック不安定性を引き起こすことである。
【特許文献1】米国特許公開第5645053号明細書
【発明の開示】
【発明が解決しようとする課題】
【0006】
中枢性睡眠時無呼吸症は繰り返しの覚醒及び酸素ヘモグロビンの不飽和化を引き起こす。たとえ中枢性睡眠時無呼吸症と疾患率及び死亡率とを結びつける確かな証拠が不足しているとしても、様々な証拠資料によって、中枢性睡眠時無呼吸症が心臓不整脈、発作又は心筋梗塞を促進する恐れがあるということが推測される。夜間での覚醒が繰り返されることは、日中の認識機能及び生活の質に悪影響を及ぼしがちである。中枢性睡眠時無呼吸症に対する有効な処置はまだ確立されていない。テオフィリンのような薬を勧めるのは有用だろうし、カーボニックアンヒドラーゼ抑制剤は中枢性睡眠時無呼吸症をかなりの程度で正常睡眠に和らげることが可能だろう。経鼻的持続陽圧呼吸療法は直接的又は間接的に換気安定性を改善することが可能である。吸い込まれた気体中の酸素分比(F)が増加しても一般的には中枢性睡眠時無呼吸症は排除されないが、吸い込まれたFCO2(FCO2=0.01〜0.03)が増加すると即座に中枢性睡眠時無呼吸症は排除される。しかし、高FCO2環境に長時間おくのは長期の治療として望ましくないだろう。
【課題を解決するための手段】
【0007】
本発明は、中枢性睡眠時無呼吸症の呼吸器サイクルのある期間での制御された再呼吸量を使用して肺の気体交換の効率を変化させることで、肺及び動脈血中の二酸化炭素及び酸素レベルでの過渡的に過度となった換気効果に対抗する。実際には、この計画はフィードバック変数における振動を最小化することで呼吸を安定化させるという試みである。そのような用途での再呼吸装置を有効に使用するために、漏れ耐性を有する患者インターフェースを使用する。このインターフェースは鼻及び口の通路のうちの1つを遮断し、口腔器具及び経鼻閉塞装置を含むのが好ましい。
【0008】
本発明は、呼吸器制御系のループゲインを減少させることで中枢性睡眠時無呼吸症による周期的呼吸に対抗する。過呼吸直前又は過呼吸期間の最中において、二酸化炭素の吸入量を増加させ、酸素の吸入量を減少させるのに再呼吸を使用することが可能である。1つの実施例では、中枢性睡眠時無呼吸症呼吸の換気サイクルが検出され、再度吸い込まれた吐出気体の量を変化させることで適切に吸入した二酸化炭素及び酸素濃度を調節できるように、患者の換気は連続的に監視され、リアルタイムで分析される。再呼吸装置は経鼻的持続陽圧呼吸療法(CPAP)システムの一部であって良い。
【0009】
中枢性睡眠時無呼吸症の呼吸器サイクルの一部の最中において制御された再呼吸を可能にするように、従来のCPAPシステムは本発明の1つの実施例では修正されている。この実施例では、バルブは再呼吸量の制御に使用される。バルブが閉じられているときには再呼吸が起こり、バルブが開いているときには再呼吸は起こらない。流量計に接続されているコンピュータは中枢性睡眠時無呼吸症の呼吸器サイクルの期間を検出するのに使用することが可能である。コンピュータは制御してバルブを開閉することが可能である。口腔器具と組み合わせられた経鼻閉塞は制御された再呼吸を得るのに使用可能である。本発明をさらにまとめたものについては以下の詳細な説明及び請求項を参照することで得ることが可能である。
【実施例】
【0010】
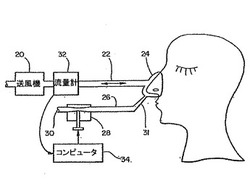
図2は本発明の再呼吸器の1つの実施例を図示している。この実施例では、送風機20、管22及び患者とのインターフェース24を含む経鼻的持続陽圧呼吸療法用装置が使用されている。口腔インターフェース及び経鼻閉塞装置を有する患者とのインターフェース24は、経鼻的持続陽圧呼吸療法処置で使用するのに気密性の堅いシールを顔に形成する。経鼻的持続陽圧呼吸療法及び好適な経鼻的持続陽圧呼吸療法用装置に関する議論は特許文献1で説明されている。従来のCPAPでは、送風機はマスク内で比較的高い一定圧力を保持する、かつ、送風機から新鮮な空気のバイアス流をマスクの外へ送り出すのに使用される。
【0011】
本発明の1つの実施例では、管26は患者インターフェースの排出部分31と接続し、気体を可変レジスタ28へ送り込む。あるいはその代わりに、バルブは患者インターフェースの排出部分上に設けて良い。管22は中枢性睡眠時無呼吸症呼吸のあるサイクルの最中で再呼吸するためのデッドスペースとして使用される。バルブ28が開いているとき、再呼吸は起こらない。その理由は、すべての排出気体は吸入が起こる前にバイアス流によって管26を通って、バルブ28を介して排出されるからである。バルブ28が閉じられているときにはバイアス流は消え、管26を介して空気が吸い込まれないからである。この場合、部分的な再呼吸が生じる。その理由は、吸い込まれた空気が管22を逆行して送風機へ向かうからである。管26中の気体は室内の空気よりも高い二酸化炭素濃度及び室内の空気よりも低い酸素濃度を有する。患者が吸入するとき、気体は送風機から患者へ送られ、それまでに吸い込まれた気体は患者によって排出される。
【0012】
通常、送風機から患者インターフェースを介して排出ポート30へ送り出される気体のバイアス流は、患者によって吐き出された気体は系内には残らないように、呼吸サイクルの呼気段階で系を完全に浄化するのに適している。よって、患者によって吸い込まれる気体は室内の空気の組成(O2濃度21%;CO2濃度約0%)を有する。反対に、バルブ28によってポート30が完全に閉塞されることでバイアス流が0に減少する場合、患者によって排出される気体は患者インターフェースと送風機とを接続する管22を満たす。そのような吐き出された気体は典型的には5%の二酸化炭素濃度及び16%の酸素濃度を有する。吸入では、患者は最初に管を満たす高二酸化炭素、低酸素混合気体を吸入し、それに続いて送風機からの室内空気を吸入する。管の長さに依存して、この混合物は1回の換気量の20%〜60%の再呼吸に匹敵する。排出ポートの流出抵抗を変化させることで、これらの限界間の再呼吸の程度は変化させることが可能であり、吸入される二酸化炭素濃度及び酸素濃度は操作可能である。1つの実施例では、コンピュータ34に接続する流量計32は送風機20から送られてくる気体の流れ及び送風機20へ送られる気体の流れを検出するのに使用される。コンピュータ34は中枢性睡眠時無呼吸症の呼吸によって引き起こされる肺の換気の周期性を特定すること、及び、中枢性睡眠時無呼吸症サイクルのある期間中での再呼吸を引き起こすバルブ28を制御するのに使用される。
【0013】
送風機からの気体流はバイアス流(患者インターフェースの排出流+漏れ流)に加えて呼吸器の空気流を有する。コンピュータはこの流れを監視し、バイアス流、漏れ流、逆流(retrograde flow)、逆排出容積(retrograde expired volume)及び洗浄容積(wash volume)を計算する。
【0014】
コンピュータ34は中枢性睡眠時無呼吸症サイクルの振幅を検出し、それに従ってバルブの抵抗を調節することが可能である。たとえば、中枢性睡眠時無呼吸症サイクル最中に肺換気の大きな変化がある場合、バルブ28は過呼吸の期間では完全に閉じることが可能である。中枢性睡眠時無呼吸症サイクル最中に肺換気の変化が小さい場合、過呼吸期間ではバルブ28は部分的に開いた状態であって良い。よって、中枢性睡眠時無呼吸症サイクルでの肺換気の変化が大きいときに起こる再呼吸は、中枢性睡眠時無呼吸症サイクルでの肺換気の変化が小さいときに起こる再呼吸よりもより高レベルである。
【0015】
CPAP送風機20のインピーダンスが低いため、流出ラインでの抵抗変化はほとんど患者インターフェース圧力に変化を生じさせない。従って所望のCPAP患者インターフェース圧力に大きな変化を設けることなく、流出抵抗を十分な範囲で変化させることが可能である。
【0016】
流量計32及びコンピュータ34は肺換気のレベルを定量することが可能である。たとえば、呼吸容積と呼吸期間との比から瞬間的な肺換気のレベルがどの程度であるかが分かる。平均吸入流速度の平均又はピークのような他の指標を使用することも可能である。
【0017】
図3は、中枢性睡眠時無呼吸症呼吸中の過呼吸及び減呼吸のサイクルを理想化した図である。この図は、換気の平均移動時間と比較した過呼吸領域50a及び減呼吸領域50bを図示している。コンピュータシステムは中枢性睡眠時無呼吸症呼吸のサイクルを決定することが可能である。典型的には、中枢性睡眠時無呼吸症での過呼吸及び減呼吸には約50秒−60秒のサイクルがある。
【0018】
中枢性睡眠時無呼吸症を排除するため、バルブ28を使用して再呼吸の程度及びタイミングを制御する多数の方法が使用されている。中枢性睡眠時無呼吸症呼吸を減少させるために再呼吸を制御する1つの方法は、中枢性睡眠時無呼吸症呼吸でのそれぞれ異なるサイクルを予測することである。たとえば図3を見ると、時間Aでは、システムは過呼吸サイクルを予測し、よって図2で図示されているようにバルブ28を閉じることで再呼吸を開始する。再呼吸部50aが発生するまでには、ある程度のレベルの再呼吸が存在する。このため、過呼吸サイクル中での肺の気体交換は非効率的で、それによって生じる肺の酸素上昇及び肺の二酸化炭素減少は小さい。その結果、血液中の酸素レベルは高くなりすぎず、二酸化炭素レベルは低くなりすぎない。これにより、動脈血中の酸素分圧及び二酸化炭素分圧は安定し、引き続き生じる減呼吸の振幅又は無呼吸の長さは減少する。時間Bでは、システムはバルブ28を開くことで事前に減呼吸サイクルを見越し、再呼吸はこれ以上起こらない。本発明の装置は中枢性睡眠時無呼吸症(線50)を図3の破線60で図示しているような低レベルへ減少させることが可能である。再呼吸の開始時間及び終了時間である時間A及び時間Bは図2で図示されているコンピュータ34によって決定することが可能である。
【0019】
図4Aは本発明で使用される受動的ループゲイン変調システムを図示している。図4Aは、入力管62及び患者インターフェース64に接続する空気送風機60のような気体供給手段を使用したシステムを図示している。このシステムは患者インターフェース用の単一の固定された出力ポートを使用する。閉塞性睡眠時無呼吸症候群で通常使用されるものよりも大きな管容積を本発明で使用して良い。たとえば、6フィートの管よりはむしろ10フィートの管を使用して良い。送風機60は非常に低いインピーダンスを有することが好ましい。つまり、空気流の変化は送風機によって供給される空圧を大きく変化させない。これにより、たとえ管の流れが逆流になっても、比較的安定した患者インターフェースの圧力を保持することが可能となる。
【0020】
加えて、1つの実施例では、空気送風機は、4cmより下になる(2cm以下になるのが好ましい)水圧を供給するように調節することが可能である。そのような小さな圧力を供給する能力により、前述の逆流が可能となる。患者インターフェースは患者の通気口について適合している。通常呼吸の間、送風機60から供給され、管62を通って患者インターフェース64に供給される空気は再呼吸を生じさせない。その理由は、次の吸い込み期間前に如何なる吐出空気も除去(flush)されるからである。激しい呼吸の最中、十分な排出空気流が管へ逆流するように所定の気体流圧力は設定される、その際、次の吸入期間中にある程度の吐出気体が再呼吸される。この実施例では、過呼吸は中枢性睡眠時無呼吸症に関連する睡眠サイクルのある期間で起こる。中枢性睡眠時無呼吸症の期間中での再呼吸は、血中酸素レベルでのスパイクを減少させる傾向にある。よって、中枢性睡眠時無呼吸症において過呼吸に続いて生じる減呼吸の期間もまた減少する。
【0021】
交互の減呼吸及び過呼吸期間は、過呼吸期間中に起こる再呼吸によって減少する。再呼吸は動脈血酸素スパイク及び過呼吸によって引き起こされる動脈血PCO2の減少を減衰させる。よって、血液が化学受容器に到達するときに低換気状態が存在する。よって、周期的呼吸の振幅は減少する。
【0022】
図4Aの実施例は、従来のCPAPを使用したときよりも所定の気体流圧力が低い、かつ/又は、従来のCPAPを使用したときよりも患者インターフェースの排出孔が小さい、という点で、従来のCPAPとは異なる。典型的なCPAP気体流圧力からの気体流圧力を減少させることで、かつ/又は、患者インターフェースの排出孔を減少させることで、過呼吸期間中の逆流は生成される。
【0023】
図4Aのシステムは、送風機圧力の能動的制御を必要としないという利点を有する。睡眠の中心状態で患者をチェックすることが可能であり、適切な送風機圧力及び患者インターフェース排出孔サイズが設定される。その後、システムは、高価な制御装置に基づくシステムを必要とせずに毎晩患者の通気口に設けることが可能である。所定の送風機圧力は、排出孔64、通常の排出圧力及び過呼吸排出圧力によって引き起こされる空気流抵抗に依存する。気体供給圧力システムが空気送風機60である場合、空気送風機の1分あたりの回転数を調節することで所定の気体流圧力を設定することが可能である。
【0024】
中枢性睡眠時無呼吸症であるが閉塞性睡眠時無呼吸症候群ではない患者の空気供給圧力は4cmより下の水圧のような比較的低いレベルでの設定が可能である。通常の患者インターフェースの排出孔はこれらの圧力で所望の効果を生じさせる。呼気終末のFCO2及び吸入されたFCO2を、患者インターフェースと接続する吸引線を有するCO2流量計によって監視することが可能である。重要なこととしては、排出気体を管62へ送り出すために、漏れ耐性を有する患者インターフェースを使用することですべての口腔漏れは排除されなくてはならないことである。これは、あごひもを使用する、又は、上の歯及び下の歯、若しくは両方の歯に使用される口蓋弓の歯科器具のような口腔器具25を使用することで実現される。困難な鼻の漏れに対する代替的アプローチは、口だけでなく鼻をも覆う全面マスクを使用することである。これは、鼻又は口から排出される気体は管62患者インターフェースと患者との間の漏れを最小化することは重要だが、患者の排出空気をできる限り保存し、再呼吸に利用できるようにすることもまた重要である。従って、患者インターフェースが鼻と接続する場合には、口の通路は遮断されなくてはならず、患者インターフェースが口と接続する場合には、鼻の通路が遮断されなくてはならない。いずれの場合でも、使用していない通路の漏れは最小限にしなくてはならない。
【0025】
口腔器具25の例については図2B及び図2Cで詳細に図示されている。図2Bでは、口腔器具25は歯科器具である。図2Bでは、口腔器具25は歯の内部で適合するように設計されており、唇と患者の歯との間で適合する上部トレイ25A及び、歯科器具を唇に固定させる面を提供する下部トレイ25Bを有する。図2Bの口腔器具25中心部の開口部25CはCPAP圧力を伝達するためにCPAPホースコネクタとやり取りをする。図2Cの口腔器具25は、歯を使用することなく、唇の上で直接患者の口と適合する。図2Cの口腔器具は、患者の通路で適合するマスク27によって患者上で保持され、紐及びパッド29Aを使用して患者頭部の後方で固着される。遮断された通常のバイアスポート29C及び低流バイアス流ポート29Dを有する管29BはCPAP接続29Eを介してCPAP装置と接続する。管29Bの長さは再呼吸量の制御を可能にする。
【0026】
本願書類で説明されている技術行為のモードにおける特徴は過換気期間でのシステムの振る舞いに関する。そのような過換気状態(phase)が発生するとき、患者は大きな1回換気量及び短い期間での排出を生じさせる。それと共に、これらは排出気体の再呼吸を誘起する。その気体は、CPAP送風機を口腔器具のような患者インターフェースに接続するCPAPパイプ29Bへ逆に流れる。自宅内で夜間に低流CPAPを使用する、中枢性睡眠時無呼吸症患者は、過換気中では、吐出気体の再呼吸が無意味になるほどの鼻の漏れが生じうるということが分かるだろう。そのような患者については、歯科器具25を使用するのが好ましい。歯科器具はCPAP圧力を、経鼻閉塞している患者の口に与える、鼻からの漏れを排除するため。歯科器具及び経鼻閉塞を使用した患者に関する研究データは、治療は中枢性睡眠時無呼吸症の解決には有効であること、及び、深呼吸状態(phase)では、吐出気体が発生しないということが分かるだろう。低流CPAPを有効に応用するには、口腔器具25のような口腔界面は経鼻閉塞と組み合わせて使用されるべきである。経鼻閉塞は、鼻孔中又は水泳選手が使用するのと同様な、外部U字クランプ29F中に挿入されたプラグを介して得ることが可能である。
【0027】
患者が閉塞性睡眠時無呼吸症候群の要素を有する場合、患者インターフェース圧力は、上部通路の障害物を示唆する証拠がすべて除去されるまで徐々に増加する。患者が心臓麻痺(心不全)処置として経鼻CPAPを受ける場合には、患者インターフェース圧力波所望のレベル(典型的には8cm〜10cmの水圧)に設定される。バイアス流は、中枢性睡眠時無呼吸症がデッドスペースを加えることなく排除されるまで減少させて良い。
【0028】
心臓の病気を抱える患者にとっては、患者インターフェース圧力は文献で示唆されている値(典型的には10cmの水圧)に設定して良い。そこでバイアス流は調節される。
【0029】
管62を介した流は送風機圧力(つまり送風機流出時の圧力)と患者インターフェース圧力との圧力差に依存する。送風機圧力は送風機の1分あたりの回転数(RPM)で設定され、送風機の内部インピーダンスは非常に小さいので近似的に一定である。呼吸器の空気流が生じないとき(つまり排出終了時)、患者インターフェース圧力は送風機圧力よりもある量だけ小さくなる。ある量とは、接続管の流耐性特性及びバイアス流速度に支配される。これは典型的には、バイアス流が0.5L/sec〜1.5L/secでの1cm〜2cmの水圧差である。患者インターフェースが患者に適用され、患者が呼吸するとき、患者インターフェース圧力は呼吸サイクル中に変化する。患者インターフェース圧力は接続管の流耐性特性及び患者が発生させる空気流に依存する。吸入中、患者インターフェース圧力は落ち込み、典型的には水1cm〜2cm、吐出圧力は過渡的にインターフェース圧力の落ち込みと同程度に上昇するだろう。穏やかに呼吸している最中では、患者インターフェース圧力のピーク間での変動は激しい呼吸又は過呼吸最中での値よりも小さい。
【0030】
よって穏やかな呼吸中では、患者インターフェース圧力は吐出中に上昇し、これにより送風機と患者インターフェースとの間の駆動圧力差が減少し、それによって管内の流が減少する。排出される1回換気量が増加する場合、しかし排出流ピークは増加し、これが患者インターフェース圧力のさらなる増加に結びつく。患者インターフェース圧力が送風機圧力に等しくなるまで増加する場合、管内の流は停止する。患者インターフェース圧力が送風機圧力を超えるとき、管内の流は逆方向となる、つまり患者インターフェースから送風機へとなる。そのような逆向きの空気流は最初吐出初期で生じ、接続管へ移動する空気容積は吐出時に後で浄化され(wash out)、患者インターフェース圧力は減少し、送風機から患者インターフェースへの流れは増加する。しかし、バイアス流が小さく、かつ1回換気量が大きい場合、多量の逆流が発生し、多量の吐出気体が管内へ移動する。バイアス流は小さいため、管を洗浄する押し出し流は小さい。そのような場合、すべての逆流容積が次の吸入前に押し出されるわけではない。その結果として、全吸入気体の酸素濃度はある程度減少し、二酸化炭素濃度はある程度上昇する。
【0031】
図15から図17は送風機と患者インターフェースとの間の管内の流れを図示している。図15は、従来のCPAPシステムの管内での空気流呼吸を図示している。吐出部中では、送風機から患者インターフェースへの流は常に、管内で逆流が生じないように、吐出圧力を上回る。これは典型的には、空気送風機圧力及び吐出ポート抵抗を、患者インターフェース外へのバイアス流は相対的に大きく、逆流の可能性は回避されるように設定することで行われる。この正常流は中枢性睡眠時無呼吸症に関連する過呼吸においてさえも生じる。
【0032】
図16及び図17は、本発明のシステム内での呼吸の効果を図示している。ここで、送風機圧力及び患者インターフェースの吐出孔から外へ出るバイアス流は、中枢性睡眠時無呼吸症に関連する過呼吸期間中に逆流が生じるように設定される。
【0033】
図16は正常呼吸が行われている状況を図示している。正常呼吸の場合でさえも、ある程度の逆流が周期202で存在する。吐出期間後半では、逆容積は、期間204で生じる正常流によって管から押し出される。よって、正常呼吸期間中に再呼吸は生じない。本発明のシステムは正常呼吸期間中にデッドスペースを付加しない。これは、デッドスペースを加えることで血流に供給される二酸化炭素濃度が上昇するので重要である。増加する二酸化炭素レベルが複数日持続する場合、人体は望ましくない方法による内部フィードバックによって再調節するものと推定されている。
【0034】
図17は本発明の装置とともに過呼吸を示す実施例を図示している。図17の実施例では、過呼吸は、逆流する吐出気体が存在するようなものである。逆流する吐出気体は次の吸入時には管内に残る。これは、結果として高濃度の二酸化炭素濃度を有する吐出気体を再吸入することを意味する。図17では、初期の吐出気体領域206は吐出気体領域208よりも大きいことに留意すべきである。
【0035】
本発明の1つの実施例では、通常呼吸の逆流容積及び洗浄容積は本発明の動作設定に使用することが可能である。1つの実施例では、逆容積領域202は通常呼吸での洗浄流領域204のサイズの1/2でなくてはならない。肺換気と患者インターフェースとの比較、及び/又は、洗浄時間と吐出期間との比較のような他のわかりやすい(thumb)規則もまた、本発明のシステム動作の設定に使用することが可能である。
【0036】
図4Bは、図4Aの装置にコンピュータ67及び流量計69を付け加えたものを図示している。流量計69は、管62内で所望の空気流を検出するのに使用される。過呼吸期間で逆流が存在し、それ以外の期間では逆流が存在しないように送風機を調節することが可能である。図4Bの装置は、各患者用の図4Aの装置の校正に使用することが可能である。
【0037】
図18A及び図18Bは、患者インターフェース吐出口サイズが夜になるとゆっくりと変化することを特徴とする実施例を図示している。この実施例では、送風機210は選択された圧力で空気流を供給する。流量計212は管214と接続する。管214は、管214内の流が、肺容積、バイアス流及びそれに類するものを含むシステムの付加的パラメータに従って決定されることを可能にする。プロセッサ216は、可変空気抵抗装置218を使用することで排出孔サイズをゆっくりと変化させる。図2のシステムとは違い、可変出力抵抗装置218は夜間にゆっくりと調節される。
【0038】
図18Bを見ると、患者が閉塞性睡眠時無呼吸症候群及び中枢性睡眠時無呼吸症を有する場合、夜になったばかりのときには、出力バルブは比較的大きく設定することが可能であり、患者インターフェースの外へ出るバイアス流を増大させ、管214への如何なる逆流の効果をも減少させる。一旦、閉塞性睡眠時無呼吸症候群が減少すると、バルブ径はゆっくりと減少し、中枢性睡眠時無呼吸症における過呼吸期間に管214への逆流を増加させることで、中枢性睡眠時無呼吸症を減少させる再呼吸を引き起こすことが可能となる。患者インターフェースのバルブ開口部の付加的調節は、プロセッサ216による計算に基づいて行うことが可能である。
【0039】
図5は送風機70が動的に制御されていることを特徴とする本発明の実施例である。流量計72は管74中の送風機70と患者インターフェース76との間に設けられている。流量計はまた、患者の顔の近くに設けられても良い。図5のシステムでは、コンピュータ制御によって睡眠サイクルのある期間での送風機圧力を減少させることが可能である。よって、激しい呼吸期間中では、送風機圧力を減少させることが可能で、それによって逆流及び再呼吸は促進される。この実施例は、患者インターフェース圧力変化による混合効果のため、利点があるとは言えない。送風機70によって供給される気体供給圧力を調節することで、管74への逆流は、所望通りに増加及び減少させることが可能である。
【0040】
図6は本発明の別な実施例である。この実施例では、患者インターフェース82は、コンピュータ制御の2つのバルブ86及び88によってデッドスペース84と接続している。睡眠サイクルのある期間での再呼吸量は、バルブ86及びバルブ88を開閉してバイアス流を変化させることで調節可能であり、それによって中枢性睡眠時無呼吸症は減少する。
【0041】
図7は再循環器90を使用した実施例である。睡眠サイクルのある期間では、再循環器90は吐出空気を引き出し、再循環させて患者インターフェース92でユーザーに供給する。このようにして、中枢性睡眠時無呼吸症は、睡眠サイクルの選択された期間において再呼吸を増大させることで減少させることが可能である。
【0042】
本発明の1つの実施例は、経鼻的持続陽圧呼吸(CPAP)療法に適用される。負のフィードバック呼吸器制御系のループゲインは主として外部デッドスペース(VED)、すなわち吸入及び吐出中に気体が通る(conduct)共通の気道、の増加によって減少する。外部デッドスペースは肺の気道を有する内部デッドスペース(VID)及び上部気道を拡張する。全デッドスペース(VD)は内部デッドスペースと外部デッドスペースとの和に等しい。
VD=VED+VID (式1)
この容積は制御系に必然的に発生する非効率さを表す。その非効率さとは、肺内部の気体交換に関わる1回換気量を減少させることである。詳細には、1回換気量は2つの成分の和で表される。
VT=VD+VA (式2)
ここでVAは1回換気量における“肺胞”による換気、すなわち呼吸器の気体交換にかかわる容積、を表す。また、VE、VA及びVDを積f・VT、f・VA及びf・VD(fは呼吸器の周波数を表す)とすると、VE=VA+VDとなる。呼吸器制御システムの負のフィードバックループ(図1)では、VEは呼吸器の中枢パターン発生装置の出力を表し、VAは動脈血気体圧力に影響を与える変数である。VEとVAとの関連は当然のことではあるが、ループゲインの動的制御を操作する基本変数VDである。
【0043】
患者がCPAP用装置を介して呼吸するときに、再呼吸容積の動的制御は実現される。従来のCPAP装置を使用するとき、鼻は、ある長さの管によって圧力発生源と接続するマスクで覆われている。鼻を覆うマスクには連続的に気体が流れる。気体は圧力発生源から流入し、マスクの排出ポートから流出する。これはバイアス流(VB)と呼ばれる。従来の用途、すなわちOSAの処置にCPAPを使用するときには、鼻からマスクへ流入する擬似的にすべての吐出気体がマスクへ流入し、排出ポートから流出するように、排出流速度は比較的大きくなる。VBが比較的大きいため、次の吸入が起こる前にマスクは完全に洗浄される。よってマスクから吸入される気体は送風機から流入する気体と同一の組成を有する(典型的には室内の空気で、F|O2=0.293;F|CO2=0.0003)。このような状況、典型的なOSA処置の状況だが、鼻を覆うマスクは外部のデッドスペースを必要としない。本発明は、小さなVBの値を使用することでVEDを動的に増加させ、これにより、続いて動的にVA(式2)を減少させる。よって、気体交換に有効な肺の換気の成分(component)、すなわち肺胞の換気(VA)は経時変化する。VAがフィードバック変数、動脈血PO2及び動脈血PCO2の値を決定するので、VDは直接的にループゲイン(図1)に影響する。よって、システムのループゲインは以下のように操作することが可能である。
↓VB→↑VED→↓VA→↓L.G. (式3)
ここで重要なのは後述するように、VEDの増加は大きく呼吸する期間でのみ生じるということである。よって、通常呼吸では、システムにデッドスペースを加える必要はない。
【0044】
第2の計画として、本発明はCPAP圧力の変化を利用して肺の容積を変化させ、それによって呼吸器制御システムのループゲインに影響を与える。特に、肺胞の換気が動的に変化するときに、フィードバック変数(動脈血PCO2及び動脈血PO2)の動的変化が減少することで、肺容積の増加でループゲインが減少する。同様に、そのような肺容積の増加は呼吸器筋肉の吐出終端部の長さを減少させる。それにより、吸入中での力の発生を減少させる。それと共に、CPAPの両方の効果はループゲインを減少させる。CPAP圧力が周期的な呼吸サイクルと同期して動的に変化するとき、両方の効果はループゲインを変調させる。しかし経験上、1cm〜10cm水圧のCPAP圧力範囲で、これらはVDを変化させるときよりもループゲインを小さく減少させる。加えて、VDの動的変化はCPAP圧力の変化よりも眠っている人を妨害しにくい。従って、CPAP圧力を増加させることで肺容積を減少させ、それによってループゲインを減少させるのは本発明の補助的計画を表す。
【0045】
中枢性睡眠時無呼吸症を患っている又は中枢性及び閉塞性睡眠時無呼吸症を併発している患者は、顔に密閉されたCPAP患者インターフェース(図2、図4A、図4B、図5、図6及び図7)を使用して眠る。口からの漏れ、もし存在するのであれば、たとえば経鼻閉塞と組み合わせた口腔器具で排除される。これが適切ではない場合には、患者インターフェースを、口及び鼻の通路のうちの1つを遮断する全面マスクに置き換える。患者インターフェースは管によって低インピーダンスの送風機の陽圧の排出口と接続している。1つの実施例では、典型的には管は2cm〜3cmの直径で、1.5mの長さを有する。バイアス流は、固定されていてサイズ選択可能な開口部(図4A、図4B、図5、図6及び図7)を通って、又は、コンピュータ制御の可変レジスタ(図2)と接続する、1つの実施例(2cm〜3cmの直径で、1.5mの長さを有する)での管を通って患者インターフェースから流出する。そのようなシステムでは、患者インターフェース圧力は送風機RPMによって決定され、バイアス流VBの速度は患者インターフェース圧力及び患者インターフェース排出口抵抗の結果として得られる。図2及び図4Bで図示された装置は送風機からの流を測定する呼吸流量図を含む。この装置は初期滴定又は夜間治療に適している。また、CO2メーターには患者インターフェースと接続するサンプリングカテーテルを付加して良い。これにより、呼気終末(end−tidal)及び吸入されたFCO2の監視が可能となる。図4Aに図示された装置は図4Bで図示された装置の単純なバージョンであって、夜間の使用に適している。
【0046】
動的に可変なバイアス流装置(図2)は、患者インターフェースの圧力をほとんど変化させずにバイアス流の経時調節を行うことが可能である。排出レジスタは、睡眠ポリグラフ調査中の独立した観測者によって制御されて良く、又は、コンピュータアルゴリズムによって自動制御されても良い。外的デッドスペース容積(VED)の制御は、排出レジスタを一定にして受動的に、又は、排出レジスタを時間変化させることで能動的に調節される。受動的調節の実装では、固定された排出開口部が使用されるため、バイアス流は時間的に一定である。能動的調節では、バイアス流レジスタの抵抗が変化するため、バイアス流は時間変化する。
【0047】
図8は、送風機と患者インターフェースとを接続する管に記録された空気流を図示している。正の値は送風機から患者インターフェースへの空気流を表し、負の値は患者インターフェースから送風機への空気流を表す。前者は、患者インターフェースからの吐出気体を排除するため、“洗浄”空気流と呼ばれ、後者は、CPAP管理中に通常生じる空気流の流れとは反対であるため、“逆”空気流と呼ばれる。図8A(上側)で図示されているように、管中の空気流は2つの空気流、VBと呼吸器空気流、の和に等しい。前者は一定で、後者は呼吸器サイクルに対して変化する。吸入空気流はVの上側歪みを生成し、吐出空気流はVの下側歪みを生成する。吐出終了時(図8Aの上側矢印)では、呼吸器空気流はゼロに等しくなり、管の空気流はバイアス空気流に等しくなる。この例では、バイアス空気流は1.0L/secに選択されている。ピークの吐出空気流は吐出初期(図8Aの下向き矢印)に生じ、この例では1.0L/secに等しい。このとき、ピークの排出空気流はVBに等しくなるため、管の空気流はゼロとなる。
【0048】
図8A、図8B、図8C、図8D、図8E及び図8Fは、VBが1.0L/sec(図8A)から0.15L/sec(図8F)まで徐々に減少するために生じる管の空気流変化を図示している。呼吸器空気流は全体を通して一定に保持されている。VBが1.0L/secから0.5,0.35,0.25,0.2及び0.15L/secまで減少するので(図8A、図8B、図8C、図8D、図8E及び図8F)、逆空気流は吐出中に現れ、徐々に大きくなる。吐出時、逆に移動する空気の容積(Vret、斜線領域)はVBが減少するに従って徐々に増加する。逆に吐出時、送風機から患者インターフェースへ移動する空気の容積(Vwash、小さな斑点で覆われた領域)は、VBが減少するに従って減少する。
【0049】
患者インターフェース内及び吐出終了時(図8Aの下向き矢印)での管内に存在する空気容積は残留容積(VR)と呼ばれる。VRはVretとVwashとの差と推定して良い。
VR=Vret−Vwash (式4)
図8で図示されている最初の5例では、VRは負の値又はゼロに等しい(図8A、図8B、図8C、図8D及び図8E)。それは、このような呼吸器パターンでは、付加されるデッドスペースが存在しないことを意味する。しかし、肺換気が増加すると仮定すると、Vretは増加し、VRは正の値になる。同様に、吐出期間(Te)が減少すると、Vwashは減少し、VRは正の値になる。動脈血PCO2の増加及び動脈血PO2の減少によって呼吸が促進されるとき、1階換気量は増加し、Teは減少する。従って、VBが比較的小さい場合(この例では0.35及び0.25)、化学的刺激は、より高レベルの肺換気がより大きなVRの値と連携するようにVRが正の値を取るようにする。
【0050】
VRが正の値を取るということは、VEDが有限の値であることを意味する(図8F)。しかし、VRはVEDとは等しくない。吸入中、患者インターフェース内及び管内に存在する気体は特に2つの場所のうち1つの場所へ流れる。それは排出ポートへの流出、又は呼吸器管への流入である。後者のみがVEDを構成する。従って、VRの一部が吸入される。VRの比は吸入流速度に対するVBの値に依存する。大きな値のVBを使用することでVEDを最小化させる。よって、呼吸の化学的刺激は呼吸器パターンに3つの変化をもたらす。1つ目は吐出空気流速度の増加、2つ目はTeの減少、そして3つ目は吸入空気流速度の増加である。各変化は引数VEDに対して独立して振る舞う。それと共に、VBが比較的小さい場合にVEが化学的刺激によって増加するとき、3つの変化はVEDの急上昇を引き起こす。図8Bは、管及び患者インターフェースが新鮮な室内空気によって洗浄(flush)されるときの吐出時間を図示している。この時間はTeの比として表され、TFRACと呼ばれている。TFRACはVBの減少に伴って徐々に増加する。TFRACが100%に等しいとき、VBの臨界値に到達し、さらなるVBの減少によって有限のVEDの値を発生させる。
【0051】
VEDを計算するため、以下の関係を使用する。
VED=VR−(VB)(t) (式5)
ここでtは図9で図示されているように、VRが患者インターフェース及び気体が通る管から排除されるのに必要な時間と定義される。VEDは吸入時間をゼロから徐々に増加させ、吸入容積VSUM及び吐出ポート容積を計算することで計算可能である。つまり、以下の式を使用するということである。
【0052】
【数1】

ここで、VIは吸入流速度、つまり全流から吸入時のバイアス流を引いた速度である。増加手段は、VSUMがVRに等しくなるまで続けられる。
【0053】
図9A、図9B、図9C及び図9Dは、肺換気が動脈血PCO2の増加によって刺激されるときに生じるVret及びVEDの変化を図示している。VBはすべての場合で0.25L/secに等しいと推定され、とどまる場合のVA(5.7L/min)の約2倍である。図9Dは刺激を受けない状態、すなわちとどまる条件(VE=8.0L/sec)での呼吸器パターンを図示している。換気が緩やかに刺激されるとき(VE=15.0L/sec、図9A)、VEDが0.26Lに等しくなるように、Vretは増加し、VEDは減少する。呼吸をさらに刺激することで(図9B)、VEが19.5L/secに等しいときにVEDは0.47Lに等しくなり、VEが25.7L/secに等しいときにVEDは0.79Lに等しくなり(図9C)、かつVEが36.7L/secに等しいときにVEDは1.19Lに等しくなる(図9D)。TFRACは、VB一定でVEが増加するのに伴って徐々に増加する。
【0054】
Vret、VED及びTFRACのVEに対する依存性は図10、図11及び図12にそれぞれ図示されている。これらの図では、VEの4つの値全てが示されている。各プロットはVBの等値線の一群を示している。Vret、VD及びTFRACは、VEの増加に対してほぼ直線的に増加する(図10、図11、図12及び図13)。
【0055】
図13はVBの5つのレベルにおけるVAとVEとの関係を図示している。1.0L/sec以上の値では、全ての点は単調増加曲線上に乗る。しかし、VBより小さな値では、2つの関係は下方へシフトする。このことは、化学的刺激の増加によって引き起こされるVEの増加は、VAの増加を小さくさせるということを意味する。このことは、ループゲインの減少を意味する。ループゲインの減少は2つの関係の傾き変化として定量が可能である。VBの値が0.35L/sec以下の領域では、VEが15L/secより大きな値で、VAは一定となることを明記しておく。換言すると、本発明はVAをある最大値で一定にする。
【0056】
図14は、比logVE/VAに対するループゲインの全体的な依存性を図示している。静止(resting)呼吸用に計算されたこの比は患者に対するVEの規格化指数を与える。logVE/VAが0から1までの範囲、つまり、とどまる条件でVEDがゼロ未満でVEが変化する範囲でその関係をプロットした。とどまるVret/Vwashが0.5から0に減少するとき、ループゲインは急激に減少することを明記しておく。この理由により、中枢性睡眠時無呼吸症の処置での通常の用途では比を0.3に選択する。この状況では、VBはVAの約2倍であり、TFRACは80%に等しい。とどまる条件にて、装置からの吐出気体の適切な洗浄より多くを供給する一方で、この値はループゲインの50%減少という結果をもたらす。従って、ループゲインはある値に減少する。その値は、患者が通常通りに呼吸し、かつ中枢性睡眠時無呼吸症でないときに外部デッドスペースを付加するリスクなく、多くの中枢性睡眠時無呼吸症患者の呼吸を安定化させる。
【0057】
受動的デッドスペース法の目的は、とどまる条件において、VED=0の状態を実現するのに十分な値のVBを有するCPAPを利用することである。しかし、ループゲインを減少させ、呼吸を安定化させるのに十分なだけVEを増加させることで、VEDは増加する。特に、呼吸低下又は通常呼吸中では、装置は呼吸での気体交換非効率を生じさせない。しかし、過呼吸では、VEが通常の値を超えて上昇することでVEDは徐々に増加する。正味の効果は、VAの周期的変動が減衰するように、VEの変化と一致させてVDを動的に調節する。これは、システムのループゲインが減少するように、動脈血PO2及び動脈血PCO2の変動が減少することを意味する。この効果は呼吸を安定化させる役割を果たす。
【0058】
デッドスペースを受動的に調節する利点は、能動的アルゴリズム、VBの動的調節を必要としない比較的単純な装置でループゲインを減少させることが可能なことである。一旦実効的なVBが決定されると、患者インターフェースの吐出口の抵抗を永続的に調節することで受動的調節は実現可能となる。それによって、吐出管レジスタ及びコンピュータ制御の吐出レジスタが不要となる。しかし、患者の呼吸器制御システムのループゲインが非常に大きい場合、受動的装置は呼吸を安定化させるほど十分にループゲインを減少させることはできない。その場合には、動的にVEDを調節す装置を使用する。動的にVBを調節する実施例では、インジケータ変数(Vret、Vwash、TFRAC及びVB/VA)はオンラインで計算される。周期的呼吸は無呼吸の再発又は、自己回帰分析によって検出される。VBは、中枢性睡眠時無呼吸症の証拠が排除される、又はインジケータ変数が限界値(Vret=0.8、Vwash=0.8、TFRAC=80%、VB/VA=2)に到達するまで徐々に減少する。
【0059】
図19は本発明の別な実施例を図示している。中枢性睡眠時無呼吸症患者は全面マスク220を装着している。全面マスク220は、経鼻閉塞して口腔インターフェースを使用するような方法によって漏れ耐性でなくてはならない。マスク220は高インピーダンス送風機222からのバイアス流によって浄化される。送風機は一定速度の空気流をマスクへ供給する。バイアス流は選択可能で、制御コンピュータ224によって即座に調節可能である。バイアス流は低抵抗熱浴管226を介して大気へ流出する。呼吸器空気流(吸入及び吐出共に)はこの熱浴管を介して生じる。管が低抵抗なため、マスク圧力は大気圧に近い値を維持する。熱浴管内の呼吸気流計(流量計228)は、バイアス流及び呼吸器空気流の監視並びに吐出中の洗浄容積及び吐出された1回換気量の計算を可能にする。
【0060】
とどまる条件、又は中枢性睡眠時無呼吸症呼吸が検出されないときには、洗浄容積が管へ吐出される気体の容積を超えるように、バイアス流は比較的大きな値で保持される。従って、吸入が開始されるとき、熱浴管はバイアス流によって完全に洗浄され、患者は室内の空気を吸入する。よって、患者が通常呼吸をし、コンピュータによって換気サイクルが検出さればいときには、外部デッドスペースは付加されない。コンピュータ222が換気サイクルを検出するとき、バイアス流は周期性に同期して変化する。瞬時の換気が移動平均より大きいときに、洗浄容積が吐出された1回換気量未満になるように、バイアス流は減少する。これによって再呼吸が起こり、システムのループゲインは減少する。減呼吸期間中では、再呼吸が生じないように、バイアス流は高い値に維持されている。吐出終端部で熱浴管226内に存在する気体容積はオンラインで計算され、瞬時の換気と移動平均換気との差に比例して調節される。よって、デッドスペースは、過呼吸が発生することで徐々に増加し、それによって動脈血気体の過剰な換気の効果を最小化する。これは順に、無呼吸期間又は過呼吸に続く呼吸低下の程度を最小化し、換気を安定化する。
【0061】
本発明が、その精神又は中心的特徴から離れることなく他の特定形式で実装することが可能なことは当業者には明白である。従って現在開示されている実施例は全ての点において例示であって、限定ではない。本発明の技術的範囲は前述の説明よりはむしろ添付の請求項によって示唆され、請求項で示唆される発明と均等な意味及び範囲内のすべての変化は本発明に含まれる。従って、上述の説明は本発明を限定するものではない。本発明は特許請求の範囲における請求項によってのみ限定される。
【図面の簡単な説明】
【0062】
【図1】中枢性睡眠時無呼吸症を示す図である。
【図2】本発明の再呼吸器の1つの実施例を図示している。
【図2A】歯科器具と共に使用される図2の実施例を図示している。
【図2B】図2Aの口腔器具の実施例を図示している。
【図2C】図2Aの口腔器具の実施例を図示している。
【図3】中枢性睡眠時無呼吸症の呼吸を図示している。
【図4A】送風機からの単一所定の気体流を使用した通気安定化のパッシブループゲインを使用した本発明の1つの実施例を図示している。
【図4B】流量計及びコンピュータを使用した図4Aのシステムの別な実施例を図示している。
【図5】送風機の圧力をコンピュータ制御して、睡眠サイクルにおけるある期間での送風機からの通気圧力を調節する、本発明の1つの実施例を図示している。
【図6】バルブに取り付けられているデッドスペースをコンピュータ制御して、睡眠サイクルにおけるある期間で再呼吸を起こす、本発明の1つの実施例を図示している。
【図7】再循環器を使用して、睡眠サイクルにおけるある期間で再呼吸を増加させる、本発明の1つの実施例を図示している。
【図8A】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8B】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8C】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8D】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8E】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8F】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図9A】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図9B】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図9C】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図9D】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図10】VEに対するVAの依存性を図示している。
【図11】VEに対するVEDの依存性を図示している。
【図12】VEに対するTFRACの依存性を図示している。
【図13】4つのレベルのVBにおけるVAとVEとの関係を図示している。
【図14】比logVE/VAに対するループゲインの一般的依存性を図示している。
【図15】従来のCPAPシステムにおける管内での呼吸空気流を図示している。
【図16】図4Aの実施例における管内での通常の呼吸空気流を図示している。
【図17】図4Aの実施例における管内での過呼吸空気流を図示している。
【図18A】患者のインターフェースにおける出口となる管のサイズが患者の睡眠サイクルでゆっくりと変化する、本発明の実施例を図示している。
【図18B】図18Aの装置における夜間での出口穴サイズの変化の一例を図示するグラフである。
【図19】送風機出力を患者による再呼吸のレベルを調節するアクティブコントロール装置として使用する別な実施例を図示している。
【技術分野】
【0001】
本発明は、呼吸障害を処置する装置及び、呼吸障害の処置方法に関する。
【背景技術】
【0002】
中枢性睡眠時無呼吸症は、規則的かつリズムを有する神経活動のバーストを生成する睡眠時の脳がうまく機能しないことを特徴とする睡眠呼吸障害の一種である。その結果として生じるリズムを有する呼吸の中断、それは無呼吸と呼ばれる、は呼吸の速さ及び深さ、つまり肺呼吸全体、を規制する呼吸器制御系の障害を意味する。中枢性睡眠時無呼吸症は閉塞性睡眠時無呼吸症候群と対比されるべきである。閉塞性睡眠時無呼吸症候群において、無呼吸のおおよその原因は、継続して呼吸器系の筋肉へリズムを有する神経出力が発生しているにも関わらず、咽頭気道が障害を有するからである。中枢性睡眠時無呼吸症と閉塞性睡眠時無呼吸症候群との差異は明確に規定され、2つは同時に存在しうる。中枢性睡眠時無呼吸症は多くの薬が使用される状況で生じうるが、最も一般的に観察されるのは、心臓麻痺(心不全)又は脳血管不全に関連している場合である。中枢性睡眠時無呼吸症の一例にはチェーン・ストークス呼吸がある。
【0003】
呼吸器制御系は、二酸化炭素、酸素及びpHをセンシングする呼吸器系の化学受容器が適切に刺激されるときに中枢性パターン発生装置が活動のリズムあるバーストを発生させることを特徴とする負のフィードバックシステムを有する。呼吸器系筋肉への脳幹の中枢性パターン発生装置の神経出力は、基本的に中枢性パターン発生装置によって発生される神経リズムから導かれる一方で、動脈血PCO2及びPO2に関連するフィードバック信号が十分に強いとはいえない場合では、発生装置は沈黙する。換言すると、呼吸器系のリズムは、動脈血PCO2及びPO2をセンシングする末梢性化学受容器及び脳のPCO2/pHをセンシングする中枢性化学受容器を起源とする適切な入力刺激を必要とする、条件的中枢性パターン発生装置によって発生される。さらに、呼吸器系中枢性パターン発生装置によって発生する神経活動の強度は直接的に動脈血PCO2に依存し、動脈血PO2に反比例する。よって、中枢性及び末梢性の化学反射ループは動脈血PCO2及び動脈血PO2を調節する負のフィードバックシステムを形成し、これらの値を狭い限界の範囲内で一定に保持する(図1)。
【0004】
動脈血液気体のこの通常の調節は、呼吸器系の中枢性パターン発生装置の安定した換気出力によって実現される。それとは対照的に、中枢性睡眠時無呼吸症は呼吸器制御系の不安定さを意味する。その不安定さは2つの機構のうちの1つから生じうる。(1)呼吸器系の化学受容器によって適切に活性化されているにもかかわらず呼吸器系の中枢性パターン発生装置が基本的に機能しないこと、又は(2)呼吸器系の化学受容器による適切に活性化しきれていないこと、である。前者は“内在的不安定性(intrinsic instability)”、後者は“化学反射不安定性(chemoreflex instability)”と呼ばれる。理論的には、2つの機構は同時に存在しうる。中枢性睡眠時無呼吸症の一般的な形態は化学反射不安定性の機構に起因すると考えられる。
【0005】
呼吸の化学反射制御は不安定性を示すだろう。その理由は、負のフィードバック信号の遅延が過度に長いため、又は、システムのゲインが過度に大きいためである。現時点での証拠が示唆していることは、後者が、心臓麻痺(心不全)による中枢性睡眠時無呼吸症での主要なかく乱の主な要因であるということである。特に、動脈血PCO2の変化に対する制御系の全体的な応答については、中枢性睡眠時無呼吸症を有する心臓麻痺(心不全)の患者では、睡眠障害に伴う呼吸を有していない患者の3倍にもなる。この増加したゲインは中枢性化学反射ループに属しているものと思われるが、末梢性化学反射ループの大きなゲインであることも排除できない。従って、中枢性睡眠時無呼吸症の基本的機構は、制御系が大きなループゲインを取ることで、睡眠中でのフィードバック不安定性を引き起こすことである。
【特許文献1】米国特許公開第5645053号明細書
【発明の開示】
【発明が解決しようとする課題】
【0006】
中枢性睡眠時無呼吸症は繰り返しの覚醒及び酸素ヘモグロビンの不飽和化を引き起こす。たとえ中枢性睡眠時無呼吸症と疾患率及び死亡率とを結びつける確かな証拠が不足しているとしても、様々な証拠資料によって、中枢性睡眠時無呼吸症が心臓不整脈、発作又は心筋梗塞を促進する恐れがあるということが推測される。夜間での覚醒が繰り返されることは、日中の認識機能及び生活の質に悪影響を及ぼしがちである。中枢性睡眠時無呼吸症に対する有効な処置はまだ確立されていない。テオフィリンのような薬を勧めるのは有用だろうし、カーボニックアンヒドラーゼ抑制剤は中枢性睡眠時無呼吸症をかなりの程度で正常睡眠に和らげることが可能だろう。経鼻的持続陽圧呼吸療法は直接的又は間接的に換気安定性を改善することが可能である。吸い込まれた気体中の酸素分比(F)が増加しても一般的には中枢性睡眠時無呼吸症は排除されないが、吸い込まれたFCO2(FCO2=0.01〜0.03)が増加すると即座に中枢性睡眠時無呼吸症は排除される。しかし、高FCO2環境に長時間おくのは長期の治療として望ましくないだろう。
【課題を解決するための手段】
【0007】
本発明は、中枢性睡眠時無呼吸症の呼吸器サイクルのある期間での制御された再呼吸量を使用して肺の気体交換の効率を変化させることで、肺及び動脈血中の二酸化炭素及び酸素レベルでの過渡的に過度となった換気効果に対抗する。実際には、この計画はフィードバック変数における振動を最小化することで呼吸を安定化させるという試みである。そのような用途での再呼吸装置を有効に使用するために、漏れ耐性を有する患者インターフェースを使用する。このインターフェースは鼻及び口の通路のうちの1つを遮断し、口腔器具及び経鼻閉塞装置を含むのが好ましい。
【0008】
本発明は、呼吸器制御系のループゲインを減少させることで中枢性睡眠時無呼吸症による周期的呼吸に対抗する。過呼吸直前又は過呼吸期間の最中において、二酸化炭素の吸入量を増加させ、酸素の吸入量を減少させるのに再呼吸を使用することが可能である。1つの実施例では、中枢性睡眠時無呼吸症呼吸の換気サイクルが検出され、再度吸い込まれた吐出気体の量を変化させることで適切に吸入した二酸化炭素及び酸素濃度を調節できるように、患者の換気は連続的に監視され、リアルタイムで分析される。再呼吸装置は経鼻的持続陽圧呼吸療法(CPAP)システムの一部であって良い。
【0009】
中枢性睡眠時無呼吸症の呼吸器サイクルの一部の最中において制御された再呼吸を可能にするように、従来のCPAPシステムは本発明の1つの実施例では修正されている。この実施例では、バルブは再呼吸量の制御に使用される。バルブが閉じられているときには再呼吸が起こり、バルブが開いているときには再呼吸は起こらない。流量計に接続されているコンピュータは中枢性睡眠時無呼吸症の呼吸器サイクルの期間を検出するのに使用することが可能である。コンピュータは制御してバルブを開閉することが可能である。口腔器具と組み合わせられた経鼻閉塞は制御された再呼吸を得るのに使用可能である。本発明をさらにまとめたものについては以下の詳細な説明及び請求項を参照することで得ることが可能である。
【実施例】
【0010】
図2は本発明の再呼吸器の1つの実施例を図示している。この実施例では、送風機20、管22及び患者とのインターフェース24を含む経鼻的持続陽圧呼吸療法用装置が使用されている。口腔インターフェース及び経鼻閉塞装置を有する患者とのインターフェース24は、経鼻的持続陽圧呼吸療法処置で使用するのに気密性の堅いシールを顔に形成する。経鼻的持続陽圧呼吸療法及び好適な経鼻的持続陽圧呼吸療法用装置に関する議論は特許文献1で説明されている。従来のCPAPでは、送風機はマスク内で比較的高い一定圧力を保持する、かつ、送風機から新鮮な空気のバイアス流をマスクの外へ送り出すのに使用される。
【0011】
本発明の1つの実施例では、管26は患者インターフェースの排出部分31と接続し、気体を可変レジスタ28へ送り込む。あるいはその代わりに、バルブは患者インターフェースの排出部分上に設けて良い。管22は中枢性睡眠時無呼吸症呼吸のあるサイクルの最中で再呼吸するためのデッドスペースとして使用される。バルブ28が開いているとき、再呼吸は起こらない。その理由は、すべての排出気体は吸入が起こる前にバイアス流によって管26を通って、バルブ28を介して排出されるからである。バルブ28が閉じられているときにはバイアス流は消え、管26を介して空気が吸い込まれないからである。この場合、部分的な再呼吸が生じる。その理由は、吸い込まれた空気が管22を逆行して送風機へ向かうからである。管26中の気体は室内の空気よりも高い二酸化炭素濃度及び室内の空気よりも低い酸素濃度を有する。患者が吸入するとき、気体は送風機から患者へ送られ、それまでに吸い込まれた気体は患者によって排出される。
【0012】
通常、送風機から患者インターフェースを介して排出ポート30へ送り出される気体のバイアス流は、患者によって吐き出された気体は系内には残らないように、呼吸サイクルの呼気段階で系を完全に浄化するのに適している。よって、患者によって吸い込まれる気体は室内の空気の組成(O2濃度21%;CO2濃度約0%)を有する。反対に、バルブ28によってポート30が完全に閉塞されることでバイアス流が0に減少する場合、患者によって排出される気体は患者インターフェースと送風機とを接続する管22を満たす。そのような吐き出された気体は典型的には5%の二酸化炭素濃度及び16%の酸素濃度を有する。吸入では、患者は最初に管を満たす高二酸化炭素、低酸素混合気体を吸入し、それに続いて送風機からの室内空気を吸入する。管の長さに依存して、この混合物は1回の換気量の20%〜60%の再呼吸に匹敵する。排出ポートの流出抵抗を変化させることで、これらの限界間の再呼吸の程度は変化させることが可能であり、吸入される二酸化炭素濃度及び酸素濃度は操作可能である。1つの実施例では、コンピュータ34に接続する流量計32は送風機20から送られてくる気体の流れ及び送風機20へ送られる気体の流れを検出するのに使用される。コンピュータ34は中枢性睡眠時無呼吸症の呼吸によって引き起こされる肺の換気の周期性を特定すること、及び、中枢性睡眠時無呼吸症サイクルのある期間中での再呼吸を引き起こすバルブ28を制御するのに使用される。
【0013】
送風機からの気体流はバイアス流(患者インターフェースの排出流+漏れ流)に加えて呼吸器の空気流を有する。コンピュータはこの流れを監視し、バイアス流、漏れ流、逆流(retrograde flow)、逆排出容積(retrograde expired volume)及び洗浄容積(wash volume)を計算する。
【0014】
コンピュータ34は中枢性睡眠時無呼吸症サイクルの振幅を検出し、それに従ってバルブの抵抗を調節することが可能である。たとえば、中枢性睡眠時無呼吸症サイクル最中に肺換気の大きな変化がある場合、バルブ28は過呼吸の期間では完全に閉じることが可能である。中枢性睡眠時無呼吸症サイクル最中に肺換気の変化が小さい場合、過呼吸期間ではバルブ28は部分的に開いた状態であって良い。よって、中枢性睡眠時無呼吸症サイクルでの肺換気の変化が大きいときに起こる再呼吸は、中枢性睡眠時無呼吸症サイクルでの肺換気の変化が小さいときに起こる再呼吸よりもより高レベルである。
【0015】
CPAP送風機20のインピーダンスが低いため、流出ラインでの抵抗変化はほとんど患者インターフェース圧力に変化を生じさせない。従って所望のCPAP患者インターフェース圧力に大きな変化を設けることなく、流出抵抗を十分な範囲で変化させることが可能である。
【0016】
流量計32及びコンピュータ34は肺換気のレベルを定量することが可能である。たとえば、呼吸容積と呼吸期間との比から瞬間的な肺換気のレベルがどの程度であるかが分かる。平均吸入流速度の平均又はピークのような他の指標を使用することも可能である。
【0017】
図3は、中枢性睡眠時無呼吸症呼吸中の過呼吸及び減呼吸のサイクルを理想化した図である。この図は、換気の平均移動時間と比較した過呼吸領域50a及び減呼吸領域50bを図示している。コンピュータシステムは中枢性睡眠時無呼吸症呼吸のサイクルを決定することが可能である。典型的には、中枢性睡眠時無呼吸症での過呼吸及び減呼吸には約50秒−60秒のサイクルがある。
【0018】
中枢性睡眠時無呼吸症を排除するため、バルブ28を使用して再呼吸の程度及びタイミングを制御する多数の方法が使用されている。中枢性睡眠時無呼吸症呼吸を減少させるために再呼吸を制御する1つの方法は、中枢性睡眠時無呼吸症呼吸でのそれぞれ異なるサイクルを予測することである。たとえば図3を見ると、時間Aでは、システムは過呼吸サイクルを予測し、よって図2で図示されているようにバルブ28を閉じることで再呼吸を開始する。再呼吸部50aが発生するまでには、ある程度のレベルの再呼吸が存在する。このため、過呼吸サイクル中での肺の気体交換は非効率的で、それによって生じる肺の酸素上昇及び肺の二酸化炭素減少は小さい。その結果、血液中の酸素レベルは高くなりすぎず、二酸化炭素レベルは低くなりすぎない。これにより、動脈血中の酸素分圧及び二酸化炭素分圧は安定し、引き続き生じる減呼吸の振幅又は無呼吸の長さは減少する。時間Bでは、システムはバルブ28を開くことで事前に減呼吸サイクルを見越し、再呼吸はこれ以上起こらない。本発明の装置は中枢性睡眠時無呼吸症(線50)を図3の破線60で図示しているような低レベルへ減少させることが可能である。再呼吸の開始時間及び終了時間である時間A及び時間Bは図2で図示されているコンピュータ34によって決定することが可能である。
【0019】
図4Aは本発明で使用される受動的ループゲイン変調システムを図示している。図4Aは、入力管62及び患者インターフェース64に接続する空気送風機60のような気体供給手段を使用したシステムを図示している。このシステムは患者インターフェース用の単一の固定された出力ポートを使用する。閉塞性睡眠時無呼吸症候群で通常使用されるものよりも大きな管容積を本発明で使用して良い。たとえば、6フィートの管よりはむしろ10フィートの管を使用して良い。送風機60は非常に低いインピーダンスを有することが好ましい。つまり、空気流の変化は送風機によって供給される空圧を大きく変化させない。これにより、たとえ管の流れが逆流になっても、比較的安定した患者インターフェースの圧力を保持することが可能となる。
【0020】
加えて、1つの実施例では、空気送風機は、4cmより下になる(2cm以下になるのが好ましい)水圧を供給するように調節することが可能である。そのような小さな圧力を供給する能力により、前述の逆流が可能となる。患者インターフェースは患者の通気口について適合している。通常呼吸の間、送風機60から供給され、管62を通って患者インターフェース64に供給される空気は再呼吸を生じさせない。その理由は、次の吸い込み期間前に如何なる吐出空気も除去(flush)されるからである。激しい呼吸の最中、十分な排出空気流が管へ逆流するように所定の気体流圧力は設定される、その際、次の吸入期間中にある程度の吐出気体が再呼吸される。この実施例では、過呼吸は中枢性睡眠時無呼吸症に関連する睡眠サイクルのある期間で起こる。中枢性睡眠時無呼吸症の期間中での再呼吸は、血中酸素レベルでのスパイクを減少させる傾向にある。よって、中枢性睡眠時無呼吸症において過呼吸に続いて生じる減呼吸の期間もまた減少する。
【0021】
交互の減呼吸及び過呼吸期間は、過呼吸期間中に起こる再呼吸によって減少する。再呼吸は動脈血酸素スパイク及び過呼吸によって引き起こされる動脈血PCO2の減少を減衰させる。よって、血液が化学受容器に到達するときに低換気状態が存在する。よって、周期的呼吸の振幅は減少する。
【0022】
図4Aの実施例は、従来のCPAPを使用したときよりも所定の気体流圧力が低い、かつ/又は、従来のCPAPを使用したときよりも患者インターフェースの排出孔が小さい、という点で、従来のCPAPとは異なる。典型的なCPAP気体流圧力からの気体流圧力を減少させることで、かつ/又は、患者インターフェースの排出孔を減少させることで、過呼吸期間中の逆流は生成される。
【0023】
図4Aのシステムは、送風機圧力の能動的制御を必要としないという利点を有する。睡眠の中心状態で患者をチェックすることが可能であり、適切な送風機圧力及び患者インターフェース排出孔サイズが設定される。その後、システムは、高価な制御装置に基づくシステムを必要とせずに毎晩患者の通気口に設けることが可能である。所定の送風機圧力は、排出孔64、通常の排出圧力及び過呼吸排出圧力によって引き起こされる空気流抵抗に依存する。気体供給圧力システムが空気送風機60である場合、空気送風機の1分あたりの回転数を調節することで所定の気体流圧力を設定することが可能である。
【0024】
中枢性睡眠時無呼吸症であるが閉塞性睡眠時無呼吸症候群ではない患者の空気供給圧力は4cmより下の水圧のような比較的低いレベルでの設定が可能である。通常の患者インターフェースの排出孔はこれらの圧力で所望の効果を生じさせる。呼気終末のFCO2及び吸入されたFCO2を、患者インターフェースと接続する吸引線を有するCO2流量計によって監視することが可能である。重要なこととしては、排出気体を管62へ送り出すために、漏れ耐性を有する患者インターフェースを使用することですべての口腔漏れは排除されなくてはならないことである。これは、あごひもを使用する、又は、上の歯及び下の歯、若しくは両方の歯に使用される口蓋弓の歯科器具のような口腔器具25を使用することで実現される。困難な鼻の漏れに対する代替的アプローチは、口だけでなく鼻をも覆う全面マスクを使用することである。これは、鼻又は口から排出される気体は管62患者インターフェースと患者との間の漏れを最小化することは重要だが、患者の排出空気をできる限り保存し、再呼吸に利用できるようにすることもまた重要である。従って、患者インターフェースが鼻と接続する場合には、口の通路は遮断されなくてはならず、患者インターフェースが口と接続する場合には、鼻の通路が遮断されなくてはならない。いずれの場合でも、使用していない通路の漏れは最小限にしなくてはならない。
【0025】
口腔器具25の例については図2B及び図2Cで詳細に図示されている。図2Bでは、口腔器具25は歯科器具である。図2Bでは、口腔器具25は歯の内部で適合するように設計されており、唇と患者の歯との間で適合する上部トレイ25A及び、歯科器具を唇に固定させる面を提供する下部トレイ25Bを有する。図2Bの口腔器具25中心部の開口部25CはCPAP圧力を伝達するためにCPAPホースコネクタとやり取りをする。図2Cの口腔器具25は、歯を使用することなく、唇の上で直接患者の口と適合する。図2Cの口腔器具は、患者の通路で適合するマスク27によって患者上で保持され、紐及びパッド29Aを使用して患者頭部の後方で固着される。遮断された通常のバイアスポート29C及び低流バイアス流ポート29Dを有する管29BはCPAP接続29Eを介してCPAP装置と接続する。管29Bの長さは再呼吸量の制御を可能にする。
【0026】
本願書類で説明されている技術行為のモードにおける特徴は過換気期間でのシステムの振る舞いに関する。そのような過換気状態(phase)が発生するとき、患者は大きな1回換気量及び短い期間での排出を生じさせる。それと共に、これらは排出気体の再呼吸を誘起する。その気体は、CPAP送風機を口腔器具のような患者インターフェースに接続するCPAPパイプ29Bへ逆に流れる。自宅内で夜間に低流CPAPを使用する、中枢性睡眠時無呼吸症患者は、過換気中では、吐出気体の再呼吸が無意味になるほどの鼻の漏れが生じうるということが分かるだろう。そのような患者については、歯科器具25を使用するのが好ましい。歯科器具はCPAP圧力を、経鼻閉塞している患者の口に与える、鼻からの漏れを排除するため。歯科器具及び経鼻閉塞を使用した患者に関する研究データは、治療は中枢性睡眠時無呼吸症の解決には有効であること、及び、深呼吸状態(phase)では、吐出気体が発生しないということが分かるだろう。低流CPAPを有効に応用するには、口腔器具25のような口腔界面は経鼻閉塞と組み合わせて使用されるべきである。経鼻閉塞は、鼻孔中又は水泳選手が使用するのと同様な、外部U字クランプ29F中に挿入されたプラグを介して得ることが可能である。
【0027】
患者が閉塞性睡眠時無呼吸症候群の要素を有する場合、患者インターフェース圧力は、上部通路の障害物を示唆する証拠がすべて除去されるまで徐々に増加する。患者が心臓麻痺(心不全)処置として経鼻CPAPを受ける場合には、患者インターフェース圧力波所望のレベル(典型的には8cm〜10cmの水圧)に設定される。バイアス流は、中枢性睡眠時無呼吸症がデッドスペースを加えることなく排除されるまで減少させて良い。
【0028】
心臓の病気を抱える患者にとっては、患者インターフェース圧力は文献で示唆されている値(典型的には10cmの水圧)に設定して良い。そこでバイアス流は調節される。
【0029】
管62を介した流は送風機圧力(つまり送風機流出時の圧力)と患者インターフェース圧力との圧力差に依存する。送風機圧力は送風機の1分あたりの回転数(RPM)で設定され、送風機の内部インピーダンスは非常に小さいので近似的に一定である。呼吸器の空気流が生じないとき(つまり排出終了時)、患者インターフェース圧力は送風機圧力よりもある量だけ小さくなる。ある量とは、接続管の流耐性特性及びバイアス流速度に支配される。これは典型的には、バイアス流が0.5L/sec〜1.5L/secでの1cm〜2cmの水圧差である。患者インターフェースが患者に適用され、患者が呼吸するとき、患者インターフェース圧力は呼吸サイクル中に変化する。患者インターフェース圧力は接続管の流耐性特性及び患者が発生させる空気流に依存する。吸入中、患者インターフェース圧力は落ち込み、典型的には水1cm〜2cm、吐出圧力は過渡的にインターフェース圧力の落ち込みと同程度に上昇するだろう。穏やかに呼吸している最中では、患者インターフェース圧力のピーク間での変動は激しい呼吸又は過呼吸最中での値よりも小さい。
【0030】
よって穏やかな呼吸中では、患者インターフェース圧力は吐出中に上昇し、これにより送風機と患者インターフェースとの間の駆動圧力差が減少し、それによって管内の流が減少する。排出される1回換気量が増加する場合、しかし排出流ピークは増加し、これが患者インターフェース圧力のさらなる増加に結びつく。患者インターフェース圧力が送風機圧力に等しくなるまで増加する場合、管内の流は停止する。患者インターフェース圧力が送風機圧力を超えるとき、管内の流は逆方向となる、つまり患者インターフェースから送風機へとなる。そのような逆向きの空気流は最初吐出初期で生じ、接続管へ移動する空気容積は吐出時に後で浄化され(wash out)、患者インターフェース圧力は減少し、送風機から患者インターフェースへの流れは増加する。しかし、バイアス流が小さく、かつ1回換気量が大きい場合、多量の逆流が発生し、多量の吐出気体が管内へ移動する。バイアス流は小さいため、管を洗浄する押し出し流は小さい。そのような場合、すべての逆流容積が次の吸入前に押し出されるわけではない。その結果として、全吸入気体の酸素濃度はある程度減少し、二酸化炭素濃度はある程度上昇する。
【0031】
図15から図17は送風機と患者インターフェースとの間の管内の流れを図示している。図15は、従来のCPAPシステムの管内での空気流呼吸を図示している。吐出部中では、送風機から患者インターフェースへの流は常に、管内で逆流が生じないように、吐出圧力を上回る。これは典型的には、空気送風機圧力及び吐出ポート抵抗を、患者インターフェース外へのバイアス流は相対的に大きく、逆流の可能性は回避されるように設定することで行われる。この正常流は中枢性睡眠時無呼吸症に関連する過呼吸においてさえも生じる。
【0032】
図16及び図17は、本発明のシステム内での呼吸の効果を図示している。ここで、送風機圧力及び患者インターフェースの吐出孔から外へ出るバイアス流は、中枢性睡眠時無呼吸症に関連する過呼吸期間中に逆流が生じるように設定される。
【0033】
図16は正常呼吸が行われている状況を図示している。正常呼吸の場合でさえも、ある程度の逆流が周期202で存在する。吐出期間後半では、逆容積は、期間204で生じる正常流によって管から押し出される。よって、正常呼吸期間中に再呼吸は生じない。本発明のシステムは正常呼吸期間中にデッドスペースを付加しない。これは、デッドスペースを加えることで血流に供給される二酸化炭素濃度が上昇するので重要である。増加する二酸化炭素レベルが複数日持続する場合、人体は望ましくない方法による内部フィードバックによって再調節するものと推定されている。
【0034】
図17は本発明の装置とともに過呼吸を示す実施例を図示している。図17の実施例では、過呼吸は、逆流する吐出気体が存在するようなものである。逆流する吐出気体は次の吸入時には管内に残る。これは、結果として高濃度の二酸化炭素濃度を有する吐出気体を再吸入することを意味する。図17では、初期の吐出気体領域206は吐出気体領域208よりも大きいことに留意すべきである。
【0035】
本発明の1つの実施例では、通常呼吸の逆流容積及び洗浄容積は本発明の動作設定に使用することが可能である。1つの実施例では、逆容積領域202は通常呼吸での洗浄流領域204のサイズの1/2でなくてはならない。肺換気と患者インターフェースとの比較、及び/又は、洗浄時間と吐出期間との比較のような他のわかりやすい(thumb)規則もまた、本発明のシステム動作の設定に使用することが可能である。
【0036】
図4Bは、図4Aの装置にコンピュータ67及び流量計69を付け加えたものを図示している。流量計69は、管62内で所望の空気流を検出するのに使用される。過呼吸期間で逆流が存在し、それ以外の期間では逆流が存在しないように送風機を調節することが可能である。図4Bの装置は、各患者用の図4Aの装置の校正に使用することが可能である。
【0037】
図18A及び図18Bは、患者インターフェース吐出口サイズが夜になるとゆっくりと変化することを特徴とする実施例を図示している。この実施例では、送風機210は選択された圧力で空気流を供給する。流量計212は管214と接続する。管214は、管214内の流が、肺容積、バイアス流及びそれに類するものを含むシステムの付加的パラメータに従って決定されることを可能にする。プロセッサ216は、可変空気抵抗装置218を使用することで排出孔サイズをゆっくりと変化させる。図2のシステムとは違い、可変出力抵抗装置218は夜間にゆっくりと調節される。
【0038】
図18Bを見ると、患者が閉塞性睡眠時無呼吸症候群及び中枢性睡眠時無呼吸症を有する場合、夜になったばかりのときには、出力バルブは比較的大きく設定することが可能であり、患者インターフェースの外へ出るバイアス流を増大させ、管214への如何なる逆流の効果をも減少させる。一旦、閉塞性睡眠時無呼吸症候群が減少すると、バルブ径はゆっくりと減少し、中枢性睡眠時無呼吸症における過呼吸期間に管214への逆流を増加させることで、中枢性睡眠時無呼吸症を減少させる再呼吸を引き起こすことが可能となる。患者インターフェースのバルブ開口部の付加的調節は、プロセッサ216による計算に基づいて行うことが可能である。
【0039】
図5は送風機70が動的に制御されていることを特徴とする本発明の実施例である。流量計72は管74中の送風機70と患者インターフェース76との間に設けられている。流量計はまた、患者の顔の近くに設けられても良い。図5のシステムでは、コンピュータ制御によって睡眠サイクルのある期間での送風機圧力を減少させることが可能である。よって、激しい呼吸期間中では、送風機圧力を減少させることが可能で、それによって逆流及び再呼吸は促進される。この実施例は、患者インターフェース圧力変化による混合効果のため、利点があるとは言えない。送風機70によって供給される気体供給圧力を調節することで、管74への逆流は、所望通りに増加及び減少させることが可能である。
【0040】
図6は本発明の別な実施例である。この実施例では、患者インターフェース82は、コンピュータ制御の2つのバルブ86及び88によってデッドスペース84と接続している。睡眠サイクルのある期間での再呼吸量は、バルブ86及びバルブ88を開閉してバイアス流を変化させることで調節可能であり、それによって中枢性睡眠時無呼吸症は減少する。
【0041】
図7は再循環器90を使用した実施例である。睡眠サイクルのある期間では、再循環器90は吐出空気を引き出し、再循環させて患者インターフェース92でユーザーに供給する。このようにして、中枢性睡眠時無呼吸症は、睡眠サイクルの選択された期間において再呼吸を増大させることで減少させることが可能である。
【0042】
本発明の1つの実施例は、経鼻的持続陽圧呼吸(CPAP)療法に適用される。負のフィードバック呼吸器制御系のループゲインは主として外部デッドスペース(VED)、すなわち吸入及び吐出中に気体が通る(conduct)共通の気道、の増加によって減少する。外部デッドスペースは肺の気道を有する内部デッドスペース(VID)及び上部気道を拡張する。全デッドスペース(VD)は内部デッドスペースと外部デッドスペースとの和に等しい。
VD=VED+VID (式1)
この容積は制御系に必然的に発生する非効率さを表す。その非効率さとは、肺内部の気体交換に関わる1回換気量を減少させることである。詳細には、1回換気量は2つの成分の和で表される。
VT=VD+VA (式2)
ここでVAは1回換気量における“肺胞”による換気、すなわち呼吸器の気体交換にかかわる容積、を表す。また、VE、VA及びVDを積f・VT、f・VA及びf・VD(fは呼吸器の周波数を表す)とすると、VE=VA+VDとなる。呼吸器制御システムの負のフィードバックループ(図1)では、VEは呼吸器の中枢パターン発生装置の出力を表し、VAは動脈血気体圧力に影響を与える変数である。VEとVAとの関連は当然のことではあるが、ループゲインの動的制御を操作する基本変数VDである。
【0043】
患者がCPAP用装置を介して呼吸するときに、再呼吸容積の動的制御は実現される。従来のCPAP装置を使用するとき、鼻は、ある長さの管によって圧力発生源と接続するマスクで覆われている。鼻を覆うマスクには連続的に気体が流れる。気体は圧力発生源から流入し、マスクの排出ポートから流出する。これはバイアス流(VB)と呼ばれる。従来の用途、すなわちOSAの処置にCPAPを使用するときには、鼻からマスクへ流入する擬似的にすべての吐出気体がマスクへ流入し、排出ポートから流出するように、排出流速度は比較的大きくなる。VBが比較的大きいため、次の吸入が起こる前にマスクは完全に洗浄される。よってマスクから吸入される気体は送風機から流入する気体と同一の組成を有する(典型的には室内の空気で、F|O2=0.293;F|CO2=0.0003)。このような状況、典型的なOSA処置の状況だが、鼻を覆うマスクは外部のデッドスペースを必要としない。本発明は、小さなVBの値を使用することでVEDを動的に増加させ、これにより、続いて動的にVA(式2)を減少させる。よって、気体交換に有効な肺の換気の成分(component)、すなわち肺胞の換気(VA)は経時変化する。VAがフィードバック変数、動脈血PO2及び動脈血PCO2の値を決定するので、VDは直接的にループゲイン(図1)に影響する。よって、システムのループゲインは以下のように操作することが可能である。
↓VB→↑VED→↓VA→↓L.G. (式3)
ここで重要なのは後述するように、VEDの増加は大きく呼吸する期間でのみ生じるということである。よって、通常呼吸では、システムにデッドスペースを加える必要はない。
【0044】
第2の計画として、本発明はCPAP圧力の変化を利用して肺の容積を変化させ、それによって呼吸器制御システムのループゲインに影響を与える。特に、肺胞の換気が動的に変化するときに、フィードバック変数(動脈血PCO2及び動脈血PO2)の動的変化が減少することで、肺容積の増加でループゲインが減少する。同様に、そのような肺容積の増加は呼吸器筋肉の吐出終端部の長さを減少させる。それにより、吸入中での力の発生を減少させる。それと共に、CPAPの両方の効果はループゲインを減少させる。CPAP圧力が周期的な呼吸サイクルと同期して動的に変化するとき、両方の効果はループゲインを変調させる。しかし経験上、1cm〜10cm水圧のCPAP圧力範囲で、これらはVDを変化させるときよりもループゲインを小さく減少させる。加えて、VDの動的変化はCPAP圧力の変化よりも眠っている人を妨害しにくい。従って、CPAP圧力を増加させることで肺容積を減少させ、それによってループゲインを減少させるのは本発明の補助的計画を表す。
【0045】
中枢性睡眠時無呼吸症を患っている又は中枢性及び閉塞性睡眠時無呼吸症を併発している患者は、顔に密閉されたCPAP患者インターフェース(図2、図4A、図4B、図5、図6及び図7)を使用して眠る。口からの漏れ、もし存在するのであれば、たとえば経鼻閉塞と組み合わせた口腔器具で排除される。これが適切ではない場合には、患者インターフェースを、口及び鼻の通路のうちの1つを遮断する全面マスクに置き換える。患者インターフェースは管によって低インピーダンスの送風機の陽圧の排出口と接続している。1つの実施例では、典型的には管は2cm〜3cmの直径で、1.5mの長さを有する。バイアス流は、固定されていてサイズ選択可能な開口部(図4A、図4B、図5、図6及び図7)を通って、又は、コンピュータ制御の可変レジスタ(図2)と接続する、1つの実施例(2cm〜3cmの直径で、1.5mの長さを有する)での管を通って患者インターフェースから流出する。そのようなシステムでは、患者インターフェース圧力は送風機RPMによって決定され、バイアス流VBの速度は患者インターフェース圧力及び患者インターフェース排出口抵抗の結果として得られる。図2及び図4Bで図示された装置は送風機からの流を測定する呼吸流量図を含む。この装置は初期滴定又は夜間治療に適している。また、CO2メーターには患者インターフェースと接続するサンプリングカテーテルを付加して良い。これにより、呼気終末(end−tidal)及び吸入されたFCO2の監視が可能となる。図4Aに図示された装置は図4Bで図示された装置の単純なバージョンであって、夜間の使用に適している。
【0046】
動的に可変なバイアス流装置(図2)は、患者インターフェースの圧力をほとんど変化させずにバイアス流の経時調節を行うことが可能である。排出レジスタは、睡眠ポリグラフ調査中の独立した観測者によって制御されて良く、又は、コンピュータアルゴリズムによって自動制御されても良い。外的デッドスペース容積(VED)の制御は、排出レジスタを一定にして受動的に、又は、排出レジスタを時間変化させることで能動的に調節される。受動的調節の実装では、固定された排出開口部が使用されるため、バイアス流は時間的に一定である。能動的調節では、バイアス流レジスタの抵抗が変化するため、バイアス流は時間変化する。
【0047】
図8は、送風機と患者インターフェースとを接続する管に記録された空気流を図示している。正の値は送風機から患者インターフェースへの空気流を表し、負の値は患者インターフェースから送風機への空気流を表す。前者は、患者インターフェースからの吐出気体を排除するため、“洗浄”空気流と呼ばれ、後者は、CPAP管理中に通常生じる空気流の流れとは反対であるため、“逆”空気流と呼ばれる。図8A(上側)で図示されているように、管中の空気流は2つの空気流、VBと呼吸器空気流、の和に等しい。前者は一定で、後者は呼吸器サイクルに対して変化する。吸入空気流はVの上側歪みを生成し、吐出空気流はVの下側歪みを生成する。吐出終了時(図8Aの上側矢印)では、呼吸器空気流はゼロに等しくなり、管の空気流はバイアス空気流に等しくなる。この例では、バイアス空気流は1.0L/secに選択されている。ピークの吐出空気流は吐出初期(図8Aの下向き矢印)に生じ、この例では1.0L/secに等しい。このとき、ピークの排出空気流はVBに等しくなるため、管の空気流はゼロとなる。
【0048】
図8A、図8B、図8C、図8D、図8E及び図8Fは、VBが1.0L/sec(図8A)から0.15L/sec(図8F)まで徐々に減少するために生じる管の空気流変化を図示している。呼吸器空気流は全体を通して一定に保持されている。VBが1.0L/secから0.5,0.35,0.25,0.2及び0.15L/secまで減少するので(図8A、図8B、図8C、図8D、図8E及び図8F)、逆空気流は吐出中に現れ、徐々に大きくなる。吐出時、逆に移動する空気の容積(Vret、斜線領域)はVBが減少するに従って徐々に増加する。逆に吐出時、送風機から患者インターフェースへ移動する空気の容積(Vwash、小さな斑点で覆われた領域)は、VBが減少するに従って減少する。
【0049】
患者インターフェース内及び吐出終了時(図8Aの下向き矢印)での管内に存在する空気容積は残留容積(VR)と呼ばれる。VRはVretとVwashとの差と推定して良い。
VR=Vret−Vwash (式4)
図8で図示されている最初の5例では、VRは負の値又はゼロに等しい(図8A、図8B、図8C、図8D及び図8E)。それは、このような呼吸器パターンでは、付加されるデッドスペースが存在しないことを意味する。しかし、肺換気が増加すると仮定すると、Vretは増加し、VRは正の値になる。同様に、吐出期間(Te)が減少すると、Vwashは減少し、VRは正の値になる。動脈血PCO2の増加及び動脈血PO2の減少によって呼吸が促進されるとき、1階換気量は増加し、Teは減少する。従って、VBが比較的小さい場合(この例では0.35及び0.25)、化学的刺激は、より高レベルの肺換気がより大きなVRの値と連携するようにVRが正の値を取るようにする。
【0050】
VRが正の値を取るということは、VEDが有限の値であることを意味する(図8F)。しかし、VRはVEDとは等しくない。吸入中、患者インターフェース内及び管内に存在する気体は特に2つの場所のうち1つの場所へ流れる。それは排出ポートへの流出、又は呼吸器管への流入である。後者のみがVEDを構成する。従って、VRの一部が吸入される。VRの比は吸入流速度に対するVBの値に依存する。大きな値のVBを使用することでVEDを最小化させる。よって、呼吸の化学的刺激は呼吸器パターンに3つの変化をもたらす。1つ目は吐出空気流速度の増加、2つ目はTeの減少、そして3つ目は吸入空気流速度の増加である。各変化は引数VEDに対して独立して振る舞う。それと共に、VBが比較的小さい場合にVEが化学的刺激によって増加するとき、3つの変化はVEDの急上昇を引き起こす。図8Bは、管及び患者インターフェースが新鮮な室内空気によって洗浄(flush)されるときの吐出時間を図示している。この時間はTeの比として表され、TFRACと呼ばれている。TFRACはVBの減少に伴って徐々に増加する。TFRACが100%に等しいとき、VBの臨界値に到達し、さらなるVBの減少によって有限のVEDの値を発生させる。
【0051】
VEDを計算するため、以下の関係を使用する。
VED=VR−(VB)(t) (式5)
ここでtは図9で図示されているように、VRが患者インターフェース及び気体が通る管から排除されるのに必要な時間と定義される。VEDは吸入時間をゼロから徐々に増加させ、吸入容積VSUM及び吐出ポート容積を計算することで計算可能である。つまり、以下の式を使用するということである。
【0052】
【数1】

ここで、VIは吸入流速度、つまり全流から吸入時のバイアス流を引いた速度である。増加手段は、VSUMがVRに等しくなるまで続けられる。
【0053】
図9A、図9B、図9C及び図9Dは、肺換気が動脈血PCO2の増加によって刺激されるときに生じるVret及びVEDの変化を図示している。VBはすべての場合で0.25L/secに等しいと推定され、とどまる場合のVA(5.7L/min)の約2倍である。図9Dは刺激を受けない状態、すなわちとどまる条件(VE=8.0L/sec)での呼吸器パターンを図示している。換気が緩やかに刺激されるとき(VE=15.0L/sec、図9A)、VEDが0.26Lに等しくなるように、Vretは増加し、VEDは減少する。呼吸をさらに刺激することで(図9B)、VEが19.5L/secに等しいときにVEDは0.47Lに等しくなり、VEが25.7L/secに等しいときにVEDは0.79Lに等しくなり(図9C)、かつVEが36.7L/secに等しいときにVEDは1.19Lに等しくなる(図9D)。TFRACは、VB一定でVEが増加するのに伴って徐々に増加する。
【0054】
Vret、VED及びTFRACのVEに対する依存性は図10、図11及び図12にそれぞれ図示されている。これらの図では、VEの4つの値全てが示されている。各プロットはVBの等値線の一群を示している。Vret、VD及びTFRACは、VEの増加に対してほぼ直線的に増加する(図10、図11、図12及び図13)。
【0055】
図13はVBの5つのレベルにおけるVAとVEとの関係を図示している。1.0L/sec以上の値では、全ての点は単調増加曲線上に乗る。しかし、VBより小さな値では、2つの関係は下方へシフトする。このことは、化学的刺激の増加によって引き起こされるVEの増加は、VAの増加を小さくさせるということを意味する。このことは、ループゲインの減少を意味する。ループゲインの減少は2つの関係の傾き変化として定量が可能である。VBの値が0.35L/sec以下の領域では、VEが15L/secより大きな値で、VAは一定となることを明記しておく。換言すると、本発明はVAをある最大値で一定にする。
【0056】
図14は、比logVE/VAに対するループゲインの全体的な依存性を図示している。静止(resting)呼吸用に計算されたこの比は患者に対するVEの規格化指数を与える。logVE/VAが0から1までの範囲、つまり、とどまる条件でVEDがゼロ未満でVEが変化する範囲でその関係をプロットした。とどまるVret/Vwashが0.5から0に減少するとき、ループゲインは急激に減少することを明記しておく。この理由により、中枢性睡眠時無呼吸症の処置での通常の用途では比を0.3に選択する。この状況では、VBはVAの約2倍であり、TFRACは80%に等しい。とどまる条件にて、装置からの吐出気体の適切な洗浄より多くを供給する一方で、この値はループゲインの50%減少という結果をもたらす。従って、ループゲインはある値に減少する。その値は、患者が通常通りに呼吸し、かつ中枢性睡眠時無呼吸症でないときに外部デッドスペースを付加するリスクなく、多くの中枢性睡眠時無呼吸症患者の呼吸を安定化させる。
【0057】
受動的デッドスペース法の目的は、とどまる条件において、VED=0の状態を実現するのに十分な値のVBを有するCPAPを利用することである。しかし、ループゲインを減少させ、呼吸を安定化させるのに十分なだけVEを増加させることで、VEDは増加する。特に、呼吸低下又は通常呼吸中では、装置は呼吸での気体交換非効率を生じさせない。しかし、過呼吸では、VEが通常の値を超えて上昇することでVEDは徐々に増加する。正味の効果は、VAの周期的変動が減衰するように、VEの変化と一致させてVDを動的に調節する。これは、システムのループゲインが減少するように、動脈血PO2及び動脈血PCO2の変動が減少することを意味する。この効果は呼吸を安定化させる役割を果たす。
【0058】
デッドスペースを受動的に調節する利点は、能動的アルゴリズム、VBの動的調節を必要としない比較的単純な装置でループゲインを減少させることが可能なことである。一旦実効的なVBが決定されると、患者インターフェースの吐出口の抵抗を永続的に調節することで受動的調節は実現可能となる。それによって、吐出管レジスタ及びコンピュータ制御の吐出レジスタが不要となる。しかし、患者の呼吸器制御システムのループゲインが非常に大きい場合、受動的装置は呼吸を安定化させるほど十分にループゲインを減少させることはできない。その場合には、動的にVEDを調節す装置を使用する。動的にVBを調節する実施例では、インジケータ変数(Vret、Vwash、TFRAC及びVB/VA)はオンラインで計算される。周期的呼吸は無呼吸の再発又は、自己回帰分析によって検出される。VBは、中枢性睡眠時無呼吸症の証拠が排除される、又はインジケータ変数が限界値(Vret=0.8、Vwash=0.8、TFRAC=80%、VB/VA=2)に到達するまで徐々に減少する。
【0059】
図19は本発明の別な実施例を図示している。中枢性睡眠時無呼吸症患者は全面マスク220を装着している。全面マスク220は、経鼻閉塞して口腔インターフェースを使用するような方法によって漏れ耐性でなくてはならない。マスク220は高インピーダンス送風機222からのバイアス流によって浄化される。送風機は一定速度の空気流をマスクへ供給する。バイアス流は選択可能で、制御コンピュータ224によって即座に調節可能である。バイアス流は低抵抗熱浴管226を介して大気へ流出する。呼吸器空気流(吸入及び吐出共に)はこの熱浴管を介して生じる。管が低抵抗なため、マスク圧力は大気圧に近い値を維持する。熱浴管内の呼吸気流計(流量計228)は、バイアス流及び呼吸器空気流の監視並びに吐出中の洗浄容積及び吐出された1回換気量の計算を可能にする。
【0060】
とどまる条件、又は中枢性睡眠時無呼吸症呼吸が検出されないときには、洗浄容積が管へ吐出される気体の容積を超えるように、バイアス流は比較的大きな値で保持される。従って、吸入が開始されるとき、熱浴管はバイアス流によって完全に洗浄され、患者は室内の空気を吸入する。よって、患者が通常呼吸をし、コンピュータによって換気サイクルが検出さればいときには、外部デッドスペースは付加されない。コンピュータ222が換気サイクルを検出するとき、バイアス流は周期性に同期して変化する。瞬時の換気が移動平均より大きいときに、洗浄容積が吐出された1回換気量未満になるように、バイアス流は減少する。これによって再呼吸が起こり、システムのループゲインは減少する。減呼吸期間中では、再呼吸が生じないように、バイアス流は高い値に維持されている。吐出終端部で熱浴管226内に存在する気体容積はオンラインで計算され、瞬時の換気と移動平均換気との差に比例して調節される。よって、デッドスペースは、過呼吸が発生することで徐々に増加し、それによって動脈血気体の過剰な換気の効果を最小化する。これは順に、無呼吸期間又は過呼吸に続く呼吸低下の程度を最小化し、換気を安定化する。
【0061】
本発明が、その精神又は中心的特徴から離れることなく他の特定形式で実装することが可能なことは当業者には明白である。従って現在開示されている実施例は全ての点において例示であって、限定ではない。本発明の技術的範囲は前述の説明よりはむしろ添付の請求項によって示唆され、請求項で示唆される発明と均等な意味及び範囲内のすべての変化は本発明に含まれる。従って、上述の説明は本発明を限定するものではない。本発明は特許請求の範囲における請求項によってのみ限定される。
【図面の簡単な説明】
【0062】
【図1】中枢性睡眠時無呼吸症を示す図である。
【図2】本発明の再呼吸器の1つの実施例を図示している。
【図2A】歯科器具と共に使用される図2の実施例を図示している。
【図2B】図2Aの口腔器具の実施例を図示している。
【図2C】図2Aの口腔器具の実施例を図示している。
【図3】中枢性睡眠時無呼吸症の呼吸を図示している。
【図4A】送風機からの単一所定の気体流を使用した通気安定化のパッシブループゲインを使用した本発明の1つの実施例を図示している。
【図4B】流量計及びコンピュータを使用した図4Aのシステムの別な実施例を図示している。
【図5】送風機の圧力をコンピュータ制御して、睡眠サイクルにおけるある期間での送風機からの通気圧力を調節する、本発明の1つの実施例を図示している。
【図6】バルブに取り付けられているデッドスペースをコンピュータ制御して、睡眠サイクルにおけるある期間で再呼吸を起こす、本発明の1つの実施例を図示している。
【図7】再循環器を使用して、睡眠サイクルにおけるある期間で再呼吸を増加させる、本発明の1つの実施例を図示している。
【図8A】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8B】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8C】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8D】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8E】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図8F】送風機と患者のインターフェースとを接続する管に空気が流れる様子を図示している。
【図9A】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図9B】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図9C】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図9D】肺の換気が動脈血PCO2の増加によって促進されるときに生じるVret及びVwashの変化を図示している。
【図10】VEに対するVAの依存性を図示している。
【図11】VEに対するVEDの依存性を図示している。
【図12】VEに対するTFRACの依存性を図示している。
【図13】4つのレベルのVBにおけるVAとVEとの関係を図示している。
【図14】比logVE/VAに対するループゲインの一般的依存性を図示している。
【図15】従来のCPAPシステムにおける管内での呼吸空気流を図示している。
【図16】図4Aの実施例における管内での通常の呼吸空気流を図示している。
【図17】図4Aの実施例における管内での過呼吸空気流を図示している。
【図18A】患者のインターフェースにおける出口となる管のサイズが患者の睡眠サイクルでゆっくりと変化する、本発明の実施例を図示している。
【図18B】図18Aの装置における夜間での出口穴サイズの変化の一例を図示するグラフである。
【図19】送風機出力を患者による再呼吸のレベルを調節するアクティブコントロール装置として使用する別な実施例を図示している。
【特許請求の範囲】
【請求項1】
呼吸障害の処置装置であって:
気体供給手段;
患者の気道に適合する、漏れ耐性を有する患者インターフェース;及び、
前記装置の能動的制御素子を調節することで、前記患者の睡眠障害を制御する再呼吸レベルを調節するプロセッサ;
を有し、
前記漏れ耐性患者インターフェースは、前記患者の鼻と口の開口部を覆う全面マスクを有し、かつ前記患者の口腔気道及び経鼻気道のうちの1つを閉塞する手段を組み込み、
前記漏れ耐性患者インターフェースは管を使用することで、前記気体供給手段と操作可能な状態で接続する、
ことを特徴とする装置。
【請求項2】
前記漏れ耐性患者インターフェースは口腔漏れを減少させる歯科器具及び、経鼻漏れを排除する経鼻閉塞装置を有することを特徴とする、請求項1に記載の装置。
【請求項3】
前記漏れ耐性患者インターフェースは出口を有し、
前記の漏れ耐性患者インターフェース出口と操作可能な状態で接続する可変空気抵抗手段をさらに有することを特徴とする、請求項1又は2に記載の装置。
【請求項4】
前記制御装置は、発生する再呼吸レベルを調節する前記可変空気抵抗手段と操作可能な状態で接続することを特徴とする、請求項1、2又は3のいずれか1つに記載の装置。
【請求項5】
前記制御装置は、漏れ耐性患者インターフェースの圧力を大きく変化させることなく、前記管内の暫定的可変空気流を保持することを特徴とする、請求項4に記載の装置。
【請求項6】
前記制御装置は、
前記呼吸障害に関連して呼吸が増加する期間では、前記患者からの吐出気体は前記管へ入り込んで前記気体供給手段へ逆流し、前記出口から排出され、かつ、
前記呼吸障害に関連して呼吸が増加する期間における初期吐出期間に、前記患者からの吐出気体は前記管へ入り込んで前記気体供給手段へ逆流し、前記出口から排出され、次の吸入期間中に十分な量の再呼吸が生じることで呼吸障害を制御できるように前記管の外へ流れることで洗浄する、
ことを特徴とする、請求項4に記載の装置。
【請求項7】
通常呼吸期間中にはほとんど再呼吸が生じないことを特徴とする、請求項6に記載の装置。
【請求項8】
通常呼吸期間中には逆流が生じるが、次の吸入期間前に、洗浄流は十分吐出空気を除去することを特徴とする、請求項6に記載の装置。
【請求項9】
前記呼吸障害に関連して呼吸が増加する期間中に、前記患者からの吐出気体は前記管へ入り込んで前記気体供給手段へ逆流し、前記出口から排出されるように備えられ、
前記気体供給手段からの気体圧力は、前記患者の呼吸器サイクルとは独立に4cmの水圧未満の制御されたレベルに設定される、
ことを特徴とする、請求項4に記載の装置。
【請求項10】
前記制御装置は前記可変空気抵抗手段を調節することで、睡眠サイクルのある期間においてデッドスペースを提供することを特徴とする、請求項9に記載の装置。
【請求項11】
呼吸障害の処置方法であって:
漏れ耐性患者インターフェースを患者の気道に適合させる手順;
前記患者の口腔気道及び経鼻気道のうちの1つを遮断する手順;及び、
前記漏れ耐性患者インターフェースと操作可能な状態で接続する再呼吸装置で前記患者を処置する手順;
を有する方法。
【請求項12】
前記漏れ耐性患者インターフェースは口腔器具及び経鼻閉塞装置を有することを特徴とする、請求項11に記載の方法。
【請求項13】
呼吸障害を処置する装置であって:
CPAP再呼吸装置;及び、
前記CPAP再呼吸装置と操作可能な状態で接続し、口腔器具及び経鼻閉塞装置を有する漏れ耐性患者インターフェース;
を有する装置。
【請求項1】
呼吸障害の処置装置であって:
気体供給手段;
患者の気道に適合する、漏れ耐性を有する患者インターフェース;及び、
前記装置の能動的制御素子を調節することで、前記患者の睡眠障害を制御する再呼吸レベルを調節するプロセッサ;
を有し、
前記漏れ耐性患者インターフェースは、前記患者の鼻と口の開口部を覆う全面マスクを有し、かつ前記患者の口腔気道及び経鼻気道のうちの1つを閉塞する手段を組み込み、
前記漏れ耐性患者インターフェースは管を使用することで、前記気体供給手段と操作可能な状態で接続する、
ことを特徴とする装置。
【請求項2】
前記漏れ耐性患者インターフェースは口腔漏れを減少させる歯科器具及び、経鼻漏れを排除する経鼻閉塞装置を有することを特徴とする、請求項1に記載の装置。
【請求項3】
前記漏れ耐性患者インターフェースは出口を有し、
前記の漏れ耐性患者インターフェース出口と操作可能な状態で接続する可変空気抵抗手段をさらに有することを特徴とする、請求項1又は2に記載の装置。
【請求項4】
前記制御装置は、発生する再呼吸レベルを調節する前記可変空気抵抗手段と操作可能な状態で接続することを特徴とする、請求項1、2又は3のいずれか1つに記載の装置。
【請求項5】
前記制御装置は、漏れ耐性患者インターフェースの圧力を大きく変化させることなく、前記管内の暫定的可変空気流を保持することを特徴とする、請求項4に記載の装置。
【請求項6】
前記制御装置は、
前記呼吸障害に関連して呼吸が増加する期間では、前記患者からの吐出気体は前記管へ入り込んで前記気体供給手段へ逆流し、前記出口から排出され、かつ、
前記呼吸障害に関連して呼吸が増加する期間における初期吐出期間に、前記患者からの吐出気体は前記管へ入り込んで前記気体供給手段へ逆流し、前記出口から排出され、次の吸入期間中に十分な量の再呼吸が生じることで呼吸障害を制御できるように前記管の外へ流れることで洗浄する、
ことを特徴とする、請求項4に記載の装置。
【請求項7】
通常呼吸期間中にはほとんど再呼吸が生じないことを特徴とする、請求項6に記載の装置。
【請求項8】
通常呼吸期間中には逆流が生じるが、次の吸入期間前に、洗浄流は十分吐出空気を除去することを特徴とする、請求項6に記載の装置。
【請求項9】
前記呼吸障害に関連して呼吸が増加する期間中に、前記患者からの吐出気体は前記管へ入り込んで前記気体供給手段へ逆流し、前記出口から排出されるように備えられ、
前記気体供給手段からの気体圧力は、前記患者の呼吸器サイクルとは独立に4cmの水圧未満の制御されたレベルに設定される、
ことを特徴とする、請求項4に記載の装置。
【請求項10】
前記制御装置は前記可変空気抵抗手段を調節することで、睡眠サイクルのある期間においてデッドスペースを提供することを特徴とする、請求項9に記載の装置。
【請求項11】
呼吸障害の処置方法であって:
漏れ耐性患者インターフェースを患者の気道に適合させる手順;
前記患者の口腔気道及び経鼻気道のうちの1つを遮断する手順;及び、
前記漏れ耐性患者インターフェースと操作可能な状態で接続する再呼吸装置で前記患者を処置する手順;
を有する方法。
【請求項12】
前記漏れ耐性患者インターフェースは口腔器具及び経鼻閉塞装置を有することを特徴とする、請求項11に記載の方法。
【請求項13】
呼吸障害を処置する装置であって:
CPAP再呼吸装置;及び、
前記CPAP再呼吸装置と操作可能な状態で接続し、口腔器具及び経鼻閉塞装置を有する漏れ耐性患者インターフェース;
を有する装置。
【図1】


【図2】


【図3】


【図2A】


【図2B】


【図2C】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】


【図8F】


【図9A】


【図9B】


【図9C】


【図9D】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18A】


【図18B】


【図19】




【図2】


【図3】


【図2A】


【図2B】


【図2C】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】


【図8F】


【図9A】


【図9B】


【図9C】


【図9D】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18A】


【図18B】


【図19】


【公開番号】特開2011−235123(P2011−235123A)
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【出願番号】特願2011−151478(P2011−151478)
【出願日】平成23年7月8日(2011.7.8)
【分割の表示】特願2006−549808(P2006−549808)の分割
【原出願日】平成17年1月21日(2005.1.21)
【出願人】(505432728)ユーティアイ・リミテッド・パートナーシップ (2)
【氏名又は名称原語表記】UTI LIMITED PARTNERSHIP
【住所又は居所原語表記】3353−31st Street, NW, Calgary, Alberta, Canada T2L 2K7
【公開日】平成23年11月24日(2011.11.24)
【国際特許分類】
【出願日】平成23年7月8日(2011.7.8)
【分割の表示】特願2006−549808(P2006−549808)の分割
【原出願日】平成17年1月21日(2005.1.21)
【出願人】(505432728)ユーティアイ・リミテッド・パートナーシップ (2)
【氏名又は名称原語表記】UTI LIMITED PARTNERSHIP
【住所又は居所原語表記】3353−31st Street, NW, Calgary, Alberta, Canada T2L 2K7
[ Back to top ]

