改善された安定性およびヘマトクリット性能(performance)を有するバイオセンサー系
本発明は、電気化学的センサーストリップ、および、試料中の分析対象物濃度を決定する、または濃度決定の性能を改善する方法に関連する。電気化学的センサーストリップは多くとも8μg/mm2のメディエーターを含むことができる。ストリップ、ストリップ試薬層、またはその方法は、20℃で4週間保管された比較ストリップと比べて、50℃で4週間保管した後の±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比の、少なくとも1つを有する濃度値の決定を提供することができる。分析対象物の定量的な決定の性能を上昇させる方法もまた、提供される。
【発明の詳細な説明】
【技術分野】
【0001】
関連する出願の参照
[001] 本出願は、その全体を参照として援用される、2006年9月22日に出願された、“改善された安定性およびヘマトクリット性能を有するバイオセンサー系”と題される、アメリカ合衆国仮特許出願第60/846,688号に対する優先権を主張する。
【背景技術】
【0002】
[002] バイオセンサーは、全血、尿、または唾液などの、生体液の分析をもたらす。典型的には、バイオセンサーは生体液試料を分析して、生体液中の、グルコース、尿酸、乳酸塩、コレステロール、またはビリルビンなどの、一つあるいはそれ以上の分析対象物の濃度を決定する。この分析は、生理学的異常の診断および治療に有用である。例えば、糖尿病個体はバイオセンサーを使用して、食餌および/または投薬の調節のため、全血中のグルコース濃度を決定することができる。
【0003】
[003] バイオセンサーは、卓上、携帯用、および、同様の装置を使用して実行されてよい。携帯用の装置は、手持ち式であってよい。バイオセンサーを、一つあるいはそれ以上の分析対象物を分析するように設計することが可能であり、またバイオセンサは、異なる容量の生体液を使用することができる。いくつかのバイオセンサーは、容量が0.25〜15マイクロリットル(μl)であるような、一滴の全血を分析することができる。携帯型の測定装置の例には、Bayer CorporationのAscensia Breeze(登録商標)およびElite(登録商標)測定装置;イリノイ州Abbott ParkのAbbottから入手可能なPrecision(登録商標)バイオセンサー;インディアナ州IndianapolisのRocheより入手可能なAccucheck(登録商標)バイオセンサー;および、カリフォルニア州MilpitasのLifescanより入手可能なOneTouch Ultra(登録商標)バイオセンサーが含まれる。卓上測定装置の例には、インディアナ州West LafayetteのBAS Instrumentsより入手可能なBAS 100B Analyzer;テキサス州AustinのCH Instrumentsより入手可能なCH Instruments' Electrochemical Workstation;カンザス州LawrenceのCypress Systemsより入手可能なCypress Electrochemical Workstatioin;および、ニュージャージー州PrincetonのPrinceton Research Instrumentsより入手可能なEG&G Electrochemical Instrumentが含まれる。
【0004】
[004] バイオセンサーは通常、電気シグナルを測定して、生体液試料中の分析対象物濃度を決定する。分析対象物は一般に、試料に入力シグナルが印加されると、酸化/還元または酸化還元反応を受ける。酵素または同様の種を試料に添加して、酸化還元反応を促進させることができる。入力シグナルは通常、電流または電圧などの電気シグナルである。酸化還元反応により、入力シグナルに応じた出力シグナルが生じる。出力シグナルは通常、電流または電圧などの電気シグナルであり、それを測定して、そして生体液中の分析対象物の濃度と相関させることができる。
【0005】
[005] 多くのバイオセンサーは、測定装置およびセンサーストリップを有する。生体液試料は、センサーストリップ内の試料チャンバーへと導入される。センサーストリップは、分析のための測定装置中に配置される。測定装置は通常、センサーストリップ内の導電体と接続する電気接点を有する。導電体は一般に、試料チャンバーへと伸びる、作用電極、対電極、および/またはその他の電極に接続される。測定装置は、電気接点を介して、センサーストリップ内の導電体へと入力シグナルを印加する。導電体は電極を介して、試料チャンバー内に沈着された試料へと入力シグナルを伝達する。分析対象物の酸化還元反応により入力シグナルに応じた出力シグナルが生じる。測定装置により、出力シグナルに応じた分析対象物濃度が決定される。
【0006】
[006] センサーストリップには、生体液試料中の分析対象物と反応する試薬が含まれてもよい。試薬には、分析対象物の酸化還元反応を促進するためのイオン化剤、および、分析対象物と導体との間の電子の移動を補助するメディエーターまたはその他の物質が含まれてもよい。イオン化剤は、全血試料中のグルコースの酸化を触媒する、分析対象物特異的な酵素などの、酸化還元酵素であってもよい。試薬には、酵素とメディエーターを一緒に保持する接着剤が含まれてもよい。
【0007】
[007] 従来型のバイオセンサーにおいて用いられる試薬組成物の、不都合な点の一つは、センサーストリップが保管される際に生じる、正確性または精密性のどちらかの測定性能の変化である。試料の分析対象物濃度を決定するために、測定装置が使用する電子技術および分析方法は、一般に、最初に製造された際に機能するセンサーストリップにおける試薬組成物を考慮して、選択される。しかしながら、運搬および保管棚での保管の後、試薬組成物は、時間および温度によって分解する。この試薬組成物の化学変化は、測定性能の低下をもたらす可能性がある。
【0008】
[008] バイオセンサー試薬組成物の長期間の安定性を上昇させるため、従来型のバイオセンサーは通常、試料の分析に必要とされるこれらの試薬量に関して、実質的に過剰な酵素およびメディエーターに依存する。これらの試薬が時間の経過とともに分解することを予測して、従来型の試薬組成物には、分析対象物と化学量論的に反応するために必要とされるよりも、大幅に多量の酵素および/またはメディエーターが含まれる。犠牲試薬の使用によって、バイオセンサーの値段が上昇することに加えて、不必要な試薬は、より大きな試料容量、より長い分析時間を必要とする可能性があり、そして、多くの因子によりバイオセンサーの測定性能を低下させる可能性がある。
【0009】
[009] 例えば、PCT公開WO 88/03270は、スクリーン印刷法において、全沈着密度3 mg/cm2(30μg/mm2)を開示する。K3Fe(CN)6の相対量は、57.7%であり、リン酸バッファーが28.8%、そしてグルコースオキシダーゼ(GO)が3.6%であった。これらの百分率をセンサーストリップ上の沈着密度に変換すると、K3Fe(CN)6の密度は17.31μg/mm2、リン酸バッファーの密度は8.64μg/mm2、そしてGOの密度は1.08μg/mm2という結果になる。別の例においては、直径4 mmのディスク電極上に15μLのトルエン中0.1 M 1,1’-ジメチルフェロセン溶液の沈着が、アメリカ合衆国特許第4,711,245号第17欄の25〜35行に開示される。分子量214 M.U.なので1,1’-ジメチルフェロセンメディエーターは、沈着密度25.5μg/mm2で適用された[(15μL*0.1 M*214 g/mol)/22*3.14 mm2 = 25.5μg/mm2]。さらなる例において、1 mLの水中、40 mgのGO、16 mgのK3Fe(CN)6、および20 mgのCMCを含む4μlの水溶液を、センサー電極上へ沈着させることが、アメリカ合衆国特許第5,958,199号に開示される。この例では、推定電極領域(沈着領域)6 mm2において、沈着密度はGOが6.67μg/mm2、K3Fe(CN)6が10.67μg/mm2、およびCMCが13.33μg/mm2であった。さらなる例において、その他の成分とともに約900 mLの水中に溶解した59 gのK3Fe(CN)6を含む試薬組成が、アメリカ合衆国特許第5,997,817号に記述される。約4.5μLのこの試薬は、21.4 mm2(3.2×6.7)の開口部上に沈着され、メディエーターの沈着密度は13.96μg/mm2となった(4.5×10-3 mL*59 g/900 mL)。
【0010】
[0010] これらの例のそれぞれにおいて、試薬組成物は、酵素の沈着密度が1〜6μg/mm2の範囲であるのに対して、メディエーターの沈着密度は10〜25μg/mm2の範囲を有した。酵素と比較して、メディエーターのこの大量のローディングは、作用電極および対電極の両方への、組成物の単回適用に起因する可能性がある。センサー設計によっては、メディエーターは対電極において、作用電極における電気化学的活性を補佐するように機能することができる。このように、両方の電極をカバーする1つの試薬組成物沈着が、実質的に作用電極へのメディエーターのオーバーローディングをもたらす可能性がある。
【0011】
[0011] 過剰な酵素およびメディエーターを使用して、正確なグルコース測定のために十分な活性成分が存在することを確実にすることを、これらの例が示す。長期間保管後に、増加された犠牲量の試薬を用いて製造されたセンサーストリップを使用することは、測定性能において不利益なドリフトをもたらす可能性がある。このドリフトは、少なくとも2つの方法により観察される可能性がある:(1)時間に応じたバックグラウンド電流の増加(検量線の切片に影響する)および(2)センサー感受性におけるシフト(検量線の傾きに影響する)。
【0012】
[0012] 保管の間に、酸化されたメディエーターと、酵素系およびポリマーとの相互作用により、還元されたメディエーターが産生される可能性がある。これは、熱力学によって支配されると考えられる、自然な過程である。メディエーターまたは酵素の量が多いほど、産生される還元されたメディエーターの量も多くなる。時間の経過とともに還元されたメディエーターの濃度が増加するため、バックグラウンド電流はセンサーストリップの保管期限の終わりに向けて上昇するであろう。
【0013】
[0013] 保管されたセンサーストリップの使用の前に、センサー性能に対するドリフトの効果を減少させる、複数の方法が提案されてきた。例えば、Genshawらは、アメリカ合衆国特許第5,653,863号において、分析前に比較的長い初期パルスを使用して、運搬および保管の間に還元されたメディエーターを酸化する方法を開示した。効果的ではあるが、この方法は分析を完了するのに必要な時間を長くした。
【0014】
[0014] 従って、運搬および保管後のバイオセンサーの測定性能を改善するために、試薬組成物の長期間安定性を増加させることが望ましいだろう。このような試薬組成物の長期間安定性の増加は、バイオセンサーの測定性能を上昇させ、また、センサーストリップのより長い保管期間を提供することができる。試薬組成物中に含まれるの犠牲酵素および/またはメディエーターの量を減少させ、そして、分析が完了するのに必要とされる時間を短縮させることもまた、望ましいであろう。
【0015】
[0015] 全血(WB)試料におけるグルコース濃度の測定に使用される、従来のバイオセンサーの別の欠点は、“ヘマトクリット効果”と言われる。水およびグルコースに加えて、WB試料は赤血球(RBC)を含む。ヘマトクリットとは、WB試料の全容量と比較したRBCにより占められるWB試料の容量であり、またしばしばパーセンテージで表現される。ヘマトクリット効果は、バイオセンサーの1つあるいはそれ以上の電極への、分析対象物および/またはメディエーターの拡散を、赤血球が阻害するときに起こる。バイオセンサーにより測定される出力シグナルは、分析対象物および/またはメディエーターの拡散の速度に対応するため、RBCはこの拡散過程を妨害することにより、分析に誤差をもたらす可能性がある。従って、WB試料において、%-ヘマトクリット系較正(calibration)からのヘマトクリットのパーセント(赤血球の容量)の偏差が大きいほど、バイオセンサーから得られるグルコース値におけるヘマトクリットバイアス(誤差)は大きい。
【0016】
[0016] WB試料は一般に、20%から60%の範囲のヘマトクリットパーセンテージを有し、平均〜40%である。同一のグルコースレベルを含むが、20%、40%、および60%のヘマトクリットを有するWB試料を検査した場合、一組の較正定数(例えば、40%のヘマトクリットを含むWB試料の傾きおよび切片)に基づいた系によって、異なる3つのグルコース値が報告されるだろう。RBCが電極表面での分析対象物および/またはメディエーターの拡散を阻害するため、グルコース濃度が同じであるにも関わらず、その系においては、20%ヘマトクリットWB試料は40%ヘマトクリットWB試料よりもグルコースを多く含み、また、60%ヘマトクリットWB試料は、40%ヘマトクリットWB試料よりも少ないグルコースを含むように報告されるであろう。このように、従来のバイオセンサーは、より低い分析対象物濃度と、RBCが拡散阻害をする、より高い分析対象物物濃度との識別ができない可能性がある。
【0017】
[0017] 従来のバイオセンサーは一般に、実際のヘマトクリット含有量に関わらず、WB試料においては40%のヘマトクリット含有量を仮定してグルコース濃度を報告するように設定される。これらの系では、40%より少ないか、または多いヘマトクリットを含む血液試料に対して行われるグルコース測定はいずれも、ヘマトクリット効果に起因するヘマトクリットバイアスを含むであろう。
【0018】
[0018] グルコース測定へのヘマトクリット効果によるバイアスを減少させるため、様々な方法および技術が提案されてきた。例えば、Oharaらは、アメリカ合衆国特許第6,475,372号において、ヘマトクリット効果に関して補正するために、順方向および逆方向の電位パルスからの電流の比を使用する方法を開示した。McAleerらは、アメリカ合衆国特許第5,708,247号および第5,951,836号において、ヘマトクリット効果を減少させるために、電極表面からRBCを濾過する、シリカ粒子を使用する試薬組成を開示した。Carterらは、アメリカ合衆国特許第5,628,890号において、ヘマトクリット効果を減少させるため、血液試料を分布させるためのメッシュ層と広い電極間隔と組み合わせて使用する方法を開示した。
【0019】
[0019] ヘマトクリット効果に起因するバイアスを減少させるためのこれらの従来技術には、(a)ヘマトクリット効果を最小限にするポリマーの共沈着(co-deposition)、(b)ポリマー層における濾過効果を促進する、様々な種類の溶融石英の添加、(c)順方向および逆方向の電位パルスからの電流の比に基づく補正係数、および(d)全血試料の液抵抗の存在を使用することによる自己補正、が含まれた。これらの方法は有用である可能性があるが、従来のグルコースセンサーは、一般に約15%から30%の、ヘマトクリット効果に起因する顕著な分析的バイアスを示し続ける。従って、ヘマトクリット効果由来のバイアスを減少させる、生体液中の分析対象物、特に全血のグルコース含有量の定量のための系を提供することが、望ましいであろう。
【先行技術文献】
【特許文献】
【0020】
【特許文献1】WO 88/03270
【特許文献2】アメリカ合衆国特許第4,711,245号
【特許文献3】アメリカ合衆国特許第5,958,199号
【特許文献4】アメリカ合衆国特許第5,997,817号
【特許文献5】アメリカ合衆国特許第5,653,863号
【特許文献6】アメリカ合衆国特許第6,475,372号
【特許文献7】アメリカ合衆国特許第5,708,247号
【特許文献8】アメリカ合衆国特許第5,951,836号
【特許文献9】アメリカ合衆国特許第5,628,890号
【発明の概要】
【0021】
[0020] 一つの観点において、電気化学的センサーストリップには、基板、基板上の第一電極および第二電極、および基板上の蓋が含まれる。ストリップには、第一導体上に少なくとも1つの第一層が含まれ、第一層には、多くても8μg/mm2のメディエーターを含む、試薬層が含まれる。このストリップは、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比のうち、少なくとも1つを有する、決定された濃度値を提供する。
【0022】
[0021] ストリップの第一電極および第二電極は、実質的に同一平面にあり、また、第二電極は、第二導体上の第一層を含むことができる。第二電極は、第二導体上の第二層を含むことができ、また、第二層には第一層の試薬層とは組成の異なる試薬層を含まれていてもよい。これらの電極は200μmよりも広く隔てられてよく、また、蓋の上部から少なくとも100μmは隔てられてよい。
【0023】
[0022] ストリップの試薬層の平均初期厚は、8μmより薄くてよく、あるいは、0.25μmから3μmであってよい。ストリップの試薬層は、沈着密度が多くとも0.2μL/mm2において、試薬溶液から形成されることができる。試薬層には、ポリマー接着剤として、ポリ(エチレンオキシド)、ポリビニルアルコール、ヒドロキシエチレンセルロース、カルボキシメチルセルロース、またはそれらの組み合わせが含まれてよい。ポリマー接着剤の沈着密度は、第一導体上で、大きくとも2μg/mm2であってよい。ポリマー接着剤は、部分的に水溶性であってよく、および/または、水和によりゲル状物質を形成することができる。
【0024】
[0023] 試薬層には、多くとも0.8μg/mm2の沈着密度の酵素系が含まれてよく、そして/あるいは、多くとも1.3ユニットの酵素が含まれていてよい。作用電極上の試薬層には、多くとも2μg/mm2のメディエーターが含まれてよい。メディエーターは2電子移動メディエーターであってよく、また、3-フェニルイミノ-3H-フェノチアジン、3-フェニルイミノ-3H-フェノキサジン、それらの塩、それらの酸、それらの誘導体、またはそれらの組み合わせであってよい。メディエーターは、ヘキサシアノ鉄(II)酸塩(ferricyanide)の酸化還元電位よりも低い、少なくとも100 mVの酸化還元電位を有することができる。
【0025】
[0024] ストリップは、-20℃で2週間または4週間保管された比較ストリップと比べて、50℃で2週間または4週間保管した後に±5%より小さい安定性バイアスを、それぞれ有することができる。ストリップは、20%から60%のヘマトクリットを含む全血試料において、±5%より小さいヘマトクリットバイアスを有することができる。ストリップは、大きくとも10 mg/dL、または大きくとも1 mg/dLである、切片対傾き比を有することができる。
【0026】
[0025] 別の観点において、電気化学的センサーストリップには、基板、基板上の第一電極および第二電極、および基板上の蓋が含まれる。このストリップには、第一導体上に少なくとも1つの第一層を含み、この第一層は、メディエーターおよび酵素系を含む試薬層を含み、この試薬層は、-20℃で2週間保管されたストリップと比較して50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比のうちの、少なくとも1つを有する、決定された濃度値を提供する。
【0027】
[0026] 別の観点において、試料中の分析対象物の濃度を決定する方法が提供される。その方法は、試料にパルスシーケンスを印加することが含まれ、このパルスシーケンスは、30秒以内に少なくとも3回のデューティサイクルを含む。この方法にはまた、試料中の分析対象物濃度を決定することが含まれ、その濃度は、±10%より小さい安定性バイアス、20%から60%のヘマトクリット範囲にわたる全血試料において±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比のうちの、少なくとも1つを有する。
【0028】
[0027] その方法には、9秒以内に少なくとも3回のデューティサイクルを含むことができ、そしてパルスシーケンスは長くとも5秒間で完了することができる。試料中の分析対象物濃度の決定することには、パルスシーケンスの印加から2秒以内に得られる電流測定より、試料中の分析対象物濃度を決定することを含むことができる。各デューティサイクルには、励起および緩和が含まれていてもよく、各励起は0.01秒から3秒の持続時間を有していてもよい。励起は、長くとも10秒、または長くとも2秒の合計持続時間を有していてもよく、そして励起は、500 mV異なる振幅を有していてもよい。励起は、パルスシーケンスの時間の、長くとも45%である可能性がある。緩和のそれぞれは、短くとも0.2秒の持続時間を有していてもよいか、あるいは0.2秒から3秒の持続時間を有していてもよい。パルスシーケンスは、0.75秒から3秒持続する初期励起を含むことができ、この初期励起はデューティサイクルの励起よりも持続が長い。
【0029】
[0028] この方法は、-20℃で2週間または4週間保管された比較ストリップと比べて、50℃で2週間または4週間保管した後に±5%より小さい安定性バイアスをそれぞれ有する濃度を決定することができる。その濃度は、20%から60%のヘマトクリットを含む全血試料において、±5%より小さいヘマトクリットバイアスを有することができる。その濃度は、大きくとも10 mg/dL、または、大きくとも1 mg/dLの切片対傾き比を有することができる。
【0030】
[0029] 別の観点において、定量的な分析対象物決定の性能を上昇させる方法には、液体組成物を有する分析対象物含有試料を電気化学的センサーストリップに導入することを含み、そのストリップは、基板、基板上の第一導体、基板上の第二導体、および、少なくとも第一導体上の少なくとも1つの第一層を有し、その少なくとも1つの第一層は、ポリマー接着剤を含む試薬層を含み、そして、試料は第一導体と第二導体の間の電気的連通を提供する。この方法はまた、30秒以内または9秒以内に少なくとも4回の読み出しパルスという形態で、第一導体と第二導体との間に電位を印加することを含み、そしてこの読み出しパルスの少なくとも1つを測定して、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%に渡るヘマトクリット範囲の全血試料における±10%より小さいヘマトクリットバイアス、大きくとも10 mg/dLの切片対傾き比、および、それらの組み合わせから選択される、少なくとも1つの性能パラメーターに起因する性能の上昇を伴う、試料中の分析対象物濃度の定量的な値を提供する。
【0031】
[0030] 読み出しパルスは、長くとも5秒間で完了することができ、その読み出しパルスは電位印加から2秒間内に測定されることができ、そして、その読み出しパルスは、それぞれ0.01秒から3秒の持続時間を有することができる。読み出しパルスは、長くとも2秒間の持続時間を有することができ、そして、500 mV以内の差をもつ振幅であってよい。
【0032】
[0031] この方法は、-20℃で2週間または4週間保管された比較ストリップと比べて、50℃で2週間または4週間保管した後に±5%より小さい安定性バイアスをそれぞれ有する、定量的な値を決定することができる。この方法は、20%から60%のヘマトクリットを含む全血試料において、±5%より小さいヘマトクリットバイアスを有する定量的な値を決定することができる。この方法は、大きくとも10 mg/dL、または大きくとも1 mg/dLである、切片対傾き比を有する定量的な値を決定することができる。
【図面の簡単な説明】
【0033】
[0032] 本発明を、以下の図面および説明を参照することにより、より良く理解することができる。図中の構成要素は、必ずしも等縮尺ではなく、代わりに、本発明の原理を示す際に強調されている場合がある。さらに、図中において、同じ参照番号は、異なる図面を通じて対応する部分を一般的に示す。
【図1−1】[0033] 図1Aは、組み立てられたセンサーストリップの透視描写である。
【図1−2】[0034] 図1Bは、蓋が外された場合のセンサーストリップの上面図である。
【図2−1】[0035] 図2Aは、図1Bのセンサーストリップの端面図である。
【図2−2】[0036] 図2Bは、メディエーターによる、酵素系から作用電極への1つの電子の移動を示す。
【図2−3】[0037] 図2Cは、メディエーターによる、酵素系から作用電極への2つの電子の移動を示す。
【図3】[0038] 図3は、試料中の分析対象物の存在および濃度を決定する電気化学的方法を示す。
【図4】[0039] 図4A〜図4Dは、複数回のデューティサイクルが試料導入後のセンサーストリップに印加される、ゲート電流測定用パルスシーケンスの例を示す。
【図5−1】[0040] 図5Aおよび図5Bは、20%、40%、および55%のヘマトクリットレベルでの、PQQ-GDH酵素系を含むセンサーストリップにおける、用量反応曲線を示す。
【図5−2】[0041] 図5Cは、実験データより決定されるI/S比をmg/dLで示す。
【図5−3】[0042] 図5Dは、試薬組成物RC2、RC3、またはRC4を有するセンサーストリップから決定される、複数のグルコース濃度における0 mg/dLから20 mg/dLのI/S比を示す。
【図5−4】[0043] 図5Eは、血漿、および40%ヘマトクリットの全血試料を有する系でのほぼ同一なヘマトクリット性能を示す。
【図6−1】[0044] 図6Aは、PQQ-GDH酵素系を含む4つの試薬組成物における、50℃で2週間後の安定性バイアスを示す。
【図6−2】[0045] 図6Bは、PQQ-GDH酵素系を含む4つの試薬組成物における、50℃で4週間後の安定性バイアスを示す。
【図6−3】[0046] 図6Cは、PQQ-GDH酵素系を含む3つの試薬組成物における、80%の相対湿度下、25℃で52週間後の安定性バイアスを示す。
【図6−4】[0047] 図6Dは、分析対象物濃度の計算に使用されるデータポイントが、分析開始後、様々な時点で取られる、RC2を含むセンサーストリップにおける安定性バイアスの変動を示す。
【図7−1】[0048] 図7Aは、複数の全血試料におけるセンサーストリップからの用量反応曲線を示す。
【図7−2】[0049] 図7Bは、複数の全血試料より得られる、4つの製造ロットのセンサーストリップにおける絶対へマトクリットバイアスの広がりを示す。
【図7−3】[0050] 図7Cは、本発明のセンサーストリップと従来型のセンサーストリップとのヘマトクリット感受性を比較する。
【発明を実施するための形態】
【0034】
[0051] バイオセンサーは、グルコースレベルのほとんど瞬時の測定という利点を患者に提供する。これらの測定における誤差は、試薬組成物の分解、および/または、ヘマトクリット効果に起因する可能性がある。試薬組成物の分解は、センサーストリップが製造後、運搬および保管される期間中に生じる、継続的に起こる過程である。温度を含む複数の因子が、試薬組成物の分解の速度に影響を及ぼす可能性がある。ヘマトクリット効果は、測定可能な種の、作用電極の導体表面への拡散速度に、赤血球がランダムに影響を及ぼす際に起こる。
【0035】
[0052] センサーストリップ上に使用されるメディエーターおよび/または酵素の量を減らすことにより、従来型のバイオセンサーおよび試薬組成物との関連で、試薬組成物の長期間安定性を増加させることができる。つまり、センサーストリップの安定性バイアス、および、切片対傾き比を、改善することができる。さらに、安定性が増強された試薬組成物とゲート分析法を組み合わせることにより、ヘマトクリット効果を減少させることができる。このように、これらのおよびその他の性能パラメーターの1つあるいはいずれかの組み合わせ、は、本発明に従って改善される可能性がある。
【0036】
[0053] 1つの観点において、本発明のバイオセンサーは、-20℃で4週間保管されたセンサーストリップと比べて、50℃で4週間保管した後、好ましくは±10%より小さく、より好ましくは、±5%より小さい安定性バイアスを示す。別の観点において、本発明のバイオセンサーは、20%から60%のヘマトクリットを含むWB試料において、好ましくは±10%より小さく、より好ましくは、±5%より小さいヘマトクリットバイアスを示す。別の観点において、本発明のバイオセンサーは、好ましくは大きくとも20 mg/dL、より好ましくは、大きくとも10 mg/dLまたは大きくとも6 mg/dL、および、さらにより好ましくは、大きくも1 mg/dLである、切片対傾き比を示す。センサーストリップの、これらおよびその他の性能パラメーターを改善することができる。
【0037】
[0054] 図1Aおよび図1Bは、本発明中で使用することができるセンサーストリップ100を示す。図1Aは、組み立てられたセンサーストリップ100の透視図であり、蓋120により少なくとも部分的に覆われたセンサー基板110を含み、蓋120には穴130、試料カバー領域140、および、投入端開口部150が含まれる。部分的に囲まれた容量160(キャピラリーギャップまたはキャップ-ギャップ)は、基板110と蓋120との間に形成される。アメリカ合衆国特許第5,120,420号および第5,798,031号に記述されるものなど、本発明に矛盾しない、その他のセンサーストリップ設計もまた、使用することができる。
【0038】
[0055] 分析のための液体試料は開口部150へ液体を導入することにより、キャップ-ギャップ160へと移すことができる。液体は、先に含まれていた空気を穴130から押し出しながら、キャップ-ギャップ160を満たす。キャップ-ギャップ160は、キャップ-ギャップ中に液体試料を保持することを補助する組成物(示されていない)を含むことができる。前記組成物の例には、カルボキシメチルセルロースおよびポリエチレングリコールなどの水膨潤性ポリマー;および、デキストランおよびポリアクリルアミドなどの多孔性ポリマーマトリクスが含まれる。
【0039】
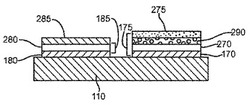
[0056] 図1Bは、蓋120を外したセンサーストリップ100の上面図を示す。導体170および180は、開口部150からそれぞれ作用電極175および対電極185へと誘電層190の下を走ることができる。1つの観点において、作用電極175および対電極185は、図に示される通り、実質的に同一平面に存在することができる。関連する観点において、作用電極175および対電極185は200μmまたは250μmより広く隔てられていてもよく、また、蓋120の上部から少なくとも100μm隔てられていてもよい。別の観点において、作用電極175および対電極185は、200μmよりも狭く隔てられていてもよい。誘電層190は、部分的に電極175、185を覆うことができ、そして、絶縁ポリマーなどの適当な誘電物質から作ることができる。
【0040】
[0057] 対電極185は、センサーストリップ100の作用電極175における電気化学的活性を補佐することができる。1つの観点において、作用電極175における電気化学的活性を補佐する電位は、対電極185を炭素などの不活性物質から形成すること、および、キャップ-ギャップ160内にヘキサシアノ鉄(II)酸塩(ferricyanide)などの可溶性酸化還元種を含ませることにより、センサー系に提供されることができる。別の観点において、対電極185における電位は、Ag/AgClなどの酸化還元ペアから対電極185を形成することにより達せられる参照電位であってよく、組み合わさった参照-対電極を提供する。あるいは、センサーストリップ100には、第三導体および第三電極(示されていない)とを提供して、センサー系に参照電位を提供することができる。
【0041】
[0058] 図2Aは図1Bに示されるセンサーストリップの端面図を示し、作用電極175および対電極185の層構造を示す。導体170および180は、基板110上に直接形成させることができる。表面導体層270および280は、それぞれ導体170および180の上に、任意に沈着することができる。表面導体層270、280は、同じ物質または異なる物質から作ることができる。
【0042】
[0059] 導体170、180、および表面導体層270、280を形成するために使用される、1つあるいは複数の物質は、すべての電導体を含むことができる。好ましい電導体は非イオン化物質であり、そのため試料の分析の間に、正味の酸化、または、正味の還元を受けない。導体170、180には、好ましくは、金、銀、白金、パラジウム、銅、またはタングステンなどの、金属または金属ペーストの薄い層が含まれる。表面導体層270、280には、好ましくは炭素、金、白金、パラジウム、またはそれらの組み合わせが含まれる。表面導体層が導体上に存在しない場合、導体は、好ましくは非イオン化物質から作られる。
【0043】
[0060] 箔蒸着、化学気相蒸着、スラリー塗布などを含む、センサーストリップの操作と互換性のある従来のすべての手法によって、表面導体物質を、導体170、180上に沈着することができる。アメリカ合衆国特許第5,798,031号に記述される通り、スラリー塗布の場合、混合物をインクとして導体170、180に印加することができる。
【0044】
[0061] 試薬層275および285を、それぞれ導体170および180上に沈着することができる。その層は、試薬および任意で接着剤を含む、少なくとも1つの試薬組成物から形成される。接着剤は、好ましくは、少なくとも部分的に水溶性のポリマー物質である。1つの観点において、接着剤は、試料により水和されると、ゲルまたはゲル状物質を形成することができる。別の観点において、接着剤は赤血球を濾過することができる。
【0045】
[0062] 接着剤としての使用に適する、部分的に水溶性のポリマー物質には、ポリ(エチレンオキシド)(PEO)、カルボキシメチルセルロース(CMC)、ポリビニルアルコール(PVA)、ヒドロキシエチレンセルロース(HEC)、ヒドロキシプロピルセルロース(HPC)、メチルセルロース、エチルセルロース、エチルヒドロキシエチルセルロース、カルボキシメチルエチルセルロース、ポリビニルピロリドン(PVP)、ポリリジンなどのポリアミノ酸、ポチスチレンスルホン酸、ゼラチン、アクリル酸、メタアクリル酸、でんぷん、それらの無水マレイン酸塩、それらの誘導体、およびそれらの組み合わせが含まれてもよい。上記の接着剤物質の中で、PEO、PVA、CMC、およびHECが好ましく、現在のところ、CMCがより好ましい。
【0046】
[0063] 接着剤に加えて、試薬層275および285には、同一の試薬、または異なる試薬が含まれてよい。同一の試薬が含まれる場合、試薬層275および285は同一の層であってよい。1つの観点において、第一層275中に存在する試薬は、作用電極175と共に使用するために選択されることができ、一方、第二層285中に存在する試薬は、対電極185と共に使用するために選択されることができる。例えば、層285中の試薬は、試料と導体180との間の電子の自由な流れを促進することができる。同様に、層275中の試薬は、分析対象物の反応を促進することができる。
【0047】
[0064] 試薬層275は、分析対象物、特に複雑な生物学的試料中の分析対象物、へのセンサー系の特異性を高めつつ分析対象物の反応を促進することができる、分析対象物に特異的な酵素系を含むことができる。酵素系は、1つあるいはそれ以上の酵素、補因子、および/または、分析対象物との酸化還元反応に参加するその他の部分を含むことができる。例えば、アルコールオキシダーゼを使用して、試料中のアルコールの存在に対して感度の高いセンサーストリップを提供することができる。そのような系は、血液アルコール濃度を測定するのに有用であるだろう。別の例では、グルコースデヒドロゲナーゼまたはグルコースオキシダーゼを使用して、試料中のグルコースの存在に対して感度の高いセンサーストリップを提供することができる。この系は、例えば糖尿病であることが既知の患者、または、疑われる患者において、血液グルコース濃度を測定する際に有用であるだろう。
【0048】
[0065] 酵素系において使用される酵素には、アルコールデヒドロゲナーゼ、乳酸脱水素酵素、β-ヒドロキシ酪酸脱水素酵素、グルコース-6-リン酸デヒドロゲナーゼ、グルコースデヒドロゲナーゼ、ホルムアルデヒドデヒドロゲナーゼ、リンゴ酸脱水素酵素、および3-ヒドロキシステロイド脱水素酵素が含まれる。好ましい酵素系は、酸素非依存性であり、つまり、実質的に酸素により酸化されない。
【0049】
[0066] そのような酸素非依存性酵素ファミリーの1つは、グルコースデヒドロゲナーゼ(GDH)である。異なる補酵素または補因子を使用して、異なるメディエーターにより異なる様式で、GDHは仲介されることができる。GDHとのその関連性に応じて、フラビンアデニンジヌクレオチド(FAD)などの補因子は、FAD-GDHの場合のように、宿主酵素によってきつく捕えられることができる;あるいは、ピロロキノリンキノン(PQQ)などの補因子は、PQQ-GDHというように、宿主酵素と共有結合することができる。これらの各酵素系の補因子は、恒久的に宿主細胞により捕えられているか、あるいは、補酵素およびアポ酵素は、試薬組成物に酵素系が加えられる前に再構成されることができる。補酵素はまた、試薬組成物中の宿主酵素部分に独立して加えられ、ニコチンアミドアデニンジヌクレオチドNAD/NADH+またはニコチンアミドアデニンジヌクレオチドリン酸NADP/NADPH+の場合のように、宿主酵素の触媒的機能を補助する。
【0050】
[0067] 試薬層275は、分析対象物の反応の結果を、表面導体270および/または導体170へ、より効率的に伝えるためのメディエーターを含むことができる。メディエーターはその電気化学的活性に基づいて、2つのグループに分けることができる。1電子移動メディエーターは、電気化学的反応の条件下で、1つのさらなる電子を捕えることができる化学部分(chemical moiety)であり、一方、2電子移動メディエーターは、反応条件下で、2つのさらなる電子を捕えることができる化学部分である。図2Bに示される通り、1電子移動メディエーターは1つの電子を酵素から作用電極へと移動させることができ、一方、図2Cに示される通り、2電子移動メディエーターは、2つの電子を移動させることができる。
【0051】
[0068] その他のメディエーターを使用することができるが、1電子移動メディエーターに関して、同モル量のメディエーターによって、酵素系から作用電極へ約2倍の電子を移動させることができるため、2電子移動メディエーターが好ましい。従来のセンサーストリップに関して、センサーが機能するために必要とされるメディエーターの量を減らすことにより、本発明のセンサーストリップは、長期間安定性の上昇を示すことができる。この安定性の上昇は、保管中のメディエーターによる酵素の変性の減少に起因する可能性がある。安定性の上昇はまた、保管中に酵素を酸化することができるメディエーターの量の減少に起因する可能性もある。
【0052】
[0069] 1電子移動メディエーターの例には、1,1’-ジメチルフェロセン、ヘキサシアノ鉄(III)酸塩(ferrocyanide)およびヘキサシアノ鉄(II)酸塩(ferricyanide)、ならびに、ルテニウム(III)およびルテニウム(II)ヘキサアミンなどの、化合物が含まれる。2電子メディエーターには、フェナトロリンキノンなどの、有機キノンおよびヒドロキノン;フェノチアジンおよびフェノキサジン誘導体;3-(フェニルアミノ)-3H-フェノキサジン;フェノチアジン;および7-ヒドロキシ-9,9-ジメチル-9H-アクリジン-2-オンおよびその誘導体が含まれる。さらなる2電子メディエーターの例には、例えば、本明細書中で参照として援用される、アメリカ合衆国特許第5,393,615号;第5,498,542号;および第5,520,786号に記載される、電子-活性有機分子が含まれる。
【0053】
[0070] 好ましい2電子移動メディエーターには、3-フェニルイミノ-3H-フェノチアジン(PIPT)および3-フェニルイミノ-3H-フェノキサジン(PIPO)が含まれる。より好ましい2電子メディエーターには、フェノキサジン誘導体の、カルボン酸または塩(たとえば、アンモニウム塩など)が含まれる。現在のところ、特に好ましい2電子メディエーターには、(E)-2-(3H-フェノチアジン-3-イリデンアミノ)ベンゼン-1,4-ジスルホン酸(構造I)、(E)-5-(3H-フェノチアジン-3-イリデンアミノ)イソフタル酸(構造II)、アンモニウム(E)-3-(3H-フェノチアジン-3-イリデンアミノ)-5-カルボキシ安息香酸(構造III)、およびそれらの組み合わせが含まれる。これらのメディエーターの構造式は以下に示される。
【0054】
【化1】

【0055】
【化2】

【0056】
【化3】

【0057】
別の観点において、好ましい2電子メディエーターは、ヘキサシアノ鉄(II)酸塩(ferricyanide)よりも少なくとも100 mV低い、より好ましくは少なくとも150 mV低い、酸化還元電位を有する。
【0058】
[0071] 印刷、液体沈着、またはインクジェット沈着などの便利な手法により、試薬層275、285を沈着させることができる。1つの観点において、この層は印刷により沈着される。その他の因子が等しい場合、印刷の刃の角度が、試薬層の厚さに、逆向きに影響する可能性がある。例えば、刃が基板110に対して約82°の角度で動かされる場合、この層は約10μmの厚さを有することができる。同様に、基板110に対して約62°の刃の角度を使用する場合、より厚い30μmの層を作成することができる。このように、刃の角度が低いほど、より厚い試薬層を提供することができる。刃の角度に加えて、ふるいサイズ(screen-size)およびエマルション組み合わせ(emulsion combination)と共に印加される、物質の粘度などのその他の因子が、試薬層275、285の結果的な厚さに影響を及ぼす可能性がある。
【0059】
[0072] より薄い試薬層が好ましい場合、マイクロピペッティング、インクジェッティング、または、ピン-沈着などの、印刷以外の沈着方法が必要とされる可能性がある。これらの沈着方法は一般に、1〜2μmといった、マイクロメートルまたはマイクロメートル未満の厚さの乾燥試薬層を与える。例えば、ピン-沈着法は、平均1μmの厚さの試薬層を提供することができる。ピン-沈着の結果である試薬層の厚さは、例えば、試薬組成物中に含まれるポリマーの量により調節されることができ、ポリマー含有量が高いほどより厚い試薬層を提供する。望ましい測定性能を維持するためおよび/または拡散バリア層(DBL)内の分析対象物を実質的に測定するために、薄い試薬層は、厚い試薬層よりも短いパルス幅を必要とする可能性がある。
【0060】
[0073] 作用電極175には、図2Aに示されるような、試薬層275の一体のものである(integral)か、または、異なる層290である、DBLが含まれていてもよい。つまりDBLは、導体上の試薬/DBLの組み合わせとして、導体上の異なる層として、または、試薬層上の区別される層として、形成されることができる。作用電極175が異なるDBL290を含む場合、試薬層275はDBL290上にあってもよいし、なくてもよい。DBL290上にあるかわりに、試薬層275は、試薬を試料中に溶解することができるセンサーストリップ100のどの部分にあってもよい。例えば、試薬層175は、基板110にあってもまたは蓋120上にあってもよい。
【0061】
[0074] DBLは、測定可能な種が存在できる内部容量を有する、多孔空間を提供する。DBLの孔を、測定可能な種がDBL内に拡散することができるが、RBCなどの物理的に大きな試料構成成分は実質的に排除されるように選択することができる。従来のセンサーストリップは、様々な物質を用いて作用電極の表面からRBCを濾過してきたが、DBLは内部多孔空間を提供して、試料から測定可能な種の一部分を含有させ、そして分離する。
【0062】
[0075] 試薬層275に水溶性接着剤が含まれる場合、励起の印加に先立って試料に溶解しない接着剤の部分は、一体のDBLとして機能することができる。DBL/試薬層の組み合わせの平均初期厚は、好ましくは、16あるいは8マイクロメートル(μm)より薄く、そしてより好ましくは、4μmより薄い。現在のところ、DBL/試薬層の組み合わせの特に好ましい初期の厚さの平均は、0.25μmから3μm、あるいは、0.5μmから2μmである。DBL/試薬層の組み合わせの望ましい平均初期厚は、DBLから、図2Aの導体170の表面または表面導体270の表面などの、導体表面への、測定可能な種の拡散速度が比較的一定になったときを基準にして、特異的な励起の長さにおいて選択されることができる。1つの観点において、0.25秒またはそれより短い励起パルス幅と組み合わされる場合、DBL/試薬層は1μm、またはそれより薄い、平均初期厚を有することができる。
【0063】
[0076] 異なるDBL290は、望ましい多孔空間を提供するすべての物質を含むことができ、試料中に、部分的に、またはゆっくりと溶解する。1つの観点において、異なるDBL290は、試薬のない試薬接着物質を含むことができる。異なるDBL290は、1μmから15μmの平均初期厚を有し、また、より好ましくは2μmから5μmである。
【0064】
[0077] 図3は、試料312中の分析対象物322の、存在および任意で濃度を決定する、電気化学的分析300を示す。310において、試料312は、図1A〜図1B、および図2Aに示されるセンサーストリップなどの、センサーストリップ314に導入される。図2Aの275および/または285などの試薬層は、試料312中に溶解し始め、これにより反応が可能になる。分析のこの時点において、試薬についての初期時間遅延、または“インキュベーション時間”を提供して、試料312と反応することは、有益である可能性がある。好ましくは、初期時間遅延は、0.5秒から5秒であってよい。初期時間遅延の徹底的な処理は、アメリカ合衆国特許第5,620,579号および第5,653,863号に見いだすことができる。
【0065】
[0078] 反応の間、320では、試料312中に存在する分析対象物322の一部分が、酸化還元酵素などによって、化学的または生化学的に酸化または還元される。酸化または還元に際して、330では、酸化還元酵素を介するなどにより、電子が分析対象物322とメディエーター332の間を移動することができる。
【0066】
[0079] 340では、電荷を帯びたメディエーター332は電気化学的に励起される(酸化または還元される)。例えば、試料312が、320においてPQQ-GDH酵素系により酸化されたグルコースを含む全血であり、それが330において、2電子を移動してフェノチアジン誘導体メディエーターを還元する場合、340の励起は、作用電極においてフェノチアジン誘導体メディエーターを酸化する。この様式において、電子がグルコース分析対象物からセンサーストリップの作用電極へと選択的に移動し、そこで、それらを測定装置により検出することができる。
【0067】
[0080] 励起340の結果として得られる電流を、350において、励起340の期間、時間の関数として記録することができる。360において、試料は緩和を受ける。好ましくは、緩和360の期間には電流は記録されない。370において、記録された電流および時間の値は、試料312中の分析対象物322の存在および/または濃度を決定するため分析されることができる。
【0068】
[0081] 電流測定センサー系は電位(電圧)をセンサーストリップに印加し、測定可能な種を励起させて、その間に電流(電流量)をモニターする。従来型の電流測定センサー系は、例えば5秒から10秒の継続的な読み出しパルス長において電流を測定している間、電位を維持することができる。従来の方法と対照的に、電気化学的分析300において使用されるデューティサイクルは、継続的で長期間の読み出しパルスを、複数回の短期間の励起および緩和に置き換える。複数回の励起および緩和、または“ゲート(gated)”パルスシーケンスの、より詳細な説明は、“Gated Amperometry”と題された、2006年7月19日に出願されたPCT/US2006/028013に見い出すことができる。
【0069】
[0082] 図3を参照すると、励起340、記録350、および緩和360により、1回のデューティサイクルが構成される。好ましくは、少なくとも2、4、6、または7回のデューティサイクルが、独立して選択された3、5、7、9、または14秒間の間、印加される。1つの観点において、デューティサイクルは、3秒間から14秒間の間、印加される。別の観点において、少なくとも4回のデューティサイクルが30秒間、9秒間、またはそれより短い時間内に、印加される。別の観点において、2から6回のデューティサイクルが、10秒間、またはそれより短い時間内に印加されることができる。別の観点において、2から4回のデューティサイクルが、3から9秒間内に印加されることができる。
【0070】
[0083] 励起340の後、360において、測定装置はセンサーストリップ314を介して回路を開くことができ、これによって系を緩和させる。緩和360の間、励起340の間に存在する電流は、少なくとも2分の1、好ましくは、一桁分、および、より好ましくはゼロへと、顕著に減少する。好ましくは、開回路、または実質的にゼロ電流を提供することが当業者に既知であるその他の方法により、ゼロ電流状態が提供される。1つの観点において、緩和360は少なくとも0.5秒、または、少なくとも0.2秒の持続時間である。別の観点において、緩和360は0.2秒から3秒、または、0.5秒から1秒の持続時間である。
【0071】
[0084] 図4A〜図4Dは、試料の導入後、センサーストリップに複数回のデューティサイクルを印加する、ゲート電流測定パルスシーケンスの例を示す。これらの例においては、炬形波パルスが使用された;しかしながら、センサー系および試験試料に適合する、その他の波形もまた使用することができる。
【0072】
[0085] 示された各パルスシーケンスには、1秒間の初期励起パルス420に続いて、複数回の0.25秒の励起430が含まれる。初期励起パルス420は、続く励起430よりも長い持続時間であってよい。例えば、初期励起パルス420は、0.75秒から3秒の範囲の持続時間であってよい。励起パルス420の長さを、ストリップ上に沈着される比較的少量の酵素系を酸化するように調整することができる。初期励起パルス420が用いられるとき、続く複数回励起430より長い持続時間が好ましい。例えば、パルスシーケンスは2秒間の持続時間を有する初期励起パルス420に続いて、3秒間の開回路緩和、続いて、0.125秒間の持続時間を有する次の励起430を含むことができる。
【0073】
[0086] 複数回励起430は、0.01秒から3秒の範囲の持続時間であってよい。1つの観点において、励起の長さの合計は、2秒またはそれより短く、そのため、1秒の初期パルス420、続いて4回の0.25秒の励起430を含む。別の観点において、励起の長さの合計は、1.5秒またはそれより短く、そのため、1秒の初期パルス420、続いて1回または2回の0.25秒の励起430を含む。パルスシーケンスは、図4Aに示される励起440などの、さらなる励起を含んでもよい。別の観点において、図4Cおよび図4Dに示されるように、励起は異なる振幅の励起であってよい。好ましい観点において、異なる振幅の励起が用いられる場合、振幅の差は500 mV以内であることができる。
【0074】
[0087] 短い励起により、従来の組成物に関して減少したポリマー、酵素系、およびメディエーター濃度を有する試薬組成物を用いた試料の正確な分析をもたらすことができる。さらに、短い励起は、センサーストリップへの最初のシグナルの印加から、分析を8.5秒、あるいはそれよりも短い、または、より好ましくは、5秒、あるいはそれより短い時間内に完了させる。
【0075】
[0088] 短い励起または長い励起を使用することができる。好ましくは、分析対象物濃度がそれにより決定される電流測定は、最初のシグナルの印加から2秒または1秒以内になされる。さらに好ましくは、試料の分析対象物濃度の決定のため、複数回の短い励起は、初期シグナルの印加から2秒、1秒、あるいは、それよりも短い時間内でなされる電流測定と組み合わされる。
【0076】
[0089] 本発明のゲート電流測定パルスシーケンスと組み合わせて、特定の量のポリマー接着剤、酵素系、および/またはメディエーターを含む試薬組成物は、ヘマトクリットバイアスを減少させ、および/または長期間の安定性を増加させることが見いだされた。従来型のストリップは、しばしば各試薬組成成分のパーセントの単位で記述されるが、長期間の安定性と関連するのは、各試薬組成成分の密度(面積当たりの絶対量)である。相互作用に使用できるメディエーターおよび酵素の量を限定することにより、分析の時点で存在する、環境的に還元されたメディエーター(根本的な分析対象物の濃度に応答しないメディエーター)の量を実質的に減少させることができる。これにより、バックグラウンド電流の有益な減少が提供される。従来のバイオセンサーは長期間安定性を改善させるための試みにおいて、過剰な酵素を使用するので、本発明のバイオセンサーにおいて酵素系および/またはメディエーターの減少が長期間安定性の改善を提供することは期待されなかった。さらに、それぞれの試薬組成物が各電極において最適化された場合、酵素と相互作用できるメディエーターの相対量は、単一の試薬組成物のセンサーストリップに比べてさらに減少する可能性がある。
【0077】
[0090] 例えば、酵素の多量のローディングに使用する際の試薬溶液中のポリマー濃度0.5%(w/w)よりも、より高いポリマー濃度2%、1.5%、および1%において、ヘマトクリットバイアスは大きかった。これは、より高いポリマー濃度はより厚い試薬層を生成することに起因する可能性があり、このことは再水和時におけるヘマトクリットバイアスに影響する。従って、アッセイ時間が短くなるので、ヘマトクリットバイアスの増加なしでの迅速な再水和が好ましい可能性がある。この様式において、試薬組成物のポリマー含有量と酵素のローディングとの間の好ましいバランスが達せられて、アッセイ時間中の望ましい水和レベルを提供することができる。センサーストリップに適用される場合、2μg/mm2またはそれより少ないポリマー沈着密度が好ましく、0.8から1.5μg/mm2のポリマー沈着密度がより好ましい。
【0078】
[0091] 異なる沈着溶液が作用電極および対電極に沈着される場合、作用電極上に存在する酵素系の量は制御されている。このように、1.2 UのPQQ-GDH酵素系、2.57μgの構造Iメディエーター、1.18μgのCMCポリマー、および3.28μgのリン酸バッファーを含む約0.24μLの溶液の沈着は、5 U/μLの酵素系、24 mMのメディエーター、0.5%のポリマー、および100 mMリン酸バッファーという濃度の試薬溶液を提供する。
【0079】
[0092] 1 mm2の作用電極領域を含む、1.5 mm2の沈着領域上へのこの試薬溶液の沈着は、作用電極での約0.8 U/mm2(1.2 U/1.5 mm2)の酵素系沈着密度、1.72μg/mm2(2.57μg/1.5 mm2)のメディエータ沈着密度、0.8μg/mm2のポリマー沈着密度、および、2.2μg/mm2のリン酸バッファー沈着密度を提供する。同様に、約2 U/μLのPQQ-GDH酵素系、24 mMの構造Iメディエーター、0.5%のCMC、および100 mMリン酸バッファーを含む試薬溶液について、酵素系沈着密度は約0.3 U/mm2となるであろう。さらに、酵素系の特異的な活性を、μg/mm2の単位で重量密度に変換することができる。例えば、酵素系の活性が770 U/mgである場合、0.3 U/mm2の酵素系の活性密度は、0.39μg/mm2の重量密度になる。このように、酵素系について沈着密度を決定するときに、酵素系の活性を考慮に入れることができる。
【0080】
[0093] 従来の試薬層は、1μg/mm2から6μg/mm2の酵素沈着密度を含む。反対に、沈着後、本発明の試薬組成物は、1μg/mm2より小さい、好ましくは0.5μg/mm2より小さい酵素系沈着密度を含むことができる。本発明の沈着溶液は、約4 U/μLまたはそれより少ない酵素系を含むことができるか、または、約3 U/μLまたはそれより少ない酵素系を含むことができる。現在のところ、2.2 U/μLまたはそれより少ないPQQ-GDH酵素系が試薬溶液中に含まれてよい。このように、試薬組成物がセンサーストリップに適用される際に、1.3 U、または、それより少ない酵素系がセンサーストリップ上に存在することができ、0.3Uから0.8Uがより好ましい。
【0081】
[0094] 従来のセンサーストリップは、一般に、10μg/mm2から25μg/mm2の範囲のメディエーター沈着密度を有する。反対に本発明においては、8μg/mm2およびそれより少ないメディエーター沈着密度が好ましく、5μg/mm2およびそれより少ないメディエーター沈着密度がより好ましい。現在のところ、2μg/mm2およびそれより少ないメディエーター沈着密度が特に好ましい。好ましい観点において、1電子メディエーターよりも2電子メディエーターが好ましい。
【0082】
[0095] 下の表Iは、以下に論じられる図5A〜図5Eおよび図6A〜図6Cで用いられる試薬組成物における、ポリマー接着剤、バッファー、酵素系、およびメディエーター組成物の沈着密度を提供する。試薬組成物3(RC3)についての酵素系沈着密度0.42μg/mm2は、先に論じた従来型ストリップの一番低い1μg/mm2の値より、60%近く少ない。
【0083】
[0096] 同様に、表1に示されるメディエーター密度は、従来型のセンサーストリップよりも約一桁小さい。例えば、RC3のメディエーター沈着密度は、従来型のセンサーストリップの約5分の1であった。従来型のセンサーストリップと比べて、メディエーター沈着密度のこの減少は、本発明の試薬組成物の長期間安定性の顕著な増加を提供することができる。
【0084】
【表1】

【0085】
[0097] 図5Aは、PQQ-GDH酵素を沈着密度0.8 U/mm2、センサー当たり1.2ユニット(U/センサー)を含んだ、RC2センサーストリップについてのWB試料中の異なるヘマトクリットレベルでのグルコース用量反応曲線を示す。図5Bは、PQQ-GDH酵素を沈着密度0.3 U/mm2、0.5 U/センサーを含んだ、RC3センサーストリップについてのWB試料中の異なるヘマトクリットレベルでの、グルコース用量反応曲線を示す。1.2 Uと0.5 Uの両方のセンサーは、±5%より少ないヘマトクリットバイアスを示した。しかしながら、1.2 Uセンサーと0.5 Uセンサー間の差が、系の感度および切片に関して認められた。
【0086】
[0098] 図5Aの1.2 U/センサーにおいてmg/dLの単位において表現される、切片対傾き比(I/S)と比較することにより、図5Bの0.5 U/センサーについての切片対傾き比の減少が見られ、この場合、より低い比は、バックグラウンドシグナルが減少していることを表す。このように、図5Aの1.2 U/センサーにおけるI/S比は〜6 mg/dLであり、一方、図5Bの0.5 U/センサーにおけるI/S比は40%ヘマトクリット濃度において、約1/40への減少である、〜0.15 mg/dLである。1.5 Uセンサーに比べて、0.5 Uセンサーの優れたバックグラウンドシグナル性能が達成された。
【0087】
[0099] 1つの観点において、低バックグラウンド(低い切片)の性能特性を、比較的低いメディエーターおよび酵素沈着密度によって提供することができる。別の観点において、高感度性(高い傾き)の性能特性を、パルスシーケンスの励起および緩和のタイミング比を最適化することにより提供することができる。例えば、1.5秒の比較的長い緩和期と0.25秒の比較的短い励起期を組み合わせると、作用電極の表面において大きい電流密度を提供する。数値的には、比較的大きい傾きの値を、比較的小さい切片の値で割ることで、I/Sをさらに改善する。つまり、好ましいセンサー性能特性(小さいI/S値)を、試薬組成物と測定方法との組み合わせにより、提供することができる。
【0088】
[0100] 下記の式(1)は、グルコースと電流との関係がi=S*G+Intであるとき、I/S比の関数として決定されるグルコース濃度における、電流の不精密性と結果の不精密性との間の分析的な関係を提供する:
【0089】
【数1】

【0090】
この式中、Gはグルコース濃度を示し、ΔG/Gはmg/dLでのグルコース濃度の相対誤差であり、Δi/iは測定された電流の相対誤差であり、SDG/GはΔG/Gにおける相対標準偏差であり、SDi/iはΔi/iにおける相対標準偏差であり、%CVGは、相対標準偏差に比例し、またグルコース測定精密性を示す分散の係数であり、%CViは、相対標準偏差に比例し、電流測定精密性を示す分散の係数であり、そして、Int/Sは、mg/dLでの切片対傾き(I/S)比である。式(1)は、微分および誤差伝播の分析について、逆関数G=f(i)=(i-Int)/Sの微分をとることによって、i=S*G+Intから導き出されることができる。1+1/G項のため、1の電流不精密性は、I/S値が0より大きい場合、グルコース濃度の不精密性が1より大きいという結果をもたらす。mg/dLで表される切片対傾き比(I/S)を、I/S(mg/dL)値を18([mg/dL]/18=グルコースについての[mM])で割ることにより、ミリモル/リットル(mM/L)の単位で表現することができる。
【0091】
[0101] 電流不精密性とは複数のセンサーストリップの電流測定間での分散をいう。つまり、電流不精密性とは、同じグルコース試料を複数のセンサーストリップを使用して分析した場合、記録された電流値と、平均の電流値との差の量を表す。特定のストリップから記録された電流値が、複数のストリップについての平均値から大きく外れるほど、そのストリップから記録された電流と試料の実際のグルコース濃度との相関は低くなる。従って、電流測定の精密性を、その不精密性または%-CViにより測定することができ、また。グルコース測定の精密性もまた、その不精密性または%-CVGによって測定することができる。
【0092】
[0102] 下記の表IIは、mg/dLで表される複数のグルコース濃度から、式(1)によって計算された傾き(1/G値)を提供する。つまり、分母を、検査された血漿グルコース濃度とした場合、1/57.6=0.0174、1/111=0.009、1/222.25=0.0045、1/444.75=0.0022、および1/669=0.0015である。グルコース濃度が増加するにつれて、式(1)による傾きの値は減少する。
【0093】
【表2】

【0094】
[0103] 図5Cは、実験データから決定されるmg/dLでのI/S比を示す。40%ヘマトクリットおよびグルコース濃度57.6、111、222.25、444.75、または669 mg/dLを含むWB試料から、ゲート電流測定パルスシーケンスによって、電流値が得られた。較正定数は、分析の中の、4、5.5、7、8.5、10、11.5、13、および14.5秒において決定された。表から見られるように、計算された値と実験によって決定された値は等しく、グルコースおよび電流の不精密性の点について、センサーストリップの振る舞いを表す、式(1)の能力が確認される。
【0095】
[0104] 50 mg/dL以下といった低グルコース濃度において、記録された電流値における根本的な不精密性から決定されるグルコース濃度に導入される不精密性を減少するために、低いI/S値を維持することが好ましい。例えば、I/S比が50 mg/dLで、グルコース濃度が50 mg/dLの場合、%-CVG/%-CViの比は2であり[1+(I/S)/G=1+50/50=2]、決定されるグルコース濃度において、すべての電流不精密性は2の倍数で増幅されるであろう。従って、記録された電流値における標準的な不精密性が3.5%である場合、50 mg/dLのI/S比を有する系では、グルコース不精密性は7%という結果になる。
【0096】
[0105] 図5Dは、上記表Iの試薬組成物RC2、RC3、またはRC4を有するセンサーストリップより決定される、グルコース濃度55.375、112.25、および433.5 mg/dLについて、0から20 mg/dLのI/S比を示す。I/S比が20から減少するにつれて、決定されたグルコース濃度に付随する不精密性もまた、減少する。つまり、先に述べた通り、より低いグルコース濃度においては、より低いI/S比が好ましいことが示される。
【0097】
[0106] これらの各因子を考慮すると、20 mg/dLあるいはそれより小さいI/S比を有するセンサーストリップが好ましく、10 mg/dLあるいはそれより小さい、または6 mg/dLあるいはそれより小さいI/S比を有するものがより好ましい。現在のところ、1 mg/dLあるいはそれより小さいI/S比を有するストリップがさらにより好ましい。
【0098】
[0107] 図5Eは、血漿と40%ヘマトクリット全血試料とを使用して、本発明に従ったセンサー系のほぼ同一のヘマトクリット性能を示す。この例において、センサーストリップの試薬組成物は、上記表Iに記述される、RC2であった。このように、本発明の試薬組成物と組み合わせたゲートパルスシーケンスは、WB試料について認められるヘマトクリット効果の実質的な減少を提供する。
【0099】
[0108] 図6Aは、センサーストリップの長期安定性に対する、環境的ストレスの影響を示す。グラフのY軸は、-20℃で保管したセンサーストリップに関して、環境的ストレスを受けたセンサーストリップについて、グルコース濃度が75 mg/dLより少ない場合はmg/dLの単位での絶対安定性バイアスを、または75 mg/dL以上のグルコース濃度では%-バイアスを示す。ストレスを受けるセンサーストリップは、25℃で18ヶ月の保管をシミュレートする加速されたプロセスとして、50℃で2週間保管された。メディエーター密度は初めは低かった(1.72 ug/mm2)ため、図6Aにおける平均安定性バイアス線は、RC1(3.2 U/mm2、または770 U/mg特異的酵素活性において4 ug/mm2)からRC2、RC3およびRC4(いずれも0.8 U/mm2またはそれより少ない)へと酵素密度が減少するにつれて、環境的に誘導されるバイアスも減少することを示した。
【0100】
[0109] 図6Aはまた、本発明に従う試薬組成物が、Genshawらによりアメリカ合衆国特許第5,653,863号に記述されるような、分析前に初期の長い酸化的パルスの必要がないほどに十分な長期間安定性を提供することができることを示した。図6Aのデータを生み出した分析は、酸化時間の合計1.5秒を含む、全持続時間4.5秒を有した(図4Aのパルスシーケンスに相当)。つまり、アメリカ合衆国特許第5,653,863号の分析(30秒の全分析時間のうち20秒の酸化)における、全アッセイ時間の〜67%と比べると、図6Aにおいては、アッセイ時間の30%のみがWB試料の酸化に充てられた。1つの観点において、全アッセイ時間の45%またはそれより短い時間が試料の酸化に充てられる。別の観点において、全アッセイ時間の35%またはそれより短い時間が試料の酸化に充てられる。
【0101】
[0110] 図6Aにおいて、構造IIIメディエーターは構造Iメディエーターよりやや低い安定性バイアスを有することを示すが、この小さい差異は、検査系の中のその他の因子に起因する可能性がある。このように、本発明のゲートパルスシーケンスと組み合わせた試薬組成物RC2、RC3、およびRC4は、50℃の温度に2週間暴露された後、±5%より小さい安定性バイアスを示したが、一方、酵素系の高い沈着密度を有するRC1は示さなかった。
【0102】
[0111] 図6Bは、50℃で4週間保管されたセンサーストリップの長期間安定性に対する、環境的ストレスの影響を示す。グラフのY軸は、-20℃で保管したセンサーストリップと比較して、環境的ストレスを受けたセンサーストリップについて、グルコース濃度が75 mg/dLより低い場合はmg/dLの単位で絶対安定性バイアスを、または75 mg/dL以上のグルコース濃度においては%-バイアスを示す。図6Aのより短い2週間の保管期間と比べて、図6Bの4週間の保管期間における安定性バイアスの増加は、RC1についてのY軸の値に見られる。メディエーター密度は初めに低かった(1.72 ug/mm2)ため、図6Bにおける平均安定性バイアス線は、RC1(3.2 U/mm2、または770 U/mg特異的酵素活性において4 ug/mm2)からRC2、RC3およびRC4(いずれも0.8 U/mm2またはそれより小さい)へと酵素密度が減少するにつれて、環境的に誘導されるバイアスも減少することを示した。つまり、図6Bのより長い4週間の保管期間についての平均安定性バイアス線もまた、RC1と比較してRC2、RC3、およびRC4において、実質的に減少する。4週間、50℃での保管の後でさえも、本発明のゲートパルスシーケンスと組み合わせた試薬組成物RC2、RC3およびRC4は±5%より小さい安定性バイアスを示した。
【0103】
[0112] 図6Cは、60%の相対湿度で25℃、52週間後の、PQQ-GDH酵素系を含む3つの試薬組成物についての安定性バイアスを示す。図6Aおよび図6Bとは異なり、より低い温度でより長い時間を使用して、ストリップをエイジングさせた(age)。RC2およびRC3におけるバイアス値は、加速されたエイジングにおいて見られたものと同じで、平均±5%より小さかった。RC4は、図6Aおよび図6Bの加速されたエイジングによる結果と比べると、バイアスの上昇が認められ、平均が±10%より少し小さいレベルに上昇した。この上昇は、実験的誤差、あるいはこの検査の特定の状況下、RC4中に用いられる大量の構造IIIメディエーターによる安定性の問題に起因する可能性がある。
【0104】
[0113] 図6Dは、RC2を含むセンサーストリップについての安定性バイアス値を示し、この場合分析対象物濃度を計算するために用いられるデータポイントが、分析が始まった後、特定の時間において取られた。例えば、2.75秒のラインは、図4Aにおける励起430などの、最初の短い励起パルスの後に決定された、分析対象物濃度のバイアス/%-バイアス値を示す。同様に、4.375秒のラインは二番目の短い励起パルスの後に決定された、分析対象物濃度のバイアス/%-バイアス値を示す。このように、RC2およびゲートパルスシーケンスを含む、環境的なストレスを受けたセンサーストリップを使用することにより、試料の分析対象物濃度は、3秒より短い時間において、正確に決定されることができる。
【実施例】
【0105】
[0114] 実施例1:センサーストリップ調製
[0115] 1つの観点において、本発明に従うセンサーストリップは、ピン-沈着を使用して作製された。対電極試薬溶液は、1%カルボキシメチルセルロース(CMC)中で100 mMリン酸バッファーのストック溶液を作製することにより調製された。次に、十分量の粉末メディエーターをバッファー/CMC溶液に溶解し、100 mMリン酸バッファーおよび1%CMC中100 mMメディエーターの最終溶液を作製した。
【0106】
[0116] 作用電極試薬溶液は、通常、0.5%CMC中100 mMリン酸バッファーのストック溶液を作製することにより調製された(例えば100 mL)。次に、十分量の粉末メディエーターをバッファー/CMCストック溶液中に溶解し、100 mMリン酸バッファーおよび0.5%CMC中24〜25 mMメディエーターの溶液を作製した(例えば10 mL)。最後に、5 U/μlの酵素ローディングのために、約33.4 mgのPQQ-GDH酵素系(749 U/mg特異的活性)をガラス容器中で5 mLのメディエーター/バッファー/CMC溶液と合わせた([5000 U/mL*5 mL]/[749 U/mg]=33.4 mg)。混合物をゆっくりとかき混ぜて、酵素の乾燥粉末を溶液中に溶解させた。この組成は、RC2用であった。最終試薬溶液2 mLのみが必要な場合は、749 U/mgの特異的活性を有する、約13.4 mgのPQQ-GDH酵素を計量した。同様に、2 U/μLのRC3組成物用には、749 U/mgの特異的活性を有する、約13.4 mgのPQQ-GDH酵素を5 mLのメディエーター/バッファー/CMC溶液に溶解して、沈着用の最終試薬溶液を調製した。最終試薬溶液2 mLのみが必要な場合は、特異的活性749 U/mgである、約5.34 mgのPQQ-GDH酵素を計量して、最終溶液を調製した。
【0107】
[0117] ピン-沈着を使用して、1つの炭素表面上へ対電極試薬溶液を沈着させて、対電極を形成した。各沈着によって供給される容量は、約0.2μlから0.24μlであり、それは、約1.5 mm2から2 mm2の領域を覆うように広がる。同様に、ピン-沈着を使用して、1つの炭素表面上へ作用電極試薬溶液を沈着させて、作用電極を形成した。各作用電極沈着の容量もまた、約0.2μlから0.24μlであり、同様の溶液が炭素上に広がって作用電極を形成した。完成したセンサーシートを、15分間風乾した後、デシケーター容器に保存し、その後最後のラミネーションにより完成したセンサーストリップが形成された。1つの観点において、作用電極において0.16μL/mm2(0.24 uL/1.5 mm2)またはそれより小さい試薬溶液沈着密度が好ましい。
【0108】
[0118] 実施例2:ドナー試験
[0119] 糖尿病をもつ21人の被験体より全血試料を収集した。各被験体で2回の分析を行って、下記の表IIIに提供されるように、SS1からSS4の4つのロットのセンサーストリップのそれぞれから、42の測定が提供された。SS1からSS3においては、異なる作用電極試薬組成物と異なる対電極試薬組成物が使用され、一方SS4は、実質的に両方の導体を覆う1つの試薬組成物が使用された。SS1、SS2、およびSS3は、同じ試薬量を使用する異なる製造ロットを示す。SS1からSS3についてそれぞれの導体に沈着された試薬組成物の容量は、それぞれが約1.5 mm2である2つの沈着領域において、約0.24μLであった。SS1については、両方の導体を覆うように沈着された試薬組成物の容量は、全沈着領域3 mm2において、約0.3μLであった。
【0109】
【表3】

【0110】
[0120] 試料は、約0.25秒の間隔をあけた2回の短い励起を含む、最初の励起に続いて1秒の緩和を有するパルスシーケンスを用いて分析された。最初の励起および緩和の後、2回の約1秒の緩和により隔てられた、3回の約0.375秒の励起のシーケンスが印加された。最初の入力シグナルの印加から約5秒後に記録された出力電流を使用して、試料のグルコース濃度が決定された。
【0111】
[0121] 下記の表IVおよび表Vは、SS1からSS4における統計的ヘマトクリットバイアスの結果を提供するものであり、21の血液試料のそれぞれにおいて、各タイプのセンサーストリップを用いて2回の分析が行われて42の読み取り値が提供された。表IVは、各センサーストリップロットにおける、傾き、切片、およびI/S比を示し、一方、表Vは、YSI参照値の±15/±15%、±10/±10%、または±5/±5%以内のバイアスを有する読み取り値のパーセンテージを示す。75 mg/dLよりも低いグルコース濃度におけるバイアスは、mg/dLとして表され(絶対値)、また、75 mg/dLおよびそれより高いグルコース濃度におけるバイアスは、パーセントで表される(相対値)。
【0112】
【表4】

【0113】
【表5】

【0114】
[0122] 表IVは、センサーストリップの各ロットが、5 mg/dLより小さいI/S比を有したことを証明し、これによりストリップの優れたバックグラウンドシグナル性能を証明する。センサー系の性能を、参照値に対するバイアスの広がりにより特徴づけることができる。この広がりは、±15 mg/dL/±15%、または±10 mg/dL/±10%などの、特定の限界内にあるバイアス値のパーセンテージにより、測定することができる。限界が小さいほど、性能が良い。測定の不精密性およびヘマトクリット効果を含む複数の因子がバイアス値の原因となるだろう。通常、性能は、データ母集団の少なくとも95%が特定の性能限界内にあることにより、判断される。よって、表Vは、SS1からSS4のデータ母集団の100%が±15 mg/dL/±15%の限界内にあったことを証明する。さらに、SS1からSS4のデータ母集団の95%以上が±10 mg/dL/±10%の範囲内であった。
【0115】
[0123] 図7Aは、21の全血試料における、SS1ロットからの、用量反応曲線を示す。R2値0.997は、ストリップが、試料の実際のグルコース濃度を正確に反映する電流値を提供する能力を有することを証明した。図7Bはドナー試験におけるグルコース濃度範囲にわたる、21の試料からの42の読み取り値の、SS1からSS4のロットにおけるバイアスの広がりを示す。図より、すべてのセンサーストリップについてバイアス値の100%が±15%以内の範囲にあり、また、SS1およびSS3製造ロットの性能は、この試験の条件下でデータ母集団の93%が±5%の範囲以内であり、優れていることが証明された。センサーストリップにおけるバイアスの広がりの狭さは、小さいI/S比に反映される感度および精密性の上昇、および、ストリップにより提供される小さいヘマトクリット効果に起因する可能性がある。
【0116】
[0124] 図7Cはヘマトクリット感受性を示し、試料のヘマトクリット含有量と関連するヘマトクリットバイアスは、HECポリマーについての沈着密度2.96μg/mm2、クエン酸バッファーについて0.69μg/mm2、グルコースオキシダーゼ酵素について2.14μg/mm2、およびヘキサシアノ鉄(II)酸塩(ferricyanide)メディエーターについて13μg/mm2を有する従来型のストリップと比較して、ロットSS1より得られた。SS1ロットにおいて、ヘマトクリット感受性は-0.26が得られ、一方、従来のセンサーストリップは、-1.26の傾きを有した。ここで、数値的により大きい傾きの値は、より大きいヘマトクリット感受性を示す。従って、SS1ロットのヘマトクリット感受性は、従来のストリップにより提供されるよりも約79%少なかった。
【0117】
[0125] 明細書および請求項の、明確で一貫性のある理解を提供するために、以下の定義が提供される。
【0118】
[0126] “系”とは、試料中の分析対象物の定量が可能である電子測定装置と、その導体を介して電気的に連通している電気化学的センサーストリップとして定義される。
【0119】
[0127] “測定装置”とは、電気的な入力シグナルを印加し、かつ、結果として得られる出力シグナルを測定できる、電子装置として定義される。測定装置は、出力シグナルに応じて、1つまたはそれ以上の分析対象物の存在および/または濃度を決定することができる過程をも含むことができる。
【0120】
[0128] “分析対象物”とは、試料中に存在する1つあるいはそれ以上の物質として定義される。分析により、試料中に存在する分析対象物の存在および/または濃度が決定される。
【0121】
[0129] “試料”とは、未知量の分析対象物を含むことができる組成物として定義される。典型的には、電気化学的分析における試料は、液体形態であり、そして好ましくは、試料は水性混合物である。試料は、血液、尿、唾液などの、生物学的試料であってよい。試料はまた、抽出物、希釈物、濾過物、または再構成沈殿物などの、生物学的試料の派生物であってよい。
【0122】
[0130] “導体”とは、電気化学的分析の間、定常状態を維持する導電性物質として定義される。導体物質の例には、固体金属、金属ペースト、導電性カーボン、導電性カーボンペースト、および導電性ポリマーが含まれる。
【0123】
[0131] “非イオン化物質”とは、分析対象物の電気化学的分析の間に、イオン化されない物質として定義される。非イオン化物質の例には、炭素、金、白金、およびパラジウムが含まれる。
【0124】
[0132] “測定性能”とは、正確性および/または精密性に関して定義される。従って、測定性能における増加は、測定の正確性および/または精密性における増加であってよい。
【0125】
[0133] “精密性”とは、同じ試料における複数回の分析対象物測定値の近さとして定義される。精密性は、平均値との関連で、複数回測定における広がり、または、分散という形で表現されることができる。
【0126】
[0134] “正確性”とは、センサーストリップによって測定された分析対象物の量が試料中の分析対象物の真の量にどの程度近く合致するか、として定義される。正確性はバイアスという形で表現され、より大きいバイアス値は低い正確性を反映する。
【0127】
[0135] “バイアス”とは、測定された値と認められた参照値との差として定義される。バイアスは、“絶対バイアス”または“相対バイアス”という形で表現されることができる。絶対バイアスは、mg/dLなどの測定の単位で表現されることができ、一方、相対バイアスは、参照値に対する絶対バイアス値のパーセンテージとして表現されることができる。ヘマトクリットバイアスまたは安定性バイアスのどちらかは、絶対バイアス値の形、またはパーセンテージとして表現されることができる。ヘマトクリットバイアスは、オハイオ州Yellow SpringsのYSI Inc.より入手可能なYSI 2300 STAT PLUSTMなどの参照器械より得られる分析対象物濃度を、認められた参照値として使用する。安定性バイアスは、-20℃の温度で保管された、センサーストリップより得られる分析対象物濃度を使用して、試薬組成物の温度変化を十分に減少させる。
【0128】
[0136] “ヘマトクリット感受性”とは、分析において試料のヘマトクリットレベルにおける変化がヘマトクリットバイアス値に影響する度合いとして決定される。
【0129】
[0137] “長期間安定性”とは、ホイルおよび乾燥剤などで包装され、また、製造後-20℃で2週間または4週間保管したセンサーストリップに対する、50℃でそれぞれ2週間または4週間暴露されたセンサーストリップに関して定義される。50℃で2週間の保管は、室温で約18ヶ月の保管とみなすことができる。-20℃で保管されたストリップに対して50℃で保管されたストリップに関する測定性能において、0%、50%、100%、および400%ヘマトクリットレベルにおける変化または分散の平均は、センサーストリップに関する長期間安定性のドリフト(drift)または“安定性バイアス”を示す。この例において、バックグラウンドシグナルまたはバイアスの増加は、センサーストリップにおける測定性能の減少を示す。つまり、包装されたセンサーストリップを50℃で保管し、-20℃で保管されたストリップと関係するバイアスの変化を観察することにより、様々な期間で保管されているセンサーストリップに関して、どのくらいのバイアスが増加するかという指標を得ることができる。
【0130】
[0138] “メディエーター”とは、酸化または還元されることができ、1つまたはそれ以上の電子を移動させることができる物質として定義される。メディエーターは電気化学的分析における試薬であり、そして、着目する分析対象物ではなく、分析対象物の間接的な測定を提供する。単純な系において、メディエーターは、分析対象物の酸化または還元に応答して酸化還元反応を受ける。酸化された、あるいは、還元されたメディエーターは、次にセンサーストリップの作用電極で逆反応を受け、そして、そのもとの酸化数に再生される。
【0131】
[0139] “測定可能な種”とは、電気化学的センサーストリップの電極表面において適切な電位の下、酸化または還元されることができる、すべての電気化学的に活性である種として、定義される。測定可能な種の例には、分析対象物、基質、またはメディエーターが含まれる。
【0132】
[0140] “酸化還元酵素”とは、測定可能な種の酸化、または還元を促進する、すべての酵素として定義される。酸化還元酵素は試薬である。酸化還元酵素という用語は、分子酸素が電子受容体である場合、酸化反応を促進する、“オキシダーゼ”;分析対象物が還元され、分子酸素が分析対象物でない場合、還元反応を促進させる、“レダクターゼ”;および、分子酸素が電子受容体でない場合に酸化反応を促進する、“デヒドロゲナーゼ”を含む。例えば、A.D. Smith, Ed., New York: Oxford University Press (1997) Oxford Dictionary of Biochemistry and Molecular Biology, Revised Edition のpp. 161, 476, 477, および 560のを参照のこと。
【0133】
[0141] “電子活性有機分子”とは、酸化還元反応を受けることができる金属をもたない有機分子として定義される。電子活性有機分子は、酸化還元種として、および/またはメディエーターとして機能することができる。電子活性有機分子の例には、補酵素ピロロキノリンキノン(PQQ)、ベンゾキノンおよびナフトキノン、N-オキシド、ニトロソ化合物、ヒドロキシルアミン、オキシン、フラビン、フェナジン、フェノチアジン、インドフェノール、およびインダミンが含まれる。
【0134】
[0142] “接着剤”とは、試薬と化学的適合性を有し、物理的に支持および封じ込め(containment)を提供する物質として定義される。
【0135】
[0143] “平均初期厚”とは、液体試料の導入前のその乾燥状態における、層の平均の高さとして定義される。層の上部表面がでこぼこしていて平らではないので、平均という言葉が用いられる。
【0136】
[0144] “沈着密度”とは、ある領域に沈着される物質の質量として定義される。例えば、2.57μgの固体を含む0.24μLの溶液を1.5 mm2の領域を有する表面に沈着する場合、沈着密度は1.72μg/mm2(2.57μg/1.5 mm2)となる。
【0137】
[0145] “酵素ユニット”(U)とは、標準条件下、1分間で、1ミクロモルの基質(分析対象物)の変換(酸化または還元)を触媒するであろう、酵素系の量として定義される。
【0138】
[0146] 酵素系に関して、“酵素活性”または“活性”とは、容量あたりの酵素ユニットの数である。従って、活性は、例えば、1 U/L=μモル/分/リットルである、U/LまたはmU/mLという単位で表されることができる。
【0139】
[0147] “酸化還元反応”とは、第一の種から第二の種への少なくとも1つの電子の移動に関わる、二つの種間での化学反応として定義される。つまり、酸化還元反応は、酸化および還元を含む。反応の酸化部分は、第一の種による少なくとも1つの電子を失うことに関与し、また、還元部分は、第二の種への少なくとも1つの電子の添加に関与する。酸化された種のイオン電荷は、移動した電子の数と等しい量だけ、より陽性になる。同様に、還元された種のイオン電荷は、移動した電子の数と等しい量だけ、陽性が弱まる。
【0140】
[0148] “酸化数”とは、原子などの化学種の形式イオン電荷として定義される。(III)などの高い酸化数は、より陽性であり、(II)などの低い酸化数は、弱い陽性である。中性の種は、ゼロ(0)のイオン電荷を有する。種の酸化は、その種の酸化数の増加をもたらし、また、種の還元は、その種の酸化数の減少をもたらす。
【0141】
[0149] “酸化還元対”とは、異なる酸化数を有する化学物質の二つの共役種として定義される。高い方の酸化数をもつ種の還元は、低い方の酸化数を有する種を産生する。代わりに、低い方の酸化数を有する種の酸化は、高い方の酸化数を有する種を産生する。
【0142】
[0150] “酸化可能種”とは、低い方の酸化数を有する酸化還元対の種として定義され、そしてそれはつまり、酸化されて高い方の酸化数を有する種になることができる。同様に、“還元可能種”という用語は、高い方の酸化数を有する酸化還元対の種として定義され、そしてそれはつまり、還元されて低い方の酸化数を有する種になることができる。
【0143】
[0151] “可溶性の酸化還元種”とは、酸化または還元を受けることができ、かつ、それは少なくとも1リットルあたり1.0グラムのレベルで水(pH7、25℃)に可溶であることができる物質として定義される。可溶性の酸化還元種には、電子活性有機分子、有機遷移金属錯体、および遷移金属配位錯体が含まれる。“可溶性の酸化還元種”という用語は、元素金属、および、孤立金属イオン、特に水に不溶あるいは溶けにくいものは除外する。
【0144】
[0152] “OTM錯体”とも言われる“有機遷移金属錯体”とは、遷移金属が少なくとも1つの炭素原子とσ結合(遷移金属とσ結合する炭素原子上の形式電荷-1)またはπ結合(遷移金属とπ結合する炭素原子上の形式電荷0)を介して結合している錯体として定義される。例えば、フェロセンは、2つのシクロペンタジエニル(Cp)環を有するOTM錯体であり、それぞれはその5つの炭素原子を介して鉄中心に2つのπ結合および1つのσ結合により結合している。OTM錯体の別の例は、ヘキサシアノ鉄(III)酸塩(ferricyanide (III))およびその還元型であるヘキサシアノ鉄(II)酸塩(ferrocyanide (II))であり、6つのシアノリガンド(6つの各リガンド上の形式電荷-1)は、シアノ基の炭素原子を介して鉄中心とσ結合している。
【0145】
[0153] “配位錯体”とは、8面体または平面四角形などの、明確な配位構造を有する錯体として定義される。その結合により定義されているOTM錯体とは異なり、配位錯体はその構造により定義される。つまり、配位錯体はOTM錯体(前述したヘキサシアノ鉄(III)酸塩(ferrocyanide)など)、または、窒素、硫黄、酸素およびリンを含むヘテロ原子などの、炭素以外の非金属原子が遷移金属中心に配位結合している錯体であってよい。例えば、ルテニウムヘキサアミンは、明確な8面体構造を有する配位錯体であり、6つのNH3リガンド(各6つのリガンド上の形式電荷0)は、ルテニウム中心と配位結合している。有機遷移金属錯体、配位錯体、および遷移金属結合のより完全な議論は、Collmanら、Principles and Applications of Organotransition Metal Chemistry (1987)、およびMiessler & Tarr、Inorganic Chemistry (1991)に見いだされることができる。
【0146】
[0154] “手持ち式の装置”とは、人の手で握ることができ、かつ、携帯可能な装置として、定義される。手持ち式装置の例は、インディアナ州、ElkhartのBayer HealthCare, LLCより入手可能な、Ascensia(登録商標) Elite Blood Glucose Monitoring Systemに付随する測定装置である。
【0147】
[0155] “〜の上に(on)”とは“〜の上側に(above)”として定義され、そして、記述される方向性に関係する。例えば、第一要素が第二要素の少なくとも一部分の上に(over)沈着される場合、第一要素は第二要素の“上に(on)沈着される”と言われる。別の例において、第一要素が第二要素の少なくとも一部分の上側に(above)存在する場合、第一要素は第二要素“上に(on)”あると言われる。“on”という用語の使用は、記述される上側の要素と下側の要素との間の物質の存在を除外しない。例えば、第一要素はその上の表面上にコーティングを有する可能性があるが、第二要素は第一要素の少なくとも一部分の上に(over)あり、そして、そのトップコーティングは第一要素“上(on)”として記述されることができる。従って、“ 上に(on)”という言葉の使用は、関係する二つの要素が互いに物理的に接触することを意味することもあり、意味しないこともある。
【0148】
[0156] 本発明の様々な態様が記述されたが、当業者においては、その他の態様および実施が本発明の範囲内で可能であることは明らかだろう。従って、本発明は、添付される請求項およびそれに相当するものに照らすことを除いては、限定されない。
【図1A】

【図1B】

【技術分野】
【0001】
関連する出願の参照
[001] 本出願は、その全体を参照として援用される、2006年9月22日に出願された、“改善された安定性およびヘマトクリット性能を有するバイオセンサー系”と題される、アメリカ合衆国仮特許出願第60/846,688号に対する優先権を主張する。
【背景技術】
【0002】
[002] バイオセンサーは、全血、尿、または唾液などの、生体液の分析をもたらす。典型的には、バイオセンサーは生体液試料を分析して、生体液中の、グルコース、尿酸、乳酸塩、コレステロール、またはビリルビンなどの、一つあるいはそれ以上の分析対象物の濃度を決定する。この分析は、生理学的異常の診断および治療に有用である。例えば、糖尿病個体はバイオセンサーを使用して、食餌および/または投薬の調節のため、全血中のグルコース濃度を決定することができる。
【0003】
[003] バイオセンサーは、卓上、携帯用、および、同様の装置を使用して実行されてよい。携帯用の装置は、手持ち式であってよい。バイオセンサーを、一つあるいはそれ以上の分析対象物を分析するように設計することが可能であり、またバイオセンサは、異なる容量の生体液を使用することができる。いくつかのバイオセンサーは、容量が0.25〜15マイクロリットル(μl)であるような、一滴の全血を分析することができる。携帯型の測定装置の例には、Bayer CorporationのAscensia Breeze(登録商標)およびElite(登録商標)測定装置;イリノイ州Abbott ParkのAbbottから入手可能なPrecision(登録商標)バイオセンサー;インディアナ州IndianapolisのRocheより入手可能なAccucheck(登録商標)バイオセンサー;および、カリフォルニア州MilpitasのLifescanより入手可能なOneTouch Ultra(登録商標)バイオセンサーが含まれる。卓上測定装置の例には、インディアナ州West LafayetteのBAS Instrumentsより入手可能なBAS 100B Analyzer;テキサス州AustinのCH Instrumentsより入手可能なCH Instruments' Electrochemical Workstation;カンザス州LawrenceのCypress Systemsより入手可能なCypress Electrochemical Workstatioin;および、ニュージャージー州PrincetonのPrinceton Research Instrumentsより入手可能なEG&G Electrochemical Instrumentが含まれる。
【0004】
[004] バイオセンサーは通常、電気シグナルを測定して、生体液試料中の分析対象物濃度を決定する。分析対象物は一般に、試料に入力シグナルが印加されると、酸化/還元または酸化還元反応を受ける。酵素または同様の種を試料に添加して、酸化還元反応を促進させることができる。入力シグナルは通常、電流または電圧などの電気シグナルである。酸化還元反応により、入力シグナルに応じた出力シグナルが生じる。出力シグナルは通常、電流または電圧などの電気シグナルであり、それを測定して、そして生体液中の分析対象物の濃度と相関させることができる。
【0005】
[005] 多くのバイオセンサーは、測定装置およびセンサーストリップを有する。生体液試料は、センサーストリップ内の試料チャンバーへと導入される。センサーストリップは、分析のための測定装置中に配置される。測定装置は通常、センサーストリップ内の導電体と接続する電気接点を有する。導電体は一般に、試料チャンバーへと伸びる、作用電極、対電極、および/またはその他の電極に接続される。測定装置は、電気接点を介して、センサーストリップ内の導電体へと入力シグナルを印加する。導電体は電極を介して、試料チャンバー内に沈着された試料へと入力シグナルを伝達する。分析対象物の酸化還元反応により入力シグナルに応じた出力シグナルが生じる。測定装置により、出力シグナルに応じた分析対象物濃度が決定される。
【0006】
[006] センサーストリップには、生体液試料中の分析対象物と反応する試薬が含まれてもよい。試薬には、分析対象物の酸化還元反応を促進するためのイオン化剤、および、分析対象物と導体との間の電子の移動を補助するメディエーターまたはその他の物質が含まれてもよい。イオン化剤は、全血試料中のグルコースの酸化を触媒する、分析対象物特異的な酵素などの、酸化還元酵素であってもよい。試薬には、酵素とメディエーターを一緒に保持する接着剤が含まれてもよい。
【0007】
[007] 従来型のバイオセンサーにおいて用いられる試薬組成物の、不都合な点の一つは、センサーストリップが保管される際に生じる、正確性または精密性のどちらかの測定性能の変化である。試料の分析対象物濃度を決定するために、測定装置が使用する電子技術および分析方法は、一般に、最初に製造された際に機能するセンサーストリップにおける試薬組成物を考慮して、選択される。しかしながら、運搬および保管棚での保管の後、試薬組成物は、時間および温度によって分解する。この試薬組成物の化学変化は、測定性能の低下をもたらす可能性がある。
【0008】
[008] バイオセンサー試薬組成物の長期間の安定性を上昇させるため、従来型のバイオセンサーは通常、試料の分析に必要とされるこれらの試薬量に関して、実質的に過剰な酵素およびメディエーターに依存する。これらの試薬が時間の経過とともに分解することを予測して、従来型の試薬組成物には、分析対象物と化学量論的に反応するために必要とされるよりも、大幅に多量の酵素および/またはメディエーターが含まれる。犠牲試薬の使用によって、バイオセンサーの値段が上昇することに加えて、不必要な試薬は、より大きな試料容量、より長い分析時間を必要とする可能性があり、そして、多くの因子によりバイオセンサーの測定性能を低下させる可能性がある。
【0009】
[009] 例えば、PCT公開WO 88/03270は、スクリーン印刷法において、全沈着密度3 mg/cm2(30μg/mm2)を開示する。K3Fe(CN)6の相対量は、57.7%であり、リン酸バッファーが28.8%、そしてグルコースオキシダーゼ(GO)が3.6%であった。これらの百分率をセンサーストリップ上の沈着密度に変換すると、K3Fe(CN)6の密度は17.31μg/mm2、リン酸バッファーの密度は8.64μg/mm2、そしてGOの密度は1.08μg/mm2という結果になる。別の例においては、直径4 mmのディスク電極上に15μLのトルエン中0.1 M 1,1’-ジメチルフェロセン溶液の沈着が、アメリカ合衆国特許第4,711,245号第17欄の25〜35行に開示される。分子量214 M.U.なので1,1’-ジメチルフェロセンメディエーターは、沈着密度25.5μg/mm2で適用された[(15μL*0.1 M*214 g/mol)/22*3.14 mm2 = 25.5μg/mm2]。さらなる例において、1 mLの水中、40 mgのGO、16 mgのK3Fe(CN)6、および20 mgのCMCを含む4μlの水溶液を、センサー電極上へ沈着させることが、アメリカ合衆国特許第5,958,199号に開示される。この例では、推定電極領域(沈着領域)6 mm2において、沈着密度はGOが6.67μg/mm2、K3Fe(CN)6が10.67μg/mm2、およびCMCが13.33μg/mm2であった。さらなる例において、その他の成分とともに約900 mLの水中に溶解した59 gのK3Fe(CN)6を含む試薬組成が、アメリカ合衆国特許第5,997,817号に記述される。約4.5μLのこの試薬は、21.4 mm2(3.2×6.7)の開口部上に沈着され、メディエーターの沈着密度は13.96μg/mm2となった(4.5×10-3 mL*59 g/900 mL)。
【0010】
[0010] これらの例のそれぞれにおいて、試薬組成物は、酵素の沈着密度が1〜6μg/mm2の範囲であるのに対して、メディエーターの沈着密度は10〜25μg/mm2の範囲を有した。酵素と比較して、メディエーターのこの大量のローディングは、作用電極および対電極の両方への、組成物の単回適用に起因する可能性がある。センサー設計によっては、メディエーターは対電極において、作用電極における電気化学的活性を補佐するように機能することができる。このように、両方の電極をカバーする1つの試薬組成物沈着が、実質的に作用電極へのメディエーターのオーバーローディングをもたらす可能性がある。
【0011】
[0011] 過剰な酵素およびメディエーターを使用して、正確なグルコース測定のために十分な活性成分が存在することを確実にすることを、これらの例が示す。長期間保管後に、増加された犠牲量の試薬を用いて製造されたセンサーストリップを使用することは、測定性能において不利益なドリフトをもたらす可能性がある。このドリフトは、少なくとも2つの方法により観察される可能性がある:(1)時間に応じたバックグラウンド電流の増加(検量線の切片に影響する)および(2)センサー感受性におけるシフト(検量線の傾きに影響する)。
【0012】
[0012] 保管の間に、酸化されたメディエーターと、酵素系およびポリマーとの相互作用により、還元されたメディエーターが産生される可能性がある。これは、熱力学によって支配されると考えられる、自然な過程である。メディエーターまたは酵素の量が多いほど、産生される還元されたメディエーターの量も多くなる。時間の経過とともに還元されたメディエーターの濃度が増加するため、バックグラウンド電流はセンサーストリップの保管期限の終わりに向けて上昇するであろう。
【0013】
[0013] 保管されたセンサーストリップの使用の前に、センサー性能に対するドリフトの効果を減少させる、複数の方法が提案されてきた。例えば、Genshawらは、アメリカ合衆国特許第5,653,863号において、分析前に比較的長い初期パルスを使用して、運搬および保管の間に還元されたメディエーターを酸化する方法を開示した。効果的ではあるが、この方法は分析を完了するのに必要な時間を長くした。
【0014】
[0014] 従って、運搬および保管後のバイオセンサーの測定性能を改善するために、試薬組成物の長期間安定性を増加させることが望ましいだろう。このような試薬組成物の長期間安定性の増加は、バイオセンサーの測定性能を上昇させ、また、センサーストリップのより長い保管期間を提供することができる。試薬組成物中に含まれるの犠牲酵素および/またはメディエーターの量を減少させ、そして、分析が完了するのに必要とされる時間を短縮させることもまた、望ましいであろう。
【0015】
[0015] 全血(WB)試料におけるグルコース濃度の測定に使用される、従来のバイオセンサーの別の欠点は、“ヘマトクリット効果”と言われる。水およびグルコースに加えて、WB試料は赤血球(RBC)を含む。ヘマトクリットとは、WB試料の全容量と比較したRBCにより占められるWB試料の容量であり、またしばしばパーセンテージで表現される。ヘマトクリット効果は、バイオセンサーの1つあるいはそれ以上の電極への、分析対象物および/またはメディエーターの拡散を、赤血球が阻害するときに起こる。バイオセンサーにより測定される出力シグナルは、分析対象物および/またはメディエーターの拡散の速度に対応するため、RBCはこの拡散過程を妨害することにより、分析に誤差をもたらす可能性がある。従って、WB試料において、%-ヘマトクリット系較正(calibration)からのヘマトクリットのパーセント(赤血球の容量)の偏差が大きいほど、バイオセンサーから得られるグルコース値におけるヘマトクリットバイアス(誤差)は大きい。
【0016】
[0016] WB試料は一般に、20%から60%の範囲のヘマトクリットパーセンテージを有し、平均〜40%である。同一のグルコースレベルを含むが、20%、40%、および60%のヘマトクリットを有するWB試料を検査した場合、一組の較正定数(例えば、40%のヘマトクリットを含むWB試料の傾きおよび切片)に基づいた系によって、異なる3つのグルコース値が報告されるだろう。RBCが電極表面での分析対象物および/またはメディエーターの拡散を阻害するため、グルコース濃度が同じであるにも関わらず、その系においては、20%ヘマトクリットWB試料は40%ヘマトクリットWB試料よりもグルコースを多く含み、また、60%ヘマトクリットWB試料は、40%ヘマトクリットWB試料よりも少ないグルコースを含むように報告されるであろう。このように、従来のバイオセンサーは、より低い分析対象物濃度と、RBCが拡散阻害をする、より高い分析対象物物濃度との識別ができない可能性がある。
【0017】
[0017] 従来のバイオセンサーは一般に、実際のヘマトクリット含有量に関わらず、WB試料においては40%のヘマトクリット含有量を仮定してグルコース濃度を報告するように設定される。これらの系では、40%より少ないか、または多いヘマトクリットを含む血液試料に対して行われるグルコース測定はいずれも、ヘマトクリット効果に起因するヘマトクリットバイアスを含むであろう。
【0018】
[0018] グルコース測定へのヘマトクリット効果によるバイアスを減少させるため、様々な方法および技術が提案されてきた。例えば、Oharaらは、アメリカ合衆国特許第6,475,372号において、ヘマトクリット効果に関して補正するために、順方向および逆方向の電位パルスからの電流の比を使用する方法を開示した。McAleerらは、アメリカ合衆国特許第5,708,247号および第5,951,836号において、ヘマトクリット効果を減少させるために、電極表面からRBCを濾過する、シリカ粒子を使用する試薬組成を開示した。Carterらは、アメリカ合衆国特許第5,628,890号において、ヘマトクリット効果を減少させるため、血液試料を分布させるためのメッシュ層と広い電極間隔と組み合わせて使用する方法を開示した。
【0019】
[0019] ヘマトクリット効果に起因するバイアスを減少させるためのこれらの従来技術には、(a)ヘマトクリット効果を最小限にするポリマーの共沈着(co-deposition)、(b)ポリマー層における濾過効果を促進する、様々な種類の溶融石英の添加、(c)順方向および逆方向の電位パルスからの電流の比に基づく補正係数、および(d)全血試料の液抵抗の存在を使用することによる自己補正、が含まれた。これらの方法は有用である可能性があるが、従来のグルコースセンサーは、一般に約15%から30%の、ヘマトクリット効果に起因する顕著な分析的バイアスを示し続ける。従って、ヘマトクリット効果由来のバイアスを減少させる、生体液中の分析対象物、特に全血のグルコース含有量の定量のための系を提供することが、望ましいであろう。
【先行技術文献】
【特許文献】
【0020】
【特許文献1】WO 88/03270
【特許文献2】アメリカ合衆国特許第4,711,245号
【特許文献3】アメリカ合衆国特許第5,958,199号
【特許文献4】アメリカ合衆国特許第5,997,817号
【特許文献5】アメリカ合衆国特許第5,653,863号
【特許文献6】アメリカ合衆国特許第6,475,372号
【特許文献7】アメリカ合衆国特許第5,708,247号
【特許文献8】アメリカ合衆国特許第5,951,836号
【特許文献9】アメリカ合衆国特許第5,628,890号
【発明の概要】
【0021】
[0020] 一つの観点において、電気化学的センサーストリップには、基板、基板上の第一電極および第二電極、および基板上の蓋が含まれる。ストリップには、第一導体上に少なくとも1つの第一層が含まれ、第一層には、多くても8μg/mm2のメディエーターを含む、試薬層が含まれる。このストリップは、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比のうち、少なくとも1つを有する、決定された濃度値を提供する。
【0022】
[0021] ストリップの第一電極および第二電極は、実質的に同一平面にあり、また、第二電極は、第二導体上の第一層を含むことができる。第二電極は、第二導体上の第二層を含むことができ、また、第二層には第一層の試薬層とは組成の異なる試薬層を含まれていてもよい。これらの電極は200μmよりも広く隔てられてよく、また、蓋の上部から少なくとも100μmは隔てられてよい。
【0023】
[0022] ストリップの試薬層の平均初期厚は、8μmより薄くてよく、あるいは、0.25μmから3μmであってよい。ストリップの試薬層は、沈着密度が多くとも0.2μL/mm2において、試薬溶液から形成されることができる。試薬層には、ポリマー接着剤として、ポリ(エチレンオキシド)、ポリビニルアルコール、ヒドロキシエチレンセルロース、カルボキシメチルセルロース、またはそれらの組み合わせが含まれてよい。ポリマー接着剤の沈着密度は、第一導体上で、大きくとも2μg/mm2であってよい。ポリマー接着剤は、部分的に水溶性であってよく、および/または、水和によりゲル状物質を形成することができる。
【0024】
[0023] 試薬層には、多くとも0.8μg/mm2の沈着密度の酵素系が含まれてよく、そして/あるいは、多くとも1.3ユニットの酵素が含まれていてよい。作用電極上の試薬層には、多くとも2μg/mm2のメディエーターが含まれてよい。メディエーターは2電子移動メディエーターであってよく、また、3-フェニルイミノ-3H-フェノチアジン、3-フェニルイミノ-3H-フェノキサジン、それらの塩、それらの酸、それらの誘導体、またはそれらの組み合わせであってよい。メディエーターは、ヘキサシアノ鉄(II)酸塩(ferricyanide)の酸化還元電位よりも低い、少なくとも100 mVの酸化還元電位を有することができる。
【0025】
[0024] ストリップは、-20℃で2週間または4週間保管された比較ストリップと比べて、50℃で2週間または4週間保管した後に±5%より小さい安定性バイアスを、それぞれ有することができる。ストリップは、20%から60%のヘマトクリットを含む全血試料において、±5%より小さいヘマトクリットバイアスを有することができる。ストリップは、大きくとも10 mg/dL、または大きくとも1 mg/dLである、切片対傾き比を有することができる。
【0026】
[0025] 別の観点において、電気化学的センサーストリップには、基板、基板上の第一電極および第二電極、および基板上の蓋が含まれる。このストリップには、第一導体上に少なくとも1つの第一層を含み、この第一層は、メディエーターおよび酵素系を含む試薬層を含み、この試薬層は、-20℃で2週間保管されたストリップと比較して50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比のうちの、少なくとも1つを有する、決定された濃度値を提供する。
【0027】
[0026] 別の観点において、試料中の分析対象物の濃度を決定する方法が提供される。その方法は、試料にパルスシーケンスを印加することが含まれ、このパルスシーケンスは、30秒以内に少なくとも3回のデューティサイクルを含む。この方法にはまた、試料中の分析対象物濃度を決定することが含まれ、その濃度は、±10%より小さい安定性バイアス、20%から60%のヘマトクリット範囲にわたる全血試料において±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比のうちの、少なくとも1つを有する。
【0028】
[0027] その方法には、9秒以内に少なくとも3回のデューティサイクルを含むことができ、そしてパルスシーケンスは長くとも5秒間で完了することができる。試料中の分析対象物濃度の決定することには、パルスシーケンスの印加から2秒以内に得られる電流測定より、試料中の分析対象物濃度を決定することを含むことができる。各デューティサイクルには、励起および緩和が含まれていてもよく、各励起は0.01秒から3秒の持続時間を有していてもよい。励起は、長くとも10秒、または長くとも2秒の合計持続時間を有していてもよく、そして励起は、500 mV異なる振幅を有していてもよい。励起は、パルスシーケンスの時間の、長くとも45%である可能性がある。緩和のそれぞれは、短くとも0.2秒の持続時間を有していてもよいか、あるいは0.2秒から3秒の持続時間を有していてもよい。パルスシーケンスは、0.75秒から3秒持続する初期励起を含むことができ、この初期励起はデューティサイクルの励起よりも持続が長い。
【0029】
[0028] この方法は、-20℃で2週間または4週間保管された比較ストリップと比べて、50℃で2週間または4週間保管した後に±5%より小さい安定性バイアスをそれぞれ有する濃度を決定することができる。その濃度は、20%から60%のヘマトクリットを含む全血試料において、±5%より小さいヘマトクリットバイアスを有することができる。その濃度は、大きくとも10 mg/dL、または、大きくとも1 mg/dLの切片対傾き比を有することができる。
【0030】
[0029] 別の観点において、定量的な分析対象物決定の性能を上昇させる方法には、液体組成物を有する分析対象物含有試料を電気化学的センサーストリップに導入することを含み、そのストリップは、基板、基板上の第一導体、基板上の第二導体、および、少なくとも第一導体上の少なくとも1つの第一層を有し、その少なくとも1つの第一層は、ポリマー接着剤を含む試薬層を含み、そして、試料は第一導体と第二導体の間の電気的連通を提供する。この方法はまた、30秒以内または9秒以内に少なくとも4回の読み出しパルスという形態で、第一導体と第二導体との間に電位を印加することを含み、そしてこの読み出しパルスの少なくとも1つを測定して、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%に渡るヘマトクリット範囲の全血試料における±10%より小さいヘマトクリットバイアス、大きくとも10 mg/dLの切片対傾き比、および、それらの組み合わせから選択される、少なくとも1つの性能パラメーターに起因する性能の上昇を伴う、試料中の分析対象物濃度の定量的な値を提供する。
【0031】
[0030] 読み出しパルスは、長くとも5秒間で完了することができ、その読み出しパルスは電位印加から2秒間内に測定されることができ、そして、その読み出しパルスは、それぞれ0.01秒から3秒の持続時間を有することができる。読み出しパルスは、長くとも2秒間の持続時間を有することができ、そして、500 mV以内の差をもつ振幅であってよい。
【0032】
[0031] この方法は、-20℃で2週間または4週間保管された比較ストリップと比べて、50℃で2週間または4週間保管した後に±5%より小さい安定性バイアスをそれぞれ有する、定量的な値を決定することができる。この方法は、20%から60%のヘマトクリットを含む全血試料において、±5%より小さいヘマトクリットバイアスを有する定量的な値を決定することができる。この方法は、大きくとも10 mg/dL、または大きくとも1 mg/dLである、切片対傾き比を有する定量的な値を決定することができる。
【図面の簡単な説明】
【0033】
[0032] 本発明を、以下の図面および説明を参照することにより、より良く理解することができる。図中の構成要素は、必ずしも等縮尺ではなく、代わりに、本発明の原理を示す際に強調されている場合がある。さらに、図中において、同じ参照番号は、異なる図面を通じて対応する部分を一般的に示す。
【図1−1】[0033] 図1Aは、組み立てられたセンサーストリップの透視描写である。
【図1−2】[0034] 図1Bは、蓋が外された場合のセンサーストリップの上面図である。
【図2−1】[0035] 図2Aは、図1Bのセンサーストリップの端面図である。
【図2−2】[0036] 図2Bは、メディエーターによる、酵素系から作用電極への1つの電子の移動を示す。
【図2−3】[0037] 図2Cは、メディエーターによる、酵素系から作用電極への2つの電子の移動を示す。
【図3】[0038] 図3は、試料中の分析対象物の存在および濃度を決定する電気化学的方法を示す。
【図4】[0039] 図4A〜図4Dは、複数回のデューティサイクルが試料導入後のセンサーストリップに印加される、ゲート電流測定用パルスシーケンスの例を示す。
【図5−1】[0040] 図5Aおよび図5Bは、20%、40%、および55%のヘマトクリットレベルでの、PQQ-GDH酵素系を含むセンサーストリップにおける、用量反応曲線を示す。
【図5−2】[0041] 図5Cは、実験データより決定されるI/S比をmg/dLで示す。
【図5−3】[0042] 図5Dは、試薬組成物RC2、RC3、またはRC4を有するセンサーストリップから決定される、複数のグルコース濃度における0 mg/dLから20 mg/dLのI/S比を示す。
【図5−4】[0043] 図5Eは、血漿、および40%ヘマトクリットの全血試料を有する系でのほぼ同一なヘマトクリット性能を示す。
【図6−1】[0044] 図6Aは、PQQ-GDH酵素系を含む4つの試薬組成物における、50℃で2週間後の安定性バイアスを示す。
【図6−2】[0045] 図6Bは、PQQ-GDH酵素系を含む4つの試薬組成物における、50℃で4週間後の安定性バイアスを示す。
【図6−3】[0046] 図6Cは、PQQ-GDH酵素系を含む3つの試薬組成物における、80%の相対湿度下、25℃で52週間後の安定性バイアスを示す。
【図6−4】[0047] 図6Dは、分析対象物濃度の計算に使用されるデータポイントが、分析開始後、様々な時点で取られる、RC2を含むセンサーストリップにおける安定性バイアスの変動を示す。
【図7−1】[0048] 図7Aは、複数の全血試料におけるセンサーストリップからの用量反応曲線を示す。
【図7−2】[0049] 図7Bは、複数の全血試料より得られる、4つの製造ロットのセンサーストリップにおける絶対へマトクリットバイアスの広がりを示す。
【図7−3】[0050] 図7Cは、本発明のセンサーストリップと従来型のセンサーストリップとのヘマトクリット感受性を比較する。
【発明を実施するための形態】
【0034】
[0051] バイオセンサーは、グルコースレベルのほとんど瞬時の測定という利点を患者に提供する。これらの測定における誤差は、試薬組成物の分解、および/または、ヘマトクリット効果に起因する可能性がある。試薬組成物の分解は、センサーストリップが製造後、運搬および保管される期間中に生じる、継続的に起こる過程である。温度を含む複数の因子が、試薬組成物の分解の速度に影響を及ぼす可能性がある。ヘマトクリット効果は、測定可能な種の、作用電極の導体表面への拡散速度に、赤血球がランダムに影響を及ぼす際に起こる。
【0035】
[0052] センサーストリップ上に使用されるメディエーターおよび/または酵素の量を減らすことにより、従来型のバイオセンサーおよび試薬組成物との関連で、試薬組成物の長期間安定性を増加させることができる。つまり、センサーストリップの安定性バイアス、および、切片対傾き比を、改善することができる。さらに、安定性が増強された試薬組成物とゲート分析法を組み合わせることにより、ヘマトクリット効果を減少させることができる。このように、これらのおよびその他の性能パラメーターの1つあるいはいずれかの組み合わせ、は、本発明に従って改善される可能性がある。
【0036】
[0053] 1つの観点において、本発明のバイオセンサーは、-20℃で4週間保管されたセンサーストリップと比べて、50℃で4週間保管した後、好ましくは±10%より小さく、より好ましくは、±5%より小さい安定性バイアスを示す。別の観点において、本発明のバイオセンサーは、20%から60%のヘマトクリットを含むWB試料において、好ましくは±10%より小さく、より好ましくは、±5%より小さいヘマトクリットバイアスを示す。別の観点において、本発明のバイオセンサーは、好ましくは大きくとも20 mg/dL、より好ましくは、大きくとも10 mg/dLまたは大きくとも6 mg/dL、および、さらにより好ましくは、大きくも1 mg/dLである、切片対傾き比を示す。センサーストリップの、これらおよびその他の性能パラメーターを改善することができる。
【0037】
[0054] 図1Aおよび図1Bは、本発明中で使用することができるセンサーストリップ100を示す。図1Aは、組み立てられたセンサーストリップ100の透視図であり、蓋120により少なくとも部分的に覆われたセンサー基板110を含み、蓋120には穴130、試料カバー領域140、および、投入端開口部150が含まれる。部分的に囲まれた容量160(キャピラリーギャップまたはキャップ-ギャップ)は、基板110と蓋120との間に形成される。アメリカ合衆国特許第5,120,420号および第5,798,031号に記述されるものなど、本発明に矛盾しない、その他のセンサーストリップ設計もまた、使用することができる。
【0038】
[0055] 分析のための液体試料は開口部150へ液体を導入することにより、キャップ-ギャップ160へと移すことができる。液体は、先に含まれていた空気を穴130から押し出しながら、キャップ-ギャップ160を満たす。キャップ-ギャップ160は、キャップ-ギャップ中に液体試料を保持することを補助する組成物(示されていない)を含むことができる。前記組成物の例には、カルボキシメチルセルロースおよびポリエチレングリコールなどの水膨潤性ポリマー;および、デキストランおよびポリアクリルアミドなどの多孔性ポリマーマトリクスが含まれる。
【0039】
[0056] 図1Bは、蓋120を外したセンサーストリップ100の上面図を示す。導体170および180は、開口部150からそれぞれ作用電極175および対電極185へと誘電層190の下を走ることができる。1つの観点において、作用電極175および対電極185は、図に示される通り、実質的に同一平面に存在することができる。関連する観点において、作用電極175および対電極185は200μmまたは250μmより広く隔てられていてもよく、また、蓋120の上部から少なくとも100μm隔てられていてもよい。別の観点において、作用電極175および対電極185は、200μmよりも狭く隔てられていてもよい。誘電層190は、部分的に電極175、185を覆うことができ、そして、絶縁ポリマーなどの適当な誘電物質から作ることができる。
【0040】
[0057] 対電極185は、センサーストリップ100の作用電極175における電気化学的活性を補佐することができる。1つの観点において、作用電極175における電気化学的活性を補佐する電位は、対電極185を炭素などの不活性物質から形成すること、および、キャップ-ギャップ160内にヘキサシアノ鉄(II)酸塩(ferricyanide)などの可溶性酸化還元種を含ませることにより、センサー系に提供されることができる。別の観点において、対電極185における電位は、Ag/AgClなどの酸化還元ペアから対電極185を形成することにより達せられる参照電位であってよく、組み合わさった参照-対電極を提供する。あるいは、センサーストリップ100には、第三導体および第三電極(示されていない)とを提供して、センサー系に参照電位を提供することができる。
【0041】
[0058] 図2Aは図1Bに示されるセンサーストリップの端面図を示し、作用電極175および対電極185の層構造を示す。導体170および180は、基板110上に直接形成させることができる。表面導体層270および280は、それぞれ導体170および180の上に、任意に沈着することができる。表面導体層270、280は、同じ物質または異なる物質から作ることができる。
【0042】
[0059] 導体170、180、および表面導体層270、280を形成するために使用される、1つあるいは複数の物質は、すべての電導体を含むことができる。好ましい電導体は非イオン化物質であり、そのため試料の分析の間に、正味の酸化、または、正味の還元を受けない。導体170、180には、好ましくは、金、銀、白金、パラジウム、銅、またはタングステンなどの、金属または金属ペーストの薄い層が含まれる。表面導体層270、280には、好ましくは炭素、金、白金、パラジウム、またはそれらの組み合わせが含まれる。表面導体層が導体上に存在しない場合、導体は、好ましくは非イオン化物質から作られる。
【0043】
[0060] 箔蒸着、化学気相蒸着、スラリー塗布などを含む、センサーストリップの操作と互換性のある従来のすべての手法によって、表面導体物質を、導体170、180上に沈着することができる。アメリカ合衆国特許第5,798,031号に記述される通り、スラリー塗布の場合、混合物をインクとして導体170、180に印加することができる。
【0044】
[0061] 試薬層275および285を、それぞれ導体170および180上に沈着することができる。その層は、試薬および任意で接着剤を含む、少なくとも1つの試薬組成物から形成される。接着剤は、好ましくは、少なくとも部分的に水溶性のポリマー物質である。1つの観点において、接着剤は、試料により水和されると、ゲルまたはゲル状物質を形成することができる。別の観点において、接着剤は赤血球を濾過することができる。
【0045】
[0062] 接着剤としての使用に適する、部分的に水溶性のポリマー物質には、ポリ(エチレンオキシド)(PEO)、カルボキシメチルセルロース(CMC)、ポリビニルアルコール(PVA)、ヒドロキシエチレンセルロース(HEC)、ヒドロキシプロピルセルロース(HPC)、メチルセルロース、エチルセルロース、エチルヒドロキシエチルセルロース、カルボキシメチルエチルセルロース、ポリビニルピロリドン(PVP)、ポリリジンなどのポリアミノ酸、ポチスチレンスルホン酸、ゼラチン、アクリル酸、メタアクリル酸、でんぷん、それらの無水マレイン酸塩、それらの誘導体、およびそれらの組み合わせが含まれてもよい。上記の接着剤物質の中で、PEO、PVA、CMC、およびHECが好ましく、現在のところ、CMCがより好ましい。
【0046】
[0063] 接着剤に加えて、試薬層275および285には、同一の試薬、または異なる試薬が含まれてよい。同一の試薬が含まれる場合、試薬層275および285は同一の層であってよい。1つの観点において、第一層275中に存在する試薬は、作用電極175と共に使用するために選択されることができ、一方、第二層285中に存在する試薬は、対電極185と共に使用するために選択されることができる。例えば、層285中の試薬は、試料と導体180との間の電子の自由な流れを促進することができる。同様に、層275中の試薬は、分析対象物の反応を促進することができる。
【0047】
[0064] 試薬層275は、分析対象物、特に複雑な生物学的試料中の分析対象物、へのセンサー系の特異性を高めつつ分析対象物の反応を促進することができる、分析対象物に特異的な酵素系を含むことができる。酵素系は、1つあるいはそれ以上の酵素、補因子、および/または、分析対象物との酸化還元反応に参加するその他の部分を含むことができる。例えば、アルコールオキシダーゼを使用して、試料中のアルコールの存在に対して感度の高いセンサーストリップを提供することができる。そのような系は、血液アルコール濃度を測定するのに有用であるだろう。別の例では、グルコースデヒドロゲナーゼまたはグルコースオキシダーゼを使用して、試料中のグルコースの存在に対して感度の高いセンサーストリップを提供することができる。この系は、例えば糖尿病であることが既知の患者、または、疑われる患者において、血液グルコース濃度を測定する際に有用であるだろう。
【0048】
[0065] 酵素系において使用される酵素には、アルコールデヒドロゲナーゼ、乳酸脱水素酵素、β-ヒドロキシ酪酸脱水素酵素、グルコース-6-リン酸デヒドロゲナーゼ、グルコースデヒドロゲナーゼ、ホルムアルデヒドデヒドロゲナーゼ、リンゴ酸脱水素酵素、および3-ヒドロキシステロイド脱水素酵素が含まれる。好ましい酵素系は、酸素非依存性であり、つまり、実質的に酸素により酸化されない。
【0049】
[0066] そのような酸素非依存性酵素ファミリーの1つは、グルコースデヒドロゲナーゼ(GDH)である。異なる補酵素または補因子を使用して、異なるメディエーターにより異なる様式で、GDHは仲介されることができる。GDHとのその関連性に応じて、フラビンアデニンジヌクレオチド(FAD)などの補因子は、FAD-GDHの場合のように、宿主酵素によってきつく捕えられることができる;あるいは、ピロロキノリンキノン(PQQ)などの補因子は、PQQ-GDHというように、宿主酵素と共有結合することができる。これらの各酵素系の補因子は、恒久的に宿主細胞により捕えられているか、あるいは、補酵素およびアポ酵素は、試薬組成物に酵素系が加えられる前に再構成されることができる。補酵素はまた、試薬組成物中の宿主酵素部分に独立して加えられ、ニコチンアミドアデニンジヌクレオチドNAD/NADH+またはニコチンアミドアデニンジヌクレオチドリン酸NADP/NADPH+の場合のように、宿主酵素の触媒的機能を補助する。
【0050】
[0067] 試薬層275は、分析対象物の反応の結果を、表面導体270および/または導体170へ、より効率的に伝えるためのメディエーターを含むことができる。メディエーターはその電気化学的活性に基づいて、2つのグループに分けることができる。1電子移動メディエーターは、電気化学的反応の条件下で、1つのさらなる電子を捕えることができる化学部分(chemical moiety)であり、一方、2電子移動メディエーターは、反応条件下で、2つのさらなる電子を捕えることができる化学部分である。図2Bに示される通り、1電子移動メディエーターは1つの電子を酵素から作用電極へと移動させることができ、一方、図2Cに示される通り、2電子移動メディエーターは、2つの電子を移動させることができる。
【0051】
[0068] その他のメディエーターを使用することができるが、1電子移動メディエーターに関して、同モル量のメディエーターによって、酵素系から作用電極へ約2倍の電子を移動させることができるため、2電子移動メディエーターが好ましい。従来のセンサーストリップに関して、センサーが機能するために必要とされるメディエーターの量を減らすことにより、本発明のセンサーストリップは、長期間安定性の上昇を示すことができる。この安定性の上昇は、保管中のメディエーターによる酵素の変性の減少に起因する可能性がある。安定性の上昇はまた、保管中に酵素を酸化することができるメディエーターの量の減少に起因する可能性もある。
【0052】
[0069] 1電子移動メディエーターの例には、1,1’-ジメチルフェロセン、ヘキサシアノ鉄(III)酸塩(ferrocyanide)およびヘキサシアノ鉄(II)酸塩(ferricyanide)、ならびに、ルテニウム(III)およびルテニウム(II)ヘキサアミンなどの、化合物が含まれる。2電子メディエーターには、フェナトロリンキノンなどの、有機キノンおよびヒドロキノン;フェノチアジンおよびフェノキサジン誘導体;3-(フェニルアミノ)-3H-フェノキサジン;フェノチアジン;および7-ヒドロキシ-9,9-ジメチル-9H-アクリジン-2-オンおよびその誘導体が含まれる。さらなる2電子メディエーターの例には、例えば、本明細書中で参照として援用される、アメリカ合衆国特許第5,393,615号;第5,498,542号;および第5,520,786号に記載される、電子-活性有機分子が含まれる。
【0053】
[0070] 好ましい2電子移動メディエーターには、3-フェニルイミノ-3H-フェノチアジン(PIPT)および3-フェニルイミノ-3H-フェノキサジン(PIPO)が含まれる。より好ましい2電子メディエーターには、フェノキサジン誘導体の、カルボン酸または塩(たとえば、アンモニウム塩など)が含まれる。現在のところ、特に好ましい2電子メディエーターには、(E)-2-(3H-フェノチアジン-3-イリデンアミノ)ベンゼン-1,4-ジスルホン酸(構造I)、(E)-5-(3H-フェノチアジン-3-イリデンアミノ)イソフタル酸(構造II)、アンモニウム(E)-3-(3H-フェノチアジン-3-イリデンアミノ)-5-カルボキシ安息香酸(構造III)、およびそれらの組み合わせが含まれる。これらのメディエーターの構造式は以下に示される。
【0054】
【化1】

【0055】
【化2】

【0056】
【化3】

【0057】
別の観点において、好ましい2電子メディエーターは、ヘキサシアノ鉄(II)酸塩(ferricyanide)よりも少なくとも100 mV低い、より好ましくは少なくとも150 mV低い、酸化還元電位を有する。
【0058】
[0071] 印刷、液体沈着、またはインクジェット沈着などの便利な手法により、試薬層275、285を沈着させることができる。1つの観点において、この層は印刷により沈着される。その他の因子が等しい場合、印刷の刃の角度が、試薬層の厚さに、逆向きに影響する可能性がある。例えば、刃が基板110に対して約82°の角度で動かされる場合、この層は約10μmの厚さを有することができる。同様に、基板110に対して約62°の刃の角度を使用する場合、より厚い30μmの層を作成することができる。このように、刃の角度が低いほど、より厚い試薬層を提供することができる。刃の角度に加えて、ふるいサイズ(screen-size)およびエマルション組み合わせ(emulsion combination)と共に印加される、物質の粘度などのその他の因子が、試薬層275、285の結果的な厚さに影響を及ぼす可能性がある。
【0059】
[0072] より薄い試薬層が好ましい場合、マイクロピペッティング、インクジェッティング、または、ピン-沈着などの、印刷以外の沈着方法が必要とされる可能性がある。これらの沈着方法は一般に、1〜2μmといった、マイクロメートルまたはマイクロメートル未満の厚さの乾燥試薬層を与える。例えば、ピン-沈着法は、平均1μmの厚さの試薬層を提供することができる。ピン-沈着の結果である試薬層の厚さは、例えば、試薬組成物中に含まれるポリマーの量により調節されることができ、ポリマー含有量が高いほどより厚い試薬層を提供する。望ましい測定性能を維持するためおよび/または拡散バリア層(DBL)内の分析対象物を実質的に測定するために、薄い試薬層は、厚い試薬層よりも短いパルス幅を必要とする可能性がある。
【0060】
[0073] 作用電極175には、図2Aに示されるような、試薬層275の一体のものである(integral)か、または、異なる層290である、DBLが含まれていてもよい。つまりDBLは、導体上の試薬/DBLの組み合わせとして、導体上の異なる層として、または、試薬層上の区別される層として、形成されることができる。作用電極175が異なるDBL290を含む場合、試薬層275はDBL290上にあってもよいし、なくてもよい。DBL290上にあるかわりに、試薬層275は、試薬を試料中に溶解することができるセンサーストリップ100のどの部分にあってもよい。例えば、試薬層175は、基板110にあってもまたは蓋120上にあってもよい。
【0061】
[0074] DBLは、測定可能な種が存在できる内部容量を有する、多孔空間を提供する。DBLの孔を、測定可能な種がDBL内に拡散することができるが、RBCなどの物理的に大きな試料構成成分は実質的に排除されるように選択することができる。従来のセンサーストリップは、様々な物質を用いて作用電極の表面からRBCを濾過してきたが、DBLは内部多孔空間を提供して、試料から測定可能な種の一部分を含有させ、そして分離する。
【0062】
[0075] 試薬層275に水溶性接着剤が含まれる場合、励起の印加に先立って試料に溶解しない接着剤の部分は、一体のDBLとして機能することができる。DBL/試薬層の組み合わせの平均初期厚は、好ましくは、16あるいは8マイクロメートル(μm)より薄く、そしてより好ましくは、4μmより薄い。現在のところ、DBL/試薬層の組み合わせの特に好ましい初期の厚さの平均は、0.25μmから3μm、あるいは、0.5μmから2μmである。DBL/試薬層の組み合わせの望ましい平均初期厚は、DBLから、図2Aの導体170の表面または表面導体270の表面などの、導体表面への、測定可能な種の拡散速度が比較的一定になったときを基準にして、特異的な励起の長さにおいて選択されることができる。1つの観点において、0.25秒またはそれより短い励起パルス幅と組み合わされる場合、DBL/試薬層は1μm、またはそれより薄い、平均初期厚を有することができる。
【0063】
[0076] 異なるDBL290は、望ましい多孔空間を提供するすべての物質を含むことができ、試料中に、部分的に、またはゆっくりと溶解する。1つの観点において、異なるDBL290は、試薬のない試薬接着物質を含むことができる。異なるDBL290は、1μmから15μmの平均初期厚を有し、また、より好ましくは2μmから5μmである。
【0064】
[0077] 図3は、試料312中の分析対象物322の、存在および任意で濃度を決定する、電気化学的分析300を示す。310において、試料312は、図1A〜図1B、および図2Aに示されるセンサーストリップなどの、センサーストリップ314に導入される。図2Aの275および/または285などの試薬層は、試料312中に溶解し始め、これにより反応が可能になる。分析のこの時点において、試薬についての初期時間遅延、または“インキュベーション時間”を提供して、試料312と反応することは、有益である可能性がある。好ましくは、初期時間遅延は、0.5秒から5秒であってよい。初期時間遅延の徹底的な処理は、アメリカ合衆国特許第5,620,579号および第5,653,863号に見いだすことができる。
【0065】
[0078] 反応の間、320では、試料312中に存在する分析対象物322の一部分が、酸化還元酵素などによって、化学的または生化学的に酸化または還元される。酸化または還元に際して、330では、酸化還元酵素を介するなどにより、電子が分析対象物322とメディエーター332の間を移動することができる。
【0066】
[0079] 340では、電荷を帯びたメディエーター332は電気化学的に励起される(酸化または還元される)。例えば、試料312が、320においてPQQ-GDH酵素系により酸化されたグルコースを含む全血であり、それが330において、2電子を移動してフェノチアジン誘導体メディエーターを還元する場合、340の励起は、作用電極においてフェノチアジン誘導体メディエーターを酸化する。この様式において、電子がグルコース分析対象物からセンサーストリップの作用電極へと選択的に移動し、そこで、それらを測定装置により検出することができる。
【0067】
[0080] 励起340の結果として得られる電流を、350において、励起340の期間、時間の関数として記録することができる。360において、試料は緩和を受ける。好ましくは、緩和360の期間には電流は記録されない。370において、記録された電流および時間の値は、試料312中の分析対象物322の存在および/または濃度を決定するため分析されることができる。
【0068】
[0081] 電流測定センサー系は電位(電圧)をセンサーストリップに印加し、測定可能な種を励起させて、その間に電流(電流量)をモニターする。従来型の電流測定センサー系は、例えば5秒から10秒の継続的な読み出しパルス長において電流を測定している間、電位を維持することができる。従来の方法と対照的に、電気化学的分析300において使用されるデューティサイクルは、継続的で長期間の読み出しパルスを、複数回の短期間の励起および緩和に置き換える。複数回の励起および緩和、または“ゲート(gated)”パルスシーケンスの、より詳細な説明は、“Gated Amperometry”と題された、2006年7月19日に出願されたPCT/US2006/028013に見い出すことができる。
【0069】
[0082] 図3を参照すると、励起340、記録350、および緩和360により、1回のデューティサイクルが構成される。好ましくは、少なくとも2、4、6、または7回のデューティサイクルが、独立して選択された3、5、7、9、または14秒間の間、印加される。1つの観点において、デューティサイクルは、3秒間から14秒間の間、印加される。別の観点において、少なくとも4回のデューティサイクルが30秒間、9秒間、またはそれより短い時間内に、印加される。別の観点において、2から6回のデューティサイクルが、10秒間、またはそれより短い時間内に印加されることができる。別の観点において、2から4回のデューティサイクルが、3から9秒間内に印加されることができる。
【0070】
[0083] 励起340の後、360において、測定装置はセンサーストリップ314を介して回路を開くことができ、これによって系を緩和させる。緩和360の間、励起340の間に存在する電流は、少なくとも2分の1、好ましくは、一桁分、および、より好ましくはゼロへと、顕著に減少する。好ましくは、開回路、または実質的にゼロ電流を提供することが当業者に既知であるその他の方法により、ゼロ電流状態が提供される。1つの観点において、緩和360は少なくとも0.5秒、または、少なくとも0.2秒の持続時間である。別の観点において、緩和360は0.2秒から3秒、または、0.5秒から1秒の持続時間である。
【0071】
[0084] 図4A〜図4Dは、試料の導入後、センサーストリップに複数回のデューティサイクルを印加する、ゲート電流測定パルスシーケンスの例を示す。これらの例においては、炬形波パルスが使用された;しかしながら、センサー系および試験試料に適合する、その他の波形もまた使用することができる。
【0072】
[0085] 示された各パルスシーケンスには、1秒間の初期励起パルス420に続いて、複数回の0.25秒の励起430が含まれる。初期励起パルス420は、続く励起430よりも長い持続時間であってよい。例えば、初期励起パルス420は、0.75秒から3秒の範囲の持続時間であってよい。励起パルス420の長さを、ストリップ上に沈着される比較的少量の酵素系を酸化するように調整することができる。初期励起パルス420が用いられるとき、続く複数回励起430より長い持続時間が好ましい。例えば、パルスシーケンスは2秒間の持続時間を有する初期励起パルス420に続いて、3秒間の開回路緩和、続いて、0.125秒間の持続時間を有する次の励起430を含むことができる。
【0073】
[0086] 複数回励起430は、0.01秒から3秒の範囲の持続時間であってよい。1つの観点において、励起の長さの合計は、2秒またはそれより短く、そのため、1秒の初期パルス420、続いて4回の0.25秒の励起430を含む。別の観点において、励起の長さの合計は、1.5秒またはそれより短く、そのため、1秒の初期パルス420、続いて1回または2回の0.25秒の励起430を含む。パルスシーケンスは、図4Aに示される励起440などの、さらなる励起を含んでもよい。別の観点において、図4Cおよび図4Dに示されるように、励起は異なる振幅の励起であってよい。好ましい観点において、異なる振幅の励起が用いられる場合、振幅の差は500 mV以内であることができる。
【0074】
[0087] 短い励起により、従来の組成物に関して減少したポリマー、酵素系、およびメディエーター濃度を有する試薬組成物を用いた試料の正確な分析をもたらすことができる。さらに、短い励起は、センサーストリップへの最初のシグナルの印加から、分析を8.5秒、あるいはそれよりも短い、または、より好ましくは、5秒、あるいはそれより短い時間内に完了させる。
【0075】
[0088] 短い励起または長い励起を使用することができる。好ましくは、分析対象物濃度がそれにより決定される電流測定は、最初のシグナルの印加から2秒または1秒以内になされる。さらに好ましくは、試料の分析対象物濃度の決定のため、複数回の短い励起は、初期シグナルの印加から2秒、1秒、あるいは、それよりも短い時間内でなされる電流測定と組み合わされる。
【0076】
[0089] 本発明のゲート電流測定パルスシーケンスと組み合わせて、特定の量のポリマー接着剤、酵素系、および/またはメディエーターを含む試薬組成物は、ヘマトクリットバイアスを減少させ、および/または長期間の安定性を増加させることが見いだされた。従来型のストリップは、しばしば各試薬組成成分のパーセントの単位で記述されるが、長期間の安定性と関連するのは、各試薬組成成分の密度(面積当たりの絶対量)である。相互作用に使用できるメディエーターおよび酵素の量を限定することにより、分析の時点で存在する、環境的に還元されたメディエーター(根本的な分析対象物の濃度に応答しないメディエーター)の量を実質的に減少させることができる。これにより、バックグラウンド電流の有益な減少が提供される。従来のバイオセンサーは長期間安定性を改善させるための試みにおいて、過剰な酵素を使用するので、本発明のバイオセンサーにおいて酵素系および/またはメディエーターの減少が長期間安定性の改善を提供することは期待されなかった。さらに、それぞれの試薬組成物が各電極において最適化された場合、酵素と相互作用できるメディエーターの相対量は、単一の試薬組成物のセンサーストリップに比べてさらに減少する可能性がある。
【0077】
[0090] 例えば、酵素の多量のローディングに使用する際の試薬溶液中のポリマー濃度0.5%(w/w)よりも、より高いポリマー濃度2%、1.5%、および1%において、ヘマトクリットバイアスは大きかった。これは、より高いポリマー濃度はより厚い試薬層を生成することに起因する可能性があり、このことは再水和時におけるヘマトクリットバイアスに影響する。従って、アッセイ時間が短くなるので、ヘマトクリットバイアスの増加なしでの迅速な再水和が好ましい可能性がある。この様式において、試薬組成物のポリマー含有量と酵素のローディングとの間の好ましいバランスが達せられて、アッセイ時間中の望ましい水和レベルを提供することができる。センサーストリップに適用される場合、2μg/mm2またはそれより少ないポリマー沈着密度が好ましく、0.8から1.5μg/mm2のポリマー沈着密度がより好ましい。
【0078】
[0091] 異なる沈着溶液が作用電極および対電極に沈着される場合、作用電極上に存在する酵素系の量は制御されている。このように、1.2 UのPQQ-GDH酵素系、2.57μgの構造Iメディエーター、1.18μgのCMCポリマー、および3.28μgのリン酸バッファーを含む約0.24μLの溶液の沈着は、5 U/μLの酵素系、24 mMのメディエーター、0.5%のポリマー、および100 mMリン酸バッファーという濃度の試薬溶液を提供する。
【0079】
[0092] 1 mm2の作用電極領域を含む、1.5 mm2の沈着領域上へのこの試薬溶液の沈着は、作用電極での約0.8 U/mm2(1.2 U/1.5 mm2)の酵素系沈着密度、1.72μg/mm2(2.57μg/1.5 mm2)のメディエータ沈着密度、0.8μg/mm2のポリマー沈着密度、および、2.2μg/mm2のリン酸バッファー沈着密度を提供する。同様に、約2 U/μLのPQQ-GDH酵素系、24 mMの構造Iメディエーター、0.5%のCMC、および100 mMリン酸バッファーを含む試薬溶液について、酵素系沈着密度は約0.3 U/mm2となるであろう。さらに、酵素系の特異的な活性を、μg/mm2の単位で重量密度に変換することができる。例えば、酵素系の活性が770 U/mgである場合、0.3 U/mm2の酵素系の活性密度は、0.39μg/mm2の重量密度になる。このように、酵素系について沈着密度を決定するときに、酵素系の活性を考慮に入れることができる。
【0080】
[0093] 従来の試薬層は、1μg/mm2から6μg/mm2の酵素沈着密度を含む。反対に、沈着後、本発明の試薬組成物は、1μg/mm2より小さい、好ましくは0.5μg/mm2より小さい酵素系沈着密度を含むことができる。本発明の沈着溶液は、約4 U/μLまたはそれより少ない酵素系を含むことができるか、または、約3 U/μLまたはそれより少ない酵素系を含むことができる。現在のところ、2.2 U/μLまたはそれより少ないPQQ-GDH酵素系が試薬溶液中に含まれてよい。このように、試薬組成物がセンサーストリップに適用される際に、1.3 U、または、それより少ない酵素系がセンサーストリップ上に存在することができ、0.3Uから0.8Uがより好ましい。
【0081】
[0094] 従来のセンサーストリップは、一般に、10μg/mm2から25μg/mm2の範囲のメディエーター沈着密度を有する。反対に本発明においては、8μg/mm2およびそれより少ないメディエーター沈着密度が好ましく、5μg/mm2およびそれより少ないメディエーター沈着密度がより好ましい。現在のところ、2μg/mm2およびそれより少ないメディエーター沈着密度が特に好ましい。好ましい観点において、1電子メディエーターよりも2電子メディエーターが好ましい。
【0082】
[0095] 下の表Iは、以下に論じられる図5A〜図5Eおよび図6A〜図6Cで用いられる試薬組成物における、ポリマー接着剤、バッファー、酵素系、およびメディエーター組成物の沈着密度を提供する。試薬組成物3(RC3)についての酵素系沈着密度0.42μg/mm2は、先に論じた従来型ストリップの一番低い1μg/mm2の値より、60%近く少ない。
【0083】
[0096] 同様に、表1に示されるメディエーター密度は、従来型のセンサーストリップよりも約一桁小さい。例えば、RC3のメディエーター沈着密度は、従来型のセンサーストリップの約5分の1であった。従来型のセンサーストリップと比べて、メディエーター沈着密度のこの減少は、本発明の試薬組成物の長期間安定性の顕著な増加を提供することができる。
【0084】
【表1】

【0085】
[0097] 図5Aは、PQQ-GDH酵素を沈着密度0.8 U/mm2、センサー当たり1.2ユニット(U/センサー)を含んだ、RC2センサーストリップについてのWB試料中の異なるヘマトクリットレベルでのグルコース用量反応曲線を示す。図5Bは、PQQ-GDH酵素を沈着密度0.3 U/mm2、0.5 U/センサーを含んだ、RC3センサーストリップについてのWB試料中の異なるヘマトクリットレベルでの、グルコース用量反応曲線を示す。1.2 Uと0.5 Uの両方のセンサーは、±5%より少ないヘマトクリットバイアスを示した。しかしながら、1.2 Uセンサーと0.5 Uセンサー間の差が、系の感度および切片に関して認められた。
【0086】
[0098] 図5Aの1.2 U/センサーにおいてmg/dLの単位において表現される、切片対傾き比(I/S)と比較することにより、図5Bの0.5 U/センサーについての切片対傾き比の減少が見られ、この場合、より低い比は、バックグラウンドシグナルが減少していることを表す。このように、図5Aの1.2 U/センサーにおけるI/S比は〜6 mg/dLであり、一方、図5Bの0.5 U/センサーにおけるI/S比は40%ヘマトクリット濃度において、約1/40への減少である、〜0.15 mg/dLである。1.5 Uセンサーに比べて、0.5 Uセンサーの優れたバックグラウンドシグナル性能が達成された。
【0087】
[0099] 1つの観点において、低バックグラウンド(低い切片)の性能特性を、比較的低いメディエーターおよび酵素沈着密度によって提供することができる。別の観点において、高感度性(高い傾き)の性能特性を、パルスシーケンスの励起および緩和のタイミング比を最適化することにより提供することができる。例えば、1.5秒の比較的長い緩和期と0.25秒の比較的短い励起期を組み合わせると、作用電極の表面において大きい電流密度を提供する。数値的には、比較的大きい傾きの値を、比較的小さい切片の値で割ることで、I/Sをさらに改善する。つまり、好ましいセンサー性能特性(小さいI/S値)を、試薬組成物と測定方法との組み合わせにより、提供することができる。
【0088】
[0100] 下記の式(1)は、グルコースと電流との関係がi=S*G+Intであるとき、I/S比の関数として決定されるグルコース濃度における、電流の不精密性と結果の不精密性との間の分析的な関係を提供する:
【0089】
【数1】

【0090】
この式中、Gはグルコース濃度を示し、ΔG/Gはmg/dLでのグルコース濃度の相対誤差であり、Δi/iは測定された電流の相対誤差であり、SDG/GはΔG/Gにおける相対標準偏差であり、SDi/iはΔi/iにおける相対標準偏差であり、%CVGは、相対標準偏差に比例し、またグルコース測定精密性を示す分散の係数であり、%CViは、相対標準偏差に比例し、電流測定精密性を示す分散の係数であり、そして、Int/Sは、mg/dLでの切片対傾き(I/S)比である。式(1)は、微分および誤差伝播の分析について、逆関数G=f(i)=(i-Int)/Sの微分をとることによって、i=S*G+Intから導き出されることができる。1+1/G項のため、1の電流不精密性は、I/S値が0より大きい場合、グルコース濃度の不精密性が1より大きいという結果をもたらす。mg/dLで表される切片対傾き比(I/S)を、I/S(mg/dL)値を18([mg/dL]/18=グルコースについての[mM])で割ることにより、ミリモル/リットル(mM/L)の単位で表現することができる。
【0091】
[0101] 電流不精密性とは複数のセンサーストリップの電流測定間での分散をいう。つまり、電流不精密性とは、同じグルコース試料を複数のセンサーストリップを使用して分析した場合、記録された電流値と、平均の電流値との差の量を表す。特定のストリップから記録された電流値が、複数のストリップについての平均値から大きく外れるほど、そのストリップから記録された電流と試料の実際のグルコース濃度との相関は低くなる。従って、電流測定の精密性を、その不精密性または%-CViにより測定することができ、また。グルコース測定の精密性もまた、その不精密性または%-CVGによって測定することができる。
【0092】
[0102] 下記の表IIは、mg/dLで表される複数のグルコース濃度から、式(1)によって計算された傾き(1/G値)を提供する。つまり、分母を、検査された血漿グルコース濃度とした場合、1/57.6=0.0174、1/111=0.009、1/222.25=0.0045、1/444.75=0.0022、および1/669=0.0015である。グルコース濃度が増加するにつれて、式(1)による傾きの値は減少する。
【0093】
【表2】

【0094】
[0103] 図5Cは、実験データから決定されるmg/dLでのI/S比を示す。40%ヘマトクリットおよびグルコース濃度57.6、111、222.25、444.75、または669 mg/dLを含むWB試料から、ゲート電流測定パルスシーケンスによって、電流値が得られた。較正定数は、分析の中の、4、5.5、7、8.5、10、11.5、13、および14.5秒において決定された。表から見られるように、計算された値と実験によって決定された値は等しく、グルコースおよび電流の不精密性の点について、センサーストリップの振る舞いを表す、式(1)の能力が確認される。
【0095】
[0104] 50 mg/dL以下といった低グルコース濃度において、記録された電流値における根本的な不精密性から決定されるグルコース濃度に導入される不精密性を減少するために、低いI/S値を維持することが好ましい。例えば、I/S比が50 mg/dLで、グルコース濃度が50 mg/dLの場合、%-CVG/%-CViの比は2であり[1+(I/S)/G=1+50/50=2]、決定されるグルコース濃度において、すべての電流不精密性は2の倍数で増幅されるであろう。従って、記録された電流値における標準的な不精密性が3.5%である場合、50 mg/dLのI/S比を有する系では、グルコース不精密性は7%という結果になる。
【0096】
[0105] 図5Dは、上記表Iの試薬組成物RC2、RC3、またはRC4を有するセンサーストリップより決定される、グルコース濃度55.375、112.25、および433.5 mg/dLについて、0から20 mg/dLのI/S比を示す。I/S比が20から減少するにつれて、決定されたグルコース濃度に付随する不精密性もまた、減少する。つまり、先に述べた通り、より低いグルコース濃度においては、より低いI/S比が好ましいことが示される。
【0097】
[0106] これらの各因子を考慮すると、20 mg/dLあるいはそれより小さいI/S比を有するセンサーストリップが好ましく、10 mg/dLあるいはそれより小さい、または6 mg/dLあるいはそれより小さいI/S比を有するものがより好ましい。現在のところ、1 mg/dLあるいはそれより小さいI/S比を有するストリップがさらにより好ましい。
【0098】
[0107] 図5Eは、血漿と40%ヘマトクリット全血試料とを使用して、本発明に従ったセンサー系のほぼ同一のヘマトクリット性能を示す。この例において、センサーストリップの試薬組成物は、上記表Iに記述される、RC2であった。このように、本発明の試薬組成物と組み合わせたゲートパルスシーケンスは、WB試料について認められるヘマトクリット効果の実質的な減少を提供する。
【0099】
[0108] 図6Aは、センサーストリップの長期安定性に対する、環境的ストレスの影響を示す。グラフのY軸は、-20℃で保管したセンサーストリップに関して、環境的ストレスを受けたセンサーストリップについて、グルコース濃度が75 mg/dLより少ない場合はmg/dLの単位での絶対安定性バイアスを、または75 mg/dL以上のグルコース濃度では%-バイアスを示す。ストレスを受けるセンサーストリップは、25℃で18ヶ月の保管をシミュレートする加速されたプロセスとして、50℃で2週間保管された。メディエーター密度は初めは低かった(1.72 ug/mm2)ため、図6Aにおける平均安定性バイアス線は、RC1(3.2 U/mm2、または770 U/mg特異的酵素活性において4 ug/mm2)からRC2、RC3およびRC4(いずれも0.8 U/mm2またはそれより少ない)へと酵素密度が減少するにつれて、環境的に誘導されるバイアスも減少することを示した。
【0100】
[0109] 図6Aはまた、本発明に従う試薬組成物が、Genshawらによりアメリカ合衆国特許第5,653,863号に記述されるような、分析前に初期の長い酸化的パルスの必要がないほどに十分な長期間安定性を提供することができることを示した。図6Aのデータを生み出した分析は、酸化時間の合計1.5秒を含む、全持続時間4.5秒を有した(図4Aのパルスシーケンスに相当)。つまり、アメリカ合衆国特許第5,653,863号の分析(30秒の全分析時間のうち20秒の酸化)における、全アッセイ時間の〜67%と比べると、図6Aにおいては、アッセイ時間の30%のみがWB試料の酸化に充てられた。1つの観点において、全アッセイ時間の45%またはそれより短い時間が試料の酸化に充てられる。別の観点において、全アッセイ時間の35%またはそれより短い時間が試料の酸化に充てられる。
【0101】
[0110] 図6Aにおいて、構造IIIメディエーターは構造Iメディエーターよりやや低い安定性バイアスを有することを示すが、この小さい差異は、検査系の中のその他の因子に起因する可能性がある。このように、本発明のゲートパルスシーケンスと組み合わせた試薬組成物RC2、RC3、およびRC4は、50℃の温度に2週間暴露された後、±5%より小さい安定性バイアスを示したが、一方、酵素系の高い沈着密度を有するRC1は示さなかった。
【0102】
[0111] 図6Bは、50℃で4週間保管されたセンサーストリップの長期間安定性に対する、環境的ストレスの影響を示す。グラフのY軸は、-20℃で保管したセンサーストリップと比較して、環境的ストレスを受けたセンサーストリップについて、グルコース濃度が75 mg/dLより低い場合はmg/dLの単位で絶対安定性バイアスを、または75 mg/dL以上のグルコース濃度においては%-バイアスを示す。図6Aのより短い2週間の保管期間と比べて、図6Bの4週間の保管期間における安定性バイアスの増加は、RC1についてのY軸の値に見られる。メディエーター密度は初めに低かった(1.72 ug/mm2)ため、図6Bにおける平均安定性バイアス線は、RC1(3.2 U/mm2、または770 U/mg特異的酵素活性において4 ug/mm2)からRC2、RC3およびRC4(いずれも0.8 U/mm2またはそれより小さい)へと酵素密度が減少するにつれて、環境的に誘導されるバイアスも減少することを示した。つまり、図6Bのより長い4週間の保管期間についての平均安定性バイアス線もまた、RC1と比較してRC2、RC3、およびRC4において、実質的に減少する。4週間、50℃での保管の後でさえも、本発明のゲートパルスシーケンスと組み合わせた試薬組成物RC2、RC3およびRC4は±5%より小さい安定性バイアスを示した。
【0103】
[0112] 図6Cは、60%の相対湿度で25℃、52週間後の、PQQ-GDH酵素系を含む3つの試薬組成物についての安定性バイアスを示す。図6Aおよび図6Bとは異なり、より低い温度でより長い時間を使用して、ストリップをエイジングさせた(age)。RC2およびRC3におけるバイアス値は、加速されたエイジングにおいて見られたものと同じで、平均±5%より小さかった。RC4は、図6Aおよび図6Bの加速されたエイジングによる結果と比べると、バイアスの上昇が認められ、平均が±10%より少し小さいレベルに上昇した。この上昇は、実験的誤差、あるいはこの検査の特定の状況下、RC4中に用いられる大量の構造IIIメディエーターによる安定性の問題に起因する可能性がある。
【0104】
[0113] 図6Dは、RC2を含むセンサーストリップについての安定性バイアス値を示し、この場合分析対象物濃度を計算するために用いられるデータポイントが、分析が始まった後、特定の時間において取られた。例えば、2.75秒のラインは、図4Aにおける励起430などの、最初の短い励起パルスの後に決定された、分析対象物濃度のバイアス/%-バイアス値を示す。同様に、4.375秒のラインは二番目の短い励起パルスの後に決定された、分析対象物濃度のバイアス/%-バイアス値を示す。このように、RC2およびゲートパルスシーケンスを含む、環境的なストレスを受けたセンサーストリップを使用することにより、試料の分析対象物濃度は、3秒より短い時間において、正確に決定されることができる。
【実施例】
【0105】
[0114] 実施例1:センサーストリップ調製
[0115] 1つの観点において、本発明に従うセンサーストリップは、ピン-沈着を使用して作製された。対電極試薬溶液は、1%カルボキシメチルセルロース(CMC)中で100 mMリン酸バッファーのストック溶液を作製することにより調製された。次に、十分量の粉末メディエーターをバッファー/CMC溶液に溶解し、100 mMリン酸バッファーおよび1%CMC中100 mMメディエーターの最終溶液を作製した。
【0106】
[0116] 作用電極試薬溶液は、通常、0.5%CMC中100 mMリン酸バッファーのストック溶液を作製することにより調製された(例えば100 mL)。次に、十分量の粉末メディエーターをバッファー/CMCストック溶液中に溶解し、100 mMリン酸バッファーおよび0.5%CMC中24〜25 mMメディエーターの溶液を作製した(例えば10 mL)。最後に、5 U/μlの酵素ローディングのために、約33.4 mgのPQQ-GDH酵素系(749 U/mg特異的活性)をガラス容器中で5 mLのメディエーター/バッファー/CMC溶液と合わせた([5000 U/mL*5 mL]/[749 U/mg]=33.4 mg)。混合物をゆっくりとかき混ぜて、酵素の乾燥粉末を溶液中に溶解させた。この組成は、RC2用であった。最終試薬溶液2 mLのみが必要な場合は、749 U/mgの特異的活性を有する、約13.4 mgのPQQ-GDH酵素を計量した。同様に、2 U/μLのRC3組成物用には、749 U/mgの特異的活性を有する、約13.4 mgのPQQ-GDH酵素を5 mLのメディエーター/バッファー/CMC溶液に溶解して、沈着用の最終試薬溶液を調製した。最終試薬溶液2 mLのみが必要な場合は、特異的活性749 U/mgである、約5.34 mgのPQQ-GDH酵素を計量して、最終溶液を調製した。
【0107】
[0117] ピン-沈着を使用して、1つの炭素表面上へ対電極試薬溶液を沈着させて、対電極を形成した。各沈着によって供給される容量は、約0.2μlから0.24μlであり、それは、約1.5 mm2から2 mm2の領域を覆うように広がる。同様に、ピン-沈着を使用して、1つの炭素表面上へ作用電極試薬溶液を沈着させて、作用電極を形成した。各作用電極沈着の容量もまた、約0.2μlから0.24μlであり、同様の溶液が炭素上に広がって作用電極を形成した。完成したセンサーシートを、15分間風乾した後、デシケーター容器に保存し、その後最後のラミネーションにより完成したセンサーストリップが形成された。1つの観点において、作用電極において0.16μL/mm2(0.24 uL/1.5 mm2)またはそれより小さい試薬溶液沈着密度が好ましい。
【0108】
[0118] 実施例2:ドナー試験
[0119] 糖尿病をもつ21人の被験体より全血試料を収集した。各被験体で2回の分析を行って、下記の表IIIに提供されるように、SS1からSS4の4つのロットのセンサーストリップのそれぞれから、42の測定が提供された。SS1からSS3においては、異なる作用電極試薬組成物と異なる対電極試薬組成物が使用され、一方SS4は、実質的に両方の導体を覆う1つの試薬組成物が使用された。SS1、SS2、およびSS3は、同じ試薬量を使用する異なる製造ロットを示す。SS1からSS3についてそれぞれの導体に沈着された試薬組成物の容量は、それぞれが約1.5 mm2である2つの沈着領域において、約0.24μLであった。SS1については、両方の導体を覆うように沈着された試薬組成物の容量は、全沈着領域3 mm2において、約0.3μLであった。
【0109】
【表3】

【0110】
[0120] 試料は、約0.25秒の間隔をあけた2回の短い励起を含む、最初の励起に続いて1秒の緩和を有するパルスシーケンスを用いて分析された。最初の励起および緩和の後、2回の約1秒の緩和により隔てられた、3回の約0.375秒の励起のシーケンスが印加された。最初の入力シグナルの印加から約5秒後に記録された出力電流を使用して、試料のグルコース濃度が決定された。
【0111】
[0121] 下記の表IVおよび表Vは、SS1からSS4における統計的ヘマトクリットバイアスの結果を提供するものであり、21の血液試料のそれぞれにおいて、各タイプのセンサーストリップを用いて2回の分析が行われて42の読み取り値が提供された。表IVは、各センサーストリップロットにおける、傾き、切片、およびI/S比を示し、一方、表Vは、YSI参照値の±15/±15%、±10/±10%、または±5/±5%以内のバイアスを有する読み取り値のパーセンテージを示す。75 mg/dLよりも低いグルコース濃度におけるバイアスは、mg/dLとして表され(絶対値)、また、75 mg/dLおよびそれより高いグルコース濃度におけるバイアスは、パーセントで表される(相対値)。
【0112】
【表4】

【0113】
【表5】

【0114】
[0122] 表IVは、センサーストリップの各ロットが、5 mg/dLより小さいI/S比を有したことを証明し、これによりストリップの優れたバックグラウンドシグナル性能を証明する。センサー系の性能を、参照値に対するバイアスの広がりにより特徴づけることができる。この広がりは、±15 mg/dL/±15%、または±10 mg/dL/±10%などの、特定の限界内にあるバイアス値のパーセンテージにより、測定することができる。限界が小さいほど、性能が良い。測定の不精密性およびヘマトクリット効果を含む複数の因子がバイアス値の原因となるだろう。通常、性能は、データ母集団の少なくとも95%が特定の性能限界内にあることにより、判断される。よって、表Vは、SS1からSS4のデータ母集団の100%が±15 mg/dL/±15%の限界内にあったことを証明する。さらに、SS1からSS4のデータ母集団の95%以上が±10 mg/dL/±10%の範囲内であった。
【0115】
[0123] 図7Aは、21の全血試料における、SS1ロットからの、用量反応曲線を示す。R2値0.997は、ストリップが、試料の実際のグルコース濃度を正確に反映する電流値を提供する能力を有することを証明した。図7Bはドナー試験におけるグルコース濃度範囲にわたる、21の試料からの42の読み取り値の、SS1からSS4のロットにおけるバイアスの広がりを示す。図より、すべてのセンサーストリップについてバイアス値の100%が±15%以内の範囲にあり、また、SS1およびSS3製造ロットの性能は、この試験の条件下でデータ母集団の93%が±5%の範囲以内であり、優れていることが証明された。センサーストリップにおけるバイアスの広がりの狭さは、小さいI/S比に反映される感度および精密性の上昇、および、ストリップにより提供される小さいヘマトクリット効果に起因する可能性がある。
【0116】
[0124] 図7Cはヘマトクリット感受性を示し、試料のヘマトクリット含有量と関連するヘマトクリットバイアスは、HECポリマーについての沈着密度2.96μg/mm2、クエン酸バッファーについて0.69μg/mm2、グルコースオキシダーゼ酵素について2.14μg/mm2、およびヘキサシアノ鉄(II)酸塩(ferricyanide)メディエーターについて13μg/mm2を有する従来型のストリップと比較して、ロットSS1より得られた。SS1ロットにおいて、ヘマトクリット感受性は-0.26が得られ、一方、従来のセンサーストリップは、-1.26の傾きを有した。ここで、数値的により大きい傾きの値は、より大きいヘマトクリット感受性を示す。従って、SS1ロットのヘマトクリット感受性は、従来のストリップにより提供されるよりも約79%少なかった。
【0117】
[0125] 明細書および請求項の、明確で一貫性のある理解を提供するために、以下の定義が提供される。
【0118】
[0126] “系”とは、試料中の分析対象物の定量が可能である電子測定装置と、その導体を介して電気的に連通している電気化学的センサーストリップとして定義される。
【0119】
[0127] “測定装置”とは、電気的な入力シグナルを印加し、かつ、結果として得られる出力シグナルを測定できる、電子装置として定義される。測定装置は、出力シグナルに応じて、1つまたはそれ以上の分析対象物の存在および/または濃度を決定することができる過程をも含むことができる。
【0120】
[0128] “分析対象物”とは、試料中に存在する1つあるいはそれ以上の物質として定義される。分析により、試料中に存在する分析対象物の存在および/または濃度が決定される。
【0121】
[0129] “試料”とは、未知量の分析対象物を含むことができる組成物として定義される。典型的には、電気化学的分析における試料は、液体形態であり、そして好ましくは、試料は水性混合物である。試料は、血液、尿、唾液などの、生物学的試料であってよい。試料はまた、抽出物、希釈物、濾過物、または再構成沈殿物などの、生物学的試料の派生物であってよい。
【0122】
[0130] “導体”とは、電気化学的分析の間、定常状態を維持する導電性物質として定義される。導体物質の例には、固体金属、金属ペースト、導電性カーボン、導電性カーボンペースト、および導電性ポリマーが含まれる。
【0123】
[0131] “非イオン化物質”とは、分析対象物の電気化学的分析の間に、イオン化されない物質として定義される。非イオン化物質の例には、炭素、金、白金、およびパラジウムが含まれる。
【0124】
[0132] “測定性能”とは、正確性および/または精密性に関して定義される。従って、測定性能における増加は、測定の正確性および/または精密性における増加であってよい。
【0125】
[0133] “精密性”とは、同じ試料における複数回の分析対象物測定値の近さとして定義される。精密性は、平均値との関連で、複数回測定における広がり、または、分散という形で表現されることができる。
【0126】
[0134] “正確性”とは、センサーストリップによって測定された分析対象物の量が試料中の分析対象物の真の量にどの程度近く合致するか、として定義される。正確性はバイアスという形で表現され、より大きいバイアス値は低い正確性を反映する。
【0127】
[0135] “バイアス”とは、測定された値と認められた参照値との差として定義される。バイアスは、“絶対バイアス”または“相対バイアス”という形で表現されることができる。絶対バイアスは、mg/dLなどの測定の単位で表現されることができ、一方、相対バイアスは、参照値に対する絶対バイアス値のパーセンテージとして表現されることができる。ヘマトクリットバイアスまたは安定性バイアスのどちらかは、絶対バイアス値の形、またはパーセンテージとして表現されることができる。ヘマトクリットバイアスは、オハイオ州Yellow SpringsのYSI Inc.より入手可能なYSI 2300 STAT PLUSTMなどの参照器械より得られる分析対象物濃度を、認められた参照値として使用する。安定性バイアスは、-20℃の温度で保管された、センサーストリップより得られる分析対象物濃度を使用して、試薬組成物の温度変化を十分に減少させる。
【0128】
[0136] “ヘマトクリット感受性”とは、分析において試料のヘマトクリットレベルにおける変化がヘマトクリットバイアス値に影響する度合いとして決定される。
【0129】
[0137] “長期間安定性”とは、ホイルおよび乾燥剤などで包装され、また、製造後-20℃で2週間または4週間保管したセンサーストリップに対する、50℃でそれぞれ2週間または4週間暴露されたセンサーストリップに関して定義される。50℃で2週間の保管は、室温で約18ヶ月の保管とみなすことができる。-20℃で保管されたストリップに対して50℃で保管されたストリップに関する測定性能において、0%、50%、100%、および400%ヘマトクリットレベルにおける変化または分散の平均は、センサーストリップに関する長期間安定性のドリフト(drift)または“安定性バイアス”を示す。この例において、バックグラウンドシグナルまたはバイアスの増加は、センサーストリップにおける測定性能の減少を示す。つまり、包装されたセンサーストリップを50℃で保管し、-20℃で保管されたストリップと関係するバイアスの変化を観察することにより、様々な期間で保管されているセンサーストリップに関して、どのくらいのバイアスが増加するかという指標を得ることができる。
【0130】
[0138] “メディエーター”とは、酸化または還元されることができ、1つまたはそれ以上の電子を移動させることができる物質として定義される。メディエーターは電気化学的分析における試薬であり、そして、着目する分析対象物ではなく、分析対象物の間接的な測定を提供する。単純な系において、メディエーターは、分析対象物の酸化または還元に応答して酸化還元反応を受ける。酸化された、あるいは、還元されたメディエーターは、次にセンサーストリップの作用電極で逆反応を受け、そして、そのもとの酸化数に再生される。
【0131】
[0139] “測定可能な種”とは、電気化学的センサーストリップの電極表面において適切な電位の下、酸化または還元されることができる、すべての電気化学的に活性である種として、定義される。測定可能な種の例には、分析対象物、基質、またはメディエーターが含まれる。
【0132】
[0140] “酸化還元酵素”とは、測定可能な種の酸化、または還元を促進する、すべての酵素として定義される。酸化還元酵素は試薬である。酸化還元酵素という用語は、分子酸素が電子受容体である場合、酸化反応を促進する、“オキシダーゼ”;分析対象物が還元され、分子酸素が分析対象物でない場合、還元反応を促進させる、“レダクターゼ”;および、分子酸素が電子受容体でない場合に酸化反応を促進する、“デヒドロゲナーゼ”を含む。例えば、A.D. Smith, Ed., New York: Oxford University Press (1997) Oxford Dictionary of Biochemistry and Molecular Biology, Revised Edition のpp. 161, 476, 477, および 560のを参照のこと。
【0133】
[0141] “電子活性有機分子”とは、酸化還元反応を受けることができる金属をもたない有機分子として定義される。電子活性有機分子は、酸化還元種として、および/またはメディエーターとして機能することができる。電子活性有機分子の例には、補酵素ピロロキノリンキノン(PQQ)、ベンゾキノンおよびナフトキノン、N-オキシド、ニトロソ化合物、ヒドロキシルアミン、オキシン、フラビン、フェナジン、フェノチアジン、インドフェノール、およびインダミンが含まれる。
【0134】
[0142] “接着剤”とは、試薬と化学的適合性を有し、物理的に支持および封じ込め(containment)を提供する物質として定義される。
【0135】
[0143] “平均初期厚”とは、液体試料の導入前のその乾燥状態における、層の平均の高さとして定義される。層の上部表面がでこぼこしていて平らではないので、平均という言葉が用いられる。
【0136】
[0144] “沈着密度”とは、ある領域に沈着される物質の質量として定義される。例えば、2.57μgの固体を含む0.24μLの溶液を1.5 mm2の領域を有する表面に沈着する場合、沈着密度は1.72μg/mm2(2.57μg/1.5 mm2)となる。
【0137】
[0145] “酵素ユニット”(U)とは、標準条件下、1分間で、1ミクロモルの基質(分析対象物)の変換(酸化または還元)を触媒するであろう、酵素系の量として定義される。
【0138】
[0146] 酵素系に関して、“酵素活性”または“活性”とは、容量あたりの酵素ユニットの数である。従って、活性は、例えば、1 U/L=μモル/分/リットルである、U/LまたはmU/mLという単位で表されることができる。
【0139】
[0147] “酸化還元反応”とは、第一の種から第二の種への少なくとも1つの電子の移動に関わる、二つの種間での化学反応として定義される。つまり、酸化還元反応は、酸化および還元を含む。反応の酸化部分は、第一の種による少なくとも1つの電子を失うことに関与し、また、還元部分は、第二の種への少なくとも1つの電子の添加に関与する。酸化された種のイオン電荷は、移動した電子の数と等しい量だけ、より陽性になる。同様に、還元された種のイオン電荷は、移動した電子の数と等しい量だけ、陽性が弱まる。
【0140】
[0148] “酸化数”とは、原子などの化学種の形式イオン電荷として定義される。(III)などの高い酸化数は、より陽性であり、(II)などの低い酸化数は、弱い陽性である。中性の種は、ゼロ(0)のイオン電荷を有する。種の酸化は、その種の酸化数の増加をもたらし、また、種の還元は、その種の酸化数の減少をもたらす。
【0141】
[0149] “酸化還元対”とは、異なる酸化数を有する化学物質の二つの共役種として定義される。高い方の酸化数をもつ種の還元は、低い方の酸化数を有する種を産生する。代わりに、低い方の酸化数を有する種の酸化は、高い方の酸化数を有する種を産生する。
【0142】
[0150] “酸化可能種”とは、低い方の酸化数を有する酸化還元対の種として定義され、そしてそれはつまり、酸化されて高い方の酸化数を有する種になることができる。同様に、“還元可能種”という用語は、高い方の酸化数を有する酸化還元対の種として定義され、そしてそれはつまり、還元されて低い方の酸化数を有する種になることができる。
【0143】
[0151] “可溶性の酸化還元種”とは、酸化または還元を受けることができ、かつ、それは少なくとも1リットルあたり1.0グラムのレベルで水(pH7、25℃)に可溶であることができる物質として定義される。可溶性の酸化還元種には、電子活性有機分子、有機遷移金属錯体、および遷移金属配位錯体が含まれる。“可溶性の酸化還元種”という用語は、元素金属、および、孤立金属イオン、特に水に不溶あるいは溶けにくいものは除外する。
【0144】
[0152] “OTM錯体”とも言われる“有機遷移金属錯体”とは、遷移金属が少なくとも1つの炭素原子とσ結合(遷移金属とσ結合する炭素原子上の形式電荷-1)またはπ結合(遷移金属とπ結合する炭素原子上の形式電荷0)を介して結合している錯体として定義される。例えば、フェロセンは、2つのシクロペンタジエニル(Cp)環を有するOTM錯体であり、それぞれはその5つの炭素原子を介して鉄中心に2つのπ結合および1つのσ結合により結合している。OTM錯体の別の例は、ヘキサシアノ鉄(III)酸塩(ferricyanide (III))およびその還元型であるヘキサシアノ鉄(II)酸塩(ferrocyanide (II))であり、6つのシアノリガンド(6つの各リガンド上の形式電荷-1)は、シアノ基の炭素原子を介して鉄中心とσ結合している。
【0145】
[0153] “配位錯体”とは、8面体または平面四角形などの、明確な配位構造を有する錯体として定義される。その結合により定義されているOTM錯体とは異なり、配位錯体はその構造により定義される。つまり、配位錯体はOTM錯体(前述したヘキサシアノ鉄(III)酸塩(ferrocyanide)など)、または、窒素、硫黄、酸素およびリンを含むヘテロ原子などの、炭素以外の非金属原子が遷移金属中心に配位結合している錯体であってよい。例えば、ルテニウムヘキサアミンは、明確な8面体構造を有する配位錯体であり、6つのNH3リガンド(各6つのリガンド上の形式電荷0)は、ルテニウム中心と配位結合している。有機遷移金属錯体、配位錯体、および遷移金属結合のより完全な議論は、Collmanら、Principles and Applications of Organotransition Metal Chemistry (1987)、およびMiessler & Tarr、Inorganic Chemistry (1991)に見いだされることができる。
【0146】
[0154] “手持ち式の装置”とは、人の手で握ることができ、かつ、携帯可能な装置として、定義される。手持ち式装置の例は、インディアナ州、ElkhartのBayer HealthCare, LLCより入手可能な、Ascensia(登録商標) Elite Blood Glucose Monitoring Systemに付随する測定装置である。
【0147】
[0155] “〜の上に(on)”とは“〜の上側に(above)”として定義され、そして、記述される方向性に関係する。例えば、第一要素が第二要素の少なくとも一部分の上に(over)沈着される場合、第一要素は第二要素の“上に(on)沈着される”と言われる。別の例において、第一要素が第二要素の少なくとも一部分の上側に(above)存在する場合、第一要素は第二要素“上に(on)”あると言われる。“on”という用語の使用は、記述される上側の要素と下側の要素との間の物質の存在を除外しない。例えば、第一要素はその上の表面上にコーティングを有する可能性があるが、第二要素は第一要素の少なくとも一部分の上に(over)あり、そして、そのトップコーティングは第一要素“上(on)”として記述されることができる。従って、“ 上に(on)”という言葉の使用は、関係する二つの要素が互いに物理的に接触することを意味することもあり、意味しないこともある。
【0148】
[0156] 本発明の様々な態様が記述されたが、当業者においては、その他の態様および実施が本発明の範囲内で可能であることは明らかだろう。従って、本発明は、添付される請求項およびそれに相当するものに照らすことを除いては、限定されない。
【図1A】

【図1B】

【特許請求の範囲】
【請求項1】
基板;
第一導体上に、多くとも8μg/mm2のメディエーターを含む試薬層を含む少なくとも1つの第一層を有する、基板上の第一電極;
基板上の第二電極;
基板上の蓋;そして
-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比の、少なくとも1つを有する決定された濃度値を、そのストリップが提供すること;
を含む、分析対象物を検出するための電気化学的センサーストリップ。
【請求項2】
第一電極および第二電極が実質的に同一平面にある、請求項1のストリップ。
【請求項3】
第二電極が第二導体上の第一層を含む、請求項1のストリップ。
【請求項4】
第二電極が第二導体上の第二層を含む、請求項3のストリップ。
【請求項5】
第二層が第一層の試薬層と異なる組成の試薬層を含む、請求項4のストリップ。
【請求項6】
電極が200μmより広く隔てられている、請求項1のストリップ。
【請求項7】
電極が蓋の上部から少なくとも100μm隔てられている、請求項1のストリップ。
【請求項8】
試薬層の平均初期厚が8μmよりも小さい、請求項1のストリップ。
【請求項9】
試薬層の平均初期厚が0.25μmから3μmである、請求項1のストリップ。
【請求項10】
試薬層が、多くとも0.2μL/mm2の沈着密度で試薬溶液から形成される、請求項1のストリップ。
【請求項11】
試薬層が、ポリ(エチレンオキシド)、ポリビニルアルコール、ヒドロキシエチレンセルロース、カルボキシメチルセルロース、および、それらの組み合わせからなるグループより選択されるポリマー接着剤を含む、請求項1のストリップ。
【請求項12】
ポリマー接着剤の沈着密度が、第一導体上で多くとも2μg/mm2である、請求項11のストリップ。
【請求項13】
試薬層が、水和によりゲル状物質を形成する、部分的に水溶性のポリマー接着剤である、請求項1のストリップ。
【請求項14】
試薬層が、多くとも0.8μg/mm2の沈着密度で酵素系を含む、請求項1のストリップ。
【請求項15】
試薬層が、多くとも1.3ユニットの酵素系を含む、請求項1のストリップ。
【請求項16】
試薬層が、多くとも2μg/mm2のメディエーターを含む、請求項1のストリップ。
【請求項17】
メディエーターが2電子移動メディエーターである、請求項1のストリップ。
【請求項18】
メディエーターが、3-フェニルイミノ-3H-フェノチアジン、3-フェニルイミノ-3H-フェノキサジン、それらの塩、それらの酸、それらの誘導体、およびそれらの組み合わせからなるグループより選択される、請求項17のストリップ。
【請求項19】
メディエーターがヘキサシアノ鉄(II)酸塩(ferricyanide)よりも、少なくとも100 mV低い酸化還元電位を有する、請求項17のストリップ。
【請求項20】
-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後の安定性バイアスが±5%より小さい、請求項1のストリップ。
【請求項21】
-20℃で4週間保管された比較ストリップと比べて、50℃で4週間保管した後の安定性バイアスが±5%より小さい、請求項1のストリップ。
【請求項22】
20%から60%のヘマトクリットを含む全血試料において、ヘマトクリットバイアスが±5%より小さい、請求項1のストリップ。
【請求項23】
切片の傾きに対する比が、大きくとも10 mg/dLである、請求項1のストリップ。
【請求項24】
切片の傾きに対する比が、大きくとも1 mg/dLである、請求項1のストリップ。
【請求項25】
基板;
第一導体上に、メディエーターおよび酵素系を含む試薬層を含む少なくとも1つの第一層を有する、基板上の第一電極であって、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比の、少なくとも1つを有する決定された濃度値をその試薬層が提供するもの;
基板上の第二電極;そして
基板上の蓋;
を含む、分析対象物を検出するための電気化学的センサーストリップ。
【請求項26】
30秒間に少なくとも3回のデューティサイクルを含むパルスシーケンスを、試料に印加すること;そして
±10%より小さい安定性バイアス、20%から60%の範囲のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比の中の少なくとも1つを有する、試料中の分析対象物濃度を決定すること;
を含む、試料中の分析対象物濃度を決定する方法。
【請求項27】
パルスシーケンスが、9秒間に少なくとも3回のデューティサイクルを含む、請求項26の方法。
【請求項28】
パルスシーケンスが、長くとも5秒間で完了する、請求項26の方法。
【請求項29】
試料中の分析対象物濃度の決定に、パルスシーケンスの印加から2秒の間に行われる電流測定から、試料中の分析対象物濃度を決定することが含まれる、請求項26の方法。
【請求項30】
各デューティサイクルが、励起および緩和を含む、請求項26の方法。
【請求項31】
励起が、それぞれ0.01秒から3秒の持続時間を有する、請求項30の方法。
【請求項32】
励起が長くとも10秒の合計持続時間を有する、請求項30の方法。
【請求項33】
励起が500 mV以内の差の振幅を有する、請求項30の方法。
【請求項34】
励起が、パルスシーケンスの時間の長くとも45%を含む、請求項30の方法。
【請求項35】
緩和が、それぞれ0.2秒から3秒の持続時間を有する、請求項30の方法。
【請求項36】
パルスシーケンスに、0.75秒から3秒持続する初期励起が含まれ、この初期励起がデューティサイクルにおける励起よりもより長く持続する、請求項30の方法。
【請求項37】
安定性バイアスが±5%より小さい、請求項26の方法。
【請求項38】
-20℃で4週間保管された比較ストリップと比べて、50℃で4週間保管した後の安定性バイアスが±5%より小さい、請求項26の方法。
【請求項39】
20%から60%のヘマトクリットを含む全血試料において、ヘマトクリットバイアスが±5%より小さい、請求項26の方法。
【請求項40】
切片の傾きに対する比が、大きくとも10 mg/dLである、請求項26の方法。
【請求項41】
ストリップは、基板、基板上の第一導体、基板上の第二導体、および、少なくとも1つの第一導体上の少なくとも第一層を有し、電気化学的センサーストリップに液体構成成分を有する試料を含む分析対象物を導入すること〔ここで、少なくとも1つの第一層は、ポリマー接着剤を含む試薬層を含み、そして、試料は第一導体と第二導体との間に電気的連通をもたらす〕;
第一導体と第二導体との間に、30秒間に少なくとも4つの読み取りパルスという形態で電位を印加すること;
読み出しパルスの少なくとも1つを測定して、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、大きくとも10 mg/dLである切片対傾き比、およびそれらの組み合わせからなるグループより選択される、少なくとも1つの性能パラメーターに起因する、上昇した性能を伴う試料中の定量的な分析対象物濃度値を提供すること;
を含む、定量的な分析対象物決定の性能を上昇させる方法。
【請求項42】
9秒以内に少なくとも4回の読み出しパルスが印加される、請求項41の方法。
【請求項43】
長くとも5秒間で読み出しパルスが完了する、請求項41の方法。
【請求項44】
2秒の電位の印加のあいだに読み出しパルスが測定され、試料中の定量的な分析対象物濃度値を提供する、請求項41の方法。
【請求項45】
読み出しパルスが長くとも2秒間の持続時間である、請求項41の方法。
【請求項46】
読み出しパルスが500 mV以内の差をもつ振幅を有する、請求項41の方法。
【請求項47】
安定性バイアスが±5%より小さい、請求項41の方法。
【請求項48】
-20℃で4週間保管された比較ストリップと比べて、50℃で4週保管した後に安定性バイアスが±5%より小さい、請求項41の方法。
【請求項49】
20%から60%の範囲のヘマトクリットを含む全血試料において、ヘマトクリットバイアスが±5%より小さい、請求項41の方法。
【請求項50】
切片対傾き比が大きくとも1 mg/dLである、請求項41の方法。
【請求項1】
基板;
第一導体上に、多くとも8μg/mm2のメディエーターを含む試薬層を含む少なくとも1つの第一層を有する、基板上の第一電極;
基板上の第二電極;
基板上の蓋;そして
-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比の、少なくとも1つを有する決定された濃度値を、そのストリップが提供すること;
を含む、分析対象物を検出するための電気化学的センサーストリップ。
【請求項2】
第一電極および第二電極が実質的に同一平面にある、請求項1のストリップ。
【請求項3】
第二電極が第二導体上の第一層を含む、請求項1のストリップ。
【請求項4】
第二電極が第二導体上の第二層を含む、請求項3のストリップ。
【請求項5】
第二層が第一層の試薬層と異なる組成の試薬層を含む、請求項4のストリップ。
【請求項6】
電極が200μmより広く隔てられている、請求項1のストリップ。
【請求項7】
電極が蓋の上部から少なくとも100μm隔てられている、請求項1のストリップ。
【請求項8】
試薬層の平均初期厚が8μmよりも小さい、請求項1のストリップ。
【請求項9】
試薬層の平均初期厚が0.25μmから3μmである、請求項1のストリップ。
【請求項10】
試薬層が、多くとも0.2μL/mm2の沈着密度で試薬溶液から形成される、請求項1のストリップ。
【請求項11】
試薬層が、ポリ(エチレンオキシド)、ポリビニルアルコール、ヒドロキシエチレンセルロース、カルボキシメチルセルロース、および、それらの組み合わせからなるグループより選択されるポリマー接着剤を含む、請求項1のストリップ。
【請求項12】
ポリマー接着剤の沈着密度が、第一導体上で多くとも2μg/mm2である、請求項11のストリップ。
【請求項13】
試薬層が、水和によりゲル状物質を形成する、部分的に水溶性のポリマー接着剤である、請求項1のストリップ。
【請求項14】
試薬層が、多くとも0.8μg/mm2の沈着密度で酵素系を含む、請求項1のストリップ。
【請求項15】
試薬層が、多くとも1.3ユニットの酵素系を含む、請求項1のストリップ。
【請求項16】
試薬層が、多くとも2μg/mm2のメディエーターを含む、請求項1のストリップ。
【請求項17】
メディエーターが2電子移動メディエーターである、請求項1のストリップ。
【請求項18】
メディエーターが、3-フェニルイミノ-3H-フェノチアジン、3-フェニルイミノ-3H-フェノキサジン、それらの塩、それらの酸、それらの誘導体、およびそれらの組み合わせからなるグループより選択される、請求項17のストリップ。
【請求項19】
メディエーターがヘキサシアノ鉄(II)酸塩(ferricyanide)よりも、少なくとも100 mV低い酸化還元電位を有する、請求項17のストリップ。
【請求項20】
-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後の安定性バイアスが±5%より小さい、請求項1のストリップ。
【請求項21】
-20℃で4週間保管された比較ストリップと比べて、50℃で4週間保管した後の安定性バイアスが±5%より小さい、請求項1のストリップ。
【請求項22】
20%から60%のヘマトクリットを含む全血試料において、ヘマトクリットバイアスが±5%より小さい、請求項1のストリップ。
【請求項23】
切片の傾きに対する比が、大きくとも10 mg/dLである、請求項1のストリップ。
【請求項24】
切片の傾きに対する比が、大きくとも1 mg/dLである、請求項1のストリップ。
【請求項25】
基板;
第一導体上に、メディエーターおよび酵素系を含む試薬層を含む少なくとも1つの第一層を有する、基板上の第一電極であって、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比の、少なくとも1つを有する決定された濃度値をその試薬層が提供するもの;
基板上の第二電極;そして
基板上の蓋;
を含む、分析対象物を検出するための電気化学的センサーストリップ。
【請求項26】
30秒間に少なくとも3回のデューティサイクルを含むパルスシーケンスを、試料に印加すること;そして
±10%より小さい安定性バイアス、20%から60%の範囲のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、および、大きくとも20 mg/dLである切片対傾き比の中の少なくとも1つを有する、試料中の分析対象物濃度を決定すること;
を含む、試料中の分析対象物濃度を決定する方法。
【請求項27】
パルスシーケンスが、9秒間に少なくとも3回のデューティサイクルを含む、請求項26の方法。
【請求項28】
パルスシーケンスが、長くとも5秒間で完了する、請求項26の方法。
【請求項29】
試料中の分析対象物濃度の決定に、パルスシーケンスの印加から2秒の間に行われる電流測定から、試料中の分析対象物濃度を決定することが含まれる、請求項26の方法。
【請求項30】
各デューティサイクルが、励起および緩和を含む、請求項26の方法。
【請求項31】
励起が、それぞれ0.01秒から3秒の持続時間を有する、請求項30の方法。
【請求項32】
励起が長くとも10秒の合計持続時間を有する、請求項30の方法。
【請求項33】
励起が500 mV以内の差の振幅を有する、請求項30の方法。
【請求項34】
励起が、パルスシーケンスの時間の長くとも45%を含む、請求項30の方法。
【請求項35】
緩和が、それぞれ0.2秒から3秒の持続時間を有する、請求項30の方法。
【請求項36】
パルスシーケンスに、0.75秒から3秒持続する初期励起が含まれ、この初期励起がデューティサイクルにおける励起よりもより長く持続する、請求項30の方法。
【請求項37】
安定性バイアスが±5%より小さい、請求項26の方法。
【請求項38】
-20℃で4週間保管された比較ストリップと比べて、50℃で4週間保管した後の安定性バイアスが±5%より小さい、請求項26の方法。
【請求項39】
20%から60%のヘマトクリットを含む全血試料において、ヘマトクリットバイアスが±5%より小さい、請求項26の方法。
【請求項40】
切片の傾きに対する比が、大きくとも10 mg/dLである、請求項26の方法。
【請求項41】
ストリップは、基板、基板上の第一導体、基板上の第二導体、および、少なくとも1つの第一導体上の少なくとも第一層を有し、電気化学的センサーストリップに液体構成成分を有する試料を含む分析対象物を導入すること〔ここで、少なくとも1つの第一層は、ポリマー接着剤を含む試薬層を含み、そして、試料は第一導体と第二導体との間に電気的連通をもたらす〕;
第一導体と第二導体との間に、30秒間に少なくとも4つの読み取りパルスという形態で電位を印加すること;
読み出しパルスの少なくとも1つを測定して、-20℃で2週間保管された比較ストリップと比べて、50℃で2週間保管した後に±10%より小さい安定性バイアス、20%から60%のヘマトクリットを含む全血試料における±10%より小さいヘマトクリットバイアス、大きくとも10 mg/dLである切片対傾き比、およびそれらの組み合わせからなるグループより選択される、少なくとも1つの性能パラメーターに起因する、上昇した性能を伴う試料中の定量的な分析対象物濃度値を提供すること;
を含む、定量的な分析対象物決定の性能を上昇させる方法。
【請求項42】
9秒以内に少なくとも4回の読み出しパルスが印加される、請求項41の方法。
【請求項43】
長くとも5秒間で読み出しパルスが完了する、請求項41の方法。
【請求項44】
2秒の電位の印加のあいだに読み出しパルスが測定され、試料中の定量的な分析対象物濃度値を提供する、請求項41の方法。
【請求項45】
読み出しパルスが長くとも2秒間の持続時間である、請求項41の方法。
【請求項46】
読み出しパルスが500 mV以内の差をもつ振幅を有する、請求項41の方法。
【請求項47】
安定性バイアスが±5%より小さい、請求項41の方法。
【請求項48】
-20℃で4週間保管された比較ストリップと比べて、50℃で4週保管した後に安定性バイアスが±5%より小さい、請求項41の方法。
【請求項49】
20%から60%の範囲のヘマトクリットを含む全血試料において、ヘマトクリットバイアスが±5%より小さい、請求項41の方法。
【請求項50】
切片対傾き比が大きくとも1 mg/dLである、請求項41の方法。
【図2−1】


【図2−2】


【図2−3】


【図3】


【図4】


【図5−1】


【図5−2】


【図5−3】


【図5−4】


【図6−1】


【図6−2】


【図6−3】


【図6−4】


【図7−1】


【図7−2】


【図7−3】




【図2−2】


【図2−3】


【図3】


【図4】


【図5−1】


【図5−2】


【図5−3】


【図5−4】


【図6−1】


【図6−2】


【図6−3】


【図6−4】


【図7−1】


【図7−2】


【図7−3】


【公表番号】特表2010−504524(P2010−504524A)
【公表日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願番号】特願2009−529302(P2009−529302)
【出願日】平成19年9月9日(2007.9.9)
【国際出願番号】PCT/US2007/077955
【国際公開番号】WO2008/036516
【国際公開日】平成20年3月27日(2008.3.27)
【出願人】(503106111)バイエル・ヘルスケア・エルエルシー (154)
【公表日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願日】平成19年9月9日(2007.9.9)
【国際出願番号】PCT/US2007/077955
【国際公開番号】WO2008/036516
【国際公開日】平成20年3月27日(2008.3.27)
【出願人】(503106111)バイエル・ヘルスケア・エルエルシー (154)
[ Back to top ]

